ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Данная заявка имеет приоритет предварительной заявки на патент США №60/846250, поданной 21 сентября 2006 года, полное содержание которой конкретно включено в данное описание изобретения.
1. Область изобретения
В общем, настоящее изобретение относится к измерению содержания коллагена в тканях. Более конкретно, оно относится к измерению содержания коллагена с использованием технологии ЖХВД (жидкостная хроматография высокого давления). В конкретных воплощениях настоящее изобретение относится к измерению содержания коллагена в заживающих ранах.
2. Описание предшествующего уровня техники
Белок коллаген состоит из полипептидных цепей, содержащих повторяющуюся последовательность аминокислот, в основном состоящую из гидроксипролина (Hyp), глицина (Gly) и пролина (Pro). Коллаген является одним из доминирующих белков, обнаруженных в организме человека, который составляет примерно 80-85% внеклеточного матрикса (ECM) в дермальном слое нормальной (нераневой) ткани кожи. Имеются доказательства того, что уникальные характеристики коллагена обеспечивают прочность на растяжение, целостность и строение нормальной ткани кожи (G.S.Schultz et al., Extracellular matrix: review of its roles in acute and chronic wounds, World Wide Wounds, (August 2005), веб-сайт worldwidewounds.com/2005/august/Schultz/Extrace-Matric-Acute-Chronic-Wounds.html). Поскольку формирование прочности на растяжение является важным компонентом успешного лечения ран, и поскольку коллаген является основным белком, участвующим в формировании прочности на растяжение, точные измерения уровня коллагена могут прогнозировать успешное заживление ран.
Для количественного определения уровня коллагена могут быть использованы различные аналитические методы, общепризнанные в биохимии и аналитической химии, такие как слектрофотометрия и газовой хроматография (H. Inoue, et al., J. of Chromatography В, 724:221-230 (1999)). Самые современные доступные спектрофотометрические колориметрические методы измерения уровня гидроксипролина представляют собой модификации метода Неймана и Логана (1950) или метода Стегемана, которые могут быть чувствительными и точными, но могут быть также громоздкими и проблематичными (H.Stegemann и K.Stalder, Clinica Chemical Acta, 18:267-273 (1967); В.R.Switzer и G.К.Summer, Analytical Biochemistry 39:487-491 (1971)).
Еще одним общепринятым аналитическим методом является жидкостная хроматография высокого давления (ЖХВД). ЖХВД осуществляется при форсированном прохождении образца через специальную упакованную колонку посредством нагнетания жидкости, в которую добавлен образец, через эту колонку при высоком давлении. Материал, упакованный внутри колонки, называется стационарной или адсорбирующей фазой. Он обычно представляет собой тонкоизмельченные порошки или гели. Жидкость, которая называется подвижной фазой, обычно представляет собой органический и/или буферный раствор. Вещества, содержащиеся в образце, разделяемые в процессе хроматографии, обычно называют аналитами. Хроматограмма, визуальный вывод данных с хроматографа, отображает различные пики или картины, соответствующие разным компонентам (таким как аналиты) разделяемой смеси. ЖХВД-данные позволяют аналитику определять, имеются ли мешающие пики или пики совместно элюирующихся веществ, и точно фиксировать, где эти пики начинаются. По пикам, полученным в процессе ЖХВД, можно анализировать разделение, а при анализе на спектрофотометре невозможно определить, относятся ли результаты к примесям.
Известные способы использования ЖХВД для измерения уровня коллагена требует специального оборудования, такого как флуоресцентные детекторы или узкоспециализированные колонки, которые могут увеличить стоимость и/или усложнить анализ, делая этот метод недоступным (H.Inoue, et аl.; J. of Chromatography В, 757:369-373 (2001); D.A.Martinez et al., Diabetes Res. and Clinical Practice, 59 1-9 (2003); F.A.Vazquez-Ortiz et al., J. of Liquid Chromatography & Related Tech., 27, 17 2771-2780 (2004)). Inoue et al. описывают способ использования ЖХВД для определения уровней пролил-дипептидов, пролина и гидроксипролина в сыворотке крови человека в качестве показателей заболеваний, в которые вовлечен метаболизм коллагена. Для осуществления этого способа требуются тандемные ЖХВД-колонки и мониторинг при двух разных длинах волн излучения. Martinez et аl. анализировали гидроксипролин с использованием метода ЖХВД с обращенными фазами на колонке Waters Pico-Tag®, которая представляет собой специализированную колонку, специально упакованную для анализа аминокислот. При количественном определении поперечных связей гидроксипролина и гидроксилизилпиридинолина Martinez et аl., получили показатель содержания коллагена в левом желудочке сердца свиньи, но содержание коллагена количественно не было определено. Vazquez-Ortiz et al. описали способ определения концентрации коллагена в мясных продуктах, таких как болонская колбаса. Этот способ включает измерение содержания гидроксипролина с использованием ЖХВД с обращенными фазами и детектора Fluorichrom.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном воплощении настоящего изобретения предложен способ измерения общего коллагена в ткани, включающий: (а) получение образца ткани: (б) обработку этого образца ткани; (в) разделение по меньшей мере одного из глицина, пролина и гидроксипролина в обработанном образце ткани методом жидкостной хроматографии высокого давления с получением площади(ей) пика(ов) аналитов; (г) определение концентраций по меньшей мере одного из глицина, пролина и гидроксипролина в ткани; и (д) корреляцию концентраций по меньшей мере одного из глицина, пролина и гидроксипролина в ткани с количеством общего коллагена в ткани.
В другом воплощении настоящего изобретения предложен способ измерения общего коллагена в ткани, включающий: (а) получение образца ткани; (б) обработку этого образца ткани; (в) разделение глицина, пролина и гидроксипролина в обработанном образце ткани методом жидкостной хроматографии высокого давления с получением площадей пиков аналитов; (г) определение концентраций глицина, пролина и гидроксипролина в ткани; и (д) корреляцию концентраций глицина, пролина и гидроксипролина в ткани с количеством общего коллагена в ткани.
В некоторых воплощениях ткань представляет собой ткань из раневого участка. В одном из воплощений изобретения ткань гранулирована.
В следующих воплощениях изобретения предложен способ оценки или мониторинга протекания процесса заживления раны, включающий: (а) получение образца ткани из раневого участка субъекта: (б) обработку этого образца ткани; (в) разделение по меньшей мере одного из глицина, пролина и гидроксипролина в обработанном образце ткани методом жидкостной хроматографии высокого давления с получением площадей пиков аналитов; (г) определение концентраций по меньшей мере одного из глицина, пролина и гидроксилролина в ткани; (д) корреляцию концентраций по меньшей мере одного из глицина, пролина и гидроксипролина в ткани с количеством общего коллагена в ткани; и (е) сравнение количества общего коллагена в ткани из раневого участка с количеством коллагена в нераневой ткани для оценки протекания процесса заживления раны.
В еще одном воплощении изобретения предложен способ оценки протекания процесса заживления раны, включающий: (а) получение образца ткани из раневого участка субъекта; (б) обработку этого образца ткани: (в) разделение глицина, пролина и гидроксипролина в образце обработанной ткани жидкостной хроматографией высокого давления с получения площадей ликов аналитов; (г) определение концентраций глицина, пролина и гидроксипролина в ткани; (д) корреляцию концентраций глицина, пролина и гидроксипролина в ткани с количеством общего коллагена в ткани; и (е) сравнение количества общего коллагена в ткани в раневом участке с количеством коллагена в нераневой ткани для оценки протекания процесса заживления раны. В некоторых воплощениях способ повторяют по меньшей мере один раз, и при каждом повторе образец ткани получают из одного и того же раневого участка одного и того же субъекта. Повтор может быть выполнен по меньшей мере один раз в течение неограниченного периода времени. В некоторых воплощениях период времени может составлять сутки, неделю, два месяца, месяц, квартал, год, два года, три года, четыре года или пять лет. В некоторых воплощениях способ можно повторять каждый второй день, каждый третий день, каждый четвертый день, каждый пятый день, каждый шестой день, каждую неделю, каждую вторую неделю, каждую третью неделю, каждую четвертую неделю, каждую пятую неделю или каждую шестую неделю. Другие воплощения включают сравнение количества общего коллагена в ткани при первом повторе с количеством общего коллагена в ткани при одном или более последующих повторах. Сравнение количества общего коллагена в ткани в раневом участке дает возможность осуществлять мониторинг и/или оценку протекания процесса заживления раны.
Образец ткани может быть получен из источников, являющихся людьми или животными, такими как млекопитающие, земноводные, пресмыкающиеся, рыбы и птицы. Некоторые не ограничивающие примеры млекопитающих включают мышей, крыс, свиней, кроликов, собак, крупный рогатый скот и людей. Ткань может быть извлечена из источника различными способами, например вырезанием, соскабливанием, отсеканием, выскабливанием или иссечением. Извлечение может быть произведено с использованием инструмента, например ножа, скальпеля, бритвы или лезвия.
Данное изобретение применимо к любому типу ткани, содержащей коллаген. Коллаген является основным компонентом внеклеточного матрикса, который составляет основу большинства тканей. Кроме того, коллаген обнаруживается внутри некоторых клеток. Коллаген является основным компонентом мягких тканей, таких как кожа, фасция, хрящ, связки и сухожилия. Коллаген также присутствует в костях и зубах. В некоторых воплощениях изобретения тканью является кожа. Кожа состоит из трех основных слоев: эпидермис, который представляет собой наружный слой: дерма, в которой сосредоточено большое количество нервных окончаний и которая представляет собой соединительная ткань; и гиподерма, или подкожно-жировой слой.
У людей и животных насчитывается множество разных типов коллагена. В некоторых источниках сообщается о 28 разных известных типах. Приблизительно 80-90% коллагена, обнаруженного в организме человека, составляет комбинация коллагена типа 1 (находится в коже, сухожилиях, кости, связках, дентине и интерстициальной ткани), коллагена типа II (находится в хряще и стекловидном теле) и коллагена типа III (находится в клеточной культуре и ткани плода). Настоящее изобретение применимо к любому типу или комбинации типов коллагена.
Используемое здесь выражение "обработанный образец ткани" относится к образцу ткани, обработанному до состояния, пригодного для разделения его компонентов методом ЖХВД. Способы обработки ткани для анализа, включая ЖХВД-анализ, известны в данной области. Способы по изобретению могут включать такую обработку образца ткани, которая в конкретных воплощениях включает одно или более из следующих: (а) удаление жира из образца ткани; (б) дегидратация образца ткани; (в) гидролиз образца до аминокислот; и/или (г) дериватизация образца. Все эти способы включают известные и общепринятые в данной области процедуры. Удаление жира может быть проведено различными способами, включая физические и химические. В некоторых воплощениях химическое обезжиривание включает промывку растворителями или детергентами. Некоторыми не ограничивающими примерами таких растворителей являются этиловый спирт, ацетонитрил, гексан, пентан и/или ацетон. Дегидратация может быть осуществлена различными способами, такими как сублимационная сушка (лиофилизация), обезвоживание, контролируемый нагрев и/или вакуумирование. В конкретном не ограничивающем воплощении образец гидролизуют под действием хлороводородной кислоты и тепла и дериватизируют в растворе 4-диметиламиноазобензол-4'-сульфонилхлорида в ацетоне.
В одном из воплощений определение концентраций глицина, пролина и гидроксипролина в ткани включает: (а) получение образцов с известными концентрациями глицина, пролина и гидроксипролина; (б) разделение глицина, пролина и гидроксипролина в образцах методом жидкостной хроматографии высокого давления; (в) нанесение на график известных концентраций глицина, пролина и гидроксипролина по оси х и площадей пиков аналитов по оси у и построение линейной калибровочной кривой; и (г) вычисление концентраций каждого из глицина, пролина и гидроксипролина в обработанном образце ткани по формуле:
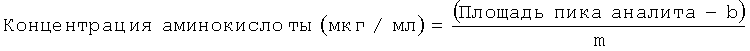
где b означает отрезок, отсекаемый по оси у, и m означает тангенс угла наклона линейной калибровочной кривой: и (д) вычисление концентраций каждого из глицина, пролина и гидроксипролина в ткани по формуле:

В еще одном воплощении корреляция концентраций глицина, пролина и гидроксипролина в ткани с количеством общего коллагена в ткани включает использование формулы:
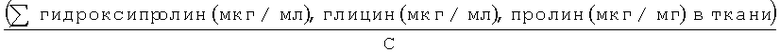
где С означает сумму значений процентного содержания глицина, пролина и гидроксипролина в коллагене. Значение "С" известно в данной области и может меняться в зависимости от типа коллагена. В не ограничивающем примере "С" равно 0,55.
Способы построения калибровочной кривой общеизвестны в данной области, и калибровочная кривая может быть построена от руки или с помощью инструмента или компьютера. Для построения калибровочной кривой могут быть использованы программы выравнивания кривых для компьютеров, калькуляторов и других приборов.
В одном воплощении изобретения жидкостная хроматография высокого давления представляет собой жидкостную хроматографию высокого давления с обращенными фазами. В другом воплощении жидкостную хроматографию высокого давления осуществляют на колонке С18, и в еще одном воплощении изобретения жидкостную хроматографию высокого давления осуществляют при рН в диапазоне от примерно 1 до примерно 12. Элюирование аналитов (глицина, пролина и гидроксипролина) во время жидкостной хроматографии высокого давления может быть измерено с использованием, например, детектора на фотодиодной матрице. В одном из воплощений элюирование измеряют при длине волны 436 нанометров. В одном из воплощений изобретения элюирование аналитов (глицина, пролина и гидроксипролина) во время жидкостной хроматографии высокого давления не измеряют с использованием флуоресцентного детектора.
В еще одном воплощении изобретения для жидкостной хроматографии высокого давления используют подвижную фазу, содержащую примерно 70% 25 мM буфера на основе фосфата калия, рН 11,0, и примерно 30% ацетонитрила. Подвижная фаза может содержать 50%, 60%, 70%, 80% или 90% буфера. Не ограничивающими примерами буферов являются фосфат калия, цитрат калия, Tris (трис(гидроксиметил)аминометан), HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота), MES (2-(N-морфолино)этансульфоновая кислота) или MOPS (3-морфолинопропансульфоновая кислота). Буферная фаза может содержать 10%, 20%, 30%, 40% или 50% ацетонитрила.
Способы по настоящему изобретению пригодны для обнаружения таких низких уровней коллагена, которые могут быть обнаружены на ранних стадиях заживления раны. В некоторых аспектах изобретения способ используют для обнаружения гидроксипролина, присутствующего в образце ткани в концентрации 1,0 мкг/мл или менее. В некоторых аспектах изобретения способ используют для обнаружения гидроксипролина, присутствующего в образце ткани в концентрации менее 0,9 мкг/мл, менее 0,8 мкг/мл, менее 0,7 мкг/мл, менее 0,6 мкг/мл, менее 0,5 мкг/мл, менее 0,4 мкг/мл, менее 0,3 мкг/мл или менее 0,2 мкг/мл. В некоторых воплощениях способ используют для обнаружения гидроксипролина, присутствующего в образце ткани в концентрации от 0,12 до 1,0 мкг/мл, от 0,12 до 0,9 мкг/мл, от 0,12 до 0,8 мкг/мл, от 0,12 до 0,7 мкг/мл, от 0,12 до 0,6 мкг/мл, от 0,12 до 0,5 мкг/мл, от 0,12 до 0,4 мкг/мл, от 0,12 до 0,3 мкг/мл, от 0,12 до 0,2 мкг/мл. В некоторых аспектах изобретения способ используют для обнаружения глицина, присутствующего в образце ткани в концентрации 1,0 мкг/мл или менее. В некоторых аспектах изобретения способ используют для обнаружения глицина, присутствующего в образце ткани в концентрации менее 0,9 мкг/мл, менее 0,8 мкг/мл, менее 0,7 мкг/мл, менее 0,6 мкг/мл, менее 0,5 мкг/мл, менее 0,4 мкг/мл, менее 0,3 мкг/мл, менее 0,2 мкг/мл или менее 0,1 мкг/мл. В некоторых воплощениях изобретения способ используют для обнаружения глицина, присутствующего в образце ткани в концентрации от 0,06 до 1,0 мкг/мл, от 0,06 до 0,9 мкг/мл, от 0,06 до 0,8 мкг/мл, от 0,06 до 0,7 мкг/мл, от 0,06 до 0,6 мкг/мл, от 0,06 до 0,5 мкг/мл, от 0,06 до 0,4 мкг/мл, от 0,06 до 0,3 мкг/мл, от 0,06 до 0,2 мкг/мл или от 06 до 0,1 мкг/мл. В некоторых аспектах изобретения способ используют для обнаружения пролина, присутствующего в образце ткани в концентрации 1,0 мкг/мл или менее. В некоторых аспектах изобретения способ используют для обнаружения пролина, присутствующего в образце ткани в концентрации менее 0,9 мкг/мл, менее 0,8 мкг/мл, менее 0,7 мкг/мл, менее 0,6 мкг/мл, менее 0,5 мкг/мл, менее 0,4 мкг/мл, менее 0,3 мкг/мл или менее 0,2 мкг/мл. В некоторых воплощениях способ используют для обнаружения пролина, присутствующего в образце ткани в концентрации от 0,12 до 1,0 мкг/мл, от 0,12 до 0,9 мкг/мл, от 0,12 до 0,8 мкг/мл, от 0,12 до 0,7 мкг/мл, от 0,12 до 0,6 мкг/мл, от 0,12 до 0,5 мкг/мл, от 0,12 до 0,4 мкг/мл, от 0,12 до 0,3 мкг/мл или от 0,12 до 0,2 мкг/мл.
Как упоминается выше, способы по настоящему изобретению пригодны для определения таких низких уровней коллагена, которые могут быть обнаружены на ранних стадиях заживления раны. Соответственно, в некоторых воплощениях настоящего изобретения предложены способы оценки протекания процесса заживления раны в моменты времени менее 9 суток, менее 8 суток, менее 7 суток, менее 6 суток, менее 5 суток, менее 4 суток, менее 3 суток или менее 2 суток от момента нанесения раны. В некоторых аспектах протекание процесса заживления раны оценивают в моменты времени от примерно 2 до 9 суток, от 2 до 8 суток, от 2 до 7 суток, от 2 до 6 суток, от 2 до 5 суток, от 2 до 4 суток, от 2 до 3 суток, от 3 до 9 суток, от 3 до 8 суток, от 3 до 7 суток, от 3 до 6 суток, от 3 до 5 суток или от 3 до 4 суток от времени нанесения раны.
Способы по настоящему изобретению также пригодны для обнаружения уровней коллагена в широком динамическом диапазоне. Этот широкий динамический диапазон полезен для мониторинга уровней коллагена в раневой ткани на всем протяжении протекания процесса заживления. В некоторых аспектах настоящего изобретения предложен способ, при котором концентрации каждого из гидроксипролина, глицина и пролина в образце ткани обнаруживают в диапазоне от 0,06 мкг/мл до 25 мкг/мл, 0,12 мкг/мл до 25 мкг/мл, 0,75 мкг/мл до 25 мкг/мл или от 0,75 мкг/мл до 24 мкг/мл.
Предполагается, что любой описанный здесь способ или композиция могут быть реализованы в любом другом описанном здесь способе или композиции.
Используемый в формуле изобретения термин "или" означает "и/или", если в прямой форме не указано, что данный термин относится только к выбору альтернатив, или альтернативы являются взаимоисключающими, хотя в описании изобретения предусмотрено определение, которое относится только к альтернативам и "и/или".
По всему тексту этой заявки термин "примерно" используется для указания на то, что числовое значение включает в себя стандартное отклонение погрешности для устройства или способа, используемых для определения этого значения.
Согласно давно существующему патентному законодательству указание в формуле изобретения или в описании изобретения термина в единственном числе в сочетании со словом "содержащий" означает "один или более", если конкретно не указано иное.
Остальные объекты, признаки и преимущества настоящего изобретения станут ясны из приведенного ниже подробного описания изобретения. Однако следует иметь в виду, что это подробное описание и конкретные примеры, демонстрирующие конкретные воплощения изобретения, приведены только для иллюстрации, поскольку различные изменения и модификации в пределах замысла и объема изобретения будут очевидны для специалистов в данной области из этого подробного описания.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Приведенные ниже графические материалы составляют часть настоящего описания изобретения и включены в него, чтобы дополнительно продемонстрировать некоторые аспекты настоящего изобретения. Сущность изобретения можно лучше понять, обращаясь к одной или более фигурам вместе с подробным описанием представленных здесь конкретных воплощений.
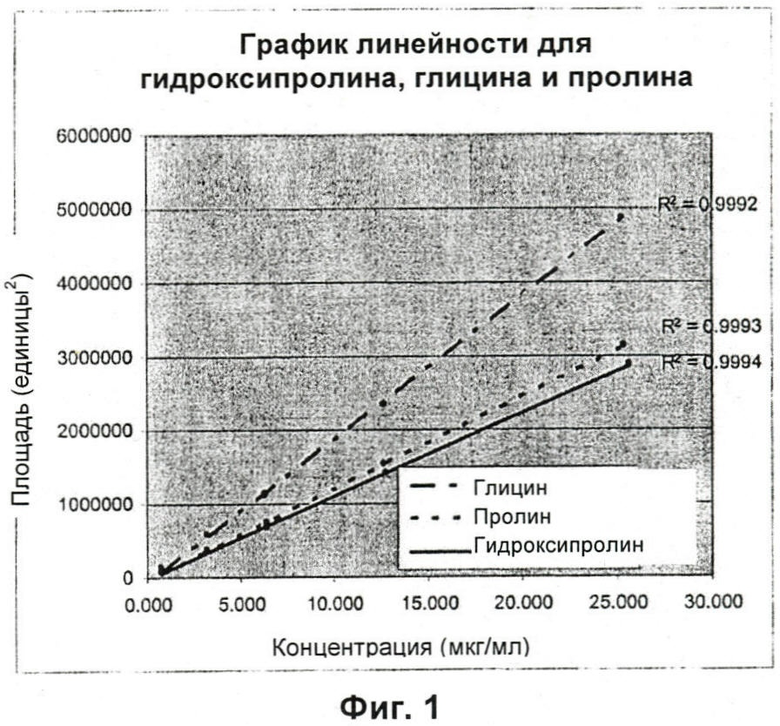
На Фиг.1 показан график линейности для гидроксипролина, глицина и пролина, репрезентативный для 1 случая для впрыскиваний стандартных смесей аминокислот 0,75 мкг/мл - 24 мкг/мл для гидроксипролина, глицина и пролина. Площади для каждой стандартной концентрации представляют собой значения, вычисленные как площади под каждым аминокислотным пиком. Указаны коэффициенты корреляции для линии общего направления каждой аминокислоты, и они свидетельствуют о том, что все аминокислотные калибровочные кривые линейны между 0,75 мкг/мл и 24 мкг/мл.
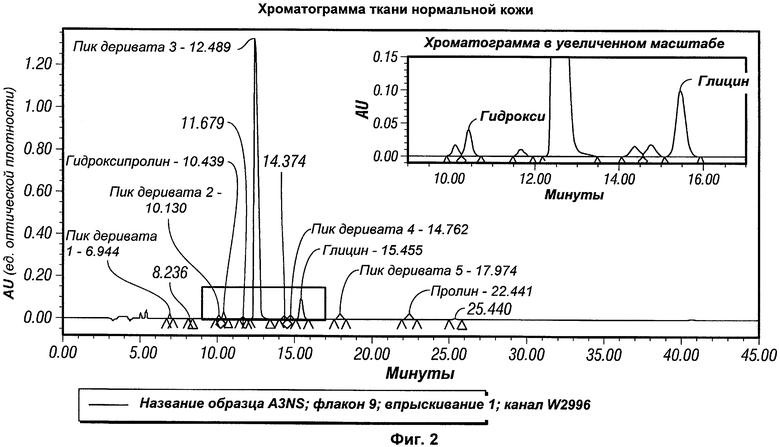
На Фиг.2 представлена типичная хроматограмма нормальной, неповрежденной кожи свиньи.
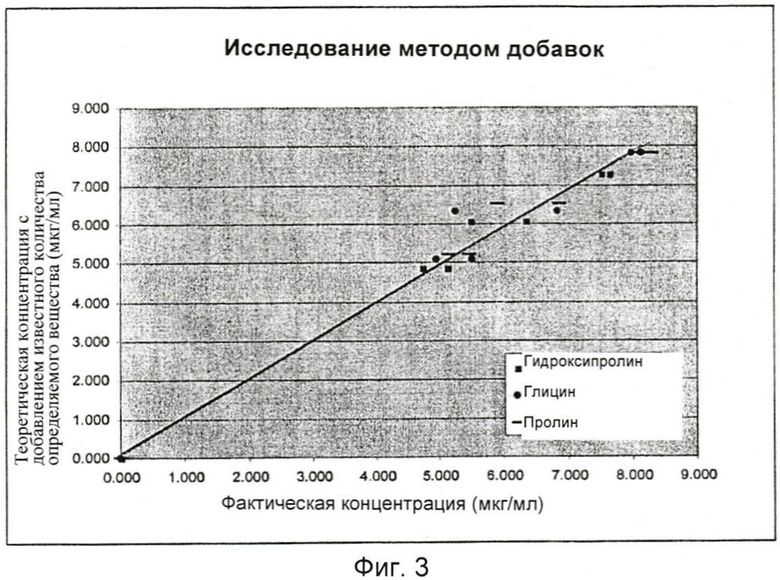
На Фиг.3 представлен график исследования методом добавок для гидроксипролина, глицина и пролина. В образец нормальной, неповрежденной кожи свиньи в двойном повторе вводили 80%, 100% и 120% 6,0 мкг/мл стандартной смеси аминокислот (целевой стандарт). Линия общего направления характерна для выхода для всех трех аминокислот. Результаты настолько сходны, что линии перекрываются. Коэффициенты корреляции для каждой аминокислоты составили 0,995 (гидроксипролин), 0,988 (глицин) и 0,995 (пролин).
ПОДРОБНОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
А. Процесс заживления раны
При нарушении целостности нормальной кожи, например, в результате хирургической операции, успешное заживление острой раны зависит от порядка прохождения через четыре известные фазы. Этими фазами являются гемостаз, воспаление, пролиферация и ремоделирование или нагноение. Во время гемостаза и на ранней фазе воспаления высвобождаются вазоконстрикторы, вызывающие констрикцию капилляров, что дает возможность тромбоцитам и воспалительным клеткам мигрировать в раневое ложе. Во время воспалительной фазы высвобождаются нейтрофилы, помогающие стабилизировать рану (R.F.Diegelmann and M.С.Evens, Frontiers in Bioscience, 9:283-289 (2004)). В пределах 2-3 суток в рану поступают макрофаги. Эти макрофаги ответственны за удаление нейтрофилов и поврежденного матрикса (A.J.Meszaros et al., J. of Immunology, 165:435-441 (2000)). Затем рана вступает в пролиферативную фазу с миграцией в рану фибробластов и кератиноцитов. Именно эти фибробласты продуцируют коллаген и другие белки внеклеточного матрикса, необходимые для образования грануляционной ткани. Грануляционная ткань обычно представляет собой перфузируемую и фиброзную соединительную ткань, которая вырастает из основания раны. Во время протекания процесса заживления раны молекулы коллагена образуют коллаген-фибриновый матрикс, который облегчает миграцию клеток в рану.
Во время пролиферативной фазы критической для протекания процесса заживления раны является инфильтрация фибробластов. Специфические цитокины, такие как тромбоцитарный фактор роста (PDGF) и трансформирующий фактор роста (TGF-β), являются регуляторами фибробластов, которые вовлечены в продуцирование грануляционной ткани. К тому же, TGF-β агрессивно стимулирует пролиферацию фибробластов, которые являются наиболее распространенным типом клеток, обнаруживаемых в раневом ложе. Во время последней фазы ремоделирования раны продолжается отложение коллагена. После двух лет ремоделирования прочность на растяжение раны достигает максимум приблизительно 80% от прочности на растяжение нормальной ткани кожи (С.Т.Hess и R.S.Kirsner, Advances in Skin & Wound Care, 16, 5:246-257 (2003)).
В некоторых случаях рана не заживает правильным предсказуемым образом за ожидаемое время. Такие раны считаются хроническими, и страдающие хроническими ранами могут получить дополнительный эмоциональный и физический стресс из-за того, что рана не заживает. Обычно хроническая рана развивается в тех случаях, когда что-то вызывает нарушение хода воспалительной фазы или пролиферативной фазы. Распространенные причины нарушения включают инфекцию, тканевую гипоксию, повторную травму, присутствие осколков и/или некротической ткани и некоторые заболевания, такие как диабет. Пациенты с хроническими ранами имеют более высокий риск инфицирования и часто жалуются на сильную боль. Для предупреждения осложнений вследствие хронических ран необходимо оценивать и контролировать состояние некоторых ран. Согласно настоящему изобретению предложены точные, специфические и надежные способы оценивания и контролирования ран путем количественного определения коллагена в раневой ткани. Эти способы достаточно чувствительны для измерения небольших количеств коллагена, находящегося в начинающих заживать ранах.
Б. Структура коллагена
Молекулы коллагена, или субъединицы "тропоколлагена", представляют собой палочки длиной примерно 300 нм и диаметром 1,5 нм. Они состоят из трех полипептидных цепочек, каждая из которых представляет собой левозакрученную спираль, которые скручены вместе в правозакрученную спираль. Самосборка субъединиц тропоколлагена происходит спонтанно, и внутри и между витками спирали имеется ковалентная сшивка. Коллагеновые фибриллы представляют собой упакованные молекулы коллагена, и коллагеновые волокна представляют собой пучки фибрилл. Расположение аминокислот в целях субъединиц коллагена является довольно характерным. Превалирует паттерн Gly-X-Рго или Gly-X-Hyp, где Х может быть любым из различных аминокислотных остатков, и конкретно конфигурация Gly-Pro-Hyp встречается часто.
Согласно настоящему изобретению предложен способ, который позволяет вычислять общий коллаген, анализируя данные для этих трех наиболее распространенных аминокислот, присутствующих в коллагене (гидроксипролина, глицина и пролина). В одном из воплощений общий коллаген вычисляют, рассчитывая сначала концентрации (мкг/мл) трех аминокислот по соответствующим калибровочным кривым. Так, концентрация (мкг/мг) гидроксипролина, глицина и пролина в каждом образце может быть определена по уравнению:
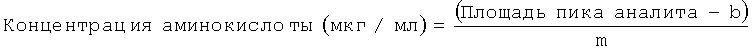
где b представляет собой отрезок, отсекаемый по оси у, и m представляет собой тангенс угла наклона линейной калибровочной кривой. Затем вычисляют концентрацию в образце влажной ткани (мкг/мг) для каждой аминокислоты, принимая в расчет массу образца, фактор разбавления и конечный объем образца (мл).

Затем общий коллаген может быть вычислен следующим образом: берут концентрации (мкг/мл) гидроксипролина, глицина и пролина, рассчитывают сумму этих трех значений и затем делят на сумму известных процентных содержаний гидроксипролина, глицина и пролина для конкретного типа коллагена, умноженную на 0,01. Это представлено ниже как "С," где С представляет собой сумму значений процентного содержания глицина, пролина и гидроксипролина в коллагене, представленную в виде доли. Так,
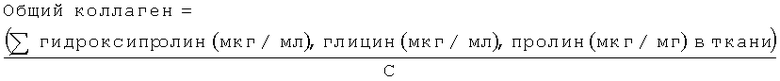
Значения С имеются в литературе, и приведенные значения могут варьировать в зависимости от типа коллагена. Например, сумма известных процентных содержаний гидроксипролина, глицина и пролина для коллагена, приведенная в Т.M.Devin, Proteins I: Composition and Structure, in: T.M.Devlin (Ed) Textbook of Biochemistry with Clinical Correlations, John Wiley & Sons, Inc., New Jersey, 2006, pp.101, составляет 55%, и сообщается также, что коллаген состоит из приблизительно 9,1% гидроксипролина, 33% глицина и 13% пролина, в сумме 55% от общего коллагена.
Перед аналитическим исследованием коллаген должен быть выделен из образца, взятого у субъекта, и зачастую химически обработан. Такие процедуры могут включать несколько стадий, таких как замораживание, распыление, лиофилизация (дегидратация), гидролиз и дериватизация. Другие стадии могут включать ферментативный гидролиз неколлагеновых молекул, фильтрование, осаждение, диализ, разбавление, сольватацию или неоднократную промывку. Известные в данной области примеры методик получения коллагена можно найти в патентах США №№5162506, 4597762 и 5814328.
В. Жидкостная хроматография высокого давления
Существует также много конкретных типов ЖХВД, основанных на материалах фаз, таких как с нормальными фазами, с обращенными фазами, ионообменные и биоаффинные. Например, ЖХВД с обращенными фазами выполняется с использованием неполярной стационарной фазы и водной, умеренно полярной подвижной фазы, и работает по принципу гидрофобных взаимодействий, вызываемых силами отталкивания между полярным элюентом, относительно неполярным аналитом и неполярной стационарной фазой. Для сравнения, ионообменная хроматография основана на притяжении ионов растворенного вещества и заряженных центров, связанных со стационарной фазой. Ионы одного и того же заряда исключаются. Несколько компаний, таких как Agilent Technologies, Hitachi и Waters Corporation изготавливают и продают установки и аксессуары для ЖХВД.
Установки для ЖХВД могут быть оснащены различными типами детекторов, например детектором на фотодиодной матрице. Детектор на фотодиодной матрице (PDA) представляет собой линейную матрицу из множественных независимых фотодиодных элементов, смонтированных вместе, например на интегральной микросхеме или мультиплексоре. Для спектроскопии она устанавливается на плоскости изображений спектрометра для обеспечения одновременного детектирования определенного диапазона длин волн. Матричные детекторы особенно полезны для регистрации полных спектров поглощения в ультрафиолетовом-видимом диапазоне образцов, которые быстро проходят через проточную измерительную ячейку, такую как в ЖХВД-детекторе.
Г. Примеры
Приведенные ниже примеры демонстрируют предпочтительные воплощения изобретения. Специалистам в данной области должно быть понятно, что методики, раскрытые в приведенных ниже примерах, представляют собой методики, разработанные авторами изобретения для успешного функционирования при практическом осуществлении изобретения, и поэтому их можно рассматривать как предпочтительные способы для его практического осуществления. Однако из описания настоящего изобретения специалистам должно быть понятно, что в раскрытых конкретных воплощениях могут быть произведены многие изменения и при этом получены сходные или аналогичные результаты, не выходя при этом за пределы сущности и объема изобретения.
1. Сбор и приготовление образцов
На спинах 20 домашних свиней (Sus scrofa) на всю толщину кожи образовывали эксцизионные раны диаметром 5 см. Лоскуты кожи, удаленные при образовании ран, моментально замораживали при -80°С в жидком азоте до использования в анализе на коллаген. Эти лоскуты служили в качестве образцов нормальной, неповрежденной кожи. На раны накладывали повязку с Duoderm™ (гидроколлоидный перевязочный материал), и повязки меняли 3 раза в неделю. На девятые сутки после нанесения ран животных подвергали эвтаназии, и лоскуты грануляционной ткани удаляли и замораживали их при -80°С в жидком азоте до использования в анализе на коллаген. Эти лоскуты служили в качестве образцов тканей, начинающих заживать.
После сбора образцов замороженные образцы кожной ткани измельчали в порошок с использованием биоизмельчителя, предназначенного для измельчения множества образцов (Multi sample biopulverizer, Biospec). Затем образцы лиофилизовали в течение ночи для удаления всей избыточной влаги.
Измельчение в порошок разрывает ткань кожи на части и экспонирует большую площадь поверхности, что способствует обезжириванию ткани. После лиофилизации образцы обезжиривали пятью последовательными 15-минутными промывками 70% этиловым спиртом, 100% этиловым спиртом, 100% ацетонитрилом и 100% ацетоном. Затем образцы оставляли сушиться при комнатной температуре. После сушки образцы подвергали гидролизу до аминокислот путем добавления 6 н. хлороводородной кислоты при 110°С в течение ночи. После лиофилизации образцы сушили под вакуумом в течение ночи для удаления всей остаточной хлороводородной кислоты и затем разводили в воде до конечной концентрации образца примерно 13 мг/мл.
Результаты для всех образцов рассчитывали из линейной кривой в диапазоне 0,75-24 мкг/мл. Образец 10 мкл, содержащий приблизительно 1,3×10-1 мг/мл ткани кожи, подвергали дериватизации с использованием одного миллилитра раствора 4-диметиламиноазобензол-4'-сульфонилхлорида в ацетоне в концентрации 1,3 мг/мл. Дериватизированные образцы разводили в 500 мкл 50 мМ бикарбоната натрия, рН 9,0, для нейтрализации рН раствора образца. Дериватизированные образцы инкубировали в течение 10-15 минут при 70°С и затем лиофилизовали в течение ночи. После лиофилизации образцы разводили в 2 мл 70% этилового спирта и фильтровали с использованием мембранного фильтра Whatman 25 мм GD/X PSU в виалы для ЖХВД.
2. ЖХВД-анализ и валидация
Все фильтрованные образцы анализировали на системе ЖХВД Waters Alliance® 2695, оснащенной детектором на фотодиодной матрице 2996, с использованием программы обработки данных Empower. Для определения содержания общего коллагена измеряли содержание гидроксипролина, глицина и пролина при 436 нм. В этом способе ЖХВД с обращенными фазами использовали предварительно кондиционированную колонку Phenomenex, Gemini™ C18 150×4,6 мм с размером частиц 3 микрона. Все образцы анализировали в изократических условиях с использованием предварительно смешанной и профильтрованной подвижной фазы, содержащей 70% буфера 25 мM фосфата калия, рН 11,0, и 30% ацетонитрила. Каждое впрыскивание длилось 45 минут со скоростью потока 0,5 мл/мин при комнатной температуре. Все гидроксилролин, глицина и пролин максимально элюировались к 25 минуте. В промежуток времени между 26 минутой и 45 минутой колонку промывали и уравновешивали перед следующим впрыскиванием.
Проводили валидацию этого способа ЖХВД в отношении линейности, правильности, прецизионности, точности/воспроизводимости, предела обнаружения и предела количественного определения. Линейность определяли по результатам анализа пяти приготовленных стандартов с известными концентрациями гидроксипролина, глицина и пролина в диапазоне 0,75-24 мкг/мл. Каждую стандартную концентрацию наносили на график зависимости площадь - известная стандартная концентрация, и для каждой вычисляли коэффициент корреляции. Каждая использованная линейность имела коэффициент корреляции более 0,996. Правильность определяли по результатам анализа шести образцов в один и тот же день и удостоверялись, что в среднем относительное стандартное отклонение (RSD) измеряемых величин составляет менее 15%. В двух отдельных случаях прецизионность определяли по результатам анализа шести впрыскиваний по 6,0 мкг/мл стандарта со сменой серии колонок для каждого случая и удостоверились, что RSD составляет менее 3%. Точность/воспроизводимость (устойчивость) оценивали по результатам испытаний шести разных препаратов образцов, приготовленных отдельными аналитиками, в трех разных случаях и удостоверялись, что RSD составляет менее 15% для каждого случая и менее 20% в среднем для всех трех случаев. Наконец, предел обнаружения и предел количественного определения определяли по результатам анализа серийных разведений стандартов ниже самой низкой стандартной концентрации линейности. Делали три последовательных впрыскивания каждого разведения, и затем результаты хроматографии анализировали в отношении предела обнаружения/предела количественного определения для гидроксипролина, глицина и пролина. Для каждой концентрации этой серии разведений вычисляли среднее значение и % RSD, а также рассчитывали соотношение максимального уровня сигнала и максимального уровня шума и записывали для каждого разведения. Предел концентрации обнаружения представлял собой концентрацию, при которой соотношение сигнал: шум равнялось 3:1. Пределом количественного определения был наименьший предел, при котором RSD составляло 15% или менее.
3. Результаты
Валидация показала, что способ по настоящему изобретению является точным, специфическим и достоверным. Проверка способа показала, что внешние стандарты гидроксипролина, глицина и пролина имеют линейный характер в диапазоне 0,75-24 мкг/мл (Фиг.1). Линейные коэффициенты корреляции (значения r2) для гидроксипролина, глицина и пролина составили 0,999±0,001, 0,999±0,002 и 0,999±0,001 соответственно. Было установлено, что наименьшие концентрации, которые могут быть обнаружены данным способом, для гидроксипролина, глицина и пролина составляют 0,12, 0,06 и 0,12 мкг/мл соответственно с использованием для вычисления этих значений соотношения сигнал:шум 3:1. Наименьшая концентрация, которая может быть количественно определена данным способом, для каждого стандарта составляет 0,24 мкг/мл для гидроксипролина, 0,12 мкг/мл для глицина и 0,24 мкг/мл для пролина. Эти значения были вычислены с использованием среднего максимального соотношения сигнал:шум 4:1 и среднего относительного стандартного отклонения в процентах (% RSD) 7,13.
Тестирование точности/воспроизводимости было сложной частью оценки данного способа и выполнялось на нераневой свиной ткани. Типичная хроматограмма ткани кожи представлена на Фиг.2. Время удерживания для гидроксипролина, глицина и пролина составляло 11,3, 18,6, и 24,9 минут соответственно. Шесть отдельных образцов обрабатывали и анализировали в трех отдельных случаях с варьированием дней анализа и/или аналитика. Затем для каждого случая вычисляли среднее значение и относительное стандартное отклонение. Общее среднее значение и общее относительное стандартное отклонение рассчитывали с использованием результатов всех трех случаев. Среднее значение для каждого случая составило 268,27 мкг/мг общего коллагена с RSD 5,20%. Общее среднее значение (для всех случаев) составило 240,82 мкг/мг общего коллагена с общим относительным стандартным отклонением 10,70%. Результаты тестирования точности/воспроизводимости для каждого случая и общие средние значения приведены в Таблице 1. Эти результаты показывают, что данный способ точен для анализа уровня коллагена в образцах кожной ткани.
Исследование методом добавок также было включено в квалификацию этого способа для подтверждения правильности способа и чтобы продемонстрировать, что этот способ не анализирует систематическую погрешность от матрикса ткани нормальной, неповрежденной кожи и что никаких помех для интересующих пиков не существует. Для этого исследования использовали один образец неповрежденной кожи, и в него добавляли в двух повторах 0%, 80%, 100% и 120% стандарта с концентрацией 6,0 мкг/мл, содержащего смесь всех трех аминокислот. Затем для каждой концентрации рассчитывали выход в процентах со средним и относительным стандартным отклонением. Выход для гидроксипролина составил 101,09% с RSD 5,93%. Выход для глицина составил 100,50% с RSD 9,52% и среднее значение выхода для пролина составило 101,23% с RSD 5,89%. Для каждого компонента были построены графики, показывающие соотношение между фактическими концентрациями и теоретической концентрацией. Для каждого графика вычисляли коэффициент корреляции, отрезок, отсекаемый по оси у, и тангенс угла наклона. Коэффициенты корреляции для каждого графика составили 0,995 для гидроксипролина, 0,988 для глицина и 0,995 для пролина (Фиг.3). Коэффициенты корреляции, почти равные единице, свидетельствуют о том, что фактическая концентрация эквивалентна теоретической. Результаты этого исследования методом добавок подтвердили отсутствие каких-либо мешающих пиков от матрикса ткани кожи.
Чтобы убедиться, что данный способ точно измеряет меньшие количества коллагена, обнаруживаемого в начинающих заживать ранах, анализировали свиную грануляционную ткань из ран 9-суточной давности. Данные этого анализа приведены в Таблице 2. Все образцы попали в линейный участок калибровочной кривой. Следовательно, концентрация общего коллагена во всех образцах может быть вычислена. Среднее количество коллагена, обнаруженное в свиной грануляционной ткани составило 56,846 мкг/мг, а среднее количество коллагена, обнаруженное в нормальной, неповрежденной коже, составило 240,823 мкг/мг.
4. Обсуждение
Этот способ ЖХВД потребовал тщательной оптимизации из-за близости времен элюирования гидроксипролина и пика деривата. В процессе оптимизации тестировали ряд разных колонок, и наилучшие результаты были получены с использованием колонки Gemini C18 с широким диапазоном рН. Валидация способа была основана на руководствах USP (Фармакопея США), содержащихся в разделе 501 Федерального закона о пищевых продуктах, медикаментах и косметических средствах (Section 501 of the Federal Food, Drug, and Cosmetic Act, <1225> Validation of Compendial Methods, in: (2004) The United States Pharmacopeia 27/The National Formulary 22, United States Pharmacopeial Convention, Inc., Maryland, 2004, pp.2622-2625). Значения коэффициента корреляции (r2) из исследований линейности показывают, что анализы всех аналитов линейны между 0,75 и 24 мкг/мл. Выход, полученный в исследовании методом добавок, показал, что данный способ является точным, и никакого вмешивающегося смешения эффектов обнаружено не было. Прецизионность способа была продемонстрирована получением результатов с погрешностью RSD менее 3% для каждого случая этого исследования. Точность/воспроизводимость способа была продемонстрирована получением значений RSD ≤ 15% в трех разных случаях и в целом ≤ 20%.
Способы, используемые для количественного определения небольших количеств коллагена, продуцируемого в ране в начальные моменты времени, должны быть чувствительными. Валидацию способа по настоящему изобретению проводили с использованием нормальной, неповрежденной кожи свиньи. Сразу после валидации способ использовали для количественного определения уровней коллагена в грануляционной ткани свиньи, чтобы удостовериться, что количественное определение коллагена в этой ткани находится в линейной области, установленной для данного способа. Доказано, что способ по настоящему изобретению является чувствительным, правильным и прецизионным по меньшей мере в диапазоне 0,75-24 мкг/мл. Этот способ дает возможность измерять количества коллагена, находящегося в нормальной ткани свиньи (приблизительно 241 мкг/мг массы свежей ткани), и у свиньи с гранулирующейся раной 9-суточной давности (приблизительно 57 мкг/мг).
Все композиции и способы, раскрытые и заявленные здесь, могут быть изготовлены и осуществлены без чрезмерного экспериментирования исходя из настоящего описания. Хотя композиции и способы по настоящему изобретению описаны на основе предпочтительных воплощений, специалисту в данной области должно быть ясно, что в описанные здесь композиции и способы, в стадии или в последовательности стадий способов, могут быть внесены изменения без отступления от концепции, сущности и объема настоящего изобретения. Более конкретно, должно быть ясно, что описанные здесь агенты могут быть заменены некоторыми агенты, которые являются и химически, и физиологически родственными, и такие же или сходные результаты будут достигнуты. Подразумевается, что все такие подобные замены и модификации, очевидные специалистам в данной области, находятся в рамках сущности, объема и концепции настоящего изобретения, которые определены прилагаемой формулой изобретения.
ССЫЛКИ
Приведенные ниже источники информации, в той степени, в которой они предоставляют описание методик или другие подробности в дополнение к изложенным здесь, конкретно включены в данное описание посредством ссылки на них.
G.S.Schultz et al., Extracellular matrix: review of its roles in acute and chronic wounds, World Wide Wounds, (August 2005) http://www.worldwidewounds.com2005/august/Schultz/Extrace-Matric-Acute-Chronic-Wounds.html;
Inoue et al., J. of Chromatography B, 724:221-230 (1999);
H.Stegemann and К.Stalder, Clinica Chemical Acta, 18:267-273 (1967); В.R.Switzer и G.К.Summer, Analytical Biochemistry 39:487-491 (1971);
H.Inoue et al.; J. of Chromatography B, 757:369-373 (2001);
D.A. Martinez et al., Diabetes Res. and Clinical Practice, 59 1-9 (2003);
F.A.Vazquez-Ortiz et al., J. of Liquid Chromatography & Related Tech., 27, 17 2771-2780 (2004);
R.F.Diegelmann and M.С.Evens, Frontiers in Bioscience, 9:283-289 (2004);
J.Meszaros et al., J. of Immunology, 165:435-441 (2000);
С.Т.Hess and R.S.Kirsner, Advances in Skin & Wound Care, 16, 5:246-257 (2003);
Патент США №5162506;
Патент США №4597762;
Патент США №5814328;
Section 501 of the Federal Food, Drug and Cosmetic Act, <1225> Validation of Compendial Methods, in: (2004) The United States Pharmacopeia 27/The National Formulary 22, United States Pharmacopeial Convention, Inc., Maryland, 2004, pp.2622-2625:
Т.M.Devin, Proteins I: Composition and Structure, in: T.M.Devlin (Ed) Textbook of Biochemistry with Clinical Correlations, John Wiley & Sons, Inc., New Jersey, 2006, pp.101.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ ДЛЯ РЕГЕНЕРАЦИИ КЛЕТОК КОЖИ И СЛИЗИСТЫХ ОБОЛОЧЕК | 2010 |
|
RU2455354C1 |
| КОМПОЗИЦИОННАЯ КОЛЛАГЕНОВАЯ ГУБКА И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 2012 |
|
RU2584348C2 |
| БИОИНЖЕНЕРНЫЙ КОНСТРУКТ ДЛЯ ИМПЛАНТАЦИИ ТКАНИ И СПОСОБ ИЗГОТОВЛЕНИЯ НАЗВАННОГО БИОИНЖЕНЕРНОГО КОНСТРУКТА (ВАРИАНТЫ) | 2008 |
|
RU2461622C2 |
| ПЕПТИДНЫЕ ФРАГМЕНТЫ ДЛЯ ИНДУКЦИИ СИНТЕЗА БЕЛКОВ ВНЕКЛЕТОЧНОГО МАТРИКСА | 2007 |
|
RU2501807C2 |
| ТЕТРАПЕПТИД, КОМПОЗИЦИЯ (ВАРИАНТЫ) И СПОСОБ СТИМУЛЯЦИИ ПРОДУКЦИИ КОЛЛАГЕНА ФИБРОБЛАСТОМ | 2007 |
|
RU2441877C2 |
| КОМПОЗИЦИИ ДЛЯ УСИЛЕНИЯ АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТИ МИЕЛОПЕРОКСИДАЗЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2529799C2 |
| Способ количественного определения дисульфирама в биологических средах | 2019 |
|
RU2701524C1 |
| ФОСФОЛИПИДНАЯ ЭМУЛЬСИЯ, ВКЛЮЧАЮЩАЯ ДИГИДРОКВЕРЦЕТИН, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2007 |
|
RU2369383C2 |
| СПОСОБ ТЕРАПИИ ПОВРЕЖДЕНИЙ КОЖИ И БИОТРАНСПЛАНТАТ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2014 |
|
RU2588835C1 |
| Композиция для регенерации кожи и слизистых оболочек | 2016 |
|
RU2621867C1 |
Изобретение относится к измерению содержания коллагена в грануляционном ложе раны и может дать информацию об успешном заживлении раны. Способ включает: (а) получение образца ткани из раневого участка субъекта; (б) обработку этого образца ткани; (в) разделение глицина, пролина и гидроксипролина в обработанном образце ткани методом жидкостной хроматографии высокого давления с получением площадей пиков аналитов; (г) определение концентраций глицина, пролина и гидроксипролина в ткани; (д) корреляцию концентраций глицина, пролина и гидроксипролина в ткани с количеством общего коллагена в ткани; и (е) сравнение количества общего коллагена в ткани в раневом участке с количеством коллагена в нераневой ткани для оценки протекания процесса заживления раны. Способ обладает точностью, специфичностью и достоверностью даже при небольших количествах коллагена, обнаруживаемых в начинающих заживать ранах. 16 з.п. ф-лы, 2 табл., 3 ил.
1. Способ оценки протекания процесса заживления раны, включающий:
(а) получение образца ткани из раневого участка субъекта;
(б) обработку этого образца ткани;
(в) разделение глицина, пролина и гидроксипролина в обработанном образце ткани методом жидкостной хроматографии высокого давления с получением площадей пиков аналитов;
(г) определение концентраций глицина, пролина и гидроксипролина в ткани;
(д) корреляцию концентраций глицина, пролина и гидроксипролина в ткани с количеством общего коллагена в ткани и (е) сравнение количества общего коллагена в ткани в раневом участке с количеством коллагена в нераневой ткани для оценки протекания процесса заживления раны.
2. Способ по п.1, где ткань представляет собой кожу.
3. Способ по п.1, где ткань гранулирована.
4. Способ по п.1, где стадии (а)-(е) повторяют по меньшей мере один раз, и при каждом повторе образец ткани получают из одного и того же раневого участка одного и того же субъекта.
5. Способ по п.4, где стадии (а)-(е) повторяют по меньшей мере один раз в течение периода времени от 3 суток до 2 лет.
6. Способ по п.4, дополнительно включающий сравнение количества общего коллагена в ткани при первом повторе с количеством общего коллагена в ткани при одном или более последующих повторах.
7. Способ по п.1, где субъектом является млекопитающее.
8. Способ по п.7, где млекопитающим является человек.
9. Способ по п.1, где обработка включает следующие стадии:
(а) удаление жира из образца ткани;
(б) дегидратация образца ткани;
(в) гидролиз образца до аминокислот и
(г) дериватизация образца.
10. Способ по п.1, где жидкостную хроматографию высокого давления осуществляют на колонке С18.
11. Способ по п.10, где колонка С18 имеет диапазон рН от 1 до 12.
12. Способ по п.1, где элюирование глицина, пролина и гидроксипролина во время жидкостной хроматографии высокого давления измеряют при 436 нм с использованием детектора на фотодиодной матрице.
13. Способ по п.1, где жидкостная хроматография высокого давления представляет собой жидкостную хроматографию высокого давления с обращенными фазами.
14. Способ по п.1, где жидкостную хроматографию высокого давления проводят с использованием подвижной фазы, содержащей 70% 25 мМ буферного раствора фосфата калия, рН 11,0, и 30% ацетонитрила.
15. Способ по п.1, где определение концентраций глицина, пролина и гидроксипролина в ткани включает:
(а) получение образцов с известными концентрациями глицина, пролина и гидроксипролина;
(б) разделение глицина, пролина и гидроксипролина в этих образцах методом жидкостной хроматографии высокого давления;
(в) нанесение на график известных концентраций глицина, пролина и гидроксипролина по оси х и площадей пиков аналитов по оси у и построение линейной калибровочной кривой; и
(г) вычисление концентраций каждого из глицина, пролина и гидроксипролина в обработанном образце ткани по формуле:
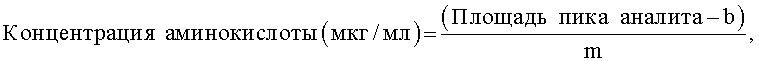
где b означает отрезок, отсекаемый по оси у, и m означает тангенс угла наклона линейной калибровочной кривой; и
(д) вычисление концентраций каждого из глицина, пролина и гидроксипролина в ткани по формуле:

16. Способ по п.1, где корреляция концентраций глицина, пролина и гидроксипролина в ткани с количеством общего коллагена в ткани включает использование формулы:
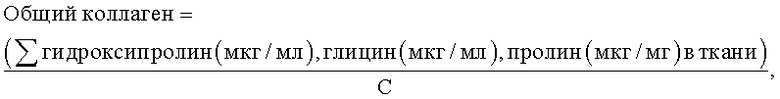
где С означает сумму значений процентного содержания глицина, пролина и гидроксипролина в коллагене, деленную на 100.
17. Способ по п.16, где С равно 0,55.
| Абаев Ю.К | |||
| Раневое заживление и сахарный диабет | |||
| Медицинские новости | |||
| Архив | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Найдено в БД Google | |||
| Телефон | 1923 |
|
SU908A1 |
| Alexander Christov et al | |||
| In Vivo Optical Analysis of Quantitative Changes in Collagen and Elastin During Arterial Remodeling | |||
| Photochemistry and Photobiology, 2005, 81:457-466 | |||
| СПОСОБ ЛЕЧЕНИЯ РАНЕВОГО ПРОЦЕССА КОЖИ ВЕК | 1999 |
|
RU2186593C2 |
Авторы
Даты
2012-06-10—Публикация
2007-09-21—Подача