Изобретение относится к области медицинской диагностики, может быть использовано для прогнозирования характера поражения матки миоматозными узлами у женщин с миомой матки.
Основная задача молекулярно-генетического типирования гена фактора некроза опухоли 1 типа - это определение единичной нуклеотидной замены в гене, которая вызывает изменение уровня продукции рецептора фактора некроза опухоли 1 типа, что может влиять на развитие опухолевого процесса при миоме матки.
Миома матки - это доброкачественная опухоль, растущая из незрелых миоцитов сосудистой стенки матки [1]. Занимает первое место среди доброкачественных опухолей половых органов, при этом каждая десятая гинекологическая больная страдает миомой матки. По поводу миомы матки выполняется до 50-70% оперативных вмешательств в гинекологических стационарах, из которых 60,9-95,5% приходится на радикальные операции, в том числе и в репродуктивном возрасте (24-26,8%) еще у совсем юных женщин, не успевших реализовать свою репродуктивную функцию [2]. Миома может состоять из нескольких, различных по размеру узлов. В медицинской практике принято оценивать размер миомы матки по аналогии с размерами развивающегося плода - неделями.
Проблема изучения этиопатогенеза миомы матки и факторов его определяющих продолжает оставаться в центре внимания отечественных и зарубежных исследователей [3, 4, 5, 6, 7, 8, 9]. Несмотря на значительный прогресс, сделанный в последние десятилетия в этом направлении [10, 11], и многочисленные гипотезы, объясняющие возникновение и течение миомы матки, ряд ключевых положений генеза этого заболевания до настоящего времени остается дискуссионным и недостаточно изученным, что затрудняет разработку новых органосохраняющих методов лечения данной патологии [12].
В последнее время накапливается все больше данных, свидетельствующих о том, что полиморфизм ряда генов имеет важное значение в формировании предрасположенности к повышенному риску развития миомы матки [13, 14]. Согласно материалам работы William H. et al., опубликованной в 2007 г. в журнале «Fertility and Sterility», в формировании миомы может быть задействовано более чем 100 генов, многие из которых участвуют в регуляции клеточного роста, дифференциации, пролиферации. В конечном итоге характер роста опухоли определяется динамическим балансом между пролиферацией клеток и клеточной гибелью.
Среди генов-кандидатов, участвующих в регуляции процессов апоптоза и клеточной пролиферации, важное значение имеют гены факторов некроза опухоли и их рецепторов [10, 11, 15]. Это определяется тем, что факторы некроза опухоли через свои специфические рецепторы фактора некроза опухоли 1-го типа - TNFR1 могут являться индукторами апоптоза [16, 17, 18].
Как свидетельствуют данные литературы, фактор некроза опухоли играет важную роль в формировании миомы матки. В работе Kurachi О. et al. (2001) на основе иммуногистохимического изучения материала 27 миом матки, размером 6·8 см, впервые был установлен более высокий уровень экспрессии TNF-α в культуре клеток лейомиомы (3,18·10-7 mol/L) по сравнению с нормальными клетками миометрия (3,67·10-8 mol/L). Интересные данные получены Кулагиной Н.В. (2008) при комплексном (иммунологическом, генетическом, морфологическом, клинико-лабораторном) обследовании 593 больных миомой матки. Автором установлены достоверно повышенные уровни ряда цитокинов, и в том числе TNF-α в перитонеальной жидкости у пациенток с длительностью течения заболевания более 5 лет по сравнению с пациентками, у которых миома матки была менее 5 лет.
Биологические эффекты факторов некроза опухоли реализуются через их взаимодействие со специфическими клеточными рецепторами. Выделяют два основных типа рецепторов факторов некроза опухоли:
- 1 типа, а именно TNFR1 или р55 TNF рецептор;
- 2 типа, а именно TNFR2 или р75 TNF рецептор.
Ген TNFR1 расположен на хромосоме 12 локус р13, а ген TNFR2 локализован на хромосоме 1 (1р36.2). Ген TNFR1 имеет «домен гибели» в цитоплазматической части молекулы данного рецептора и поэтому способен передавать летальный сигнал внутрь клетки-мишени, т.е. осуществлять индукцию апоптоза. TNFR2, в отличие от TNFR1, не содержит «доменов смерти» и вследствие этого данный тип рецепторов преимущественно вовлечен в регуляцию экспрессии генов, ответственных за рост и дифференцировку клеток. Рецепторы факторов некроза опухоли играют важную роль в регуляции иммунного ответа в организме, течении воспалительного процесса, проявлении избирательной цитотоксичности в отношении опухолевых клеток.
Из уровня техники роль различных генотипов факторов некроза опухоли и их рецепторов в отношении миомы матки до сих пор не известны.
Задачей изобретения является разработка способа прогнозирования характера поражения матки миоматозными узлами на основе данных о генотипах локуса +36 A/G рецептора фактора некроза опухоли 1 типа, иными словами локуса +36 A/G TNFR1.
Технический результат использования изобретения - получение критериев оценки характера роста миомы матки по площади, объему узлов и размеру матки, что позволит в кратчайшие сроки определить тактику ведения больной с миомой матки. При прогностически небольших размерах миоматозных узлов осуществлять консервативное наблюдение с применением гормональных препаратов, при прогнозировании больших размеров миоматозных узлов - проведение оперативного лечения в виде консервативной миомэктомии или эмболизации маточной артерии.
В соответствии с поставленной задачей был разработан способ прогнозирования характера поражения матки, включающий:
1) выделение ДНК из периферической венозной крови;
2) анализ генотипов локуса +36 A/G рецептора фактора некроза опухоли 1 типа TNFR1;
3) прогнозирование характера наименьшего поражения матки миоматозными узлами, включая площадь и объем узлов, а также размер матки при выявлении генотипов +36 GG и +36 AG TNFR1;
4) прогнозирование характера наибольшего поражения матки миоматозными узлами, включая площадь и объем узлов, а также размер матки при выявлении генотипа +36 АА TNFR1.
Таким образом, осуществление предлагаемого изобретения позволяет разработать индивидуальную тактику ведения больной. Например, осуществление консервативного наблюдения с применением гормональных препаратов при выявлении генотипов +36 GG и +36 AG TNFR1. Проведение оперативного лечения в виде консервативной миомэктомии или эмболизации маточной артерии при обнаружении у больной миомой матки генотипа +36 АА TNFR1.
Новизна и изобретательский уровень заключаются в том, что из уровня техники не известна возможность определения особенностей характера поражения матки миоматозными узлами на основе данных о генотипах локуса +36 A/G рецептора фактора некроза опухоли 1 типа TNFR1.
Способ характеризуется следующими графическими материалами.
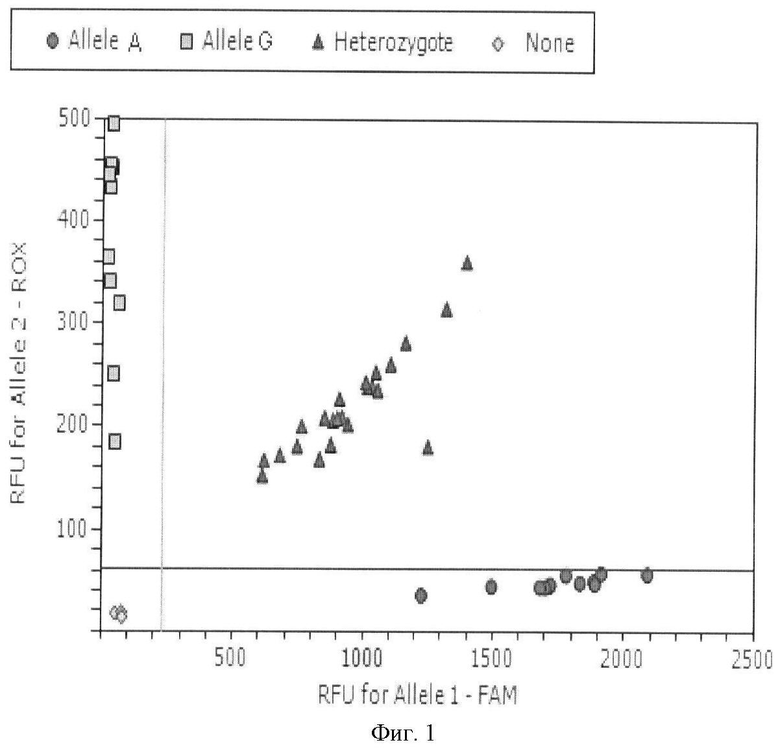
На Фиг.1 представлен стандартный график для генотипирования методом Tag Man зондов по данным величин RFU (уровень относительной флуоресценции) каждого зонда. Дискриминация аллелей по локусу 36A/G TNFR1 (где  - гомозиготы 36АА TNFR1,
- гомозиготы 36АА TNFR1,  - гомозиготы 36GG TNFR1,
- гомозиготы 36GG TNFR1,  - гетерозиготы 36AG TNFR1).
- гетерозиготы 36AG TNFR1).
На фиг.2 представлена зависимость размера матки (недели) от выявленного генотипа локуса +36 A/G рецептора фактора некроза опухоли 1 типа TNFR1.
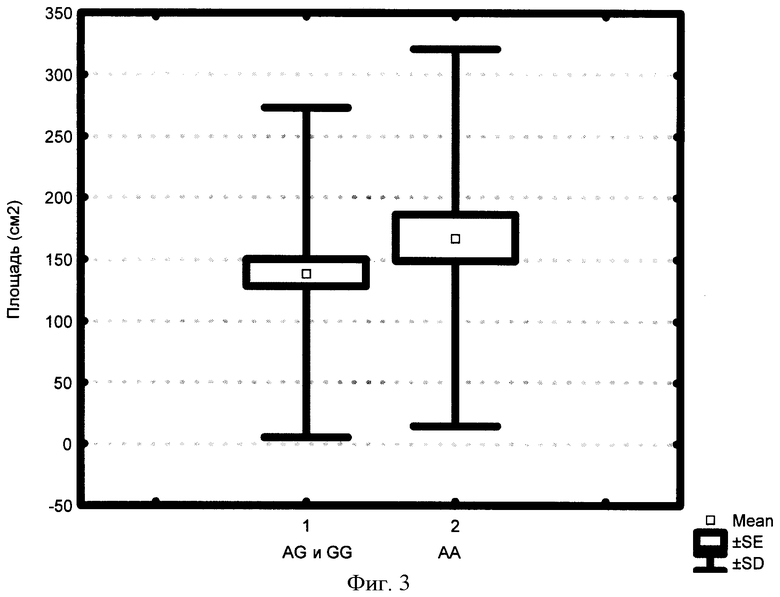
На фиг.3 представлена зависимость площади (см2) миоматозных узлов от выявленного генотипа локуса +36 A/G рецептора фактора некроза опухоли 1 типа TNFR1.
На фиг.4 представлена зависимость объема (см3) миоматозных узлов от выявленного генотипа локуса +36 A/G рецептора фактора некроза опухоли 1 типа TNFR1.
Для проведения анализа генотипов локуса +36 A/G рецептора фактора некроза опухоли 1 типа TNFR1 осуществляют забор периферической венозной крови.
На первом этапе к 4 мл крови добавляют 25 мл лизирующего буфера, содержащего 320 мМ сахарозы, 1% тритон Х-100, 5 мМ MgCl2, 10 мМ трис-HCl (pH 7,6). Полученную смесь перемешивают и центрифугируют при 4°C, 4000 об/мин в течение 20 минут. После центрифугирования надосадочную жидкость сливают, к осадку добавляют 4 мл раствора, содержащего 25 мМ ЭДТА (рН 8,0) и 75 мМ NaCl, ресуспензируют. Затем прибавляют 0,4 мл 10% SDS, 35 мкл протеиназы К (10 мг/мл) и инкубируют образец при 37°C в течение 16 часов.
На втором этапе из полученного лизата последовательно проводят экстракцию ДНК равными объемами фенола, фенол-хлороформа (1:1) и хлороформа с центрифугированием при 4000 об/мин в течение 10 минут. После каждого центрифугирования производят отбор водной фазы. ДНК осаждают из раствора двумя объемами охлажденного 96% этанола. Сформированную ДНК растворяют в бидистиллированной, деионизованной воде и хранят при - 20°C.
Анализ генотипов локуса TNFR1 (+36 A/G TNFR1) проводят методом полимеразной цепной реакции синтеза ДНК на амплификаторе IQ5 (Bio-Rad) с использованием стандартных олигонуклеотидных праймеров и специфических зондов с последующим анализом полиморфизма методом дискриминации аллелей (таблица 1).
Реакционная смесь объемом 25 мкл включает: 67 мМ трис-HCl (pH 8,8), 2,5 мМ MgCl2, 0,1 мкг геномной ДНК, по 10 пМ каждого праймера, по 5 пкмоль каждого зонда, по 200 мкМ dATP, dGTP, dCTP, dTTP и 1 единицу активной Taq-полимеразы. После денатурации (4 мин при 95°C) выполняют 40 циклов амплификации по схеме: отжиг праймеров - 1 мин при 59°C; денатурация - 15 сек при 95°C.
При проведении ПЦР в амплификаторе с флюоресцентной детекцией (амплификатор IQ5) генотипирование осуществляют методом Tag Man зондов по данным величин RFU (уровень относительной флуоресценции) каждого зонда. Зонд с флуоресцентным красителем ROX соответствует генотипу GG, зонд с красителем FAM - генотипу АА. Две полосы, вертикальная и горизонтальная, делят график на четыре секции: одна для каждого гомозиготного состояния, одна для гетерозиготного состояния и одна секция без реакции. Присвоение генотипов неизвестным образцам определяется вычерчиванием RFU для одного флуорофора (на оси х) относительно RFU для другого флуорофора (на оси у) на диаграмме дискриминации аллелей (фиг.1).
- Если значения RFU неизвестного образца находятся выше горизонтальной полосы и правее вертикальной полосы, то его генотип AG.
- Если значения RFU неизвестного образца находятся выше горизонтальной полосы и левее вертикальной полосы - генотип GG (RFU генотип GG отложены по оси у).
- Если значения RFU неизвестного образца находятся ниже горизонтальной полосы и правее вертикальной - генотип АА (RFU генотип АА отложены по оси х).
- Если значения RFU неизвестного образца находятся ниже горизонтальной полосы и левее вертикальной, определение генотипа невозможно (в данном случае неопределенный образец - отрицательный контроль).
Формирование базы данных и статистические расчеты осуществлялись с использованием программы «STATISTICA 6.0». Сравнивалась степень поражения матки миоматозными узлами у женщин с различными генотипами по локусу +36 A/G TNFR1.
В качестве конкретного примера представлен анализ результатов наблюдений 229 женщин с миомой матки. Пациенты включались в группу обследования только после установления диагноза заболевания, подтвержденного с помощью клинических и лабораторно-инструментальных методов обследования.
Проведено изучение характера поражения матки миоматозными узлами в зависимости от генотипов локуса +36 A/G рецептора фактора некроза опухоли 1 типа TNFR1. Выявлено, что у женщин с миомой размер матки в среднем составляет 7,60±0,16 нед, площадь миоматозных узлов равняется в среднем 144,79±7,87 см2, а объем миоматозных узлов - 168,05±15,58 см3. Характер распределения данных количественных признаков по размеру матки, площади и объему миоматозных узлов в исследуемой группе пациенток не соответствует закону нормального распределения, о чем свидетельствуют значения критерия Шапиро-Уилка W=0,63-0,83 с уровнем их статистической значимости p<0,001. Поэтому для сравнительного анализа характера поражения матки у пациенток с разными генотипами по изучаемым молекулярно-генетическим маркерам, использовали непараметрические методы (критерий Манна-Уитни).
Установлено, что у пациенток с генотипами +36 GG и +36 AG гена рецептора фактора некроза опухоли 1 типа размер матки в среднем составляет 7,41 нед, тогда как у женщин с генотипом +36 АА по этому локусу данный показатель равняется 8,18 нед (фиг.2). Различия между сравниваемыми группами статистически достоверны (р=0,045).
Аналогичной направленности различия между двумя сравниваемыми группами больных с миомой матки по локусу +36 A/G TNFR1 выявлены и по таким патогенетическим важным показателям, как площадь миоматозных узлов и их объем. Пациентки с генотипами +36 GG и +36 AG гена TNFR1 имеют среднюю площадь миоматозных узлов - 139,23 см2 (фиг.3), а средний объем миоматозных узлов - 155,67 см3 (фиг.4), что статистически значимо (р=0,0032 и р=0,021, соответственно) отличается от аналогичных данных в группе больных с генотипом +36 АА TNFR1, где эти показатели составили - 167,57 см2 и 212,38 см3, соответственно.
Таким образом, установлено, что у женщин с миомой матки, имеющих генотипы +36 GG и +36 AG TNFR1, можно прогнозировать наименьшие размеры матки, меньшую площадь и объем миоматозных узлов, чем у пациенток с генотипом +36 АА, у которых наблюдается более выраженный характер поражения матки при миоме, а именно большая площадь и объем миоматозных узлов, наибольшие размеры матки.
Приведенные примеры подтверждают, что поставленная задача - разработка способа прогнозирования характера поражения матки миоматозными узлами на основе данных о генотипах локуса +36 A/G рецептора фактора некроза опухоли 1 типа решена. При выявлении у больной миомой матки генотипов +36 GG и +36 AG TNFR1 можно предсказать меньшую площадь и объем миоматозных узлов, наименьшие размеры матки у данной пациентки и на этой основе разработать индивидуальную тактику ведения данной больной путем осуществления консервативного наблюдения с применением гормональных препаратов. При обнаружении у больной миомой матки генотипа +36 АА TNFR1 можно предполагать большую площадь и объем миоматозных узлов, наибольшие размеры матки у этой пациентки и соответственно в качестве индивидуальной тактики ведения данной больной следует избирать проведение оперативного лечения в виде консервативной миомэктомии или эмболизации маточной артерии на ранней стадии развития миомы.
Использование предложенного способа позволит прогнозировать характер поражения матки миоматозными узлами на ранних стадиях развития, что позволит более уверенно использовать органосохраняющие методы лечения при данной патологии.
Источники информации
1. Змушко Е.И., Белозеров Е.С., Митин Ю.И. Клиническая иммунология. - Изд. Питер., 2001 - 576 с.
2. Кулагина Н.В., Сысоев К.А., Чухловин А.Б., Морозова Е.Б. и др. Роль системы хемокинов в развитии различных клинических вариантов течения миомы матки // Материалы межрегиональной научно-практической конференции, посвященной 65-летию кафедры перинатологии, акушерства и гинекологии лечебного факультета «Актуальные вопросы акушерства и гинекологии». - Красноярск: Изд-во ООО «Версо», 2008. - С.83-89.
3. Савицкий Г.А., Савицкий А.Г. Миома матки. Проблемы патогенеза и патогенетической терапии / 3-е изд. - СПб.: Элби-СПб, 2003. - 236 с.
4. Сидорова И.С., Рыжова О.В. Роль факторов роста в патогенезе миомы матки // Акушерство и гинекология. - 2002. - №1. - С.12-13.
5. Сидорова И.С. Миома матки. - М., 2003. - 256 с.
6. Тихомиров А.Л., Лубнин Д.М. Миома матки. - МИА. - 2006. - 174 с.
7. Унанян А.Л., Сидорова И.С, Коган Е.А., Леваков С.А. Роль апоптоза и пролиферации в патогенезе миомы матки в сочетании с аденомиозом // Материалы VI Российского форума «Мать и дитя». - 2004. - С.512-513.
8. Asghar Т., Yoshida S., Kennedy S. et al. The tumor necrosis factor-alpha promoter-1031C polymorphism is associated with decreased risk of endometriosis in a Japanese population // Hum Reprod. - 2004. - Vol.19. - P.2509-2514.
9. Burroughs K.D., Kiguchi K., Howe S.R. et al. Regulation of apoptosis in uterine leiomyomata // Endocrinology. - 1997. - Vol.138. - P.3056-3064.
10. Flake G.P., Andersen J., Dison D. Etiology and pathogenesis of uterine leiomyomas: a review // Environ. Health. Perspect. - 2003. - Vol.111. - P.1037-1054.
11. Fujimoto J., Ffirose R., Sakaguchi Ff., Tamaya T. Expression of size-polymorphic androgen receptor gene in uterine leiomyoma according to the number of cytosine, adenine, and guanine repeats in androgen receptor alleles // Tumour Biol. - 2000. - Vol.21, №1. - Р.33-37.
12. Hisaoka M., Sheng W.Q. et al. HMGIC alterations in smooth muscle tumors of soft tissues and other sites // Cancer Genet. Cytogenet. - 2002. - Vol.138, №1. - P.50-55.
13. Karube-Harada A., Sugino N., Kashida S. et al. Induction of manganese superoxide dismutase by tumour necrosis factor - α in human endometrial stromal cells // Molecular human reproduction. - 2001. - Vol.7, №11. - P.1065-1072.
14. Kokawa K., Shikone Т., Otani T. et al. Apoptosis and the expression of Bcl-2 and Bax in patients with endometrioid, clear cell and serous carcinomas of the uterine endometrium // Gynecol. Oncol. - 2001. - Vol.81. - P.178-183.
15. Kurachi O., Matsuo H., Samoto Т., Maruo T. Tumour necrosis factor - α expression in human uterine leiomyoma and its down-regulation by progesterone // J. Clin. endocrinology and metabolism. - 2001. - Vol.86, №5. - P.2275-2280.
16. Olovsson M., Бурлев В.А., Волков Н.И. и др. Клеточная пролиферация, апоптоз и рецепторы к стероидным гормонам у больных с миомой матки // Акуш. и гин. - 2005. - №4. - С.23-28.
17. Rein M.S. Advances in uterine leiomyemata research: the progesterone hypothesis // Environ Health Perspect. - 2000. - Vol.108, №1. - P.791-793.
18. Wu X., Blanck A., Olovsson M. et al. Expression of Bcl-2, Bcl-x, Mcl-1, Bax and Bak in human uterine leiomyomas and myometrium during the menstrual cycle and after menopause // J Steroid Biochem Mol Biol. - 2002. - Vol.80. - P.77-83.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ДОБРОКАЧЕСТВЕННОЙ ДИСПЛАЗИИ МОЛОЧНОЙ ЖЕЛЕЗЫ У ЖЕНЩИН С ГЕНИТАЛЬНЫМ ЭНДОМЕТРИОЗОМ | 2012 |
|
RU2480763C1 |
| Способ прогнозирования риска развития миоматозных узлов больших размеров у пациенток с миомой матки | 2016 |
|
RU2616246C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ МНОГОУЗЛОВЫХ ПОРАЖЕНИЙ ПРИ ЛЕЙОМИОМЕ МАТКИ | 2011 |
|
RU2445625C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ПЛОЩАДИ МИОМАТОЗНЫХ УЗЛОВ ПРИ МИОМЕ МАТКИ | 2010 |
|
RU2433402C1 |
| Способ прогнозирования риска развития миомы матки у женщин с нормальной массой тела | 2024 |
|
RU2833110C1 |
| Способ прогнозирования риска развития миомы матки на основе молекулярно-генетического тестирования | 2024 |
|
RU2833106C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА ФОРМИРОВАНИЯ ГИПЕРПЛАСТИЧЕСКИХ ПРОЦЕССОВ ЭНДОМЕТРИЯ | 2014 |
|
RU2557977C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИНТЕНСИВНОСТИ И РЕЗИСТЕНТНОСТИ БОЛЕВОГО СИНДРОМА ПОСЛЕ ОПЕРАЦИИ ВИДЕОЛАПАРОСКОПИЧЕСКОЙ ХОЛЕЦИСТЭКТОМИИ У БОЛЬНЫХ ХРОНИЧЕСКИМ КАЛЬКУЛЕЗНЫМ ХОЛЕЦИСТИТОМ | 2011 |
|
RU2461830C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ФОРМИРОВАНИЯ ХРОНИЧЕСКОГО ЛИМФОЛЕЙКОЗА И РАЗВИТИЯ СОЧЕТАННЫХ ОСЛОЖНЕНИЙ В ДЕБЮТЕ ЗАБОЛЕВАНИЯ | 2011 |
|
RU2458349C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ИШЕМИЧЕСКОГО ИНСУЛЬТА С УЧЕТОМ ГЕНЕТИЧЕСКИХ И СРЕДОВЫХ ФАКТОРОВ | 2018 |
|
RU2679635C1 |


Изобретение относится к области медицины. Предложен способ прогнозирования характера поражения матки миоматозными узлами у больной миомой матки, включающий выделение ДНК из периферической венозной крови, анализ генотипов локуса +36 A/G рецептора фактора некроза опухоли 1 типа TNFR1 и анализ миоматозных узлов, а также размер матки. При выявлении генотипов +36 GG и +36 AG TNFR1 прогнозируют наименьшую степень поражения матки. При выявлении генотипа +36 АА TNFR1 прогнозируют наибольшую степень поражения матки. Использование предложенного способа позволяет прогнозировать характер поражения матки миоматозными узлами на ранних стадиях развития. 4 ил., 1 табл., 1 пр.
Способ прогнозирования характера поражения матки миоматозными узлами у больной миомой матки, включающий выделение ДНК из периферической венозной крови, анализ генотипов локуса +36 A/G рецептора фактора некроза опухоли 1 типа TNFR1, прогнозирование характера поражения матки миоматозными узлами, включая площадь и объем узлов, а также размер матки, причем при выявлении генотипов +36 GG и +36 AG TNFR1 прогнозируют наименьшую степень поражения матки, при выявлении генотипа +36 АА TNFR1 прогнозируют наибольшую степень поражения матки.
| КУЛАГИНА Н.В | |||
| Миома матки: иммунологическая и психосоматическая концепция развития, индивидуальный прогноз и тактика ведения | |||
| Автореф | |||
| дисс | |||
| д.м.н | |||
| - СПб., 2008, 473 с | |||
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
Авторы
Даты
2012-06-20—Публикация
2010-06-17—Подача