Техническая область
Настоящее изобретение касается производного аминоспирта, пригодного в качестве иммунодепрсссивного средства, а также его соли и гидрата.
Предпосылки настоящего изобретения
Иммунодепрессивные средства широко используются как лечебные при аутоиммунных заболеваниях, таких как ревматоидный артрит, нефрит, дегенеративный артрит коленного сустава и системная красная волчанка; при хронических воспалительных заболеваниях, таких как воспаление кишечника; и аллергических заболеваниях, таких как астма и дерматит. В частности, в связи с развитием медицинской технологии, за последние годы произведено большое количество операций по трансплантации тканей, органов и им подобных операций. При такой медицинской практике надежный контроль вероятности послеоперационного отторжения трансплантата определяет, была ли трансплантация успешной или нет. В этой области иммунодепрессивные средства также играют важную роль.
При трансплантации органов используют: антиметаболиты, представленные азатиоприном и микофенолятом мофетила; ингибиторы кальциневрина, представленные циклоспорином А и такролимусом; а также гормоны коры надпочечников, представленные преднизолоном. Однако в некоторых случаях эффективность этих фармацевтических средств была неудовлетворительной, или для предотвращения серьезных побочных эффектов (типа поражения почек), был важен мониторинг концентрации крови. Таким образом, с точки зрения эффективности и побочных действий указанные фармацевтические средства не всегда являлись адекватными.
Помимо этого, в целях ослабления побочного действия иммунодепрессивного средства, а также для достижения достаточной иммунодспрсссивной активности типична терапия с использованием большого количества лекарственных средств. Таким образом, существует также потребность разработки нового типа фармацевтического средства, механизм действия которого отличается от механизма описанных выше иммунодспрессивных средств.
В настоящее время в качестве новых иммунодепрессивных средств привлекают внимание различные производные аминоспиртов, типа производных 2-амино-1,3-пропандиола и производных 2-аминоэтанола. Однако сами по себе эти производные аминоспиртов не обладают иммунодепрессивной активностью. Эти лекарственные средства подвергаются метаболизму после их введения в организм, продуцируя фосфат, и именно этот фосфат представляет собой истинное физиологически активное вещество. Получаемый в результате этого фосфат обладает агонистической и антагонистической активностью в отношении рецепторов сфингозин-1-фосфата (S1P). В частности, в 2002 году впервые было сделано сообщение о том, что агонистическая активность в отношении рецепторов S1P1 выражается как иммунодепрессивная активность, реализуемая за счет регулировки миграции лейкоцитов (непатентные документы 1 и 2). Также раскрывается, что, помимо эффективности при трансплантации различных органов, ряд производных, представленных в этих патентных документах, эффективен при ревматоидном артрите, почечной волчанке, системной красной волчанке, хроническом тиреоидите, множественном склерозе, бульбоспинальном параличе, сахарном диабете I и II второго типа, аутоиммунных заболеваниях (типа болезни Хорна), аллергических заболеваниях (типа атопического дерматита, аллергического ринита, аллергического конъюнктивита и аллергического контактного дерматита), а также воспалительных заболеваниях (типа воспалительных заболеваний кишечника или язвенного колита) (патентные документы 1 и 2). Из этих сообщений следует, что не только производные аминоспиртов, но и различные соединения (такие, как аминофосфатные производные и производные аминокарбоновых кислот) раскрываются в качестве иммунодепрессивных средств или регуляторов рецепторов S1P1-S1P5; особо выделены рецепторы S1P1 (патентные документы 3-66).
Далее, поскольку рецепторы S1P4 в основном сконцентрированы в иммуннокомпетентных клетках (типа лейкоцитов), а также в органах, которые вносят основной вклад в иммунную систему, то предполагают, что рецепторы S1P4 имеют значительный вклад в указанную систему. Действительно, раскрыта агонистическая активность соединений S1P4 в отношении аутоиммунных заболеваний, таких как ревматизм и астма, аллергических заболеваний, типа атопнческого дерматита, а также воспалительных заболеваний (патентные документы 34, 39 и 50).
Таким образом, в то время как большое внимание уделяется лекарственным средствам - агонистам рецептора S1P, которые могут иметь скрытый потенциал для широкого ряда медицинских приложений, однако не все лекарственные агонисты рецептора S1P обеспечивают нужное воздействие на организм.
Например, было установлено, что лекарственное средство - агонист рецептора S1P, который в клинических испытаниях продемонстрировал эффективность по подавлению отторжения трансплантированных органов, вызывает брадикардию, являющуюся побочным действием введения этого лекарственного средства. Отмечается, что, вероятно, этот эффект может быть вызван агонистической активностью в отношении рецептора S1P3 (непатентные документы 3 и 4). Кроме того, отмечалось также, что в эксперименте на лабораторных животных агонистическая активность в отношении рецептора S1P3 препятствует току крови миокарда (непатентный документ 5), вызывает спазмы церебральных артерий (непатентный документ 6) и отек легких (непатентный документ 7).
Патентный документ 1 WO 0218395 проспект
Патентный документ 2 WO 02076995 проспект
Патентный документ 3 WO 9408943 проспект
Патентный документ 4 выложенная открытая заявка Японии № Hei 9-2579602
Патентный документ 5 WO 0206268 проспект
Патентный документ 6 выложенная открытая заявка Японии №2002-53572
Патентный документ 7 выложенная открытая заявка Японии №2002-167382
Патентный документ 9 WO 02076995 проспект
Патентный документ 10 выложенная открытая заявка Японии №2003-137894
Патентный документ 11 WO 03040097 проспект
Патентный документ 12 WO 02064616 проспект
Патентный документ 13 WO 02062389 проспект
Патентный документ 14 выложенная открытая заявка Японии №2002-267936
Патентный документ 15 выложенная открытая заявка Японии №2003-267936
Патентный документ 16 WO 03051876 проспект
Патентный документ 17 WO 03061567 проспект
Патентный документ 18 WO 03062248 проспект
Патентный документ 19 WO 03062252 проспект
Патентный документ 20 WO 03073986 проспект
Патентный документ 21 WO 03074008 проспект
Патентный документ 22 WO 03105771 проспект
Патентный документ 23 WO 04010949проспект
Патентный документ 24 WO 04024673 проспект
Патентный документ 25 WO 04058149 проспект
Патентный документ 26 WO 04071442 проспект
Патентный документ 27 WO 04096752 проспект
Патентный документ 28 WO 04096757 проспект
Патентный документ 29 WO 04103279 проспект
Патентный документ 30 WO 04103306 проспект
Патентный документ 31 WO 04103309 проспект
Патентный документ 32 WO 04110979 проспект
Патентный документ 33 WO 04113330 проспект
Патентный документ 34 WO 04074297 проспект
Патентный документ 35 WO 05014603 проспект
Патентный документ 36 WO 05020882 проспект
Патентный документ 37 WO 04002531 проспект
Патентный документ 38 WO 05032465 проспект
Патентный документ 39 WO 05041899 проспект
Патентный документ 40 WO 05058848 проспект
Патентный документ 41 WO 05070886 проспект
Патентный документ 42 WO 05082089 проспект
Патентный документ 43 WO 05082841 проспект
Патентный документ 44 WO 05021503 проспект
Патентный документ 45 WO 05040091 проспект
Патентный документ 46 WO 05085179 проспект
Патентный документ 47 WO 05118523 проспект
Патентный документ 48 WO 05014525 проспект
Патентный документ 49 WO 06020951 проспект
Патентный документ 50 WO 06001463 проспект
Патентный документ 51 WO 03029184 проспект
Патентный документ 52 WO 03029205 проспект
Патентный документ 53 WO 04026817 проспект
Патентный документ 54 WO 04074297 проспект
Патентный документ 55 WO 05021503 проспект
Патентный документ 56 выложенная открытая заявка Японии №2004-307439
Патентный документ 57 выложенная открытая заявка Японии №2004-307440
Патентный документ 58 выложенная открытая заявка Японии №2005-307441
Патентный документ 59 выложенная открытая заявка Японии №2004-307442
Патентный документ 60 WO 06041015 проспект
Патентный документ 61 выложенная открытая заявка Японии №2004-137208
Патентный документ 62 выложенная открытая заявка Японии №2005-41867
Патентный документ 63 выложенная открытая заявка Японии №2005-47899
Патентный документ 64 WO 05040091 проспект
Патентный документ 65 WO 05063671 проспект
Патентный документ 66 WO 05079788 проспект
Непатентный документ 1 - S.Mandala et al., Science, 296, 346 (2002).
Непатентный документ 2 - V.Brinkmann et al., J.Biol. Chem., 277, 21453 (2002).
Непатентный документ 3 - M.G.Sanna et al., J. Biol. Chem., 279, 13839 (2004).
Непатентный документ 4 - М.Forrest et al., J. Pharmacol. Exp. Ther., 309, 758 (2004).
Непатентный документ 5 - В.Levkau ct al., Circulation, 100 3358 (2004).
Непатентный документ 6 - S.Salomone et al., Eur. J. Pharmacol., 469, 125 (2003).
Непатентный документ 7 - Y.Gon et al., PNAS 102, 9270 (2005).
Раскрытие настоящего изобретения. Задачи, которые должно решить настоящее изобретение
Целью настоящего изобретения является обеспечение производного аминоспирта, обладающего очень высокой иммунодепрессивной активностью при незначительных побочных эффектах.
Способы решения указанных задач
В результате интенсивных исследований, касающихся иммунодепрессивных средств, обладающих различным механизмом действия метаболитов и ингибиторов кальциневрина, заявителями было выявлено, что новое производное аминоспирта при высокой безопасности имеет превосходную иммунодспрессивную активность, что делает настоящее изобретение завершенным.
В частности, настоящее изобретение касается:
1) Производного аминоспирта, представленного общей формулой (1)
[Химическая формула 1]
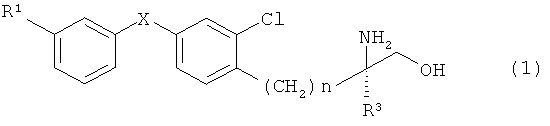
(в которой R1 представляет собой атом хлора или неразветвленную алкильную группу, содержащую 1-3 атомов углерода или трифторметильную группу, R2 представляет собой атом фтора или атом хлора, R3 представляет собой неразветвленную алкильную группу, содержащую 1-3 атомов углерода, X представляет собой атом кислорода или атом серы, а n обозначает 2 или 3); или его фармацевтически пригодной соли или гидрата.
2) Производного аминоспирта согласно пункту 1), отличающегося тем, что соединение, представленное общей формулой (1), является соединением, представленным общей формулой (1а)
[Химическая формула 2]
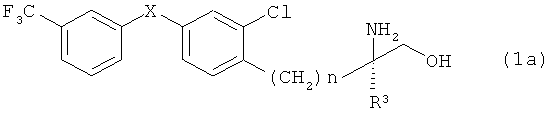
(в которой R3, X и n имеют указанные выше значения);
или его фармацевтически пригодной соли или гидрата.
3) Производного аминоспирта согласно пункту 1) или 2), отличающегося тем, что в общей формуле (1) или (1a) R3 представляет собой метильную группу;
или его фармацевтически приемлемой соли или гидрата.
4) Производного аминоспирта согласно пункту 1), отличающегося тем, что соединение общей формулы (1) представляет собой
(R)-2-амино-5-[2-хлор-4-(3-трифторметилфенокси)фенил]-2-метил-пентилпентан-1-ол,
(R)-2-амино-5-[2-хлор-4-(3-трифторметилфенилтио)фенил]-2-метил-пентан-1-ол,
(R)-2-амино-4-[2-хлор-4-(3-трифторметилфенокси)фенил]-2-метил-бутан-1-ол,
(R)-2-амино-4-[2-хлор-4-(3-трифторметилфенилтио)фенил]-2-метил-бутан-1-ол,
(R)-2-амино-5-[2-хлор-4-(3-этилфенилтио)фенил]-2-метилпентан-1-ол,
(R)-2-амино-5-[2-фтор-4-(3-трифторметилфенилтио)фенил]-2-метил-пентан-1-ол, или
(R)-2-амино-5-[2-хлор-4-(3-трифторметилфенилтио)фенил]-2-пропил-пентан-1-ол; или их фармацевтически приемлемой соли или гидрата.
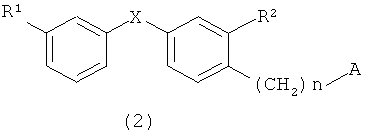
5) Производного аминоспирта согласно пункту 1) или его фармацевтически пригодной соли или гидрата, которые можно получить с помощью стадии, делающей возможным соединение, представленное общей формулой (2)
[Химическая формула 3]

(в которой R1 представляет собой атом хлора или неразветвленную алкильную группу, содержащую 1-3 атома углерода, или трифторметильную группу, R2 представляет собой атом фтора или атом хлора, А представляет собой атом галогена, X представляет собой атом кислорода или атом серы, а n означает 2 или 3), и соединение, представленное общей формулой (10)
[Химическая формула 4]

(в которой R3 представляет собой неразветвленную алкильную группу с 1-3 атомами углерода, a R4 представляет собой алкильную группу, содержащую 1-6 атомов углерода), взаимодействовать в присутствии основания, стадию ацидолиза полученного в результате продукта с последующей защитой атома азота трет-бутоксикарбонильной группой, восстановления, а также снятия защиты с атома азота;
или его фармацевтически приемлемой соли или гидрата.
6) Фармацевтического средства, содержащего в качестве активного ингредиента производное аминоспирта;
или его фармацевтически приемлемой соли или гидрата согласно любому из пунктов 1)-5).
7) Фармацевтического средства согласно пункту 6), представляющего собой иммунодепрессивнос средство.
8) Фармацевтического средства согласно пункту 6), представляющего собой профилактическое или лечебное средство при отторжении трансплантатов органов или трансплантата костного мозга.
9) Фармацевтического средства, содержащего производное аминоспирта, или его фармацевтически приемлемой соли или гидрата согласно любому из пунктов 1)-5) в сочетании с ингибитором кальциневрина.
Эффект настоящего изобретения
Согласно настоящему изобретению может быть обеспечено производное аминоспирта, обладающее очень высокой иммунодепрессивной активностью и безопасностью. Соединение по настоящему изобретению полезно в качестве профилактического или лечебного средства при отторжении трансплантатов органов или трансплантата костного мозга; профилактического или лечебного средства при аутоиммунных заболеваниях (типа воспалительного заболевания кишечника, системной красной волчанки, болезни Хорна, нефротического синдрома, гломерусклерозе, гломерунефрите, множественном склерозе, бульбоспинальном параличе); профилактического или лечебного средства при ревматоидном артрите; профилактического или лечебного средства при псориазе, аллергическом контактном дерматите и атопическом дерматите; профилактического или лечебного средства при гепатите, ожирении печени, токсическом поражении печени, циррозе печени или связанных с диабетом заболеваниях печени; профилактического или лечебного средства при аллергическом рините, аллергическом конъюнктивите и им подобных; и профилактического или лечебного средства при пневмосклерозе, идиопатической интенстициальной пневмонии и бронхиальной астме.
Наилучший способ реализации настоящего изобретения
В настоящем изобретении неразветвленная алкильная группа, содержащая 1-3 атомов углерода (R1 и R3), представляет собой метильную группу, этильную группу, или н-пропильную группу.
Исходя из перспективы безопасного получения предпочтительно, чтобы R1 представлял собой этильную группу, пропильную группу или трифторметильную группу, более предпочтительно - трифторметильную группу. Помимо этого, предпочтительно, чтобы R3 представлял собой метильную группу, а n - предпочтительно равно 3.
Далее, исходя из перспективы получения высокой иммунодепрессивной активности, предпочтительно, чтобы X представлял собой атом серы, и предпочтительной является такая конфигурация R3, которую имеет основной продукт, полученный согласно описанной ниже схемы синтеза по варианту В (с использованием соединения (10)).
В настоящем изобретении примеры фармацевтически приемлемых солей включают кислые аддитивные соли, типа кислых солей соляной, бромистоводородной, уксусной, трифторуксусной, метансульфоновой, лимонной кислот или винной кислоты.
Соединение по настоящему изобретению, представленное общей формулой (1), может быть получено, например, согласно описанному ниже синтезу по варианту А.
[Химическая формула 5]
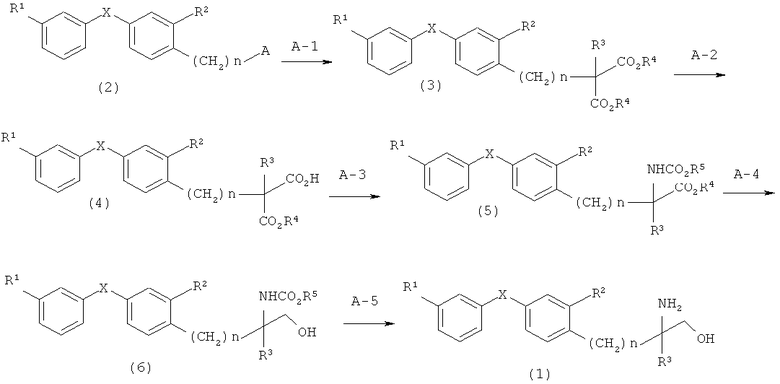
При синтезе по варианту А соединение, представленное общей формулой (3)
[Химическая формула 6]

(в которой R1, R2, R3, R4, X и n имеют описанные выше значения), может быть получено при возможности взаимодействия соединения, представленного общей формулой (2) [Химическая формула 7]
(в которой R1, R2, A, X и n имеют описанные выше значения) и соединения, представленного общей формулой (7)
[Химическая формула 8]
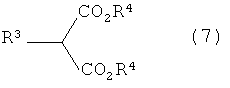
(в которой R3 и R4 имеют описанные выше значения), в присутствии основания (стадия А-1).
Реакция может быть проведена с использованием в качестве растворителя метанола, этанола, 1,4-диоксана, диметилсульфоксида (ДМСО), N,N-диметилформамида (ДМФ), тетрагидрофурана (ТГФ), или им подобных. Указанная реакция проводится в присутствии неорганического основания, типа гидрида натрия, гидрида калия, метоксида натрия, этоксида натрия, трет-бутоксида натрия, метоксида калия, этоксида калия, трет-бутоксида калия и карбоната калия; температура реакции составляет диапазон от 0°C до температуры дефлегмации (предпочтительно от 80°C до 100°C).
При синтезе по варианту А соединение, представленное общей формулой (4)
[Химическая формула 9]

(в которой R1, R2, R3, R4, X и n имеют описанные выше значения), можно получить гидролизом соединения, представленного общей формулой (3) (стадия А-2).
Реакция может быть проведена в присутствии основания, типа водного гидроксида натрия, водного гидроксида калия и водного гидроксида лития; в качестве растворителя используют метанол, этанол, 1,4-диоксан, ДМСО, ДМФ, ТГФ или им подобные. Температура реакции находится в диапазоне от 0°C до температуры дефлегмации. Особенно предпочтительно проведение реакции в среде этанола при 50°C с использованием в качестве основания гидроксида калия.
Несмотря на то, что соединение по настоящему изобретению предпочтительно является оптически активным, время оптического разделения специально не ограничено. На этой стадии оптическое разделение проводят методом ВЭЖХ на специальной хроматографичсской колонке, при этом возможно получение целевого соединения с хиральным центром.
При синтезе по варианту А соединение, представленное общей формулой (5)
[Химическая формула 10]

(в которой R5 представляет собой алкильную группу с 1-6 атомами углерода, a R1, R2, R3, R4, X и n имеют описанные выше значения), может быть получено из соединения, представленного общей формулой (4), путем перегруппировки Куртиуса (стадия А-3).
В этой реакции можно использовать стандартную методику превращения карбоксильной группы в карбамат. Например, может быть использована методика, при которой соединяются, например, хлорэтилкарбонат и NaN3, или оксалилхлорид и NaN3, или методика, при которой возможно применение одного азида дифенилфосфорила (DPPA). Указанную реакцию предпочтительно проводят после нагревания азида дифенилфосфорила до дефлегмации, процесс осуществляют в присутствии органического основания (типа триэтиламина), используя в качестве растворителя бензол или толуол. При этом получаемый в результате продукт насыщают спиртом, представленным общей формулой (8)

(в которой R5 имеет значения, указанный выше), а получаемый раствор продолжают нагревать при встряхивании или после удаления выпариванием использованного в реакции растворителя (типа бензола или толуола); реакция протекает при нагревании до дефлегмации спирта, представленного общей формулой (8).
На этой стадии оптическое разделение проводят методом ВЭЖХ на специальной хроматографической колонке, при этом возможно получение целевого соединения с хиральным центром.
При синтезе по варианту А соединение, представленное общей формулой (6)
[Химическая формула 11]
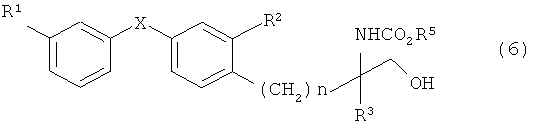
(в которой R1, R2, R3, R5, X и n имеют описанные выше значения), может быть получено путем восстановления соединения, представленного общей формулой (5) (стадия А-4).
Указанная реакция может быть осуществлена с использованием производного алкилборана (типа 9-борабицикло[3.3.1]нонана (9-BBN) или комплексного соединения гидрида металла, типа гидрида дииизобутилалюминия ((iBu)2AlH), борогидрида натрия (NaBH4), борогидрида лития (LiBH4) и литий-алюминий гидрида (LiAlH4); при этом предпочтителен LiBH4. В качестве растворителя применяют ТГФ, 1,4-диоксан, этанол или метанол, а реакцию проводят при температуре от 0°C до температуры дефлегмации (предпочтительна комнатная температура).
Далее, на этой стадии оптическое разделение можно также провести методом ВЭЖХ на специальной хроматографической колонке, при этом возможно получение целевого соединения с хиральным центром.
При синтезе по варианту А соединение, представленное общей формулой (1) может быть получено при ацидолизе или гидролизе соединения, представленного общей формулой (6) (стадия А-5).
Эта реакция может быть проведена в диапазоне температур от комнатной до температуры дефлегмации в неорганической или органической кислоте (типа соляной, бромистоводородной, метансульфоновой кислоты, уксусной кислоты и трифторуксусной кислоты), или при добавлении к неорганической или органической кислоте (типа соляной, бромистоводородной, метансульфоновой кислоты, уксусной кислоты и трифторуксусной кислоты) органического растворителя (типа метанола, этанола, ТГФ и 1,4-диоксана). Реакция может быть также осуществлена в присутствии основания, типа водного гидроксида натрия, водного гидроксида калия и водного гидроксида лития, при использовании в качестве растворителя метанола, этанола, ТГФ, 1,4-диоксана, ДМСО и ДМФ; реакцию проводят в диапазоне температур от 0°C до температуры дефлегмации, предпочтительна температура от 80 до 100°C.
При синтезе по варианту А из соединений, представленных общей формулой (5), в которой R5 представляет собой трет-бутильную группу, в частности соединение, представленное общей формулой (5а)
[Химическая формула 12]
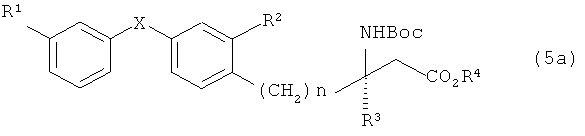
(в которой Boc представляет трет-бутоксикарбонильную группу, a R1, R2, R3, R4, X и n имеют значения, указанные выше), а при синтезе по варианту А из соединений, представленных общей формулой (6), в которой R5 представляет собой трет-бутильную группу, в частности, соединение, представленное общей формулой (6а),
[Химическая формула 13]

(в которой R1, R2, R3, X, Boc и n имеют значения, указанные выше), могут быть получены путем синтеза по варианту В.
Вариант синтеза В
[Химическая формула 14]
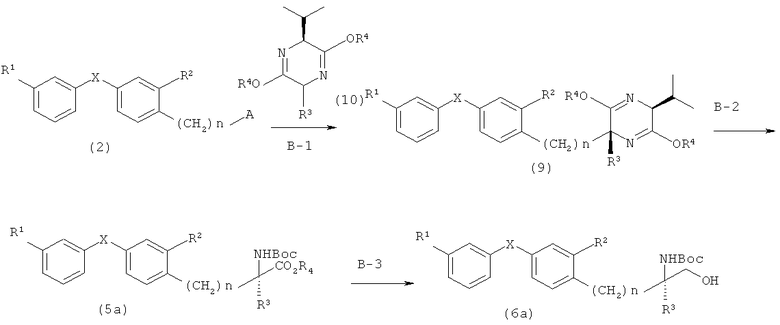
При синтезе по варианту В соединение, представленное общей формулой (9)
[Химическая формула 15]
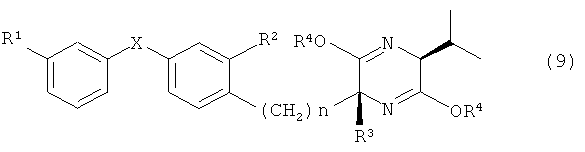
(в которой R1, R2, R3, R4 X и n имеют значения, указанные выше), может быть получено при возможности соединения, представленного общей формулой (2) и соединения, представленного общей формулой (10)
[Химическая формула 16]

(в которой R3 и R4 имеют значения, указанные выше), взаимодействовать между собой в присутствии основания (стадия В-1).
Указанную реакцию можно осуществить, используя в качестве растворителя 1,4-диоксан, ТГФ и простой эфир, а в качестве основания - основание типа н-бутиллития и амида диизопропиллития. Процесс проводят путем обработки соединения, представленного общей формулой (10), при температуре, составляющей -78°C, с последующей возможностью действия соединения, представленного общей формулой (2) при указанной температуре, а также их взаимодействия при постепенном повышения температуры до значения комнатной температуры.
При синтезе по варианту В соединение, представленное общей формулой (5а), может быть получено путем разложения под действием кислоты соединения, представленного общей формулой (9), при последующей защите атома азота трет-бутоксикарбонильной группой (группа Boc) (стадия В-2).
В этой реакции аминный эфир может быть получен с использованием метанола, этанола, ТГФ, 1,4-диоксана или этилацетата, в которых растворяют соляную кислоту (предпочтителен 1,4-диоксан, содержащий соляную кислоту), взаимодействие происходит при температуре дефлегмации с последующей нейтрализацией основанием. Кроме того, предпочтительна возможность взаимодействия с BoC2O в диапазоне температур от 0°C до комнатной температуры с использованием в качестве растворителя этилацетата, ТГФ, ДМФ, 1,4-диоксана, метиленхлорида, хлороформа, метанола, этанола, ацетонитрила, или им подобных.
При варианте синтеза В соединение, представленное общей формулой (6а), может быть получено восстановлением соединения, представленного общей формулой (5а) (стадия В-3).
Указанная реакция может быть осуществлена с использованием борана, производного алкилборана (типа 9-BBN) или комплексного соединения гидрида металла (типа гидрида дииизобутилалюминия ((iBu)2A1H), борогидрида натрия (NaBH4), борогидрида лития (Li BH4) и литий-алюминий гидрида (LiAl H4)); при этом предпочтителен Li BH4. В качестве растворителя применяют ТГФ, 1,4-диоксан, этанол или метанол, а реакцию проводят при температуре от 0°C до температуры дефлегмации (предпочтительна комнатная температура).
Относительно способов синтеза соединения, представленного общей формулой (2), отмечается, что указанное соединение может быть получено способами, описанными в проспектах заявок WO 03039184, WO 03029205, WO 04026817, WO 04074297 и WO 050444780.
Соединение по настоящему изобретению в организме подвергается метаболизму с продуцированием фосфата (сложного эфира фосфорной кислоты). Соединение по настоящему изобретению полезно в качестве профилактического или лечебного средства при отторжении трансплантатов органов или трансплантата костного мозга; профилактического или лечебного средства при аутоиммунных заболеваниях (типа воспалительного заболевания кишечника, системной красной волчанки, болезни Хорна, нефротического синдрома, при гломерусклерозе, гломерунефрите, множественном склерозе, бульбоспинальном параличе); профилактического или лечебного средства при ревматоидном артрите; профилактического или лечебного средства при псориазе, аллергическом контактном дерматите и атопическом дерматите; профилактического или лечебного средства при гепатите, ожирении печени, токсическом поражении печени, циррозе печени или связанных с диабетом заболеваниях печени; профилактического или лечебного средства при аллергическом рините, аллергическом конъюнктивите и им подобных; и профилактического или лечебного средства при пневмосклерозе, идиопатической интенстициальной пневмонии и бронхиальной астме.
При использовании в указанных выше случаях требуемая курсовая доза зависит от способа введения, специфики заболевания, а также от нужного эффекта. Однако обычно предпочтительна суточная доза, которая составляет от приблизительно 0,03 мг до 2,5 мг на 1 кг массы тела. Для млекопитающих (человека) рекомендуемая суточная доза представляет собой диапазон от приблизительно 0,5 мг до приблизительно 100 мг. Предпочтительно введение производят отдельными дозами 4 раза в сутки (или менее), или осуществляют введение ретардной формы. Пригодная для перорального использования единичная доза содержит приблизительно 1-50 мг активного ингредиента.
Соединение по настоящему изобретению может быть введено любым удобным способом, в частности энтерально (например перорально) в виде таблетки или капсулы; или парентерально, например, в виде инъекционного раствора или суспензии; местно, например, в виде лосьона, геля, мази или крема; или назально, или в форме суппозитория. Фармацевтический состав, содержащий соединение по настоящему изобретению в свободном виде или в виде фармацевтически приемлемой соли в сочетании, по меньшей мере, с одним видом фармацевтически приемлемого носителя или разбавителя, можно получить стандартным способом, путем смешивания с фармацевтически приемлемым носителем или разбавителем.
Далее, соединение по настоящему изобретению пригодно также при использовании вместе с иммунодепрессантом и/или фармацевтическим соединением, обладающим противовоспалительным действием на основе другого механизма. Примеры веществ, которые можно использовать совместно, включают: иммунодепрессанты, применяемые при лечении и предотвращении острого или хронического отторжения аллогенных трансплантатов и гетерологичных трансплантатов, при воспалительных заболеваниях и аутоиммунных заболеваниях; иммунодепрессанты с иммуномодулирующей активностью; и/или противовоспалительные средства, обладающие противовоспалительной активностью или способные подавлять рост злокачественных клеток. Специфические примеры включают ингибиторы кальциневрина - циклоспорин А и FK506, mTOR ингибиторы рапамицина-40-O-(2-гидроксиметил)рапамицин, СС1779 и АВТ578, аскомицины АВТ281 и ASM981, которые обладают иммуннодепрессивным действием; микофенольную кислоту, мофетилмикофенолят, азатиоприн, мизорибин, циклофосфамид и им подобные. Другие примеры включают антифолат метотрексата, кортикостероиды надпочечников, обладающие широкой противовоспалительной активностью; ауронофин, актарит, месалазин или сульфалазин и им подобные, которые имеют иммунномодулирующее действие; инфликсимаб, являющийся антителом в отношении TNFa; MRA, являющийся антителом в отношении рецептора анти-IL-6; натализумаб, являющийся антителом в отношении антиинтегрина, и им подобные.
Примеры
Далее настоящее изобретение описано со ссылкой на следующие специфические примеры, которые, однако, не ограничивают настоящее изобретение.
Кроме того, в качестве промежуточных соединений и им подобных, представленных общей формулой (2), можно использовать соединения из заявок WO 03029184, WO 03029205, WO 04026817, WO 04074297 и WO 050444780. Помимо этого, согласно работам Ulrich Shollkopn: al., Synthesis 969 (1981), Chunrong Ma et al., J. Org. Chem., 66, 4525 (2001) можно синтезировать (5S)-3,6-диэтокси-5-изопропил-2-метил-2,5-дигидропиразин, (5S)-3,6-диметокси-5-изопропил-2-метил-2,5-дигидропиразин и (5S)-2-аллил-3,6-диэтокси-5-изопропил-2,5-дигидропиразин. Промежуточные соединения и им подобные, которые были вновь синтезированы на основе экспериментальных методик, описанных в этих документах, описаны далее в справочных примерах.
Справочный пример 1
2-фтор-4-(3-трифторметилфенилтио)бензальдегид
[Химическая формула 17]
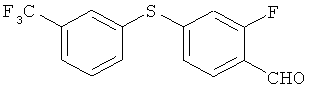
Этилдиизопропиламин 97,0 мл), аддукт трис(дибензилиден-ацетон)дипалладия (0) (518 мг), ксанфос (578 мг) и 3-трифторметил-тиофенол (3,56 г) добавили в раствор 4-бром-2-фторбензальдегида (4,06 г) в 1,4 диоксане; процесс проводили в атмосфере аргона, и полученный в результате раствор нагревали вплоть до дефлегмации в течение 5 ч. В реакционный раствор добавили воду и провели экстракцию этилацетатом. Затем провели последовательное промывание сначала водой, а потом насыщенным солевым раствором. После этого осуществили высушивание над безводным сульфатом натрия. Растворитель выпарили, а для получения целевого продукта остаток очистили на хроматографической колонке с силикагелем (гексан: этилацетат=30:1). В результате был получен целевой продукт (4,08 г) в виде бесцветного масла.
1H-ЯМР(CDСI3, 400 MHz): δ 6.86 (1H, dd, J=10, 1.8 Hz), 7.02 (1H, dd, J=7.9, 1.8 Hz), 7.58 (1H, t, J=7.9 Hz), 7.68-7.73 (2H, m), 7.76 (1H, t, J=7.9 Hz), 7.80 (1H, s), 10.26 (1H, s)
EIMS (+): 300 [M]+
Справочный пример 2
2-хлор-4-(3-хлорфенилтио)бензальдегид
[Химическая формула 18]

3-хлорбензотиол и 2-хлор-4-фторбензальдегид взаимодействовали согласно методике из справочного примера 1 в проспекте заявки WO 03029205. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР(CDСI3, 400 MHz): δ 7.11 (1H, dd, J=9.2, 1.8 Hz), 7.17 (1H, d, J=1.8 Hz), 7.36-7.44 (3H, m), 7.52 (1H, t, J=1.8 Hz), 7.80 (1H, d, J=7.9 Hz), 10.37 (1H, s)
EIMS (+): 282 [M]+
Справочный пример 3
2-хлор-4-(3-метилфенокси)бензальдегид
[Химическая формула 19]
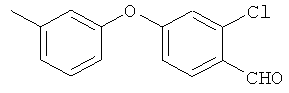
м-крсзол и 2-хлор-4-фторбензальдегид взаимодействовали согласно методике из справочного примера 1 в проспекте заявки WO 03029205. В результате был получен целевой продукт в виде бесцветного порошка.
1H-ЯМР (CDСI3, 400 MHz): δ 2.38 (3H, s), 6.87-6.96 (4H, m), 7.07 (1H, d, J=7.3 Hz), 7.31 (1H, t, J=7.6 Hz), 7.90 (1H, d, J=8.6 Hz), 10.36 (1H, s)
EIMS (+): 246 [M]+
Справочный пример 4
2-хлор-4-(3-этилфенилтио)бензальдегид
[Химическая формула 20]

3-этилбензилтиол и 2-хлор-4-фтор6ензальдегид взаимодействовали согласно методике из справочного примера 1 в проспекте заявки WO 03029205. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDСI3, 400 MHz): δ 1.26 (3H, t, J=7.3 Hz), 2.68 (2H, q, J=7.3 Hz), 7.04-7.11 (2H, m), 7.28-7.40 (2H, m), 7.76 (1H, d, J=7.3 Hz), 7.31 (1H, d, J=8.6 Hz), 10.35 (1H, s)
EIMS (+): 276 [M]+
Справочный пример 5
2-хлор-4-(3-пропилфенокси)6ензальдегид
[Химическая формула 21]
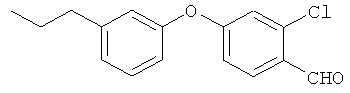
3-пропилфенол и 2-хлор-4-фтор6ензальдегид взаимодействовали согласно методике из справочного примера 1 в проспекте заявки WO 03029205. В результате был получен целевой продукт в виде бледно-коричневого масла.
1H-ЯМР (CDСI3, 400 MHz): δ 0.95 (3H, t, J=7.3 Hz), 1.62-1.68 (2H, m), 2.61 (2H, t, J=7.3 Hz), 6.89-6.94 (3H, m), 6.96 (1H, d, J=2.1 Hz), 7.08 (1H, d, J=7.9 Hz), 7.31-7.35 (1H, m), 7.90 (1H, d, J=8.9 Hz), 10.36 (1H, d, J=0.6 Hz)
EIMS (+): 274 [M]+
Справочный пример 6
[2-хлор-4-(3-этилфенилтио)фенил]ацетальдегид [Химическая формула 22]
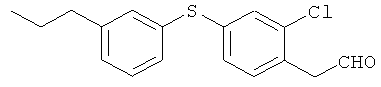
Соединение из справочного примера 4 взаимодействовало согласно методике из справочного примера 326 в проспекте заявки WO 04074297. В результате был получен целевой продукт в виде бледно-желтого масла.
Справочный пример 7
Этил3-[2-хлор-4-(3-этилфенилтио)фенил]акрилат
[Химическая формула 23]
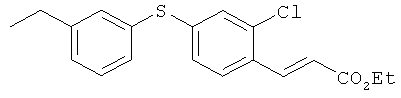
Соединение из справочного примера 4 взаимодействовало согласно методике из справочного примера 10 в проспекте заявки WO 03029205. В результате был получен целевой продукт в виде бледно-желтого масла.
EIMS (+): 346 [М]+
Справочный пример 8
3-[2-хлор-4-(3-этилфенилтио)фенил]пропан-1-ол
[Химическая формула 24]

Соединение из справочного примера 7 взаимодействовало согласно методике из справочного примера 19 в проспекте заявки WO 03029205. Полученный в результате продукт был восстановлен согласно методике из справочного примера 35 в проспекте заявки WO 03029205. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDСI3, 400 MHz): δ 1.22 (3H, t, J=7.3 Hz), 1.84-1.90 (2H, m), 2.62 (2H, q, J=7.6 Hz), 2.78-2.82 (2H, m), 3.69 (2H, t, J=6.1 Hz), 7.10-7.18 (4H, m), 7.23-7.29 (3H, m)
Справочный пример 9
3-[2-хлор-4-(3-этилфенокси)фенил]пропан-1-ол
[Химическая формула 25]
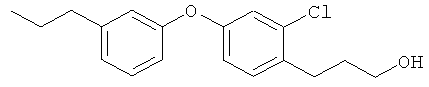
Соединение из справочного примера 5 вначале взаимодействовало согласно методике из справочного примера 7, а затем - из справочного примера 8. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDСI3, 400 MHz): δ 0.94 (3H, t, J=7.3 Hz), 1.37 (1H, br.s), 1.58-1.68 (2H, m), 1.85-1.92 (2H, m), 2.57 (2H, t, J=7.6 Hz), 2.80 (2H, t, J=7.6 Hz), 3.70 (2H, dt, J=6.1, 4.6 Hz), 6.80-6.85 (3H, m), 6.95 (2H, d, J=7.9 Hz), 7.00 (1H, d, J=2.8 Hz), 7.17 (1H, d, J=8.3 Hz), 7.24 (2H, d, J=7.9 Hz).
EIMS (+): 304 [M]+
Справочный пример 10
3-[2-фтор-4-(3-трифторметилфенилтио)фенил]пропан-1-ол
[Химическая формула 26]
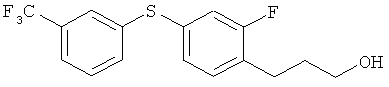
Соединение из справочного примера 1 вначале взаимодействовало согласно методике из справочного примера 7, а затем - из справочного примера 8. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDСI3, 400 MHz): δ 1.88 (2H, tt, J=6.7, 6.1 Hz), 2. 75 (2H, t, J=6.7 Hz), 3.69 (2H, t, J=6.1 Hz), 7.05 (1H, dd, J=10, 1.8 Hz), 7.10 (1H, dd, J=7.9,1.8 Hz), 7.20 (1H, t, J=7.9 Hz), 7.38-7.51 (3H, m), 7.55 (1H, m),
Справочный пример 11
3-[2-хлор-4-(3-хлорфенилтио)фенил]пропан-1-ол
[Химическая формула 27]

Соединение из справочного примера 2 вначале взаимодействовало согласно методике из справочного примера 7, а затем - из справочного примера 8. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDСI3, 400 MHz): δ 1.33 (1H, br s), 1.83-1.95 (2H, m), 2.81-2.85 (2H, m), 3.70 (2H, br s), 7.15-7.23 (5H, m), 7.24-7.29 (1H, m), 7.38 (1H, d, J=1.8 Hz)
Справочный пример 12
3-[2-хлор-4-(3-метилфенокси)фенил]пропан-1-ол
[Химическая формула 28]
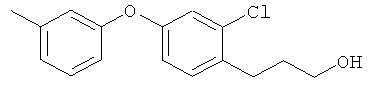
Соединение из справочного примера 3 вначале взаимодействовало согласно методике из справочного примера 7, а затем - из справочного примера 8. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDСI3, 400 MHz): δ 1.31 (1H, br s), 1.87-1.90 (2H, m), 2.34 (3H, s), 2.80 (2H, t, J=7.3 Hz), 3.70 (2H, dd, J=11.6, 6.1 Hz), 6.79-6.86 (3H, m), 6.94 (1H, d, J=7.3 Hz), 6.99 (1H, d, J=2.4 Hz), 7.18 (1H, d, J=7.9 Hz), 7.22 (1H, t, J=7.3 Hz),
EIMS (+): 276 [M]+
Справочный пример 13
2-хлор-4-(3-этилфенилтио)-1-(2-иодоэтил)бензол
[Химическая формула 29]

Соединение из справочного примера 6 вначале взаимодействовало согласно методике справочного примера 327, из проспекта заявки WO 04074297. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDСI3, 400 MHz): δ 1.22 (3H, t, J=7.3 Hz), 2.63 (2H, q, J=7.3 Hz), 3.23- 3.28 (2H, m), 3.32-3.35 (2H, m), 7.09-7.29 (7H, m).
EIMS (+): 402 [M]+
Справочный пример 14
2-хлор-4-(3-этилфенилтио)-1-(3-иодопропил)бензол
[Химическая формула 30]

Соединение из справочного примера 8 взаимодействовало согласно методике справочного примера 164, из проспекта заявки WO 03029184. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDCI3, 400 MHz): δ 1.22 (3H, t, J=7.3 Hz), 2.12 (2H, q, J=7.3 Hz), 2.63 (2H, q, J=7.3 Hz), 2.81 (2H, q, J=7.3 Hz), 3.19 (2H, q, J=7.3 Hz), 7.09-7.19 (4H, m), 7.24-7.28 (3H, m).
EIMS (+): 416 [M]+
Справочный пример 15
2-хлор-1-(3-иодопропил)-4-(3-пропилфенокси)бензол
[Химическая формула 31]
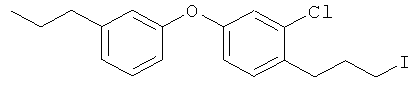
Соединение из справочного примера 9 взаимодействовало согласно методике справочного примера 164, из проспекта заявки WO 03029184. В результате был получен целевой продукт в виде бледно-желтого масла.
1H-ЯМР (CDCI3, 400 MHz): δ 0.94 (3H, t, J=7.3 Hz), 1.60- 1.68 (2H, m), 2.10-2.17 (2H, m), 2.57 (2H, t, J=7.6 Hz), 2.81 (2H, t, J=7.3 Hz), 3.21 (2H, t, J=7.0 Hz), 6.80-6.85 (3H, m), 6.96 (1H, d, J=7.9 Hz), 6.99 (1H, d, J=2.4 Hz), 7.19 (1H, d, J=8.3 Hz), 7.25 (1H, t, J=7.9 Hz),
EIMS (+): 414 [M]+
Справочный пример 16
2-фтор-1-(3-иодопропил)-4-(3-трифторметилфенилтио)бензол
[Химическая формула 32]
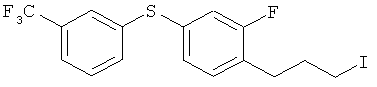
Соединение из справочного примера 10 взаимодействовало согласно методике справочного примера 164, из проспекта заявки WO 03029184. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDCI3, 400 MHz): δ 2.13 (2H, q, J=7.3 Hz), 2.76 (2H, t, J=7.3 Hz), 3.18 (2H, t, J=6.7 Hz), 7.03 (1H, dd, J=10, 1.8 Hz), 7.09 (1H, dd, J=7.9, 1.8 Hz), 7.20 (1H, t, J=7.9 Hz), 7.39-7.52 (3H, m), 7.57 (1H, s)
EIMS (+): 404 [M]+
Справочный пример 17
2-хлор-4-(3-хлорфенилтио)-1-(3-иодопропил)бензол
[Химическая формула 33]

Соединение из справочного примера 11 взаимодействовало согласно методике справочного примера 164, из проспекта заявки WO 03029184. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDСI3, 400 MHz): δ 2.14 (2H, tt, J=7.3, 6.7 Hz), 2.84 (2H, t, J=7.3 Hz), 3.20 (2H, t, J=6.7 Hz), 7.16-7.25 (5H, m), 7.28 (1H, t, J=1.8 Hz), 7.36 (1H, d, J=1.8 Hz)
EIMS (+): 422 [M]+
Справочный пример 18
2-хлор-1-(3-иодопропил)-4-(3-метилфенокси)бензол
[Химическая формула 34]
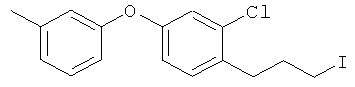
Соединение из справочного примера 12 взаимодействовало согласно методике справочного примера 164, из проспекта заявки WO 03029184. В результате был получен целевой продукт в виде желтого масла.
1H-ЛМР (CDСI3, 400 MHz): δ 2.13 (2H, q, J=7.3, 6.7 Hz), 2.34 (3H,s), 2.81(2H, t, J=7.3 Hz), 3.21 (2H, t, J=7.3 Hz), 6.81-6.84 (3H, m), 6.95 (1H, d, J=2.4 Hz), 6.99 (1H, d, J=2.4 Hz), 7.18 (1H, d, J=7.9 Hz), 7.23 (1H, t, J=7.9 Hz).
EIMS (+): 386 [M]+
Пример 1
(2R,5S)-2-[2-хлор-4-(3-трифторметилфенокси)фенил]пропил-3,6-диэтокси-5-изопропил-2-метил-2,5-дигидропиразин
[Химическая формула 35]
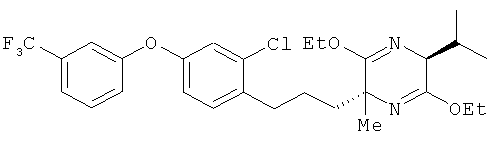
Раствор н-бутиллития в гексане (1,54 мол/л, 3,59 мл) добавили в раствор (5S)-3,6-диэтокси-5-изопропил-2-метил-2,5-дигидропиразина (905 мг) в ТГФ (16 мл); этот процесс осуществляли в атмосфере аргона при -78°C. Полученный в результате раствор перемешивали в течение 30 мин при -78°C. После этого в реакционную смесь добавили 2-хлор-1-(3-иодопропил)-4-(3-триформетилфенокси)бензол (2,47 г) в ТГФ, и проводили перемешивание сначала в течение 30 мин при -78°C, а затем в течение 1 ч при 0°C. В раствор добавили воду, осуществили экстракцию этилацетатом, затем промывали последовательно, сначала водой, а потом насыщенным солевым раствором и высушили над безводным сульфатом натрия. Растворитель выпарили, а для получения целевого продукта остаток очистили на хроматографической колонке с силикагелем (гексан:этилацетат=60:1). В результате был получен целевой продукт (1,59 г) в виде бесцветного масла
1H-ЯМР (CDСI3, 400 MHz): δ 0.70 (1Н, d, J=6.7 Hz), 1.05 (3H, d, J=6.7 Hz), 1.18-1.50 (9H, m), 1.32 (3H,s), 1.86-1.97 (1Н, m), 2.21-2.30 (1Н, m), 2.65 (2H, t, J=7.6 Hz), 3.90 (1Н, d, J=2.1 Hz), 3.97-4.21 (4H, m), 6.84 (1Н, dd, J=7.9, 2.4 Hz), 7.00 (1Н, d, J=2.4 Hz), 7.15 (2H, d, J=7.9 Hz), 7.24 (1Н, b s), 7.36 (1Н, d, J=7.9 Hz), 7.44 (1Н, t, J=7.9 Hz).
Пример 2
(2R,5S)-2-[2-хлор-4-(3-трифторметилфенилтио)фенил]пропил-3,6-диэтокси-5-изопропил-2-метил-2,5-дигидропиразин
[Химическая формула 36]
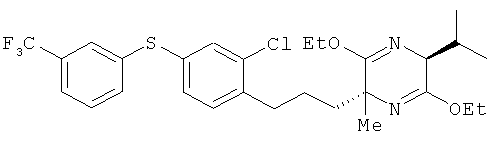
(5S)-3,6-диэтокси-5-изопропил-2-метил-2,5-дигидропиразин и 2-хлор-1-(3-иодопропил)-4-(3-трифторметилфенилтио)бензол взаимодействовали между собой таким же образом, как это описано в примере 1. В результате был получен целевой продукт в виде бесцветного масла
1H-ЯМР (CDCI3, 400 MHz): δ 0.63 (3H, d, J=6.7 Hz), 1.07 (3H, d, J=6.7Hz), 1.18-1.29 (10Н, m), 1.32 (3H,s), 1.34-1.66 (2H, m), 1.79-1.91 (1H, m), 2.25-2.33 (1H, m), 2.70 (2H, t, J=7.6 Hz), 3.85 (1H, b s), 3.99-4.23 (4H, m), 7.16 (2H, d, J=7.9 Hz), 7.20 (1H, dd, J=7.9 Hz), 7.36-7.42 (3H, m), 7.44-7.50 (1H, m), 7.52 (1H, b s).
Пример 3
(2R,5S)-2-[2-хлор-4-(3-трифторметилфенокси)фенил]этил-3,6-диэтокси-5-изопропил-2-метил-2,5-дигидропиразин
[Химическая формула 37]
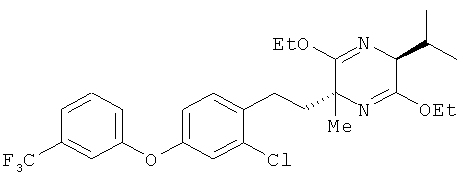
(5S)-3,6-диэтокси-5-изопропил-2-метил-2,5-дигидропиразини2-хлор-1-(2-иодоэтил)-4-(3-трифторметилфенокси)бензол взаимодействовали между собой таким же образом, как это описано в примере 1. В результате был получен целевой продукт в виде бесцветного масла
1H-ЯМР (CDСI3, 400 MHz): δ 0.72 (3H, d, J=6.7Hz), 1.08 (3H, d, J=6.7 Hz), 1.29 (6H, t, J=7.3 Hz), 1.36 (3H,s), 1.74-1.82 (1H, m), 2.13-2.20 (1H, m), 2.25-2.32 (1H, m), 2.39-2.56 (2H, m), 3.95 (1H, d, J=3.1 Hz), 4.02-4.22 (4H, m), 6.83 (1H, dd, J=8.6,2.4 Hz), 6.99 (1H, d, J=2.4 Hz), 7.12-7.15 (2H, m), 7.23 (1H, b s), 7.35 (1H, d, J=7.8 Hz), 7.44 (1H, t, J=7.8 Hz).
Пример 4
(2R,5S)-2-[2-хлор-4-(3-трифторметилфенилтио)фенил]этил-3,6-диэтокси-5-изопропил-2-метил-2,5-дигидропиразин
[Химическая формула 38]

(5S)-3,6-диэтокси-5-изопропил-2-метил-2,5-дигидропиразин и 2-хлор-1-(2-иодоэтил)-4-(3-трифторметилфенокси)бензол взаимодействовали между собой таким же образом, как это описано в примере 1. В результате был получен целевой продукт в виде бесцветного масла
1H-ЯМР (CDСI3, 400 MHz): δ 0.72 (3H, d, J=6.7 Hz), 1.08 (3H, d, J=6.7 Hz), 1.29 (6H, t, J=7.3 Hz), 1.36 (3H,s), 1.74-1.82 (1H, m), 2.13-2.20 (1H, m), 2.25-2.32 (1H, m), 2.39-2.56 (2H, m), 3.95 (1H, d, J=3.1 Hz), 4.02-4.22 (4H, m), 7.13 (1H, d, J=7.9 Hz), 7.18 (1H, dd, J=7.9, 2.4 Hz), 7.35-7.42 (2H, m), 7.43-7.48 (IH.m), 7.54 (1H, bs).
Пример 5
(2R,5S)-2-[2-хлор-4-(3-этилфенилтио)фенил]этил-3,6-диэтокси-5-изопропил-2-метил-2,5-дигидропиразин
[Химическая формула 39]
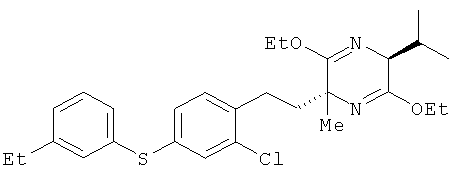
(5S)-3,6-диэтокси-5-изопропил-2-метил-2,5-дигидропиразин и соединение из справочного примера 13 взаимодействовали между собой таким же образом, как это описано в примере 1. В результате был получен целевой продукт в виде бесцветного масла
1H-ЯМР (CDCI3, 400 MHz): δ 0.72 (3H, d, J=6.7 Hz), 1.07 (3H, d, J=6.7 Hz), 1.21 (3H, t, J=7.3 Hz), 1.28 (3H, t, J=7.3 Hz), 1.29 (3H, t, J=7.3 Hz), 1.34 (3H,s), 1.70-1.79 (1H, m), 2.09-2.16 (1H, m), 2.24-2.32 (1H, m), 2.35-2.52 (2H, m), 2.61 (2H, q, J=7.3 Hz), 3.95 (1H, d, J=3.1 Hz), 4.03-4.20 (4H, m), 7.04-7.15 (4H,m), 7.21-7.26 (3H, m).
ESIMS(+):501[M+H]+
Пример 6
(2R,5S)-2-[2-хлор-4-(3-метилфенокси)фенил]пропил-3,6-диэтокси-5-изопропил-2-метил-2,5-дигидропиразин
[Химическая формула 40]
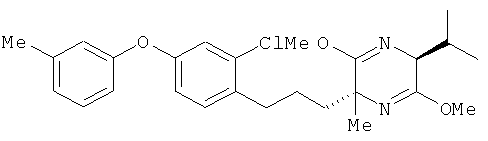
(5S)-3,6-диэтокси-5-изопропил-2-метил-2,5-дигидропиразин и соединение из справочного примера 18 взаимодействовали между собой таким же образом, как это описано в примере 1. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 MHz): δ 0.68 (3H, d, J=6.7 Hz), 1.07 (3H, d, J=6.7 Hz), 1.33 (3H, s), 1.36-1.43 (1H, m), 1.55-1.62 (1H, m), 1.86-1.92 (1H, m), 2.24-2.26 (1H, m), 2.34 (3H, s), 2.62 (2H, q, J=7.9 Hz), 3.65 (3H, s), 3.66 (3H, s), 3.94 (1H, d, J=3.7 Hz), 6.79- 6.82 (3H, m), 6.93 (1H, d, J=7.3 Hz), 6.96 (1H, d, J=2.4 Hz), 7.09 (1H, d, J=7.9 Hz), 7.2 (1H, t, J=7.9 Hz).
EIMS (+): 456 [M+H]+
Пример 7
(2R,5S)-2-[2-хлор-4-(3-этилфенилтио)фенил]пропил-3,6-диэтокси-5-изопропил-2-метил-2,5-дигидропиразин
[Химическая формула 41]
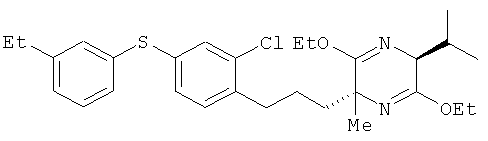
(5S)-3,6-диэтокси-5-изопропил-2-метил-2,5-дигидропиразин и соединение из справочного примера 14 взаимодействовали между собой таким же образом, как это описано в примере 1. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 MHz): δ 0.68 (3H, d, J=6.7 Hz), 1.04 (3H, d, J=6.7 Hz), 1.20-1.26 (9H, m), 1.31 (3H, s) 1.36-1.43 (1H, m), 1.50-1.57 (1 H, m), 1.85-1.92 (1 H, m), 2.21-2.28 (1H, m), 2.60-2.65 (4H, m), 3.88 (1H, d, J=3.7 Hz), 4.00-4.16 (4 H, m), 7.06-7.16 (4 H, m), 7.22-7.27 (3H, m).
ESIMS(+):515[M+H]+
Пример 8
(2R,5S)-2-[2-хлор-4-(3-хлорфенилтио)фенил]пропил-3,6-диэтокси-5-изопропил-2-метил-2,5-дигидропиразин
[Химическая формула 42]
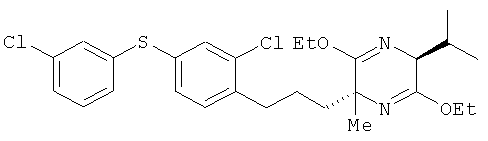
(5S)-3,6-диэтокси-5-изопропил-2-метил-2,5-дигидропиразин и соединение из справочного примера 17 взаимодействовали между собой таким же образом, как это описано в примере 1. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 MHz): δ 0.69 (3H, d, J=6.7 Hz), 1.08 (3H, d, J=6.7 Hz), 1.18-1.29 (7H, m), 1.31 (3H, s), 1.34-1.47 (1H, m), 1.50-1.63 (1H, m), 1.85-1.95 (1H, m), 2.20-2.30 (1H, m), 2.65 (2H, t, J=7.6 Hz), 3.89 (1H, d, J=3.1 Hz), 3.99- 4.23 (4H, m) 7.11-7.23 (6H, m), 7.35 (1H, d, J=1.8 Hz).
ESIMS (+): 521 [M+H]+
Пример 9
(2R,5S)-2-[2-фтор-4-(3-трифторметилфенилтио)фенил]пропил-3,6-диэтокси-5-изопропил-2-метил-2,5-дигидропиразин
[Химическая формула 43]
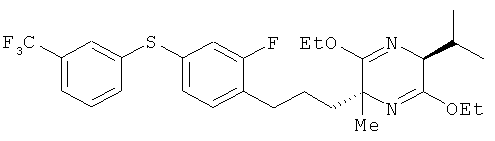
(5S)-3,6-диэтокси-5-изопропил-2-метил-2,5-дигидропиразин и соединение из справочного примера 16 взаимодействовали между собой таким же образом, как это описано в примере 1. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 MHz): δ 0.67 (3H, d, J=6.7 Hz), 1.06 (3H, d, J=6.7 Hz), 1.18-1.29 (7H, m), 1.33 (3H, s), 1.36-1.66 (2H, m), 1.85-1.95 (1H, m), 2.23-2.33 (1H, m), 2.67 (2H, t, J=7.6 Hz), 3.89 (1H, d, J=3.1 Hz), 3.99-4.23 (4H, m), 7.02 (1H, dd, J=9.8 Hz), 7.08 (1 H, dd, J=7.9 Hz, 2.4 Hz), 7.13 (1Н, t, J=7.9 Hz), 7.38-7.50 (3H, m), 7.55 (1H, s).
Пример 10
(2R,5S)-2-аллил-2-[2-хлор-4-(3-трифторметилфенил-тио)фенил]пропил-3,6-диэтокси-5-изопропил-2-метил-2,5-дигидропиразин
[Химическая формула 44]
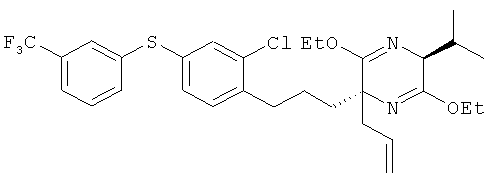
(5S)-2-аллил-3,6-диэтокси-5-изопропил-2-метил-2,5-дигидропиразин и 2-хлор-1 -(3-иодопропил)-4-(3-трифторметилфенилтио)бензол взаимодействовали между собой таким же образом, как это описано в примере 1. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 MHz): δ 0.67 (3H, d, J=6.7 Hz), 1.05 (3H, d, J=6.7 Hz), 1.23 (3H,t, J=6.4 Hz), 1.25 (3H, t, J=6.4 Hz), 1.30-1.64 (3H, m), 1.80-1.90 (1H, m), 2.23-2.39 (2H, m), 2.53 (1H, dd, J=12.4, 7.3 Hz), 2.65 (2H, t, J=7.6 Hz), 3.83 (1H, d, J=3.1 Hz), 4.03-4.18 (4 H, m), 4.92-5.04 (2H, m), 5.60-5.73 (1H, m), 7.13 (2H, d, J=7.9 Hz), 7.18 (1H, dd, J=7.9 Hz, 1.8 Hz), 7.36 (1H, d, J=1.8 Hz), 7.38-7.42 (2H, m), 7.44-7.49 (1H, m), 7.55 (1H, br s)
Пример 11
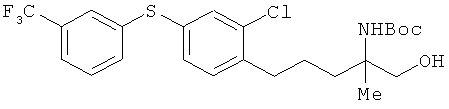
Этил (R)-2-трет-бутоксикарбониламино-5-[2-хлор-4-(3-трифторметил-фенокси)фенил]-2-метилпентаноат
[Химическая формула 45]
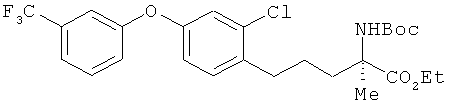
К раствору соединения из примера 1 (1,59 г) в 1,4-диоксанс (50 мл) добавили 0,5 мол/л соляной кислоты (30 мл). Полученный раствор встряхивали в течение 1 ч при комнатной температуре, а потом оставили при этой же температуре на ночь. После этого раствор упарили, провели нейтрализацию насыщенным водным раствором кислого карбоната натрия, а затем - экстракцию этилацетатом. Полученный экстракт упарили, а остаток растворили в ацетонитриле (15 мл). К этому раствору добавили ди-трет-бутоксидикарбонат (1,55 г), и получившийся раствор вначале встряхивали в течение 4 ч при комнатной температуре, а потом отставили на ночь при этой же температуре. В реакционный раствор добавили воду и провели экстракцию этилацетатом. Затем провели последовательное промывание сначала водой, а потом насыщенным солевым раствором. После этого осуществили высушивание над безводным сульфатом натрия. Растворитель выпарили, а для получения целевого продукта остаток очистили на хроматографической колонке с силикагелем (гексан:этилацетат=9:1). В результате был получен целевой продукт (1,00 г) в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 MHz): δ 1.26 (3H, t, J=7.3 Hz), 1.43 (9H, s), 1.53 (3H, s), 1.45-1.68 (2H, m), 1.80-1.90 (1H, m), 2.12-2.30 (1H, m), 2.69 (2H, t, J=7.6 Hz), 4.16-4.24 (2H, m), 5.33 (1H, br s), 6.85 (1H, dd, J=7.9 Hz, 2.4 Hz), 7.02 (1H, d, J=2.4 Hz), 7.15 (1 H, dd, J=7.9 Hz, 2.4 Hz), 7.17 (1 H, d, J=7.9 Hz), 7.24 (1H, br s), 7.37 (1H, d, J=7.9 Hz), 7.45 (1 H, t, J=7.9 Hz)
Пример 12
(R)-2-трет-бутоксикарбониламино-5-[2-фтор-4-(3-трифторметил-фенилтио)фенил]-2-метилпентаноат
[Химическая формула 46]
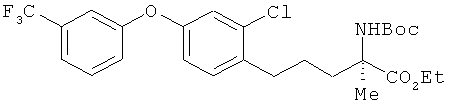
Соединение из примера 9 взаимодействовало таким же образом, как и в примере 11. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDСl3, 400 MHz): δ 1.26 (3H, t, J=7.3 Hz), 1.42 (9H, s), 1.51 (3H, s), 1.45-1.68 (2H, m), 1.77-1.86 (1H, m), 2.09-2.20 (1H, m), 2.69 (2H, t, J=7.6 Hz), 4.13-4.23 (2H, m), 5.29 (1H, br s), 7.02 (1H, dd, J=9.8 Hz), 7.08 (1H, dd, J=7.9 Hz), 7.13 (1H, t, J=7.9), 7.38-7.50 (3H, m), 7.55 (1H, s).
Пример 13
Этил (S)-2-аллил-2-трет-бутоксикарбониламино-5-[2-хлор-4-(3-трифтор-метилфенилтио)фенил]пентаноат
[Химическая формула 47]
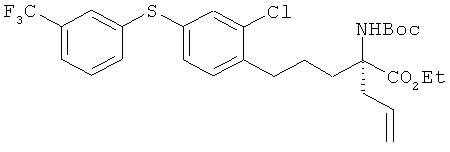
Соединение из примера 10 взаимодействовало таким же образом, как и в примере 11. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDСl3, 400 MHz): δ 1.24 (3H, t, J=7.3 Hz), 1.29-1.39 (1H, m), 1.43 (9H, s), 1.60-1.70 (1H, m), 1.78-1.86 (1H, m), 2.32-2.50 (2H, m), 2.66-2.73 (2H, m), 2.99-3.10 (1H, m), 4.19 (2H, q), 5.03 (1H, d, J=3.1 Hz), 5.09 (1H, s), 5.49 (1H, br s), 5.54-5.68 (1H, m), 7.16 (1H, d, J=7.9 Hz), 7.19 (1H, dd, J=7.9 Hz, 1.8 Hz), 7.35 (1H, d, J=1.8 Hz), 7.39-7.44 (2H, m), 7.45-7.50 (1H, m), 7.54 (1H, br s).
Пример 14
Этил (R)-2-трет-бутоксикарбониламино-5-[2-хлор-4-(3-трифторметил-фенилтио)фенил]пентаноат
[Химическая формула 48]

В раствор соединения из примера 13 (400 мг) в этилацетате (20 мл) добавили комплекс палладия на активированном угле/этилендамине (100 мг). Получившийся раствор перемешивали в течение 24 ч в атмосфере водорода при комнатной температуре. Реакционный раствор отфильтровали через цеолит, и растворитель выпарили, а для получения целевого продукта остаток очистили на хроматографической колонке с силикагелем (гексан:этилацетат=30:1). В результате был получен целевой продукт (293 мг) в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 MHz): δ 0.91 (3H, t, J=7.3 Hz), 1.42 (9H, s), 1.15-1.77 (8H, m), 2.72 (2H, t, J=7.3 Hz), 3.63 (1H, d, J=12 Hz), 3.67 (1H, d, J=12 Hz), 4.52 (1H, br s), 7.19-7.22 (2H, m), 7.39 (1H, s), 7.40-7.50 (3H, m), 7.54 (1H, brs).
FABMS (+): 532 [M+H]+
Пример 15
(R)-2-трет-6утоксикарбониламино-5-[2-хлор-4-(3-трифторметил-фенокси)фенил]-2-метилпентан-1-ол
[Химическая формула 49]
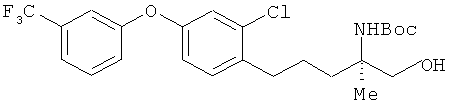
В раствор соединения из примера 11 (1.00 г) в ТГФ (14 мл) добавляли сначала литий борогидрид (229 мг), а затем - по каплям этанол (1.4 мл); процесс проводили при охлаждении льдом. В реакционный раствор добавили 10% водную лимонную кислоту, провели экстракцию этилацетатом. Затем провели последовательное промывание сначала водой, а потом насыщенным солевым раствором. После этого осуществили высушивание над безводным сульфатом натрия. Растворитель выпарили, а для получения целевого продукта остаток очистили на хроматографической колонке с силикагелем (гексан: этилацетат=4:1). В результате был получен целевой продукт (910 мг) в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 MHz): δ 1.16 (3H, s), 1.43 (9H, s), 1.53-1.74 (3H, m), 1.81-1.93 (1H, m), 2.73 (2H, t, J=7.3 Hz), 3.61 (1H, d, J=12 Hz), 3.65 (1 H, d, J=12 Hz), 4.58 (1H, br s), 4.58 (1H, br s), 6.86 (1H, dd, J=7.9, 2.4 Hz), 7.03 (1H, d, J=2.4 Hz), 7.16 (1H, dd, J=7.9 Hz, 2.4 Hz), 7.21 (1H, d, J=7.9 Hz), 7.24 (1H, br s), 7.37 (1H, d, J=7.8 Hz), 7.45 (1H, t, J=7.9 Hz).
Пример 16
(R)-2-трет-6утоксикарбониламино-5-[2-хлор-4-(3-трифторметилфенил-тио)фенил]-2-метилпентан-1-ол
[Химическая формула 50]

Соединение из примера 2 взаимодействовало таким же образом, как и в примере 11, в результате был получен сложный эфир. Этот сложный эфир затем вступил в реакцию таким же образом, как это описано в примере 15. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 MHz): δ 1.14 (3H, s), 1.42 (9H, s), 1.48-1.76 (4H, m), 1.81-1.90 (1H, m), 2.74 (2H, t, J=6.7 Hz), 3.61 (1H, d, J=12 Hz), 3.65 (1H, d, J=12 Hz), 4.56 (1H, br s), 4.58 (1H, br s), 7.20 (2H, d, J=1.2 Hz), 7.37-7.50 (4H, m), 7.54 (1H, br s).
Оптическое вращение: [α]D 27+14.31 (с 0.63, CHCl3)
Пример 17
(R)-2-трет-бутоксикарбониламино-4-[2-хлор-4-(3-трифторметил-фенокси)фенил]-2-метилбутан-1-ол
[Химическая формула 51]

Соединение из примера 3 взаимодействовало таким же образом, как и в примере 11, в результате был получен сложный эфир. Этот сложный эфир затем вступил в реакцию таким же образом, как это описано в примере 15. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 MHz): δ 1.26 (3H, s), 1.45 (9H, s), 1.80-1.88 (1H, m), 2.05-2.12 (1H, m), 2.66-2.80 (2H, m), 3.68 (1H, d, J=11.6 Hz), 3.73 (1 H, d, J=l 1.6 Hz), 3.73 (1H, d, J=11.6 Hz), 4.70 (1H, br s), 6.86 (1H, dd, J=8.5,2.5 Hz), 7.13-7.16 (1H, m), 7.22-7.24 (2H, m), 7.37 (1H, d, J=7.9 Hz), 7.45 (1H, t, J=7.9 Hz).
FABMS (+): 474 [M+H]+
Пример 18
(R)-2-трет-бутоксикарбониламино-4-[2-хлор-4-(3-трифторметилфенил-тио)фенил]-2-метилбутан-1-ол
[Химическая формула 52]
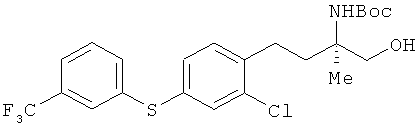
Соединение из примера 4 взаимодействовало таким же образом, как и в примере 11, в результате был получен сложный эфир. Этот сложный эфир затем вступил в реакцию таким же образом, как это описано в примере 15. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 MHz): δ 1.25 (3Н, s), 1.44 (9Н, s), 1.79-1.89 (1H, m), 2.05-2.13 (1H, m), 2.66-2.83 (2H, m), 3.68 (1H, d, J=12 Hz), 3.71 (1 H, d, J=12 Hz), 4.69 (1H, br s), 7.20-7.23 (2H, m), 7.37-7.42 (3, m), 7.45 -7.50 (2H, m), 7.55 (1H. brs).
Пример 19
(R)-2-трет-бутоксикарбониламино-4-[2-хлор-4-(3-этилфенил-тио)фенил]-2-метилбутан-1-ол
[Химическая формула 53]

Соединение из примера 5 взаимодействовало таким же образом, как и в примере 11, в результате был получен сложный эфир. Этот сложный эфир затем вступил в реакцию таким же образом, как это описано в примере 15. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 MHz): δ 1.22 (3Н, t, J=7.3 Hz), 1.24 (3Н, s), 1.44 (9Н, m), 1.77-1.85 (1H, m), 2.02-2.09 (1H, m), 2.62 (2H, q, J=7.3 Hz), 2.63-2.78 (2H, m), 4.08 (1H, br s), 4.68 (1H, br s), 7.10-7.17 (4H, m), 7.22-7.28 (3Н, m).
ESIMS (+): 450 [M+H]+
Пример 20
(R)-2-трет-бутоксикарбониламино-5-[2-хлор-4-(3-метилфенокси)фенил]-2-метилпентан-1-ол
[Химическая формула 54]
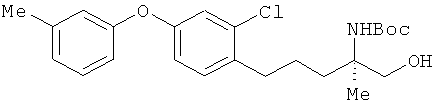
Соединение из примера 6 взаимодействовало таким же образом, как и в примере 11, в результате был получен сложный эфир. Этот сложный эфир затем вступил в реакцию таким же образом, как это описано в примере 15. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 MHz): δ 1.15 (3H, m), 1.43 (9H, s), 1.61-1.67 (3H, s), 1.83-1.87 (1H, m), 2.34 (3H, s), 2.70 (2H, t, J=7.0 Hz), 3.62-3.65 (2H, m), 4.57 (1H, s), 6.81-6.84 (3H, m), 6.94 (1H, d, J=7.3 Hz), 6.98 (1H, d, J=3.1Hz), 7.15 (1H, d, J=7.9 Hz), 7.22 (1H, t, J=7.9 Hz).
ESIMS (+): 434 [M+H]+
Пример 21
(R)-2-трет-бутоксикарбониламино-5-[2-хлор-4-(3-этилфенил-тио)фенил]-2-метилпентан-1-ол
[Химическая формула 55]
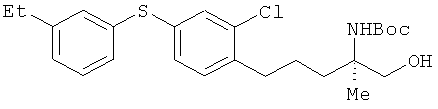
Соединение из примера 7 взаимодействовало таким же образом, как и в примере 11, в результате был получен сложный эфир. Этот сложный эфир затем вступил в реакцию таким же образом, как это описано в примере 15. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 MHz): δ 1.14 (3H, s), 1.22 (3H, t, J=7.3 Hz), 1.43 (9H, s), 1.54-1.70 (3H, s), 1.79-1.89 (1H, m), 2.62 (2H, q, J=7.3 Hz), 2.70 (2H, t, J=7.0 Hz), 3.57-3.66 (2H, m), 4.05 (1H, br), 4.55 (1H, br s), 7.10-717 (4H, m), 7.17-7.28 (3H, m).
ESIMS (+): 464 [M+H]+
Пример 22
(R)-2-трет-бутоксикарбониламино-5-[2-хлор-4-(пропилфенокси)фенил]-2-метилпентан-1-ол
[Химическая формула 56]

Соединение из справочного примера 15 и (5S)-3,6-диэтокси-5-изопропил-2-метил-2,5-дигидропиразин взаимодействовали таким же образом, как в примере 1. Полученное в результате соединение взаимодействовало так же, как в примере 1, в итоге был получен сложный эфир. Этот сложный эфир затем вступил в реакцию таким же образом, как это описано в примере 15. В результате был получен целевой продукт в виде бесцветного масла.
1Н-ЯМР (CDCl3, 400 MHz): δ 0.94 (3H, t, J=7.3 Hz), 1.15 (3H, s), 1.24-1.28 (2H, m), 1.43 (9H, s), 1.60-1.69 (3H, m), 1.80-1.90 (1H, m), 2.57 (2H, t, J=7.6 Hz), 2.70 (2H, t, J=7.6 Hz), 3.58-3.67 (2H, m), 4.11 (1H, br s), 4.58 (1 H, br s), 6,79-6.85 (3H, m), 6.95 (1H, d, J=7.9 Hz), 6.99 (1H, d, J=2.8 Hz), 7.15 (1H, d, J=8.3 Hz), 7.24 (1H, t, J=7.9 Hz).
Пример 23
(R)-2-трет-бутоксикарбониламино-5-[2-хлор-4-(3-хлорфенил-тио)фенил]-2-метилпентан-1-ол
[Химическая формула 57]

Соединение из примера 8 взаимодействовало таким же образом, как и в примере 11, в результате был получен сложный эфир. Этот сложный эфир затем вступил в реакцию таким же образом, как это описано в примере 15. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 MHz): δ 1.14 (3H, s), 1.43 (9H, s), 1.58-1.74 (3H, s), 1.79-1.89 (1H, m), 2.73 (3H, t, J=6.7 Hz), 3.61 (1H, d, J=12 Hz), 3.64 (1H, d, J=12 Hz), 4.08 (1H, br s), 4.57 (1H, br s), 7.17-7.27 (6H, m), 7.37 (1H, s).
ESIMS (+): 470 [M+H]+
Пример 24
(R)-2-трет-бутоксикарбониламино-5-[2-фтор-4-(3-трифторметилфенил-тио)фенил]-2-метилпентан-1-ол
[Химическая формула 58]

Соединение из примера 12 взаимодействовало таким же образом, как и в примере 15. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 MHz): δ 1.14 (3H, s), 1.42 (9H, s), 1.55-1.74 (3H, m), 1.75-1.85 (1H, m), 2.65 (2H, t, J=6.7 Hz), 3.58-3.64 (2H, m), 4.03 (1H, br s), 4.55 (1H, br s), 7.04 (1H, dd, J=7.9 Hz), 7.10 (1H, dd, J=7.9 Hz), 7.17 (1H, t, J=7.9 Hz), 7.38-7.50 (3H, m), 7.54 (1H, br s).
Пример 25
(R)-2-трет-бутоксикарбониламино-5-[2-хлор-4-(3-трифторметилфенил-тио)фенил]-2-метилпентан-1-ол
[Химическая формула 59]

Соединение из примера 14 взаимодействовало таким же образом, как и в примере 15. В результате был получен целевой продукт в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 MHz): δ 0.92 (3H, t, J=7.3 Hz), 1.42 (9H, s), 1.14-1.80 (8H, m), 2.72 (2H, t, J=7.3 Hz), 3.62 (1H, d, J=12 Hz), 3.66 (1H, d, J=12 Hz), 4.54 (1H, br s), 7.16-7.22 (2H, m), 7.39 (1H, s), 7.40-7.48 (3H, m), 7.55 (1H, br s).
FABMS (+): 532 [M+H]+
Пример 26
Гидрохлорид (R)-2-амино-5-[2-хлор-4-(3-трифторметил-фенокси)фенил]-2-метилпентан-1-ола
[Химическая формула 60]
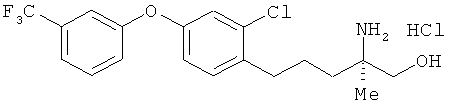
К соединению из примера 15 (6,50 г) добавили раствор соляной кислоты (10 вес/вес %) в метаноле (причем метанол содержал 67 мл соляной кислоты). Полученную в результате смесь встряхивали в течение 1 ч при комнатной температуре и оставили при указанной температуре на ночь. После этого растворитель выпарили, в результате был получен целевой продукт (5, 15 г) в виде бесцветного аморфного вещества.
1Н-ЯМР (DMSO-d6, 400 MHz): δ 0.7 (3H, s), 1.46-1.64 (4H, m), 2.62-2.72 (2H, m), 3.31-3.36 (2H, m), 7.03 (1H, dd, J=7.9, 2.4 Hz), 7.20 (1H, d, J=2.4 Hz), 7.30 (1H, d, J=7.9 Hz), 7.34 (1H, s), 7.39 (1H, d, J=2.4 Hz), 7.52 (1H, d, J=7.9 Hz), 7.63 (1H, t, J=7.9 Hz).
Оптическое вращение: [α]D 23-2.74 (с 0.63, CHCl3)
Пример 27
Гидрохлорид (R)-2-амино-5-[2-хлор-4-(3-трифторметилфенил-тио)фенил]-2-метилпентан-1-ола
[Химическая формула 61
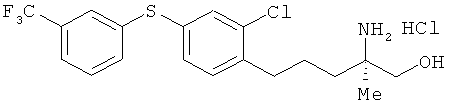
Соединение из примера 16 взаимодействовало таким же образом, как в примере 26. В результате был получен целевой продукт в виде белого порошка.
1Н-ЯМР (DMSO-d6, 400 MHz): δ 0.9 (3H, s), 1.49-1.63 (4H, m), 2.65-2.71 (2H, br s), 3.34 (1H, d, J=12 Hz), 3.38 (1H, d, J=12 Hz), 7.34 (1H, d, J=7.9 Hz, 2.4 Hz), 7.41 (1H, d, J=7.9 Hz), 7.49 (1H, d, J=2.4 Hz), 7.55 (1H, d, J=7.9 Hz), 7.61 (1H, t, J=2.4 Hz), 7.67 (1H, d, J=7.9 Hz), 7.53-7.74 (3H, br s).
ESIMS (+): 404 [M+H]+
Элементный анализ: Измерено: С 51,65%, Н 4,86%, N 2,86%. Вычислено для C19H2ClF3NOS·HCl: С 51,82%, Н 5,04%, N 3,18%.
Оптическое вращение: [α]D 23 - 3.45 (с 1.00, СНСl3)
Пример 28
Гидрохлорид (R)-2-амино-4-[2-хлор-4-(3-трифторметил-фенокси)фенил]-2-метилбутан-1-ола
[Химическая формула 62]
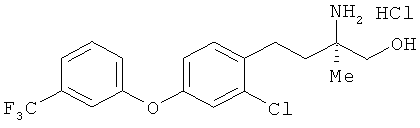
Соединение из примера 17 взаимодействовало таким же образом, как в примере 26. В результате был получен целевой продукт в виде белого порошка.
1Н-ЯМР (DMSO-d6, 400 MHz): δ 1.24 (3H, s), 1.70-1.80 (2H, m), 2.71 (2H, t, J=8.6 Hz), 3.44 (1H, dd, J=11 Hz, 4.9 Hz), 3.50 (1H, dd, J=11 Hz, 4.9 Hz), 5.54 (1H, t, J- 4.9 Hz), 7.04 (1H, dd, J=8.6 Hz, 2.4 Hz), 7.21 (1H, d, J=2.4 Hz), 7.31 (1Н, dd, J=8.6 Hz, 2.4 Hz), 7.35 (3H, br s), 7.41 (1H, d, J=8.6 Hz), 7.52 (1H, d, J=7.9 Hz), 7.63 (1H, d, J=7.9 Hz), 7.95 (3H, br s).
FABMS (+): 404 [M+H]+
Элементный анализ: Измерено: С 52,38%, Н 4,80%, N 3,42%. Вычислено для C18H19ClF3NO2·HCl: C 52,70%, Н 4,91%, N 3,41%.
Пример 29
Гидрохлорид (R)-2-амино-4-[2-хлор-4-(3-трифторметилфенилтио)фенил]-2-метилбутан-1-ола
[Химическая формула 63]
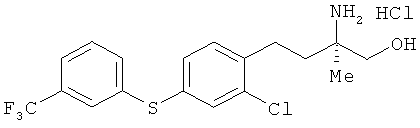
Соединение из примера 18 взаимодействовало таким же образом, как в примере 26. В результате был получен целевой продукт в виде белого порошка.
1Н-ЯМР (DMSO-d6, 400 MHz): δ 1.22 (3H, s), 1.66-1.83 (2H, m), 2.72 (2H, t, J=8.6 Hz), 3.42 (1H, dd, J=11 Hz, 7.9 Hz), 3.42 (1H, dd, J=11 1 Hz, 7.9 Hz), 3.49 (1H, dd, J=11 Hz, 7.9 Hz), 5.54 (1H, t, J=4.9 Hz), 7.36 (1H, dd, J=7.9 Hz, 1.8 Hz), 7.42 (1H, d, J=7.9 Hz), 7.50 (1H, d, J=1.8 Hz), 7.53-7.64 (3H, m), 7.67 (1H, d, J=7.9Hz), 7.82 (3H, brs).
FABMS (+): 390 [M+H]+
Элементный анализ: Измерено: С 50,47%, Н 4,65%, N 3,36%. Вычислено для C18H19ClF3NOS·HCl: C 50,71%, H 4,73%, N 3,29%.
Оптическое вращение: [α]D 26.7+5.78 (с 0.33, CHCl3)
Пример 30
Гидрохлорид (R)-2-амино-4-[2-хлор-4-(3-этилфенилтио)фенил]-2-метил-бутан-1-ола
[Химическая формула 64]

Соединение из примера 19 взаимодействовало таким же образом, как в примере 26. В результате был получен целевой продукт в виде белого порошка.
1Н-ЯМР (DMSO-d6, 400 MHz): δ 1.14 (3Н, t, J=7.3 Hz), 1.22 (3H, s), 1.67-1.81 (2H, m), 2.59 (2H, q, J=7.3 Hz), 2.69 (2H, t, J=8.6 Hz), 3.42 (1H, dd, J=l 1.6 Hz, 5.5 Hz), 5.52 (1H, t, J=4.9 Hz), 7.16-7.22 (2H, m), 7.26-7.27 (2H, m), 7.30-7.35 (2H, m), 7.93 (3H, br s.
ESIMS (+): 350 [M+H]+
Элементный анализ: Измерено: С 58,90%, Н 6,42%, N 3,59%. Вычислено для C18H24ClNOS·HCl: С 59,06%, Н 6,52%, N 3,639%.
Пример 31
Гидрохлорид (R)-2-амино-5-[2-хлор-4-(3-метилфенокси)фенил]-2-метил-пентан-1-ола
[Химическая формула 65]
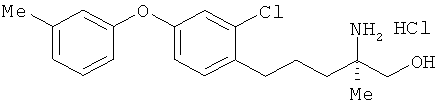
Соединение из примера 20 взаимодействовало таким же образом, как в примере 26. В результате был получен целевой продукт в виде бесцветного аморфного вещества.
1Н-ЯМР (DMSO-d6,400 MHz): δ 1.11 (3H, s), 1.57 (4H, br s), 2.29 (3H, s), 2.64 (2H, br s), 3.35-3.59 (2H, m), 5.45 (1H, t, J=4.9 Hz), 6.81 (1H, dd, J=8.6 Hz, 2.4 Hz), 6.85 (1H, s), 6.92 (1H, dd, J=8.6, 2.4 Hz), 6.99 (1H, d, J=8.6 Hz), 7.03 (1H, d, J=2.4 Hz), 7.28 (1H, t, J=8.6 Hz), 7.34 (1H, t, J=8.6 Hz), 7.77 (3H, br s).
HRESIMS (+): 334. 15655 (Вычислено для C19H25ClNO2: 334.15738)
Оптическое вращение: [α]D 26,7-5.75 (с 0.60, CHCl3)
Пример 32
Гидрохлорид (R)-2-амино-5-[2-хлор-4-(3-этилфенилтио)фенил]-2-метил-пентан-1-ола
[Химическая формула 66]
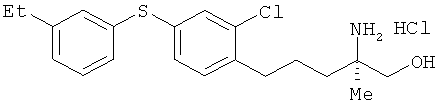
Соединение из примера 21 взаимодействовало таким же образом, как в примере 26. В результате был получен целевой продукт в виде бесцветного масла.
1Н-ЯМР (DMSO-d6, 400 MHz): δ 1.10 (3H, s), 1.15 (3H, t, J=7.3 Hz), 1.52-1.58 (4H, m), 2.59 (2H, q, J=7.3 Hz), 2.62-2.66 (2H, m), 3.32-3.39 (2H, m), 5.43 (1H, br), 7.15-7.22 (3H, m), 7.26 (2H, d, J=1.8 Hz), 7.32 (2H, dd, J=7.3, 1.8 Hz), 7.81(3H, brs),
HRESIMS (+): 364.15051 (Вычислено для C20H27ClNOS: 364.15019)
Пример 33
Гидрохлорид (R)-2-амино-5-[2-хлор-4-(3-пропилфенокси)фенил]-2-метил-пентан-1-ола
[Химическая формула 67]
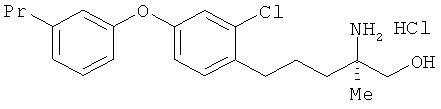
Соединение из примера 22 взаимодействовало таким же образом, как в примере 26. В результате был получен целевой продукт в виде бесцветного аморфного вещества.
1H-ЯМР (DMSO-d6, 400 MHz): δ 0.86 3H, t, J=7.3 Hz), 1.11 (3H, s), 1.51-1.61 (6H, m), 2.53 (2H, t, J=7.3 Hz), 2.63 (2H, t, J=6.7 Hz), 3.34-3.42 (2H, m), 5.45 (1H, t, J=4.9 Hz), 6.81 (1H, ddd, J=7.9, 1.8, 0.9 Hz), 6.87 (1H, t, J=1.8 Hz), 6.91 (1H, dd, J=8.6, 2.4 Hz), 7.00 (1H, d, J=7.9 Hz), 7.02 (1H, d, J=2.4 Hz), 7.30 (1H, t, J=7.9 Hz), 7.34 (1H, d, J=8.6 Hz), 7.85 (3H, br s).
ESIMS (+): 362 [M+H]+
HRESIMS (+): 362.19198 (Вычислено для C21H29ClF3NO2: 362.18868)
Оптическое вращение: [α]D 25.1-4.46 (с 1.27, CHCl3)
Пример 34
Гидрохлорид (R)-2-амино-5-[2-хлор-4-(3-хлорфенилтио)фенил]-2-метил-пентан-1-ола
[Химическая формула 68]
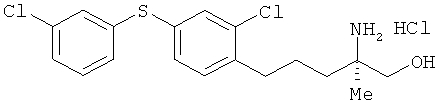
Соединение из примера 23 взаимодействовало таким же образом, как в примере 26. В результате был получен целевой продукт в виде бесцветного аморфного вещества.
1Н-ЯМР (DMSO-d6, 400 MHz): δ 1.10 (3H, s), 1.49-1.64 (4H, m), 2.68 (2H, br s), 3.33 (1H, dd, J=12,4.9 Hz), 3.38 (1H, dd, J=12,4.9 Hz), 5.45 (1H, t, J=4.9 Hz), 7.26 (1H, dt, J=7.3,1.8 Hz), 7.30-7.43 (5H, m), 7.45 (1H, d, J=1.8 Hz), 7.77 (3H,brs).
HRESIMS (+): 370.07999 (Вычислено для C18H21Cl2NOS: 370.07999)
Оптическое вращение: [α]D 27-3.81 (с 0.50, CHCl3)
Пример 35
Гидрохлорид (R)-2-амино-5-[2-фтор-4-(3-трифторметилфенилтио)фенил]-2-метилпентан-1-ола
[Химическая формула 69]

Соединение из примера 24 взаимодействовало таким же образом, как в примере 26. В результате был получен целевой продукт в виде бесцветного аморфного вещества.
1Н-ЯМР (DMSO-d6, 400 MHz): δ 1.09 (3H, s), 1.48-1.61 (4H, m), 2.57-2.64 (2H, br s), 3.32 (1H, dd, J=11, 4.9 Hz), 3.37 (1H, dd, J=11, 4.9 Hz), 5.44 (1H, t, J=4.9 Hz), 7.20 (1H, dd, J=7.9, 1.8 Hz), 7.26 (1H, dd, J=9.8, 1,8 Hz), 7.37 (1H, t, J=7.9 Hz), 7.54-7.68 (4H, m), 7.74 (3H, br s).
HRESIMS (+): 388.1345 (Вычислено для C19H22F4NOS: 388.1358)
Оптическое вращение: [α]D 24-3.23 (с 0.69, CHCl3)
Пример 36
Гидрохлорид (R)-2-амино-5-[2-хлор-4-(3-трифторметилфенилтио)фенил]-2-пропилпентан-1-ола
[Химическая формула 70]

Соединение из примера 25 взаимодействовало таким же образом, как в примере 26. В результате был получен целевой продукт в виде белого порошка.
1Н-ЯМР (DMSO-d6, 400 MHz): δ 0.84 (3H, t, J=7.3 Hz), 1.20 (2H, q, J=7.3 Hz), 1.36-1.63 (6H, m), 2.68 (2h, t, J=7.3 Hz), 3.36 (2H, d, J=4.9 Hz), 5.40 (1H, d, J=4.9 Hz), 7.35 (1H, dd, J=7.9 Hz, 1.8 Hz), 7.42 (1H, d, J=7.9 Hz), 7.50 (1H, d, J=1.8 Hz), 7.55 (1H, d, J=7.9 Hz), 7.58-7.63 (2H, m), 7.67 (1H, d, J=7.9 Hz), 7.69 (3H, br s).
FABMS (+): 432 [M+H]+
Элементный анализ: Измерено: С 53,46%, Н 5,62%, N 2,98%. Вычислено для C21H25ClF3NOS·HCl: С 53,85%, Н 5,59%, N 2,99%.
Оптическое вращение: [α]D 23+3.85 (с 0.69, CHCl3)
Пример 37
(R)-2-амино-5-[2-хлор-4-(3-трифторметилфенилтио)фенил]-2-метил-пентан-1-ол
[Химическая формула 71]
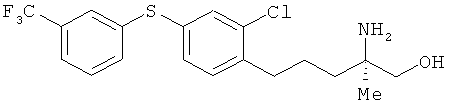
В раствор соединения из примера 27 (9,3 г) в этилацетате (450 мл) добавили насыщенный водный раствор кислого карбоната натрия (450 мл). Получившийся раствор встряхивали в течение 10 мин при комнатной температуре. Органический слой сначала промыли водой, а затем насыщенным солевым раствором, и после этого высушили над безводным сульфатом натрия. Растворитель выпарили, а для получения целевого продукта остаток очистили на хроматографической колонке с силикагелем (этилацетат: метанол=4: 1). В результате был получен целевой продукт (8,9 г) в виде белого порошка.
1Н-ЯМР (DMSO-d6, 400 MHz): δ 0.85 (3H, s), 1.21 (2H, br s), 1.28 (2H, t, J=8.6 Hz), 1.46-1.67 (2H, m), 2.65 (2H, t, J=8.6 Hz), 3.06 (2H, br s), 4.49 (1H, br s), 7.32 (1H, dd, J=7.9, 1.8 Hz), 7.40 (1H, d, J=9.8 Hz), 7.47 (1H, d, J=1.8 hz), 7..54 (1H. dd, J=6.7, 1.8 Hz), 7.56-7.62 (2H, m), 7.65 (1H, dd, J=6.7,1.8 Hz).
ESIMS (+): 404 [M+H]+
Элементный анализ: Измерено: С 56,26%, Н 5,14%, N 3,40%. Вычислено для C19H21ClF3NOS: С 56,50%, Н 5,24%, N 3,47%.
Пример 38
Диэтил 2-{3-[2-хлор-4-(3-трифторметилфенилтио)фенил]пропил} -2-метил-малонат
[Химическая формула 72]
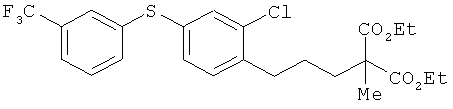
2-хлор-1-(3-иодопропил)-4-(3-трифторметилфенилтио)бензол и диэтил 2-метилмалонат взаимодействовали между собой таким же образом, как в примере 152 заявки WO 04026817. В результате был получен целевой продукт в виде бесцветного масла.
1Н-ЯМР (DMSO-d6, 400 MHz): δ 1.25 (6H, t, J=7.4 Hz), 1.40 (3H, s), 1.51-1.63 (2H, m), 1.90-1.97 (2H, m), 2.73 (2H, t, J=7.9 Hz), 4.17 (4H, q, J=7.4 Hz), 7.17-7.23 (2H, m), 7.38 (1H, d, J=2.2 Hz), 7.39-7.44 (2H, m), 7.45-7.50 (1H, m), 7.55 (1H, s).
ESIMS (+): 502 [M+H]+
Пример 39
(±)-5-[2-хлор-4-(3-трифторметилфенилтио)фенил]пропил}-2-этокси-карбонил-2-метилпентаноевая кислота
[Химическая формула 73]
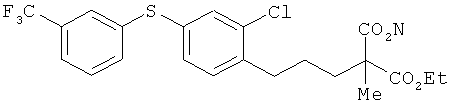
К раствору соединения из примера 38 (16,8 г) в этаноле (167 мл) добавили гидроксид калия (2,40 г). Получившийся в результате раствор встряхивали в течение 24 ч при 50°C. В реакционную смесь добавили воду, провели нейтрализацию 2 мол/л соляной кислотой, а затем экстрагировали этилацетатом. Органический слой сначала промыли водой, а затем насыщенным солевым раствором и после этого высушили над безводным сульфатом натрия. Растворитель выпарили, а для получения целевого продукта остаток очистили на хроматографической колонке с силикагелем (гексан: этилацетат=1: 1). В результате был получен целевой продукт (11,2 г) в виде бесцветного масла.
1Н-ЯМР (DMSO-d6, 400 MHz): δ 1.26 (6H, t, J=7.4 Hz), 1.47 (3H, s), 1.55-1.66 (2H, m), 1.87-2.06 (2H, m), 2.73 (2H, t, J=7.9 Hz), 4.22 (2H, q, J=7.4 Hz), 7.18 (1H, d, J=7.9 Hz), 7.20 (1H, dd, J=7.9, 1.8 Hz), 7.38 (1H, d, J=1.8 Hz), 7.39-7.44 (2H, m), 7.45-7.50 (1H, m), 7.55 (1H, s).
ESIMS (+): 475 [M+H]+
Пример 40
Этил (±)-5-[2-хлор-4-(3-трифторметилфенилтио)фенил]пропил}-2-метокси-карбониламино-2-метилпентаноат
[Химическая формула 74]
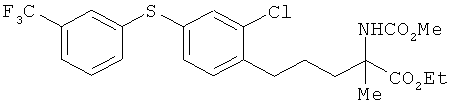
К раствору соединения из примера 39 (15,8 г) в бензоле (166 мл) добавили азид дифенилфосфорила (7,86 мл) и триэтиламин (6,01 мл). Получившийся в результате раствор нагревали вплоть до дефлегмации в течение 1,5 ч. После этого температуру реакционного раствора вернули до значения комнатной температуры, и на протяжении 20 мин по каплям добавляли метанол (20 мл). Получившийся в результате раствор нагревали вплоть до дефлегмации в течение 30 мин, а затем добавили метоксид натрия (3,58 г) и вновь нагревали до дефлегмации в течение 1,5 ч. В реакционный раствор ввели насыщенный водный раствор хлорида аммония и провели экстракцию этилацетатом. Органический слой сначала промыли водой, а затем насыщенным солевым раствором и после этого высушили над безводным сульфатом натрия. Растворитель выпарили, а для получения целевого продукта остаток очистили на хроматографической колонке с силикагелем (гексан: этилацетат=5: 1). В результате был получен целевой продукт (15,6 г) в виде бесцветного масла.
1Н-ЯМР (DMSO-d6, 400 MHz): δ 1.25 (3H, t, J=7.3 Hz), 1.32-1.47 (1H, s), 1.52-1.67 (1H, m), 1.57 (3H, s), 1.80-1.90 (1H, m), 2.20-2.37 (1H, m), 2.62-2.76 (2H, m), 3.64 (3H, s), 4.15-4.25 (2H, m), 5.62 (1H, br s), 7.16 (1H, d, J=7.9 Hz), 7.20 (1H, dd, J=7.9, 1.8 Hz), 7.38 (1H, d, J=1.8 Hz), 7.40-7.44 (2H, m), 7.45-7.50 (1H, m), 7.55 (1H, s).
ESIMS (+): 504 [M+H]+
Пример 41
(±)-5-[2-хлор-4-(3-трифторметилфенилтио)фенил]пропил}-2-метокси-карбониламино-2-метилпентан-1 -ол
[Химическая формула 75]

К раствору соединения из примера 41 (12,9 г) в тетрагидрофуране (60 мл) и метаноле (120 мл) добавили 5 мол/л водный раствор гидроксида калия (60 мл), процесс проводили при охлаждении льдом. Получившийся в результате раствор нагревали вплоть до дефлегмации в течение 86 ч. В реакционный раствор добавили воду и провели экстракцию этилацетатом. Органический слой сначала промыли водой, а затем насыщенным солевым раствором и после этого высушили над безводным сульфатом натрия. Экстракт упарили, а остаток растворили в 1,4-диоксане (279 мл). В полученный в результате раствор добавили ди-трет-бутоксидикарбонат (9,13 г), встряхивали его в течение 2 ч при комнатной температуре, а затем при этой же температуре оставили на ночь. В реакционный раствор добавили воду и провели экстракцию этилацетатом. Органический слой сначала промыли водой, а затем насыщенным солевым раствором и после этого высушили над безводным сульфатом натрия. Растворитель выпарили, а для получения целевого продукта остаток очистили на хроматографической колонке с силикагелем (гексан: этилацетат=2:1). В результате был получен целевой продукт (13,0 г) в виде бесцветного масла.
1Н-ЯМР (DMSO-d6, 400 MHz): δ 1.14 (3H, s), 1.42 (9H, m), 1.53-1.74 (3Н, m), 1.79-1.92 (1H, m), 2.74 (2H, t, J=7.9 Hz), 3.58-3.69 (2H, m), 4.05 (1H, br s), 4.57 (1H, br s), 7.20-7.22 (2H, m), 7.38-7.50 (4H, m), 7.54 (1H, s).
ESIMS (+):504 [M+H]+
Пример 42
(±)-2-трет-бутоксикарбониламино-5-[2-хлор-4-(3-трифторметилфенил-тио)фенил]-2-метилпентан-1-ол
[Химическая формула 76]
К раствору соединения из примера 40 (15,6 г) в тетрагидрофуране (249 мл) добавили сначала борогидрид лития (3,75 г), а затем по каплям - этанол (16,6 мл). Процесс проводили при охлаждении льдом. Получившийся в результате раствор перемешивали в течение 1 ч, продолжая охлаждение льдом. В реакционный раствор ввели 10% водный раствор лимонной кислоты и провели экстракцию этилацетатом. Органический слой сначала промыли водой, а затем насыщенным солевым раствором и после этого высушили над безводным сульфатом натрия. Растворитель выпарили, а для получения целевого продукта остаток очистили на хроматографической колонке с силикагелем (гексан: этилацетат=1: 1). В результате был получен целевой продукт (12,9 г) в виде бесцветного масла.
1Н-ЯМР (DMSO-d6, 400 MHz): δ 1.18 (3H, s), 1.54-1.74 (3H, m), 1.78-1.89 (1H, m), 2.73 (2H, t, J=7.9 Hz), 3.63 (3H, s), 3.56-3.70 (2H, m), 4.23 (1H, br s), 7.17-7.22 (2H, m), 7.38-7.50 (4H, m), 7.54 (1H, s).
ESIMS (+): 462 [M+H]+
Примеры 43 и 44
(+)-2-трет-бутоксикарбониламино-5-[2-хлор-4-(3-трифторметил-фенилтио)]фенил-2-метилпентан-1-оли
(-)-2-трет-бутоксикарбониламино-5-[2-хлор-4-(3-трифторметил-фенилтио)]фенил-2-метилпентан-1-ол
Оптическое разделение соединения из примера 42 было проведено с использованием жидкостной хроматографии высокого разрешения (CHIRALCEL OJ-H, гексан:изопропанол:диэтиламин=98:2:0,1 объем /объем); измерения осуществляли при длине УФ-волны 278 нм, скорость расхода 1,0 мл/мин). Из порции до вымывания было получено бесцветное масло, имеющее [α]D 25+15,08 (с 0,63, CHCl3) (пример 43), а из порции после вымывания получили бесцветное масло, имеющее [α]D 26-13,91 (с 0,63, СНСl3) (пример 44).
Пример 45
Гидрохлорид (-)-2-амино-5-[2-хлор-4-(3-трифтор-метилфенилтио)фенил]-2-метилпентан-1-ола
Соединение из примера 43 взаимодействовало таким же образом, как в примере 26. В результате был получен целевой продукт в виде белого порошка.
FABMS (+): 404 [М+Н]
Оптическое вращение: [α]D 25-4,48 (с 1,00, СНСl3)
Далее результаты, подтверждающие полезность соединения по настоящему изобретению, показаны с помощью примеров, полученных в результате экспериментов.
Пример, полученный в результате эксперимента 1.
Влияние активнодействующих веществ на общее количество лейкоцитов в периферической крови мышей.
Исследуемое соединение было растворено в диметилсульфоксиде (ДМСО) или суспендировано в нем, а затем для приготовления дозировочных растворов (с конечной концентраций ДМСО, составляющей 1%) был добавлен физиологический раствор. Если дозировочные растворы не имели растворенную форму или вид однородного суспендированного состояния, то в этих случаях добавляли Твин 80; добавка проводилась с таким расчетом, чтобы конечная концентрация составляла 0,01%-0,1%. Получившийся в результате раствор обрабатывали ультразвуком для формирования тонкой суспензии. Приготовленные таким образом растворы исследуемых соединений вводили мужским особям мышей (BALB/crS1c) в возрасте 8-14 недель. Введение осуществлялось интраперитонеально в количествах, составляющих 0,1 мл или 0,2 мл на 10 г массы тела. Контрольной группе животных таким же образом вводили только растворитель, состав которого был таким же, как в препарате исследуемого соединения. Спустя 6 ч после введения растворов исследуемого соединения, используя эфирную анестезию, собрали посткавальную кровь (в качестве антикоагулянта добавили 10 мл 10% ЭДТК). Измерения общего количества лейкоцитов проводили с помощью автоматизированного анализатора клеток крови (Sysmex F-820).
В этом эксперименте соединения, имеющие ингибирующее соотношение, которое составляло 60% или выше, были обозначены «+++»; соединения, у которых ингибирующее соотношение составляло менее 60%, но более 50% или равнялось 50%, были обозначены «++»; а соединения, у которых ингибирующее соотношение составляло менее 50%, но более 40% или равнялось 40%, были обозначены «+». Ингибирующие соотношения, являющиеся результатом введения дозы 0,3 мг, обозначены []. Полученные данные приведены в таблице 1.
Пример, полученный в результате эксперимента 2.
Ингибирующее действие исследуемых соединений на реакцию отторжения «хозяин-трансплантат» у мышей
Этот эксперимент проводился со ссылкой на способы, описанные в работе Transplantation, vol.55, No 3, pp.578-591, 1993. Была собрана селезенка мужских особей BALB/c мышей в возрасте 6-23 недель (Japan SLC). Полученные образцы селезенки экстрагировали в среде RPMI-1640 (Sigma), а затем превратили в суспензию клеток селезенки. Указанную суспензию готовили путем измельчения с помощью 2-х стеклянных пластин и последующего пропускания через сито (70 мк. Falcon). Приготовленные таким образм суспензии клеток селезенки отцентрифугировали, а супернатанты удалили. После этого добавили изотонический буферный раствор хлорида аммония и провели гемолиз красных кровяных телец. После центрифугирования и троекратного промывания средой RPMI-1640 клетки были суспендированы в указанной среде. Добавили митомицин (Kyowa Hakko) таким образом, чтобы конечная концентрация стала равной 25 мкг/мл. После этого клетки инкубировали в течение 30 мин при 37°C при 5% содержании CO2. После центрифугирования и троекратного промывания средой RPMI-1640 клетки были суспендированы в указанной среде таким образом, чтобы их концентрация составила 2,5×108 клеток/мл. Эта суспензия клеток была использована как стимулирующая. 20 мкл этой суспензии вводили инъекцией в подушку правой задней лапы мужских особей C3H/HeN мышей в возрасте 6-11 недель (Clea Japan). Инъекцию осуществляли подкожно с помощью иглы 27 G и микрошприца (Hamilton). Обычной контрольной группе инъекционно вводили только среду RPMI-1640. Спустя 4 суток экстрагировали правые подколенные лимфатические узлы животных, и их вес установили с помощью электронного устройства Mettler AT201 (Mettler Toledo). Начиная со дня инъекции стимулирующей суспензии в течение 3 последующих дней осуществляли интраперитонеальное введение исследуемых соединений, общее количество введений - 4, по одной инъекции в день. Контрольной группе животных таким же образом вводили только растворитель, состав которого был таким же, как в препарате исследуемого соединения. В таблице 2 приведены полученные результаты. В качестве растворителя использовали физиологический солевой раствор, содержащий 0,5% ДМСО (соответственно подобранные согласно растворимости конкретного соединения). Ингибирующее соотношение было подсчитано по следующей формуле.

Соединения, у которых значение ED50 составляло менее 0,1 мг/кг, были отмечены символом «+++»; соединения, у которых значение ED50 составляло менее 1 мг/кг, но было больше или равнялось 0,1 мг/кг, отмечены символом «++»; соединения, у которых значение ED50 составляло менее 10 мг/кг, но было больше или равно 1 мг/кг, отмечены символом «+».
Пример, полученный в результате эксперимента 3
Ингибирующая активность исследуемых соединений в модели на трансплантате кожи крыс.
Активность в отношении реакции отторжения изучалась на модели трансплантата кожи крысы. Аллогенный трансплантат кожи с подобранным комплексом гистосовместимости (МНС) был изготовлен по ссылкой на способы, описанные в работах Am. J. Med. Technol. 36, 149-157, 1970; Transplant. Proc.; 28,1056-1059,1996.
Была снята кожа брюшного отдела крыс LEW/CrlCrlj, служивших донорами (мужские особи 5 недельного возраста, Japan Charles River), и удален мышечный слой под этой кожей. Затем был приготовлен трансплантат - образец кожи размером 1,8 см×1,8 см. Далее крысам F344/DuCrlCrlj (мужские особи 5 недельного возраста, Japan Charles River), служившим реципиентами, была сделана анестезия интраперитонеальным введением пентобарбитала натрия (40 мг/кг) (нембутал, Dainippon Sumitomo Pharma). Шерсть со спины крыс была удалена электрической машинкой для стрижки, а оставшаяся часть шерсти - выбрита с помощью бритвы. После этого на спине крыс сделали метку размером 1,8 см×1,8 см и вдоль этой метки скальпелем сделали неглубокий разрез. Затем для приготовления основы трансплантата вдоль этого разреза шерсть удалили щипчиками. На указанную основу нанесли несколько капель стерильного физиологического раствора (Otsuka Pharmaceuticals) и просушили марлей. Нанесли несколько капель пенициллина (Meiji Seika) и после этого на основу поместили трансплантат. Удалив лишнюю влагу марлей, поверх трансплантата прикрепили бинт, а туловище крысы обернули лейкопластырем. На третий день после операции поверх этого обернули свежий лейкопластырь. На пятый день после операции бинт и лейкопластыри разрезали ножницами и удалили. Начиная с этого дня проводилось наблюдение за трансплантатом. Если отмирало 90% трансплантата или более, или если он становился коричневым, то фиксировалось отторжение трансплантата. В качестве периода жизнеспособности было выбрано количество дней, начиная с момента трансплантации вплоть до подтверждения отторжения. Среднее значение периода жизнеспособности для каждой группы подсчитывалось как среднее время жизнеспособности (MST). В каждой группе в исследовании участвовало по 5 животных, все животные помещались в индивидуальных клетках. Исследуемые соединия были растворены в очищенной воде, и их вводили перорально и однократно в течение нескольких последовательных дней, начиная с дня трансплантации. В контрольной группе в таком же режиме вводили такую же очищенную воду.
Полученные результаты приведены в таблице 3. Значение MST для контрольной группы составило 8,8 дней. Трансплантаты тех животных, которым в качестве иммунодепрессивного средства вводили циклоспорин (CsA) в дозе 30 мг/кг, считались жизнеспособными (MST 28 дней и более) на протяжении всего периода наблюдения. В примере 27 эффект увеличения периода жизнеспособности трансплантата был обнаружен при индивидуальном введении.
Далее исследовалось влияние соединения из примера 27 (0.3-10 мг/кг) в сочетании с CsA в дозе (10 мг/кг); при этом в случае индивидуального введения жизнеспособность трансплантата не наблюдалась. В результате совместного использования этих веществ MST составило 26 дней и более, что подтверждает четкий эффект объединения.
Пример, полученный в результате эксперимента 4
Влияние на массу легкого крыс
В этом эксперименте были использованы мужские особи крыс (Crlj:Wistar) в возрасте 5-8 недель. Крысам перорально вводили водный раствор исследуемых соединений в количестве, составляющем 0,5 мл на 100 г массы тела животного. Спустя 6 ч легкие крыс были удалены и определена их масса.
Исследование по введению соединения из примера 26 в дозе до 30 мг/кг массы тела, а также соединения из примера 27 в дозе до 100 мг/кг массы тела показали, что какое-либо воздействие на массу легких отсутствует.
В результате этого подтверждено, что соединения из примеров 26 и 27 обладают высокой степенью безопасности, а их побочное действие снижено.
Техническое назначение
Согласно настоящему изобретению возможно обеспечение производного аминоспирта, обладающего очень высокой иммунодепрессивной активностью и безопасностью.
Соединение по настоящему изобретению полезно в качестве профилактического или лечебного средства при отторжении трансплантатов органов или трансплантата костного мозга; профилактического или лечебного средства при аутоиммунных заболеваниях (типа воспалительного заболевания кишечника, системной красной волчанки, болезни Хорна, нефротического синдрома, гломерусклерозе, гломерунефрите, множественном склерозе, бульбоспинального паралича); профилактического или лечебного средства при ревматоидном артрите; профилактического или лечебного средства при псориазе, аллергическом контактном дерматите и атоническом дерматите; профилактического или лечебного средства при гепатите, ожирении печени, токсическом поражении печени, циррозе печени или связанных с диабетом заболеваниях печени; профилактического или лечебного средства при аллергическом рините, аллергическом конъюнктивите и им подобных; и профилактического или лечебного средства при пневмосклерозе, идиопатической интенстициальной пневмонии и бронхиальной астме.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНОЕ АМИНОФОСФАТА И МОДУЛЯТОР РЕЦЕПТОРА S1P, СОДЕРЖАЩИЙ ЕГО В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2007 |
|
RU2430925C2 |
| ПРОИЗВОДНОЕ ЦИКЛОПЕНТИЛАКРИЛАМИДА | 2009 |
|
RU2565070C2 |
| СОЕДИНЕНИЯ, ПРИГОДНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ TRPM8 | 2011 |
|
RU2608109C2 |
| БИФЕНИЛЬНЫЕ ПРОИЗВОДНЫЕ И ФАРМАЦЕВТИЧЕСКАЯ И КОСМЕТИЧЕСКАЯ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 1998 |
|
RU2193552C2 |
| МОЛЕКУЛЫ С ПЕСТИЦИДНОЙ ФУНКЦИЕЙ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, КОМПОЗИЦИИ И СПОСОБЫ, СВЯЗАННЫЕ С НИМИ | 2016 |
|
RU2735602C2 |
| БИ-АРИЛ-МЕТА-ПИРИМИДИНОВЫЕ ИНГИБИТОРЫ КИНАЗ | 2006 |
|
RU2589878C2 |
| БИ-АРИЛ-МЕТА-ПИРИМИДИНОВЫЕ ИНГИБИТОРЫ КИНАЗ | 2006 |
|
RU2597364C2 |
| НОВОЕ ПРОИЗВОДНОЕ ПИРРОЛА, ИМЕЮЩЕЕ В КАЧЕСТВЕ ЗАМЕСТИТЕЛЕЙ УРЕИДОГРУППУ, АМИНОКАРБОНИЛЬНУЮ ГРУППУ И БИЦИКЛИЧЕСКУЮ ГРУППУ, У КОТОРЫХ МОГУТ БЫТЬ ЗАМЕСТИТЕЛИ | 2009 |
|
RU2500669C2 |
| АМИНОСПИРТОВЫЕ ПРОИЗВОДНЫЕ | 2005 |
|
RU2399614C2 |
| СПОСОБ ВОССТАНОВЛЕНИЯ НАРУШЕННЫХ ФУНКЦИЙ ОПИОИДНЫХ РЕЦЕПТОРОВ | 1996 |
|
RU2307833C2 |
Изобретение относится к новым производным аминоспирта или их фармацевтически приемлемым солям. В формуле I(а):

R3 представляет собой алкильную группу с неразветвленной цепью, содержащую от 1 до 3 атомов углерода, Х представляет собой атом кислорода или атом серы, а n обозначает 2 или 3. Изобретение также относится к фармацевтическому средству, пригодному для применения в качестве иммунодепрессивного средства при отторжении трансплантатов, содержащему указанные соединения. 4 н. и 4 з.п. ф-лы, 3 табл., 45 пр.
1. Производное аминоспирта, представленное общей формулой I(а)

в которой R3 представляет собой алкильную группу с неразветвленной цепью, содержащую от 1 до 3 атомов углерода, Х представляет собой атом кислорода или атом серы, а n обозначает 2 или 3, или его фармацевтически приемлемая соль.
2. Производное аминоспирта по п.1, отличающееся тем, что в общей формуле (1а) R3 представляет собой метальную группу; или его фармацевтически приемлемую соль.
3. Производное аминоспирта по п.1, отличающееся тем, что соединение общей формулы (1а) представляет собой
(R)-2-амино-5-[2-хлор-4-(3-трифторметилфенокси)фенил]-2-метилпентан-1-ол,
(R)-2-амино-5-[2-хлор-4-(3-трифторметилфенилтио)фенил]-2-метилпентан-1-ол,
(R)-2-амино-4-[2-хлор-4-(3-трифторметилфенокси)фенил]-2-метилбутан-1-ол,
(R)-2-амино-4-[2-хлор-4-(3-трифторметилфенилтио)фенил]-2-метилбутан-1-ол,
или
(R)-2-амино-5-[2-хлор-4-(3-трифторметилфенилтио)фенил]-2-пропилпентан-1-ол; или их фармацевтически приемлемую соль.
4. Производное аминоспирта по п.1, отличающееся тем, что указанное соединение, представленное общей формулой (1а) представляет собой соединение, представленное формулами (1b), (1c), (1d), (1e) или (1f):
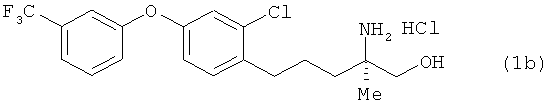
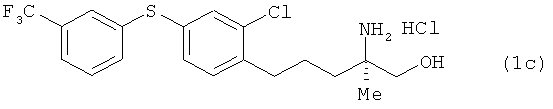

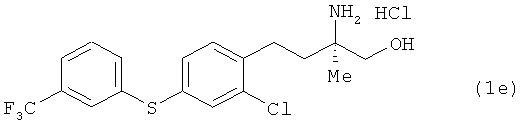
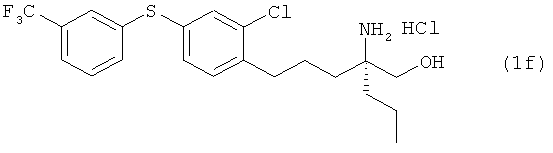
или их фармацевтически приемлемой солью.
5. Производное аминоспирта по п.1, отличающееся тем, что представляет собой соединение
(-)-2-амино-5-[2-хлор-4-(3-трифторметилфенилтио)фенил]-2-метилпентан-1-ол; или его фармацевтически приемлемую соль.
6. Фармацевтическое средство, пригодное для применения в качестве иммунодепрессивного средства при отторжении трансплантатов, содержащее в качестве активного ингредиента эффективное количество производного аминоспирта, или его фармацевтически приемлемой соли по любому из пп.1-5.
7. Фармацевтическое средство, пригодное для применения в качестве профилактического или лечебного средства при отторжении трансплантатов органов или трансплантатов костного мозга, содержащее в качестве активного ингредиента эффективное количество производного аминоспирта, или его фармацевтически приемлемой соли по любому из пп.1-5.
8. Фармацевтическое средство, пригодное для применения в качестве иммунодепрессивного средства при отторжении трансплантатов, содержащее в качестве активного ингредиента эффективное количество производного аминоспирта или его фармацевтически приемлемой соли по любому из пп.1-5, в сочетании с эффективным количеством циклоспорина.
| Зажимное устройство | 1986 |
|
SU1548003A1 |
| ПРИМЕНЕНИЕ АГОНИСТА РЕЦЕПТОРА S1P И СПОСОБ ЛЕЧЕНИЯ, ОБЛЕГЧЕНИЯ ИЛИ ЗАДЕРЖКИ ПРОГРЕССИРОВАНИЯ НЕВРИТА ЗРИТЕЛЬНОГО НЕРВА ИЛИ ДЕМИЕЛИНИЗАЦИОННЫХ ЗАБОЛЕВАНИЙ | 2003 |
|
RU2391094C2 |
| ЕР 1431284 А1, 23.06.2004. | |||
Авторы
Даты
2012-08-10—Публикация
2007-08-07—Подача