ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к ингибиторам протеин-тирозинкиназ, фармацевтически доступным композициям, содержащим соединения, заявленные в соответствии с настоящим изобретением, и способам использования указанных композиций для лечения различных заболеваний. В частности, настоящее изобретение относится к ингибиторам протеин-тирозинкиназ из семейства JAK.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Протеинкиназы представляют собой семейство ферментов, которые катализируют фосфорилирование специфических остатков белков, их условно классифицируют на тирозин- и серин/треонин киназы. Нарушение активности киназ, которое обычно является следствием мутации, их гипер-экспрессия или нарушенная регуляция, дисрегуляция или дерегуляция, а также гиперпродукция или пониженная продукция факторов роста или цитокинов, характерно для многих заболеваний, включая, без ограничений указанными, раковые заболевания, заболевания сердечнососудистой системы, аллергические заболевания, астму и другие респираторные заболевания, аутоиммунные заболевания, воспалительные заболевания, заболевания костей, метаболические нарушения и неврологические и нейродегенеративные заболевания, такие, как болезнь Альцгеймера. Нарушение активности киназ запускает различные биологические клеточные ответы, включая клеточный рост, дифференцировку клеток, выживаемость клеток, апоптоз, митогенез, контроль клеточного цикла и клеточную мобильность; указанные процессы участвуют в патогенезе перечисленных выше заболеваний.
Протеинкиназы - очень важный класс ферментов и мишени действия различных лекарственных агентов. В частности, клеточные тирозинкиназы из семейства JAK (Jak1, Jak2, Jak3 и Tyk2) играют центральную роль в передаче сигналов цитокинов (Kisseleva et al. Gene, 2002, 285, 1; Yamaoka et al. Genome Biology 2004, 5, 253)). Путем связывания со своими рецепторами, цитокины активируют JAK, которые затем фосфорилируют цитокиновый рецептор, что приводит к формированию участков "причаливания" для сигнальных молекул, в частности, членов семейства переносчиков сигнала и активаторов транскрипции (STAT, от англ. Signal Transducer and Activator of Transcription), что в конце концов приводит к экспрессии генов. Известно, что многие цитокины активируют JAK семейство. К указанным цитокинам относятся, интерфероны (IFN-αs/β/ω/Лимитин, INF-γ, IL-10, IL-19, IL-20, IL-22), члены семейства gp130 (IL-6, IL-11, OSM, LIF, CNTF, NNT-1/BSF-3, G-CSF, СТ-1, лептин, IL-12, IL-23), члены семейства γС (IL-2, IL-7, TSLP, IL-9, IL-15, IL-21, IL-4, IL-13), члены IL-3 семейства (IL-3, I1-5, GM-CSF), члены семейства одноцепочечных молекул (ЕРО, GH, PRL, ТРО), рецепторы тирозинкиназ (EGF, PDGF, CSF-1, HGF) и рецепторы, связанные с G-белком (AT1).
До настоящего времени, терапевтический потенциал ингибиторов JAK изучали главным образом в отношении различных заболеваний, поражающих иммунную систему. К ним относятся, без ограничений указанными, атопии (аллергическая астма, атопический дерматит, аллергический ринит), клеточно-опосредованная гриперчувствительность (аллергический контактный дерматит, гиперчувствительный пневмонит), ревматические заболевания (системная красная волчанка (СКВ), ревматоидный артрит, ювенильный артрит, синдром Шегрена, склеродермия, полимиозит, анкилозирующий спондилит, псориатический артрит), иммунные реакции после трансплантации (отторжение трансплантата, реакция трансплантат против хозяина), вирусные заболевания (заболевания, вызванные вирусом Эпштейн-Барр, гепатит В, гепатит С, ВИЧ, заболевания, вызванные вирусом Т-клеточного лейкоза человека 1, вирусом ветряной оспы, вирусом папилломы человека), раковые заболевания (лейкемии, лимфомы), заболевания сердечно-сосудистой системы (гипертрофия миокарда, атеросклероз и артериосклероз), нейродегенеративные заболевания (болезнь моторных нейронов), пищевые аллергии, воспалительные заболевания кишечника, болезнь Крона, воспалительные заболевания кожи и иммунная супрессия, вызванная солидными опухолями. В настоящее время ингибирование JAK3 рассматривается как мишень для иммуносупрессии, например при трансплантации органов и приживаемости трансплантатов (см, например, Borie et al. Current Opinion in Investigational Drugs, 2003, 4(11). 1297).
Совсем недавно были сделаны два открытия, касающиеся роли сигнального пути EPO-JAK2 в патогенезе миелопролиферативных заболеваний и пролиферативной диабетической ретинопатии. Во-первых, было обнаружено, что соматическая (приобретенная) мутация JAK2 киназы (V617F), проявляющаяся повышением ее функции, является причиной различных "типичных" миелопролиферативных заболеваний, включая истинную полицитемию, первичную тромбоцитемию, мелофиброз с миелоидной метаплазией, кроме того, данную мутацию обнаружили у пациентов, страдающих "атипичными" миелопролиферативными заболеваниями и миелодиспластическим синдромом (см, например, Tefferi and Gilliland, Cell Cycle 2005, 4(8), e61; Pesu et al. Molecular Interventions 2005, 5(4), 211). Кроме того, ученые обнаружили, что (а) мутация V617F JAK2 ассоциирована с конститутивным фосфорилированием JAK2 и эффекторных молекул пониженной регуляции, а также с индукцией гиперчувствительности к эритропоэтину, что было показано в экспериментах на клеточном уровне, (b) V167F-JAK-2-индуцированная клеточная пролиферация ингибируется синтетическими ингибиторами JAK2 и (с) введение ретровируса, несущего V617F JAK2 в костный мозг мышей индуцирует у животных развитие эритрозитоза.
Кроме того, недавно было показано, что мутации в гене EPO-R также приводят к постоянной активации JAK пути передачи сигнала, что стимулирует развитие миелопролиферативных заболеваний.
Во вторых, было показано, что ЕРО является потенциальным ангиогенным фактором в патогенезе прлиферативной диабетической ретинопатии, которая является основной причиной потери зрения больных сахарным диабетом трудоспособного возраста, (см., например, Aiello, New England Journal of Medicine, 2005, 353 (8), 839; Watanabe et al. New England Journal of Medicine 2005 353 (8), 782).
Кроме того, в исследовании Watanabe были сделаны следующие открытия (а) интраокулярный уровень ЕРО и VEGF (другой хорошо известный ангиогенный фактор в патогенезе пролиферативной диабетической ретинопатии) был значительно выше у людей с пролиферативной диабетической ретинопатией, чем у людей с неактивной формой заболевания или у людей в контрольной группе, (b) уровни ЕРО и VEGF строго между собой не коррелируют, (с) уровни ЕРО более строго коррелируют с наличием пролиферативной диабетической ретинопатии, чем уровни VEGF, (d) ЕРО стимулирует рост и внутриклеточную передачу сигналов в эпителиальных клетках сетчатки, и (е) ингибирование как ЕРО, так и VEGF приводит к уменьшению индуцированной гипоксией неоваскуляризации сетчатки у модельных грызунов.
Не так давно было показано, что мутации ЕРО рецептора также могут влиять на передачу сигнала по JAK-пути, а это, в свою очередь, может играть роль в патогенезе тех заболеваний, для которых передача сигнала по JAK-пути является важным фактором.
Существует еще одна особенность, касающаяся ингибиторов JAK-пути передачи сигнала. Было показано, что JAK-путь необходим также для выживания и пролиферации клеток. Например, для клеток, которые являются положительными по Филадельфийской хромосоме, что является причиной хронического миелогенного лейкоза (CML, от англ. Chronic Myelogenous Leukemia), доказано участие JAK-пути в конститутивной активации. Соответственно, использование JAK ингибитора может быть полезным для лечения CML, при котором доказано, что филадельфийская хромосома продуцирует гибридный Bcr-Abl, что поддерживает конститутивную активность клеток.
Кроме того, считается, что в случае устойчивых мутаций, которые возникают вследствие воздействия специфических ингибиторов к BCR-ABL, а также в случае T315I мутаций контрольных генов, или любых других мутаций, возможно использование JAK ингибиторов, поскольку именно этот путь активации сигнала "используют" BCR-ABL мутанты (как в случае BCR-ABL (T315I). Таким образом, JAK ингибиторы могут использоваться для лечения пациентов с устойчивостью к известным способам лечения, при этом прямой мишенью является BCR-ABL; в настоящее время доказано, что именно эта мутация является доминантной (50-90%) у пациентов с устойчивостью к существующим способам лечения.
Использование JAK ингибиторов также может найти применение при других заболеваниях миелоидного ростка, как заболеваниях крови, так и других заболеваниях при которых страдает миелоидный росток, а также при других заболеваниях, в патогенезе которых напрямую или косвенно участвует JAK-путь передачи сигнала.
Таким образом, существует необходимость разработать соединения, полезные в качестве ингибиторов киназ, в частности, JAK киназ, которые можно использовать вместо существующих неадекватных способов лечения указанных выше заболеваний, при которых происходит дисрегуляция JAK-пути передачи сигнала, который напрямую или косвенно задействован в патогенезе указанных заболеваний.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Согласно одному варианту своего осуществления, настоящее изобретение относится к соединению, имеющему структуру (А):
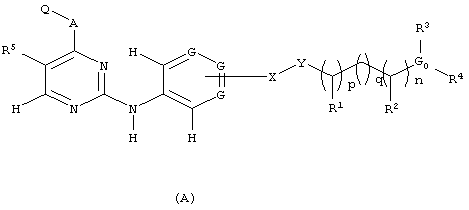
Согласно другому варианту своего осуществления, настоящее изобретение относится к способу лечения заболеваний, ассоциированных с ангиогенезом, заключающемуся во введении нуждающемуся субъекту терапевтически эффективного количества, по крайней мере, одного соединения, имеющего структуру (А), или его фармацевтически доступных солей, гидратов, сольватов, полиморфных модификаций, кристаллических форм, N-оксидов, и индивидуальных энантиомеров и диастереомеров.
Согласно другому варианту своего осуществления, настоящее изобретение относится к фармацевтическим композициям и изделиям промышленного производства, содержащим, по крайней мере, одно соединение, имеющее структуру (А), или его фармацевтически доступные соли, гидраты, сольваты, кристаллические формы и индивидуальные диастереомеры.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
А. Термины и определения
Приведенные ниже термины и определения, которые используются в данном описании, в целом имеют значения, рекомендованные Международным Союзом Теоретической Прикладной Химии (IUPAC):
Термин "гетероатом" относится к неуглеродному атому, например, атому N, О или S.
Термин "ароматический" относится к циклически конъюгированной молекуле, обладающей стабильностью за счет делокализации, которая существенно превышает таковую гипотетической локализованной структуры, такой, как, например, структура Kekulé.
Термин "гетероциклический", в том случае, когда он используется для описания ароматического кольца, относится к ароматическим кольцам, содержащим, по крайней мере, один гетероатом, как определено выше.
Термин "гетероциклический" в том случае, когда он не используется для описания ароматического кольца, относится к циклическим (то есть, содержащим кольцо) группам, отличным от ароматических групп, при этом указанная циклическая группа сформирована приблизительно из 3-14 атомов углерода и, по крайней мере, одного гетероатома, как определено выше.
Термин "замещенный гетероцикл" относится как к ароматическим, так и не к ароматическим стуктурам, к гетероциклическим группам, которые дополнительно содержит один или более заместитель, описанный ниже.
Термин "алкил" относится к моновалентной, прямой или разветвленной углеводородной цепочке, сформированной приблизительно из 1-12 атомов углерода, например, метилу, этилу, n-пропилу, изо-пропилу, n-бутилу, изо-бутилу, терт-бутилу, n-пентилу (также известен как n-амил), n-гексилу и им подобным соединениям. Термин "низший алкил" относится к алкильным группам, состоящим приблизительно из 1-6 атомов углерода.
Термин "замещенный алкил" относится к алкильным группам, которые дополнительно включают один или более заместитель, такой, как гидрокси-, алкокси-, меркапто-, циклоалкил-, замещенный циклоалкил, гетероцикл, замещенный гетероцикл, арил, замещенный арил, гетероарил, замещенный гетероарил, арилокси, замещенный арилокси, галоген, циано, нитро, амино, амидо, альдегид, ацил, оксиацид, карбоксил, сульфонил, сульфонамид, сульфурил и им подобные соединения.
Термин "алкенил" относится к прямой или разветвленной углеводородной цепочке, имеющей, по крайней мере, одну двойную связь углерод-углерод, и включающей приблизительно от 2 до 12 атомов углерода, а термин "замещенный алкенил" относится к алкенильной группе, которая дополнительно содержит один или более заместитель, описанный выше.
Термин "алкинил" относится к прямой или разветвленной углеводородной цепочке, имеющей, по крайней мере, одну тройную связь углерод-углерод и включающей приблизительно от 2 до 12 атомов углерода, а термин "замещенный алкинил" относится к алкинильной группе, которая дополнительно содержит один или более заместитель, описанный выше.
Термин "арил" относится к ароматическим группам, включающим приблизительно от 5 до 14 атомов углерода, а термин "замещенный арил" относится к арильным группам, которые дополнительно содержат один или более заместитель, описанный выше.
Термин "гетероарил" относится к ароматическому кольцу, при этом структура кольца включает от 3 до приблизительно 14 атомов углерода, и, по крайней мере, один гетероатом, описанный выше, а термин "замещенный гетероарил" относится к гетероарильным группам, которые дополнительно содержат один или более заместитель, описанный выше.
Термин "алкокси" относится к молекуле -O-алкил, при этом алкил определен выше, а термин "замещенная алкокси-группа" относится к алкокси-группам, которые дополнительно содержат один или более заместитель, описанный выше.
Термин "циклоалкил" относится к алкильным группам, включающим от 3 до приблизительно 8 атомов углерода, которые сформированы в кольцо, а термин "замещенный циклоалкил" относится к циклоалкильным группам, которые дополнительно содержат один или более заместитель, описанный выше.
Термин "алкиларил" относится к алкил-замещенным арильным группам, а термин "замещенный алкиларил" относится к алкилариловым группам, которые дополнительно содержат один или более заместитель, описанный выше.
Термин "арилалкил" относится к арил-замещенным алкильным группам, а термин "замещенный арилалкил" относится к арилалкильным группам, которые дополнительно содержат один или более заместитель, описанный выше.
Термин "арилалкенил" относится к арил-замещенным алкенильным группам, а термин "замещенный арилалкенил" относится к арилалкенильным группам, которые дополнительно содержит один или более заместитель, описанный выше.
Термин "арилалкинил" относится к арил-замещенным алкинильным группам, а термин "замещенный арилалкинил" относится к арилалкинильным группам, которые дополнительно содержит один или более заместитель, описанный выше.
Термин "арилен" относится к дивалентным ароматическим группам, включающим от 5 до приблизительно 14 атомов углерода, а термин "замещенный арилен" относится к ариленовым группам, которые дополнительно содержат один или более заместитель, описанный выше.
Термин "химически связанный" относится к химическому соединению, в котором две молекулы связаны между собой прямой химической связью.
Термин "киназа" относится к любому ферменту, который катализирует добавление фосфатной группы к белковому остатку, например, серин и треонин-киназы катализируют добавление фосфатной группы к остаткам серина и треонина.
Термин "JAK-киназа" относится к ферменту, который находится в клетках иммунной системы и участвует в клеточной передаче сигнала, которая приводит к развитию белых кровяных клеток.
Термин "терапевтически эффективное количество" относится к такому количеству соединения или фармацевтически активной композиции, которое вызывает биологический или терапевтический ответ в тканях или органах животного или человека, регистрируемый исследователем, ветеринаром, врачом или другим клиницистом, такой, как например, восстановление или поддержание васкулостаза, или профилактика нарушения или уменьшения васкулостаза; уменьшение объема опухоли; снижение смертности и/или заболеваемости.
Термин "фармацевтически доступный" означает, что носитель, растворитель или наполнитель является совместимым с другим ингредиентом композиции и не оказывает вредного действия на организм реципиента.
Термин "введение соединения" обозначает, что соединение или фармацевтически доступная композиция, заявленная в соответствии с настоящим изобретением, поступает в организм субъекта, нуждающегося в этом.
Термин "антитело" относится к интактным молекулам поликлональных или моноклональных антител, а также к их фрагментам, таким, как Fab и F(ab')2, Fv и SCA фрагменты, которые обладают способностью связывать эпитопную детерминанту.
Термин "сосудистый стаз или васкулостаз" относится к поддержанию гомеостатического функционирования сосудов, что приводит к их нормальному функционированию.
Термин "васкулостатические агенты" относится к агентам, которые создают условия, при которых поддерживается васкулостаз.
В. Варианты осуществления изобретения
Согласно одному варианту своего осуществления, настоящее изобретение относится к соединениям, имеющим структуру (А) и предназначенным для лечения различных заболеваний, нарушений и патологических состояний:

В структуре (А), Х может быть любой связью, О, С=O, SO2 или CH2, a Y может быть любой связью или NR9; или Х и Y вместе могут представлять собой связь. Кроме того, в структуре (А) каждый R1 и R2 может представлять собой Н, C1-С6 замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероцикл, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил; или R1 или R2 вместе могут представлять собой связь; или R1 или R2 вместе могут формировать молекулу, такую, как (СН2)m, (CH2)r-S-(CH2)m, (CH2)r-SO-(CH2)m, (CH2)r-SO2-(CH2)m, (CH2)r-NR9-(СН2)m, или (СН2)r-O-(СН2)m, при этом каждый из р, q, r, n, m независимо друг от друга представляют собой целое число от 0 до 6.
Кроме того, в структуре (А), R9 может представлять собой Н, C1-С6 алкил, C1-С6 циклоалкил, C1-С6 разветвленный алкил, C1-С6 замещенный алкил, C1-С6 аминоалкил, или C1-С6 гидроксиалкил; G0 может представлять собой N, О, Н или СН, с той оговоркой, что если G0 представляет собой N, тогда каждый из R3 и R4 может представлять собой Н, C1-С6 алкил, C1-С6 замещенный или незамещенный гидроксиалкил или аминоалкил, C1-С6 замещенный или незамещенный разветвленный алкил, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил, или R3 или R4 вместе могут формировать молекулу, такую, как (СН2)m, (СН2)r-S-(СН2)m, (CH2)r-SO-(CH2)m, (CH2)r-SO2-(CH2)m, (CH2)r-NR9-(CH2)m или (СН2)r-O-(СН2)m.
Кроме того, существует несколько дополнительных оговорок, касающихся G0 в структуре (А). Более специфически, если G0 представляет собой N, в том случае R1 и R9 вместе могут формировать молекулу, такую, как ((СН2)m, (СН2)r-S-(СН2)m, (CH2)r-SO-(CH2)m, (CH2)r-SO2-(CH2)m, (CH2)r-NR9-(CH2)m или (СН2)r-O-(СН2)m; или R1 и R4 вместе могут формировать молекулу, такую, как (СН2)m, (СН2)r-S-(СН2)m, (CH2)r-SO-(CH2)m, (CH2)r-SO2-(CH2)m, (CH2)r-NR9-(CH2)m или (СН2)r-O-(СН2)m; или R9 и R4 вместе могут формировать молекулу, такую, как (СН2)m, (СН2)r-S-(СН2)m, (CH2)r-SO-(CH2)m, (CH2)r-SO2-(CH2)m, (CH2)r-NR9-(CH2)m или (СН2)r-O-(СН2)m; или R3 и R4 вместе могут формировать молекулу, такую, как (СН2)m, (СН2)r-S-(СН2)m, (CH2)r-SO-(CH2)m, (CH2)r-SO2-(CH2)m, (CH2)r-NR9-(CH2)m или (СН2)r-O-(СН2)m.
В том случае, если в структуре (A) G0 представляет собой О, тогда R3 может представлять собой Н, C1-С6 алкил и C1-С6 замещенный или незамещенный гидроксиалкил или аминоалкил, замещенный или незамещенный разветвленный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероцикл, соединенный через углерод или азот, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил, соединенный через углерод или азот, без группы R4; R1 и R9 вместе могут формировать молекулу, такую, как (СН2)m, (СН2)r-S-(СН2)m, (CH2)r-SO-(CH2)m, (CH2)r-SO2-(CH2)m, (CH2)r-NR9-(CH2)m или (СН2)r-O-(СН2)m; или R1 и R3 вместе могут формировать молекулу, такую, как (СН2)m, (СН2)r-S-(СН2)m, (CH2)r-SO-(CH2)m, (CH2)r-SO2-(CH2)m, (CH2)r-NR9-(CH2)m или (СН2)r-O-(СН2)m; или R9 и R3 вместе могут формировать молекулу, такую, как ((СН2)m, (СН2)r-S-(СН2)m, (CH2)r-SO-(CH2)m, (CH2)r-SO2-(CH2)m, (CH2)r-NR9-(CH2)m или (СН2)r-O-(СН2)m.
В том случае, если в структуре (A) Go представляет собой СН, тогда R3 и R4 могут представлять собой Н, C1-С6 алкил, C1-С6 замещенный или незамещенный гидроксиалкил или аминоалкил, C1-С6 замещенный или незамещенный разветвленный алкил, замещенный или незамещенный арил, C1-С6 замещенный или незамещенный гетроцикл, соединенный через углерод или азот, или замещенный или незамещенный гетероарил, соединенный через углерод или азот, или R3 и R4 вместе могут формировать молекулу, такую, как (СН2)m, (СН2)r-S-(СН2)m, (CH2)r-SO-(CH2)m, (CH2)r-SO2-(CH2)m, (CH2)r-NR9-(CH2)m или (СН2)r-O-(СН2)m.
Кроме того, если в структуре (A) G представляет собой N или CR6, и каждый G не зависит от другого G, с той оговоркой, что не более, чем две группы G представляют собой N, с дополнительной оговоркой, что для каждого CR6, каждый R6 не зависит от каждой другой группы R.
Кроме того, в структуре (А) R5 представляет собой метил, a Q представляет собой молекулу, представленную ниже

В структуре Q, каждый из R6, R7, R8 может представлять собой Н, C1-С6 замещенный или незамещенный алкил, C1-С6 замещенный или незамещенный алкенил, C1-С6 замещенный или незамещенный алкинил, С1-С6 замещенный или незамещенный гидроксиалкил или аминоалкил, C1-С6 замещенный или незамещенный разветвленный алкил, C1-С6 замещенный или незамещенный циклоалкил, замещенный или незамещенный арил, соединенный через углерод или гетероатом, замещенный или незамещенный гетероарил, соединенный через углерод или гетероатом, C1-С6 алкокси, галоген, CF3-OCF3, CHR3R4, SR3, SOR3, SO2R3, SO2NR3R4, SO3R3, POR3, PO2R3, PO2NR3R4, PO2CR3R4, PO3R3, NR3R4, NO2, CN, OH, CONR3R4, COR3, COOR3, NR3CR4, NR3CONR3R4, OCONR3R4, CSNR3R4, CSR3, NR3CSNR3R4, SCONR3R4, SCSNR3R4 или SCSNR3R4; или каждый из R6 и R7 вместе, или R7 и R8 вместе, или R6 и R8 вместе могут формировать молекулу, независимо выбранную из группы, включающей: -NH-СН=СН-, -NH-N=CH-, -NH-N=N-, -O(CH2)nO-, -S(СН2)nS-, -N=CH-S, -CH=N-O-, -CH=N-S, -N=CH-O-, -C=N-O-, -C=N-O-, -ON-O-, -CH=CH-CH=CH-, -N=CH-CH=CH-, -CH=N-CH=CH-, -O-CH=CH, и S-CH=CH-; или R3 и R4 вместе могут формировать молекулу, такую, как (CHR9)r-(CHR9)m-(CHR9)p, (CHR9)r-S-(CHR9)m, (CHR9)r-SO-(CHR9)m, (CHR9)r-SO2-(CHR9)m, (CHR9)r-NR9-(CHR9)m, или (CHR9)r-O-(CHR9)m.
Кроме того, в структуре (А), А может представлять собой О, NR3, CR3R4, S, SO и SO2; а в молекуле Q, G1 может представлять собой СН, N, NH, S и О, и G2 может представлять собой CR7, N, NH, S и О, при этом каждая R7 группа не зависит от другой R7 группы; в том случае, если G1 или G2 представляют собой NH, S или О, тогда Q представляет собой пятичленное гетероароматическое кольцо, возможно объединенное с шестичленным ароматическим или неароматическим кольцом; а если G1 или G2 представляет собой N, тогда Q представляет собой пяти- или шестичленное ароматическое кольцо, возможно объединенное с шестичленным ароматическим или неароматическим кольцом, с дополнительной оговоркой, что Х или G0 включает, по крайней мере, один гетероатом, включенный в Х и выбранный из группы, включающей О, S и N, или G0 включает, по крайней мере, четыре не-водородных атома, включая гетероатом, и R3 и R4, или R1 или R9, или R1 и R4, или R9 и R4 вместе могут формировать ароматическую, гетероароматическую, циклическую или гетероциклическую кольцевую систему, либо, если присутствует нециклическая система, тогда в структуре присутствует более одного гетероатома, а если А представляет собой NR3, тогда любой R6, R7 или R8, или любая их комбинация независимо включает, по крайней мере, два не-водородных атома, или если А представляет собой NR3, тогда Q формирует объединенное кольцо из R6-R7, или из R7-R8.
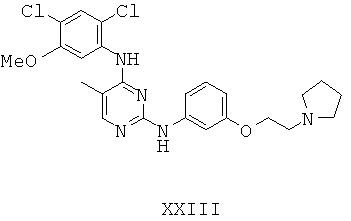
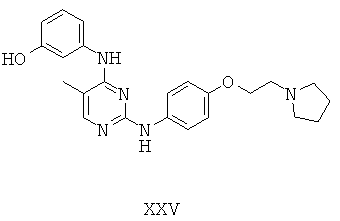
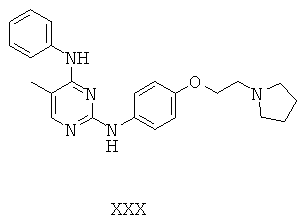
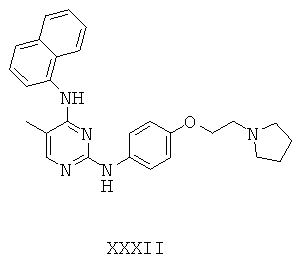
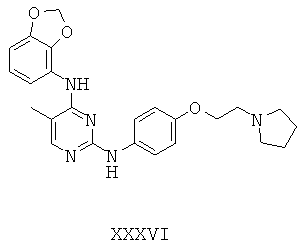
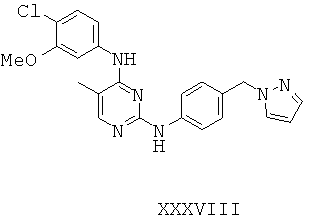
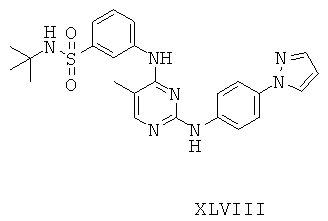
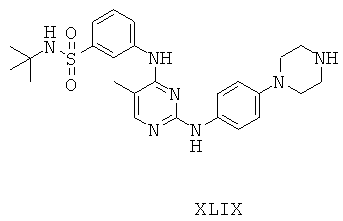
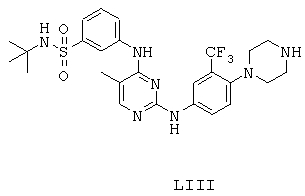
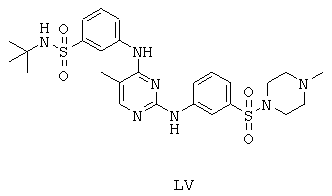
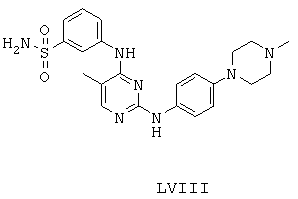
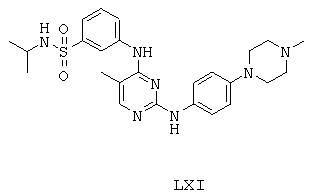
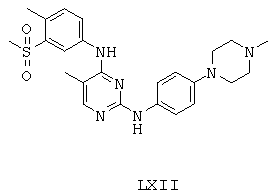
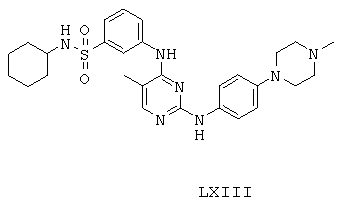
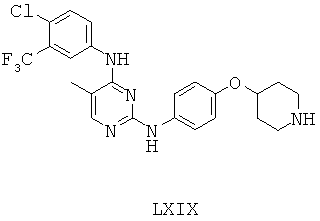
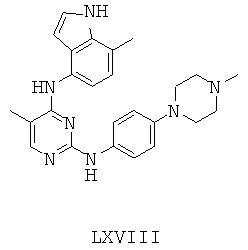
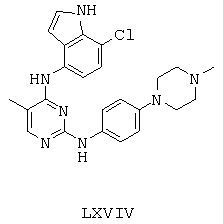
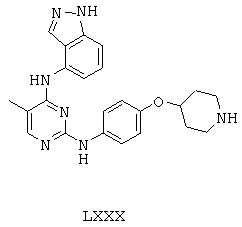
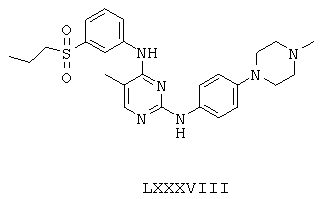
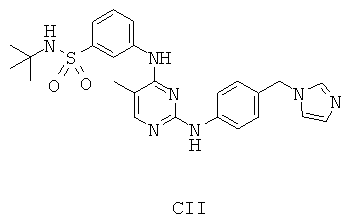
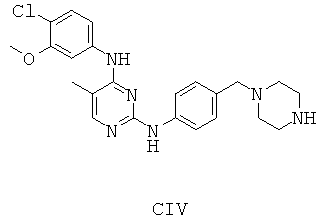
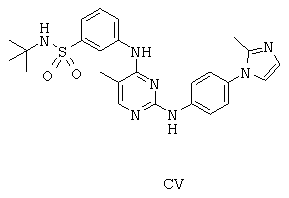
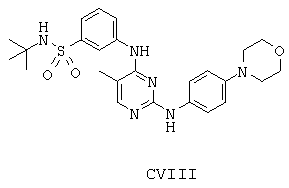
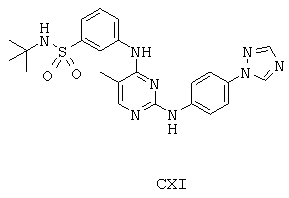
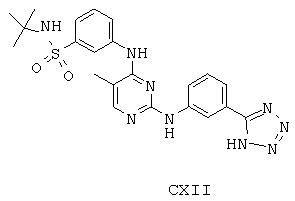
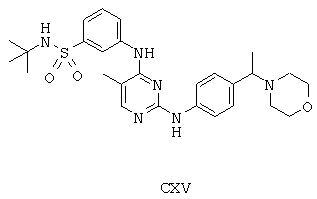
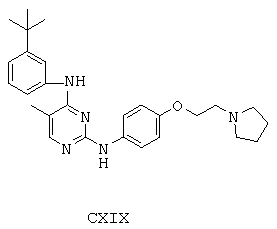
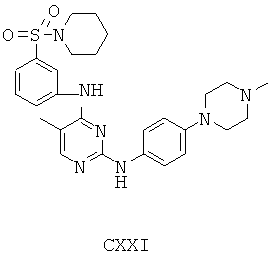
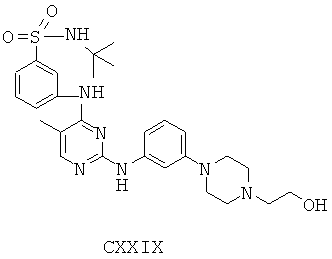
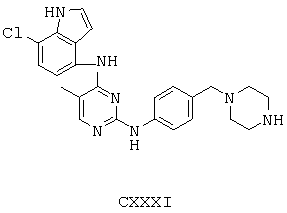
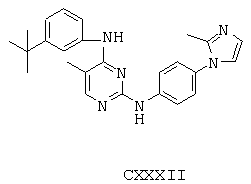
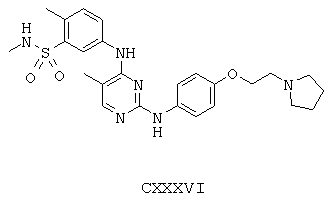
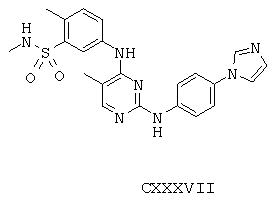
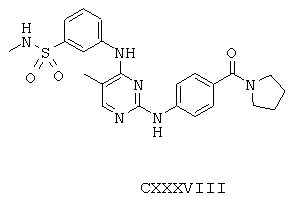
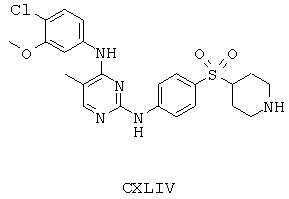
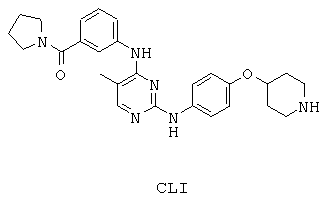
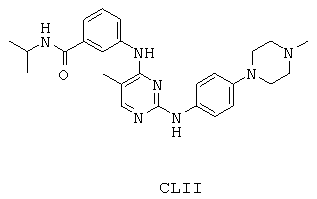
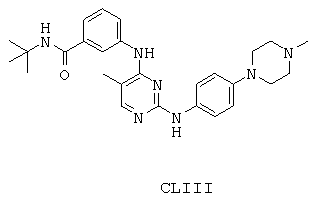
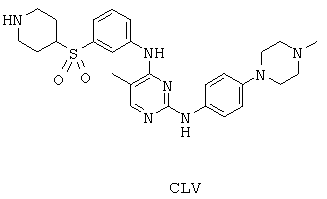
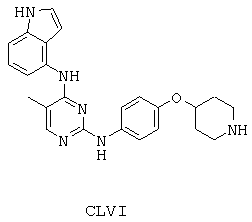
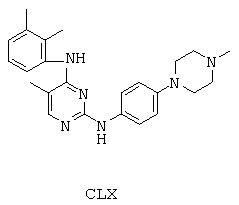
Некоторые примерные соединения, имеющие структуру (А), которые могут использоваться в соответствии с настоящим изобретением, являются соединения с I по CLXII, представленные ниже (без ограничений указанными):




















































































































 and
and
 .
.
Согласно другому варианту своего осуществления, настоящее изобретение относится к соединениям, имеющим общую структуру (Z):

и предназначенным для лечения различных заболеваний, нарушений и патологических состояний.
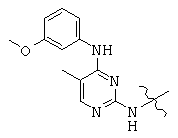
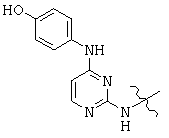
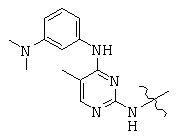
Общая структура (Z) включает две химически связанные структуры В и С. Структура В в общей структуре (Z) включает любую молекулу, выбранную из группы, включающей:










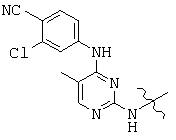







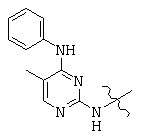


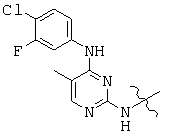

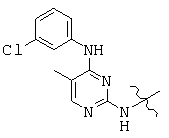



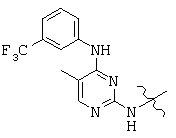


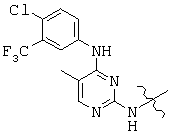

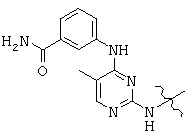
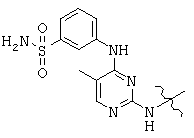

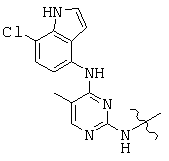







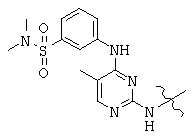
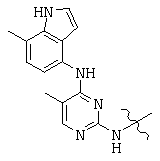

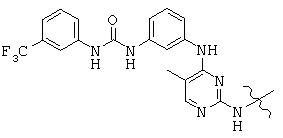












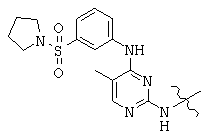


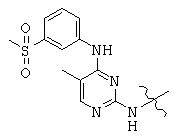



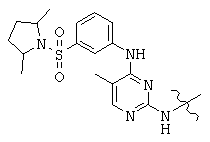
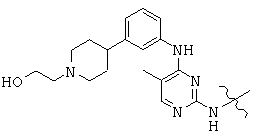
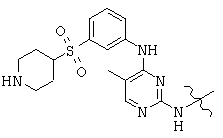

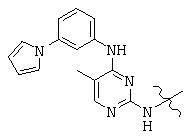




 , and
, and
 .
.
Структура С в общей структуре (Z), см. выше, включает любую молекулу, выбранную из группы, включающей:


















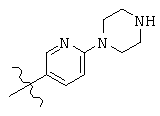





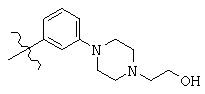

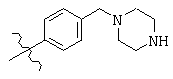

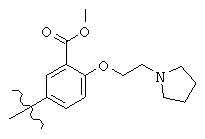














 , and
, and  .
.
Соединения и способы, заявленные в соответствии с настоящим изобретением, или фармацевтически доступные соли, сольваты, кристаллические формы и индивидуальные диастереомеры заявленных соединений, которые могут вводиться как самостоятельно, так и в комбинации с другими агентами (например, химиотерапевтическими агентами или белковыми лекарственными агентами, описанными ниже), являются полезными для лечения различных заболеваний, включая, без ограничений указанными, миелопролиферативные заболевания, пролиферативную диабетическую ретинопатию и другие заболевания, ассоциированные с ангиогенезом, включая солидные опухоли и другие типы рака, заболевания глаз, воспалительные заболевания, псориаз и вирусные инфекции. К типам рака, для лечения которых могут использоваться заявленные соединения, относятся, без ограничений указанными, опухоли желудочно-кишечного тракта, рак толстого кишечника, рак печени, рак кожи, рак молочной железы, рак яичников, рак предстательной железы, лимфома, лейкозы (включая острый миелогенный лейкоз и хронический миелогенный лейкоз), рак почек, рак легких, опухоли мышечной ткани, опухоли костей, рак мочевого пузыря или опухоли головного мозга.
Некоторыми примерами заболеваний и патологических состояний, для лечения которых могут использоваться заявленные соединения, являются, без ограничений указанными, неоваскуляризация глаз, гемангиомы у детей, гипоксия органов, сосудистая гиперплазия, реакции отторжения трансплантатов, волчанка, рассеянный склероз, ревматоидный артрит, псориаз, сахарный диабет 1-го типа и его осложнения, воспалительные заболевания, острый панкреатит, хронический панкреатит, астма, аллергии, острый респираторный дистресс синдром, заболевания сердечно-сосудистой системы, заболевания печени, другие заболевания крови, астма, ринит, атопии, дерматиты, аутоиммунные заболевания щитовидной железы, язвенный колит, болезнь Крона, метастатическая меланома, саркома Капоши, рассеянная миелома, патологические состояния, ассоциированные с цитокинами, и другие аутоиммунные заболевания, включая гломерулонефрит, склеродермию, хронический тиреоидит, болезнь Грейвса, аутоиммунный гастрит, аутоиммунная гемолитическая анемия, аутоиммунная нейтропения, тромбоцитопения, атопии (например, аллергическая астма, атопический дерматит или аллергический ринит), хронический активный гепатит, миастения-гравис, рассеянный склероз, воспалительные заболевания толстого кишечника, реакция трансплантат против хозяина, нейродегенеративные заболевания, включая заболевания моторных нейронов, болезнь Альцгеймера, болезнь Паркинсона, амиотрофический боковой склероз, болезнь Гантингтона, церебральная ишемия или нейродегенеративные заболевания, вызванные травматическим повреждением, ударом, глутаматной нейротоксичностью или гипоксией; ишемическое/реперфузионное повреждение, миокардиальная ишемия, ренальная ишемия, сердечные атаки, гипертрофия миокарда, атеросклероз и артериосклероз, гипоксия органов и агрегация тромбоцитов.
Примерами других заболеваний и патологических состояний, для лечения которых могут использоваться заявленные соединения, являются также клеточно-опосредовання гипечувствительность (аллергический контактный дерматит, гиперчувствительный пневмонит), ревматические болезни (например, системная красная волчанка, ювенильный артрит, синдром Шегрена, склеродермия, полимиозит, анкилозирующий спондилит, псориатический артрит), вирусные заболевания (вызванные вирусом Эпштейн-Барр, Гепатит В, Гепатит С, ВИЧ, вирусом Т-клеточного лейкоза человека, вирусом ветряной оспы, вирусом папилломы человека), пищевые аллергии, воспалительные заболевания кожи и иммунная супрессия, вызванная солидными опухолями.
Кроме того, некоторые варианты осуществления настоящего изобретения относятся к промышленным изделиям, которые включают упаковочный материал и фармацевтические композиции, заключенные в указанный упаковочный материал. Упаковочный материал может включать метку, которая указывает, что фармацевтическая композиция может использоваться для лечения одного или более заболевания, указанного выше.
Фармацевтическая композиция может включать соединение, заявленное в соответствии с настоящим изобретением. Помимо соединения, заявленного в соответствии с настоящим изобретением, фармацевтическая композиция может также включать другие терапевтические агенты и быть сформирована, например, при использовании традиционных твердых или жидких носителей или растворителей, а также фармацевтических добавок, подходящих для желаемого пути введения (например, таких добавок, как наполнители, связующие агенты, консерваторы, стабилизаторы, ароматизаторы и т.д.), при помощи технологий, хорошо известных специалистам в данной области.
Таким образом, согласно одному варианту своего осуществления, настоящее изобретение относится к фармацевтической композиции, включающей лекарственный агент и соединение, заявленное в соответствии с настоящим изобретением. Соединение присутствует в концентрации, эффективной для лечения, например, рака или другого заболевания или патологического состояния из указанных выше.
Соединения, заявленные в соответствии с настоящим изобретением, могут входить в состав лекарственных композиций в натуральной форме или в форме солей. К фармацевтически доступным нетоксичным солям относятся основные аддитивные соли (сформированные при участии свободного карбоксила или другой анионной группы), которые могут быть получены из неогранических оснований, таких, как гидроксиды натрия, калия, аммиака, кальция или железа, а также из таких органических оснований, таких, как изопропиламин, триметиламин, 2-этиламино-этанол, гистидин, прокаин и т.п. Такие соли также могут представлять собой аддитивные соли кислот с любой из свободных катионных групп и в целом могут быть сформированы с участием неорганических кислот, таких, как соляная, серная или фосфорная кислота, или органических кислот, таких, как уксусная, лимонная, р-толуолсульфоновая кислота, метансульфоновая кислота, щавелевая кислота, тартаровая кислота, миндальная кислота и т.п.
К солям, заявленным в соответствии с настоящим изобретением, относятся также аминные соли, сформированные путем протонирования амино-группы неорганическими солями, такими, как соляная кислота, бромисто-водородная кислота, йодисто-водородная кислота, серная кислота, фосфорная кислота и т.п. К солям, заявленным в соответствии с настоящим изобретением, также аминные соли, сформированные путем протонирования амино группы подходящими органическими солями, такими, как р-толуолсульфоновая кислота, уксусная кислота, метансульфоновая кислота и т.п. Дополнительные наполнители, которые могут использоваться в соответствии с настоящим изобретением, хорошо известны специалистам в данной области и описаны, например, в Фармакопее США том XXII и Национальном Формуляре, том XVII, Фармакопея США, Inc., Rockville, MD (1989), указанные источники включены в настоящее описание в качестве ссылок. Кроме того, настоящее изобретение относится к полиморфным модификациям заявленных соединений.
Фармацевтические композиции, заявленные в соответствии с настоящим изобретением, могут вводиться любым из известных способов, например, перорально, то есть в форме таблеток, капсул, гранул или порошков; сублингвально; буккально; парентерально, путем подкожных, внутривенных, внутримышечных, интратрахеальных или интрацистернальных инъекций или инфузий (например, в форме стерильных растворов или суспензий на водной или другой основе); назально, в форме аэрозольного спрея; местно, например, в форме кремов или мазей; или ректально в форме суппозиторий; при этом используются лекарственные формы, содержащие нетоксичные, фармацевтически доступные носители или наполнители. Заявленные соединения могут вводиться, например, в лекарственных формах с немедленным или замедленным высвобождением активного вещества. Немедленное или замедленное высвобождение может быть достигнуто за счет использования подходящих фармацевтических композиций, содержащих заявленные соединения, или, в случае замедленного высвобождения, за счет использования специальных устройств, таких, как подкожные импланты или осмотические помпы. Соединения, заявленные в соответствии с настоящим изобретением, также могут вводиться при помощи липосом.
Способы, заявленные в соответствии с настоящим изобретением, могут использоваться для лечения различных млекопитающих, помимо приматов, таких, как человек. В частности, к таким млекопитающим относятся, без отграничений указанными, коровы, овцы, козы, лошади, собаки, кошки, морские свинки, крысы или различные виды указанных животных. Однако, заявленный способ может использоваться также и у других организмов, например, у птиц (например, кур).
Фармацевтические композиции, предназначенные для введения заявленных соединений, как по отдельности, так и в комбинации с другими лекарственными средствами, могут быть представлены в единичной лекарственной форме и получены при помощи любого способа, хорошо известного специалистам в области фармакологии. Все указанные способы включают объединение активного ингредиента и носителя, который представляет собой один из возможных дополнительных ингредиентов. В целом, фармацевтические композиции получают путем равномерного и тщательного перемешивания активного ингредиента с жидким носителем или измельченным твердым носителем, или с обоими веществами, и затем, если это необходимо, путем придания продукту желаемой формы. Активный ингредиент в составе фармацевтической композиции находится в количестве, достаточном для обеспечения желаемого эффекта в отношении заболевания или патологического состояния. Фармацевтические композиции, содержащие активный ингредиент, могут иметь форму, подходящую для перорального использования, например, форму таблеток, пастилок, таблеток для рассасывания, водных или масляных суспензий, дисперсных порошков или гранул, эмульсий, мягких или твердых капсул, а также сиропов и эликсиров.
Композиции, предназначенные для перорального введения, могут быть получены при помощи любого известного способа приготовления фармацевтических композиций; при этом указанные композиции могут содержать один или более агент, выбранный из группы, включающей: подсластители, ароматизаторы, красители и консерванты, для того, чтобы придать фармацевтической композиции приятный вид и форму. Таблетки содержат активный ингредиент в смеси с нетоксичными фармацевтически доступными наполнителями, которые подходят для приготовления таблеток. Указанные наполнители могут, например, представлять собой инертные растворители, такие, как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и дезинтегрирующие агенты, например, кукурузный крахмал или алгиновая кислота; связующие агенты, например, крахмал, желатин или камедь, или любриканты, например, стеарат магния, стеариновая кислота или тальк. Таблетки могут не иметь оболочки, либо быть покрыты оболочками при помощи методик, хорошо известных специалистам в данной области, что замедляет их разрушение и абсорбцию в желудочно-кишечном тракте и обеспечивает замедленное действие активного ингредиента в течение более продолжительного периода времени. Например, может использоваться специальный материал с отсроченным действием, такой, как глицерин моностеарат или глицерин дистеарат. Таблетки также могут быть покрыты специальной оболочкой для формирования осмотических лекарственных таблеток с контролируемым высвобождением активного ингредиента.
Композиции для перорального введения также могут иметь форму твердых желатиновых капсул, при этом активный ингредиент находится в смеси с инертным твердым наполнителем, например, карбонатом кальция, фосфатом кальция или каолином; или мягких желатиновых капсул, при этом активный ингредиент находится в смеси с водой или масляной средой, например, кокосовым маслом, жидким парфином или оливковым маслом.
Водные суспензии содержат активные материалы в смеси с наполнителями, подходящими для получения водных суспензий. Указанные наполнители представляют собой суспендирующие агенты, такие, как например, натриевая карбоксиметилцеллюлоза, метилцеллюлоза, гидрокси-пропилметилцеллюлоза, альгинат натрия, поливинил-пирролидон, трагакантовая камедь и гуммиарабик; диспергирующие или увлажняющие агенты, такие, как природные фосфатиды, например, лецитин, или продукты конденсации алкиленоксида и жирных кислот, например, полиоксиэтилен стеарат, или продукты конденсации этиленоксида и длинноцепочечных алифатических спиртов, например, гептадекаэтиленоксиэтанол, или продукты конденсации этиленоксида с частичными эфирами, полученными на основе жирных кислот и гекситола, такие, как полиоксиэтилен-сорбитол-моноолеат, или продукты конденсации этиленоксида с частичными сложными эфирами, полученными на основе жирных кислот и гекситол ангидридов, например, попиэтилен-сорбитан-моноолеат.Также в качестве солюбилизатора может использоваться полиэтиленгликоль. Водные суспензии также могут содержать один или более консерзжрующий агент, например, этил или п-пропил, р-гидроксибензоат; один или более краситель, один или более ароматизатор и один или более подсластитель, такой, как сахаре за или сахарин.
Масляные суспензии могут быть получены путем суспендирования активного ингредиента в овощном масле, например, арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральном масле, таком, как жидкий парафин. Масляные суспензии могут содержать загущающий агент, например, пчелиный воск, твердый парафин или цетиловый спирт. Для получения приятной на вкус композиции могут использоваться подсластители, указанные выше, и ароматизаторы. Указанные композиции могут быть консервированы путем добавления антиоксиданта, такого, как аскорбиновая кислота.
Дисперсные порошки или гранулы, подходящие для приготовления водных суспензий путем добавления воды, представляют собой смесь активного ингредиента с диспергирующим или увлажняющим агентом, суспендирующим агентом или одним и более консерватором. Подходящие диспергирующие или увлажняющие агенты и суспендирующие агенты описаны выше. Также могут использоваться дополнительные наполнители, такие, как подсластители, ароматизаторы и красители.
Сиропы и эликсиры могут включать подсластители, например, глицерол, пропиленгликоль, сорбитол или сахарозу. Указанные лекарственные формы также могут содержать смягчающий агент, консерватор, ароматизатор и краситель.
Фармацевтические композиции могут быть представлены в форме стерильных водных или масляных суспензий. Указанные суспензии могут быть получены при помощи способов, хорошо известных специалистам в данной области, которые подразумевают использование подходящих диспергирующих, увлажняющих и суспендирующих агентов, упомянутых выше. Стерильная форма для инъекций может также представлять собой стерильный раствор для инъекций или стерильную суспензию в растворителе, совместном растворителе или комплексообразующем агенте или диспрегирующем агенте или наполнителе, или их комбинации, например, 1,3-бутандиоле, полиэтиленгликоле, полипропиленгликоле, этаноле и других спиртах, повидонах, различных вариантах TWEEN сурфактанта, додецилсульфате натрия, деоксихолате натрия, жиметилацетамиде, полисорбате, полоксамерах, циклодекстринах, липидах и наполнителях, таких, как неорганические соли (например, хлорид натрия), буферные агенты (например, цитрат натрия, фосфат натрия) и сахара (например, сахароза и декстроза). К подходящим носителям или растворителям также относятся вода, растворы декстрозы, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителей или суспендирующих сред могут использоваться стерильные жирные масла. Для этой цели может использоваться любое мягкое жирное масло, включая синтетические моно- или диглицериды. Кроме того, для приготовления лекарственных форм для инъекций могут использоваться жирные кислоты, такие, как олеиновая кислота.
В зависимости от заболевания, заявленные фармацевтические композиции могут вводиться системно или местно. Методики получения фармацевтических композиций и способы их введения описаны в последнем издании "Remington's Pharmaceuticals Sciences" (Mack Publishing Co, Easton Pa). Подходящие пути введения включают, например, пероральный или чресслизистый путь введения; а также парентеральный путь введения, включая внутримышечное, подкожное, интрамедуллярное, интратекальное, интравентрикулярное, внутривенное, интраперитонеальное или интраназальное введение. Для инъекционного введения фармацевтические композиции, заявленные в соответствии с настоящим изобретением, могут быть представлены в форме водных растворов, предпочтительно, в физиологических буферных растворах, таких, как раствор Ханка, раствор Рингера или физиологический буферный солевой раствор. Для тканевого или клеточного введения, в композициях используются специальные смачивающие реагенты, обеспечивающие проникновение композиции через определенные барьеры. Указанные реагенты хорошо известны специалистам в данной области. К фармацевтическим композициям для парентерального введения относятся водные растворы активных соединений. Кроме того, суспензии активных соединений могут быть приготовлены в форме масляных инъекционных суспензий. Подходящие липофильные растворители или носители включают жирные кислоты, такие, как кунжутное масло, или синтетические сложные эфиры жирных кислот, такие, как этилолеат или триглицериды, или липосомы.
Водные инъекционные суспензии могут содержать вещества, которые увеличивают вязкость супензии, такие, как натриевая карбоксиметилцеллюлоза, сорбитол или декстран. Суспензии также могут содержать подходящие стабилизаторы или агенты, которые увеличивают растворимость соединений, что позволяет получить композиции с высокой концентрацией раствора.
Соединения, заявленные в соответствии с настоящим изобретением, также могут входить в состав лекарственных форм для ректального введения, таких, как суппозитории. Указанные композиции могут быть получены путем смешивания лекарственного агента с подходящим нетоксичным наполнителем, который является твердым при обычной температуре, а при ректальной температуре расплавляется и растворяется в прямой кишке с высвобождением активного соединения. Указанными материалами являются кокосовое масло и полиэтиленгликоли.
Для местного применения используются крема, мази, гели, растворы или суспензии и т.д., содержащие активные соединения, заявленные в соответствии с настоящим изобретением, (для этих целей, композиции для местного применения должны содержать жидкости для полоскания рта).
Согласно одному варианту осуществления настоящего изобретения, заявленные соединения вводятся субъекту, нуждающемуся в этом, в комбинации с противовоспалительными агентами, антигистаминами, химиотерапевтическими агентами, иммуномодуляторами, лекарственными антителами или ингибиторами протеинкиназ, например, ингибиторами тирозинкиназ. Без ограничений указанными, к химиотерапевтическим агентам относятся антиметаболиты, такие, как метотрексат, ДНК-перекрестно-связывающие агенты, такие, как цисплатин/карбоплатин; алкилирующие агенты, такие, как канбустил; ингибиторы топоизомеразы I, такие, как дактиномицин; микротубулярные ингибиторы, такие, как таксол (паклитаксол) и т.п. К другим химиотерапевтическим агентам относятся, например, алкалоиды винки, антибиотики митомицинового типа, антибиотики типа блеомицина, антифолаты, колхицин, демеколин, этопозид, таксан., антрациклиновые антибиотики, доксарубицин, даунорубицин, карминомицин, эпирубицин, идарубицин, митоксантрон, 4-диметокси-дауномицин, 11-деоксидаунорубицин, 13-деоксидаунорубицин, адриамицин-14-бензоат, адриамицин-14-октаноат, адриамицин-14-нафталенацетат, амсакрин, кармустин, циклофосфамид, цитарабин, этопозид, ловастатин, мелфалан, топетекан, оксалаплатин, хлорамбуцил, метатрексат, ломустин, тиогуанин, аспарагиназа, винбластин, виндестин, тамоксифен, или мехлорэтамин. Без ограничений указанными, к лекарственным антителам относятся антитела к HER2 белку, такие, как трастузумаб; антитела к факторам роста и рецепторам фактора роста, такие, как бевацизумаб, который направлен к против эндотелиального фактора роста, и OSI-774, который направлен против эпидермального фактора роста; антитела к интегриновым рецепторам, такие, как Витаксин (также известный как MEDI-522) и т.д. В композициях и способах, заявленных в соответствии с настоящим изобретением, могут использоваться следующие классы противоопухолевых агентов (без ограничений указанными): 1) алкалоиды, включая ингибиторы микротрубочек клеток (например, Винкристин, Винбластин и Виндестин, и т.д.) и ингибиторы функции хроматина, включая ингибиторы топоизомераз, такие, как эпидофиллотоксины (например, Этапозид [VP-16] и Тенипозид [VM-26] и т.д.) и агенты, которые направлены против топоизомеразы I (например, Камптотецин и Изиринотекан [СРТ-11] и т.д.); 2) ковалентные ДНК-связывающие агенты [алкилирующие агенты], включая азотистые иприты (например, Мехлоретамин, Хлорамбуцил, Циклофосфамид, Ифосфамид и Бусульфан [Милеран] и т.д), нитрозомочевина (например, Кармустин, Ломустин и Семусин и т.д.) и другие алкилирующие агенты (например, Дакарбазин, Гидроксиметилмеламин, Тиотепа и Митоцицин, и т.д.); 3) нековалентные ДНК-связывающие агенты [противоопухолевые антитела], включая ингибиторы нуклеиновых кислот (например, Дактиномицин [Актиномицин D], и т.д.), антрациклины (например, Даунорубицин [Дауномицин и Церубидин]. Доксорубицин [Адриамицин] и Идарубицин [Идамицин] и т.д.), антрацендионы (например, аналоги антрациклинов, такие, как [Митоксантрон], и т.д.), блеомицины (Бленоксан), и т.д. и пликамицин (Митрамицин), и т.д 4) Антиметаболиты, включая, антифолаты (например, Метотрексат, Фолекс и Мексат, и т.д.), пуриновые антиметаболиты (например, 6-меркаптопурин [6-МР, Пуринэтол], 6-тиогуанин [6-TG], Азатиоприн, Ацикловир, Ганцикловир, Хлордеоксиаденозин, 2-Хлородеоксиаденозин [Cda] и 2'-Деоксикоформицин [Пентостатин] и т.д.), антагонисты пиримидина (например, фторпиримидины [например, 5-фторурацил (Адруцил), 5-фтордеоксиуридин (FdUrd) (Флоксуридин)] и т.д.) и цитозин арабинозиды (например, Циозар [ара-С] и Флударабин, и т.д.; 5) Ферменты, включая L-аспарагиназу; 6) Гормоны, включая глюкокортикоиды, такие, как антиэстрогены (например, Тамоксифен, и т.д.), нннестероидные антиандрогены (например, Флутамид, и т.д.) и ингибиторы ароматазы (например, анастрозол [Аримидекс] и т.д.); 7) Соединения платины (например, Цисплатин и Карбоплатин, и т.д); 8) Моноклональные антитела, конъюгированные с противоопухолевыми лекарственными средствами, токсинами и/или радионуклидами, и т.д.; 9) Модификаторы биологического ответа (например, интерфероны [например, IFN-альфа, и т.д.] и интерлейкины [например, IL-2, и т.д.] и т.д.;) 10) Адоптивная иммунотерапия; 11) Гемопоэтические факторы роста; 12) Агенты, индуцирующие дифференцировку опухолевых клеток (например, полностью-транс-ретиноевая кислота, и т.д.); 13) Методики генной терапии; 14) Агенты для антисмысловой терапии; 15) Опухолевые вакцины; 16) Лекарственные средства, направленные против опухолевого метастазирования (например, Батимустат и т.д); и 17) Ингибиторы ангиогенеза.
Фармацевтические композиции, заявленные в соответствии с настоящим изобретением, могут дополнительно включать другие лекарственные агенты, упомянутые в описании, которые обычно используются для лечения указанных выше патологических состояний. Примерами дополнительных лекарственных агентов являются: циклоспорины (например, циклоспорин A), CTLA4-Ig, антитела, такие, как ICAM-3, анти-1b-2 рецептор (Анти-Тас), анти-С045КВ, анти-С02, анти-CDS (ОКТ-3), анти-СВ4, анти-СР8, анти-С086, агенты, блокирующие взаимодействия между CD40 и gp 39, такие, как антитела, специфичные для CD40 и/или gp39 (то есть, CD 154), белки слияния CD40 и gp39 (CD40Ig и CD8gp39), ингибиторы, например, ингибиторы транслокации белков, ингибиторы функции NF-каппа В, такие, как деоксиспергулиан (DSG), ингибиторы биосинтеза холестерола, такие, как ингибиторы ГМГ-КоА-редуктазы (ловастатин и симвастатин), нестероидные противовоспалительные средства (НПВС), такие, как ибупрофен и ингибиторы циклооксигеназы, такие, как рофекоксиб, стероиды, такие, как преднизолон или дексаметазон, соединения золота, антипролиферативные агенты, такие, как метотрексат, FK506 (такролимус, Prograf), микофенолата мофетил, цитотоксические лекарственные средства, такие, как азатиоприн и циклофосфамид, ингибиторы TNF-альфа, такие, как тенидап, анти-TNF антитела или растворимый TNF рецептор, и рапамицин (сиролимус или рапамун) или их производные.
К другим агентам, которые могут вводиться в комбинации с соединениями, заявленными в соответствии с настоящим изобретением, относятся белковые терапевтические агенты, такие, как цитокины, иммуномодулирующие агенты и антитела. Используемый здесь термин "цитокин" объединяет хемокины, интерлейкины, лимфокины, монокины, колониестимулирующие факторы, рецептор-ассоциированные белки и их функциональные фрагменты. Используемый здесь термин "функциональный фрагмент" относится к полипептиду или пептиду, который обладает биологической функцией или активностью, которая определяется в специфическом функциональном исследовании.
К цитокинам относятся эндотелиальный моноцитарный активирующий полипептид II (EMAP-II), гранулоцитарно-макрофагальный-колониестимулирующий фактор (GM-CSF), гранулоцитарный-колониестимулирующий фактор (M-CSF), IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-12 и IL-13, интерфероны и им подобные соединения, ассоциированные с определенным механизмом биологического, морфогенетического или фенотипического изменения клеток.
В том случае, когда заявленные соединения вводятся в комбинации с другими лекарственными агентами, указанные агенты используются в дозировках, представленных во врачебных справочниках, либо указанные дозировки могут быть легко определены специалистом.
Для лечения или профилактики патологических состояний, ассоциированных с клеточной пролиферацией, подходящие дозы, в общем, составляют приблизительно от 0.01 до приблизительно 1000 мг на 1 кг массы тела пациента в день, и могут вводиться как однократно, так и многократно. Например, подходящая доза может составлять приблизительно от 0.01 до приблизительно 250 мг/кг в день; более узкий предел составляет приблизительно от 0.5 до приблизительно 100 мг/кг в день. Подходящая доза может варьировать приблизительно от 0.01 до приблизительно 250 мг/кг в день; приблизительно от 0.05 до приблизительно 100 мг/кг в день, или приблизительно от 0.1 до приблизительно 50 мг/кг массы тела в день, или приблизительно 1.0 мг/кг в день. Например, в указанном промежутке, доза может составлять приблизительно от 0.05 до приблизительно 0.5 мг/кг в день, или приблизительно от 0.5 до приблизительно 5 мг/кг в день, или приблизительно от 5 мг/кг до 50 мг/кг в день. Для перорального введения композиции представлены в форме таблеток, содержащих приблизительно от 1.0 до приблизительно 1000 мг активного ингредиента, например приблизительно 1.0, приблизительно 5.0, приблизительно 10.0, приблизительно 15.0, приблизительно 20.0, приблизительно 25.0, приблизительно 50.0, приблизительно 75.0, приблизительно 100.0, приблизительно 150.0, приблизительно 200.0, приблизительно 250.0, приблизительно 300.0, приблизительно 400.0, приблизительно 500.0, приблизительно 600.0, приблизительно 750.0, приблизительно 800.0, приблизительно 900.0 и приблизительно 1000.0 мг активного ингредиента при симптоматическом подборе дозы для каждого пациента. Соединения могут вводиться в режиме, включающем от 1 до 4-х введений в день, например, один раз в день или дважды в день. Между режимами лечения могут быть перерывы, когда композиция не вводится.
Должно быть понятно, что специфическая доза и частота введения для каждого конкретного пациента своя и зависит от различных факторов, включая активность специфического лекарственного соединения, его метаболическую стабильность и продолжительность действия; возраст, массу тела, общее состояние здоровья, пол и диету пациента, путь и время введения соединения, скорость экскреции лекарственного средства, комбинацию с другими лекарственными препаратами, тяжесть заболевания, и субъект, нуждающегося в лечении.
Соединения, заявленные в соответствии с настоящим изобретением, могут использоваться самостоятельно или в комбинации с эффективным количеством лекарственного антитела (или его фрагмента), химиотерапевтического агента или иммунотоксичного агента, предназначенного для лечения опухолей. Иллюстративными примерами химиотерапевтических агентов, которые могут использоваться для этих целей, являются доксорубицин, доцетаксел или таксол. Также должно быть понятно, что настоящее изобретение также относится к комбинированной терапии, включающей введение заявленного соединения в комбинации с (без ограничений указанными) васкулостатическими агентами, такими, как ингибиторы тирозин-, серин- или треонин-киназ, и любыми химиотерапевтическими агентами или лекарственными антителами.
С. Примеры
Представленные ниже примеры дополнительно иллюстрируют преимущества и особенности настоящего изобретения и ни коим образом не ограничивают его сущности.
ПРИМЕР 1: Общие методы
Все эксперименты осуществляют в безводных условиях (т.е. в сухих растворителях) в атмосфере аргона, за исключением, если это оговорено, с применением специальных осушающих устройств и стандартных процедур по работе с чувствительными к воздуху материалами. Водные растворы бикарбоната натрия и хлорида натрия (физ. раствор) насыщают. Осуществляют аналитическую тонкослойную хроматографию на планшетах Merck Kieselgel 60 F 254 с визуализацией в ультрафиолете и/или при погружении в анисальдегид, перманганат калия или фосфомолибденовую кислоту. Обратно-фазовую хроматографию (HPLC) осуществляют в жидкостном держателе Gilson 215, оснащенном картриджем Waters Symmetry Shield RP18 7 мкм (40×100 мм) Prep-Pak. Добавляют подвижную фазу, состоящую из ацетонитрила и DI воды, к которым добавлено 0,1% TFA. Очистку проводят при скорости потока 40 мл/мин. Данные ЯМР-спктра: H1 ЯМР-спектр регистрируют при 500 МГц. Данные представлены следующим образом: химический сдвиг, мультиплетность (s - синглет, t - триплет, q - квартет, qn - квинтет, dd - дуплет дуплетов, m - мультиплет, brs - широкий синглет), константа взаимодействия (J/Hz) и интеграция. Константы взаимодействия определяют непосредственно по данным спектра и не корректируют. Масс-спектр низкого разрешения: используют ионизацию путем электровпрыска (ES+). Фиксируют протонированный родительский ион (М+Н) или фрагмент наибольшей массы. Если не указано иное, используют аналитический градиент от 10%-ного водного ACN до 100%-ного водного ACN в течение 5 мин.
ПРИМЕР 2: N4-(4-метокси-фенил)-пиримидин-2,4-диамин (Промежуточное соединение I)

Смесь 4-хлор-пиримидин-2-иламина (0.30 г, 2.3 ммоль) и 4-метокси-фениламина (0.30 г, 2.4 ммоль) суспендируют в уксусной кислоте (10 мл) и нагревают при 100°С в течение 2 ч. Смесь оставляют охлаждаться при комнатной температуре, а уксусную кислоту удаляют при пониженном давлении. Осадок поглощают водой (20 мл) и нейтрализуют до рН ~7 с 7М раствора NaOH. Полученный раствор экстрагируют EtOAc (30 мл) и органический слой сепарируют. Органический слой отмывают физиологическим раствором, высушивают над MgSO4 и фильтруют. Фильтрат концентрируют в вакууме, а сырой продукт очищают при помощи флэш-хроматографии на колонке с силикагелем (гексан к EtOAc) с получением нужного промежуточного соединения 1 (0.23 г, 45%) в форме твердого белого вещества.
1Н NMR (500 MHz, DMSO-d6): 3.9 (s, 3Н), 5.84 (d, J=5.8 Hz, 1H), 6.79 (d, J=9.1 Hz, 2H), 7.63 (d, J=9.1 Hz, 2H), 7.78 (d, J=5.8 Hz, 1H), 8.65 (s, 1H); MS (ESI+): m/z 217 (M+H)+.
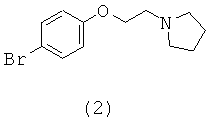
ПРИМЕР 3: N4-(4-Метокси-фенил)-N2-[4-(2-пирролидин-1-ил-этокси)-фенил]-пиримидин-2,4-диамин (Соединение I)

Для синтеза соединения I используют промежуточное соединение 1, описанное выше, и промежуточное соединение 2. Промежуточное соединение 2, 1-[2-(4-бромо-фенокси)-этил]-пирролидин, представленное ниже, является коммерчески доступным и используется в том виде, в котором его получают.
Суспензию промежуточного соединения 1 (74 мг, 0.34 ммоль), промежуточного соединения 2 (0.10 г, 0.37 ммоль), Pd (OAc)2 (5 мг, 0.022 ммоль), Xantphos (26 мг, 0.05 ммоль) и калий терт-бутоксид (80 мг, 0.71 ммоль) в диоксане/DMF (3/1; 4 мл) помещают в реакционную пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют, а отфильтрованное твердое вещество отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи HPLC с получением нужного соединения I (20 мг TFA соли, 11%) в виде твердого коричневого вещества.
1H-NMR (500 MHz, DMSO-d6): 1.80-1.95 (m, 2H), 1.95-2.10 (m, 2H), 3.05-3.20 (m, 2H), 3.55-3.65 (m, 4H), 3.77 (s, 3H), 4.29 (t, J=4.9 Hz, 2H), 6.30 (d, J=6.8 Hz, 1H), 6.96 (d, J=8.3 Hz, 2H), 6.98 (d, J=8.3 Hz, 2H), 7.41 (d, J=8.8 Hz, 2H), 7.55 (d, J=8.8 Hz, 2H), 7.89 (d,=6.2 Hz, 1H), 9.87 (br s, 1H), 10.22 (br s, 1H), 10.44 (br s, 1H); MS (ESI+): m/z 406 (M+H)+.
ПРИМЕР 4: 4-[4-(4-Метокси-фениламино)-пиримидин-2-иламино]-N-(2-пирролидин-1-ил-этил)-бензолсульфонамид (Соединение II)

Для синтеза соединения II, используют промежуточное соединение 1, описанное выше, и промежуточное соединение 3. Промежуточное соединение 3, 4-бромо-N-(2-пирролидин-1-ил-этил)-бензолсульфонамид, формула которого представлена ниже, синтезируют из 4-бромофенилсульфонилхлорида и 2-аминоэтилпирролидина при помощи хорошо известных методик синтеза.

Суспензию промежуточного соединения 1, описанного выше (70 мг, 0.32 ммоль), промежуточного соединения 3 (0.12 г, 0.36 ммоль), Pd(OAc)2 (5 мг, 0.022 ммоль), Xantphos (26 мг, 0.05 ммоль) и калий терт-бутоксид (80 мг, 0.71 ммоль) в диоксане/DMF (3/1; 4 мл) помещают в реакционную пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют, а отфильтрованное твердое вещество отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи HPLC с получением нужного соединения II (0.16 г TFA соли, 85%) в виде твердого белого вещества.
1H-NMR (500 MHz, DMSO-d6): 1.80-1.95 (m, 2H), 1.95-2.10 (m, 2H), 2.95-3.05 (m, 4H), 3.23 (q, J=5.8 Hz, 2H), 3.50-3.60 (m, 2H), 3.79 (s, 3H), 6.41 (d, J=6.8 Hz, 1H), 6.99 (d, J=8.9 Hz, 2H), 7.43 (d, J=8.9 Hz, 2H), 7.71 (d, J=8.6 Hz, 2H), 7.85-7.95 (m, 2H), 7.96 (t, J=6.1 Hz, 1H), 8.02 (d, J=6.2 Hz, 1H), 9.64 (br s, 1H), 10.21 (br s, 1H). 10.71 (br s, 1H); MS (ESI+): m/z 469 (M+H)+.
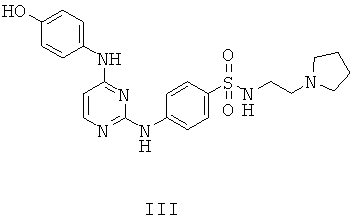
ПРИМЕР 5. 4-[4-(4-Гидрокси-фениламино)-пиримидин-2-иламино]-N-(2-пирролидин-1-ил-этил)-сульфонамид (Соединение III)

К раствору соединения II, описанного выше, (50 мг, 0.09 ммоль) в DCM (6 мл) при комнатной температуре добавляют BBr3 (0.1 мл) и смесь перемешивают при комнатной температуре в течение 2.5 ч. Реакцию гасят насыщенным раствором NaHCO3 пока рН смеси не достигнет ~7, после чего смесь экстрагируют EtOAc (30 мл). Органический слой сепарируют и отмывают физиологическим раствором, высушивают над MgSO4 и фильтруют. Фильтрат концентрируют и полученное твердое вещество повторно растворяют в минимальном количестве EtOAc. Добавляют гексан до тех пор, пока не произойдет распад твердого вещества, желаемое соединение III отфильтровывают в виде твердого белого вещества (25 мг, 64%) без дополнительной очистки.
1H-NMR (500 MHz, DMSO-d6): 1.55-1.65 (m, 4H), 2.30-2.40 (m, 4H), 2.43 (t, J=7.0 Hz, 2H), 2.82 (t, J=6.6 Hz, 2H), 6.20 (d. J=5.8 Hz, 1H), 6.70 (d, J=8.8 Hz, 2H), 7.40 (d, J=8.6 Hz, 2H), 7.64 (d, J=8.8 Hz, 2H), 7.92 (d, J=8.4 Hz, 2H), 8.03 (d, J=5.5 Hz, 1H), 8.93 (s, 1H), 9.08 (br s, 1H), 9.70 (s, 1H); MS (ESI+): m/z 455 (M+H)+.
ПРИМЕР 6. 4-(4-Хлор-пиримидин-2-иламино)-N-(2-пирролидин-1-ил-этил)-бензолсульфонамид (Промежуточное соединение 4).

Смесь 4-хлор-пиримидин-2-иламина (1.0 г, 7.8 ммоль), описанного выше промежуточного соединения 3 (2.6 г, 7.8 ммоль), Pd (ОАс)2 (90 мг, 0.40 ммоль), Xantphos(0.50 г, 0.86 ммоль) и калий-терт-бутоксид (2.2 г, 20 ммоль) суспендируют в диоксане (30 мл) и нагревают при дефлегмации в атмосфере аргона в течение 16 ч. Смесь выливают в воду (30 мл) и экстрагируют EtOAc (60 мл). Органический слой сепарируют и отмывают физиологическим раствором, высушивают над MgSO4 и фильтруют. Фильтрат концентрируют в вакууме и сырой продукт очищают при помощи флэш-хроматографии на колонке с силикагелем (DCM к 25% MeOH/DCM) с получением промежуточного соединения 4 (0.15 г, 5%) в виде коричневого твердого вещества. MS (ESI+): m/z 382 (М+Н)+.
ПРИМЕР 7. 4-[4-(3-Метокси-фениламино)-пиримидин-2-иламино]-N-(2-пирролидин-1-ил-этил)-бензолсульфонамид (Соединение IV)

Смесь описанного выше промежуточного соединения 4 (0.10 г, 0.26 ммоль) и 3-метокси-фениламин (0.05 мл, 0.45 ммоль) суспендируют в уксусной кислоте (6 мл) и нагревают до 100°С в течение 1.5 ч. Смесь оставляют охлаждаться до комнатной температуры и уксусную кислоту удаляют при пониженном давлении. Осадок собирают в воду (20 мл) и нейтрализуют рН ~ до 7. Полученный раствор экстрагируют EtOAc (30 мл) и органический слой сепарируют. Органический слой отмывают физиологическим раствором, высушивают над MgSO4 и фильтруют. Фильтрат концентрируют в вакууме и сырой продукт очищают при помощи HPLC с получением нужного соединения IV (55 мг TFA соли, 36%) в виде твердого белого вещества.
1H-NMR (500 MHz, DMSO-d6): 1.80-1.90 (m, 2H), 1.95-2.05 (m, 2H), 2.95-3.05 (m, 4H), 3.24 (q, J=6.0 Hz, 2H), 3.50-3.60 (m, 2H), 3.73 (s, 3Н), 6.40 (d, J=6.3 Hz, 1H), 6.68 (d, J=7.3 Hz, 1H), 7.18 (d, J=8.2 Hz, 1H), 7.26 (t, J=8.0 Hz, 1H), 7.30 (s, 1H), 7.72 (d, J=8.9 Hz, 2H), 7.91 (t, J=6.1 Hz, 1H), 7.95 (d, J=8.7 Hz, 2H), 8.10 (d, J=6.2 Hz, 1H), 9.59 (br s, 1H), 9.87 (br s, 1H), 10.38 (br s, 1H); MS (ESI+): m/z 469 (M+H)+.
ПРИМЕР 8. 4-[4-(3-Гидрокси-фениламино)-пиримидин-2-иламино]-N-(2-пирролидин-1-ил-этил)-бензолсульфонамид (Соединения V)

К раствору описанного выше соединения VI (30 мг, 0.05 ммоль) в DCM (6 мл) при комнатной температуре добавляют BBr3 (0.1 мл) и полученную смесь перемешивают при комнатной температуре в течение 2.5 ч. Реакцию гасят насыщенным раствором NaHCO3 пока рН смеси не достигнет ~7, после чего смесь экстрагируют EtOAc (30 мл). Органический слой сепарируют и отмывают физиологическим раствором, высушивают над MgSO4 и фильтруют. Фильтрат концентрируют и осадок очищают при помощи HPLC с получением нужного соединения V (13 мг соли TFA, 46%) в виде твердого белого вещества.
1H-NMR (500 MHz, DMSO-d6): 1.80-1.90 (m, 2H), 1.95-2.05 (m, 2H), 2.95-3.05 (m, 4H), 3.20-3.30 (m, 2H), 6.39 (d, J=6.3 Hz, 1H), 6.53 (d, J=7.2 Hz, 1H), 7.01 (d, J=9.2 Hz, 1H), 7.09 (s, 1H), 7.14 (t, J=8.1 Hz, 1H), 7.73 (d, J=8.8 Hz. 2H), 7.90 (t, J=6.2 Hz, 1H), 7.97 (d, J=8.8 Hz, 2H), 8.08 (d, J=6.4 Hz, 1H), 9.48 (br s, 1H), 9.57 (br s, 1H), 9.86 (br s, 1H), 10.41 (br s, 1H); MS (ESI+): m/z 455 (M+H)+.
ПРИМЕР 9. Бензо[1.3]диоксол-5-ил(2-хлоро-5-метил-пиримидин-4-ил)-амин (Промежуточное соединение 5).

Смесь 2-хлор-5-метил-пиримидин-4-иламин (0.30 г, 2.1 ммоль), 5-бромо-бензо[1,3]диоксол (0.45 г, 2.2 ммоль), Pd (OAc)2 (30 мг, 0.13 ммоль), Xantphos (0.15 г, 0,26 ммоль) и калий терт-бутоксид (0.45 г, 4.0 ммоль) суспендируют в диоксане (15 мл) и нагревают при дефлегмации в атмосфере аргона в течение 16 ч. Реакционную смесь охлаждают до комнатной температуре и растворяют в DMC (20 мл). Смесь фильтруют и фильтрат концентируют в вакууме. Осадок очищают при помощи флэш-хроматографии на колонке с силикагелем (гексан к 50% EtOAc/гексан) с получением нужного промежуточного соединения 5 (0.10 г, 18%) в виде твердого белого вещества. MS (ESI+): m/z 264 (М+Н)+.
ПРИМЕР 10: N4-Бензо[1,3]диоксол-5-ил-5-метил-N2-[4-(2-пирролидин-1-ил-этокси)-фенил]-пиримидин-2,4-диамин (Соединение VI)

Для синтеза соединения VI используют промежуточное соединение 5, описанное выше, и промежуточное соединение 6. Промежуточное соединение 6, 4-(2-пирролидин-1-ил-этокси)-фениламин, формула которого приведена ниже, синтезируют в два этапа, путем алкилирования 4-нитрофенола с использованием 2-хлорэтилпирролидона, с последующим восстановлением с получением анилинового производного.

Для синтеза промежуточного соединения 6 используются известные методики синтеза. Смесь описанного выше промежуточного соединения 5 (90 мг, 0.34 ммоль), промежуточного соединения 6 (95 мг, 0.46 ммоль), Pd2(dba)3 (20 мг, 0.02 ммоль), Xantphos (30 мг, 0.05 ммоль) и карбоната цезия (0.30 г, 0.9 ммоль) суспендируют в диоксане (10 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Реакционную смесь охлаждают до комнатной температуре и растворяют в DMC (20 мл). Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения VI (40 мг соли TFA, 21%) в виде твердого коричневого вещества.
1H-NMR (500 MHz, DMSO-d6): 1.85-1.95 (m, 2H), 1.95-2.05 (m, 2H), 2.13 (s, ЗН), 3.10-3.20 (m, 2H), 4.26 (t, J=5.0 Hz, 2H), 6.07 (s, 2H), 6.90-7.00 (m, 4H), 7.19 (s, 1H), 7.37 (d, J=9.0 Hz, 2H), 7.84 (s, 1H), 9.60 (br s, 1H), 9.89 (br s, 1H), 10.32 (br s, 1H); MS (ESI+): m/z 2455 (M+H)+.
ПРИМЕР 11. (4-Хлоро-3-метокси-фенил)-(2-хлоро-5-метил-пиримидин-4-ил)-амин (Промежуточное соединение 7)

Смесь 2-хлор-5-метил-пиримидин-4-иламина (0.50 г, 3.5 ммоль), 4-бром-1-хлор-2-метокси-бензола (0.65 мл, 4.8 ммоль), Pd2(dba)3 (0.17 г, 0.1119 ммоль), Xantphos (0.22 г, 0.38 ммоль) и карбоната цезия (0.30 г, 0.9 ммоль) суспендируют в диоксане (20 мл) и нагревают при дефлегмации в атмосфере аргона в течение 5 ч. Реакционную смесь охлаждают до комнатной температуре и растворяют в DMC (30 мл). Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок очищают при помощи флэш-хроматографии на колонке с силикагелем (гексан к 40% EtOAc/гексан) с получением нужного промежуточного соединения 7 (0.55 г, 55%) в виде желтого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): 2.18 (s, 3Н), 3.85 (s, 3Н), 7.35 (dd, J=8.6, J=2.3 Hz, 1H), 7.39 (d, J=8.7 Hz, 1H), 7.56 (d, J=2.3 Hz, 1H), 8.09 (d, J=0.9 Hz, 1H), 8.91 (s, 1H); MS (ESI+): m/z 455 (M+H)+.
ПРИМЕР 12. (4-Хлоро-3-метокси-фенил)-(2-хлоро-5-метил-пиримидин-4-ил)-метил-амин (Промежуточное соединение 8).
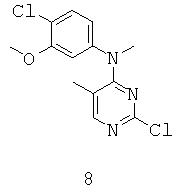
Суспензию промежуточного соединения 7 (0.50 г, 1.8 ммоль) и гидрида натрия (60% в минеральном масле, 0.15 г, 3.8 ммоль) в THF (10 мл) перемешивают в атмосфере аргона при 0°С в течение 5 минут. В полученную смесь впрыскивают метилиодид (0.15 мл, 2.4 ммоль) при той же температуре. Полученный раствор перемешивают при нагревании от 0°С до комнатной температуры в течение 15 минут и дополнительно перемешивают при комнатной температуре еще 17 часов. Реакцию гасят водой (10 мл) и затем экстрагируют EtOAc (30 мл). Органический слой сепарируют и отмывают физиологическим раствором, высушивают над MgSO4 и фильтруют. Фильтрат концентрируют и осадок очищают при помощи флэш-хроматографии на колонке с силикагелем (гексан к 20% EtOAc/гексан) с получением нужного промежуточного соединения 8 (0.20 г, 38%) в виде твердого белого вещества. MS (ESI+): m/z 298 (М+Н)+.
ПРИМЕР 13: N2-(4-(2-пирролидин-1-ил)этокси)фенил)-N4-(4-хлоро-3-метоксифенил)-N4,5-диметилпиримидин-2,4-диамин (Соединение VII)

Смесь промежуточного соединения 8 (0.15 г, 0.49 ммоль) и промежуточного соединения 6 (0.15 г, 0.73 ммоль), оба соединения описаны выше, суспендируют в уксусной кислоте (8 мл) и нагревают при 100°С в течение 17 ч. Смесь оставляют охлаждаться до комнатной температуры и уксусную кислоту удаляют при пониженном давлении. Осадок поглощают водой (15 мл) и нейтрализуют до рН ~7 с 7М раствора NaOH. Полученный раствор экстрагируют EtOAc (30 мл) и органический слой сепарируют. Органический слой отмывают физиологическим раствором, высушивают над MgSO4 и фильтруют. Фильтрат концентрируют в вакууме, а сырой продукт очищают при помощи HPLC с получением нужного промежуточного соединения VII (0.14 г соли TFA, 49%) в форме твердого белого вещества.
1H-NMR (500 MHz, DMSO-d6): 1.85-1.95 (m, 2H), 2.00-2.10 (m, 2H), 3.08-3.18 (m, 2H), 3.46 (s, 3H), 3.55-3.65 (m, 4H), 3.85 (s, 3H), 4.27 (t, J=5.0 Hz, 2H), 6.86 (d, J=7.4Hz, 1H), 7.01 (d, J=9.0 Hz, 2H), 7.15 (s, 1H), 7.46 (d, J=8.4 Hz, 1H), 7.58 (d, J=8.9 Hz, 2H), 7.83 (s, 1H) 9.85 (br s, 1H), 10.04 (br s, 1H), 10.32 (br s, 1H); MS (ESI+): m/z 468 (M+H)+.
ПРИМЕР 14. (2-Хлоро-5-метил-пиримидин-4-ил)-(4-хлоро-фенил)-амин (Промежуточное соединение 9).

Смесь 2-хлор-5-метил-пиримидин-4-иламина (0.30 г, 2.1 ммоль), 1-бром-1-хлорбензола (0.6 г, 3.1 ммоль), Pd2(dba)3 (95 мг, 0.10 ммоль), Xantphos (0.12 г, 0.20 ммоль) и карбоната цезия (1.3 г, 4.0 ммоль) суспендируют в диоксане (20 мл) и нагревают при дефлегмации в атмосфере аргона в течение 4 ч. Реакционную смесь охлаждают до комнатной температуре и растворяют в DMC (20 мл). Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок очищают при помощи флэш-хроматографии на колонке с силикагелем (гексан к 30% EtOAc/гексан) с получением нужного промежуточного соединения 9 (0.15 г, 28%) в виде бледно-желтого твердого вещества. MS (ESI+): m/z 254 (М+Н)+.
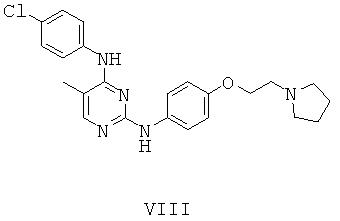
ПРИМЕР 15. N4-(4-Хлор-фенил)-5-метил-N2-[4-(2-пирролидин-1-ил-этокси)-фенил]-пиримидин-2,4-диамин (Соединение VIII)

Смесь описанных выше промежуточных соединений 9 (0.15 г, 0.60 ммоль) и 6 (0.20 г, 0.97 ммоль) суспендируют в уксусной кислоте (8 мл) и нагревают до 100°С в течение 6 ч. Смесь оставляют охлаждаться до комнатной температуры и уксусную кислоту удаляют при пониженном давлении. Осадок поглощают водой (15 мл) и нейтрализуют до рН ~7 с 7М раствора NaOH. Полученное коричневое твердое вещество фильтруют и дополнительно очищают при помощи HPLC с получением нужного соединения VIII (38 мг соли TFA, 12%) в виде коричневого масла.
1H-NMR (500 MHz, DMSO-d6): 1.80-1.95 (m, 2H), 2.00-2.10 (m, 2H), 2.15 (s, 3H), 3.10-3.20 (m, 2H), 3.55-3.65 (m, 4H), 3.77 (s, 3H), 4.28 (t, J=5.0 Hz, 2H), 6.95 (d, J=9.0 Hz, 2H), 7.38 (d, J=8.9 Hz, 2H), 7.42 (d, J=8.9 Hz, 2H), 7.62 (d, J=8.8 Hz, 2H), 7.90 (s, 1H), 9.84 (br s, 1H) 9.84 (br s, 1H), 10.10 (br s, 1H); MS (ESI+): m/z 424 (M+H)+.
ПРИМЕР 16: 2-(4-Амино-Фенокси)-этанол (Промежуточное соединение 10).

Раствор 2-(4-нитро-фенокси)-этанола (2.1 г, 12 ммоль) в МеОН (30 мл) насыщают аргоном и затем заряжают Pd/C (10% по об.). Смесь эвакуируют в вакууме и затем наполняют водородом из водородного баллона. Цикл повторяют, и смесь перемешивают при комнатной температуре в течение 12 ч. Гетерогенную реакционную смесь фильтруют через подушку с целлитом, отмывают МеОН и концентрируют в вакууме с получением нужного промежуточного вещества 10 (1.8 г, 99%) в виде твердого коричневого вещества. MS (ESI+): m/z 154 (М+Н)+.
ПРИМЕР 17. 2-{4-[4-(4-Хлоро-3-метокси-фениламино)-5-метил-пиримидин-2-иламино]-фенокси}-этанол (Соединение IX)

Суспензию описанных выше промежуточных соединений 7 (50 мг, 0.17 ммоль), 10 (40 мг, 0.26 ммоль), Pd2(dba)3 (8 мг, 0.01 ммоль), Xantphos (10 мг, 0.02 ммоль) и карбоната цезия (0.13 г, 0.40 ммоль) в диоксане (3 мл) помещают в реакционную пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют, а отфильтрованное твердое вещество отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи флэш-хроматографии на колонке с силикагелем (гексан к EtOAc) с получением нужного соединения IX (14 мг, 21%) в виде твердого светло-коричневого вещества.
1H-NMR (500 MHz, DMSO-d6): 2.10 (s, 3Н), 3.69 (t, J=5.3 Hz, 2H), 3.75 (s, 3Н), 3.92 (t, J=5.1 Hz, 2H), 4.83 (t, J=5.6 Hz, 1H), 6.78 (d, J=9.0 Hz, 2H), 7.29 (d, J=8.5 Hz, 1H), 7.43 (dd, J=8.6 Hz, J=2.2 Hz, 1H), 7.48 (d, J=2.3 Hz, 1H), 7.52 (d, J=9.0 Hz, 2H), 7.88 (s, 1H), 8.31 (s, 1H), 8.80 (s, 1H); MS (ESI+): m/z 401 (M+H)+.
ПРИМЕР 18. 5-Метил-N2-[4-(2-пирролидин-1-ил-этокси)-фенил]-пиримидин-2,4-диамин (Промежуточное соединение 11)

Смесь 2-хлоро-5-метил-пиримидин-4-иламин (0.13 г, 0.87 ммоль) и описанного выше промежуточного соединения 6 (0.30 г, 1.5 ммоль) суспендируют в уксусной кислоте (8 мл) и нагревают до 100°С в течение 2 ч. Смесь оставляют охлаждаться до комнатной температуры и уксусную кислоту удаляют при пониженном давлении. Осадок поглощают водой (15 мл) и нейтрализуют до рН ~7 с 7М раствора NaOH. Полученное твердое вещество фильтруют (30 мг) и отмывают сложным эфиром. Фильтрат экстрагируют EtOAc (30 мл) и органический слой сепарируют. Органический слой отмывают физиологическим раствором, высушивают над Mg2SO4 и фильтруют. Фильтрат концентрируют с получением дополнительного твердого вещества (0.2 г), которое объединяют с первым с получением желаемого промежуточного вещества 11 (0.23 г, 85%) в виде светло-желтого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): 1.65-1.70 (m, 4H), 1.89 (s, 3H), 2.74 (t, J=6.0 Hz, 2H), 3.98 (t, J=6.1 Hz, 2H), 6.30 (s, 2H), 6.78 (d, J=9.1 Hz, 2H), 7.62 (d, J=9.1 Hz, 2H), 7.64 (s, 1H), 8.50 (s, 1H), 8.50 (s, 1H); MS (ESI+): m/z 314 (M+H)+.
ПРИМЕР 19. 5-Метил-N4-фенил-N2-[4-(2-пирролидин-1-ил-этокси)-фенил]пиримидин-2,4-диамин (Соединение X)

Суспензию описанного выше промежуточного соединения 11 (25 мг, 0.08 ммоль), бромбензола (0.05 мл, 0.50 ммоль), Pd2(dba)3 (5 мг, 0.006 ммоль), Xantphos (10 мг, 0.02 ммоль) и карбоната цезия (70 мг, 0.21 ммоль) в диоксане (3 мл) помещают в реакционную пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют, а отфильтрованное твердое вещество отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи флэш-хроматографии на колонке с силикагелем (DCM к 30% MeOH/DCM) с получением нужного соединения Х (10 мг, 32%) в виде твердого светло-коричневого вещества.
1Н-NMR (500 MHz, DMSO-d6): 1.65-1.72 (m, 4H), 2.10 (s, 3H), 2.48-2.58 (m, 4H), 2.75-2.82 (m, 2H), 4.00 (t, J=5.9 Hz, 2H), 6.77 (d, J=9.0 Hz, 2H), 7.04 (d, J=7.3 Hz, 1H), 7.32 (t, J=7.9 Hz, 2H), 7.54 (d, J=9.0 Hz, 2H), 7.71 (d, J=7.8 Hz, 2H), 7.84 (s, 1H), 8.20 (s, 1H), 8.76 (s, 1H); MS (ESI+): m/z 390 (M+H)+.
ПРИМЕР 20: (4-Хлоро-3-фтор-фенил)-(2-хлор-5-метилчгаримидин-4-ил)-амин (Промежуточное соединение 12)

Смесь 2-хлор-5-метил-пиримидин-4-иламина (0.50 г, 3.5 ммоль), 4-бром-1-хлор-2-фтор-бензола (1.0 г, 4.8 ммоль), Pd2(dba)3 (0.16 г, 0.17 ммоль), Xantphos (0.20 г, 0.34 ммоль) и карбоната цезия (2.3 г, 7.0 ммоль) суспендируют в диоксане (25 мл) и нагревают при дефлегмации в атмосфере аргона в течение 15 ч. Затем реакционную смесь оставляют охлаждаться при комнатной температуре и разводят DCM (30 мл). Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок очищают при помощи флэш-хроматографии на колонке с силикагелем (гексан к 40% EtOAc/гексан) с получением нужного соединения 12 (0.75 г, 80%) в виде грязно-белого вещества. MS (ESI)+: m/z 272 (M+H)+.
ПРИМЕР 21. N4-(4-Хлор-3-Фтор-фенил)-5-метил-N2-[4-(2-пирролидин-1-ил-этокси)-фенил]-пиримидин-2,4-диамин (Соединение XI).

Смесь описанных выше промежуточных соединений 12 (0.20 г, 0.74 ммоль) и 6 (0.20 г, 0.097 ммоль) суспендируют в уксусной кислоте (8 мл) и нагревают до 100°С в течение 6 ч. Смесь охлаждают до комнатной температуры и уксусную кислоту удаляют при пониженном давлении. Осадок поглощают водой (15 мл) и нейтрализуют до рН ~7 с 7М раствора NaOH. Полученный раствор экстрагируют EtOAc (30 мл) и органический слой сепарируют. Органический слой отмывают физиологическим раствором, высушивают над MgSO4 и фильтруют. Фильтрат концентрируют в вакууме и сырой продукт очищают при помощи флэш-хроматографии на колонке с силикагелем (DCM к 30% MeOH/DCM) с получением нужного соединения XI (90 мг, 28%) в виде твердого белого вещества.
1H-NMR (500 MHz, DMSO-d6): 1.65-1.71 (m, 4H), 2.10 (s, 3H), 2.45-2.55 (m, 4H), 2.77 (t, J=6.0 Hz, 2H), 4.01 (t, J=6.0 Hz, 2H), 6.82 (d, J=9.0 Hz, 2H), 7.44 (d, J=8.8 Hz, 1H), 7.50 (d, J=9.0 Hz, 2H), 7.55 (dd, J=8.9 Hz, J=2.0 Hz, 1H), 7.91 (s, 1H), 8.07 (dd, J=12.5 Hz, J=2.0 Hz, 1H), 8.43 (s, 1H), 8.90 (s, 1H); MS (ESI+): m/z 442 (M+H)+.
ПРИМЕР 22: N4-(4-Хлоро-3-метокси-фенил)-5-метил-N4-(4-морфолин-4-илметил-фенил)-пиримидин-2,4-диамин (Соединение XII).

Суспензию описанного выше промежуточного соединения 7 (50 мг, 0.17 ммоль), 4-морфолин-4-илметил-фениламина (50 мг, 0.26 ммоль), Pd2(dba)3 (8 мг, 0.009 ммоль), Xantphos (10 мг, 0.02 ммоль) и карбоната цезия (0.13 г, 0.40 ммоль) в диоксане (3 мл) помещают в реакционную пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют, а отфильтрованное твердое вещество отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи HPLC с получением нужного соединения XII (40 мг соли TFA, 43%) в виде твердого светло-желтого вещества.
1H-NMR (500 MHz, DMSO-d6): 2.16 (s, 3Н), 3.05-3.15 (m, 2H), 3.10-3.20 (m, 2H), 3.60-3.70 (m, 2H), 3.90-4.00 (m, 2H), 4.28 (s, 2H), 4.01 (t, J=6.0 Hz, 2H), 7.25-7.35 (m, 3Н), 7.35-7.41 (m, 2H), 7.65 (d, J=8.3 Hz, 2H), 7.98 (s, 1H), 9.10 (br s, 1H), 9.86 (br s, 1H), 9.95 (br s, 1H); MS (ESI+): m/z 440 (M+H)+.
ПРИМЕР 23. Бензо[b]тиофен-5-ил-(2-хлор-5-метил-пиримидин-4-ил)-амин (Промежуточное соединение 13).
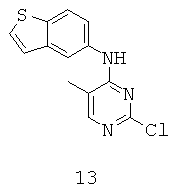
Смесь 2-хлор-5-метил-пиримидин-4-иламина (0.30 г, 2.1 ммоль), 4-бром-бензо[b]тиофена (0.6 г, 2.8 ммоль), Pd2(dba)3 (95 мг, 0.10 ммоль), Xantphos (0.12 г, 0.20 ммоль) и карбоната цезия (1.3 г, 4.0 ммоль) суспендируют в диоксане (25 мл) и нагревают при дефлегмации в атмосфере аргона в течение 3 ч. Затем реакционную смесь оставляют охлаждаться при комнатной температуре и разводят DCM (30 мл). Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок очищают при помощи флэш-хроматографии на колонке с силикагелем (гексан к 30% EtOAc/гексан) с получением нужного соединения 13 (0.23 г, 40%) в виде белого твердого вещества. MS (ESI)+: m/z 276 (M+H)+.
ПРИМЕР 24. N4-Бензо[b]тиофен-5-ил-метил-N2-[4-(2-пирролидин-1-ил-этокси)-фенил]-пиримидин-2,4-диамин (Соединение XIII).

Смесь описанных выше промежуточных соединений 13 (0.23 г, 0.83 ммоль) и 6 (0.35 г, 1.7 ммоль) суспендируют в уксусной кислоте (8 мл) и нагревают до 100°С в течение 6 ч. Смесь охлаждают до комнатной температуры и уксусную кислоту удаляют при пониженном давлении. Осадок поглощают водой (15 мл) и нейтрализуют до рН ~7 с 7М раствора NaOH. Полученный раствор экстрагируют EtOAc (30 мл) и органический слой сепарируют. Органический слой отмывают физиологическим раствором, высушивают над MgSO4 и фильтруют. Фильтрат концентрируют в вакууме и сырой продукт очищают при помощи флэш-хроматографии на колонке с силикагелем (DCM к 15% MeOH/DCM) с получением нужного соединения XIII (0.13 г, 35%) в виде твердого белого вещества.
1H-NMR (500 MHz, DMSO-d6): 1.65-1.75 (m, 4H), 2.12 (s, 3H), 2.50-2.62 (m, 4H), 2.75-2.85 (m, 2H), 3.99 (t, J=5.9 Hz, 2H), 6.70 (d, J=9.0 Hz, 2H), 7.36 (d, J=5.4 Hz, 1H), 7.51 (d, J=9.1 Hz, 2H), 7.61 (dd, J=8.7 Hz, J=2.0 Hz. 1H), 7.74 (d, J=5.4 Hz, 1H), 7.85 (d, J=0.8 Hz, 1H), 7.92 (d, J=8.6 Hz, 1H), 8.92 (d, J=1.7 Hz, 1H), 8.34 (s, 1H), 8.76 (s, 1H); MS (ESI+): m/z 446 (M+H)+.
ПРИМЕР 25. Бензо[b]тиофен-3-ил-(2-хлоро-5-метил-пиримидин-4-ил)-амин (Промежуточное соединение 14).

Смесь 2-хлор-5-метил-пиримидин-4-иламина (0.30 г, 2.1 ммоль), 3-бром-бензо[b]тиофена (0.6 г, 2.8 ммоль), Pd2(dba)3 (95 мг, 0.10 ммоль), Xantphos (0.12 г, 0.20 ммоль) и карбоната цезия (1.3 г, 4.0 ммоль) суспендируют в диоксане (25 мл) и нагревают при дефлегмации в атмосфере аргона в течение 3 ч. Затем реакционную смесь оставляют охлаждаться при комнатной температуре и разводят DCM (30 мл). Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок очищают при помощи флэш-хроматографии на колонке с силикагелем (гексан к 30% EtOAc/гексан) с получением нужного соединения 14 (65 мг, 11%) в виде желтого твердого вещества. MS (ESI)+: m/z 276 (М+Н)+.
ПРИМЕР 26. N4-Бензо[b]тиофен-3-ил-5-метил-N2-f4-(2-пирролидин-1-ил-этокси)-фенил]-пиримидин-2,4-диамин (Соединение XIV)

Смесь описанных выше промежуточных соединений 14 (50 мг, 0.18 ммоль) и 6 (0.10 г, 0.48 ммоль) суспендируют в уксусной кислоте (8 мл) и нагревают до 100°С в течение 15 ч. Смесь охлаждают до комнатной температуры и уксусную кислоту удаляют при пониженном давлении. Осадок поглощают водой (15 мл) и нейтрализуют до рН ~7 с 7М раствора NaOH. Полученный раствор экстрагируют EtOAc (20 мл) и органический слой сепарируют. Органический слой отмывают физиологическим раствором, высушивают над MgSO4 и фильтруют. Фильтрат концентрируют в вакууме и сырой продукт очищают при помощи флэш-хроматографии на колонке с силикагелем (DCM к 15% MeOH/DCM) с получением нужного соединения XIV (10 мг, 13%) в виде твердого грязно-белого вещества.
1H-NMR (500 MHz, DMSO-d6): 1.70-1.80 (m, 4H), 2.19 (s, 3Н), 2.65-2.80 (m, 4H), 2.85-3.00 (m, 2H), 3.98-4.03 (m, 2H), 6.63 (d, J=8.8 Hz, 2H), 7.37 (d, J=8.6 Hz, 2H), 7.38-7.45 (m, 2H), 7.79-7.83 (m, 1H), 7.87 (s, 1H), 7.90-8.03 (m, 1H), 8.33 (s, 1H), 8.78 (s, 1H); MS (ESI+): m/z 446 (M+H)+.
ПРИМЕР 27. (2-Хлор-5-метил-пиримидин-4-ил)-(3-хлоро-фенил)-амин (Промежуточное соединение 15)

Смесь 2-хлор-5-метил-пиримидин-4-иламина (0.30 г, 2.1 ммоль), 1-бром-3-хлорбензола (0.06 г, 3.1 ммоль), Pd2(dba)3 (95 мг, 0.10 ммоль), Xantphos (0.12 г, 0.20 ммоль) и карбоната цезия (1.3 г, 4.0 ммоль) суспендируют в диоксане (20 мл) и нагревают при дефлегмации в атмосфере аргона в течение 4 ч. Затем реакционную смесь оставляют охлаждаться при комнатной температуре и разводят DCM (20 мл). Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок очищают при помощи флэш-хроматографии на колонке с силикагелем (гексан к 40% EtOAc/гексан) с получением нужного соединения 15 (0.30 г, 56%) в виде бледно-желтого твердого вещества. MS (ESI)+: m/z 254 (M+H)+.
ПРИМЕР 28. N4-(3-Хлор-фенил)-5-метил-N4-[4-(2-пирролидин-1-ил-этокси)-фенил]-пиримидин-2,4-диамин (Соединение XV)

Смесь описанных выше промежуточных соединений 15 (0.15 г, 0.59 ммоль) и 6 (0.25 г, 1.2 ммоль) суспендируют в уксусной кислоте (8 мл) и нагревают до 100°С в течение 21 ч. Смесь охлаждают до комнатной температуры и уксусную кислоту удаляют при пониженном давлении. Осадок поглощают водой (15 мл) и нейтрализуют до рН ~7 с 7М раствора NaOH. Полученный раствор экстрагируют EtOAc (30 мл) и органический слой сепарируют. Органический слой отмывают физиологическим раствором, высушивают над MgSO4 и фильтруют. Фильтрат концентрируют в вакууме и сырой продукт очищают при помощи флэш-хроматографии на колонке с силикагелем (DCM к 10% MeOH/DCM) с получением нужного соединения XV (60 мг, 24%) в виде твердого белого вещества.
1H-NMR (500 MHz, DMSO-d6): 1.65-1.72 (m, 4H), 2.10 (s, 3H), 2.50-2.60 (m, 4H), 2.78-2.83 (m, 2H), 4.01 (t, J=5.9 Hz, 2H), 6.81 (d, J=9.1 Hz, 2H), 7.05-7.08 (m, 1H), 7.32 (t, J=8.1 Hz, 1H), 7.52 (d, J=9.0 Hz, 2H), 7.71 (d, J=8.3 Hz, 1H), 7.85 (t, J=2.1 Hz, 1H), 7.89 (d, J=0.7 Hz, 1H), 8.33 (s, 1H), 8.86 (s, 1H); MS (ESI+): m/z 424 (M+H)+.
ПРИМЕР 29. 3-Бром-N-метил-бензамид (Промежуточное соединение 16)

Раствор 3-бром-бензоилхлорида (2.93 г, 13.3 ммоль, 1 экв.) в 30 мл THF тщательно перемешивают и обрабатывают 2.0М метиламина в THF (15 мл, 29.4 ммоль, 2.2 экв.). Наблюдают образование белого преципитата и реакционную смесь дополнительно перемешивают в течение 20 минут. Затем реакционную смесь вливают в этилацетат (100 мл) и отмывают водой (2×150 мл) и физиологическим раствором (1×150 мл). Органическую фазу отделяют от водной фазы и высушивают над сульфатом натрия, фильтруют и выпаривают с получением нужного соединения 16 в виде белого порошка. (2.29 г, 82% выход).
ПРИМЕР 30. 3-(2-Хлор-5-метил-пиримидин-4-иламино)-N-метил-бензамид (Промежуточное соединение 17)

В сухой круглой колбе объемом 50 мл объединяют 2-хлор-5-метил-пиримидин-4-иламин (0.3 г, 2.09 ммоль, 1 экв.), 3-бром-N-метил-бензамид (0.489 г, 2.20 ммоль, 1.1 экв.), карбонат цезия (2.04 г, 6.27 ммоль, 3 экв.), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (0.242 г, 0.418 ммоль, 0.2 экв.) и трис(дибензилиденацетон)дипалладий (0.191 г, 0.209 ммоль, 0.1 экв.). Реагирующие вещества разводят диоксаном (20 мл), насыщают аргоном и помещают в обратный конденсатор. Реакцию нагревают при дефлегмации в течение 16 часов. Затем реакционную смесь переносят в пробирку для центрифугирования, прокручивают, сливают с осадка и выпаривают до получения сухого вещества. Полученное твердое вещество разводят DMC и абсорбируют на силикагеле. При помощи хроматографии (градиент 50% этилацетат в гексане вплоть до 100% этилацетата) получают нужное промежуточное соединение 17 в виде светло-желтого порошка (0.25 г, 43% выход). MS (ESI+) 277.01 (М+Н), r.t.=1.92 мин.
ПРИМЕР 31. N-Метил-3-{5-метил-2-[4-(2-пирролидин-1-ил-этокси)-фениламино]-пиримидин-4-иламино}-бензамида TFA соль (Соединение XVI)

Описанное выше промежуточное соединение 17 (0.068 г, 0.246 ммоль, 1 экв.), 4-(2-Пирролидин-1-ил-этокси)-фениламин (0.061 г, 0.296 ммоль, 12 экв.), карбонат цезия (0.241 г, 0.74 ммоль, 3 экв.), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (0.029 г, 0.05 ммоль, 0.2 экв.) и трис(дибензилиденацетон)дипалладий (0.023 г, 0.025 ммоль, 0.1 экв.) объединяют в пробирке для микроволновой печи объемом 15 мл. Реагенты затем разводят 7 мл диоксана и облучают микроволнами в течение 15 минут при 160°С. Реакционную пробирку центрифугируют, сливают с осадка и выпаривают до получения сухого вещества. При помощи HPLC получают TFA соль нужного соединения XVI (0.084 г, 76%). MS (ESI+): 447.20 (М+Н), r.t=1.53 мин.
1H-NMR (500 MHz, DMSO-d6): δ 1.87-1.91 (m, 2H), 2.02-2.06 (m, 2H), 2.16 (s, 3H), 2.79 (d, J=4. Hz, 3Н), 3.11-3.15 (m, 2H), 3.57-3.61 (m, 5H), 4.23 (t, J=5.0 Hz, 3Н), 6.84 (d, J=8.8 Hz, 2H), 7.34 (d, J=8.9 Hz, 2H), 7.47 (t, J=7.9 Hz, 1H), 7.68-7.70 (m, 2H), 7.93 (s, 1H), 8.00 (s, 1H), 8.46-8.47 (m, 1H), 9.80 (bs, 1H), 9.93 (bs, 1H) 10,41 (bs, 1H).
ПРИМЕР 32. N4-(4-Хлор-3-метокси-фенил)-5-метил-N2-[4-(2-пирролидин-1-ил-этокси)-фенил]-пиримидин-2,4-диамин TFA соль (Соединение XVII).

Описанное выше промежуточное соединение 7 (0.083 г, 0.293 ммоль, 1 экв.), 4-(2-Пирролидин-1-ил-этокси)-фениламин (0.073 г, 0.352 ммоль, 1.2 экв.), карбонат цезия (0.287 г, 0.879 ммоль, 3 экв.), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (0.034 г, 0.059 ммоль, 0.2 экв.) и трис(дибензилиденацетон)дипалладий (0.027 г, 0.029 ммоль, 0.1 экв.) объединяют в пробирке для микроволновой печи объемом 15 мл. Реагенты затем разводят 7 мл диоксана и облучают микроволнами в течение 15 минут при 160°С. Реакционную пробирку центрифугируют, сливают с осадка и выпаривают до получения сухого вещества. При помощи HPLC получают TFA соль нужного соединения XVII (0.1 г, 75%). MS (ESI+): 454.13 (M+H), r.t=1.82 мин.
1H-NMR (500 MHz, DMSO-d6): δ 1.87-1.90 (m, 2H), 2.02-2.05 (m, 2H), 2.15 (s, 3Н), 3.11-3.14 (m, 2H), 3.58-3.61 (m, 5H), 3.70 (s, 3Н), 4.26 (t, J=5.0 Hz, 3Н), 6.91 (d, J=8.9 Hz, 2H), 7.23 (m, 1H), 7.34-7.4 (m, 4H), 7.93 (s, 1H), 9.63 (bs, 1H), 9.96 (bs, 1H), 10.40 (bs, 1H).
ПРИМЕР 33. N-(2-Хлор-5-метил-пиримидин-4-ил)-N',N'-диметил-бензол-1,3-диамин (Промежуточное соединение 18).

2-Хлор-5-метил-пиримидин-4-иламин (0.343 г, 2.38 ммоль, 1 экв.), (3-бром-фенил)-диметил-амин (0.524 г, 2.62 ммоль, 1.1 экв.), карбонат цезия (2.3 г, 7.15 ммоль, 3 экв.), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (0.218 г, 0.238 ммоль, 0.1 экв.) объединяют в пробирке для микроволновой печи объемом 30 мл. Реагенты затем разводят 12 мл диоксана и облучают микроволнами в течение 25 минут при 160°С. Затем реакционную смесь переносят в пробирку для центрифугирования, прокручивают, сливают с осадка и выпаривают до получения сухого вещества. Полученное твердое вещество разводят DMC и абсорбируют на силикагеле. При помощи хроматографии (градиент 0% метанола в DMC вплоть до 25% метанола в DMC) получают нужное промежуточное соединение 18 в виде оранжевого твердого вещества (0.184 г, 29% выход). MS (ESI+) 263.02 (M+H), r.t.=1.72 мин.
ПРИМЕР 34. N4-(3-Диметиламино-фенил)-5-метил-N2-[4-(2-пирролидин-1-ил-этокси)-фенил]-пиримидин-2,4-диамин TFA соль (Соединение XVIII)

Описанное выше промежуточное соединение 18 (0.092 г, 0.35 ммоль, 1 экв.), 4-(2-пирролидин-1-ил-этокси)-фениламин (0.087 г, 0.42 ммоль, 1.2 экв.), карбонат цезия (0.343 г, 1.05 ммоль, 3 экв.), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (0.041 г, 0.0702 ммоль, 0.2 экв.) и трис(дибензилиденацетон)дипалладий (0.032 г, 0.035 ммоль, 0.1 экв.) объединяют в пробирке для микроволновой печи объемом 15 мл. Реагенты затем разводят 7 мл диоксана и облучают микроволнами в течение 15 минут при 160°С. Реакционную пробирку центрифугируют, сливают с осадка и выпаривают до получения сухого вещества. При помощи HPLC получают TFA соль нужного соединения XVIII (0.035 г, 23%). MS (ESI+): 433.21 (М+Н), r.t=1.52 мин.
1H-NMR (500 MHz, DMSO-d6): δ 1.87-1.90 (m, 2H), 2.03-2.06 (m, 2H), 2.15 (s, 3H), 3.12-3.15 (m, 2H), 3.57-3.60 (m, 4H), 3.70 (s, 3H), 4.25 (t, J=5.0 Hz, 3H), 6.34 (dd, J=8.4 Hz, J=2.3 Hz, 2H), 6.28-6.90 (m, 4H), 7.20 (t, J=8.0 Hz, 1H), 7.39 (d, J=9.1 Hz, 2H), 7.85 (s, 1H), 9.63 (bs, 1H), 9.90 (bs, 1H), 10.39 (bs, 1H).
ПРИМЕР 35. (2-Хлор-5-мстил-пиримидин-4-ил)-(3,4-дихлор-фенил)-амин (Промежуточное соединение 19).

2-хлор-5-метил-пиримидин-4-иламин (0.408 г, 2.83 ммоль, 1 экв.), 4-Бром-1,2-дихлор-бензол (0.704 г, 3.12 ммоль, 1.1 экв.), карбонат цезия (2.8 г, 8.49 ммоль, 3 экв.), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (0.328 г, 0.57 ммоль, 0.2 экв.) и трис(дибензилиденацетон)дипалладий (0.26 г, 0.283 ммоль, 0.1 экв.) объединяют в пробирке для микроволновой печи объемом 30 мл. Реагенты затем разводят 12 мл диоксана и облучают микроволнами в течение 25 минут при 160°С. Реакционную пробирку центрифугируют, сливают с осадка и выпаривают до получения сухого вещества. Полученное твердое вещество растворяют в DMC и абсорбируют на силикагеле. При помощи хроматографии (градиент 15% этилацетата в гексане вплоть до 80% этилацетата в гексане) получают нужное промежуточное соединение 19 в виде светло-желтого порошка (0.036 г, 45% выход). MS (ESI+): 287,97, r.t=3.12 мин.
ПРИМЕР 36. N4-(3,4-Дихлор-фенил)-5-метил-N2-[4-(2-пирролидн-1-ил-этокси)-фенил]-пиримидин-2,4-диамин TFA соль (Соединение XIX)

Описанное выше промежуточное соединение 19 (0.09 г, 0.313 ммоль, 1 экв.), 4-(2-пирролидин-1-ил-этокси)-фениламин (0.078 г, 0.376 ммоль, 1.2 экв.), карбонат цезия (0.307 г, 0.941 ммоль, 3 экв.), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (0.036 г, 0.063 ммоль, 0.2 экв.) и трис(дибензилиденацетон)дипалладий (0.029 г, 0.0314 ммоль, 0.1 экв.) объединяют в пробирке для микроволновой печи объемом 15 мл. Реагенты затем разводят 7 мл диоксана и облучают микроволнами в течение 15 минут при 160°С. Реакционную пробирку центрифугируют, сливают с осадка и выпаривают до получения сухого вещества. При помощи HPLC получают TFA соль нужного соединения XIX (0.056 г, 39%). MS (ESI+): 458.1 (М+Н), r.t=1.93 мин.
1H-NMR (DMSO-d6): δ 1.87-1.91 (m, 2H), 2.03-2.06 (m, 2H), 2.14 (s, 3H), 3.12-3.15 (m, 3H), 3.57-3.60 (m, 4H), 4.26 (t, J=5.0 Hz, 2H), 6.97 (d, J=9.0 Hz, 1H), 7.40 (d, J=9 Hz, 2H), 7.60 (s, 2H), 7.97 (d, J=15.35 Hz, 2H), 9.46 (bs, 1H), 9.89 (bs, 1H), 10.17 (bs, 1H).
ПРИМЕР 37. Tetr-бутиловый сложный эфир 4-{3-[4-(4-Хлор-3-метокси-фениламино)-5-метил-пиримидин-2-иламино]-бензил}-пиперазин-1-карбоновой кислоты (Промежуточное соединение 20).

(4-Хлор-3-метокси-фенил)-(2-хлор-5-метил-пиримидин-4-ил)-амин (0.092 г, 0.325 ммоль, 1 экв.), tert-бутиловый сложный эфир 4-(3-амино-бензил)-пиперазин-1-карбоновой кислоты (0.114 г, 0.39 ммоль, 1.2 экв.), карбонат цезия (0.318 г, 0.975 ммоль, 3 экв.), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (0.038 г, 0.065 ммоль, 0.2 экв.) и трис(дибензилиденацетон)дипалладий (0.03 г, 0.0325 ммоль, 0.1 экв.) объединяют в пробирке для микроволновой печи объемом 15 мл. Реагенты затем разводят 7 мл диоксана и облучают микроволнами в течение 15 минут при 160°С. Реакционную пробирку центрифугируют, сливают с осадка и выпаривают до получения сухого вещества. При помощи HPLC получают TFA соль нужного промежуточного соединения 20 (0.075 г, 43%). MS (ESI+): 539.32 (M+H), r.t=2.09 мин.
ПРИМЕР 38. N4-(4-Хлор-3-метокси-фенил)-5-метил-N2-(3-пиперазин-1-илметил-фенил)-пиримидин-2,4-диамин TFA соль (Соединение XX)

Тщательно перемешанный раствор описанного выше промежуточного соединения 20 (0.075 г, 0.14 ммоль, 1 экв.) в DCM (6 мл) обрабатывают TFA (2 мл). Через 2 ч. Растворители выпаривают и полученный осадок растирают в порошок вместе со сложным эфиром с получением нужного соединения XX в виде белых, гигроскопичных твердых частиц соли TFA (0.05 г, 82%). MS (ESI+): 439.13 (М+Н), r.t=1.67 мин.
1H-NMR (DMSO-d6): δ 2.17 (s, 3Н), 2.89 (bs, 4H), 3.2 (bs, 4H), 3.68 (s, 3H), 3.82 (bs, 3Н), 7.16-7.20 (m, 2H), 7.28 (t, J=7.7 Hz, 1H), 7.33 (d, J=2.3 Hz, 1H), 7.39 (s, 1H), 7.42 (d, J=8.5 Hz, 1H), 7.49-7.51 (m, 1H), 7.98 (s, 1H), 8.87 (bs, 1H, 9.79 (bs, 1H) 10.57 (bs, 1H).
ПРИМЕР 39. 2-(4-(2-Пирролидин-1-ил)этокси)фениламино)-4-аминопиримидин-5-карбонитрил (Промежуточное соединение 21)

К раствору 2,4-диаминопиримидин-5-карбонитрила (135 мг, 1.00 ммоль) в 1,4-диоксане (20 мл) добавляют 1-(2-(4-бромфенокси)этил)пирролидин (270 мг, 1.0 ммоль), Cs2CO3 (1.3 г, 4.0 ммоль), Pd2(dba)3 (92 мг, 0.1 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xant Phos, 174 мг, 0.3 ммоль). Смесь нагревают при дефлегмации в течение 4 ч в атмосфере аргона. Твердые частицы отфильтровывают, и фильтрат отмывают физиологическим раствором (1×100 мл). Органический раствор сепарируют и высушивают (Na2SO4). Растворитель удаляют до 5 мл и добавляют гексан (50 мл), твердые частицы собирают путем фильтрации. Сырой продукт очищают при помощи HPLC с получением нужного соединения 21 (32 мг, 10%).
ПРИМЕР 40. 4-(2,4-Дихлор-5-метоксифениламино)-2-(4-(2-(пирролидин-1-ил)этокси)фенил-амино)пиримидин-5-карбонитрил (Соединение XXI)

88 К раствору описанного выше промежуточного соединения 21 (32 мг, 0.1 ммоль) в 1,4-диоксане (10 мл) добавляют 1-бром-2,4-дихлор-5-метоксибензол (28 мг, 0.11 ммоль), Cs2CO3 (97 мг, 0.3 ммоль), Pd2(dba)3 (7 мг, 0.0074 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xant Phos, 13 мг, 0.022 ммоль). Смесь нагревают при дефлегмации в течение 4 ч в атмосфере аргона. Твердые частицы отфильтровывают, и фильтрат отмывают физиологическим раствором (1×50 мл). Органический раствор сепарируют и высушивают (Na2SO4). Растворитель удаляют в вакууме. Сырой продукт очищают при помощи хроматографии (SiO2/CH2Cl2: MeOH: NH3.Н2О, DMSO-d6) с получением нужного соединения XXI (35 мг, 67%).
1H-NMR (500 MHz, DMSO-d6): 1.88-1.90 (m, 2H), 2.00-2.03 (m, 2H), 3.07-3.11 (m, 2H), 3.54-3.56 (m, 4H), 3.81 (s, 3H), 4.25 (br, 2H), 6.68 (br, 2H), 7.32 (br, 2H), 7.33 (s, 1H), 7.75 (s, 1H), 8.50 (s, 1H), 9.73 (br, 1H), 9.94 (br, 1H), 10.60 (br, 1H). MS (EI): 499.0
ПРИМЕР 41. 2-(3-(2-(Пирролидин-1-ил)этокси)фениламино)-4-аминопиримидин-5-карбонитрил (Промежуточное соединение 22)

К раствору 2,4-диаминопиримидин-5-карбонитрила (145 мг, 1.07 ммоль) в 1,4-диоксане (20 мл) добавляют 1-(2-(3-бромфенокси)этил)пирролидин (290 мг, 1.07 ммоль), Cs2CO3 (1.43 г, 4.4 ммоль), Pd2(dba)3 (92 мг, 0.1 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xant Phos, 174 мг, 0.3 ммоль). Смесь нагревают при дефлегмации в течение 4 ч в атмосфере аргона. Твердые частицы отфильтровывают, и фильтрат отмывают физиологическим раствором (1×100 мл). Органический раствор сепарируют и высушивают (Na2SO4). Растворитель удаляют до 5 мл и добавляют гексан (50 мл), твердые частицы собирают путем фильтрации. Сырой продукт очищают при помощи HPLC с получением нужного соединения 22 (55 мг, 16%).
ПРИМЕР 42. 4-(2,4-Дихлор-5-метоксифениламино)-2-(3-(2-(пирролидин-1-ил)этокси)фенил-амино)пиримидин-5-карбонитрил (Соединение XXII)

К раствору описанного выше промежуточного соединения 22 (50 мг, 0.15 ммоль) в 1,4-диоксане (10 мл) добавляют 1-бром-2,4-дихлор-5-метоксибензол (44 мг, 0.17 ммоль), Cs2CO3 (200 мг, 0.62 ммоль), Pd2(dba)3 (14 мг, 0.015 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xant Phos, 27 мг, 0.05 ммоль). Смесь нагревают при дефлегмации в течение 4 ч в атмосфере аргона. Твердые частицы отфильтровывают, и фильтрат отмывают физиологическим раствором (1×50 мл). Органический раствор сепарируют и высушивают (Na2SO4). Растворитель удаляют в вакууме. Сырой продукт очищают при помощи HPLC с получением нужного соединения XXII (6 мг, 8%).
1H-NMR (500 MHz, DMSO-d6): 1.87-1.89 (m, 2H), 1.90-2.03 (m, 2H), 3.04-3.08 (m, 2H). 3.52-3.56 (m, 4H), 3.80 (s, 3H), 4.23 (br, 2H), 6.62 (d, J=6.4 Hz, 2H), 6.97 (br, 1H), 7.14 (br, 2H), 7.34 (s, 1H), 7.74 (s, 1H), 8.54 (s, 1H), 9.70 (br, 1H), 9.95 (br, 1H); 10.83 (br, 1H). MS (EI): 499.0
ПРИМЕР 43. 2-Хлор-N-(2,4-дихлор-5-метоксифенил)-5-метилпиримидин-4-амин (Промежуточное соединение 23)

К раствору 2-хлор-5-метилпиримидин-4-амина (44.8 мг, 0.31 ммоль) в 1,4-диоксане (20 мл) добавляют 1-бром-2,4-дихлор-5-метоксибензол (96 мг, 0.37 ммоль), Cs2CO3 (408 мг, 1.25 ммоль), Pd2(dba)3 (37 мг, 0.04 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xant Phos, 70 мг, 0.12 ммоль). Смесь нагревают при дефлегмации в течение 4 ч в атмосфере аргона. Твердые частицы отфильтровывают, и фильтрат отмывают физиологическим раствором (1×100 мл). Органический раствор сепарируют и высушивают (Na2SO4). Растворитель удаляют в вакууме. Сырой продукт используют для следующей реакции без дополнительной очистки.
ПРИМЕР 44: N2-(3-(2-(пирролидин-1-ил)этокси)фенил)-N4-(2,4-дихлор-5-метоксифенил)-5-метилпиримидин-2,4-диамин (Соединение XXIII)

К раствору описанного выше промежуточного соединения 23 в 1,4-диоксане (10 мл) добавляют 3-(2-(пирролидин-1-ил)этокси)бензоламин (77.3 мг, 0.38 ммоль), Cs2CO3 (488 мг, 1.25 ммоль), Pd2(dba)3 (28 мг, 0.03 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xant Phos, 53 мг, 0.09 ммоль). Смесь нагревают при дефлегмации в течение 4 ч в атмосфере аргона. Твердые частицы отфильтровывают, и фильтрат отмывают физиологическим раствором (1×50 мл). Органический раствор сепарируют и высушивают (Na2SO4). Растворитель удаляют в вакууме. Сырой продукт очищают при помощи HPLC с получением нужного соединения XXIII (25 мг, 15%).
1H-NMR (500 MHz, DMSO-d6): 1.87-1.89 (m, 2H), 1.90-2.03 (m, 2H), 2.18 (s, 3H), 3.04-3.08 (m, 2H), 3.52-3.56 (m, 4H), 3.80 (s, 3H), 4.24 (t, J=5.0 Hz, 2H), 6.71 (d, J=7.65 Hz, 1H), 6.91 (s, 1H), 6.96 (d, J=8.5 Hz 1H), 7.02 (t, J=8.2 Hz, 1H), 7.37 (s,lH), 7.83 (s, 1H), 8.02 (s, 1H); 10.09 (br, 1H), 10.66 (br, 1H) 10.82 (br, 1H). MS (EI): 488.2.
ПРИМЕР 45: 2-Хлор-N-(3-мстоксифенил)-5-метилпиримидин-4-амин (Промежуточное соединение 24)

К раствору 2-хлор-5-метилпиримидин-4-амина (320 мг, 2.23 ммоль) в 1,4-диоксане (40 мл) добавляют 1-бром-3-метоксибензол (458.5 мг, 2.45 ммоль), Cs2CO3 (2.9 г, 8.9 ммоль), Pd2(dba)3 (201 мг, 0.22 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xant Phos, 382 мг, 0.66 ммоль). Смесь нагревают при дефлегмации в течение 4 ч в атмосфере аргона. Твердые частицы отфильтровывают, и фильтрат отмывают физиологическим раствором (1×100 мл). Органический раствор сепарируют и высушивают (Na2SO4). Растворитель удаляют до 5 мл и добавляют гексан (100 мл), твердые частицы собирают путем фильтрации. Сырой продукт, нужное промежуточное соединение 24 (500 мг, 90%), используют для следующей реакции без дополнительной очистки.
ПРИМЕР 46. N2-(4-(2-(пирролидин-1-ил)этокси)фенил)-N4-(3-метоксифенил)-5-метил-пиримидин-2,4-диамин (Соединение XXIV)

К раствору описанного выше промежуточного соединения 24 (240 мг, 0.96 ммоль) в 1,4-диоксане (20 мл) добавляют 4-(2-(пирролидин-1-ил)этокси)бензоламин (200 мг, 0.96 ммоль), Cs2CO3 (1.3 мг, 4.0 ммоль), Pd2(dba)3 (82 мг, 0.09 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xant Phos, 156 мг, 0.27 ммоль). Смесь нагревают при дефлегмации в течение 4 ч в атмосфере аргона. Твердые частицы отфильтровывают, и фильтрат отмывают физиологическим раствором (1×50 мл). Органический раствор сепарируют и высушивают (Na2SO4). Растворитель удаляют в вакууме. Сырой продукт очищают при помощи HPLC с получением нужного соединения XXIV (85 мг, 20%).
1H-NMR (500 MHz, DMSO-d6): 1.89-1.91 (m, 2H), 1.98-2.05 (m, 2H), 2.16 (s, 3Н), 3.07-3.12 (m, 2H), 3.52-3.56 (m, 4H), 3.73 (s, 3H), 4.33 (t, J=4.5 Hz, 2H), 6.83-6.85 (m, 1H), 6.91 (d, J=8.8 Hz, 2H), 7.17 (s, 1H), 7.34 (d, J=8.8 Hz, 2H), 7.41 (t, J=7.7 Hz,lH), 7.56 (d, J=7.7 Hz, 1H), 7.89 (s, 1H), 9.75 (s, 1H), 10.51 (s, 1H), 10.96 (br, 1H) MS (EI): 420.2.
ПРИМЕР 47. 3-(2-(4-(2-Пирролидин-1-ил)этокси)фениламино)-5-метилпиримидин-4-иламино)-фенол (Соединение XXV)

К раствору описанного выше соединения XXIV (50 мг, 0.1 ммоль) в безводном CH2Cl2 (10 мл) добавляют 1.0 М BBr3 в CH2Cl2 (0.3 мл, 0.3 ммоль). Смесь перемешивают при комнатной температуре в течение 3 ч. Добавляют насыщенный NaHCO3 (20 мл) и органический слой сепарируют. Водный слой экстрагируют CH2Cl2 (3×10 мл). Комбинированный органический раствор высушивают (Na2SO4). Продукт очищают при помощи HPLC с получением нужного соединения XXV (17 мг, 35%) в виде желтого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): 1.89 (br, 2H), 2.00 (br, 2H), 2.14 (s, 3Н), 3.09 (br, 2H), 3.42 (br, 4H), 4.33 (br, 2H), 6.72 (d, J=7.1 Hz, 1H), 6.91 (d, J=8.4 Hz, 2H), 6.96 (d, J=7.6 Hz, 1H), 7.00 (s, 1H), 7.18 (t, J=8.0 Hz, 1H), 7.38 (d, J=8.6 Hz, 2H). 7.88 (s, 1H), 9.70 (s, 1H), 9.74 (s, 1H), 10.55 (s, 1H), 11.09 (br, 1H) MS (EI): 406.2.
ПРИМЕР 48. 2-Хлор-5-метил-N-(3-нитрофенил)пиримидин-4-амин (Промежуточное соединение 25)

К раствору 2-хлор-5-метилпиримидин-4-амина (232 мг, 1.61 ммоль) в 1,4-диоксане (40 мл) добавляют 1-бром-3-нитробензол (359 мг, 1.78 ммоль), Cs2CO3 (2.1 г, 6.4 ммоль), Pd2(dba)3 (146 мг, 0.16 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xant Phos, 278 мг, 0.48 ммоль). Смесь нагревают при дефлегмации в течение 4 ч в атмосфере аргона. Твердые частицы отфильтровывают, и фильтрат отмывают физиологическим раствором (1×100 мл). Органический раствор сепарируют и высушивают (Na2SO4). Растворитель удаляют до 5 мл и добавляют гексан (100 мл), твердые частицы собирают путем фильтрации. Сырой продукт, нужное промежуточное соединение 25, используют для следующей реакции без дополнительной очистки.
ПРИМЕР 49. N2-(4-(2-(пирролидин-1-ил)этокси)фенил)-5-метил-N4-(3-нитрофенил)пиримидин-2,4-диамин (Соединение XXVI)

К раствору описанного выше промежуточного соединения 25 в 1,4-диоксане (40 мл) добавляют 4-(2-(пирролидин-1-ил)этокси)бензоламин (367 мг, 1.78 ммоль), Cs2CO3 (2.1 мг, 6.4 ммоль), Pd2(dba)3 (146 мг, 0.16 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xant Phos, 218 мг, 0.48 ммоль). Смесь нагревают при дефлегмации в течение 4 ч в атмосфере аргона. Твердые частицы отфильтровывают, и фильтрат отмывают физиологическим раствором (1×50 мл). Органический раствор сепарируют и высушивают (Na2SO4). Растворитель удаляют в вакууме. Сырой продукт очищают при помощи HPLC с получением нужного соединения XXVI (51 мг, 7%).
1H-NMR (500 MHz, DMSO-d6): 1.89-1.92 (m, 2H), 1.98-2.05 (m, 2H), 2.21 (s, 3Н), 3.10-3.12 (m, 2H), 3.52-3.57 (m, 4H), 4.33 (t, J=4.8 Hz, 2H), 6.90 (d, J=8.9 Hz, 2H), 7.32 (d, J=8.9 Hz, 2H), 7.67 (t, J=8.2 Hz, 1H), 7.99 (s, 1H), 7.56 (dd, J=8.4 Hz, J=1.8 Hz, 1H), 8.09 (d, J=7.4 Hz, 1H), 8.45 (s, 1H), 10.14 (s, 1H), 10.60 (s, 1H), 11.17 (br, 1H) MS (EI); 435.2.
ПРИМЕР 50. 4-(2-Хлор-метилпиримидин-4-иламино)-2-хлорбензонитрил (Промежуточное соединение 26)

К раствору 2-хлор-5-метилпиримидин-4-амина (144 мг, 1.0 ммоль) в 1,4-диоксане (20 мл) добавляют 4-бром-2-хлорбензонитрил (217 мг, 1.0 ммоль), Cs2CO3 (1.3 г, 4.0 ммоль), Pd2(dba)3 (91 мг, 0.1 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xant Phos, 173 мг, 0.3 ммоль). Смесь нагревают при дефлегмации в течение 4 ч в атмосфере аргона. Твердые частицы отфильтровывают, и фильтрат отмывают физиологическим раствором (1×100 мл). Органический раствор сепарируют и высушивают (Na2SO4). Растворитель удаляют до 5 мл и добавляют гексан (100 мл), твердые частицы собирают путем фильтрации. Сырой продукт, нужное промежуточное соединение 26, используют для следующей реакции без дополнительной очистки.
ПРИМЕР 51. 4-(2-(4-(2-(пирролидин-1-ил)этокси)фениламино)-5-метилпиримидин-4-иламино)-2-хлорбензонитрил (Соединение XXVII)

К раствору описанного выше промежуточного соединения 26 (140 мг, 0.5 ммоль) в 1,4-диоксане (20 мл) добавляют 4-(2-(пирролидин-1-ил)этокси)бензоламин (113 мг, 0.55 ммоль), Cs2CO3 (660 мг, 2.0 ммоль), Pd2(dba)3 (46 мг, 0.05 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xant Phos, 87 мг, 0.15 ммоль). Смесь нагревают при дефлегмации в течение 4 ч в атмосфере аргона. Твердые частицы отфильтровывают, и фильтрат отмывают физиологическим раствором (1×50 мл). Органический раствор сепарируют и высушивают (Na2SO4). Растворитель удаляют в вакууме. Сырой продукт очищают при помощи HPLC с получением нужного соединения XXVII (11.5 мг, 5%) в виде желтого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): 1.89-1.92 (m, 2H), 1.98-2.05 (m, 2H), 2.20 (s, 3H), 3.08-3.13 (m, 2H), 3.56-3.59 (m. 4H), 4.36 (t, J=4.9 Hz, 2H), 7.03 (d, J=9.0 Hz, 2H), 7.40 (d, J=9.0 Hz, 2H), 7.87 (br, 1H), 7.92 (d, J=8.6 Hz, 1H), 8.03 (s, 1H), 8.16 (s, 1H), 9.82 (br, 1H), 10.37 (br, 1H), 10.90 (br, 1H). MS (EI): 449.1.
ПРИМЕР 52. N2-(4-(2-пирролидин-1-ил)этокси)фенил)-5-метил-N4-p-толуолпиримидин-2,4-диамин (Соединение XXVIII).

К раствору описанного выше промежуточного соединения 11 (50 мг, 0.16 ммоль) в 1,4-диоксане (20 мл) добавляют 1-бром-4-метилбензол (28 мг, 0.16 ммоль), Cs2CO3 (210 мг, 0.64 ммоль), Pd2(dba)3 (10 мг, 0.01 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xant Phos, 18 мг, 0.03 ммоль). Смесь нагревают при дефлегмации в течение 4 ч в атмосфере аргона. Твердые частицы отфильтровывают. Растворитель удаляют в вакууме. Сырой продукт очищают при помощи HPLC с получением нужного соединения XXVIII (15.7 мг, 6%) в виде желтого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): 1.85-1.89 (m, 2H), 1.96-2.01 (m, 2H), 2.12 (s, 3H), 2.31 (s, 2H), 3.04-3.08 (m, 2H), 3.51-3.55 (m, 4H), 4.32 (br, 2H), 6.89 (br, 2H), 7.18 (br, 2H), 7.31 (br, 2H), 7.41 (br, 2H), 7.84 (s, 1H), 9.71 (s, 1H), 10.46 (s, 1H), 11.13 (br, 1H). MS (EI): 404.2.
ПРИМЕР 53. N2-(4-(2-(пирролидин-1-ил)этокси)фенил)-N4-(4-хлор-3-метилфенил)-5-метилпиримидин-2,4-диамин (Соединение XXIX)

К раствору описанного выше промежуточного соединения 11 (80 мг, 0.25 ммоль) в 1,4-диоксане (20 мл) добавляют 4-бром-1-хлор-2-метилбензол (63 мг, 0.30 ммоль), Cs2CO3 (326 мг, 1.0 ммоль), Pd2(dba)3 (18 мг, 0.02 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xant Phos, 36 мг, 0.06 ммоль). Смесь нагревают при дефлегмации в течение 4 ч в атмосфере аргона. Твердые частицы отфильтровывают. Растворитель удаляют в вакууме. Сырой продукт очищают при помощи HPLC с получением нужного соединения XXIX (17.5 мг, 6%) в виде желтого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): 1.85-1.89 (m, 2H), 1.96-2.01 (m, 2H), 2.12 (s, 3H), 2.25 (s, 2H), 3.04-3.08 (m, 2H), 3.51-3.55 (m, 4H), 4.32 (br, 2H), 6.91 (br, 2H), 7.04 (br, 2H), 7.31 (br, 1H), 7.41 (br, 2H), 7.58 (s, 1H), 7.89 (br, 1H), 9.75 (s, 1H), 10.54 (s, 1H), 11.13 (br, 1H). MS (EI): 438.1.
ПРИМЕР 54. N-(4-(2-(пирролидин-1-ил)этокси)фенил)-4-бензил-5-метилпиримидин-2-амин (Соединение XXX)

К раствору 4-бензил-2-хлорпиримидина (286 мг, 1.4 ммоль) в 1,4-диоксане (20 мл) добавляют 4-(2-(пирролидин-1-ил)этокси)бензоламин (288 мг, 1.4 ммоль), Cs2CO3 (1.82 г, 5.6 ммоль), Pd2(dba)3 (92 мг, 0.1 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xant Phos, 173 мг, 0.3 ммоль). Смесь нагревают при дефлегмации в течение 4 ч в атмосфере аргона. Твердые частицы отфильтровывают. Растворитель удаляют в вакууме. Сырой продукт очищают при помощи HPLC с получением нужного соединения XXX (42 мг, 10%) в виде желтого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): 1.89 (br, 2H), 2.00 (br, 2H), 3.09 (br, 2H), 3.54 (br, 4H), 4.31 (br, 2H), 6.71 (d, J=5.0 Hz, 1H), 6.93 (d, J=8.8 Hz, 2H), 7.24 (m, 1H), 7.32 (m, 4H), 7.62 (d, J=8.8 Hz, 2H), 8.32 (d, J=5.0 Hz, 1H), 9.66 (s, 1H), 10.92 (br, 1H). MS (EI): 375.2.
ПРИМЕР 55. 4-((1Н-индол-4-ил)метил)-N-(4-(2-(пирролидин-1-ил)этокси)фенил)-5-метилпиримидин-2-амин (Соединение XXXI)

К раствору описанного выше промежуточного соединения 11 (460 мг, 1.46 ммоль) в 1,4-диоксане (20 мл) добавляют 4-бром-1H-хлор-2-индол (288 мг, 1.46 ммоль), Cs2CO3 (1.95 мг, 6.0 ммоль), Pd2(dba)3 (128 мг, 0.14 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xant Phos, 243 мг, 0.42 ммоль). Смесь нагревают при дефлегмации в течение ночи в атмосфере аргона. Твердые частицы отфильтровывают. Растворитель удаляют в вакууме. Сырой продукт очищают при помощи HPLC с получением нужного соединения XXXI (66 мг, 10%) в виде желтого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): 1.87 (br, 2H), 1.98-2.05 (m, 2H), 2.21 (s, 3Н), 3.15 (br, 2H), 3.52 (br, 2H), 3.69 (br, 2H), 4.24 (br, 2H), 6.33 (s, 1H), 6.60 (br, 2H), 6.82 (br, 1H), 6.92 (br, 1H), 7.02 (br, 2H), 7.16 (br, 1H), 7.26 (br, 1H), 7.43 (m, 1H), 7.88 (m, 1H), 10.11 (s, 1H). MS (EI): 429.1.
ПРИМЕР 56: 2-Хлор-5-метил-N-(наФтален-1-ил)пиримидин-4-амин {Промежуточное соединение 27)
К раствору 2-хлор-5-метилпиримидин-4-амина (144 мг, 1.0 ммоль) в 1,4-диоксане (40 мл) добавляют 1-бромнафтален (227 мг, 1.1 ммоль), Cs2CO3 (1.3 г, 4.0 ммоль), Pd2(dba)3 (91 мг, 0.1 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xant Phos, 183 мг, 0.3 ммоль). Смесь нагревают при дефлегмации в течение 4 ч в атмосфере аргона. Твердые частицы отфильтровывают и фильтрат отмывают физиологическим раствором (1×100 мл). Органический раствор сепарируют и высушивают (NaSO4). Растворитель удаляют до 5 мл и добавляют гексан (100 мл), твердые частицы собирают путем фильтрации. Сырой продукт, нужное промежуточное соединение 27, используют для следующей реакции без дополнительной очистки.
ПРИМЕР 57. N-(4-(2-(пирролидин-1-ил)этокси)фенил)-5-метил-4-(нафтален-1-ил)пиримидин-2-амин (Соединение XXXII)

К раствору описанного выше промежуточного соединения 27 (235 мг, 0.87 ммоль) в 1,4-диоксане (20 мл) добавляют 4-(2-(пирролидин-1-ил)этокси)бензоламин (183 мг, 0.87 ммоль), Cs2CO3 (1.3 мг, 4.0 ммоль), Pd2(dba)3 (46 мг, 0.05 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xant Phos, 87 мг, 0.15 ммоль). Смесь нагревают при дефлегмации в течение 4 ч в атмосфере аргона. Твердые частицы отфильтровывают, и фильтрат отмывают физиологическим раствором (1×50 мл). Органический раствор сепарируют и высушивают (Na2SO4). Растворитель удаляют в вакууме. Сырой продукт очищают при помощи HPLC с получением нужного соединения XXXII (89 мг, 21%) в виде желтого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): 1.88-1.90 (m, 2H), 1.97-2.03 (m, 2H), 2.30 (s, 3H), 3.03-3.08 (m, 2H), 3.56-3.53 (m, 4H), 4.21 (t, J=4.9 Hz, 2H), 6.50 (d, J=7.2 Hz, 2H), 6.82 (d, J=8.6 Hz, 2H), 7.54 (d, J=7.8 Hz, 2H), 7.57-7.61 (m, 1H), 7.63 (t, J=7.4 Hz, 1H), 7.89 (d, J=8.3 Hz, 2H), 7.95 (s, 1H), 8.02 (d, J=8.3 Hz, 1H), 8.08 (d, J=7.7 Hz, 1H), 10.37 (s, 1H), 10.43 (s, 1H), 10.93 (br, 1H). MS (EI): 440.1.
ПРИМЕР 58. 1-(2-Хлор-5-метилпиримидин-4-ил)изохинолин (Промежуточное соединение 28)

К раствору 2-хлор-5-метилпиримидин-4-амина (144 мг, 1.0 ммоль) в 1,4-диоксане (40 мл) добавляют 1-хлоризохинолин (164 мг, 1.0 ммоль), Cs2CO3 (1.3 г, 4.0 ммоль), Pd2(dba)3 (91 мг, 0.1 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xant Phos, 183 мг, 0.3 ммоль). Смесь нагревают при дефлегмации в течение 4 ч в атмосфере аргона. Твердые частицы отфильтровывают и фильтрат отмывают физиологическим раствором (1×100 мл). Органический раствор сепарируют и высушивают (NaSO4). Растворитель удаляют до 5 мл и добавляют гексан (100 мл), твердые частицы собирают путем фильтрации. Сырой продукт, нужное промежуточное соединение 28, используют для следующей реакции без дополнительной очистки.
ПРИМЕР 59. N-(4-(2-(пирролидин-1-ил)этокси)Фенил)-4-(изохинолин-1-ил)-5-метилпиримидин-2-амин (Соединение XXXIII)

К раствору описанного выше промежуточного соединения 28 (90 мг, 0.33 ммоль) в 1,4-диоксане (20 мл) добавляют 4-(2-(пирролидин-1-ил)этокси)бензоламин (76 мг, 0.37 ммоль), Cs2CO3 (391 мг, 1.2 ммоль), Pd2(dba)3 (28 мг, 0.03 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xant Phos, 52 мг, 0.09 ммоль). Смесь нагревают при дефлегмации в течение 4 ч в атмосфере аргона. Твердые частицы отфильтровывают, и фильтрат отмывают физиологическим раствором (1×50 мл). Органический раствор сепарируют и высушивают (Na2SO4). Растворитель удаляют в вакууме. Сырой продукт очищают при помощи HPLC с получением нужного соединения XXXIII (21 мг, 15%) в виде желтого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): 1.64-1.70 (m, 6H), 2.23 (s, 3Н), 2.78 (t, J=5.9 Hz, 2H), 4.04 (t, J=5.9 Hz, 2H), 6.38 (d, J=7.2 Hz, 1H), 6.93 (d, J=9.0 Hz, 2H), 6.97 (d, J=7.2 Hz, 1H), 7.45 (br, 1H), 7.57 (d, J=8.8 Hz, 1H), 7.58-7.62 (m, 1H), 7.70-7.78 (m, 2H), 8.04 (s, 1H), 8.75 (d, J=8.1 Hz, 1H), 9.06 (s, 1H), 9.19 (s, 1H). MS (EI): 441.2.
ПРИМЕР 60. N2-(4-(2-(пирролидин-1-ил)этокси)фенил-N4-(3-(трифторметил)фенил)-5-метилпиримидин-2,4-диамин (Соединение XXXIV)

Смесь 2-хлор-5-метил-пиримидин-4-иламина (143 мг, 1.0 ммоль), 1-бром-3-(трифторметил)бензол (225 мг, 1.0 ммоль), Pd2(dba)3 (9.0 мг, 0.01 ммоль), Xantphos (12 мг, 0.02 ммоль) и карбоната цезия (650 мг, 2.0 ммоль) суспендируют в диоксане (15 мл) и нагревают при дефлегмации в атмосфере аргона в течение 15 ч. Реакционную смесь охлаждают до комнатной температуры и разводят DMC (30 мл). Смесь фильтруют и фильтрат концентрируют в вакууме. Очищение осадка при помощи HPLC приводит к получению N4-(3-(трифторметил)фенил)-5-метилпиримидин-2,4-диамина в виде грязно-белого твердого вещества (192 мг, 67%). MS (ESI+): m/z 288 (М+Н)+. Смесь N4-(3-(трифторметил)фенил)-5-метилпиримидин-2,4-диамина (28.7 мг, 0.1 ммоль) и 4-(2-(пирролидин-1-ил)этокси)бензоламин (22 мг, 0.12 ммоль) растворяют в уксусной кислоте (5 мл) и нагревают в микроволновой печи до 150°С в течение 10 минут. Смесь охлаждают до комнатной температуры и уксусную кислоту удаляют при пониженном давлении. Осадок очищают при помощи HPLC с получением нужного соединения XXXIV в виде твердого коричневого вещества (16 мг, 35%).
1H-NMR (500 MHz, DMSO-d6): 1.65-1.71 (m, 4H), 2.11 (s, 3H), 2.45-2.55 (m, 4H), 2.74 (t, J=6.0 Hz, 2H), 3.98 (d, J=6.0 Hz, 2H), 6.76 (d, J=9.0 Hz, 2H), 7.35 (d, J=5.1 Hz, 1H), 7.45-7.57 (m, 3H), 7.9-7.97 (m, 2H), 8.20 (d, J=7.6 Hz, 1H), 8.41 (s, 1H), 8.85 (s, 1H), m/z 458 (M+H)+.
ПРИМЕР 61. 2-Хлор-N-(4-(трифторметил)фенил)-5-метилпиримидин-4-амин (Промежуточное соединение 29)

Суспензию 2-хлор-5-метилпиримидин-4-амина (159 мкл, 1.2 ммоль), 1-бром-4-(трифторметил)бензол (150 мг, 1.0 ммоль), tert-бутоксид, калия (224 мг, 2.0 ммоль), Xantphos (120 мг, 0.2 ммоль) и ацетат палладия (26 мг, 0.1 ммоль) помещают в пробирку для микроволновой печи и облучают при 160°С в течение 15 минут. Смесь оставляют охлаждаться до комнатной температуры, твердые частицы отфильтровывают с использованием DMC для промывания, а раствор концентрируют при пониженном давлении. Осадок очищают при помощи флэш-хроматографии на колонке с силикагелем (гексан к EtOAc) с получением нужного промежуточного соединения 29 (128.7 мг, 43%) в виде твердого белого вещества. MS (ESI+): m/z 288 (М+Н)+.
ПРИМЕР 62: N2-(4-(2-(пирролидин-1-ил)этокси)фенил)-N4-(4-(трифторметил)фенил)-5-метилпиримидин-2,4-диамин (Соединение XXXV)
Смесь описанных выше промежуточных соединений 29 (128 мг, 0.5 ммоль) и 6 (212 мг, 1.0 ммоль) суспендируют в уксусной кислоте (5 мл) и нагревают до 75°С в течение 18 ч. Смесь оставляют охлаждаться до комнатной температуры и уксусную кислоту удаляют при пониженном давлении. Осадок превращают в основание при помощи насыщенного, водного NaHCO3 (50 мл) и экстрагируют DCM (2×50 мл). Органический слой концентрируют в вакууме и сырой продукт очищают при помощи флэш-хроматографии с обращенной фазой на С18 (вода к CH3CN, 0.1% TFA). Водные фракции нейтрализуют насыщенным водным NaHCO3 и экстрагируют EtOAc. Органическую фазу концентрируют в вакууме и осадок поглощают DCM. Добавляют НС1 в диоксане вместе с эфиром и полученные твердые частицы отфильтровывают с получением хлористовод сродной соли нужного соединения XXXV (166 мг, 70%) в виде серого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): 1.80-1.95 (m, 2H), 1.95-2.10 (m, 2H), 2.19 (s, 3H), 3.05-3.20 (m, 2H), 3.55-3.65 (m, 6H), 4.33 (t, J=4.7 Hz, 2H), 6.97 (d, J=8.7 Hz, 2H), 7.34 (d, J=8.8 Hz, 2H), 7.73 (d, J=8.5 Hz, 2H), 7.83 (d, J=8.0 Hz, 2H), 7.94 (s, 1H), 9.92 (br s, 1H), 10.44 (br s, 1H), 10.85 (br s, 1H): MS (ESI+): m/z 458.5 (M+H)+.
ПРИМЕР 63. Бензо[1,3]диоксол-4-ил(2-хлор-5-метил-пиримидин-4-ил)-амин (Промежуточное соединение 30).

Смесь 2-хлор-5-метил-пиримидин-4-иламина (1.4 г, 9.7 ммоль), 4-бром-бензо[1,3]диоксола (2.0 г, 10 ммоль), Pd2(dba)3 (0.80 г, 0.87 ммоль), Xantphos (1.0 г, 1.7 ммоль) и карбоната цезия (6.3 г, 19 ммоль) суспендируют в диоксане (40 мл) и нагревают при дефлегмации в атмосфере аргона в течение 5 ч. Реакционную смесь охлаждают до комнатной температуры и разводят DCM (30 мл). Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок очищают при помощи флэш-хроматографии на колонке с силикагелем (гексаны к 50% EtOAc/гексаны) с получением нужного соединения (1.0 г, 39%) в виде твердого белого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 2.13 (s, 3Н), 5.99 (s, 2H), 6.80-6.90 (m, 3Н), 8.01 (s, 1H), 8.92 (s, 1H): m/z 264 (M+H)+.
ПРИМЕР 64. N4-Бензо[1,3]диоксол-4-ил-5-метил-N2-[4-(2-пирролидин-1-ил-этокси)-фенил]-пиримидин-2,4-диамин (Соединение XXXVI)

Смесь описанного выше промежуточного соединения 30 (0.25 г, 0.95 ммоль) и 4-(2-пирролидин-1-ил-этокси)-фениламина (0.40 г, 1.9 ммоль) суспендируют в уксусной кислоте (15 мл) и нагревают до 100°С в течение 20 ч. Смесь охлаждают до комнатной температуры и уксусную кислоту удаляют при пониженном давлении. Осадок поглощают водой (20 мл) и нейтрализуют до рН ~7 10% раствором NaOH. Полученный раствор экстрагируют EtOAc (2×30 мл) и органический слой сепарируют. Органический слой отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют в вакууме и сырой продукт очищают при помощи флэш-хроматографии на колонке с силикагелем (DCM к 20% MeOH/DCM) с получением нужного соединения XXXVI (0.14 г, 34%) в виде твердого белого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 1,65-1.75 (m, 4H), 2.06 (s, 3Н), 2.55-2.65 (m, 4H), 2.78-2.88 (m, 2H), 3.98 (t, J=5.8 Hz, 2H), 5.89 (s, 2H), 6.65 (d. J=9.0 Hz, 2H), 6.79-6.84 (m, 2H), 6.89 (dd, J=7.7. 1.7 Hz, 1H), 7.45 (d, J=9.1 Hz, 2H), 7.81 (s, 1H), 8.23 (s, 1H), 8.73 (s, 1H); MS (ESI+): m/z 434 (M+H)+.
ПРИМЕР 65. N4-Бензо[1,3]диоксол-4-ил-5-метил-N2-[4-(4-метил-пиперазин-1-ил)-фенил]-пиримидин-2,4-диамин (Соединение XXXVII)

Смесь промежуточного соединения 30 (0.10 г, 0.38 ммоль) и 4-(4-метил-пиперазин-1-ил)-фениламина (0.12 г, 0.51 ммоль) в уксусной кислоте (3 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 150°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и смесь концентрируют. Осадок поглощают водой (20 мл) и смесь нейтрализуют 10% раствором NaOH до тех пор, пока не произойдет преципитация твердых частиц. Твердые частицы отфильтровывают и затем очищают при помощи флэш-хроматографии на колонке с силикагелем (DCM к 15% MeOH/DCM) с получением нужного соединения (22 мг, 14%) в виде светло-красного твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 2.06 (s, 3Н), 2.06 (s, 3H), 2.21 (s, 3H), 2.44 (t, J=4.8 Hz, 4H), 2.97 (t, J=4.9 Hz, 4H), 5.89 (s, 2H), 6.67 (d, J=9.1 Hz, 2H), 6.80-6.86 (m, 2H), 6.91 (dd, J=7.6, 1.7 Hz, 1H), 7.41 (d, J=9.0 Hz, 2H), 7.79 (s, 1H), 8.17 (s, 1H), 8.63 (s, 1H); MS (ESI+): m/z 419 (M+H)+.
ПРИМЕР 66. (4-Хлор-3-метокси-фенил)-(2-хлор-5-метил-пиримидин-4-ил)амин (Промежуточное соединение 31)

Смесь 2-хлор-5-метил-пиримидин-4-иламина (1.50 г, 3.5 ммоль), 4-бром-1-хлор-2-метокси-бензол (0.65 мл, 4.8 ммоль), Pd2(dba)3 (0.17 г, 0.19 ммоль), Xantphos (0.22 г, 0.38 ммоль) и карбоната цезия (2.3 г, 7.1 ммоль) суспендируют в диоксане (20 мл) и нагревают при дефлегмации в атмосфере аргона в течение 5 ч. Реакционную смесь охлаждают до комнатной температуры и разводят DCM (30 мл). Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок очищают при помощи флэш-хроматографии на колонке с силикагелем (гексаны к 40% EtOAc/гексаны) с получением нужного соединения (0.55 г, 55%) в виде твердого желтого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 2.18 (s, 3H), 3.85 (s, 3H), 7.35 (dd, J=8.6, 2.3 Hz, 1H), 7.39 (d, J=8.7 Hz, 1H), 7.56 (d, J=2.3 Hz, 1H), 8.09 (d, J=0.9 Hz, 1H), 8.91 (s, 1H); MS (ESI+): m/z 419 (M+H)+.
ПРИМЕР 67. N4-(4-Хлор-3-метокси-фенил)-5-метил-N2-(4-пиразол-1-илметил-фенил)-пиримидин-2,4-диамин (Соединение XXXVIII)

Суспензию промежуточного соединения 31 (0.20 г, 0.70 ммоль), 4-пиразол-!-илметил-фениламина (0.14 г, 0.81 ммоль), Pd2(dba)3 (40 мг, 0.044 ммоль), Xantphos (50 мг, 0.086 ммоль) и карбоната цезия (0.50 г, 1.5 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки, полученную смесь фильтруют и отфильтрованные твердые частицы отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи HPLC. Фракции объединяют и вливают в насыщенный раствор NaHCO3 (40 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и полученные твердые частицы растворяют в минимальном количестве EtOAc и добавляют гексан до тех пор, пока не произойдет преципитация твердых частиц. После фильтрации получают нужное соединение в виде грязно-белого вещества (0.13 г, 44%).
1H-NMR (500 MHz, DMSO-d6): δ 2.11 (s, 3H), 3.74 (s, 3H), 5.22 (s, 2H), 6.25 (t, J=2.1 Hz, 1H), 7.08 (d, J=8.6 Hz, 2H), 7.27 (d, J=9.3 Hz, 1H), 7.40-7.45 (m, 3H), 7.60 (d, J=8.6 Hz, 2H), 7.75 (d, J=1.8 Hz, 1H), 7.91 (s, 1H), 8.36 (s. 1H), 9.04 (s, 1H); MS (ESI+): m/z 421 (M+H)+.
ПРИМЕР 68. 5-Метил-N2-[4-(4-метил-пиперазин-1-ил-фенил]пиримидин-2,4-диамин (Промежуточное соединение 23)
Смесь 2-хлор-5-метил-пиримидин-4-иламина (1.0 г, 6.9 ммоль) и 4-(4-метил-пиперазин-1-ил)-фениламина (1.5 мл, 7.8 ммоль) в уксусной кислоте (15 мл) нагревают до 100°С в течение 2.5 ч. Смесь оставляют охлаждаться при комнатной температуре и уксусную кислоту удаляют при пониженном давлении. Осадок помещают в воду (20 мл) и смесь нейтрализуют 10% раствором NaOH до тех пор, пока не произойдет преципитация твердых частиц. После фильтрации и отмывания водой, получают нужное соединение в виде серого твердого вещества (1.3 г, 63%).
1H-NMR (500 MHz, DMSO-d6): δ 1.88 (s, 3Н), 2.21 (s, 3H), 2.21 (s, 3H), 2.44 (t, J=4.8 Hz, 4H), 3.00 (d, J=4.8 Hz, 4H), 6.27 (s, 2H), 6.79 (d, J=9.0 Hz, 2H), 7.57 (d, J=9.0 Hz, 2H), 7.63 (s, 1H), 8.42 (s, 1H). MS (ESI+): m/z 299 (M+H)+.
ПРИМЕР 60. N4-(4-Хлор-3-метокси-фенил)-5-метил-N2-[4-(4-метил-пиперазин-1-ил)-фенил]-пиримидин-2,4-диамин (Соединение XXXIX)

Суспензию промежуточного соединения 32 (0.30 г, 1.0 ммоль), 4-бром-1-хлор-2-метокси-бензола (0.20 мл, 1.5 ммоль), Pd2(dba)3 (50 мг, 0.055 ммоль), Xantphos (65 мг, 0.11 ммоль) и карбоната цезия (0.70 г, 2.1 ммоль) в диоксане/DMF (3/1, 8 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки, полученную смесь фильтруют и отфильтрованные твердые частицы отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи HPLC. Фракции объединяют и вливают в насыщенный раствор NaHCO3 (40 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и осадок измельчают в порошок со смесью EtOAc/гексаны (1/5, 30 мл). После фильтрации получают нужное соединение в виде грязно-белого вещества (0.20 г, 46%).
1H-NMR (500 MHz, DMSO-d6): δ 2.09 (s, 3Н), 2.21 (s, 3Н), 2.45 (t, J=4.9 Hz, 4H), 3.02 (t, J=4.9 Hz, 4H), 3.73 (s, 3Н), 6.79 (d, J=9.1 Hz, 2H), 7.27 (d, J=8.6 Hz, 1H), 7.42-7.47 (m, 3Н), 7.49 (d, J=2.3 Hz, 1H), 7.86 (s, 1H), 8.28 (s, 1H), 8.72 (s, 1H); MS (ESI+): m/z 439 (M+H)+.
ПРИМЕР 70. N4-(4-Хлор-3-метокси-фенил)-5-метил-N2-(4-морфолин-4-ил-фенил)-пиримидин-2,4-диамин (Соединение XL)

Смесь промежуточного соединения 31 (0.10 г, 0.35 ммоль) и 4-морфолин-4-ил-фениламина (80 мг, 0.45 ммоль) в уксусной кислоте (3 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и смесь концентрируют. Осадок поглощают водой (20 мл) и смесь нейтрализуют 10% раствором NaOH до тех пор, пока не произойдет преципитация твердых частиц. Твердые частицы отфильтровывают и затем очищают при помощи флэш-хроматографии на колонке с силикагелем (DCM к 10% MeOH/DCM) с получением нужного соединения (55 мг, 37%) в виде светло-коричневого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 2.10 (s, 3Н), 3.00 (t, J=4.8 Hz, 4H), 3.71-3.76 (m, 7H), 6.80 (d, J=9.0 Hz, 2H), 7.28 (d, J=8.6 Hz, 1H), 7.45 (dd, J=8.7, 2.2 Hz, 1H), 7.47-7.50 (m, 3Н), 7.87 (s, 1H), 8.29 (s, 1H), 8.75 (s, 1H). MS (ESI+): m/z 426 (M+H)+.
ПРИМЕР 71. N4-(4-Хлор-3-метокси-фенил)-5-метил-N2-(4-пиразол-1-ил-фенил)-пиримидин-2,4-диамин (Соединение XLI)

Смесь промежуточного соединения 31 (90 мг, 0.32 ммоль) и 4-пиразол-1-ил-фениламина (70 мг, 0.44 ммоль) в уксусной кислоте (3 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и смесь концентрируют. Осадок поглощают водой (20 мл) и смесь нейтрализуют 10% раствором NaOH до тех пор, пока не произойдет преципитация твердых частиц. Твердые частицы отфильтровывают и затем очищают при помощи HPLC. Нужные фракции объединяют и концентрируют с получением нужного соединения (40 г соли TFA, 24%) в виде твердого белого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 2.17 (s, 3H), 3.75 (s, 3H), 6.54 (t, J=1.9 Hz, 1H), 7.30 (d, J=6.6 Hz, 1H), 7.39 (d, J=2.1 Hz, 1H), 7.40 (d, J=8.6 Hz, 1H), 7.59 (d, J=8.9 Hz, 2H), 7.71 (d, J=8.9 Hz, 2H), 7.73 (d, J=1.6 Hz, 1H), 7.93 (s, 1H), 8.41 (d, J=2.5 Hz, 1H), 9.41 (s, 1H), 10.05 (s, 1H). MS (ESI+): m/z 407 (M+H)+.
ПРИМЕР 72. N4-(4-Хлор-3-метокси-фенил)-5-метил-N2-(4-пиперидин-1-ил-фенил)-пиримидин-2,4-диамин (Соединение XLII)

Смесь промежуточного соединения 31 (0.11 г, 0.39 ммоль) и 4-пиперидин-1-ил-фениламина (90 мг, 0.51 ммоль) в уксусной кислоте (3 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и смесь концентрируют. Осадок поглощают водой (20 мл) и смесь нейтрализуют 10% раствором NaOH до тех пор, пока не произойдет преципитация твердых частиц. Твердые частицы отфильтровывают и затем очищают при помощи флэш-хроматографии на колонке с силикагелем (гексаны к 70% EtOAc/гексаны) с получением нужного соединения (10 мг, 6%) в виде светло-коричневого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 1.48-1.53 (m, 2H), 1.59-1.65 (m, 4H), 2.09 (s, 3H), 3.00 (t, J=5.4 Hz, 4H), 3.73 (s, 3H), 6.78 (d, J=9.0 Hz, 2H), 7.27 (d, J=8.7 Hz, 1H), 7.40-7.47 (m, 3H), 7.50 (d, J=2.2 Hz, 1H), 7.86 (s, 1H), 8.28 (s, 1H), 8.71 (s, 1H). MS (ESI+): m/z 424 (M+H)+.
ПРИМЕР 73. N4-[(4-Хлор-3-метокси-фенил)-5-метил-N2-[4-(4-метил-пиперазин-1-илметил)-фенил]-пиримидин-2,4-диамин (Соединение XLIII)

Суспензию промежуточного соединения 31 (50 мг, 0.18 ммоль), 4-(4-метил-пиперазин-1-илметил)-фениламина (50 мг, 0.24 ммоль), Pd2(dba)3 (10 мг, 0.011 ммоль), Xantphos (13 мг, 0.022 ммоль) и карбоната цезия (0.12 г, 0.37 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки, полученную смесь фильтруют и отфильтрованные твердые частицы отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи флэш-хроматографии на колонке с силикагелем (DCM к 10% MeOH/DCM) с получением нужного соединения (35 мг, 44%) в виде грязно-белого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 2.11 (s, 3H), 2.15 (s, 3H), 2.20-2.45 (m, 8H), 3.35 (s, 2H), 3.75 (s, 3H), 7.07 (d, J=8.5 Hz, 2H), 7.28 (d. J=8.5 Hz, 1H), 7.44 (dd, J=8.7, 2.3 Hz, 1H), 7.47 (d. J=2.3 Hz, 1H), 7.57 (d, J=8.5 Hz, 2H), 7.91 (s, 1H), 8.36 (s, 1H), 8.98 (s, 1H); MS (ESI+): m/z 453 (M+H)+.
ПРИМЕР 74. N4-[(4-Хлор-3-метокси-фенил)-5-метил-N2-(4-пиперазин-1-ил-фенил)-фенил]-пиримидин-2,4-диамин (Соединение XLIV)

Суспензию промежуточного соединения 31 (0.20 г, 0.70 ммоль), tert-бутилового сложного эфира 4-(4-амино-фенил)-пиперазин-1-карбоновой кислоты (0.22 г, 0.79 ммоль), в уксусной кислоте (4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 150°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и смесь концентрируют. Осадок очищают при помощи HPLC и нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (40 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и полученные твердые частицы растворяют в минимальном количестве EtOAc и добавляют гексаны до тех пор, пока не произойдет преципитация твердых частиц. После фильтрации получают нужное соединение в виде грязно-белого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 2.10 (s, 3H), 3.16 (s, 8H), 3.73 (s, 3H), 6.83 (d, J=9.0 Hz, 2H), 7.29 (d, J=8.8 Hz, 1H), 7.44 (dd, J=8.7, 2.1 Hz, 1H), 7.49-7.52 (m, 3H), 7.88 (s, 1H), 8.32 (s, 1H), 8.81 (s, 1H). MS (ESI+): m/z 425 (M+H)+.
ПРИМЕР 75. N-tert-Бутил-3-{5-метил-2-[4-(4-метил-пиперазин-1-ил)-фениламино]-пиримидин-4-иламино}-бензолсульфонамид (Соединение XLV)

Суспензию промежуточного соединения 32 (0.3 0 г, 1.0 ммоль), 3-бром-N-tert-бутил-бензолсульфонамида (0.35 г, 1.2 ммоль), Pd2(dba)3 (60 мг, 0.066 ммоль), Xantphos (70 мг, 0.12 ммоль) и карбоната цезия (0.70 г, 2.1 ммоль) в диоксане/DMF (3/1, 8 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки, полученную смесь фильтруют и отфильтрованные твердые частицы отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (40 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и осадок измельчают в порошок со смесью EtOAc/гексаны (1/7, 40 мл). После фильтрации, нужное соединение получают в виде грязно-белого твердого вещества (0.30 г, 59%).
1H-NMR (500 MHz, DMSO-d6): δ 1.12 (s, 9H), 2.11 (s, 3Н), 2.22 (s, 3H), 2.45 (t, J=4.7 Hz, 4H), 3.02 (t, J=4.8 Hz, 4H), 6.81 (d, J=9.1 Hz, 2H), 7.45-7.52 (m, 4H), 7.56 (s, 1H), 7.89 (s, 1H), 8.10-8.16 (m, 2H), 8.51 (s, 1H), 8.70 (s, 1H); MS (ESI+): m/z 510 (M+H)+.
ПРИМЕР 76: N-tert-Бутил-3-(2-хлор-5-метил-пиримидин-4-иламино)-бензолсульфонамид (Промежуточное соединение 33)

Смесь 2-хлор-5-метил-пиримидин-4-иламина (0.4 г, 2.8 ммоль), 3-бром-N-tert-бензолсульфонамида (1.0 г, 3.4 ммоль), Pd2(dba)3 (0.17 г, 0.19 ммоль), Xantphos (0.2 г, 3.5 ммоль) и карбоната цезия (2.0 г, 6.1 ммоль) суспендируют в диоксане (25 мл) и нагревают при дефлегмации в атмосфере аргона в течение 3 ч. Реакционную смесь охлаждают до комнатной температуры и разводят DCM (30 мл). Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок растворяют в EtOAc и добавляют гексаны, до тех пор, пока не произойдет преципитация твердых частиц. После фильтрации получают нужное соединение (1.2 г, 98%) в виде светло-желтого твердого вещества. Его используют на следующем этапе синтеза без дополнительной очистки. MS (ESI+): m/z 355 (М+Н)+.
ПРИМЕР 77. N-tert-Бутил-3-[5-метил-2-(4-морфолин-4-илметил-фениламино)-пиримидин-4-иламино1-бензолсульфонамид (Соединение XLVI)

Смесь промежуточного соединения 33 (0.50 г, 1.4 ммоль), 4-морфолин-4-илметил-фениламина (0.35 г, 1.8 ммоль), Pd2(dba)3 (0.10 г, 0.11 ммоль), Xantphos (0.12 г, 0.21 ммоль) и карбоната цезия (1.0 г, 3.1 ммоль) суспендируют в диоксане (25 мл) и нагревают при дефлегмации в атмосфере аргона в течение 3 ч. Реакционную смесь охлаждают до комнатной температуры и разводят DCM (30 мл). Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок очищают при помощи HPLC, нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (50 мл). Объединенные водные слои экстрагируют EtOAc (2×50 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют, а полученное твердое вещество растворяют в минимальном количестве EtOAc и добавляют гексаны до тех пор, пока не произойдет преципитация твердых частиц. После фильтрации получают нужное соединение в виде грязно-белого вещества (0.23 г, 31%).
1H-NMR (500 MHz, DMSO-d6): δ 1.12 (s, 9H), 2.13 (s, 3H), 2.28-2.34 (m, 4H), 3.35 (s, 2H), 3.55 (t, J=4.8 Hz, 4H), 7.10 (d, J=8.5 Hz, 2H), 7.45-7.52 (m, 2H), 7.57 (s, 1H), 7.59 (d, J=8.5 Hz, 2H), 7.94 (s, 1H), 8.10 (s, 1H), 8.13-8.16 (m, 1H), 8.58 (s, 1H), 8.95 (s, 1H). MS (ESI+): m/z 511 (M+H)+.
ПРИМЕР 78. N-tert-Бутил-3-{5-метил-2-[4-(4-окси-морфолин-4-илметил)-фениламино]-пиримидин-4-иламино}-бензолсульфонамид (Соединение XLVII)

Раствор описанного выше соединения XLVI (30 мг, 0.06 ммоль) и 3-хлорбензойной кислоты (77%, 14 мг, 0.06 ммоль) в хлороформе (30 мл) перемешивают при комнатной температуре в течение 1 ч. Растворитель удаляют путем вращения с выпариванием, а полученную смесь очищают на колонке с силикагелем с 20% СН3ОН/CHCl3 в качестве элюента с получением нужного соединения в виде грязно-белого твердого вещества (15 мг, 48%).
1H-NMR (500 MHz, DMSO-d6): δ 1.12 (s, 9H), 2.14 (s, 3H), 2.71 (d, J=10.9 Hz, 2H), 3.63 (d, J=9.9 Hz, 2H), 4.08 (t, J=11.6 Hz, 2H), 4.28 (s, 2H), 7.38 (d, J=8.5 Hz, 2H), 7.50 (d, J=5.0 Hz, 2H), 7.61 (s, 1H), 7.66 (d, J=8.5 Hz, 2H), 7.96 (s, 1H), 8.13 (m, 2H), 8.63 (s, 1H), 9.13 (s, 1H). MS (ESI+): m/z 527 (M+H)+.
ПРИМЕР 79. N-tert-Бутил-3-[5-метил-2-(4-пиразол-1-ил-фениламино)-пиримидин-4-иламино]-бензолсульфонамид (Соединение XLVIII)

Суспензию промежуточного соединения 33 (0,10 г, 0.28 ммоль) и 4-пиразол-1-ил-фениламина (50 мг, 0.31 ммоль) в уксусной кислоте помещают в пробирку для микроволновой печи и облучают микроволнами при 130°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и концентрируют полученную смесь. Осадок поглощают водой (20 мл) и нейтрализуют 10% раствором NaOH до преципитации твердых частиц. Коричневые твердые частицы отфильтровывают и затем очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и полученное твердое вещество растворяют в минимальном количестве EtOAc, после чего добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде белого твердого вещества (15 мг, 11%).
1H-NMR (500 MHz, DMSO-d6): δ 1.12 (s, 9H), 2.15 (s, 3H), 6.49 (t, J=2.2 Hz, 1H), 7.50-7.55 (m, 2H), 7.58 (s, 1H), 7.62 (d, J=9.1 Hz, 2H), 7.68 (d, J=1.3 Hz, 1H), 7.77 (d, J=9.1 Hz, 2H), 7.96 (s, 1H), 8.11 (s, 1H), 8.13-8.16 (m, 1H), 8.33 (d, J=2.5 Hz, 1H), 8.64 (s, 1H), 9.17 (s, 1H). MS (ESI+): m/z 478 (M+H)+.
ПРИМЕР 80. N-tert-Бутил-3-[5-метил-2-(6-пиперазин-1-ил-пиридин-3-иламино)-пиримидин-4-иламино]-бензолсульфонамид (Соединение XLIX)

Смесь промежуточного соединения 33 (0.10 г, 0.28 ммоль) и tert-бутилового сложного эфира 4-(5-амино-пиридин-2-ил)-пиперазин-1-карбоновой кислоты (90 мг, 0.32 ммоль) в уксусной кислоте (3 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 130°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и смесь концентрируют. Осадок растворяют в DCM (5 мл) и добавляют 30% TFA/DCM. Смесь перемешивают при комнатной температуре в течение 1 ч, концентрируют и осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Комбинированные водные слои экстрагируют EtOAc (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и полученное твердое вещество растворяют в минимальном количестве EtOAc, после чего добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде белого твердого вещества (10 мг, 7%).
1H-NMR (500 MHz, DMSO-d6): δ 1.12 (s, 9H), 2.11 (s, 3H), 2.83 (t, J=5.0 Hz, 4H), 3.28-3.33 (m, 4H), 6.73 (d, J=9.1 Hz, 1H), 7.40-7.49 (m, 2H), 7.57 (s, 1H), 7.86 (dd, J=9.1, 2.7 Hz, 1H), 7.88 (s, 1H), 8.10-8.16 (m, 2H), 8.28 (d, J=2.5 Hz, 1H), 8.53 (s, 1H), 8.72 (s, 1H). MS (ESI+): m/z 497 (M+H)+.
ПРИМЕР 81. N-tert-Бутил-3-[5-метил-2-(4-пиразол-1-илметил-фениламина)-пиримидин-4-иламино]-бензолсульфонамид (Соединение L)

Суспензию промежуточного соединения 33 (0.10 г, 0.28 ммоль) и 4-пиразол-1-илметил-фениламина (50 мг, 0.29 ммоль) в уксусной кислоте (3 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 130°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и концентрируют полученную смесь. Осадок очищают при помощи HPLC и нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и полученное твердое вещество растворяют в минимальном количестве EtOAc, после чего добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде белого твердого вещества (15 мг, 9%).
1H-NMR (500 MHz, DMSO-d6): δ 1.12 (s, 9H), 2.13 (s, 3H), 5.21 (s, 2H), 6.24 (t, J=1.9 Hz, 1H), 7.08 (d, J=8.5 Hz, 2H), 7.27-7.50 (m, 3H), 7.56 (s, 1H), 7.60 (d, J=8.4 Hz, 2H), 7.75 (d, J=2.1 Hz, 1H), 7.94 (s, 1H), 8.14 (d, J=7.9 Hz, 1H), 8.59 (s, 1H), 9.01 (s, 1H). MS (ESI+): m/z 492 (M+H)+.
ПРИМЕР 82. 5-Метил-N2-[3-(пиперидин-1-сульфонил)-фенил]-пиримидин-2,4-диамин (Промежуточное соединение 34)

Смесь 2-хлор-5-метил-пиримидин-4-иламина(0.25 г, 1.74 ммоль) и 3-(пиперидин-1-сульфонил)-фениламина (0.50 г, 2.1 ммоль) в уксусной кислоте (4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 130°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и концентрируют полученную смесь. Осадок поглощают водой (20 мл) и доводят рН смеси приблизительно до 9 при помощи 10% раствора NaOH. Полученный раствор экстрагируют EtOAc (2×30 мл) и органический слой сепарируют. Объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют в вакууме и сырой продукт (~0.6 г) используют на следующем этапе синтеза без дополнительной очистки. MS (ESI+): m/z 348 (М+Н)+.
ПРИМЕР 83. N-tert-Бутил-3-{5-метил-2-Г3-(пиперидин-1-сульфонил)-фениламино]-пиримидин-4-иламино}-бензолсульфонамид (Соединение LI)

Суспензию промежуточного соединения 34 (0.10 г, 0.29 ммоль), 3-бром-N-tert-бутил-бензолсульфонамида (84 мг, 0.29 ммоль), Pd2(dba)3 (15 мг, 0.016 ммоль), Xantphos (20 мг, 0.035 ммоль) и карбоната цезия (0.18 г, 0.55 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки, полученную смесь фильтруют и отфильтрованные твердые частицы отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи HPLC. Фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и осадок растворяют в минимальном количестве EtOAc, после чего добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде белого твердого вещества (20 мг, 12%).
1H-NMR (500 MHz, DMSO-d6): δ 1.12 (s, 9H), 1.30-1.40 (m, 2H), 1.50-1.56 (m, 4H), 2.16 (s, 3H), 2.88 (t, J=5.3 Hz, 4H), 7.17 (d, J=7.8 Hz, 1H), 7.43 (t, J=8.0 Hz, 1H), 7.59-7.60 (m, 2H), 7.58 (s, 1H), 8.13 (s, 1H), 7.16 (dd, J=7.9, 1.9 Hz, 1H), 8.18-8.22 (m, 1H), 8.67 (s, 1H), 9.37 (s, 1H). MS (ESI+): m/z 559 (M+H)+.
ПРИМЕР 84. N-tert-Бутил-3-{5-метил-2-[4-(4-метил-пиперазин-1-илметил)-фениламино]-пиримидин-4-иламино}-бензолсульфонамид (Соединение LII)

Суспензию промежуточного соединения 33 (0.10 г, 0.28 ммоль), 4-(4-метил-пиперазин-1-илметил)-фениламин (65 мг, 0.32 ммоль), Pd2(dba)3 (20 мг, 0.022 ммоль), Xantphos (25 мг, 0.043 ммоль) и карбоната цезия (0.18 г, 0.55 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 170°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки, полученную смесь фильтруют и отфильтрованные твердые частицы отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи HPLC. Фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и осадок растворяют в минимальном количестве EtOAc, после чего добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде белого твердого вещества (53 мг, 36%).
1H-NMR (500 MHz, DMSO-d6): δ 1.12 (s, 9H), 2.13 (s, 3H), 2.15 (s, 3H), 2.20-2.45 (m, 4H). 3.25-3.40 (m, 6H), 7.08 (d, J=8.6 Hz, 2H), 7.45-7.52 (m, 2H), 7.56 (s, 1H), 7.57 (d, J=8.6 Hz, 2H), 7.94 (s, 1H), 8.09 (s, 1H), 8.13-8.26 (m, 1H), 8.58 (s, 1H), 8.94 (s, 1H). MS (ESI+): m/z 524 (M+H)+.
ПРИМЕР 85. N-tert-Бутил-3-[5-метил-2-[4-пиперазин-1-ил-3-трифторметил-фениламино)-пиримидин-4-иламино1-бензолсульфонамид (Соединение LIII)

Смесь промежуточного соединения 33 (0.10 г, 0.28 ммоль), tert-бутилового сложного эфира 4-(4-амино-2-трифторметил-фенил)-пиперазин-1-карбоновой кислоты (0.1 г, 0.29 ммоль), Pd2(dba)3 (20 мг, 0.022 ммоль), Xantphos (25 мг, 0.043 ммоль) и карбоната цезия (0.18 г, 0.55 ммоль) в диоксане/DMF (3/1,4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 170°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки, полученную смесь фильтруют. Отфильтрованные твердые частицы отмывают DCM и фильтрат концентрируют. Осадок растворяют в DCM (5 мл) и добавляют 50% TFA/DCM (6 мл). Смесь перемешивают при комнатной температуре в течение 2 ч, концентрируют и осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и осадок растворяют в минимальном количестве EtOAc, после чего добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде белого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 1.12 (s, 9H), 2.14 (s, 3H), 2.70-2.75 (m, 4H), 2.80-2.85 (m, 4H), 7.36 (d, J=8.5 Hz, 2H), 7.45-7.52 (m, 2H), 7.55 (s, 1H), 7.90-8.00 (m, 3H). 8.07 (s, 1H), 8.15 (d, J=7.6 Hz, 1H), 8.63 (s, 1H), 9.22 (s, 1H). MS (ESI+): m/z 564 (M+H)+.
ПРИМЕР 86. 3-{2-[4-(4-Ацетил-пиперазин-1-ил)-3-трифторметил-фениламино]-5-метил-пиримидин-4-иламино}-N-tert-бутил-бензолсульфонамид (Соединение LIV)

Смесь промежуточного соединения 33 (0.10 г, 0.28 ммоль), 1-[4-(4-амино-2-трифторметил-фенил)-пиперазин-1-ил]-этанона (0.1 г, 0.35 ммоль), Pd2(dba)3 (15 мг, 0.016 ммоль), Xantphos (20 мг, 0.035 ммоль) и карбоната цезия (0.20 г, 0.61 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки, полученную смесь фильтруют. Отфильтрованные твердые частицы отмывают DCM и фильтрат концентрируют и осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и осадок растворяют в минимальном количестве EtOAc, после чего добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде белого твердого вещества (64 мг, 38%).
1H-NMR (500 MHz, DMSO-d6): δ 1.12 (s, 9H), 2.04 (3, H), 2.14 (s, 3H), 2.73 (t, J=4.9 Hz, 2H), 2.79 (t, J=4.7 Hz, 2H), 3.50-3.60 (m, 4H), 7.40 (d, J=8.7 Hz, 2H), 7.45-7.52 (m, 2H), 7.56 (s, 1H), 7.90-8.00 (m, 3H), 8.07 (s, 1H), 8.14 (d, J=7.2 Hz, 1H), 8.64 (s, 1H), 9.26 (s, 1H). MS (ESI+): m/z 606 (M+H)+.
ПРИМЕР 87. 5-Метил-N2-[3-(4-метил-пиперазин-1-сульфонил)-фенил]-пиримидин-2,4-диамин (Промежуточное соединение 35)
Смесь 2-хлор-5-метил-пиримидин-4-иламина(0.25 г, 1.74 ммоль) и 3-(4-метил-пиперазин-1-сульфонил)-фениламина (0.50 г, 2.0 ммоль) в уксусной кислоте (4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 130°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и концентрируют полученную смесь. Осадок поглощают водой (20 мл) и доводят рН смеси приблизительно до 9 при помощи 10% раствора NaOH. Полученный раствор экстрагируют EtOAc (2×30 мл) и органический слой сепарируют. Объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют в вакууме и сырой продукт (~0.42 г) используют на следующем этапе синтеза без дополнительной очистки. MS (ESI+): m/z 363 (М+Н)+.
ПРИМЕР 88. N-tert-Бутил-3-{5-метил-2-[3-(4-метил-пиперазин-1-сульфонил)-фениламино]-пиримидин-4-иламино}-бензолсульфонамид (Соединение LV)

Суспензию промежуточного соединения 35 (0.10 г, 0.28 ммоль), 3-бром-N-tert-бутил-бензолсульфонамида (80 мг, 0.27 ммоль), Pd2(dba)3 (15 мг, 0.016 ммоль), Xantphos (20 мг, 0.035 ммоль) и карбоната цезия (0.18 г, 0.55 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки, полученную смесь фильтруют и отфильтрованные твердые частицы отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи HPLC. Фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и осадок растворяют в минимальном количестве EtOAc, после чего добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде белого твердого вещества (10 мг, 6%).
1H-NMR (500 MHz, DMSO-d6): δ 1.12 (s, 9H), 2.13 (s, 3H), 2.16 (s, 3H), 2.33-2.40 (m, 4H), 2.85-2.94 (m, 4H), 7.18 (d, J=8.1 Hz, 1H), 7.44 (t, J=8.0 Hz, 1H), 7.49-7.54 (m, 2H), 7.58 (s, 1H), 8.00-8.03 (m, 2H), 8.13 (s, 1H), 8.15 (dd, J=8.6, 1.6 Hz, 1H), 8.18-8.23 (m, 1H), 8.66 (s, 1H), 9.38 (s, 1H). MS (ESI+): m/z 574 (M+H)+.
ПРИМЕР 89. N-tert-Бутил-3-[5-метил-2-(4-пиперазин-1-илметил-фениламино)-пиримидин-4-иламино]-бензолсульфонамид (Соединение LVI)

Смесь промежуточного соединения 33 (0.10 г, 0.28 ммоль), tert-бутиловый сложный эфир 4-(4-амино-бензил)-пиперазин-1-карбоновой кислоты (0.1 г, 0.34 ммоль), Pd2(dba)3 (15 мг, 0.016 ммоль), Xantphos (20 мг, 0.035 ммоль) и карбоната цезия (0.20 г, 0.61 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 170°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют. Отфильтрованные твердые частицы отмывают DCM и фильтрат концентрируют. Осадок растворяют в DCM (6 мл) и добавляют TFA (3 мл). Смесь перемешивают при комнатной температуре в течение 1 ч, концентрируют и осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и полученное твердое вещество измельчают в порошок со смесью гексаны/EtOAc (10/1, 55 мл). После фильтрации получают нужное соединение в виде твердого белого вещества (32 мг, 22%).
1H-NMR (500 MHz, DMSO-d6): δ 1.12 (s, 9H), 2.13 (s, 3H), 2.30-2.40 (m, 4H), 2.85 (t, J=4.7 Hz, 4H), 3.38 (s, 2H), 7.09 (d, J=8.5 Hz, 2H), 7.45-7.52 (m, 2H), 7.56 (s, 1H), 7.59 (d, J=8.5 Hz, 2H), 7.94 (s, 1H), 8.10 (s, 1H), 8.13-8.16 (m, 1H), 8.59 (s, 1H), 8.96 (s, 1H) MS (ESI+): m/z 510(M+H)+.
ПРИМЕР 90. N-tert-Бутил-3-{5-метил-2-[4-(2-пирролидин-1-ил-этокси)-фениламино]-пиримидин-4-иламино}-бензолсульфонамид (Соединение LVII)

Смесь промежуточного соединения 33 (0.10 г, 0.28 ммоль) и 4-(2-пирролидин-1-ил-этокси)-фениламина (0.10 г, 0.49 ммоль) в уксусной кислоте (3 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 150°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и концентрируют полученную смесь. Осадок очищают при помощи HPLC, нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и полученное твердое вещество растворяют в минимальном количестве EtOAc, после чего добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде белого твердого вещества (40 мг, 27%).
1H-NMR (500 MHz, DMSO-d6): δ 1.12 (s, 9H), 1.65-1.70 (m, 4H), 2.12 (s, 3H), 2.45-2.55 (m, 4H), 2.76 (t, J=5.8 Hz, 2H), 3.99 (t, J=6.0 Hz, 2H), 6.79 (d, J=9.0 Hz, 2H), 7.46-7.53 (m, 4H), 7.56 (s, 1H), 7.90 (s, 1H), 8.10-8.15 (m, 2H), 8.53 (s, 1H), 8.77 (s, 1H). MS (ESI+): m/z 525 (M+H)+.
ПРИМЕР 91. 3-{5-Метил-2-[4-(4-метил-пиперазин-1-ил)-фениламино1-пиримидин-4-иламино}-бензолсульфонамид (Соединение LVIII)

Суспензию промежуточного соединения 32 (0.10 г, 0.33 ммоль), 3-бром-бензолсульфонамида (0.10 г, 0.42 ммоль), Pd2(dba)3 (20 мг, 0.022 ммоль), Xantphos (25 мг, 0.043 ммоль) и карбоната цезия (0.25 г, 0.77 ммоль) в диоксане (3 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют, отфильтрованные твердые частицы отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи HPLC. Фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют с получением нужного соединения в виде твердого серого вещества (10 мг, 7%).
1H-NMR (500 MHz, DMSO-d6): δ 2.10 (s, 3H), 2.22 (s, 3H), 2.44 (t, J=4.9 Hz, 4H), 3.03 (t, J=4.9 Hz, 4H), 6.81 (d, J=9.0 Hz, 2H), 7.34 (s, 2H), 7.45-7.50 (m, 4H), 7.89 (s, 1H), 8.06 (s, 1H), 8.13-8.18 (m, 1H), 8.54 (s, 1H), 8.70 (s, 1H). MS (ESI+): m/z 454 (M+H)+.
ПРИМЕР 92. N-Метил-3-{5-метил-2-[4-(4-метил-пиперазин-1-ил)-фениламино1-пиримидин-4-иламино}-бензолсульфонамид (Соединение LIX)

Суспензию промежуточного соединения 32 (0.10 г, 0.33 ммоль), 3-бром-N-метил-бензолсульфонамида (0.11 г, 0.44 ммоль), Pd2(dba)3 (20 мг, 0.022 ммоль), Xantphos (25 мг, 0.043 ммоль) и карбоната цезия (0.25 г, 0.77 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют, отфильтрованные твердые частицы отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи HPLC. Фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и осадок истирают в порошок со смесью DCM/Et20 (1/5, 30 мл). После фильтрации получают нужное соединение в виде твердого светло-коричневого вещества (65 мг, 42%).
1H-NMR (500 MHz, DMSO-d6): δ 2.11 (s, 3H), 2.23 (s, 3H), 2.44 (d, J=5.0 Hz, ЗН), 2.45-2.50 (m, 4H), 3.03 (t, J=4.9 Hz, 4H), 6.81 (d, J=9.1 Hz, 2H), 7.40-7.43 (m, 2H), 7.46 (d, J=9.1 Hz, 2H), 7.52 (t, J=8.0 Hz, 1H), 7.89 (s, 1H), 7.94 (t, J=1.8 Hz, 1H), 8.29 (br d, J=8.3 Hz, 1H), 8.56 (s, 1H), 8.72 (s, 1H). MS (ES+): m/z 468 (M+H)+.
ПРИМЕР 93. N,N-Диметил-3-{5-метил-2-[4-(4-метил-пиперазин-1-ил)-фениламино]-пиримидин-4-иламино}-бензолсульфонамид (Соединение LX)

Суспензию промежуточного соединения 32 (0.13 г, 0.43 ммоль), 3-бром-N,N-диметил-бензолсульфонамида (0.14 г, 0.53 ммоль), Pd2(dba)3 (25 мг, 0.027 ммоль), Xantphos (30 мг, 0.052 ммоль) и карбоната цезия (0.33 г, 1.0 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют, отфильтрованные твердые частицы отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи HPLC. Фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и осадок истирают в порошок со смесью EtOAc/гексаны (1/5, 30 мл). После фильтрации получают нужное соединение в виде твердого грязно-белого вещества (60 мг, 29%).
1H-NMR (500 MHz, DMSO-d6): δ 2.17 (s, 3H), 2.23 (s, 3H), 2.44 (d, J=5.0 Hz, ЗН), 2.45-2.50 (m, 4H), 2.63 (s. 6Н), 3.03 (t, J=4.9 Hz, 4H), 6.81 (d, J=9.1 Hz, 2H), 7.36 (d, J=8.0 Hz, 1H), 7.45 (d, J=9.1 Hz, 2H), 7.54 (t, J=8.0 Hz, 1H), 7.84 (t, J=1.9 Hz, 1H), 7.90 (s, 1H), 8.46 (br d, J=7.8 Hz, 1H), 8.57 (s, 1H), 8.74 (s, 1H). MS (ES+): m/z 482 (M+H)+.
ПРИМЕР 94. N-Изопропил-3-{5-метил-2-[4-(4-метил-пиперазин-1-ил)-фениламино]-пиримидин-4-иламино}-бензолсульфонамид (Соединение LXI)

Суспензию промежуточного соединения 32 (0.10 г, 0.33 ммоль), 3-бром-Т-изопропил-бензолсульфонамида (0.11 г, 0.39 ммоль), Pd2(dba)3 (20 мг, 0.022 ммоль), Xantphos (25 мг, 0.043 ммоль) и карбоната цезия (0.25 г, 0.77 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют, отфильтрованные твердые частицы отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи HPLC. Фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и осадок истирают в порошок со смесью EtOAc/гексаны (1/10, 33 мл). После фильтрации получают нужное соединение в виде твердого грязно-белого вещества (47 мг, 29%).
1H-NMR (500 MHz, DMSO-d6): δ 0.98 (d, J=6.6 Hz, 6H), 2.11 (s, 3H), 2.24 (s, 3H), 2.45-2.50 (m, 4H), 3.03 (t, J=4.8 Hz, 4H), 3.20-3.27 (m, 1H), 6.80 (d, J=9.0 Hz, 2H), 7.40-7.52 (m, 4H), 7.59 (d, J=7.1 Hz, 1H), 7.89 (s, 1H), 8.21 (br d, J=7.9 Hz, 1H), 8.53 (s, 1H), 8.71 (s, 1H). MS (ES+): m/z 496 (M+H)+.
ПРИМЕР 95. N4-(3-Метансульфонил-4-метил-фенил)-5-метил-N2-[4-(4-метил-пиперазин-1-ил)-фенил]-пиримидин-2,4-диамин (Соединение LXII)

Суспензию промежуточного соединения 32 (0.10 г, 0.33 ммоль), 4-бром-2-метансульфонил-1-метил-бензола (0.10 г, 0.40 ммоль), Pd2(dba)3 (20 мг, 0.022 ммоль), Xantphos (25 мг, 0.043 ммоль) и карбоната цезия (0.25 г, 0.77 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют, отфильтрованные твердые частицы отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи HPLC. Фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и осадок истирают в порошок со смесью EtOAc/гексаны (1/5, 30 мл). После фильтрации получают нужное соединение в виде твердого светло-коричневого вещества (41 мг, 27%).
1H-NMR (500 MHz, DMSO-d6): δ 2.09 (s, 3Н), 2.22 (s, 3H), 2.45 (t, J=4.7 Hz, 4H), 2.61 (s, 3H), 3.03 (t, J=4.9 Hz, 4H), 3.20 (s, 3H), 6.80 (d, J=9.1 Hz, 2H), 7.35 (d, J=8.5 Hz, 1H), 7.44 (d, J=9.0 Hz, 2H), 7.87 (s, 1H), 8.05 (d, J=2.4 Hz, 1H), 8.21 (br d, J=7.0 Hz, 1H), 8.55 (s, 1H), 8.71 (s, 1H). MS (ES+): m/z 467 (M+H)+.
ПРИМЕР 96. N-Циклогексил-3-{5-метил-2-[4-(4-метил-пиперазин-1-ил)-фениламино]-пиримидин-4-иламино}-бензолсульфонамид (Соединение LXIII)

Суспензию промежуточного соединения 32 (0.10 г, 0.33 ммоль), 3-бром-N-циклогексил-бензолсульфонамида (0.13 г, 0.41 ммоль), Pd2(dba)3 (20 мг, 0.022 ммоль), Xantphos (25 мг, 0.043 ммоль) и карбоната цезия (0.25 г, 0.77 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют, отфильтрованные твердые частицы отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи HPLC. Фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и осадок истирают в порошок со смесью EtOAc/гексаны (1/10, 33 мл). После фильтрации получают нужное соединение в виде твердого светло-коричневого вещества (45 мг, 25%).
1H-NMR (500 MHz, DMSO-d6): δ 1.07-1.17 (m, 6H), 1.53-1.63 (m, 4H), 2.11 (s, 3H), 2.22 (s, 3Н), 2.45 (t, J=4.7 Hz, 4H), 2.90-3.00 (m, 1H), 3.02 (t, J=4.8 Hz, 4H), 6.80 (d, J=9.1 Hz, 2H), 7.43-7.53 (m, 4H), 7.65 (d, J=7.3 Hz, 1H), 7.89 (s, 1H), 8.05 (s, 1H), 8.18 (br d, J=7.7 Hz, 1H), 8.52 (s, 1H), 8.71 (s, 1H). MS (ES+): m/z 536 (M+H)+.
ПРИМЕР 97. N,N-Диметил-3-{5-метил-2-[4-(4-метил-пиперазин-1-ил)-фениламино]-пиримидин-4-иламино}-бензолсульфонамид (Соединение LXIV)

Суспензию промежуточного соединения 32 (0.10 г, 0.33 ммоль), 3-бром-N,N-диэтил-бензолсульфонамида (0.12 г, 0.41 ммоль), Pd2(dba)3 (20 мг, 0.022 ммоль), Xantphos (25 мг, 0.043 ммоль) и карбоната цезия (0.25 г, 0.77 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют, отфильтрованные твердые частицы отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи HPLC. Фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и осадок истирают в порошок со смесью EtOAc/гексаны (1/10, 33 мл). После фильтрации получают нужное соединение в виде твердого грязно-белого вещества (45 мг, 27%).
1H-NMR (500 MHz, DMSO-d6): δ 1.06 (t, J=7.1 Hz, 6H), 2.11 (s, 3H), 2.22 (s, 3H), 2.44 (t, J=4.7 Hz, 4H), 3.03 (t, J=4.8 Hz, 4H), 3.16 (q, J=7.1 Hz, 4H), 6.80 (d, J=9.1 Hz, 2H), 7.39 (d, J=8.1 Hz, 1H), 7.45 (d, J=9.0 Hz, 2H), 7.50 (t, J=8.1 Hz, 1H), 7.89 (t, J=1.9 Hz, 1H), 7.89 (s, 1H), 8.39 (br d, J=7.9 Hz, 1H), 8.53 (s, 1H), 8.74 (s, 1H). MS (ES+): m/z 510 (M+H)+.
ПРИМЕР 98. 5-Метил-N2-[4-(4-метил-пиперазин-1-ил)-фенил]-N4-[3-(морфолин-4-сульфонил)-фенил]-пиримидин-2,4-диамин (Соединение LXV)
Суспензию промежуточного соединения 32 (0.10 г, 0.33 ммоль), 4-(3-бром-бензолсульфонил)-морфолина (0.12 г, 0.39 ммоль), Pd2(dba)3 (20 мг, 0.022 ммоль), Xantphos (25 мг, 0.043 ммоль) и карбоната цезия (0.25 г, 0.77 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют, отфильтрованные твердые частицы отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи HPLC. Фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и осадок истирают в порошок со смесью EtOAc/гексаны (1/10, 33 мл). После фильтрации получают нужное соединение в виде твердого светло-красного вещества (90 мг, 52%).
1H-NMR (500 MHz, DMSO-d6): δ 2.12 (s, 3Н), 2.22 (s, 3Н), 2.45 (t, J=4.8 Hz, 4H), 2.89 (t, J=4.6 Hz, 4H), 3.03 (t, J=4.8 Hz, 4H), 3.64 (t, J=4.7 Hz, 4H), 6.81 (d, J=9.1 Hz, 2H), 7.35 (d, J=8.1 Hz, 1H), 7.45 (d, J=9.0 Hz, 2H), 7.56 (t, J=8.1 Hz, 1H), 7.84 (t, J=1.9 Hz, 1H), 7.91 (s, 1H), 8.47 (br d, J=8.4 Hz, 1H), 8.59 (s, 1H), 8.75 (s, 1H). MS (ES+): m/z 524 (M+H)+.
ПРИМЕР 99. Этиловый эфир 3-{5-Метил-2-[4-(4-метил-пиперазин-1-ил)-фепиламино]-пиримидин-4-иламино}-бензойной кислоты (Промежуточное соединение 36)

Суспензию промежуточного соединения 32 (0.10 г, 0.33 ммоль), этиловый эфир 3-бром-бензойной кислоты (0.07 мл, 0.44 ммоль), Pd2(dba)3 (20 мг, 0.022 ммоль), Xantphos (25 мг, 0.043 ммоль) и карбоната цезия (0.25 г, 0.77 ммоль) в диоксане (3 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют, отфильтрованные твердые частицы отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи флэш-хроматографии на колонке с силикагелем (DCM к 10% MeOH/DCM) с получением нужного соединения (0.10 г, 68%). MS (ES+): m/z 447 (M+H)+.
ПРИМЕР 100. 3-{5-Метил-2-[4-(4-метил-пиперазин-1-ил)-фениламино]-пиримидин-4-иламино}-бензамид (Соединение LXVI)

Смесь промежуточного соединения 36 (0.10 г, 0.22 ммоль) в концентрированном NH4OH помещают в реакционную пробирку и нагревают до 50°С в течение 3 ч. Смесь вливают в воду (15 мл) и экстрагируют EtOAc (2×30 мл). Объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Водный слой экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и осадок растирают в порошок со смесью EtOAc/гексаны (1/10, 33 мл). После фильтрации получают нужное соединение в виде белого твердого вещества (10 мг, 11%).
1H-NMR (500 MHz, DMSO-d6): δ 2.10 (s, 3Н), 2.22 (s, 3H), 2.40-2.50 (m, 4H), 2.95-3.05 (m, 4H), 6.75 (d, J=9.1 Hz, 2H), 7.30-7.40 (m, 2H), 7.45 (d, J=9.1 Hz, 2H), 7.53-7.58 (m, 1H), 7.85 (s, 1H), 7.90 (br s, 2H), 8.03 (s, 1H), 8.37 (s, 1H). MS (ES+): m/z 418 (M+H)+.
ПРИМЕР 101. Этиловый эфир 2-Метил-3-{5-метил-2-[4-(4-метил-пиперазин-1-ил)-фениламино]-пиримидин-4-иламино}-бензойной кислоты (Соединение LXVII)

Суспензию промежуточного соединения 32 (0.10 г, 0.33 ммоль), этиловый эфир 3-бром-2-метил-бензойной кислоты (0.10 мл, 0.41 ммоль), Pd2(dba)3 (20 мг, 0.022 ммоль), Xantphos (25 мг, 0.043 ммоль) и карбоната цезия (0.25 г, 0.77 ммоль) в диоксане (3 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют, отфильтрованные твердые частицы отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи флэш-хроматографии на колонке с силикагелем (DCM к 30% МеОН и 1% TEA в DCM) с получением нужного соединения (0.14 г, 92%) в виде светло-коричневого масла.
1H-NMR (500 MHz, DMSO-d6): δ 1.32 (t, J=7.1 Hz, 3H), 2.10 (s, 3H), 2.21 (s, 3H), 2.32 (s, 3H), 2.40-2.45 (m, 4H), 2.94 (t, J=4.8 Hz, 4H), 4.30 (q, J=7.1 Hz, 2H), 6.57 (d, J=9.1 Hz, 2H), 7.25 (d, J=8.9 Hz, 2H), 7.35 (t, J=7.8 Hz, 1H), 7.48 (dd, J=7.9, 1.0 Hz, 1H), 7.70 (dd, J=7.8, 1.1 Hz, 1H), 7.78 (s, 1H), 8.23 (s, 1H), 8.58 (s, 1H). MS (ES+): m/z 461 (M+H)+.
ПРИМЕР 102. 2-Метил-3-{5-метил-2-[4-(4-метил-пиперазин-1-ил)-фениламино]-пиримидин-4-иламино}-бензамид (Соединение LXVIII)

К смеси описанного выше соединения LXVII (0.10 г, 0.22 ммоль) и формамида (0.05 мл, 1.3 ммоль) в DMF (5 мл) при 100°С добавляют NeOMe (0.10 г, 0.46 ммоль) в атмосфере аргона. Смесь перемешивают при такой же температуре в течение 2 ч, а затем при комнатной температуре еще 15 часов. Смесь вливают в воду (15 мл) и экстрагируют EtOAc (2×15 мл). Объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Водный слой экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и осадок растирают в порошок со смесью EtOAc/гексаны (1/5, 30 мл). После фильтрации получают нужное соединение в виде белого твердого вещества (20 мг, 21%).
1H-NMR (500 MHz, DMSO-d6): δ 2.09 (s, 3H), 2.21 (s, 3H), 2.23 (s, 3H), 2.40-2.45 (m, 4H), 2.97 (t, J=4.8 Hz, 4H), 6.69 (d, J=9.1 Hz, 2H), 7.24-7.28 (m, 2H), 7.35 (d, J=9.0 Hz, 2H), 7.39-7.43 (m, 2H), 7.69 (s, 1H), 7.78 (s, 1H), 8.01 (s, 1H), 8.53 (s, 1H). MS (ES+): m/z 432 (M+H)+.
ПРИМЕР 103. (2-Хлор-5-метил-пиримидин-4-ил)-(4-хлор-3-трифторметил-фенил)-амин (Промежуточное соединение 37)
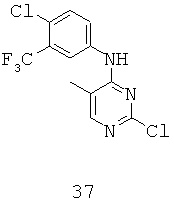
Смесь 2-хлор-5-метил-пиримидин-4-иламина (0.30 г, 2.1 ммоль), 4-бром-1-хлор-2-трифторметил-бензола (0.40 мл, 2.7 ммоль), Pd2(dba)3 (0.10 г, 0.11 ммоль), Xantphos (0.13 г, 0.22 ммоль) и карбоната цезия (1.5 г, 4.6 ммоль) в диоксане/DMF (6/1, 7 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 15 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют, отфильтрованные твердые частицы отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи флэш-хроматографии на колонке с силикагелем (гексаны к 50% EtOAc/гексаны) с получением нужного соединения (0.65 г, 96%) в виде белого твердого вещества. MS (ES+): m/z 322 (М+Н)+.
ПРИМЕР 104. N4-(4-Хлор-3-трифторметил-фенил)-5-метил-N2-[4-(пиперидин-4-илокси)-фенил]-пиримидин-2,4-диамин (Соединение LXIX)

Смесь промежуточного соединения 37 (0.10 г, 0.31 ммоль) и tert-бутилового сложного эфира 4-(4-амино-фенокси)-пиперидин-1-карбоновой кислоты (0.12 г, 0.41 ммоль) в уксусной кислоте (3 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 150°С в течение 15 минут. После охлаждения до комнатной температуры удаляют пробку с пробирки и смесь концентрируют. Затем осадок поглощают водой (20 мл) и нейтрализуют 10% раствором NaOH до тех пор, пока не произойдет преципитация твердых частиц. Полученные твердые частицы фильтруют и очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Водный слой экстрагируют EtOAc (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют с получением нужного соединения в виде белого твердого вещества (30 мг, 20%).
1H-NMR (500 MHz, DMSO-d6): δ 1.69-1.77 (m, 2H), 2.00-2.04 (m, 2H), 2.11 (s, 3H), 2.90-3.00 (m, 2H), 3.10-3.20 (m, 2H), 4.40-4.48 (m, 1H), 6.84 (d, J=9.0 Hz, 2H), 7.49 (d, J=9.0 Hz, 2H), 7.58 (d, J=8.8 Hz, 1H), 7.94 (s, 1H), 8.12 (d, J=2.6 Hz, 1H), 8.21 (br d, J=8.2 Hz, 1H), 8.64 (s, 1H), 8.64 (s, 1H), 8.93 (s, 1H). MS (ES+): m/z 478 (М+H)+.
ПРИМЕР 105. 5-Метил-N2-[4-(2-пирролидин-1-ил-этокси)-фенил]пиримидин-2,4-диамин (Промежуточное соединение 38).

Смесь 2-хлор-5-метил-пиримидин-4-иламина (0.50 г, 3.5 ммоль) и 4-(2-пирролидин-1-ил-этокси)-фениламина (1.1 г, 5.3 ммоль) в уксусной кислоте (8 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 150°С в течение 15 минут. После охлаждения до комнатной температуры удаляют пробку с пробирки, полученную смесь концентрируют. Осадок поглощают водой (30 мл) и нейтрализуют 10% раствором NaOH до тех пор, пока рН не достигнет ~10. Полученный водный слой экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют с получением нужного соединения в виде серого твердого вещества (0.80 г, 73%). Полученное соединение используют на следующем этапе синтеза без дополнительной очистки. MS (ES+): m/z 314 (М+Н)+.
ПРИМЕР 106. 3-{5-Метил-2-[4-(2-пирролидин-1-ил-этокси)-фениламино}-пиримидин-4-иламино}-бензолсульфонамид (Соединение LXX)

Смесь промежуточного соединения 38 (0.10 г, 0.32 ммоль) и 3-бром-бензолсульфонамида (0.10 г, 0.42 ммоль), Pd2(dba)3 (20 мг, 0.022 ммоль), Xantphos (25 мг, 0.043 ммоль) и карбоната цезия (0.20 г, 0.16 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 170°С в течение 25 минут. После охлаждения до комнатной температуры удаляют пробку с пробирки, полученную смесь фильтруют и отфильтрованные твердые частицы отмывают DCM. Фильтрат концентрируют и осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Водный слой экстрагируют EtOAc (2×30 мл), а объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и осадок растирают в порошок со смесью EtOAc/гексанов (1/10, 33 мл). После фильтрации получают нужное соединение в виде белого твердого вещества (11 мг, 7%).
1H-NMR (500 MHz, DMSO-d6): δ 1.65-1.72 (m, 4H), 2.11 (s, 3H), 2.49-2.52 (m, 4H), 2.75-2.80 (m, 2H), 4.00 (t, J=5.9 Hz, 2H), 6.80 (d, J=9.0 Hz, 2H), 7.34 (s, 2H), 7.45-7.50 (m, 2H), 7.52 (d, J=9.0 Hz. 2H), 7.90 (s, 1H), 8.05 (s, 1H), 8.10-8.15 (m, 1H), 8.57 (s, 1H), 8.77 (s, 1H). MS (ES+): m/z 469 (M+H)+.
ПРИМЕР 107. 3-Метил-N2-(4-морфолин-4-илметил-фенил)-пиримидин-2,4-диамин (Промежуточное соединение 39).

Смесь 2-хлор-5-метил-пиримидин-4-иламина (0.40 г, 2.8 ммоль) и 4-морфолин-4-илметил-фениламина (0.60 г, 3.1 ммоль) в уксусной кислоте (15 мл) нагревают до 70°С в течение 17 ч. После охлаждения до комнатной температуры смесь концентрируют. Осадок поглощают водой (30 мл) и нейтрализуют 10% раствором NaOH до тех пор, пока рН не достигнет ~10. Полученный водный слой экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют с получением нужного соединения в виде коричневого сиропа (0.70 г, 83%). Полученное соединение используют на следующем этапе синтеза без дополнительной очистки. MS (ES+): m/z 300 (M+H)+.
ПРИМЕР 108. N4-(1H-Индол-4-ил)-5-метил-N2-(4-морфолин-4-илметил-фенил)-пиримидин-2,4-диамин (Соединение LXXI)

Смесь промежуточного соединения 39 (0.40 г, 1.3 ммоль), 4-бром-1-триизопропилсиланил-1Н-индола (0.50 г, 1.4 ммоль), Pd2(dba)3 (0.10 мг, 0.11 ммоль), Xantphos (0.12 мг, 0.21 ммоль) и карбоната цезия (0.90 г, 2.8 ммоль) суспендируют в диоксане (20 мл) и нагревают при дефлегмации в атмосфере аргона в течение 4 ч. Реакционную смесь охлаждают до комнатной температуры и разводят DCM (30 мл). Смесь фильтруют и полученный фильтрат концентрируют в вакууме. Осадок очищают при помощи флэш-хроматографии на колонке с силикагелем (гексаны к EtOAc) с получением TIPS защищенного предшественника в виде желтого масла.
К описанному выше TIPS защищенному предшественнику (50 мг, 0.088 ммоль) в THF (5 мл) добавляют TBAF (0.5 мл, 1М в THF). Смесь перемешивают при комнатной температуре в течение 1 ч и затем вливают в воду (20 мл). Водный слой экстрагируют EtOAc (2×20 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Водный слой экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и твердые частицы растворяют в минимальном количестве EtOAc, после чего добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде светло-коричневого твердого вещества (6 мг, общий выход 1%).
1H-NMR (500 MHz, DMSO-d6): δ 2.17 (s, 3Н), 2.25-2,30 (m, 4H), 3.29 (s, 2H), 3.54 (t, J=4.5 Hz, 4H), 6.40 (t, J=2.2 Hz, 1H), 6.89 (d, J=8.5 Hz, 2H), 7.09 (t, J=7.8 Hz, 1H), 7.25 (d, J=8.0 Hz, 1H), 7.27 (t, J=2.8 Hz, 1H), 7.30 (d, J=7.5 Hz, 1H), 7.43 (d, J=8.5 Hz, 2H), 7.85 (s, 1H), 8.14 (s, 1H), 8.77 (s, 1H), 11.10 (s, 1H). MS (ES+): m/z 415 (M+H)+.
ПРИМЕР 109. Tetr-бутиловый сложный эфир 4-[4-(4-Амино-5-метил-пиримидин-2-иламино)-бензил]-пиперазин-1-карбоновой кислоты (Промежуточное соединение 40).

Смесь 2-хлор-5-метил-пиримидин-4-иламина (0.35 г, 2.4 ммоль) и tert-бутилового сложного эфира 4-(4-амино-бензил)-пиперазин-1-карбоновой кислоты (0.80 г, 2.8 ммоль) в уксусной кислоте (20 мл) нагревают до 70°С в течение 1 ч. После охлаждения до комнатной температуры смесь концентрируют. Осадок поглощают водой (30 мл) и нейтрализуют 10% раствором NaOH до тех пор, пока рН не достигнет ~10. Полученный водный слой экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют с получением нужного соединения, которое используют на следующем этапе синтеза без дополнительной очистки. MS (ES+): m/z 399 (М+Н)+.
ПРИМЕР 110. N4-(1H-Индол-4-ил)-5-метил-N2-(4-пиперазин-1-илметил-фенил)-пиримидин-2,4-диамин (Соединение LXXII)

Смесь промежуточного соединения 40 (0.78 г, 2.0 ммоль), 4-бром-1-триизопропилсиланил-1H-индола (0.70 г, 2.0 ммоль), Pd2(dba)3 (0.15 мг, 0.16 ммоль), Xantphos (0,19 мг, 0.32 ммоль) и карбоната цезия (1.3 г, 4.0 ммоль) суспендируют в диоксане (20 мл) и нагревают при дефлегмации в атмосфере аргона в течение 4.5 ч. Реакционную смесь охлаждают до комнатной температуры, фильтруют и отфильтрованные твердые частицы отмывают DCM (30 мл). Фильтрат концентрируют и осадок очищают при помощи флэш-хроматографии на колонке с силикагелем (гексаны к 30% EtOAc/гексаны) с получением TIPS защищенного предшественника.
К описанному выше TIPS защищенному предшественнику (0.10 г, 0.15 ммоль) в DCM (8 мл) добавляют TFA (2 мл). Смесь перемешивают при комнатной температуре в течение 2 ч и концентрируют. Осадок очищают при помощи HPLC, а нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Водный слой экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и твердые частицы растирают в порошок со смесью EtOAc/гексаны (1/5, 30 мл). После фильтрации получают нужное соединение в виде твердого белого вещества (25 мг, 3% общий выход).
1H-NMR (500 MHz, DMSO-d6): δ 2.17 (s, 3Н), 2.20-2.30 (m, 4H), 2.73 (t, J=4.6 Hz, 4H), 3.28 (s, 2H), 6.41 (t, J=2.2 Hz, 1H), 6.89 (d, J=8.5 Hz, 2H), 7.09 (t, J=7.8 Hz, 1H), 7.24 (d, J=8.3 Hz, 1H), 7.27 (t, J=2.8 Hz, 1H), 7.31 (d, J=7.5 Hz, 1H), 7.44 (d, J=8.5 Hz, 2H), 7.85 (s, 1H), 8.13 (s, 1H), 8.77 (s, 1H), 11.10 (s, 1H). MS (ES+): m/z 414 (M+H)+.
ПРИМЕР 111. 5-Метил-N4-(7-метил-1H-индол-4-ил)-N2-(4-(4-метилпиперазин-1-ил)фенил)пиримидин-2,4-диамин (Соединение LXXIII).

Смесь промежуточного соединения 32 (674 мг, 2.25 ммоль), 4-бром-7-метил-1Н-индола (522 мг, 2.48 ммоль), Pd2(dba)3 (182 мг, 0.2 ммоль), Xantphos (360 мг, 0.6 ммоль) и карбоната цезия (2.6 г, 8 ммоль) суспендируют в диоксане (50 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют, полученный фильтрат концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (136 мг в форме соли HCl, 13%) в виде белого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 2.21 (s, 3Н), 2.55 (s, 3Н), 2.80 (d, J=4.6 Hz, 3Н), 3.00-3.05 (m, 2H), 3.10-3.16 (m, 2H), 3.45-3.48 (m, 2H). 3.64-3.66 (m, 2H), 6.33-6.34 (m, 1H), 6.63 (br, 2H), 6.92-6.97 (m, 4H), 7.35 (t, J=2.7 Hz, 1H), 7.83 (s, 1H), 10.04 (s, 1H), 10.24 (s, 1H), 11.08 (br s, 1H), 11.34 (s, 1H), 12.12 (br s, 1H). MS (ES+): m/z 428 (M+H)+.
ПРИМЕР 112. N4-(7-Хлор-1Н-индол-4-ил)-5-метил-N2-(4-(4-метилпиперазин-1-ил)фенил)пиримидин-2,4-диамин (Соединение LXXIV)

Смесь промежуточного соединения 32 (298 мг, 1.0 ммоль), 4-бром-7-хлор-1H-индола (231 мг, 1.04 ммоль), Pd2(dba)3 (92 мг, 0.1 ммоль), Xantphos (180 мг, 0.3 ммоль) и карбоната цезия (1.3 г, 4 ммоль) суспендируют в диоксане (50 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют, полученный фильтрат концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (251 мг в форме соли HCl, 51%) в виде белого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 2.21 (s, 3H), 2.80 (d, J=4.6 Hz, 3Н), 3.01-3.05 (m, 2H), 3.08-3.13 (m, 2H), 3.46-3.48 (m, 2H), 3.65-3.67 (m, 2H), 6.46-6.47 (m, 1H), 6.64 (br s, 1H), 6.93 (d, J=8.9 Hz, 2H), 7.05 (d, J=8.1 Hz, 2H), 7.25 (d, J=8.0 Hz, 2H), 7.43-7.44 (m, 1H), 7.87 (s, 1H), 10.13 (s, 1H), 10.27 (s, 1H), 11.00 (brs, 1H), 11.70(s, 1H), 12.23 (brs, H). MS (ES+): m/z 448 (M+H)+.
ПРИМЕР 113. N2-(4-(2-(Пирролидин-1-ил)этокси)фенил)-5-метил-N4-(7-метил-1H-индол-4-ил)пиримидин-2,4-диамин (Соединение LXXV)

Смесь промежуточного соединения 38 (410 мг, 1.3 ммоль), 4-бром-7-метил-1H-индола (274 мг, 1.3 ммоль), Pd2(dba)3 (92 мг, 0.1 ммоль), Xantphos (180 мг, 0.3 ммоль) и карбоната цезия (1.3 г, 4 ммоль) суспендируют в диоксане (50 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют, полученный фильтрат концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (92 мг в форме соли HCl, 15%) в виде белого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 1.88-1.90 (m, 2H), 1.93-2.02 (m, 2H), 2.21 (s, 3H), 2.55 (s, 3Н), 3.06-3.10 (m, 2H), 3.51-3.54 (m, 4H), 4.26 (t, J=4.9 Hz, 2H), 6.33-6.34 (m, 1H), 6.61 (br d, 2H), 6.93-6.95 (m, 2H), 7.03 (d, J=8.9 Hz, 2H), 7.34 (t, J=2.8 Hz, 1H), 7.85 (s, 1H), 10.07 (s, 1H), 10.33 (s, 1H), 10.91 (br s, 1H), 11.34 (s, 1H), 12.15 (br s, 1H). MS (ES+): m/z 443 (M+H)+.
ПРИМЕР 114. N2-(4-(2-(Пирролидин-1-ил)этокси)фенил)-5-метил-N4-(7-хлор-1H-индол-4-ил)пиримидин-2,4-диамин (Соединение LXXVI)

Смесь промежуточного соединения 38 (270 мг, 0.86 ммоль), 4-бром-7-хлор-1H-индола (198 мг, 0.86 ммоль), Pd2(dba)3 (72 мг, 0.08 ммоль), Xantphos (140 мг, 0.24 ммоль) и карбоната цезия (1.3 г, 4 ммоль) суспендируют в диоксане (50 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют, полученный фильтрат концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (33 мг в форме соли HCl, 8%) в виде белого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 1.88-1.90 (m, 2H), 1.93-2.02 (m, 2H), 2.22 (s, 3Н), 3.06-3.10 (m, 2H), 3.51-3.54 (m, 4H), 4.27 (t, J=4.9 Hz, 2H), 6.46-6.47 (m, 1H), 6.63 (br d, 2H), 6.95 (d, J=8.2 Hz, 2H), 7.06 (d, J=8.0 Hz, 2H), 7.25 (d, J=8.0 Hz, 1H), 7.43 (t, J=2.8 Hz, 1H), 7.90 (s, 1H), 10.13 (s, 1H), 10.40 (s, 1H), 10.94 (brs, 1H), 11.70 (s, 1H), 12.33 (brs, H). MS (ES+): m/z 463 (M+H)+.
ПРИМЕР 115. N2-(4-(2-(Пирролидин-1-ил)этокси)фенил)-5-метил-N4-(7-фтор-1H-индол-4-ил)пиримидин-2,4-диамин (Соединение LXXVII)

Смесь промежуточного соединения 38 (413 мг, 1.3 ммоль), 4-бром-7-фтор-1H-индола (310 мг, 1.45 ммоль), Pd2(dba)3 (92 мг, 0.1 ммоль), Xantphos (180 мг, 0.3 ммоль) и карбоната цезия (1.3 г, 4 ммоль) суспендируют в диоксане (50 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют, полученный фильтрат концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (10 мг в форме соли HCl, 1.5%) в виде коричневого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 1.88-1.90 (m, 2H), 1.93-2.02 (m, 2H), 2.21 (s, 3H), 3.06-3.10 (m, 2H), 3.51-3.56 (m, 4H), 4.26 (t, J=4.9 Hz, 2H), 6.42-6.43 (m, 1H), 6.63 (br d, 2H), 6.95-7.04 (m, 3H), 7.35 (d, J=8.9 Hz, 1H), 7.42 (t, J=2.8 Hz, 1H), 7.89 (s, 1H), 10.08 (s, 1H), 10.41 (s, 1H), 10.90 (br s, 1H), 11.85 (s, 1H), 12.33 (br s, H). MS (ES+): m/z 447 (M+H)+.
ПРИМЕР 116. N4-(3-tert-Бутилфенил)-5-метил-N2-(4-(4-метилпиперазин-1-ил)фенил)пиримидин-2,4-диамин (Соединение LXXVIII)

Смесь промежуточного соединения 32 (298 мг, 1.0 ммоль), l-ил-бутил-3-бромбензола (256 мг, 1.2 ммоль), Pd2(dba)3 (92 мг, 0.1 ммоль), Xantphos (180 мг, 0.3 ммоль) и карбоната цезия (1.3 г, 4 ммоль) суспендируют в диоксане (50 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют, полученный фильтрат концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (27 мг в форме соли HCl, 6 %) в виде белого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 1.25 (s, 9H), 2.16 (s, 3H), 2.80 (d, J=4.6 Hz, 3H), 3.04-3.16 (m, 4H), 3.47-3.49 (m, 2H), 3.65-3.67 (m, 2H), 6.90 (d, J=8.9 Hz, 2H), 7.26 (d, J=9.0 Hz, 2H), 7.28-7.35 (m, 2H), 7.45 (t, J=1.8 Hz, 1H), 7.50 (d, J=7.8 Hz, 1H), 7.86 (s, 1H), 9.70 (s, 1H), 10.37 (s, 1H), 11.01 (br s, 1H), 12.34 (br s, 1H). MS (ES+): m/z 431 (M+H)+.
ПРИМЕР 117. N-(3-tert-Бутилфенил)-2-хлор-5-метилпиримидин-4-амин (Промежуточное соединение 41)

Смесь 2-хлор-5-метилпиримидин-4-амина (670 мг, 4.7 ммоль), 1-tert-бутил-3-бромбензола (1.5 г, 7 ммоль), Pd2(dba)a (366 мг, 0.4 ммоль), Xantphos (695 мг, 1.2 ммоль) и карбоната цезия (6.1 г, 19 ммоль) суспендируют в диоксане (150 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют, полученный фильтрат концентрируют в вакууме. Осадок растворяют в EtOAc (10 мл) и добавляют гексаны (100 мл). Твердые частицы собирают путем фильтрации и отмывают гексанами с получением сырого нужного соединения (1.2 г, 99%) в виде желтого твердого вещества.
ПРИМЕР 118. N4-(3-tert-Бутилфенил)-5-метил-N2-(4-(пиперидин-4-илокси)фенил)пиримидин-2,4-диамин (Соединение LXXIX)

Смесь промежуточного соединения 41 (720 мг, 2.68 ммоль) и tert-бутил-4-(4-аминофенокси)пиперидин-1-карбоксилата (500 мг, 1.71 ммоль) суспендируют в уксусной кислоте (10 мл) и нагревают до 100°С в течение 4 ч. Смесь охлаждают до комнатной температуры и уксусную кислоту удаляют при пониженном давлении. Осадок поглощают водой (20 мл) и нейтрализуют рН смеси до ~7. Полученный раствор экстрагируют EtOAc (30 мл) и сепарируют органический слой. Органический слой отмывают физиологическим раствором, высушивают над MgSO4 и фильтруют, Фильтрат концентрируют в вакууме и сырой продукт очищают при помощи HPLC с получением нужного соединения (276 мг соли HCl, 35%) в виде желтого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 1.22 (s, 9H), 1.77-1.81 (m, 2H), 2.03-2.07 (m, 3H), 2.14 (s, 3H), 3.00-3.04 (m, 2H), 3.18 (br s, 2H), 4.56-4.57 (m, 1H), 6.86 (d, J=8.9 Hz, 2H), 7.26-7.31 (m, 4H), 7.40 (s, 1H), 7.44 (d, J=7.5 Hz, 1H), 7.84 (s, 1H), 8.93 (br s, 1H), 8.99 (br s, 1H), 9.67 (s, 1H), 10.31 (s, 1H). MS (ES+): m/z 432 (M+H)+.
ПРИМЕР 119. tert-Бутил-4-(4-(4-амино-5-метилпиримидин-2-иламино)фенокси)пиперидин-1-карбоксилат (Промежуточное соединение 42)

Смесь 2-хлор-5-метилпиримидин-4-амина (540 мг, 3.7 ммоль) и tert-бутил-4-(4-аминофенокси)пиперидин-1-карбоксилата (1.1 г, 3.7 ммоль) суспендируют в уксусной кислоте (20 мл) и нагревают до 70°С в течение 1 ч. Смесь охлаждают до комнатной температуры и уксусную кислоту удаляют при пониженном давлении. Осадок поглощают водой (20 мл) и нейтрализуют рН смеси до ~7. Полученный раствор экстрагируют EtOAc (30 мл) и сепарируют органический слой. Органический слой отмывают физиологическим раствором, высушивают над MgSO4 и фильтруют. Фильтрат концентрируют в вакууме с получением нужного соединения (1.4 г, 95%) в виде желтого твердого вещества.
ПРИМЕР 120. N4-(1H-Индазол-4-ил)-5-метил-N2-(4-пиперидин-4-илокси)фенил)пиримидин-2,4-диамин (Соединение LXXX)

Смесь промежуточного соединения 42 (480 мг, 1.2 ммоль), 4-бром-1H-индазола (236 мг, 1.2 ммоль), Pd2(dba)3 (92 мг, 0.1 ммоль), Xantphos (180 мг, 0.3 ммоль) и карбоната цезия (1.3 г, 4 ммоль) суспендируют в диоксане (50 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют, полученный фильтрат концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (27 мг в форме соли HCl, 6 %) в виде белого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 1.75-1.80 (m, 2H), 2.02-2.07 (m, 2H), 2.24 (s, 3Н), 3.05-3.09 (m, 2H), 3.17-3.21 (m, 2H), 4.52 (br s, 1H), 6.63 (d, J=8.6 Hz, 2H), 7.01 (d, J=8.6 Hz, 2H), 7.14 (d, J=7.3 Hz, 2H), 7.38-7.44 (m, 2H), 7.62 (d, J=8.9 Hz, 2H), 7.92 (s, 1H), 9.70 (s, 1H), 8.02 (s, 1H), 9.00 (br s, 1H), 9.04 (br s, 1H), 10.20 (s, 1H), 10.33 (s, 1H). MS (ES+): m/z 416 (M+H)+.
ПРИМЕР 121. tert-бутиловый сложный эфир 4-{3-[4-(4-Хлор-3-метокси-фениламино)-5-метил-пиримидин-2-иламино]-бензил}-пиперазин-1-карбоновой кислоты (Промежуточное соединение 43)

Смесь промежуточного соединения 31 (0.092 г, 0.33 ммоль) tert-бутилового сложного эфира 4-(3-амино-бензил)-пиперазин-1-карбоновой кислоты (0.11 г, 0.39 ммоль), Pd2(dba)3 (0.03 г, 0.033 ммоль), Xantphos (0.038 г, 0.065 ммоль) и карбоната цезия (0.32 г, 0.98 ммоль) суспендируют в диоксане (5 мл) и облучают микроволнами при 160°С в течение 15 минут. Реакционную смесь охлаждают до комнатной температуры и центрифугируют. Реакцию сливают с осадка и органическую фазу концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (0.075 г, 43%) в виде коричневого твердого вещества.
ПРИМЕР 122. N4-(4-Хлор-3-метокси-фенил)-5-метил-N2-(3-пиперазин-1-илметил-фенил)-пиримидин-2,4-диамин (Соединение LXXXI)

Раствор промежуточного соединения 43 (0.075 г, 0.14 ммоль) в DCM (8 мл) обрабатывают TFA (2 мл). Через 2 часа перемешивания удаляют растворители и полученный осадок растирают в порошок с диэтиловым эфиром, что приводит к получению белого гигроскопического порошка (0.05 г, 82%).
1H-NMR (500 MHz, DMSO-d6): δ 2.17 (s, 3Н), 2.89 (br s, 4H), 3.2 (br s, 4H), 3.68 (s, 4H), 3.82 (br s, 3Н), 7.16-7.19 (m, 2H), 7.28 (t, J=7.9 Hz, 1H), 7.33 (d, J=2.3 Hz, 1H), 7.39 (s, 1H), 7.43 (d, J=8.5 Hz, 1H), 7.49 (d, 8.6 Hz, 1H), 7.98 (s, 1H), 8.8 (br s, 2H), 9.78 (br s, 1H), 10.57 (br s, 1H). MS (ES+): m/z 439 (M+H)+.
ПРИМЕР 123. N4-(4-Хлор-3-метокси-фенил)-5-метил-N2-[4-(пиперидин-4-илокси)-фенил]-пиримидин-2,4-диамин (Соединение LXXXII)

Смесь промежуточного соединения 31 (0.66 г, 2.3 ммоль) tert-бутилового сложного эфира 4-(4-амино-фенокси)-пиперидин-1-карбоновой кислоты (0.88 мг, 3.0 ммоль) в укусной кислоте (15 мл) облучают микроволнами при 160°С в течение 15 минут. Смесь оставляют охлаждаться при комнатной температуре и уксусную кислоту удаляют при пониженном давлении. Осадок помешают в воду (20 мл) и смесь нейтрализуют 10% раствором NaOH до преципитации твердых частиц. При помощи фильтрации с последующей флэш-хроматографии на колонке с получением нужного соединения в виде твердых частиц бежевого цвета (0.51 г, 50%).
1H-NMR (500 MHz, DMSO-d6): δ 1.37-1.44 (m, 2H), 1.86-1.89 (m, 2H), 2.09 (s, 3Н), 2.50-2.56 (m, 2H), 2.91-2.95 (m, 2H), 3.16 (s, 3Н), 3.32 (br s, 3Н), 3.72 (s, 3Н), 4.09 (br s, 1H), 4.21-4.26 (m, 1H), 6.77 (d, J=9.0 Hz, 2H), 7.27 (d, J=8.5 Hz, 1H), 7.40-7.42 (m, 1H), 7.46-7.49 (m, 3Н), 7.87 (s, 1H), 8.31 (s, 1H), 8.78 (s, 1H). MS (ES+): m/z 440 (M+H)+.
ПРИМЕР 124. Tert-бутиловый сложный эфир 4-{3-[4-(4-Хлор-3-метокси-фениламино)-5-метил-пиримидин-2-иламино]-фенил}-пиперазин4-карбоновой кислоты (Промежуточное соединение 44)

Смесь промежуточного соединения 31 (0.13 г, 0.46 ммоль) tert-бутилового сложного эфира 4-(3-амино-фенил)-пиперазин-1-карбоновой кислоты (0.19 мг, 0.68 ммоль) в укусной кислоте (8 мл) облучают микроволнами при 80°С в течение 15 минут. Смесь оставляют охлаждаться при комнатной температуре и уксусную кислоту удаляют при пониженном давлении. Осадок помешают в воду (20 мл) и смесь нейтрализуют 10% раствором NaOH. Затем реакционную смесь экстрагируют этилацетатом, отмывают физиологическим раствором и выпаривают до получения масляного осадка. При помощи флэш-хроматографии на колонке получают нужное соединение в виде твердого белого вещества (0.12 г, 48%).
ПРИМЕР 125. N4-(4-Хлор-3-метокси-фенил)-5-метил-N2-(3-пиперазин-1-ил-фенил)-пиримидин-2,4-диамина (Соединение LXXXIII)

Раствор промежуточного соединения 44 (0.11 г, 0.21 ммоль) в DCM (8 мл) обрабатывают TFA (1 мл). Через 3 часа перемешивания удаляют растворители и полученный осадок поглощают этилацетатом и отмывают 10% раствором бикарбоната натрия. Затем органическую фазу высушивают над сульфатом натрия, фильтруют и выпаривают до получения белого порошка. Его разводят DCM (5 мл) и обрабатывают 4М HCl в диоксане (0.5 мл). Растворители немедленно удаляют с получением HCl соли нужного соединения в виде твердого белого вещества (0.06 г, 67%).
1H-NMR (500 MHz, DMSO-d6): δ 2.18 (s, 3Н), 3.12 (br s, 4H), 3.22 (br s, 4H), 3.65 (s, 3H), 6.80 (d, J=8.1 Hz, 1H), 6.95 (s, 2H), 7.14 (t, J=8.2 Hz, 1H), 7.23 (d, J=7.0 Hz, 1H), 7.37-7.40 (m, 2H), 7.95 (s, 1H), 9.33 (br s, 2H), 9.88 (s, 1H), 10.62 (s, 1H). MS (ES+): m/z 425 (M+H)+.
ПРИМЕР 126. 2-[4-(3-Бром-фенил)-пиперидин-1-ил]-этанол (Промежуточное соединение 45)

4-(3-Бром-фенил)-пиперидин (1.2 г, 4.8 ммоль) и 2-бромэтанол (0.72 мл, 10 ммоль) растворяют в DMF (20 мл) и обрабатывают карбонатом калия (2.7 г, 20 ммоль). Полученную реакционную смесь перемешивают при температуре окружающей среды в течение 18 ч и затем вливают в воду и экстрагируют этилацетатом. Органические фазы отмывают физиологическим раствором, высушивают над сульфатом натрия, фильтруют и выпаривают до получения прозрачного масла (0.6 г, 44%).
ПРИМЕР 127. 2-[4-(3-{5-Метил-2-[4-(4-метил-пиперазин-1-ил)-фениламино]-пиримидин-4-иламино}-фенил)-пиперидин-1-ил]-этанол (Соединение LXXXIV)

Смесь промежуточного соединения 32 (0.11 г, 0.38 ммоль), промежуточного соединения 45 (0.21 г, 0.75 ммоль), Pd2(dba)3 (0.0034 г, 0.037 ммоль), Xantphos (0.043 г, 0.075 ммоль) и карбоната цезия (0.37 г, 1.1 ммоль) суспендируют в диоксане (10 мл) и облучают микроволнами при 160°С в течение 15 минут. Реакционную смесь охлаждают до комнатной температуры и центрифугируют. Реакцию сливают с осадка и органические фазы концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (0.075 г, 43%) в виде твердого вещества пурпурного цвета (0.02 г, 11%).
1H-NMR (500 MHz, DMSO-d6): δ 1.60-1.67 (m, 2H), 1.73 (d, J=11.3 Hz, 2H), 2.02-2.07 (m, 2H), 2.08 (s, 3H), 2.21 (s, 3H), 2.39-2.45 (m, 7H), 2.95 (d, J=11.4 Hz 2H), 3.00 (t, J=4.66 Hz, 4H), 3.50 (t, J=6.44 Hz, 2H), 6.76 (d, J=9.0 Hz. 2H), 6.92 (d, J=8.5 Hz, 1H), 7.22 (t, J=7.8 Hz, 1H), 7.45-7.49 (m, 3H), 7.66 (d, J=7.7 Hz, 1H), 7.82 (s, 1H), 8.09 (s, 1H), 8.67 (s, 1H). MS (ES+): m/z 502 (M+H)+.
ПРИМЕР 128. Tetr-бутиловый сложный эфир 4-(3-бром-бензолсульфониламин)-пиперидин-1-карбоновой кислоты (Промежуточное соединение 46)

3-Бром-бензолсульфонилхлорид (2.2 г, 8.7 ммоль) и tert-бутиловый сложный эфир 4-амино-пиперидин-1-карбоновой кислоты (2 г, 10 ммоль) объединяют и разводят DCM (50 мл) и TEA (3.6 мл, 26 ммоль). Через 16 ч, реакционную смесь вливают в сепарационную воронку и отмывают водой. Органические фазы отмывают физиологическим раствором, высушивают над сульфатом натрия, фильтруют и выпаривают до получения прозрачного масла, которое затвердевает, если его оставить. (3.6 г, 98%).
ПРИМЕР 129. Tetr-бутиловый сложный эфир 4-(3-{5-Метил-2-[4-(4-метил-пиперазин-1-ил)-фениламино]-пиримидин-4-иламино}-бензолсульфониламино)-пиперидин-1-карбоновой кислоты (Промежуточное соединение 47)

Смесь промежуточного соединения 32 (0.15 г, 0.518 ммоль), промежуточного соединения 46 (0.28 г, 0.67 ммоль), Pd2(dba)3 (0.024 г, 0.026 ммоль). Xantphos (0.03 г, 0.052 ммоль) и карбоната цезия (0.34 г, 1 ммоль) суспендируют в диоксане (10 мл) и облучают микроволнами при 160°С в течение 15 минут. Реакционную смесь охлаждают до комнатной температуры и центрифугируют. Реакцию сливают с осадка на лед. Полученный преципитат высушивают и используют на следующем этапе удаления защитных групп (0.2 г).
ПРИМЕР 130. 3-{5-Метил-2-[4-(4-метил-пиперазин-1-ил)-фениламино]-пиримидин-4-иламино}-N-пиперидин-4-ил-бензолсульфонамид (Соединение LXXXV)

Промежуточное соединение 47 (0.2 г, 0.32 ммоль) разводят в DCM (10 мл) и обрабатывают TFA (0.3 мл). Через 3 часа удаляют растворители и полученный осадок очищают при помощи HPLC (0.01 г, 6%).
1H-NMR (500 MHz, DMSO-d6): δ 1.30-1.35 (m, 2H), 1.56-1.58 (m, 2H), 1.98 (s, 2H), 2.11 (s, 3Н), 2.21 (s, 3Н), 2.43-2.45 (m, 4H), 2.84-2.87 (m, 2H), 3.02 (t, J=4.6 Hz, 2H), 6.80 (d, J=9 Hz, 2H), 7.45-7.51 (m, 4H), 7.78 (br s, 1H), 7.88 (s, 1H), 8.05 (s, 1H), 8.20 (d, J=7.6 Hz, 1H), 8.53 (s, 1H), 8.71 (s, 1H). MS (ES+): m/z 537 (M+H)+.
ПРИМЕР 131. N4-(4-Трифторметил)-3-метилфенил)-5-метил-N2-(4-(4-метилпиперазин-1-ил)фенил)пиримидин-2,4-диамина гидрохлорид (Соединение LXXXVI)

Суспензию промежуточного соединения 32 (0.12 г, 0.40 ммоль), 1-бром-3-(трифторметил)-2-метилбензола (0.14 г, 0.59 ммоль), Pd2(dba)3 (37 мг, 0.04 ммоль), Xantphos (47 мг, 0.08 ммоль) и карбоната цезия (0.39 г, 1.20 ммоль) в диоксане (20 мл) дегазируют аргоном в течение 2 минут и затем подвергают дефлегмации в запаянной колбе в течение ночи. После охлаждения до комнатной температуры, растворитель удаляют путем вращения с выпариванием, а полученную смесь очищают на колонке с силикагелем с 10% СН3ОН/CHCl3 в качестве элюента с получением нужного соединения в виде грязно-белого твердого вещества. Полученное белое вещество растворяют в CHCl3 (30 мл) и титруют 2М HCl в диоксане до рН 1. Растворитель удаляют путем вращения с выпариванием и твердое вещество рекристаллизовывают из ацетона (25 мг, 13%).
1H-NMR (500 MHz, DMSO-d6): δ 2.20 (s, 3H), 2.26 (s, 3H), 2.77 (d, J=4.5 Hz, 3H), 3.00-3.20 (m, 4H), 3.45 (d, J=11.6 Hz, 2H), 3.63 (d, J=12.2 Hz, 2H), 6.71 (d, J=8.1 Hz, 2H), 7.05 (d, J=9.0 Hz, 2H), 7.55 (t, J=7.9 Hz, 1H), 7.63 (d, J=7.8 Hz, 1H), 7.77 (d, J=7.77 Hz, 1H). 7.94 (s, 1H), 10.13 (s, 1H), 10.60 (s, 1H), 11.28 (s, 1H). MS (ES+): m/z 457 (M+H)+.
ПРИМЕР 132. 5-Метил-N2-(4-(4-метилпиперазин-1-ил)фенил)-N4-(3-(метилфульфонил)фенил)-пиримидин-2,4-диамин (Соединение LXXXVII)

Суспензию промежуточного соединения 32 (0.13 г, 0.44 ммоль), 1-бром-3-(метилсульфонил)бензола (0.24 г, 1.0 ммоль), Pd2(dba)3 (40 мг, 0.04 ммоль), Xantphos (50 мг, 0.08 ммоль) и карбоната цезия (0.43 г, 1.32 ммоль) в диоксане (50 мл) дегазируют аргоном в течение 2 минут и затем подвергают дефлегмации в течение ночи. После охлаждения до комнатной температуры, растворитель удаляют путем вращения с выпариванием, а полученную смесь очищают на колонке с силикагелем с 10% СН3ОН/CHCl3 в качестве элюента с получением нужного соединения в виде бледно-желтого твердого вещества (35 мг, 15%).
1H-NMR (500 MHz, DMSO-d6): δ 2.11 (s, 3H), 2.23 (s, 3H), 2.46 (br s, 4H), 3.03 (t, J=4.4 Hz, 4H), 3.19 (s, 3H), 6.81 (d, J=9.0 Hz, 2H), 7.45 (d, J=8.9 Hz, 2H), 7.5-7.6 (m, 2H), 7.91 (s, 1H), 8.05 (s, 1H), 8.36 (d, J=6.7 Hz, 1H), 8.06 (s, 1H), 8.77 (s, 1H). MS (ES+): m/z 453 (M+H)+.
ПРИМЕР 133. 1-Бром-3-(пропилсульфонил)бензол (Промежуточное соединение 48)

К раствору 3-бромбензолэтиола (0.50 г, 2.6 ммоль) в диоксане (50 мл) добавляют 1-йодопропан (1.1 г, 6.5 ммоль) и карбонат цезия (2.2 г, 6.8 ммоль), полученную смесь перемешивают при дефлегмации, пока не произойдет реакция 3-бромбензолэтиола. Реакцию гасят насыщенным раствором NaHCO3 (25 мл) и смесь экстрагируют СНС1з (60 мл). Продукт в CHCl3 подвергают дефлегмации с mCPBA (2.9 г, 13 ммоль) пока все исходные соединения не прореагируют. Органический слой отмывают 2М NaOH для удаления избыточного количества mCPBA, высушивают над Na2SO4 и фильтруют. Фильтрат концентрируют и сырой продукт очищают на колонке с силикагелем со смесью гексаны/CHCl3 1:1 в качестве элюента с получением бесцветного масла (0.30 г, 43% в 2 этапа).
1H-NMR (500 MHz, DMSO-d6): 0.92 (t, J=7.4 Hz, 3H), 1.52-1.60 (m, 2H), 3.35-3.38 (m, 2H), 7.63 (t, J=8.0 Hz, 1H), 7.88-7.91 (m, 1H), 7.95-7.98 (m, 1H), 8.04 (t, J=1.8 Hz, 1H).
ПРИМЕР 134. 5-Метил-N4-(4-(4-метилпиперазин-1-ил)фенил)-N4-(3-пропилсульфонил)фенил)-пиримидин-2,4-диамина гидрохлорид (Соединение LXXXVIII)

Суспензию промежуточного соединения 32 (0.25 г, 0.84 ммоль), промежуточного соединения 48 (0.26 г, 1 ммоль), Pd2(dba)3 (8 мг, 0.01 ммоль), Xantphos (16 мг, 0.03 ммоль) и карбоната цезия (0.82 г, 2.52 ммоль) в диоксане (50 мл) дегазируют аргоном в течение 2 минут и затем подвергают дефлегмации в течение ночи. После охлаждения до комнатной температуры, растворитель удаляют путем вращения с выпариванием, а полученную смесь очищают на колонке с силикагелем с 10% СН3ОН/CHCl3 в качестве элюента с получением нужного соединения в виде белого твердого вещества. Полученное белое вещество растворяют в CHCl3 (30 мл) и титруют 2М HCl в диоксане до рН 1, Растворитель удаляют путем вращения с выпариванием и твердое вещество рекристаллизовывают из метанола (65 мг, 15%).
1H-NMR (500 MHz, DMSO-d6): 0.90 (t, J=7.4 Hz, 3H), 1.50-1.60 (m, 2H), 2.18 (s, 3H), 2.81 (s, 3H), 3.00-3.13 (m, 4H), 3.27 (t, J=7.7 Hz, 2H), 3.48 (d, J=10.9 Hz, 2H), 3.75 (d, J=11.4 Hz, 2H), 6.95 (d, J=8.8 Hz, 2H), 7.27 (d, J=8.9 Hz, 2H), 7.64 (t, J=8.0 Hz, 1H), 7.73 (d, J=7.8 Hz, 1H), 7.93 (s, 1H), 8.00 (s, 1H), 8.07 (s, 1H), 9.92 (s, 1H), 10.36 (s, 1H), 10.99 (s, 1H). MS (ES+): m/z 481 (M+H)+.
ПРИМЕР 135. 3-(Морфолинометил)бензоламин (Промежуточное соединение 49)

К раствору 3-нитробензальдегида (5.9 г, 39.02 ммоль), морфолина (3.4 г, 39.02 ммоль), цианоборогидрида натрия (2.7 г, 43 ммоль) в метаноле (50 мл) при комнатной температуре добавляют хлорид цинка (0.1 г, 0.73 ммоль). Раствор нагревают при дефлегмации в течение 1 часа. После охлаждения реакцию гасят водой (2 мл), а метанол удаляют путем выпаривания с вращением. Сырой продукт растворяют в 2М NaOH (50 мл) и экстрагируют CHCl3, высушивают над Na2SO4 и фильтруют. Фильтрат концентрируют в вакууме.
Полученный сырой продукт в метаноле (200 мл) восстанавливают при помощи никеля Рене и гидразина при комнатной температуре. Реакцию контролируют при помощи TLC в этилацетате. После того, как прореагирует весь исходный материал, метанол удаляют путем выпаривания с вращением. Сырой продукт очищают на колонке с силикагелем с этилацетатом в качестве элюента с получением желтого твердого вещества (1.5 г, 50% в 2 этапа).
1H-NMR (500 MHz, DMSO-d6): 2.31 (s, 4H), 3.28 (s, 2H), 3.56 (t, J=4.6 Hz, 4H), 4.97 (s, 2H), 6.40-6.45 (m, 2H), 6.53 (t, J=1.8 Hz, 1H), 6.93 (t, J=7.7 Hz, 1H).
ПРИМЕР 136. 5-Метил-N2-(3-(морфолинометил)фенил)пиримидин-2,4-диамин (Промежуточное соединение 50)

Смесь 2-хлор-5-метилпиримидин-4-амина (0.17 г, 1.17 ммоль) и промежуточного соединения 49 (0.25 г, 1.30 ммоль) суспендируют в уксусной кислоте (10 мл) и нагревают до 100°С в течение 2 часов. Смесь оставляют охлаждаться при комнатной температуре и уксусную кислоту удаляют при пониженном давлении. Осадок поглощают водой (20 мл) и нейтрализуют рН приблизительно до 8. Полученный раствор экстрагируют CHCl3 (100 мл) и органический слой сепарируют. Органический слой отмывают физиологическим раствором, высушивают над Na2SO4 и фильтруют. Фильтрат концентрируют в вакууме и сырой продукт очищают на колонке с силикагелем с 10% СН3ОН/EtOAc в качестве элюента с получением нужного соединения в виде масла (0.15 г, 43%).
1H-NMR (500 MHz, DMSO-d6): 1.91 (s, 3Н), 2.35 (s, 4H), 3.17 (s, 2H), 3.57 (t, J=4.4 Hz, 4H), 6.37 (s, 2H), 6.78 (d, J=7.5 Hz, 1H), 7.13 (t, J=7.8 Hz, 1H), 7.59 (s, 1H), 7.69 (s, 1H), 7.74 (d, J=9.3 Hz, 1H), 8.86 (s, 1H).
ПРИМЕР 137. N-tert-Бутил-3-[5-метил-2-(3-морфолин-4-илметил-фениламино)-пиримидин-4-иламино]-бензол сульфонамида гидрохлорид (Соединение LXXXIX)

Суспензию промежуточного соединения 50 (1.0 г, 3.42 ммоль), 3-бром-N-tert-бутил-бензолсульфонамида (1.28 г, 4.28 ммоль), Pd2(dba)3 (30 мг, 0.03 ммоль), Xantphos (40 мг, 0.07 ммоль) и карбоната цезия (3.34 г, 10.24 ммоль) в диоксане (50 мл) дегазируют аргоном в течение 2 минут и затем подвергают дефлегмации в течение ночи. После охлаждения до комнатной температуры, растворитель удаляют путем вращения с выпариванием, а полученную смесь очищают на колонке с силикагелем с 10% СН3ОН/CHCl3 в качестве элюента с получением нужного соединения в виде белого твердого вещества. Полученное белое вещество растворяют в диоксане (150 мл) и титруют 2М HCl в диоксане до рН 1. Растворитель удаляют путем вращения с выпариванием и твердое вещество рекристаллизовывают из метанола (0.15 мг, 8%).
1H-NMR (500 MHz, DMSO-d6): 1.08 (s, 9H), 2.20 (s, 3Н), 3.03-3.2 (m, 4H), 3.7-4.0 (m, 4H), 4.23 (s, 2H), 7.33 (t, J=7.9 Hz, 1H), 7.38 (d, J=7.7 Hz, 1H), 7.48 (s, 1H), 7.55-7.65 (m, 3Н), 7.71 (d, J=7.9 Hz, 1H), 7.90 (d, J=7.4 Hz, 1H), 8.01 (s,lH), 9.96 (br s, 1H), 10.61 (br s, 1H), 11.31 (brs, 1H). MS (ES+): m/z 511 (M+H)+.
ПРИМЕР 138. 2-Хлор-5-метил-N-(3,5-диметилфенил)пиримидин-4-амин (Промежуточное соединение 51)
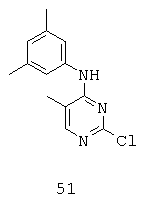
Смесь 1-бром-3,5-диметилбензола (104 мкл, 0.77 ммоль), 2-хлор-5-метил-пиримидин-4-иламин (104 мг, 0.72 ммоль), Pd(OAC)2 (15 мг, 0.07 ммоль), Xantphos (83 мг, 0.14 ммоль) и tert-бутоксид калия (159 мг, 1.42 ммоль) в диоксане (8 мл) облучают микроволнами 160°С в течение 20 минут. Реакционную смесь оставляют при комнатной температуре и фильтруют, промывая DCM и метанолом. Фильтрат концентрируют и очищают при помощи градиентной флэш-хроматографии (0-100% этилацетат в гексанах) с получением нужного соединения в виде желтого масла (89 мг, 50%). MS (ES+): m/z 248 (M+H)+.
ПРИМЕР 139. 5-Метил-N4-(3,5-диметилфенил)-N2-(4-(пиперидин-4-илокси)фенил)пиримидин-2,4-диамин (Соединение ХС)

Смесь промежуточного соединения 51 (89 мг, 0.36 ммоль) и tert-бутиловый сложный эфир 4-(4-амино-фенокси)-пиперидин-1-карбоновой кислоты (139 мг, 0.47 ммоль) в уксусной кислоте перемешивают при комнатной температуре в течение 16 ч, затем нагревают до 95°С в течение 2 ч. Реакционную смесь концентрируют в вакууме, очищают при помощи препаративной HPLC. Повышают основность продукта при помощи NaHCO3 (водн.) (10 мл) и экстрагируют этилацетатом (3×30 мл). Объединенные органические слои отмывают физиологическим раствором (5 мл), высушивают (Na2SO4) и концентрируют. Свободное основание поглощают МеОН (5 мл) и конц. HCl (5 капель) и через 2 минут концентрируют в вакууме в присутствии DCM и гексанов с получением HCl соли нужного соединения в виде грязно-белого твердого вещества (63 мг, 40%).
1H-NMR (500 MHz, DMSO-d6): δ 1.72-1.83 (m, 2H), 2.02-2.08 (m, 2H), 2.14 (d, J=0.6 Hz, 3Н), 2.24 (s, 6H), 3.04-3.15 (m, 2H), 3.21-3.31 (m, 2H), 4.57-4.60 (m, 1H), 6.85 (s, 1H), 6.91 (d, J=8.9 Hz, 2H), 7.20 (s, 2H), 7.37 (d, J=8.9 Hz, 2H), 7.85 (s,lH), 8.50 (br s, 1H), 8.56 (br s, 1H),9.36 (br s, 1H), 10.10 (br s, 1H). MS (ES+): m/z 404 (M+H)+.
ПРИМЕР 140. 2-Хлор-N-(3,5-диметоксифенил)-5-метилпиримидин-4-амин (Промежуточное соединение 52)
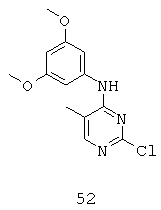
Смесь 1-бром-3,5-диметоксибензола (436 мг, 2.01 ммоль), 2-хлор-5-метил-пиримидин-4-иламина (287 мг, 2.00 ммоль), Pd(Oac)2 (44 мг, 0.20 ммоль), Xantphos (237 мг, 0.41 ммоль) и tert-бутоксида калия (448 мг, 3.99 ммоль) в диоксане (15 мл) и DMF (5 мл) облучают микроволнами при 160°С в течение 20 минут. Реакционную смесь охлаждают до комнатной температуры и фильтруют, промывая DCM и метанолом. Фильтрат концентрируют и очищают при помощи градиентной флэш-хроматографии (0-100% этилацетат в гексанах) с получением нужного соединения в виде желтого твердого вещества (182 мг, 33%).
1H-NMR (500 MHz, DMSO-d6): δ 2.17 (s, 3Н), 3.74 (s, 6H), 6.27 (t, J=2.2 Hz, 1H), 6.99 (d, J=2.2 Hz, 2H), 8.06 (s, 2H), 8.71 (s, 1H). MS (ES+): m/z 280 (M+H)+.
ПРИМЕР 141. N4-(3,5-Диметоксифенил)-5-метил-N2-(4-(пиперидин-4-илокси)фенил)пиримидин-2,4-диамин (Соединение XCI)

Смесь промежуточного соединения 52 (100 мг, 0.36 ммоль) и tert-бутилового сложного эфира 4-(4-амино-фенокси)-пиперидин-1-карбоновой кислоты (106 мг, 0.36 ммоль) в уксусной кислоте нагревают до 95°С в течение 2 ч. Реакционную смесь концентрируют в вакууме и очищают при помощи препаративной HPLC с получением TFA соли нужного соединения в виде коричневого твердого вещества (75 мг, 39%).
1H-NMR (500 MHz, DMSO-d6): δ 1.74-1.83 (m, 2H), 2.03-2.11 (m, 2H), 2.15 (s, 3H), 3.06-3.15 (m, 2H), 3.21-3.30 (m, 2H), 3.69 (s, 6H), 4.57-4.60 (m, 1H), 6.39 (t, J=2.2 Hz, 1H), 6.80 (d, J=2.2 Hz, 2H), 6.89 (d, J=8.9 Hz, 2H), 7.37 (d, J=9.0 Hz, 2H), 7.86 (s,lH), 8.53 (br s, 1H), 8.58 (br s, 1H), 9.49 (br s, 1H), 10.24 (br s, 1H). MS (ES+): m/z 436 (M+H)+.
ПРИМЕР 142. 3-Метил-N2-(4-(4-метилпиперазин-1-ил)фенил)-N4-(3-пиперидин-1-ил)фенил)пиримидин-2,4-диамин (Соединение XCII)

Смесь 1-(3-бромфенил)пиперидина (91 мг, 0.38 ммоль), промежуточного соединения 32 (99 мг, 0.33 ммоль), Pd2(dba)3 (15 мг, 0.02 ммоль), Xantphos (24 мг, 0.04 ммоль) и карбоната цезия (219 мг, 0.67 ммоль) в диоксане (4 мл) и DMF (5 мл) облучают микроволнами при 160°С в течение 15 минут. Реакционную смесь охлаждают до комнатной температуры, концентрируют в вакууме, поглощают метанолом и фильтруют, промывая DCM и метанолом. Фильтрат концентрируют и очищают при помощи градиентной хроматографии с получением TFA соли нужного соединения в виде грязно-белого твердого вещества (14 мг, 8%).
1H-NMR (500 MHz, DMSO-d6): δ 1.47-1.53 (m, 2H), 1.56-1.61 (m, 4H), 2.07 (s, 3H), 2.21 (s, 3H), 2.44 (t, J=4.9 Hz, 4H), 3.01 (t, J=4.9 Hz, 4H), 3.08 (t, J=5.4 Hz, 4H), 6.63 (dd, J=8.2, 2.3 Hz, 1H), 6.76 (d, J=9.0 Hz, 2H), 7.12 (t, J=8.3 Hz, 1H), 7.14 (s, 1H), 7.27 (d, J=7.6 Hz, 1H), 7.50 (d, J=9.0 Hz, 2H), 7.81 (s, 1H), 8.00 (s, 1H), 8.67 (s, 1H). MS (ES+): m/z 458 (M+H)+.
ПРИМЕР 143. N4-(3-(1H-Пиррол-1-ил)фенил)-5-метил-N2-(4-(4-метилпиперазин-1-ил)фенил)пиримидин-2,4-диамин (Соединение XCIII)

Смесь 1-(3-бромфенил)-1H-пиррола (86 мг, 0.39 ммоль), промежуточного соединения 32 (99 мг, 0.33 ммоль), Pd2(dba)3 (16 мг, 0.02 ммоль), Xantphos (26 мг, 0.05 ммоль) и карбоната цезия (215 мг, 0.66 ммоль) в диоксане (4 мл) облучают микроволнами при 160°С в течение 15 минут. Реакционную смесь охлаждают до комнатной температуры, концентрируют в вакууме, поглощают метанолом и фильтруют, промывая DCM и метанолом. Фильтрат концентрируют и очищают при помощи градиентной хроматографии с получением TFA соли нужного соединения в виде грязно-белого твердого вещества (32 мг, 18%).
1H-NMR (500 MHz, DMSO-d6): δ 2.11 (s, 3Н), 2.21 (s, 3Н), 2.42 (t, J=4.9 Hz, 4H), 2.95 (t, J=4.9 Hz, 4H), 6.24 (t, J=2.2 Hz, 2H), 6.58 (d, J=8.9 Hz, 2H), 7.23 (dd, J=7.8, 1.8 Hz, 1H), 7.31 (t, J=2.2 Hz, 2H), 7.37 (t, J=8.1 Hz, 1H), 7.43 (d, J=9.0 Hz, 2H), 7.60 (d, J=8.8 Hz, 1H), 7.86 (t, J=2.2 Hz, 1H), 7.87 (s, 1H), 8.30 (s, 1H), 8.74 (s, 1H). MS (ES+): m/z 440 (M+H)+.
ПРИМЕР 144. Tert-бутиловый сложный эфир 5-{2-[4-(1-tert-Бутоксикарбонил-пиперидин-4-илокси)-фениламино]-5-метил-пиримидин-4-иламино}-индол-1-карбоновой кислоты (Промежуточное соединение 53)
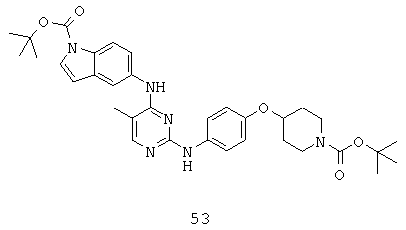
Смесь tert-бутил-5-бром-1H-индол-1-карбоксилата (161 мг, 0.54 ммоль), промежуточного соединения 42 (202 мг, 0.50 ммоль), Pd2(dba)3 (29 мг, 0.03 ммоль), Xantphos (36 мг, 0.07 ммоль) и карбоната цезия (321 мг, 0.98 ммоль) в диоксане (5 мл) облучают микроволнами при 160°С в течение 20 минут. Реакционную смесь охлаждают до комнатной температуры и фильтруют, промывая DCM. Фильтрат концентрируют и очищают при помощи градиентной флэш-хроматографии (0-20% МеОН в DCM) с получением нужного соединения в виде светло-коричневого твердого вещества (290 мг, 94%). MS (ES+): m/z 615 (М+Н)+.
ПРИМЕР 145. N4-(1H-Индол-5-ил)-5-метил-N2-(4-(пиперидин-4-илокси)фенил)пиримидин-2,4-диамин (Соединение XCIV)

К раствору ацетилхлорида (670 мкл, 9.42 ммоль) в метаноле (22 мл) добавляют промежуточное соединение 53 (290 мг, 0.47 ммоль) и реакционную смесь нагревают до 60°С в течение 4 ч. Смесь концентрируют в вакууме и очищают при помощи препаративной HPLC с получением TFA соли нужного соединения в виде твердого коричневого вещества (6 мг, 2%).
1H-NMR (500 MHz, DMSO-d6): δ 1.70-1.78 (m, 2H), 1.98-2.07 (m, 2H), 2.16 (s, 3H), 3.02-3.11 (m, 2H), 3.21-3.30 (m, 2H), 4.44-4.53 (m, 1H), 6.43 (s, 1H), 6.75 (d, J=8.2 Hz, 2H), 7.16 (d, J=8.4 Hz, 1H), 7.31 (d, J=8.7 Hz, 2H), 7.40-7.42 (m, 2H). 7.71 (s, 1H), 7.78 (s, 1H), 8.48 (br s, 1H), 8.54 (br s, 1H), 9.65 (br s, 1H), 9.99 (br s, 1H), 11.18 (s, 1H). MS (ES+): m/z 415 (M+H)+.
ПРИМЕР 146. N4-(4-Хлор-3-метокси-фенил)-5-метил-N2-(6-пиперазин-1-ил-пиридин-3-ил)-пиримидин-2,4-диамин (Соединение XCV)

Смесь промежуточного соединения 31 (0.10 г, 0.35 ммоль), tert-бутиловый сложный эфир 4-(5-амино-пиридин-2-ил)-пиперазин-1-карбоновой кислоты (0.10 г, 0.36 ммоль), Pd2(dba)3 (30 мг, 0.033 ммоль), Xantphos (35 мг, 0.06 ммоль) и карбоната цезия (0.23 мг, 0.71 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 170°С в течение 30 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют. Отфильтрованные твердые частицы отмывают DCM и фильтрат концентрируют. Осадок очищают при помощи флэш-хроматографии на силикагеле (гексаны к EtOAc) с получением Вос-защищенного предшественника. К раствору предшественника в DCM (5 мл) добавляют TFA (3 мл). Смесь перемешивают при комнатной температуре в течение 30 минут, концентрируют, а осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и полученное твердое вещество растирают в порошок со смесью гексаны/EtOAc (10/1, 55 мл). После фильтрации, получают нужное соединение в виде твердого белого вещества (20 мг, 13%).
1H-NMR (500 MHz, DMSO-d6): δ 2.09 (s, 3Н), 2.81 (t, J=5.0 Hz, 4H), 3.29-3.31 (m, 4H), 3.73 (s, 3Н), 6.70 (d, J=9,1 Hz, 1H), 7.26 (d, J=8.6 Hz, 1H), 7.42 (d, J=9.1 Hz, 1H), 7.49 (d, J=2.2 Hz, 1H), 7.76 (dd, J=9.1, 2.6 Hz, 1H), 7.86 (s, 1H), 8.29 (s, 1H), 8.31 (d, J=2.6 Hz, 1H), 8.71 (s, 1H). MS (ES+): m/z 426 (M+H)+.
ПРИМЕР 147. Tert-бутиловый сложный эфир 4-(4-Амино-2-метоксикарбонил-фенил)-пиперазин-1-карбоновой кислоты

К раствору tert-бутилового сложного эфира 4-(2-метоксикарбонил-4-нитро-фенил)-пиперазин-1-карбоновой кислоты (1.0 г, 2.7 ммоль) в МеОН (30 мл) добавляют 10 вес% Pd/C (0.1 экв. по весу) в атмосфере аргона. Смесь эвакуируют и затем насыщают водородом (3 цикла), после чего перемешивают при комнатной температуре в течение 2 ч. Гетерогенную реакционную смесь фильтруют через подушку с целлитом, отмывают МеОН и концентрируют в вакууме. Сырое амино-соединение используют на следующем этапе без дополнительной очистки. MS (ES+): m/z 336 (M+H)+.
ПРИМЕР 148. Метиловый сложный эфир 5-[4-(4-Хлор-3-метокси-фениламино)-5-метил-пиримидин-2-иламино]-2-пиперазин-1-ил-бензойной кислоты (Соединение XCVI)

Смесь промежуточного соединения 31 (0.10 г, 0.35 ммоль), промежуточного соединения 54 (0.14 г, 0.42 ммоль), Pd2(dba)3 (30 мг, 0.033 ммоль), Xantphos (35 мг, 0.06 ммоль) и карбоната цезия (0.23 мг, 0.71 ммоль) суспендируют в диоксане (15 мл) и нагревают при дефлегмации в атмосфере аргона в течение 2.5 ч. Реакционную смесь охлаждают до комнатной температуры и разводят DCM (30 мл). Смесь фильтруют и фильтрат концентрируют. Осадок очищают при помощи флэш-хроматографии на колонке с силикагелем (гексаны к 60% EtOAc/гексаны) с получением Вос-защищенного предшественника. К раствору предшественника в DCM (5 мл) добавляют TFA (2 мл). Смесь перемешивают при комнатной температуре в течение 1 ч, концентрируют, а осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и поглощают минимальным количеством EtOAc. Добавляют гексаны до тех пор, пока не произойдет преципитация твердых частиц. После фильтрации, получают нужное соединение в виде твердого белого вещества (40 мг, 24%).
1H-NMR (500 MHz, DMSO-d6): δ 2.11 (s, 3Н), 2.80-2.90 (m, 8H), 3.73 (s, 3H), 3.74 (s, 3H), 6.98 (d, J=8.9 Hz, 1H), 7.25 (d, J=8.5 Hz, 1H), 7.40-7.48 (m, 2H), 7.69 (dd, J=8.9, 2.6 Hz, 1H), 7.90 (d, J=2.6 Hz, 1H), 7.91 (s, 1H), 8.36 (s, 1H), 9.04 (s, 1H). MS (ES+): m/z 483 (M+H)+.
ПРИМЕР 149. Метиловый эфир 5-Амино-2-(2-пирролидин-1-ил-этокси)-бензойной кислоты (Промежуточное соединение 55)
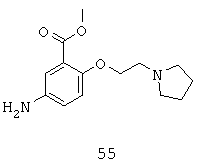
Смесь метилового эфира 5-амино-2-гидрокси-бензойной кислоты (1.0 г, 6.0 ммоль), 1-(2-хлор-этил)-пирролидин гидрохлорида (1.2 г, 7.1 ммоль) и карбоната цезия (5.0 г, 15 ммоль) в DMF (40 мл) нагревают при 60°С в течение 17 ч. Смесь оставляют охлаждаться при комнатной температуре, вливают в воду (60 мл) и экстрагируют EtOAc (2×50 мл). Объединенные экстракты отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и осадок очищают при помощи флэш-хроматографии на силикагеле (DCM к 30% MeOH/DCM) с получением нужного соединения (0.2 г, 13%) в виде светло-коричневого твердого вещества. MS (ES+): m/z 265 (М+Н)+.
ПРИМЕР 150. Метиловый эфир 5-[4-(Бензо[1,3]диоксол-4-иламино)-5-метил-пиримидин-2-иламино]-2-(2-пирролидин-1-ил-этокси)-бензойной кислоты (Соединение XCVII)

Смесь промежуточного соединения 30 (0.15 г, 0.57 ммоль), промежуточного соединения 55 (0.20 г, 0.75 ммоль), Pd2(dba)3 (50 мг, 0.055 ммоль), Xantphos (60 мг, 0.10 ммоль) и карбоната цезия (0.30 г, 0.92 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют. Отфильтрованные твердые частицы отмывают DCM и фильтрат концентрируют и осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и затем поглощают минимальным количеством EtOAc. Добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде грязно-белого вещества (30 мг, 11%).
1H-NMR (500 MHz, DMSO-d6): δ 1.65-1.72 (m, 4H), 2.07 (s, 3H), 2.50-2.62 (m, 4H), 2.75-2.85 (m, 2H), 3.73 (s, 3H), 4.02 (t, J=5.8 Hz, 2H), 5.88 (s, 2H), 6.78-6.88 (m, 3H), 6.92 (dd, J=8.0, 2.1 Hz, 1H), 7.75-7.80 (m, 2H), 7.83 (s, 1H), 8.22 (s, 1H), 8.89 (s, 1H). MS (ES+): m/z 492 (M+H)+.
ПРИМЕР 151. N-tert-Бутил-3-{5-метил-2-[4-(пиперидин-4-илокси)-фениламино]-пиримидин-4-иламин}-бензолсульфонамид (Соединение XCVIII)

Смесь промежуточного соединения 33 (0.15 г, 0.42 ммоль) и tert-бутилового сложного эфира 4-(4-амино-фенокси)-пиперидин-1-карбоновой кислоты (0.15 г, 0.51 ммоль) в уксусной кислоте (3 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 150°С в течение 20 минут. После охлаждения до комнатной температуры удаляют пробку с пробирки и смесь концентрируют. Осадок поглощают водой (20 мл) и доводят рН смеси 10% раствором NaOH до преципитации твердых частиц. Твердые частицы отфильтровывают и затем очищают при помощи HPLC. Нужные фракции объединяют, вливают в насыщенный раствор NaHCO3 (30 мл) и экстрагируют EtOAc (2×30 мл). Объединенные экстракты отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют.Фильтрат концентрируют и затем поглощают минимальным количеством EtOAc. Добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде белого вещества (20 мг, 9%).
1H-NMR (500 MHz, DMSO-d6): δ 1.12 (s, 9H), 1.65-1.73 (m, 2H), 1.95-2.05 (m, 2H), 2.12 (s, 3Н), 2.89-2.95 (m, 2H), 3.10-3.20 (m, 2H), 4.40-4.45 (m, 1H), 6.84 (d, J=9.1 Hz, 2H), 7.45-7.60 (m, 6H), 7.90 (s, 1H), 8.10-8.15 (m, 2H), 8.55 (s, 1H), 8.81 (s, 1H). MS (ES+): m/z 511 (M+H)+.
ПРИМЕР 152. 2-(5-Амино-пиридин-2-илокси)-этанол (Промежуточное соединение 56)

К раствору 2-(5-нитро-пиридин-2-илокси)-этанола (1.0 г, 5.4 ммоль) в МеОН (30 мл) добавляют 10 вес% Pd/C (0.1 экв. по весу) в атмосфере аргона. Смесь эвакуируют и затем насыщают водородом (3 цикла), после чего перемешивают при комнатной температуре в течение 1 ч. Гетерогенную реакционную смесь фильтруют через подушку с целлитом, отмывают МеОН и концентрируют в вакууме. Сырое амино-соединение используют на следующем этапе без дополнительной очистки. MS (ES+): m/z 155 (М+Н)+.
ПРИМЕР 153. 2-{5-[4-Бензол[1,3]диоксол-4-иламино)-5-метил-пиримидин-2-иламино]-пиридин-2-илокси}-этанол (Соединение XCIX)

Смесь промежуточного соединения 30 (0.10 г, 0.38 ммоль), промежуточного соединения 56 (0.10 г, 0.65 ммоль), Pd2(dba)3 (30 мг, 0.033 ммоль), Xantphos (35 мг, 0.06 ммоль) и карбоната цезия (0.26 г, 0.80 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют. Отфильтрованные твердые частицы отмывают DCM, фильтрат концентрируют и осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и затем поглощают минимальным количеством EtOAc. Добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде грязно-белого вещества (50 мг, 35%).
1H-NMR (500 MHz, DMSO-d6): δ 2.06 (s, 3H), 3.66 (q, J=5.4 Hz, 2H), 4.15 (t, J=5.2 Hz, 2H), 4.77 (t, J=5.5 Hz, 2H), 5.91 (s, 2H), 6.52 (d, J=9.0 Hz, 1H), 6.78-6.90 (m, 3H), 7.82 (s, 1H), 7.96 (dd, J=8.9,2.7 Hz, 1H), 8.22 (d, J=2.6 Hz, 1H), 8.27 (s, 1H), 8.84 (s, 1H). MS (ES+): m/z 382 (M+H)+.
ПРИМЕР 154. 1-[2-(2-Метокси-4-нитро-фенокси)-этил]-пирролидин (Промежуточное соединение 57)

Суспензию 2-метокси-4-нитро-фенолата калия (2.0 г, 9.7 ммоль), 1-(2-хлор-этил)-пирролидин гидрохлорида (2.0 г, 12 ммоль) и карбоната цезия (7.0, 22 моль в DMF (35 мл) нагревают до 80°С в течение 16 ч. Смесь оставляют охлаждаться до комнатной температуры, вливают в воду (60 мл) и экстрагируют EtOAc (2×50 мл). Объединенные экстракты отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и используют на следующем этапе синтеза без дополнительной очистки. MS (ES+): m/z 267 (М+Н)+.
ПРИМЕР 155. 3-Метокси-4-(2-пирролидин-1-ил-этокси)-фениламин (Промежуточное соединение 58)

К раствору промежуточного соединения 37 (1.7 г, 6.4 ммоль) в МеОН (30 мл) добавляют 10 вес% Pd/C (0.1 экв. по весу) в атмосфере аргона. Смесь эвакуируют и затем насыщают водородом (3 цикла), после чего перемешивают при комнатной температуре в течение 1 ч. Гетерогенную реакционную смесь фильтруют через подушку с целлитом, отмывают МеОН и концентрируют в вакууме. Сырое амино-соединение используют на следующем этапе без дополнительной очистки. MS (ES+): m/z 237 (М+Н)+.
ПРИМЕР 156. N4-Бензо[1,3]диоксол-4-ил-N2-[3-метокси-4-(2-пирролидин-1-ил-этокси)-фенил]-5-метил-пиримидин-2,4-диамин (Соединение С)

Смесь промежуточного соединения 30 (0.10 г, 0.38 ммоль), промежуточного соединения 58 (0.11 г, 0.46 ммоль), Pd2(dba)3 (30 мг, 0.033 ммоль), Xantphos (35 мг, 0.06 ммоль) и карбоната цезия (0.25 г, 0.77 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют. Отфильтрованные твердые частицы отмывают DCM, фильтрат концентрируют и осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и затем поглощают минимальным количеством EtOAc. Добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде белого вещества (50 мг, 28%).
1H-NMR (500 MHz, DMSO-d6): δ 1.65-1.72 (m, 4H), 2.06 (s, 3H), 2.50-2.62 (m, 4H), 2.75-2.85 (m, 2H), 3.50 (s, 3H), 3.94 (d, J=6.1 Hz, 2H), 5.84 (s, 2H), 6.67 (d, J=8.8 Hz, 1H), 6.78 (dd, J=7.8, 1.1 Hz, 1H), 6.83 (t, J=7.9 Hz, 1H), 6.92 (dd, J=8.1, 1.1 Hz, 1H), 7.14 (dd, J=8.7, 2.4 Hz, 1H), 7.23 (d, J=2.4 Hz,lH). 7.83 (s, 1H), 8.21 (s, 1H), 8.69 (s, 1H). MS (ES+): m/z 464 (M+H)+.
ПРИМЕР 157. N-tert-Бутил-3-[2-(4-имидазол-1-ил-фениламино)-5-метил-пиримидин-4-иламино]-бензолсульфонамид (Соединение CI)

Смесь промежуточного соединения 33 (0.40 г, 1.1 ммоль), 4-имидазол-1-ил-фениламина (0.20 г, 1.3 ммоль), Pd2(dba)3 (0.10 г, 0.11 ммоль), Xantphos (0.12 г, 0.21 ммоль) и карбоната цезия (0.80 г, 2.5 ммоль) в диоксане/DMF (3/1, 8 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 30 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют. Отфильтрованные твердые частицы отмывают DCM, фильтрат концентрируют и осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (40 мл). Объединенные водные слои экстрагируют EtOAc (2×40 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и затем поглощают минимальным количеством EtOAc. Добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде грязно-белого вещества (0.15 г, 28%).
1H-NMR (500 MHz, DMSO-d6): δ 1.12 (s, 9H), 2.15 (s, 3H), 7.07 (s, 1H), 7.43 (d, J=9.0 Hz, 2H), 7.50-7.60 (m, 3H), 7.61 (s, 1H), 7.79 (d, J=9.0 Hz, 2H), 7.98 (s, 1H), 8.08-8.13 (m, 3H), 8.64 (s, 1H), 9.19 (s, 1H). MS (ES+): m/z 478 (M+H)+.
ПРИМЕР 158. N-tert-Бутил-3-[2-(4-имидазол-1-илметил-фениламино)-5-метил-пиримидин-4-иламино]-бензолсульфонамид (Соединение CII)

Смесь промежуточного соединения 33 (0.10 г, 0.28 ммоль), 4-имидазол-1-илметил-фениламина (60 г, 0.35 ммоль), Pd2(dba)3 (25 г, 0027. ммоль), Xantphos (30 мг, 0.052 ммоль) и карбоната цезия (0.20 г, 0.61 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют. Отфильтрованные твердые частицы отмывают DCM, фильтрат концентрируют и осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и затем поглощают минимальным количеством EtOAc. Добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде белого вещества (40 мг, 29%).
1H-NMR (500 MHz, DMSO-d6): δ 1.12 (s, 9H), 2.13 (s, 3H), 5.07 (s, 2H), 6.89 (s, 1H), 7.12 (d, J=8.6 Hz, 2H), 7.15 (s, 1H), 7.46 (t, J=7.9 Hz, 1H), 7.49-7.52 (m, 1H), 7.56 (s, 1H), 7.63 (d, J=8.6 Hz, 2H), 7.72 (s, 1H), 7.94 (s, 1H), 8.09 (s, 1H), 8.14 (d, J=8.1 Hz, 1H), 8.60 (s, 1H), 9.02 (s, 1H). MS (ES+): m/z 492 (M+H)+.
ПРИМЕР 159. 2-(4-Амино-фенокси)-этанол (Промежуточное соединение 59)

Раствор 2-(4-нитро-фенокси)-этанола (2.1 г, 12 ммоль) в МеОН (30 мл) промывают аргоном и затем заряжают 10 вес% Pd/C (0.1 экв. по весу). Смесь эвакуируют в вакууме и затем насыщают водородом из водородного баллона. Цикл повоторяют снова и смесь перемешивают при комнатной температуре в течение 2 ч. Гетерогенную реакционную смесь фильтруют через подушку с целлитом, отмывают МеОН и концентрируют в вакууме с получением нужного соединения (1.8 г, 99%) в виде коричневого твердого вещества. MS (ES+): m/z 154 (М+Н)+.
ПРИМЕР 160. N-tert-Бутил-3-{2-[4-(2-гидрокси-этокси)-фениламино]-5-метил-пиримидин-4-иламино}-бензолсульфонамид (Соединение CIII)

Смесь промежуточного соединения 33 (0.10 г, 0.28 ммоль), промежуточного соединения 59 (55 г, 0.36 ммоль), Pd2(dba)3 (25 мг, 0027. ммоль), Xantphos (30 мг, 0.052 ммоль) и карбоната цезия (0.20 г, 0.61 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют. Отфильтрованные твердые частицы отмывают DCM, фильтрат концентрируют и осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и затем поглощают минимальным количеством EtOAc. Добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде белого твердого вещества (15 мг, 11%).
1H-NMR (500 MHz, DMSO-d6): δ 1.12 (s, 9H), 2.12 (s, 3H), 3.69 (q, J=5.2 Hz, 2H), 3.91 (t, J=5.1 Hz, 2H), 4.82 (t, J=5.5 Hz, 2H), 6.80 (d, J=9.1 Hz, 2H), 7.45-7.50 (m, 2H), 7.52 (d, J=9.0 Hz, 2H), 7.55 (s, 1H), 7.90 (s, 1H), 8.08-8.15 (m, 2H), 8.53 (s, 1H), 8.77 (s, 1H), MS (ES+): m/z 472 (M+H)+.
ПРИМЕР 161. N4-(4-Хлор-3-метокси-фенил)-5-метил-N2-(4-пиперазин-1-илметил-фенил)-пиримидин-2,4-диамин (Соединение CIV)

Смесь промежуточного соединения 31 (0.10 г, 0.35 ммоль), tert-бутилового сложного эфира 4-(4-амино-бензил)-пиперазин-1-карбоновой кислоты (0.12 г, 0.41 ммоль), Pd2(dba)3 (30 мг, 0033. ммоль), Xantphos (35 мг, 0.06 ммоль) и карбоната цезия (0.23 г, 0.71 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют. Отфильтрованные твердые частицы отмывают DCM и фильтрат концентрируют. Осадок очищают при помощи флэш-хроматографии на силикагеле (гексаны к 66% EtOAc/гексаны) с получением Вос-защищенного предшественника. К раствору предшественника в DCM (5 мл) добавляют TFA (3 мл). Смесь перемешивают при комнатной температуре в течение 1 ч, концентрируют и осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и затем поглощают минимальным количеством EtOAc. Добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде белого твердого вещества (13 мг, 9%).
1H-NMR (500 MHz, DMSO-d6): δ 2.11 (s, 3H), 2.30-2.40 (m, 4H), 2.83 (t, J=4.8 Hz, 4H), 3.37 (s, 2H), 3.75 (s, 3H), 7.08 (d, J=8.6 Hz, 2H), 7.29 (d, J=8.6 Hz, 1H), 7.43 (dd, J=8.6, 2.2 Hz, 1H), 7.47 (d, J=2.2 Hz, 1H), 7.59 (d, J=8.6 Hz 2H), 7.91 (s, 1H), 8.37 (s, 1H), 8.99 (s, 1H). MS (ES+): m/z 439 (M+H)+.
ПРИМЕР 162. N-tert-Бутил-3-{5-метил-2-[4-(2-метил-имидазол-1-ил)-фениламино]-пиримидин-4-иламино}-бензолсульфонамид (Соединение CV)

Смесь промежуточного соединения 33 (0.10 г, 0.28 ммоль), 4-(2-метил-имидазол-1-ил)-фениламина (60 мг, 0.35 ммоль), Pd2(dba)3 (25 мг, 0.027.ммоль), Xantphos (30 мг, 0.052 ммоль) и карбоната цезия (0.20 г, 0.61 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют. Отфильтрованные твердые частицы отмывают DCM, фильтрат концентрируют, а осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и затем поглощают минимальным количеством EtOAc. Добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде белого твердого вещества (30 мг, 22%).
1H-NMR (500 MHz, DMSO-d6): δ 1.11 (s, 9H), 2.15 (s, 3H), 2.24 (s, 3H), 6.87 (d, J=1.2 Hz, 1H), 7.18 (d, J=1.3 Hz, 1H), 7.22 (d, J=8.9 Hz, 2H), 7.50-7.55 (m, 2H), 7.56 (s, 1H), 7.79 (d, J=8.9 Hz, 2H), 7.98 (s, 1H), 8.07-8.10 (m, 2H), 8.65 (s, 1H), 9.26 (s, 1H). MS (ES+): m/z 492 (M+H)+.
ПРИМЕР 163. N-tert-Бутил-3-{5-метил-2-[4-(2-метил-имидазол-1-илметил)-фениламино]-пиримидин-4-иламино}-бензолсульфонамид (Соединение CVI)

Смесь промежуточного соединения 33 (0.10 г, 0.28 ммоль), 4-(2-метил-имидазол-1-илметил)-фениламина (65 мг, 0.35 ммоль), Pd2(dba)3 (25 мг, 0.027.ммоль), Xantphos (30 мг, 0.052 ммоль) и карбоната цезия (0.20 г, 0.61 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют. Отфильтрованные твердые частицы отмывают DCM, фильтрат концентрируют, а осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и затем поглощают минимальным количеством EtOAc. Добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде белого твердого вещества (30 мг, 21%).
1H-NMR (500 MHz, DMSO-d6): δ 1.12 (s, 9H), 2.13 (s, 3H), 2.24 (s, 3H), 5.01 (s, 2H), 6.73 (d, J=1.2 Hz, 1H), 7.01 (d, J=8.6 Hz, 2H), 7.07 (d, J=1.1 Hz, 1H), 7.44 (t, J=7.9 Hz, 1H), 7.48-7.51 (m, 1H), 7.56 (s, 1H), 7.62 (d, J=8.6 Hz, 2H), 7.94 (s, 1H), 8.08 (s, 1H), 8.12 (d, J=8.1 Hz, 1H), 8.60 (s, 1H), 9.02 (s, 1H). MS (ES+): m/z 506 (M+H)+.
ПРИМЕР 164. N-tert-Бутил-3-[5-метил-2-(4-пиридин-4-илметил-фениламино)-пиримидин-4-иламино]-бензолсульфонамид (Соединение CVII)

Смесь промежуточного соединения 33 (0.10 г, 0.28 ммоль), 4-Пиридин-4-илметил-фениламина (65 мг, 0.35 ммоль), Pd2(dba)3 (25 мг, О027.ммоль), Xantphos (30 мг, 0.052 ммоль) и карбоната цезия (0.20 г, 0.61 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют. Отфильтрованные твердые частицы отмывают DCM, фильтрат концентрируют, а осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и затем поглощают минимальным количеством EtOAc. Добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде белого твердого вещества (45 мг, 32%).
1H-NMR (500 MHz, DMSO-d6): δ 1.11 (s, 9H), 2.13 (s, 3H), 3.87 (s, 2H), 7.07 (d, J=8.6 Hz, 2H), 7.22 (d, J=6.0 Hz, 2H), 7.43 (t, J=7.9 Hz, 1H), 7.47-7.50 (m, 1H). 7.56 (d, J=6.3 Hz, 2H), 7.58 (s, 1H), 7.93 (s, 1H), 8.09 (s, 1H), 8.13 (d, J=8.0 Hz, 1H), 8.44 (d, J=5.8 Hz, 2H), 8.58 (s, 1H), 8.94 (s, 1H). MS (ES+): m/z 503 (M+H)+.
ПРИМЕР 165. N-tert-Бутил-3-[5-метил-2-(4-морфолин-4-ил-фениламино)-пиримидин-4-иламино]-бензолсульфонамид (Соединение CVIII)

Смесь промежуточного соединения 33 (0.10 г, 0.28 ммоль), 4-морфолин-4-ил-фениламина (60 мг, 0.34 ммоль), Pd2(dba)3 (25 мг, 0.027 ммоль), Xantphos (30 мг, 0.052 ммоль) и карбоната цезия (0.20 г, 0.61 ммоль) в диоксане/DMF (3/1, 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют. Отфильтрованные твердые частицы отмывают DCM, фильтрат концентрируют, а осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и затем поглощают минимальным количеством EtOAc. Добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде серого твердого вещества (45 мг, 32%).
1H-NMR (500 MHz, DMSO-d6): δ 1.12 (s, 9H), 2.12 (s, 3H), 3.00 (t, J=4.8 Hz, 4H), 3.73 (t, J=4.8 Hz, 4H), 6.82 (d, J=9.1 Hz, 2H), 7.45-7.52 (m, 4H), 7.56 (s, 1H), 7.89 (s, 1H), 8.10-8.17 (m, 2H), 8.52 (s, 1H), 8.73 (s, 1H). MS (ES+): m/z 497 (M+H)+.
ПРИМЕР 166. N-tert-Бутил-3-[5-метил-2-(4-[1,2,4]-триазол-1-илметил-фениламино)-пиримидин-4-иламино]-бензолсульфонамид (Соединение CIX)

Смесь промежуточного соединения 33 (0.10 г, 0.28 ммоль), 4-[1,2,4]триазол-1-илметил-фениламина (60 мг, 0.34 ммоль), Pd2(dba)3 (25 мг, 0.027 ммоль), Xantphos (30 мг, 0.052 ммоль) и карбоната цезия (0.20 г, 0.61 ммоль) в диоксане (4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют. Отфильтрованные твердые частицы отмывают DCM, фильтрат концентрируют, а осадок очищают при помощи HPLC, Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и затем поглощают минимальным количеством EtOAc. Добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде белого твердого вещества (37 мг, 27%).
1H-NMR (500 MHz, DMSO-d6): δ 1.17 (s, 9H), 2.13 (s, 3H), 5.29 (s, 2H), 7.14 (d, J=8.6 Hz, 2H), 7.46 (t, J=7.8 Hz, 1H), 7.48-7.51 (m, 1H), 7.56 (s, 1H), 7.63 (d, J=8.6 Hz, 2H), 7.94 (s, 1H), 7.95 (s, 1H), 8.08 (s, 1H), 8.13 (d, J=8.0 Hz, 1H), 8.59 (s, 1H), 8.60 (s, 1H), 9.04 (s, 1H). MS (ES+): m/z 493 (M+H)+.
ПРИМЕР 167. N-tert-Бутил-3-{5-метил-2-[4-(4-метил-имидазол-1-ил)-фениламино]-пиримидин-4-иламино}-бензолсульфонамид (Соединение СХ)

Смесь промежуточного соединения 33 (0.10 г, 0.28 ммоль), 4-(4-метил-имидазол-1-ил)-фениламина (60 мг, 0.35 ммоль), Pd2(dba)3 (25 мг, 0.027 ммоль), Xantphos (30 мг, 0.052 ммоль) и карбоната цезия (0.20 г, 0.61 ммоль) в диоксане (4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют. Отфильтрованные твердые частицы отмывают DCM, фильтрат концентрируют, а осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и затем поглощают минимальным количеством EtOAc. Добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде грязно-белого твердого вещества (20 мг, 15%).
1H-NMR (500 MHz, DMSO-d6): δ 1.12 (s, 9H), 2.15 (s, 3H), 2.16 (s, 3H), 7.30 (s, 1H), 7.38 (d, J=9.0 Hz, 2H), 7.50-7.56 (m, 2H), 7.57 (s, 1H), 7.76 (d, J=9.0 Hz, 2H), 7.96 (s, 1H), 7.97 (s, 1H), 8.09-8.13 (m, 2H), 8.63 (s, 1H), 9.16 (s, 1H). MS (ES+): m/z 492 (M+H)+.
ПРИМЕР 168. N-tert-Бутил-3-[5-метил-2-(4-[1,2,4]триазол-1-ил-фениламино)-пиримидин-4-иламино]-бензолсульфонамид (Соединение CXI)

Смесь промежуточного соединения 33 (0.10 г, 0.28 ммоль), 4-[1,2,4]триазол-1-ил-фениламина (55 мг, 0.34 ммоль), Pd2(dba)3 (25 мг, 0.027 ммоль), Xantphos (30 мг, 0.052 ммоль) и карбоната цезия (0.20 г, 0.61 ммоль) в диоксане (3 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют. Отфильтрованные твердые частицы отмывают DCM, фильтрат концентрируют, а осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и затем поглощают минимальным количеством EtOAc. Добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде белого твердого вещества (40 мг, 29%).
1H-NMR (500 MHz, DMSO-d6): δ 1.12 (s, 9H), 2.15 (s, 3H), 7.50-7.58 (m, 3H), 7.63 (d, J=9.1 Hz, 2H), 7.83 (d, J=9.0 Hz, 2H), 7.99 (s, 1H), 8.09 (s, 1H), 8.10-8.15 (m, 1H), 8.17 (s, 1H), 8.66 (s, 1H), 9.12 (s, 1H), 9.27 (s, 1H). MS (ES+): m/z 479 (M+H)+.
ПРИМЕР 169. N-tert-Бутил-3-{5-метил-2-[3-(1H-тетразол-5-ил)-фениламино]-пиримидин-4-иламино}-бензолсульфонамид (Соединение CXII)

Смесь промежуточного соединения 33 (0.10 г, 0.28 ммоль), 3-(1Н-тетразол-5-ил)-фениламина (55 мг, 0.34 ммоль), Pd2(dba)3 (25 мг, 0.027 ммоль), Xantphos (30 мг, 0.052 ммоль) и карбоната цезия (0.20 г, 0.61 ммоль) в диоксане (3 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют. Отфильтрованные твердые частицы отмывают DCM, фильтрат концентрируют, а осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и затем поглощают минимальным количеством EtOAc. Добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде белого твердого вещества (15 мг, 11%).
1H-NMR (500 MHz, DMSO-d6): δ 1.13 (s, 9H), 2.15 (s, 3H), 7.26 (t, J=7.9 Hz, 1H), 7,38 (d, J=8.0 Hz, 1H), 7.44 (dd, J=7.9, 1.1 Hz, 1H), 7.50 (d, J=7.6 Hz, 1H), 7.58 (s, 1H), 7.79 (dd, J=8.1, 1.4 Hz, 1H), 7.98 (s, 1H), 8.16 (s, 1H), 8.22 (s, 1H), 8.27 (d, J=7.8 Jz, 1H), 8.57 (s, 1H), 9.08 (s, 1H). MS (ES+): m/z 480 (M+H)+.
ПРИМЕР 170. 4-(1H-Тетразол-5-ил)-фениламин (Промежуточное соединение 60)

К раствору 5-(4-нитро-фенил)-1H-тетразола (1.0 г, 5.2 ммоль) в МеОН (30 мл) добавляют 10% вес. Pd/C (0.1 экв., по весу) в атмосфере аргона. Смесь эвакуируют, насыщают водородом (3 цикла) и перемешивают при комнатной температуре в течение 1.5 ч. Гетерогенную реакционную смесь фильтруют через подушку с целлитом, отмывают МЕОН и концентрируют в вакууме. Сырое амино-соединение используют на следующем этапе без дополнительной очистки. MS (ES+): m/z 162 (М+Н)+.
ПРИМЕР 171. N-tert-Бутил-3-{5-метил-2-[4-(1H-тетразол-5-ил)-фениламино]-пиримидин-4-иламино}-бензолсульфонамид (Соединение CXII)

Смесь промежуточного соединения 33 (0.10 г, 0.28 ммоль), промежуточного соединения 60 (60 мг, 0.37 ммоль), Pd2(dba)3 (25 мг, 0.027 ммоль), Xantphos (30 мг, 0.052 ммоль) и карбоната цезия (0.20 г, 0.61 ммоль) в диоксане/DMF (3/1; 4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют. Отфильтрованные твердые частицы отмывают DCM, фильтрат концентрируют, а осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и затем поглощают минимальным количеством EtOAc. Добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде белого твердого вещества (15 мг, 11%).
1H-NMR (500 MHz, DMSO-d6): δ 1.13 (s, 9H), 2.16 (s, 3Н), 7.52-7.56 (m, 2H), 7.57 (s, 1H), 7.83 (s, 4H), 8.01 (s, 1H), 8.08 (s, 1H), 8.13-8.19 (m, 1H), 8.69 (s, 1H), 9.34 (s, 1H). MS (ES+): m/z 480 (M+H)+.
ПРИМЕР 172. 3-{2-[4-(4-Ацетил-пиперазин-1-ил)-фениламино]-5-метил-пиримидин-4-иламино}-N-tert-бутил-бензолсульфонамид (Соединение CXIV)

Смесь промежуточного соединения 33 (0.10 г, 0.28 ммоль), 1-[4-(4-амино-фенил)-пиперазин-1-ил]-этанона (80 мг, 0.36 ммоль), Pd2(dba)3 (25 мг, 0.027 ммоль), Xantphos (30 мг, 0.052 ммоль) и карбоната цезия (0.20 г, 0.61 ммоль) в диоксане (3 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют. Отфильтрованные твердые частицы отмывают DCM, фильтрат концентрируют, а осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и затем поглощают минимальным количеством EtOAc. Добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде грязно-белого твердого вещества (55 мг, 37%).
1H-NMR (500 MHz, DMSO-d6): δ 1.12 (s, 9H), 2.04 (s, 3H), 2.12 (s, 3H), 2.97 (t, J=5.2 Hz, 2H), 3.03 (t, J=5.1 Hz, 2H), 3.57 (q, J=5.4 Hz, 4H), 6.85 (d, J=9.0 Hz, 2H), 7.46-7.52 (m, 4H), 7.56 (s, 1H), 7.90 (s, 1H), 8.10-8.17 (m, 2H), 8.52 (s, 1H), 8.75 (s, 1H). MS (ES+): m/z 538 (M+H)+.
ПРИМЕР 173. N-tert-Бутил-3-{5-метил-2-[4-(1-морфолин-4-ил-этил)-фениламино]-пиримидин-4-иламино}-бензолсульфонамид (Соединение CXII)

Смесь промежуточного соединения 33 (0.10 г, 0.28 ммоль), 4-(1-морфолин-4-ил-этил)-фениламина (80 мг, 0.39 ммоль), Pd2(dba)3 (30 мг, 0033 ммоль), Xantphos (35 мг, 0.061 ммоль) и карбоната цезия (0.26 г, 0.80 ммоль) в диоксане (4 мл) помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 минут. После охлаждения до комнатной температуры, удаляют пробку с пробирки и полученную смесь фильтруют. Отфильтрованные твердые частицы отмывают DCM, фильтрат концентрируют, а осадок очищают при помощи HPLC. Нужные фракции объединяют и вливают в насыщенный раствор NaHCO3 (30 мл). Объединенные водные слои экстрагируют EtOAc (2×30 мл) и объединенные органические слои отмывают физиологическим раствором, высушивают над безводным Na2SO4 и фильтруют. Фильтрат концентрируют и затем поглощают минимальным количеством EtOAc. Добавляют гексаны до преципитации твердых частиц. После фильтрации получают нужное соединение в виде белого твердого вещества (40 мг, 27%).
1H-NMR (500 MHz, DMSO-d6): δ 1.12 (s, 9H), 1.25 (d, J=6.6 Hz, 3H), 2.13 (s, 3H), 2.20-2.30 (m, 2H), 2.30-2.40 (m, 2H), 3.24 (q, J=6.6 Hz, 1H), 3.54 (t, J=4.4 Hz, 4H), 7.10 (d, J=8.5 Hz, 2H), 7.45-7.52 (m, 2H), 7.55 (s, 1H), 7.57 (d, J=8.5 Hz, 2H), 7.93 (s, 1H), 8.09 (s, 1H), 8.15 (d, J=7.7 Hz, 1H), 8.57 (s, 1H), 8.92 (s, 1H). MS (ES+): m/z 525 (M+H)+.
ПРИМЕР 174. N4-(1H-Индол-4-ил)-5-метил-N2-(4-(4-метилпиперазин-1-ил)фенил)пиримидин-2,4-диамин (Соединение CXVI)

Смесь промежуточного соединения 32 (270 мг, 0.9 ммоль), 4-бром-1H-индола (196 мг, 0.9 ммоль), Pd2(dba)3 (91 мг, 0.09 ммоль), Xantphos (157 мг, 0.27 ммоль) и карбоната цезия (1.2 г, 3.6 ммоль) суспендируют в диоксане (100 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (55 мг HCl соли, 14%) в виде белого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 2.22 (s, 3Н), 2.79 (d, J=4.3 Hz, 3H), 2.98-3.03 (m, 2H), 3.08-3.14 (m, 2H), 3.46-3.48 (m, 2H), 3.64-3.66 (m, 2H), 6.35-6.36 (m, 1H), 6.63 (br d, J=8.0 Hz, 1H), 6.98 (d, J=9.1 Hz, 2H), 7.05 (d, J=7.4 Hz, 1H), 7.16 (t, J=7.6 Hz, 1H), 7.36 (t, J=2.8 Hz, 2H), 7.43 (d, J=8.0 Hz, 1H), 7.86 (s, 1H), 10.07 (s, 1H), 10.27 (s, 1H), 11.00 (br s,lH), 11.38 (s, 1H),12.16 (brs, H). MS (ES+): m/z 414 (M+H)+.
ПРИМЕР 175. 2-Хлор-5-метил-N-(2,3-диметилфенил)пиримидин-4-амин (Промежуточное соединение 61)

Смесь 2-хлор-5-метилпиримидин-4-амина (143.6 мг, 1 ммоль), 1-бром-2,3-диметилбензола (222 мг, 1.2 ммоль), Pd2(dba)3 (92 мг, 0.1 ммоль), Xantphos (174 мг, 0.3 ммоль) и карбоната цезия (1.3 г, 4 ммоль) суспендируют в диоксане (150 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок растворяют в EtOAc (10 мл) и добавляют гексаны (100 мл). Твердые частицы отфильтровывают и отмывают гексанами с получением сырого нужного соединения в виде желтого твердого вещества.
ПРИМЕР 176. 3-Метил-N4-(2,3-диметилфеннил)-N2-(пиперидин-4-илокси)фенил)пиримидин-2,4-диамина (Соединение CXVII)

Смесь промежуточного соединения 61 (1.0 ммоль) и tert-бутил 4-(4-аминофенокси)пиперидин-1-карбоксилата (292.4 мг, 1,0 ммоль) суспендируют в уксусной кислоте (10 мл) и нагревают до 100°С в течение 4 ч. Смесь оставляют охлаждаться до комнатной температуры, после чего уксусную кислоту удаляют при пониженном давлении. Осадок поглощают водой (20 мл) и нейтрализуют рН приблизительно до 7. Полученный раствор экстрагируют EtOAc (30 мл) и органический слой сепарируют. Органический слой отмывают физиологическим раствором, высушивают над MgSO4 и фильтруют. Фильтрат концентрируют в вакууме и сырой продукт очищают при помощи HPLC с получением нужного соединения в виде желтого твердого вещества (105 мг соли HCl, 24%).
1H-NMR (500 MHz, DMSO-d6): δ 1.76-1.83 (m, 2H), 2.03 (s, 3H), 2.05-2.09 (m, 2H), 2.17 (s, 3Н), 2.30 (s, 3H), 3.02-3.05 (m, 2H), 3.18 (br s, 2H), 4.53-4.56 (m, 1H), 6.72 (d, J=8.5 Hz, 2H), 7.11-7.14 (m, 3H), 7.19-7.24 (m, 2H), 7.87 (s, 1H), 9.06 (br s, 1H), 9.13 (br s, 1H), 9.92 (s, 1H), 10.43 (s, 1H). MS (ES+): m/z 414 (M+H)+.
ПРИМЕР 177. N4-(4-Хлор-3,5-диметилфенил)-5-метил-N2-(4-(4-метилпиперазин-1-ил)фенил)пиримидин-2,4-диамин (Соединение CXVIII)

Смесь промежуточного соединения 32 (240 мг, 0.8 ммоль), 5-бром-2-хлор-1,3-диметилбензол (212 мг, 0.96 ммоль), Pd2(dba)3 (92 мг, 0.1 ммоль), Xantphos (170 мг, 0.3 ммоль) и карбоната цезия (1.3 г, 4 ммоль) суспендируют в диоксане (100 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (63 мг HCl соли, 17%) в виде белого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 2.15 (s, 3H), 2.17 (s, 3H), 2.80 (d, J=2.5 Hz, 3Н), 3.06-3.14 (m, 4H), 3.48-3.52 (m, 2H), 3.75-3.77 (m, 2H), 6.93 (d, J=8.9 Hz, 2H), 7.29 (d, J=8.9 Hz, 2H), 7.46 (s, 2H), 7.90 (s, 1H), 9.65 (s, 1H), 10.49 (s, 1H), 11.13 (br s, 2H). MS (ES+): m/z 437 (M+H)+.
ПРИМЕР 178. N2-(4-(2-Пирролидин-1-ил)этокси)фенил)-N4-(3-tert-бутилфенил)-5-метил-пиримидин-2,4-диамин (Соединение CXIX)

Смесь промежуточного соединения 41 (365 мг, 1.32 ммоль) и 4-(2-(пирролидин-1-ил)этокси)бензоламина (410 мг, 1.98 ммоль) суспендируют в уксусной кислоте (20 мл) и нагревают до 100°С в течение 4 ч. Смесь оставляют охлаждаться до комнатной температуры, после чего уксусную кислоту удаляют при пониженном давлении. Осадок поглощают водой (20 мл) и нейтрализуют рН приблизительно до 7. Полученный раствор экстрагируют EtOAc (30 мл) и органический слой сепарируют. Органический слой отмывают физиологическим раствором, высушивают над MgSO4 и фильтруют. Фильтрат концентрируют в вакууме и сырой продукт очищают при помощи HPLC с получением нужного соединения в виде белого твердого вещества (127 мг соли HCl, 20%).
1H-NMR (500 MHz, DMSO-d6): δ 1.89-1.91 (m, 2H), 1.98-2.02 (m, 2H), 2.17 (s, 3H), 3.07-3.12 (m, 2H), 3.52-3.57 (m, 4H), 4.32 (t, J=4.8 Hz, 2H), 6.90 (d, J=8.9 Hz, 2H), 7.29-7.38 (m, 4H), 7.43-7.44 (m, 1H), 7.48 (d, J=7.9 Hz, 1H), 7.89 (s, 1H), 9.75 (s, 1H), 10.51 (s, 1H), 11.07 (br s, 1H). MS (ES+): m/z 446 (M+H)+.
ПРИМЕР 179. N2-(4-(2-(Пирролидин-1-ил)этокси)фенил)-N4-(4-(3-tert-бутилфениламино)-5-метилпиримидин-2-ил)-5-метилпиримидин-2,4-диамин (Соединение СХХ)

Смесь промежуточного соединения 41 (210 мг, 0.67 ммоль), промежуточного соединения 38 (185 мг, 0.67 ммоль), Pd2(dba)3 (55 мг, 0.06 ммоль), Xantphos (104 мг, 0.18 ммоль) и карбоната цезия (782 г, 2.4 ммоль) суспендируют в диоксане (50 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (94 мг HCl соли, 24%) в виде желтого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 1.29 (s, 9H), 1.84-1.88 (m, 2H), 1.94-2.01 (m, 2H), 2.14 (s, 3H), 2.27 (s, 3H), 3.06-3.10 (m, 2H), 3.51-3.56 (m, 4H), 4.29 (t, J=4.9 Hz, 2H), 6.97 (d, J=9.1 Hz, 2H), 7.27 (d, J=8.6 Hz, 2H), 7.34 (t, J=7.9 Hz, 2H), 7.57 (t, J=1.9 Hz, 2H), 7.65 (d, J=9.1 Hz, 1H), 7.72 (d, J=8.6 Hz, 2H), 8.15 (s, 1H), 8.39 (s, 1H), 9.82 (s, 1H), 10.21 (br s, 1H), 10.68 (br s, 1H), 10.93 (br s, 1H). MS (ES+): m/z 553 (M+H)+.
ПРИМЕР 180. 5-Метил-N2-[4-(4-метил-пиперазин-1-ил)-фенил]-N4-[3-(пиперидин-1-сульфонил)-фенил]-пиримидин-2,4-диамин (Соединение CXXI)

Смесь промежуточного соединения 32 (150 мг, 0.5 ммоль), 1-(3-бром-бензолсульфонил)-пиперидина (152 мг, 0.5 ммоль), Pd2(dba)3 (46 мг, 0.05 ммоль), Xantphos (87 мг, 0.15 ммоль) и карбоната цезия (652 мг, 2 ммоль) суспендируют в диоксане (20 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (84 мг HCl соли, 37%) в виде белого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 1.30-1.34 (m, 2H), 1.50-1.55 (m, 4H), 2.17 (s, 3H), 2.81 (d, J=4.5 Hz, 3H), 2.88 (t, J=5.3 Hz, 4H), 3.04-3.16 (m, 4H), 3.47-3.51 (m, 2H), 3.75-3.77 (m, 2H), 6.33-6.34 (m, 1H), 6.95 (d, J=9.0 Hz, 2H), 7.25 (d, J=9.0 Hz, 2H), 7.56-7.63 (m, 2H), 7.83 (t, J=1.7 Hz, 1H), 7.92 (s, 1H), 8.05 (d, J=9.3 Hz, 1H), 9.94 (s, 1H), 10.38 (s, 1H), 10.88 (br s, 1H). MS (ES+): m/z 522 (M+H)+.
ПРИМЕР 181. 5-Метил-N2-[4-(4-метил-пиперазин-1-ил)-фенил]-N4- [3-(2-метил-пиперидин-1-сульфонил)-фенил]-пиримидин-2,4-диамин (Соединение CXXII)

Смесь промежуточного соединения 32 (161 мг, 0.54 ммоль), 1-(3-бром-бензолсульфонил)-2-метил-пиперидина (172 мг, 0.54 ммоль), Pd2(dba)3 (46 мг, 0.05 ммоль), Xantphos (87 мг, 0.15 ммоль) и карбоната цезия (652 мг, 2 ммоль) суспендируют в диоксане (20 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (10 мг HCl соли, 3%) в виде белого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 0.98 (d, J=6.9 Hz, 3Н), 1.15-1.21 (m, 1H), 1.36-1.40 (m, 3Н), 1.47-1.53 (m, 2H), 2.18 (s, 3Н), 2.80 (d, J=4.5 Hz, 3Н), 2.94-2.99 (m, 2H), 3.05-3.16 (m, 4H), 3.47-3.49 (m, 2H), 3.59-3.61 (m, 2H), 3.73-3.76 (m, 2H), 4.08-4.10 (m, 1H), 6.93 (d, J=8.9 Hz, 2H), 7.25 (d, J=8.9 Hz, 2H), 7.58 (t, J=8.9 Hz, 1H), 7.65 (d, J=8.0 Hz, 1H), 7.92 (d, J=7.1 Hz, 2H), 7.96 (br, 1H), 9.95 (s, 1H), 10.45 (s, 1H). 11.00 (br s, 1H). MS (ES+): m/z 536 (M+H)+.
ПРИМЕР 182. N-Циклопентил-3-{5-метил-2-[4-(4-метил-пиперазин-1-ил)-фениламино]-пиримидин-4-иламино}-бензолсульфонамид (Соединение CXXIII)

Смесь промежуточного соединения 32 (229 мг, 0.78 ммоль), 3-бром-N-циклопентил-бензолсульфонамида (280 мг, 0.92 ммоль), Pd2(dba)3 (92 мг, 0.1 ммоль), Xantphos (180 мг, 0.3 ммоль) и карбоната цезия (1.3 г, 4 ммоль) суспендируют в диоксане (100 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (130 мг HCl соли, 25%) в виде белого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 1.27-1.36 (m, 4H), 1.36-1.58 (m, 4H), 2.18 (s, 3Н), 2.80 (d, J=4.6 Hz, 3Н), 3.05-3.15 (m, 4H), 3.36-3.42 (m, 1H), 3.47-3.49 (m, 2H), 3.74-3.76 (m, 2H), 6.94 (d, J=8.7 Hz, 2H), 7.26 (d, J=8.9 Hz, 2H), 7.59 (t, J=8.0 Hz, 1H), 7.68 (d, J=8.0 Hz, 1H), 7.75 (d, J=7.1 Hz, 2H), 7.92 (br, 2H), 7.93 (br, 1H), 9.96 (s, 1H), 10.45 (s, 1H), 10.45 (s, 1H), 11.98 (br s, 1H). MS (ES+): m/z 522 (M+H)+.
ПРИМЕР 183. 5-Метил-N2-[4-(4-метил-пиперазин-1-ил)-фенил]-N4-[3-(пирролидин-1-сульфони)фенил]-пиримидин-2,4-диамин (Соединение CXXIV)

Смесь промежуточного соединения 32 (228 мг, 1.0 ммоль), 1-(3-бром-бензолсульфонил)-пирролидина (360 мг, 1.24 ммоль), Pd2(dba)3 (92 мг, 0.1 ммоль), Xantphos (180 мг, 0.3 ммоль) и карбоната цезия (1.3 г, 4 ммоль) суспендируют в диоксане (100 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (200 мг HCl соли, 37%) в виде белого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 1.61-1.65 (m, 4H), 2.19 (s, 3H), 2.80 (br s, 3H), 3.06-3.16 (m, 10Н), 3.74-3.77 (br, 2H), 6.94 (d, J=9.0 Hz, 2H), 7.26 (d, J=9.0 Hz, 2H), 7.60 (t, J=8.0 Hz, 1H), 7.65 (d, J=8.0 Hz, 1H), 7.91 (t, J=1.7 Hz, 1H), 7.93 (s, 1H), 8.05 (d, J=7.5 Hz, 1H), 9.95 (s, 1H), 10.43 (s, 1H), 11.07 (br s, 1H). MS (ES+): m/z 508 (M+H)+.
ПРИМЕР 184. N4-[3-(2,5-Диметил-пирролидин-1-сульфонил)-фенил]-5-метил-N2-[4-(4-метил-пиперазин-1-ил)-фенил]-пиримидин-2,4-диамин (Соединение CXXV)

Смесь промежуточного соединения 32 (298 мг, 1.0 ммоль), 1-(3-бром-бензолсульфонил)-2,5-диметил-пирролидина (318 мг, 1.0 ммоль), Pd2(dba)3 (92 мг, 0.1 ммоль), Xantphos (180 мг, 0.3 ммоль) и карбоната цезия (1.3 г, 4 ммоль) суспендируют в диоксане (100 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (100 мг HCl соли, 17%) в виде белого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 1.26 (s, 3H), 1.27 (s, 3H), 1.45-1.48 (m, 4H), 2.19 (s, 3H), 2.80 (d, J=4.6 Hz, 3H), 3.06-3.15 (m, 4H), 3.47-3.50 (m, 2H), 3.60-3.64 (m, 2H), 3.74-3.76 (m, 2H), 6.94 (d, J=9.0 Hz, 2H), 7.25 (d, J=9.0 Hz, 2H), 7.59 (t, J=8.0 Hz, 1H), 7.68 (d, J=7.6 Hz, 1H), 7.93 (br, 2H), 8.02 (br, 1H), 9.97 (s, 1H), 10.47 (s, 1H), 11.07 (br s, 1H). MS (ES+): m/z 536 (M+H)+.
ПРИМЕР 185. N-tert-Бутил-3-[5-метил-2-(4-пиперазин-1-ил-фениламино)-пиримидин-4-иламино]-бензолсульфонамид (Соединение CXXVI)

Смесь промежуточного соединения 33 (355 мг, 1.0 ммоль), tert-бутил-4-(4-аминофенил)пиперазин-1-карбоксилата (278 мг, 1.0 ммоль), Pd2(dba)3 (92 мг, 0.1 ммоль), Xantphos (180 мг, 0.3 ммоль) и карбоната цезия (1.3 г, 4 ммоль) суспендируют в диоксане (100 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок растворяют в CH2Cl2 (10 мл) и добавляют трифторуксусную кислоту (2 мл). Смесь перемешивают при комнатной температуре в течение 4 ч, затем добавляют 10% NaOH. Органический слой сепарируют и водный слой экстрагируют CH2Cl2 (10 мл × 2). Объединенные органические слои высушивают (Na2SO4). Растворитель удаляют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (62 мг, 12%) в виде белого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 1.10 (s, 9H), 2.18 (s, 3H), 3.20 (br. 4H), 3.33 (br, 4H), 6.94 (d, J=9.0 Hz, 2H), 7.25 (d, J=9.0 Hz, 2H), 7.57 (t, J=8.0 Hz, 1H), 7.63 (s, 1H), 7.71 (d, J=8.1 Hz, 1H), 7.87 (br, 1H), 7.92 (br, 1H), 7.96 (br, 1H), 9.30 (br, 1H), 9.96 (s, 1H), 10.46 (s, 1H). MS (ES+): m/z 496 (M+H)+.
ПРИМЕР 186. N-tert-Бутил-3-(2-{4-[4-(2-гидрокси-этил)-пиперазин-1-ил]-фениламино}-[5-метил-пиримидин-4-иламино]-бензолсульФонамид (Соединение CXXVII)

Описанное выше соединение CXXVI (31 мг, 0.06 ммоль) растворяют в DMF (10 мл), после чего добавляют 2-бромэтанол (16 мг, 0.13 ммоль) и диизопропилэтиламин (33 мг, 0.25 ммоль). Смесь перемешивают при комнатной температуре в течение 48 ч Растворитель удаляют в вакууме и осадок растворяют в EtOAc (20 мл). Раствор отмывают насыщенным NaHCO3 и физиологическим раствором. Объединенные органические слои высушивают и концентрируют до 2 мл раствора, после чего добавляют Et2O (20 мл). Твердые частицы собирают путем центрифугирования и превращают в HCl соль нужного соединения (10.7 мг, 30%).
1H-NMR (500 MHz, DMSO-d6): δ 1.09 (s, 9H), 2.17 (s, 3H), 3.12-3.23 (m, 4H), 3.56-3.60 (m, 2H), 3.69-3.74 (m, 2H), 3.83 (br, 2H), 4.13 (br, 2H), 6.94 (d, J=9.0 Hz, 2H), 7.25 (d, J=9.0 Hz, 2H), 7.57 (t, J=8.0 Hz, 1H), 7.63 (s, 1H), 7.71 (d, J=8.1 Hz, 1H), 7.87 (br, 1H), 7.93 (br, 1H), 7.95 (br, 1H), 9.98 (s, 1H), 10.53 (s, 1H), 10.75 (br, 1H). MS (ES+): m/z 540 (M+H)+.
ПРИМЕР 187. N-tert-Бутил-3-[5-метил-2-(3-пиперазин-1-ил-фениламино)-пиримидин-4-иламино]-бензолсульфонамид (Соединение CXXVIII)

Смесь промежуточного соединения 33 (240 мг, 0.67 ммоль), tert-бутил-4-(3-аминофенил)пиперазин-1-карбоксилата (166 мг, 0.6 ммоль), Pd2(dba)3 (55 мг, 0.06 ммоль), Xantphos (104 мг, 0.18 ммоль) и карбоната цезия (782 мг, 2.4 ммоль) суспендируют в диоксане (100 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок растворяют в CH2Cl2 (10 мл) и добавляют трифторуксусную кислоту (2 мл). Смесь перемешивают при комнатной температуре в течение 4 ч, затем добавляют 10% NaOH. Органический слой сепарируют и водный слой экстрагируют CH2Cl2 (10 мл × 2). Объединенные органические слои высушивают (Na2SO4). Растворитель удаляют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (18 мг, 6%) в виде белого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 1.10 (s, 9H), 2.19 (s, 3H), 3.17 (br, 4H), 3.27-3.29 (m, 4H), 6.80 (d, J=8.1 Hz, 1H), 6.87 (br, 1H), 6.96 (d, J=8.1 Hz, 1H), 7.16 (t, J=8.1 Hz, 1H), 7.53 (t, J=8.3 Hz, 1H), 7.61 (s, 1H), 7.70 (d, J=7.8 Hz, 1H), 7.94 (br, 3H), 9.19 (br, 2H), 9.93 (s, 1H), 10.48 (s, 1H). MS (ES+): m/z 496 (M+H)+.
ПРИМЕР 188. N-tert-Бутил-3-(2-{3-[4-(2-гидрокси-этил)-пиперазин-1-ил]-фениламиноМ5-метил-пиримидин-4-иламино]-бензолсульфонамид (Соединение CXXIX)

Описанное выше соединение CXXVI (12 мг, 0.024 ммоль) растворяют в DMF (10 мл), после чего добавляют 2-бромэтанол (6.1 мг, 0.048 ммоль) и диизопропилэтиламин (12 мг, 0.092 ммоль). Смесь перемешивают при комнатной температуре в течение 48 ч Растворитель удаляют в вакууме и осадок растворяют в EtOAc (20 мл). Раствор отмывают насыщенным NaHCO3 и физиологическим раствором. Объединенные органические слои высушивают и концентрируют до 2 мл раствора, после чего добавляют Et2O (20 мл). Твердые частицы собирают путем центрифугирования и превращают в HCl соль нужного соединения (7 мг, 51%).
1H-NMR (500 MHz, DMSO-d6): δ 1.09 (s, 9H), 2.19 (s, 3H), 3.12-3.22 (m, 4H), 3.56-3.60 (m, 2H), 3.69-3.74 (m, 2H), 3.81 (br, 2H), 4.12 (br, 2H), 6.80 (br, 1H), 6.88 (br, 1H), 6.96 (br, 1H), 7.16 (br, 1H), 7.57 (br, 1H), 7.60 (s, 1H), 7.69 (d, J=7.8 Hz, 1H), 7.94 (br, 3H), 9.94 (s, 1H), 10.49 (s, 1H). MS (ES+): m/z 540 (M+H)+.
ПРИМЕР 189. N2-(4-(1H-Пиразол-1-ил)фенил)-N4-(3-tert-бутилфенил)-5-метилпиримидин-2,4-диамин (Соединение СХХХ)

Смесь промежуточного соединения 41 (580 мг, 2.1 ммоль) и 4-(1Н-пиразол-1-ил)бензоламина (335 мг, 2.1 ммоль) суспендируют в уксусной кислоте (10 мл) и нагревают до 100°С в течение 4 ч. Смесь оставляют охлаждаться до комнатной температуры и уксусную кислоту удаляют при пониженном давлении. Осадок поглощают водой (20 мл) и нейтрализуют рН ~7. Полученный раствор экстрагируют EtOAc (30 мл) и органический слой сепарируют. Органический слой отмывают физиологическим раствором, высушивают над MgSO4 и фильтруют. Фильтрат концентрируют в вакууме и сырой продукт очищают при помощи HPLC с получением нужного соединения (31 мг, 4%) в виде желтого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 1.24 (s, 9H), 2.18 (s, 3H), 6.53 (t, J=2.0 Hz, 1H), 7.33 (d, J=8.0 Hz, 1H), 7.38 (t, J=7.9 Hz, 1H), 7.44 (s, 1H), 7.47 (d, J=8.2 Hz, 1H), 7.50 (d, J=8.9 Hz, 2H), 7.67 (d, J=8.9 Hz, 2H). 7.73 (s, 1H), 7.95 (s, 1H), 8.43 (d, J=2.4 Hz, 1H), 9.81 (br s, 1H), 10.67 (s, 1H). MS (ES+): m/z 399 (M+H)+.
ПРИМЕР 190. N4-(7-Хлор-1H-индол-4-ил)-5-метил-N2-(4-((пиперазин-1-ил)метил)фенил-пиримидин-2,4-диамин (Соединение CXXXI)

Смесь промежуточного соединения 40 (150 мг, 0.37 ммоль), 4-бром-7-хлор-1H-индола (87 мг, 037 ммоль), Pd2(dba)3 (38 мг, 0.04 ммоль), Xantphos (76 мг, 0.12 ммоль) и карбоната цезия (521 мг, 1.6 ммоль) суспендируют в диоксане (50 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок растворяют в CH2Cl2 (10 мл) и добавляют трифторуксусную кислоту (2 мл). Смесь перемешивают при комнатной температуре в течение 4 ч, затем добавляют 10% NaOH. Органический слой сепарируют и водный слой экстрагируют CH2Cl2 (10 мл × 2). Объединенные органические слои высушивают (Na2SO4). Растворитель удаляют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (26 мг, 15%) в виде белого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 2.21 (s, 3Н), 3.30 (br, 4H), 3.50 (br, 4H), 4.20 (br, 2H), 6.91 (s, 1H), 7.11 (d, J=8.3 Hz, 1H), 7.40 (d, J=7.5 Hz, 1H), 7.42 (t, J=2.7 Hz, 1H), 7.70 (br, 4H), 8.03 (s, 1H), 9.87 (br,lH), 9.95 (s, 1H), 10.64 (s, 1H), 11.64 (s, 1H). MS (ES+): m/z 448 (M+H)+.
ПРИМЕР 191. N4-(3-tert-Бутилфенил)-5-метил-N2-(4-(2-метил-1Н-имидазол-1-ил)фенил)-пиримидин-2,4-диамин (Соединение CXXXII)

Смесь промежуточного соединения 41 (180 мг, 0.65 ммоль), 4-(2-метил-1Н-имидазол-1-ил)бензоламина (113 мг, 0.65 ммоль), Pd2(dba)3 (55 мг, 0.06 ммоль), Xantphos (104 мг, 0.18 ммоль) и карбоната цезия (782 мг, 2.4 ммоль) суспендируют в диоксане (100 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (78 мг HCl соли, 27%) в виде белого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 1.26 (s, 9H), 2.21 (s, 3H), 2.50 (s, 3H), 7.31-7.36 (m, 1H), 7.40 (t, J=7.8 Hz, 1H), 7.44 (d, J=8.9 Hz, 2H), 7.47 (d, J=8.0 Hz, 2H), 7.65 (d, J=8.9 Hz, 2H), 7.75 (d, J=2.1 Hz, 1H), 7.79 (d, J=2.1 Hz, 2H), 8.03 (s.lH), 10.02 (s, 1H), 11.26 (s, 1H). MS (ES+): m/z 413 (M+H)+.
ПРИМЕР 192. 4-(4-Метил-1H-имидазол-1-ил)-бензоламин (Промежуточное соединение 62)

К раствору 1-фтор-4-нитробензола (1.7 г, 12 ммоль) в DMF (100 мл) добавляют 4-метил-1H-имидазол (0.82 г, 10 ммоль) и К2СО3 (11 г, 80 ммоль). Смесь нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок растворяют в EtOAc (100 мл) и отмывают физиологическим раствором (100 мл × 2). Органический слой высушивают и концентрируют. Твердые частицы растворяют в МеОН и насыщают Ar в течение 2 мин, после чего добавляют 10% Pd-C. Гидрогенизацию завершают в течение 4 ч. Катализатор удаляют путем фильтрации, а растворитель удаляют в вакууме с получением нужного соединения (1.5 г, 87%) в виде коричневого твердого вещества.
ПРИМЕР 193. N4-(3-tert-Бутилфенил)-5-метил-N2-(4-(4-метил-1H-имидазол-1-ил)фенил)пиримидин-2,4-диамин (Соединение CXXXIII)

Смесь промежуточного соединения 41 (318 мг, 1.15 ммоль) и промежуточного соединения 62 (200 мг, 1.15 ммоль), Pd2(dba)3 (92 мг, 0.1 ммоль), Xantphos (180 мг, 0.3 ммоль) и карбоната цезия (1.3 мг, 4 ммоль) суспендируют в диоксане (100 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (66 мг соли HCl, 20%) в виде белого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 1.26 (s, 9H), 2.19 (s, 3H), 2.36 (s, 3H), 7.30 (d, J=7.9 Hz, 1H), 7.41 (d, J=7.9 Hz, 1H), 7.44 (t, J=1.8 Hz, 1H), 7.54 (d, J=7.9 Hz, 1H), 7.59 (d, J=9.0 Hz, 2H), 7.68 (d, J=9.0 Hz, 2H), 7.94 (s, 1H), 7.99 (s,lH), 9.53 (d, J=1.3 Hz, 1H), 9.72 (br s, 1H), 10.81 (br s, 1H). MS (ES+): m/z 413 (M+H)+.
ПРИМЕР 194. tert-Бутил-4-(4-аминофенил)пиперидин-1-карбоксилат (Промежуточное соединение 63)

К раствору 4-(4-нитрофенил)пиперидина (412 мг, 2 ммоль) в CH2Cl2 (100 мл) добавляют ди-tert-бутилкарбонат (480 мг, 2.2 ммоль) и N,N-диметилпиридин-4-амин (50 мг, 0.4 ммоль). Смесь перемешивают в течение 20 минут при комнатной температуре. К смеси добавляют насыщенный NaHCO3 (100 мл). Органический слой сепарируют и водный слой экстрагируют CH2Cl2 (50 мл × 2). Объединенный органический раствор высушивают и концентрируют в вакууме. Осадок растворяют в МеОН и насыщают Ar в течение 2 ч, после чего добавляют 100% Pd-C. Гидрогенизацию завершают в течение 4 ч. Катализатор удаляют путем фильтрации и растворитель удаляют в вакууме с получением нужного соединения (460 мг, 83%) в виде белого твердого вещества.
ПРИМЕР 195. N4-(3-tert-Бутилфенил)-5-метил-N2-(4-пиперидин-4-ил)фенил)пиримидин-2,4-диамин (Соединение CXXXIV)

Смесь промежуточного соединения 41 (170 мг, 0.6 ммоль) и промежуточного соединения 63 (170 мг, 0.6 ммоль) суспендируют в уксусной кислоте (10 мл) и нагревают до 100°С в течение 4 ч. Смесь оставляют охлаждаться до комнатной температуры и уксусную кислоту удаляют при пониженном давлении. Осадок поглощают водой (20 мл) и нейтрализуют рН ~7. Полученный раствор экстрагируют EtOAc (30 мл) и органический слой сепарируют. Органический слой отмывают физиологическим раствором, высушивают над MgSO4 и фильтруют. Фильтрат концентрируют в вакууме и сырой продукт очищают при помощи HPLC с получением нужного соединения (8 мг, 3%) в виде белого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 1.26 (s, 9H), 1.76-1.88 (m, 4H), 2.17 (s, 3H), 2.76-2.81 (m, 1Н), 2.93-3.00 (m, 2H), 3.36-3.40 (m, 2H), 7.07 (d, J=8.5 Hz, 1H), 7.30-7.36 (m, 4H), 7.44 (s, 1H), 7.46 (d, J=8.7 Hz, 1H), 7.91 (s, 1H), 8.84 (br s, 1H), 8.92 (br s, 1H), 9.73 (s, 1H), 10.45 (s, 1H). MS (ES+): m/z 416 (M+H)+.
ПРИМЕР 196. N4-[3-tert-Бутилфенил)-5-метил-N2-(4-(1-морфолиноэтил)фенил)пиримидин-2,4-диамин (Соединение CXXXV)

Смесь промежуточного соединения 41 (276 мг, 1.0 ммоль) и 4-(1-морфолиноэтил)бензоламина (210 мг, 1.0 ммоль), Pd2(dba)3 (92 мг, 0.1 ммоль), Xantphos (180 мг, 0.3 ммоль) и карбоната цезия (1.3 мг, 4 ммоль) суспендируют в диоксане (100 мл) и нагревают при дефлегмации в атмосфере аргона в течение 20 ч. Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (17 мг соли HCl, 4%) в виде желтого твердого вещества.
1H-NMR (500 MHz, DMSO-d6): δ 1.26 (s, 9H), 1.66 (d, J=6.8 Hz, 3H), 2.19 (s, 3H), 2.79 (br, 2H), 2.92 (br, 1H), 3.61-3.64 (m, 2H), 3.77-3.82 (m, 2H), 3.94-3.99 (m, 2H), 7.32 (d, J=7.8 Hz, 1H), 7.42 (t, J=1.9 Hz, 1H), 7.43 (d, J=7.8 Hz, 1H), 7.46-7.52 (m, 5H), 7.97 (s, 1H), 9.86 (s, 1H), 10.78 (s, 1H), 11.72 (br s, 1H). MS (ES+): m/z 446 (M+H)+.
ПРИМЕР 197. 5-Бром-2-метил-бензолсульфонил хлорид (Промежуточное соединение 64)

Бромид (1.99 г, 11.61 ммоль) энергично взбалтывают и обрабатывают хлорсульфоновой кислотой (1.55 мл, 23.22 ммоль). Полученный красный сироп нагревают до 60°С. При помощи реакционной TLC подтверждают отсутствие исходного материала, реакционную смесь гасят, выливая на лед. Продукт экстрагируют путем отмывания EtOAc (2×150 мл). Органическую фазу высушивают над Na2SO4, фильтруют и выпаривают до желтого масла (2.2 г, 70%).
ПРИМЕР 198. 5-Бром-2,N-диметил-бензолсульфонамид (Промежуточное соединение 65)

Взболтанную суспензию промежуточного соединения 64 (0.43 г, 1.58 ммоль) в DCM (5 мл) обрабатывают 2.0 М раствора метиламина в THF (2.4 мл, 4.8 ммоль). Через 16 ч удаляют растворители, и полученный осадок разводят EtOAc (150 мл) и отмывают водой. Органическую фазу высушивают над Na2SO4, фильтруют и выпаривают до белого твердого вещества (0.37 г, 89%).
ПРИМЕР 199. 2,N-Диметил-5-{5-метил-2-[4-(2-пирролидин-1-ил-этокси)-фениламино]-пиримидин-4-иламино}-бензолсульфонамид (Соединение CXXXVI)

Смесь промежуточного соединения 65 (0.14 г, 0.52 ммоль), промежуточного соединения 38 (0.14 г, 0.43 ммоль), Pd2(dba)3 (0.040 г, 0.043 ммоль), Xantphos (0.050 г, 0.087 ммоль) и карбоната цезия (0.43 мг, 1.3 ммоль) суспендируют в диоксане (100 мл), помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 15 мин. Реакционную смесь охлаждают до комнатной температуры и центрифугируют. Реакцию сливают с осадка и органическую фазу концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения в виде белого твердого вещества (0.052 г, 24%).
1H-NMR (500 MHz, DMSO-d6): δ 1.66-1.70 (m, 4H), 2.08 (s, 3H), 2.43 (d, J=4.9 Hz, 3H), 2.5 (br s, 4H), 2.78, (t, J=5.7 Hz), 4.00(t, J=5.9 Hz), 6.79 (d, J=9.0 Hz 2H), 7.31 (d, J=9.7, 1H), 7.42 (q, J=9.8 Hz, 1H), 7.49 (d, J=9.0 Hz, 1H), 7.87 (s, 1H), 7.97 (d, J=2.3 Hz, 1H), 8.07-8.09 (m, 1H), 8.49 (s, 1H), 8.75 (s, 1H), MS (ES+): m/z 497 (M+H)+.
ПРИМЕР 200. 5-Бром-N-tert-бутил-2-метил-бензолсульфонамид (Промежуточное соединение 66)
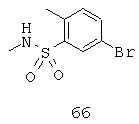
Взболтанную суспензию промежуточного соединения 64 (1.22 г, 4.5 ммоль) в DCM (25 мл) обрабатывают tert-бутиламином (1.4 мл, 13.6 ммоль). Через 16 ч удаляют растворители, и полученные твердые частицы растирают в порошок с водой. Твердые частицы высушивают в вакууме в течение ночи (1.3 г, 94%).
ПРИМЕР 201. N-tert-Бутил-5-(2-хлор-5-метил-пиримидин-4-иламино)-2-метил-бензолсульфонамид (Промежуточное соединение 67)

Смесь промежуточного соединения 66 (0.90 г, 2.96 ммоль), 2-хлор-5-метил-пиримидин-4-иламина (0.33 г, 2.28 ммоль), Pd2(dba)3 (0.21 г, 0.23 ммоль), Xantphos (0.264 г, 0.46 ммоль) и карбоната цезия (2.2 г, 6.8 ммоль) суспендируют в диоксане (15 мл), помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 15 мин. Реакционную смесь охлаждают до комнатной температуры и центрифугируют. Реакцию сливают с осадка и органическую фазу концентрируют в вакууме. Осадок очищают на колонке с силикагелем с получением нужного соединения в виде белого твердого вещества (0.12 г, 14%).
ПРИМЕР 202. N-tert-Бутил-5-[2-(4-имидазол-1-ил-фениламино)-5-метил-пиримидин-4-иламино]-2-метил-бензолсульфонамид (Соединение CXXXVII)

Смесь промежуточного соединения 67 (0.113 г, 0.31 ммоль), 4-имидазол-1-ил-фениламина (0.059 г, 0.37 ммоль), Pd2(dba)3 (0.028 г, 0.03 ммоль), Xantphos (0.036 г, 0.06 ммоль) и карбоната цезия (0.3 г, 0.92 ммоль) суспендируют в диоксане (6 мл), помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 15 мин. Реакцию сливают с осадка и органическую фазу концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения в виде белого твердого вещества (0.052 г, 24%).
1H-NMR (500 MHz, DMSO-d6): δ 1.11 (s, 9H), 2.13 (s, 3H), 2.58 (s, 3H), 7.07 (s, 1H), 7.34, (d, J=8.5 Hz, 1H), 7.42 (d, J=8.9 Hz, 2H), 7.48 (s, 1H), 7.60 (s, 1H), 7.78 (d, J=8.9 Hz, 2H), 7.94 (s, 1H), 7.98-8.00 (m, 1H), 8.09 (s, 1H), 8.12 (d, J=2.3 Hz, 1H), 8.56 (s, 1H), 9.16 (s, 1H). MS (ES+): m/z 492 (M+H)+
ПРИМЕР 203. N-tert-Бутил-3-{5-метил-2-[4-(пирролидин-1-карбонил)-фениламино]-пиримидин-4-иламино}-бензолсульфонамид (Соединение CXXXVIII)

Смесь промежуточного соединения 33 (0.11 г, 0.32 ммоль), (4-амино-фенил)-пирролидин-1-ил-метанона (0.072 г, 0.38 ммоль), Pd2(dba)3 (0.029 г, 0.032 ммоль), Xantphos (0.037 г, 0.063 ммоль) и карбоната цезия (0.3 г, 0.95 ммоль) суспендируют в диоксане (6 мл), помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 15 мин. Реакцию сливают с осадка и органическую фазу концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения в виде белого твердого вещества (0.040 г, 25%).
1H-NMR (500 MHz, DMSO-d6): δ 1.11 (s, 9H), 1.8 (br s, 4H), 2.14 (s, 3H), 3.44 (t, J=6.6 Hz, 4H), 7.38 (d, J=9.0 Hz, 2H), 7.52-7.54 (m, 2H), 7.56 (s, 1H), 7.70 (d, J=9.8 Hz, 2H), 7.98 (s, 1H), 8.08-8.10 (m, 2H), 8.60 (br s, 1H), 9.24 (s, 1H). MS (ES+): m/z 509 (M+H)+
ПРИМЕР 204. N-tert-Бутил-3-{5-метил-2-[4-морфолин-4-карбонил)-фениламино]-пиримидин-4-иламино}-бензолсульфонамид (Соединение CXXXIX)

Смесь промежуточного соединения 33 (0.13 г, 0.37 ммоль), (4-амино-фенил)-морфолин-4-ил-метанона (0.092 г, 0.45 ммоль), Pd2(dba)3 (0.034 г, 0.037 ммоль), Xantphos (0.043 г, 0.075 ммоль) и карбоната цезия (0.37 г, 1.1 ммоль) суспендируют в диоксане (6 мл), помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 15 мин. Реакцию сливают с осадка и органическую фазу концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения в виде белого твердого вещества (0.065 г, 33%).
1H-NMR (500 MHz, DMSO-d6): δ 1.11 (s, 9H), 2.14 (s, 3H), 3.49 (br s, 4H), 3.59 (br s, 4H), 5.75 (s, 1H), 7.25 (d, J=9.0 Hz, 2H), 7.52-7.54 (m, 2H), 7.56 (s, 1H), 7.71 (d, J=9.0 Hz, 2H), 7.98 (s, 1H), 8.06-8.08 (m, 2H), 8.65 (br s, 1H), 9.26 (s, 1H). MS (ES+): m/z 525 (М+H)+.
ПРИМЕР 205. N-tert-Бутил-3-{5-метил-2-[4-(пиперазин-1-карбонил)-фениламино]-пиримидин-4-иламино}-бензолсульфонамид (Соединение CXL)

Смесь промежуточного соединения 33 (0.12 г, 0.33 ммоль), tert-бутилового сложного эфира 4-(4-амино-бензоил)-пиперазин-1-карбоновой кислоты (0.12 г, 0.45 ммоль), Pd2(dba)3 (0.030 г, 0.037 ммоль), Xantphos (0.038 г, 0.075 ммоль) и карбоната цезия (0.37 г, 1.1 ммоль) суспендируют в диоксане (6 мл), помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 15 мин. Реакцию сливают с осадка и органическую фазу концентрируют в вакууме. Осадок очищают при помощи хроматографии на колонке с силикагелем (25%-100% EtOAc в гексанах). Затем полученный продукт обрабатывабт 20 мл 20% раствора TFA в DCM. Затем растворители удаляют путем выпаривания с вращением. Полученный материал очищают при помощи HPLC с получением нужного соединения в виде белого твердого вещества (0.045 г, 26%).
1H-NMR (500 MHz, DMSO-d6): δ 1.11 (s, 9H), 2.14 (s, 3H), 3.49 (br s, 4H), 3.59 (br s, 4H), 5.75 (s, 1H), 7.25 (d, J=9.0 Hz, 2H), 7.52-7.54 (m, 2H), 7.56 (s, 1H), 7.71 (d, J=9.0 Hz, 2H). 7.98 (s, 1H), 8.06-8.08 (m, 2H), 8.65 (br s, 1H), 9.26 (s, 1H). MS (ES+): m/z 525 (M+H)+.
ПРИМЕР 206. tert-Бутил-4-(4-(4-(3-метоксифениламино)-5-метилпиримидин-2-иламино)фенокси)пиперидин-1-карбоксилат (Промежуточное соединение 68)

Смесь 1-бром-3-метоксибензола (69.5 мкл, 0.56 ммоль), промежуточного соединения 42 (205 мг, 0.51 ммоль), Pd2(dba)3 (23 мг, 0.03 ммоль), Xantphos (33 мг, 0.06 ммоль) и карбоната цезия (359 мг, 1.10 ммоль) суспендируют в диоксане (3 мл), помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 20 мин. Реакционную смесь охлаждают до комнатной температуры, фильтруют и фильтрат промывают DCM и МеОН. Объединенные жидкости концентрируют в вакууме и очищают при помощи градиентной флэш-хроматографии (0-100% этилацетат в гексанах) с получением нужного соединения в виде твердого вещества бежевого цвета (215 мг, 83%).
ПРИМЕР 207. 3-(2-(4-(Пиперидин-4-илокси)фениламино)-5-метилпиримидин-4-иламино)фенол (Соединение CXLI)

К смеси промежуточного соединения 68 (215 мг, 0.42 ммоль) в DCM (4 мл) добавляют BBr3 (120 мкл, 1.27 ммоль) и перемешивают при комнатной температуре в течение 64 ч. Реакцию гасят МеОН и концентрируют в вакууме. Осадок очищают при помощи препаративной HPLC, полученные фракции концентрируют в вакууме с получением TFA соли нужного соединения (116 мг, 56%). TFA соль поглощают МеОН и пропускают через SPE PL-НСО3 MP-Resin картриджи, концентрируют в вакууме, растирают в порошок с эфиром и фильтруют с получением нужного соединения в виде белого твердого вещества (31 мг, 69% восстановления).
1H-NMR (500 MHz, DMSO-d6): δ 1.51-1.60 (m, 2H), 1.90-1.98 (m, 2H), 2.07 (s, 3H), 2.70-2.78 (m, 2H), 3.02-3.09, (m, 2H), 4.28-4.36 (m, 1H), 6.48 (dd, J=8.1, 2.2 Hz, 1H), 6.79 (d, J=9.1 Hz, 2H), 7.06-7.11 (m, 2H), 7.16 (d, J=8.5 Hz, 1H), 7.57 (d, J=9.1 Hz, 2H), 7.82 (s, 1H), 8.08 (s, 1H). 8.73 (s,lH), 9.27 (br s, 1H). MS (ES+): m/z 392 (M+H)+
ПРИМЕР 208. (2-Хлор-5-метил-пиримидин-4-ил)-(4-фтор-3-метокси-фенил)-амин (Промежуточное соединение 69)

Смесь 2-хлор-5-метил-пиримидин-4-иламина (1.2 г, 8.1 ммоль), 4-бром-1-фтор-2-метокси-бензола (1.8 г, 8.9 ммоль), Pd2(dba)3 (0.74 г, 0.81 ммоль), Xantphos (0.93 г, 1.6 ммоль) и карбоната цезия (7.88 г, 24.2 ммоль) суспендируют в диоксане (60 мл) и нагревают при дефлегмации в атмосфере аргона в течение 5 ч. Реакционную смесь охлаждают до комнатной температуры и разводят DCM (30 мл). Смесь фильтруют и фильтрат концентрируют в вакууме. Осадок очищают при помощи флэш-хроматографии на колонке с силикагелем с получением нужного соединения (0.3 г, 14%) в виде твердого вещества бежевого цвета.
ПРИМЕР 209. N4-(4-Фтор-3-метокси-фенил)-5-метил-N2-[4-(2-пирролидин-1-ил-этокси)-фенил]-пиримидин-2,4-диамин (Соединение CXLII)

Смесь промежуточного соединения 69 (0.1 г, 0.37 ммоль) и 4-(2-пирролидин-1-ил-этокси)-фениламина (0.16 г, 0.75 ммоль) суспендируют в уксусной кислоте (10 мл) и нагревают до 110°С в течение 16 ч. Реакционную смесь охлаждают до комнатной температуры и концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (0.03 г, 17%) в виде твердого вещества зеленого цвета.
1H-NMR (500 MHz, DMSO-d6): δ 1.88 (br s, 2H), 2.0 (br s, 2H), 2.15 (s, 3H), 3.08 (br s, 2H), 3.55, (br s, 4H), 3.7 (s, 3H), 4.32 (br s, 2H), 6.9 (d, J=7.9 Hz, 2H), 7.13 (br s, 1H), 7.21-7.25 (m, 1H), 7.32-7.34 (m, 3H), 7.89 (s, 1H), 9.78 (br s, 1H), 10.48 (br s, 1H), 10.92 (br s, 1H). MS (ES+): m/z 438 (M+H)+
ПРИМЕР 210. (2-Хлор-пиримидин-4-ил)-(3-метокси-2-метил-фенил)-амин (Промежуточное соединение 70)

Смесь 3-метокси-2-метил-фениламин (0.68 г, 5 ммоль) и 2,4-дихлор-пиримидин (0.74 г, 5 ммоль) суспендируют в этиловом спирте (10 мл) и перемешивают при комнатной температуре в течение 20 ч. Реакционную смесь разводят DCM (50 мл), фильтруют и концентрируют в вакууме. Осадок очищают на колонке с силикагелем с получением нужного соединения (0.085 г, 7%) в виде желтого твердого вещества.
ПРИМЕР 211. N4-(3-Метокси-2-метил-фенил)-N2-[4-(2-пирролидин-1-ил-этокси)-фенил]-пиримидин-2,4-диамин (Соединение CXLIII)

Смесь промежуточного соединения 70 (0.08 г, 0.32 ммоль) и 4-(2-пирролидин-1-ил-этокси)-фениламина (0.13 г, 0.64 ммоль) суспендируют в уксусной кислоты (10 мл) и нагревают до 80°С в течение 16 ч. Реакционную смесь охлаждают до комнатной температуры и концентрируют в вакууме. Осадок очищают при помощи HPLC с получением нужного соединения (0.03 г, 17%) в виде серого твердого вещества. 1H-NMR (500 MHz, DMSO-d6): δ 1.89 (br s, 2H), 2.0 (br s, 4H), 3.08 (br s, 2H), 3.4 (br s, 4H), 3.54 (br s, 4H), 3.83 (s, 3Н), 4.31 (br s, 2H), 6.86 (br s, 2H), 6.97 (d, J=8.1 Hz, 2H), 7.26 (t, J=8.1 Hz, 1H), 7.34 (br s, 2H), 7.89 (s, 1H), 9.73 (br s, 1H), 10.62 (br s, 1H), 11.01 (br s, 1H). MS (ES+): m/z 420 (M+H)+
ПРИМЕР 212. Tetr-бутиловый сложный эфир 4-(4-Ацетиламино-бензолсульфонил)-пиперидин-1-карбоновой кислоты (Промежуточное соединение 71)

Смесь tert-бутиловый сложный эфир 4-(4-бром-бензолсульфонил)-пиперидин-1-карбоновой кислоты (4 г, 9.92 ммоль), ацетамида (0.88 г, 14.9 ммоль), Pd2(dba)3 (0.46 г, 0.49 ммоль), Xantphos (0.56 г, 0.99 ммоль) и карбоната цезия (9.7 г, 29.8 ммоль) суспендируют в диоксане (60 мл) и нагревают при дефлегмации в атмосфере аргона в течение 4 ч. Реакционную смесь охлаждают до комнатной температуры и выливают на лед. Полученные твердые частицы желтого цвета собирают путем фильтрации и высушивают. Сырой продукт очищают при помощи флэш-хроматографии на колонке с силикагелем с получением нужного соединения в виде твердого вещества бежевого цвета (3.12 г, 82%).
ПРИМЕР 213. Tetr-бутиловый сложный эфир 4-(4-Амино-бензолсульфонил)-пиперидин-1-карбоновой кислоты (Промежуточное соединение 72)
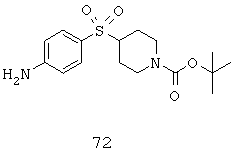
Суспензию промежуточного соединения 71 (2.6 г, 6.7 ммоль) разводят 60 мл основания Клайзена (88 г КОН растворяют в 63 мл H2O и разводят МеОН до объема 250 мл) и нагревают до 90°С. Через 2 часа нагревание прекращают, реакцию охлаждают до комнатной температуры и разводят водой (50 мл). Твердые частицы серого цвета собирают при помощи вакуумной фильтрации, отмывают водой и высушивают в течение ночи (2.2 г, 97%).
ПРИМЕР 214. N4-(4-Хлор-3-метокси-фенил)-5-метил-N2-[4-(пиперидин-4-сульфонил)-фенил]-пиримидин-2,4-диамин (Соединение CXLIV)

Смесь промежуточного соединения 31 (0.14 г, 0.51 ммоль), промежуточного соединения 72 (0.19 г, 0.56 ммоль), Pd2(dba)3 (0.046 г, 0.051 ммоль), Xantphos (0.59 г, 0.1 ммоль) и карбоната цезия (0.5 г, 1.52 ммоль) суспендируют в диоксане (8 мл), помещают в пробирку для микроволновой печи и облучают микроволнами при 160°С в течение 15 мин. Реакционную смесь охлаждают до комнатной температуры и центрифугируют. Растворители сливают с осадка и выпаривают. Полученный осадок очищают при помощи флэш-хроматографии на колонке с силикагелем с получением N-защищенного предшественника нужного соединения. Указанное твердое вещество обрабатывают 20% TFA в растворе DCM и незамедлительно выпаривают. Осадок растворяют в минимальном количестве EtOAc и по каплям добавляют диэтиловый эфир до избыточного количества. Полученный светло-желтый порошок собирают путем фильтрации и высушивают (0.16 г, 55%).
1H-NMR (500 MHz, DMSO-d6): δ 1.61-1.69 (m, 2H), 1.98-2.01 (m, 2H), 2.16 (s, 3H), 2.86 (q, J=12 Hz, 2H), 3.35 (d, J=12.6 Hz, 2H), 3.64 (tt, J=11.7 Hz, J=3.8 Hz, 1H), 3.79 (s, 3H), 7.34 (dd, J=8.7 Hz, J=2.0 Hz, 1H), 7.39-7.41 (m, 2H), 7.6 (d, J=8.9 Hz, 2H), 7.91 (d, J=8.9 Hz, 2H), 8.02 (s, 1H), 8,19-8.21 (m, 1H), 8.6-8.63 (m, 1H), 8.89 (br s, 1H). MS (ES+): m/z 488 (M+H)+
ПРИМЕР 215. (4-Хлор-3-метил-Фенил)-(2-хлор-5-метил-пиримидин-4-ил)-амин (Промежуточное соединение 73)

Смесь 2-хлор-5-метил-пиримидин-4-иламина (0.34 г, 2.34 ммоль), 4-бром-1-хлор-2-метил-бензола (0.58 г, 2.8 ммоль), Pd2(dba)3 (0.21 г, 0.23 ммоль), Xantphos (0.47 г, 0.47 ммоль) и карбоната цезия (2.3 г, 7 ммоль) суспендируют в диоксане (9 мл) облучают микроволнами при 160°С в течение 20 минут. Реакционную смесь охлаждают до комнатной температуры и центрифугируют. Затем растворители сливают и выпаривают. Полученный осадок очищают при помощи флэш-хроматографии на колонке с силикагелем с получением нужного соединения в виде желтого твердого вещества (0.24 г, 38%).
ПРИМЕР 216. N4-(4-Хлор-3-метил-фенил)-5-метил-N2-[4-(пиперидин-4-илокси)-фенил]-пиримидин-2,4-диамин (Соединение CXLV)

Смесь промежуточного соединения 73 (0.071 г, 0.27 ммоль) и tert-бутилового сложного эфира 4-(4-амино-фенокси)-пиперидин-1-карбоновой кислоты (0.1 г, 0.35 ммоль) разводят НОАс (5 мл) и облучают микроволнами при 150°С в течение 15 мин. Затем растворители удаляют и полученный осадок очищают при помощи HPLC. Нужное соединение в изолированном виде представляет собой твердое белое вещество (0.025 г, 22%).
1H-NMR (500 MHz, DMSO-d6): δ 1.76-1.83 (m, 2H), 2.05-2.09 (m, 2H), 2.13 (s, 3H), 2.27 (s, 3H), 3.10 (br s, 2H), 3.16 (br s, 2H), 4.58-4.61 (m, 1H), 6.93 (d, J=9 Hz, 2H), 7.34-7.39 (m, 3H), 7.43-7.45 (m, 1H), 7.59 (s, 1H), 7.87 (s, 1H), 8.51 (br s, 1H), 8.55 (br s, 1H), 9.38 (br s, 1H), 10.0 (br s, 1H). MS (ES+): m/z 424 (М+H)+
ПРИМЕР 217. N-(3-Бром-фенил)-ацетамид (Промежуточное соединение 74)

Раствор 3-бром-фениламина (1.04 г, 6 ммоль) обрабатывают DIEA (2.3 м, 13.3 ммоль) и охлаждают до нуля. Добавляют ацетилхлорид (0.47 мл, 6.7 ммоль) по каплям при помощи шприца. Реакцию оставляют, пока температура смеси не поднимется до комнатной, после чего перемешивают в течение 1 ч. Затем реакционную смесь вливают в воду и отмывают однократно. Органическую фазу выпаривают с получением твердого вещества бежевого цвета (1.25 г, 98%).
ПРИМЕР 218. N-[3-(2-Хлор-5-метил-пиримидин-4-иламино)-фенил]-ацетамид (Промежуточное соединение 75).

Смесь 2-хлор-5-метил-пиримидин-4-иламина (0.71 г, 4.9 ммоль), промежуточного соединения 74 (1.25 г, 5.9 ммоль), Pd2(dba)3 (0.45 г, 0.49 ммоль), Xantphos (0.57 г, 0.98 ммоль) и карбоната цезия (4.8 г, 14.7 ммоль) суспендируют в диоксане (40 мл) и подвергают дефлегмации в течение 18 ч. Реакционную смесь охлаждают до комнатной температуры, фильтруют и растворители выпаривают. Полученный осадок очищают при помощи флэш-хроматографии на силикагеле с получением нужного соединения в виде белого твердого вещества (0.44, 32%).
ПРИМЕР 219. N-(3-{5-Метил-2-[4-(пиперидин-4-илокси)-фениламино]-пиримидин-4-иламино}-фенил)-ацетамид (Соединение CXLVI)

Смесь промежуточного соединения 75 (0.074 г, 0.27 ммоль) и tert-бутиловый сложный эфир 4-(4-амино-фенокси)-пиперидин-1-карбоновой кислоты (0.1 г, 0.35 ммоль) разводят НОАс (5 мл) и облучают микроволнами при 150°С в течение 15 минут. Затем растворители удаляют и полученный осадок очищают при помощи HPLC. Нужное соединение (0.072 г, 62%) в изолированном виде представляет собой белое твердое вещество.
1H-NMR (500 MHz, DMSO-d6): δ 1.74-1.81 (m, 2H), 2.03-2.07 (m, 5H), 2.15 (s, 3H), 3.09 (br s, 2H), 3.24 (br s, 2H), 4.54-5.47 (m, 1H), 6.85 (d, J=8.8 Hz, 2H), 7.22 (d, J=7.7 Hz, 2H), 7.29-7.39 (m, 4H), 7.77 (s, 1H), 7.87 (s, 1H), 8.55 (br s, 1H), 8.60 (br s, 1H), 9.67 (s, 1H), 10.0 (br s, 1H), 10.2 (br s, 1H). MS (ES+): m/z 433 (M+H)+
ПРИМЕР 220. N-(3-Бром-2-метил-фенил)-ацетамид (Промежуточное соединение 76)

Раствор 3-бром-2-метил-фениламина (4.1 г, 21.9 ммоль) обрабатывают DIEA (8.4 мл, 48 ммоль) и охлаждают до нуля. Добавляют ацетилхлорид (1.7 мл, 24.1 ммоль) по каплям при помощи шприца. Реакцию оставляют, пока температура смеси не поднимется до комнатной, после чего перемешивают в течение 1 ч. Затем реакционную смесь вливают в воду и отмывают однократно. Органическую фазу выпаривают с получением грязно-белого вещества. Путем растирания в порошок с гексанами получают нужное соединение в виде белого твердого вещества (4.4 г, 89%).
ПРИМЕР 221. N-[3-(2-Хлор-5-метил-пиримидин-4-иламин)-2-метил-фенил]-ацетамид (Промежуточное соединение 77)
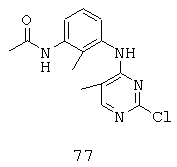
Смесь 2-хлор-5-метил-пиримидин-4-иламина (0.86 г, 5.9 ммоль), промежуточного соединения 76 (1.6 г, 7.1 ммоль), Pd2(dba)3 (0.55 г, 0.59 ммоль), Xantphos (0.69 г, 1.2 ммоль) и карбоната цезия (5.8 г, 17.8 ммоль) суспендируют в диоксане (40 мл) и подвергают дефлегмации в течение 16 ч. Реакционную смесь охлаждают до комнатной температуры, фильтруют и растворители выпаривают. Полученный осадок очищают при помощи флэш-хроматографии на силикагеле с получением нужного соединения в виде белого твердого вещества (0.56 г, 32%).
ПРИМЕР 222. N-(2-Метил-3-{5-метил-2-14-(пиперидин-4-илокси)-фениламино]-пиримидин-4-иламино}-фенил)-ацетамид (Соединение CXLVII)

Смесь промежуточного соединения 77 (0.15 г, 0.5 ммоль) и tert-бутилового сложного эфира 4-(4-Амино-фенокси)-пиперидин-1-карбоновой кислоты (0.19 г, 0.65 ммоль) разводят в НОАс (5 мл) и облучают микроволнами при 150°С в течение 15 минут. Затем растворители удаляют и полученный осадок очищают при помощи HPLC. Нужное соединение (0.091 г, 41%) в изолированном виде представляет собой белое твердое вещество.
1H-NMR (500 MHz, DMSO-d6): δ 1.71-1.78 (m, 2H), 2.02-2.08 (m, 8H), 2.16 (s, 3H), 3.09 (br s, 2H), 3.24 (br s, 2H), 4.50-4.52 (m, 1H), 6.77 (d, J=8.4 Hz, 2H), 7.09-7.15 (m, 3H), 7.27 (t, J=7.9 Hz, 1H), 7.49 (d, J=8.1 Hz, 1H), 7.86 (s, 1H), 8.54 (br s, 1H), 8.59 (br s, 1H), 9.45 (s, 1H), 9.84 (br s, 1H), 10.34 (br s, 1H). MS (ES+): m/z 447 (M+H)+
ПРИМЕР 223. 5-Метил-N2-[4-(4-метил-пиперазин-1-ил)-фенил]-N4-(3-нитро-фенил)-пиримидин-2,4-диамин (Промежуточное соединение 78)

Смесь 1-бром-3-нитро-бензола (0.77 г, 3.8 ммоль), промежуточного соединения 32 (0.95 г, 3.2 ммоль), Pd2(dba)3 (0.29 г, 0.32 ммоль), Xantphos (0.37 г, 0.64 ммоль) и карбоната цезия (3.1 г, 9.6 ммоль) суспендируют в диоксане (40 мл) и подвергают дефлегмации в течение 16 ч. Реакционную смесь охлаждают до комнатной температуры, фильтруют и растворители выпаривают. Полученный осадок очищают при помощи флэш-хроматографии на силикагеле с получением нужного соединения в виде белого твердого вещества (0.53 г, 40%).
ПРИМЕР 224. N4-(3-Амино-фенил)-5-метил-N2-[4-(4-метил-пиперазин-1-ил)-фенил]-пиримидин-2,4-диамин (Промежуточное соединение 79)

Суспензию промежуточного соединения 78 (0.23 г, 0.54 ммоль) в МеОН (25 мл) пропускают через аргон и обрабатывают Pd/C 10% вес. (0.18 г). Атмосферу, в которой осуществляют реакцию, замещают на атмосферу водорода и перемешивают в течение 4 ч. Затем водородный баллон удаляют и реакционную смесь снова насыщают аргоном, после чего фильтруют через целлит. Затем растворители выпаривают с получением бледно-коричневого твердого вещества (0.17 г, 83%).
ПРИМЕР 225. 1-(3-{5-Метил-2-[4-(4-метил-пиперазин-1-ил)-фениламино)-пиримидин-4-иламино}-фенил)-3-фенил-мочевина (Соединение CXLVIII)

Суспензию промежуточного соединения 79 (0.17 г, 0.45 ммоль) в DCM (10 мл) обрабатывают фенилизоцианатом (0.058 мл, 0.54 ммоль) и перемешивают при комнатной температуре в течение 1 ч. Затем растворители удаляют и полученный осадок очищают при помощи HPLC с получением нужного соединения в виде белого твердого вещества (0.075 г, 33).
1H-NMR (500 MHz, DMSO-d6): δ 2.09 (s, 3H), 2.15 (s, 3H), 2.30-2.32 (m, 4H), 2.92-2.94 (m, 4H), 6.74 (d, J=8.4 Hz, 2H), 6.94-6.97 (m, 1H), 7.19-7.28 (m, 5H), 7.45 (d, J=8.8 Hz, 2H), 7.53 (d, J=9.0 Hz, 2H), 7.73 (br s, 1H), 7.83 (s, 1H), 8.23 (s, 1H), 8.68 (s, 1H), 8.74 (s, 1H), 8.78 (s, 1H). MS (ES+): m/z 509 (M+H)+
ПРИМЕР 226. 1-(3-{5-Метил-2-[4-(4-метил-пиперазин-1-ил)-фениламино]-пиримидин-4-иламино}-фенил)-3-(3-трифторметил-фенил)-мочевина (Соединение CXLIX)
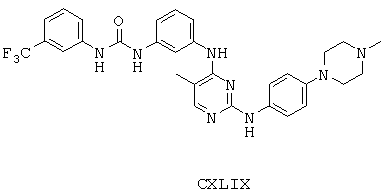
Суспензию промежуточного соединения 79 (0.1 г, 0.26 ммоль) в DCM (8 мл) обрабатывают 1-изоциано-3-трифторметил-бензолом (0.043 мл, 0.31 ммоль) и перемешивают в течение 1 ч. Затем удаляют растворители и полученный осадок очищают при помощи HPLC с получением нужного соединения в виде белого твердого вещества (0.039 г, 26%).
1H-NMR (500 MHz, DMSO-d6): δ 2.16 (s, 3Н), 2.82 (s, 3Н), 2.86 (br s, 2H), 3.08 (br s, 2H), 3.42 (br s, 2H), 3.69 (br s, 2H), 6.88 (d, J=8.4 Hz, 2H), 7.20 (br s, 1H), 7.29-7.33 (m, 5H), 7.52 (t, J=7.9 Hz, 1H), 7.57 (d, J=8.5 Hz, 1H), 7.77 (s, 1H), 7.84 (s, 1H), 8.09 (s, 1H), 9.42 (s, 1H), 9.66 (s, 1H), 9.71 (br s. 1H), 10.1 (br s, 1H). MS (ES+): m/z 577 (M+H)+
ПРИМЕР 227. (2-Хлор-5-метил-пиримидин-4-ил)-(2-метил-3-триФторметил-фенил)-амин (Промежуточное соединение 80)
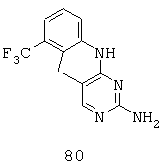
Смесь 2-хлор-5-метил-пиримидин-4-иламина (0.18 г, 5.9 ммоль), 1-бром-2-метил-3-трифторметил-бензола (0.33 г, 1.4 ммоль), Pd2(dba)3 (0.12 г, 0.13 ммоль), Xantphos (0.15 г, 0.25 ммоль) и карбоната цезия (1.23 г, 3.8 ммоль) суспендируют в диоксане (8 мл) и облучают микроволнами в течение 160°С в течение 18 минут. Реакционную пробирку затем центрифугируют и реакционную смесь сливают с осадка. Затем растворители выпаривают и полученный осадок очищают при помощи флэш-хроматографии на силикагеле с получением нужного соединения в виде белого твердого вещества (0.095 г, 25%).
ПРИМЕР 228. 5-Метил-N4-(2-метил-3-трифторметил-фенил)-N2-[4-(пиперидин-4-илокси)-фенил]-пиримидин-2,4-диамин (Соединение CL)

Смесь промежуточного соединения 80 (0.058 г, 0.2 ммоль) и tert-бутилового сложного эфира 4-(4-амино-фенокси)-пиперидин-1-карбоновой кислоты (0.073 г, 0.25 ммоль) разводят в НОАс (5 мл) и облучают микроволнами при 150°С в течение 15 минут. Затем растворители удаляют и полученный осадок очищают при помощи HPLC. Нужное соединение (0.025 г, 30%) в изолированном виде представляет собой белое твердое вещество.
1H-NMR (500 MHz, DMSO-d6): δ 1.71-1.78 (m, 2H), 2.00-2.04 (m, 2H), 2.18 (s, 3Н), 2.25 (s, 3Н), 3.08 (br s, 2H), 3.22 (br s, 2H), 4.50-4.52 (m, 1H), 6.70 (d, J=8.3 Hz, 2H), 7.10 (d, J=8.9 Hz, 2H), 7.54 (t, J=7.8 Hz, 1H), 7.62 (d, J=7.7 Hz, 1H), 7.75 (d, J=7.8 Hz, 1H), 7.91 (s, 1H), 8.54 (br s, 1H), 8.61 (br s, 1H), 9.88 (s, 1H), 10.34 (br s, 1H). MS (ES+): m/z 458 (M+H)+
ПРИМЕР 229. (3-Бром-фенил)-пирролидин-1-ил-метанон (Промежуточное соединение 81)
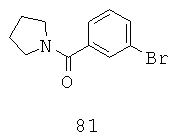
Раствор 3-бром-бензоилхлорида (2.7 г, 12 ммоль) в DCM (40 мл) охлаждают до нуля и обрабатывают пирролидином (3 мл, 36.8 ммоль). Реакцию оставляют, пока температура смеси не поднимется до комнатной, после чего перемешивают в течение 1 ч. Затем реакционную смесь вливают в воду и отмывают однократно. Органическую фазу отмывают физиологическим раствором, высушивают над сульфатом натрия, фильтруют и выпаривают до масла янтарного цвета (3.1 г, 100%).
ПРИМЕР 230. [3-(2-Хлор-5-метил-пиримидин-4-иламино)-фенил]-пирролидин-1-ил-метанон (Промежуточное соединение 82)
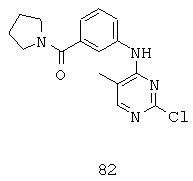
Смесь 2-хлор-5-метил-пиримидин-4-иламина (0.22 г, 1.5 ммоль), промежуточного соединения 81 (0.46 г, 1.8 ммоль), Pd2(dba)3 (0.14 г, 0.15 ммоль), Xantphos (0.17 г, 0.3 ммоль) и карбоната цезия (1.5 г, 4.5 ммоль) суспендируют в диоксане (8 мл) и облучают микроволнами в течение 160°С в течение 18 минут.Реакционную пробирку затем центрифугируют и реакционную смесь сливают с осадка. Затем растворители выпаривают и полученный осадок очищают при помощи флэш-хроматографии на силикагеле с получением нужного соединения в виде белого твердого вещества (0.25 г, 53%).
ПРИМЕР 231. (3-{5-Метил-2-[4-(пиперидин-4-илокси)-фениламино]-пиримидин-4-иламино}-фенил)-пирролидин-1-ил-метанон (Соединение CLI)

Смесь промежуточного соединения 82 (0.1 г, 0.32 ммоль) и tert-бутилового сложного эфира 4-(4-амино-фенокси)-пиперидин-1-карбоновой кислоты (0.12 г, 0.41 ммоль) разводят в НОАс (6 мл) и облучают микроволнами при 150°С в течение 15 минут. Затем растворители удаляют и полученный осадок очищают при помощи HPLC. Нужное соединение (0.005 г, 3%) в изолированном виде представляет собой белое твердое вещество.
1H-NMR (500 MHz, DMSO-d6): δ 1.74-1.81 (m, 4H), 1.83-1.88 (m, 2H), 2.05-2.09 (m, 2H), 2.16 (s, 3H), 2.25 (s, 3H), 3.25 (br s, 2H), 3.34 (t, J=6.5 Hz, 2H), 3.46 (t, J=6.9 Hz, 2H), 4.45-4.59 (m, 1H), 6.91 (d, J=8.8 Hz, 2H), 7.32 (d, J=8.9 Hz, 2H), 7.36 (d, J=7.7 Hz, 1H), 7.43 (t, J=7.8, 1H), 7.67 (d, J=7.9 Hz, 1H). 7.70 (s, 1H), 7.89 (s, 1H), 8.50 (br s, 1H), 8.56 (br s, 1H), 9.64 (br s, 1H), 10.21 (br s, 1H). MS (ES+): m/z 473 (M+H)+
ПРИМЕР 232. 3-Бром-N-изопропил-бензамид (Промежуточное соединение 83)
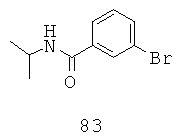
Раствор 3-бром-бензоилхлорида (0.83 г, 3.8 ммоль) в DCM (40 мл) охлаждают до нуля и обрабатывают изопропиламином (0.96 мл, 11.32 ммоль). Реакцию оставляют, пока температура смеси не поднимется до комнатной, после чего перемешивают в течение 24 ч. Затем реакционную смесь вливают в воду и отмывают однократно. Органическую фазу отмывают физиологическим раствором, высушивают над сульфатом натрия, фильтруют и выпаривают до масла янтарного цвета (0.6 г, 66%).
ПРИМЕР 233. N-Изопропил-3-{5-метил-2-[4-(4-метил-пиперазин-1-ил)-фениламино]-пиримидин-4-иламино}-бензамид (Соединение CLII)

Смесь промежуточного соединения 32 (0.1 г, 0.34 ммоль), промежуточного соединения 83 (0.13 г, 0.54 ммоль), Pd2(dba)3 (0.031 г, 0.034 ммоль), Xantphos (0.039 г, 0.067 ммоль) и карбоната цезия (0.33 г, 1 ммоль) суспендируют в диоксане (8 мл) и облучают микроволнами в течение 160°С в течение 15 минут. Реакционную пробирку затем центрифугируют и реакционную смесь сливают с осадка. Затем растворители выпаривают и полученный осадок очищают при помощи HPLC с получением нужного соединения в виде белого твердого вещества (0.011 г, 7%).
1H-NMR (500 MHz, DMSO-d6): δ 1.14 (d, J=6.7 Hz. 6H), 2.16 (s, 4H), 2.87 (s, 4H), 3.10 (br s, 2H), 3.51 (s, 2H), 4.22 (m, 1H). 6.85 (d, J=8.8 Hz, 2H), 7.30-7.32 (m, 2H), 7.45 (t, J=7.8 Hz, 1H), 7.69-7.70 (m, 2H), 7.90 (s, 1H), 7.99 (s, 1H), 8.24 (d, J=7.7, 1H), 9.70 (br s, 1H), 9.94 (br s, 1H), 10.2 (br s, 1H). MS (ES+): m/z 460 (М+H)+
ПРИМЕР 234. 3-Бром-N-tert-бутил-бензамид (Промежуточное соединение 84)

Раствор 3-бром-бензоилхлорида (0.83 г, 3.8 ммоль) в DCM (10 мл) охлаждают до нуля и обрабатывают tert-бутиламином (1.2 мл, 11.3 ммоль). Реакцию оставляют, пока температура смеси не поднимется до комнатной, после чего перемешивают в течение 4 ч. Затем реакционную смесь вливают в воду и отмывают однократно. Органическую фазу отмывают физиологическим раствором, высушивают над сульфатом натрия, фильтруют и выпаривают до масла янтарного цвета (0.9 г, 94%).
ПРИМЕР 235. N-tert-Бутил-3-{5-метил-2-[4-(4-метил-пиперазин-1-ил)-фениламино]-пиримидин-4-иламино}-бензамид (Соединение CLIII)

Смесь промежуточного соединения 32 (0.1 г, 0.34 ммоль), промежуточного соединения 84 (0.1 г, 0.4 ммоль), Pd2(dba)3 (0.031 г, 0.034 ммоль), Xantphos (0.039 г, 0.067 ммоль) и карбоната цезия (0.33 г, 1 ммоль) суспендируют в диоксане (8 мл) и облучают микроволнами в течение 160°С в течение 15 минут. Реакционную пробирку затем центрифугируют и реакционную смесь сливают с осадка. Затем растворители выпаривают и полученный осадок очищают при помощи HPLC с получением нужного соединения в виде белого твердого вещества (0.055 г, 35%).
1H-NMR (500 MHz, DMSO-d6): δ 1.36 (s, 9H), 2.09 (s, 3H), 2.21 (s, 3H), 2.43 (t, J=2.8 Hz, 4H), 3.00 (t, J=2.8 Hz, 4H), 6.74 (d, J=9.1 Hz, 2H), 7.35 (t, J=7.9 Hz, 1H), 7.44-7.48 (m, 3H), 7.67 (s, 1H), 7.85 (s, 1H), 7.88-7.92 (m, 2H), 8.36 (s, 1H), 8.74 (s, 1H). MS (ES+): m/z 474 (M+H)+
ПРИМЕР 236. 5-Метил-N2-[4-(4-метил-пиперазин-1-ил)-фенил]-N4-(3-пиперидин-4-ил)-фенил)-пиримидин-2,4-диамин (Соединение CLIV)

Смесь промежуточного соединения 32 (0.08 г, 0.27 ммоль), 4-(3-бром-фенил)-пиперидина (0.084 г, 0.35 ммоль), Pd2(dba)3 (0.025 г, 0.027 ммоль), Xantphos (0.031 г, 0.054 ммоль) и карбоната цезия (0.26 г, 0.81 ммоль) суспендируют в диоксане (8 мл) и облучают микроволнами в течение 160°С в течение 15 минут. Реакционную пробирку затем центрифугируют и реакционную смесь сливают с осадка. Затем растворители выпаривают и полученный осадок очищают при помощи HPLC с получением нужного соединения в виде белого твердого вещества (0.007 г, 6%).
1H-NMR (500 MHz, DMSO-d6): δ 1.74-1.79 (m, 3H), 2.09 (s, 3H), 2.21 (s, 3H), 2.43 (t, J=2.8 Hz, 4H), 3.00 (t, J=2.8 Hz, 4H), 6.76 (d, J=9.1 Hz, 2H), 6.90 (d, J=7.7 Hz, 1H), 7.24 (t, J=7.9 Hz, 1H), 7.47-7.53 (m, 3H), 7.68 (d, J=8.2 Hz, 1H), 7.82 (s, 1H), 8.18 (s, 1H), 8.67 (s, 1H). MS (ES+): m/z 458 (M+H)+
ПРИМЕР 237. Бензиловый сложный эфир 4-(3-{5-Метил-2-[4-(4-метил-пиперазин-1-ил)-фениламино]-пиримидин-4-иламино}-бензолсульфонил)-пиперидин-1-карбоновой кислоты (Промежуточное соединение 85)

Смесь промежуточного соединения 32 (0.17 г, 0.58 ммоль), бензилового сложного эфира 4-(3-бром-бензолсульфонил)-пиперидин-1-карбоновой кислоты (0.28 г, 0.64 ммоль), Pd2(dba)3 (0.053 г, 0.058 ммоль), Xantphos (0.067 г, 0.12 ммоль) и карбоната цезия (0.57 г, 1.74 ммоль) суспендируют в диоксане (8 мл) и облучают микроволнами в течение 160°С в течение 15 минут. Реакционную пробирку затем центрифугируют и реакционную смесь сливают с осадка. Собирают полученные твердые частицы желтого цвета и используют их на следующем этапе синтеза без дополнительной очистки (0.4 г, 100%).
ПРИМЕР 238. 5-Метил-N2-[4-(4-метил-пиперазин-1-ил)-фенил]-N4-[3-(пиперидин-4-сульфонил)-фенил]-пиримидин-2,4-диамин (Соединение CLV)

Взболтанный раствор промежуточного соединения 85 (0.17 г, 0.26 ммоль) в DCM (15 мл) обрабатывают 1 М BBr3 в DCM (2 мл, 2 ммоль). Через 4 ч реакцию гасят, медленно добавляя МеОН (4 мл), после чего удаляют растворители. Осадок очищают при помощи HPLC с получением нужного соединения в виде порошка пурпурного цвета (0.008 г, 6%).
1H-NMR (500 MHz, DMSO-d6): δ 1.31-1.40 (m, 2H), 1.75 (d, J=10.8 Hz, 2H), 2.12 (s, 3H), 2.21 (s, 3H), 2.36-2.41 (m, 2H), 2.44 (t, J=4.9 Hz, 4H), 2.95 (d, J=12.5 Hz, 2H), 3.02 (t, J=4.9 Hz, 4H), 3.24 (tt, J=11.7 Hz, J=3.8 Hz, 1H), 6.81 (d, J=9.0 Hz, 2H), 7.44 (m, 3H), 7.56 (t, J=8.0 Hz, 1H), 7.90-7.91 (m, 2H), 8.49 (d, J=7.6 Hz, 1H), 8.60 (s, 1H), 8.74 (s, 1H). MS (ES+): m/z 522 (M+H)+
ПРИМЕР 239. tert-Бутил-4-(4-(4-(1Н-индол-4-иламино)-5-метилпиримидин-2-иламино)фенокси)пиперидин-1-карбоксилат (Промежуточное соединение 86)

Смесь промежуточного 4-бром-1H-индола (41 мкл, 0.33 ммоль), промежуточного соединения 42 (131 мг, 0.33 ммоль), Pd2(dba)3 (30 мг, 0.03 ммоль), Xantphos (60 мг, 0.10 ммоль) и карбоната цезия (428 мг, 1.31 ммоль) суспендируют в диоксане (3 мл) и облучают микроволнами в течение 160°С в течение 20 минут. Реакционную смесь охлаждают до комнатной температуры и фильтруют, промывая DCM. Фильтрат концентрируют и очищают при помощи градиентной флэш-хроматографии (0-15% МеОН в DCM) с получением нужного соединения в виде белого твердого вещества (30 мг, 17%).
ПРИМЕР 240. N4-(1H-Индол-4-ил)-5-метил-N2-(4-(пиперидин-4-илокси)фенил) пиримидин-2,4-диамин (Соединение CLVI)

Смесь промежуточного соединения 86 (27 мг, 0.05 ммоль) в 30% TFA/DCM (1 мл) перемешивают в течение 3 ч. Реакционную смесь концентрируют в вакууме и очищают при помощи препаративной HPLC. Полученные фракции концентрируют в вакууме получением TFA соли нужного соединения в виде бурого твердого вещества (11 мг, 43%).
1H-NMR (500 MHz, DMSO-d6): δ 1.71-1.77 (m, 2H), 1.98-2.06 (m, 2H), 2.22 (s, 3H), 3.03-3.12 (m, 2H), 3.19-3.27 (m, 2H), 4.44-4.53 (m, 1H), 6.34-6.37 (m, 1H), 6.64 (br d, J=8.3 Hz, 2H), 7.08 (t, J=7.2 Hz, 3H), 7.14 (t, J=7.8 Hz, 1H), 7.36 (t, J=2.7 Hz, 1H), 7.39 (d, J=8.1 Hz, 1H), 7.84 (s, 1H), 8.48 (br s, 1H), 8.55 (br s, 1H), 9.85 (br s, 1H), 9.98 (br s, 1H), 11.27 (s, 1H).
ПРИМЕР 241. 2-Хлор-N-{2-[4-(2-пирролидин-1-ил-этокси)-фениламино]-пиримидин-5-ил}-5-(3-трифторметил-бензоиламино)-бензамид (Соединение CLVII)

Смесь 3-бромпиридина (379 мг, 2.4 ммоль), 4-амино-2-хлор-5-метилпиримидина (287 мг, 2.0 ммоль), Pd2(dba)3 (18 мг, 0.02 ммоль), Xantphos (23 мг, 0.04 ммоль) и карбоната цезия (975 мг, 3.0 ммоль) суспендируют в диоксане (15 мл) и нагревают при дефлегмации в атмосфере аргона в течение 1 ч. Растворитель удаляют и осадок очищают при помощи HPLC с получением промежуточного соединения, 2-хлор-5-метил-N-(пиридин-3-ил)пиримидин-4-амина, в виде желтого твердого вещества (252 мг, 57%). На втором этапе, смесь 2-хлор-5-метил-N-(пиридин-3-ил)пиримидин-4-амина (80 мг, 0.36 ммоль), 4-(2-(пирролидин-1-ил)этокси)бензоламина (74 мг, 0.34 ммоль), Pd2(dba)3 (3.2 мг, 0.003 ммоль), Xantphos (4.2 мг, 0.007 ммоль) и карбоната цезия (234 мг, 0.72 ммоль) в диоксане (5 мл) нагревают при дефлегмации в течение 1 ч в атмосфере аргона. Сырой продукт очищают при помощи HPLC с получением нужного соединения в виде светло-коричневого твердого вещества (28 мг, 20%).
1H-NMR (500 MHz, DMSO-d6): δ 1.85-1.95 (m, 2H), 2.0-2.09 (m, 2H), 2.18 (s, 3H), 3.09-3.18 (m, 2H), 3.55-3.65 (m, 4H), 4.27 (dd, J=5.2, 4.7 Hz, 2H), 6.94 (d, J=8.9 Hz, 2H), 7.35 (d, J=8.9 Hz, 2H), 7.50 (dd, J=8.2, 4.8 Hz, 1H), 7.92-7.96 (m, 1H), 8.08-8.15 (m, 1H), 8.45 (dd, J=4.8, 1.4,1H), 8.84, 9.75, 9.85, 10.24 (4 br s, 1H, каждый). MS (ES+): m/z 329 (M+H)+
ПРИМЕР 242. N2-(4-(2-(пирролидин-1-ил)этокси)фенил)-5-метил-N4-(3-{трифторметокси)фенил)пиримидин-2,4-диамин (Соединение CLVIII)

Смесь 1-бром-3-(трифторметокси)бензола (241 мг, 1.0 ммоль), 4-амино-2-хлор-5-метилпиримидина (143 мг, 1.0 ммоль), Pd2(dba)3 (9 мг, 0.01 ммоль), Xantphos (14 мг, 0.02 ммоль) и карбоната цезия (650 мг, 2.0 ммоль) в диоксане (15 мл) нагревают при дефлегмации в атмосфере аргона в течение 10 ч. Растворитель удаляют и осадок очищают при помощи HPLC с получением промежуточного соединения, 2-хлор-5-метил-N-(пиридин-3-ил)пиримидин-4-амина в виде коричневого твердого вещества (260 мг, 85%). Смесь указанного промежуточного соединения (100 мг, 0.33 ммоль) и 4-(2-(пирролидин-1-ил)этокси)бензоламина (67 мг, 0.33 ммоль) в ледяной уксусной кислоте (5 мл) нагревают при дефлегмации в течение 3 ч в атмосфере аргона. Сырой продукт очищают при помощи HPLC с получением нужного соединения в виде белого твердого вещества (11 мг, 7%).
1H-NMR (500 MHz, DMSO-d6): δ 1.65-1.72 (m, 4H), 2.11 (s, 3H), 2.51-2.55 (m, 2H, с наслоением пика растворителя), 2.75 (t, J=5.9 Hz, 2H), 3.25-3.34 (m, 2H, с наслоением пика воды), 3.99 (t, J=5.9 Hz, 2H), 6.79 (d, J=8.9 Hz, 2H), 6.89 (d, J=8.0 Hz, 1H), 7.40 (dd, J=7.6, 7.4 Hz, 1H), 7.50 (d, J=8.9 Hz, 2H), 7.76 (br s, 1H), 7.87 (d, J=8.4, 1H), 7.90, 8.31, 8.41, 8.84 (4 s, 1H, каждый). MS (ES+): m/z 474 (M+H)+
ПРИМЕР 243. N2-(4-(2-(пирролидин-1-ил)этокси)фенил)-N4-(4-хлор-3-(трифторметил)фенил)-5-метилпиримидин-2,4-диамин (Соединение CLIX)
Смесь 4-бром-1-хлор-2-(трифторметил)бензола (259 мг, 1.0 ммоль), 4-амино-2-хлор-5-метилпиримидина (143 мг, 1.0 ммоль), Pd2(dba)3 (9 мг, 0.01 ммоль), Xantphos (14 мг, 0.02 ммоль) и карбоната цезия (650 мг, 2.0 ммоль) в диоксане (15 мл) нагревают при дефлегмации в атмосфере аргона в течение 10 ч. Растворитель удаляют и осадок очищают при помощи HPLC с получением промежуточного соединения, 2-хлор-N-(4-хлор-3-(трифторметил)фенил)-5-метилпиримидин-4-амина в виде коричневого твердого вещества (200 мг, 62%). Смесь указанного промежуточного соединения (161 мг, 0.5 ммоль) и 4-(2-(пирролидин-1-ил)этокси)бензоламина (103 мг, 0.5 ммоль) в ледяной уксусной кислоте (5 мл) нагревают при дефлегмации в течение 3 ч в атмосфере аргона. Сырой продукт очищают при помощи HPLC с получением нужного соединения в виде коричневого твердого вещества (75 мг, 31%).
1H-NMR (500 MHz, DMSO-d6): δ 1.65-1.72 (m, 4H), 2.10 (s, 3H), 2.51-2.55 (m, 4H, с наслоением пика растворителя), 2.75 (t, J=6.0 Hz, 2H), 4.0 (t, J=5.9 Hz, 2H), 6.79 (d, J=8.5 Hz, 2H), 7.47 (d, J=9.0 Hz, 2H), 7.58 (d, J=9.0 Hz, 2H), 7.93 (s, 1H), 8.01 (d, J=2.5 Hz, 1H), 8.22 (d, J=8.5 Hz, 2H), 8.60, 8.88 (2 s, 1H, каждый). MS (ES+): m/z 492 (M+H)+
ПРИМЕР 244. Определение Величины IC50 для Jak2 Киназы
Величины IC50 для соединений определяют при помощи люминисцентного исследования киназ с использованием рекомбинантной JAK2, выделенной из клеточной среды сигнальных молекул. На белом, плоскодонном 96-луночном планшете (Nunc) осуществляют параллельные исследования при комнатной температуре при конечном объеме 50 мкл. Каждая лунка содержит 40 мкл буфера, включающего 40 мМ Tris буфера, рН 7.4, состоящего из 50 мМ MgCl2, 800 мкм Triton X-100, 2 мМ β-меркаптоэтанола, 100 мкм пептидного субстрата (PDKtide; Upstate Cell Signaling Solutions) и необходимого количества JAK2 (75-25 нг на лунку), таким образом исследование является линейным в течение 60 мин. Конечные концентрации TargeGen соединений для определения IC50 величин варьировали от 1000 до 0.01 мкМ при добавлении подходящего количества соединения в 2.5 мкл DMSO; DMSO в каждом исследовании использовали в постоянной концентрации 5%. Реакцию инициируют путем добавления 10 мкл АТР до конечной исследуемой концентрации 3 мкм. После того, как реакция продолжается в течение 60 мин, добавляют 50 мкл реагента Kinase-Glo (Promega) для завершения реакции. Полученный раствор оставляют для продолжения реакции еще в течение 10 минут для того, чтобы максимизировать реакцию люминесценции.
Затем измеряют величины с использованием аппарата Ultra 384 (Tecan) для люминесцентных исследований. Также осуществляют две контрольные реакции: одну реакцию без соединения и вторую реакцию без ингибитора и пептидного субстрата. IC50 величины получают из экспериментальных данных с использованием нелинейных кривых, построенных при помощи программы Prism (Version 4; GraphPad Software). Результаты представлены в Таблице 1.





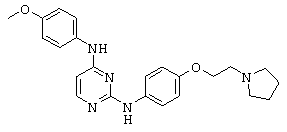










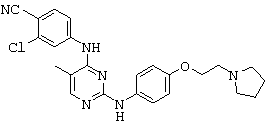

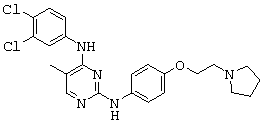
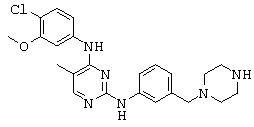

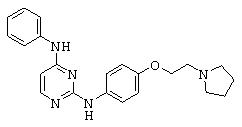



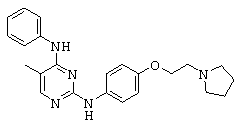
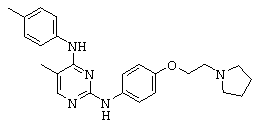
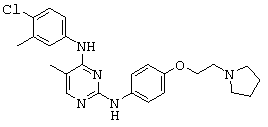

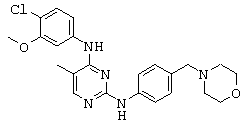
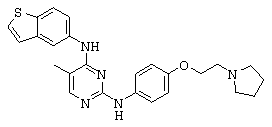











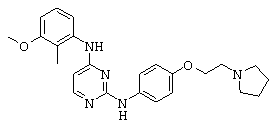
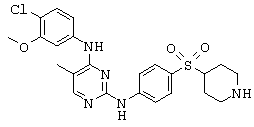


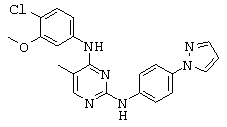
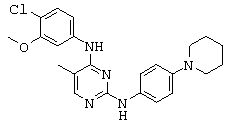
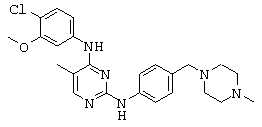



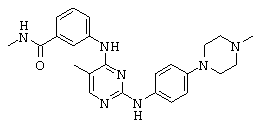



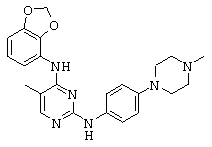
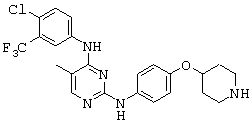







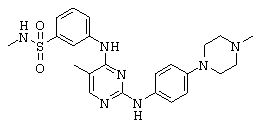
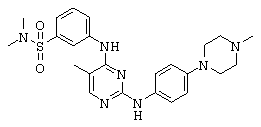
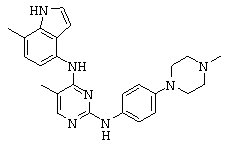


















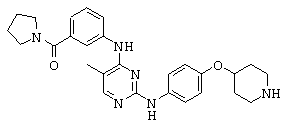
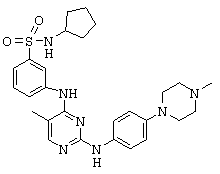




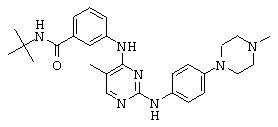
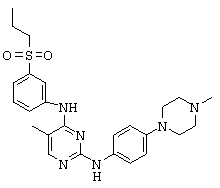

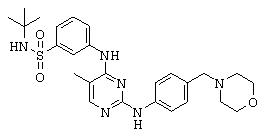
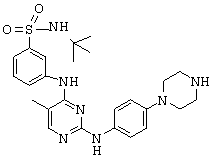





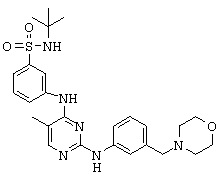
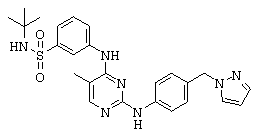

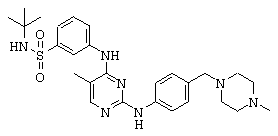


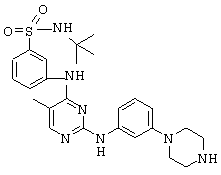


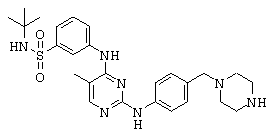









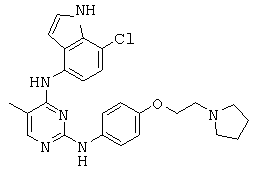

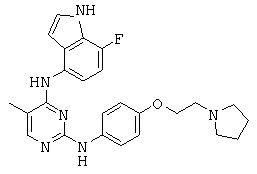
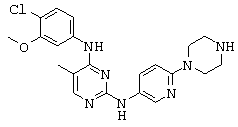



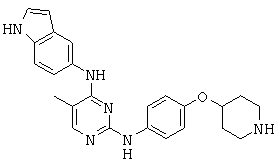



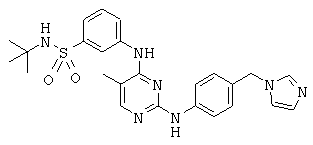
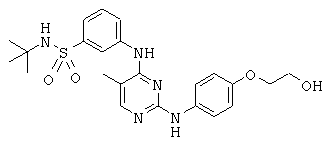
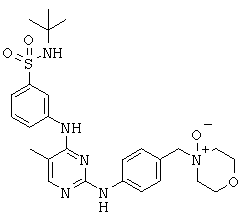




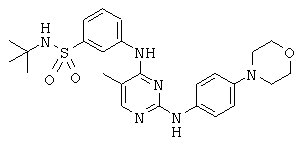


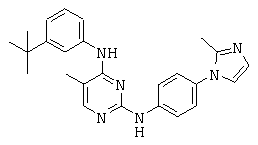
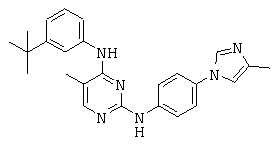



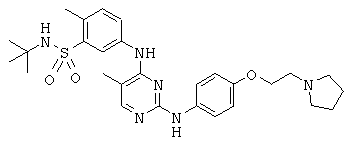
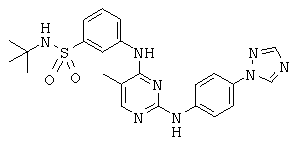
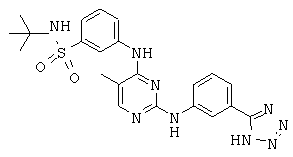




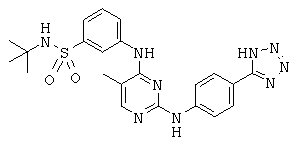


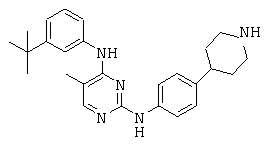




ПРИМЕР 245. Определение эффективности выбранных соединений
HEL, CTLL-2 и нормальные фибробласты кожи человека (NHDF) получают из Американской коллекции типовых клеточных культур в Роквилле, MD. Клетки BaF/3 получают из Исследовательского ракового центра DKFZ в Гейдельберге, Германия.
Клетки HEL, NHDF и BaF/3 выращивают в среде RPMI 1640 (Gibco BRL, Гейтерсбург, MD) с добавлением пенициллина, стрептомицина, L-глутамина и 10% сыворотки плода коровы (FBS). Клетки CTLL-2 выращивают в той же питательной среде с добавлением 20 ед/мл рекомбинантного IL-2 (Hoffmann-LaRoche, Нутлей, NJ). Плазмиду, содержащую последовательность, кодирующую JAK2 человека, покупают у фирмы Invitrogen (Мэдисон, WI). КДНК JAK2V617F получают при использовании сайт-направленного мутагенеза для введения мутации V617F в последовательность, кодирующую JAK2 человека, с последующим подтверждением правильности мутирования двунаправленным секвенированием. Указанную кДНК затем субклонируют в ретровирусном векторе и вводят путем трансдукции в клетки BaF/3. Перманентно трансдуцированные BaF/3, экспрессирующие JAK2V617F, отбирают и поддерживают с помощью G418 в концентрации 1 мг/мл. GFP вводят в указанные клетки при лентивирусной трансдукции при использовании pLenti6-GFP (Invitrogen) с последующей селекцией бластомицином и подтверждением экспрессии GFP анализом РАС.
Исследование клеточной пролиферации осуществляют при использовании набора клеточной пролиферации ХТТ в соответствии с инструкциями производителя (Roche, Alameda, СА). Коротко говоря, примерно 2,5×103 клеток помещают при трехкратном повторении в лунки микропланшетов для титрования в 100 мкл ростовой среды RPMI с добавлением различных доз XLV. Через 72 ч инкубации в каждую лунку добавляют 20 мкл ХТТ и оставляют культуры на 4-6 ч. Образовавшиеся окрашенные формазаном продукты измеряют спектрофотометрически с помощью спектрофотометра Vmax (Molecular Devices, Sunnyvale, CA) при 450 нм с коррекцией при 650 нм. Значения IC50 оценивают при использовании программного обеспечения GraphPad Prism 4.0 (San Diego, CA), причем значения OD откладывают по оси у (линейная шкала), а концентрацию (мМ) - по оси х (логарифмическая шкала). Данные обрабатывают с помощью нелинейного регрессионного анализа подгонки и определяют значения IC50 как концентрацию, которая ингибируют пролиферацию клеток на 50%.
Пролиферация ЕС 50:
HEL - 270 нМ
BaF/3: JAK2 V617F - 297 нМ
Контрольные данные: индуцируемая IL-1 JAK3-зависимая пролиферация - 3395 нМ
Контрольные данные: нормальные фибробласты кожи человека - 6487 нМ.
Анализ апоптоза
Клетки BaF/3-JAK2V617F выращивают в среде RPMI 1640 с добавлением 10% FBS, 1 мг/мл G418 и 10 мкг/мл бластацидина и обрабатывают XLV в концентрации 1, 3 и 10 мкМ в течение 24 ч. После сбора клеток центрифугированием при 890 RCF (относительная сила центрифугирования) в течение 5 мин выделяют геномную ДНК из осадка клеток с помощью набора для выделения ДНК (Puregen, Chino, CA). 5 мкг геномной ДНК из каждого образца подвергают электрофорезу в геле 1,2%-ной агарозы для выявления фрагментации геномной ДНК («лестничный» анализ ДНК). В качестве контроля культивируют адгезивные нормальные фибробласты кожи человека (NHDF) в ростовой среде (Cambrex, Walkersville, MD) при 60%-ном монослое и обрабатывают их XLV, как описано выше. После двух отмываний клеток NHDF ледяным PBS из них выделяют геномную ДНК электрофорезом в геле агарозы.
Иммуноблоттинг
Клетки BaF/3-JAK2V617F, обработанные XLV или контрольным носителем, центрифугируют, дважды отмывают ледяным PBS и лизируют буфером RIPA. Концентрацию белка определяют методом ВСА (Pierce, Rockford, IL) 100 мкг общего клеточного белка из каждого образца в IX буфере Лэммли подвергают Вестерн-блоттингу. В качестве пробы для белковых блотов используют анти-фосфо- STAT5 (Tyr694/699) (Upstate Biotechnology, Charlottesville, VA), затем блоты очищают и обрабатывают антителами к STAT5 (Cell Signaling Technology, МА). Белок фосфо-STAT5 и STAT5 визуализируют методом усиленной хемилюминесценции (Pierce). In vivo исследования осуществляют сходным образом. Коротко говоря, на 11-ый день после инъекции клеток животным перорально вводят дозы носителя или 100 мг/кг XLV. Через 7 дней после введения препаратов извлекают селезенку и быстро гомогенизируют ее в устройстве FastPrep (Qbiogen, Irvine, CA). 100 мкг каждого селезеночного гомогената подвергают Вестерн-блоттингу. В качестве пробы для белковых блотов используют анти-фосфо- STAT5 и затем блоты обрабатывают антителами к STAT5 и визуализируют методом усиленной хемилюминесценции.
FACs анализ циркулирующей опухолевой нагрузки
На 11-ый день после введения клеток BaF/3-JAK2V617F забирают 1 мл крови методом кардиальной терминации у одной мыши, которая получала вектор; кроме того, по 0, 1 мл крови забирают нелетальным ретро-орбитальным методом у 10 мышей из каждой из трех групп, которые получали 10, 30 или 100 мг/кг XLV, и объединяют вместе полученные пробы в пределах одной дозы. Мононуклеарные клетки крови выделяют методом центрифугирования на фиколовой (Sigma-Aldrich, St. Louis, МО) подушке (600 RCF при 30 мин). Выделенные клетки подвергают FACs анализу для выявления процента GFP-позитивных клеток BaF/3-JAK2V617F. Результаты исследований приведены ниже на диаграмме.
Модель опухолевой циркуляции
Мышей SCID внутривенно инъецируют клетками BaF/3-JAK2V17F, экспрессирующими JAK2 V617F^ и GFP. Перорально мышам вводят XLV в обозначенных дозах, начиная с третьего дня после инфузии и заканчивая на двадцатый день после инфузии. На 11-ый день у животных каждой группы забирают кровь и подвергают FACs анализу для выявления процента циркулирующих GFP-позитивных клеток. В параллельном исследовании животных обрабатывают, как описано выше, за тем исключением, что они получают единичную дозу лекарственного препарата 100 мг/кг на 11-ый день, через 4 часа животных умерщвляют и анализируют STAT5 фосфорилирование в увеличенной опухолью селезенке. Результаты исследований приведены ниже на диаграмме.
Глазное введение и данные по эффективности
Данные по эффективности действия соединений в концентрации 0, 1%, введенных при закапывании в глаза.
Данные, полученные при определении уровней дозированных лекарственных средств (0, 1%-ные дозы в 0, 2%-ном тилоксаполе/1%-ном НРМС/4%-ном маннитоле) в глазных тканях мышей после местного применения показаны в двух временных интервалах, а именно 2 ч и 7 ч. Данные по эффективности выбранных соединений при ведены ниже в Таблице 2.
ПРИМЕР 246. Определение эффективности соединения XVII при глазном введении на модели индуцированной кислородом ретинопатии (OIR)
Соединение XVII тестируют на мышиной модели индуцированной кислородом ретинопатии (OIR), в которой инициируют ретинальную неоваскуляризацию у мышей-сосунков, циклически переходя от нормоксии к гипероксии и обратно к нормоксии. Мышей C57BL/6 выборочно помещают в гипероксидное окружение (70% O2), начиная с 7 дня после рождения (Р7). Через 5 дней животных возвращают в нормальные кислородные условия (21% О2), где их выдерживают дополнительно еще 5 дней, во время которых они получают местные аппликации соединения XVII и подходящего носителя. В конце указанного периода готовят препараты ретинальных бугорков и окрашивают их флуоресцентно-меченным лектином (BSL I), который распознает мышиный эндотелий. И, наконец, получают цифровые изображения с помощью флуоресцентной микроскопии и анализируют их при использовании компьютерной программы анализа изображений для количественного определения васкулярной области. В одном исследовании у животных, которым вводили 0,1%-ную дозу XVII дважды в день, обнаруживается 29%-ная редукция васкулярной области по сравнению с животными, получавшими носитель (Р менее 0,05, n=11-15); в другом исследовании выявляют 22%-ную редукцию ((Р менее 0,02, n=6). Результаты суммированы в Таблице 3.
Несмотря на то, что изобретение описано со ссылкой на приведенные выше примеры, должно быть понятно, что оно охватывает и все возможные варианты и модификации, которые могут быть сделаны в рамках данного изобретения. Соответственно, изобретение ограничивается только его формулой.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИ-АРИЛ-МЕТА-ПИРИМИДИНОВЫЕ ИНГИБИТОРЫ КИНАЗ | 2006 |
|
RU2597364C2 |
| Замещенные N-{ 3-[4-(1-метил-1Н-индол-3-ил)пиримидин-2-иламино]-4-метоксифенил} -амиды в качестве модуляторов EGFR, предназначенные для лечения рака | 2015 |
|
RU2606949C9 |
| Замещенные N2-(4-амино-2-метоксифенил)-N4-[2-(диметилфосфорил)-фенил]-5-хлор-пиримидин-2,4-диамины в качестве модуляторов ALK и EGFR, предназначенные для лечения рака | 2015 |
|
RU2607371C1 |
| ПРОИЗВОДНЫЕ 1-(3-АМИНОФЕНИЛ)-6,8-ДИМЕТИЛ-5-(4-ИОД-2-ФТОР-ФЕНИЛАМИНО)-3-ЦИКЛОПРОПИЛ-1H,6H-ПИРИДО[4,3-d]ПИРИМИДИН-2,4,7-ТРИОНА В КАЧЕСТВЕ ИНГИБИТОРОВ МЕК1/2 | 2015 |
|
RU2605400C1 |
| ИНГИБИТОРЫ GCN2 И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2811408C2 |
| СОЕДИНЕНИЯ БЕНЗАЗЕПИНА ДИКАРБОКСАМИДА | 2016 |
|
RU2712248C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ТРИАЗОЛОПИРАЗИНА И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2643361C2 |
| N-(1H-ИМИДАЗОЛ-2-ИЛ)БЕНЗАМИД И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2020 |
|
RU2806754C1 |
| НОВОЕ ПРОИЗВОДНОЕ ПИРРОЛА, ИМЕЮЩЕЕ В КАЧЕСТВЕ ЗАМЕСТИТЕЛЕЙ УРЕИДОГРУППУ, АМИНОКАРБОНИЛЬНУЮ ГРУППУ И БИЦИКЛИЧЕСКУЮ ГРУППУ, У КОТОРЫХ МОГУТ БЫТЬ ЗАМЕСТИТЕЛИ | 2009 |
|
RU2500669C2 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА | 2015 |
|
RU2704125C2 |


Изобретение относится к новому соединению формулы 32 и к способу получения соединения формулы XLV с использованием соединения формулы 32 в качестве исходного соединения. Соединения формулы XLV обладают способностью ингибировать киназы из семейства JAK-киназ, в частности JAK2 киназ. Соединения XLV могут быть использованы для лечения миелопролиферативного заболевания, при лечении истинной полицитемии, первичной тромбоцитопении, миелоидного фиброза, пролиферативной диабетической ретинопатии, рака или заболевании глаз. Соединение формулы 32 соответствует нижеуказанной структурной формуле

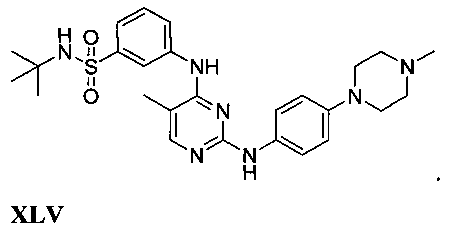
Способ получения соединения формулы XLV заключается во взаимодействии 3-бром-N-трет-бутилбензолсульфонамида с соединением формулы 32. Способ включает очистку реакционной смеси, полученной на стадии взаимодействия соединения формулы 32 с 3-бром-N-трет-бутилбензолсульфонамидом для выделения соединения формулы XLV. 2 н. и 1 з.п. ф-лы, 2 ил., 3 табл., 246 пр.
1. Соединение формулы 32:

2. Способ получения соединения формулы XLV:

включающий взаимодействие 3-бром-N-трет-бутилбензолсульфонамида с соединением формулы 32:

3. Способ по п. 2, дополнительно включающий очистку реакционной смеси, полученной на стадии взаимодействия соединения формулы 32 с 3-бром-N-трет-бутилбензолсульфонамидом, для выделения соединения формулы XLV.
| WO 2001064656 A1, 07.09.2001 & US 2003181474 A1 | |||
| ЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ ПРОТЕИНТИРОЗИНКИНАЗ | 2000 |
|
RU2260592C9 |
| Устройство для записи речи оратора | 1928 |
|
SU12485A1 |
| US 2004209896 A1, 21.10.2004. | |||
Авторы
Даты
2016-07-10—Публикация
2006-10-26—Подача