Область техники
Изобретение относится к области химии биологически активных полимеров. Более конкретно изобретение относится к сополимеру на основе N-винилпирролидона, представленному общей формулой (I):
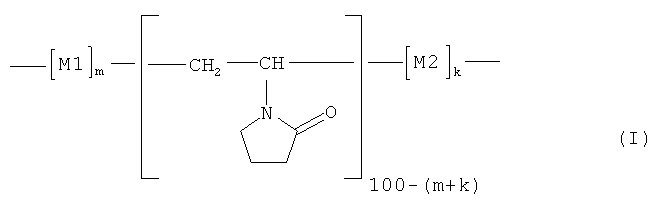
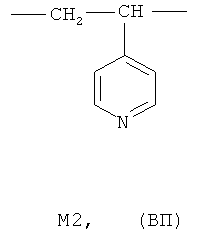
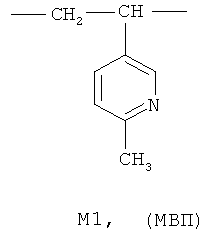
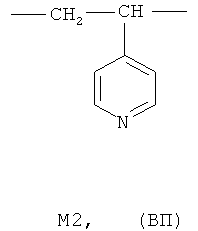
где мономерное звено M1 представляет собой фрагмент 2-метил-5-винилпиридина (МВП), а мономерное звено M2 - фрагмент 4-винилпиридина (ВП):

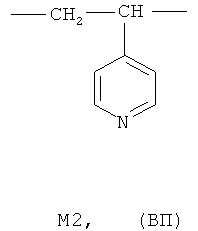
содержание мономерных звеньев M1 и М2 (m+k) составляет 20-90 мольн.%, при этом доля мономерных звеньев M2 (k) составляет 0,05·(m+k)-0,30·(m+k), а средневязкостная молекулярная масса Mµ сополимера равна Mµ=15-250 кДа.
Указанные сополимеры обладают противоопухолевой, иммуномодулирующей, фагоцитной и адъювантной активностью.
Уровень техники
В авторском свидетельстве SU 1578143 (опубл. 15.07.1990) описан сополимер N-винилпирролидона и 5-изопропенил-тетразола с молекулярной массой, определенной методом светорассеяния, равной 85 кДа, в котором содержание 5-изо-пропенилтетразольных звеньев составляет 0,40-0,74 мольн. доли, обладающий свойствами иммуноадъюванта поверхностного антигена вирусного гепатита B.
Указанный сополимер получают радикальной сополимеризацией 5-изопропенилтетразола и N-винилпирролидона в присутствии динитрила азоизомасляной кислоты в качестве инициатора сополимеризации с одновременной загрузкой всех компонентов реакционной смеси. В одном варианте радикальную сополимеризацию проводят в среде этанола, а целевой продукт выделяют осаждением в диэтиловый эфир. В другом варианте реакцию проводят в водной среде, необязательно, с добавлением водного раствора NaOH для повышения pH до 5,5, а целевой продукт выделяют фильтрованием или центрифугированием. В случае добавления щелочи стадии выделения продукта предшествует его осаждение в 0,1М раствор HCl. Наилучшей адъювантной активностью обладает сополимер, содержащий 0,74 мольн. доли 5-изопропенилтетразольных звеньев. В патенте RU 2000004 (опубл. 15.02.1993) раскрыты сополимеры N-винилпирролидона и 2-метил-5-винилпиридина со средневязкостной молекулярной массой в диапазоне 29-40 кДа, содержащие 25-40 мольн.% 2-метил-5-винилпиридиновых звеньев, обладающие иммуностимулирующим действием. В патенте RU 2015993 (опубл. 15.07.1994) указано, что эти сополимеры также проявляют противоопухолевое действие.
Указанные сополимеры получают радикальной сополимеризацией N-винилпирролидона и 2-метил-5-винилпиридина в присутствии динитрила азобис-изомасляной кислоты в качестве инициатора сополимеризации, пероксида водорода и циклогексана в качестве регулятора молекулярной массы, а целевой продукт выделяют осаждением в диэтиловый эфир.
Наиболее близкий аналог настоящего изобретения раскрыт в патенте RU 2415876 (опубл. 10.04.2011), касающемся сополимера N-винилпирролидона, содержащего 25-90 мол.% мономерных звеньев 2-метил-5-винилтетразола (МВТ) или 2-метил-5-винилпиридина со средневязкостной молекулярной массой 46-250 кДа, который может применяться в качестве адъюванта при изготовлении вакцины против гриппа.
Описание изобретения
Целью данного изобретения является расширение арсенала биологически активных соединений на основе сополимеров N-винилпирролидона, которые могут найти применение в медицине. Авторы настоящего изобретения провели исследования и установили, что сополимеры на основе N-винилпирролидона (N-ВП), содержащие не только мономерные звенья 2-метил-5-винилпиридина (МВП), но также и фрагменты 4-винилпиридина (ВП), обладают более широким спектром действия, и в некоторых случаях их активность значимо превышает активность известных аналогов.
Авторы установили, что отношение наблюдаемых констант сополимеризации N-ВП с МВП и N-ВП с ВП практически постоянно во всем диапазоне температур и концентраций реагентов, в которых проводят сополимеризацию. При этом константы полимеризации N-ВП и МВП или ВП различаются более чем на порядок, вследствие чего МВП и ВП расходуются быстрее, чем N-ВП. Поэтому для синтеза сополимера заданного состава необходимо компенсировать расход мономеров подпиточной смесью. Учет выявленных закономерностей позволяет получать сополимеры в соответствии с изобретением, в которых мольные доли звеньев МВП и ВП определяются соотношениями МВП и ВП в подпиточной смеси.
В соответствии с первым вариантом данного изобретения получают сополимер формулы (I), в котором содержание мономерных звеньев Ml и М2 (m+k) составляет 20-50 мольн.%, при этом доля мономерных звеньев М2 (k) составляет 0,05·(m+k)-0,30·(m+k), а средневязкостная молекулярная масса Mµ сополимера равна Mµ=15-40 кДа.
Предпочтительно содержание мономерных звеньев M1 и М2 (m+k) составляет 25-40 мольн.%, при этом доля мономерных звеньев М2 (k) составляет 0,05·(m+k)-0,15·(m+k), а средневязкостная молекулярная масса Mµ сополимера равна Mµ=15-30 кДа.
В соответствии со вторым вариантом данного изобретения получают сополимер формулы (I), в котором содержание мономерных звеньев M1 и М2 (m+k) составляет 25-90 мольн.%, при этом доля мономерных звеньев М2 (k) составляет 0,10·(m+k)-0,30·(m+k), а средневязкостная молекулярная масса Mµ сополимера равна Mµ=45-250 кДа.
Предпочтительно содержание мономерных звеньев M1 и М2 (m+k) составляет 55-90 мольн.%, при этом доля мономерных звеньев М2 (k) составляет 0,10·(m+k)-0,25·(m+k), а средневязкостная молекулярная масса Mµ сополимера равна Mµ=50-150 кДа.
Настоящее изобретение относится к применению сополимера в соответствии с изобретением в качестве активатора продуцирования интерлейкина-1α и интерлейкина-β.
Среди белков семейства ИЛ-1 главным эндогенным медиатором защитных реакций организма служит интерлейкин-1β (ИЛ-1β). В частности, различные типы клеток синтезируют и секретируют ИЛ-1β в ответ на повреждение тканей, например, под воздействием ионизирующих излучений, тогда как ИЛ-1α существует, в основном, в виде мембранной формы. Одно из главных свойств обоих типов ИЛ-1 заключается в способности стимулировать функциональную активность многих типов лейкоцитов и лимфоцитов в ходе развития иммунного ответа на воспаление и пролиферацию злокачественных клеток. Кроме того, ИЛ-1 стимулирует костномозговое кроветворение и воздействует на функции фибробластов и эндотелиальных клеток.
Благодаря своим свойствам рекомбинантный ИЛ-β человека находит применение в клинической практике. Например, медицинский препарат «Беталейкин» разрешен к медицинскому применению в РФ (Приказ Минздрава РФ №51 от 18.02.1997 г., рег. №97/51/6) в качестве иммуностимулятора и как средство восстановления костномозгового кроветворения у раковых больных после интенсивных курсов химио- и радиотерапии. С этой целью препарат применяется у онкологических больных для восстановления подавленного лейкопоэза. Его применение ведет к значительному сокращению сроков нейтропении, снижению частоты суперинфекций и увеличению выживаемости, что подтверждается результатами сравнений с данными медицинской статистики за предшествующие десятилетия. Кроме того, «Беталейкин» используется как гемостимулирующее средство при пересадках костного мозга.
Таким образом, сополимеры настоящего изобретения могут найти применение в качестве агентов, повышающих терапевтическую эффективность обеих форм интерлейкина-1 при лечении онкологических заболеваний, особенно с применением лучевой терапии, а также как средства, улучшающие общее состояние больного, за счет восстановления показателей гемопоэза. К указанным онкологическим заболеваниям относятся, в первую очередь, злокачественные поражения печени, почек, мочевого пузыря, костного мозга и молочной железы.
В связи с вышеописанным настоящее изобретение также относится к применению сополимера в соответствии с изобретением в качестве противоракового агента, где рак выбран из группы, состоящей из рака печени, почек, мочевого пузыря, костного мозга и молочной железы.
Далее настоящее изобретение относится к применению сополимера в соответствии с изобретением в качестве активатора фагоцитоза.
Настоящее изобретение далее относится к применению сополимера в соответствии с изобретением в качестве адъюванта при изготовлении вакцин. Предпочтительно применять сополимер для приготовления вакцины против гриппа.
Для реализации первого и второго вариантов изобретения проводят радикальную сополимеризацию N-ВП и смеси МВП и ВП в присутствии динитрила азобис-изомасляной кислоты (ДАК) в качестве инициатора сополимеризации, пероксида водорода (ПВ) и циклогексана (ЦГ) в качестве регулятора молекулярной массы. Продукт выделяют осаждением в диэтиловый эфир (ДЭ).
Исходная реакционная смесь содержит 83,5-92,0 мас.% N-ВП, 1,5-9,5 мас.% смеси МВП и ВП, 6,5-7,0 мас.% ЦГ, 0,1 мас.% ПВ и 0,4 мас.% ДАК. Подпиточная смесь содержит 7-72 мас.% N-ВП, 27,5-92,5 мас.% смеси МВП и ВП, 0,2 мас.% ПВ и 0,4 мас.% ДАК.
Требуемое содержание 4-винилпиридиновых мономерных звеньев М2 (k) обеспечивается введением соответствующих количеств ВП как в исходную, так и в подпиточную смеси. Например, если требуется получить сополимер, содержащий около 60 мольн.% N-ВП с содержанием мономерных звеньев M1 и М2 (m+k), равным приблизительно 40 мольн.% и долей мономерных звеньев М2 на уровне 0,05·(m+k), то подпиточная смесь должна содержать 60 мольн.% N-ВП, 38 мольн.% МВП и 2 мольн.% ВП. Учитывая различие в скоростях полимеризации, исходная реакционная смесь должна иметь на порядок меньшее содержание МВП и ВП: 3,8 мольн.% МВП и 0,2 мольн.% ВП, и ее остаток, т.е. 96 мольн.%, должен составлять N-ВП.
Применяя проиллюстрированный выше подход, можно заранее оценивать составы исходной реакционной смеси и подпиточной смеси. При необходимости, можно более точно определять содержания каждого из реагентов по данным анализа полученного продукта. Продукт характеризуется, в частности, числом мономерных звеньев МВП (m) и ВП (k). В одном варианте его вычисляют по данным элементного анализа с учетом стехиометрии сополимера. Получение необходимых для этого расчетных формул доступно среднему специалисту в данной области. В другом варианте строение полученного продукта определяют по данным ЯМР-спектрометрии, например 1H-, 13C- или 15N-ЯМР, по соотношениям интегральных интенсивностей сигналов определенных ядер. Решение указанной задачи также доступно среднему специалисту в данной области.
Объем подпиточной смеси вычисляют каждые 10-20 минут по результатам анализа соотношения концентраций мономеров в реакционной смеси. Реакцию сополимеризации проводят при температуре 60-70°C. По достижении степени конверсии по мономерам около 20-25% реакционную массу охлаждают до 20°C и осаждают в диэтиловый эфир.
В одном варианте подпиточную смесь готовит и добавляет оператор (аппаратчик), основываясь на данных анализа и регламенте синтеза. В другом варианте добавление подпиточной смеси осуществляется автоматически с помощью системы контроля и управления синтезом. Такая система объединяет высокоэффективный жидкостный хроматограф, управляющее устройство и исполнительные устройства. В качестве управляющего устройства может быть использована ЭВМ, реализующая алгоритм управления синтезом, построенный на основе математической модели процесса. В качестве исполнительных устройств могут быть использованы управляемые запорные устройства, например клапаны с пневматическим или электромеханическим приводом.
Для контроля протекания реакции, а также для определения физико-химических характеристик продукта, применяют средства анализа и методы, описанные выше. Кроме того, для обеспечения экспрессности анализа применяют ВЭЖХ. Условия хроматографирования и способ детектирования аналитического сигнала могут быть определены средним специалистом в данной области на основании знаний в рамках известного уровня техники. Предпочтительно применение ОФ-ВЭЖХ с элюированием водно-спиртовыми элюентами, в частности - с градиентным элюированием. В качестве детектора может применяться УФ-спектрометр.
Полученный продукт также характеризуется средневязкостной молекулярной массой, которую вычисляют по характеристической вязкости сополимеров. Выбор методики и подбор условий измерения вязкости является рутинной процедурой, доступной среднему специалисту в данной области. В одном варианте характеристическую вязкость определяют в растворителе, состоящем из 85 об.% ДМФА и 15 об.% 0,1М водного раствора LiBr.
При необходимости для усиления определенного вида активности сополимера в соответствии с настоящим изобретением продукт реакции с широким молекулярно-массовым распределением может быть дополнительно фракционирован, например, методом гель-хроматографии. Условия выполнения фракционирования известны среднему специалисту в данной области. Кроме того, в соответствии с настоящим изобретением имеется возможности регулировать диапазон средневязкостной молекулярной массы Mµ сополимера на стадии синтеза, изменяя количества ПВ и ЦГ.
В частности, сополимеры по п.1, в которых содержание мономерных звеньев M1 и М2 (m+k) составляет 20-50 мольн.%, при этом доля мономерных звеньев М2 (k) составляет 0,05·(m+k)-0,30·(m+k), а средневязкостная молекулярная масса Mµ сополимера равна Mµ=15-40 кДа, обладают более выраженными свойствами активаторов фагоцитоза и продуцирования интерлейкинов, а также противораковыми свойствами по сравнению с адъювантными свойствами. Сополимеры, в которых содержание мономерных звеньев M1 и М2 (m+k) составляет 25-90 мольн.%, при этом доля мономерных звеньев М2 (k) составляет 0,10·(m+k)-0,30·(m+k), а средневязкостная молекулярная масса Mµ сополимера равна Mµ=45-250 кДа, обладают более выраженными адъювантными свойствами и свойствами активаторов фагоцитоза.
Присутствие у соединений указанных видов активности может быть подтверждено исследованиями in vivo. Специалисту в данной области очевиден выбор вирусов и их серотипов, а также подопытных животных, в качестве которых могут быть использованы млекопитающие и птицы. В одном из вариантов млекопитающими являются беспородные белые мыши. В другом варианте млекопитающими являются морские свинки.
Сополимеры в соответствии с любым из вариантов настоящего изобретения являются нетоксичными. В качестве признаков токсического воздействия сополимера на подопытных животных могут рассматриваться, например, гибель, снижение массы тела, изменения походки и поведения, цвета мочи, консистенции экскрементов, состояния глаз и ушей, выпадение зубов и шерсти, а также раздражение кожи в месте введения препарата.
Далее приведены иллюстративные примеры осуществления изобретения, способствующие более точному и полному пониманию его сути. Специалисту в данной области очевидны возможные модификации и замены, например, относящиеся к протоколам исследований, которые не выходят за рамки формулы изобретения.
Пример 1. Получение сополимера N-винилпирролидона (N-ВП), 2-метил-5-винилпиридина (МВП) и 4-винилпиридина (ВП)
В реактор загружают исходную реакционную смесь, содержащую 2,30 кг (2,21 л) N-ВП (90,5 мас.%), 35,9 г (44 мл) МВП (1,5 мас.%), 1,7 г (1,8 мл) ВП (0,1 мас.%), 2,9 г (3,1 мл) 30% водного раствора пероксида водорода (ПВ)(0,1 мас.%), 190 г (245 мл) циклогексана (ЦГ) (7,5 мас.%) и 10,0 г ДАК (0,4 мас.%). Реакционную массу нагревают до 60-70°C и ведут синтез при данной температуре, периодически отбирая пробы для хроматографического анализа (ВЭЖХ, Сферисорб C-18, 5 мкм, 4,6×250 мм, EtOH/H2O 6:94, 2,5 мл/мин (50°C), 254 нм) и подавая подпиточную смесь, содержащую 450 г (433 мл) N-ВП (77,5 мас.%), 121,3 г (127 мл) МВП (20,9 мас.%), 5,6 г (5,9 мл) ВП (1,0 мас.%), 1,2 г (1,1 мл) 30% водного раствора ПВ (0,2 мас.%) и 2,6 г ДАК (0,4 мас.%). По достижении степени конверсии по мономерам 20-25% реакционную массу охлаждают до 20°C и осаждают в диэтиловый эфир. Целевой продукт промывают на фильтре 2 л ДЭ, выделяют фильтрацией и сушат: сначала при атмосферном давлении при 40-60°C, а затем - в вакуумном сушильном шкафу при 80-90°С. Получают 550 г аморфного порошка белого цвета, растворимого в воде (10 мас.% водный раствор имеет pH 7,12), с суммарным содержанием звеньев МВП и ВП равным 21 мольн.% и долей звеньев ВП равной 0,048. Мµ сополимера: 15-40 кДа.
Примеры 2-7. Синтез и выделение сополимеров осуществляют в условиях, указанных в Примере 1. Состав исходной и подпиточной смесей, а также выход сополимера (Вых), содержание в нем звеньев МВП и ВП (m+k, мольн.%), доля звеньев ВП (k) и интервалы средневязкостной молекулярной массы Mµ сополимера приведены в Таблице 1.
Пример 10. Исследование in vivo острой токсичности сополимеров в соответствии с изобретением
Исследование проводят в группе из 6 здоровых беспородных белых мышей массой 18-22 г. Сополимер, полученный в соответствии с каждым из Примеров 1-6, растворяют в стерильном изотоническом растворе NaCl из расчета 5 мас.% и вводят каждому животному 1,0 мл этого раствора. Соединение считают выдержавшим испытание, если через 7 суток наблюдения в группе не погибло ни одно животное. В исследовании, проведенном для сополимеров, полученных в Примерах 1-9, гибели животных не отмечено.
Пример 11. Исследование in vivo аномальной токсичности противогриппозной вакцины, содержащей сополимеры в соответствии с Примерами 1, 3, 5 и 9
Аномальную токсичность исследуют при однократном внутрибрюшинном введении белым беспородным мышам одной прививочной дозы вакцины (0,5 мл), содержащей соединения Примера 4, 6 или 7 в качестве адъюванта. Самцов и самок мышей с массой тела 18-22 г разделяют на 5 опытных и 1 контрольную группу по 5 животных в каждой. Перед началом исследований животные проходят карантин при групповом содержании в клетках, а также подробный клинический осмотр непосредственно перед формированием групп.
Проявление аномальной токсичности определяют по результатам наблюдений в течение 7 суток, регистрируя следующие события и характеристики (качественные оценки): гибель животного, походка и поведение, цвет мочи, консистенция экскрементов, состояние глаз и ушей, выпадение зубов и шерсти, а также раздражение кожи в месте введения препарата. Количественной оценкой может служить усредненное по группе изменение массы тела животных за 7 суток.
Ни одного факта гибели животного как в контрольной, так и в опытных группах, не наблюдалось. Походка, поведение, цвет мочи, консистенция экскрементов, состояние глаз и ушей оставались неизменными в течение всего периода наблюдений. Выпадение зубов и шерсти, а также раздражение кожи в месте введения препарата также не отмечено.
Данные об изменении массы тела подопытных животных, наблюдаемых в течение 7 суток, представлены в Таблице 2.
Анализ данных свидетельствует об отсутствии аномальной токсичности у противогриппозной вакцины, содержащей сополимеры в соответствии с изобретением.
Пример 12. Исследование адъювантного действия сополимеров в соответствии с изобретением
Метод исследования основан на выявлении прироста специфических антител в сыворотке крови после двукратного, с интервалом 7 суток, внутрибрюшинного введения вакцины беспородным белым мышам.
Вакциной является гриппозная тривалентная субъединичная жидкая вакцина. В 1 дозе (0,5 мл) вакцины содержится по 5 мкг гемагглютинина вируса гриппа подтипов A (H1N1) и A (H3N2), 11 мкг гемагглютинина вируса гриппа подтипа B и 85-115 мкг/мг консерванта (мертиолят). В качестве иммуномодулятора (адъюванта) применяют сополимеры, полученные в соответствии с Примерами 3 и 8 (Серии 1 и 2 соответственно) или сополимер, раскрытый в Примере 11 патента RU 2415876 (Серия 3). Данные о приросте титра представлены в Таблице 3.
На основании полученных данных можно заключить, что вакцина, содержащая соединение в соответствии с Примером 8 настоящего изобретения, является более эффективной, чем аналогичная вакцина известного уровня техники. Вакцина, содержащая соединение в соответствии с Примером 3 настоящего изобретения, проявляет сопоставимую активность.
Пример 13. Исследование противораковой активности сополимеров в соответствии с изобретением
Самок беспородных белых крыс с массой тела 250-300 г разделили на 6 групп по 50 крыс в каждой группе. Животным первой группы по схеме вводили изотонический раствор (негативный контроль), вторая группа получала внутримышечно по схеме сополимер в соответствии с Примером 2 настоящего изобретения, третья группа получала внутримышечно по схеме сополимер в соответствии с Примером 3 патента RU 2415876. Животным четвертой группы по схеме вводили изотонический раствор после введения дозы нитрата плутония-239, достаточной для индуцирования подострого поражения (405 кБк/кг, позитивный контроль). Крысам пятой группы была введена такая же доза нитрата плутония-239, после чего они получали внутримышечно по схеме сополимер в соответствии с Примером 2 настоящего изобретения. Крысам шестой группы, также получившим нитрат плутония-239 в дозе, соответствующей 405 кБк/кг, внутримышечно по схеме вводили сополимер в соответствии с Примером 3 патента RU 2415876. Схема введения сополимеров: первый месяц - 0,5 мл 1 раз в неделю, второй месяц - 0,5 мл 1 раз в 2 недели, третий месяц - 0,5 мл 1 раз в 4 недели.
Через 420 суток после начала исследования в группе негативного контроля (группа 1) осталось 37 крыс (смертность: 26%). В группах 2 и 3 осталось 27 и 28 крыс соответственно (смертность: 10 и 7%). В группе позитивного контроля выжило 2 крысы (смертность: 93%), тогда как в группах 4 и 5, получавших сополимеры внутримышечно и перорально, выжило по 5 крыс (смертность: 83%).
Показатели периферической крови по группам крыс приведены в таблице 4.
Результаты некропсии крыс, умерших до момента окончания исследования, а также животных, умерщвленных по окончании исследования, показывают, что опухоль в подмышечной впадине в группах 5 и 6, в среднем, имеет объем в 2-3 раза меньший, чем в группе позитивного контроля. Злокачественные изменения печени и/или почек в этих группах также зарегистрированы в 2-3 раза реже по сравнению с группой позитивного контроля.
В результате проведенных исследований констатируется, что введение сополимеров в соответствии с настоящим изобретением оказывает статистически значимое подавляющее действие на развитие злокачественных опухолей в печени и почках подопытных животных, а также улучшает общие показатели анализа крови. При этом, введение сополимера в соответствии с Примером 1 настоящего изобретения по показателям общего анализа крови (снижение выраженности лейкопении, снижение содержания эритроцитов) способствует улучшению состояния подопытных животных в большей степени, чем введение его известного аналога.
Пример 14. Исследование активности перитонеальных макрофагов в присутствии красителя Нейтрофильного красного
Оценку фагоцитарной активности перитонеальных макрофагов проводили по интенсивности поглощения ими красителя Нейтрофильного красного (Таблица 5) или коллоидной туши (Таблица 6). Сополимеры применяли в дозе 50 мг/кг в объеме 250 мкл. Животным контрольной группы вводили равный объем воды для инъекций.
Краситель вводили мышам внутрибрюшинно в виде 0,05% суспензии в объеме 2 мл. Исследование проводили через 24 часа после завершения курса введения сополимера или воды. Количество поглощенного красителя определяли по оптической плотности перитонеального лизата при длине волны 620 нм.
В аналогичных условиях мышам внутрибрюшинно вводили 2 мл 0,05% суспензии коллоидной туши. Исследование проводили через 24 часа после введения сополимера мышам. Через 10 минут после введения туши брюшную полость мышей промывали 5 мл изотонического раствора NaCl. Собранные клетки перитонеального экссудата трижды отмывали и суспендировали в 1 мл изотонического раствора NaCl. Процент фагоцитирующих клеток (%ФК) определяли по результатам микроскопического подсчета. После этого клетки осаждали центрифугированием, удаляли супернатант, и осадок клеток лизировали водой для инъекций. Лизаты помещали в фотометрические планшеты и определяли светопоглощение при длине волны 620 нм, пропорциональное количеству туши, поглощенной перитонеальными фагоцитами. Фагоцитарный индекс (ФИ), вычисляемый как отношение светопоглощения к числу фагоцитирующих клеток, отражает степень активации фагоцитоза. Индекс завершенности фагоцитоза, т.е. отношение среднего числа частиц (ФК), поглощенное одной фагоцитирующей клеткой за 1 ч, к ФК за 2,5 ч, отражает переваривающую способность фагоцитов.
Исследованные соединения, вводимые внутримышечно в дозе 50 мг/кг, статистически достоверно увеличивали фагоцитарную активность на 15-45% по сравнению с контролем в исследованиях с красителем Нейтрофильным красным, а также повышали долю фагоцитирующих клеток на 8-23%, а индекс завершенности фагоцитоза - на 85-138% в исследованиях с частицами коллоидной туши. В последнем случае отмечалось, что введение сополимеров, практически не изменяя числа фагоцитирующих клеток, в 1,5-2 раза увеличивает переваривающую способность макрофагов. Сополимеры, полученные в соответствии с Примерами 1 и 6 настоящего изобретения, обладают несколько более высокой активностью, чем их известный аналог. Активность сополимера Примера 4 сопоставима с активностью аналога.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОПОЛИМЕРЫ 2-МЕТИЛ-5-ВИНИЛПИРИДИНА И N-ВИНИЛПИРРОЛИДОНА, ОБЛАДАЮЩИЕ СВОЙСТВАМИ АКТИВАТОРОВ ФАГОЦИТОЗА | 2010 |
|
RU2430933C1 |
| СОПОЛИМЕРЫ 4-ВИНИЛПИРИДИНА ИЛИ 2-МЕТИЛ-5-ВИНИЛПИРИДИНА И N-ВИНИЛПИРРОЛИДОНА С КОНЦЕВЫМ ОСТАТКОМ ЦИАНОВАЛЕРИАНОВОЙ КИСЛОТЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ПНЕВМОКОНИОЗОВ | 2014 |
|
RU2550820C1 |
| СОПОЛИМЕРЫ 2-МЕТИЛ-5-ВИНИЛПИРИДИНА И N-ВИНИЛПИРРОЛИДОНА, АКТИВИРУЮЩИЕ ПРОДУЦИРОВАНИЕ ИНТЕРЛЕЙКИНА-1, И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВОРАКОВЫХ АГЕНТОВ | 2010 |
|
RU2430932C1 |
| СОПОЛИМЕРЫ НА ОСНОВЕ N-ВИНИЛПИРРОЛИДОНА В ФОРМЕ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ КИСЛОТ | 2013 |
|
RU2533113C1 |
| СОПОЛИМЕРЫ НА ОСНОВЕ N-ВИНИЛПИРРОЛИДОНА | 2010 |
|
RU2415876C1 |
| ПРИМЕНЕНИЕ СОПОЛИМЕРА НА ОСНОВЕ N-ВИНИЛПИРРОЛИДОНА В КАЧЕСТВЕ СРЕДСТВА, ПОТЕНЦИРУЮЩЕГО АНАЛЬГЕТИЧЕСКИЙ ЭФФЕКТ МОРФИНА ГИДРОХЛОРИДА | 2011 |
|
RU2471491C1 |
| СОПОЛИМЕР, СОДЕРЖАЩИЙ ЗВЕНЬЯ N-ВИНИЛПИРРОЛИДОНА И НЕОБЯЗАТЕЛЬНО С-МЕТИЛИРОВАННОГО ВИНИЛПИРИДИНА, ЧАСТИЧНО МЕТИЛКВАТЕРНИЗИРОВАННОГО МЕТИЛИОДИДОМ, ОБЛАДАЮЩИЕ ПРОТИВОГРИППОЗНОЙ АКТИВНОСТЬЮ (ВАРИАНТЫ) | 2023 |
|
RU2827701C1 |
| СОПОЛИМЕР, ОБЛАДАЮЩИЙ АКТИВНОСТЬЮ ПРОТИВ ГРИППА ТИПА А (ВАРИАНТЫ), СОДЕРЖАЩИЙ ЗВЕНЬЯ N-ВИНИЛПИРРОЛИДОНА И НЕОБЯЗАТЕЛЬНО С-МЕТИЛИРОВАННОГО ВИНИЛПИРИДИНА, ПОЛНОСТЬЮ МЕТИЛКВАТЕРНИЗИРОВАННЫЙ МЕТИЛЙОДИДОМ | 2023 |
|
RU2827336C1 |
| ОФТАЛЬМОЛОГИЧЕСКИЙ ПРЕПАРАТ В ВИДЕ ГЛАЗНЫХ КАПЕЛЬ, СОДЕРЖАЩИЙ РАЗВЕТВЛЕННЫЕ ПОЛИГЕКСАМЕТИЛЕНГУАНИДИНЫ И СОПОЛИМЕР НА ОСНОВЕ N-ВИНИЛПИРРОЛИДОНА | 2012 |
|
RU2509562C1 |
| Лекарственное средство на основе синтетического сополимера винилпиридинового ряда для лечения тканевых гельминтозов | 2019 |
|
RU2727935C1 |
Изобретение относится к области химии биологически активных полимеров. Предложен сополимер на основе N-винилпирролидона общей формулы (I):

где мономерное звено M1 представляет собой фрагмент 2-метил-5-винилпиридина (МВП), а мономерное звено М2 - фрагмент 4-винилпиридина (ВП):

содержание мономерных звеньев M1 и М2 (m+k) составляет 20-90 мольн.%, при этом доля мономерных звеньев М2 (k) составляет 0,05-(m+k)-0,30·(m+k), а средневязкостная молекулярная масса Мµ сополимера равна Мµ=15-250 кДа. Предложено также применение указанного сополимера в качестве активатора продуцирования интерлейкина-1, агента против рака печени, почек, мочевого пузыря, костного мозга и молочной железы, активатора фагоцитоза и адъюванта при изготовлении вакцины против гриппа. Технический результат - предложенный сополимер расширяет арсенал биологически активных соединений на основе сополимеров N-винилпирролидона и имеет более широкий спектр действия по сравнению с известными аналогами. 5 н. и 4 з.п. ф-лы, 6 табл., 14 пр.
1. Сополимер на основе N-винилпирролидона, представленный общей формулой (I):
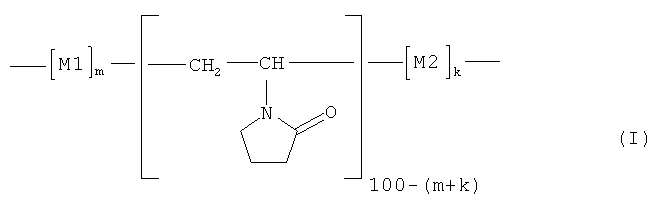 ,
,
где мономерное звено M1 представляет фрагмент 2-метил-5-винилпиридина (МВП), а мономерное звено М2 представляет фрагмент 4-винилпиридина (ВП):
 ,
,
содержание мономерных звеньев M1 и М2 (m+k) составляет 20-90 мол.%, при этом доля мономерных звеньев М2 (k) составляет 0,05(m+k)-0,30·(m+k), а средневязкостная молекулярная масса Мµ сополимера равна Мµ=15-250 кДа.
2. Сополимер по п.1, в котором содержание мономерных звеньев M1 и М2 (m+k) составляет 20-50 мол.%, при этом доля мономерных звеньев М2 (k) составляет 0,05(m+k)-0,30·(m+k), а средневязкостная молекулярная масса Мµ сополимера равна Мµ=15-40 кДа.
3. Сополимер по п.2, в котором содержание мономерных звеньев M1 и М2 (m+k) составляет 25-40 мол.%, при этом доля мономерных звеньев М2 (k) составляет 0,05-(m+k)-0,15·(m+k), а средневязкостная молекулярная масса Мµ сополимера равна Мµ=15-30 кДа.
4. Сополимер по п.1, в котором содержание мономерных звеньев M1 и М2 (m+k) составляет 25-90 мол.%, при этом доля мономерных звеньев М2 (k) составляет 0,10-(m+k)-0,30·(m+k), а средневязкостная молекулярная масса Мµ сополимера равна Мµ=45-250 кДа.
5. Сополимер по п.4, в котором содержание мономерных звеньев M1 и М2 (m+k) составляет 55-90 мол.%, при этом доля мономерных звеньев М2 (k) составляет 0,10-(m+k)-0,25·(m+k), а средневязкостная молекулярная масса Мµ сополимера равна Мµ=50-150 кДа.
6. Применение сополимера по любому из пп.1-5 в качестве активатора продуцирования интерлейкина-1α и интерейкина-1β.
7. Применение сополимера по любому из пп.1-5 в качестве агента против рака печени, почек, мочевого пузыря, костного мозга и молочной железы.
8. Применение сополимера по любому из пп.1-5 в качестве активатора фагоцитоза.
9. Применение сополимера по любому из пп.1-5 в качестве адьюванта при изготовлении вакцины против гриппа.
| СОПОЛИМЕРЫ НА ОСНОВЕ N-ВИНИЛПИРРОЛИДОНА | 2010 |
|
RU2415876C1 |
| Сополимер 5-изопропенилтетразола и N-винилпирролидона, обладающий свойствами иммуноадъюванта поверхностного антигена вирусного гепатита В | 1988 |
|
SU1578143A1 |
| СОПОЛИМЕР 2-МЕТИЛ-5-ВИНИЛПИРИДИНА И N-ВИНИЛПИРРОЛИДОНА, ОБЛАДАЮЩИЙ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 1992 |
|
RU2015993C1 |
| US 4057625 А, 08.11.1977. | |||
Авторы
Даты
2012-08-27—Публикация
2011-10-05—Подача