ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способу снижения частоты поражения нервных клеток, включая клеточную ГИБЕЛЬ, вызванного транзиторной церебральной гипоксией и/или ишемией. Способ включает стадии: диагностика субъекта, находящегося в состоянии транзиторной церебральной гипоксии и/или ишемии, и не позднее чем через 16 часов после наступления этого состояния введение субъекту нейропротективного количества фармацевтического агента. Фармацевтический агент, предпочтительно, выбирают из группы, состоящей из стимулятора центральной нервной системы (CNSS), моноаминного нейромедиатора, ингибитора моноаминоксидазы (MAOI), трициклического антидепрессанта (ТСА) или их комбинации. Предпочтительные агенты включают амфетамины, метамфетамин (МА), метилфенидат, метилендиоксиметамфетамин или их комбинацию.
Предпосылки создания изобретения
Инсульты являются основной причиной нетрудоспособности взрослых, причем более 80% из них составляет ишемический инсульт. В настоящее время отсутствует какая-либо предупредительная или нейропротективная терапия, доказавшая свою эффективность на людях. Амфетамины представляют собой одну из наиболее подробно изученных и наиболее обещающих групп лекарств, применяемых для того, чтобы содействовать выздоровлению после поражения нервных клеток (см. Martinson and Eksborg, 2004)). У крыс разовая доза амфетаминов (например, дексамфетамина), введенная через 24 часа после удаления сенсомоторной области коры мозга, стимулирует восстановление после гемиплегии (Feeney et al., 1982). Это благотворное действие было подтверждено на различных моделях и видах локального поражения (Sutton et al., 1989; Hovda and Feeney, 1984; Hovda and Feeney, 1985; Schmanke et al., 1996; Dietrich et al., 1990; Stroemer et al., 1998). В каждом из этих исследований ишемическое поражение моделируют с помощью перманентной перевязки (наложения лигатуры)/эмболии сосудистого компонента или кортикальной абляции.
Другой тип ишемического поражения включает транзиторное прерывание и реперфузию тока крови к головному мозгу. Гиппокамп чрезвычайно чувствителен к такому типу ишемического инсульта. У человека и у экспериментальных животных моделей краткие ишемические эпизоды могут вызвать селективную и замедленную смерть нейронов, локализованных в гиппокампе, в особенности пирамидных клеток зоны (поля) СА1 (Kirino, 1982). Этот тип поражения ухудшает работоспособность при решении когнитивных задач, которые требуют пространственной памяти (Zola-Morgan et al., 1986; Squire and Zola-Morgan, 1991). Хотя введение амфетаминов связано с ускорением восстановления поведенческих реакций у моделей локальной ишемии или кортикальной абляции, в предыдущем уровне техники сообщалось, что лечение амфетаминами не снижает объем инфаркта и, следовательно, не является профилактическим или защитным средством для нейронов. В предыдущем уровне техники также высказывается предположение, что амфетамины способствуют восстановлению поведенческих реакций после поражения кортикальной коры за счет влияния на пластичность головного мозга (Gold et al., 1984), а также на разрешение диасхиза (Hovda et al., 1987; Sutton et al. 2000)/ Однако в предыдущей технике указывается далее, что амфетамины не улучшают восстановление после некоторых типов поражения, включая патологические изменения в черном веществе (Mintz and Tomer - 1986). В предыдущем уровне техники также указывается, что введение амфетаминов (например, метамфетамина - МА) до локальной (точечной, местной) ишемии действительно повышает объем инфаркта в областях кортикальной и стриарной коры (Wang et al., 2001).
По-прежнему существует необходимость в лечении, которое предупреждало бы нервное поражение до его появления и на самом деле обеспечивало бы защиту нервных клеток (нейронов) после наступления состояния транзиторной церебральной гипоксии и/или ишемии, чтобы свести к минимуму или предупредить поражение. Такой профилактический способ раскрывается в данном описании, которое предоставляет способ предупреждения или уменьшения поражения нервных клеток головного мозга до его наступления, вместо того чтобы пытаться лечить поражение после его появления и стимулировать восстановление.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу снижения частоты поражения нервных клеток, вызванного транзиторной церебральной гипоксией и/или ишемией. Предпочтительно, способ включает стадии: диагностика субъекта, находящегося в состоянии транзиторной церебральной гипоксии и/или ишемии; и не позднее 16 часов после наступления этого состояния введение субъекту нейропротективного количества фармацевтического агента. Фармацевтический агент, предпочтительно, выбирают из группы, состоящей из стимулятора центральной нервной системы (CNSS), моноаминного нейромедиатора, ингибитора моноаминоксидазы (MAOI), трициклического антидепрессанта (ТСА) или их комбинации.
Предпочтительные фармацевтические агенты включают амфетамины, метамфетамин, метилфенидат, метилендиоксиметамфетамин или их комбинацию.
В одном конкретном варианте изобретения фармацевтический агент представляет собой метамфетамин, вводимый субъекту в виде стандартных лекарственных доз в количестве менее 5 мг/кг.
В других конкретных вариантах изобретения фармацевтический агент представляет собой комбинацию метамфетамина, метилфенидата, метилендиоксиметамфетамина или комбинацию их и, по меньшей мере, одного дополнительного агента, выбранного из группы, состоящей из моноаминного нейромедиатора, MAOI или ТСА. Дополнительный агент может также включать моноаминный нейромедиатор, предпочтительно, выбранный из группы, состоящей из дофамина, норпинефрина или серотонина.
Материалы по настоящему изобретению, предпочтительно, снижают частоту поражения нервных клеток головного мозга. В предпочтительном варианте материал по настоящему изобретению снижает частоту поражения нервных клеток гиппокампа.
Обычно состояние транзиторной церебральной гипоксии и/или ишемии вызывается кровопотерей или инфарктом миокарда, странгуляцией, хирургической операцией (например, кардиохирургической операцией), ударом, непроходимостью (нарушением проходимости) дыхательных путей, ишемической оптической нейропатией, травмами спинного мозга, травмами головного мозга или низким кровяным давлением. Однако состояние может быть вызвано многими заболеваниями, которые вызывают поражение нервных клеток вследствие недостатка кислорода и/или глюкозы, достигающего нервных клеток за короткий период времени.
В некоторых предпочтительных вариантах изобретения фармацевтический агент вводят не позднее чем через 16, 14, 12, 10, 8, 6, 4 или 2 часа после наступления болезненного состояния. Предпочтительно, агент вводят парентерально или перорально, но рассматриваются и могут применяться в зависимости от состояния другие пути введения.
В одном варианте изобретения фармацевтический агент вводят в фармацевтической композиции, содержащей фармацевтически приемлемый носитель. Фармацевтическая композиция может представлять собой лекарственную форму с немедленным (мгновенным) или пролонгированным высвобождением в зависимости от состояния и вероятности повторения (рецидива).
КРАТКОЕ ОПИСАНИЕ ФИГУР
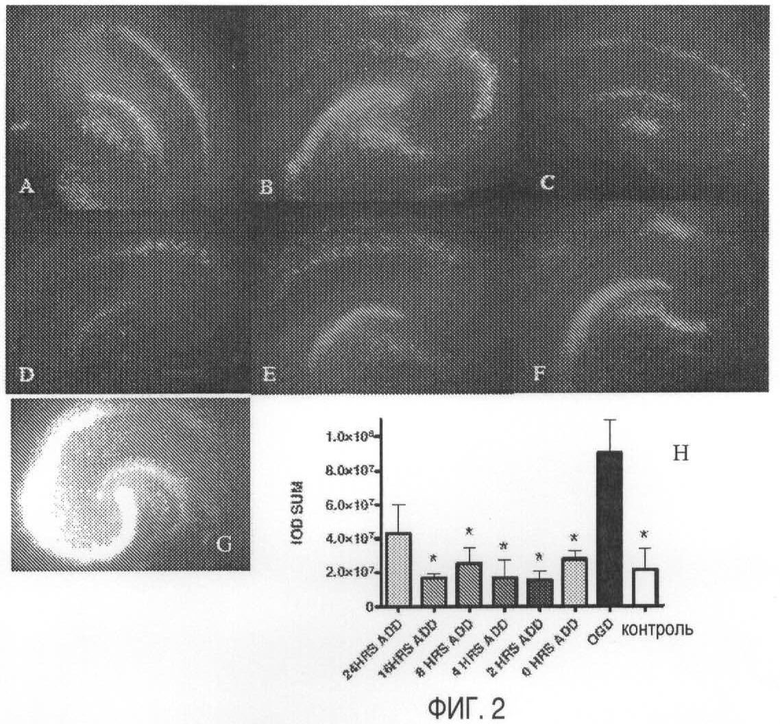
На Фигуре 1 показан эффект нейропротективной дозы МА после депривации по кислороду-глюкозе (OGD). Показаны типичные изображения окрашенных иодидом пропидия культур срезов гиппокампа крыс, сделанных через 48 часов после OGD. Культуры обрабатывают нижеприведенными дозами МА: (А) Контроль без OGD; (В) 125 мкМ МА добавляют через 5 мин после OGD; (С) 250 мкМ МА добавляют через 5 мин после OGD; (D) 500 мкМ МА добавляют через 5 мин после OGD; (Е) 1 мМ МА добавляют через 5 мин после OGD; (F) только OGD. На рисунке (G) показан статистический анализ PI окрашивания, представленный в виде относительной интенсивности флуоресценции (IOD). **=p<0.01, односторонний ANOVA, апостериорный (Post-Hoc) тест Даннета (OGD), “усы” = среднее & SEM (стандартная ошибка среднего); (OGD) n=10, (He-OGD) n=13, (1 мМ МА) n=10, (500 мкМ МА) n=11, (250 мкМ МА) n=9, (125 мкМ МА) n=7.
На Фигуре 2 показаны результаты временнóго анализа опосредованной МА нейропротекции после OGD. Показаны типичные изображения окрашенных иодидом пропидия культур срезов гиппокампа крыс, сделанных через 48 часов после OGD. Дозу 250 мкМ МА вводят после удара в указанные временные точки: (А) не-OGD; (В) 0-5 мин после OGD; (С) 2 час после OGD; (D) 4 час после OGD; (Е) 8 час после OGD; (F) 16 час после OGD; (G) OGD - “необработанный”. На рисунке (Н) показан статистический анализ PI окрашивания, представленный в виде относительной интенсивности флуоресценции (IOD). n=4, **=p<0.05, односторонний ANOVA, апостериорный (Post-Hoc) тест Даннета (OGD), “усы” = среднее & SEM.
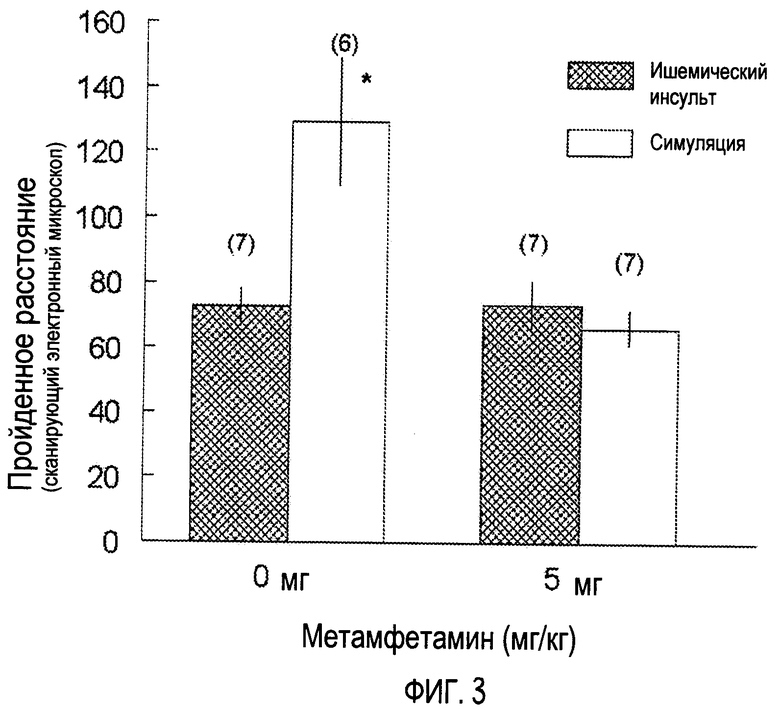
На Фигуре 3 показано среднее (+SEM) расстояние, проходимое на новом приборе в тесте “открытое поле”. Животных тестируют через 24 час после 5-мин 2-VO (Isch) или мнимой (имитированной, симулированной) операции (Sham). После операции (через 1-2 мин) песчанки получают метамфетамин (5 мг) или носитель - физиологический раствор (0 мг). Песчанок помещают в центр и дают им возможность исследовать новую среду в течение 5 мин и получают данные о расстоянии, используя автоматическую систему наблюдения. Ишемические песчанки, не получавшие метамфетамина, значительно более активны по сравнению с не получавшими лекарства животными из группы Sham. Между песчанками из групп Isch и Sham, получавшими лекарства, различия нет, а с помощью лекарства не удается значительно изменить уровни активности по сравнению с контрольным состоянием. *Р<0.05 vs. Isch + лекарство состояние.
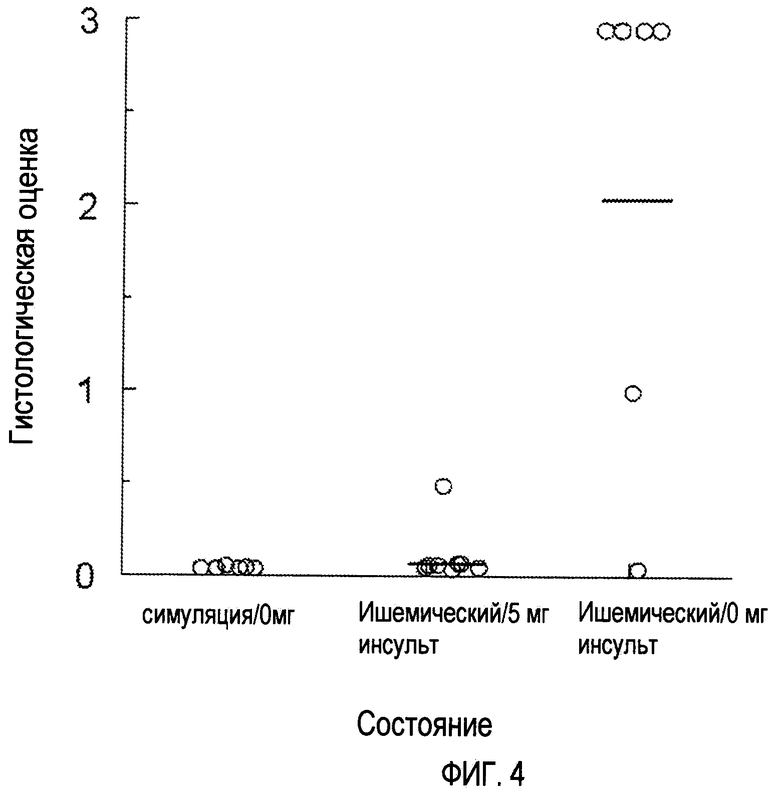
На Фигуре 4 показаны оценки по гистологической шкале срезов гиппокампа через 21 день после ишемического инсульта (Isch) или мнимой (имитированной, симулированной) операции (Sham). Через 1-2 мин после операции песчанки получают метамфетамин (5 мг) или носитель (0 мг). Поражение в поле СА1 гиппокампа оценивают по 4-балльной шкале. Каждому животному дают оценку: 0 (4-5 компактных слоев тел нормальных нейронов), 1 (4-5 компактных слоев при наличии некоторых измененных нейронов), 2 (тела резервных нейронов с “теневыми (повторными) промежутками” и/или глиальными клетками между ними), 3 (абсолютное отсутствие или присутствие только редких тел нормальных нейронов с интенсивным глиозом в поле СА1). Анализ показал, что введение метамфетамина значительно уменьшает поражение поля СА1 гиппокампа после ишемического инсульта.
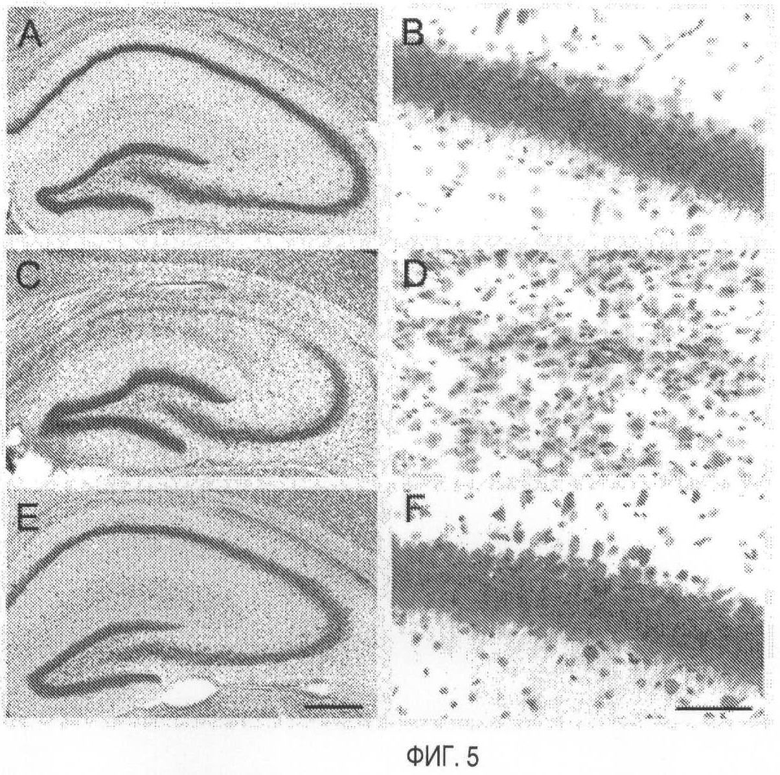
На Фигуре 5 даны микрофотоснимки срезов гиппокампа через 21 день после ишемического инсульта или мнимой (Sham) процедуры с последующим введением метамфетамина (5 мг/кг) или носителя. 5-мин 2-VO приводит в результате к селективной утрате пирамидных нейронов в поле СА1 гиппокампа (рисунки С, D). Как ожидалось, мнимая (Sham) хирургическая операция (рисунки А, В) не вызывает никакой утраты нервных клеток. У песчанок, получивших метамфетамин через 1-2 мин после ишемического инсульта, не удалось обнаружить никакого поражения гиппокампа (панели Е, F). Срезы окрашивали крезилвиолетом. Линейный масштаб = 200 мкм (А, С, Е) и 60 мкм (В, D, F).
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ИЗОБРЕТЕНИЯ
Способ по настоящему изобретению можно использовать для снижения частоты поражения нервных клеток головного мозга, включая клеточную смерть, вызванного состоянием транзиторной церебральной гипоксии и/или ишемии. Предпочтительно, способ позволяет снижать частоту поражения нервных клеток, а именно клеток гиппокампа. Состояние транзиторной церебральной гипоксии и/или ишемии может определяться многими условиями (патологическими состояниями), которые вызывают временный недостаток кислорода и/или глюкозы в клетках головного мозга. Например, инфарктом миокарда, странгуляцией, хирургической операцией (например, кардиохирургической операцией), ударом, кровопотерей, непроходимостью (нарушением проходимости) дыхательных путей или низким кровяным давлением. Предпочтительно, пролечиваемым субъектом является млекопитающее, например обезьяна, собака, кошка, лошадь, крупный рогатый скот, овца, свинья, и, более предпочтительно, этим субъектом является человек.
В отличие от способов предыдущего уровня техники способ по данному описанию действительно обеспечивает защиту и предупреждает поражение нервных клеток головного мозга после события транзиторной церебральной гипоксии и/или ишемии вместо того чтобы просто стимулировать восстановление после того как поражение нервных клеток уже наступило. Для обеспечения наибольшей нейропротекции субъекта нейропротективный агент следует вводить субъекту не позднее чем через 16 часов (например, через 10, 8, 6, 4, 2 часа) после наступления состояния транзиторной церебральной гипоксии и/или ишемии. Предпочтительно, нейропротективный агент выбирают из группы, состоящей из стимулятора центральной нервной системы (CNSS), моноаминного нейромедиатора, ингибитора моноаминоксидазы (MAOI), трициклического антидепрессанта (ТСА) или их комбинации.
В более предпочтительном варианте изобретения нейропротективный агент представляет собой амфетамин, метамфетамин, метилфенидат, этилендиоксиметамфетамин или их комбинацию. В одном предпочтительном варианте изобретения амфетамин представляет собой соединение, содержащее фенилэтиламин. В некоторых вариантах изобретения фенилэтиламин представляет собой D-амфетамин, такой как декстроамфетамин, например аспартат декстроамфетамина, сульфат декстроамфетамина, сахарат декстроамфетамина, метамфетамин и т.д. Конкретные неограничивающие примеры включают Адрекс (Adrex), Бифетамин, Дезоксин, Декседрин, Ферндекс, Робез (Robese), Спансул, Оксидесс II, Декстростат.
В одном варианте изобретения фармацевтический агент вводят в виде фармацевтической композиции, содержащей фармацевтически приемлемый носитель. Фармацевтическая композиция может представлять собой композицию с немедленным или с пролонгированным высвобождением в зависимости от патологического состояния и вероятности повторения. Композиции могут дополнительно включать другие фармацевтически активные соединения, в том числе, по меньшей мере, один дополнительный агент, выбранный из группы, состоящей из моноаминного нейромедиатора, MAOI или ТСА. Дополнительный агент может также включать моноаминный нейромедиатор, предпочтительно, выбранный из группы, состоящей из дофамина, норпинефрина или серотонина, и, более предпочтительно, норпинефрин.
Специалисты в данной области техники найдут различные синтетические методики, которые можно использовать для получения нетоксических фармацевтически приемлемых композиций, содержащих нейропротективный агент.
Фармацевтические композиции и лекарственные формы по изобретению содержат активные ингредиенты по данному описанию. Термин “фармацевтический агент” или “нейропротективный агент” обозначает соединения по изобретению, представленные в данном описании, или их соли. Фармацевтические композиции или лекарственные формы по изобретению могут дополнительно содержать фармацевтически приемлемый носитель.
В одном варианте изобретения выражение “фармацевтически приемлемый” означает утвержденный регулятивным органом Федерального правительства или правительства штата или перечисленный в Фармакопее США (U.S.P.) или другой общепризнанной фармакопее для применения на животных и, более конкретно, на людях. Термин “носитель” относится к разбавителю, адъюванту, эксципиенту или среде (наполнителю), вместе с которым вводят активный ингредиент. Такие фармацевтические носители могут представлять собой жидкости, такие как вода и масла, включая масла из нефти, масла животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п. Фармацевтическими носителями могут являться физиологический раствор, аравийская камедь, желатин, крахмальная паста, тальк, кератин, коллоидный оксид кремния, мочевина и т.п. Помимо этого могут применяться другие эксципиенты.
Лекарственные формы для однократного введения по изобретению пригодны для перорального введения, введения в слизистую оболочку (например, назально, подъязычно, вагинально, трансбуккально или ректально), для парентерального введения (например, подкожного, внутривенного, в виде болюсной инъекции, внутримышечного или внутриартериального) или для трансдермального введения пациенту. Примеры лекарственных форм включают, но без ограничения: таблетки; каплеты; капсулы, такие как мягкие эластичные желатиновые капсулы; облатки; пастилки; лепешки; дисперсии; суппозитории; мази; припарки (компрессы); пасты; порошки; повязки; кремы; пластыри; растворы; пэтчи; аэрозоли (например, назальные спреи или ингаляторы); гели; жидкие лекарственные формы, пригодные для перорального введения или введения в слизистую оболочку пациента, включая суспензии (например, водные или неводные жидкие суспензии, эмульсии типа масло-в-воде или вода-в-масле), растворы и эликсиры; жидкие лекарственные формы, пригодные для парентерального введения пациенту; и стерильные твердые препараты (например, кристаллические или аморфные твердые лекарственные формы), которые могут восстанавливаться (реконституция), при этом получают жидкие лекарственные формы, пригодные для парентерального введения пациенту. Предпочтительно, агент вводят парентерально или перорально, но рассматриваются подробно обсуждаемые в данном описании другие способы, в значительной степени их применение зависит от ишемического состояния.
Состав, форма и тип лекарственных форм по изобретению обычно меняется в зависимости от способа введения и подлежащего лечению животного. Например, лекарственная форма для парентерального введения может содержать меньшие количества одного или более активных ингредиентов, чем пероральная лекарственная форма, применяемая для лечения того же самого заболевания. Эти и другие особенности, которым отличаются друг от друга конкретные лекарственные формы, охватываемые данным изобретением, будут очевидны для специалистов в данной области техники. См., например, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton Pa. (1990).
Типичные фармацевтические композиции и лекарственные формы содержат один или более эксципиентов. Подходящие эксципиенты хорошо известны специалистам в области фармации, а неограничивающие примеры подходящих эксципиентов приводятся в данном описании. Пригоден ли конкретный эксципиент для включения в фармацевтическую композицию или лекарственную форму - это зависит от различных факторов, общеизвестных в уровне техники и включающих, но без ограничения, способ введения лекарственной формы пациенту. Например, пероральные лекарственные формы, такие как таблетки, могут содержать эксципиенты, не подходящие для применения в парентеральных лекарственных формах. Пригодность конкретного эксципиента может также зависеть от конкретного активного ингредиента в лекарственной форме. Например, разложение некоторых активных ингредиентов может ускоряться некоторыми эксципиентами, такими как лактоза, или экспозицией с водой.
Далее изобретение охватывает фармацевтические композиции и лекарственные формы, которые содержат одно или более соединений, которые уменьшают скорость разложения активного ингредиента. Такие соединения, которые в данном описании называются “стабилизаторами”, включают, но без ограничения, антиоксиданты, такие как аскорбиновая кислота, pH буферы или буферные соли.
В конкретном состоянии или методе лечения дозу определяют эмпирически, используя известные методы, и доза зависит от таких показателей, как биологическая активность конкретного используемого соединения, способа введения, возраста, состояния здоровья и веса тела хозяина; природы и силы симптомов; частоты лечения; применения других лекарств и нужного эффекта. Далее в данном описании представлены различные возможные дозировки и способы введения, но следует понимать, что они предлагаются только в качестве иллюстрации. Действительные дозировки и способ введения или доставки может определить только специалист в данной области техники. Например, когда нейропротективный агент представляет собой метамфетамин для введения человеку, стандартная (унифицированная) доза обычно менее 5 мг/кг. Большие дозы, как правило, являются токсическими и обычно не применяются.
Частота введения доз также может меняться в зависимости от используемого соединения и от того, используется ли препарат с пролонгированным высвобождением. Однако для лечения большинства расстройств предпочтительной является однократная (разовая) доза.
Пероральные лекарственные формы
Фармацевтические композиции по изобретению, пригодные для перорального введения, можно представить как дискретные лекарственные формы, такие, но без ограничения, как таблетки (например, жевательные таблетки), каплеты, капсулы и жидкости (например, ароматизированные сиропы). Такие лекарственные формы содержат заданные количества активных ингредиентов и их можно приготовить методами, применяемыми в фармацевтике, общеизвестными специалистам в данной области техники. См. в целом Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton Pa. (1990).
Типичные пероральные лекарственные формы по изобретению готовят, непосредственно смешивая активные ингредиенты, по меньшей мере, с одним эксципиентом в соответствии с обычными методами приготовления лекарств. Эксципиенты могут иметь разнообразные формы в зависимости от вида вводимого препарата. Например, эксципиенты, пригодные для применения в жидкой или аэрозольной лекарственной форме, включают, но без ограничения, воду, гликоли, масла, агенты, придающие вкус и запах, консерванты и красители. Примеры эксципиентов, пригодных для применения в твердых пероральных лекарственных формах (например, порошках, таблетках, капсулах и каплетах), включают, но без ограничения, крахмалы, сахара, микрокристаллическую целлюлозу, разбавители, гранулирующие агенты, смазки, связующие и дезинтегранты, вещества, способствующие расщеплению.
Благодаря простоте применения таблетки и капсулы представляют собой наиболее подходящие пероральные лекарственные формы для однократного применения, в данном случае применяются твердые эксципиенты. При желании таблетки можно покрывать оболочкой стандартными водными или неводными методами. Такие лекарственные формы можно приготовить любым методом, применяемым в фармации. Обычно фармацевтические композиции и лекарственные формы готовят при равномерном и тщательном смешении активных ингредиентов с жидкими носителями, тонкоизмельченными твердыми носителями или с теми и другими, а затем, при необходимости, продукт формуют, придавая нужный вид.
Например, таблетку можно приготовить прессованием или формованием. Прессованные таблетки можно приготовить на соответствующей установке прессованием активных ингредиентов в сыпучем виде, таком как порошок или гранулы, необязательно смешанных с эксципиентом. Формованные таблетки можно приготовить на соответствующей установке формованием смеси порошкообразного соединения, увлажненного инертным жидким разбавителем.
Примеры эксципиентов, которые можно применять в пероральных лекарственных формах по изобретению, включают, но без ограничения, связующие, наполнители, вещества, способствующие дезинтеграции, и смазки. Связующие, пригодные для применения в фармацевтических композициях и лекарственных формах, включают, но без ограничения, кукурузный крахмал, картофельный крахмал или другие крахмалы, желатин, природные и синтетические камеди, такие как аравийская камедь, альгинат натрия, альгиновая кислота, другие альгинаты, порошок трагаканта, камедь гвара, целлюлоза и ее производные (например, этилцеллюлоза, ацетат целлюлозы, кальций-карбоксиметилцеллюлоза, натрий-карбоксиметилцеллюлоза), поливинилпирролидон, метилцеллюлоза, прежелатинизированный крахмал, гидроксипропилметилцеллюлоза (например, No.2208, 2906, 2910), микрокристаллическая целлюлоза и их смеси.
Подходящие формы микрокристаллической целлюлозы включают, но без ограничения, материалы с торговыми названиями AVICEL-PH-101, AVICEL-PH-103, AVICEL RC-581, AVICEL-PH-105 (от корпорации FMC, American Viscose Division, Avicel Sales, Marcus Hook, Pa.) и их смеси. Специфическим связующим является смесь микрокристаллической целлюлозы и натрий-карбоксиметилцеллюлозы с торговым названием AVICEL RC-581. Подходящие безводные эксципиенты или добавки или эксципиенты или добавки с низкой влажностью включают AVICEL-PH-103 и Крахмал Starch 1500 LM.
Примеры наполнителей, пригодных для применения в фармацевтических композициях и лекарственных формах, раскрываемых в данном описании, включают, но без ограничения, тальк, карбонат кальция (например, гранулы или порошок), микрокристаллическую целлюлозу, порошковую целлюлозу, декстраты, каолин, маннит, кремниевую кислоту, сорбит, крахмал, прежелатинизированный крахмал и их смеси. В фармацевтических композициях по изобретению связующее или наполнитель присутствует обычно в количестве, примерно, 50-99% вес. от веса фармацевтической композиции или лекарственной формы.
Дезинтегранты, вещества, способствующие измельчению (дезинтеграции), применяются в композициях по изобретению для получения таблеток, которые расщепляются в водной среде. Таблетки, которые содержат слишком много дезинтегранта, могут подвергаться дезинтеграции при хранении, тогда как таблетки, содержащие слишком мало дезинтегранта, могут не расщепляться с заданной скоростью или в заданных условиях. Таким образом, для приготовления пероральных лекарственных форм по изобретению следует применять достаточное количество дезинтегранта, не слишком большое, не слишком маленькое, для того, чтобы не оказывать пагубного влияния на высвобождение активных ингредиентов. Количество применяемого дезинтегранта меняется в зависимости от типа препарата и это очевидно для рядовых специалистов в данной области техники. Типичные фармацевтические композиции содержат около 0.5-15% вес. дезинтегранта, предпочтительно, около 1-5% вес. дезинтегранта.
Дезинтегранты, которые можно использовать в фармацевтических композициях и лекарственных формах по изобретению, включают, но без ограничения, агар-агар, альгиновую кислоту, карбонат кальция, микрокристаллическую целлюлозу, натрия кроскармеллозу, кросповидон, полакрилин калия, натрия крахмал гликолят, картофельный или маниоковый крахмал, другие крахмалы, прежелатинизированный крахмал, глины, другие альгины, другие целлюлозы, камеди и их смеси.
Смазки, которые можно использовать в фармацевтических композициях и лекарственных формах по изобретению, включают, но без ограничения, стеарат кальция, стеарат магния, минеральное масло, легкое минеральное масло, глицерин, сорбит, маннит, полиэтиленгликоль, другие гликоли, стеариновую кислоту, лаурилсульфат натрия, тальк, гидрогенизированное растительное масло (например, арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло), стеарат цинка, этилолеат, этиллаурат, агар и их смеси. Дополнительные смазки включают, например, силикагель типа “syloid” (AEROSIL 200, выпускаемый корпорацией W.R.Grace Co. of Baltimore, Md.), коагулированный аэрозоль синтетического оксида кремния (выпускаемый корпорацией Degussa Co. of Plano, Тех.), CAB-O-SIL (пирогенный диоксид кремния (кремнезем), выпускаемый корпорацией Cabot. Co. of Boston, Mass.) и их смеси. Если смазки применяют, то их применяют в количестве менее 1% вес. от веса фармацевтических композиций или лекарственных форм, в которые они включены.
Предпочтительная пероральная лекарственная форма по изобретению содержит активный ингредиент, безводную лактозу, микрокристаллическую целлюлозу, поливинилпирролидон, стеариновую кислоту, коллоидный безводный диоксид кремния и желатин.
Парентеральные лекарственные формы
Парентеральные лекарственные формы можно вводить пациентам различными способами, включая, но без ограничения, подкожный, внутривенный, болюсную инъекцию, внутримышечный и внутриартериальный. Так как способ их введения обычно позволяет обходить естественную систему защиты пациента от примесей (загрязнений), то парентеральные лекарственные формы, предпочтительно, являются стерильными или их можно стерилизовать перед введением пациенту. Примеры парентеральных лекарственных форм включают, но без ограничения, растворы, приготовленные для инъекции, сухие продукты, готовые для растворения или суспендирования в фармацевтически приемлемом носителе (среде) для инъекции, суспензии, приготовленные для инъекции, и эмульсии.
Подходящие носители, которые можно использовать в парентеральных лекарственных формах по изобретению, хорошо известны специалистам в данной области техники. Примеры включают, но без ограничения, воду для инъекций USP; водные носители, такие, но без ограничения, как хлорид натрия для инъекций, раствор Рингера для инъекций, раствор декстрозы и хлорида натрия для инъекций и раствор Рингера-лактата для инъекций; смешивающиеся с водой носители, такие, но без ограничения, как этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные носители, такие, но без ограничения, как кукурузное масло, хлопковое масло, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат.
Настоящее изобретение иллюстрируется нижеприведенными неограничивающими примерами. Следует понимать, что выше описаны предпочтительные варианты настоящего изобретения и что их можно модифицировать, не отступая от сущности или объема настоящего изобретения, представленных в Формуле изобретения.
ПРИМЕРЫ
Нейропротективная активность амфетаминов после транзиторного церебрального ишемического инсульта ранее не изучалась. В настоящей работе оценивают метамфетамин (МА), используя in vitro и in vivo модели транзиторной церебральной ишемии. Для in vitro модели культуры, выращенные из срезов гиппокампа крыс, стимулируют депривацией по кислороду-глюкозе. Во второй серии экспериментов используют модель песчанки с 5-мин 2-VO окклюзией в комбинации с поведенческим тестированием для проверки нейропротективной активности МА in vivo. В ходе настоящего исследования было с удивлением обнаружено и продемонстрировано, что введение МА не позднее чем через 16 час после появления транзиторной церебральной ишемии действительной является нейропротективным, уменьшая поражение нервных клеток, включая (клеточную) смерть.
Материалы и методы
1.1 Животные
Все эксперименты на подопытных животных утверждены Университетской институционной комиссией по защите животных и работе с животными. Для экспериментов in vivo берут двадцать восемь взрослых самцов монгольских песчанок (Meriones unguiculatus) весом 60-80 г. Этих животных помещают по отдельности в среду с контролируемым световым (12-часовой светотемновой цикл) и температурным (23°C) режимами. Продажные кормовые гранулы для грызунов и воду дают ad libitum (вволю).
1.2 Исследования in vitro на срезах гиппокампа
Новорожденных крыс (Sprague-Dawley) на 7 день после рождения (Р7) декапитируют и в стерильных условиях извлекают гиппокампы. Гиппокампы рассекают на части (срезы) по 400 мкм на устройстве Макилвейна (McIlwain) для рассечения тканей и отдельные срезы культивируют на проницаемых мембранах Millicell (размер пор 0.4 мкМ) в шестилуночных планшетах в течение 6 дней при 37°C и 5% CO2. В первые два дня срезы выдерживают в первичной среде для посева (50% DMEM (+) глюкоза, 25% HBSS (+) глюкоза, 25% термоинактивированной лошадиной сыворотки, 5 мг/мл D-глюкозы (Sigma), 1 мМ Глютамакса, 1.5% ПенСтреп/Фунгизон (Gibco), и 5 мл 50Х В27 (Gibco)), дополненной антиоксидантами, которую меняют каждые 24 час. На четвертый день срезы помещают в бессывороточную нейробазальную среду (10 мл Neurobasal-А, 200 мкл 50Х В27 добавки, 100 мкл 100Х фунгизона и 100 мкл 100Х глютамакса) и эту среду меняют каждые 48 час. За 24 час до эксперимента инсерты (вкладыши) помещают в бессывороточную нейробазальную среду, дополненную В27, без антиоксидантов. Перед депривацией по кислороду-глюкозе (OGD) через не содержащий глюкозы равновесный солевой раствор (BSS) (120 мМ NaCl, 5 мМ KCl,1.25 мМ NaH2PO4, 2 мМ MgSO4, 2 мМ CaCl2, 25 мМ NaHCO3, 20 мМ HEPES, 25 мМ сахарозы pH 7.3) в течение 1 часа продувают (диффундируют) 5% CO2 и азот (газ, 10 л/час). Затем вкладыши (инсерты) переносят в бескислородный раствор BSS и помещают в (37°) реактор (Pro-Ox) с кислородным датчиком по типу обратной связи, поддерживающим уровни газа при 0.1% O2, 5% CO2, 94.4% азота в течение 90 мин. После OGD срезы сразу же переносят обратно в предварительно нагретую нейробазальную среду и анализируют в соответствии с протоколами эксперимента.
1.3 Транзиторная церебральная ишемия
Анестезию песчанок проводят изофлураном и температуру тела во время хирургического вмешательства поддерживают при 37-38°C с помощью гомеотермического одеяла (Harvard Apparatus, South Natick, USA). На шее делают срединный разрез и общие сонные артерии изолируют и пережимают в течение 5 мин с помощью аневризматических клипс с усилием сжатия 85 г (ISCH; n=14). Вторую группу песчанок (SHAM; n=14) подвергают идентичной процедуре, за исключением того, что сонные артерии не зажимают. Разрез зашивают и не позже чем через 2 мин после реперфузии животные получают МА (5 мг/кг; интраперитонеально (i.p.)) или равный объем носителя (физиологический раствор; 0 мг). Животных помещают в нагретую клетку и наблюдают в течение 30 минут. В питьевую воду добавляют тайленол (8 мг/мл) с целью обеспечить послеоперационное обезболивание.
1.4 Поведенческое тестирование и гистологическая оценка
Каждую песчанку тестируют через 48 час после операции на приборе для теста “открытое поле”, состоящем из пола в виде металлического экрана размером 77 см × 77 см со стенками высотой 15 см. Животных помещают в центр и дают возможность исследовать новое окружение в течение 5 мин. Динамические характеристики (пройденное расстояние, скорость) регистрируют с помощью автоматической системы слежения (ANY-maze, Stoelting, DL) и оценивают по отдельности, используя ANOVA и соответствующий апостериорный (post hoc) тест (P<0.05 считается значимым). Через двадцать один день после операции песчанок подвергают эвтаназии с помощью CO2 и заливают фосфатно-солевым буферным раствором, а затем 4%-ным раствором параформальдегида. Ткани мнимо оперированных (Sham) песчанок, получавших МА (SHAM + 0 mg) не оценивают, так как не предполагалось, что экстренное введение МА изменит гистологическую картину гиппокампа в этой группе. Головной мозг извлекают и затем фиксируют, по меньшей мере, в течение 48 час перед тем как отобрать вибратомные срезы области гиппокампа толщиной 40 мкм. Срезы заключают в микроскопические препараты и окрашивают крезилвиолетом. Поражение поля СА1 области гиппокампа оценивают два независимых эксперта, не зная условия обработки, по 4-балльной шкале, описанной в другом месте (Babcock et al., 1993). Каждому животному дают оценку: 0 (4-5 компактных слоев тел нормальных нейронов), 1 (4-5 компактных слоев при наличии некоторых измененных нейронов), 2 (тела резервных нейронов с “теневыми (повторными) промежутками” и/или глиальными клетками между ними), 3 (абсолютное отсутствие или присутствие только редких тел нормальных нейронов с интенсивным глиозом в поле СА1). Баллы усредняют и оценивают с помощью непараметрической статистики (тест Крускал-Уоллиса и U тест Манна-Уитни; P<0.05 считается значимым).
Результаты
2.1 In vitro исследования среза гиппокампа
Срезы гиппокампа крыс, экспонированные с 90 мин депривацией по кислороду-глюкозе (OGD) и обработанные метамфетамином (МА), показывают значительно (p<0.01) пониженные уровни накопления пропидия иодида (PI), что указывает на пониженную смерть нейронов по сравнению со срезами с OGD только (Фигура 1). В исследованиях зависимости доза - эффект с МА мы наблюдаем оптимальную дозу 250 мкМ МА и повышение накопления PI по мере повышения или понижения концентрации по сравнению с этим количеством. Однако при всех тестированных концентрациях (125 мкМ, 250 мкМ, 500 мкМ, 1 мМ) мы наблюдаем значительную нейропротекцию (p=<0.01) по сравнению со срезами только с OGD.
Для того чтобы далее выяснить влияние МА, мы добавляем 250 мкМ в различные временные точки после OGD и обнаруживаем, что МА значительно (значимо) (p=<0.05) снижает смерть нейронов при введении не позже чем через 16 час после OGD. Добавление МА через 24 час после OGD снижает смерть нейронов, но это снижение незначительно отличается от OGD.
2.2 Изучение транзиторной церебральной ишемии
У песчанок наблюдаются координированные движения не позже чем через 10 минут по окончании действия изофлорана. У животных, получавшие МА, наблюдается пилоэрекция и подвижность хвоста. Животных тестируют на приборе “открытое поле” через 48 час после операции. Песчанки, перенесшие ишемический инсульт без МА обработки, проходят (перемещаются на) 129.4 м (±20; SEM), тогда как контрольные после мнимой операции (Sham) с введением или без введения лекарства перемещаются на 72.7 м (±6) и 73.2 м (±7.5) соответственно. Ишемические песчанки, получившие МА после операции, перемещаются на 66.3 м ± 5.6. Анализ данных по активности выявляет заметную взаимосвязь между лечением лекарством и условиями операции (P<0.05). Последующий планомерный анализ (сравнения) показывает, что ишемические песчанки в отсутствие лечения МА значительно более активны по сравнению с не получающей лекарства Sham группой (группой с мнимой, имитированной операцией) (P<0.05). Между ишемическими песчанками и песчанками из группы с мнимой, имитированной операцией (Sham), получавшими МА, нет заметной разницы (P>0.05). Наконец, с помощью введения МА не удается заметно изменить уровни активности по сравнению с контрольным состоянием (SHAM + 0 мг vs. SHAM + 5 мг; P>0.05). Анализ скорости (пройденное расстояние/время) показывает, что она аналогична скорости ишемических песчанок, получавших физиологический раствор (у ISCH наблюдается значительно более высокие скорости по сравнению со всеми другими экспериментальными группами (данные не показаны)).
Данные гистопатологии и типичные микрофотоснимки анализируемых групп показаны на Фигурах 3 и 4 соответственно. У песчанок в группе ISCH + 0 мг наблюдается сильное поражение в поле СА1 области гиппокампа. У четырех из шести песчанок в этой группе наблюдается абсолютное отсутствие тел нормальных нейронов при интенсивном глиозе поля СА1. Напротив, всех песчанок в группе SHAM + 0 мг определяют как не имеющих заметного поражения гиппокампа (средний балл 0+0). У шести животных из группы ISCH + 5 мг МА наблюдаются 4-5 компактных слоев тел нормальных нейронов в гиппокампе (показатель группы.07±.07). Только у одной песчанки в этой группе наблюдается некое детектируемое поражение в поле СА1. Анализ оценочных баллов показывает заметную разницу между группами (P<0.05). Последующая оценка данных отдельных групп показывает, что между группами SHAM + 0 мг и ISCH + 5 мг существует незначительная разница (P>0.05) и обе эти группы заметно отличаются от группы ISCH + 0 мг (P<0.05).
Обсуждение
Результаты настоящего исследования показывают, что если нейропротективный агент, например МА, вводится не позднее чем через 16 часов после наступления транзиторного ишемического инсульта, поражение нервных клеток в гиппокампе можно уменьшить или предупредить. Например, МА вызывает зависимый от дозы нейропротективный ответ в культурах срезов гиппокампа крыс, сенсибилизированных (индуцированных, стимулированных) депривацией по кислороду-глюкозе. Доза 250 мкг показывает наивысшую степень защиты и является эффективной при введении ее не позднее чем через 16 часов после депривации по кислороду-глюкозе. Введение МА через 24 часа после OGD незначительно снижает накопление PI, это показывает, что дозу МА следует вводить в течение сравнительно короткого периода времени после OGD с целью активировать механизм(ы), отвечающий(е) за уменьшение поражение и смерть нейронов.
Нейропротективная активность МА также продемонстрирована in vivo на модели 5-мин 2-VO транзиторной ишемии у песчанок. Введение МА в течение 1-2 минут после реперфузии предупреждает какую-либо заметную утрату пирамидных клеток в поле СА1 гиппокампа. Гистологический анализ показывает, что у ишемических песчанок, получавших МА, наблюдается почти абсолютная защита СА1 области гиппокампа, причем только у 1 из 7 животных имеется некая детектируемая патология нейронов в гиппокампе. 5-минутная билатеральная окклюзия сонной артерии у песчанки вызывает повышенную локомоторную активность, которая коррелирует с клеточной смертью в поле СА1 гиппокампа (Wang and Corbett, 1990; Babcock et al., 1993). Локомоторная активность ишемических песчанок, пролеченных МА, в настоящем исследовании сравнима с контрольными уровнями, что является показателем значительной нейропротекции. Не исключено, что активация и гиперактивность, которую вызывают амфетамины, может влиять на поведение при ишемии. Однако поведенческое тестирование в настоящем исследовании проводилось после того как лекарство должно было метаболизировать (через 48 час). С этой интерпретацией согласуется наблюдение, что контрольные песчанки, пролеченные МА, не гиперактивны по сравнению с животными, получившими физиологический раствор (SHAM + 0 мг). Дозу МА в эксперименте in vivo берут из предыдущих сообщений, в которых используют песчанок (Teuchert-Noodt et al., 2000; Araki et al., 2002) в качестве экспериментальной модели. Мы также проводили предварительное исследование, в котором было найдено, что дозы МА выше 5 мг/кг (например, 10 и 20 мг/кг) являются летальными для песчанок после операции и далее не анализировались.
Было показано, что амфетамин в комбинации с обучением (тренингом) является обещающей фармакологической стратегией возвращения поведения к норме после удара (см. Martinsson and Eksborg, 2004). Наше наблюдение, что МА на самом деле предупреждает детектируемое поражение гиппокампа после ишемического инсульта, если дается не позднее конкретного периода времени после инсульта, т.е. не позднее 16 часов, представляет собой новый факт (открытие). Следует отметить, эти данные показывают, что нейропротекция не зависит от какого-либо обучения навыкам поведения после инсульта. Возможно, способность МА действительно защищать нейроны гиппокампа от поражения и предупреждать их поражение, в отличие от раскрытий предыдущего уровня техники, когда проводят лечение после наступления поражения, представляет собой эффект, действует в случае транзиторной церебральной ишемии. В отличие от локальной ишемии или других типов кортикального поражения транзиторная церебральная ишемия характеризуется характером задержанной клеточной смерти, ограниченной пирамидными клетками гиппокампа. Реперфузия после короткого ишемического эпизода в данной модели является ключевым событием для последующей клеточной смерти, которая наступает через 3-5 дней после инсульта.
Современные работы по введению МА до события острого удара показывают, что МА значительно увеличивает смерть нейронов (Wang et al., 2001). Однако в свете наших нынешних открытий нельзя исключить, что лечение с помощью МА перед событием удара истощает запасы дофамина и норэпинефрина, которые остаются недоступными для высвобождения после события удара, и при этом возможно, что последующее снижение эффективности передачи нейронного сигнала играет главную роль при поражении, наблюдаемом при предварительном введении МА и ударе. Способность CNSS, например МА, индуцировать высвобождение чрезвычайно большого количества этих нейромедиаторов за очень короткое время может частично объяснить нейропротективный эффект, который мы наблюдаем в наших экспериментах. Дальнейшие исследования, целью которых является осмысление нейропротективного механизма CNSS агентов, могут способствовать выяснению точного механизма и лечения острых ишемических событий.
В вышеприведенном специальном раскрытии описаны пояснительные (иллюстративные) варианты способа снижения частоты поражения нервных клеток, вызванного транзиторной церебральной гипоксией и/или ишемией, но не предполагается ограничить настоящее изобретение исключительно этими вариантами изобретения. Кроме того, предполагается, что в объем изобретения входят любые изменения и/или модификации, которые могут быть очевидны рядовому специалисту в родственной области техники, включая, но без ограничения, производные фармацевтических солей или нефункциональные изменения.
Источники информации



| название | год | авторы | номер документа |
|---|---|---|---|
| 7-ГИДРОКСИЭПИАНДРОСТЕРОН, ОБЛАДАЮЩИЙ НЕЙРОПРОТЕКТИВНОЙ АКТИВНОСТЬЮ | 2001 |
|
RU2307654C2 |
| Способ профилактики ишемических и реперфузионных повреждений нейронов гиппокампа в постреанимационном периоде | 2019 |
|
RU2707875C1 |
| ЭСТРОГЕННЫЕ КОМПОНЕНТЫ ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ НЕВРОЛОГИЧЕСКИХ РАССТРОЙСТВ | 2013 |
|
RU2627846C2 |
| СПОСОБ ЛЕЧЕНИЯ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ И ЦЕРЕБРАЛЬНОГО ПОВРЕЖДЕНИЯ НЕЙРОПРОТЕКТОРНЫМ СРЕДСТВОМ | 1996 |
|
RU2194527C2 |
| СМЕСЬ КОМПОНЕНТОВ С ВЫСОКОЙ МОЛЕКУЛЯРНОЙ МАССОЙ, ПОЛУЧЕННЫХ ИЗ ВОСКА САХАРНОГО ТРОСТНИКА (Saccharum officinarum L.) | 2022 |
|
RU2840422C2 |
| СПОСОБ ПРОФИЛАКТИКИ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ | 2018 |
|
RU2696203C1 |
| НОВЫЕ ПРОИЗВОДНЫЕ ЦИКЛОАЛКАНДИОНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В ФАРМАЦЕВТИКЕ | 2003 |
|
RU2322445C2 |
| Лекарственное средство для профилактики и лечения заболеваний головного мозга и способ лечения заболеваний головного мозга | 2015 |
|
RU2692063C2 |
| ЛЕЧЕНИЕ НЕВРОЛОГИЧЕСКОЙ ДИСФУНКЦИИ С ПРИМЕНЕНИЕМ СУЛЬФАМАТОВ ФРУКТОПИРАНОЗЫ И ЭРИТРОПОЭТИНА | 2002 |
|
RU2317086C2 |
| СПОСОБ ЛЕЧЕНИЯ НЕВРОЛОГИЧЕСКИХ НАРУШЕНИЙ | 2008 |
|
RU2492137C2 |
Группа изобретений относится к области медицины. Проводят диагностику субъекта, находящегося в состоянии транзиторной церебральной гипоксии и/или ишемии, в том числе вызванных травмой мозга. Не позднее чем через 16 часов после наступления этого состояния субъекту вводят терапевтически эффективное количество метамфетамина. Использование заявленной группы изобретений позволяет эффективно снизить частоту повреждения или гибели нервных клеток, вызванных транзиторной церебральной гипоксией и/или ишемией. 2 н. и 13 з.п. ф-лы, 5 ил., 1 пр.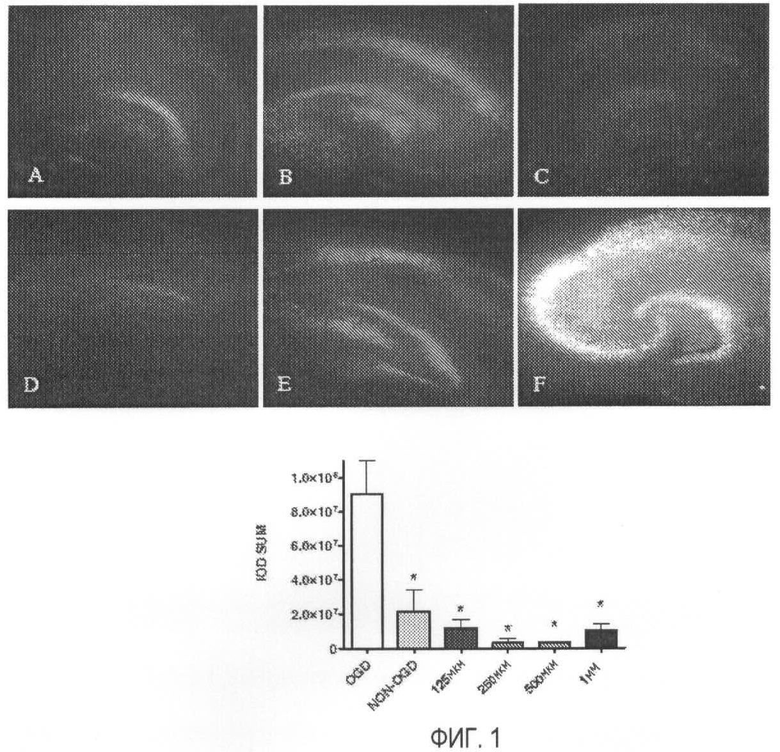
1. Способ снижения частоты поражения или гибели нервных клеток, вызванных транзиторной церебральной гипоксией и/или ишемией, включающий диагностику субъекта, находящегося в состоянии транзиторной церебральной гипоксии и/или ишемии; и, не позднее, чем через 16 ч после наступления этого состояния, введение субъекту терапевтически эффективного количества метамфетамина.
2. Способ по п.1, отличающийся тем, что метамфетамин вводят субъекту в виде стандартной дозы в количестве менее 5 мг/кг.
3. Способ по п.1, отличающийся тем, что лечение снижает частоту поражения нервных клеток в клетках гиппокампа.
4. Способ по п.1, отличающийся тем, что патологическое состояние вызвано низким кровяным давлением, кровопотерей, инфарктом миокарда, странгуляцией, хирургической операцией, инсультом, ишемической оптической нейропатией или непроходимостью дыхательных путей.
5. Способ по п.4, отличающийся тем, что патологическое состояние вызвано операцией на сердце.
6. Способ по п.4, отличающийся тем, что патологическое состояние вызвано травмой мозга.
7. Способ по п.1, отличающийся тем, что введение осуществляют не позднее, чем через 14 ч после наступления этого патологического состояния, и тем, что вводят только одну стандартную дозу метамфетамина.
8. Способ по п.1, отличающийся тем, что введение осуществляют в виде болюсной инъекции.
9. Способ по п.8, отличающийся тем, что метамфетамин включен в фармацевтическую композицию, содержащую фармацевтически приемлемый носитель.
10. Способ по п.9, отличающийся тем, что фармацевтическая композиция представляет собой препарат с пролонгированным высвобождением.
11. Способ по п.1, отличающийся тем, что субъектом является человек, нуждающийся в таком лечении.
12. Способ по п.11, отличающийся тем, что патологическое состояние вызвано ишемическим инсультом, операцией на сердце или ишемической оптической нейропатией.
13. Способ по п.11, отличающийся тем, что метамфетамин вводят не позднее, чем через 12 ч после операции.
14. Способ по п.11, отличающийся тем, что метамфетамин вводят не позднее, чем через 2 ч после операции.
15. Способ снижения частоты поражения или гибели нервных клеток, вызванных транзиторной церебральной гипоксией и/или ишемией, вызванной травмой мозга, включающий диагностику субъекта с травмой мозга и, не позднее, чем через 16 ч после наступления травмы, введение субъекту терапевтически эффективного количества метамфетамина.
| СПОСОБ ЛЕЧЕНИЯ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ И ЦЕРЕБРАЛЬНОГО ПОВРЕЖДЕНИЯ НЕЙРОПРОТЕКТОРНЫМ СРЕДСТВОМ | 1996 |
|
RU2194527C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ИШЕМИЧЕСКОГО ИНСУЛЬТА И СПОСОБ ЛЕЧЕНИЯ | 2002 |
|
RU2251429C2 |
| WO 9964028 A1, 16.12.1999 | |||
| AU 3074592 A, 15.06.1993. | |||
Авторы
Даты
2012-10-27—Публикация
2007-08-15—Подача