Родственные заявки
По настоящей заявке испрашивается приоритет предварительной патентной заявки США, серийный № 60/789725, поданной 5 апреля 2006 г., предварительной патентной заявки США, серийный № 60/790414, поданной 6 апреля 2006 г., полное содержание каждой из которых, таким образом, приведено здесь в качестве ссылки.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Крупномасштабная, экономичная очистка белков становится все более важной проблемой биотехнологической промышленности. Как правило, белки продуцируют в культуре клеток с использованием линий клеток либо млекопитающих, либо бактерий для получения интересующего белка посредством введения рекомбинантной плазмиды, содержащей ген белка. Поскольку применяемые линии клеток представляют собой живые организмы, их необходимо подкармливать комплексной питательной средой для роста, содержащей сахара, аминокислоты и факторы роста, как правило, дополненной препаратами из сыворотки животных. Отделение желаемого белка от смеси соединений для питания клеток и от побочных продуктов самих клеток до чистоты, достаточной для применения в качестве лекарственного средства для человека, представляет собой серьезное испытание.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Существует необходимость в улучшенных способах получения препаратов антитела, содержащих уменьшенное количество белка клетки-хозяина, включая прокатепсин L. Изобретение относится к способу очистки антител, экспрессированных в экспрессирующих системах клетки-хозяина, где полученный препарат содержит уменьшенное количество белка клетки-хозяина, включая прокатепсин L. Улучшенный способ по изобретению включает в себя также разработку воспроизводимых способов точной детекции белков клетки-хозяина и анализ кинетики.
Изобретение относится к способу получения препарата антитела с уменьшенным уровнем белка клетки-хозяина (HCP) из смеси, содержащей антитело и, по меньшей мере, один HCP, включающему стадию ионообменного разделения, где смесь подвергают воздействию первого ионообменного материала так, что получают препарат антитела с уменьшенным уровнем HCP. В одном варианте осуществления стадия ионообменного разделения включает в себя пропускание смеси через первый ионообменный материал так, что получают первый элюат с уменьшенным уровнем HCP. В одном варианте осуществления способ по изобретению дополнительно включает в себя вторую стадию ионообменного разделения, где первый элюат подвергают воздействию второго ионообменного материала, такого, что получают первый проскок с уменьшенным уровнем HCP. В другом варианте осуществления способ по изобретению дополнительно включает в себя стадию разделения с гидрофобным взаимодействием, где первый проскок подвергают воздействию первого материала для гидрофобного взаимодействия так, что получают второй элюат с уменьшенным уровнем HCP.
В одном варианте осуществления изобретения стадия ионообменного разделения включает в себя первую стадию ионообменной хроматографии, где смесь наносят на колонку, содержащую первый ионообменный материал, так, что получают первый элюат с уменьшенным уровнем HCP. В одном варианте осуществления изобретение дополнительно включает в себя вторую стадию ионообменной хроматографии, включающую в себя нанесение первого элюата на колонку, содержащую второй ионообменный материал, так, что получают первый проскок.
В одном варианте осуществления изобретение дополнительно включает в себя стадию разделения с гидрофобным взаимодействием, включающую в себя нанесение первого проскока на колонку, содержащую первый материал для гидрофобного взаимодействия, так, что получают второй элюат. В одном варианте осуществления стадия разделения с гидрофобным взаимодействием включает в себя хроматографию гидрофобного взаимодействия. В одном варианте осуществления хроматография гидрофобного взаимодействия представляет собой хроматографию на фенилсефарозе. В другом варианте осуществления количество антитела, нанесенного на материал для гидрофобного взаимодействия, лежит в диапазоне от приблизительно 20 до приблизительно 40 граммов антитела на литр материала для гидрофобного взаимодействия. В другом варианте осуществления количество антитела, нанесенного на материал для гидрофобного взаимодействия, лежит в диапазоне от приблизительно 30 до приблизительно 36 граммов антитела на литр материала для гидрофобного взаимодействия.
В одном варианте осуществления стадия ионообменной хроматографии представляет собой катионообменную хроматографию. В другом варианте осуществления катионообменная хроматография включает в себя синтетическую полимерную смолу на основе метакрилата, присоединенного к группе сульфоната. В другом варианте осуществления изобретение дополнительно включает в себя промывку ионообменного материала с помощью множества стадий промывки. В одном варианте осуществления множество стадий промывки включает в себя увеличение электропроводности. В одном варианте осуществления ионообменный материал промывают с помощью промывки, включающей в себя 40-50% буфера для элюции и приблизительно 50-60% воды (например, воды для инъекций (WFI)). В одном варианте осуществления буфер для элюции представляет собой 20 мМ Na2PO4, 150 мМ хлорид натрия, pH 7.
В одном варианте осуществления первый элюат подвергают инактивации вирусов перед первой стадией ионообменной хроматографии. В одном варианте осуществления инактивации вирусов достигают посредством pH-инактивации вирусов (например, понижения pH первого элюата, чтобы таким образом инактивировать вирусы).
В одном варианте осуществления изобретения вторая стадия ионообменной хроматографии включает в себя анионообменную хроматографию. В одном варианте осуществления анионообменная хроматография представляет собой хроматографию на Q-сефарозе.
Изобретение относится также к способу получения препарата антитела с уменьшенным уровнем белков клетки-хозяина (HCP) из смеси, содержащей антитело и, по меньшей мере, один HCP, где уменьшенного уровня HCP достигают посредством изменения pH и электропроводности первого элюата, так что pH и электропроводность первого элюата являются, по существу, сходными с pH и электропроводностью второго ионообменного материала. В одном варианте осуществления pH второго ионообменного материала лежит в диапазоне от приблизительно 7,7 до приблизительно 8,3. В другом варианте осуществления pH первого элюата меняется в диапазоне от приблизительно 7,7 до приблизительно 8,3. В другом варианте осуществления pH первого элюата меняется до приблизительно 8,0. В одном варианте осуществления электропроводность второго ионообменного материала лежит в диапазоне от приблизительно 3,5 мСм/см до приблизительно 5,2 мСм/см, или от приблизительно 3,5 мСм/см до приблизительно 4,9 мСм/см. В одном варианте осуществления электропроводность первого элюата меняется в диапазоне от приблизительно 3,5 мСм/см до приблизительно 5,2 мСм/см или от приблизительно 3,5 мСм/см до приблизительно 4,9 мСм/см.
В одном варианте осуществления изобретения первый элюат содержит в диапазоне от приблизительно 90 до приблизительно 100 меньше HCP, чем смесь, как определено по ELISA HCP. В другом варианте осуществления первый проскок содержит в диапазоне от приблизительно 840 до приблизительно 850 меньше HCP, чем первый элюат, как определено по ELISA HCP. В другом варианте осуществления второй элюат содержит в диапазоне от приблизительно 3 до приблизительно 5 раз меньше HCP, чем первый проскок, как определено по ELISA HCP.
Изобретение относится к способу получения препарата антитела с уменьшенным уровнем прокатепсина L из смеси, содержащей антитело и прокатепсин L, включающему стадию ионообменного разделения, где смесь подвергают воздействию первого ионообменного материала так, что получают препарат антитела с уменьшенным уровнем прокатепсина L.
В одном варианте осуществления стадия ионообменного разделения включает в себя пропускание смеси через первый ионообменный материал так, что получают первый элюат с уменьшенным уровнем прокатепсина L. В одном варианте осуществления стадия ионообменного разделения включает в себя первую стадию ионообменной хроматографии, где смесь наносят на колонку, содержащую первый ионообменный материал, так, что получают первый элюат с уменьшенным уровнем прокатепсина L.
В одном варианте осуществления изобретение дополнительно включает в себя вторую стадию ионообменного разделения, где первый элюат подвергают воздействию второго ионообменного материала так, что получают первый проскок с уменьшенным уровнем прокатепсина L. В одном варианте осуществления изобретение дополнительно включает в себя вторую стадию ионообменной хроматографии, включающую в себя нанесение первого элюата на колонку, содержащую второй ионообменный материал, так, что получают первый проскок.
В одном варианте осуществления изобретение дополнительно включает в себя стадию разделения с гидрофобным взаимодействием, где первый проскок подвергают воздействию первого материала для гидрофобного взаимодействия так, что получают второй элюат с уменьшенным уровнем прокатепсина L. В другом варианте осуществления изобретение дополнительно включает в себя стадию разделения с гидрофобным взаимодействием, включающую в себя нанесение первого проскока на колонку, содержащую первый материал для гидрофобного взаимодействия так, что получают второй элюат.
В одном варианте осуществления стадия ионообменной хроматографии представляет собой катионообменную хроматографию, включая в качестве неограничивающих примеров синтетическую полимерную смолу на основе метакрилата, присоединенного к группе сульфоната.
В другом варианте осуществления стадия ионообменной хроматографии дополнительно включает в себя промывку ионообменного материала с помощью множества стадий промывки. В одном варианте осуществления множество стадий промывки включают в себя увеличение электропроводности. В одном варианте осуществления ионообменный материал промывают с помощью буфера для промывки, содержащего приблизительно 40-50% буфера для элюции и приблизительно 50-60% воды (например, воды для инъекций (WFI)). В другом варианте осуществления буфер для элюции представляет собой 20 мМ Na2PO4, 150 мМ хлорид натрия, pH 7.
В одном варианте осуществления изобретения первый элюат подвергают инактивации вирусов перед стадией ионообменной хроматографии. В одном варианте осуществления инактивации вирусов достигают посредством pH-инактивации вирусов (например, снижения pH первого элюата, чтобы таким образом инактивировать вирусы).
В одном варианте осуществления стадия ионообменной хроматографии включает в себя анионообменную хроматографию. В одном варианте осуществления анионообменная хроматография представляет собой хроматографию на Q-сефарозе.
Изобретение относится также к способу, где уменьшенного уровня прокатепсина L достигают посредством изменения pH и электропроводности первого элюата, так, что pH и электропроводность первого элюата являются, по существу, сходными с pH и электропроводностью второго ионообменного материала. В одном варианте осуществления pH второго ионообменного материала лежит в диапазоне от приблизительно 7,7 до приблизительно 8,3. В другом варианте осуществления pH первого элюата меняется в диапазоне от приблизительно 7,7 до приблизительно 8,3. В другом варианте осуществления pH первого элюата меняется до приблизительно 8,0. В другом варианте осуществления электропроводность второго ионообменного материала лежит в диапазоне от приблизительно 3,5 мСм/см до приблизительно 5,2 мСм/см или от приблизительно 3,5 мСм/см до приблизительно 4,9 мСм/см. В одном варианте осуществления электропроводность первого элюата меняется в диапазоне от приблизительно 3,5 мСм/см до приблизительно 5,2 мСм/см или от приблизительно 3,5 мСм/см до приблизительно 4,9 мСм/см.
В одном варианте осуществления изобретения стадия разделения с гидрофобным взаимодействием включает в себя хроматографию гидрофобного взаимодействия. В одном варианте осуществления хроматография гидрофобного взаимодействия представляет собой хроматографию на фенилсефарозе. В другом варианте осуществления количество антитела, наносимого на материал для гидрофобного взаимодействия, лежит в диапазоне от приблизительно 20 до приблизительно 40 граммов антитела на литр материала для гидрофобного взаимодействия. В другом варианте осуществления количество антитела, наносимого на материал для гидрофобного взаимодействия, лежит в диапазоне от приблизительно 30 до приблизительно 36 граммов антитела на литр материала для гидрофобного взаимодействия.
В одном варианте осуществления первый элюат обладает активностью катепсина L в диапазоне от приблизительно 25 до приблизительно 60 RFU/сек/мг антитела, как измеряют посредством анализа кинетики катепсина L.
В другом варианте осуществления первый проскок обладает активностью катепсина L в диапазоне от приблизительно 0,4 до приблизительно 4 RFU/сек/мг антитела, как измеряют посредством анализа кинетики катепсина L.
В другом варианте осуществления второй элюат обладает активностью катепсина L в диапазоне от приблизительно 0,5 до приблизительно 1,5 RFU/сек/мг антитела, как измеряют посредством анализа кинетики катепсина L. В одном варианте осуществления изобретения уровень прокатепсина L является воспроизводимо низким.
В особенно предпочтительном аспекте изобретение относится к способам очистки антитела, в которых большие количества смеси антитело-HCP можно наносить на ионообменную смолу для достижения уменьшения уровня HCP в смеси. Этот способ обладает тем преимуществом, что его можно использовать для смесей антитело-HCP, которые не подвергали связыванию с белком A перед нанесением смеси антитело-HCP на ионообменную смолу. Связывание с белком A, при котором смесь антитело-HCP наносят на колонку с белком A так, что антитело связывается с белком A, а HCP протекают мимо него, как правило, используют как начальную стадию очистки в качестве средства для удаления HCP. Таким образом, способы по изобретению являются применимыми для очистки больших партий смеси антитело-HCP без необходимости проводить хроматографию с белком A в качестве начальной стадии.
Таким образом, в одном варианте осуществления изобретение относится к способу получения препарата антител с уменьшенным уровнем белков клетки-хозяина (HCP) из смеси, содержащей антитело и, по меньшей мере, один HCP, где способ включает в себя:
(a) нанесение смеси на первую ионообменную смолу в буфере для уравновешивания, где наносят более чем 30 граммов антитела на литр смолы;
(b) отмывку HCP со смолы с помощью множества стадий промывки; и
(c) элюцию антитела со смолы с помощью буфера для элюции для получения первого элюата так, что получают препарат антитела с уменьшенным уровнем HCP.
В другом варианте осуществления наносят приблизительно 35-70 граммов антитела на литр смолы. В другом варианте осуществления наносят приблизительно 70 граммов антитела на литр смолы. В предпочтительном варианте осуществления смесь, содержащую антитело и, по меньшей мере, один HCP не подвергают связыванию с белком A (например, не наносят на колонку с белком A) перед нанесением смеси на первую ионообменную смолу.
Предпочтительно, множество стадий промывки включают в себя, по меньшей мере, первую промывку и вторую промывку, где присутствует увеличение электропроводности от первой промывки до второй промывки. Более предпочтительно, первую промывку проводят с помощью буфера для уравновешивания, и вторую промывку проводят с помощью смеси буфера для элюции и воды (например, WFT). Например, смесь буфера для элюции и воды может содержать приблизительно 40-50% буфера для элюции и приблизительно 50-60% воды. Более предпочтительно, смесь буфера для элюции и воды может содержать приблизительно 45% буфера для элюции и приблизительно 55% воды. В предпочтительном варианте осуществления буфер для элюции содержит 20 мМ фосфат натрия и 150 мМ хлорид натрия. В этом случае смесь буфера для элюции и воды, то есть 45% буфера для элюции и приблизительно 55% воды, представляет собой 9 мМ фосфат натрия и 68 мМ хлорид натрия. В предпочтительном варианте осуществления первую промывку проводят с помощью буфера для уравновешивания, содержащего 20 мМ фосфат, 25 мМ хлорид натрия, вторую промывку проводят с помощью буфера, содержащего 9 мМ фосфат, 68 мМ хлорид натрия (45% буфер для элюции, 55% воды), и буфер для элюции содержит 20 мМ фосфат натрия и 150 мМ хлорид натрия. В одном варианте осуществления способ с использованием первой ионообменной смолы осуществляют при pH 7. В другом варианте осуществления способ с использованием первой ионообменной смолы осуществляют при pH 5. В другом варианте осуществления способ с использованием первой ионообменной смолы осуществляют при pH в диапазоне от приблизительно pH 5 до приблизительно pH 7 или в диапазоне pH 5 - pH 7. При применении pH 7 предпочтительно наносят приблизительно 35 граммов антитела на литр смолы. При применении pH 5, предпочтительно, наносят приблизительно 70 граммов антитела на литр смолы. При применении pH в диапазоне от приблизительно pH 5 до приблизительно pH 7 (например, pH 5 - pH 7), предпочтительно, наносят количество антитела от приблизительно 35 до приблизительно 70 граммов антитела на литр смолы (например, 35-70 граммов антитела на литр смолы).
В предпочтительном варианте осуществления достигают лучшей очистки смеси антитело-HCP от HCP (например, при pH 5) благодаря тому, что наносят больше антитела на смолу (например, приблизительно 70 граммов антитела на литр смолы), чем достигают в случае, когда меньше антитела (например, приблизительно 30 граммов антитела на литр смолы) наносят на смолу. Считают, что это является результатом вытеснения HCP со смолы антителом при использовании условий, при которых аффинность связывания антитела со смолой значительно выше, чем аффинность связывания HCP со смолой.
Предпочтительно, первая ионообменная смола представляет собой катионообменную смолу. Предпочтительно, катионообменной смолой набивают колонку, и смесь, содержащую антитело и, по меньшей мере, один HCP, наносят на колонку. Предпочтительно, катионообменная смола включает в себя синтетическую полимерную смолу на основе метакрилата, присоединенного к группе сульфоната (например, фрактогель S). Альтернативно, катионообменная смола может включать в себя, например, синтетические полимеры на основе метакрилата или полистирол, силикагель, агарозу с высоким поперечным сшиванием с декстрановым увеличителем поверхности, смолы с поперечно-сшитым сополимером аллилдекстрана и N. N. метилен-бис-акрила, присоединенным к группам сульфоната, таким как сульфониевые ионы или сульфоэтил.
В другом аспекте по изобретению после осуществления способа с использованием первой ионообменной смолы, описанного выше, способ дополнительно включает в себя подвергание первого элюата стадии инактивации вирусов. Например, инактивации вирусов можно достигать посредством pH-инактивации вирусов для получения препарата с инактивированными вирусами (например, первый элюат подвергают условиям низкого pH, такого как pH приблизительно 3,5, чтобы таким образом инактивировать вирусы). Предпочтительно, препарат с инактивированными вирусами наносят на вторую ионообменную смолу, где перед нанесением препарата с инактивированными вирусами на вторую ионообменную смолу pH и электропроводность препарата с инактивированными вирусами доводят так, чтобы они являлись, по существу, сходными с pH и электропроводностью второй ионообменной смолы. Например, pH второй ионообменной смолы может находиться в диапазоне от приблизительно pH 7,7 до приблизительно pH 8,3, и pH препарата с инактивированными вирусами доводят так, чтобы он находился в диапазоне от приблизительно pH 7,7 до приблизительно pH 8,3. В другом варианте осуществления pH второй ионообменной смолы может находиться в диапазоне от приблизительно pH 7,8 до приблизительно pH 8,2, и pH препарата с инактивированными вирусами доводят так, чтобы он находился в диапазоне от приблизительно pH 7,8 до приблизительно pH 8,2. Более предпочтительно, pH второй ионообменной смолы равен приблизительно pH 8,0, и pH препарата с инактивированными вирусами доводят так, чтобы он был равен приблизительно pH 8,0. Кроме того, электропроводность второй ионообменной смолы может находиться в диапазоне от приблизительно 3,5 мСм/см до приблизительно 5,2 мСм/см, и электропроводность препарата с инактивированными вирусами доводят так, чтобы она находилась в диапазоне от приблизительно 3,5 мСм/см до приблизительно 5,2 мСм/см. Предпочтительно, электропроводность второй ионообменной смолы составляет приблизительно 5,0 мСм/см, и электропроводность препарата с инактивированными вирусами доводят так, чтобы она составляла приблизительно 5,0 мСм/см.
В предпочтительном варианте осуществления вторая ионообменная смола представляет собой анионообменную смолу. Например, анионообменная смола может представлять собой смолу Q-сефарозу. Предпочтительно, второй ионообменной смолой набивают колонку, и препарат с инактивированными вирусами наносят на колонку так, что получают первый проскок.
В другом аспекте по изобретению, после того, как получают первый проскок со второй ионообменной смолы, первый проскок можно наносить на колонку для гидрофобного взаимодействия так, что получают второй элюат. В предпочтительном варианте осуществления колонка для гидрофобного взаимодействия представляет собой колонку с фенилсефарозой. В одном варианте осуществления первый проскок, наносимый на колонку для гидрофобного взаимодействия, содержит от приблизительно 20 до приблизительно 40 граммов антитела на литр материала для колонки для гидрофобного взаимодействия. В другом варианте осуществления первый проскок, наносимый на колонку для гидрофобного взаимодействия, содержит от приблизительно 30 до приблизительно 36 граммов антитела на литр материала для колонки для гидрофобного взаимодействия. Обнаружено, что благодаря эффективности предыдущих стадий способа очистки нет необходимости подвергать второй элюат, полученный с колонки для гидрофобного взаимодействия, фракционированию пиков продукта. Таким образом, в одном варианте осуществления второй элюат не подвергают фракционированию пиков продукта.
В особенно предпочтительном варианте осуществления способ по изобретению для получения препарата антител с уменьшенным уровнем белков клетки-хозяина (HCP) из смеси, содержащей антитело и, по меньшей мере, один HCP, включает в себя:
(a) нанесение смеси на катионообменную смолу в буфере для уравновешивания, где смесь не подвергали связыванию с белком A перед нанесением на катионообменную смолу и где наносят более чем 30 граммов антитела на литр смолы;
(b) отмывку HCP с катионообменной смолы с помощью множества стадий промывки;
(c) элюцию антитела с катионообменной смолы с помощью буфера для элюции для получения первого элюата;
(d) подвергание первого элюата стадии инактивации вирусов;
(e) нанесение препарата с инактивированными вирусами на анионообменную смолу для получения первого проскока; и
(f) нанесение первого проскока на колонку для гидрофобного взаимодействия, так что получают второй элюат;
так что получают препарат антител с уменьшенным уровнем HCP.
В одном варианте осуществления катионообменная смола обладает pH 7, и наносят приблизительно 35 граммов антитела на литр смолы. В другом варианте осуществления катионообменная смола обладает pH 5, и наносят приблизительно 70 граммов антитела на литр смолы. В другом варианте осуществления pH лежит в диапазоне от приблизительно pH 5 до приблизительно pH 7 (например, pH 5 - pH 7), и наносят количество антитела от приблизительно 35 до приблизительно 70 граммов антитела на литр смолы (например, 35-70 граммов антитела на литр смолы).
Предпочтительно, множество стадий промывки включает в себя промывку смолы с помощью первой промывки с использованием буфера для уравновешивания и второй промывки с использованием смеси буфера для элюции и воды. Например, смесь буфера для элюции и воды может содержать приблизительно 40-50% буфера для элюции и приблизительно 50-60% воды (например, WFI), более предпочтительно, приблизительно 45% буфера для элюции и приблизительно 55% воды (например, WFI). В предпочтительном варианте осуществления буфер для элюции содержит 20 мМ фосфат натрия и 150 мМ хлорид натрия. В этом случае смесь буфера для элюции и воды, то есть 45% буфера для элюции и приблизительно 55% воды, представляет собой 9 мМ фосфат натрия и 68 мМ хлорид натрия. В предпочтительном варианте осуществления первую промывку проводят с помощью буфера для уравновешивания, содержащего 20 мМ фосфат, 25 мМ хлорид натрия; вторую промывку проводят с помощью буфера, содержащего 9 мМ фосфат, 68 мМ хлорид натрия (45% буфера для элюции, 55% воды), и буфер для элюции содержит 20 мМ фосфат натрия и 150 мМ хлорид натрия.
Предпочтительно, в вышеописанном способе со стадиями (a)-(f), перед нанесением препарата с инактивированными вирусами на анионообменную смолу (т.е. между стадиями (d) и (e)), pH и электропроводность препарата с инактивированными вирусами доводят так, чтобы они являлись, по существу, сходными с pH и электропроводностью анионообменной смолы. Например, pH второй ионообменной смолы может находиться в диапазоне от приблизительно pH 7,7 до приблизительно pH 8,3, и pH препарата с инактивированными вирусами доводят так, чтобы он лежал в диапазоне от приблизительно pH 7,7 до приблизительно pH 8,3. В другом варианте осуществления pH второй ионообменной смолы может находиться в диапазоне от приблизительно pH 7,8 до приблизительно pH 8,2, и pH препарата с инактивированными вирусами доводят так, чтобы он лежал в диапазоне от приблизительно pH 7,8 до приблизительно pH 8,2. Более предпочтительно, pH второй ионообменной смолы составляет приблизительно pH 8,0, и pH препарата с инактивированными вирусами доводят так, чтобы он составлял приблизительно pH 8,0. Кроме того, электропроводность второй ионообменной смолы может находиться в диапазоне от приблизительно 3,5 мСм/см до приблизительно 5,2 мСм/см, и электропроводность препарата с инактивированными вирусами доводят так, чтобы она лежала в диапазоне от приблизительно 3,5 мСм/см до приблизительно 5,2 мСм/см. Предпочтительно, электропроводность второй ионообменной смолы составляет приблизительно 5,0 мСм/см, и электропроводность препарата с инактивированными вирусами доводят так, чтобы она составляла приблизительно 5,0 мСм/см.
В вышеописанном способе со стадиями (a)-(f), предпочтительно, катионообменная смола представляет собой синтетическую полимерную смолу на основе метакрилата, присоединенного к группе сульфоната (например, фрактогель), анионообменная смола представляет собой смолу Q-сефарозу, и колонка для гидрофобного взаимодействия представляет собой колонку с фенилсефарозой.
Предпочтительно, первый элюат содержит в диапазоне от приблизительно 90 до приблизительно 100 раз меньше HCP, чем смесь, как определено по ELISA HCP. Предпочтительно, первый проскок содержит в диапазоне от приблизительно 840 до приблизительно 850 раз меньше HCP, чем первый элюат, как определено по ELISA HCP. Предпочтительно, второй элюат содержит в диапазоне от приблизительно 3 до приблизительно 5 раз меньше HCP, чем первый проскок, как определено по ELISA HCP.
В особенно предпочтительном варианте осуществления способ по изобретению для получения препарата антител с уменьшенным уровнем белков клетки-хозяина (HCP) из смеси, содержащей антитело и, по меньшей мере, один HCP, включает в себя:
(a) нанесение смеси на катионообменную смолу в буфере для уравновешивания, где катионообменная смола обладает pH 7, и наносят приблизительно 35 граммов антитела на литр смолы, или катионообменная смола обладает pH в диапазоне pH 5 - pH 7 и наносят от приблизительно 35 до приблизительно 70 граммов антитела на литр смолы, или катионообменная смола обладает pH 5 и наносят приблизительно 70 граммов антитела на литр смолы;
(b) отмывку HCP с катионообменной смолы с помощью стадий промывки, включающих в себя первую промывку с использованием буфера для уравновешивания и вторую промывку с использованием смеси буфера для элюции и воды;
(c) элюцию антитела с катионообменной смолы с помощью буфера для элюции для получения первого элюата;
(d) подвергание первого элюата стадии инактивации вирусов, где инактивации вирусов достигают посредством pH-инактивации вирусов для получения препарата с инактивированными вирусами;
(e) нанесение препарата с инактивированными вирусами на анионообменную смолу, где перед нанесением препарата с инактивированными вирусами на анионообменную смолу pH и электропроводность препарата с инактивированными вирусами доводят так, чтобы они являлись, по существу, сходными с pH и электропроводностью анионообменной смолы, и получают первый проскок; и
(f) нанесение первого проскока на колонку для гидрофобного взаимодействия так, что получают второй элюат;
так что получают препарат антитела с уменьшенным уровнем HCP.
Предпочтительно, смесь с антителом не подвергали связыванию с белком A перед нанесением на катионообменную смолу. Предпочтительно, смесь буфера для элюции и воды содержит приблизительно 40-50% буфера для элюции и приблизительно 50-60% воды, более предпочтительно, приблизительно 45% буфера для элюции и приблизительно 55% воды (например, WFI). В предпочтительном варианте осуществления буфер для элюции содержит 20 мМ фосфат натрия и 150 мМ хлорид натрия. В этом случае смесь буфера для элюции и воды, то есть 45% буфера для элюции и приблизительно 55% воды, представляет собой 9 мМ фосфат натрия и 68 мМ хлорид натрия. В предпочтительном варианте осуществления первую промывку проводят с помощью буфера для уравновешивания, содержащего 20 мМ фосфат, 25 мМ хлорид натрия, вторую промывку проводят с помощью буфера, содержащего 9 мМ фосфат, 68 мМ хлорид натрия (45% буфера для элюции, 55% воды), и буфер для элюции содержит 20 мМ фосфат натрия и 150 мМ хлорид натрия. Предпочтительно, первый элюат содержит в диапазоне от приблизительно 90 до приблизительно 100 раз меньше HCP, чем смесь, как определено по ELISA HCP. Предпочтительно, первый проскок содержит в диапазоне от приблизительно 840 до приблизительно 850 меньше HCP, чем первый элюат, как определено по ELISA HCP. Предпочтительно, второй элюат содержит в диапазоне от приблизительно 3 до приблизительно 5 раз меньше HCP, чем первый проскок, как определено по ELISA HCP.
В предпочтительном аспекте любого из вышеописанных способов очистки HCP содержит прокатепсин L, так что получают препарат антитела с уменьшенным уровнем прокатепсина L. Предпочтительно, элюат обладает активностью катепсина L в диапазоне от приблизительно 25 до приблизительно 60 RFU/сек/мг антитела, как измеряют посредством анализа кинетики катепсина L. Предпочтительно, первый проскок обладает активностью катепсина L в диапазоне от приблизительно 0,4 до приблизительно 4 RFU/сек/мг антитела, как измеряют посредством анализа кинетики катепсина L. Предпочтительно, второй элюат обладает активностью катепсина L в диапазоне от приблизительно 0,5 до приблизительно 1,5 RFU/сек/мг антитела, как измеряют посредством анализа кинетики катепсина L. Предпочтительно, уровень прокатепсина L является воспроизводимо низким.
В другом аспекте изобретение относится к способу получения препарата антител с уменьшенным уровнем белков клетки-хозяина (HCP) из смеси, содержащей антитело и, по меньшей мере, один HCP, где способ включает в себя:
(a) нанесение смеси на катионообменную смолу для получения первого элюата;
(b) нанесение первого элюата на анионообменную смолу для получения первого проскока; и
(c) нанесение первого проскока на колонку для гидрофобного взаимодействия так, что получают второй элюат;
так, что получают препарат антитела с уменьшенным уровнем HCP.
Предпочтительно, смесь, содержащую антитело и, по меньшей мере, один HCP, не подвергают связыванию с белком A перед нанесением смеси на первую ионообменную смолу. Предпочтительно, способ дополнительно включает в себя подвергание первого элюата стадии инактивации вирусов перед нанесением первого элюата на анионообменную смолу. Например, инактивации вирусов можно достигать посредством pH-инактивации вирусов.
Предпочтительно, катионообменная смола включает в себя синтетическую полимерную смолу на основе метакрилата, присоединенного к группе сульфоната (например, катионообменная смола может представлять собой колонку с фрактогелем S). Например, колонку с фрактогелем S можно уравновешивать буфером для уравновешивания, содержащим 20 мМ фосфат натрия, 25 мМ хлорид натрия, смесь можно наносить на колонку, колонку можно промывать, по меньшей мере, однократно буфером для уравновешивания, и первый элюат можно получать посредством элюции с помощью буфера для элюции, содержащего 20 мМ фосфат натрия, 150 мМ хлорид натрия.
Предпочтительно, анионообменная смола представляет собой колонку с Q-сефарозой. Например, колонку с Q-сефарозой можно уравновешивать буфером для уравновешивания, содержащим 25 мМ троламин, 40 мМ хлорид натрия, pH 7,6.
Предпочтительно, колонка для гидрофобного взаимодействия представляет собой колонку с фенилсефарозой. Например, колонку с фенилсефарозой можно уравновешивать буфером для уравновешивания, содержащим 20 мМ фосфат натрия, 1,1 M (NH4)2SO4, pH 7, первый проскок можно наносить на колонку, колонку можно промывать, по меньшей мере, однократно буфером для уравновешивания, и можно получать второй элюат посредством осуществления ступенчатого градиента соли до 11 мМ фосфата натрия, 0,625 M (NH4)2SO4, pH 7,0.
Предпочтительно, pH-инактивации вирусов достигают посредством поддержания первого элюата при pH 3,5 в течение приблизительно одного часа.
В другом аспекте изобретение относится к способу получения препарата адалимумаба с уменьшенным уровнем белков клетки-хозяина (HCP) из смеси, содержащей адалимумаб и, по меньшей мере, один HCP, где способ включает в себя:
(a) нанесение смеси на катионообменную смолу, где смесь не подвергают связыванию с белком A перед нанесением смеси на первую ионообменную смолу, для получения первого элюата;
(b) подвергание первого элюата pH-инактивации вирусов для получения препарата с инактивированными вирусами;
(c) нанесение препарата с инактивированными вирусами на анионообменную смолу для получения первого проскока; и
(c) нанесение первого проскока на колонку для гидрофобного взаимодействия так, что получают второй элюат;
так, что получают препарат адалимумаба с уменьшенным уровнем HCP.
Предпочтительно, катионообменная смола представляет собой колонку с фрактогелем S, анионообменная смола представляет собой колонку с Q-сефарозой, и колонка для гидрофобного взаимодействия представляет собой колонку с фенилсефарозой. Например, колонку с Фрактогелем S можно уравновешивать буфером для уравновешивания, содержащим 20 мМ фосфат натрия, 25 мМ хлорид натрия, смесь можно наносить на колонку, колонку можно промывать, по меньшей мере, однократно буфером для уравновешивания, и первый элюат можно получать посредством элюции буфером для элюции, содержащим 20 мМ фосфат натрия, 150 мМ хлорид натрия. Также, например, колонку с Q-сефарозой можно уравновешивать буфером для уравновешивания, содержащим 25 мМ троламин, 40 мМ хлорид натрия, pH 7,6. Также, например, колонку с фенилсефарозой можно уравновешивать буфером для уравновешивания, содержащим 20 мМ фосфат натрия, 1,1 M (NH4)2SO4, pH 7, первый проскок можно наносить на колонку, колонку можно промывать, по меньшей мере, однократно буфером для уравновешивания и второй элюат можно получать посредством осуществления ступенчатого градиента соли до 11 мМ фосфата натрия, 0,625 M (NH4)2SO4s pH 7,0. Также, например, pH-инактивации вирусов можно достигать посредством поддержания первого элюата при pH 3,5 в течение приблизительно одного часа.
Что касается всех вышеописанных способов очистки, в предпочтительном варианте осуществления изобретения антитело представляет собой антитело против фактора некроза опухоли-альфа (TNFα) или его антигенсвязывающую часть. В одном варианте осуществления антитело против TNFα, или его антигенсвязывающая часть представляет собой химерное антитело, гуманизированное антитело или мультивалентное антитело. В одном варианте осуществления антитело против TNFα или его антигенсвязывающая часть представляет собой инфликсимаб или голимумаб.
В другом варианте осуществления антитело против TNFα или его антигенсвязывающая часть представляет собой антитело человека. В одном варианте осуществления антитело против TNFα или его антигенсвязывающая часть представляет собой выделенное антитело человека, которое диссоциирует от TNFα человека с KD 1×10-8 M или менее и константой скорости Koff 1×10-3сек-1 или менее, обе определены посредством поверхностного плазмонного резонанса, и нейтрализует цитотоксичность TNFα в общепринятом анализе in vitro L929 с IC50 1×10-7 M или менее.
В другом варианте осуществления антитело против TNFα или его антигенсвязывающая часть представляет собой выделенное антитело человека со следующими характеристиками:
a) диссоциирует от TNFα человека с константой скорости Koff 1 x 10-3 сек-1 или менее, как определено посредством поверхностного плазмонного резонанса;
b) обладает доменом CDR3 легкой цепи, содержащим аминокислотную последовательность SEQ ID NO:3, или модифицированную из SEQ ID NO:3 посредством одиночной замены на аланин в положении 1, 4, 5, 7 или 8, или посредством от одной до пяти консервативных аминокислотных замен в положениях 1, 3, 4, 6, 7, 8 и/или 9;
c) обладает доменом CDR3 тяжелой цепи, содержащим аминокислотную последовательность SEQ ID NO:4, или модифицированную из SEQ ID NO:4 посредством одиночной замены на аланин в положении 2, 3, 4, 5, 6, 8, 9, 10 или 11 или посредством от одной до пяти консервативных аминокислотных замен в положениях 2, 3, 4, 5, 6, 8, 9, 10, 11 и/или 12.
В другом варианте осуществления антитело против TNFα или его антигенсвязывающая часть представляет собой выделенное антитело человека с вариабельной областью легкой цепи (LCVR), содержащей аминокислотную последовательность SEQ ID NO:1, и вариабельной областью тяжелой цепи (HCVR), содержащей аминокислотную последовательность SEQ ID NO:2.
В другом варианте осуществления антитело против TNFα или его антигенсвязывающая часть представляет собой адалимумаб.
Изобретение относится к препарату антитела, который является в основном свободным от HCP, как измерено по ELISA HCP, полученному с использованием любого из способов по изобретению. Изобретение относится также к фармацевтической композиции, содержащей препарат антитела с уменьшенным уровнем HCP, полученный с использованием любого из способов по изобретению, и фармацевтически приемлемый носитель.
Изобретение относится к фармацевтической композиции, содержащей антитело с уменьшенным уровнем HCP, где уровень HCP составляет не более чем приблизительно 70 нг HCP на 1 мг антитела, как измерено посредством ELISA HCP, и фармацевтически приемлемый носитель. В одном варианте осуществления уровень HCP составляет не более чем приблизительно 13 нг HCP на 1 мг антитела, как измерено посредством ELISA HCP. В другом варианте осуществления уровень HCP составляет не более чем приблизительно 5 нг HCP на 1 мг антитела, как измерено посредством ELISA HCP.
Изобретение относится к композиции, содержащей антитело, где указанная композиция не обладает поддающимся выявлению уровнем HCP, как определено по анализу ELISA HCP.
Изобретение относится также к препарату антитела, который является в основном свободным от прокатепсина L, полученному с использованием любого из способов, описанных здесь. Изобретение относится также к фармацевтической композиции, содержащей препарат антитела с уменьшенным уровнем прокатепсина L, полученный с использованием любого из способов, описанных здесь, и фармацевтически приемлемый носитель.
Изобретение относится к фармацевтической композиции, содержащей антитело с уменьшенным уровнем прокатепсина L и фармацевтически приемлемый носитель, где уровень прокатепсина L составляет не более чем активность катепсина приблизительно 3,0 RFU/сек/мг антитела.
Что касается всех описанных выше препаратов антител и фармацевтических композиций, предпочтительно, антитело представляет собой антитело против фактора некроза опухоли-альфа (TNFα) или его антигенсвязывающую часть. В одном варианте осуществления антитело против TNFα или его антигенсвязывающая часть представляет собой антитело, выбранное из группы, состоящей из гуманизированного, химерного или мультивалентного антитела. В одном варианте осуществления антитело против TNFα или его антигенсвязывающая часть представляет собой инфликсимаб или голимумаб.
В другом варианте осуществления антитело против TNFα или его антигенсвязывающая часть представляет собой антитело человека. В одном варианте осуществления антитело против TNFα или его антигенсвязывающая часть представляет собой выделенное антитело человека, которое диссоциирует от TNFα человека с Kd 1×10-8 M или менее и константой скорости Koff 1×10-3 сек-1 или менее, обе определены посредством поверхностного плазмонного резонанса, и нейтрализует цитотоксичность TNFα в общепринятом анализе in vitro L929 с IC50 1×10-7 M или менее.
В другом варианте осуществления антитело против TNFα или его антигенсвязывающая часть представляет собой выделенное антитело человека со следующими характеристиками:
a) диссоциирует от TNFα человека с константой скорости Koff 1×10-3 сек-1 или менее, как определено посредством поверхностного плазмонного резонанса;
b) обладает доменом GDR3 легкой цепи, содержащим аминокислотную последовательность SEQ ID NO:3, или модифицированную из SEQ ID NO:3 посредством одиночной замены на аланин в положении 1, 4, 5, 7 или 8, или посредством от одной до пяти консервативных аминокислотных замен в положениях 1, 3, 4, 6, 7, 8 и/или 9;
c) обладает доменом CDR3 тяжелой цепи, содержащим аминокислотную последовательность SEQ ID NO:4, или модифицированную из SEQ ID NO:4 посредством одиночной замены на аланин в положении 2, 3, 4, 5, 6, 8, 9, 10 или 11 или посредством от одной до пяти консервативных аминокислотных замен в положениях 2, 3, 4, 5, 6, 8, 9, 10, 11 и/или 12.
В другом варианте осуществления антитело против TNFα или его антигенсвязывающая часть представляет собой выделенное антитело человека с вариабельной областью легкой цепи (LCVR), содержащей аминокислотную последовательность SEQ ID NO:1, и вариабельной областью тяжелой цепи (HCVR), содержащей аминокислотную последовательность SEQ ID NO:2
В другом варианте осуществления антитело против TNFα или его антигенсвязывающая часть представляет собой адалимумаб.
Изобретение относится к способу лечения нарушения, при котором активность TNFα является неблагоприятной, включающему в себя введение человеку фармацевтических композиций, содержащих антитело, полученное с использованием любого из способов по изобретению. В одном варианте осуществления препарат вводят человеку в течение продолжительного периода времени. В одном варианте осуществления продолжительный период времени включает в себя, по меньшей мере, приблизительно 3 месяца, по меньшей мере, приблизительно 4 месяца или, по меньшей мере, приблизительно 5 месяцев.
В одном варианте осуществления нарушение, при котором активность TNFα является неблагоприятной, выбрано из группы, состоящей из аутоиммунного нарушения, нарушения желудочно-кишечного тракта и заболевания кожи. В одном варианте осуществления аутоиммунное нарушение выбрано из группы, состоящей из ревматоидного артрита, ревматоидного спондилита, остеоартрита, подагрического артрита, аллергии, рассеянного склероза, псориатического артрита, аутоиммунного диабета, аутоиммунного увеита, нефротического синдрома и ювенильного ревматоидного артрита. В другом варианте осуществления нарушение желудочно-кишечного тракта представляет собой болезнь Крона. В другом варианте осуществления заболевание кожи представляет собой псориаз.
В одном варианте осуществления фармацевтическую композицию вводят в сочетании с дополнительным лекарственным средством. В одном варианте осуществления дополнительное лекарственное средство представляет собой метотрексат.
Изобретение относится к способу лечения нарушения, при котором активность TNFα является неблагоприятной, включающему в себя введение человеку фармацевтической композиции, содержащей антитело, полученное с использованием любого из способов по изобретению. В одном варианте осуществления препарат вводят человеку в течение продолжительного периода времени. В одном варианте осуществления продолжительный период времени включает в себя, по меньшей мере, приблизительно 3 месяца, по меньшей мере, приблизительно 4 месяца или, по меньшей мере, приблизительно 5 месяцев. В одном варианте осуществления нарушение, при котором активность TNFα является неблагоприятной, выбрано из группы, состоящей из аутоиммунного нарушения, нарушения желудочно-кишечного тракта и заболевания кожи. В одном варианте осуществления аутоиммунное нарушение выбрано из группы, состоящей из ревматоидного артрита, ревматоидного спондилита, остеоартрита, подагрического артрита, аллергии, рассеянного склероза, псориатического артрита, аутоиммунного диабета, аутоиммунного увеита, нефротического синдрома и ювенильного ревматоидного артрита. В одном варианте осуществления нарушение желудочно-кишечного тракта представляет собой болезнь Крона. В одном варианте осуществления заболевание кожи представляет собой псориаз.
В одном варианте осуществления фармацевтическую композицию вводят в сочетании с дополнительным лекарственным средством. В одном варианте осуществления дополнительное лекарственное средство представляет собой метотрексат.
Изобретение относится к изделию, содержащему упаковочный материал, адалимумаб, и этикетку или вкладыш, содержащиеся внутри упаковочного материала, указывающие, что состав с адалимумабом содержит не более чем приблизительно 70 нг HCP на 1 мг адалимумаба. В одном варианте осуществления приблизительно 70 нг HCP на 1 мг адалимумаба измерено посредством ELISA HCP.
Изобретение относится также к изделию, содержащему упаковочный материал, адалимумаб, и этикетку или вкладыш, содержащиеся внутри упаковочного материала, указывающие, что состав с адалимумабом содержит не более чем приблизительно 13 нг HCP на 1 мг адалимумаба. В одном варианте осуществления приблизительно 13 нг HCP на 1 мг адалимумаба измерено посредством ELISA HCP.
Изобретение относится к изделию, содержащему упаковочный материал, адалимумаб и этикетку или вкладыш, содержащиеся внутри упаковочного материала, указывающие, что состав с адалимумабом содержит не более чем приблизительно 5 нг HCP на 1 мг адалимумаба. В одном варианте осуществления приблизительно 5 нг HCP на 1 мг адалимумаба измерено посредством ELISA HCP.
Изобретение относится к изделию, содержащему упаковочный материал, адалимумаб и этикетку или вкладыш, содержащиеся внутри упаковочного материала, указывающие, что состав с адалимумабом содержит уровень прокатепсина L, не превышающий тот, на который указывает активность катепсина L приблизительно 3,0 RFU/сек/мг адалимумаба. В одном варианте осуществления активность катепсина L измеряют посредством анализа кинетики катепсина L.
Кроме того, изобретение относится к анализу кинетики для определения количества прокатепсина L в материале, полученном из экспрессирующей системы в клетках млекопитающих, включающему в себя контактирование материала, полученного из экспрессирующей системы в клетках млекопитающих, с ферментом, чтобы процессировать прокатепсин L до формы активного катепсина L так, что получают образец катепсина L; контактирование образца катепсина L с субстратом для катепсина L; и определение активности катепсина L в образце катепсина L в качестве показателя количества прокатепсина L в материале, полученном из экспрессирующей системы в клетках млекопитающих. В одном варианте осуществления экспрессирующая система в клетках млекопитающих представляет собой клетки яичника китайского хомяка (CHO). В другом варианте осуществления фермент для процессинга прокатепсина L представляет собой эндопептидазу. В другом варианте осуществления субстрат для катепсина L содержит метку. В другом варианте осуществления метка представляет собой флуоресцентное средство. В одном варианте осуществления флуоресцентное средство содержит флуоресцентную группу 7-амино-4-метилкумарин (AMC). В одном варианте осуществления субстрат для катепсина L содержит Z-лейцин-аргинин. В другом варианте осуществления Z-лейцин-аргинин содержит группу AMC.
На фиг.1A и 1B показаны типичные профили элюции для стадии хроматографии на фрактогеле S для каждого способа, включая способ по изобретению (фиг.1A) и способ A (фиг.1B).
На фиг.2A и 2B показано сравнение стадии отмывки проскока стадии хроматографии FF на Q-сефарозе, включая способ по изобретению (фиг.2A) и способ A (фиг.2B).
На фиг.3A и 3B показано сравнение профиля элюции для стадии хроматографии на фенилсефарозе HP, включая способ B (фиг.3A) и способ A (фиг.3B).
На фиг.4 показано графическое изображение постепенного снижения уровня прокатепсина L в среднем для способа B (ромбовидная форма) и в среднем для способа A (квадратная форма).
На фиг.5 показано графическое изображение постепенного снижения уровня HCP в среднем для способа B (ромбовидная форма) и способа A (квадратная форма).
На фиг.6 показано, что считывание кинетики активированных полученных в ходе процесса образцов указывает на линейную зависимость флуоресцентного сигнала от времени реакции.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Определения
Чтобы настоящее изобретение можно было легче понять, сначала определены конкретные термины.
Термин «смесь», как применяют здесь, относится к материалу, обладающему вязкостью, который необходимо очистить, содержащему, по меньшей мере, одно интересующее антитело, которое пытаются очистить от других веществ, которые также могут присутствовать. Смеси могут представлять собой, например, водные растворы, системы органических растворителей, или смеси водных/органических растворителей или растворов. Смеси часто представляют собой сложные смеси или растворы, содержащие многие биологические молекулы (такие как белки, антитела, гормоны и вирусы), малые молекулы (такие как соли, сахара, липиды и т.д.) и даже твердые частицы. В то время как типичная смесь биологического происхождения может сначала представлять собой водный раствор или суспензию, она может также содержать органические растворители, применяемые на более ранних стадиях очистки, таких как преципитация, экстракция растворителями и тому подобное. Примеры смесей, которые могут содержать ценные биологические вещества, поддающиеся очистке посредством различных вариантов осуществления настоящего изобретения, включают в себя в качестве неограничивающих примеров, культуральный супернатант из биореактора, гомогенизированную суспензию клеток, плазму, фракции плазмы и молоко.
Под «очисткой» антитела из смеси, содержащей антитело и одно или более веществ, понимают увеличение степени чистоты антитела в смеси посредством удаления (полностью или частично), по меньшей мере, одного вещества из композиции. Вещество может представлять собой примесь или загрязнение, такие как, в качестве неограничивающих примеров, белок клетки-хозяина (HCP).
Термин «белок (белки) клетки-хозяина» или «HCP» относится к белкам в смеси, которые отличаются от интересующего антитела и, как правило, происходят из источника продукции антитела. HCP желательно исключить из конечного препарата антитела.
Термин «с уменьшенным уровнем» относится к уменьшению или снижению количества вещества. Препарат с уменьшенным уровнем включает в себя препарат, обладающий меньшим уровнем вещества, такого как HCP или прокатепсин L, по отношению к исходному количеству. В одном варианте осуществления вещество представляет собой примесь или загрязнение. В одном варианте осуществления термин «с уменьшенным уровнем» означает, по существу, меньше вещества. В другом варианте осуществления термин «с уменьшенным уровнем» означает отсутствие количества вещества. В одном варианте осуществления отсутствие количества вещества включает в себя «отсутствие количества вещества, поддающегося детекции» с использованием анализов, описанных здесь.
Термин «в основном свободный» включает в себя отсутствие количества вещества, однако может включать в себя также минимальное количество вещества. В одном варианте осуществления отсутствие количества вещества включает в себя «отсутствие количества вещества, поддающегося детекции» с использованием анализов, описанных здесь.
Термин «с уменьшенным уровнем белков клетки-хозяина (HCP)» относится к композиции, включающей в себя, в качестве неограничивающих примеров, элюат, препарат, проскок, содержащий антитело и уменьшенное или сниженное количество HCP после одной или нескольких стадий очистки. В одном варианте осуществления термин «со сниженным уровнем HCP» означает, по существу, меньше HCP в композиции, содержащей антитело. В другом варианте осуществления термин «с уменьшенным уровнем HCP» означает отсутствие количества HCP в композиции, содержащей антитело. В одном варианте осуществления термин «со сниженным уровнем HCP» означает отсутствие количества, поддающегося детекции с использованием анализов, описанных здесь, в композиции, содержащей антитело.
Термин «с уменьшенным уровнем прокатепсина L» относится к композиции, включающей в себя, в качестве неограничивающих примеров, элюат, препарат, проскок, содержащий антитело и уменьшенное или сниженное количество прокатепсина L после одной или нескольких стадий очистки. В одном варианте осуществления термин «с уменьшенным уровнем прокатепсина L» означает, по существу, меньше HCP в композиции, содержащей антитело. В другом варианте осуществления термин «с уменьшенным уровнем прокатепсина L» означает отсутствие количества HCP в композиции, содержащей антитело. В одном варианте осуществления термин «с уменьшенным уровнем прокатепсина L» означает отсутствие количества, поддающегося детекции с использованием анализов, описанных здесь, в композиции, содержащей антитело.
Термин «воспроизводимо низкий» относится к возможности постоянно достигать уменьшенного или сниженного количества, например, возможности постоянно достигать уменьшенного или сниженного количества, по меньшей мере, на 80% за раз, более предпочтительно, по меньшей мере, на 90% за раз, более предпочтительно, по меньшей мере, на 95% за раз и даже более предпочтительно, по меньшей мере, на 98% за раз.
Термин «стадия ионообменного разделения» относится к стадии, где нежелательные вещества или загрязнения, например HCP или прокатепсин L, отделяют от интересующего антитела на основании различий в ионных взаимодействиях интересующего антитела и нежелательного вещества с заряженным материалом. Стадия ионообменного разделения включает в себя в качестве неограничивающих примеров ионообменную хроматографию, включая анионообменную хроматографию и катионообменную хроматографию.
«Ионообменный материал» относится к ионному материалу, который используют в качестве основы для отделения нежелательных веществ или загрязнений, например HCP или прокатепсина L, от антитела. Примеры ионообменных материалов включают в себя анионные и катионные смолы.
«Катионообменный материал» относится к ионообменной смоле с ковалентно связанными отрицательно заряженными лигандами, которая, таким образом, обладает свободными катионами для обмена с катионами в растворе, с которым контактирует смола. Широкое множество катионообменных смол известно в данной области, например те, где ковалентно связанные группы представляют собой карбоксилат или сульфонат. Коммерчески доступные катионообменные смолы включают в себя CMC-целлюлозу, SP-Sephadex™ и Fast S-Sepharose™ (последние две являются коммерчески доступными от Pharmacia).
«Анионообменный материал» относится к ионообменной смоле с ковалентно связанными положительно заряженными группами, такими как четвертичные аминогруппы. Коммерчески доступные анионообменные смолы включают в себя DEAE целлюлозу, TMAE, QAE Sephadex™, и Fast Q-Sepharose™ (последние две являются коммерчески доступными от Pharmacia).
Под «связыванием» молекул с ионообменным материалом понимают подвергание молекулы воздействию ионообменного материала в подходящих условиях (pH/электропроводность) так, что молекула является обратимо иммобилизованной в или на ионообменном материале благодаря ионным взаимодействиям между молекулой и заряженной группой или заряженными группами ионообменного материала.
Термин «стадия гидрофобного взаимодействия» относится к стадии, где нежелательные вещества, например HCP или прокатепсин L, отделяют от интересующего антитела на основании различий в гидрофобных взаимодействиях интересующего антитела и нежелательного вещества с гидрофобным материалом.
Термин «материал для гидрофобного взаимодействия» относится к гидрофобному материалу, который используют в качестве основы для разделения нежелательных веществ или загрязнений, например HCP или прокатепсина L, и антитела. Примеры материалов для гидрофобного взаимодействия включают в себя гидрофобные лиганды, такие как алкильные группы, обладающие от приблизительно 2 до приблизительно 8 атомами углерода, или арильные группы, такие как фенил.
Термин «промывка» или «стадия промывки» включает в себя пропускание подходящего буфера через данный материал или поверх данного материала, например ионообменного материала или материала для гидрофобного взаимодействия.
Термин «множество стадий промывки» включает в себя более чем одну последовательную стадию промывки. Последовательные буферы могут обладать различными свойствами, такими как pH, электропроводность, концентрация растворителя и тому подобными, рассчитанными для диссоциации и удаления различных типов загрязнений, которые являются неспецифически связанными с данным материалом, например ионообменным материалом или материалом для гидрофобного взаимодействия. В одном варианте осуществления множество стадий промывки включает в себя промежуточную промывку, дополнительно включающую в себя приблизительно 40-50% буфера для элюции.
«Элюировать» молекулу (например, антитело или загрязняющее вещество) с материала означает удалить молекулу оттуда посредством изменения буфера, окружающего материал и таким образом уменьшения взаимодействия молекулы и материала. В одном варианте осуществления антитело элюируют с ионообменной колонки, где буфер конкурирует с антителом за заряженные участки ионообменного материала.
Термин «элюат» относится к жидкости, содержащей молекулу (например, антитело или загрязняющее вещество), полученной последовательным связыванием интересующего антитела с материалом для хроматографии и добавлением буфера для элюции для диссоциации антитела. Элюаты можно обозначать по отношению к стадии способа очистки. Например, термин «первый элюат» относится к элюату с первой стадии хроматографии, термин «второй элюат» относится к элюату со второй стадии хроматографии и т.д.
Термин «проскок» относится к жидкости, содержащей молекулу (например, антитело или загрязняющее вещество), которую получают посредством пропускания смеси, содержащей молекулу, через материал для хроматографии так, что молекула проходит через материал без связывания.
«Буфер» относится к веществу, которое, посредством его присутствия в растворе, увеличивает количество кислоты или щелочи, которое необходимо добавить, чтобы вызвать изменение pH на единицу. Забуференный раствор устойчив к изменениям pH благодаря действию его компонентов - конъюгатов кислота-щелочь. Забуференные растворы для использования с биологическими реагентами, как правило, способны поддерживать постоянную концентрацию ионов водорода, так что pH раствора лежит в физиологическом диапазоне. Общепринятые компоненты буфера включают в себя в качестве неограничивающих примеров органические и неорганические соли, кислоты и основания. Примерные буферы для использования для очистки биологических молекул (например, антител) включают в себя цвиттерионные буферы или буферы «Good», смотри, например, Good et al. (1966) Biochemistry 5:467 и Good and Izawa (1972) Methods Enzymol. 24:62. Буферы включают в себя в качестве неограничивающих примеров TES, MES, PIPES, HEPES, MOPS, MOPSO, ТРИЦИН и БИЦИН.
«Буфер для промывки», как применяют здесь, всегда обозначает вещество, используемое для удаления примесей из данного материала, например ионообменного материала или материала для гидрофобного взаимодействия, с которым связано антитело.
«Буфер для элюции» обозначает вещество, используемое для диссоциации антитела с данного материала, например ионообменного материала или материала для гидрофобного взаимодействия, после того, как его промыли одним или несколькими веществами для промывки. Буфер для элюции действует для диссоциации антитела. Типичные вещества для элюции хорошо известны в данной области и могут обладать более высокими концентрациями солей, свободных аффинных лигандов или аналогов, или других веществ, которые способствуют диссоциации намеченного вещества, например антитела, с данного материала. Электропроводность и/или pH буфера для элюции является/являются такими, что антитело элюируют с ионообменного материала или с материала для гидрофобного взаимодействия.
Термин «электропроводность» относится к способности водного раствора проводить электрический ток между двумя электродами. В растворе ток протекает посредством ионного транспорта. Таким образом, при увеличивающемся количестве ионов, присутствующих в водном растворе, раствор будет обладать более высокой электропроводностью. Единицей измерения для электропроводности является mmhos (мСм/см), и ее можно измерять с использованием кондуктометра, например, поставляемого Orion. Электропроводность раствора можно изменять посредством изменения концентрации ионов в нем. Например, концентрацию забуферивающего средства и/или концентрацию соли (например, NaCl или KCl) в растворе можно изменять, чтобы достигать желаемой электропроводности. В одном варианте осуществления концентрацию соли в буфере для промывки или любом другом водном растворе, применяемом для хроматографии, модифицируют для достижения желаемой электропроводности.
«pI» или «изоэлектрическая точка» полипептида, такого как антитело, относится к pH, при котором положительный заряд полипептида уравновешивает его отрицательный заряд. pi можно вычислять из суммарного заряда аминокислотных остатков полипептида или можно определять посредством изоэлектрической фокусировки.
Термин «инактивация вирусов» включает в себя перевод вируса, содержащегося в смеси, в нефункциональное состояние или удаление вируса из смеси, подлежащей очистке. Вирус может происходить из источника продукции антитела нижележащих стадий обработки или условий производства. Способы перевода вируса в нефункциональное состояние или удаления вируса включают в себя тепловую инактивацию, pH-инактивацию, химические инактивирующие средства и т.д. Термин «pH-инактивация вирусов» включает в себя подвергание вируса воздействию pH, достаточного для перевода вируса в нефункциональное состояние.
Термин «TNFα человека» (обозначенный здесь hTNFα или просто hTNF), как применяют здесь, предназначен для обозначения цитокина человека, который существует в секретируемой форме 17 кДа и в связанной с мембраной форме 26 кДа, биологически активная форма которого состоит из тримера нековалентно связанных молекул 17 кДа. Структура hTNFα дополнительно описана, например, в Pennica, D., et al. (1984) Nature 312:724-729; Davis, J.M., et al. (1987) Biochemistry 26:1322-1326; и Jones, E. Y., et al. (1989) Nature 338:225-228. Термин TNFα человека предназначен, чтобы включать в себя рекомбинантный TNFα человека (rhTNFα), который можно получить посредством общепринятых рекомбинантных способов экспрессии или приобрести из коммерческих источников (R & D Systems, Catalog № 210-TA, Minneapolis, MN). TNFα обозначают также как TNF.
Термин «антитело», как применяют здесь, предназначен, чтобы относиться к молекулам иммуноглобулина, состоящим из четырех полипептидных цепей, двух тяжелых (H) цепей и двух легких (L) цепей, связанных между собой посредством дисульфидных связей. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (обозначенной здесь как HCVR или VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (обозначенной здесь как LCVR или VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, CL. Области VH и VL можно дополнительно подразделить на области гипервариабельности, обозначенные определяющими комплементарность областями (CDR), перемежающимися с более консервативными областями, обозначенными каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от N-конца до С-конца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Антитела по изобретению более подробно описаны в патентах США № 6090382; 6258562; и 6509015, полное содержание каждого из которых приведено здесь в качестве ссылки. В одном варианте осуществления антитело по изобретению представляет собой анти-TNFα, которое мешает активности TNFα. Антитела против TNFα включают в себя в качестве неограничивающих примеров, антитела и части антител человека против TNFα, описанные здесь, а также описанные в патентах США № 6090382; 6258562; 6509015 и в патентных заявках США серийные № 09/801185 и 10/302356, содержание каждого из которых приведено здесь в качестве ссылки. В одном варианте осуществления ингибитор TNFα, применяемый по изобретению, представляет собой антитело против TNFα или его фрагмент, включая инфликсимаб (Remicade®, Johnson and Johnson; описан в патенте США № 5656272, приведенном здесь в качестве ссылки), CDP571 (гуманизированное моноклональное антитело IgG4 против TNF-альфа), CDP 870 (фрагмент гуманизированного моноклонального антитела против TNF-альфа), анти-TNF dAb (Peptech), CNTO 148 (голимумаб; Medarex and Centocor), антитела, описанные в WO 02/12502, и адалимумаб (Humira® Abbott Laboratories, mAb человека против TNF, описанное в US 6090382 как D2E7). Дополнительные антитела или их фрагменты, которые можно применять по изобретению, описанные в патентах США № 6593458; 6498237; 6451983; и 6448380, содержание каждого из которых приведено здесь в качестве ссылки. Термин включает в себя «интересующее антитело», которое представляет собой антитело, являющееся целью способа по изобретению.
Термин «антигенсвязывающая часть» антитела (или просто «часть антитела»), как применяют здесь, обозначает один или несколько фрагментов антитела, сохраняющих способность специфически связывать антиген (например, hTNFα). Показано, что антигенсвязывающую функцию антитела можно осуществлять посредством фрагментов полноразмерного антитела. Примеры связывающих фрагментов, охватываемых термином «антигенсвязывающая часть» антитела, включают в себя (i) Fab-фрагмент, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) F(ab')2-фрагмент, двухвалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из доменов VH и CH1; (iv) Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела, (v) dAb-фрагмент (Ward et al, (1989) Nature 341:544-546), состоящий из домена VH; и (vi) выделенную определяющую комплементарность область (CDR). Более того, хотя два домена Fv-фрагмента, VL и VH, являются кодированными двумя отдельными генами, их можно объединить с использованием рекомбинантных способов посредством синтетического линкера, позволяющего получить их как одну белковую цепь, в которой области VL и VH соединены с формированием моновалентной молекулы (известной так же, как одноцепочечный Fv (scFv); смотри, например, Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Такие одноцепочечные антитела также предназначены, чтобы входить в термин «антигенсвязывающая часть» антитела. Включены также другие формы одноцепочечных антител, такие как диатела. Диатела представляют собой двухвалентные, биспецифические антитела, в которых домены VH и VL экспрессированы на одной полипептидной цепи, но с использованием линкера, слишком короткого, чтобы позволить спаривание между двумя доменами одной и той же цепи, таким образом заставляя домены спариваться с комплементарными доменами другой цепи и создавая два антигенсвязывающих участка (смотри, например, Holliger, P., et al. (1993) Proc. Natl. Acad. Sci. USA 90:6444-6448; Poljak, R. J., et al. (1994) Structure 2:1121-1123). Части антитела по изобретению описаны более подробно в патентах США № 6090382, 6258562, 6509015, полное содержание каждого из которых приведено здесь в качестве ссылки.
Связывающие фрагменты получают посредством способов рекомбинантной ДНК или посредством ферментативного или химического расщепления интактных иммуноглобулинов. Связывающие фрагменты включают в себя Fab, Fab', F(ab')2, Fabc, Fv, отдельные цепи и одноцепочечные антитела. Под отличными от «биспецифических» или «бифункциональных» иммуноглобулинов или антител понимают иммуноглобулин или антитело, обладающие идентичными каждым из его связывающих участков. «Биспецифическое» или «бифункциональное антитело» представляет собой искусственное гибридное антитело, обладающее двумя различными парами тяжелая/легкая цепь и двумя различными связывающими участками. Биспецифические антитела можно получать множеством способов, включая слияние гибридом или связывание Fab'-фрагментов. Смотри, например, Songsivilai & Lachmann, Clin. Exp. Immunol. 79:315-321 (1990); Kostelny et al., J. Immunol. 148, 1547-1553 (1992).
«Консервативная аминокислотная замена», как применяют здесь, представляет собой замену, при которой один из аминокислотных остатков заменяют другим аминокислотным остатком, обладающим сходной боковой цепью. В данной области определены семейства аминокислотных остатков, обладающих сходными боковыми цепями, включая основные боковые цепи (например, лизин, аргинин, гистидин), кислые боковые цепи (например, аспарагиновая кислота, глутаминовая кислота), незаряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин).
«Химерные антитела» обозначает антитела, где одна часть каждой из аминокислотных последовательностей тяжелой и легкой цепей является гомологичной соответствующим последовательностям в антителах, полученных из конкретных видов или принадлежащих к конкретному классу, в то время как оставшийся фрагмент является гомологичным соответствующим последовательностям из других видов. В одном варианте осуществления изобретение относится к химерному антителу или антигенсвязывающему фрагменту, в котором вариабельные области как легкой, так и тяжелых цепей имитируют вариабельные области антител, полученных из одного вида млекопитающих, в то время как константные части являются гомологичными последовательностям антител, полученных из другого вида. В предпочтительном варианте осуществления изобретения химерные антитела получают посредством прививки CDR из антитела мыши в каркасные области антитела человека.
«Гуманизированные антитела» относятся к антителам, содержащим, по меньшей мере, одну цепь, содержащую каркасные остатки вариабельной области в основном из цепи антитела человека (обозначаемого как акцепторный иммуноглобулин или антитело) и, по меньшей мере, одну определяющую комплементарность область (CDR) в основном из не относящегося к человеку антитела (например, мыши). В дополнение к прививке CDR, гуманизированные антитела, как правило, подвергают дополнительным изменениям для улучшения аффинности и/или иммуногенности.
Термин «мультивалентное антитело» относится к антителу, содержащему более одного узнающего антиген участка. Например, «бивалентное» антитело обладает двумя узнающими антиген участками, в то время как «тетравалентное» антитело обладает четырьмя узнающими антиген участками. Термины «моноспецифическое», «биспецифическое», «триспецифическое», «тетраспецифическое» и т.д. относятся к числу различных специфичностей узнающего антиген участка (в отличие от числа узнающих антиген участков), присутствующих в мультивалентном антителе. Например, участки узнавания антигена «моноспецифического» антитела все связывают один и тот же эпитоп. «Биспецифическое» антитело или антитело «с двойной специфичностью» обладает, по меньшей мере, одним участком узнавания антигена, который связывает первый эпитоп, и, по меньшей мере, одним участком узнавания антигена, который связывает второй эпитоп, отличающийся от первого эпитопа. «Мультивалентное моноспецифическое» антитело обладает множеством участков узнавания антигена, которые все связывают один и тот же эпитоп. «Мультивалентное биспецифическое» антитело обладает множеством участков узнавания антигена, некоторое число из которых связывает первый эпитоп, и некоторое число из которых связывает второй эпитоп, который отличается от первого эпитопа.
Термин «антитело человека», как применяют здесь, предназначен, чтобы включать в себя антитела, обладающие вариабельными и константными областями, происходящими из последовательностей иммуноглобулина зародышевой линии. Антитела человека по изобретению могут содержать аминокислотные остатки, не кодируемые зародышевыми последовательностями иммуноглобулина человека (например, мутации, введенные случайным или сайт-направленным мутагенезом in vitro или соматической мутацией in vivo), например, в CDR, и в частности, CDR3. Однако термин «антитело человека», как применяют здесь, не предназначен, чтобы включать в себя антитела, в которых последовательности CDR, происходящие из зародышевой линии других видов млекопитающих, таких как мышь, привиты в человеческие каркасные последовательности.
Термин «рекомбинантное антитело человека», как применяют здесь, предназначен, чтобы включать все антитела человека, подготовленные, экспрессированные, полученные или выделенные рекомбинантными способами, такие как антитела, экспрессированные с использованием рекомбинантного экспрессирующего вектора, трансфицированного в клетку-хозяина (описанные далее ниже), антитела, выделенные из рекомбинантной, комбинаторной библиотеки антител человека (описанные далее ниже), антитела, выделенные из животного (например, мыши), которое является трансгенным для генов иммуноглобулина человека (см., например, Taylor, L. D., et al. (1992) Nucl. Acids Res. 20:6287), или антитела, подготовленные, экспрессированные, полученные или выделенные посредством любых других способов, включающих в себя стыковку последовательностей гена иммуноглобулина с другими последовательностями ДНК. Такие рекомбинантные антитела человека обладают вариабельными и константными областями, происходящими из зародышевых последовательностей иммуноглобулина человека. В конкретных вариантах осуществления, однако, такие рекомбинантные антитела человека подвергают мутагенезу in vitro (или при использовании животного, трансгенного для последовательностей Ig человека, соматическому мутагенезу in vivo) и, таким образом, аминокислотные последовательности областей VH и VL рекомбинантных антител представляют собой последовательности, которые, в то время как являются полученными из зародышевых последовательностей VH и VL человека, и родственными им, могут не существовать в природе в пределах зародышевого репертуара антител человека in vivo.
Такие химерные, гуманизированные человеческие антитела и антитела с двойной специфичностью можно получать способами рекомбинантной ДНК, известными в данной области, например, с использованием способов, описанных в Международной заявке PCT № PCT/US86/02269; Европейской патентной заявке № 184187; Европейской патентной заявке № 171496; Европейской патентной заявке № 173494; Международной публикации PCT № WO 86/01533; патенте США № 4816567; Европейской патентной заявке № 125023; Better et al (1988) Science 240:1041-1043; Liu et al. (1987) Proc. Natl. Acad. Sci. USA 84:3439-3443; Liu et al. (1987) J. Immunol 139:3521-3526; Sun et al. (1987) Proc. Natl. Acad. Sci. USA 84:214-218; Nishimura et al. (1987) Cancer Res. 47:999-1005; Wood et al. (1985) Nature 314:446-449; Shaw et al. (1988) J. Natl. Cancer Inst. 80:1553-1559); Morrison (1985) Science 229: 1202-1207; Oi et al. (1986) BioTechniques 4:214; патенте США № 5225539; Jones et al. (1986) Nature 321:552-525; Verhoeyan et al. (1988) Science 239:1534; и Beidler et al. (1988) J. Immunol. 141:4053-4060, Queen et al., Proc. Natl. Acad. Sci. USA 86:10029-10033 (1989), US 5530101, US 5585089, US 5693761, US 5693762, Selick et al, WO 90/07861, и Winter, US 5225539.
«Выделенное антитело», как применяют здесь, предназначено для обозначения антитела, которое является в основном свободным от других антител, обладающих отличающимися антигенными специфичностями (например, выделенное антитело, которое специфически связывает hTNFα, является в основном свободным от антител, которые специфически связывают антигены, отличные от hTNFα). Выделенное антитело, которое специфически связывает hTNFα, может, однако, обладать перекрестной реактивностью для других антигенов, таких как молекулы TNFα из других видов (более подробно обсуждаются ниже). Более того, выделенное антитело может являться в основном свободным от другого клеточного материала и/или химических веществ.
«Нейтрализующее антитело», как применяют здесь (или «антитело, нейтрализующее активность hTNFα»), предназначено для обозначения антитела, связывание которого с hTNFα приводит к ингибированию биологической активности hTNFα. Это ингибирование биологической активности hTNFα можно оценить посредством измерения одного или нескольких показателей биологической активности hTNFα, таких как индуцированная hTNFα цитотоксичность (либо in vitro, либо или in vivo), индуцированная hTNFα активация клеток и связывание hTNFα с рецепторами hTNFα. Эти показатели биологической активности hTNFα можно оценивать посредством одного или нескольких общепринятых анализов in vitro или in vivo, известных в данной области (смотри патент США № 6090382). Предпочтительно, способность антитела нейтрализовывать активность hTNFα оценивают посредством ингибирования индуцированной hTNFα цитотоксичности клеток L929. В качестве дополнительного или альтернативного параметра активности hTNFα можно оценивать способность антитела ингибировать индуцированную hTNFα экспрессию ELAM-1 на HUVEC в качестве показателя индуцированной hTNFα активации клеток.
Термин «поверхностный плазмонный резонанс», как применяют здесь, обозначает оптический феномен, позволяющий анализ биоспецифических взаимодействий в реальном времени посредством детекции изменений концентраций белка внутри матрицы биосенсора, например, с использованием системы BIAcore (Pharmacia Biosensor AB, Uppsala, Sweden и Piscataway, NJ). Дополнительные описания смотри в примере 1 из патента США 6258562 и Jöhnsson et al. (1993) Ann. Biol. Clin. 51:19; Jöhnsson et al. (1991) Biotechniques 11:620-627; Johnsson et al. (1995) J. Mol. Recognit. 8:125; и Johnsson et al. (1991) Anal. Biochem. 198:268.
Термин «Koff», как применяют здесь, предназначен для обозначения константы скорости обратной реакции для диссоциации антитела из комплекса антитело/антиген.
Термин «Kd», как применяют здесь, предназначен для обозначения равновесной константы диссоциации для конкретного взаимодействия антитело-антиген.
Термин «IC50», как применяют здесь, предназначен для обозначения концентрации ингибитора, необходимой для ингибирования интересующей биологической конечной точки, например нейтрализации активности цитотоксичности.
Термин «молекула нуклеиновой кислоты», как применяют здесь, предназначен, чтобы включать в себя молекулы ДНК и молекулы РНК. Молекула нуклеиновой кислоты может являться одноцепочечной или двухцепочечной, но предпочтительно представляет собой двухцепочечную ДНК.
Термин «выделенная молекула нуклеиновой кислоты», как применяют здесь по отношению к нуклеиновым кислотам, кодирующим антитела или части антител (например, VH, VL, CDR3), связывающих hTNFα, предназначен для обозначения молекулы нуклеиновой кислоты, в которой нуклеотидные последовательности, кодирующие антитело или часть антитела, являются свободными от других нуклеотидных последовательностей, кодирующих антитела или части антител, связывающих антигены, отличные от hTNFα, где другие последовательности в природе могут фланкировать нуклеиновую кислоту в геномной ДНК человека. Таким образом, например, выделенная нуклеиновая кислота по изобретению, кодирующая VH-область антитела против hTNFα, не содержит других последовательностей, кодирующих другие VH-области, связывающие антигены, отличные от hTNFα.
Термин «вектор», как применяют здесь, предназначен для обозначения молекулы нуклеиновой кислоты, способной переносить другую нуклеиновую кислоту, с которой она связана. Одним типом вектора является «плазмида», которая обозначает кольцевую петлю двухцепочечной ДНК, в которую можно лигировать дополнительные фрагменты ДНК. Другим типом вектора является вирусный вектор, где дополнительные фрагменты ДНК можно лигировать в вирусный геном. Конкретные векторы являются способными к автономной репликации в клетке-хозяине, в которую они введены (например, бактериальные векторы, обладающие бактериальной точкой начала репликации, и эписомальные векторы млекопитающих). Другие векторы (например, не эписомальные векторы млекопитающих) можно интегрировать в геном клетки-хозяина при введении в клетку-хозяина, и таким образом они реплицируются вместе с геномом хозяина. Кроме того, конкретные векторы способны управлять экспрессией генов, с которыми они функционально связаны. Такие векторы обозначены здесь «рекомбинантные экспрессирующие векторы» (или просто «экспрессирующие векторы»). Как правило, экспрессирующие векторы для использования в способах рекомбинантной ДНК часто присутствуют в форме плазмиды. В настоящем описании «плазмиду» и «вектор» можно использовать как взаимозаменяемые, так как плазмида является наиболее общепринятой формой вектора. Однако изобретение предназначено, чтобы включать в себя другие такие формы экспрессирующих векторов, такие как вирусные векторы (например, дефектные по репликации ретровирусы, аденовирусы и аденоассоциированные вирусы), выполняющие эквивалентные функции.
Термин «рекомбинантная клетка-хозяин» (или просто «клетка-хозяин»), как применяют здесь, предназначен для обозначения клетки, в которую введен рекомбинантный экспрессирующий вектор. Следует понимать, что такие термины предназначены для обозначения не только конкретной рассматриваемой клетки, но и потомства такой клетки. Поскольку в последующих поколениях могут присутствовать определенные модификации, в результате либо мутаций, либо воздействия внешней среды, такое потомство фактически может не являться идентичным родительской клетке, однако еще входит в объем термина «клетка-хозяин», как применяют здесь.
Термин «набор», как применяют здесь, относится к упакованному продукту или изделию, содержащему компоненты. Набор предпочтительно содержит коробку или контейнер, где содержатся компоненты набора. К коробке или контейнеру присоединяют этикетку или протокол, одобренный Управлением по контролю за продуктами питания и лекарственными средствами. Коробка или контейнер содержит компоненты по изобретению, предпочтительно содержащиеся внутри пластиковых, полиэтиленовых, полипропиленовых, этиленовых или пропиленовых флаконов. Флаконы могут представлять собой пробирки или бутылки с крышкой. Набор может включать в себя также инструкции для введения антитела против TNFα по изобретению. В одном варианте осуществления набор по изобретению содержит состав, содержащий антитело человека D2E7, как описано в PCT/IB03/04502 и U.S. Appln. № 10/222140.
Различные аспекты изобретения более подробно описаны ниже.
II. Получение антитела
Изобретение здесь относится к способам очистки антитела из смеси, содержащей антитело и один или несколько HCP. Исходная смесь, как правило, представляет собой смесь, полученную после рекомбинантного получения антитела. Альтернативно, исходная смесь может являться результатом получения антитела посредством пептидного синтеза (или другими синтетическими способами), или антитело можно очищать из природного источника антитела.
Для экспрессии антител или частей антител по изобретению ДНК, кодирующие полноразмерные или частичные легкие и тяжелые цепи, вставляют в экспрессирующие векторы, так что гены являются функционально связанными с последовательностями для контроля транскрипции и трансляции. В этом контексте термин «функционально связанный» предназначен, чтобы означать, что ген антитела лигирован в вектор таким образом, что последовательности для контроля транскрипции и трансляции внутри вектора выполняют предназначенную им функцию регуляции транскрипции и трансляции гена антитела. Экспрессирующий вектор и контролирующие экспрессию последовательности выбирают так, чтобы они являлись совместимыми с экспрессирующей клеткой-хозяином. Ген для легкой цепи антитела и ген для тяжелой цепи антитела можно вставлять в отдельные векторы, или, что более обычно, оба гена вставляют в один и тот же экспрессирующий вектор. Гены антитела вставляют в экспрессирующий вектор посредством общепринятых способов (например, посредством лигирования комплементарных участков рестрикционного расщепления в фрагменте гена антитела и в векторе, или посредством лигирования тупых концов, если не присутствуют участки рестрикционного расщепления). Перед вставкой последовательностей для легкой и тяжелой цепей, относящихся к антителу или родственных антителу, экспрессирующий вектор может уже нести последовательности для константных областей антитела. Например, один способ превращения последовательностей VH и VL из адалимумаба или родственных адалимумабу в гены полноразмерного антитела представляет собой их вставку в экспрессирующие векторы, уже кодирующие константные области тяжелой и легкой цепей соответственно, так что фрагмент VH является функционально связанным с фрагментом (фрагментами) CH в векторе, а фрагмент VL является функционально связанным с фрагментом CL в векторе. Дополнительно или альтернативно, рекомбинантный экспрессирующий вектор может кодировать сигнальный пептид, облегчающий секрецию цепи антитела из клетки-хозяина. Ген для цепи антитела можно клонировать в вектор так, чтобы связывать сигнальный пептид в рамке с N-концом гена для цепи антитела. Сигнальный пептид может представлять собой сигнальный пептид иммуноглобулина или гетерологичный сигнальный пептид (т.е. сигнальный пептид из не относящегося к иммуноглобулину белка).
Помимо генов для цепей антитела, рекомбинантные экспрессирующие векторы по изобретению содержат регуляторные последовательности, контролирующие экспрессию генов цепей антитела в клетке-хозяине. Термин «регуляторная последовательность» предназначен, чтобы включать в себя промоторы, энхансеры и другие элементы для контроля экспрессии (например, сигналы полиаденилирования), контролирующие транскрипцию или трансляцию генов для цепей антитела. Такие регуляторные последовательности описаны, например, в Goeddel; Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, CA (1990). Специалисту в данной области понятно, что дизайн экспрессирующего вектора, включающий в себя выбор регуляторных последовательностей, может зависеть от таких факторов, как выбор подлежащей трансформации клетки-хозяина, желательный уровень экспрессии белка и т.д. Предпочтительные регуляторные последовательности для экспрессии в клетках-хозяевах млекопитающих включают в себя вирусные элементы, управляющие высоким уровнем экспрессии белка в клетках млекопитающих, такие как промоторы и/или энхансеры, полученные из цитомегаловируса (CMV) (такие как промотор/энхансер CMV), вируса обезьян 40 (SV40) (такие как промотор/энхансер SV40), аденовируса (например, главный поздний промотор аденовируса (AdMLP)) и полиомы. Дополнительное описание вирусных регуляторных элементов и их последовательностей смотри, например, в патенте США № 5168062 Stinski, патенте США № 4510245 Bell et al. и патенте США № 4968615 Schaffner et al.
Помимо генов для цепей антитела и регуляторных последовательностей, рекомбинантные экспрессирующие векторы по изобретению могут содержать дополнительные последовательности, такие как последовательности, регулирующие репликацию вектора в клетках-хозяевах (например, точки начала репликации), и гены селективных маркеров. Гены селективных маркеров облегчают отбор клеток-хозяев, в которые был введен вектор (смотри, например, патенты США № 4399216, 4634665 и 5179017, все Axel et al.). Например, обычно гены селективных маркеров обеспечивают клетке-хозяину, в которую введен вектор, устойчивость к цитотоксическим лекарственным средствам, таким как G418, гигромицин или метотрексат. Предпочтительные гены селективных маркеров включают в себя ген для дигидрофолатредуктазы (DHFR) (для использования в dhfr-клетках-хозяевах с отбором/амплификацией с метотрексатом) и ген neo (для отбора с G418).
Для экспрессии легких и тяжелых цепей экспрессирующий вектор(ы), кодирующий(ие) тяжелые и легкие цепи, трансфицируют в клетку-хозяина посредством общепринятых способов. Различные формы термина «трансфекция» предназначены, чтобы включать в себя широкое множество способов, общепринятых для введения экзогенной ДНК в прокариотическую или эукариотическую клетку-хозяина, например электропорацию, кальций-фосфатную преципитацию, DEAE-декстрановую трансфекцию и т.п. Хотя теоретически является возможным экспрессировать антитела по изобретению либо в прокариотических, либо в эукариотических клетках-хозяевах, наиболее предпочтительной является экспрессия антител в эукариотических клетках и, наиболее предпочтительно, в клетках-хозяевах млекопитающих, поскольку вероятность сборки и секреции правильно свернутого иммунологически активного антитела выше в таких эукариотических клетках, и особенно в клетках млекопитающих, чем в прокариотических клетках. Опубликованы данные, что прокариотическая экспрессия генов антитела является неэффективной для получения высоких выходов активного антитела (Boss, M. A. and Wood, C. R. (1985) Immunology Today 6:12-13).
Подходящие клетки-хозяева для клонирования или экспрессии ДНК в векторах здесь представляют собой клетки прокариот, дрожжей или высших эукариот, описанные выше. Подходящие прокариоты для этой цели включают в себя эубактерии, такие как грамотрицательные или грамположительные организмы, например Enterobacteriaceae, такие как Escherichia, например E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например Salmonella typhimurium, Serratia, например Serratia marcescans, и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis (например, B. licheniformis 41P, описанный в DD 266710, опубликованном 12 апреля 1989 г.), Pseudomonas, такие как P. aeruginosa и Streptomyces. Одним из предпочтительных хозяев E. coli для клонирования является E. coli 294 (ATCC 31446), хотя пригодны другие штаммы, такие как E. coli B, E. coli X1776 (ATCC 31537) и E. coli W3110 (ATCC 27325). Эти примеры являются иллюстративными, а не ограничивающими.
В дополнение к прокариотам, эукариотические микроорганизмы, такие как мицелиальные грибы или дрожжи, являются подходящими хозяевами для клонирования или экспрессии кодирующих полипептид векторов. Saccharomyces cerevisiae, или общепринятые пекарские дрожжи, являются наиболее общеупотребительными среди микроорганизмов-хозяев - низших эукариот. Однако ряд других родов, видов и штаммов являются общедоступными и применимыми здесь, такие как Schizosaccharomyces pombe; хозяева Kluyveromyces, например такие как K. lactis, K. fragilis (ATCC 12424), K. bulgaricus (ATCC 16045), K. wickeramii (ATCC 24178), K. waltii (ATCC 56500), K. drosophilarum (ATCC 36906), K. thermotolerans и K. marxianus; yarrowia (EP 402226); Pichia pastoris (EP 183070); Candida; Trichoderraa reesia (EP 244234); Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis; и мицелиальные грибы, например, такие как хозяева Neurospora, Penicillium, Tolypocladium, и Aspergillus, такие как A. nidulans и A. niger.
Подходящие клетки-хозяева для экспрессии гликозилированных антител получены из многоклеточных организмов. Примеры клеток беспозвоночных включают в себя клетки растений и насекомых. Идентифицировано множество бакуловирусных штаммов и вариантов и соответствующих пермиссивных клеток-хозяев насекомых из таких хозяев, как Spodoptera frugiperda (гусеница), Aedes aegypti (москит), Aedes albopictus (москит), Drosophila melanogaster (плодовая мушка) и Bombyx mori. Множество штаммов вирусов для трансфекции являются широко доступными, например вариант L-1 Autographa californica NPV и штамм Bm-5 Bombyx mori NPV, и такие вирусы можно использовать здесь в качестве вирусов в соответствии с настоящим изобретением, в частности для трансфекции клеток Spodoptera frugiperda. Также в качестве хозяев можно использовать культуры клеток растений хлопка, кукурузы, картофеля, сои, петунии, томата и табака.
Предпочтительные клетки-хозяева млекопитающих для экспрессии рекомбинантных антител по изобретению включают в себя клетки яичника китайского хомяка (клетки CHO) (включая dhfr-клетки CHO, описанные в Urlaub and Chasin, (1980) PNAS USA 77:4216-4220, которые использовали вместе с DHFR-селективным маркером, например, как описано, в Kaufman and Sharp (1982) Mol. Biol. 159:601-621), клетки миеломы NS0, клетки COS и клетки SP2. При введении рекомбинантных экспрессирующих векторов, кодирующих гены антитела, в клетки-хозяева млекопитающих, антитела получают посредством культивирования клеток-хозяев в течение периода времени, достаточного для обеспечения экспрессии антитела в клетках-хозяевах, или, более предпочтительно, для секреции антитела в культуральную среду, в которой выращивают клетки-хозяева. Другими примерами применимых линий клеток-хозяев млекопитающих являются линии клеток почек мартышки CV1, трансформированных SV40 (COS-7, ATCC CRL 1651); линия клеток эмбриональной почки человека (клетки 293 или 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol. 36:59 (1977)); клетки детеныша хомяка (BHK, ATCC CCL 10); клетки яичника китайского хомяка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); клетки Sertoli мыши (TM4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почек мартышки (CV1 ATCC CCL 70); клетки почек африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки цервикальной карциномы человека (HELA, ATCC CCL 2); клетки почек собаки (MDCK, ATCC CCL 34); клетки печени крысы Буффало (BRL 3A, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); клетки опухоли молочной железы мыши (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N. Y. Acad. Sci. 383:44-68 (1982)); MRC 5 cells; FS4 cells; и линию гепатомы человека (Hep G2).
Клетки-хозяева трансформируют описанными выше векторами для экспрессии или клонирования для продукции антитела и культивируют в общепринятой питательной среде, модифицированной соответствующим образом для индукции промоторов, селекции трансформантов или амплификации генов, кодирующих желаемые последовательности.
Клетки-хозяева, используемые для продукции антитела, можно культивировать в разнообразных средах. Для культивирования клеток-хозяев пригодными являются коммерчески доступные среды, такие как среда Хэма F10 (Sigma), минимальная поддерживающая среда ((MEM), (Sigma)), RPMI-1640 (Sigma) и среда Игла, модифицированная Дульбекко, ((DMEM), Sigma). Кроме того, в качестве культуральной среды для клеток-хозяев можно использовать любую из сред, описанных в Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal Biochem. 102:255 (1980), патентах США № 4767704; 4657866; 4927762; 4560655 или 5122469; WO 90/03430; WO 87/00195; или патенте США № Re. 30985. Любые их этих сред можно дополнить при необходимости гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид натрия, кальция, магния и фосфат), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как лекарственное средство гентамицин), микроэлементами (определяемыми как неорганические соединения, обычно представленные в конечных концентрациях микромолярного диапазона) и глюкозой или эквивалентным источником энергии. Также можно добавлять любые другие необходимые добавки в соответствующих концентрациях, которые известны специалистам в данной области. Условия культивирования, такие как температура, pH и тому подобные, представляют собой условия, которые ранее использовали для выбранных для экспрессии клеток-хозяев, и они будут очевидными среднему специалисту в данной области.
Клетки-хозяева можно использовать также для получения частей интактных антител, таких как Fab-фрагменты или scFv-молекулы. Понятно, что варианты описанного выше способа включены в объем настоящего изобретения. Например, может являться желательным трансфицировать клетку-хозяина ДНК, кодирующей либо легкую цепь, либо тяжелую цепь (но не обе) антитела по этому изобретению. Способ рекомбинантной ДНК можно также использовать для удаления некоторых или всех ДНК, кодирующих любую или обе из легких и тяжелых цепей, которые не являются необходимыми для связывания hTNFα. Молекулы, экспрессируемые с таких усеченных молекул ДНК, также включены в антитела по изобретению. Кроме того, является возможным получить бифункциональные антитела, в которых одна тяжелая цепь и одна легкая цепь представляют собой антитело по изобретению, а другая тяжелая цепь и другая легкая цепь обладают специфичностью к антигену, отличному от hTNFα, посредством перекрестного связывания антитела по изобретению со вторым антителом посредством общепринятых способов химического перекрестного сшивания.
В предпочтительной системе для рекомбинантной экспрессии антитела по изобретению или его антигенсвязывающей части рекомбинантный экспрессирующий вектор, кодирующий как тяжелую цепь антитела, так и легкую цепь антитела, вводят в клетки dhfr- CHO посредством трансфекции, опосредованной фосфатом кальция. В рекомбинантном экспрессирующем векторе гены для тяжелых и легких цепей антитела в каждом случае являются функционально связанными с регуляторными элементами CMV энхансер/AdMLP-промотор, чтобы обеспечивать высокие уровни транскрипции генов. Рекомбинантный экспрессирующий вектор несет также ген DHFR, который позволяет отбор клеток CHO, трансфицированных вектором, с использованием селекции/амплификации с метотрексатом. Отобранные трансформированные клетки-хозяева культивируют, чтобы обеспечить экспрессию тяжелых и легких цепей антитела, и интактное антитело выделяют из культуральной среды. Общепринятые молекулярно-биологические способы используют для получения рекомбинантного экспрессирующего вектора, трансфекции клеток-хозяев, отбора трансформантов, культивирования указанных клеток-хозяев и выделения антитела из культуральной среды.
Рекомбинантные антитела человека по изобретению, включая адалимумаб или его антигенсвязывающую часть, или родственные адалимумабу антитела, описанные здесь, можно выделять посредством скрининга рекомбинантной комбинаторной библиотеки антител, предпочтительно, библиотеки фагового дисплея scFv, полученной с использованием кДНК для VL и VH человека, полученной с мРНК, полученной из лимфоцитов человека. Способы для получения и скрининга таких библиотек известны в данной области. В дополнение к коммерчески доступным наборам для получения библиотек фагового дисплея (например, фаговая система рекомбинантных антител от Pharmacia, каталожный № 27-9400-01; и набор для фагового дисплея SurfZAP™ от Stratagene, каталожный № 240612), примеры способов и реагентов, в частности, пригодных для применения для получения и скрининга библиотек дисплея антител можно найти, например, в Ladner et al. Патент США № 5223409; Kang et al. Публикация PCT № WO 92/18619; Dower et al. Публикация PCT № WO 91/17271; Winter et al. Публикация PCT № WO 92/20791; Markland et al. Публикация PCT № WO 92/15679; Breitling et al. Публикация PCT № WO 93/01288; McCafferty et al. Публикация PCT № WO 92/01047; Garrard et al. Публикация PCT № WO 92/09690; Fuchs et al. (1991) Bio/Technology 9:1370-1372; Hay et al. (1992) Hum Antibod Hybridomas 3:81-85; Huse et al. (1989) Science 246:1275-1281.; McCafferty et al., Nature (1990) 348:552-554; Griffiths et al. (1993) EMBO J 12:725-734; Hawkins et al (1992) J Mol Biol 226:889-896; Clackson et al. (1991) Nature 352:624-628; Gram et al. (1992) PNAS 89:3576-3580; Garrard et al. (1991) Bio/Technology 9:1373-1377; Hoogenboom et al. (1991) Nuc Acid Res 19:4133-4137; и Barbas et al (1991) PNAS 88:7978-7982.
При использовании рекомбинантных способов антитело можно продуцировать внутри клеток, в периплазматическом пространстве, или напрямую секретировать в среду. Если антитело продуцируют внутри клеток, в качестве первой стадии, обломки частиц, либо клеток-хозяев, либо лизированных клеток (например, в результате гомогенизации), удаляют, например, посредством центрифугирования или ультрафильтрации. Когда антитело секретируют в среду, супернатанты из таких экспрессирующих систем, как правило, сначала концентрируют с использованием коммерчески доступного фильтра для концентрирования белка, например устройства для ультрафильтрации от Amicon или Millipore Pellicon.
Перед способом по изобретению способы для очистки антител от обломков клеток в первую очередь зависят от места экспрессии антитела. Такие антитела можно заставлять секретироваться напрямую из клетки в окружающую среду для роста; другие получают внутри клеток. В случае последних антител первая стадия способа очистки включает в себя лизис клетки, который можно осуществлять множеством способов, включая механическое разрезание, осмотический шок или ферментативные обработки. Таким разрушением высвобождают полностью содержимое клетки в гомогенат и, кроме того, получают субклеточные фрагменты, которые трудно удалить из-за их небольшого размера. Как правило, их удаляют посредством дифференциального центрифугирования или фильтрации. Когда антитело секретировано в среду, супернатанты из таких экспрессирующих систем, как правило, сначала концентрируют с использованием коммерчески доступного фильтра для концентрирования белка, например устройства для ультрафильтрации от Amicon или Millipore Pellicon. Когда антитело секретировано в среду, рекомбинантные клетки-хозяева можно также отделить от среды для культивирования клеток, например, посредством проточной фильтрации вдоль потока. Антитела можно далее выделять из культуральной среды с использованием способов очистки антитела по изобретению.
В одном варианте осуществления способ по изобретению включает в себя антитела человека или их антигенсвязывающие части, которые связываются с TNFα человека с высокой аффинностью и низкой скоростью диссоциации и обладают высокой нейтрализующей способностью. Предпочтительно, антитела человека представляют собой рекомбинантные нейтрализующие антитела против hTNFα человека. Наиболее предпочтительное рекомбинантное нейтрализующее антитело, применяемое в способах по изобретению, обозначено здесь как адалимумаб, Humira® и D2E7 (аминокислотная последовательность области VL D2E7 показана на SEQ ID NO:1; аминокислотная последовательность области VH D2E7 показана на SEQ ED NO: 2). Свойства D2E7 (адалимумаб; Humira®) описаны в Salfeld et al., патентах США № 6090382, 6258562 и 6509015, содержание каждого из которых приведено здесь в качестве ссылки. Другие примеры антител против TNFα включают в себя химерные и гуманизированные антитела мыши против hTNFα, которые подвергали клиническому тестированию для лечения ревматоидного артрита (смотри, например, Elliott et al. (1994) Lancet 344:1125-1127; Elliot et al. (1994) Lancet 344:1105-1110; Rankin et al. (1995) Br. J. Rheumatol. 34:334-342). В другом варианте осуществления антитело против TNFα, применяемое по изобретению, представляет собой инфликсимаб (Remicade®, Johnson and Johnson; описанное в патенте США № 5656272, приведенном здесь в качестве ссылки), CDP571 (гуманизированное моноклональное антитело IgG4 против TNF-альфа), CDP 870 (фрагмент гуманизированного моноклонального антитела против TNF-альфа), анти-TNF dAb (Peptech) и CNTO 148 (голимумаб; Medarex and Centocor, смотри также WO 02/12502).
В одном варианте осуществления способы по изобретению включают в себя антитела и части антитела адалимумаб, родственные адалимумабу антитела и части антител, и другие антитела и части антител человека со свойствами, эквивалентными свойствам адалимумаба, такими как высокоаффинное связывание с hTNFα с низкими показателями кинетики диссоциации и высокой нейтрализующей способностью. В одном варианте осуществления изобретение относится к лечению с помощью выделенного антитела человека или его антигенсвязывающей части, которая диссоциирует от TNFα человека с Kd 1×10-8 M или менее и константой скорости Koff 1×10-3 сек-1 или менее, обе определены посредством поверхностного плазмонного резонанса, и нейтрализует цитотоксичность TNFα человека в общепринятом анализе in vitro L929 c IC50 1×10-7 M или менее. Более предпочтительно, выделенное антитело человека или его антигенсвязывающая часть диссоциирует от TNFα человека с Koff 5×10-4 сек-1 или менее; или даже более предпочтительно, с Koff 1×10-4 сек-1 или менее. Более предпочтительно, выделенное антитело человека или его антигенсвязывающая часть нейтрализует цитотоксичность TNFα человека в общепринятом анализе in vitro L929 с IC50 1×10-8 M или менее, даже более предпочтительно, с IC50 1×10-9 M или менее и еще более предпочтительно, с IC50 1×10-10 M или менее. В предпочтительном варианте осуществления антитело представляет собой выделенное рекомбинантное антитело человека или его антигенсвязывающую часть.
В данной области хорошо известно, что домены CDR3 тяжелой и легкой цепи антитела играют важную роль в специфичности/аффинности связывания антитела с антигеном. Соответственно, в другом аспекте изобретение относится к способам лечения ревматоидного артрита посредством введения антител человека, полученных с использованием способов по изобретению, где антитела обладают медленной кинетикой диссоциации для связывания с hTNFα и обладают доменами CDR3 легкой и тяжелой цепей, которые являются структурно идентичными доменам адалимумаба или родственными им. Положение 9 CDR3 VL адалимумаба может быть занято Ala или Thr без существенного влияния на Koff. Соответственно, консенсусный мотив для CDR3 VL адалимумаба содержит аминокислотную последовательность: Q-R-Y-N-R-A-P-Y-(T/A) (SEQ ID NO:3). Кроме того, положение 12 CDR3 VH адалимумаба может быть занято Tyr или Asn без существенного влияния на Koff. Соответственно, консенсусный мотив для CDR3 VH адалимумаба содержит аминокислотную последовательность: V-S-Y-L-S-T-A-S-S-L-D-(Y/N) (SEQ ID NO:4). Более того, как показано в примере 2 из патента США № 6090382, в домен CDR3 тяжелой и легкой цепей адалимумаба можно вводить замену на одиночный остаток аланина (в положениях 1, 4, 5, 7 или 8 внутри CDR3 VL или в положениях 2, 3, 4, 5, 6, 8, 9, 10 или 11 внутри CDR3 VH) без существенного влияния на Koff. Кроме того, опытный специалист в данной области будет признавать, что при условии того, что в домены CDR3 VL и VH адалимумаба можно вводить замены на аланин, может являться возможной замена других аминокислот в доменах CDR3, в то время как еще сохраняется низкая константа диссоциации антитела, в частности замены на консервативные аминокислоты. Предпочтительно, не более чем от одной до пяти консервативных аминокислотных замен выполняют в доменах CDR3 VL и/или VH адалимумаба. Более предпочтительно, не более чем от одной до трех консервативных аминокислотных замен выполняют в доменах CDR3 VL и/или VH адалимумаба. Кроме того, не следует выполнять консервативные аминокислотные замены в положениях аминокислот, критических для связывания с hTNFα. Положения 2 и 5 CDR3 VL адалимумаба и положения 1 и 7 CDR3 VH адалимумаба, по-видимому, являются критическими для взаимодействия с hTNFα и, таким образом консервативные аминокислотные замены предпочтительно не выполняют в этих положениях (хотя замена на аланин в положении 5 CDR3 VL адалимумаба является приемлемой, как описано выше) (смотри патент США № 6090382).
Соответственно, в другом варианте осуществления антитело или его антигенсвязывающая часть предпочтительно обладает следующими характеристиками:
a) диссоциирует от TNFα с константой скорости Koff 1×10-3 сек-1 или менее, как определено посредством поверхностного плазмонного резонанса;
b) обладает доменом CDR3 легкой цепи, содержащим аминокислотную последовательность SEQ ID NO:3, или модифицированную из SEQ ID NO:3 посредством одиночной замены на аланин в положениях 1, 4, 5, 7 или 8, или посредством от одной до пяти консервативных аминокислотных замен в положениях 1, 3, 4, 6, 7, 8 и/или 9;
c) обладает доменом CDR3 тяжелой цепи, содержащим аминокислотную последовательность SEQ ID NO:4, или модифицированную из SEQ ID NO:4 посредством одиночной замены на аланин в положениях 2, 3, 4, 5, 6, 8, 9, 10 или 11 или посредством от одной до пяти консервативных аминокислотных замен в положениях 2, 3, 4, 5, 6, 8, 9, 10, 11 и/или 12.
Более предпочтительно, антитело или его антигенсвязывающая часть диссоциирует от TNFα человека с Koff 5×10-4 сек-1 или менее. Даже более предпочтительно, антитело или его антигенсвязывающая часть диссоциирует от TNFα человека с Koff 1×10-4 сек-1 или менее.
В другом варианте осуществления антитело или его антигенсвязывающая часть предпочтительно содержит вариабельную область легкой цепи (LCVR), обладающую доменом CDR3, содержащим аминокислотную последовательность SEQ ID NO:3, или модифицированную из SEQ ID NO:3 посредством одиночной замены на аланин в положениях 1, 4, 5, 7 или 8, и вариабельную область тяжелой цепи (HCVR), обладающую доменом CDR3, содержащим аминокислотную последовательность SEQ ID NO:4, или модифицированную из SEQ ID NO:4 посредством одиночной замены на аланин в положениях 2, 3, 4, 5, 6, 8, 9, 10 или 11. Предпочтительно, LCVR дополнительно обладает доменом CDR2, содержащим аминокислотную последовательность SEQ ID NO:5 (т.е. CDR2 VL адалимумаба), и HCVR дополнительно обладает доменом CDR2, содержащим аминокислотную последовательность SEQ ID NO:6 (т.е. CDR2 VH адалимумаба). Даже более предпочтительно, LCVR дополнительно обладает доменом CDR1, содержащим аминокислотную последовательность SEQ ID NO:7 (т.е. CDR1 VL адалимумаба), и HCVR обладает доменом CDR1, содержащим аминокислотную последовательность SEQ ID NO:8 (т.е. CDR1 VH адалимумаба). Каркасные области для VL предпочтительно происходят из семейства зародышевых VKI человека, более предпочтительно, из зародышевого гена Vk A20 человека, и наиболее предпочтительно, из каркасных последовательностей VL адалимумаба, показанных на фиг.1A и 1B из патента США № 6090382. Каркасные области для VH предпочтительно происходят из семейства зародышевых VH3 человека, более предпочтительно, из зародышевого гена VH DP-31 человека и, наиболее предпочтительно, из каркасных последовательностей VH адалимумаба, показанных на фиг.2A и 2B из патента США № 6090382.
Соответственно, в другом варианте осуществления антитело или его антигенсвязывающая часть предпочтительно содержит вариабельную область легкой цепи (LCVR), содержащую аминокислотную последовательность SEQ ID NO:1 (т.е., VL адалимумаба), и вариабельную область тяжелой цепи (HCVR), содержащую аминокислотную последовательность SEQ ID NO:2 (т.е. VH адалимумаба). В конкретных вариантах осуществления антитело содержит константную область тяжелой цепи, такую как константная область IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD. Предпочтительно, константная область тяжелой цепи представляет собой константную область тяжелой цепи IgG1 или константную область тяжелой цепи IgG4. Кроме того, антитело может содержать константную область легкой цепи, либо константную область легкой цепи каппа, либо константную область легкой цепи лямбда. Предпочтительно, антитело содержит константную область легкой цепи каппа. Альтернативно, часть антитела может представлять собой, например, Fab-фрагмент или одноцепочечный Fv-фрагмент.
В других вариантах осуществления антитело или его антигенсвязывающая часть предпочтительно содержит родственные адалимумабу домены VL и VH CDR3, например антитела или их антигенсвязывающие части с вариабельной областью легкой цепи (LCVR), обладающей доменом CDR3, содержащим аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:3, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25 и SEQ ID NO:26, или с вариабельной областью тяжелой цепи (HCVR), обладающей доменом CDR3, содержащим аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:4, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29, SEQ ID NO:30, SEQ ID NO:31, SEQ ID NO:32, SEQ ID NO:33, SEQ ID NO:34 и SEQ ID NO:35.
Антитело против TNFα, применяемое по изобретению, можно модифицировать. В некоторых вариантах осуществления антитело против TNFα или его антигенсвязывающие фрагменты химически модифицируют для обеспечения желаемого эффекта. Например, можно выполнять пегилирование антител и фрагментов антител по изобретению посредством любой из реакций пегилирования, известных в данной области, как описано, например, в следующих ссылках: Focus on Growth Factors 3:4-10 (1992); EP 0154316; и
EP 0401384 (полное содержание каждого из которых приведено здесь в качестве ссылки). Предпочтительно, пегилирование выполняют посредством реакции ацилирования или реакции алкилирования с реакционноспособной молекулой полиэтиленгликоля (или аналогичного реакционноспособного водорастворимого полимера). Предпочтительным водорастворимым полимером для пегилирования антител и фрагментов антитела по изобретению является полиэтиленгликоль (PEG). Как применяют здесь, подразумевают, что «полиэтиленгликоль» включает в себя любую из форм PEG, которые использовали для дериватизации других белков, такую как моно (C1-C10)алкокси- или арилокси-полиэтиленгликоль.
Способы получения пегилированных антител и фрагментов антитела по изобретению, как правило, будут включать в себя стадии (a) реакции антитела или фрагмента антитела с полиэтиленгликолем, таким как реакционноспособное эфирное или альдегидное производное PEG, в условиях, при которых антитело или фрагмент антитела становится присоединенным к одной или нескольким группам PEG, и (b) получения продуктов реакции. Рядовым специалистам в данной области будет очевиден выбор оптимальных условий реакции или реакций ацилирования на основании известных параметров и желаемого результата.
Пегилированные антитела и фрагменты антител, как правило, можно использовать для лечения связанных с TNFα нарушений по изобретению посредством введения антител и фрагментов антитела против TNFα, описанных здесь. Как правило, пегилированные антитела и фрагменты антител обладают увеличенным временем полужизни по сравнению с не пегилированными антителами и фрагментами антител. Пегилированные антитела и фрагменты антител можно применять по отдельности, вместе или в сочетании с другими фармацевтическими композициями.
В другом варианте осуществления изобретения антитела против TNFα или их фрагменты можно изменять, когда константную область антитела модифицируют для уменьшения, по меньшей мере, одной опосредуемой константной областью биологической эффекторной функции по сравнению с немодифицированным антителом. Чтобы модифицировать антитело по изобретению так, чтобы оно обладало уменьшенным связыванием с Fc-рецептором, в фрагмент константной области иммуноглобулина антитела можно вводить мутации в конкретных областях, необходимых для взаимодействий с Fc-рецептором (FcR) (смотри, например, Canfield and Morrison (1991) J. Exp. Med. 173:1483-1491; и Lund et al. (1991) J. of Immunol 147:2657-2662). Снижение способности антитела связывать FcR также может снижать другие эффекторные функции, которые основаны на взаимодействиях с FcR, такие как опсонизация, фагоцитоз и антигензависимая клеточная цитотоксичность.
Антитело или часть антитела по изобретению можно дериватизировать или присоединять к другой функциональной молекуле (например, другому пептиду или белку). Соответственно, антитела и части антител по изобретению предназначены, чтобы включать в себя дериватизированные и другим способом модифицированные формы антител человека против hTNFα, описанных здесь, включая молекулы иммуноадгезии. Например, антитело или часть антитела по изобретению можно функционально связывать (посредством химического присоединения, слияния генов, нековалентного связывания или иным образом) с одной или несколькими другими молекулами, такими как другое антитело (например, биспецифическое антитело или диатело), поддающееся детекции средство, цитотоксическое средство, фармацевтическое средство и/или белок или пептид, который может опосредовать связывание антитела или части антитела с другой молекулой (такой как коровая область стрептавидина или полигистидиновая метка).
Один тип дериватизированного антитела получают посредством перекрестного сшивания двух или более антител (одинакового типа или различных типов, например, для получения биспецифических антител). Подходящие перекрестно сшивающие агенты включают в себя агенты, которые являются гетеробифункциональными, обладающими двумя различными реакционноспособными группами, разделенными подходящим спейсером (например, m-малеимидобензоил-N-гидроксисукцинимидный эфир), или гомобифункциональными (например, дисукцинимидилсуберат). Такие линкеры доступны из Pierce Chemical Company, Rockford, IL.
Применимые подлежащие детекции средства, с помощью которых можно дериватизировать антитело или фрагмент антитела по изобретению, включают в себя флуоресцентные соединения. Примеры подлежащих детекции флуоресцентных средств включают в себя флуоресцеин, изотиоцианат флуоресцеина, родамин, хлорид 5-диметиламин-1-нафталинсульфонила, фикоэритрин и т.п. Антитело можно дериватизировать также подлежащими детекции ферментами, такими как щелочная фосфатаза, пероксидаза хрена, оксидаза глюкозы и т.п. Когда антитело дериватизируют подлежащим детекции ферментом, его выявляют добавлением дополнительных реагентов, которые фермент использует для образования подлежащего детекции продукта реакции. Например, когда присутствует подлежащее детекции средство пероксидаза хрена, добавление перекиси водорода и диаминобензидина приводит к образованию окрашенного продукта реакции, который можно детектировать. Антитело можно также дериватизировать биотином и детектировать посредством непрямого измерения связывания авидина или стрептавидина.
Антитело или часть антитела по изобретению можно получать посредством рекомбинантной экспрессии генов легких и тяжелых цепей иммуноглобулина в клетке-хозяине. Для рекомбинантной экспрессии антитела клетку-хозяина трансфицируют одним или несколькими рекомбинантными экспрессирующими векторами, несущими фрагменты ДНК, кодирующие легкие и тяжелые иммуноглобулиновые цепи указанного антитела, таким образом экспрессируя легкие и тяжелые цепи в клетке-хозяине и, предпочтительно, секретируя их в среду, в которой культивируют указанные клетки-хозяева, из этой среды можно выделять антитела. Чтобы получить гены для тяжелой и легкой цепей антитела, вставить эти гены в рекомбинантные экспрессирующие векторы и ввести векторы в клетки-хозяева, используют общепринятые способы рекомбинантной ДНК, такие как способы, описанные в Sambrook, Fritsch and Maniatis (eds.), Molecular Cloning; A Laboratory Manual, Second Edition, Cold Spring Harbor, N. Y., (1989), Ausubel, F.M. et al. (eds.) Current Protocols in Molecular Biology, Greene Publishing Associates, (1989) и в патенте США 4816397 Boss et al.
Для экспрессии адалимумаба или родственного адалимумабу антитела сначала получают фрагменты ДНК, кодирующие вариабельные области легкой и тяжелой цепей. Эти ДНК можно получить посредством амплификации и модификации последовательностей легкой и тяжелой цепей зародышевой линии с использованием полимеразной цепной реакции (ПЦР). Последовательности ДНК зародышевой линии генов вариабельных областей тяжелой и легкой цепей человека известны в данной области (см., например, базу данных последовательностей зародышевой линии человека «Vbase»; см. также Kabat Е.А. et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No 91-3242; Tomlinson I.M. et al. (1992) "The Repertoire of Human Germline VH Sequences Reveals about Fifty Groups of VH Segments with Different Hypervariable Loops" J. Mol. Biol. 227:776-798; и Cox J.P.L et al. (1994) "A Directory of Human Germ-line V78 Segments Reveals a Strong Bias in their Usage" Eur. J. Immunol. 24:827-836; содержание каждого из которых специально приведено здесь в качестве ссылки). Для получения фрагмента ДНК, кодирующего вариабельную область тяжелой цепи адалимумаба или родственного адалимумабу антитела, член семейства VH3 генов VH зародышевой линии человека амплифицируют с помощью общепринятой ПЦР. Наиболее предпочтительно, амплифицируют последовательности зародышевой линии VH DP-31. Для получения фрагмента ДНК, кодирующего вариабельную область легкой цепи адалимумаба или родственного адалимумабу антитела, член семейства VκI генов VL зародышевой линии человека амплифицируют посредством общепринятой ПЦР. Наиболее предпочтительно, амплифицируют последовательности зародышевой линии VL A20. Праймеры для ПЦР, пригодные для использования при амплификации последовательностей зародышевой линии VH DP-31 и зародышевой линии VL A20, можно сконструировать на основе нуклеотидных последовательностей, описанных в ссылках, цитированных выше, с использованием общепринятых способов.
После получения фрагментов VH и VL зародышевой линии эти последовательности можно подвергать мутагенезу, чтобы они кодировали описанные здесь аминокислотные последовательности адалимумаба или родственные адалимумабу. Аминокислотные последовательности, кодируемые последовательностями ДНК VH и VL зародышевых линий, сначала сравнивают с аминокислотными последовательностями VH и VL адалимумаба или родственными адалимумабу для идентификации остатков аминокислот в последовательности адалимумаба или родственной адалимумабу, которые отличаются от зародышевой линии. Затем соответствующие нуклеотиды последовательностей ДНК зародышевой линии подвергают мутагенезу таким образом, что мутантная последовательность зародышевой линии кодирует аминокислотную последовательность адалимумаба или родственную адалимумабу, используя при этом генетический код для определения, какие изменения нуклеотидов следует выполнить. Мутагенез последовательностей зародышевой линии выполняют общепринятыми способами, такими как опосредованный ПЦР мутагенез (при котором мутантные нуклеотиды включают в праймеры для ПЦР таким образом, что продукт ПЦР содержит мутации) или сайт-направленный мутагенез.
После получения фрагментов ДНК, кодирующих фрагменты VH и VL адалимумаба или родственных адалимумабу интересующего антитела (посредством амплификации и мутагенеза зародышевых генов VH и VL, как описано выше), с этими фрагментами ДНК можно дополнительно манипулировать с использованием общепринятых способов рекомбинантной ДНК, например, чтобы превратить гены для вариабельных областей в гены для полноразмерных цепей антитела, в гены для Fab-фрагментов или в ген scFv. При этих манипуляциях фрагмент ДНК, кодирующий VL или VH, функционально связывают с другим фрагментом ДНК, кодирующим другой белок, например константную область антитела или гибкий линкер. Термин «функционально связанный», как применяют в этом контексте, предназначен для обозначения, что два фрагмента ДНК связаны таким образом, что аминокислотные последовательности, кодируемые двумя фрагментами ДНК, остаются в рамке.
Выделенную ДНК, кодирующую область VH, можно превратить в ген для полноразмерной тяжелой цепи посредством функционального связывания VH-кодирующей ДНК, с другой молекулой ДНК, кодирующей константные области тяжелой цепи (CH1, CH2 и CH3). Последовательности генов константной области тяжелой цепи человека известны в данной области (смотри, например, Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication № 91-3242), и фрагменты ДНК, перекрывающие эти области, можно получить посредством общепринятой амплификации ПЦР. Константная область тяжелой цепи может представлять собой константную область из IgG1, IgG2, IgG3, IgG4, IgM, IgA, IgE или IgD, но более предпочтительной является константная область IgG1 или IgG4. В случае гена для Fab-фрагмента тяжелой цепи VH-кодирующую ДНК можно функционально связывать с другой молекулой ДНК, кодирующей только константную область CH1 тяжелой цепи.
Выделенную ДНК, кодирующую область VL, можно превратить в ген для полноразмерной легкой цепи (так же, как в ген для Fab легкой цепи) посредством функционального связывания VL-кодирующей ДНК с другой молекулой ДНК, кодирующей константную область CL легкой цепи. Последовательности генов константной области легкой цепи человека известны в данной области (смотри Kabat, E.A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication № 91-3242), и фрагменты ДНК, перекрывающие эти области, можно получить посредством общепринятой амплификации ПЦР. Константная область легкой цепи может представлять собой константную область каппа или лямбда, но наиболее предпочтительной является константная область каппа.
Для получения гена scFv VH- и VL-кодирующие фрагменты ДНК функционально связывают с другим фрагментом, кодирующим гибкий линкер, например кодирующим аминокислотную последовательность (Gly4-Ser)3 так, что последовательности VH и VL можно экспрессировать как непрерывный одноцепочечный белок, где области VL и VH связаны друг с другом посредством гибкого линкера (смотри, например, Bird et al. (1988) Science 242:423-426; Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883; McCafferty et al., Nature (1990) 348:552-554).
Чтобы экспрессировать антитела или части антител по изобретению, ДНК, кодирующие частичные или полноразмерные легкие и тяжелые цепи, полученные, как описано выше, встраивают в экспрессирующие векторы так, что гены являются функционально связанными с последовательностями для контроля транскрипции и трансляции. В этом контексте термин «функционально связанный» предназначен, чтобы означать, что ген антитела лигирован в вектор таким образом, что последовательности для контроля транскрипции и трансляции внутри вектора выполняют предназначенную им функцию регуляции транскрипции и трансляции гена антитела. Экспрессирующий вектор и контролирующие экспрессию последовательности выбирают так, чтобы они являлись совместимыми с используемой клеткой-хозяином. Ген для легкой цепи антитела и ген для тяжелой цепи антитела можно вставлять в отдельные векторы, или, что более обычно, оба гена вставляют в один и тот же экспрессирующий вектор. Гены антитела вставляют в экспрессирующий вектор посредством общепринятых способов (например, посредством лигирования комплементарных участков рестрикционного расщепления в фрагменте гена антитела и в векторе, или посредством лигирования тупых концов, если не присутствуют участки рестрикционного расщепления). Перед вставкой последовательностей для легкой и тяжелой цепей адалимумаба или родственных адалимумабу, экспрессирующий вектор может уже нести последовательности для константных областей антитела. Например, один способ превращения последовательностей VH и VL из адалимумаба или родственных адалимумабу в гены полноразмерного антитела представляет собой их вставку в экспрессирующие векторы, уже кодирующие константные области тяжелой и легкой цепи, соответственно, так что фрагмент VH является функционально связанным с фрагментом (фрагментами) CH в векторе, а фрагмент VL является функционально связанным с фрагментом CL в векторе. Дополнительно или альтернативно, рекомбинантный экспрессирующий вектор может кодировать сигнальный пептид, облегчающий секрецию цепи антитела из клетки-хозяина. Ген для цепи антитела можно клонировать в вектор так, чтобы связывать сигнальный пептид в рамке с N-концом гена для цепи антитела. Сигнальный пептид может представлять собой сигнальный пептид иммуноглобулина или гетерологичный сигнальный пептид (т.е. сигнальный пептид из не относящегося к иммуноглобулину белка).
Помимо генов для цепей антитела, рекомбинантные экспрессирующие векторы по изобретению содержат регуляторные последовательности, контролирующие экспрессию генов цепей антитела в клетке-хозяине. Термин «регуляторная последовательность» предназначен, чтобы включать в себя промоторы, энхансеры и другие элементы для контроля экспрессии (например, сигналы полиаденилирования), контролирующие транскрипцию или трансляцию генов для цепей антитела. Такие регуляторные последовательности описаны, например, в Goeddel; Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, CA (1990). Специалисту в данной области понятно, что дизайн экспрессирующего вектора, включающий в себя выбор регуляторных последовательностей, может зависеть от таких факторов, как выбор подлежащей трансформации клетки-хозяина, желательный уровень экспрессии белка и т.д. Предпочтительные регуляторные последовательности для экспрессии в клетках-хозяевах млекопитающих включают в себя вирусные элементы, управляющие высоким уровнем экспрессии белка в клетках млекопитающих, такие как промоторы и/или энхансеры, полученные из цитомегаловируса (CMV) (такие как промотор/энхансер CMV), вируса обезьян 40 (SV40) (такие как промотор/энхансер SV40), аденовируса (например, главный поздний промотор аденовируса (AdMLP)) и полиомы. Дополнительное описание вирусных регуляторных элементов и их последовательностей смотри, например, в патенте США № 5168062 Stinski, патенте США № 4510245 Bell et al. и патенте США № 4968615 Schaffner et al.
Помимо генов для цепей антитела и регуляторных последовательностей рекомбинантные экспрессирующие векторы по изобретению могут содержать дополнительные последовательности, такие как последовательности, регулирующие репликацию вектора в клетках-хозяевах (например, точки начала репликации), и гены селективных маркеров. Гены селективных маркеров облегчают отбор клеток-хозяев, в которые был введен вектор (смотри, например, патенты США № 4399216, 4634665 и 5179017, все Axel et al.). Например, обычно гены селективных маркеров обеспечивают клетке-хозяину, в которую введен вектор, устойчивость к цитотоксическим лекарственным средствам, таким как G418, гигромицин или метотрексат. Предпочтительные гены селективных маркеров включают в себя ген для дигидрофолатредуктазы (DHFR) (для использования в dhfr-клетках-хозяевах с отбором/амплификацией с метотрексатом) и ген neo (для отбора с G418).
Для экспрессии легких и тяжелых цепей экспрессирующий(ие) вектор(ы), кодирующие тяжелые и легкие цепи, трансфицируют в клетку-хозяина посредством общепринятых способов. Различные формы термина «трансфекция» предназначены, чтобы включать в себя широкое множество способов, общепринятых для введения экзогенной ДНК в прокариотическую или эукариотическую клетку-хозяина, например электропорацию, кальций-фосфатную преципитацию, DEAE-декстрановую трансфекцию и т.п. Хотя теоретически является возможным экспрессировать антитела по изобретению либо в прокариотических, либо в эукариотических клетках-хозяевах, наиболее предпочтительной является экспрессия антител в эукариотических клетках и, наиболее предпочтительно, в клетках-хозяевах млекопитающих, поскольку вероятность сборки и секреции правильно свернутого иммунологически активного антитела выше в таких эукариотических клетках, и особенно в клетках млекопитающих, чем в прокариотических клетках. Опубликованы данные, что прокариотическая экспрессия генов антитела является неэффективной для получения высоких выходов активного антитела (Boss, M. A. and Wood, C. R. (1985) Immunology Today 6:12-13).
Предпочтительные клетки-хозяева млекопитающих для экспрессии рекомбинантных антител по изобретению включают в себя клетки яичника китайского хомяка (клетки CHO) (включая dhfr-клетки CHO, описанные в Urlaub and Chasin, (1980) Proc. Natl. Acad. Sci. USA 77:4216-4220, которые использовали вместе с DHFR-селективным маркером, как описано, например, в Kaufman and Sharp (1982) Mol. Biol. 159:601-621), клетки миеломы NS0, клетки COS и клетки SP2. При введении рекомбинантных экспрессирующих векторов, кодирующих гены антитела, в клетки-хозяева млекопитающих, антитела получают посредством культивирования клеток-хозяев в течение периода времени, достаточного для обеспечения экспрессии антитела в клетках-хозяевах, или, более предпочтительно, для секреции антитела в культуральную среду, в которой выращивают клетки-хозяева. Антитела можно выделять из культуральной среды с использованием способов очистки белка.
Клетки-хозяева можно использовать также для получения частей интактных антител, таких как Fab-фрагменты или scFv-молекулы. Понятно, что варианты описанного выше способа включены в объем настоящего изобретения. Например, может являться желательным трансфицировать клетку-хозяина ДНК, кодирующей либо легкую цепь, либо тяжелую цепь (но не обе) антитела по этому изобретению. Способ рекомбинантной ДНК можно также использовать для удаления некоторых или всех ДНК, кодирующих любую или обе из легких и тяжелых цепей, которые не являются необходимыми для связывания hTNFα. Молекулы, экспрессируемые с таких усеченных молекул ДНК, также включены в антитела по изобретению. Кроме того, является возможным получить бифункциональные антитела, в которых одна тяжелая цепь и одна легкая цепь представляют собой антитело по изобретению, а другая тяжелая цепь и другая легкая цепь обладают специфичностью к антигену, отличному от hTNFα, посредством перекрестного связывания антитела по изобретению с вторым антителом посредством общепринятых способов химического перекрестного сшивания.
В предпочтительной системе для рекомбинантной экспрессии антитела по изобретению или его антигенсвязывающей части рекомбинантный экспрессирующий вектор, кодирующий как тяжелую цепь антитела, так и легкую цепь антитела, вводят в клетки dhfr-CHO посредством трансфекции, опосредованной фосфатом кальция. В рекомбинантном экспрессирующем векторе гены для тяжелых и легких цепей антитела в каждом случае являются функционально связанными с регуляторными элементами CMV энхансер/AdMLP-промотор, чтобы обеспечивать высокие уровни транскрипции генов. Рекомбинантный экспрессирующий вектор несет также ген DHFR, который позволяет отбор клеток CHO, трансфицированных вектором, с использованием селекции/амплификации с метотрексатом. Отобранные трансформированные клетки-хозяева культивируют, чтобы обеспечить экспрессию тяжелых и легких цепей антитела, и интактное антитело выделяют из культуральной среды. Общепринятые молекулярно-биологические способы используют для получения рекомбинантного экспрессирующего вектора, трансфекции клеток-хозяев, отбора трансформантов, культивирования указанных клеток-хозяев и выделения антитела из культуральной среды.
Рекомбинантные антитела человека по изобретению, помимо адалимумаба или его антигенсвязывающей части или родственных адалимумабу антител, описанных здесь, можно выделять посредством скрининга рекомбинантной комбинаторной библиотеки антител, предпочтительно, библиотеки фагового дисплея scFv, полученной с использованием кДНК для VL и VH человека, полученной с мРНК, полученной из лимфоцитов человека. Способы для получения и скрининга таких библиотек известны в данной области. В дополнение к коммерчески доступным наборам для получения библиотек фагового дисплея (например, фаговая система рекомбинантных антител от Pharmacia, каталожный № 27-9400-01; и набор для фагового дисплея SurfZAP™ от Stratagene, каталожный № 240612), примеры способов и реагентов, в частности, пригодных для применения для получения и скрининга библиотек дисплея антител можно найти, например, в Ladner et al. Патент США № 5223409; Kang et al. Публикация PCT № WO 92/18619; Dower et al. Публикация PCT № WO 91/17271; Winter et al Публикация PCT № WO 92/20791; Markland et al. Публикация PCT № WO 92/15679; Breitling et al. Публикация PCT № WO 93/01288; McCafferty et al. Публикация PCT № WO 92/01047; Garrard et al Публикация PCT № WO 92/09690; Fuchs et al. (1991) Bio/Technology 9:1370-1372; Hay et al. (1992) Hum Antibod Hybridomas 3:81-85; Huse et al. (1989) Science 246:1275-1281: McCafferty et al, Nature (1990) 348:552-554; Griffiths et al. (1993) EMBO J 12:725-734; Hawkins et al (1992) J Mol Biol 226:889-896; Clackson et al (1991) Nature 352:624-628; Gram et al (1992) PNAS 89:3576-3580; Garrard et al (1991) Bio/Technology 9:1373-1377; Hoogenboom et al. (1991) Nuc Acid Res 19:4133- 4137; и Barbas et al (1991) PNAS 88:7978-7982.
В предпочтительном варианте осуществления для выделения антител человека с высокой аффинностью и низкой константой скорости диссоциации для hTNFα, антитела мыши против hTNFα, обладающие высокой аффинностью и низкой константой скорости диссоциации для hTNFα (например, МАК 195, гибридома для получения которых обладает номером депонирования ЕСАСС 87 050801), сначала используют для отбора последовательностей тяжелой и легкой цепей человека, обладающих сходной активностью связывания для hTNFα, с применением способов импринтинга эпитопов, описанных Hoogenboom et al., публикация РСТ № WO 93/06213. Библиотеки антител, применяемые по этому способу, предпочтительно представляют собой библиотеки scFv, полученные и подвергаемые скринингу, как описано в McCafferty et al.; публикация РСТ № WO 92/01047; McCafferty et al., Nature (1990) 348:552-554; Griffiths et al. (1993) EMBO J. 12:725-734. Скрининг библиотек антител scFv предпочтительно проводят с использованием в качестве антигена рекомбинантного hTNFα человека.
После отбора исходных фрагментов VL и VH человека проводят эксперименты «комбинирования для получения оптимальных вариантов», в которых проводят скрининг различных пар первоначально выбранных фрагментов VL и VH по связыванию hTNFα для отбора предпочтительных комбинаций пар VL/VH. Кроме того, для дальнейшего улучшения аффинности и/или снижения константы скорости диссоциации для связывания hTNFα, фрагменты VL и VH предпочтительной пары (пар) VL/VH можно подвергать случайному мутагенезу, предпочтительно в области CDR3 VH и/или VL, способом, аналогичным процессу получения соматической мутации in vivo, ответственному за созревание аффинности антител в ходе естественного иммунного ответа. Это созревание аффинности in vitro можно осуществлять посредством амплификации областей VH и VL с использованием праймеров для ПЦР, комплементарных CDR3 VH или CDR3 VL, соответственно, где в данные праймеры «вбивают» случайную смесь четырех нуклеотидных оснований в определенные положения, так что полученные продукты ПЦР кодируют фрагменты VH и VL, в которые введены случайные мутации в области CDR3 VH и/или VL. Эти фрагменты VH и VL со случайными мутациями можно снова подвергать скринингу по связыванию hTNFα, и можно отбирать последовательности, обладающие высокой аффинностью и низкой константой скорости диссоциации для связывания hTNFα.
После скрининга и выделения антитела против hTNFα по изобретению из библиотеки дисплея рекомбинантных иммуноглобулинов нуклеиновую кислоту, кодирующую отобранное антитело, можно выделить из упаковки дисплея (например, из генома фага) и субклонировать в другие экспрессирующие векторы посредством общепринятых способов рекомбинантной ДНК. Если желательно, возможны дальнейшие манипуляции с нуклеиновой кислотой для создания других форм антител по изобретению (например, связывание с нуклеиновой кислотой, кодирующей дополнительные иммуноглобулиновые домены, такие как дополнительные константные области). Для экспрессии рекомбинантного человеческого антитела, выделенного при скрининге комбинаторной библиотеки, ДНК, кодирующую антитело, клонируют в рекомбинантный экспрессирующий вектор и вводят в клетки-хозяева млекопитающего, как более подробно описано выше.
Способы выделения антител человека с высокой аффинностью и низкой константой диссоциации для hTNFα описаны также в патентах США № 6090382, 6258562 и 6509015, каждый из которых приведен здесь в качестве ссылки.
III. Очистка антитела
Изобретение относится к способу получения препарата антитела с уменьшенным уровнем HCP из смеси, содержащей антитело и, по меньшей мере, один HCP. Изобретение относится также к способу получения препарата антитела с уменьшенным уровнем прокатепсина L из смеси, содержащей антитело и, по меньшей мере, один прокатепсин L. Способ очистки по изобретению начинается со стадии разделения после того, как антитело получено с использованием способов, описанных в разделе II, и общепринятых в данной области способов. Как правило, в данной области смесь антитело-HCP подвергают связыванию с белком A (например, на колонке с белком A) в качестве начальной стадии, поскольку антитело связывается с белком A, в то время как HCP будет протекать через него. Способы очистки по изобретению обладают тем преимуществом, что не является необходимым подвергать смесь, содержащую антитело и, по меньшей мере, один HCP, связыванию с белком A (например, на колонке с белком A) в качестве начальной стадии, или в качестве любой стадии способа очистки.
После получения осветленного раствора или смеси, содержащей антитело, отделение антитела от других белков, продуцированных клеткой, таких как HCP, осуществляют с использованием сочетания различных способов очистки, включая стадию (стадии) ионообменного разделения и стадию (стадии) разделения с гидрофобным взаимодействием. На стадии разделения разделяют смеси белков на основании их заряда, степени гидрофобности, и/или размера. В одном варианте осуществления изобретения разделение осуществляют с использованием хроматографии, включая катионную, анионную и гидрофобную. Для каждого из этих способов доступно несколько различных смол для хроматографии, позволяющих точную настройку схемы очистки для конкретного вовлеченного белка. Сущностью каждого из способов разделения является то, что белки можно заставить либо двигаться с различными скоростями к низу длинной колонки, достигая физического разделения, которое увеличивается с их дальнейшим прохождением к низу колонки, либо избирательно связываться со средой для разделения последующей элюцией различными растворителями. В некоторых случаях антитело отделяют от примесей, когда примеси специфически связываются с колонкой, а антитело не связывается, то есть антитело присутствует в проскоке.
Способы очистки антитела от нежелательных белков представлены ниже, например способ A. В одном варианте осуществления изобретение относится к стадиям, по отдельности или в сочетании, описанным ниже в способе A. Способ A относится к способу очистки смеси, содержащей антитело, с использованием ионообменного разделения (катионообменная хроматография и анионообменная хроматография) и разделения с гидрофобным взаимодействием, с получением препарата антитела, пригодного для применения в фармацевтической композиции. Способ A обладает тем преимуществом, что его можно осуществлять без необходимости осуществлять связывание с белком A в качестве начальной стадии очистки антитела. В одном варианте осуществления антитело, очищенное с использованием способа A, представляет собой адалимумаб. Способ A, как правило, включает в себя следующее.
Смесь, содержащую антитело и примеси, например HCP, наносят на ионообменную колонку, такую как катионообменная колонка. Смесь можно наносить при загрузке приблизительно ≤30 г антитела/л на цикл. Смесь, нанесенную на катионную колонку, последовательно промывают буфером для промывки (буфером для уравновешивания). Затем антитело элюируют с колонки и получают первый элюат.
Затем в первом элюате часто инактивируют вирусы и доводят pH в препарате для анионообменной хроматографии. В первом элюате инактивируют вирусы посредством доведения pH до низкого pH относительно буфера для элюции (описан ниже в разделе IIIC). pH элюата после инактивации вирусов последовательно доводят более чем за одну стадию, до конечного pH приблизительно 7,6, что представляет собой pH анионообменной колонки, которая следует за этим.
После инактивации вирусов первый элюат часто подвергают второй стадии ионообменного разделения, где первый элюат наносят на анионообменную колонку (например, колонку с Q-сефарозой). Колонку промывают буфером для промывки, и получают первый проскок, содержащий антитело.
Проскок далее очищают посредством нанесения на колонку для гидрофобного взаимодействия (фенилсефароза). Колонку промывают, и антитело элюируют с колонки так, что получают второй элюат.
Способ B описан ниже и представляет собой улучшенный способ для получения препарата антител с уменьшенным уровнем белков клетки-хозяина (HCP) из смеси, содержащей антитело. Выражение «уменьшенный» по отношению к HCP или прокатепсину L, включает в себя улучшения по отношению к уровням, например, концентрации или активности, HCP или прокатепсина L в сопоставимых точках по способу A. В одном варианте осуществления первый элюат по способу B содержит уменьшенный уровень HCP или прокатепсина L по сравнению с первым элюатом по способу A. В одном варианте осуществления первый проскок по способу B содержит уменьшенный уровень HCP или прокатепсина L по сравнению с первым проскоком по способу A. В одном варианте осуществления второй элюат по способу B содержит уменьшенный уровень HCP или прокатепсина L по сравнению со вторым элюатом по способу A. В другом варианте осуществления препарат антитела, полученный по способу B, содержит уменьшенный уровень HCP или прокатепсина L по сравнению с препаратом антитела, полученным в результате способа A.
Способ B в основном включает в себя следующее.
Смесь, содержащую антитело и примеси, например HCP, наносят на ионообменную колонку, такую как катионообменная колонка. Смесь можно наносить при загрузке приблизительно ≤35 г антитела/л на цикл при pH 7 или при загрузке приблизительно ≤70 г антитела/л на цикл при pH 5. Затем смесь, нанесенную на катионную колонку, промывают буфером для промывки (буфером для уравновешивания). После уравновешивания буфером для промывки проводят стадию промежуточной промывки, где колонку промывают промежуточным буфером, обладающим такой же электропроводностью, как буфер для элюции. Эта стадия промежуточной промывки улучшает очистку от связанных со способом примесей. Затем антитело элюируют с колонки с использованием буфера для элюции и получают первый элюат.
Затем в первом элюате инактивируют вирусы и доводят pH в препарате для анионообменной хроматографии. В первом элюате инактивируют вирусы посредством доведения pH до низкого pH по сравнению с буфером для элюции. Затем pH и электропроводность элюата после инактивации вирусов доводят за одну стадию до конечного pH приблизительно 7,8-8,2, что представляет собой pH уравновешенной анионообменной колонки, которая следует за этим.
После инактивации вирусов первый элюат подвергают второй стадии ионообменного разделения, где первый элюат наносят на анионообменную колонку (например, колонку с Q-сефарозой). Колонку промывают буфером для промывки и получают первый проскок, содержащий антитело.
Проскок очищают далее посредством нанесения на колонку для гидрофобного взаимодействия (фенилсефароза). Колонку промывают, и антитело элюируют с колонки так, что получают второй элюат. Результатом способа B является препарат с уменьшенным уровнем HCP, включая прокатепсин L. Дополнительные результаты по способу B включают в себя удаление критических моментов способа, например получение большей производительности при увеличении масштаба культуры клеток посредством помещения очистки от HCP в начало процесса и общее увеличение выхода антитела. Дополнительные подробности относительно улучшенного способа по изобретению приведены ниже.
III.A. Ионообменное разделение
Настоящее изобретение относится к способам получения препарата антитела с уменьшенным уровнем HCP из смеси, содержащей антитело и, по меньшей мере, один HCP, посредством подвергания смеси, по меньшей мере, одной стадии ионообменного разделения так, что получают первый элюат, содержащий антитело. Ионообменное разделение включает в себя любой способ, которым два вещества разделяют на основании разницы в их соответствующих ионных зарядах.
При проведении разделения смесь с антителом можно приводить в контакт с ионообменным материалом, например, с использованием способа очистки на установке периодического действия или хроматографии. Например, для очистки на установке периодического действия ионообменный материал получают или уравновешивают в желательном начальном буфере. Получают взвесь ионообменного материала. Раствор антитела приводят в контакт с взвесью для адсорбции антитела, подлежащего разделению, на ионообменном материале. Раствор, содержащий HCP, которые не связываются с ионообменным материалом, отделяют от взвеси, например, позволяя взвеси осесть и удаляя супернатант. Взвесь можно подвергать одной или нескольким стадиям промывки. Если желательно, взвесь можно приводить в контакт с раствором более высокой электропроводности для десорбции HCP, связавшихся с ионообменным материалом. Чтобы элюировать связавшиеся полипептиды, концентрацию соли можно увеличивать.
Ионообменную хроматографию можно использовать также в качестве ионообменного способа разделения. Ионообменной хроматографией разделяют молекулы на основании разницы между общими зарядами молекул. Для очистки антитела антитело должно обладать зарядом, противоположным заряду функциональной группы, присоединенной к ионообменному материалу, например смоле, чтобы связываться. Например, антитела, которые, как правило, обладают общим положительным зарядом в буфере с pH ниже их pI, будут хорошо связываться с катионообменным материалом, который содержит отрицательно заряженные функциональные группы.
При ионообменной хроматографии заряженные участки на поверхности растворенного вещества притягиваются противоположными зарядами, присоединенными к смоле для хроматографии, при условии, что ионная сила окружающего буфера является низкой. Элюции, как правило, достигают посредством увеличения ионной силы (т.е. электропроводности) буфера для конкуренции с растворенным веществом за заряженные участки на ионообменной матрице. Изменение pH и изменение таким образом заряда растворенного вещества является другим способом достижения элюции растворенного вещества. Изменение электропроводности или pH может являться постепенным (градиентная элюция) или ступенчатым (ступенчатая элюция).
Анионные или катионные заместители можно присоединять к матрицам для получения анионных или катионных подложек для хроматографии. Анионообменные заместители включают в себя диэтиламиноэтил (DEAE), четвертичный аминоэтил (QAE) и четвертичные группы амина (Q). Катионные заместители включают в себя карбоксиметил (CM), сульфоэтил (SE), сульфопропил (SP), фосфат (P) и сульфонат (S). Целлюлозные ионообменные смолы, такие как DE23, DE32, DE52, CM-23, CM-32 и CM-52, доступны из Whatman Ltd. Maidstone, Kent, U.K. Известны также ионообменники на основе SEPHADEX® и ионообменники с низким поперечным сшиванием. Например, DEAE-, QAE-, CM-, и SP-SEPHADEX® и DEAE-, Q-, CM- и S-SEPHAROSE® и SEPHAROSE® Fast Flow - все являются доступными из Pharmacia AB. Кроме того, как DEAE, так и CM-дериватизированный сополимер этиленгликоля-метакрилата, такой как TOYOPEARL DEAE-650S или M и TOYOPEARL CM-650S или M, доступны из Toso Haas Co., Philadelphia, Pa.
В одном варианте осуществления изобретения смесь, содержащую антитело и, по меньшей мере, один HCP, наносят на колонку для катионообменной хроматографии (CEX). Смесь наносят на колонку для CEX в буфере для нанесения, который может являться таким же, как буфер для уравновешивания, применяемый для уравновешивания колонки. При пропускании содержащей HCP смеси через колонку для CEX белок-мишень адсорбируется на смоле для CEX, а различные HCP (такие как белки клетки-хозяина, когда белок-мишень продуцируют в рекомбинантной клетке-хозяине, или другие полученные при способе примеси) попадают в проскок или связываются слабо или неспецифически со смолой для CEX. В различных вариантах осуществления смола для CEX представляет собой синтетическую полимерную смолу на основе метакрилата, присоединенного к группе сульфоната (фрактогель SO3 (фрактогель S)). В одном варианте осуществления буфер для уравновешивания содержит 20 мМ Na2PO4, 25 мМ NaCl, pH 6,8. Другие подходящие буферы для уравновешивания включают в себя, например, BIS и HEPES в физиологических концентрациях, например в концентрациях в диапазоне между приблизительно 0,5 мМ и приблизительно 100 мМ (например, 10 мМ, 20 мМ, 50 мМ и т.д.), и физиологические концентрации соли (например, приблизительно 0,15 мМ NaCl) при pH 5,0-9,0.
В примерных вариантах осуществления CEX хроматография представляет собой колонку с фрактогелем S. В одном варианте осуществления от приблизительно 30 граммов (г) антитела на литр (L) смолы до приблизительно 40 г антитела на 1 л смолы наносят на колонку с фрактогелем S. В другом варианте осуществления приблизительно 35 г антитела на 1 л смолы наносят на колонку с фрактогелем S при pH 7. Обнаружили, что нанесение количества приблизительно 35 г антитела на 1 л смолы при pH 7 увеличивает очищение от примесей, например, HCP и прокатепсина L. Приемлемые рабочие диапазоны для колонки с фрактогелем S для применения в способе по изобретению описаны в таблице 1 ниже.
Приемлемые рабочие диапазоны для хроматографии на фрактогеле S при pH 7
Далее обнаружили, что емкость колонки для нанесения можно увеличить посредством проведения хроматографии при pH 5. В частности, обнаружили, что нанесение количества приблизительно 70 г антитела на 1 л смолы при pH 5 увеличивает очистку от примесей, например, HCP и прокатепсина L. Соответственно, в диапазоне pH от приблизительно pH 5 до приблизительно pH 7 можно использовать наносимое количество от приблизительно 35 г до приблизительно 70 г антитела на 1 л смолы.
После нанесения смеси с антителом на колонку смолу CEX промывают буфером для промывки. В частности, обнаружили, что множество стадий промывки различными буферами для промывки в дальнейшем приводит к препарату антитела с уменьшенным уровнем HCP. Конкретно, обнаружили, что уровни прокатепсина L можно уменьшить посредством использования стадии первой промывки и стадии промежуточной промывки с использованием буфера для промывки и буфера для промежуточной промывки, соответственно. В одном варианте осуществления проводят первую промывку смолы CEX буфером для промывки, который является таким же, как буфер для уравновешивания. В конкретных вариантах осуществления буфер для промывки представляет собой 20 мМ Na2PO4, 25 мМ NaCl, pH 6,8. Другие подходящие буферы для промывки включают в себя, например, BIS и HEPES в физиологических концентрациях, например концентрации в диапазоне между приблизительно 0,5 мМ и приблизительно 100 мМ (например, 10 мМ, 20 мМ, 50 мМ и т.д.), и физиологические концентрации соли (например, приблизительно 0,15 мМ NaCl) при pH 5,0-9,0.
В предпочтительном варианте осуществления изобретения проводят стадию промежуточной промывки. Обнаружили, что уменьшенных уровней HCP в целом, и в частности прокатепсина L, можно достигать с использованием буфера для промежуточной промывки, содержащего, частично, тот же самый буфер, что и буфер для элюции CEX. Улучшение уменьшения уровня HCP в целом, и в частности прокатепсина L, частично является результатом увеличения электропроводности в буфере для промежуточной промывки. Увеличение электропроводности буфера для промежуточной промывки вызывает смещение заряда HCP, которые обладают более низкой pI по сравнению с pI антитела, таким образом вызывая более слабое связывание HCP для отмывки с колонки. Увеличение очистки от более слабо связывающихся примесей, например HCP, включая прокатепсин L, в свою очередь, обеспечивает больше площади связывания для намеченного вещества, например антитела. В других вариантах осуществления буфер для промежуточной промывки содержит от приблизительно 40% до приблизительно 50% буфера для элюции и от приблизительно 50% до приблизительно 60% воды для инъекции. В следующих вариантах осуществления буфер для промежуточной промывки содержит 45% буфер для элюции и 55% воды для инъекции. В одном варианте осуществления буфер для промывки, применяемый для промежуточной промывки, представляет собой 20 мМ Na2PO4, 150 мМ хлорид натрия, pH 7.
После множества промывок антитело элюируют с первого катионообменного материала, так что получают первый элюат с уменьшенным уровнем HCP. Первый элюат обладает также уменьшенным уровнем прокатепсина L вследствие стадии промежуточной промывки. В одном варианте осуществления первый элюат, полученный с использованием способа по изобретению, содержит уровни HCP, уменьшенные от приблизительно 3 до приблизительно 5 раз по сравнению с сопоставимой стадией способа A. В другом варианте осуществления первый элюат, полученный с использованием способа по изобретению, обладает активностью катепсина L, уменьшенной от приблизительно 2 до приблизительно 3 раз по сравнению с сопоставимой стадией способа A. В одном варианте осуществления первый элюат содержит в диапазоне от приблизительно 90 до приблизительно 100 раз меньше HCP, чем смесь, как определено по ELISA HCP. В другом варианте осуществления первый элюат обладает активностью катепсина L в диапазоне от приблизительно 25 до приблизительно 60 RFU/сек/мг антитела, как измеряют посредством анализа кинетики катепсина L.
В предпочтительном варианте осуществления начальный элюат, содержащий антитело, пропускают через второй IE материал и получают проскок, содержащий дополнительно уменьшенный уровень HCP. В некоторых вариантах осуществления вторая стадия IE может представлять собой очистку на установке периодического действия, как описано ниже. В других вариантах осуществления вторая стадия IE включает в себя нанесение первого элюата на вторую колонку для ионообменной хроматографии, промывку колонки и получение первого проскока. Второй IE материал может представлять собой анионообменную (AEX) смолу, например колонку с Q-сефарозой. В некоторых вариантах осуществления между приблизительно 30 г антитела на 1 л смолы и приблизительно 40 г антитела на 1 л смолы наносят на анионообменную колонку. Увеличение наносимого количества между приблизительно 40 г антитела на 1 л смолы и приблизительно 50 г антитела на 1 л смолы вызывает уменьшение очистки от примесей, например HCP. При пропускании содержащей HCP смеси через AEX колонку различные HCP связываются со смолой AEX, а антитело проходит через смолу AEX или связывается с ней неспецифически. В конкретных вариантах осуществления анионообменная смола представляет собой Q-сефарозу.
Часто смесь с антителом, подлежащая очистке, будет присутствовать в буфере с предыдущей стадии очистки. Доступно множество буферов, и их можно выбирать посредством общепринятых экспериментов. Например, можно использовать буфер для уравновешивания 25 мМ троламин, 40 мМ NaCl, pH 8. В одном варианте осуществления перед пропусканием начального элюата через второй IE материал, второй IE материал можно уравновешивать буфером для уравновешивания. Это можно осуществлять, например, посредством изменения pH и электропроводности первого элюата, так что pH и электропроводность первого элюата являются, по существу, сходными с pH и электропроводностью уравновешенного второго IE материала или соответствуют им, т.е. изменения pH и электропроводности первого элюата, так что они соответствуют pH и электропроводности уравновешенного второго ионообменного материала. В некоторых вариантах осуществления pH AEX материала (например, Q-сефарозы) доводят буфером для уравновешивания до диапазона от приблизительно 7,7 до приблизительно 8,3. В следующих вариантах осуществления pH CEX элюата (например, начального элюата) доводят до диапазона от приблизительно 7,7 до приблизительно 8,3. В конкретных вариантах осуществления pH как AEX материала, так и исходного элюата составляет приблизительно 8. В некоторых вариантах осуществления электропроводность AEX материала лежит в диапазоне от приблизительно 3,5 мСм/см до приблизительно 4,9 мСм/см. В дополнительных вариантах осуществления электропроводность начального элюата лежит в диапазоне от приблизительно 3,5 мСм/см до приблизительно 4,9 мСм/см. Обнаружили, что доведение электропроводности и pH при нанесении до электропроводности и pH второго ионообменного материала улучшает очистку от примесей. Относительно способа A обнаружили, что общее уменьшение электропроводности и/или увеличение pH первого элюата и/или уравновешенного второго ионообменного материала приводит к увеличенной очистке от HCP.
После нанесения смеси с антителом на колонку затем смолу AEX промывают буфером для промывки. Буфер для промывки может являться таким же, как буфер для уравновешивания, например 25 мМ троламин, 40 мМ NaCl, pH 8. В одном варианте осуществления смыв можно объединять с проскоком, так что получают первый проскок, содержащий антитело и обладающий уменьшенным уровнем HCP. В следующих вариантах осуществления первый проскок обладает уменьшенным уровнем прокатепсина L. В одном варианте осуществления первый проскок, полученный с использованием способа по изобретению, содержит уровни HCP, уменьшенные от приблизительно 7 до приблизительно 700 раз по сравнению с сопоставимой стадией способа A. В другом варианте осуществления первый проскок, полученный с использованием способа по изобретению, обладает активностью катепсина L, уменьшенной от приблизительно 6 до приблизительно 25 раз по сравнению с сопоставимой стадией способа A. В других вариантах осуществления первый проскок содержит в диапазоне от приблизительно 840 до приблизительно 850 раз меньше HCP, чем первый элюат, как определено по ELISA HCP. В другом варианте осуществления первый проскок обладает активностью катепсина L в диапазоне между приблизительно 0,4 и приблизительно 4 RFU/сек/мг антитела, как измеряют посредством анализа кинетики катепсина L.
Приемлемые рабочие диапазоны для хроматографии на Q-сефарозе для применения в способе по изобретению описаны в таблице 2.
Приемлемые рабочие диапазоны для хроматографии FF на Q-сефарозе
Выбор для использования катионообменного материала или анионообменного материала основан на общем заряде белка, как обсуждают выше. Таким образом, в объем этого изобретения входит применение анионообменного материала перед использованием катионообменного материала. Более того, в объем этого изобретения входит применение только катионообменного материала или только анионообменного материала.
Способы по настоящему изобретению могут, необязательно, включать в себя дополнительные стадии очистки. Примеры дополнительных способов очистки, которые можно проводить до, во время или после способа ионообменной хроматографии, включают в себя фракционирование при хроматографии гидрофобного взаимодействия (например, на фенилсефарозе), осаждение этанолом, изоэлектрическую фокусировку, обращенно-фазовую HPLC, хроматографию на силикагеле, хроматографию на гепаринсефарозе, дополнительную анионообменную хроматографию и/или дополнительную катионообменную хроматографию, хроматофокусировку, SDS-PAGE, осаждение сульфатом аммония, хроматографию на гидроксилапатите, гель-электрофорез, диализ и аффинную хроматографию (например, с использованием белка A, белка G, антитела, специфического субстрата, лиганда или антигена в качестве связывающего реагента).
III.B. Разделение с гидрофобным взаимодействием
Настоящее изобретение относится также к способам получения препарата антитела с уменьшенным уровнем HCP из смеси, содержащей антитело и, по меньшей мере, один HCP, дополнительно включающим в себя стадию разделения с гидрофобным взаимодействием, где первый проскок подвергают воздействию первого материала для гидрофобного взаимодействия, так что получают второй элюат с уменьшенным уровнем HCP.
При проведении разделения смесь полипептидов можно приводить в контакт с материалом HIC, например, с использованием очистки способом периодического действия или с использованием колонки. Перед очисткой HIC может быть желательным удалить любые хаотропные вещества или очень гидрофобные вещества, например, посредством пропускания смеси через предварительную колонку.
Например, для очистки на установке периодического действия материал HIC получают в желательном буфере для уравновешивания или уравновешивают до желательного буфера для уравновешивания. Получают взвесь материала HIC. Раствор антитела приводят в контакт с взвесью для адсорбции антитела, подлежащего разделению на материале. Раствор, содержащий HCP, не связывающийся с материалом HIC, отделяют от взвеси, например, позволяя взвеси осесть и удаляя супернатант. Взвесь можно подвергать одной или нескольким стадиям промывки. Если желательно, взвесь можно приводить в контакт с раствором более низкой электропроводности для десорбции антител, связавшихся с материалом HIC. Чтобы элюировать связанные антитела, можно уменьшать концентрацию соли.
В других вариантах осуществления стадия разделения с гидрофобным взаимодействием включает в себя нанесение первого проскока на колонку, содержащую первый материал для гидрофобного взаимодействия, и промывку первого материала для гидрофобного взаимодействия так, что получают второй элюат.
Стадия разделения с гидрофобным взаимодействием может включать в себя стадию хроматографии гидрофобного взаимодействия (HIC). В то время как ионообменная хроматография основана на зарядах белков, например, антител, для их разделения, для хроматографии гидрофобного взаимодействия используют гидрофобные свойства некоторых белков, например, антител. Гидрофобные группы антитела связываются с гидрофобными группами на колонке. Чем более гидрофобным является белок, тем сильнее он будет связываться с колонкой. На стадии HIC удаляют, например, примеси, полученные из клетки-хозяина (например, ДНК и другие связанные с продуктом молекулы высокой и низкой молекулярной массы).
Гидрофобные взаимодействия являются более сильными при высокой ионной силе, таким образом, эту форму разделения удобно проводить после способов осаждения солями или ионного обмена. Адсорбции антитела на колонке HIC благоприятствуют высокие концентрации соли, однако действительные концентрации могут меняться в широком диапазоне в зависимости от природы антитела и конкретного выбранного лиганда HIC. Различные ионы можно располагать в так называемые сольвофобные серии в зависимости от того, облегчают ли они гидрофобные взаимодействия (эффекты высаливания) или нарушают структуру воды (хаотропный эффект) и приводят к ослаблению гидрофобного взаимодействия. Катионы ранжируют на основании увеличения эффекта высаливания как Ba++<; Ca++<; Mg++<; Li+<; Cs+<; Na+<; K+<; Rb+<; NH4 +, в то время как анионы можно ранжировать на основании увеличения хаотропного эффекта как PO--<; SO4 --<; CH3COOO-<; Cl-<; Br-<; NO3 -<; ClO4 -<; I-<; SCN-.
Как правило, сульфаты Na, K или NH4 эффективно способствуют взаимодействию лигнанд-белок при HIC. Можно составлять соли, которые влияют на силу взаимодействия, как показано посредством следующего соотношения: (NH4)2SO4>; Na2SO4>; NaCl>; NH4Cl>; NaBr>; NaSCN. Как правило, применяют концентрации соли между приблизительно 0,75 и приблизительно 2M сульфата аммония или между приблизительно 1 и 4M NaCl.
Колонки HIC обычно содержат матрицу-основу (например, перекрестно-сшитую агарозу или синтетический сополимерный материал), к которой присоединены гидрофобные лиганды (например, алкильные или арильные группы). Предпочтительная колонка HIC содержит агарозную смолу с замещением фенильными группами (например, колонка с фенил-Sepharose™). Многие колонки HIC коммерчески доступны. Они включают в себя в качестве неограничивающих примеров колонку фенил-Sepharose™ 6 Fast Flow с низким или высоким замещением (Pharmacia LKB Biotechnology, AB, Sweden); колонку фенил-Sepharose™ High Performance (Pharmacia LKB Biotechnology, AB, Sweden); колонку октил-Sepharose™ High Performance (Pharmacia LKB Biotechnology, AB, Sweden); колонки с пропил-Fractogel™ EMD или фенил-Fractogel™ EMD (E. Merck, Germany); Macro-Prep™ Mehyl или подложки с Macro-Prep™ трет-бутил (Bio-Rad, California); колонку WP HI-пропил (C.sub.3)™ (J. T. Baker, New Jersey); и колонки с эфиром Toyopearl™, фенил- или бутил-Toyopearl™ (TosoHaas, PA).
После любой предварительной стадии (стадий) очистки смесь, содержащую интересующее антитело и HCP, можно подвергать HIC. Часто композиция антитела, подлежащего очистке, будет присутствовать в буфере с предыдущей стадии очистки. Однако может быть необходимым добавить буфер к композиции антитела перед стадией HIC. Доступно множество буферов, и их можно выбрать посредством общепринятых экспериментов. В одном варианте осуществления pH смеси, содержащей подлежащее очистке антитело и, по меньшей мере, один HCP в буфере для нанесения, доводят до pH приблизительно 7 с использованием либо кислоты, либо соли, в зависимости от исходного pH, и электропроводности от приблизительно 136 до приблизительно 158 мСм/см. В одном варианте осуществления смесь с антителом разводят буфером, содержащим 40 мМ фосфат натрия, 2,2 M (NH4)ZSO4, pH 7.
Перед нанесением смеси с антителом колонку можно уравновешивать буфером для уравновешивания. В некоторых вариантах осуществления буфер для уравновешивания представляет собой 20 мМ фосфат натрия, 1,1 M (NH4)2SO4, pH 7.
В одном варианте осуществления смесь, например первый проскок, содержащий антитело, наносят на колонку с фенилсефарозой HIC. В конкретных вариантах осуществления белок, наносимый на этой стадии, лежит в диапазоне между приблизительно 20 и приблизительно 40 г белка на 1 л смолы. В других вариантах осуществления белок, наносимый на этой стадии, составляет приблизительно 35 г белка на 1 л смолы. В некоторых вариантах осуществления может требоваться два или три цикла хроматографии для переработки всего количества доступного материала.
После связывания белка с колонкой для гидрофобного взаимодействия колонку можно промывать буфером для промывки, который может являться таким же, как буфер для уравновешивания, например 1,1 M (NH4)2SO4, pH 7. Антитело элюируют с колонки с использованием буфера для элюции, так что получают второй элюат. Буфер для элюции можно выбрать с использованием общепринятых экспериментов. pH буфера для элюции лежит в диапазоне между приблизительно 6 и приблизительно 8, и он обладает низкой концентрацией сульфата аммония (т.е. менее чем приблизительно 1 M (NH4)2SO4). Электропроводность буфера для элюции лежит в диапазоне от приблизительно 87 до приблизительно 101 мСм/см. В одном варианте осуществления буфер для элюции содержит 11 мМ фосфат натрия, 0,625 M (NH4)2SO4), pH 7. Обнаружили, что более низкие концентрации приводят к меньшему связыванию адалимумаба со смолой. Антитело элюируют со второго ионообменного материала так, что получают второй элюат с уменьшенным уровнем HCP. Второй элюат обладает также уменьшенным уровнем прокатепсина L. В одном варианте осуществления второй элюат, полученный с использованием способа по изобретению, содержит уровни HCP, уменьшенные от приблизительно 10 до приблизительно 96 раз по сравнению с сопоставимой стадией способа A. В другом варианте осуществления второй элюат, полученный с использованием способа по изобретению, обладает от приблизительно 5 до приблизительно 15 раз меньшей активностью катепсина L по сравнению с сопоставимой стадией способа A. В одном варианте осуществления второй элюат содержит в диапазоне от приблизительно 3 до приблизительно 5 раз меньше HCP, чем первый проскок, как определено по ELISA HCP. В другом варианте осуществления второй элюат обладает активностью катепсина L, лежащей в диапазоне от приблизительно 0,5 до приблизительно 1,5 RFU/сек/мг антитела, как измеряют посредством анализа кинетики катепсина L.
Приемлемые рабочие диапазоны для хроматографии на колонке с фенилсефарозой, применяемые в способах по изобретению, показаны в таблице 3.
Приемлемые рабочие диапазоны для хроматографии на фенилсефарозе HP
Дополнительные стадии очистки могут включать в себя стадии удаления вируса, а также стадии нанофильтрации, ультрафильтрации и/или диафильтрации, как описано в настоящем описании.
III.C. Инактивация вирусов
Чтобы обеспечить запас безопасности, потенциальные невыявленные вирусы инактивируют в ходе способа очистки. Способы инактивации вирусов известны в данной области и включают в себя тепловую инактивацию (пастеризацию), pH-инактивацию, обработку растворителем/детергентом, облучение UV и гамма-излучением, и добавление конкретных химических инактивирующих средств, таких как β-пропиолактон или, например, медь с фенантролином, как в патенте США № 4534972, и т.д. В некоторых вариантах осуществлении подвергание смеси инактивации вирусов может включать в себя pH-инактивацию вирусов. Методы для способов pH-инактивации вирусов также хорошо известны в данной области. Например, типичные способы инактивации вирусов включают в себя инкубацию смеси в течение периода времени при низком pH с последующей нейтрализацией pH и удалением твердых частиц фильтрацией. Выбор уровня pH в большой степени зависит от профиля стабильности продукта антитела и компонентов буфера. Известно, что на качество намеченного антитела во время инактивации вируса низким pH влияет pH и продолжительность инкубации при низком pH. Инактивация вируса зависит от тех же самых параметров в дополнение к концентрации белка, которая может уменьшать инактивацию при высоких концентрациях. Таким образом, соответствующие параметры концентрации белка, pH и продолжительности инактивации можно выбирать посредством общепринятых экспериментов.
pH смеси можно понижать посредством любой подходящей кислоты, включая, в качестве неограничивающих примеров, лимонную кислоту, уксусную кислоту, каприловую кислоту или другие подходящие кислоты. В предпочтительных вариантах осуществления pH смеси регулируют 1 M лимонной кислотой.
В некоторых вариантах осуществления смесь инкубируют при pH от приблизительно 2,9 до приблизительно 3,9 в течение от приблизительно 15 минут до приблизительно 180 минут. В следующих вариантах осуществления смесь инкубируют при pH приблизительно 3,5 в течение от приблизительно 60 минут до приблизительно 120 минут. В других вариантах осуществления смесь инкубируют при pH приблизительно 3,5 в течение от приблизительно 60 минут до приблизительно 180 минут.
В одном варианте осуществления смесь, содержащую антитело и HCP, подвергают инактивации вирусов перед IE разделением. В других вариантах осуществления начальный элюат подвергают инактивации вирусов перед IE разделением. В конкретных вариантах осуществления начальный элюат подвергают инактивации вирусов перед анионообменной хроматографией.
После инактивации вирусов смесь адаптируют, как необходимо для дальнейших стадий очистки. Например, пул с доведенным pH можно подвергать фильтрации. В одном варианте осуществления после инактивации вирусов низким pH и/или фильтрации pH смеси, как правило, доводят до более нейтрального pH, например от приблизительно 6,5 до приблизительно 8,5. Например, смесь можно промывать водой для инъекций (WFI) для получения желаемого pH.
Параметры инактивации вирусов низким pH, применяемые по способу по изобретению, показаны в таблице 4 ниже.
Приемлемые рабочие параметры
для инактивации вирусов низким pH
Изобретение относится к способу, где первый элюат с ионообменной колонки подвергают инактивации вирусов перед второй стадией ионообменной хроматографии. В одном варианте осуществления инактивации вирусов достигают посредством pH-инактивации вирусов.
IV. Способ определения уровней белка клетки-хозяина (HCP)
Настоящее изобретение также относится к способам для определения остаточных уровней концентрации белка клетки-хозяина (HCP) в очищенной композиции антитела. Как описано выше, HCP желательно исключить из конечного продукта намеченного вещества, например антитела. Примерные HCP включают в себя белки, происходящие из источника продукции антитела. Невозможность обнаружения и достаточного удаления HCP из намеченного антитела может приводить к уменьшенной эффективности и/или неблагоприятным реакциям пациента.
Как применяют здесь, термин «ELISA HCP» относится к ELISA, где второе антитело, применяемое в анализе, является специфическим для HCP, продуцируемых из клеток, например клеток CHO, применяемых для получения антитела, например адалимумаба. Второе антитело можно получить согласно общепринятым способам, известным специалистам в данной области. Например, второе антитело можно получить с использованием HCP, полученных посредством проведения ложной продукции и очистки, т.е. используют ту же самую линию клеток, применяемую для продукции интересующего антитела, но линию клеток не трансфицируют ДНК для антитела. В примерном варианте осуществления второе антитело получают с использованием HPC, сходных с HPC, экспрессируемых в экспрессирующей системе выбранных клеток, т.е. экспрессирующей системе клеток, применяемой для продукции намеченного антитела.
В общем, ELISA HCP включает в себя формирование сэндвич-структуры жидкого образца, содержащего HCP, между двух слоев антител, т.е. первого антитела и второго антитела. Образец инкубируют, и в течение этого времени HCP в образце связываются с первым антителом, например антителом козы анти-CHO, аффинно очищенным (Cygnus). Добавляют меченое второе антитело, специфическое для HCP, продуцируемых в клетках, применяемых для продукции антитела, например биотинилированное анти-CHO HCP, и оно связывается с HCP в образце. Количество HCP, содержащееся в образце, определяют с использованием соответствующего теста, основанного на метке второго антитела.
ELISA HCP можно использовать для определения уровня HCP в композиции антитела, такой как элюат или проскок, полученный с использованием способа, описанного в разделе III выше. Настоящее изобретение также относится к композиции, содержащей антитело, где композиция не обладает поддающимся детекции уровнем HCP, как определяют посредством твердофазного иммуноферментного анализа («ELISA») HCP. В одном варианте осуществления первый элюат содержит между приблизительно 12000 и приблизительно 19500 нг/мг HCP. В одном варианте осуществления второй элюат содержит между приблизительно 1,0 и приблизительно 0,0 нг/мг HCP.
V. Способ определения уровней прокатепсина L
Изобретение относится к анализу кинетики (или анализу кинетики катепсина L) для определения количества прокатепсина L в образце. Прокатепсин L представляет собой белок клетки-хозяина, полученный из определенных экспрессирующих систем, и известно, что после активации до катепсина L он вызывает фрагментацию белков, включая антитела, такие как адалимумаб. Исследования показали, что прокатепсин L синтезируется как неактивный зимоген и позднее подвергается процессингу до формы активного катепсина L. Активация прокатепсина L происходит посредством протеолитического удаления N-концевой области пропептида либо посредством других протеаз, таких как катепсин D, либо посредством автокаталитической активации в кислых условиях лизосомы (Turk et al. (1999) Eur J Biochem 259:929). Более того, Mason et al (смотри Mason et al. (1992) Biochem Biophysical Res Comm 189: 1659) опубликовали, что можно достигать более высокой степени активации катепсина L при pH 5,5 с помощью добавления отрицательно заряженных молекул, таких как декстрансульфат, в условиях более низкого pH.
Предшествующие способы определения уровней прокатепсина L (или активной формы катепсина L) включали в себя аналитические способы, такие как слабая анионообменная хроматография. Однако такие способы являются ограниченными при тестировании образцов, полученных в ходе процесса, т.е. образцов, полученных в результате процесса, описанного выше в разделе III, из-за влияния буферной системы и эффектов матрицы. Таким образом, изобретение относится к высокопроизводительному флуоресцентному ферментативному способу для лучшего мониторирования прокатепсина L, например, для целей мониторирования процесса.
Анализ кинетики по изобретению относится к способу определения прокатепсина L в уровнях, которые невозможно легко детектировать посредством общепринятых анализов в конечных точках. Анализ кинетики относится также к способам определения того, является ли уровень прокатепсина L воспроизводимо низким. В одном варианте осуществления образцы можно получать из любой точки процесса, описанного в разделе III, чтобы подтвердить или определить, что уровень прокатепсина L является уменьшенным для способа в целом. Прокатепсин L активируют посредством удаления N-конца белка. В одном варианте осуществления активации достигают с использованием пептидазы, такой как, в качестве неограничивающих примеров, катепсин D. После активации катепсин L может избирательно гидролизовать субстраты. Субстрат приводят в контакт с образцом и мониторируют активность катепсина L на основании изменений субстрата.
В предпочтительном варианте осуществления субстрат для катепсина L содержит метку. Метка может включать в себя любое средство, которое позволяет определять активность катепсина. Примеры меченых субстратов, которые катепсин L может избирательно гидролизовать, включают в себя синтетические субстраты, такие как Z-лейцин-аргинин-AMC (R & D Systems). Пептидный субстрат может содержать флуоресцентную группу 7-амино-4-метилкумарин (AMC), которую гасят посредством амидной связи между аминогруппой AMC и карбоксильной группой аргинина. После расщепления амидной связи посредством катепсина L высвобождаемая группа AMC является флуоресцентной и ее можно измерять посредством длины волны возбуждения и излучения 380 нм и 460 нм соответственно. Это возбуждение можно измерять и использовать для определения активности катепсина L. Скорость преобразования субстрата является прямо пропорциональной количеству катепсина L, присутствующего в образце. Это измерение используют в сочетании с контрольным образцом, обладающим известной активностью катепсина L и известным количеством катепсина L. Затем активность катепсина L в образце сопоставляют с количеством антитела, присутствующего в образце. В одном варианте осуществления первый элюат обладает активностью катепсина L в диапазоне между приблизительно 25 и приблизительно 60 RFU/сек/мг антитела. В другом варианте осуществления первый проскок обладает активностью катепсина L в диапазоне между приблизительно 0,4 и приблизительно 4 RFU/сек/мг антитела. В одном варианте осуществления второй элюат обладает активностью катепсина L в диапазоне между приблизительно 0,5 и приблизительно 1,5 RFU/сек/мг антитела.
В одном варианте осуществления анализ кинетики включает в себя определение количества прокатепсина L в материале, полученном из экспрессирующей системы клеток млекопитающих, включающее в себя приведение материала в контакт с ферментом для процессинга прокатепсина L до активной формы катепсина L так, что получают образец катепсина L. После активации катепсин L может избирательно гидролизовать субстраты, включая синтетические субстраты, такие как Z-лейцин-аргинин-AMC. Затем к образу добавляют субстрат, включая, например, Z-лейцин-аргинин-AMC, который содержит флуоресцентную группу 7-амино-4-метилкумарина (AMC), которую гасят посредством амидной связи между аминогруппой AMC и карбоксильной группой аргинина. После расщепления амидной связи посредством катепсина L высвобождаемая группа AMC является флуоресцентной и ее можно измерять посредством длины волны возбуждения и излучения 380 нм и 460 нм соответственно. Определенную активность катепсина L используют как показатель количества прокатепсина L в материале, полученном из экспрессирующей системы клеток млекопитающих, например клеток яичников китайского хомяка (CHO).
В одном варианте осуществления первый элюат обладает активностью катепсина L в диапазоне между приблизительно 25 и приблизительно 60 RFU/сек/мг антитела. В другом варианте осуществления первый проскок обладает активностью катепсина L в диапазоне между приблизительно 0,4 и приблизительно 4 RFU/сек/мг антитела. В одном варианте осуществления второй элюат обладает активностью катепсина L в диапазоне между приблизительно 0,5 и приблизительно 1,5 RFU/сек/мг антитела.
Изобретение относится также к диапазонам, промежуточным для указанных выше количеств, также предназначенным, чтобы являться частью этого изобретения. Например, диапазоны величин с применением сочетания любых из указных выше величин в качестве верхних и/или нижних пределов предназначены для включения сюда так же, как любое число между описанными диапазонами.
Изобретение относится к любым из вышеупомянутых модификаций, по отдельности или в сочетании друг с другом.
VI. Фармацевтические композиции
Антитела, полученные с использованием способа по изобретению, можно вводить в фармацевтические композиции, пригодные для введения субъекту. Как правило, фармацевтическая композиция содержит антитело или его антигенсвязывающую часть и фармацевтически приемлемый носитель. Как применяют здесь, «фармацевтически приемлемый носитель» включает в себя все без исключения растворители, дисперсионные среды, оболочки, антибактериальные и противогрибковые средства, изотонические и задерживающие абсорбцию агенты и тому подобное, которые являются физиологически совместимыми. Примеры фармацевтически приемлемых носителей включают в себя один или несколько из воды, солевого раствора, фосфатно-солевой буфер, глюкозу, глицерин, этанол и тому подобное, а также их сочетания. Во многих случаях является предпочтительным включить в композицию изотонические средства, например сахара, многоатомные спирты, такие как маннит, сорбит или хлорид натрия. Фармацевтически приемлемые носители могут дополнительно содержать минорные количества вспомогательных веществ, таких как увлажняющие или эмульгирующие средства, консерванты или буферы, которые увеличивают время хранения или эффективность антитела или его антигенсвязывающей части.
Фармацевтические композиции, содержащие антитела или их антигенсвязывающие части, очищенные с использованием способов по изобретению, могут находиться в различных формах. Они включает в себя, например, жидкие, полутвердые и твердые лекарственные формы, такие как жидкие растворы (например, растворы, пригодные для инъекций и инфузий), дисперсии или суспензии, таблетки, пилюли, порошки, липосомы и суппозитории. Предпочтительная форма зависит от предлагаемого способа введения и терапевтического применения. Типичные предпочтительные композиции присутствуют в форме растворов, пригодных для инъекций или инфузий, например композиции, сходные с композициями, применяемыми для пассивной иммунизации человека другими антителами или другими ингибиторами TNFα. Предпочтительным способом введения является парентеральный (например, внутривенный, подкожный, внутрибрюшинный, внутримышечный). В предпочтительном варианте осуществления антитело вводят внутривенной инфузией или инъекцией. В другом предпочтительном варианте осуществления антитело вводят внутримышечной или подкожной инъекцией.
Терапевтические композиции, как правило, должны являться стерильными и стабильными в условиях производства и хранения. Композиции можно составлять в виде раствора, микроэмульсии, дисперсии, липосомы или другой упорядоченной структуры, подходящей для высокой концентрации лекарственного средства. Стерильные растворы для инъекций можно получить введением активного соединения (т.е. антитела или его антигенсвязывающей части) в необходимом количестве в соответствующий растворитель с одним или сочетанием перечисленных выше ингредиентов, как необходимо, с последующей стерилизацией посредством фильтрации. Как правило, дисперсии получают введением активного соединения в стерильный носитель, который содержит дисперсионную среду-основу и другие необходимые ингредиенты из перечисленных выше. В случае стерильных порошков для получения стерильных растворов для инъекции предпочтительными способами получения являются сушка в вакууме и лиофилизация, с помощью которых получают порошок активного ингредиента с любым дополнительным желательным ингредиентом из его предварительного стерилизованного фильтрацией раствора. Соответствующую текучесть раствора можно поддерживать, например, посредством использования покрытия, такого как лецитин, поддержания необходимого размера частиц в случае дисперсии и использования поверхностно-активных веществ. Замедленного всасывания композиций для инъекции можно достигать включением в композицию средства, замедляющего поглощение, например солей моностеарата и желатина.
В композиции можно включать также дополнительные активные соединения. В конкретных вариантах осуществления антитело или его антигенсвязывающую часть для применения в способах по изобретению составляют совместно и/или вводят совместно с одним или несколькими дополнительными терапевтическими средствами. Например, антитело против hTNFα или часть антитела по изобретению можно составлять совместно и/или вводить совместно с одним или несколькими DMARD или с одним или несколькими NSAID, или с одним или несколькими дополнительными антителами, которые связывают другие мишени (например, антитела, которые связывают другие цитокины или связывают молекулы поверхности клетки), с одним или несколькими цитокинами, с растворимым рецептором TNF (смотри, например, публикацию PCT № WO 94/06476), и/или с одним или несколькими химическими средствами, которые ингибируют продукцию или активность hTNFα (такими как производные циклогексанилидена, как описано в публикации РСТ № WO 93/19751), или с любым их сочетанием. Более того, одно или несколько антител по изобретению можно использовать в сочетании с двумя или более из вышеупомянутых терапевтических средств. В таких способах комбинированной терапии можно преимущественно использовать низкие дозы вводимых терапевтических средств, избегая таким образом возможных побочных эффектов, токсичности осложнений или низкого уровня ответа пациента, связанных с различными способами монотерапии.
В одном варианте осуществления изобретение относится к фармацевтическим композициям, содержащим эффективное количество антитела против TNFα или его антигенсвязывающей части и фармацевтически приемлемый носитель, где эффективное количество антитела против TNFα может являться эффективным для лечения связанного с TNFα нарушения, включая, например, болезнь Крона. В одном варианте осуществления антитело или часть антитела вводят в фармацевтический состав, как описано в PCT/IB03/04502 и US Appln. № 10/222140, приведенных здесь в качестве ссылки. Этот состав содержит антитело адалимумаб в концентрации 50 мг/мл, где один предварительно заполненный шприц содержит 40 мг антитела для подкожной инъекции.
Антитела или части антител, полученные с использованием способов по настоящему изобретению, можно вводить множеством способов, известных в данной области, хотя для многих терапевтических применений предпочтительным путем/способом введения является подкожная инъекция. В другом варианте осуществления введение осуществляют посредством внутривенной инъекции или инфузии. Как будет понятно специалисту в данной области, путь и/или способ введения будет меняться в зависимости от желательных результатов. В конкретных вариантах осуществления активное соединение можно получать с носителем, который будет защищать соединение от быстрого высвобождения, таким как состав с контролируемым высвобождением, включая имплантаты, чрескожные пластыри и микроинкапсулированные системы доставки. Можно использовать биоразлагаемые, биологически совместимые полимеры, такие как этилен-винил-ацетат, полиангидриды, полигликолевую кислоту, коллаген, полиортоэфиры и полимолочную кислоту. Множество способов получения таких составов запатентованы или широко известны специалистам в данной области. Смотри, например, Sustained and Controlled Release Drug Delivery Systems, J.R. Robinson, ed., Marcel Dekker, Inc., New York, 1978.
Антитела или их антигенсвязывающие части, полученные с использованием способов по изобретению, можно вводить также в форме кристаллических составов белка, которые содержат сочетание кристаллов белка, инкапсулированных в полимерном носителе для получения частиц с покрытием. Частицы с покрытием из кристаллического состава белка могут обладать сферической морфологией и представлять собой микросферы вплоть до 500 микрометров в диаметре, или они могут обладать какой-либо другой морфологией и представлять собой микрочастицы. Увеличенная концентрация кристаллов белка позволяет вводить антитело по изобретению подкожно. В одном варианте осуществления антитела по изобретению вводят посредством системы доставки белка, где один или несколько составов или композиций кристаллов белка вводят субъекту со связанным с TNFα нарушением. Композиции и способы получения стабилизированных составов кристаллов целого антитела или кристаллов фрагментов антитела описаны также в WO 02/072636, приведенной здесь в качестве ссылки. В одном варианте осуществления состав, содержащий кристаллизованные фрагменты антитела, описанные в PCT/IB03/04502 и US Appln. № 10/222140, приведенных здесь в качестве ссылки, используют для лечения связанного с TNFα нарушения с использованием способов множественной переменной дозы по изобретению.
В конкретных вариантах осуществления антитела или их антигенсвязывающие части, полученные с использованием способов по изобретению, можно вводить перорально, например, с инертным растворителем или усваиваемым съедобным носителем. Соединение (и другие ингредиенты, если желательно) можно также заключать в желатиновую капсулу с твердой или мягкой оболочкой, прессовать в таблетки или вводить непосредственно в диету субъекта. Для перорального терапевтического введения соединения можно вводить с наполнителями и использовать в форме проглатываемых таблеток, трансбуккальных таблеток, буккальных таблеток, лепешек, капсул, эликсиров, суспензий, сиропов, облаток и т.п. Чтобы ввести соединение по изобретению иначе, чем парентеральным введением, может быть необходимым покрыть соединение материалом для предотвращения его инактивации или ввести соединение совместно с ним.
Фармацевтические композиции по изобретению могут содержать «терапевтически эффективное количество» или «профилактически эффективное количество» антитела или его антигенсвязывающей части по изобретению. «Терапевтически эффективное количество» обозначает количество, эффективное в необходимых дозах и в течение необходимых периодов времени, для достижения желаемого терапевтического результата. Терапевтически эффективное количество антитела или его антигенсвязывающей части по изобретению может меняться в соответствии с такими факторами, как стадия заболевания, возраст, пол и масса индивидуума, и способность антитела, части антитела, другого ингибитора TNFα стимулировать желательный ответ у индивидуума. Терапевтически эффективным количеством является также количество, для которого любые токсические или неблагоприятные эффекты антитела или его антигенсвязывающей части перевешиваются терапевтически благоприятными эффектами. «Профилактически эффективное количество» обозначает количество, эффективное в необходимых дозах и в течение необходимых периодов времени, для достижения желаемого профилактического результата. Как правило, поскольку профилактическую дозу используют у субъектов до заболевания или на более ранней его стадии, профилактически эффективное количество будет меньше, чем терапевтически эффективное количество.
Режимы дозирования можно регулировать для обеспечения оптимального желаемого ответа (например, терапевтического или профилактического ответа). Например, можно однократно вводить болюс, можно вводить несколько раздельных доз в течение времени, или можно пропорционально уменьшать или увеличивать дозу, как показано по острой необходимости в терапевтической ситуации. Особенно благоприятно составлять парентеральные композиции в форме единицы дозирования для простоты введения и однородности дозирования. Форма единицы дозирования, как применяют здесь, обозначает физически дискретные единицы, служащие однократными дозами для субъектов - млекопитающих, подлежащих лечению; каждая единица содержит предопределенное количество активного соединения, рассчитанное для получения желательного терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Требования к формам единиц дозирования по изобретению продиктованы и напрямую обусловлены (a) уникальными характеристиками активного соединения и конкретного терапевтического или профилактического эффекта, подлежащего достижению, и (b) ограничениями, принятыми в области изготовления лекарств, такими как чувствительность индивидуумов к активному соединению для лечения.
Примерный неограничивающий диапазон терапевтически или профилактически эффективного количества антитела или его антигенсвязывающей части составляет 10-200 мг, более предпочтительно 20-160 мг, более предпочтительно 40-80 мг и наиболее предпочтительно 80 мг. В одном варианте осуществления терапевтически эффективное количество антитела или его антигенсвязывающей части составляет приблизительно 20 мг. В другом варианте осуществления терапевтически эффективное количество антитела или его части составляет приблизительно 40 мг. В другом варианте осуществления терапевтически эффективное количество антитела или его антигенсвязывающей части составляет приблизительно 80 мг. В одном варианте осуществления терапевтически эффективное количество антитела или его части для применения в способах по изобретению составляет приблизительно 120 мг. В другом варианте осуществления терапевтически эффективное количество антитела или его антигенсвязывающей части составляет приблизительно 160 мг. Диапазоны, промежуточные для вышеуказанных доз, например от приблизительно 78,5 до приблизительно 81,5; от приблизительно 15 до приблизительно 25; от приблизительно 30 до приблизительно 50; от приблизительно 60 до приблизительно 100; от приблизительно 90 до приблизительно 150; от приблизительно 120 до приблизительно 200, также предназначены, чтобы являться частью этого изобретения. Например, диапазоны величин с использованием сочетания любых из вышеуказанных величин в качестве верхнего и/или нижнего пределов предназначены для включения сюда.
Следует отметить, что величины дозы могут меняться с типом и тяжестью состояния, подлежащего облегчению. Кроме того, понятно, что для любого конкретного субъекта конкретные режимы дозирования следует корректировать с течением времени согласно нуждам индивидуума и профессионального суждения лица, вводящего композиции или руководящего их введением, и что приведенные здесь диапазоны дозирования являются только примерными и не предназначены для ограничения объема или практического применения заявленной композиции.
Антитела или части антител, полученные с использованием способов по изобретению, можно вводить в режиме дозирования дважды в неделю, как описано в WO 02/100330, в режиме низкой дозы, как описано в WO 04/037205, и множественной переменной дозы, как описано в WO 05/110452, каждая из которых приведена здесь в качестве ссылки.
Изобретение относится также к упакованным фармацевтическим композициям, изделиям или наборам, содержащим антитело или его антигенсвязывающую часть, полученные с использованием способа по изобретению. Изделие может содержать антитело или его антигенсвязывающую часть, полученную с использованием способа по изобретению, и упаковочный материал. Изделие может содержать также этикетку или вкладыш, указывающие, что состав или композиция, содержащая антитело или его антигенсвязывающую часть, обладает уменьшенным уровнем HCP и/или прокатепсина L. Изделие может содержать этикетку или вкладыш, содержащиеся внутри упаковочного материала, указывающие, что состав с адалимумабом содержит не более чем приблизительно 70 нг/мг HCP, или этикетку или вкладыш, содержащиеся внутри упаковочного материала, указывающие, что состав с адалимумабом содержит не более чем приблизительно 13 нг/мг. Изделие может содержать этикетку или вкладыш, содержащиеся внутри упаковочного материала, указывающие, что состав с адалимумабом содержит не более чем приблизительно 5 нг HCP/мг адалимумаба. Изделие может содержать также упаковочный материал, указывающий, что состав с адалимумабом содержит уровень прокатепсина L, не превышающий тот, на который указывает активность катепсина L приблизительно 3,0 RFU/сек/мг адалимумаба.
VII. Способы лечения
Изобретение относится к способу получения препарата антитела с уменьшенным уровнем HCP или прокатепсина L, который можно использовать для ингибирования активности TNFα у субъекта, страдающего от нарушения, при котором активность TNFα является неблагоприятной. TNFα вовлечен в патофизиологию широкого ряда нарушений (смотри, например, Moeller, A., et al. (1990) Cytokine 2:162-169; патент США № 5231024 Moeller et al; европейская патентная заявка № 260610 B1 Moeller, A.). TNFα вовлечен в патофизиологию широкого ряда связанных с TNFα нарушений, включая сепсис, инфекции, аутоиммунные заболевания, отторжение трансплантата и заболевание трансплантат против хозяина (смотри, например, Moeller, A., et al. (1990) Cytokine 2:162-169; патент США № 5231024 Moeller et al., Европейская патентная публикация № 260610 B1 Moeller, A., et al. Vasilli, P. (1992) Annu. Rev. Immunol. 10:411-452; Tracey, K.J. and Cerami, A. (1994) Annu. Rev. Med.45:491-503). Изобретение относится к способам получения препарата антитела с уменьшенным уровнем HCP или прокатепсина L, который является благоприятным для ингибирования активности TNFα у субъекта, страдающего от связанного с TNFα нарушения, где способ включает в себя введение субъекту начальной индуцирующей дозы и последующее введение лечебной дозы антитела или его антигенсвязывающего фрагмента, так что ингибируют активность TNFα. Предпочтительно, TNFα представляет собой TNFα человека, и субъект представляет собой человека. В одном варианте осуществления ингибитор TNFα представляет собой адалимумаб, обозначенный так же как HUMIRA® (D2E7).
Как применяют здесь, термин «нарушение, при котором активность TNFα является неблагоприятной», предназначен, чтобы включать в себя заболевания и другие нарушения, при которых было продемонстрировано или предположено, что присутствие TNFα у субъекта, страдающего от нарушения, либо является ответственным за патофизиологию нарушения, либо является фактором, вносящим вклад в ухудшение нарушения. Соответственно, нарушение, при котором активность TNFα является неблагоприятной, представляет собой нарушение, при котором ожидают, что ингибирование активности TNFα будет облегчать симптомы и/или прогрессирование нарушения. Такие нарушения можно подтверждать, например, по увеличению концентрации TNFα в биологической жидкости субъекта, страдающего от нарушения (например, увеличению концентрации TNFα в сыворотке, плазме, синовиальной жидкости и тому подобном субъекта), которое можно детектировать, например, с использованием антитела против TNFα, как описано выше. Существуют многочисленные примеры нарушений, при которых активность TNFα является неблагоприятной. Применение антител и частей антител против TNFα, полученных с использованием способов по изобретению, для лечения конкретных нарушений, обсуждают далее ниже.
A. Сепсис
Установлено, что фактор некроза опухоли играет роль в патофизиологии сепсиса с биологическими эффектами, включающими в себя гипотензию, ослабление миокарда, синдром подтекания сосудов, некроз органов, стимуляцию высвобождения токсических вторичных медиаторов и активацию каскада свертывания крови (см., например, Moeller A., et al. (1990), Cytokine 2:162-169; патент США № 5231024 Moeller et al.; Европейская патентная публикация № 260610 В1 Moeller A.; Tracey K.J. and Cerami A. (1994) Annu. Rev. Med. 45:491-503; Russel D. and Thompson R.C. (1993) Curr. Opin. Biotech. 4:714-721). Способы множественной переменной дозы по изобретению можно использовать для лечения сепсиса в любом из его клинических проявлений, включая септический шок, эндотоксический шок, сепсис, вызываемый грамотрицательными бактериями, и синдром токсического шока.
Более того, для лечения сепсиса антитело и фрагменты антитела против hTNFα, полученные с использованием способа по изобретению, можно вводить вместе с одним или несколькими дополнительными терапевтическими средствами, которые могут дополнительно облегчать сепсис, такими как ингибитор интерлейкина-1 (такой, как описанные в публикациях РСТ № WO 92/16221 и WO 92/17583), цитокин интерлейкин-6 (смотри, например, публикацию РСТ № WO 93/11793) или антагонист фактора активации тромбоцитов (смотри, например, европейскую патентную заявку № EP 374510). В предпочтительном варианте осуществления антитело или часть антитела против TNFα вводят человеку из подгруппы пациентов с сепсисом с концентрацией IL-6 в сыворотке или плазме более 500 пг/мл и, более предпочтительно, 1000 пг/мл на момент лечения (см. публикацию РСТ № WO 95/20978 Daum L. et al.).
B. Аутоиммунные заболевания
Установлено, что фактор некроза опухоли играет роль в патофизиологии ряда аутоиммунных заболеваний. Например, TNFα вовлечен в активацию воспаления тканей и вызывает разрушение суставов при ревматоидном артрите (смотри, например, Moeller A. et al. (1990), Cytokine 2:162-169; патент США № 5231024 Moeller et al.; европейскую патентную публикацию № 260610 В1 Moeller A.; Tracey K.J. and Cerami A., выше; Arend W.P. and Dayer J-M. (1995) Arth. Rheum. 38:151-160; Fava R.A. et al. (1993) Clin. Exp. Immunol. 94:261-266). TNFα вовлечен также в стимуляцию гибели клеток островков и в опосредовании устойчивости к инсулину при диабете (смотри, например, Tracey and Cerami, выше; публикацию РСТ № WO 94/08609). TNFα вовлечен также в опосредование цитотоксичности для олигодендроцитов и индукцию воспалительных бляшек при рассеянном склерозе (смотри, например, Tracey and Cerami, выше). Химерные и гуманизированные мышиные антитела против hTNFα прошли клиническое тестирование для лечения ревматоидного артрита (смотри, например, Elliot M.J. et al. (1994); Lancet 344:1125-1127; Elliot M.J. et al. (1994) Lancet 344:1105-1110; Rankin E.C. et al. (1995) Br. J. Rheumatol. 34:334-342).
Антитела против TNFα, такие как адалимумаб, можно использовать для лечения аутоиммунных заболеваний, в частности, связанных с воспалением. Примеры таких аутоиммунных состояний включают в себя ревматоидный артрит, ревматоидный спондилит, остеоартрит и подагрический артрит, аллергию, рассеянный склероз, аутоиммунный диабет, аутоиммунный увеит и нефротический синдром. Другие примеры аутоиммунных состояний включают в себя мультисистемные аутоиммунные заболевания и аутоиммунную потерю слуха.
Как правило, антитело или часть антитела вводят системно, хотя для определенных нарушений может являться благоприятным местное введение антитела или части антитела в участке воспаления (например, местное введение в суставы при ревматоидном артрите или наружное применение при диабетических язвах, отдельно или в сочетании с производным циклогексанилидена, как описано в публикации РСТ № WO 93/19751). TNFα ингибиторы, включая антитела и части антител человека, такие как D2E7, можно вводить также с одним или несколькими дополнительными терапевтическими средствами, применяемыми при лечении аутоиммунных заболеваний многократной меняющейся дозой, как обсуждают далее ниже.
В одном варианте осуществления изобретения антитело против TNFα, полученное с использованием способов по изобретению, применяют для лечения аутоиммунных нарушений, таких как волчанка. Показано, что волчанка связана с активностью TNF (Shvidel et al. (2002) Hematol J. 3:32; Studnicka-Benke et al. (1996) Br J Rheumatol. 35:1067). Термин «волчанка», как применяют здесь, относится к хроническому воспалительному аутоиммунному нарушению, называемому красной волчанкой, которое может повреждать многие системы органов, включая кожу, суставы и внутренние органы. Волчанка представляет собой общий термин, который включает в себя ряд специфических типов волчанки, включая системную волчанку, волчаночный нефрит и церебральную волчанку. При системной волчанке (SLE) естественная защита организма обращается против организма, и уклоняющиеся иммунные клетки атакуют ткани организма. Могут продуцироваться антитела, которые могут проявлять реакцию против клеток крови, органов и тканей организма. Эта реакция приводит к тому, что иммунные клетки атакуют поврежденные системы, приводя к хроническому заболеванию. Волчаночный нефрит, обозначаемый так же как гломерулярное заболевание при волчанке, представляет собой повреждение почек, которое обычно является осложнением SLE и характеризуется разрушением клубочка и прогрессирующей потерей функции почек. Церебральная волчанка относится к другому осложнению SLE, которое представляет собой воспаление в мозге и/или центральной нервной системе.
Другое аутоиммунное заболевание, которое можно лечить с использованием антитела против TNFα, представляет собой болезнь Крона, более подробно описанную ниже в разделе «Нарушения желудочно-кишечного тракта».
C. Инфекционные заболевания
Фактор некроза опухоли вовлечен в опосредование биологических эффектов, наблюдаемых при ряде инфекционных болезней. Например, TNFα вовлечен в опосредование воспаления головного мозга и тромбоза капилляров и инфаркта при малярии. TNFα вовлечен также в опосредование воспаления головного мозга, индукцию повреждения гематоэнцефалического барьера, запускание синдрома септического шока и активацию венозного инфаркта при менингите. TNFα вовлечен также в индукцию кахексии, стимуляцию пролиферации вирусов и опосредование повреждений центральной нервной системы при синдроме приобретенного иммунодефицита (СПИД). Соответственно, антитела и части антител, направленные против TNF, можно использовать для лечения инфекционных болезней, включая бактериальный менингит (смотри, например, публикацию европейской патентной заявки № ЕР 585705), церебральную малярию, СПИД и СПИД-ассоциированный комплекс (ARC) (смотри, например, публикацию европейской патентной заявки № ЕР 230574), а также вторичную инфекцию цитомегаловируса при трансплантации (смотри, например, Fietze et al. (1994) Transplantation 58:675). Антитела и части антител по изобретению можно использовать для облегчения симптомов, связанных с инфекционными заболеваниями, включая лихорадку и миалгии, обусловленные инфекцией (такой как грипп), и вторичную кахексию при инфекции (например, вторичную по отношению к СПИД или ARC).
D. Трансплантация
Фактор некроза опухоли вовлечен как ключевой медиатор в отторжение трансплантата и заболевание трансплантат против хозяина (GVHD) и в опосредование побочной реакции, которую наблюдали, когда антитело крысы ОКТЗ, направленное против комплекса Т-клеточный рецептор - CDR, использовали для ингибирования отторжения трансплантатов почек (смотри, например, Eason et al. (1995) Transplantation 59:300; Suthanthiran and Strom (1994) New Engl. J. Med. 331:365). Соответственно, антитела и части антител по изобретению можно использовать для ингибирования отторжения трансплантата с использованием лечения многократной меняющейся дозой, включая отторжение аллотрансплантатов и ксенотрансплантатов, и для ингибирования GVHD. Хотя антитело или часть антитела можно использовать по отдельности, более предпочтительно их использование в сочетании с одним или несколькими средствами, которые ингибируют иммунный ответ против аллотрансплантата или ингибируют GVHD. Например, в одном варианте осуществления антитело или часть антитела по изобретению используют в сочетании с одним или несколькими антителами, направленными на другие мишени, вовлеченными в регуляцию иммунных ответов, такие как молекулы поверхности клетки CD25 (рецептор-α интерлейкина-2), CD11a (LFA-1), CD54 (ICAM-1), CD4, CD45, CD28/CTLA4, CD80 (В7-1) и/или CD86 (В7-2). В другом варианте осуществления антитело или часть антитела по изобретению используют в сочетании с одним или несколькими общими иммуносупрессирующими средствами, такими как циклоспорин А или FK506.
E. Злокачественные новообразования
Фактор некроза опухоли вовлечен в индукцию кахексии, стимуляцию роста опухоли, усиление метастатического потенциала и опосредование цитотоксичности при злокачественных новообразованиях. Соответственно, антитела и части антител, направленные против TNF, можно использовать при лечении злокачественных новообразований, где лечение ингибирует рост или метастазирование опухоли и/или облегчает вторичную кахексию при злокачественных новообразованиях. Антитело или часть антитела можно вводить системно или местно в области опухоли.
F. Легочные нарушения
Фактор некроза опухоли вовлечен в патофизиологию респираторного дистресс-синдрома взрослых (ARDS), включая стимуляцию активации эндотелиальных лейкоцитов, направленность цитотоксичности на пневмоциты и индукцию синдрома подтекания сосудов. Антитело, полученное с использованием способов по изобретению, можно использовать при лечении различных легочных нарушений, включая респираторный дистресс-синдром взрослых (смотри, например, публикацию РСТ № WO 91/04054), легочный шок, хроническое легочное воспалительное заболевание, легочный саркоидоз, легочный фиброз и силикоз. Антитело или часть антитела можно вводить системно или местно на поверхность легких, например, в виде аэрозоля. Антитело или часть антитела можно вводить также с одним или несколькими дополнительными терапевтическими средствами, используемыми при лечении легочных нарушений, как обсуждают далее ниже.
Другие примеры легочных нарушений, в патофизиологию которых вовлечен TNFα, включают в себя идиопатическое интерстициальное заболевание легких и хронические обструктивные нарушения дыхательных путей (смотри, например, Piquet et al (1989) J Exp Med. 170:655; Whyte et al. (2000) Am J Respir Crit Care Med. 162:755; Anticevich et al. (1995) Eur J Pharmacol. 284:221). Кроме того, изобретение относится к способам лечения против активности TNFα у субъекта, страдающего от такого легочного нарушения, где способ включает в себя введение субъекту антитела или части антитела, так что ингибируют активность TNFα у субъекта, страдающего идиопатическим интерстициальным заболеванием легких или хроническим обструктивным нарушением дыхательных путей. Примеры идиопатических интерстициальных заболеваний легких и хронических обструктивных нарушений дыхательных путей, при которых активность TNFα является неблагоприятной, обсуждают далее ниже.
1. Идиопатическое интерстициальное заболевание легких
В одном варианте осуществления антитело против TNFα, полученное с использованием способа по изобретению, используют для лечения субъектов, страдающих идиопатическим интерстициальным заболеванием легких. Термин «идиопатический фиброз легких» или «IPF» относится к группе нарушений, характеризующихся воспалением и, в конечном счете, образованием рубцов на глубоких тканях легких, приводящим к затруднению дыхания. Образование рубцов на альвеолах (альвеолярных мешочках) и поддерживающих их структурах (интерстиции) при IPF в конечном счете приводит к потере функциональных альвеолярных единиц и уменьшению переноса кислорода из воздуха в кровь. IPF обозначают так же как диффузное паренхиматозное заболевание легких; альвеолит; криптогенный фиброзирующий альвеолит (CFA); идиопатический пневмонит легких (IPP) и обычный интерстициальный пневмонит (UIP). IPF часто используют как синонимы с UIP («DPF/UTP»), поскольку UIP представляет собой наиболее общую клеточную картину, наблюдаемую при патологическом диагнозе IPF.
Идиопатические интерстициальные заболевания легких поражают легкие тремя путями: во-первых, ткань легких повреждается некоторым известным или неизвестным образом; во-вторых, стенки альвеолярных мешочков легких становятся воспаленными; и наконец, образование рубцов (или фиброз) начинается в интерстиции (или ткани между альвеолярными мешочками), и легкие становятся жесткими. Примеры идиопатических интерстициальных заболеваний легких включают в себя идиопатический фиброз легких (IPF). Фактор некроза опухоли вовлечен в патофизиологию идиопатического фиброза легких (IPF) (смотри Piquet et al. (1989) J Exp Med. 170:655; Whyte et al (2000) Am J Respir Crit Care Med 162:755 Corbett et al. (2002) Am J Respir Crit Care Med. 165:690). Например, обнаружено, что пациенты с IPF обладают увеличенными уровнями экспрессии TNF в макрофагах и в эпителиальных клетках типа II (Piquet et al. (1993) Am J Pathol 143:651; Nash et al (1993) Histopathology 22:343; Zhang et al (1993) J Immunol 150:4188). Конкретные генетические полиморфизмы также ассоциированы с увеличенной экспрессией TNF и вовлечены в то, что он играет роль при IPF и силикозе (Whyte et al., выше; Corbett et al, выше).
У пациентов с IPF часто проявляются конкретные симптомы, включая сухой кашель, боль в груди и/или затруднение дыхания. Общепринятыми лекарственными средствами для лечения IPF являются преднизон и цитоксан, хотя только у части пациентов есть улучшения при продолжительном применении этих лекарственных средств (American Thoracic Society (2000) Am. J. Respir. Crit. Care Med. 161:646). Введение кислорода и трансплантация легкого представляют собой другие выборы для лечения. В одном варианте осуществления антитела, полученные посредством способов по изобретению, можно использовать в сочетании с другим лекарственным средством, например кислородом, для лечения идиопатического фиброза легких.
Примеры моделей на животных, применяемых для изучения идиопатического интерстициального заболевания легких и хронических обструктивных нарушений дыхательных путей, включают в себя индуцированную овальбумином (OVA) аллергическую астму у мышей и индуцированное сигаретным дымом хроническое обструктивное заболевание легких у мышей (смотри Hessel et al (1995) Eur J Pharmacol. 293:401; Keast et al. (1981) J. Pathol. 135:249).
2. Хроническое обструктивное нарушение дыхательных путей
В одном варианте осуществления антитело против TNFα применяют для лечения субъекта, страдающего хроническим обструктивным нарушением дыхательных путей. При этих заболеваниях обструкция дыхательных путей может являться хронической и персистентной или эпизодической и рецидивирующей. Обструкцию дыхательных путей обычно определяют посредством форсированной спирометрии, которая представляет собой регистрацию выдыхаемого объема в зависимости от времени во время максимального выдоха. У субъекта без обструкции дыхательных путей полный форсированный выдох обычно занимает между 3 и 4 секундами. У пациента с хроническим обструктивным нарушением дыхательных путей, где присутствует обструкция дыхательных путей, он обычно занимает вплоть до 15-20 секунд и может являться ограниченным посредством времени задержки дыхания. Нормальный объем форсированного выдоха в первую секунду выдоха (FEV1) легко измерить и точно предсказать на основании возраста, пола и роста. Отношение FEV1 к форсированной жизненной емкости легких (FEV1/FVC) в норме превышает 0,75. Регистрация потока воздуха в зависимости от объема во время форсированного выдоха и последующего форсированного вдоха - цикл поток-объем - также является применимой, в основном, чтобы отличить верхнее сужение дыхательных путей от нижнего. Примеры хронических обструктивных нарушений дыхательных путей описаны ниже.
a. Астма
Фактор некроза опухоли вовлечен в патофизиологию астмы (Anticevich et al. (1995) Eur J Pharmacol. 284:221; Thomas et al 1995. Am J Respir Crit Care Med. 152:76; Thomas and Heywood (2002) Thorax. 57:774). Например, обнаружено, что острые приступы астмы связаны с легочной нейтрофилией и повышенными уровнями BAL TNF (Ordonez et al. (2000) Am J Respir Crit Care Med 161:1185). Обнаружено, что тяжесть симптомов астмы коррелирует с уровнями эндотоксина в домашней пыли. У крыс антитела против TNF уменьшали индуцированные эндотоксином изменения дыхательных путей (Kips et al. (1992) Am Rev Respir Dis 145:332).
Термин «астма», как применяют здесь, относится к нарушению, при котором воспаление дыхательных путей вызывает ограничение потока воздуха в легкие и из легких. Астму также обозначают как бронхиальную астму, вызванную нагрузкой астму - бронхиальную, и реактивное заболевание дыхательных путей (RAD). В некоторых случаях астма связана с аллергией и/или является семейной. Астма включает в себя состояние, которое характеризуется обширными изменениями диаметра или толщины бронхиальных дыхательных путей в течение коротких периодов времени, что приводит к изменениям функции легких. Полученная увеличенная устойчивость к потоку воздуха вызывает у пораженного субъекта симптомы, включающие в себя одышку (диспноэ), сжатие или «стесненность» в груди и свистящее дыхание.
Астму у пациентов, охарактеризованных согласно рекомендациям NIH, описывают как умеренную интермиттирующую, умеренную персистирующую, персистирующую средней тяжести и тяжелую персистирующую (смотри NAEPP Expert Panel Report Guidelines for the Diagnosis and Management of Asthma-Update on Selected Topics 2002. JACI 2002; 110: S141-S209; Guidelines for the Diagnosis and Management of Asthma. NIH Publication 97-4051, July 1997). Пациентов с диагнозом персистирующая астма средней тяжести часто лечат ингаляцией кортикостероидов. Пациентов с диагнозом тяжелая персистирующая астма часто лечат ингаляцией высокой дозы кортикостероидов и p.o. кортикостероидами.
b. Хроническое обструктивное заболевание легких (COPD)
Фактор некроза опухоли вовлечен в патофизиологию хронического обструктивного заболевания легких (Keatings (2000) Chest. 118:971; Sakao et al. ( 2001 ) Am J Respir Crit Care Med. 163:420; Sakao et al. (2002) Chest. 122:416). Термин «хроническое обструктивное заболевание легких» или «COPD», как применяют здесь взаимозаменяемо, относится к группе заболеваний легких, характеризующихся ограниченным потоком воздуха с различными степенями увеличения альвеолярных мешочков и разрушения ткани легких. Термин COPD включает в себя хронический бронхит (повышенная секреция слизи с гиперплазией бокаловидных клеток подслизистой железы), хронический обструктивный бронхит или эмфизему (разрушение паренхимы дыхательных путей), или сочетание этих состояний. Эмфизема и хронический бронхит являются наиболее распространенными формами хронического обструктивного заболевания легких. COPD определяют как необратимую обструкцию дыхательных путей.
При COPD хроническое воспаление приводит к постоянному сужению малых дыхательных путей и паренхимы легких и разрушению альвеолярной стенки (эмфиземе). Это характеризуется увеличением числа альвеолярных макрофагов, нейтрофилов и цитотоксических T-лимфоцитов и высвобождением множества медиаторов воспаления (липиды, хемокины, цитокины, факторы роста). Это воспаление приводит к фиброзу с сужением малых дыхательных путей и разрушению паренхимы легких. Присутствует также высокий уровень окислительного стресса, который может усиливать это воспаление.
G. Нарушения желудочно-кишечного тракта
Фактор некроза опухоли вовлечен в патофизиологию воспалительных кишечных нарушений, включая болезнь Крона (смотри, например, Tracy et al. (1986) Science 234:470; Sun et al. (1988) J. Clin. Invest. 81:1328; MacDonald et al (1990) Clin. Exp. Immunol. 81:301). Химерные мышиные антитела против hTNFα прошли клиническое тестирование для лечения болезни Крона (van Dullemen et al. (1995) Gastroenterology 109:129). Изобретение относится к лечению, включающему в себя введение антитела против TNFα, полученного с использованием способа по изобретению, для лечения нарушений желудочно-кишечного тракта, таких как воспалительное заболевание кишечника, с использованием антител человека или их антигенсвязывающих фрагментов. Идиопатическое воспалительное заболевание кишечника включает в себя два синдрома - болезнь Крона и язвенный колит. В одном варианте осуществления антитело, полученное с использованием способа по изобретению, используют также для лечения нарушений, часто связанных с IBD и болезнью Крона. Термин «нарушение, связанное с воспалительным заболеванием кишечника (IBD)» или «нарушение, связанное с болезнью Крона», как применяют взаимозаменяемо здесь, используют для описания состояний и осложнений, обычно связанных с IBD и болезнью Крона.
Изобретение относится к режиму множественной переменной дозы, включающему в себя введение антитела против TNFα для лечения болезни Крона. Лечение болезни Крона основывается на локализации, степени и тяжести заболевания. Фармакологические вмешательства включают в себя противовоспалительные средства (аминосалицилаты и кортикостероиды) и иммуномодулирующие средства (азатиоприн и 6-меркаптопурин [6-MP], циклоспорин, метотрексат [MTX], антибиотические средства и биологические средства). Уровни C-реактивного белка (CRP) и скорости оседания эритроцитов (ESR) отражают неспецифические реакции в острой фазе. Эндоскопия является первичным средством диагностики болезни Крона. Радиологические признаки болезни Крона, показанные по исследованию с барием, включают в себя отек слизистых оболочек, афтоз и линейные изъязвления, асимметрические сужение и стриктуры и разделение соседних петель кишечника, вызванное утолщением брыжейки. Аномалии являются фокальными и асимметричными. Первичным гистологическим поражением является афтозная язва. Субъектов с болезнью Крона можно оценивать с использованием индекса активности болезни Крона (CDAI), который является стандартным критерием тяжести заболевания, где более высокие показатели указывают на более тяжелую активность заболевания.
Примеры нарушений, связанных с болезнью Крона, которые можно лечить с использованием способов по изобретению, включают в себя фистулы мочевого пузыря, вагины и кожи; обструкции кишечника; абсцессы; дефицит питательных веществ; осложнения от использования кортикостероидов; воспаление суставов; узловатую эритему; гангренозную пиодермию и повреждения глаза. Другие нарушения, обычно связанные с болезнью Крона, включают в себя связанные с болезнью Крона артралгии, фистулизирующую болезнь Крона, неопределенные формы колита и паучит.
H. Кардиальные нарушения
Антитело или его антигенсвязывающий фрагмент, полученные с использованием способа по изобретению, можно также использовать для лечения различных кардиальных или коронарных нарушений, включая ишемию сердца (смотри, например, публикацию европейской патентной заявки № EP 453898) и сердечную недостаточность (слабость сердечной мышцы) (смотри, например, публикацию PCT № WO 94/20139). TNFα вовлечен также в патофизиологию рестеноза (смотри, например, Clausell et al. (1994), выше; Medall et al (1997) Heart 78:273).
Как применяют здесь, термин «кардиальное нарушение, при котором активность TNFα является неблагоприятной» предназначен, чтобы включать в себя коронарные и сердечно-сосудистые заболевания, при которых показали или подозревают, что присутствие TNFα у субъекта, страдающего от нарушения, либо отвечает за патофизиологию нарушения, либо является фактором, вносящим вклад в ухудшение нарушения, включая сердечно-сосудистые нарушения, например рестеноз. Термин «сердечно-сосудистое нарушение» или «коронарное нарушение», как применяют здесь взаимозаменяемо, относится к любому заболеванию, нарушению или состоянию, затрагивающему сердечно-сосудистую систему, например сердце, кровеносные сосуды и/или кровь. Коронарное нарушение, как правило, характеризуется сужением кровеносных сосудов, которые снабжают кровью и кислородом сердце (коронарные артерии). Коронарное заболевание может возникать в результате скопления жирового материала и бляшек. При сужении коронарных артерий поток крови к сердцу может замедляться или останавливаться. Коронарные нарушения по изобретению можно применять к любой аномалии артерии, структурной, гистологической, биохимической или любой другой аномалии. Примером коронарной болезни сердца является рестеноз. В одном варианте осуществления коронарное нарушение относится к любому заболеванию, нарушению или состоянию, затрагивающему сердечно-сосудистую систему, включая ишемию сердца и сердечную недостаточность.
Коронарные нарушения, при которых активность TNFα является неблагоприятной, часто возникают в результате закупорки артерии. Такая закупорка может быть вызвана сгустком, который обычно формируется в коронарной артерии, которая ранее была сужена из-за изменений, обычно связанных с атеросклерозом. Например, если атеросклеротическая бляшка внутри артериальной стенки разрывается, она может запускать формирование тромба или сгустка. Такие нарушения можно выявлять, например, по увеличению концентрации TNFα в биологической жидкости субъекта, страдающего от нарушения (например, по увеличению концентрации TNFα в сыворотке, плазме, синовиальной жидкости и тому подобном субъекта), которое можно детектировать, например, с использованием антитела против TNFα, как описано выше. Коронарное нарушение может быть также вызвано дисбалансом артериального давления, нарушением функции сердца или окклюзией кровеносного сосуда, например, посредством тромба. Коронарные нарушения включают в себя как болезнь коронарных артерий, так и периферическое сосудистое заболевание.
Существует множество примеров кардиальных нарушений, при которых активность TNFα является неблагоприятной, включая рестеноз. Применение антител, частей антител для лечения конкретных коронарных нарушений обсуждают далее ниже. В конкретных вариантах осуществления антитело, часть антитела вводят субъекту в сочетании с другим лекарственным средством, как описано ниже.
Антитела, полученные с использованием способов по изобретению, можно также использовать для ингибирования активности TNFα у субъекта с кардиальным нарушением. Изобретение относится к способам ингибирования или уменьшения активности TNFα у субъекта с коронарным нарушением, включающим в себя введение субъекту антитела или части антитела, или другого ингибитора TNFα по изобретению, так что активность TNFα у субъекта ингибируют или уменьшают. Предпочтительно, TNFα представляет собой TNFα человека, и субъект представляет собой человека. Альтернативно, субъект может представлять собой млекопитающее, экспрессирующее TNFα, с которым перекрестно реагирует антитело по изобретению. Кроме того, субъект может представлять собой млекопитающее, которому вводят hTNFα (например, посредством введения hTNFα или посредством экспрессии трансгена для hTNFα). Антитело по изобретению можно вводить человеку для терапевтических целей.
Более того, антитело по изобретению можно вводить не относящемуся к человеку млекопитающему, экспрессирующему TNFα, с которым антитело перекрестно реагирует (например, примату, свинье или мыши), для целей ветеринарии или в качестве модели заболевания человека на животных. Что касается последнего, такие модели на животных можно применять для оценки терапевтической эффективности множественной переменной дозы (например, тестирования доз и периодов введения). Общепринятые модели на животных для изучения коронарных нарушений, включая рестеноз, включают в себя модель лигирования сонной артерии на крысе или мыши и модель повреждения сонной артерии (Ferns et al. (1991) Science 253:1129; Clowes et al. (1983) Lab. Invest. 49:208; Lindner et al. (1993) Circ Res. 73:792). В модели лигирования сонной артерии проток артериальной крови прерывают посредством лигирования сосуда около дистальной бифуркации. Как описано у Clowes et al., модель повреждения сонной артерии осуществляют таким образом, что общую сонную артерию обнажают от эндотелия посредством внутрипросветного прохождения баллонного катетера, введенного через внешнюю сонную артерию. Через 2 недели сонная артерия заметно сужается из-за сокращения гладкомышечных клеток, однако между 2 и 12 неделями интима вдвое увеличивается по толщине, приводя к уменьшению размера просвета. Любую из этих моделей можно использовать для определения потенциального терапевтического действия антител против TNFα по изобретению для предупреждения и лечения рестеноза у человека.
Изобретение относится к лечению сердечно-сосудистых нарушений, при которых активность TNFα является неблагоприятной, где ожидают, что ингибирование активности TNFα будет облегчать симптомы и/или прогрессирование коронарного заболевания или предупреждать коронарное заболевание. Субъектов, страдающих от коронарных нарушений или подверженных риску развития коронарных нарушений, можно идентифицировать посредством клинических симптомов. Клинические симптомы при коронарном заболевании часто включают в себя боль в груди, затруднение дыхания, слабость, приступы слабости, изменения сознания, острую боль, пароксизмальное ночное диспноэ, транзиторные ишемические атаки и другие такие явления, испытываемые пациентом. Клинические признаки коронарного заболевания могут включать в себя также аномалии EKG, измененный периферический пульс, артериальный шум, аномальные звуки, частоты и хрипы сердца, набухание шейных вен, неврологические изменения и другие такие признаки, замеченные клиницистом. Коронарные нарушения можно также подтвердить, например, по увеличению концентрации TNFα в биологической жидкости субъекта, страдающего от нарушения (например, по увеличению концентрации TNFα в сыворотке, плазме, синовиальной жидкости и тому подобном субъекта).
Сердечно-сосудистые нарушения включают в себя в качестве неограничивающих примеров болезнь коронарных артерий, стенокардию, инфаркт миокарда, повреждение тканей сердца и сосудов, вызванное остановкой сердца, повреждение тканей сердца и сосудов, вызванное сердечным шунтом, кардиогенный шок и гипертензию, атеросклероз, спазм коронарной артерии, болезнь коронарных артерий, заболевание клапанов, аритмии и кардиомиопатии. Применение антител, частей антител для лечения конкретных сердечно-сосудистых заболеваний обсуждают далее ниже. В конкретных вариантах осуществления антитело, часть антитела вводят субъекту в сочетании с другим лекарственным средством, как описано ниже.
1. Рестеноз
Термин «рестеноз», как применяют здесь, относится к рецидиву стеноза, который представляет собой сужение или сокращение артерии. Рестеноз часто возникает как пре-окклюзивное поражение, которое после реконструктивной процедуры развивается в пораженном заболеванием кровеносном сосуде. Термин применяют не только к рецидиву существующего ранее стеноза, но также к ранее нормальным сосудам, которые подвергаются частичной окклюзии после шунтирования сосудов. В другом варианте осуществления изобретение относится к способу лечения рестеноза, включающему в себя введение антитела или его антигенсвязывающей части, полученной с использованием изобретения, субъекту, страдающему от рестеноза или подверженному риску развития рестеноза.
TNFα вовлечен в патофизиологию рестеноза (смотри Zhou et al. (2002) Atherosclerosis. 161:153; Javed et al. (2002) Exp and Mol Pathol 73:104). Например, на модели перевязки проволокой сонной артерии у мышей для мышей TNF -/- показали уменьшение начальной гиперплазии в семь раз по сравнению с мышами дикого типа (Zimmerman et al. (2002) Am J Phsiol Regul Integr Comp Physiol 283:R505). Рестеноз может возникать в результате любого типа реконструкции сосудов, либо в коронарных сосудах, либо на периферии (Colburn and Moore (1998) Myointimal Hyperplasia pp. 690-709 in Vascular Surgery: A Comprehensive Review Philadelphia: Saunders). Например, опубликованы результаты исследований с частотой симптоматического рестеноза 30-50% после коронарной ангиопластики (смотри Berk and Harris (1995) Adv. Intern. Med. 40:455). В качестве следующего примера, после эндартерэктомий сонной артерии 20% исследуемых пациентов обладали сужением просвета, превышающим 50% (Clagett et al. (1986) J. Vase. Surg. 3:10). Рестеноз доказывают по совокупности симптомов различных степеней, которые сопровождают пре-окклюзивные поражения различных анатомических локализаций, обусловленных сочетанием факторов, включая природу затронутых сосудов, степень остаточного заболевания и местную гемодинамику.
«Стеноз», как применяют здесь, относится к сужению артерии, какое наблюдают при окклюзивном нарушении или рестенозе. Стеноз могут сопровождать такие симптомы, отражающие уменьшение кровотока после суженного участка артерии, что в этом случае нарушение, вызвавшее стеноз, обозначают заболеванием (т.е. окклюзивным заболеванием или рестенозным заболеванием). Стеноз в сосуде может присутствовать без симптомов и подлежит детекции только посредством диагностического вмешательства, такого как ангиография или лабораторное исследование сосудов.
Антитела, полученные с использованием способа по изобретению, можно использовать для лечения субъекта, страдающего от рестеноза или подверженного риску развития рестеноза. Субъект, подверженный риску развития рестеноза, включает в себя субъекта, подвергавшегося PTCA. Субъект может обладать также стентом, вставленным для предотвращения рестеноза. Антитело против TNFα можно использовать отдельно или в сочетании со стентом для предотвращения повторного возникновения стеноза у субъекта, страдающего сердечно-сосудистым заболеванием.
2. Застойная сердечная недостаточность
TNFα вовлечен в патофизиологию застойной сердечной недостаточности (смотри Zhou et al. (2002) Atherosclerosis 161: 153). Уровни TNFα в сыворотке повышены у пациентов с застойной сердечной недостаточностью таким образом, что являются прямо пропорциональными тяжести заболевания (Levine et al. (1990) N Engl J Med 323:236; Torre-Amione et al. (1996) J Am Coll Cardiol 27:1201). Кроме того, показано также, что ингибиторы TNFα улучшают симптомы застойной сердечной недостаточности (Chung et al. (2003) Circulation 107:3133).
Как применяют здесь, термин «застойная сердечная недостаточность» включает в себя состояние, характеризующееся уменьшенной способностью сердца обеспечивать потребность организма в кислороде. Симптомы и признаки застойной сердечной недостаточности включают в себя уменьшение кровотока к различным тканям организма, скопление избыточной крови в различных органах, например, когда сердце неспособно откачать кровь, возвращаемую к нему большими венами, диспноэ при напряжении, утомляемость и/или периферический отек, например периферический отек, вызванный дисфункцией левого желудочка. Застойная сердечная недостаточность может являться острой или хронической. Застойная сердечная недостаточность обычно проявляется как вторичная для ряда кардиальных или системных нарушений, разделяющих временную или постоянную потерю кардиальной функции. Примеры таких нарушений включают в себя гипертензию, болезнь коронарных артерий, заболевание клапанов и кардиомиопатии, например гипертрофическую, дилатационную или рестриктивную кардиомиопатию.
«Субъект, обладающий или страдающий застойной сердечной недостаточностью» представляет собой субъекта, обладающего нарушением, включающим в себя клинический синдром множественной этиологии, объединенный общим действующим началом - нарушением действия сердечного насоса, при котором сердце не может прокачивать кровь в соответствии с потребностями метаболизирующих тканей или может делать это только при повышенном давлении наполнения. «Субъект, подверженный риску развития застойной сердечной недостаточности» представляет собой субъекта, обладающего предрасположенностью к развитию застойной сердечной недостаточности из-за конкретных факторов, повреждающих сердечно-сосудистую систему субъекта. Является желательным уменьшить риск или предупредить развитие застойной сердечной недостаточности у этих субъектов. Фраза «с застойной сердечной недостаточностью» включает в себя пациентов, подверженных риску страдать от этого состояния по сравнению с общей популяцией, даже хотя они могут еще не страдать от него, на основании выявления факторов риска. Например, пациент с гипертензией без лечения может не страдать от застойной сердечной недостаточности, но являться подверженным риску из-за его или ее гипертензивного состояния. В одном варианте осуществления изобретения антитело адалимумаб используют для лечения субъекта, подверженного риску развития застойной сердечной недостаточности.
3. Острые коронарные синдромы
TNFα вовлечен в патофизиологию острых коронарных синдромов (смотри Libby (1995) Circulation 91:2844 ). Острые коронарные синдромы включают в себя те нарушения, где субъект испытывает боль из-за ограничения кровотока в результате того, что недостаточно кислорода достигает сердца. Исследования обнаружили, что TNFα играет роль при острых коронарных синдромах. Например, для новой модели гетеротопической трансплантации сердца - коронарного лигирования на крысах, способной индуцировать инфаркт миокарда в отсутствие гемодинамических эффектов ниже по течению, введение химерного растворимого рецептора TNF (sTNFR) прекращает временное ремоделирование и дисфункцию LV (Nakamura, et al. (2003) J. Cardiol. 41:41). Обнаружено также, что прямая инъекция в миокард плазмиды, экспрессирующей sTNFR, приводит к уменьшению площади инфаркта у экспериментальных крыс с острым инфарктом миокарда (AMI) (Sugano et al. (2002) FASEB J 16:1421).
В одном варианте осуществления антитело против TNFα используют для лечения или предупреждения острого коронарного синдрома у субъекта, где острый коронарный синдром представляет собой инфаркт миокарда или стенокардию.
Как применяют здесь, термин «инфаркт миокарда» или «MI» относится к сердечному приступу. Инфаркт миокарда включает в себя некроз или постоянное разрушение области сердца из-за неадекватного снабжения этой области кислородом. Этот некроз, как правило, является вызванным обструкцией коронарной артерии либо из-за атеросклероза, либо из-за эмбола. MI, которые лечили антителом против TNFα, полученным с использованием способов по изобретению, включают в себя как Q-образующий, так и Q-необразующий инфаркт миокарда. Большинство сердечных приступов вызваны сгустком, который блокирует одну из коронарных артерий (кровеносных сосудов, приносящих кровь и кислород к сердечной мышце). Например, сгусток в коронарной артерии прерывает приток крови и кислорода к сердечной мышце, приводя к гибели клеток сердца в этой области. Поврежденная сердечная мышца навсегда утрачивает способность сокращаться, и оставшейся сердечной мускулатуре необходимо это компенсировать. MI может также являться вызванным подавляющим стрессом у индивидуума.
Термин «стенокардия» относится к спазматической, сдавливающей или удушающей боли и особенно в качестве обозначения стенокардии, которая представляет собой приступообразную боль в груди, обусловленную, наиболее часто, аноксией миокарда. Стенокардия включает в себя оба варианта - стенокардию и стенокардию напряжения. Субъект, обладающий стенокардией, обладает ишемической болезнью сердца, которая проявляется неожиданной, тяжелой, сдавливающей загрудинной болью, которая часто распространяется на левое плечо и по левой руке. TNFα вовлечен в стенокардию, так как присутствует повышающая регуляция уровней TNFα у пациентов как с MI, так и со стабильной стенокардией (Balbay et al. (2001) Angiology 52109).
4. Атеросклероз
«Атеросклероз», как применяют здесь, относится к состоянию, при котором жировой материал откладывается вдоль стенок артерий. Этот жировой материал утолщает, отверждает и может в конечном счете блокировать артерии. Атеросклероз обозначают также как артериосклероз, отверждение артерий и образование артериальной бляшки. Показано, что поликлональные антитела, направленные против TNFα, являются эффективными для нейтрализации активности TNFα, приводящей к воспалению и рестенозу в модели атеросклероза на кроликах (Zhou et al., выше). Соответственно, антитело против TNFα можно использовать для лечения или предупреждения для субъектов, страдающих атеросклерозом или подверженных риску атеросклероза.
5. Кардиомиопатия
Термин «кардиомиопатия», как применяют здесь, используют для определения заболеваний миокарда, где сердечная мышца или миокард ослаблены, что обычно приводит к неадекватной работе сердечного насоса. Кардиомиопатию могут вызывать вирусные инфекции, сердечные приступы, алкоголизм, долговременная тяжелая гипертензия (высокое кровяное давление) или аутоиммунные причины. У приблизительно 75-80% пациентов с сердечной недостаточностью болезнь коронарных артерий является первопричиной кардиомиопатии и обозначена «ишемическая кардиомиопатия». Ишемическая кардиомиопатия вызвана сердечными приступами, которые оставляют рубцы на сердечной мышце или миокарде. Пораженный миокард затем является неспособным вносить вклад в функционирование сердечного насоса. Чем больше рубцы или чем более многочисленны сердечные приступы, тем выше шанс развития ишемической кардиомиопатии.
Кардиомиопатии, которые нельзя объяснить лежащей в основе болезнью коронарных артерий, обозначают «неишемические кардиомиопатии». Неишемические кардиомиопатии включают в себя в качестве неограничивающих примеров идиопатическую кардиомиопатию, гипертрофическую кардиомиопатию, алкогольную кардиомиопатию, дилатационную кардиомиопатию, кардиомиопатию беременных и рестриктивную кардиомиопатию.
I. Спондилоартропатии
TNFα вовлечен в патофизиологию широкого ряда нарушений, включая воспалительные заболевания, такие как спондилоартропатии (смотри, например, Moeller et al. (1990) Cytokine 2:162; патент США № 5231024; публикация европейского патента № 260610). Изобретение относится к способам множественной переменной дозы для ингибирования активности TNFα у субъекта, страдающего от спондилоартропатии, где способ включает в себя введение субъекту антитела, части антитела, так что ингибируют активность TNFα у субъекта, страдающего от спондилоартропатии.
Как применяют здесь, термин «спондилоартропатия» или «спондилоартропатии» используют для обозначения любого из тяжелых заболеваний, повреждающих суставы позвоночника, где такие заболевания разделяют общие клинические, радиологические и гистологические признаки. Ряд спондилоартропатий разделяют генетические характеристики, т.е. они являются ассоциированными с аллелем HLA-B27. В одном варианте осуществления термин спондилоартропатия используют для обозначения любого из тяжелых заболеваний, повреждающих суставы позвоночника, включая анкилозирующий спондилит, где такие заболевания разделяют общие клинические, радиологические и гистологические признаки. Примеры спондилоартропатий включают в себя анкилозирующий спондилит, псориатический артрит/спондилит, энтеропатический артрит, реактивный артрит или синдром Рейтера и недифференцированные спондилоартропатии. Примеры моделей на животных, применяемых для исследования спондилоартропатий, включают в себя трансгенных мышей ank/ank, трансгенных крыс HLA-B27 (смотри Taurog et al. (1998) The Spondylarthritides. Oxford:Oxford University Press).
Способы множественной переменной дозы по изобретению можно также использовать для лечения субъектов, подлежащих риску развития спондилоартропатии, с использованием способов множественной переменной дозы. Примеры субъектов, подлежащих риску развития спондилоартропатии, включают в себя людей, страдающих от артрита. Спондилоартропатии могут являться связанными с другими формами артрита, включая ревматоидный артрит. В одном варианте осуществления изобретения антитела используют в способах множественной переменной дозы для лечения субъекта, страдающего от спондилоартропатии, связанной с ревматоидным артритом. Примеры спондилоартропатий, которые можно лечить антителом против TNFα, описаны ниже.
1. Анкилозирующий спондилит (AS)
Фактор некроза опухоли вовлечен в патофизиологию анкилозирующего спондилита (смотри Verjans et al. (1991) Arthritis Rheum. 34:486; Verjans et al. (1994) Clin Exp Immunol. 97:45; Kaijtzel et al. (1999) Hum Immunol. 60:140). Анкилозирующий спондилит (AS) представляет собой воспалительное нарушение, вовлекающее воспаление одного или нескольких позвонков. AS представляет собой хроническое воспалительное заболевание, повреждающее осевой скелет и/или периферические суставы, включая суставы между позвонками позвоночника, крестцово-подвздошные сочленения и суставы между позвоночником и тазом. AS в конечном итоге заставляет пораженные позвонки спаиваться или срастаться вместе. Спондилоартропатии, включая AS, могут являться связанными с псориатическим артритом (PsA) и/или воспалительным заболеванием кишечника (IBD), включая язвенный колит и болезнь Крона.
Ранние проявления AS можно выявлять радиографическими тестами, включая сканирования CT и сканирования MRI. Ранние проявления AS часто включают в себя сакроилеит и изменения в крестцово-подвздошных сочленениях, как доказывают по размазыванию кортикальных границ субхондральной кости с последующими эрозиями и склерозом. Замечено, что утомляемость также является общераспространенным симптомом AS (Duffy et al. (2002) ACR 66th Annual Scientific Meeting Abstract). Соответственно, способы множественной переменной дозы, включающие в себя введение антитела или его антигенсвязывающего фрагмента по изобретению, можно использовать для лечения AS.
В одном варианте осуществления способ множественной переменной дозы по изобретению используют для лечения спондилоартропатии, связанной с IBD, включая AS. AS часто лечат нестероидными противовоспалительными лекарственными средствами (NSAID), такими как аспирин или индометацин. Соответственно, антитело против TNFα, применяемое в способе множественной переменной дозы по изобретению, можно вводить также в сочетании со средствами, общепринятыми для уменьшения воспаления и боли, обычно связанных с анкилозирующим спондилитом.
2. Псориатический артрит
Фактор некроза опухоли вовлечен в патофизиологию псориатического артрита (PsA) (Partsch et al. (1998) Ann Rheum Dis. 57:691; Ritchlin et al. (1998) J Rheumatol. 25:1544). Как ссылаются здесь, псориатический артрит или псориаз, связанный с кожей, относится к хроническому воспалительному артриту, связанному с псориазом, который представляет собой общее хроническое состояние кожи, которое вызывает красные пятна на теле. Приблизительно у 1 из 20 индивидуумов с псориазом будет развиваться артрит вместе с состоянием кожи, и приблизительно в 75% псориаз предшествует артриту. PsA проявляется различным образом, в диапазоне от легкого до тяжелого артрита, где артрит обычно поражает пальцы и позвоночник. При поражении позвоночника симптомы являются сходными с симптомами анкилозирующего спондилита, как описано выше. Антитело против TNFα или его антигенсвязывающий фрагмент, полученные с использованием изобретения, можно использовать для лечения PsA.
PsA иногда связан с мутилирующим артритом. Мутилирующий артрит относится к нарушению, которое характеризуется избыточной эрозией кости, приводящей к обширной эрозивной деформации, которая искажает сустав. В одном варианте осуществления антитела, полученные с использованием способа по изобретению, используют для лечения мутилирующего артрита.
3. Реактивный артрит/синдром Рейтера
Фактор некроза опухоли вовлечен в патофизиологию реактивного артрита, обозначаемого также как синдром Рейтера (Braun et al. (1999) Arthritis Rheum. 42(10):2039). Реактивный артрит (ReA) относится к артриту, являющемуся осложнением инфекции где-нибудь в другом месте организма, часто следующему за кишечной или урогенитальной инфекцией. ReA часто характеризуется конкретными клиническими симптомами, включая воспаление суставов (артрит), уретрит, конъюнктивит и поражения кожи и мембран слизистых оболочек. Кроме того, ReA может возникать после инфекции с заболеванием, передающимся половым путем, или дизентерийной инфекции, включая инфекцию хламидией, кампилобактерией, сальмонеллой или иерсинией. Соответственно, антитела, полученные с использованием способа по изобретению, можно использовать для лечения ReA.
4. Недифференцированные спондилоартропатии
В одном варианте осуществления антитела, полученные с использованием способов по изобретению, используют для лечения субъектов, страдающих от недифференцированных спондилоартропатий (смотри Zeidler et al. (1992) Rheum Dis Clin North Am. 18:187). Другие термины, применяемые для описания недифференцированных спондилоартропатий, включают в себя серонегативный олигоартрит и недифференцированный олигоартрит. Недифференцированные спондилоартропатии, как применяют здесь, относятся к нарушению, где для субъекта показывают только некоторые из симптомов, связанных со спондилоартропатией. Это состояние обычно наблюдают у молодых взрослых, не обладающих IBD, псориазом или классическими симптомами AS или синдрома Рейтера. В некоторых случаях, недифференцированные спондилоартропатии могут являться ранними признаками AS. В одном варианте осуществления изобретение относится к введению антитела против TNFα или его антигенсвязывающего фрагмента, полученного с использованием заявленного способа, для лечения недифференцированных спондилоартропатий.
J. Нарушения метаболизма
TNFα вовлечен в патофизиологию широкого ряда нарушений, включая нарушения метаболизма, такие как диабет и ожирение (Spiegelman and Hotamisligil (1993) Cell 73:625; Chu et al (2000; Int J Obes Relat Metab Disord. 24:1085; Ishii et al (2000) Metabolism. 49:1616). Термин «нарушение метаболизма», как применяют здесь, относится к заболеваниям или нарушениям, которые влияют на то, как организм перерабатывает вещества, необходимые для выполнения физиологических функций. Нарушения метаболизма включают в себя в качестве неограничивающих примеров диабет и ожирение. В одном варианте осуществления изобретения термин «нарушение метаболизма» применяют для обозначения нарушений, которые влияют на то, как организм перерабатывает вещества, необходимые для выполнения физиологических функций, включая аутоиммунный диабет.
Изобретение относится к способам ингибирования активности TNFα у субъекта, страдающего от такого нарушения метаболизма, где способ включает в себя введение субъекту антитела, части антитела, так что ингибируют активность TNFα у субъекта, страдающего от нарушения метаболизма. Антитела против TNFα можно использовать также для лечения субъектов, подлежащих риску развития нарушения метаболизма.
Нарушения метаболизма часто связаны с артритом, включая ревматоидный артрит. В одном варианте осуществления ингибитор TNFα, такой как антитело, используют в режиме множественной переменной дозы для субъекта, страдающего от нарушения метаболизма, связанного с ревматоидным артритом. В другом варианте осуществления изобретение относится к введению антитела против TNFα для лечения нарушений, связанных с диабетом или ожирением.
Примеры моделей на животных для оценки эффективности антитела против TNFα для лечения нарушения метаболизма включают в себя трансгенных мышей NOD, мышей AMta, трансгенных мышей NSY и мышей ob/ob (смотри Baeder et al. (1992) Clin Exp Immunol. 89:174; Haseyama et al. (2002) Tohoku J Exp Med. 198:233; Makino et al. (1980): Exp.Anim. 29:1; Kolb (1987) Diabetes/Metabolism Reviews 3:751; Hamada et al.(2001) Metabolism. 50:1282; Coleman, (1978) Diabetologia, 14:141; Bailey et al. (1982) Int. J. Obesity 6:11). Примеры моделей на животных, применяемых для исследования васкулита, включают в себя модель на мышах HSV (болезнь Бехчета), модель на мышах с L. casei (болезнь Кавасаки) и модель на мышах ANCA (болезнь Кавасаки). Другие модели васкулита включают в себя штамм McH5-lpr/lpr (Nose et al. (1996) Am. J. Path. 149:1763) и штамм мышей SCG/Kj (Kinjoh et al. (1993) Proc. Natl. Acad. Sci., USA 90:3413). У этих штаммов мышей спонтанно развивается суставный гломерулонефрит и некротический васкулит малых артерий и артериол селезенки, желудка, сердца, матки и яичников. У этих животных развивается гипергаммаглобулинемия и аутоантитела ANCA, которые реагируют с миелопероксидазой (MPO). Кроме того, иммунизация крыс MPO человека приводит к ANCA-ассоциированному некротизирующему суставному гломерулонефриту (Brouwer et al. (1993) J. Exp. Med. 177:905).
Нарушения метаболизма влияют на то, как организм перерабатывает вещества, необходимые для выполнения физиологических функций. Ряд нарушений метаболизма по изобретению разделяют конкретные характеристики, т.е. они связаны с устойчивостью к инсулину, отсутствием способности регулировать уровень сахара в крови, увеличением массы и увеличением индекса массы тела. Примеры нарушений метаболизма включают в себя диабет и ожирение. Примеры диабета включают в себя сахарный диабет типа 1, сахарный диабет типа 2, диабетическую невропатию, периферическую невропатию, диабетическую ретинопатию, язвы при диабете, язвы при ретинопатии, диабетическую макроваскулопатию и ожирение. Примеры нарушений метаболизма, которые можно лечить с использованием способов множественной переменной дозы, включающих в себя введение антитела против TNFα, более подробно описаны ниже.
1. Диабет
Фактор некроза опухоли вовлечен в патофизиологию диабета (смотри, например, Navarro et al. (2003) Am J Kidney Dis. 42:53; Daimon et al. (2003) Diabetes Care. 26:2015; Zhang et al. (1999) J Tongji Med Univ. 19:203; Barbieri et al.(2003) Am J Hypertens. 16:537). Например, TNFα вовлечен в патофизиологию устойчивости к инсулину. Обнаружено, что уровни TNF в сыворотке у пациентов с раком желудочно-кишечного тракта коррелируют с устойчивостью к инсулину (смотри, например, McCall et al.(1992) Br. J. Surg. 79:1361).
Термин «диабет» или «диабетическое нарушение», или «сахарный диабет», как применяют взаимозаменяемо здесь, относится к заболеванию, характеризующемуся повышенными уровнями сахара (глюкозы) в крови. Диабет может являться вызванным слишком маленьким уровнем инсулина (химическое вещество, продуцируемое поджелудочной железой для регулирования уровня сахара в крови), устойчивостью к инсулину или и тем, и другим. Диабет включает в себя два наиболее распространенных типа нарушения, а именно диабет типа I и диабет типа II, где оба происходят от неспособности организма регулировать инсулин. Инсулин представляет собой гормон, высвобождаемый поджелудочной железой в ответ на увеличенные уровни сахара крови (глюкозы) крови.
Термин «диабет типа 1», как применяют здесь, относится к хроническому заболеванию, которое возникает, когда поджелудочная железа продуцирует слишком мало инсулина, чтобы соответствующим образом регулировать уровни сахара в крови. Диабет типа 1 обозначают также как инсулинозависимый сахарный диабет, IDMM, ювенильный диабет и диабет типа I. Диабет типа 1 представляет собой результат прогрессирующего аутоиммунного разрушения β-клеток поджелудочной железы с последующей недостаточностью инсулина.
Термин «диабет типа 2» относится к хроническому заболеванию, возникающему, когда поджелудочная железа не производит достаточно инсулина для поддержания нормальных уровней глюкозы, часто из-за того, что организм не отвечает хорошо на инсулин. Диабет 2 обозначают также как инсулин-независимый сахарный диабет, NDDM и диабет типа II.
Диабет можно диагностировать посредством введения глюкозы для теста устойчивости. Клинически диабет часто разделяют на несколько основных категорий. Первичные примеры этих категорий включают в себя аутоиммунный сахарный диабет, инсулин-независимый сахарный диабет (NDDM типа 1), инсулинозависимый сахарный диабет (IDDM типа 2), не аутоиммунный сахарный диабет, инсулин-независимый сахарный диабет (NIDDM типа 2) и диабет зрелого возраста у молодых (MODY). Дополнительные категории, часто обозначаемые как вторичные, относятся к диабету, вызываемому некоторым поддающимся идентификации состоянием, которое вызывает диабетический синдром или позволяет диабетическому синдрому развиваться. Примеры вторичных категорий включают в себя диабет, вызванный заболеванием поджелудочной железы, гормональными аномалиями, вызванный лекарственными средствами или химическими веществами диабет, вызванный аномалиями рецептора инсулина диабет, связанный с генетическими синдромами диабет и диабет из-за других причин (смотри, например, Harrison's (1996) 14th ed., New York, McGraw-Hill).
Диабет часто лечат диетой, дозами инсулина и различными лекарственными средствами, описанными здесь. Соответственно, антитело против TNFα можно вводить также в сочетании со средствами, общепринятыми для лечения нарушений метаболизма и боли, обычно связанных с диабетом.
Кроме того, фраза «нарушения, связанные с диабетом», как применяют здесь, относится к состояниям и другим заболеваниям, которые обычно связаны с диабетом или являются родственными диабету. Примеры нарушений, связанных с диабетом, включают в себя, например, гипергликемию, гиперинсулинемию, гиперлипидемию, устойчивость к инсулину, нарушение метаболизма глюкозы, ожирение, диабетическую ретинопатию, дегенерацию желтого пятна, катаракты, диабетическую нефропатию, гломерулосклероз, диабетическую невропатию, эректильную дисфункцию, предменструальный синдром, рестеноз сосудов, язвенный колит, коронарную болезнь сердца, гипертензию, стенокардию, инфаркт миокарда, инсульт, нарушения кожи и соединительной ткани, язвы на ногах, метаболический ацидоз, артрит и остеопороз.
Диабет проявляется в вышеуказанных категориях и вызывает тяжелые осложнения, которые обсуждают в следующих разделах. Соответственно, антитело или его антигенсвязывающий фрагмент по изобретению можно использовать для лечения диабета. В одном варианте осуществления антитело против TNFα или его антигенсвязывающий фрагмент используют для лечения диабета, связанного с указанными выше категориями. В другом варианте осуществления изобретение включает в себя введение антитела против TNFα для лечения нарушений, связанных с диабетом. Диабет проявляется во многих осложнениях и состояниях, связанных с диабетом, включая следующие категории.
a. Диабетическая невропатия и периферическая невропатия
Фактор некроза опухоли вовлечен в патофизиологию диабетической невропатии и периферической невропатии (Смотри Benjafield et al. (2001) Diabetes Care. 24:753; Qiang et al. (1998) Diabetologia 41:132l; Pfeiffer et al. (1997) Horm Metab Res. 29:111).
Термин «невропатия», обозначаемый также как повреждение нервов - диабетическое, как применяют здесь, относится к общераспространенному осложнению диабета, при котором нервы повреждаются в результате гипергликемии (высоких уровней сахара в крови). Распознают множество диабетических невропатий, таких как дистальная сенсомоторная полиневропатия, фокальная моторная невропатия и автономная невропатия.
Термин «периферическая невропатия», известная также как периферический неврит и диабетическая невропатия, как применяют здесь, относится к неспособности нервов переносить информацию от головного и спинного мозга, и обратно. Периферическая невропатия вызывает такие симптомы, как боль, потерю чувствительности и неспособность контролировать мышцы. В некоторых случаях неспособность нервов контролировать кровеносные сосуды, функцию кишечника и других органов приводит к аномальному кровяному давлению, пищеварению и утрате других основных непроизвольных процессов. Периферическая невропатия может вовлекать повреждение отдельного нерва или группы нервов (мононевропатия) или может поражать множество нервов (полиневропатия).
Невропатии, которые поражают малые миелинизированные и немиелинизированные волокна симпатических и парасимпатических нервов, известны как «периферические невропатии». Более того, нарушение, родственное периферической невропатии, известное также как периферический неврит и диабетическая невропатия, относится к неспособности нервов переносить информацию от головного и спинного мозга, и обратно. Это вызывает такие симптомы, как боль, потерю чувствительности и неспособность контролировать мышцы. В некоторых случаях неспособность нервов контролировать кровеносные сосуды, функцию кишечника и других органов приводит к аномальному кровяному давлению, пищеварению и утрате других основных непроизвольных процессов. Периферическая невропатия может вовлекать повреждение отдельного нерва или группы нервов (мононевропатия) или может поражать множество нервов (полиневропатия).
Термин «диабетическая невропатия» относится к общераспространенному осложнению диабета, при котором нервы повреждаются в результате гипергликемии (высоких уровней сахара в крови). Диабетическую невропатию обозначают также как невропатию и повреждение нервов - диабетическое. Различают множество диабетических невропатий, таких как дистальная сенсомоторная полиневропатия, фокальная моторная невропатия и автономная невропатия.
b. Диабетическая ретинопатия
Фактор некроза опухоли вовлечен в патофизиологию диабетической ретинопатии (Scholz et al. (2003) Trends Microbiol. 11:171). Термин «диабетическая ретинопатия», как применяют здесь, относится к прогрессирующему повреждению сетчатки глаза, вызванному долговременным диабетом. Диабетическая ретинопатия включает в себя пролиферативную ретинопатию. Пролиферативная невропатия, в свою очередь, включает в себя неоваскуляризацию, ретинальную геморрагию и отслоение сетчатки.
При ретинопатии на поздних стадиях малые сосуды пролиферируют на поверхности сетчатки. Эти кровеносные сосуды являются хрупкими, проявляют тенденцию к кровотечению и могут вызывать ретинальную геморрагию. Геморрагия может нарушать зрение, и при геморрагии резорбированная фиброзная ткань формирует предрасположенность к отслоениям сетчатки и потере зрения. Кроме того, диабетическая ретинопатия включает в себя пролиферативную ретинопатию, которая включает в себя неоваскуляризацию, ретинальную геморрагию и отслоение сетчатки. Диабетическая ретинопатия включает в себя также «фоновую ретинопатию», включающую в себя изменения, происходящие со слоями сетчатки.
c. Язвы при диабете и язвы при ретинопатии
Фактор некроза опухоли вовлечен в патофизиологию язв при диабете (смотри Lee et al. (2003) Hum Immunol. 64:614; Navarro et al. (2003) Am J Kidney Dis. 42:53; Daimon et al (2003) Diabetes Care. 26:2015; Zhang et al. (1999) J Tongji Med Univ. 19:203; Barbieri et al. (2003) Am J Hypertens. 16:537; Venn et al. (1993) Arthritis Rheum. 36:819; Westacott et al. (1994) J Rheumatol 21:1710).
Термин «язвы при диабете», как применяют здесь, относится к язве, возникающей в результате осложнения диабета. Язва представляет собой кратерообразное повреждение кожи или мембраны слизистых оболочек, вызванное воспалением, инфекцией, злокачественным состоянием или нарушением метаболизма. Как правило, язвы при диабете можно обнаружить на конечностях, более конкретно ногах. Эти язвы, вызванные диабетическим состоянием, таким как невропатия и сосудистая недостаточность, могут приводить к ишемии и плохому заживлению ран. Более обширные изъязвления могут прогрессировать до остеомиелита. После развития остеомиелита его может быть трудно уничтожить только с помощью антибиотиков, и может потребоваться ампутация.
Термин «язвы при ретинопатии», как применяют здесь, относится к язве, которая вызывает повреждения глаза и сетчатки глаза или приводит к ним. Язвы при ретинопатии могут включать в себя такие состояния, как ретинальная геморрагия.
d. Диабетическая макроваскулопатия
Фактор некроза опухоли вовлечен в патофизиологию диабетической макроваскулопатии (Devaraj et al. (2000) Circulation. 102:191; Hattori et al. (2000) Cardiovasc Res. 46:188; Clausell et al. (1999) Cardiovasc Pathol.8:145). Термин «диабетическая макроваскулопатия», обозначаемый также как «макрососудистое заболевание», как применяют здесь, относится к заболеванию кровеносных сосудов, происходящему от диабета. Осложнение диабетической макроваскулопатии возникает, например, когда сгустки жира и крови накапливаются в крупных кровеносных сосудах и прилипают к стенкам сосуда. Диабетические макроваскулопатиии включают в себя такие заболевания, как коронарное заболевание, цереброваскулярное заболевание и заболевание периферических сосудов, гипергиликемию и седечно-сосудистое заболевание, и инсульты.
2. Ожирение
Фактор некроза опухоли вовлечен в патофизиологию ожирения (смотри, например, Pihlajamaki J et al. (2003) Obes Res. 11:912; Barbieri et al. (2003) Am J Hypertens. 16:537; Tsuda et al. (2003) J Nutr. 133:2125). Термин «ожирение», как применяют здесь, относится к состоянию, при котором субъект обладает избытком жира в организме относительно безжировой массы тела. В одном варианте осуществления ожирение относится к состоянию, при котором масса индивидуума, по меньшей мере, приблизительно на 20% или более превышает максимальную массу, желательную при его росте. Если взрослый обладает более чем 100 фунтами избыточной массы, считают, что он или она обладает «болезненным ожирением» В другом варианте осуществления ожирение определяют как BMI (индекс массы тела) более 30 кг/м2. Ожирение увеличивает для человека риск болезни и смерти из-за диабета, инсульта, болезни коронарных артерий, гипертензии, высокого уровня холестерина и нарушений почек и желчного пузыря. Ожирение может также увеличивать риск некоторых типов рака и может являться фактором риска для развития остеоартрита и апноэ во сне.
K. Анемия
TNFα вовлечен в патофизиологию широкого ряда анемий (смотри, например, Jongen-Lavrencic et al. (1997) J. Rheumatol.24:15Q4; Demeter et al. (2002) Ann Hematol. 81:566; DiCato (2003) The Oncologist 8 (suppl 1):19). Изобретение относится к способу ингибирования активности TNFα у субъекта, страдающего от анемии, где способ включает в себя введение субъекту антитела, части антитела, так что ингибируют активность TNFα у субъекта, страдающего анемией. В одном варианте осуществления анемия связана с ревматоидным артритом.
Термин «анемия», как применяют здесь, относится к аномально низкому количеству циркулирующих красных клеток или уменьшенной концентрации гемоглобина в крови. Примеры анемии, связанной с ревматоидным артритом, включают в себя, например, хроническое заболевание анемией, железодефицитную анемию и аутоиммунную гемолитическую анемию. В одном варианте осуществления изобретение относится к способу лечения связанных анемий, например анемий, связанных с ревматоидным артритом, анемий из-за инфекций и хронических воспалительных заболеваний, железодефицитной анемии, аутоиммунной гемолитической анемии, миелофтизной анемии, апластической анемии, гипопластической анемии, истинной эритроцитарной аплазии и анемии, связанной с почечной недостаточностью или эндокринными нарушениями, мегалобластных анемий, дефектов синтеза гема или глобина, анемии, вызванной структурным дефектом красных клеток крови, например серповидноклеточной анемии, и анемий неизвестного происхождения, таких как сидеробластная анемия, анемии, связанной с хроническими инфекциями, такими как малярия, трипаносомоз, HIV, вирус гепатита или другие вирусы, и миелофтизных анемий, вызванных недостаточностью костного мозга.
Примеры моделей на животных, применяемых для изучения анемии, включают в себя крыс с инокуляцией полимеров пептидоглкан-полисахарид (смотри Coccia et al., (2001) Exp Hematology. 29:1201-1209). Примеры моделей на животных для изучения боли хорошо известны в данной области и включают в себя модель лигирования седалищного нерва у крыс и модель сегментарного лигирования спинномозгового нерва у крыс (смотри Bennett and Zie, (1988) Pain. 33:87-107; Kim and Chung, (1992) Pain 50:355-363).
L. Боль
TNFα вовлечен в патофизиологию широкого ряда болевых синдромов (смотри, например, Sorkin et al. (1997) Neuroscience. 81:255; Huygen et al. (2002) Mediators Inflamm. 11:47; Parada et al. (2003) Eur J Neurosci. 17: 1847). Термин «боль», как применяют здесь, относиться ко всем типам боли. Термин должен относиться к острой и хронической боли, такой как невропатическая боль и послеоперационная боль, хроническая боль в нижнем отделе спины, кластерная головная боль, невралгия при герпесе, фантомная боль в конечностях, центральная боль, зубная боль, устойчивая к опиоидам боль, висцеральная боль, хирургическая боль, боль при повреждении кости, боль во время схваток и родов, боль в результате ожогов, включая солнечные ожоги, послеродовая боль, мигрень, боль при ангине и связанная с мочеполовым трактом боль, включая цистит. Термин включает в себя также ноцицептивную боль или ноцицепцию.
Изобретение относится к способам ингибирования активности TNFα у субъекта, страдающего от такого болевого нарушения, где способ включает в себя введение субъекту антитела, части антитела, так что ингибируют активность TNFα у субъекта, страдающего от боли. Боль определяют различными способами, включая ноцицептивную боль и невропатическую боль. Наиболее часто испытываемую форму боли можно определить как эффект стимулирования нервных окончаний, который приводит к передаче импульса в головной мозг. Боль также обычно является связанной с воспалительными нарушениями, включая, например, ревматоидный артрит. В одном варианте осуществления антитело по изобретению используют для лечения субъекта, страдающего от боли, связанной с ревматоидным артритом. Примеры болевых нарушений, при которых активность TNFα является неблагоприятной, обсуждают далее ниже.
1. Невропатическая боль
Фактор некроза опухоли вовлечен в патофизиологию невропатической боли (смотри Sommer (1999) Schmerz. 13:315; Empl et al, (2001) Neurology. 56:1371; Schafers et al. (2003) J Neurosci. 23:3028). Как применяют здесь, термин «невропатическая боль» относится к боли, происходящей от повреждения нерва, спинного мозга или головного мозга, и часто включает в себя сверхчувствительность нейронов. Примеры невропатической боли включают в себя хроническую боль в нижнем отделе спины, боль, связанную с артритом, боль, связанную с раком, невралгию при герпесе, фантомную боль в конечностях, центральную боль, устойчивую к опиоидам невропатическую боль, боль при повреждении кости и боль во время схваток и родов. Другие примеры невропатической боли включают в себя послеоперационную боль, кластерную головную боль, зубную боль, хирургическую боль, боль в результате тяжелых ожогов, например, третьей степени, послеродовую боль, боль при ангине, связанную с мочеполовым трактом боль, включая цистит.
Невропатическую боль отличают от ноцицептивной боли. Боль, вовлекающая ноцицептивный механизм, обычно является ограниченной во времени периодом репарации ткани и, как правило, облегчается посредством доступных анальгетических средств или опиоидов (Myers (1995) Regional Anesthesia 20:173). Невропатическая боль, как правило, является долговременной или хронической и часто развивается спустя несколько суток или месяцев после начального острого повреждения ткани. Невропатическая боль может включать в себя персистирующую, спонтанную боль, а также аллодинию, которая представляет собой болезненный ответ на стимул, в норме не являющийся болезненным. Невропатическая боль также может характеризоваться гипералгезией, при которой присутствует усиленный ответ на болезненный стимул, который обычно является незначительным, такой как укол булавкой. В отличие от ноцицептивной боли, невропатическая боль, как правило, является устойчивой к терапии опиодами (Myers, выше, 1995). Соответственно, антитела, полученные с использованием способов по изобретению, можно использовать для лечения невропатической боли.
2. Ноцицептивная боль
Как применяют здесь, термин «ноцицептивная боль» относится к боли, которая переносится через нормальные интактные нейрональные пути, т.е. боли, вызванной повреждением организма. Ноцицептивная боль включает в себя соматическую чувствительность и нормальную функцию боли и информирует субъекта об угрожающем повреждении ткани. Ноцицептивный путь существует для защиты субъекта, например боль, испытываемая в ответ на ожог. Ноцицептивная боль включает в себя боль в кости, висцеральную боль и боль, связанную с мягкими тканями.
Фактор некроза опухоли вовлечен в патофизиологию висцеральной боли (смотри Coelho et al. (2000) Am J Physiol Gastrointest Liver Physiol. 279:G781; Coelho et al. (2000) Brain Res Bull. 52:223). Висцеральную боль используют для обозначения ноцицептивной боли, опосредованной рецепторами на нервных волокнах A-дельта и C. Нервные волокна A-дельта и C локализованы в коже, кости, соединительной ткани, мышцах и внутренних органах. Висцеральная боль может являться неопределенной по распределению, спазматической по природе, и ее обычно описывают как глубокую, ноющую, сдавливающую и коликообразную по природе. Примеры висцеральной боли включают в себя боль, связанную с сердечным приступом, где висцеральная боль может присутствовать слева в руке, шее и/или спине, и боль в капсуле печени, где висцеральную боль можно чувствовать в спине и/или правом плече. Соответственно, антитела, полученные с использованием изобретения, можно использовать для лечения висцеральной боли.
M. Нарушения печени
TNFα вовлечен в патофизиологию широкого ряда нарушений печени (смотри, например, Colletti et al (1990) J Clin Invest. 85: 1936; Tiegs (1997) Acta Gastroenterol Belg. 60:176; Fernandez et al. (2000) J Endotoxin Res. 6:321). Изобретение относится к способам ингибирования активности TNFα у субъекта, страдающего от такого нарушения печени.
Как применяют здесь, термин «нарушение печени, при котором активность TNFα является неблагоприятной» предназначен, чтобы включать в себя заболевания и другие нарушения в печени или состояния, связанные с повреждением клеток печени или нарушениями желчных путей, при которых показали или подозревают, что присутствие TNFα у субъекта, страдающего от нарушения, либо отвечает за патофизиологию нарушения, либо является фактором, вносящим вклад в ухудшение нарушения. Соответственно, нарушение печени, при котором активность TNFα является неблагоприятной, представляет собой нарушение, при котором ожидают, что активность TNFα будет облегчать симптомы и/или прогрессию нарушения печени. В одном варианте осуществления нарушения печени относятся к заболеванию печени человека или состоянию, связанному с повреждением клеток печени, или нарушению желчных путей, исключая гепатит, алкогольный гепатит и вирусный гепатит.
Примеры моделей на животных, применяемых для оценки терапевтической эффективности средства для лечения нарушения печени с использованием способов множественной переменной дозы, включают в себя модель с вирусом гепатита C на шимпанзе (смотри Shimizu et al. (1990) Proc Natl Acad Sci. USA 87:6441). Примеры моделей на животных, применяемых для исследования нарушения кожи и ногтей, включают в себя, например, модель тяжелого комбинированного иммунодефицита (SCID) на мышах (псориаз), цыплятах линии Smith (SL) и мышах с депигментацией (витилиго) (смотри Nickoloff (2000) Investig Dermatol Symp Proc. 5:67; Austin et al. (1995) Am J Pathol. 146: 1529; Lerner et al (1986) J Invest Dermatol. 87:299).
Нарушения печени включают в себя многие заболевания и нарушения, где печень функционирует неправильно или прекращает функционировать. Повреждения клеток печени могут включать в себя алкогольный цирроз, дефицит α1 антитрипсина, аутоиммунный цирроз, криптогенный цирроз, скоротечный гепатит, гепатит B и C и стеатогепатит. Примеры нарушений желчных путей включают в себя кистозный фиброз, первичный биллиарный цирроз, склерозирующий холангит и обструкцию желчных путей (Wiesner (1996) «Current Indications, Contra Indications and Timing for Liver Transplantation» in Transplantation of the Liver, Saunders (publ.); Busuttil and Klintmalm (eds.) Chapter 6; Klein (1998) Partial Hypertension: The Role of Liver Transplantation, Musby (publ.) in Current Surgical Therapy 6.sup.th Ed. Cameron, J. (ed)).
Термин «гепатит» относится к воспалению печени. Гепатит может являться вызванным инфекциями различными организмами, включая бактерии, вирусы (гепатит A, B, C и т.д.) или паразитов. Химические токсины, такие как спирт, лекарственные средства или ядовитые грибы, также могут повреждать печень и вызывать воспаление в ней. Редкий, однако чрезвычайно опасный, случай гепатита происходит от передозировки ацетаминофена (Tylenol), что может являться смертельным. Кроме того, иммунные клетки организма могут атаковать печень и вызывать аутоиммунный гепатит. Гепатит может проходить быстро (острый гепатит) или вызывать продолжительное заболевание (хронический гепатит). В некоторых случаях результатом может являться прогрессирующее повреждение печени или печеночная недостаточность. Заболеваемость гепатитом и его тяжесть меняются в зависимости от многих факторов, включая причину повреждения печени и любое основное заболевание пациента.
В одном варианте осуществления изобретение относится к способам лечения нарушения печени, при котором активность TNFα является неблагоприятной, включая введение субъекту эффективного количества ингибитора TNFα в дозе для индукции, а затем в дозе для лечения, так что лечат указанное нарушение. В одном варианте осуществления нарушение печени выбрано из группы, состоящей из инфекции вирусом гепатита C, аутоиммунного гепатита, жировой инфильтрации печени, инфекции вирусом гепатита B, гепатотоксичности и неалкогольного гепатита, включая неалкогольный стеатогепатит (NASH). Примеры нарушений печени описаны далее ниже.
1. Вирус гепатита C (HCV)
Фактор некроза опухоли вовлечен в патофизиологию инфекции вирусом гепатита C (смотри Gonzalez-Amaro. (1994) J Exp Med. 179:841; Nelson et al. (1997) Dig Dis Sci 42:2487; Kallinowski et al. (1998) Clin Exp Immunol. 111:269). Термин «вирус гепатита C» или «HCV» используют для описания вируса гепатита, который является возбудителем заболевания гепатита не-A, не-B. Вирус гепатита C вызывает воспаление печени. Инфекция HCV вызывает гепатит C. Гепатит C в острой стадии, как правило, мягче, чем гепатит B, однако, более значительная часть таких инфекций становятся хроническими. HCV является главной причиной острого гепатита и хронического заболевания печени, включая цирроз и рак печени. HCV представляет собой один из вирусов (A, B, C, D и E), которые вместе ответственны за подавляющее большинство случаев вирусного гепатита. Он представляет собой оболочечный РНК-вирус семейства флавивирусов, которые, по-видимому, обладают узким кругом хозяев. Важным свойством вируса является относительная мутабельность его генома, которая, в свою очередь, вероятно, связана с высокой предрасположенностью (80%) к индукции хронической инфекции. HCV является кластеризованным в несколько отдельных генотипов, которые могут являться важными для определения тяжести заболевания и ответа на лечение. В одном варианте осуществления изобретение относится к способу множественной переменной дозы для лечения HCV.
2. Аутоиммунный гепатит (AIH)
Фактор некроза опухоли вовлечен в патофизиологию аутоиммунного гепатита (смотри Cookson et al., (1999) Hepatology 30:851; Jazrawi et al., (2003) Liver Transpl. 9:377). Как применяют здесь, «аутоиммунный гепатит» относится к нарушению печени, характеризующемуся воспалением печени, вызванным уклоняющимися иммунными клетками, которые принимают нормальные клетки печени за чужеродную ткань или патоген (возбудитель заболевания). Аутоиммунный гепатит часто отвечает за прогрессирующее разрушение паренхимы печени с высокой смертностью, если его оставить без лечения (Johnson et al. (1993) Hepatology, 18:998). Одной из характеристик аутоиммунного гепатита является присутствие циркулирующих аутоантител в сыворотке почти у 90% пациентов. Такие антитела можно использовать для идентификации субъектов с аутоиммунным гепатитом.
Клинические и серологические различия между пациентами привели к классификации AEH на два типа. Тип 1 характеризуется присутствием антител против гладкой мускулатуры (SMA) и/или против ядерных антигенов (ANA) в сыворотке пациентов, в то время как в сыворотке пациентов типа II показали антитела к микросомам печени и почек типа 1 (LKM1) (Homberg et al., (1987) Hepatology, 7:1333; Maggiore et al. (1993) J. Pediatr. Gastroenterol Nutr. 17:376). Серологический маркер, антитела к цитозольному печеночному антигену типа 1 (LC1), идентифицировали у 30% пациентов с AIH типа II. Кроме того, показали, что LC1 является единственным серологическим маркером у 10% тестированных пациентов (Martini et al. (1988) Hepatology, 8:1662). В одном варианте осуществления способ по изобретению используют для лечения AIH.
3. Жировая инфильтрация печени
Фактор некроза опухоли вовлечен в патофизиологию жировой инфильтрации печени (смотри Valenti et al, (2002) Gastroenerology 122:274; Li et al, (2003) Hepatology 37:343). Жировая инфильтрация печени относится к заболеванию, где жир (гепатоциты) избыточно накапливается в печени. Считают, что жировая инфильтрация печени вызвана перееданием, избыточным употреблением алкоголя, диабетом и побочными эффектами из-за введения лекарственных средств. Жировая инфильтрация печени может вызывать тяжелые заболевания, такие как хронический гепатит и цирроз печени. У пациентов с жировой инфильтрацией печени липиды, в частности нейтральный жир, накапливаются в гепатоцитах в такой степени, что количество превышает физиологически допустимый диапазон. С биохимической точки зрения, стандартом для заключения о жировой инфильтрации печени является то, что масса нейтрального жира составляет приблизительно 10% (100 мг/г массы во влажном состоянии) или более от массы ткани печени во влажном состоянии. В одном варианте осуществления способ по изобретению используют для лечения жировой инфильтрации печени.
4. Вирус гепатита B (HBV)
Фактор некроза опухоли вовлечен в патофизиологию инфекции вирусом гепатита B (смотри Kasahara et al, (2003) J Virol 77:2469; Wang (2003) World J Gastroenterol. 9:641; Biermer et al (2003) J Virol 77:4033). Термин «вирус гепатита B» (HBV) используют для описания вируса (вируса сывороточного гепатита), который вызывает вирусный гепатит типа B у человека. Это вирусное заболевание с длительным инкубационным периодом (приблизительно 50-160 суток), в отличие от вируса гепатита A (вируса инфекционного гепатита), который обладает коротким инкубационным периодом. Вирус гепатита B обычно передается посредством инъекции инфицированной крови или производных крови или просто посредством использования зараженных игл, ланцетов или других инструментов. Клинически и патологически заболевание является сходным с вирусным гепатитом типа A; однако, не существует перекрестно-реактивного иммунитета. Вирусный антиген (HBAg) обнаружили в сыворотке после инфекции. Вирус гепатита B инфицирует людей с очень высокой частотой. Большинство людей, инфицированных гепатитом B, освобождаются от вируса в течение 6 месяцев, где короткая инфекция известна как «острый» случай гепатита B. Определили, что, по меньшей мере, приблизительно 300 миллионов человек являются хроническими носителями HBV. Инфекция вирусом приводит к ряду клинических симптомов, включая от незначительных гриппозных симптомов до смерти. В одном варианте осуществления способ множественной переменной дозы по изобретению используют для лечения инфекции HBV.
5. Гепатотоксичность
Фактор некроза опухоли вовлечен в патофизиологию гепатотоксичности (смотри Bruccoleri et al. (1997) Hepatology 25:133; Luster et al (2000) Ann NY Acad Sci. 919:214; Simeonova et al. (2001) Toxicol Appl Pharmacol. 177:112). Термин гепатотоксичность относится к повреждению печени, вызванному лекарственными средствами и другими химическими веществами или наркотиками. Наилучшим показателем для идентификации токсичности для печени у субъекта является повышение при измерении в крови конкретных ферментов, таких как AST (аспартатаминотрансфераза), ALT (аланинаминотрансфераза) и GOT (глутаматоксалоацетаттрансаминаза).
Гепатотоксичность может вызывать постоянное повреждение и смерть. Начальные симптомы гепатотоксичности могут включать в себя симптомы желудочно-кишечного тракта, например тяжелую диарею. Вторая фаза гепатотоксичности характеризуется ослаблением симптомов. Во время этого кажущегося облегчения появляются биохимические доказательства повреждения печени. Олигурия (уменьшенное выделение мочи) является обычной во время второй фазы. Третья фаза, которая выявляет повреждение печени, становится клинически очевидной через 3-5 суток после употребления химического вещества, с появлением желтухи. Может возникать также почечная недостаточность. Симптомы химически индуцированного (индуцированного лекарственным средством) гепатита являются сходными с симптомами инфекционного гепатита. В одном варианте осуществления способ по изобретению используют для лечения гепатотоксичности.
6. Печеночная недостаточность (например, хроническая печеночная недостаточность)
Фактор некроза опухоли вовлечен в патофизиологию печеночной недостаточности (например, хронической печеночной недостаточности) (смотри Takenaka et al, (1998) Dig Dis Sci. 43:887; Nagaki et al. (1999) J Hepatol. 31:997; Streetz et al., (2000) Gastroenterology. 119:446). Печеночная недостаточность, включая хроническую печеночную недостаточность, обычно развивается в течение периода нескольких лет и вызвана повторяющимися повреждающими факторами для печени (такими как алкогольная зависимость или инфекция вирусом гепатита), которые медленно разрушают орган. Менее обычно, печеночная недостаточность является острой и возникает в течение периода нескольких суток или недель. Причины острой печеночной недостаточности включают в себя инфекции вирусом гепатита, лекарственные средства, беременность, аутоиммунное заболевание и неожиданный низкий приток крови к печени. В одном варианте осуществления способ по изобретению используют для лечения печеночной недостаточности.
7. Неалкогольный гепатит, включая NASH
Фактор некроза опухоли вовлечен в патофизиологию неалкогольного гепатита, включая неалкогольный стеатогепатит (смотри Crespo et al., (2001) Hepatology. 34:1158; Pessayre et al. (2002) 282(2):G193). Термин «неалкогольный стеатогепатит» или «NASH» относится к развитию гистологических изменений в печени, сравнимых с изменениями, вызванными избыточным употреблением алкоголя, но в отсутствие алкогольной зависимости. NASH характеризуется макровезикулярным и/или микровезикулярным стеатозом, лобулярным и портальным воспалением и, иногда, тельцами Мэллори с фиброзом и циррозом. NASH также обычно связан с гиперлипидемией, ожирением и сахарным диабетом типа II.
Дополнительные клинические состояния, которые характеризуются стеатозом печени и воспалением, включают в себя избыточное голодание, еюноилеальное шунтирование, полностью парентеральное питание, хронический гепатит C, болезнь Вильсона и вредные эффекты лекарственных средств, такие как эффекты кортикостероидов, блокаторов кальциевых каналов, высоких доз синтетических эстрогенов, метотрексата и амиодарона. Таким образом, термин «неалкогольный стеатогепатит» можно использовать для описания пациентов с такими обнаружениями при биопсии, в сочетании с отсутствием (a) значительного употребления алкоголя, (b) предшествующей хирургической операции для уменьшения массы, (c) истории применения лекарственных средств, связанного со стеатогепатитом, (d) доказательства генетического заболевания печени или (e) хронической инфекция гепатитом C (смотри, например, Ludwig et ah, (1980) Mayo Clin. Proc. 55:434; Powell et al. (1990) Hepatol. 11:74). В одном варианте осуществления антитела, полученные с использованием способа по изобретению, используют для лечения NASH.
N. Повреждения кожи и ногтей
Фактор некроза опухоли вовлечен в патофизиологию повреждений кожи и ногтей. В одном варианте осуществления антитела, полученные с использованием способа по изобретению, вводят для лечения повреждений кожи и ногтей. Термин «повреждение кожи» или «заболевание кожи» применяют здесь взаимозаменяемо для обозначения аномалий кожи, отличных от раневого повреждения, которые индуцируют состояние воспаления. В одном варианте осуществления повреждение кожи по изобретению представляет собой воспалительное повреждение кожи, где кожа характеризуется расширением капилляров, инфильтрацией лейкоцитов, покраснением, нагревом и/или болью. Повреждения кожи включают в себя в качестве неограничивающих примеров псориаз, обыкновенную пузырчатку, склеродермию, атопический дерматит, саркоидоз, узловатую эритему, гнойный гидраденит, красный плоский лишай, синдром Свита и витилиго. Как применяют здесь, термин «повреждение кожи и ногтей, при котором активность TNFα является неблагоприятной» предназначен, чтобы включать в себя повреждения кожи и/или ногтей и другие нарушения, при которых показали или подозревают, что присутствие TNFα у субъекта, страдающего от нарушения, либо отвечает за патофизиологию нарушения, либо является фактором, который вносит вклад в ухудшение нарушения, например псориаза. Соответственно, повреждения кожи и ногтей, при которых активность TNFα является неблагоприятной, представляют собой нарушения, при которых ожидают, что ингибирование активности TNFα облегчит симптомы и/или прогрессирование нарушения. Применение антител, частей антител и других ингибиторов TNFα по изобретению для лечения конкретных повреждений кожи и ногтей обсуждают далее ниже. В конкретных вариантах осуществления способ лечения по изобретению осуществляют в сочетании с другим лекарственным средством, как описано ниже. В одном варианте осуществления антитела, полученные с использованием способа по изобретению, включая введение антитела против TNFα в сочетании с другим лекарственным средством, используют для лечения псориаза и лечения псориаза, связанного с артритом.
1. Псориаз
Фактор некроза опухоли вовлечен в патофизиологию псориаза (Takematsu et al. (1989) Arch Dermatol Res. 281:398; Victor and Gottlieb (2002); J Drugs Dermatol. 1:264). Термин «псориаз», как применяют здесь, относится к повреждениям кожи, связанным с гиперплазией эпидермиса. Псориаз включает в себя в качестве неограничивающих примеров хронический пятнистый псориаз, каплевидный псориаз, инверсный псориаз, пустулезный псориаз, обычный псориаз и эритродермический псориаз. Псориаз может также являться связанным с другими воспалительными нарушениями, включая воспалительное заболевание кишечника (IBD) и ревматоидный артрит (RA).
Псориаз описывают как воспаление кожи (раздражение и покраснение), характеризующееся частыми эпизодами покраснения, зуда и толстыми, сухими, серебристыми чешуйками на коже. В частности, формируются поражения, вовлекающие первичные и вторичные изменения пролиферации эпидермиса, воспалительные ответы кожи и экспрессию регуляторных молекул, таких как лимфокины и факторы воспаления. Кожа при псориазе морфологически характеризуется усиленной заменой эпидермальных клеток, утолщением эпидермиса, аномальной кератинизацией, инфильтрацией воспалительных клеток в эпидермис и инфильтрацией полиморфно-ядерных лейкоцитов и лимфоцитов в слой эпидермиса, что приводит к увеличению цикла базальных клеток. Псориаз часто затрагивает ногти, для которых часто наблюдают выкрашивание, отделение ногтя, утолщение и обесцвечивание. Псориаз часто связан с другими воспалительными нарушениями, например артритом, включая ревматоидный артрит, воспалительным заболеванием кишечника (IBD) и болезнью Крона. Приблизительно одна треть субъектов с псориазом страдают также псориатическим артритом (PsA), который, как описано выше, вызывает тугоподвижность, опухание суставов, боль и уменьшенный диапазон движений (Greaves et al. (1995) N. Eng. J. Med. 332:581).
Признаки псориаза наиболее часто наблюдают на туловище, локтях, коленях, коже головы, в складках кожи или на ногтях пальцев рук, однако он может повреждать любую или все части кожи. В норме, для новой клетки кожи требуется приблизительно месяц, чтобы подняться от нижних слоев к поверхности. При псориазе этот процесс занимает только несколько суток, приводя к накоплению мертвых клеток кожи и образованию толстых чешуек. Симптомы псориаза включают в себя: пятна на коже, которые являются сухими или красными, покрытие серебристыми чешуйками, приподнятые участки кожи, сопровождающиеся красными границами, которые могут трескаться и становиться болезненными и которые обычно локализованы на локтях, коленях, туловище, коже головы и руках; поражения кожи, включая пустулы, трещины кожи и покраснение кожи; боль в суставах или боль, которая может являться связанной с артритом, например псориатическим артритом.
Лечение псориаза часто включает в себя местные кортикостероиды, аналоги витамина D, и местные или пероральные ретиноиды или их сочетания. В одном варианте осуществления антитело против TNFα по изобретению вводят в сочетании с одним из этих общепринятых лекарственных средств или в их присутствии. Дополнительные лекарственные средства, которые можно сочетать с антителом против TNFα, полученным с использованием способов по изобретению, для лечения псориаза, более подробно описаны ниже.
Диагноз «псориаз» обычно основан на внешнем виде кожи. Кроме того, может потребоваться биопсия или соскабливание кожи и культивирование фрагментов кожи, чтобы исключить другие повреждения кожи. Можно использовать рентген для проверки псориатического артрита, если боль в суставах присутствует и является персистирующей.
Улучшения при псориазе у субъекта можно мониторировать по показателям индекса площади и тяжести псориаза (PASI). Способ для определения PASI описан в Fredriksson and Pettersson (1978) Dermatologica 157:238 и Marks et al (1989) Arch Dermatol 125:235. Коротко, индекс основан на оценке четырех анатомических участков, включая голову, верхние конечности, туловище и нижние конечности, по покраснению, уплотнению и шелушению с использованием 5-балльной шкалы (0 - отсутствие симптомов; 1 - слабые; 2 - умеренные; 3 - выраженные; 4 - очень выраженные). На основании степени поражения в данном анатомическом участке пораженной области приписывают числовое значение (0=0; 1=<10%; 2=10-29%; 3=30-49%; 4=50-69%; 5=70=89%; 6=90-100%). Затем рассчитывают показатель PASI, где возможный диапазон PASI составляет 0,0-72,0, где наивысший балл представляет полную эритродерму самой тяжелой степени.
В одном варианте осуществления изобретения антитело против TNFα используют для лечения псориаза, включая хронический пятнистый псориаз, каплевидный псориаз, инверсный псориаз, пустулезный псориаз, обыкновенную пузырчатку, эритродермический псориаз, псориаз, связанный с воспалительным заболеванием кишечника (IBD), и псориаз, связанный с ревматоидным артритом (RA). В другом варианте осуществления антитело против TNFα, такое как адалимумаб, используют для лечения субъектов с псориазом в сочетании с PsA. Конкретные типы псориаза, включенные в способы лечения по изобретению, подробно описаны ниже.
a. Хронический пятнистый псориаз
Фактор некроза опухоли вовлечен в патофизиологию хронического пятнистого псориаза (Asadullah et al. (1999) Br J Dermatol.141:94). Хронический пятнистый псориаз (обозначаемый также как обычный псориаз) является наиболее распространенной формой псориаза. Хронический пятнистый псориаз характеризуется приподнятыми покрасневшими участками кожи в диапазоне от размера монеты до значительно больших. При хроническом пятнистом псориазе пятна могут являться одиночными или множественными, они могут меняться по размеру от нескольких миллиметров до нескольких сантиметров. Пятна обычно являются красными с чешуйчатой поверхностью и отражают свет при осторожном почесывании, создавая «серебристый» эффект. Повреждения (которые часто являются симметричными) от хронического пятнистого псориаза возникают по всему телу, но с предрасположенностью к внешним поверхностям, включая колени, локти, пояснично-крестцовые области, кожу головы и ногти. Иногда хронический пятнистый псориаз может возникать на половом члене, женских наружных половых органах и в складках, однако, шелушение обычно отсутствует. Диагноз для пациентов с хроническим пятнистым псориазом обычно основан на клинических признаках, описанных выше. В частности, распределение, цвет и типичное серебристое шелушение очагов при хроническом пятнистом псориазе являются характерными для хронического пятнистого псориаза.
b. Каплевидный псориаз
Каплевидный псориаз относится к форме псориаза с характерными чешуйчатыми бляшками в форме капель воды. Обострения каплевидного псориаза обычно следуют за инфекцией, что особенно касается стрептококковой инфекции горла. Диагноз каплевидный псориаз обычно основан на внешнем виде кожи и том факте, что часто присутствует история недавней боли в горле.
c. Инверсный псориаз
Инверсный псориаз представляет собой форму псориаза, при которой пациент обладает гладкими, обычно влажными областями кожи, которые являются красными и воспаленными, что отличается от шелушения, связанного с пятнистым псориазом. Инверсный псориаз обозначают так же как интертригинозный псориаз с опрелостью или псориаз в сгибах. Инверсный псориаз возникает главным образом в подмышечных впадинах, в паховой области, под молочными железами и в других складках кожи около гениталий и ягодиц, и, в результате локализации проявлений, трение и потение могут раздражать пораженные области.
d. Пустулезный псориаз
Пустулезный псориаз, обозначаемый также как ладонно-подошвенный псориаз, представляет собой форму псориаза, который вызывает заполненные гноем пузыри, которые различаются по размеру и локализации, но часто возникают на руках и ступнях. Пузыри могут являться локализованными или распространяться по большим областям тела. Пустулезный псориаз может быть как ноющим, так и болезненным, может вызывать лихорадки.
e. Другие псориатические нарушения
Другие примеры псориатических нарушений, которые можно лечить антителом против TNFα, полученным с использованием способов по изобретению, включают в себя эритродермический псориаз, обыкновенный, псориаз, связанный с IBD, и псориаз, связанный с артритом, включая ревматоидный артрит.
2. Обыкновенная пузырчатка
Обыкновенная пузырчатка представляет собой серьезное аутоиммунное системное дерматологическое заболевание, которое часто поражает мембрану слизистой оболочки полости рта и кожу. Считают, что патогенез обыкновенной пузырчатки является аутоиммунным процессом, направленным на десмосомы кожи и мембраны слизистой оболочки полости рта. Затем клетки не проявляют адгезию друг с другом. Нарушение проявляется в виде больших наполненных жидкостью, чувствительных к разрыву пузырей и обладает типичными гистологическими признаками. Противовоспалительные средства являются единственной эффективной терапией для этого заболевания, обладающего высоким уровнем смертности. Осложнения, возникающие у пациентов, страдающих обыкновенной пузырчаткой, представляют собой хроническую боль, нарушения с потерей питательных веществ и жидкости и инфекции.
3. Атопический дерматит/экзема
Атопический дерматит (обозначаемый также как экзема) представляет собой хроническое повреждение кожи, классифицируемое по чешуйчатым и зудящим бляшкам. Люди с экземой часто обладают семейной историей аллергических состояний, таких как астма, поллиноз или экзема. Атопический дерматит представляет собой реакцию гиперчувствительности (сходную с аллергией), которая возникает на коже, вызывая хроническое воспаление. Воспаление заставляет кожу зудеть и шелушиться. Хроническое раздражение и расчесывание может приводить к утолщению и кожистой фактуре кожи. Воздействие внешних раздражителей может ухудшать симптомы, так же, как сухость кожи, воздействие воды, изменения температуры и стресс.
Субъектов с атопическим дерматитом можно идентифицировать по конкретным симптомам, которые часто включают в себя интенсивный зуд, волдыри с намоканием и образованием корки, покраснение кожи или воспаление вокруг волдырей, сыпь, сухие, кожистые области кожи, грубые области кожи из-за расчесывания и выделение/кровотечение из ушей.
4. Саркоидоз
Саркоидоз представляет собой заболевание, при котором гранулематозное воспаление возникает в лимфатических узлах, легких, печени, глазах, коже и/или других тканях. Саркоидоз включает в себя кожный саркоидоз (саркоидоз кожи) и нодулярный саркоидоз (саркоидоз лимфатических узлов). Пациентов с саркоидозом можно идентифицировать по симптомам, которые часто включают в себя общий дискомфорт, беспокойство или чувство нездоровья; лихорадку; поражения кожи.
5. Узловатая эритема
Узловатая эритема относится к воспалительному нарушению, которое характеризуется ноющими красными узлами под кожей, как правило на передней части голени. Поражения, связанные с узловатой эритемой, часто начинаются как плоские, но твердые, горячие красные болезненные шишки (приблизительно дюйм в поперечнике). Через несколько суток повреждения могут стать пурпурными и затем через несколько недель спадают до коричневого плоского пятна.
В некоторых случаях узловатая эритема может являться связанной с инфекциями, включая инфекцию стрептококком, кокцидиоидомикоз, туберкулез, гепатит B, сифилис, заболевание от кошачьих царапин, туляремию, инфекцию иерсиниями, лептоспироз, пситтакоз, гистоплазмоз, мононуклеоз (EBV). В других случаях узловатая эритема может являться связанной с чувствительностью к конкретным лекарственным средствам, включая пероральные контрацептивы, пенициллин, сульфонамиды, сульфоны, барбитураты, гидантоин, фенацетин, салицилаты, иодиды и прогестин. Узловатая эритема часто связана с другими нарушениями, включая лейкоз, саркоидоз, ревматическую атаку и язвенный колит.
Симптомы узловатой эритемы обычно проявляются на голенях, однако, очаги могут возникать также на других областях тела, включая ягодицы, икры, голеностопные суставы, бедра и верхние конечности. Другие симптомы у субъектов с узловатой эритемой могут включать в себя лихорадку и дискомфорт.
6. Гнойный гидраденит
Гнойный гидраденит относится к поражению кожи, при котором распухшие, болезненные воспаленные очаги или шишки развиваются в паховой области и иногда в подмышечных впадинах и под молочными железами. Гнойный гидраденит возникает, когда выходы апокринных желез становятся заблокированными при потении или неспособны к нормальному осушению из-за неполного развития железы. Секреты, удерживаемые в железах, вытесняют пот и бактерии в окружающие ткани, вызывая подкожное уплотнение, воспаление и инфекцию. Гнойный гидраденит является ограниченным областями организма, которые содержат апокринные железы. Эти области представляют собой подмышечные впадины, ареолу соска, паховую область, промежность, области около ануса и пупка.
7. Красный плоский лишай
Фактор некроза опухоли вовлечен в патофизиологию красного плоского лишая (Sklavounou et al. (2000) J Oral Pathol Med. 29:370). Красный плоский лишай относится к нарушению кожи и мембран слизистых оболочек, приводящему к воспалению, зуду и характерным повреждениям кожи. Красный плоский лишай может быть связанным с гепатитом C или конкретными лекарственными средствами.
8. Синдром Свита
Воспалительные цитокины, включая фактор некроза опухоли, вовлечены в патофизиологию синдрома Свита (Reuss-Borst et al. (1993) Br J Haematol. 84:356). Синдром Свита, описанный R.D. Sweet в 1964, характеризуется неожиданным началом лихорадки, лейкоцитозом и кожным высыпанием. Высыпание состоит из ноющих эритематозных, хорошо разделенных папул и бляшек, для которых наблюдают под микроскопом плотные инфильтраты нейтрофилов. Поражения могут возникать в любом месте, но преимущественно в верхней части тела, включая лицо. Отдельные поражения часто описывают как псевдовезикулярные или псевдопустулезные, но они могут являться явно пустулезными, буллезными или язвенными. Часто публикуют вовлечение полости рта и глаза (конъюнктивит или эписклерит) у пациентов с синдромом Свита. Лейкоз также связан с синдромом Свита.
9. Витилиго
Витилиго относится к состоянию кожи, при котором присутствует потеря пигмента из областей кожи, что приводит к неравномерным белым пятнам с нормальной текстурой кожи. Поражения, характерные для витилиго, выглядят как плоские депигментированные области. Границы поражений являются четко определенными, но неровными. Часто поражаемые области у субъектов с витилиго включают в себя лицо, локти и колени, руки и ноги и гениталии.
10. Склеродермия
Фактор некроза опухоли вовлечен в патофизиологию склеродермии (Tutuncu et al. (2002) Clin Exp Rheumatol 20(6 Suppl 28):S146; Mackiewicz et al (2003) Clin Exp Rheumatol. 21:41; Murota et a (2003) Arthritis Rheum. 48:1117). Склеродермия относится к диффузному заболеванию соединительной ткани, характеризующемуся изменениями кожи, кровеносных сосудов, скелетных мышц и внутренних органов. Склеродермию также обозначают синдром CREST или прогрессивная системная склеродермия, и она обычно поражает людей в возрасте между 30-50 годами. Женщины более часто являются пораженными, чем мужчины.
Причина склеродермии неизвестна. Заболевание может вызывать местные или системные симптомы. Течение и тяжесть заболевания широко меняются у пораженных. Симптомы вызывает избыток отложений коллагена в коже и других органах. Происходит также разрушение малых кровеносных сосудов в коже и пораженных органах. В коже могут происходить изъязвление, кальциноз и изменения пигментации. Системные признаки могут включать в себя фиброз и дегенерацию сердца, легких, почек и желудочно-кишечного тракта.
Для пациентов, страдающих склеродермией, показали конкретные клинические признаки, включая побеление, синеву или покраснение пальцев рук и ног в ответ на тепло и холод (феномен Рейно), боль, тугоподвижность и опухание пальцев и суставов, утолщение кожи и лоснящиеся кисти и предплечья, желудочно-пищеводный рефлюкс или изжогу, трудность глотания и затруднение дыхания. Другие клинические симптомы, применяемые для диагностики склеродермии, включают в себя повышенную скорость оседания эритроцитов (ESR), увеличенный ревматоидный фактор (RF), положительный тест на антиядерные антитела, анализ мочи, при котором показывают белок и микроскопические количества крови, рентгеновский анализ грудной клетки, при котором могут показывать фиброз, и исследования функции легких, при которых показывают рестриктивный легочный процесс.
11. Повреждения ногтей
Повреждения ногтей включают в себя любую аномалию ногтей. Термин «повреждение ногтей» или «заболевание ногтей», как применяют здесь, относится к состояниям, где ногти пальцев рук или ногти пальцев ног обладают аномальным цветом, формой, текстурой или толщиной. Специфические повреждения ногтей включают в себя, в качестве неограничивающих примеров, выкрашивание, койлонихию, линии Бо, ложкообразные ногти, онихолизис, желтые ногти, птеригий (наблюдаемый при красном плоском лишае) и лейконихию. Выкрашивание характеризуется присутствием малых выемок на поверхности ногтя. Бугорки или линейные возвышения могут развиваться на ногте, возникая в «продольном» или «поперечном» направлении. Линии Бо являются линейными выемками, которые возникают «поперечно» (поперек) ногтя пальца руки. Лейконихия описывает белые штрихи или пятна на ногтях. Койлонихия представляет собой аномальную форму ногтей пальцев рук, где ноготь обладает поднятыми бугорками и является тонким и вогнутым. Койлонихия часто связана с дефицитом железа.
Повреждения ногтей, которые можно лечить с помощью антитела против TNFα по изобретению, включают в себя пораженные псориазом ногти. Пораженные псориазом ногти включают в себя изменения ногтей, которые можно отнести к псориазу. В некоторых случаях псориаз может возникать только на ногтях и нигде больше в организме. Псориатические изменения ногтей лежат в диапазоне от мягких до тяжелых, как правило, отражая степень затрагивания псориазом ногтевой пластинки, матрикса ногтя, т.е. ткани, из которой растет ноготь, ногтевого ложа, т.е. ткани под ногтем и кожи в основании ногтя. Повреждение ногтевого ложа псориазом пустулезного типа может приводить к потере ногтя. Изменения ногтя при псориазе попадают в общие категории, которые могут возникать по отдельности или все вместе. В одной категории пораженных псориазом ногтей ногтевая пластинка глубоко выкрашивается, возможно, из-за дефектов роста ногтей, вызванных псориазом. В другой категории ноготь обладает обесцвечиванием, от желтого до желто-розового, возможно, из-за затрагивания псориазом ногтевого ложа. Третий подтип пораженных псориазом ногтей характеризуется белыми областями, которые появляются под ногтевой пластинкой. Белые области фактически представляют собой отмеченные пузырьками воздуха пятна, где ногтевая пластинка становится отсоединенной от ногтевого ложа. Может присутствовать также покраснение кожи вокруг ногтя. Четвертую категорию доказывают по выкрашиванию ногтевой пластинки в желтоватых пятнах, т.е. ониходистрофии, возможно, вызванному затрагиванием псориазом матрикса ногтя. Пятую категорию характеризуют полной потерей ногтя из-за затрагивания псориазом матрикса ногтя и ногтевого ложа. Антитела, полученные с использованием способа по изобретению, можно также использовать для лечения повреждений ногтей, часто связанных с красным плоским лишаем. Для ногтей субъектов с красным плоским лишаем часто показывают истончение и шероховатость поверхности ногтевой пластинки с продольными неровностями или птеригием.
Антитела, полученные с использованием изобретения, можно использовать для лечения повреждений ногтей, таких как описанные здесь. Часто повреждения ногтей связаны с повреждениями кожи. В одном варианте осуществления изобретение относится к лечению повреждений ногтей с использованием антитела против TNFα. В другом варианте осуществления повреждение ногтей связано с другим нарушением, включая повреждение кожи, такое как псориаз. В другом варианте осуществления нарушение, связанное с повреждением ногтей, представляет собой артрит, включая псориатический артрит.
12. Другие повреждения кожи и ногтей
Антитела, полученные с использованием способа по изобретению, можно использовать для лечения других повреждений кожи и ногтей, таких как хронический актинический дерматит, буллезный пемфигоид и круговая алопеция. Хронический актинический дерматит (CAD) обозначают так же как синдром фоточувствительного дерматита/актинического ретикулоида (PD/AR). CAD представляет собой состояние, при котором кожа становится воспаленной, в частности, в областях, которые подвергались воздействию солнечного света или искусственного света. Обычно пациенты с CAD страдают аллергией на конкретные вещества, которые приходят в контакт с их кожей, в частности различные цветы, деревья, парфюмерные изделия, солнцезащитные средства и соединения каучука. Буллезный пемфигоид относится к повреждению кожи, характеризующемуся образованием больших волдырей на туловище и конечностях. Круговая алопеция относится к потере волос, характеризующейся круглыми участками полного облысения на коже головы или в бороде.
O. Васкулиты
TNFα вовлечен в патофизиологию ряда васкулитов (смотри, например, Deguchi et al. (1989) Lancet.2:745). В одном варианте осуществления изобретение относится к способу множественной переменной дозы для ингибирования активности TNFα у субъекта, страдающего от васкулита, при котором активность TNFα является неблагоприятной. Термин «васкулит» или «васкулиты», как применяют взаимозаменяемо здесь, относится к группе нарушений, характеризующихся воспалением кровеносных сосудов. Кровеносные сосуды всех размеров могут являться пораженными, от самого крупного сосуда в организме (аорты) до самых маленьких сосудов в коже (капилляров). Размер пораженных кровеносных сосудов меняется в соответствии с конкретным типом васкулита. Как применяют здесь, термин «васкулит, при котором активность TNFα является неблагоприятной» предназначен, чтобы включать в себя васкулит, при котором показали или подозревают, что присутствие TNFα у субъекта, страдающего от нарушения, либо отвечает за патофизиологию нарушения, либо является фактором, вносящим вклад в ухудшение при нарушении. Такие нарушения можно подтвердить, например, по увеличению концентрации TNFα в биологической жидкости субъекта, страдающего от нарушения (например, по увеличению концентрации TNFα в сыворотке, плазме, синовиальной жидкости и тому подобном субъекта), которую можно детектировать, например, с использованием антитела против TNFα, как описано выше.
Существуют многочисленные примеры васкулитов, при которых активность TNFα является неблагоприятной, включая болезнь Бехчета. Применение антител или их антигенсвязывающих частей для лечения конкретных васкулитов обсуждают далее ниже. В конкретных вариантах осуществления антитело или часть антитела, полученные с использованием изобретения, вводят субъекту в сочетании с другим лекарственным средством, как описано ниже.
Антитело или часть антитела, полученные с использованием изобретения, можно также использовать для лечения васкулита, при котором активность TNFα является неблагоприятной, где ожидают, что ингибирование активности TNFα будет облегчать симптомы и/или прогрессирование васкулита или предупреждать васкулит. Субъектов, страдающих от васкулита или подверженных риску развития васкулита, можно идентифицировать посредством клинических симптомов и тестов. Например, у субъектов с васкулитами часто обнаруживают антитела к конкретным белкам в цитоплазме нейтрофилов, антинейтрофильные цитоплазматические антитела (ANCA). Таким образом, в некоторых случаях васкулиты можно доказывать посредством тестов (например, ELISA), измеряющих присутствие ANCA.
Васкулит и его последствия могут являться единственным проявлением заболевания или могут являться вторичным компонентом другого первичного заболевания. Васкулит может быть ограниченным отдельным органом или может одновременно повреждать несколько органов, и, в зависимости от синдрома, артерии и вены всех размеров могут являться пораженными. Васкулит может поражать любой орган в организме.
При васкулите просвет сосуда обычно нарушен, что связано с ишемией тканей, снабжаемых затронутым сосудом. Широкий диапазон нарушений, который может являться результатом этого процесса, обусловлен тем фактом, что могут затрагиваться сосуды любого типа, размера и локализации (например, артерия, вена, артериола, венула, капилляр). Васкулиты, как правило, классифицируют согласно размеру поврежденных сосудов, как описано ниже. Следует отметить, что некоторые васкулиты малых и крупных сосудов могут затрагивать артерии среднего размера, однако васкулиты крупных сосудов и сосудов среднего размера не затрагивают сосуды, меньшие, чем артерии. Заболевание крупных сосудов включает в себя в качестве неограничивающих примеров гигантоклеточный артериит, известный так же как височный артериит или краниальный артериит, ревматическую полимиалгию и заболевание или артериит Такаясу, известный так же как синдром дуги аорты, артериит молодых женщин и болезнь отсутствия пульса. Заболевание сосудов среднего размера включает в себя в качестве неограничивающих примеров классический узелковый полиартериит и болезнь Кавасаки, известную так же как слизисто-кожный лимфоузелковый синдром. Неограничивающими примерами заболевания малых сосудов являются болезнь Бехчета, гранулематоз Вегенера, микроскопический полиангиит, васкулит гиперчувствительности, известный так же как кожный васкулит, васкулит малых сосудов, пурпура Геноха-Шенлейна, аллергический гранулематоз и васкулит, известный так же как синдром Черджа-Строс. Другие васкулиты включают в себя в качестве неограничивающих примеров изолированный васкулит центральной нервной системы и облитерирующий тромбангиит, известный так же как болезнь Бюргера. Классический узелковый полиартериит (PAN), микроскопический PAN и аллергический гранулематоз часто группируют вместе и называют системными некротическими васкулитами. Дополнительное описание васкулита описано ниже.
1. Васкулит крупных сосудов
В одном варианте осуществления антитело против TNFα, полученное с использованием изобретения, можно использовать для лечения субъектов с васкулитом крупных сосудов. Термин «крупный сосуд(ы)», как применяют здесь, относится к аорте и наиболее крупным ответвлениям, направленным к основным областям организма. Крупные сосуды включают в себя, например, аорту и ее ветви и соответствующие вены, например подключичную артерию; плечеголовную артерию; общую сонную артерию; безымянную вену; внутреннюю и наружную яремные вены; легочные артерии и вены; полую вену; почечные артерии и вены бедренные артерия и вены; и сонные артерии. Примеры васкулитов крупных сосудов описаны ниже.
a. Гигантоклеточный артериит (GCA)
Фактор некроза опухоли вовлечен в патофизиологию гигантоклеточного артериита (Sneller (2002) Cleve. Clin. J. Med. 69:SII40; Schett et al. (2002) Ann. Rheum. Dis. 61:463). Гигантоклеточный артериит (GCA) относится к васкулиту, вовлекающему воспаление и повреждение кровеносных сосудов, в частности крупных или средних артерий, которые ответвляются от внешней сонной артерии шеи. GCA обозначают так же как височный артериит или краниальный артериит, и он является наиболее распространенным первичным васкулитом у пожилых. Он почти исключительно поражает индивидуумов в возрасте старше 50 лет, однако существуют хорошо документированные случаи пациентов 40 лет и старше. GCA обычно поражает внечерепные артерии. GCA может поражать ответвления сонных артерий, включая височную артерию. GCA также представляет собой системное заболевание, которое может затрагивать артерии множества локализаций.
Гистопатологически GCA представляет собой панартериит с инфильтрацией воспалительных мононуклеарных клеток внутри стенки сосуда с частым образованием гигантских клеток типа Лангханса. Присутствует пролиферация интимы, гранулематозное воспаление и фрагментация внутренней эластичной ламины. Патологические признаки в органах являются результатом ишемии, связанной с пораженными сосудами. Для пациентов, страдающих от GCA, показывают конкретные клинические симптомы, включая лихорадку, головную боль, анемию и высокую скорость оседания эритроцитов (ESR). Другие типичные признаки GCA включают в себя боли в челюсти или языке, болезненность кожи головы, системные симптомы, отек бледного диска зрительного нерва (в частности, отек «бледного как мел» диска) и нарушения зрения. Диагноз подтверждают биопсией височной артерии.
b. Ревматическая полимиалгия
Фактор некроза опухоли вовлечен в патофизиологию ревматической полимиалгии (Straub et al. (2002) Rheumatology (Oxford) 41:423; Uddhammar et al. (1998) Br. J. Rheumatol. 37:766). Ревматическая полимиалгия относится к ревматическому нарушению, связанному с мышечной болью от умеренной до сильной и тугоподвижностью в шее, плечах и бедрах, наиболее заметной утром. Экспрессию IL-6 и IL-1β также детектировали в большинстве циркулирующих моноцитов у пациентов с ревматической полимиалгией. Ревматическая полимиалгия может возникать независимо или она может существовать одновременно с GCA или предшествовать GCA, который представляет собой воспаление кровеносных сосудов.
c. Артериит Такаясу
Фактор некроза опухоли вовлечен в патофизиологию артериита Такаясу (Kobayashi and Numano (2002) Intern. Med. 41:44; Fraga and Medina (2002) Curr. Rheumatol. Rep 4:30). Артериит Такаясу относится к васкулиту, характеризующемуся воспалением аорты и ее основных ответвлений. Артериит Такаясу (известный так же как синдром дуги аорты, артериит молодых женщин и болезнь отсутствия пульса) поражает грудную и брюшную аорту и их основные ответвления или легочные артерии. Фиброзное утолщение стенки аорты и ее ответвлений (например, сонной, безымянной и подключичной артерий) может приводить к уменьшению размера просвета сосудов, отходящих от дуги аорты. Это состояние также, как правило, поражает почечные артерии.
Артериит Такаясу преимущественно поражает молодых женщин, обычно в возрасте 20-40, особенно азиатского происхождения, и может проявляться посредством дискомфорта, артралгий и постепенным началом хромоты конечностей. Большинство пациентов обладают асимметрично уменьшенным пульсом, обычно вместе с разницей кровяного давления в руках. Может возникать стеноз коронарной и/или почечной артерии.
Клинические признаки артериита Такаясу можно разделить на признаки раннего воспалительного заболевания и признаки более позднего заболевания. Клинические признаки ранней воспалительной стадии заболевания Такаясу представляют собой: дискомфорт, слабое проявление лихорадки, потерю массы, миалгию, артралгию и полиформную эритему. Более поздние стадии заболевания Такаясу характеризуются фиброзным стенозом артерий и тромбозом. Основными возникающими в результате клиническими признаками являются ишемические явления, например слабые и асимметричные пульсы артерий, несоответствие кровяного давления между руками, нарушение зрения, например скотома и гемианопия, другие неврологические признаки, включая вертиго и обморок, гемипарез или инсульт. Клинические признаки возникают в результате ишемии из-за артериального стеноза и тромбоза.
2. Заболевание сосудов среднего размера
В одном варианте осуществления антитело против TNFα, полученное с использованием изобретения, можно использовать для лечения субъектов с васкулитом сосудов среднего размера. Термин «сосуд(ы) среднего размера» применяют для обозначения тех кровеносных сосудов, которые представляют собой основные висцеральные артерии. Примеры сосудов среднего размера включают в себя брыжеечные артерии и вены, подвздошные артерии и вены и верхнечелюстные артерии и вены. Примеры васкулитов сосудов среднего размера описаны ниже.
a. Узелковый полиартериит
Фактор некроза опухоли вовлечен в патофизиологию узелкового полиартериита (DiGirolamo et al. (1997) J. Leukoc. Biol. 61:667). Узелковый полиартериит или узелковый периартериит относится к васкулиту, представляющему собой тяжелое заболевание кровеносных сосудов, при котором артерии малого и среднего размера становятся опухшими и поврежденными, поскольку их атакуют уклоняющиеся иммунные клетки. Узелковый полиартериит обычно поражает взрослых более часто, чем детей. Он повреждает ткани, снабжаемые пораженными артериями, поскольку они не получают достаточно кислорода и питательных веществ без надлежащего кровоснабжения.
Симптомы, которые наблюдают у пациентов с узелковым полиартериитом, как правило, являются результатом повреждения пораженных органов, часто кожи, сердца, почек и нервной системы. Общие симптомы узелкового полиартериита включают в себя лихорадку, утомляемость, слабость, потерю аппетита и потерю массы. Боли в мышцах (миалгия) и боли в суставах (артралгия) являются распространенными. На коже субъектов с узелковым полиартериитом можно наблюдать также сыпь, опухание, язвы и шишки (узелковые повреждения). Классический PAN (узелковый полиартериит) представляет собой системный артериит мышечных артерий от малого до среднего размера, при котором является общераспространенным затрагивание почечных и висцеральных артерий. Брюшные сосуды обладают аневризмами или окклюзиями у 50% пациентов с PAN. Классический PAN не затрагивает легочные артерии, хотя может затрагивать бронхиальные сосуды. Гранулемы, значительная эозинофилия и аллергический диатез не являются частью синдрома. Хотя любая система органов может являться пораженной, наиболее распространенные проявления включают в себя периферическую невропатию, множественный мононеврит, ишемию желудочно-кишечного тракта, ишемию почек, боль в семенниках и гроздевидную кожу.
b. Болезнь Кавасаки
Фактор некроза опухоли вовлечен в патофизиологию болезни Кавасаки (Sundel (2002) Curr. Rheumatol. Rep. 4:474; Gedalia (2002) Curr. Rheumatol Rep. 4:25). Хотя причина болезни Кавасаки неизвестна, она связана с острым воспалением коронарных артерий, что позволяет предполагать, что повреждение тканей, связанное с этим заболеванием, может являться опосредованным провоспалительными агентами, такими как TNFα. Болезнь Кавасаки относится к васкулиту, который поражает мембраны слизистых оболочек, лимфатические узлы, выстилку кровеносных сосудов и сердце. Болезнь Кавасаки часто обозначают как слизисто-кожный лимфоузелковый синдром, слизисто-кожное лимфоузелковое заболевание и детский полиартериит. У субъектов, страдающих болезнью Кавасаки, развивается васкулит, часто затрагивающий коронарные артерии, что может приводить к миокардиту и перикардиту. Часто после уменьшения острого воспаления может развиваться аневризма, тромбоз коронарных артерий, и это может приводить к инфаркту миокарда.
Болезнь Кавасаки представляет собой фебрильный системный васкулит, связанный с отеком ладоней и подошв ног, с увеличением шейных лимфатических узлов, растрескиванием губ и «малиновым языком». Хотя обнаружили воспалительный ответ сосудов по всему организму, наиболее распространенным участком повреждения органа-мишени являются коронарные артерии. Болезнь Кавасаки преимущественно поражает детей в возрасте менее 5 лет. Наивысшей частоты заболевание достигает в Японии, однако его все больше распознают на Западе, и в настоящее время оно является ведущей причиной приобретенного заболевания сердца у детей в США. Наиболее тяжелым осложнением болезни Кавасаки является коронарный артериит и образование аневризмы, которое происходит у трети пациентов без лечения.
3. Заболевание малых сосудов
В одном варианте осуществления антитело против TNFα используют для лечения субъектов с васкулитом малых сосудов. Термин «малый сосуд(ы)» используют для обозначения артериол, венул и капилляров. Артериолы представляют собой артерии, содержащие только 1 или 2 слоя гладкомышечных клеток, и заканчиваются и продолжаются капиллярной сетью. Венулы переносят кровь от капиллярной сети к венам, и капилляры соединяют артериолы и венулы. Примеры васкулитов малых сосудов описаны ниже.
a. Болезнь Бехчета
Фактор некроза опухоли вовлечен в патофизиологию болезни Бехчета (Sfikakis (2002) Ann. Rheum. Dis. 61:ii51-3; Dogan and Farah (2002) Oftalmologia. 52:23). Болезнь Бехчета представляет собой хроническое нарушение, включающее в себя воспаление кровеносных сосудов по всему организму. Болезнь Бехчета может вызывать также различные типы поражений кожи, артрит, воспаление кишечника и менингит (воспаление мембран головного и спинного мозга). В результате болезни Бехчета субъект с нарушением может обладать воспалением в тканях и органах по всему организму, включая желудочно-кишечный тракт, центральную нервную систему, сосудистую систему, легкие и почки. Болезнь Бехчета является в три раза более распространенной у мужчин, чем у женщин, и является более распространенной в Восточном Средиземноморье и Японии.
Для субъектов с болезнью Бехчета могут наблюдать клинические симптомы, включающие в себя рецидивирующие язвы полости рта (напоминающие афтозный стоматит), рецидивирующие язвы гениталий и воспаление глаза. Уровни в сыворотке TNFα, IL-8, IL-1, IL-6 INF-γ и IL-12 повышены у пациентов с болезнью Бехчета, и показано, что продукция этих факторов повышена в моноцитах пациентов с болезнью Бехчета (смотри, например, Inflammatory Disease of Blood Vessels (2001) Marcel Dekker, Inc., eds. G.S. Hoffman and C.M. Weyand, p.473).
b. Гранулематоз Вегенера
Фактор некроза опухоли вовлечен в патофизиологию гранулематоза Вегенера (Marquez et al. (2003) Curr. Rheumatol. Rep. 5:128; Harman and Margo (1998) Surv. Ophthalmol. 42:458). Гранулематоз Вегенера относится к васкулиту, который вызывает воспаление кровеносных сосудов в верхних дыхательных путях (носу, синусах, ушах), легких и почках. Гранулематоз Вегенера обозначают также как срединный гранулематоз. Гранулематоз Вегенера включает в себя гранулематозное воспаление, затрагивающее дыхательные пути, и некротизирующий васкулит, поражающий сосуды от малого до среднего размера. Субъекты с гранулематозом Вегенера часто страдают также артритом (воспалением суставов). Гломерулонефрит также может присутствовать у пораженных субъектов, но фактически любой орган может являться затронутым.
Для пациентов, пораженных гранулематозом Вегенера, как правило, наблюдают клинические симптомы, включающие в себя рецидивирующий синусит или носовое кровотечение, язвы слизистых оболочек, средний отит, кашель, кровохарканье и диспноэ. Первые симптомы гранулематоза Вегенера часто включают в себя симптомы верхних дыхательных путей, боли в суставах, слабость и утомляемость.
c. Синдром Черджа-Стросс
Фактор некроза опухоли вовлечен в патофизиологию синдрома Черджа-Стросс (Gross (2002) Curr. Opin. Rheumatol. 14:11; Churg (2001) Mod. Pathol. 14:1284). Синдром Черджа-Стросс относится к васкулиту, который является системным и обладает ранними признаками проявления астмы и эозинофилии. Синдром Черджа-Стросс обозначают также как аллергический гранулематоз и ангиит, и он возникает при развитии аллергического ринита, астмы и эозинофилии. Синуситы и инфильтрации легких также возникают при синдроме Черджа-Стросс, в первую очередь поражая легкие и сердце. Периферическая невропатия, коронарный артериит и поражения желудочно-кишечного тракта являются общераспространенными.
Пациентов, пораженных синдромом Черджа-Стросс, можно диагностировать согласно критериям, установленным American College of Rheumatology (ACR). Эти критерии предназначены, чтобы отличать CSS от других форм васкулита. Не все пациенты соответствуют каждому критерию. Некоторые фактически могут обладать только 2 или 3 критериями, однако их все еще классифицируют как страдающих синдромом Черджа-Стросс. В ACR выбрано 6 признаков (критериев) заболевания в качестве отличающих синдром Черджа-Стросс от других васкулитов. Эти критерии включают в себя: 1) астму; 2) эозинофилию [>10% от числа дифференцированных WBC]; 3) мононевропатию; 4) временные инфильтраты в легкие по рентгенографии грудной клетки; 5) аномалии околоносовых синусов и 6) биопсию, содержащую кровеносные сосуды с внесосудистыми эозинофилами.
P. Другие связанные с TNFα нарушения
В одном варианте осуществления изобретение относится к способу множественной переменной дозы для лечения связанного с TNFα нарушения, при котором активность TNFα является неблагоприятной, включающему в себя введение субъекту антитела против TNFα, так что лечат указанное связанное с TNFα нарушение. Примеры связанных с TNFα нарушений, при которых активность TNFα является неблагоприятной, обсуждают далее ниже.
1. Ювенильный артрит
Фактор некроза опухоли вовлечен в патофизиологию ювенильного артрита, включая ювенильный ревматоидный артрит (Grom et al. (1996) Arthritis Rheum. 39:1703; Mangge et al. (1995) Arthritis Rheum. 8:211). В одном варианте осуществления антитело против TNFα по изобретению используют для лечения ювенильного ревматоидного артрита.
Термин «ювенильный ревматоидный артрит» или «JRA», как применяют здесь, относится к хроническому, воспалительному заболеванию, возникающему до возраста 16 лет, которое может вызывать повреждение суставов или соединительной ткани. JRA обозначают также как ювенильный хронический полиартрит и болезнь Стилла.
JRA вызывает воспаление и тугоподвижность суставов более чем на 6 недель у ребенка в возрасте 16 лет или меньше. Воспаление вызывает покраснение, опухание, нагревание и болезненность суставов. Любой сустав может являться пораженным, и воспаление может ограничивать подвижность пораженных суставов. Один тип JRA может поражать также внутренние органы.
JRA часто классифицируют на три типа по числу затронутых сосудов, симптомам и присутствию или отсутствию конкретных антител, обнаруженных при анализе крови. Эта классификация помогает терапевту определить, как будет прогрессировать заболевание и поражены ли внутренние органы или кожа. Классификация JRA включает в себя следующее.
a. Олигоартрикулярный JRA с поражением небольшого количества суставов, где у пациента поражены четыре или менее сустава. Олигоартрикулярная форма является наиболее распространенной формой JRA и, как правило, поражает крупные суставы, такие как коленные.
b. Полиартрикулярный HRA, где поражено пять или более суставов. Малые суставы, такие как суставы кистей и стоп, наиболее часто являются пораженными, однако заболевание может поражать также крупные суставы.
c. Системный JRA характеризуется опуханием суставов, лихорадкой, легкой кожной сыпью и может поражать также внутренние органы, такие как сердце, печень, селезенку и лимфатические узлы. Системный JRA обозначают так же как болезнь Стилла. У небольшого процента этих детей развивается артрит во многих суставах, и они могут страдать тяжелым артритом, который продолжается во взрослом возрасте.
2. Эндометриоз
Фактор некроза опухоли вовлечен в патофизиологию эндометриоза, так как женщины c эндометриозом облают повышенными перитонеальными уровнями TNF (Eisermann et al. (1988) Fertil Steril 50:573; Halme (1989) Am J Obstet Gynecol 161:1718; Mori et al (1991) Am J Reprod Immunol 26:62; Taketani et al. (1992) Am J Obstet Gynecol 167:265; Overton et al. (1996) Hum Reprod 1996; 11:380). В одном варианте осуществления антитело против TNFα можно использовать для лечения эндометриоза. Термин «эндометриоз», как применяют здесь, относится к состоянию, при котором ткань, которая в норме выстилает матку (эндометрий), вырастает в других областях организма, вызывая боль, нерегулярное кровотечение и часто бесплодие.
3. Простатит
Фактор некроза опухоли вовлечен в патофизиологию простатита, так как мужчины с хроническим простатитом и хронической тазовой болью обладают значительно более высокими уровнями TNF и IL-1 в сперме по сравнению с контролями (Alexander et al. (1998) Urology 52:744; Nadler et al. (2000) J Urol 164:214; Orhan et al. (2001) Int J Urol 8:495). Более того, в модели простатита на крысах уровни TNF также являлись увеличенными по сравнению с контролями (Asakawa et al. (2001) Hinyokika Kiyo 47:459; Harris et al. (2000) Prostate 44:25). В одном варианте осуществления антитело против TNFα по изобретению используют для лечения простатита.
Термин «простатит», как применяют здесь, относится к воспалению предстательной железы. Простатит обозначают так же как синдром тазовой боли. Простатит проявляется во множестве форм, включая небактериальный простатит, острый простатит, бактериальный простатит и хронический простатит. Острый простатит относится к воспалению предстательной железы, которое развивается неожиданно. Острый простатит обычно вызван бактериальной инфекцией предстательной железы. Хронический простатит представляет собой воспаление предстательной железы, которое развивается постепенно, продолжается в течение длительного периода и, как правило, обладает слабовыраженными симптомами. Хронический простатит обычно также вызван бактериальной инфекцией.
4. Хороидальная неоваскуляризация
Фактор некроза опухоли вовлечен в патофизиологию хороидальной неоваскуляризации. Например, в хирургически удаленных хороидальных неоваскулярных мембранах неоваскулярные сосуды являлись положительно окрашенными как по TNF, так и по IL-1 (Oh H et al. (1999) Invest Ophthalmol Vis Sci 40:1891). В одном варианте осуществления антитело против TNFα используют для лечения хороидальной неоваскуляризации. Термин «хороидальная неоваскуляризация», как применяют здесь, относится к росту новых кровеносных сосудов, происходящих из хороида, посредством разрыва мембраны Бруха, в субретинальном пигментном эпителии (суб-RPE) или субретинальном пространстве. Хороидальная неоваскуляризация (CNV) является главной причиной потери зрения у пациентов с этим состоянием.
5. Воспаление седалищного нерва
Фактор некроза опухоли вовлечен в патофизиологию воспаления седалищного нерва (Ozaktay et al. (2002) Eur Spine J. 11:467; Brisby et al.(2002) Eur Spine J. 11:62). В одном варианте осуществления антитело против TNFα по изобретению используют для лечения воспаления седалищного нерва. Термин «воспаление седалищного нерва», как применяют здесь, относится к состоянию, включающему в себя нарушение подвижности и/или чувствительности в ноге, вызванное повреждением седалищного нерва. Воспаление седалищного нерва также обычно обозначают как невропатию седалищного нерва и дисфункцию седалищного нерва. Воспаление седалищного нерва представляет собой форму периферической невропатии. Оно возникает, когда присутствует повреждение седалищного нерва, локализованное на задней стороне ноги. Седалищный нерв контролирует мышцы на задней стороне колена и голени и обеспечивает чувствительность задней стороны бедра, части голени и подошвы ноги. Воспаление седалищного нерва может являться признаком другого нарушения, включая грыжу люмбального диска, стеноз позвоночника, остеохондроз, истмический спондилолистез и синдром грушевидной мышцы.
6. Синдром Шегрена
Фактор некроза опухоли вовлечен в патофизиологию синдрома Шегрена (Koski et al. (2001) Clin Exp Rheumatol. 19:131). В одном варианте осуществления антитело против TNFα по изобретению используют для лечения синдрома Шегрена. Термин «синдром Шегрена», как применяют здесь, относится к системному воспалительному нарушению, характеризующемуся сухостью во рту, пониженным слезоотделением и сухостью других мембран слизистых оболочек и часто связанному с аутоиммунными ревматическими нарушениями, такими как ревматоидный артрит. Сухость глаз и рта является наиболее общераспространенным симптомом этого синдрома. Симптомы могут возникать по отдельности или с симптомами, связанными с ревматоидным артритом или другими заболеваниями соединительной ткани. Может присутствовать связанное увеличение слюнных желез. Другие органы могут становиться пораженными. Синдром может являться связанным с ревматоидным артритом, системной красной волчанкой, склеродермией, полимиозитом и другими заболеваниями.
7. Увеит
Фактор некроза опухоли вовлечен в патофизиологию увеита (Wakefield and Lloyd (1992) Cytokine 4:1; Woon et al (1998) Curr Eye Res. 17:955). В одном варианте осуществления антитело против TNFα по изобретению используют для лечения увеита. Термин «увеит», как применяют здесь, относится к воспалению сосудистой оболочки глаза, которая представляет собой слой между склерой и сетчаткой, которая включает в себя радужную оболочку, ресничное тело и хориоид. Увеит также обычно обозначают как ирит, средний увеит, хориоидит, хориоретинит, передний увеит и задний увеит. Наиболее распространенной формой увеита является передний увеит, который включает в себя воспаление передней части глаза, которое часто ограничено радужной оболочкой глаза. Это состояние часто называют иритит. В одном варианте осуществления термин увеит относится к воспалению сосудистой оболочки глаза, которое исключает воспаление, связанное с аутоиммунным заболеванием, т.е. исключает аутоиммунный увеит.
8. Влажная макулодистрофия
Фактор некроза опухоли вовлечен в патофизиологию влажной макулодистрофии. В одном варианте осуществления антитело против TNFα по изобретению используют для лечения влажной макулодистрофии. Термин «влажная макулодистрофия», как применяют здесь, относится к нарушению, поражающему желтое пятно (центральную часть сетчатки глаза) и вызывающему снижение остроты зрения и возможную потерю центрального зрения. У пациентов с влажной макулодистрофией развиваются новые кровеносные сосуды под сетчаткой, что вызывает геморрагию, опухание и образование рубцовой ткани.
9. Остеопороз
Фактор некроза опухоли вовлечен в патофизиологию остеопороза (Tsutsumimoto et αl. (1999) J Bone Miner Res. 14:1751). Остеопороз используют для обозначения нарушения, характеризующегося прогрессирующей потерей плотности кости и истончением костной ткани. Остеопороз возникает, когда организм неспособен формировать достаточно новой кости, или когда слишком много старой кости резорбируется в организме, или при том и другом. Антитело против TNFα или его антигенсвязывающий фрагмент по изобретению можно использовать для лечения остеопороза.
10. Остеоартрит
Фактор некроза опухоли вовлечен в патофизиологию остеоартрита Venn et al. (1993) Arthritis Rheum. 36:819; Westacott et al. (1994) J Rheumatol.21:1710). Остеоартрит (OA) обозначают так же как гипертрофический остеоартрит, остеоартроз, и дегенеративное заболевание суставов. OA представляет собой хроническое дегенеративное заболевание суставов скелета, которое поражает конкретные суставы, обычно суставы коленей, бедер, рук и позвоночника у взрослых всех возрастов. OA характеризуется рядом следующих проявлений, включая дегенерацию и истончение суставного хряща со связанным развитием «язв» или кратеров, образованием остеофитов, гипертрофией кости на границах и изменениями в синовиальной мембране и увеличением пораженных суставов. Более того, остеоартрит сопровождается болью и тугоподвижностью, в частности, после продолжительной активности. Антитело или его антигенсвязывающий фрагмент по изобретению можно использовать для лечения остеоартрита. Характерные радиографические признаки остеоартрита включают в себя сужение суставной щели, субхондральный склероз, остеофитоз, формирование субхондральной кисты, потерю костной ткани (или «артремфит»).
Лекарственные средства, применяемые для лечения остеоартрита, включают в себя множество нестероидных, противовоспалительных лекарственных средств (NSAID). Кроме того, ингибиторы COX 2, включая целебрекс, виокс, бекстра и эторикоксиб, также используют для лечения OA. Стероиды, которые инъецируют непосредственно в сустав, можно также использовать для уменьшения воспаления и боли. В одном варианте осуществления изобретения антитела против TNFα по изобретению вводят в сочетании с NSAID, ингибитором COX2 и/или стероидами.
11. Другие
Способы по изобретению можно использовать также для лечения различных других нарушений, при которых активность TNFα является неблагоприятной. Примеры других заболеваний и нарушений, при которых активность TNFα вовлечена в патофизиологию и которые, таким образом, можно лечить с использованием антитела или части антитела по изобретению, включают в себя воспалительные нарушения кости, заболевание резорбции кости, нарушения коагуляции, ожоги, реперфузионное повреждение, келоидное образование, образование рубцовой ткани, пирексию, периодонтальное заболевание, ожирение, токсичность радиоактивного облучения, возрастную кахексию, болезнь Альцгеймера, отек мозга, воспалительное повреждение мозга, рак, синдром хронической усталости, дерматомиозит, реакции на лекарственные средства, такие как синдром Стивенса-Джонсона и реакция Джарича-Херксхеймера, отек в спинном мозге и/или около него, наследственные перемежающиеся лихорадки, синдром Фелти, фиброз, гломерулонефрит (например, постстрептококковый гломерулонефрит или IgA-нефропатия), расшатывание протезов, микроскопический полиангиит, смешанное заболевание соединительной ткани, множественную миелому, рак и кахексию, множественное поражение органов, миелодиспластический синдром, остеолитический орхит, панкреатит, включая острый, хронический и абсцедирующий панкреатит, полимиозит, прогрессирующую почечную недостаточность, псевдоподагру, гангренозную пиодермию, рецидивирующий полихондрит, ревматический порок сердца, саркоидоз, склерозирующий холангит, инсульт, торакоабдоминальную реконструкцию аорты при аневризме (TAAA), периодический синдром, связанный с рецептором TNF (TRAPS), симптомы, связанные с вакцинацией против желтой лихорадки, воспалительные заболевания, связанные с ухом, хроническое воспаление уха, хронический средний отит с холестеатомой или без, педиатрическое воспаление уха, миозит, рак яичника, рак ободочной и прямой кишки, индуцированный лечением воспалительный синдром (например, синдромы после введения IL-2) и нарушение, связанное с реперфузионным повреждением.
Понятно, что все из вышеупомянутых связанных с TNFα нарушений включают в себя как взрослую, так и ювенильные формы заболевания, когда это целесообразно. Понятно также, что все вышеупомянутые нарушения включают в себя как хроническую, так и острую формы заболевания. Кроме того, способы множественной переменной дозы по изобретению можно использовать для лечения каждого из вышеупомянутых связанных с TNFα нарушений по отдельности или в сочетании друг с другом, например, у субъекта, страдающего увеитом и волчанкой.
Дополнительные лекарственные средства
Изобретение относится к фармацевтической композиции и способам ее применения для лечения связанного с TNFα нарушения с использованием режима множественной переменной дозы. Фармацевтические композиции содержат первое средство, предупреждающее или ингибирующее связанное с TNFα нарушение. Фармацевтическая композиция и способы применения могут включать в себя второе средство, представляющее собой активный фармацевтический ингредиент; то есть второе средство является лекарственным средством, и его функция выходит за пределы функции неактивного ингредиента, такого как фармацевтический носитель, консервант, разбавитель или буфер. Второе средство может являться применимым для лечения или предупреждения связанных с TNFα нарушений. Второе средство может уменьшать или лечить, по меньшей мере, один симптом(ы), связанный с намеченным заболеванием. Первое и второе средства могут проявлять их биологические эффекты посредством сходных или неродственных механизмов действия или либо одно, либо оба из первого и второго средства могут проявлять их биологические эффекты посредством множества механизмов действия. Фармацевтическая композиция может содержать также третье соединение или даже больше, где третье (и четвертое и т.д.) соединение обладает такими же характеристиками, как второе средство.
Следует понимать, что фармацевтические композиции, описанные здесь, могут содержать первое и второе, третье или дополнительные средства в одном и том же фармацевтически приемлемом носителе или в различных фармацевтически приемлемых носителях для каждого из описанных вариантов осуществления. Кроме того, следует понимать, что первое, второе, третье и дополнительные средства можно вводить одновременно или последовательно в пределах описанных вариантов осуществления. Альтернативно, первое и второе средство можно вводить одновременно, и третье или дополнительное средство можно вводить до или после двух первых средств.
Сочетание средств, применяемых в способах и фармацевтических композициях, описанных здесь, может обладать терапевтически аддитивным или синергическим эффектом на состояние (состояния) или заболевание (заболевания), намеченные для лечения. Сочетания средств, применяемых в способах или фармацевтических композициях, описанных здесь, могут также уменьшать неблагоприятный эффект, связанный, по меньшей мере, с одним из средств, при введении отдельно или без другого средства (средств) конкретной фармацевтической композиции. Например, токсичность побочных эффектов одного средства может ослаблять другое средство композиции, таким образом, обеспечивая возможность более высокого дозирования, улучшая податливость пациента и улучшение терапевтического исхода. Аддитивные или синергические эффекты, выгоды и преимущества композиций применяют к классам лекарственных средств, либо структурным, либо функциональным классам, или к самим отдельным соединениям.
Дополнительные активные соединения также можно включать в композиции. В конкретных вариантах осуществления антитело или часть антитела по изобретению составляют совместно и/или вводят совместно с одним или несколькими дополнительными лекарственными средствами, применимыми для лечения связанного с TNFα нарушения, при котором активность TNFα является неблагоприятной. Например, антитело против hTNFα, часть антитела или другой ингибитор TNFα по изобретению можно составлять совместно и/или вводить совместно с одним или несколькими дополнительными антителами, которые связывают другие мишени (например, антитела, связывающие другие цитокины или связывающие молекулы поверхности клеток), одним или несколькими цитокинами, растворимым рецептором TNFα (смотри, например, публикацию PCT № WO 94/06476) и/или одним или несколькими химическими средствами, ингибирующими продукцию или активность hTNFα (такими как производные циклогексанилидена, как описано в публикации PCT № WO 93/19751). Более того, одно или несколько антител или других ингибиторов TNFα по изобретению можно использовать в сочетании с двумя или несколькими вышеописанными лекарственными средствами. В таких способах комбинированной терапии можно преимущественно использовать низкие дозы вводимых терапевтических средств, избегая таким образом возможной токсичности или осложнений, связанных с различными способами монотерапии. Конкретное лекарственное средство (средства), как правило, выбирают на основании конкретного связанного с TNFα нарушения, подлежащего лечению, как обсуждают ниже.
Неограничивающие примеры лекарственных средств, с которыми можно сочетать антитело, часть антитела или другой ингибитор TNFα в способе лечения многократной меняющейся дозой по изобретению, включают в себя следующие: нестероидное противовоспалительное средство (средства) (NSAID); супрессирующее цитокины противовоспалительное лекарственное средство (средства) (CSAID); CDP-571/BAY-10-3356 (гуманизированное антитело против TNFα; Celltech/Bayer); cA2/инфликсимаб (химерное антитело против TNFα; Centocor); 75 кДа TNFR-IgG/этанерцепт (слитый белок 75 kD рецептор TNF - IgG; Immunex; смотри, например, Arthritis & Rheumatism (1994) Vol. 37, S295; J. Invest. Med. (1996) Vol. 44, 235A); 55 кДа TNF-IgG (слитый белок 55 кДа рецептор TNF - IgG; Hoffrnann-LaRoche); IDEC-CE9,1/SB 210396 (неистощающее приматизированное антитело против CD4; IDEC/SmithKline; смотри, например, Arthritis & Rheumatism (1995) Vol. 38, Sl 85); DAB 486-IL-2 и/или DAB 389-IL-2 (слитые белки с IL-2; Seragen; смотри например, Arthritis & Rheumatism (1993) Vol. 36, 1223); анти-Tac (гуманизированное анти-IL-2Rα; Protein Design Labs/Roche); IL-4 (противовоспалительный цитокин; DNAX/Schering); IL-10 (SCH 52000; рекомбинантный IL-10, противовоспалительный цитокин; DNAX/Schering); IL-4; агонисты IL-10 и/или IL-4 (например, антитела-агонисты); IL-1RA (IL-1 рецептор антагонист; Synergen/Amgen); анакинра (Kineret®/Amgen); TNF-bp/s-TNF (растворимый связывающий TNF белок; смотри, например, Arthritis & Rheumatism (1996) Vol. 39, № 9 (supplement), S284; Amer. J. Physiol. - Heart and Circulatory Physiology (1995) Vol. 268, pp. 37-42); R973401 (ингибитор фосфодиэстеразы типа IV; смотри, например, Arthritis & Rheumatism (1996) Vol. 39, № 9 (supplement), S282); MK-966 (ингибитор COX-2; смотри, например, Arthritis & Rheumatism (1996) Vol. 39, № 9 (supplement), S81); илопрост (смотри, например, Arthritis & Rheumatism (1996) Vol. 39, № 9 (supplement), S82); метотрексат; талидомид (смотри, например, Arthritis & Rheumatism (1996) Vol. 39, № 9 (supplement), S282) и родственные талидомиду лекарственные средства (например, Celgen); лефлуномид (противовоспалительный ингибитор и ингибитор цитокинов; смотри, например, Arthritis & Rheumatism (1996) Vol. 39, № 9 (supplement), S131; Inflammation Research (1996) Vol.45, pp. 103-107); транексамовую кислоту (ингибитор активации плазминогена; смотри, например, Arthritis & Rheumatism (1996) Vol. 39, № 9 (supplement), S284); T-614 (ингибитор цитокинов; смотри, например, Arthritis & Rheumatism (1996) Vol. 39, № 9 (supplement), S282); простагландин E1 (смотри, например, Arthritis & Rheumatism (1996) Vol. 39, № 9 (supplement), S282); тенидап (нестероидное противовоспалительное лекарственное средство; смотри, например, Arthritis & Rheumatism (1996) Vol. 39, № 9 (supplement), S280); напроксен (нестероидное противовоспалительное средство; смотри, например, Neuro Report (1996) Vol. 7, pp. 1209-1213); мелоксикам (нестероидное противовоспалительное средство); ибупрофен (нестероидное противовоспалительное лекарственное средство); пироксикам (нестероидное противовоспалительное средство); диклофенак (нестероидное противовоспалительное средство); индометацин (нестероидное противовоспалительное лекарственное средство); сульфасалазин (смотри, например, Arthritis & Rheumatism (1996) Vol. 39, № 9 (supplement), S281); азатиоприн (смотри, например, Arthritis & Rheumatism (1996) Vol. 39, № 9 (supplement), S281); ICE ингибитор (ингибитор интерлейкин-1β-превращающего фермента); ингибитор zap-70 и/или lck (ингибитор тирозинкиназы zap-70 или lck); ингибитор VEGF и/или ингибитор VEGF-R (ингибиторы фактора роста эндотелия сосудов или рецептора фактора роста эндотелия сосудов; ингибиторы ангиогенеза); кортикостероидные противовоспалительные лекарственные средства (например, SB203580); ингибиторы TNF-конвертазы; антитела против IL-12; антитела против IL-18; интерлейкин-11 (смотри, например, Arthritis & Rheumatism (1996) Vol. 39, № 9 (supplement), S296); интерлейкин-13 (смотри, например, Arthritis & Rheumatism (1996) Vol. 39, № 9 (supplement), S308); ингибиторы интерлейкина-17 (смотри, например, Arthritis & Rheumatism (1996) Vol. 39, № 9 (supplement), S120); золото; пеницилламин; хлороквин; гидроксихлороквин; хлорамбуцил; циклоспорин; циклофосфамид; тотальное облучение лимфоидной ткани; антитимоцитарный глобулин; антитела против CD4; CD5-токсины; перорально вводимые пептиды и коллаген; лобензарит динатрия; регулирующие цитокины средства (CRA) HP228 и HP466 (Houghten Pharmaceuticals, Inc.); антисмысловые фосфоротиоатные олигодезоксинуклеотиды для ICAM-I (ISIS 2302; Isis Pharmaceuticals, Inc.); растворимый рецептор комплемента 1 (TP10; T Cell Sciences, Inc.); преднизон; орготеин; полисульфат гликозаминогликана; миноциклин; антитела против IL2R; морские и растительные липиды (жирные кислоты рыбы и семян растений; смотри, например, DeLuca et al. (1995) Rheum. Dis. Clin. North Am. 21:759-777); ауранофин; фенилбутазон; меклофенамовую кислоту; флуфенамовую кислоту; внутривенный иммуноглобулин; зилеутон; азарибин; микофеноловую кислоту (RS-61443); такролимус (FK-506); сиролимус (рапамицин); амиприлозу (терафектин); кладрибин (2-хлордезоксиаденозин); метотрексат; противовирусные средства и иммуномодулирующие средства. Любое из вышеупомянутых средств можно вводить в сочетании с антителом против TNFα по изобретению для лечения связанного с TNFα нарушения с использованием способа множественной переменной дозы или однократной дозы лекарственных средств по изобретению.
В одном варианте осуществления антитело против TNFα по изобретению вводят в сочетании с одним из следующих средств для лечения ревматоидного артрита с использованием способа лечения многократной меняющейся дозой по изобретению: низкомолекулярный ингибитор KDR (ABT-123), низкомолекулярный ингибитор Tie-2; метотрексат; преднизон; целекоксиб; фолиевая кислота; сульфат гидроксихлороквина; рофекоксиб; этанерцепт; инфликсимаб; анакинра (Kineret®/Amgen); лефлуномид; напроксен; вальдекоксиб; сульфасалазин; ибупрофен; метилпреднизолон; мелоксикам; ацетат метилпреднизолона; тиомалат золота-натрия; аспирин; азатиоприн; ацетонид триамцинолона; напсилат пропоксифена/апап; фолат; набуметон; диклофенак; пироксикам; этодолак; диклофенак натрия; оксапрозин; оксикодон hcl; гидрокодон битартрат/апап; диклофенак натрия/мизопростол; фентанил; анакинра, человеческая рекомбинантная; трамадол hcl; салсалат; сулиндак; цианкобаламин/fa/пиридоксин; ацетаминофен; алендронат натрия; преднизолон; сульфат морфина; гидрохлорид лидокаина; индометацин; сульфат глюкозамина/хондроитин; циклоспорин; сульфадиазин; амитриптилин hcl; оксикодон hcl/ацетаминофен; олопатадин hcl; мизопростол; напроксен натрия; омепразол; микофенолят мофетила; циклофосфамид; ритуксимаб; IL-1 TRAP; MRA; CTLA4-IG; IL-18 BP; ABT-874; ABT-325 (анти-IL 18); анти-IL 15; BIRB-796; SCIO-469; VX-702; AMG-548; VX-740; рофлумиласт; IC-485; CDC-801 и мезопрам. В другом варианте осуществления антитело против TNFα по изобретению вводят с использованием способа множественной переменной дозы для лечения связанного с TNFα нарушения в сочетании с одним из вышеупомянутых средств для лечения ревматоидного артрита. В другом варианте осуществления вышеупомянутые дополнительные средства используют в сочетании с антителом против TNFα в способе лечения однократной дозой по изобретению.
В одном варианте осуществления антитело против TNFα по изобретению вводят с использованием режима множественной переменной дозы в сочетании с одним из следующих средств для лечения связанного с TNFα нарушения, при котором активность TNFα является неблагоприятной: антитело против IL12 (ABT 874); антитело против IL18 (ABT 325); низкомолекулярный ингибитор LCK; низкомолекулярный ингибитор COT; антитело против IL1; низкомолекулярный ингибитор MK2; антитело против CD19; низкомолекулярный ингибитор CXCR3; низкомолекулярный ингибитор CCR5; низкомолекулярный ингибитор CCR11, антитело против селектина E/L; низкомолекулярный ингибитор P2X7; низкомолекулярный ингибитор IRAK-4; низкомолекулярный агонист рецептора глюкокортикоидов; антитело против рецептора C5a; низкомолекулярный ингибитор рецептора C5a; антитело против CD32 и CD32 в качестве терапевтического белка.
В другом варианте осуществления антитело против TNFα, полученное с использованием изобретения, можно вводить в сочетании с антибиотиком или противоинфекционным средством. Противоинфекционные средства включают в себя эти средства, известные в данной области для лечения вирусных, грибковых, паразитарных или бактериальных инфекций. Термин «антибиотик», как применяют здесь, относится к химическому веществу, которое ингибирует рост микроорганизмов или убивает их. Этот термин относится к антибиотику, продуцируемому микроорганизмом, так же, как синтетические антибиотики (например, аналоги), известные в данной области. Антибиотики включают в себя в качестве неограничивающих примеров кларитромицин (Biaxin®), ципрофлоксацин (Cipro®) и метронидазол (Flagyl®).
В другом варианте осуществления антитело против TNFα, полученное с использованием изобретения, можно вводить с дополнительным лекарственным средством для лечения воспаления седалищного нерва или боли. Примеры средств, которые можно использовать для уменьшения или ингибирования симптомов воспаления седалищного нерва или боли, включают в себя гидрокодон битартрат/апап, рофекоксиб, циклобензаприн hcl, метилпреднизолон, напроксен, ибупрофен, оксикодон hcl/ацетаминофен, целекоксиб, вальдекоксиб, метилпреднизолон ацетат, преднизон, кодеин фосфат/апап, трамадол hcl/ацетаминофен, метаксалон, мелоксикам, метокарбамол, гидрохлорид лидокаина, диклофенак натрия, габапентин, дексаметазон, карисопродол, трометамин кеторолака, индометацин, ацетаминофен, диазепам, набуметон, оксикодон hcl, тизанидин hcl, диклофенак натрия/мизопростол, напсилат пропоксифена/апап, asa/оксикод./оксикодон тер., ибупрофен/гидрокодон bit, трамадол hcl, этодолак, пропоксифен hcl, амитриптилин hcl, карисопродол/кодеин фос./asa, сульфат морфина, мультивитамины, напроксен натрия, цитрат орфенадрина и темазепам.
В другом варианте осуществления связанное с TNFα нарушение лечат антителом против TNFα, полученным с использованием изобретения, в сочетании с гемодиализом.
В другом варианте осуществления антитело против TNFα, полученное с использованием изобретения, можно использовать в сочетании с лекарственным средством, используемым для лечения болезни Крона или родственного болезни Крона нарушения в режиме множественной переменной дозы по изобретению. Примеры лекарственных средств, которые можно использовать для лечения болезни Крона, включают в себя месаламин, преднизон, азатиоприн, меркаптопурин, инфликсимаб, будезонид, сульфасалазин, метилпреднизолона натр. сукц., дифеноксилат/атроп. сульф., гидрохлорид лоперамида, метотрексат, омепразол, фолат, ципрофлоксацин/сахароза-вода, гидрокодон битартрат/апап, гидрохлорид тетрациклина, флуоцинонид, метронидазол, тимеросал/борная кислота, сульфат хиосциамина, холестирамин/сахароза, гидрохлорид ципрофлоксацина, гидрохлорид меперидина, гидрохлорид мидазолама, оксикодон hcl/ацетаминофен, гидрохлорид прометазина, фосфат натрия, сульфаметоксазол/триметоприм, целекоксиб, поликарбофил, напсилат пропоксифена, гидрокортизон, мультивитамины, балсалазид динатрия, кодеин фосфат/апап, колесевилам hcl, цианокобаламин, фолиевую кислоту, левофлоксацин, натализумаб, метилпреднизолон, интерферон-гамма и сарграмостим (GM-CSF). В одном варианте осуществления метотрексат вводят для лечения болезни Крона в дозе от 2,5 мг до 30 мг в неделю.
В другом варианте осуществления антитело против TNFα вводят в сочетании с дополнительным лекарственным средством для лечения астмы в режиме множественной переменной дозы по изобретению. Примеры средств, которые можно использовать для уменьшения или ингибирования симптомов астмы, включают в себя следующие: альбутерол; сальметерол/флутиказон; натрий; пропионат флутиказона; будезонид; преднизон; ксинафоат сальметерола; левальбутерол hcl; сульфат/ипратропиум; фосфат преднизолона натрия; ацетонид триамцинолона; дипропионат беклометазона; бромид ипратропиума; азитромицин; ацетат пирбутерола; преднизолон; безводный теофиллин; зафирлукаст; метилпреднизолон натр. сукц.; кларитромицин; фумарат формотерола; противогриппозную вакцину; метилпреднизолон; тригидрат; инъекцию аллергена; кромолин натрия; цефпрозил; гидрохлорид фексофенадина; флунизолид/ментол; левофлоксацин; амоксициллин/клавуланат, устройство для ингаляции, гуайфенезин, фосфат дексаметазона натр.; моксифлоксацин hcl; гиклат; гуайфенезин/d-меторфан; гатифлоксацин; p-эфедрин/cod/хлорфенир; гидрохлорид цетиразина; фуроат мометазона; ксинафоат сальметерола; бензонатат; цефалексин; pe/гидрокодон/хлорфенир; цетиризин hcl/псевдоэфед.; фенилэфрин/cod/прометазин; кодеин/прометазин; флунизолид; дексаметазон; гуайфенезин/псевдоэфедрин; хлорфенирамин/гидрокодон; недокромил натрия; сульфат тербуталина; эпинефрин и метилпреднизолон, сульфат метапротеренола.
В другом варианте осуществления антитело против TNFα по изобретению вводят в сочетании с дополнительным лекарственным средством для лечения COPD. Примеры средств, которые можно использовать для уменьшения или ингибирования симптомов COPD, включают в себя альбутерол сульфат/ипратропиум; ипратропиум бромид; сальметерол/флутиказон; альбутерол; сальметерол; ксинафоат; флутиказон пропионат; преднизон; безводный теофиллин; левофлоксацин; метилпреднизолон натр. сукц.; монтелукаст натрия; будезонид; фумарат формотерола; ацетонид триамцинолона; гуайфенезин; азитромицин; беклометазон; дипропионат; левальбутерол hcl; флунизолид; натрий; тригидрат; гатифлоксацин; зафирлукаст; фуроат; амоксициллин/клавуланат; флунизолид/ментол; хлорфенирамин/гидрокодон; метапротеренол сульфат; метилпреднизолон; эфедрин/cod/хлорфенир; пиребутерол ацетат; p-эфедрин/лоратидин; тербуталин сульфат; бромид тиотропиума; (R,R)-формотерол; TgAAT; циломиласт и рофлумиласт.
В другом варианте осуществления антитело против TNFα по изобретению вводят в сочетании с дополнительным лекарственным средством для лечения IPF. Примеры средств, которые можно использовать для уменьшения или ингибирования симптомов IPF, включают в себя преднизон; азатиоприн; альбутерол; колхицины; сульфат; дигоксин; гамма-интерферон; метилпреднизолона натр. сукц.; фуросемид; лизиноприл; нитроглицерин; спиронолактон; циклофосфамид; бромид ипратропиума; актиномицин d; альтеплазу; пропионат флуказона; левофлоксацин; сульфат метапротеренола; сульфат морфина; оксикодон hcl; хлорид калия; ацетонид триамцинолона; безводный такролимус; кальций; интерферон-альфа; метотрексат; микофенолят мофетила.
В одном варианте осуществления изобретения антитело против TNFα вводят в сочетании со средством, которое обычно используют для лечения спондилоартропатий. Примеры таких средств включают в себя нестероидные противовоспалительные лекарственные средства (NSAID), ингибиторы COX 2, включая Celebrex®, Vioxx®, Bextra® и эторикоксиб. Физиотерапия также является общепринятым средством для лечения спондилоартропатий, обычно вместе с нестероидными противовоспалительными лекарственными средствами.
В другом варианте осуществления антитело против TNFα по изобретению можно вводить в сочетании с дополнительным лекарственным средством для лечения анкилозирующего спондилита. Примеры средств, которые можно использовать для лечения или ингибирования симптомов анкилозирующего спондилита, включают в себя ибупрофен, диклофенак и мизопростол, напроксен, мелоксикам, индометацин, диклофенак, целекоксиб, рофекоксиб, сульфасалазин, преднизон, метотрексат, азатиоприн, миноциклин, преднизон, этанерцепт и инфликсимаб.
В другом варианте осуществления антитело против TNFα по изобретению вводят в сочетании с дополнительным лекарственным средством для лечения псориатического артрита. Примеры средств, которые можно использовать для уменьшения или ингибирования симптомов псориатического артрита, включают в себя метотрексат; этанерцепт; рофекоксиб; целекоксиб; фолиевую кислоту; сульфасалазин; напроксен; лефлуномид; ацетат метилпреднизолона; индометацин; сульфат гидроксихлороквина; сулиндак; преднизон; усиленный дипропионат бетаметазона; инфликсимаб; метотрексат; фолат; ацетонид триамцинолона; диклофенак; диметилсульфоксид; пироксикам; диклофенак натрия; кетопрофен; мелоксикам; преднизон; метилпреднизолон; набуметон; толметин натрия; кальципотриен; циклоспорин; диклофенак; натрий/мизопростол; флуоционид; сульфат глюкозамина; тиомалат золота-натрия; гидрокодон; битартрат/апап; ибупрофен; ризедронат натрия; сульфадиазин; тиогуанин; вальдекоксиб; алефацепт и эфализумаб.
В одном варианте осуществления ингибитор TNFα вводят после начальной процедуры для лечения коронарной болезни сердца в режиме множественной переменной дозы по изобретению. Примеры таких процедур включают в себя в качестве неограничивающих примеров шунтирование коронарной артерии (CABG) и чрескожную чреспросветную коронарную баллонную ангиопластику (PTCA) или ангиопластику. В одном варианте осуществления ингибитор TNFα вводят для предотвращения повторного возникновения стеноза. В другом варианте осуществления изобретения ингибитор TNFα вводят для предупреждения или лечения рестеноза. Изобретение относится также к способу лечения, где ингибитор TNFα вводят до, во время или после вставки стента в артерию субъекта, подвергаемого процедуре лечения коронарной болезни сердца. В одном варианте осуществления стент вводят после CABG или PTCA.
Широкое множество стент-графтов можно использовать в контексте настоящего изобретения, в зависимости от участка и природы желаемого лечения. Стент-графты могут представлять собой, например, раздвоенные или трубчатые трансплантаты, цилиндрические или конусовидные, самораскрывающиеся или баллонорасширяемые, несущие или модульные. Более того, стент-графты можно адаптировать для высвобождения лекарственного средства только на дальних концах или на протяжении всего стент-графта. Ингибитор TNFα по изобретению можно также вводить на стенте. В одном варианте осуществления антитело против TNFα, включая, например, адалимумаб/D2E7/HUMIRA®, вводят посредством стента, содержащего лекарственные средства.
Антитело против TNFα можно вводить в сочетании с дополнительным лекарственное средством для лечения рестеноза. Примеры средств, которые можно использовать для лечения или предупреждения рестеноза, включают в себя сиролимус, паклитаксел, эверолимус, такролимус, ABT-578 и ацетаминофен.
Антитело против TNFα по изобретению можно вводить в сочетании с дополнительным лекарственным средством для лечения инфаркта миокарда. Примеры средств, которые можно использовать для лечения или предупреждения инфаркта миокарда, включают в себя аспирин, нитроглицерин, тартрат метопролола, эноксапарин натрия, гепарин натрия, бисульфат клопидогрела, карведилол, атенолол, сульфат морфина, сукцинат метопролола, варфарин натрия, лизиноприл, мононитрат изосорбида, дигоксин, фуросемид, симвастатин, рамиприл, тенектеплазу, малеат эналаприла, торсемид, ретавазу, лозартан калия, квинаприл hcl/mag carb, буметанид, альтеплазу, эналаприлат, гидрохлорид амиодарона, тирофибан hcl m-гидрат, гидрохлорид дилтиазема, каптоприл, ирбесартан, валсартан, гидрохлорид пропранолола, фосиноприл натрия, гидрохлорид лидокаина, эптифибатид, цефазолин натрия, сульфат атропина, аминокапроновую кислоту, спиронолактон, интерферон, гидрохлорид соталола, хлорид калия, докузат натрия, добутамин hcl, альпразолам, правастатин натрия, аторвастатин кальция, гидрохлорид мидазолама, гидрохлорид меперидина, динитрат изосорбида, эпинефрин, гидрохлорид допамина, бивалирудин, розувастатин, эзетимиб/симвастатин, авазимиб, абциксимаб и карипорид.
Антитело против TNFα по изобретению можно вводить в сочетании с дополнительным лекарственным средством для лечения стенокардии. Примеры средств, которые можно использовать для лечения или предупреждения стенокардии, включают в себя аспирин; нитроглицерин; мононитрат изосорбида; атенолол; сукцинат метопролола; тартрат метопролола; безилат амлодипина; дигоксин; гидрохлорид дилитиазема; динитрат изосорбида; бисульфат клопидогрела; нифедипин; аторвастатин кальция; хлорид калия; симвастатин; верапамил hcl; фуросемид; пропранолол hcl; карведилол; лизиноприл; спиронолактон; гидрохлортиазид; малеат эналаприла; мадолол; рамиприл; эноксапарин натрия; гепарин натрия; валсартан; гидрохлорид соталола; фенофибрат; эзетимиб; буметанид; лозартан калия; лизиноприл/гидрохлортиазид; фелодипин; каптоприл и фумарат бизопролола.
В одном варианте осуществления изобретения антитело против TNFα вводят в сочетании со средством, общепринятым для лечения инфекции вируса гепатита C. Примеры таких средств включают в себя интерферон-альфа-2a, интерферон-альфа-2b, интерферон-альфа con1, интерферон-альфа-n1, пегилированный интерферон-альфа-2a, пегилированный интерферон-альфа-2b, рибавирин, пэгинтерферон альфа-2b и рибавирин, урсодезоксихолевую кислоту, глицирризиновую кислоту, тимальфазин, махамин и VX-497.
Антитело против TNFα можно вводить в сочетании с местными кортикостероидами, аналогами витамина D, и местными или пероральными ретиноидами или их сочетаниями для лечения псориаза. Кроме того, антитело против TNFα можно вводить в сочетании с одним из следующих средств для лечения псориаза: низкомолекулярный ингибитор KDR (ABT-123), низкомолекулярный ингибитор Tie-2, кальципотриен, пропионат клобетазола, ацетонид триамцинолона, пропионат галобетазола, тазаротен, метотрексат, флуоцинонид, усиленный дипропионат бетаметазона, флуоцинолон, ацетонид, ацитретин, дегтярный шампунь, валерат бетаметазона, фуроат мометазона, кетоконазол, прамоксин/флуоцинолон, валерат гидрокортизона, флурандренолид, мочевина, бетаметазон, пропионат клобетазола/смягчающее средство, пропионат флутиказона, азитромицин, гидрокортизон, увлажняющий состав, фолиевая кислота, дезонид, деготь, диацетат дифлоразона, этанерцепт, фолат, молочная кислота, метоксален, hc/субгаллат висмута/znox/resor, ацетат метилпреднизолона, преднизон, солнцезащитное средство, салициловая кислота, галцинонид, антралин, пивалат клокортолона, экстракт угля, деготь/салициловая кислота, деготь/салициловая кислота/сера дезоксиметазон, диазепам, смягчающее средство, смягчающее средство/пимекролимус, флуоционид/смягчающее средство, минеральное масло/касторовое масло/лактат натрия, минеральное масло/арахисовое масло, вазелин/миристат изопропила, псорален, салициловая кислота, мыло/трибромсалан, тимеросал/борная кислота, целекоксиб, инфликсимаб, алефацепт, эфализумаб, такролимус, пимекролимус, PUVA, UVB и другая фототерапия и сульфасалазин.
Антитело, часть антитела можно использовать в сочетании с другими средствами для лечения состояний кожи. Например, антитело, часть антитела или другой ингибитор TNFα по изобретению сочетают с терапией PUVA. PUVA представляет собой сочетание псоралена (P) и длинноволнового ультрафиолетового излучения (UVA), которое используют для лечения многих различных состояний кожи. Антитела, части антител или другие ингибиторы TNFα по изобретению можно сочетать также с пимекролимусом. В другом варианте осуществления антитела по изобретению используют для лечения псориаза, где антитела вводят в сочетании с такролимусом. В следующем варианте осуществления такролимус и ингибиторы TNFα вводят в сочетании с метотрексатом и/или циклоспорином. В другом варианте осуществления ингибитор TNFα по изобретению вводят с лечением эксимерным лазером для лечения псориаза.
Неограничивающие примеры других лекарственных средств, с которыми можно сочетать антитело против TNFα для лечения повреждения кожи или ногтей, включают в себя фототерапию UVA и UVB. Другие неограничивающие примеры, которые можно использовать в сочетании с ингибитором TNFα, включают в себя лекарственные средства анти-IL-12 и анти-IL-18, включая антитела.
В одном варианте осуществления антитело против TNFα можно вводить в сочетании с дополнительным лекарственным средством для лечения болезни Бехчета. Дополнительные лекарственные средства, которые можно использовать для лечения болезни Бехчета, включают в себя в качестве неограничивающих примеров преднизон, циклофосфамид (цитоксан), азатиоприн (называемый также имуран), метотрексат, тиметоприм/сульфаметоксазол (называемый также бактрим или септра) и фолиевую кислоту.
Любое из вышеупомянутых лекарственных средств, по отдельности или в их сочетании, можно вводить субъекту, страдающему связанным с TNFα нарушением, при котором TNFα является неблагоприятным, в сочетании с антителом против TNFα с использованием режима множественной переменной дозы по изобретению. В одном варианте осуществления любое из вышеупомянутых лекарственных средств, по отдельности или в их сочетании, можно вводить субъекту, страдающему ревматоидным артритом, в дополнение к антителу против TNFα для лечения связанного с TNFα нарушения. Следует понимать, что дополнительные лекарственные средства можно использовать в комбинированной терапии, как описано выше, но также можно использовать при других показаниях, описанных здесь, где благоприятный эффект является желательным.
Это изобретение дополнительно иллюстрируется посредством следующих примеров, которые не следует рассматривать как ограничивающие. Содержания всех ссылок, патентов и опубликованных патентных заявок, процитированных на протяжении этой заявки, приведены здесь в качестве ссылок.
ПРИМЕРЫ
Пример 1: Способ очистки для адалимумаба
В этом примере разработан способ очистки для очистки смеси адалимумаба и белков клетки-хозяина (HCP), где способ обозначен способ A. По способу A смесь адалимумаб-HCP не подвергают стадии хроматографии с белком A. Первая колонка, используемая по способу A, содержала катионообменную смолу, фрактогель S, с которой адалимумаб связывался, в то время как HCP попадали в проскок. Затем адалимумаб элюировали с колонки с фрактогелем S в первом элюате. Затем первый элюат подвергали pH-инактивации вирусов для получения препарата с инактивированными вирусами. Затем препарат с инактивированными вирусами наносили на анионообменную смолу, колонку с Q-сефарозой, с которой адалимумаб не связывается, чтобы таким образом получить первый проскок. Затем проскок наносили на колонку для гидрофобного взаимодействия, колонку с фенилсефарозой, с которой адалимумаб связывается, а HCP остается в проскоке, чтобы таким образом получить второй элюат. Проводили дальнейшую переработку и упаковку второго элюата для получения конечного продукта, разлитого по флаконам.
Более подробно, способ A включает в себя следующие стадии.
Стадия 1: Колонка с фрактогелем S, 100×20 см (157 л), v = 175 см/час, загрузка ≤30 г белка/л смолы на цикл, уравновешенная 20 мМ фосфатом натрия, 25 мМ хлоридом натрия. После нанесения адалимумаба колонку промывали один раз буфером для уравновешивания и элюировали буфером для элюции, содержащим 20 мМ фосфат натрия, 150 мМ хлорид натрия, для получения первого элюата.
Стадия 2: Фильтрация для очистки от липидов.
Стадия 3: Ультрафильтрация.
Стадия 4: pH-инактивация при pH 3,5 в течение 1 часа; после завершения инактивации pH доводили до 6,8-7,5, серию фильтров промывали двумя объемами 50 мМ троламина.
Стадия 5: Колонка с Q-сефарозой FF, 60×30 см (85 л), v = 150 см/час, загрузка ≤40 г белка/л смолы на цикл, уравновешенная буфером для уравновешивания, содержащим 25 мМ троламин, 40 мМ хлорид натрия, pH 7,6; получен проскок.
Стадия 6: Колонку с фенилсефарозой HP, 80×15 см (75 л), v = 75 см/час (элюция 37,5 см/час), загрузка 20-40 г белка/л смолы на цикл, уравновешенную буфером для уравновешивания, содержащим 20 мМ фосфат натрия, 1,1 M (NH4)2SO4, pH 7, промывали один раз буфером для уравновешивания и проводили элюцию посредством ступенчатого градиента соли до 11 мМ фосфата натрия, 0,625 M (NH4)2SO4, pH 7,0, чтобы таким образом получить второй элюат, с пиком фракционирования продукта при нанесении ≤35 г белка/л смолы.
Стадия 7: Фильтрация вирусов.
Стадия 8: Конечная ультрафильтрация/диафильтрация.
Стадия 9: Конечный блоттинг.
Дополнительные подробности способа A описаны также в примере 2 ниже.
Пример 2: Очистка адалимумаба для улучшения входа и уменьшения примесей
Модификации вводили в способы связывания и тонкой очистки способа изготовления антитела адалимумаба, а именно способа A, описанного в примере 1, выше. Модифицированный способ обозначен здесь как «способ B» и включает в себя следующие общие стадии. Исходный материал представлял собой смесь, полученную после способа ферментации с использованием экспрессирующей системы клеток яичника китайского хомяка (CHO). Сначала смесь разделяли с использованием катионообменной хроматографии, т.е. колонки с фрактогелем S, где адалимумаб связывался с колонкой (обозначено «связывание»). Загрузку на колонку с фрактогелем S увеличивали из-за вытеснения. Использовали улучшенный способ промывки колонки с фрактогелем S для уменьшения количества белка клетки-хозяина (HCP). Колонку с фрактогелем S со связанным адалимумабом промывали с помощью множества промывок, включая промежуточную промывку, представляющую собой промывку с более высокой электропроводностью, включающую в себя 45% буфера для элюции и 55% воды для инъекций (WFI). После связывания и промывки адалимумаб элюировали с колонки с фрактогелем S и элюат подвергали анионообменной хроматографии, т.е. на колонке с Q-сефарозой. Перед пропусканием первого элюата с адалимумабом через анионообменную колонку элюат подвергали инактивации вирусов с использованием улучшенного способа, основанного на pH и электропроводности. Препарат адалимумаба собирали в проскоке анионной колонки и затем разделяли далее хроматографией гидрофобного взаимодействия, т.е. на колонке с фенилсефарозой. Элюат с колонки с фенилсефарозой далее подвергали фильтрации вирусов, конечной ультрафильтрации и конечному блоттингу согласно общепринятым в данной области способам.
Способ B представляет собой улучшенный способ очистки для получения препарата антитела с уменьшенным уровнем HCP и прокатепсина L. Способы, описанные здесь, осуществляли с использованием объема 6000 л, однако, следует отметить, что модификации, описанные по способу B, можно использовать для любого объема. Сравнение между модификациями способа A по отношению к способу B представлено в таблице 5 (модификации по способу B выделены жирным).
Сравнение способа A и способа B
Загрузка ≤30 г белка/л на цикл
Промывка 1 - буфер для уравновешивания
Элюция - буфер для элюции
Загрузка ≤35 г белка/л на цикл
Промывка 1 - буфер для уравновешивания
Промывка 2 = 45% буфер для элюции: 55% WFI
Элюция - буфер для элюции
v=150 см/час
Загрузка ≤40 г белка/л смолы на цикл
v=150 см/час
Загрузка ≤40 г белка/л смолы на цикл
v=75 см/час (элюция 37,5 см/час)
Загрузка 20-40 г белка/л смолы на цикл с пиком фракционирования продукта при загрузке ≤35 г/л смолы
v=75 см/час (элюция 37,5 см/час)
Загрузка 20-40 г белка/л смолы на цикл без пика фракционирования продукта при загрузке ≤35 г/л смолы
диафильтрация
Модификации различных стадий по способу B более подробно описаны ниже.
Катионная хроматография
Первичные операции выделения и очистки по способу B включают в себя глубокую фильтрацию, катионообменную хроматографию на фрактогеле SO33 - (фрактогель S), последняя из которых служит для связывания адалимумаба из осветленного продукта сбора и уменьшения количества связанных с процессом примесей (например, примеси из клетки-хозяина CHO и среды). Для этой операции использовали колонку диаметром 100 см × 20 см длины (объем слоя 157 л). Колонку набивали смолой фрактогель S (EM Industries, Hawthorne, NY) и измеряли асимметричность и высоту, эквивалентную теоретической тарелке (HETP), для определения качества набивки. Затем колонку дезинфицировали 1,0 M NaOH в течение 1 часа и хранили в 0,1 M NaOH до готовности к использованию.
На катионообменную хроматографию можно влиять посредством загрузки белка, ионной силы (контролируемой разведением фильтрованного продукта сбора), pH и линейной скорости. Загрузка белка может влиять на избирательность, разрешение (чистоту) и выход. Ионная сила (контролируемая разведением при загрузке) и pH образца при нанесении могут влиять на емкость, избирательность, разделение и выход. Линейная скорость может влиять на свойства переноса массы, потенциально приводя к снижению связывания и разделения при очень высоких скоростях потока и осевой дисперсии при очень низких скоростях потока. Максимальную загрузку на колонку с фрактогелем S увеличивали до 35 г белка на литр смолы. Катионную колонку уравновешивали 20 мМ фосфатом натрия, 25 мМ NaCl, pH 7. После уравновешивания на колонку наносили ≤35 г белка/л смолы из разведенного продукта глубокой фильтрации. Одну часть продукта глубокой фильтрации разводили приблизительно 1,3 частями воды для уменьшения электропроводности до приблизительно 6,1 мСм/см. Затем колонку промывали до уровня фона буфером для уравновешивания с последующей промывкой 9 мМ фосфатом натрия, 68 мМ NaCl, pH 7 (эквивалентно 45% буфера для элюции, 55% WFI). Продукт элюировали с колонки в отдельной фракции 20 мМ фосфатом натрия, 150 мМ NaCl, pH 7 (буфер для элюции). Пул продукта собирали для 10% полного отклонения от пика продукта при A280 с переднего и заднего краев. Обработку на колонке повторяли циклически, как необходимо для переработки грубого адалимумаба. Элюаты с каждого цикла на колонке с фрактогелем S объединяли в одном сборном резервуаре. Между каждыми циклами колонку регенерировали 25 мМ фосфатом натрия, 1,0 M NaCl, pH 7.
Исследования, проведенные в лабораторном масштабе, показали, что эффективного выделения продукта и уменьшения уровня HCP можно достигать при более высоких диапазонах нанесения, чем установленные ранее приемлемые рабочие диапазоны (AOR) 15-30 г белка/л смолы. Анализ проскока адалимумаба в зависимости от загрузки колонки показал, что рассчитанный 5% проскок присутствует при 38 г/л смолы при pH 7. Таким образом, определили пересмотренный AOR ≤35 г белка/л смолы для стадии хроматографии на фрактогеле S. В целом, предел загрузки также увеличили до 35 граммов белка на литр смолы для увеличения производительности способа.
В другой серии экспериментов со смолой фрактогель исследовали эффект pH на проскок адалимумаба в зависимости от загрузки колонки. В частности, кривую продукта проскока использовали для определения емкости динамического связывания при определенных условиях нанесения. В таблице 6 ниже суммированы данные выделения для исследования емкости нанесения на фрактогель в описанных ранее условиях pH 7. Процент выделения при 10 г/л использовали для нормализации как 100%.
Данные выделения для исследования емкости нанесения на фрактогель при pH 7
Результаты при pH 7 показали, что наблюдали более чем 90% выделение адалимумаба для условий нанесения менее чем 50 г адалимумаба на литр смолы фрактогель. Строили график проскока адалимумаба в зависимости от емкости нанесения для получения теоретической кривой проскока. При pH 7 обнаружили, что теоретический 10% проскок присутствует для 54 г адалимумаба на литр смолы фрактогель. Также при pH 7 обнаружили, что теоретический 5% проскок присутствует для 38 г адалимумаба на литр смолы фрактогель, что подтверждает описанные выше результаты. Проводили подобное исследование, как описано выше, за исключением того, что условия pH для нанесения и первой промывки доводили до pH 5. Катионную колонку уравновешивали 24 мМ лимонной кислотой и 51 мМ фосфатом натрия, двухосновным, pH 5. После уравновешивания на колонку наносили вплоть до 80 г белка/л смолы из разведенного продукта глубокой фильтрации. В продукте сбора культуры клеток pH доводили до 5,0 с помощью 3M уксусной кислоты перед глубокой фильтрацией. Одну часть продукта глубокой фильтрации разводили приблизительно одинаковым объемом воды для уменьшения электропроводности приблизительно до 8-10 мСм/см. Снова строили график проскока адалимумаба в зависимости от емкости нанесения для получения теоретической кривой проскока. В исследуемых условиях обнаружили, что теоретический 10% проскок присутствует для приблизительно 74 г адалимумаба на литр смолы фрактогель. Обнаружили, что теоретический 5% проскок присутствует для приблизительно 73 г адалимумаба на литр смолы фрактогель. Из-за катионообменного характера смолы снижение pH в условиях хроматографии значительно увеличивало емкость динамического связывания адалимумаба. При сравнении кривых проскока при pH 5 и pH 7 наблюдали, что связывание между молекулой адалимумаба и смолой фрактогель являлось более сильным при низком pH. Обнаружили также, что при более высокой емкости динамического связывания при pH 5 достигают лучшей очистки от HCP. В таблице 7 ниже суммированы данные для исследования емкости нанесения на фрактогель в зависимости от HCP, присутствующих в элюате в новых тестируемых условиях pH 5. Данные ясно показывают, что в тестируемых условиях происходит вытеснение HCP адалимумабом.
Присутствие HCP в элюате после фрактогеля при различных емкостях нанесения при pH 5
Поскольку анализ проскока адалимумаба в зависимости от нанесения на колонку при pH 5 показал, что рассчитанный 5% проскок присутствует для 73 г/л смолы, можно определить пересмотренный AOR ≤70 г белка/л смолы для стадии хроматографии на фрактогеле S при pH 5. В целом, предел загрузки, который ранее увеличили до 35 граммов белка на литр смолы при pH 7 (как описано выше), можно далее увеличивать до 70 граммов белка на литр смолы посредством понижения pH до 5.
Промежуточная промывка
Для дальнейшего уменьшения количества примесей в препарате адалимумаба проводили стадию промежуточной промывки перед элюцией адалимумаба с катионной колонки (смотри таблицу 8 ниже). Эта дополнительная промывка регулировала электропроводность относительно буфера для элюции и помогала улучшить очистку от HCP. Включение стадии промежуточной промывки перед элюцией уменьшало количество HCP, элюированных с адалимумабом, более чем на 60% по сравнению со способом A. Исследуемые параметры включали в себя смешивание буфера для элюции с водой, применяемое для промывки (% буфера для элюции), электропроводность, pH, объем для промывки, скорость потока и возраст смолы. Оптимум состоял из смеси 45% буфера для элюции (20 мМ фосфат натрия, 150 мМ хлорид натрия, pH 7) и 55% воды. В таблице 8 представлены данные сравнения уровня HCP в элюате с фрактогелем S с дополнительной промывкой и без нее. В образцах элюата с фрактогеля S анализировали HCP и сравнивали с уровнями HCP в элюате в процессе с фрактогелем S пилотного масштаба, который включает в себя более высокую загрузку и стадию промывки. Данные для пилотного масштаба показывают, что добавление стадии второй промывки значительно улучшает очистку от HCP на стадии фрактогеля S.
Уровни HCP в элюате с фрактогелем S со стадией промывки перед элюцией и без в лабораторном масштабе
b Загрузка состояла из смеси фильтрованных продуктов сбора из различных партий.
c Размер колонки в пилотном масштабе составлял 10 (D) × 21 (л) см; буфер для 2-й промывки: 45% буфер для элюции (20 мМ фосфат натрия, 150 мМ хлорид натрия, pH 7,2), 55% вода для инъекций.
Типичные профили элюции для стадии хроматографии на фрактогеле S для каждого способа представлены на фигуре 1. Способ B включает в себя вышеупомянутую дополнительную стадию промежуточной промывки перед элюцией, таким образом, передний край пика элюции является более острым, с обнаружением меньшего количества рано элюированных молекул, чем для предшествующих способов. В целом, стадию промежуточной промывки, непосредственно перед элюцией адалимумаба, вводили на стадии фрактогеля S для улучшения очистки от связанных со способом примесей, таких как HCP.
Инактивация вирусов
Стадия инактивации при низком pH по способу B обеспечивает запас безопасности посредством инактивации потенциальных невыявленных оболочечных вирусов, которые могут присутствовать в продукте глубокой фильтрации. Затем в пуле после инактивации вирусов нейтрализуют pH и фильтруют для удаления твердых частиц и минимизации биологической нагрузки. На качество адалимумаба во время инактивация вирусов при низком pH может влиять pH и продолжительность инкубации при низком pH.
Инактивация вирусов зависит от тех же самых параметров, и на нее может влиять концентрация белка, которая может уменьшать инактивацию при высоких концентрациях. Минимальное время инкубации при низком pH увеличили от 15 минут до 60 минут. Анализ производственных образцов, взятых до и после стадии низкого pH, подтвердил, что адалимумаб можно безопасно выдерживать при pH 3,5 в течение 1 часа без опасности для его способности защищать мышиные клетки L929 против цитотоксических эффектов фактора некроза опухоли (TNF).
После инактивации pH и электропроводность элюата c инактивированными вирусами доводили в соответствии с буфером для уравновешивания следующей колонки, например колонки с Q-сефарозой. pH доводили до 7,8-8,2, с намеченным pH 8,0. В целом, pH и электропроводность пула после инактивации вирусов, служащего для загрузки на Q-сефарозу FF, доводили до совпадения с pH и электропроводностью буфера для уравновешивания Q-сефарозы.
Анионная хроматография
Стадия анионной колонки, т.е. Q-сефарозы, служит для уменьшения уровня связанных со способом примесей, таких как HCP, конкретно включая прокатепсин L, так же, как ДНК и инсулин. Колонку диаметром 60 см × 30 см длины (объем слоя 85 л) использовали для хроматографии на Q-сефарозе FF. Колонку набивали смолой Q-сефарозой FF (Amersham Pharmacia, Piscataway, NJ) и измеряли асимметричность и HETP для определения качества набивки. Затем колонку дезинфицировали 1,0 M NaOH в течение 1 часа и хранили в 25 мМ фосфате натрия, 20% изопропаноле до готовности к использованию.
Уравновешивание смолы осуществляли 25 мМ троламином, 40 мМ NaCl, pH 8 (буфер для уравновешивания). Максимальная загрузка белка для этой стадии составляла ≤40 г белка/л смолы на цикл. Связанные со способом примеси адсорбировались на смоле, а адалимумаб протекал через колонку. Разведенный фильтрованный материал после инактивации вирусов, как правило, перерабатывали за два цикла в приблизительно равных количествах; дополнительные циклы могут являться необходимыми для переработки всего доступного материала. Нанесение и элюцию проводили при 150 см/час и проскок с колонки собирали, когда A280 поднималось выше 2% полной шкалы. Затем колонку промывали буфером для уравновешивания и смыв собирали, пока A280 не возвращалось к 5% полной шкалы. Смыв объединяли с проскоком и обозначали FTW для Q-сефарозы. Между циклами колонку регенерировали 25 мМ фосфатом натрия, 1,0 M NaCl, pH 7 и затем уравновешивали буфером для уравновешивания.
На анионообменную хроматографию, выполняемую проточным способом, может влиять загрузка белка, ионная сила (электропроводность, которую можно контролировать разведением фильтрата после инактивации при низком pH), pH и линейная скорость. Загрузка белка может влиять на избирательность и выход. Ионная сила и pH наносимого образца может влиять на емкость связывания и избирательность. Линейная скорость может влиять на свойства переноса массы, потенциально приводя к снижению связывания связанных со способом примесей при очень высоких скоростях потока и осевой дисперсии при очень низких скоростях потока. На основании лабораторных исследований разработали новые диапазоны электропроводности и pH.
Лабораторные исследования показали, что уменьшение уровня HCP на стадии Q-сефарозы FF можно усилить посредством изменения условий нанесения. Исследуемые параметры включали в себя pH при нанесении, электропроводность и количество граммов белка, наносимых на л смолы. Регулирование электропроводности и pH при нанесении, чтобы они совпадали с электропроводностью и pH буфера для уравновешивания колонки (5 мСм/см, pH 8), и ограничение загрузки ≤40 г адалимумаба/л смолы приводит к улучшению очистки от HCP и прокатепсина L. В таблице 9 представлены данные, полученные в лабораторном масштабе, показывающие уменьшение уровня HCP по способу A (pH 7,7, электропроводность 6,65 мСм/см) и улучшенные условия процесса pH 8 и электропроводность 5 мСм/см по способу B.
Ограничение загрузки на колонку с Q-сефарозой до 40 г/л смолы обеспечивает четырехкратное улучшение очистки от HCP, и дополнительные модификации pH и электропроводности при нанесении приводят к дополнительному трехкратному улучшению уменьшения уровня HCP.
Уменьшение уровня HCP при различных условиях нанесения
на Q-сефарозу FF
Затем проскок с уменьшенным уровнем HCP, содержащий адалимумаб, полученный с ионообменной колонки, использовали для хроматографии гидрофобного взаимодействия.
Хроматография гидрофобного взаимодействия
Целью хроматографии на колонке с фенилсефарозой HP являлось дальнейшее уменьшение количества связанных с процессом и связанных с продуктом примесей, таких как белки клетки-хозяина и агрегаты, соответственно. Для этой операции использовали колонку диаметром 80 см × 15 см длины (объем слоя 75 л). Колонку набивали смолой фенилсефарозой HP (Amersham Pharmacia, Piscataway, NJ) и измеряли асимметричность и HETP для определения качества набивки. Затем колонку дезинфицировали 1,0 M NaOH в течение 1 часа и хранили в 25 мМ фосфате Na, 20% изопропаноле до готовности к использованию.
Уравновешивание смолы осуществляли 20 мМ фосфатом натрия, 1,1 M (NH4)2SO4, pH 7,0 (буфер для уравновешивания). Загрузка белка для этой стадии составляла 20-40 г белка на л смолы, и два или три цикла хроматографии являлись необходимыми для переработки всего количества доступного материала. Колонка действовала при линейной скорости 75 см/час. Проскок после Q-сефарозы разводили равным объемом 40 мМ фосфата натрия, 2,2 M (NH4)2SO4, pH 7,0. После нанесения колонку промывали 20 мМ фосфатом натрия, 1,1 M (NH4)2SO4, pH 7,0. Продукт элюировали осуществлением ступенчатого градиента соли до 11 мМ фосфата натрия, 0,625 M (NH4)2SO4, pH 7,0. Продукт собирали, когда поглощение поднималось выше 50% полной шкалы UV, и продолжали, пока поглощение не уменьшалось до менее чем 20% полной шкалы UV в качестве хвостов пиков.
Модификации способа на стадиях хроматографии на фрактогеле S и Q-сефарозе FF значительно уменьшали нагрузку связанных со способом примесей, оцениваемую на стадии фенилсефарозы HP. В качестве последствий изменений главной функцией стадии фенилсефарозы HP являлось удаление агрегатов адалимумаба.
По способу A необходимо, чтобы при загрузках колонки 35 г белка/л смолы или выше продукт собирали, когда поглощение UV поднималось выше 50% полной шкалы отклонения, и продолжали, пока поглощение не уменьшалось до <20% полной шкалы. При загрузках колонки ниже 35 г белка/л смолы первые 0,15 объема колонки из пика элюата исключают из собираемого пула для улучшения очистки от HCP на этой стадии. Включение модификаций на предыдущих стадиях хроматографии по способу B смягчает необходимость исключения пика при загрузках ниже 35 г белка/л смолы, поскольку поступающая нагрузка HCP значительно снижена. Уменьшение нагрузки HCP позволяет расширение диапазона загрузки без фракционирования. Эффект этого изменения позволяет переработку всего материала после каждой ферментации посредством способа очистки без отсекания пика на фенилсефарозе HP.
Линейную скорость потока для операции на фенилсефарозе исследовали в лабораторном масштабе. Загрузку адалимумаба поддерживали постоянной и исследовали скорости потока 25-125 см/час. Скорость потока влияла на выделение продукта, но не влияла на качество продукта, как оценивали по SEC (% мономера) и очистке от HCP (таблица 10), оправдывая более широкий диапазон 25-125 см/час. Намеченные скорости потока для производственных операций с фенилсефарозой оставались, как установлено ранее, при 75 см/час и 37,5 см/час для фазы элюции.
Оценка скорости потока для фенилсефарозы
b Предел действия стадии фенилсефарозы по SEC: ≥98% мономера
Исследовали приемлемые рабочие диапазоны для хроматографии на фенилсефарозе HP. На хроматографию гидрофобного взаимодействия может влиять загрузка белка, ионная сила (электропроводность) и линейная скорость. Загрузка белка может влиять на избирательность и выход. Ионная сила наносимого образца может влиять на емкость связывания, избирательность и разделение. Линейная скорость может влиять на свойства переноса массы, потенциально приводя к снижению отделения связанных со способом примесей при очень высоких скоростях потока и осевой дисперсии при очень низких скоростях потока. Диапазон линейной скорости потока расширили до 25-125 см/час. Другие приемлемые рабочие диапазоны для хроматографии на фенилсефарозе оставались неизменными по сравнению с установленными ранее для процесса при 6000 л и перечислены в таблице 10.
Показали сопоставимую производительность операций тонкой очистки для обоих способов. Изменения, внесенные как часть улучшенного способа B, включают в себя регулирование pH и электропроводности пула после инактивации вирусов, который служит для нанесения на Q-сефарозу FF, чтобы они соответствовали буферу для уравновешивания Q-сефарозы, ограничение загрузки на Q-сефарозу менее чем 40 г белка на литр смолы и исключение необходимости фракционирования элюата с фенилсефарозы при нанесении менее чем 35 г белка на литр смолы. Качество промежуточных продуктов, как определяли посредством анализов SEC и WCX-10, являлось сопоставимым для двух способов.
Типичные профили элюции для стадий хроматографии на Q-сефарозе FF и фенилсефарозе HP для каждого способа представлены на фигурах 2 и 3, соответственно. Проскок после Q-сефарозы, содержащий адалимумаб, собирали. Значения наносимого объема для способа B являлись более высокими, чем для предшествующего способа, из-за более высоких загрузок на предыдущей стадии хроматографии (фрактогель S) и увеличения объема при разведении; таким образом, общий объем проскока, соответственно, является более высоким.
В целом, необходимость фракционирования элюата с фенилсефарозы для нанесения менее чем 35 г белка на литр смолы исключена из-за улучшения очистки от примесей, являющегося результатом изменений в операциях на фрактогеле S и Q-сефарозе. Кроме того, диапазон линейной скорости потока расширен до 25-125 см/час.
Уменьшение уровня HCP
Способ B включает в себя модификации на стадиях хроматографии на фрактогеле S и Q-сефарозе, которые осуществили для улучшения контроля над связанными со способом примесями, такими как белок клетки-хозяина (HCP) и, конкретно, прокатепсин L. Провели исследование для оценки вклада способа B в удаление этих примесей. Способность колонок с фрактогелем S, Q-сефарозой FF и фенилсефарозой HP удалять белки клетки-хозяина CHO оценивали в производственном масштабе. Уровни белка клетки-хозяина определяли посредством ELISA HCP (смотри пример 3) и данные выражали в нг HCP/мг адалимумаба.
Репрезентативные образцы отбирали в ходе способа B и анализировали по HCP. Результаты представлены в таблице 11. Изменения на стадиях хроматографии представляют собой более строгие условия хроматографии, которые, как ожидают, будут улучшать очистку от HCP. Опубликованные результаты фильтрации для очистки от липидов представляют собой результаты для способа A. Стадию фильтрации для очистки от липидов не изменяли для способа B, таким образом, степень уменьшения уровня HCP, достигаемая на этой стадии, включена в общую производительность по способу B. В среднем, по способу B возможно удалить более чем 4,35 log10 HCP. Как хроматографией на фрактогеле S, так и хроматографией на Q-сефарозе FF очищают более чем 1 log10 HCP и на стадии глубокой фильтрации также очищают более чем 1 log10. Дополнительные HCP удаляют посредством колонки с фенилсефарозой, однако, фактор очистки невозможно рассчитать, поскольку уровни HCP как при загрузке, так и в элюате ниже уровня количественного определения. Для лекарственного вещества, полученного по способу B, показали уровни HCP ниже предела количественного определения (LOQ) для трех тестовых образцов.
Очистка от белка клетки-хозяина
b Данные по способу A.
c Log10 фактора уменьшения менее чем 1 не включали в общий расчет очистки.
Общее улучшение уровней HCP и прокатепсина L показано также в таблицах 12 и 13, соответственно, где для способа B показали значительное уменьшение обоих уровней по сравнению со способом A.
Составление карты процесса по прокатепсину L
Промежуточные образцы для процесса отбирали на различных стадиях и анализировали по флуоресценции, полученной при активации прокатепсина L до катепсина L. Результаты показаны в таблице 14 ниже для образцов по способу B и способу A. Образцы загрузки для фрактогеля S и загрузки и элюата для фенилсефарозы было невозможно оценить из-за помех, связанных с методом. Стадия хроматографии на Q-сефарозе FF обладает способностью удаления более чем 90% поддающегося детекции фермента при загрузке. Проскок и смыв для Q-сефарозы (FTW) по улучшенному способу содержит приблизительно на 50% меньше поддающегося активации прокатепсина L, чем FTW для Q-сефарозы по предыдущему способу для 6000 л. Уменьшение происходит также между стадиями фрактогеля S и Q-сефарозы, во время которых выполняют операции фильтрации для очистки от липидов, концентрации посредством ультрафильтрации, инактивации вирусов при низком pH и глубокой фильтрации.
Составление карты способа A и способа B по прокатепсину L
Сравнение уменьшения уровня прокатепсина L для способов A и B показано на фигуре 4. Способ B продемонстрировал более низкие уровни прокатепсина L, чем способ A, на каждой промежуточной стадии, что указывает на то, что модификации стадий хроматографии на фрактогеле S и Q-сефарозе улучшают производительность способа по отношению к удалению этой примеси.
Составление карты процесса по HCP
Промежуточные образцы для процесса отбирали для обоих способов A и B и анализировали по содержанию HCP. Это исследование проводили для непосредственного сравнения двух способов по уменьшению уровня HCP. Результаты анализа HCP показаны в таблице 15. Значительное удаление HCP происходит на стадиях фрактогеля S и Q-сефарозы в обоих способах, но способ B показал улучшенную очистку от HCP на обеих этих стадиях. Улучшенная стадия фрактогеля S, которая включает в себя вторую стадию промывки перед элюцией продукта, обладает фактором уменьшения 96 (1,96 log10), тогда как та же самая стадия предшествующего способа приводит к фактору уменьшения 48 (1,67 log10). Оба способа показали фактор уменьшения 50, сопровождающий фильтрацию для очистки от липидов, проводимую между стадиями хроматографии на фрактогеле S и Q-сефарозе. Операцию на Q-сефарозе по способу B проводят с регулированием pH и электропроводности при нанесении по буферу для уравновешивания колонки. Фактор уменьшения уровня HCP, достигаемый на улучшенной стадии Q-сефарозы, в четыре раза превышает фактор, показанный для предыдущего способа (21 против 5). Дополнительное уменьшение происходит на стадии фенилсефарозы, так что уровень HCP ниже уровня количественного определения для пула UF/DF и лекарственного вещества по улучшенному способу; предыдущие образцы лекарственного вещества показали очень низкие, но поддающиеся измерению уровни HCP.
Составление карты способов A и B по белку клетки-хозяина
661000
3370
339000
9160
442
Сравнение уменьшения уровня HCP по способу B по сравнению со способом A, нанесенного на график в шкале log10, показано на фигуре 5. Способ B показал более низкие уровни HCP, чем способ A, на каждой промежуточной стадии, включая 10-кратную разницу после стадии Q-сефарозы, что указывает на то, что модификации стадий хроматографии на фрактогеле S и Q-сефарозе улучшают производительность способа по отношению к удалению HCP.
Вклад операций связывания и тонкой очистки в производительность обработки
Два изменения введены для увеличения производительности обработки в операции связывания и тонкой очистки по способу B. Первое представляло собой увеличение допустимого предела загрузки на колонку с фрактогелем S от 30 г белка/л смолы до 35 г белка/л смолы при pH 7 и от 30 г белка/л смолы до 70 г белка/л смолы при pH 5. Эти изменения позволяют наносить весь фильтрованный собранный материал из биореактора на колонку с фрактогелем S. Средняя загрузка на колонку с фрактогелем S являлась приблизительно на 9% выше для улучшенного способа (при pH 7), чем загрузка для предыдущего способа (таблица 16).
Второе изменение представляло собой исключение необходимости фракционирования пика продукта после фенилсефарозы при нанесении менее чем 35 г белка/л смолы. Фракционирование приводит к выбрасыванию значительной части пика продукта, чтобы адекватно контролировать белки клетки-хозяина. Изменения, выполненные на стадиях фрактогеля S и Q-сефарозы для контроля уровней белков клетки-хозяина и прокатепсина L, делают фракционирование пика после фенилсефарозы необязательным. Это изменение позволяет по способу B проводить три цикла на колонке с фенилсефарозой при более низком диапазоне нанесения, что приводит к 12% увеличению общей загрузки на колонку с фенилсефарозой по сравнению со способом A.
В таблице 16 сравнивают загрузки на колонки с фрактогелем S и с фенилсефарозой, а также конечные количества лекарственных веществ по улучшенному и предыдущему способам. Улучшенный способ показал приблизительно 8% общее увеличение выхода адалимумаба для трех тестовых образцов.
Сравнение загрузок на колонки с фрактогелем S и фенилсефарозой и выходов лекарственного вещества по способам A и B
Улучшенный способ очистки антитела адалимумаба улучшал очистку от HCP и прокатепсина L (относительно способа A), приводя к их уменьшенным уровням в лекарственном веществе. Более конкретно, по сравнению с данными выхода партий лекарственного вещества, определили следующие уровни HCP и прокатепсина L, как показано в таблице 17.
Сравнение HCP и прокатепсина L в способах A и B
b 14 из 17 партий ниже предела LOQ 5 нг/мг; значение 5 нг/мг использовали для вычисления среднего и стандартного отклонения.
c LOQ лежали в диапазоне 3,30-3,85.
d LOQ лежали в диапазоне 3,29-3,61.
e LOQ составлял 3,3 (LOQ = предел количественного определения).
Провели расширенную характеризацию лекарственного вещества, полученного с использованием способа B. Лекарственное вещество из трех тестовых образцов анализировали и сравнивали со стандартным образцом адалимумаба с использованием анализов, включая анализ аминокислот, круговой дихроизм, аналитическое центрифугирование, QSTAR LC-масс-спектрометрию, пептидное картирование трипсином в невосстанавливающих условиях и LYS C с детекцией MS, анализ свободного сульфгидрила, пептидное картирование трипсином с детекцией MS, иммуноблоттинг, биоанализ L929 и BIAcore. Все партии лекарственного вещества, изготовленного посредством улучшенного способа, соответствовали критериям приемки и являлись сравнимыми со стандартным образцом.
В целом, показано, что производительность способа B является сравнимой со способом A на стадиях ферментации, связывания и тонкой очистки. Однако способ B показал улучшенные возможности по отношению к уменьшению уровня белка клетки-хозяина и прокатепсина L, а также увеличение емкости по отношению к выходу адалимумаба. Тестирование лекарственного вещества на выходе и исследования для расширенной характеризации дополнительно показали сопоставимость лекарственного вещества адалимумаба, полученного по способу B, с веществом, полученным по способу A.
Общее улучшение уровней HCP
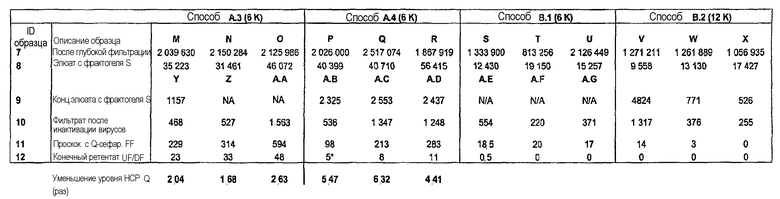
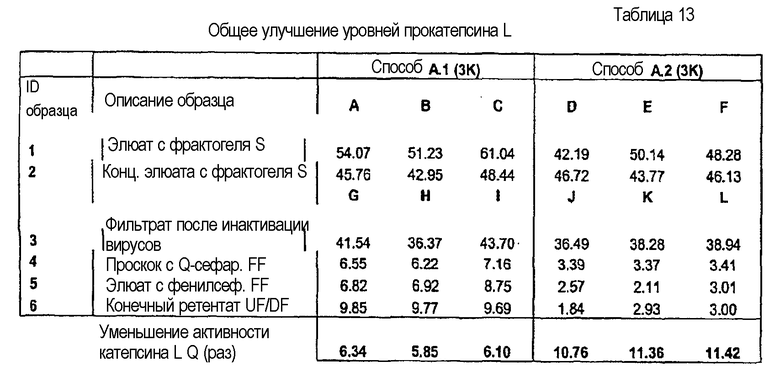
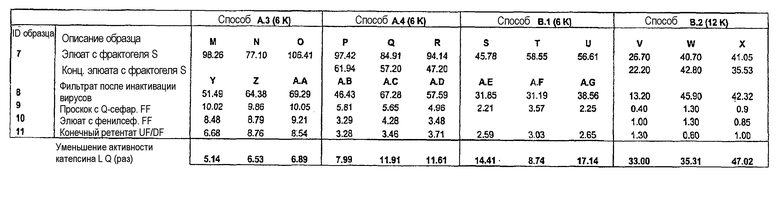
Активность катепсина L: Единицы, используемые для красных номеров,
представляют собой скорость высвобождения флуоресцентного сигнала,
описанную как RFU/сек/мг D2E7
Пример 3: Анализ для детекции HCP
В следующем примере описан способ ELISA HCP для определения остаточной концентрации белка клетки-хозяина (HCP) в образцах лекарственного вещества адалимумаба, полученных по способу B, описанных в примере 2. Твердофазный иммуноферментный анализ (ELISA) использовали для формирования сэндвич-структуры образца, содержащего HCP, между двумя слоями специфических антител. Это сопровождали блокированием неспецифических участков казеином. Затем образец инкубировали, и в течение этого времени молекулы антигена связывались с первым антителом (покрывающее антитело козы против CHO (Chinese Hamster Ovary), Cygnus, аффинно очищенное). Затем добавляли второе антитело (биотинилированное против белка клетки-хозяина CHO), которое связывалось с антигеном (белки клетки-хозяина CHO). Важно, что второе антитело, специфическое для HCP, продуцировали из клеток, применяемых для получения антитела. Добавляли HRP, конъюгированную с нейтравидином, которая связывалась с биотинилированным антителом против белка клетки-хозяина CHO. Это сопровождали добавлением субстрата K синего. Хромогенный субстрат гидролизуют посредством связанного фермента, конъюгированного с антителом, с получением синей окраски. Реакцию останавливали с помощью 2 M H3PO4 с изменением окраски на желтую. Интенсивность окраски являлась прямо пропорциональной количеству антигена, связавшегося с лункой. ELISA HCP показал улучшение для определения уровней HCP в препарате антитела по сравнению с общепринятыми способами ELISA.
Пример 4: Анализ кинетики катепсина L
Разработали анализ кинетики и использовали для количественной оценки активности катепсина L для промежуточных продуктов процесса изготовления адалимумаба по способу B (смотри пример 2). Анализ слабой анионообменной HPLC (WAX-10 HPLC), используемый для измерения HCP при тестировании лекарственного вещества на выходе, нельзя использовать для этого исследования, поскольку переменное содержание белка и состав буфера образцов, полученных в ходе процесса, создают помехи для этого способа. Невозможность прямой количественной оценки прокатепсина L в промежуточных продуктах процесса привела к разработке анализа для измерения активности катепсина L посредством кинетического флуоресцентного способа. Анализ кинетики, т.е. высокопроизводительный флуоресцентный ферментативный способ, меньше подвержен влиянию образцов, полученных в ходе процесса, чем общепринятые способы, применяемые для детекции уровней прокатепсина L. Анализ кинетики также предоставляет средства для анализа воспроизводимости очистки полученных в ходе процесса образцов адалимумаба, описанных в примерах 1 и 2.
Этот способ ускоряет активацию прокатепсина L в образцах до катепсина L посредством добавления декстрансульфата. Флуорогенный пептидный субстрат, Z-лейцин-аргинин-AMC (7-амино-4-метилкумарин), использовали для детекции активности катепсина L при возбуждении 380 нм и испускании 460 нм. Уровень активности флуоресценции в образцах определяли по углу наклона кривой флуорогенного сигнала, полученного посредством расщепления субстрата в секунду. Определили, что диапазон этого анализа активности флуоресценции составляет между 0,0144-1,04 RFU/сек. Эту активность соотносили с количеством адалимумаба, присутствующим в тестируемом образце; таким образом, результаты выражают как RFU/сек/мг адалимумаба. Оптимальные условия активации для достижения максимального флуоресцентного сигнала разрабатывали для каждого промежуточного образца процесса с использованием выведенных программным обеспечением JMP экспериментов DOE. Рекомендуемые условия активации для этого анализа суммированы в таблице 16.
Материалы и методы
Получение исходного раствора 500 мМ DTT
7,7 граммов сверхчистого DTT (Invitrogen) добавляли к 90 мл воды Milli-Q и перемешивали до гомогенности. Раствор доводили водой Milli-Q до конечного объема 100 мл. Затем этот исходный раствор 500 мМ DTT делили на аликвоты и хранили при -80°C.
Получение буфера для активации (25 мМ NaOAc, 5 мМ DTT, 1 мМ ЭДТА pH5,5)
3,44 граммов ацетата натрия (J.T. Baker), 0,38 граммов ЭДТА (J.T. Baker) и 950 мл воды Milli-Q помещали в подходящий контейнер и перемешивали до полной гомогенности. pH буфера доводили до 5,5 с помощью 1 M HCl и доводили до конечного объема 1 л в мерной колбе. Буфер фильтровали через 0,22 мкм фильтр и хранили при 4°C перед использованием. 500 мкл исходного раствора DTT (500 мМ, описанный выше) добавляли к 50 мл буфера до конечной концентрации 5 мМ в сутки использования.
Получение исходного раствора декстрансульфата + 0,1% азида натрия
1 грамм декстрансульфата (EM Science) добавляли в 90 мл воды Milli-Q и перемешивали до гомогенности. Добавляли 100 мкл азида натрия из исходного раствора 1 мг/мл (J.T. Baker). Раствор доводили до конечного объема 100 мл. Затем этот раствор разделяли на аликвоты и хранили при -80°C.
Разработка анализа кинетики
Для образцов, подлежащих тестированию по активности катепсина L, необходима активация профермента (прокатепсина L) для активации фермента (катепсин L). Этого достигают разведением образцов в буфере для активации, добавлением декстрансульфата и инкубацией при 37°C в течение соответствующего времени (подробности обсуждают ниже). После активации образцы можно хранить при -80°C, и они остаются стабильными. Оптимальные условия активации, определенные для образцов, полученных в ходе процесса, показаны в таблице 18.
Обобщение уточненных условий активации для образцов, полученных в ходе процесса
На сутки тестирования аликвоты тестируемых образцов забирали из морозильника с температурой -80°C и оттаивали в ледяной бане. Как только тестируемые образцы оттаивали, (2×) 100 мкл каждого образца наносили на черный полистироловый планшет для микротитрования (Corning кат. # 3650). Аликвоту флуорогенного пептидного субстрата VII Z-L-R-AMC (R&D Systems) оттаивали, защищая от света. Субстрат разводили 1:1350 ацетатным буфером до конечной концентрации 20 мкм. 100 мкл флуорогенного субстрата добавляли к каждой лунке. Затем планшет перемешивали в течение ~1 секунды и инкубировали при 37°C в течение 3 минут, защищая от света. Затем планшет помещали в считыватель для флуоресцентных планшетов, подогретый до 37°C. Длину волны возбуждения устанавливали на 380 нм и испускание устанавливали на 460 нм. Флуоресценцию каждой лунки измеряли каждые 3 минуты в течение 30 минут и рассчитывали скорость гидролиза субстрата. Результаты, принимая во внимание фактор разведения, затем делили на концентрацию адалимумаба для сравнения. Результаты использования этого кинетического анализа описаны выше в примере 2.
Концентрацию адалимумаба определяли по A280 с использованием коэффициента экстинкции 1,39. Определение количества адалимумаба проводили для исследуемых образцов с использованием анализа Poros A. Применяли разведение образцов для получения считывания внутри стандартной кривой. Систему HPLC Shimadzu оснащали сенсорным картриджем для иммунодетекции Poros A (Applied Biosystems, Foster City, CA). Колонку поддерживали при температуре окружающей среды. Система работала при 2 мл/мин. Температуру штатива автодозатора устанавливали на 4°C. Измеряли поглощение при 280 нм. Буфер A представляет собой 1X PBS; буфер B представляет собой 0,1 M уксусную кислоту и 150 мМ хлорид натрия. Впрыскивали образец и адалимумаб элюировали с использованием 100% буфера B.
Расщепление флуорогенного пептида с использованием образца загрузки на фрактогель (смотри первый элюат примера 2; способ B) из материала, полученного после экспрессии адалимумаба в клетках CHO, показано на фигуре 6. Этот образец разводили до 200, 50 и 20 мкг/мл адалимумаба буфером для активации с использованием 0,5 мкг/мл декстрансульфата и инкубировали при 37°C в течение 16 часов. Для этой партии при 50 и 20 мкг/мл были показаны линейные ответы. Значения R2 составляют ≥0,99. Однако при 200 мкг/мл для партии показано нелинейное расщепление субстрата в конце 30-минутного времени измерения, с получением более низкого значения R2 0,91. Таким образом, точное разведение образца является критическим для поддержания линейных скоростей гидролиза.
Проводили также анализы, чтобы подтвердить, что анализ кинетики с использованием активности катепсина для определения уровня прокатепсина A соответствуют рекомендациям ICH, включая точность анализа, включая воспроизводимость точности. Более того, определили, что тип контейнера, например стеклянные и полипропиленовые флаконы, влияет на активность катепсина L. Результаты позволяют предполагать, что наивысших уровней катепсина L достигают при инкубации в полипропиленовом контейнере в отличие от стеклянного контейнера. В обоих случаях добавление 0,5 мкг/мл декстрансульфата необходимо для активации прокатепсина L при pH 5,5.
В целом, точность анализа кинетики показывает, что этот анализ является применимым для детекции потенциальной активности катепсина L в промежуточных продуктах процесса получения адалимумаба.
Эта заявка является родственной патентам США № 6090382, 6258562 и 6509015. Эта заявка является также родственной патентной заявке США, серийный № 09/801185, поданной 7 марта 2001 г.; патентной заявке США, серийный № 10/302356, поданной 22 ноября 2002 г.; патентной заявке США, серийный № 10/163657, поданной 5 июня 2002 г.; и патентной заявке США, серийный № 10/133715, поданной 26 апреля 2002 г.; патентной заявке США, серийный № 10/222140, поданной 16 августа 2002 г.; патентной заявке США, серийный № 10/693233, поданной 24 октября 2003 г.; патентной заявке США, серийный № 10/622932, поданной 18 июля 2003 г.; патентной заявке США, серийный № 10/623039, поданной 18 июля 2003 г.; патентной заявке США, серийный № 10/623076, поданной 18 июля 2003 г.; патентной заявке США, серийный № 10/623065, поданной 18 июля 2003 г.; патентной заявке США, серийный № 10/622928, поданной 18 июля 2003 г.; патентной заявке США, серийный № 10/623075, поданной 18 июля 2003 г.; патентной заявке США, серийный № 10/623035, поданной 18 июля 2003 г.; патентной заявке США, серийный № 10/622683, поданной 18 июля 2003 г.; патентной заявке США, серийный № 10/622205, поданной 18 июля 2003 г.; патентной заявке США, серийный № 10/622210, поданной 18 июля 2003 г., и патентной заявке США, серийный № 10/623318, поданной 18 июля 2003 г. Эта заявка является также родственной PCT/US05/12007, поданной 11 апреля 2005 г. Полное содержание каждого (каждой) из этих патентов и патентных заявок, таким образом, приведено здесь в качестве ссылки.
ЭКВИВАЛЕНТЫ
Специалистам в данной области известно или они будут способны выявить с использованием не более чем общепринятых экспериментов множество эквивалентов конкретных вариантов осуществления изобретения, описанных здесь. Такие эквиваленты предназначены, чтобы входить в следующую формулу изобретения. Содержание всех ссылок, патентов и опубликованных патентных заявок, процитированных на протяжении данной заявки, приведено здесь в качестве ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВЫДЕЛЕНИЕ И ОЧИСТКА АНТИТЕЛ С ИСПОЛЬЗОВАНИЕМ АФФИННОЙ ХРОМАТОГРАФИИ НА ОСНОВЕ БЕЛКА А | 2009 |
|
RU2520838C2 |
| ОЧИСТКА АНТИТЕЛ С ПОМОЩЬЮ ХРОМАТОГРАФИИ С ПСЕВДОДВИЖУЩИМСЯ СЛОЕМ | 2011 |
|
RU2608499C2 |
| ИНАКТИВАЦИЯ ВИРУСА ПРИ ОЧИСТКЕ АНТИТЕЛ | 2009 |
|
RU2551237C2 |
| ВЫДЕЛЕНИЕ И ОЧИСТКА АНТИТЕЛ ПРОТИВ IL-13 С ПРИМЕНЕНИЕМ АФФИННОЙ ХРОМАТОГРАФИИ С БЕЛКОМ А | 2010 |
|
RU2603055C2 |
| СПОСОБЫ ОЧИСТКИ АНТИТЕЛ | 2017 |
|
RU2759909C2 |
| УЛУЧШЕНИЕ АФФИННОЙ ХРОМАТОГРАФИИ ИММУНОГЛОБУЛИНОВ ПУТЕМ ПРИМЕНЕНИЯ ФЛОКУЛЯЦИИ ДО ЗАХВАТА | 2020 |
|
RU2794431C1 |
| УЛУЧШЕННЫЕ СПОСОБЫ ОЧИСТКИ ВЕКТОРОВ НА ОСНОВЕ РЕКОМБИНАНТНОГО AAV | 2010 |
|
RU2588387C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА АНТИТЕЛА ПРОТИВ IL-18 ИЛИ ЕГО АНТИГЕНСВЯЗЫВАЮЩЕЙ ЧАСТИ (ВАРИАНТЫ) | 2009 |
|
RU2514657C2 |
| ПОЛНОСТЬЮ МАСШТАБИРУЕМЫЙ СПОСОБ ПРОИЗВОДСТВА rAAV НА ОСНОВЕ КОЛОНОК | 2017 |
|
RU2754467C2 |
| СПОСОБ АФФИННОЙ ХРОМАТОГРАФИИ ДЛЯ ПОЛУЧЕНИЯ ОЧИЩЕННОГО БЕЛКА | 2012 |
|
RU2609633C2 |










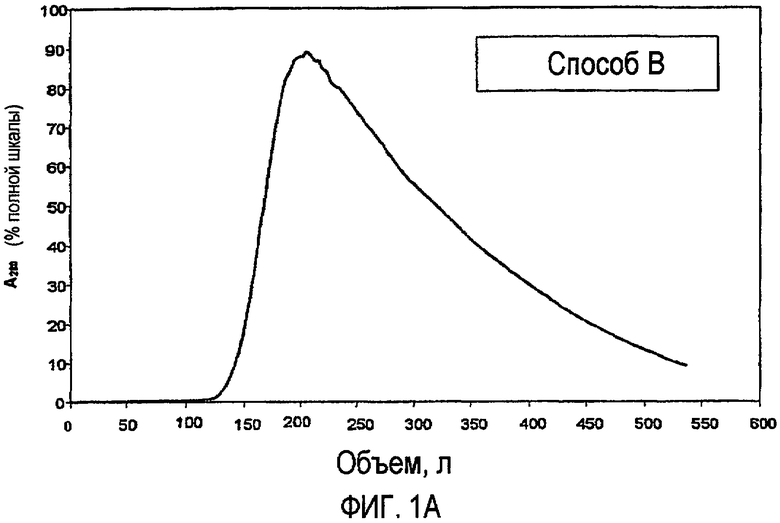
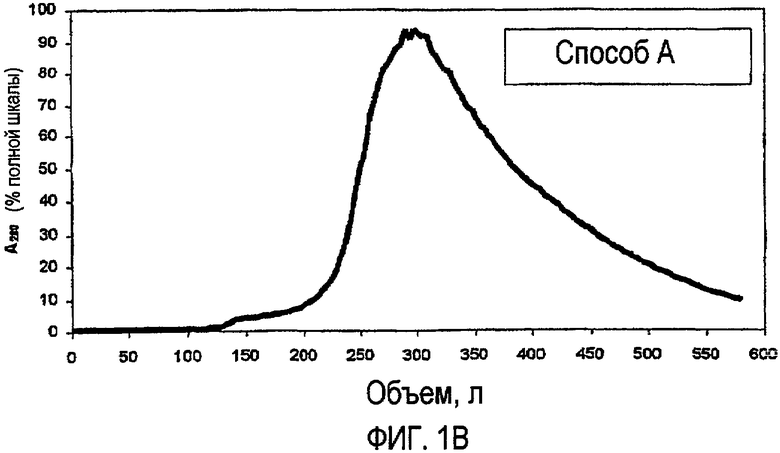
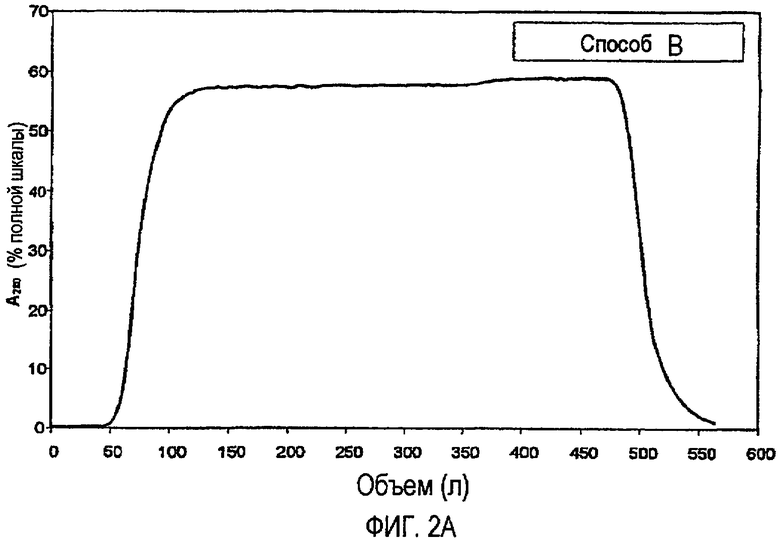
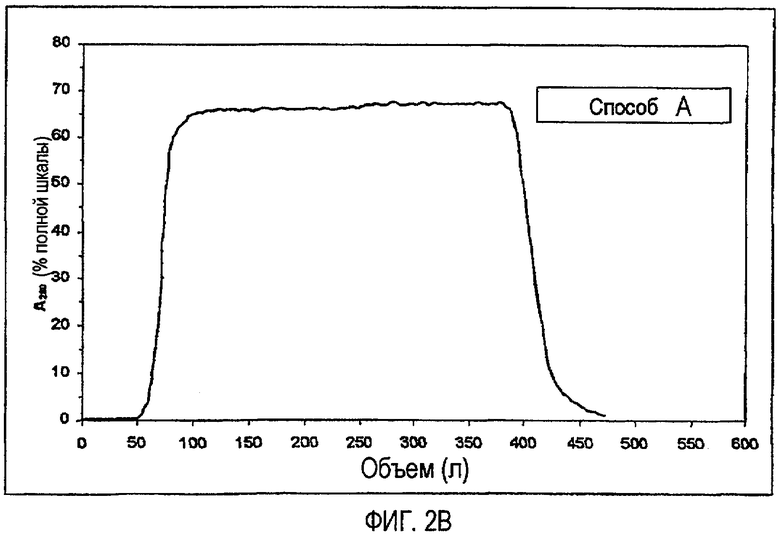
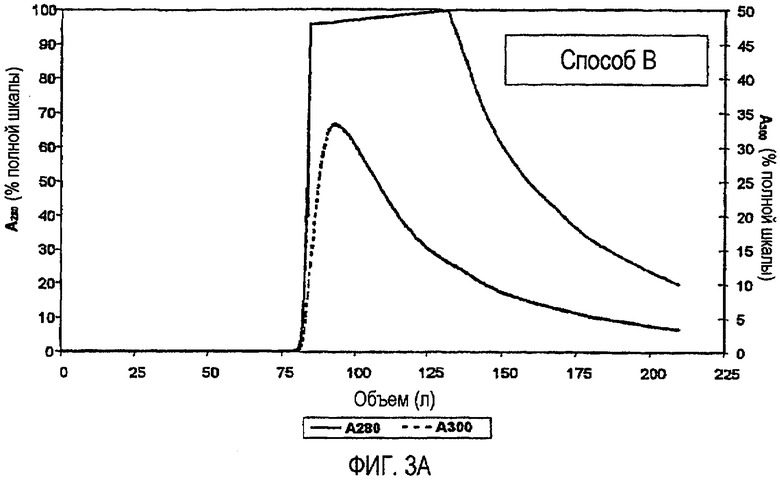
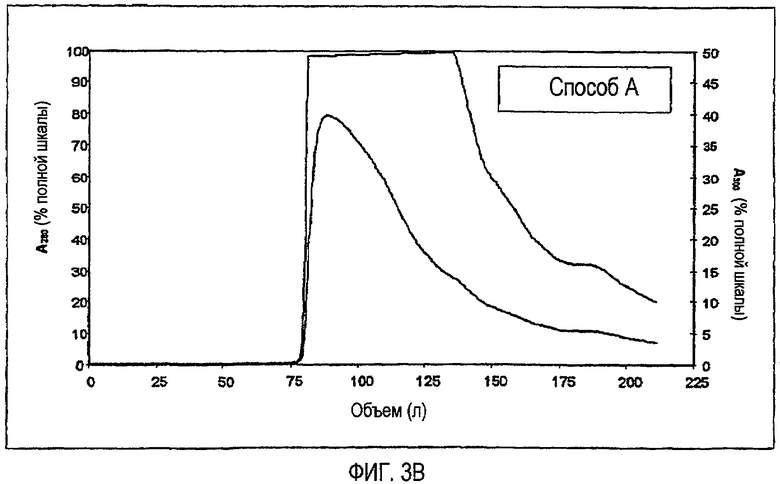
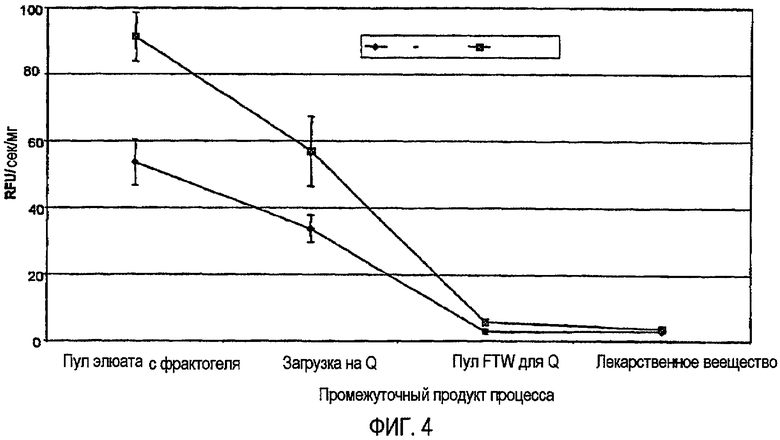
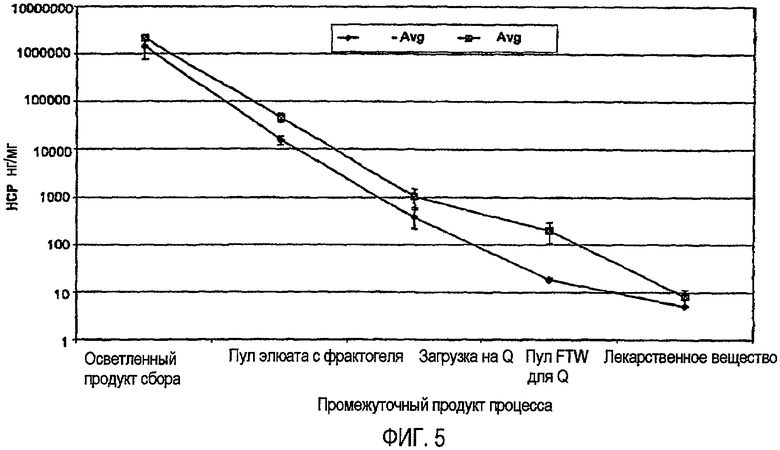
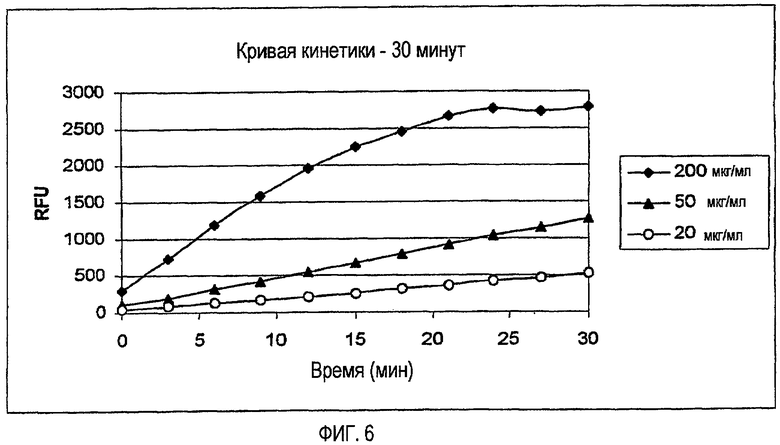
Группа изобретений относится к способам получения препарата антитела с уменьшенным уровнем белков клетки-хозяина (НСР) из смеси, содержащей антитело и, по меньшей мере, один НСР, включающему в себя стадию ионообменного разделения, где смесь подвергают воздействию первого ионообменного материала так, что получают препарат антитела с уменьшенным уровнем НСР. Группа изобретений позволяет произвести быструю и качественную очистку препарата антитела. 4 н. и 60 з.п. ф-лы, 6 ил., 18 табл., 4 пр.
1. Способ получения препарата антител с уменьшенным уровнем белков клетки-хозяина (НСР) из смеси, содержащей антитело и, по меньшей мере, один НСР, причем способ включает:
нанесение смеси на катионообменную смолу, уравновешенную с помощью буфера для уравновешивания, где наносят более чем 30 г антитела на литр катионообменной смолы;
отмывку НСР с катионообменной смолы с помощью множества стадий промывки, включающую первую промывку и вторую промывку, где проводимость первой промывки эквивалентна проводимости буфера для уравновешивания, и с каждой последовательной промывкой из множества стадий промывки происходит повышение проводимости;
элюцию антитела с катионообменной смолы с помощью буфера для элюции с получением первого элюата; и
нанесение первого элюата на анионообменную смолу, где перед нанесением первого элюата на анионообменную смолу рН и проводимость первого элюата делают, по существу, подобными рН и проводимости анионообменной смолы,
получение первого проскока, содержащего антитело, и
получение препарата антител с уменьшенным уровнем НСР.
2. Способ по п.1, где наносят приблизительно 35-70 г антитела на литр катионообменной смолы.
3. Способ по п.1, где катионообменная смола обладает рН 5, и где наносят приблизительно 70 г антитела на литр смолы.
4. Способ по п.1, где смесь, содержащую антитело и, по меньшей мере, один НСР, не подвергают связыванию с белком А перед нанесением смеси на катионообменную смолу.
5. Способ по п.1, где первую промывку проводят с помощью буфера для уравновешивания, и вторую промывку проводят с помощью смеси буфера для элюции и воды.
6. Способ по п.5, где смесь буфера для элюции и воды содержит приблизительно 40-50% буфера для элюции и приблизительно 50-60% воды.
7. Способ по п.6, где смесь буфера для элюции и воды содержит приблизительно 45% буфера для элюции и приблизительно 55% воды.
8. Способ по п.7, где буфер для элюции содержит 20 мМ фосфата натрия и 150 мМ хлорида натрия.
9. Способ по п.1, где катионообменная смола обладает рН 7.
10. Способ по п.1, где рН катионообменной смолы составляет между приблизительно рН 5 и приблизительно рН 7.
11. Способ по п.1, где катионообменная смола обладает рН 5.
12. Способ по п.1, где катионообменной смолой набивают колонку, и смесь, содержащую антитело и, по меньшей мере, один НСР, наносят на колонку.
13. Способ по п.12, где катионообменная смола включает синтетическую полимерную смолу на основе метакрилата, присоединенного к группе сульфоната.
14. Способ по п.1, который дополнительно включает подвергание первого элюата стадии инактивации вирусов.
15. Способ по п.14, где инактивации вирусов достигают посредством рН-инактивации вирусов, что приводит к получению первого элюата с инактивированными вирусами.
16. Способ по п.1, где рН анионообменной смолы лежит в диапазоне от приблизительно рН 7,7 до приблизительно рН 8,3, и рН первого элюата с инактивированными вирусами доводят так, чтобы он лежал в диапазоне от приблизительно рН 7,7 до приблизительно рН 8,3.
17. Способ по п.16, где рН анионообменной смолы составляет приблизительно рН 8,0, и рН первого элюата с инактивированными вирусами доводят так, чтобы он составлял приблизительно рН 8,0.
18. Способ по п.1, где проводимость анионообменной смолы лежит в диапазоне от приблизительно 3,5 мСм/см до приблизительно 5,2 мСм/см, и проводимость первого элюата с инактивированными вирусами доводят так, чтобы она лежала в диапазоне от приблизительно 3,5 мСм/см до приблизительно 5,2 мСм/см.
19. Способ по п.18, где проводимость анионообменной смолы составляет приблизительно 5,0 мСм/см, и проводимость первого элюата с инактивированными вирусами доводят так, чтобы она составляла приблизительно 5,0 мСм/см.
20. Способ по п.1, где анионообменная смола представляет собой смолу Q-сефарозу.
21. Способ по п.1, где анионообменной смолой набивают колонку.
22. Способ по п.1, дополнительно включающий нанесение первого проскока наносят на колонку для гидрофобного взаимодействия, так что получают второй элюат.
23. Способ по п.22, где колонка для гидрофобного взаимодействия представляет собой колонку с фенилсефарозой.
24. Способ по п.22, где первый проскок содержит от приблизительно 20 до приблизительно 40 г антитела на литр материала для колонки для гидрофобного взаимодействия.
25. Способ по п.24, где первый проскок содержит от приблизительно 30 до приблизительно 36 г антитела на литр материала для колонки для гидрофобного взаимодействия.
26. Способ по п.22, где второй элюат не подвергают фракционированию пиков продукта.
27. Способ по п.1, где НСР содержит прокатепсин L, так что получают препарат антител с уменьшенным уровнем прокатепсина L.
28. Способ по п.27, где первый элюат обладает активностью катепсина L в диапазоне от приблизительно 25 до приблизительно 60 RFU/с/мг антитела, как это измеряют посредством анализа кинетики катепсина L.
29. Способ по п.27, где уровень прокатепсина L является воспроизводимо низким.
30. Способ по любому из пп.1-4, 5, 10, 11 и 14, где антитело представляет собой антитело против фактора некроза опухоли-альфа (TNFα) или его антигенсвязывающую часть.
31. Способ по п.30, где антитело против TNFα или его антигенсвязывающая часть представляет собой гуманизированное антитело, химерное антитело или мультивалентное антитело.
32. Способ по п.30, где антитело против TNFα или его антигенсвязывающая часть представляет собой инфликсимаб.
33. Способ по п.30, где антитело против TNFα или его антигенсвязывающая часть представляет собой антитело человека.
34. Способ по п.33, где антитело против TNFα или его антигенсвязывающая часть представляет собой выделенное антитело человека, которое диссоциирует от TNFα человека с КD 1·10-8 М или менее и константой скорости Koff 1·10-3 с-1 или менее, где обе определены посредством поверхностного плазменного резонанса, и нейтрализует цитотоксичность TNFα в общепринятом анализе in vitro L929 с IС50 1·10-7 М или менее.
35. Способ по п.33, где антитело против TNFα или его антигенсвязывающая часть представляет собой выделенное антитело человека со следующими характеристиками:
a) диссоциирует от TNFα человека с константой скорости Koff 1·10-3 с-1 или менее, как определено посредством поверхностного плазменного резонанса;
b) обладает доменом CDR3 легкой цепи, содержащим аминокислотную последовательность SEQ ID NO:3 или модифицированную из SEQ ID NO:3 посредством одиночной замены на аланин в положении 1, 4, 5, 7 или 8, или посредством от одной до пяти консервативных аминокислотных замен в положениях 1, 3, 4, 6, 7, 8 и/или 9;
c) обладает доменом CDR3 тяжелой цепи, содержащим аминокислотную последовательность SEQ ID NO:4 или модифицированную из SEQ ID NO:4 посредством одиночной замены на аланин в положении 2, 3, 4, 5, 6, 8, 9, 10 или 11 или посредством от одной до пяти консервативных аминокислотных замен в положениях 2, 3, 4, 5, 6, 8, 9, 10, 11 и/или 12.
36. Способ по п.33, где антитело против TNFα или его антигенсвязывающая часть представляет собой выделенное антитело человека с вариабельной областью легкой цепи (LCVR), содержащей аминокислотную последовательность SEQ ID NO:1, и вариабельной областью тяжелой цепи (HCVR), содержащей аминокислотную последовательность SEQ ID NO:2.
37. Способ по п.33, где антитело против TNFα или его антигенсвязывающая часть представляет собой адалимумаб.
38. Способ по п.30, где антитело против TNFα или его антигенсвязывающая часть представляет собой голимумаб.
39. Способ получения препарата антител с уменьшенным уровнем белков клетки-хозяина (НСР) из смеси, содержащей антитело и, по меньшей мере, один НСР, причем способ включает:
нанесение смеси на катионообменную смолу, уравновешенную с помощью буфера для уравновешивания, где наносят более чем 30 г антитела на литр смолы;
отмывку НСР с катионообменной смолы с помощью множества стадий промывки, включающую первую промывку и вторую промывку, где от первой промывки ко второй промывке происходит повышение проводимости;
элюцию антитела с катионообменной смолы с помощью буфера для элюции с получением первого элюата;
подвергание первого элюата стадии инактивации вирусов;
нанесение первого элюата на анионообменную смолу с получением первого проскока, где перед нанесением первого элюата на анионообменную смолу рН и проводимость первого элюата делают, по существу, подобными рН и проводимости анионообменной смолы;
нанесение первого проскока на колонку для гидрофобного взаимодействия, так что получают второй элюат;
получение препарата антител с уменьшенным уровнем НСР.
40. Способ по п.39, где катионообменная смола обладает рН 7, и наносят приблизительно 35 г антитела на литр смолы.
41. Способ по п.39, где катионообменная смола обладает рН 5, и наносят приблизительно 70 г антитела на литр смолы.
42. Способ по п.39, где множество стадий промывки включает промывку смолы с помощью первой промывки с использованием буфера для уравновешивания и второй промывки с использованием смеси буфера для элюции и воды.
43. Способ по п.42, где смесь буфера для элюции и воды содержит приблизительно 40-50% буфера для элюции и приблизительно 50-60% воды.
44. Способ по п.39, где первый элюат содержит в диапазоне от приблизительно 90 до приблизительно 100 раз меньше НСР, чем смесь, как определено по ELISA НСР.
45. Способ по п.39, где первый проскок содержит в диапазоне от приблизительно 840 до приблизительно 850 раз меньше НСР, чем первый элюат, как определено по ELISA НСР.
46. Способ по п.39, где второй элюат содержит в диапазоне от приблизительно 3 до приблизительно 5 раз меньше НСР, чем первый проскок, как определено по ELISA НСР.
47. Способ получения препарата антител с уменьшенным уровнем белков клетки-хозяина (НСР) из смеси, содержащей антитело и, по меньшей мере, один НСР, причем способ включает:
нанесение смеси на катионообменную смолу, уравновешенную с помощью буфера для уравновешивания, где катионообменная смола обладает рН 7, и наносят приблизительно 35 г антитела на литр смолы, или катионообменная смола обладает рН в диапазоне от рН 5 до рН 7, и наносят от приблизительно 35 до приблизительно 70 г антитела на литр смолы;
отмывку НСР с катионообменной смолы с помощью стадий промывки, включающих первую промывку с использованием буфера для уравновешивания и вторую промывку с использованием смеси буфера для элюции и воды;
элюцию антитела с катионообменной смолы с помощью буфера для элюции с получением первого элюата;
подвергание первого элюата стадии инактивации вирусов, где инактивации вирусов достигают посредством рН-инактивации вирусов, что приводит к получению первого элюата с инактивированными вирусами;
нанесение первого элюата на анионообменную смолу, где перед нанесением первого элюата на анионообменную смолу рН и проводимость препарата с инактивированными вирусами доводят так, чтобы они являлись, по существу, сходными с рН и проводимостью анионообменной смолы, так что получают первый проскок; и
нанесение первого проскока на колонку для гидрофобного взаимодействия, так что получают второй элюат; и
получение препарата антител с уменьшенным уровнем НСР.
48. Способ по п.47, где смесь с антителом не подвергали связыванию с белком А перед нанесением на катионообменную смолу.
49. Способ по п.40, где смесь буфера для элюции и воды содержит приблизительно 40-50% буфера для элюции и приблизительно 50-60% воды.
50. Способ по п.47, где первый элюат содержит в диапазоне от приблизительно 90 до приблизительно 100 раз меньше НСР, чем смесь, как определено по ELISA НСР.
51. Способ по п.47, где первый проскок содержит в диапазоне от приблизительно 840 до приблизительно 850 раз меньше НСР, чем первый элюат, как определено по ELISA НСР.
52. Способ по п.40, где второй элюат содержит в диапазоне от приблизительно 3 до приблизительно 5 раз меньше НСР, чем первый проскок, как определено по ELISA НСР.
53. Способ по п.47, где первый проскок обладает активностью катепсина L в диапазоне от приблизительно 0,4 до приблизительно 4 RFU/с/мг антитела, как это измеряют посредством анализа кинетики катепсина L.
54. Способ по п.47, где второй элюат обладает активностью катепсина L в диапазоне от приблизительно 0,5 до приблизительно 1,5 RFU/с/мг антитела, как это измеряют посредством анализа кинетики катепсина L.
55. Способ получения препарата антител с уменьшенным уровнем белков клетки-хозяина (НСР) из смеси, содержащей антитело и, по меньшей мере, один НСР, причем способ включает:
нанесение смеси на катионообменную смолу, уравновешенную с помощью буфера для уравновешивания, где наносят более чем 30 г антитела на литр смолы;
отмывку НСР с катионообменной смолы с помощью множества стадий промывки, включающую первую промывку и вторую промывку, где первая промывка осуществляется буфером для уравновешивания, вторая промывка представляет собой смесь буфера для элюции и воды;
элюцию антитела с катионообменной смолы с помощью буфера для элюции с получением первого элюата;
нанесение первого элюата на анионообменную смолу с получением первого проскока, где перед нанесением первого элюата на анионообменную смолу рН и проводимость первого элюата делают, по существу, подобными рН и проводимости анионообменной смолы, получение первого проскока, содержащего антитело; и
получение препарата антител с уменьшенным уровнем НСР.
56. Способ по любому из пп.39, 47 и 55, где антитело представляет собой антитело против фактора некроза опухоли-альфа (TNFα) или его антигенсвязывающую часть.
57. Способ по п.56, где антитело против TNFα или его антигенсвязывающая часть представляет собой гуманизированное антитело, химерное антитело или мультивалентное антитело.
58. Способ по п.56, где антитело против TNFα или его антигенсвязывающая часть представляет собой инфликсимаб.
59. Способ по п.56, где антитело против TNFα или его антигенсвязывающая часть представляет собой антитело человека.
60. Способ по п.56, где антитело против TNFα или его антигенсвязывающая часть представляет собой выделенное антитело человека, которое диссоциирует от TNFα человека с КD 1·10-8 М или менее и константой скорости Koff 1·10-3 с-1 или менее, где обе определены посредством поверхностного плазменного резонанса, и нейтрализует цитотоксичность TNFα в общепринятом анализе in vitro L929 с IС50 1·10-7 М или менее.
61. Способ по п.56, где антитело против TNFα или его антигенсвязывающая часть представляет собой выделенное антитело человека со следующими характеристиками:
a) диссоциирует от TNFα человека с константой скорости Koff 1·10-3 с-1 или менее, как определено посредством поверхностного плазменного резонанса;
b) обладает доменом CDR3 легкой цепи, содержащим аминокислотную последовательность SEQ ID NO:3 или модифицированную из SEQ ID NO:3 посредством одиночной замены на аланин в положении 1, 4, 5, 7 или 8, или посредством от одной до пяти консервативных аминокислотных замен в положениях 1, 3, 4, 6, 7, 8 и/или 9;
c) обладает доменом CDR3 тяжелой цепи, содержащим аминокислотную последовательность SEQ ID NO:4 или модифицированную из SEQ ID NO:4 посредством одиночной замены на аланин в положении 2, 3, 4, 5, 6, 8, 9, 10 или 11 или посредством от одной до пяти консервативных аминокислотных замен в положениях 2, 3, 4, 5, 6, 8, 9, 10, 11 и/или 12.
62. Способ по п.56, где антитело против TNFα или его антигенсвязывающая часть представляет собой выделенное антитело человека с вариабельной областью легкой цепи (LCVR), содержащей аминокислотную последовательность SEQ ID NO:1, и вариабельной областью тяжелой цепи (HCVR), содержащей аминокислотную последовательность SEQ ID NO:2.
63. Способ по п.56, где антитело против TNFα или его антигенсвязывающая часть представляет собой голимумаб.
64. Способ по п.56, где антитело против TNFα или его антигенсвязывающая часть представляет собой адалимумаб.
| US 6870034 В2, 22.03.2005 | |||
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| M | |||
| ISABEL GONZA'LEZ, et al | |||
| Purification of Lactic Acid from Fermentation Broths by Ion-Exchange Resins | |||
| Ind | |||
| Eng | |||
| Chem | |||
| Res | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
Авторы
Даты
2012-11-20—Публикация
2007-04-04—Подача