ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Эта заявка претендует на эффект по предварительной заявке США № 61/196753 от 20 октября 2008г., полное содержание которой включено в настоящий документ путем ссылки.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Способы очистки моноклональных антител фармацевтического качества, получаемых из ферментирующей культуры, обычно включают четыре основных стадии. Эти стадии включают: (1) сбор/осветление-отделение клеток-хозяев от ферментирующей культуры; (2) захват-отделение антитела от большинства компонентов осветленного продукта; (3) доочистку-удаление остаточных примесей и агрегатов из клеток-хозяев; и (4) приготовление состава-введение антитела в соответствующий носитель для максимальной стабильности и времени хранения.
Однако эти стадии часто не приводят к композиции антитела с чистотой, достаточной для использования в фармацевтике. Поэтому в настоящий момент необходимы способы получения и очистки представляющих интерес антител в достаточно чистой форме, подходящих для использования в фармацевтике. Настоящее изобретение направлено на эту цель.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение направлено на способы выделения и очистки антител из образца культурального материала. В некоторых аспектах изобретение направлено на способы очистки антител, в которых используется аффинная хроматография, предпочтительно хроматография на основе белка А. В определенных аспектах в способах по настоящему изобретению используют стадию инактивации кислотой, стадию аффинной хроматографии и одну или более дополнительных стадий хроматографии и/или фильтрации. Хроматографические стадии могут включать одну или более стадий ионообменной хроматографии и/или хроматографии гидрофобных взаимодействий. Кроме того, настоящее изобретение направлено на фармацевтические композиции, содержащие одно или более антител, очищенных описанным в настоящем документе способом.
Один из вариантов осуществления настоящего изобретения направлен на способ очистки антитела или его антигенсвязывающего участка из образца культурального материала, в котором полученная композиция антитела по существу свободна от белков клетки-хозяина («БКХ»). В одном аспекте культуральный материал включает продукт клеточной линии, причем клеточную линию используют для продукции специфических антител по настоящему изобретению. В конкретном аспекте образец культурального материала (или просто образец) получают из клеточной линии, используемой для продукции антител к IL-12; в другом аспекте образец культурального материала получают из клеточной линии, используемой для продукции антител к TNFα; и в еще одном аспекте образец культурального материала получают из клеточной линии, используемой для продукции антител к IL-18.
Один способ по настоящему изобретению включает подведение рН в образце культурального материала, содержащем потенциально представляющее интерес антитело или его антигенсвязывающий участок. В одном аспекте рН подводят до кислых значений рН. Примером подходящего рН является показатель рН между примерно 3 и 5, предпочтительно рН примерно 3,5. Это первичное выделение проводят отчасти для уменьшения количества или инактивации рН-чувствительных вирусов. Кроме снижения количества и/или инактивации вирусов, кислые условия облегчают удаление клеток и клеточного дебриса, в результате чего образуется первичный выделенный образец. После соответствующего отрезка времени рН можно подвести до более нейтрального или основного значения и провести аффинную хроматографию, предпочтительно хроматографию на основе белка А, первичного выделенного образца. В одном аспекте образец после аффинной хроматографии собирают и дополнительно проводят последовательные стадии хроматографической очистки, такой как ионообменная хроматография или хроматография гидрофобных взаимодействий.
В одном варианте осуществления изобретения стадия аффинной хроматографии включает нанесение первичного выделенного образца на колонку, содержащую подходящий носитель для аффинной хроматографии. Неограничивающие примеры таких хроматографических носителей включают, но не ограничены ими, смолу на основе белка А, смолу на основе белка G, аффинные носители, содержащие антиген, к которому получали представляющее интерес антитело, и аффинные носители, содержащие Fc-связывающий белок. Для аффинной очистки и выделения антител (IgG) пригодна смола на основе белка А. В одном аспекте колонку на основе белка А уравновешивают соответствующим буфером до нанесения образца. Примером соответствующего буфера является Tris/NaCl-буфер с pH примерно 7,2. После уравновешивания образец можно нанести на колонку. После нанесения на колонку ее можно промыть один или несколько раз, используя, например, буфер для уравновешивания. Перед элюцией с колонки можно использовать другие промывки, включая промывки другими буферами. Затем образец можно элюировать с колонки на основе белка А, используя соответствующий элюирующий буфер. Примером подходящего элюирующего буфера является буфер, содержащий уксусную кислоту и NaCl, с рН примерно 3,5. Элюцию можно контролировать с помощью методик, хорошо известных специалистам в данной области. Например, можно наблюдать за поглощением при 280 нм (OD280). Представляющие интерес элюированные фракции(ию) затем можно подготовить для дополнительной очистки.
В одном варианте осуществления изобретения за аффинной хроматографией на основе белка А следует ионообменная стадия. Эта ионообменная стадия представляет собой катионный или анионный обмен или их комбинацию. Эта стадия может представлять собой одну процедуру ионообмена или может включать несколько ионообменных стадий, таких как катионообменная стадия, за которой следует анионообменная стадия, или наоборот. В одном аспекте ионообменная стадия представляет собой одностадийную процедуру. В другом аспекте ионообменная стадия представляет собой двухстадийный ионообменный процесс. Подходящей катионообменной колонкой является колонка, неподвижная фаза которой включает анионные группы. Примером такой колонки является Fractogel™ SO3 -. Эта стадия ионообменной захватывающей хроматографии облегчает выделение антител из образца. Подходящей анионообменной колонкой является колонка, неподвижная фаза которой включает катионные группы. Примером такой колонки является колонка Q Sepharose™. Одна или более ионообменных стадий дополнительно очищают антитела, снижая содержание примесей, таких как белки и ДНК клеток-хозяев, и при необходимости содержание белка из аффинного носителя. Эту процедуру анионного обмена проводят хроматографией в режиме проскока, при котором целевые антитела не взаимодействуют с анионообменной смолой (или твердой фазой) или не связывают ее. Однако многие примеси взаимодействуют с анионообменной смолой или связываются с ней. В конкретном аспекте ионообменная стадия представляет собой анионообменную хроматографию.
Элюат после аффинной хроматографии подготавливают для ионообмена, подводя рН и ионную силу в буфере для нанесения образца. Например, рН элюата после аффинной хроматографии можно подвести до показателя от примерно 6,0 до примерно 8,5 1М Tris-буфером. Перед нанесением образца (элюата после аффинной хроматографии) на ионообменную колонку ее можно уравновесить, используя подходящий буфер. Примером подходящего буфера является Tris/NaCl-буфер с рН от примерно 6,0 до примерно 8. После уравновешивания на колонку можно нанесли элюат после аффинной хроматографии. После нанесения колонку можно промыть один или несколько раз подходящим буфером. Примером подходящего буфера является сам буфер для уравновешивания. К сбору проскока можно приступать, например, когда поглощение (OD280) поднимется выше примерно 0,2 AU.
В некоторых вариантах осуществления изобретения в настоящий способ включена дополнительная стадия. Эта стадия включает использование хроматографии гидрофобных взаимодействий («ХГВ»). Подходящей колонкой является колонка, у которой неподвижная фаза содержит гидрофобные группы. Примером такой колонки является колонка со смолой Phenyl-Sepharose™ (фенил-сефарозой). В ходе процесса выделения/очистки возможно образование агрегатов целевых антител. Эта стадия гидрофобной хроматографии облегчает удаление этих агрегатов. Она также способствует удалению примесей. В процедуре используется высокосолевой буфер, который усиливает взаимодействие антител (или их агрегатов) с гидрофобной колонкой. Элюцию с колонки осуществляют более низкими концентрациями соли.
В еще одном варианте осуществления изобретения элюат после ХГВ фильтруют через фильтр для удаления вирусов, такой как фильтр Ultipor DV20™. Эта процедура отделяет вирусные частицы из элюата после колонки с фенил-сефарозой для снижения количества вирусов (если таковые присутствуют) до безопасного уровня. В этом варианте осуществления изобретения можно использовать фильтры, хорошо известные специалистам в данной области.
Чистоту интересующих антител в полученном образце продукта можно проанализировать, используя способы, хорошо известные специалистам в данной области, например, гель-фильтрацию, ВЭЖХ-анализ на колонке Poros™ A, БКХ-ELISA (твердофазный ИФА на белки клеток-хозяев), белок A-ELISA (твердофазный ИФА на белок А) и Вестерн-блот анализ.
В еще одном варианте осуществления изобретение направлено на одну или более фармацевтических композиций, содержащих выделенное антитело или его антигенсвязывающий участок и приемлемый носитель. В другом аспекте композиции дополнительно содержат один или более фармацевтических агентов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 приведены последовательности вариабельных областей тяжелой и легкой цепей из неограничивающего примера антитела к IL-12 (ABT-847).
На фиг. 2 приведены последовательности тяжелой и легкой цепей из неограничивающего примера антитела к IL-18 (ABT-325).
На фиг. 3 приведены последовательности вариабельных областей тяжелой и легкой цепей из неограничивающего примера антитела к TNFα (Адалимумаба).
На фиг. 4 изображена типичная хроматограмма, показывающая чистоту продукта из биореактора объемом 300 л после использования хроматографии на основе белка А (на смоле MabSelect™) для захвата антител к IL-12 и снижения примесей в продукте и примесей, связанных с процессом, таких как одиночные и двойные фрагменты легкой цепи, белки и ДНК клеток-хозяев СНО и т.д.
На фиг. 5 приведена оценка условий промывки MabSelect™.
Фиг. 6 представляет собой фотографию разделения в полиакриламидном геле осадков, полученных после подведения рН элюата с MabSelect™ до 8 и проводимости до 7 мСм/см.
На фиг. 7 представлен типичный хроматографический профиль проскока с хроматографической колонки Q Sepharose™ FF в масштабе биореактора 300 л.
На фиг. 8 представлен типичный хроматографический профиль элюции с хроматографической колонки Phenyl Sepharose™ НР в масштабе биореактора 300 л.
На фиг. 9 показаны результаты анализа динамической обменной емкости, в результате которого было установлено, что 10%-ная точка проскока для смолы MabSelect™ составляет 37,4 г антитела на л смолы.
Фиг. 10 представляет собой фотографию разделения в полиакриламидном геле, приведенную для сравнения отличий между промежуточными продуктами выделения способа, в котором используется белок А, и способа AY-04. Наносили по 2 мкг антител для каждого образца.
На фиг. 11 представлен выход Адалимумаба после очистки на MabSelect™ относительно рН элюции. На фигуре продемонстрировано, что выход, по меньшей мере, 90% получали в диапазоне рН элюции, составляющем 2,5-3,8, а при рН 4 выход значительно снижался.
На фиг. 12 показаны результаты анализа сравнения выхода мономера Адалимумаба относительно рН элюции и времени инкубации.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение направлено на способы выделения и очистки антител из образца культурального продукта. Один аспект изобретения направлен на снижение количества вирусов/их инактивацию в образцах, получаемых на различных стадиях очистки антител. В конкретном аспекте в способах по настоящему изобретению используется стадия кислотного снижения количества/инактивации вирусов, за которой следуют одна или более хроматографических стадий. Хроматографические стадии могут включать одну или более из следующих хроматографических процедур: ионообменную хроматографию, аффинную хроматографию и хроматографию гидрофобных взаимодействий. Кроме того, настоящее изобретение направлено на фармацевтические композиции, содержащие одно или более антител, очищенных описанным в настоящем документе способом.
Для ясности, а не для ограничения, это подробное описание было разбито на следующие разделы:
1. Определения.
2. Получение антител.
3. Продукция антител.
4. Очистка антител.
5. Способы оценки чистоты продукта.
6. Дополнительные модификации.
7. Фармацевтические композиции.
8. Применение антител.
1. Определения
Для более легкого понимания настоящего изобретения далее прежде всего приведены определения некоторых терминов.
Термин «антитело» включает молекулу иммуноглобулина, состоящую из четырех полипептидных цепей: двух тяжелых (Н) цепей и двух легких (L) цепей, соединенных друг с другом дисульфидными связями. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно называемой в настоящем описании HCVR или VH) и константной области тяжелой цепи (СН). Константная область тяжелой цепи состоит из трех доменов, CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно называемой в настоящем описании LCVR или VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, CL. VH- и VL-области можно дополнительно разделить на гипервариабельные области, называемые определяющими комплементарность областями (CDR), перемежаемыми более консервативными областями, называемыми каркасными областями (FR). Каждая VH- и VL-область состоит из трех CDR и четырех FR, расположенных, начиная с амино-конца до карбокси-конца в следующем порядке: FR1, CDRl, FR2, CDR2, FR3, CDR3, FR4.
Термин «антигенсвязывающий участок» антитела (или «участок антитела») включает фрагменты антитела, которые сохраняют способность специфически связывать антиген (например, hIL-12, hTNFα или hIL-18). Было показано, что антигенсвязывающую функцию антитела могут выполнять фрагменты полноразмерного антитела. Примеры связывающих фрагментов, охваченных термином «антигенсвязывающий участок», антитела включают (i) Fab-фрагмент, моновалентный фрагмент, содержащий VL-, VH-, CL- и CH1-домены; (ii) F(ab')2-фрагмент, бивалентный фрагмент, содержащий два Fab-фрагмента, соединенных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, содержащий VH- и CH1-домены; (iv) Fv-фрагмент, содержащий VL- и VH-домены одного плеча антитела; (v) dAb-фрагмент (Ward et al., (1989) Nature 341:544-546, полное содержание которой включено в настоящее описание путем ссылки), который содержит VH-домен; и (vi) изолированную определяющую комплементарность область (CDR). Кроме того, хотя два домена Fv-фрагмента, VL и VH, кодируются разными генами, их можно соединить рекомбинантными способами через синтетический линкер, что позволяет изготавливать их в виде одной белковой цепи, в которой VL- и VH-области образуют пару, давая моновалентную молекулу (известную как одноцепочечный Fv-фрагмент (scFv); смотри, например, Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883, полное содержание которых включено в настоящее описание путем ссылки). Также подразумевается, что такие одноцепочечные антитела охвачены термином «антигенсвязывающий участок» антитела. Также охвачены другие формы одноцепочечных антител, такие как диантитела. Диантитела являются бивалентными биспецифичными антителами, в которых VH- и VL-домены экспрессируются в одной полипептидной цепи, но с использованием линкера, который является слишком коротким для образования пар между двумя доменами в одной цепи, таким образом, обуславливая образование пар между комплементарными доменами разных цепей и создавая два антигенсвязывающих участка (см., например, Holliger, P., et al. (1993) Proc. Natl. Acad. Sci. USA 90:6444-6448; Poljak, R. J., et al. (1994) Structure 2:1121-1123, полное содержание которых включено в настоящее описание путем ссылки). Кроме того, антитело или его антигенсвязывающий участок могут представлять собой часть более крупной иммуноадгезионной молекулы, образуемой ковалентными или нековалентными связями антитела или участка антитела с одним или несколькими другими белками или пептидами. Примеры таких иммуноадгезионных молекул включают использование «коровой» (связывающей биотин) области стрептавидина для создания тетрамерной scFv-молекулы (Kipriyanov, S. M., et al. (1995) Human Antibodies and Hybridomas 6:93-101, полное содержание которой включено в настоящее описание путем ссылки) и использование остатка цистеина, маркерного пептида и С-концевой полигистидиновой метки для создания бивалентных и биотинилированных scFv-молекул (Kipriyanov, S. M., et al. (1994) Mol. Immunol. 31:1047-1058, полное содержание которой включено в настоящее описание путем ссылки). Участки антител, такие как Fab- и F(ab')2-фрагменты, можно получить из полноразмерных антител, используя общепринятые методики, такие как расщепление папаином или пепсином соответственно полноразмерных антител. Более того, антитела, участки антител и иммуноадгезионные молекулы можно получить, используя стандартные методики рекомбинантных ДНК, описанные в настоящем документе. В одном аспекте антигенсвязывающие участки представляют собой полноразмерные домены или пары полноразмерных доменов.
Используемая в настоящем описании фраза «интерлейкин-12 человека» (сокращенно называемый в настоящем описании hIL-12 или IL-12) включает цитокин человека, секретируемый в основном макрофагами и дендритными клетками. Термин включает гетеродимерный белок, содержащий субъединицу 35 кДа (р35) и субъединицу 40 кДа (р40), которые соединены друг с другом дисульфидным мостиком. Гетеродимерный белок называется «субъединицей р70». Структура IL-12 человека более подробно описана, например, в Kobayashi, et al. (1989) J. Exp Med. 170:827-845; Seder, et al. (1993) Proc. Natl. Acad. Sci. 90:10188-10192; Ling, et al. (1995) J. Exp Med. 154:116-127; Podlaski, et al. (1992) Arch. Biochem. Biophys. 294:230-237, полное содержание которых включено в настоящее описание путем ссылки. Кодирующая IL-12 нуклеиновая кислота имеет номер доступа NM_000882 в базе данных GenBank, а полипептидная последовательность имеет номер доступа NP_000873.2 в базе данных GenBank. Подразумевается, что термин IL-12 человека включает рекомбинантный IL-12 человека (rhIL-12), который можно получить стандартными способами рекомбинантной экспрессии.
Используемая в настоящем описании фраза «интерлейкин-18 человека» (сокращенно называемый в настоящем описании hIL-18 или IL-18) включает цитокин человека, который исходно синтезируется в виде биологически неактивного 193-аминокислотного белка-предшественника, а также 156-аминокислотный зрелый белок, получаемый (например, а не в качестве ограничения) расщеплением белка-предшественника, например, каспазой-1 или каспазой-4, который проявляет биологическую активность, включающую костимуляцию пролиферации Т-клеток, усиление цитотоксичности NK-клеток и индукцию продукции IFN-γ Т-клетками и NK-клетками и усиление дифференцировки Т-хелперов 1-го типа (Th1). Кодирующая IL-18 нуклеиновая кислота имеет номер доступа NM_001562 в базе данных GenBank, а полипептидная последовательность имеет номер доступа NP_001553 в базе данных GenBank. Подразумевается, что термин IL-18 человека включает рекомбинантный IL-18 человека (rhIL-18), который можно получить стандартными способами рекомбинантной экспрессии.
Фраза «фактор некроза опухолей α» (сокращенно называемый в настоящем описании hTNFα или TNFα) относится к многофункциональному провоспалительному цитокину, секретируемому преимущественно моноцитами/макрофагами, который действует на метаболизм липидов, коагуляцию, инсулинорезистентность и функцию эндотелия. TNFα представляет собой растворимый гомотример белковых субъединиц с молекулярным весом 17 кДа. Также существует мембраносвязанная форма белка-предшественника с молекулярным весом 26 кД. Он был обнаружен в синовиальных клетках и макрофагах в тканях. Другие клетки (помимо моноцитов и макрофагов) также продуцируют TNFα. Например, немоноцитарные опухолевые клеточные линии человека продуцируют TNFα, а также его продуцируют CD4+ и CD8+ Т-лимфоциты периферической крови и некоторые культивируемые Т- и В-клеточные линии. Кодирующая TNFα нуклеиновая кислота имеет номер доступа X02910 в базе данных GenBank, а полипептидная последовательность имеет номер доступа CAA26669 в базе данных GenBank. Подразумевается, что термин TNFα человека включает рекомбинантный TNFα человека (rhTNFα), который можно получить стандартными способами рекомбинантной экспрессии.
Термины «нумерация по Кабат», «определения по Кабат» и «разметка по Кабат» используются в настоящем описании взаимозаменяемо. Эти известные в данной области термины относятся к системе нумерации аминокислотных остатков, которые являются более вариабельными (т.е. гипервариабельными) по сравнению с другими аминокислотными остатками в вариабельных областях тяжелой и легкой цепей антитела или его антигенсвязывающего участка (Kabat et al. (1971) Ann. NY Acad, Sci. 190:382-391; и Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242, полное содержание которых включено в настоящее описание путем ссылки). Для вариабельной области тяжелой цепи гипервариабельная область соответствует аминокислотам с 31-ной по 35-ную для CDR1, аминокислотам с 50-ной по 65-ную для CDR2 и аминокислотам с 95-ной по 102-ную для CDR3. Для легкой цепи гипервариабельная область соответствует аминокислотам с 24-ной по 34-ную для CDR1, аминокислотам с 50-ной по 56-ную для CDR2 и аминокислотам с 89-ной по 97-ную для CDR3.
Термин «антитело человека» включает антитела, имеющие вариабельные и константные области, соответствующие последовательностям иммуноглобулинов зародышевой линии человека, описанным Kabat et al. (см. Kabat, et al. (1991) Sequences of proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Антитела человека по изобретению могут включать аминокислотные остатки, не кодируемые последовательностями иммуноглобулинов зародышевой линии человека (например, мутации, введенные в результате случайного или сайт-специфического мутагенеза in vitro или в результате соматических мутаций in vivo), например, в CDR-областях и, в частности, CDR3. Мутации можно ввести с использованием «подхода селективного мутагенеза». Антитело человека может иметь, по меньшей мере, одну замененную аминокислотную позицию, например, усиливающим активность аминокислотным остатком, который не кодируется последовательностью иммуноглобулина зародышевой линии. Антитело человека может иметь до двадцати позиций, замененных аминокислотными остатками, которые не являются частью последовательности иммуноглобулина зародышевой линии человека. В других вариантах осуществления изобретения заменены до десяти, до пяти, до трех или до двух позиций. В одном варианте осуществления изобретения эти замены расположены в CDR-областях. Однако используемый в настоящем описании термин «антитело человека» не предполагает включение антител, в которых последовательности CDR, полученные из зародышевой линии других видов млекопитающих, таких как мышь, перенесены в каркасные последовательности иммуноглобулина человека.
Фраза «подход селективного мутагенеза» включает способ усиления активности антитела путем отбора и индивидуального мутагенеза аминокислот из CDR, по меньшей мере, по одной из подходящей для селективного мутагенеза позиции, позиции, по которой проходит гипермутация, и/или контактной позиции. «Селективно мутированное» антитело человека представляет собой антитело, которое содержит мутацию в позиции, выбранной с использованием подхода селективного мутагенеза. В другом аспекте предполагается, что подход селективного мутагенеза обеспечивает способ предпочтительного мутагенеза выбранных индивидуальных аминокислотных остатков в CDR1, CDR2 или CDR3 вариабельной области тяжелой цепи (в дальнейшем H1, H2 и H3 соответственно), или CDR1, CDR2 или CDR3 вариабельной области легкой цепи (в дальнейшем L1, L2 и L3 соответственно) антитела. Аминокислотные остатки могут быть выбраны из позиций для селективного мутагенеза, контактных позиций или гипермутирующих позиций. Индивидуальные аминокислоты выбирают, исходя из их позиции в вариабельной области легкой или тяжелой цепи. Следует понимать, что гипермутирующая позиция также может быть контактной позицией. В одном аспекте подход селективного мутагенеза представляет собой «направленный подход». Предполагается, что выражение «направленный подход» включает способ мутагенеза выбранных индивидуальных аминокислотных остатков в CDR1, CDR2 или CDR3 вариабельной области тяжелой цепи, или CDR1, CDR2 или CDR3 вариабельной области легкой цепи антитела направленным образом, например, в виде «группового направленного подхода» или «CDR-направленного подхода». В «групповом направленном подходе» индивидуальные аминокислотные остатки в конкретных группах являются мишенями селективного мутагенеза, включая группы I (включающие L3 и H3), II (включающие H2 и L1) и III (включающие L2 и H1), группы перечислены в порядке предпочтения для мутагенеза. В «CDR-направленном подходе» индивидуальные аминокислотные остатки в конкретных CDR являются мишенями для селективного мутагенеза в следующем порядке предпочтения для мутагенеза: H3, L3, H2, L1, H1 и L2. Выбранный аминокислотный остаток заменяют, например, по меньшей мере, на два других аминокислотных остатка и определяют эффект мутации на активность антитела. Активность измеряют как изменение специфичности связывания/аффинности антитела и/или нейтрализующей способности антитела. Следует понимать, что подход селективного мутагенеза можно использовать для оптимизации любого антитела, полученного из любого источника, включая фаговый дисплей, трансгенных животных с зародышевыми линиями IgG человека и антитела человека, выделенные из В-клеток человека. Подход селективного мутагенеза можно использовать для антител, которые нельзя дополнительно оптимизировать с помощью методики фагового дисплея. Следует понимать, что антитела из любого источника, включая фаговый дисплей, трансгенные животные с зародышевыми линиями IgG человека и антитела человека, выделенные из В-клеток человека, могут быть предметом обратного мутагенеза до или после подхода селективного мутагенеза.
Фраза «рекомбинантное антитело человека» включает антитела человека, которые получают, экспрессируют, создают или выделяют рекомбинантными средствами, такие как антитела, экспрессированные с использованием рекомбинантного экспрессионного вектора, трансфицированного в клетку-хозяина, антитела, выделенные из рекомбинантной комбинаторной библиотеки антител человека, антитела, выделенные из животного (например, мыши), которые являются трансгенными по генам иммуноглобулинов человека (см., например, Taylor, L. D., et al. (1992) Nucl. Acids Res. 20:6287-6295, полное содержание которой включено в настоящее описание путем ссылки), или антитела, полученные, экспрессированные, созданные или выделенные любыми другими средствами, которые включают соединение последовательностей генов иммуноглобулинов человека с другими последовательностями ДНК. Такие рекомбинантные антитела человека имеют вариабельные и константные области, полученные из последовательностей иммуноглобулинов зародышевой линии человека (см., Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NEH Publication No. 91-3242). Однако в некоторых вариантах осуществления изобретения такие рекомбинантные антитела человека подвергаются мутагенезу in vitro (либо в случае использования трансгенных животных для последовательностей Ig человека - соматическому мутагенезу in vivo), и поэтому аминокислотные последовательности VH- и VL-областей рекомбинантных антител представляют собой последовательности, которые, будучи полученными из VH- и VL-последовательностей зародышевой линии человека или связанными с ними, могут не существовать в природном репертуаре антител человека зародышевой линии in vivo. Однако в некоторых вариантах осуществления изобретения такие рекомбинантные антитела являются результатом селективного мутагенеза или обратного мутагенеза, либо двух этих подходов.
«Выделенное антитело» включает антитело, которое по существу свободно от других антител, имеющих другую антигенную специфичность (например, выделенное антитело, которое специфично связывает hIL-12, по существу свободно от антител, которые специфично связывают другие антигены, кроме hIL-12). Выделенное антитело, которое специфично связывает hIL-12, может связывать молекулы IL-12 других биологических видов. Более того, выделенное антитело может быть по существу свободным от другого клеточного материала и/или химических соединений. Подходящие антитела к IL-12, которые можно очистить в контексте настоящего изобретения, раскрыты в патенте США № 6914128 (полное содержание которого, таким образом, включено путем ссылки), в том числе, но не ограниченные этим, антитело к IL-12, обозначенное в данном патенте как J695, и которое впоследствии обозначается ABT-874. Подходящие антитела к IL-18, которые можно очистить и выделить в контексте настоящего изобретения, раскрыты в USSN 09/780035 и 10/988360, включая антитело, которое впоследствии обозначается ABT-325. Подходящим антителом к TNFα является Адалимумаб (Abbott Laboratories).
«Нейтрализующее антитело» (или «антитело, которое нейтрализует активность hIL-12») включает антитело, чье связывание с hIL-12 приводит к ингибированию биологической активности hIL-12. Это ингибирование биологической активности hIL-12 можно оценить, измеряя один или более индикаторов биологической активности hIL-12, например, ингибирование индуцируемой фитогемагглютинином (ФГА) пролиферации бластных клеток человека в анализе пролиферации бластных клеток, индуцируемой ФГА, или ингибирование связывания рецептора в анализе связывания рецептора IL-12 человека. Эти индикаторы биологической активности hIL-12 можно оценить с помощью одного или нескольких стандартных in vitro или in vivo методов анализа, известных в данной области.
«Нейтрализующее антитело» (или «антитело, которое нейтрализует активность hIL-18») включает антитело, чье связывание с hIL-18 приводит к ингибированию биологической активности hIL-18. Это ингибирование биологической активности hIL-18 можно оценить, измеряя один или более индикаторов биологической активности hIL-18, например, индукцию синтеза IFNγ T-клетками или NK-клетками, или ингибирование связывания рецептора IL-18 в анализе связывания рецептора IL-18 человека. Эти индикаторы биологической активности hIL-18 можно оценить с помощью одного или нескольких стандартных in vitro или in vivo методов анализа, известных в данной области.
Термин «активность» включает активность, такую как специфичность связывания/аффинность антитела к антигену, например, антитела к hIL-12, связывающего антиген IL-12, и/или нейтрализующую способность антитела, например, антитела к hIL-12, чье связывание с hIL-12 ингибирует биологическую активность hIL-12, например, ингибирование индуцируемой ФГА пролиферации бластных клеток или ингибирование связывание рецептора в анализе связывания рецептора IL-12 человека. Термин «активность» включает активность, такую как специфичность связывания/аффинность антитела к IL-18 к своему антигену, например, антитела к hIL-18, связывающего антиген IL-18, и/или нейтрализующую способность антитела, например, антитела к hIL-18, чье связывание с hIL-18 ингибирует биологическую активность hIL-18. Термин «активность» также включает активность, такую как специфичность связывания/аффинность антитела к TNFα антитела к своему антигену, например, антитела к TNFα, связывающего антиген TNFα, и/или нейтрализующую способность антитела, например, антитела к TNFα, чье связывание с hTNFα ингибирует биологическую активность hTNFα.
Фраза «поверхностный плазмонный резонанс» включает оптическое явление, которое позволяет анализировать биоспецифические взаимодействия в режиме реального времени путем детекции изменения концентраций белков в биосенсорном носителе, например, с помощью системы BIAcore (Pharmacia Biosensor AB, Uppsala, Sweden and Piscataway, NJ.). Дополнительное описание см. в Jonsson, U., et al. (1993) Ann. Biol. Clin. 51:19-26; Jonsson, U., et al. (1991) Biotechniques 11:620-627; Johnsson, B., el al. (1995) J. Mol. Recognit. 8:125-131; и Johnnson, B., et al. (1991) Anal. Biochem. 198:268-277, полное содержание которых включено в настоящий документ.
Предполагается, что используемый в настоящем описании термин «Koff» относится к константе скорости диссоциации для диссоциации антитела из комплекса антиген/антитело.
Предполагается, что используемый в настоящем описании термин «Kd» относится к константе диссоциации конкретного взаимодействия антиген/антитело.
Фраза «молекула нуклеиновой кислоты» включает молекулы ДНК и РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но в одном аспекте представляет собой двухцепочечную ДНК.
Фраза «выделенная молекула нуклеиновой кислоты», используемая в настоящем описании в отношении нуклеиновых кислот, кодирующих антитела или участки антител (например, VH, VL, CDR3), например, антитела, которые связывают hIL-12, hTNFα или hIL-18, включает молекулу нуклеиновой кислоты, в которой нуклеотидные последовательности, кодирующие антитело или участок антитела, свободны от других нуклеотидных последовательностей, кодирующих антитела или участки антител, связывающих другие антигены помимо hIL-12, hTNFα или hIL-18, которые могут в природе окружать нуклеиновую кислоту в геномной ДНК человека. Таким образом, например, выделенная нуклеиновая кислота по изобретению, кодирующая VH-область антитела к IL-12h, антитела к TNFα или антитела к hIL-18, не содержит других последовательностей, кодирующих другие VH-области, которые связывают другие антигены, помимо, например, IL-12, hTNFα или hIL-18. Также предполагается, что фраза «выделенная молекула нуклеиновой кислоты» включает последовательности, кодирующие бивалентные, биспецифичные антитела, такие как диантитела, в которых VH- и VL-области не содержат других последовательностей, кроме последовательностей диантитела.
Фраза «рекомбинантная клетка-хозяин» (или просто «клетка-хозяин») включает клетку, в которую введен рекомбинантный экспрессионный вектор. Следует понимать, что такие термины относятся не только к конкретной клетке, но и к потомству такой клетки. Поскольку в последующих поколениях могут возникнуть некоторые модификации вследствие либо мутаций, либо воздействия окружающей среды, такое потомство может в действительности быть не идентичным родительской клетке, но оно все еще включено в объем термина «клетка-хозяин», используемый в настоящем документе.
Предполагается, что используемый в настоящем документе термин «модификация» относится к изменению одной или более аминокислот в антителах или их антигенсвязывающих участках. Изменения можно вносить добавлением, заменой или удалением аминокислот по одной или нескольким позициям. Изменения можно вносить, используя известные методики, такие как ПЦР-мутагенез.
Предполагается, что используемый в настоящем документе термин «примерно» относится к диапазону приблизительно в 10-20% выше или ниже указываемого значения. Для специалиста в данной области будет ясно, что в некоторых обстоятельствах вследствие природы указываемого значения термин «примерно» может относиться к диапазону меньше или больше 10-20%-ного отклонения от этого значения.
Предполагается, что используемая в настоящем документе фраза «снижение количества/инактивация вирусов» относится к снижению числа вирусных частиц в конкретном образце («снижение количества»), а также к снижению активности, например, но не ограниченной этим, инфицирующей способности или способности к репликации вирусных частиц в конкретном образце («инактивация»). Такое снижение количества и/или активности вирусных частиц может быть порядка от примерно 1% до примерно 99%, предпочтительно от примерно 20% до примерно 99%, более предпочтительно от примерно 30% до примерно 99%, более предпочтительно от примерно 40% до примерно 99%, еще более предпочтительно от примерно 50% до примерно 99%, еще более предпочтительно от примерно 60% до примерно 99%, еще более предпочтительно от примерно 70% до примерно 99%, еще более предпочтительно от примерно 80% до примерно 99%, и еще более предпочтительно от примерно 90% до примерно 99%. В некоторых неограничивающих вариантах осуществления изобретения количество вируса (если он присутствует) в очищенном продукте антитела составляет меньше ID50 (количества вируса, которое инфицирует 50 процентов популяции-мишени) для этого вируса, предпочтительно, по меньшей мере, в 10 раз меньше ID50 для этого вируса, более предпочтительно, по меньшей мере, в 100 раз меньше ID50 для этого вируса и еще более предпочтительно, по меньшей мере, в 1000 раз меньше ID50 для этого вируса.
Фраза «контактная позиция» включает аминокислотную позицию в CDR1, CDR2 или CDR3 вариабельной области тяжелой цепи или вариабельной области легкой цепи антитела, которая занята аминокислотой, контактирующей с антигеном в одной из двадцати шести известных структур антиген-антитело. Если аминокислота из CDR в любой из двадцати шести известных установленных структур комплексов антиген-антитело контактирует с антигеном, то можно считать, что эта аминокислота занимает контактную позицию. Контактные позиции имеют большую вероятность быть занятыми аминокислотой, которая контактирует с антигенами, чем неконтактные позиции. В одном аспекте контактная позиция представляет собой позицию из CDR, которая содержит аминокислоту, которая контактирует с антигеном в более 3 из 26 структур (>1,5%). В другом аспекте контактная позиция представляет собой позицию из CDR, которая содержит аминокислоту, которая контактирует с антигеном в более 8 из 25 структур (>32%).
2. Получение антител
Используемый в этом разделе термин «антитело» относится к интактному антителу или его антигенсвязывающему фрагменту.
Антитела по настоящему изобретению можно получить с помощью различных методик, включая иммунизацию животного представляющим интерес антигеном, за которой следует стандартная методика получения моноклональных антител, например, стандартная методика гибридизации соматических клеток по Kohler and Milstein (1975) Nature 256:495. Хотя предпочтительными являются методики гибридизации соматических клеток, в принципе можно использовать другие методики получения моноклональных антител, например, вирусную или онкогенную трансформацию лимфоцитов.
Одной предпочтительной животной системой для получения гибридом является мышиная система. Получение гибридом представляет собой хорошо отработанную процедуру. Иммунизационные протоколы и методики выделения иммунизированных спленоцитов для слияния известны в данной области. Партнеры для слияния (например, клетки миеломы мышей) и процедуры слияния также известны.
Предпочтительное антитело может представлять собой антитело человека, химерное или гуманизированное антитело. Химерные или гуманизированные антитела по настоящему изобретению можно получить на основе последовательности моноклонального антитела другого биологического вида, кроме человека, полученного, как описано выше. Из представляющей интерес гибридомы, полученной из клеток другого биологического вида, кроме человека, можно получить ДНК, кодирующую тяжелую и легкую цепи иммуноглобулинов, и с помощью стандартных методик молекулярной биологии ввести в нее последовательности иммуноглобулинов другого биологического вида кроме мыши (например, человека). Например, для создания химерного антитела вариабельные области иммуноглобулина мыши можно соединить с константными областями иммуноглобулина человека, используя способы, известные в данной области (см., например, патент США № 4816567 авторов Cabilly et al.). Для создания «гуманизированного» антитела CDR-области иммуноглобулина мыши можно встроить в каркасную область иммуноглобулина человека, используя способы, известные в данной области (см., например, патент США № 5225539 автора Winter и патенты США № 5530101, 5585089, 5693762 и 6180370 авторов Queen et al.).
В одном неограничивающем варианте осуществления изобретения антителами являются моноклональные антитела человека. Такие моноклональные антитела человека, направленные против IL-12, TNFα или IL-18, можно получить, используя трансгенных или трансхромосомных мышей, несущих части иммунной системы человека вместо иммунной системы мыши. Эти трансгенные и трансхромосомные мыши включают мышей, упоминаемых в настоящем документе как HuMAb Mouse® (Medarex, Inc.), KM Mouse® (Medarex, Inc.) и XenoMouse® (Amgen).
Более того, в данной области существуют альтернативные системы трансхромосомных животных, экспрессирующих гены иммуноглобулинов человека, и их можно использовать для получения антител по изобретению, таких как антитела к IL-12, TNFα или IL-18. Например, можно использовать мышей, несущих как трансхромосому тяжелой цепи человека, так и трансхромосому легкой цепи человека, именуемых «ТХ-мыши»; такие мыши описаны в статье Tomizuka et al. (2000) Proc. Natl. Acad. Sci. USA 97:722-727. Кроме того, в данной области были описаны коровы, несущие трансхромосомы тяжелых и легких цепей человека (например, в статье Kuroiwa et al. (2002) Nature Biotechnology 20:889-894 и РСТ-заявке № WO 2002/092812), и их можно использовать для получения антител к IL-12, к TNFα или к IL-18 по этому изобретению.
Рекомбинантные антитела человека по изобретению, включающие, но не ограниченные этим, антитела к IL-12, к TNFα или к IL-18 или их антигенсвязывающие участки, либо антитела, родственные антителам к IL-12, к TNFα или к IL-18, раскрытые в настоящем документе, можно выделить скринингом комбинаторной библиотеки рекомбинантных антител, например, библиотеки scFv-фагового дисплея, полученной с использованием кДНК VL и VH, полученных на основе мРНК из лимфоцитов человека. Методики получения и скрининга таких библиотек известны в данной области. В дополнение к доступным в продаже наборам для создания библиотек фагового дисплея (например, Pharmacia Recombinant Phage Antibody System, каталожный № 27-9400-01; и Stratagene SurfZAPTM phage display kit, каталожный № 240612, полное содержание которых включено в настоящее описание), примеры способов и реагентов, особенно подходящих для использования при создании и скрининге библиотек антител, можно найти, например, в патенте США № 5223409 авторов Ladner et al.; РСТ-публикации № WO 92/18619 авторов Kang et al.; РСТ-публикации № WO 91/17271 авторов Dower et al.; РСТ-публикации № WO 92/20791 авторов Winter et al.; РСТ-публикации № WO 92/15679 авторов Markland et al.; РСТ-публикации № WO 93/01288 авторов Breitling et al.; РСТ-публикации № WO 92/01047 авторов McCafferty et al.; РСТ-публикации № WO 92/09690 авторов Garrard et al.; статьях Fuchs et al. (1991) Bio/Technology 9:1370-1372; Hay et al. (1992) Hum Antibod Hybridomas 3:81-85; Huse et al. (1989) Science 246:1275-1281; McCafferty et al., Nature (1990) 348:552-554; Griffiths et al. (1993) EMBO J 12:725-734; Hawkins et al. (1992) J Mol Biol 226:889-896; Clackson et al. (1991) Nature 352:624-628; Gram et al. (1992) PNAS 89:3576-3580; Garrard et al. (1991) Bio/Technology 9:1373-1377; Hoogenboom et al. (1991) Nuc Acid Res 19:4133-4137; и Barbas et al. (1991) PNAS 88:7978-7982; полное содержание которых включено в настоящее описание.
Моноклональные антитела человека по этому изобретению можно также получить, используя SCID-мышей, в которых воссозданы клетки иммунной системы человека таким образом, чтобы при иммунизации можно было получить гуморальный иммунный ответ человека. Такие мыши описаны, например, в патентах США № 5476996 и 5698767 авторов Wilson et al.
В некоторых вариантах осуществления изобретения способы включают антитела к IL-12, к TNFα или к IL-18 или их антигенсвязывающие участки, антитела и участки антител, родственные антителам к IL-12, к TNFα или к IL-18, и антитела человека и участки антител со свойствами, аналогичными антителам к IL-12, к TNFα или к IL-18, таким как высокоаффинное связывание с hIL-12, hTNFα или hIL-18 с низкой скоростью диссоциации и высокую нейтрализующую способность. В одном аспекте изобретение относится к лечению выделенным антителом человека или его антигенсвязывающим участком, который диссоциирует с hIL-12, hTNFα или hIL-18 с Kd примерно 1x10-8 M или ниже и константой скорости диссоциации Koff 1x10-3 с-1 или ниже, определенными с помощью поверхностного плазмонного резонанса. В определенных неограничивающих вариантах осуществления изобретения антитело к IL-12, очищенное по изобретению, конкурентно ингибирует связывание ABT-874 с IL-12 при физиологических условиях. В определенных неограничивающих вариантах осуществления изобретения антитело к IL-18, очищенное по изобретению, конкурентно ингибирует связывание ABT-325 с IL-18 при физиологических условиях. В определенных неограничивающих вариантах осуществления изобретения антитело к TNFα, очищенное по изобретению, конкурентно ингибирует связывание Адалимумаба с TNFα при физиологических условиях.
В еще одном варианте осуществления изобретения антитела или их фрагменты, такие как, но не ограниченные этим, антитела к IL-12, к TNFα или к IL-18 или их фрагменты, могут быть изменены, причем константная область антитела может быть модифицирована для уменьшения, по меньшей мере, одной опосредованной константной областью биологической эффекторной функции, связанной с немодифицированным антителом. Для модификации антитела по изобретению, например, для уменьшения его связывания с Fc-рецептором, сегмент константной области антитела можно мутировать в конкретных областях, необходимых для взаимодействия с Fc-рецептором (FcR) (см., например, Canfield and Morrison (1991) J. Exp. Med. 173:1483-1491; и Lund et al. (1991) J. of Immunol. 147:2657-2662, полное содержание которых включено в настоящее описание). Снижение способности антитела связывать FcR также может уменьшить другие эффекторные функции, которые зависят от взаимодействия с FcR, такие как опсонизация и фагоцитоз, а также антигензависимую клеточную цитотоксичность.
3. Продукция антител
Для экспрессии антител по изобретению ДНК, кодирующую частичные или полноразмерные легкие и тяжелые цепи, встраивают в один или более экспрессионных векторов таким образом, чтобы гены были функционально соединены с последовательностями транскрипционного и трансляционного контроля. (См., например, патент США № 6914128, полное содержание которого включено в настоящий документ путем ссылки.) Предполагается, что в данном контексте термин «функционально соединенный» означает, что ген антитела лигирован в вектор таким образом, что последовательности транскрипционного и трансляционного контроля в векторе служат для их предполагаемой функции регуляции транскрипции и трансляции гена антитела. Экспрессионный вектор и контролирующие экспрессию последовательности выбирают так, чтобы они были совместимы с используемой для экспрессии клеткой-хозяином. Ген легкой цепи антитела и ген тяжелой цепи антитела можно встроить в отдельные векторы, или, чаще, оба гена встраивают в один экспрессионный вектор. Гены антител встраивают в экспрессионный вектор стандартными способами (например, лигированием комплементарных сайтов рестрикции на фрагменте гена антитела и вектора или лигированием по «тупым» концам, если сайты рестрикции отсутствуют). До встраивания последовательностей легких или тяжелых цепей антитела или родственной молекулы экспрессионный вектор может уже нести последовательности константных областей антитела. Например, одним подходом для превращения VH- и VL-последовательностей антител к IL-12, к TNFα или к IL-18 или молекул, родственных антителам к IL-12, к TNFα или к IL-18, в полноразмерные гены антител является встраивание их в экспрессионные векторы, которые уже кодируют константные области тяжелой и легкой цепей, соответственно, таким образом, чтобы VH-сегмент был функционально соединен с СН-сегментом (СН-сегментами) в векторе, а VL-сегмент был функционально соединен с CL-сегментом в векторе. В дополнение или в качестве альтернативы, рекомбинантный экспрессионный вектор может кодировать сигнальный пептид, который облегчает секрецию цепи антитела из клетки-хозяина. Ген цепи антитела можно клонировать в вектор таким образом, что сигнальный пептид будет соединен с сохранением рамки считывания с амино-концом гена цепи антитела. Сигнальный пептид может представлять собой иммуноглобулиновый сигнальный пептид или гетерологичный сигнальный пептид (т.е. сигнальный пептид из белка, не относящегося к семейству иммуноглобулинов).
В дополнение к генам цепей антитела рекомбинантный экспрессионный вектор по изобретению может нести одну или более регуляторных последовательностей, которые контролируют экспрессию генов цепей антитела в клетке-хозяине. Предполагается, что термин «регуляторная последовательность» включает промоторы, энхансеры и другие элементы для контроля экспрессии (например, сигналы полиаденилирования), которые контролируют транскрипцию или трансляцию генов цепей антитела. Такие регуляторные последовательности описаны, например, в книге Goeddel; Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, CA (1990), полное содержание которой включено в настоящее описание путем ссылки. Для опытных специалистов в данной области будет очевидно, что конструирование экспрессионного вектора, включая выбор регуляторных последовательностей, может зависеть от таких факторов, как выбор трансформируемой клетки-хозяина, желаемого уровня экспрессии белка и т.д. Подходящие регуляторные последовательности для экспрессии в клетках-хозяевах из млекопитающих включают вирусные элементы, которые дают высокий уровень экспрессии белка в клетках млекопитающих, такие как промоторы и/или энхансеры цитомегаловируса (CMV) (такой как, CMV-промотор/энхансер), вируса обезьян 40 (SV40) (такой как SV40-промотор/энхансер), аденовируса (например, основной поздний промотор аденовируса (AdMLP)) и вируса полиомы. Для дополнительного описания вирусных регуляторных элементов и их последовательностей, см., например, патент США № 5168062 автора Stinski, патент США № 4510245 авторов Bell et al. и патент США № 4968615 авторов Schaffner et al., полное содержание которых включено в настоящее описание путем ссылки.
В дополнение к генам цепей антитела и регуляторным последовательностям рекомбинантный экспрессионный вектор по изобретению может нести одну или более дополнительных последовательностей, таких как последовательность, регулирующая репликацию вектора в клетках-хозяевах (например, точки инициации репликации) и/или ген селективного маркера. Ген маркера селекции облегчает селекцию клеток-хозяев, в которых введен вектор (см., например, патенты США № 4399216, 4634665 и 5179017, все авторов Axel et al., полное содержание которых включено в настоящее описание путем ссылки). Например, обычно ген маркера селекции придает устойчивость к лекарственным соединениям, таким как G418, гигромицин или метотрексат, клетке-хозяину, в которую он введен. Подходящие гены селективных маркеров включают ген дигидрофолатредуктазы (DHFR) (для использования в dhfr- клетках-хозяевах с селекцией/амплификацией на метотрексате) и ген neo (для селекции на G418).
Антитело или участок антитела по изобретению можно получить с помощью рекомбинантной экспрессии генов легкой и тяжелой цепи иммуноглобулина в клетках-хозяевах. Для рекомбинантной экспрессии антитела клетки-хозяева трансфицируют одним или несколькими рекомбинантными экспрессионными векторами, несущими фрагменты ДНК, кодирующие легкую и тяжелую цепи антитела, так что легкая и тяжелая цепи экспрессируются в клетках-хозяевах и секретируются в среду, в которой культивируют клетки-хозяева, из которой можно выделить антитела. Для получения генов тяжелой и легкой цепей антитела, включения этих генов в рекомбинантные экспрессионные векторы и введения этих векторов в клетки-хозяева используют стандартные методики рекомбинантных ДНК, такие как описанные в Sambrook, Fritsch and Maniatis (eds), Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor, N. Y., (1989), Ausubel et al. (eds.) Current Protocols in Molecular Biology, Greene Publishing Associates, (1989) и в патентах США № 4816397 и 6914128, полное содержание которых включено в настоящее описание.
Для экспрессии легкой и тяжелой цепей экспрессионный вектор (экспрессионные векторы), кодирующие тяжелую и легкую цепи, трансфицируют в клетку-хозяина с помощью стандартных методик. Предполагается, что различные формы термина «трансфекция» охватывают широкий спектр методик, обычно используемых для введения экзогенной ДНК в прокариотическую или эукариотическую клетку-хозяина, например, с помощью электропорации, кальций-фосфатного осаждения, DEAE-декстрановой трансфекции и т.п. Несмотря на то, что теоретически возможно экспрессировать антитела по изобретению либо в прокариотических, либо в эукариотических клетках-хозяевах, подходящей является экспрессия антител в эукариотических клетках, таких как клетки-хозяева из млекопитающих, поскольку в таких эукариотических клетках и, в частности, клетках млекопитающих, более вероятны (по сравнению с прокариотическими клетками) сборка и секреция иммунологически активных антител с правильной укладкой. Было опубликовано, что прокариотическая экспрессия генов антител является неэффективной для получения большого выхода активного антитела (статья Boss and Wood (1985) Immunology Today 6:12-13, полное содержание которой включено в настоящее описание путем ссылки).
Подходящими клетками-хозяевами для клонирования или экспрессии ДНК в векторах по настоящему изобретению являются клетки прокариот, дрожжей или высших эукариот, описанные выше. Подходящие для этой цели прокариоты включают эубактерии, такие как грамотрицательные или грамположительные организмы, например, энтеробактерии, такие как бактерии из рода Escherichia, например, E. coli, рода Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например, Salmonella typhimurium, рода Serratia, например, Serratia marcescans, и Shigella, а также бактерии класса Bacilli, такие как B. subtilis и B. licheniformis (например, штамм B. licheniformis 41P, раскрытый в DD 266710, опубликованном 12 апреля 1989 г.), рода Pseudomonas, такие как P. aeruginosa, и рода Streptomyces. Одним из подходящих для клонирования штаммов-хозяев E. coli является E. coli 294 (ATCC 31446), хотя подходят и другие штаммы, такие как E. coli B, E. coli X1776 (ATCC 31537) и E. coli W3110 (ATCC 27325). Эти примеры являются иллюстративными и не ограничивают изобретение.
Кроме прокариот в качестве хозяев для клонирования или экспрессии векторов, кодирующих полипептиды, подходят эукариотические микроорганизмы, такие как филаментные грибы или дрожжи. Среди низших эукариотических микроорганизмов-хозяев наиболее широко используются дрожжи Saccharomyces cerevisiae, или обычные пекарские дрожжи. Однако для настоящего изобретения широко доступен и пригоден ряд других родов, видов и штаммов, таких как Schizosaccharomyces pombe; клетки-хозяева рода Kluyveromyces, такие как, например, K. lactis, K. fragilis (ATCC 12424), K. bulgaricus (ATCC 16,045), K. wickeramii (ATCC 24178), K. waltii (ATCC 56500), K. drosophilarum (ATCC 36906), K. thermotolerans и K. мarxianus; рода Yarrowia (EP 402226); Pichia pastoris (EP 183070); рода Candida; Trichoderma reesia (EP 244234); Neurospora crassa; рода Schwanniomyces, такие как Schwanniomyces occidentalis; и филаментные грибы, такие как, например, рода Neurospora, Penicillium, Tolypocladium, и клетки-хозяева рода Aspergillus, такие как A. nidulans и A. niger.
Клетки-хозяева, подходящие для экспрессии гликозилированных антител, получают из многоклеточных организмов. Примеры клеток беспозвоночных включают клетки растений и насекомых. Идентифицированы многочисленные бакуловирусные штаммы и их варианты и соответствующие пермиссивные клетки насекомых из видов, таких как Spodoptera frugiperda (совки), Aedes aegypti (комары), Aedes albopictus (комары), Drosophila melanogaster (плодовая мушка) и Bombyx mori. Также общедоступны разнообразные вирусные штаммы для трансфекции, например, вариант L-1 вируса ядерного полиэдроза (ВЯП) Autographa californica и штамм Bm-5 ВЯП Bombyx mori, и такие вирусы можно использовать в качестве вируса по настоящему изобретению, в частности, для трансфекции клеток Spodoptera frugiperda. Также в качестве клеток-хозяев можно использовать культуры клеток растений хлопчатника, кукурузы, картофеля, сои, петуньи, томата и табака.
Подходящие клетки-хозяева млекопитающих для экспрессии рекомбинантных антител по изобретению включают клетки яичников китайского хомячка (клетки СНО) (включая dhfr- клетки CHO, описанные в статье Urlaub and Chasin, (1980) PNAS USA 77:4216-4220, используемые с селективным маркером DHFR, как описано в статье Kaufman and Sharp (1982) Mol. Biol. 159:601-621, полное содержание которой включено в настоящий документ путем ссылки), клетки миеломы NS0, клетки COS и клетки SP2. При введении рекомбинантных экспрессионных векторов, кодирующих гены антител, в клетки-хозяева млекопитающих антитела получают, культивируя клетки-хозяева в течение времени, достаточного для получения экспрессии антитела в клетках-хозяевах или секреции антитела в культуральную среду, в которой выращиваются клетки. Другими примерами пригодных клеточных линий млекопитающих являются следующие линии: линия CV1 почки обезьяны, трансформированная SV40 (COS-7, ATCC CRL 1651); линия почки эмбриона человека (293, или клетки 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol. 36:59 (1977)); клетки почки детеныша хомячка (BHK, ATCC CCL 10); клетки яичников китайского хомячка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); мышиные клетки Сертоли (TM4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки обезьяны (CV1, ATCC CCL 70); клетки почки африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени крысы buffalo (BRL 3A, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); клетки опухоли молочной железы мыши (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N. Y. Acad. Sci. 383:44-68 (1982)); клетки MRC 5; клетки FS4; и линия гепатомы человека (Hep G2) (полное содержание цитируемых источников включено в настоящее описание путем ссылки).
Для получения антител клетки-хозяева трансформируют вышеописанными экспрессионными векторами или векторами для клонирования и культивируют в обычной питательной среде, модифицированной соответствующим образом для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих желаемые последовательности.
Используемые для продукции антител клетки-хозяева можно культивировать в различных средах. Для культивирования клеток-хозяев подходят доступные в продаже среды, такие как Ham's F10™ (Sigma), Minimal Essential Medium™ ((MEM) Sigma), RPMI-1640 (Sigma) и Dulbecco's Modified Eagle's Medium™ ((DMEM), Sigma). Кроме того, в качестве культуральной среды для клеток-хозяев можно использовать любую среду, описанную в Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102:255 (1980), патентах США № 4767704, 4657866, 4927762, 4560655 или 5122469, WO 90/03430; WO 87/00195 или патенте США Re № 30985, полное содержание которых включено в настоящее описание путем ссылки. В любую из этих сред при необходимости можно добавить гормоны и/или другие факторы роста (такие как инсулин, трансферрин или фактор роста эпидермиса), соли (такие как хлорид натрия, кальций, магний и фосфат), буферы (такие как HEPES), нуклеотиды (такие как аденозин и тимидин), антибиотики (такие как гентамицин), микроэлементы (неорганические соединения, обычно присутствующие в конечной концентрации в микромолярном диапазоне) и глюкозу или аналогичный источник энергии. Также могут быть включены в соответствующих концентрациях любые другие необходимые добавки, которые будут известны опытным специалистам в данной области. Условия культивирования, такие как температура, рН и т.п., соответствуют условиям, используемым для клеток-хозяев, выбранных для экспрессии, и будут известны обычному специалисту в данной области.
Клетки-хозяева также можно использовать для получения участков интактных антител, таких как Fab-фрагменты или scFv-молекулы. Следует понимать, что вариации вышеописанной процедуры входят в объем настоящего изобретения. Например, в некоторых вариантах осуществления изобретения может быть целесообразно трансфицировать клетки-хозяева ДНК, кодирующей либо легкую цепь, либо тяжелую цепь (а не обе эти цепи) антитела по изобретению. Технологию рекомбинантных ДНК также можно использовать для удаления части или всей ДНК, кодирующей любую или обе из легкой и тяжелой цепей, которая не нужна для связывания с IL-12, в частности, hIL-12, в контексте антител к IL-12, или ДНК, которая не нужна для связывания с IL-18, в частности, hIL-18, в контексте антитело к IL-18 антител, или ДНК, которая не нужна для связывания с TNFα, в частности, hTNFα, в контексте антител к TNFα. Молекулы, экспрессирующиеся с таких укороченных молекул ДНК, также включены в антитела по изобретению. Кроме того, можно получить бифункциональные антитела (в которых одна тяжелая и одна легкая цепь являются антителом по изобретению, а другие тяжелая и легкая цепи специфичны к другому антигену, кроме IL-12, TNFα или IL-18, в зависимости от специфичности антитела по изобретению) путем сшивки антитела по изобретению со вторым антителом стандартными способами химической сшивки.
В системе, подходящей для рекомбинантной экспрессии антитела или его антигенсвязывающего участка по изобретению, рекомбинантный экспрессионный вектор, кодирующий как тяжелую цепь, так и легкую цепь антитела, вводят в клетки dhfr-CHO кальций-фосфатной трансфекцией. В рекомбинантном экспрессионном векторе каждый из генов тяжелой и легкой цепей антитела функционально соединен с регуляторными элементами (CMV энхансером/AdMLP промотором) для получения высокого уровня транскрипции этих генов. Рекомбинантный экспрессионный вектор также несет ген DHFR, который позволяет селекцию клеток СНО, трансфицированных вектором с помощью селекции/амплификации на метотрексате. Отобранных трансформантов (клеток-хозяев) культивируют для получения экспрессии тяжелой и легкой цепей антитела, а интактное антитело выделяют из культуральной среды. Для создания рекомбинантного экспрессионного вектора, трансфекции клеток-хозяев, отбора трансформантов, культивирования клеток-хозяев и выделения антитела из культуральной среды используют стандартные методики молекулярной биологии.
При использовании рекомбинантных методик антитело можно получать внутри клеток, в периплазматическом пространстве или напрямую секретирующимся в среду. В одном аспекте, при внутриклеточной продукции антитела в качестве первой стадии, можно удалить твердый осадок, либо клетки-хозяева, либо лизированные клетки (например, в результате гомогенизации), например, с помощью центрифугирования или ультрафильтрации. Если антитело секретируется в среду, супернатанты из таких экспрессионных систем можно сначала концентрировать, используя доступные в продаже концентрационные фильтры, например, устройства для ультрафильтрации Amicon™ или Millipore Pellicon™.
До способа по изобретению процедуры очистки антител из клеточного дебриса исходно зависели от места экспрессии антитела. Некоторые антитела могут прямо секретироваться из клетки в окружающую ростовую среду; другие получают внутри клетки. В случае последних первая стадия процесса очистки обычно включает: лизис клетки, который можно осуществить различными способами, включая механическое воздействие, осмотический шок или обработку ферментами. Такое разрушение высвобождает все содержание клетки в гомогенат и, кроме того, приводит к появлению субклеточных фрагментов, которые трудно удалить вследствие их малого размера. Их обычно удаляют дифференциальным центрифугированием или фильтрацией. Если антитело секретируется, то супернатанты из таких систем экспрессии обычно сначала концентрируют, используя доступные в продаже фильтры для концентрации белков, например, системы ультрафильтрации Amicon™ или Millipore Pellicon™. Если антитело секретируется в среду, то рекомбинантные клетки-хозяева можно также отделить от клеточной культуральной среды, например, на тарельчатом сепараторе тангенциальной проточной фильтрацией. Антитела можно далее выделить из культуральной среды, используя способы очистки антител по изобретению.
4. Очистка антител
4.1. Общее описание очистки антител
Изобретение относится к способу получения очищенных (или с пониженным содержанием «БКХ») препаратов антител из смеси, содержащей антитело и, по меньшей мере, один БКХ. Процесс очистки по изобретению начинается со стадии разделения после продукции антитела с использованием способов, описанных выше, и способов, обычно используемых в данной области. В таблице 1 приведено краткое описание одного варианта схемы очистки. Предусмотрены вариации этой схемы, включающие, но не ограниченные этим, вариации, в которых исключена стадия аффинной хроматографии на основе белка А, или стадии ионообмена идут в обратном порядке, и они включены в объем этого изобретения.
Стадии очистки и их предназначение
После получения осветленного раствора или смеси, содержащей полученное антитело, антитело отделяют от других белков, продуцируемых клеткой, таких как БКХ, используя комбинацию различных методик очистки, включая ионообменные стадии разделения и стадии разделения с помощью хроматографии гидрофобных взаимодействий. На стадиях разделения смеси белков разделяют, исходя из их заряда, степени гидрофобности или размера. В одном аспекте изобретения разделение проводят с помощью хроматографии, включая катионную, анионную и хроматографию гидрофобных взаимодействий. Для каждой из этих методик доступны несколько различных хроматографических смол, что позволяет точно подобрать схему очистки к конкретному белку. Идея каждого из способов разделения состоит в том, что либо белки двигаются с различной скоростью по колонке, что обеспечивает возможность их физического разделения, увеличивающегося при их продвижении по колонке, либо они селективно прикрепляются к разделяющей среде, после чего их дифференциально элюируют различными растворителями. В некоторых случаях антитело отделяют от примесей, когда примеси специфически связываются с колонкой, а антитело нет, то есть антитело присутствует в проскоке.
Как упомянуто выше, точный подбор схемы очистки основан на свойствах очищаемого белка. В некоторых вариантах осуществления изобретения стадии разделения по настоящему изобретению используются для отделения антитела от одного или нескольких БКХ. Антитела, которые можно успешно очистить с использованием способов, описанных в настоящем документе, включают, но не ограничены этим, антитела IgA1, IgA2, IgD, IgE, IgG1, IgG2, IgG3, IgG4 и IgM человека. В некоторых вариантах осуществления изобретения стратегии очистки по настоящему изобретению исключают использование аффинной хроматографии на основе белка А, например, в контексте очистки антител IgG3, поскольку антитела IgG3 неэффективно связываются с белком А. Другие факторы, которые позволяют специфичный подбор схемы очистки, включают, но не ограничены этим: присутствие или отсутствие Fc-области (например, в контексте полноразмерного антитела по сравнению с его Fab-фрагментом), поскольку белок А связывается с Fc-областью; конкретные последовательности зародышевой линии, используемые при получении целевых антител; и аминокислотную композицию антитела (например, первичную последовательность антитела, а также общий заряд/гидрофобность молекулы). Имеющие одну или более таких особенностей антитела можно очищать, используя стратегии очистки, подобранные таким образом, чтобы использовать эту особенность.
4.2. Первичное выделение
Первые стадии способов очистки по настоящему изобретению включают первую фазу осветления и первичного выделения антитела из образца культурального материала. Кроме того, в процессе первичного выделения можно также снизить количество вирусов, которые присутствуют в образце культурального материала, или инактивировать их. Например, в ходе фазы первичного выделения очистки можно использовать любой один или более из ряда способов уменьшения количества/инактивации вирусов, включая температурную инактивацию (пастеризацию), рН-инактивацию, обработку растворителем/детергентом, УФ- или рентгеновское облучение и добавление некоторых химических инактивирующих агентов, таких как β-пропиолактон или, например, фенантролин меди, как в патенте США № 4534972, полное содержание которого включено в настоящее описание путем ссылки. В некоторых вариантах осуществления настоящего изобретения в ходе фазы первичного выделения используют рН для снижения количества/инактивации вирусов в образце культурального материала.
Способы снижения количества/инактивации вирусов с помощью рН включают, но не ограничены этим, инкубацию смеси при низком рН, последующую нейтрализацию рН и удаление осадка фильтрацией. В некоторых вариантах осуществления изобретения смесь будет инкубироваться при рН между примерно 2-5, предпочтительно при рН между примерно 3-4 и более предпочтительно при рН примерно 3,5. рН смеси-образца можно понизить любой соответствующей кислотой, в том числе, но не ограниченной этим, лимонной кислотой, уксусной кислотой, каприловой кислотой или другими подходящими кислотами. Выбор значения рН в основном зависит от профиля стабильности антитела и буферных компонентов. Известно, что на качество целевого антитела в ходе снижения количества/инактивации вирусов с помощью низкого рН отрицательно влияют рН и длительность инкубации при низком рН. В некоторых вариантах осуществления изобретения длительность инкубации при низком рН будет составлять от 0,5 ч до 2 ч, предпочтительно от 0,5 ч до 1,5 ч и более предпочтительно длительность будет составлять 1 ч. Снижение количества/инактивация вирусов зависит от этих параметров наряду с концентрацией белка, которая может ограничивать снижение количества/инактивацию при высоких концентрациях. Поэтому для достижения желаемого уровня снижения количества/инактивации вирусов можно выбрать нужные параметры концентрации белка, рН и длительности процесса снижения количества/инактивации вирусов.
В некоторых вариантах осуществления изобретения можно снизить количество вирусов/инактивировать вирусы, используя соответствующие фильтры. Неограничивающим примером подходящего фильтра является фильтр Ultipor DV50™ от Pall Corporation. Хотя в некоторых вариантах осуществления настоящего изобретения такая фильтрация используется в ходе фазы первичного выделения, в других вариантах осуществления изобретения она используется в других фазах процесса очистки, включая, например, либо предпоследнюю, либо финальную стадию очистки. В некоторых вариантах осуществления настоящего изобретения для снижения количества/инактивации вирусов можно использовать альтернативные фильтры, такие как, но не ограниченные этим, фильтры Viresolve™ (Millipore, Billerica, Mass.); фильтры Zeta Plus VR™ (CUNO; Meriden, Conn.); и фильтры Planova™ (Asahi Kasei Pharma, Planova Division, Buffalo Grove, Ill.).
В этих вариантах осуществления изобретения при использовании стадии снижения количества/инактивации вирусов рН смеси-образца можно подвести, при необходимости, для дальнейшей очистки. Например, после снижения количества/инактивации вирусов с помощью низкого рН показатель рН в смеси-образце обычно подводят до более нейтральных значений, например, от примерно 4,5 до примерно 8,5 и предпочтительно до примерно 4,9 перед продолжением процесса очистки. Дополнительно смесь можно промыть водой для инъекций (WFI) для получения желаемой проводимости.
В некоторых вариантах осуществления изобретения первичное выделение будет включать одну или более стадий центрифугирования для дополнительного осветления образца культурального материала, тем самым способствуя очистке антител к IL-12, к TNFα или к IL-18. Образец можно центрифугировать, например, но не в качестве ограничения, при ускорении от 7000×g до приблизительно 12750×g. В контексте крупномасштабной очистки такое центрифугирование можно осуществлять в потоке со скоростью потока, установленной так, чтобы получить (для примера, а не в качестве ограничения) уровень мутности в супернатанте - 150 NTU. Такой супернатант затем можно собрать для дальнейшей очистки.
В некоторых вариантах осуществления изобретения первичное выделение будет включать использование одной или нескольких стадий глубинной фильтрации для дополнительного осветления образца культурального материала, тем самым способствуя очистке антител по настоящему изобретению. Глубинные фильтры содержат фильтрующий элемент, имеющий различную плотность. Такая различная плотность позволяет захватывать большие частицы около поверхности фильтра, в то время как частицы меньшего размера проходят через более крупные поры на поверхности фильтра только для того, чтобы быть захваченными в меньших порах ближе к центру фильтра. В некоторых вариантах осуществления настоящего изобретения стадия глубинной фильтрации может представлять собой стадию глубинной фильтрации с удалением липидов. Хотя в некоторых вариантах осуществления изобретения стадии глубинной фильтрации используются только в ходе фазы первичного выделения, в других вариантах осуществления изобретения глубинные фильтры, включая глубинные фильтры для удаления липидов, используются в ходе одной или нескольких дополнительных фаз очистки. Неограничивающие примеры глубинных фильтров, которые можно использовать в контексте настоящего изобретения, включают глубинные фильтры Cuno™ модель 30/60ZA (3M Corp.) и двухслойные фильтровальные картриджи 0,45/0,2 мкм Sartopore™.
4.3. Аффинная хроматография
В некоторых вариантах осуществления изобретения образец после первичного выделения подвергается аффинной хроматографии для дальнейшей очистки представляющего интерес антитела от БКХ. В некоторых вариантах осуществления изобретения хроматографический материал способен селективно или специфически связывать интересующее антитело. Неограничивающие примеры такого хроматографического материала включают: белок А, белок G, хроматографический материал, содержащий антиген, связываемый интересующим антителом, и хроматографический материал, содержащий Fc-связывающий белок. В конкретных вариантах осуществления изобретения стадия аффинной хроматографии включает нанесение продукта после первичного выделения на колонку, содержащую подходящую смолу на основе белка А. Смола на основе белка А пригодна для аффинной очистки и выделения различных изотипов антител, в частности, IgG1, IgG2 и IgG4. Белок А является белком клеточной стенки бактерий, который связывает иммуноглобулины млекопитающих в основном через их Fc-области. В нативном состоянии белок А имеет пять IgG-связывающих доменов, а также другие домены с неизвестной функцией.
В продаже имеется несколько вариантов смолы на основе белка А. Одной подходящей смолой является MabSelect™ от компании GE Healthcare. Неограничивающим примерном подходящей колонки с MabSelect™ является колонка диаметром примерно 1,0 см и длиной примерно 21,6 см (объем слоя составляет примерно 17 мл). Колонку этого размера можно использовать для мелкомасштабной очистки и можно проводить ее сравнение с другими колонками, используемыми для масштабирования процесса. Например, для более масштабной очистки можно использовать колонку 20×21 см с объемом слоя примерно 6,6 л. Вне зависимости от колонки в ней в качестве носителя можно использовать любую подходящую смолу, такую как MabSelect™.
В некоторых вариантах осуществления изобретения предпочтительно определить динамическую обменную емкость (ДОЕ) смолы на основе белка А для подгонки способа очистки к конкретному интересующему антителу. Например, а не в качестве ограничения, ДОЕ для колонки MabSelect™ можно определить либо нагружением при единой скорости потока, либо нагружением при двух скоростях потока. Нагружение при единой скорости можно оценить при скорости примерно 300 см/ч в течение всего периода нагружения. Нагружение при двух скоростях потока можно определить, нагружая колонку до примерно 35 мг белка на мл смолы при линейной скорости примерно 300 см/ч, затем снижая линейную скорость наполовину, что дает более большее время удерживания для последней части нагрузки.
В некоторых вариантах осуществления изобретения перед нанесением образцов колонку на основе белка А можно уравновесить подходящим буфером. Неограничивающим примером подходящего буфера является Tris/NaCl-буфер с рН примерно 7,2. Неограничивающим примером подходящих условий для уравновешивания являются 25 мМ Tris, 100 мМ NaCl, pH примерно 7,2. После такого уравновешивания образец можно наносить на колонку. После нагрузки колонку можно промыть один или более раз, например, буфером для уравновешивания. До проведения элюции можно выполнить другие промывки, включая промывки, в которых используются другие буферы. Например, колонку можно промыть, используя один или более объемов буфера: 20 мМ лимонная кислота/цитрат натрия, 0,5 М NaCl, pH примерно 6,0. За этой промывкой необязательно могут следовать одна или более промывок буфером для уравновешивания. Затем колонку элюируют соответствующим буфером для элюции. Неограничивающим примером подходящего элюирующего буфера является буфер, содержащий уксусную кислоту и NaCl, с pH примерно 3,5. Подходящими условиями являются, например, 0,1 М уксусная кислота, рН примерно 3,5. Состав элюата можно контролировать с помощью методик, известных опытным специалистам в данной области. Например, можно следить за поглощением при 280 нм (OD280). Элюат с колонки можно собирать, начиная с исходного отклонения примерно 0,5 AU до показаний примерно 0,5 AU в «хвосте» элюируемого пика. Представляющие интерес элюируемые фракции затем можно подготовить для дальнейшей обработки. Например, рН собранного образца можно подвести примерно до 5,0 с помощью Tris-буфера (например, 1,0 М) с рН примерно 10. Необязательно, этот продукт с подведенным рН можно отфильтровать и дополнительно обработать.
4.4. Ионообменная хроматография
В некоторых вариантах осуществления настоящее изобретение относится к способам получения препаратов антител с уменьшенным содержанием БКХ из смеси, содержащей антитела и, по меньшей мере, один БКХ, проводя, по меньшей мере, одну ионообменную стадию разделения смеси, для того чтобы получить элюат, содержащий антитело. Ионообменное разделение включает любой способ, с помощью которого два вещества разделяют на основе отличий их соответствующих ионных зарядов, и в нем можно использовать либо катионообменный материал, либо анионообменный материал.
Использование катионообменного материала или анионообменного материала зависит от общего заряда белка. Поэтому в объем настоящего изобретения входит использование стадии анионного обмена перед применением стадии катионного обмена или стадии катионного обмена перед применением стадии анионного обмена. Кроме того, в объем данного изобретения входит использование только стадии катионного обмена, только стадии анионного обмена или любой последовательной комбинации этих двух стадий.
При проведении разделения исходная смесь антител может контактировать с ионообменным материалом с помощью любой из ряда методик, например, методики очистки в объеме или хроматографической методики.
Например, в контексте очистки в объеме ионообменный материал приготавливают или уравновешивают желаемым стартовым буфером. После приготовления или уравновешивания получают взвесь ионообменного материала. Раствор антитела приводят в контакт с взвесью для адсорбции разделяемого антитела на ионообменном материале. Раствор, содержащий БКХ, которые не связываются с ионообменным материалом, отделяют от взвеси, например, позволяя взвеси осесть и удаляя супернатант. Взвесь можно промыть один или более раз. При желании взвесь можно промыть раствором с более высокой проводимостью для десорбции БКХ, которые связаны с ионообменным материалом. Для элюции связанных полипептидов можно увеличить концентрацию соли в буфере.
В качестве методики ионообменного разделения также можно использовать ионообменную хроматографию. В ионообменной хроматографии молекулы разделяются на основе различий между общим зарядом молекул. При очистке антитела заряд антитела должен быть противоположен заряду функциональной группы, присоединенной к ионообменному материалу, например, смоле, для их связывания. Например, антитела, которые обычно имеют общий положительный заряд в буфере с рН ниже их изоэлектрической точки, будут хорошо связываться с катионообменным материалом, который содержит отрицательно заряженные функциональные группы.
В ионообменной хроматографии заряженные участки на поверхности молекул в растворе притягиваются противоположными зарядами, прикрепленными к хроматографическому носителю, при условии низкой ионной силы окружающего буфера. Элюцию обычно осуществляют, увеличивая ионную силу буфера (например, проводимость) для конкуренции с растворенными молекулами за заряженные участки на ионообменном носителе. Изменение рН и, таким образом, изменение заряда растворенной молекулы являются другим путем элюции растворенной молекулы. Изменение проводимости или рН может быть плавным (градиентная элюция) или ступенчатым (ступенчатая элюция).
К носителям могут быть присоединены анионные или катионные заместители для образования анионных или катионных носителей для хроматографии. Неограничивающие примеры анионообменных заместителей включают диэтиламиноэтильные (DEAE), четвертичные аминоэтильные (QAE) и четвертичные амино (Q) группы. Катионные заместители включают карбоксиметильные (СМ), сульфоэтильные (SE), сульфопропильные (SP), фосфатные (P) и сульфонатные (S) группы. Целлюлозные ионообменные смолы, такие как DE23™, DE32™, DE52™, CM-23™, CM-32™ и CM-52™ доступны от Whatman Ltd. Maidstone, Kent, U.K. Также известны ионообменники на основе SEPHADEX® и поперечно сшитые. Например, DEAE-, QAE-, CM- и SP-SEPHADEX®, и DEAE-, Q-, CM- и S-SEPHAROSE®, а также SEPHAROSE® Fast Flow, доступны от Pharmacia AB. Кроме того, оба DEAE- и CM-производные этиленгликоль-метакрилатного сополимера, такие как TOYOPEARL™ DEAE-650S или M и TOYOPEARL™ CM-650S или M доступны от Toso Haas Co., Philadelphia, Pa.
Смесь, содержащую антитело и примеси, например, БКХ, наносят на ионообменную колонку, например, катионообменную колонку. Например, а не в качестве ограничения, смесь можно нанести в количестве 80 г белка/л смолы в зависимости от используемой колонки. Примером подходящей катионообменной колонки является колонка длиной 23 см с диаметром 80 см, объем слоя которой составляет 116 л. Смесь, нанесенную на такую катионную колонку, можно далее промыть буфером для промывания (буфером для уравновешивания). Затем антитело элюируют с колонки и получают первый элюат.
Эта ионообменная стадия способствует захвату интересующего антитела, одновременно уменьшая количество примесей, таких как БКХ. В некоторых аспектах ионообменной колонкой является катионообменная колонка. Например, но не в качестве ограничения, подходящей смолой для такой катионообменной колонки является смола CM HyperDF. Эти смолы доступны в продаже, например, от Pall Corporation. Эту катионообменную процедуру можно проводить при температуре, равной или примерно равной комнатной температуре.
4.5 Ультрафильтрация/Диафильтрация
В некоторых вариантах осуществления настоящего изобретения используются стадии ультрафильтрации и/или диафильтрации для дополнительной очистки и концентрации образца антитела. Ультрафильтрация подробно описана в: Microfiltration and Ultrafiltration: Principles and Applications, L. Zeman and A. Zydney (Marcel Dekker, Inc., New York, N. Y., 1996); и в: Ultrafiltration Handbook, Munir Cheryan (Technomic Publishing, 1986; ISBN No. 87762-456-9). Предпочтительным фильтрационным способом является тангенциальная проточная фильтрация, описанная в каталоге компании Millipore с названием «Pharmaceutical Process Filtration Catalogue», стр. 177-202 (Bedford, Mass., 1995/96). Обычно считается, что ультрафильтрация означает фильтрацию с использованием фильтров с размером пор меньше 0,1 мкм. В результате использования фильтров с таким маленьким размером пор объем продукта может быть уменьшен в результате прохождения буфера через фильтр, в то время как антитела остаются за фильтром.
Диафильтрация представляет собой способ, в котором используются ультрафильтры для удаления и обмена солей, сахаров и неводных растворителей, для отделения свободных частиц от связанных, для удаления низкомолекулярных соединений и/или для быстрого обмена ионного окружения и/или рН среды. Растворенные микроскопические соединения наиболее эффективно удаляются путем добавления растворителя к ультрафильтруемому раствору при скорости, приблизительно равной скорости ультрафильтрации. Этот процесс вымывает микрочастицы из раствора при постоянном объеме, эффективно очищая удерживаемое антитело. В некоторых вариантах настоящего изобретения стадии диафильтрации используют для обмена различных буферов, используемых в настоящем изобретении, необязательно, перед дальнейшими хроматографическими или другими стадиями очистки, а также для удаления примесей из препаратов антител.
4.6 Хроматография гидрофобных взаимодействий
Настоящее изобретение также включает способы получения препарата антитела со сниженным содержанием БКХ из смеси, содержащей антитело и, по меньшей мере, один БКХ, дополнительно включающие стадию разделения на основе гидрофобных взаимодействий. Например, первый элюат, полученный после ионообменной колонки, можно нанести на материал для разделения на основе гидрофобных взаимодействий, чтобы получить второй элюат, имеющий сниженное содержание БКХ. Стадии хроматографии гидрофобных взаимодействий, такие как описанные в настоящем документе, обычно проводят для удаления белковых агрегатов, таких как агрегаты антител и примесей, связанных со способом очистки.
При проведении разделения смесь-образец контактирует с материалом ХГВ, например, в объеме или на колонке. Перед ХГВ-очисткой может быть желательным удалить любые хаотропные агенты или сильно гидрофобные вещества, например, пропуская смесь через предколонку.
Например, в контексте очистки в объеме ХГВ-материал приготавливают или уравновешивают в желаемом буфере для уравновешивания. Получают взвесь ХГВ-материала. Раствор антител приводят в контракт с взвесью для адсорбции разделяемого антитела на ХГВ-материале. Раствор, содержащий БКХ, которые не связываются ХГВ-материалом, отделяют от взвеси, например, позволяя взвеси осесть и удаляя супернатант. Взвесь можно промыть один или более раз. При желании взвесь можно перевести в раствор с меньшей проводимостью для десорбции антител, связавшихся ХГВ-материалом. Для элюции связавшихся антител можно снизить концентрацию соли.
В то время как ионообменная хроматография основана на заряде антител для их выделения, в хроматографии гидрофобных взаимодействий используются гидрофобные свойства антител. Гидрофобные группы на антителе взаимодействуют с гидрофобными группами на колонке. Чем более гидрофобным является белок, тем сильнее он будет взаимодействовать с колонкой. Поэтому на ХГВ-стадии удаляются клеточные примеси (например, ДНК и другие высокомолекулярные и низкомолекулярные связанные с продуктом частицы).
Гидрофобные взаимодействия наиболее сильны при высокой ионной силе, поэтому эту форму разделения удобно проводить после осаждения солью или ионообмена. Адсорбции антитела на ХГВ-колонку способствует высокая концентрация соли, но актуальные концентрации могут варьировать в широком диапазоне в зависимости от природы антитела и конкретного выбранного ХГВ-лиганда. Различные ионы можно подобрать в так называемые солюфобные серии в зависимости от того, усиливают они гидрофобные взаимодействия (высаливающие эффекты) или разрушают структуру воды (хаотропный эффект) и приводят к ослаблению гидрофобного взаимодействия. Катионы можно выстроить в ряд по увеличению высаливающего эффекта: Ba++, Ca++, Mg++, Li+, Cs+, Na+, K+, Rb+, NH4+; в то время как анионы можно выстроить по увеличению хаотропного эффекта: PO---, S04--, CH3CO3-, Cl-, Br-, NO3-, ClO4-, I-, SCN-.
Обычно сульфаты Na, K или NH4 эффективно усиливают лиганд-белковое взаимодействие в ХГВ. Соли влияют на силу взаимодействия, как указано в следующем ряду: (NH4)2SO4>Na2SO4>NaCl>NH4Cl>NaBr>NaSCN. В общем, подходит концентрация соли между 0,75 и 2М сульфата аммония или между 1 и 4М NaCl.
ХГВ-колонки обычно содержат базовый носитель (например, перекрестно-сшитую агарозу или синтетический сополимер), к которому присоединены гидрофобные лиганды (например, алкильные или арильные группы). Подходящая ХГВ-колонка содержит агарозную смолу, замещенную фенильными группами (например, колонка Phenyl Sepharose™). Многие колонки для ХГВ доступны в продаже. Примеры включают, но не ограничены этим, колонку Phenyl Sepharose™ 6 Fast Flow с низкой или высокой степенью замещения (Pharmacia LBCB Biotechnology, AB, Sweden); колонку Phenyl Sepharose™ High Performance (Pharmacia LKB Biotechnology, AB, Sweden); колонку Octyl Sepharose™ High Performance (Pharmacia LKB Biotechnology, AB, Sweden); колонки Fractogel™ EMD Propyl или Fractogel™ EMD Phenyl (E. Merck, Germany); носители Macro-Prep™ Mehyl или Macro-Prep™ t-Butyl (Bio-Rad, California); колонку WP HI-Propyl (C3)™ (J. T. Baker, New Jersey); и колонки Toyopearl™ ether, phenyl или butyl (TosoHaas, PA).
4.7. Примеры вариантов очистки
В некоторых вариантах осуществления изобретения первичное выделение можно осуществить последовательным снижением рН, центрифугированием и фильтрацией для удаления клеток или клеточного дебриса (включающих БКХ) из продукта, получаемого из биореактора. В качестве примера, а не в качестве ограничения, в культуре (содержащей антитела, среду и клетки) можно с помощью рН снизить количество вирусов/инактивировать вирусы, инкубируя при рН примерно 3,5 в течение приблизительно 1 часа. Показатель рН можно снизить с помощью известных препаратов кислоты, такой как лимонная кислота, например, 3 М лимонной кислоты. Инкубирование в кислом рН снижает, если полностью не элиминирует, рН-чувствительные вирусы и способствует выпадению в осадок некоторых примесей из среды/клеток. После этой стадии снижения количества/инактивации вирусов рН подводят до примерно 4,9 или 5,0, используя основание, такое как гидроксид натрия, например, 3 М гидроксид натрия, в течение от примерно двадцати до примерно 40 минут. Подведение рН можно проводить при температуре примерно 20°С. В некоторых вариантах осуществления изобретения культуру с подведенным рН затем центрифугируют при ускорении от приблизительно 7000×g до приблизительно 11000×g. В некоторых вариантах осуществления изобретения полученный супернатант образца затем пропускают через набор фильтров, содержащий ряд глубинных фильтров. В некоторых вариантах осуществления изобретения набор фильтров содержит около двенадцати 16-дюймовых глубинных фильтров Cuno™, модель 30/60ZA (3M Corp.) и примерно три круглых фильтровальных корпуса, заполненных 30-дюймовыми фильтровальными картриджами Sartopore™ 2, 0,45/0,2 мкм (Sartorius). Осветленный супернатант собирают в емкость, такую как стерильную емкость для сбора продуктов из биореактора, и хранят при температуре приблизительно 8°С. Эту температуру затем подводят до приблизительно 20°С перед стадией захватывающей хроматографии или перед описанными ниже стадиями. Следует отметить, что специалист в данной области может варьировать указанные выше условия, не выходя за рамки объема настоящего изобретения.
В некоторых вариантах осуществления изобретения за первичным выделением будет следовать аффинная хроматография на смоле на основе белка А. В продаже имеется смола на основе белка А от различных производителей. Одной подходящей смолой является MabSelect™ от GE Healthcare. Примером подходящей колонки с MabSelect™ является колонка диаметром примерно 1,0 см и длиной примерно 21,6 см (объем слоя составляет примерно 17 мл). Колонку этого размера можно использовать для экспериментального масштаба. Эту колонку можно сравнивать с другими колонками, используемыми для увеличения масштаба. Например, для коммерческого производства можно использовать колонку 20×21 см с объемом слоя, составляющим примерно 6,6 л. Вне зависимости от колонки она может содержать соответствующую смолу, такую как MabSelect™.
В некоторых аспектах колонку на основе белка А можно уравновесить подходящим буфером до нанесения образцов. Примером подходящего буфера является Tris/NaCl-буфер с pH примерно 6-8, предпочтительно примерно 7,2. Конкретным примером подходящих условий являются: 25 мМ Tris, 100 мМ NaCl, pH 7,2. После уравновешивания продукт можно нанести на колонку. После нанесения колонку можно промыть один или более раз, используя, например, буфер для уравновешивания. Перед элюцией с колонки можно использовать другие промывки, включая промывки различными буферами. Например, колонку можно промыть, используя один или более объемов колонки, буфером (20 мМ лимонная кислота/цитрат натрия, 0,5 M NaCl, pH примерно 6,0). За этой промывкой может, необязательно, следовать одна или более промывок уравновешивающим буфером. Затем колонку на основе белка А можно элюировать, используя соответствующий буфер для элюции. Примером подходящего элюирующего буфера является буфер, содержащий уксусную кислоту и NaCl, с рН примерно 3,5. Подходящим условиями являются, например, 0,1 М уксусная кислота, рН 3,5. Элюцию можно контролировать с помощью методик, хорошо известных специалистам в данной области. Например, можно наблюдать за поглощением при 280 нм (OD280). Элюат с колонки можно собирать, начиная с исходного отклонения примерно 0,5 AU до показаний примерно 0,5 AU в «хвосте» элюируемого пика. Представляющие интерес элюируемые фракции затем можно подготовить для дальнейшей обработки. Например, рН собранного продукта можно подвести до примерно 5,0 с помощью Tris-буфера (например, 1,0 М) с рН примерно 10. Необязательно, этот продукт с подведенным рН можно отфильтровать и дополнительно обработать.
Динамическую обменную емкость (ДОЕ) для колонки MabSelect™ можно определить либо нагружением при единой скорости потока, либо нагружением при двух скоростях потока. Нагружение при единой скорости можно оценить при скорости примерно 300 см/ч в течение всего периода нагружения. Нагружение при двух скоростях потока можно определить, нагружая колонку до примерно 35 мг белка на мл смолы при линейной скорости примерно 300 см/ч, а затем снижая линейную скорость наполовину, что дает большее время удерживания для последней части нагрузки.
Затем элюат с колонки на основе белка А можно дополнительно очистить, используя катионообменную колонку. В некоторых вариантах осуществления изобретения уравновешивающим буфером, используемым для катионообменной колонки, является буфер, имеющий рН примерно 5,0. Примером подходящего буфера является примерно 210 мМ ацетат натрия, рН 5,0. После уравновешивания на колонку наносят образец, полученный после вышеописанной стадии первичного выделения. Колонку заполняют катионообменной смолой, такой как как смола CM Sepharose™ Fast Flow от GE Healthcare. Затем колонку промывают буфером для уравновешивания. После чего колонку элюируют, используя буфер, имеющий большую ионную силу по сравнению с уравновешивающим буфером или промывочным буфером. Например, подходящим элюирующим буфером может быть 790 мМ ацетат натрия, рН 5,0. За элюируемыми антителами можно наблюдать с помощью УФ-спектрофотометра, контролируя поглощение при 280 нм (OD280). В конкретном примере осуществления изобретения элюат можно собирать с 3 OD280 на подъеме пика до 8 OD280 на спуске пика. Следует понимать, что специалист в данной области может варьировать условия, не выходя за рамки объема настоящего изобретения.
В некоторых вариантах осуществления изобретения элюат со смолы на основе белка А дополнительно очищают с использованием анионообменной колонки. Неограничивающим примером подходящей колонки для этой стадии является колонка диаметром 60 см и длиной 30 см, чей объем слоя составляет примерно 85 л. Колонка содержит анионообменную смолу, такую как Q Sepharose™ Fast Flow от GE Healthcare. Колонку можно уравновесить, используя примерно семь объемов колонки соответствующего буфера, такого как Tris/NaCl-буфер. Примером подходящих условий будут: 25 мМ Tris, 50 мМ хлорид натрия при рН 8,0. Опытный специалист в данной области может варьировать условия, не выходя за рамки объема изобретения. На колонку наносят собранный образец после стадии очистки на основе белка А, описанной выше. В другом аспекте на колонку наносят элюат, собранный после катионного обмена. После нанесения на колонку ее промывают буфером для уравновешивания (например, Tris/NaCl-буфером). Содержащий антитела проскок можно контролировать с помощью УФ-спектрофотометра, наблюдая за поглощением при 280 нм (OD280). Эта стадия анионного обмена уменьшает содержание связанных с процессом примесей, таких как нуклеиновые кислоты, например, ДНК, и белки клеток-хозяев. Разделение происходит за счет того, что целевые антитела по существу не взаимодействуют или не связываются с твердой фазой колонки, например, со смолой Q Sepharose™, а многие примеси взаимодействуют и связываются с твердой фазой колонки. Анионный обмен можно проводит при температуре примерно 12°С.
В некоторых вариантах осуществления изобретения элюат после катионного обмена или анионного обмена, в зависимости от того, какая стадия осуществляется первой, затем фильтруют, используя 16-дюймовый фильтр Cuno™ для удаления липидов. За этой фильтрацией, в которой используется фильтр для удаления липидов, может следовать, например, 30-дюймовый двухслойный фильтровальный картридж Sartopore™, 0,45/0,2 мкм. Для удаления остаточного объема, остающегося в фильтрах, и подготовки образца для ультрафильтрации/диафильтрации можно использовать элюирующий буфер для ионообмена.
Для выполнения стадии ультрафильтрации/диафильтрации приготавливают среду для фильтрации в подходящем буфере, например, 20 мМ фосфате натрия, рН 7,0. Для увеличения ионной силы можно добавить соль, такую как хлорид натрия, например, 100 мМ хлорид натрия. Эта стадия ультрафильтрации/диафильтрации служит для концентрации антител к IL-12, к TNFα или к IL-18, удаления ацетата натрия и подведения рН. Фильтры для выполнения этой стадии доступны в продаже. Например, компания Millipore изготавливает кассету с целлюлозной мембраной для ультрафильтрации с порогом отсечения 30 кДа. Эту процедуру можно проводить при комнатной или приблизительно комнатной температуре.
В некоторых вариантах осуществления изобретения продукт после стадии захватывающей фильтрации подвергают второй стадии ионообменного разделения. Предпочтительно, чтобы это второе ионообменное разделение включало разделение на основе заряда, противоположного заряду первого ионообменного разделения. Например, если после первичного выделения используют анионообменную стадию, то второй ионообменной хроматографической стадией может быть стадия катионного обмена. И наоборот, если за стадией первичного выделения следует стадия катионного обмена, за этой стадией может следовать стадия анионного обмена. В некоторых вариантах осуществления изобретения элюат после первого ионообмена можно напрямую использовать во второй ионообменной хроматографической стадии, причем элюат после первого ионообмена переводят в соответствующий буфер. Подходящие материалы для анионного и катионного разделения и условия этого разделения описаны выше.
В некоторых вариантах осуществления настоящего изобретения образец, содержащий антитела, будет проходить дополнительную обработку с использованием стадии разделения на основе гидрофобных взаимодействий. Неограничивающим примером подходящей колонки для такой стадии является колонка диаметром 80 см и длиной 15 см, чей объем слоя составляет примерно 75 л, которая содержит соответствующую смолу, используемую для ХГВ, такую как, но не ограниченную этим, Phenyl HP Sepharose™ от Amersham Biosciences, Upsala, Sweden. Проскок, получаемый после предшествующей анионообменной хроматографической стадии, содержащий интересующие антитела, можно разбавить равным объемом буфера, содержащего примерно 1,7 М сульфат аммония, 50 мМ фосфат натрия, рН 7,0. Этот препарат можно затем профильтровать, используя двухслойный фильтр Sartopore™, 0,45/0,2 мкм, или его эквивалент. В некоторых вариантах осуществления изобретения процедура гидрофобной хроматографии включает два или несколько циклов.
В некоторых вариантах осуществления изобретения ХГВ-колонку сначала уравновешивают подходящим буфером. Неограничивающим примером подходящего буфера является 0,85 М сульфат аммония, 50 мМ фосфат натрия, рН 7,0. Специалист в данной области может изменять буфер для уравновешивания, не выходя за рамки объема настоящего изобретения, путем изменения концентрации буферных агентов и/или заменой буфера аналогичными буферами. В некоторых вариантах осуществления изобретения на колонку затем наносят проскок после анионного обмена и промывают несколько раз, например, три раза, соответствующей буферной системой, такой как буфер, содержащий сульфат аммония и фосфат натрия. Пример подходящей буферной системы включает буфер, содержащий 1,1 М сульфат аммония, 50 мМ фосфат натрия, с рН примерно 7,0. Необязательно можно провести дополнительные циклы промывки колонки. Например, следующий промывочный цикл может включать многократную промывку колонки, например, от одного до семи раз, с использованием соответствующей буферной системы. Неограничивающий пример подходящей буферной системы включает: 0,85 мМ сульфат аммония, 50 мМ фосфат натрия, рН 7,0. В одном аспекте нагруженную колонку подвергают промывке третий раз, используя соответствующую буферную систему. Колонку можно многократно промывать, например, от одного до трех раз, используя буферную систему, такую как 1,1 М сульфат аммония, 50 мМ фосфат натрия при рН около 7,0. Кроме того, опытный специалист в данной области может варьировать буферные условия, не выходя за рамки объема настоящего изобретения.
Колонку элюируют, используя соответствующий буфер для элюции. Подходящим примером такого элюирующего буфера является 0,5 М сульфат аммония, 15 мМ фосфат натрия при рН около 7,0. Представляющие интерес антитела можно детектировать и собирать, используя обычный спектрофотометр и начиная сбор фракций с 3 OD280 на подъеме и 3 OD280 на спуске пика.
В некоторых аспектах изобретения элюат после стадии гидрофобной хроматографии подвергают фильтрации для удаления вирусных частиц, включая интактные вирусы (при их наличии). Неограничивающим примером подходящего фильтра является фильтр Ultipor DV50™ от Pall Corporation. На этой стадии фильтрации можно использовать другие фильтры для вирусов, которые хорошо известны опытным специалистам в данной области. Элюат после ХГВ пропускают через увлажненный фильтр с диаметром пор примерно 0,1 мкм и набор 2х30-дюймовых фильтров Ultipor DV50™ при давлении примерно 34 фунт/кв.дюйм. В некоторых вариантах осуществления изобретения после процесса фильтрации фильтр промывают, используя, например, элюирующий буфер для ХГВ для удаления антител, оставшихся в корпусе фильтра. Фильтрат можно хранить в стерильном контейнере при температуре примерно 12°С.
В некоторых вариантах осуществления изобретения фильтрат после вышеописанных стадий еще раз подвергают ультрафильтрации/диафильтрации. Эта стадия важна, если конечной целью применения изобретения на практике является использование антитела, например, в фармацевтическом составе. Этот процесс (если он применялся) может способствовать концентрации антитела, удалению ранее используемых буферных солей и замене их буфером, используемым в конкретной рецептуре. В некоторых вариантах осуществления изобретения проводят непрерывную диафильтрацию несколькими объемами, например, двумя объемами, рецептурного буфера. Неограничивающим примером подходящего рецептурного буфера является буфер, содержащий 5 мМ метионин, 2% маннит, 0,5% сахарозу, рН 5,9 (не содержащий Tween). После завершения обмена этих двух объемов антитела концентрируют. После получения определенной концентрации антитела специалист, применяющий изобретение на практике, может вычислить количество 10%-го Tween, которое необходимо добавить, чтобы получить конечную концентрацию Tween примерно 0,005% (по объему).
Некоторые варианты осуществления настоящего изобретения будут включать дополнительные стадии очистки. Примеры дополнительных процедур очистки, которые можно осуществить до, в течение или после ионообменной хроматографии, включают осаждение этанолом, изоэлектрическую фокусировку, обращенно-фазовую ВЭЖХ, хроматографию на силикагеле, хроматографию на гепарин-Sepharose™, дополнительную анионообменную хроматографию, хроматофокусирование, электрофорез в ДСН-ПААГ, осаждение сульфатом аммония, хроматографию на гидроксиапатите, электрофорез в геле, диализ и аффинную хроматографию (например, с использованием белка G, антитела, специфичного субстрата, лиганда или антигена в качестве захватывающего реагента).
В некоторых вариантах осуществления настоящего изобретения антителом к IL-12 является антитело изотипа IgA1, IgA2, IgD, IgE, IgG1, IgG2, IgG3, IgG4 или IgM, содержащее последовательности вариабельных областей тяжелой и легкой цепей, приведенные на фиг. 1. В предпочтительных вариантах осуществления изобретения антителом к IL-12 является антитело изотипа IgG1, IgG2, IgG3 или IgG4, содержащее последовательности вариабельных областей тяжелой и легкой цепей, приведенные на фиг. 1, наиболее предпочтительно антителом к IL-12 является антитело изотипа IgG1, содержащее последовательности вариабельных областей тяжелой и легкой цепей, приведенные на фиг. 1. В некоторых вариантах осуществления настоящего изобретения антителом к TNFα является антитело изотипа IgA1, IgA2, IgD, IgE, IgG1, IgG2, IgG3, IgG4 или IgM, содержащее последовательности вариабельных областей тяжелой и легкой цепей, приведенные на фиг. 3. В предпочтительных вариантах осуществления изобретения антителом к TNFα является антитело изотипа IgG1, IgG2, IgG3 или IgG4, содержащее последовательности вариабельных областей тяжелой и легкой цепей, приведенные на фиг. 3, наиболее предпочтительно антителом к TNFα является антитело изотипа IgG1, содержащее последовательности вариабельных областей тяжелой и легкой цепей, приведенные на фиг. 3.
5. Способы анализа чистоты продукта
5.1 Анализ белков клеток-хозяев
Настоящее изобретение также относится к способам определения остаточного уровня концентрации белков клеток-хозяев (БКХ) в композиции выделенного/очищенного антитела. Как указано выше, желательно исключить БКХ из конечного продукта, например, антитела к IL-12, антитела к TNFα или антитела к IL-18. Примеры БКХ включают белки, источником которых является источник продукции антител. Неспособность идентифицировать и в достаточной степени удалить БКХ из целевого антитела может привести к снижению эффективности и/или неблагоприятной реакции у пациента.
Используемый в настоящем описании термин «БКХ-ELISA», в котором второе антитело, используемое в анализе специфично к БКХ, продуцируемым клетками, например, клетками СНО, используемыми для синтеза антитела (например, антитела к IL-12, к TNFα или к IL-18). Второе антитело можно получить стандартными способами, известными специалистам в данной области. Например, второе антитело можно продуцировать, используя БКХ, полученные проведением «пустых» продукции и очистки, т.е. используют такую же клеточную линию, как для продукции представляющего интерес антитела, но ее не трансфицируют ДНК антитела. В примере варианта осуществления изобретения второе антитело продуцируют, используя БКХ, аналогичные белкам, которые экспрессируются в выбранной клеточной системе экспрессии, т.е. клеточной системе экспрессии, используемой для продукции целевого антитела.
В общем, БКХ-ELISA включает образование «сэндвича» из белков жидкого образца, содержащего БКХ, между двумя слоями антител, т.е. первого антитела и второго антитела. В течение инкубации продукта БКХ из него захватываются первым антителом, например, но не ограниченным этим, аффинно очищенным козьим антителом к СНО (Cygnus). Добавляют меченое второе антитело или смесь антител, специфичных к БКХ, продуцируемым клетками, используемыми для получения антител, например, биотинилированное антитело к БКХ из CHO, которое связывает БКХ в продукте. В некоторых аспектах первое и второе антитела представляют собой смеси поликлональных антител, полученных против БКХ, например, но не ограниченных этим, биотинилированные козьи антитела против смеси белков клеток-хозяев 599/626/748. Количество БКХ, содержащееся в продукте, определяют, используя соответствующий тест, основанный на метке второго антитела.
БКХ-ELISA можно использовать для определения уровня БКХ в композиции антитела, такой как элюат или проскок, полученные с использованием описанного выше способа. Настоящее изобретение также относится к композиции, содержащей антитело, в которой композиция не содержит детектируемого уровня БКХ, определяемого с помощью твердофазного иммуноферментного анализа (ELISA) на БКХ.
5.2 Анализ на материал аффинной хроматографии
В некоторых вариантах осуществления настоящее изобретение также относится к способам определения остаточного уровня материала аффинной хроматографии в композиции выделенного/очищенного антитела. В некоторых случаях такой материал вымывается в композицию антитела в ходе процесса очистки. В некоторых вариантах осуществления изобретения используют анализ для определения концентрации белка А в композиции выделенного/очищенного антитела. Используемый в настоящем описании термин «белок А-ELISA» относится к ELISA, в котором второе антитело, используемое в анализе, специфично к белку А, используемому для очистки представляющего интерес антитела, например, антитела к IL-12, к TNFα или к IL-18. Второе антитело можно получить стандартными способами, известными специалистам в данной области. Например, второе антитело можно продуцировать, используя природный или рекомбинантный белок А в стандартных способах получения и продукции антител.
В общем, белок А-ELISA включает образование «сэндвича» из жидкого образца, содержащего белок А (или возможно содержащего белок А), между двумя слоями антител к белку А, т.е. первого антитела к белку А и второго антитела к белку А. Образец добавляют к первому слою антител к белку А, например, но не ограниченными этим, поликлональные антитела или смесь поликлональных антител, и инкубируют в течение времени, достаточного для захвата белка А из образца первым антителом. Затем добавляют меченое второе антитело, например, но не ограниченное этим, поликлональные антитела или смесь поликлональных антител, специфичные к белку А, которые связывают захваченный белок А в образце. Дополнительные неограничивающие примеры антител к белку А, пригодные в контексте настоящего изобретения, включают куриные антитела к белку А и биотинилированные антитела к белку А. Количество белка А, содержащегося в образце, определяют, используя соответствующий тест на основе метки вторичного антитела. Аналогичные анализы можно использовать для определения концентрации других материалов аффинной хроматографии.
Белок А-ELISA можно использовать для определения уровня белка А в композиции антител, такой как элюат или проскок, полученные с использованием описанного выше способа. Настоящее изобретение также относится к композиции, содержащей антитело, причем композиция не содержит детектируемого количества белка А, определяемого с помощью твердофазного иммуноферментного анализа (ELISA) на белок А.
6. Дополнительные модификации
Антитела по настоящему изобретению можно модифицировать. В некоторых вариантах осуществления изобретения антитела или их антигенсвязывающие фрагменты химически модифицированы для получения желаемого эффекта. Например, можно провести ПЭГилирование антител или фрагментов антител по изобретению с помощью любой из реакций ПЭГилирования (присоединения молекул ПЭГ), известных в данной области, описанных, например, в следующих ссылках: Focus on Growth Factors 3:4-10 (1992); EP 0154316 и EP 0401384, полное содержание каждого из которых включено в настоящий документ путем ссылки. В одном аспекте ПЭГилировние проводят с помощью реакции ацилирования или алкилирования с реакционноспособными молекулами полиэтиленгликоля (или аналогичного реакционноспособного водорастворимого полимера). Подходящим водорастворимым полимером для ПЭГилирования антител и фрагментов антител по изобретению является полиэтиленгликоль (ПЭГ). Подразумевается, что используемый в настоящем описании термин «полиэтиленгликоль» охватывает любую из форм ПЭГ, которая использовалась для получения производных других белков, такую как моно(C1-C10)алкокси- или арилокси-полиэтиленгликоль.
Способ получения ПЭГилированных антител и фрагментов антител по изобретению будет в общем включать стадии: (а) реакции антитела или фрагмента антитела с полиэтиленгликолем, таким как реакционноспособное сложноэфирное или альдегидное производное ПЭГ, в подходящих условиях, в результате чего антитело или фрагмент антитела становятся присоединенными к одной или нескольким ПЭГ-группам, и (б) выделения продуктов реакции. Для среднего специалиста в данной области будет очевидно, как выбрать оптимальные условия реакции или реакций ацилирования, исходя из известных параметров и желаемого результата.
ПЭГилированные антитела и фрагменты антител, специфичные к IL-12, TNFα или IL-18, обычно можно использовать для лечения связанных с IL-12, TNFα или IL-18 расстройств по изобретению путем введения антител к IL-12, к TNFα или к IL-18 и фрагментов антител, описанных в настоящем документе. В общем, ПЭГилированные антитела и фрагменты антител имеют увеличенное время полужизни по сравнению с немодифицированными ПЭГ антителами и фрагментами антител. ПЭГилированные антитела и фрагменты антител можно использовать по отдельности, совместно или в комбинации с другими фармацевтическими композициями.
Из антитела или участка антитела по изобретению можно получить производное или присоединить их к другой функциональной молекуле (например, другому пептиду или белку). Соответственно, предполагается, что антитела и участки антител по изобретению включают производные или иным образом модифицированные формы антител к hIL-12, к TNFα или к hIL-18 человека, описанные в настоящем документе, включая молекулы иммуноадгезии. Например, антитело или участок антитела по настоящему изобретению можно функционально соединить (химической связью, генетическим слиянием, нековалентной связью или иным образом) с одной или несколькими молекулами, такими как другое антитело (например, биспецифичное антитело или диантитело), детектируемый агент, цитотоксичный агент, фармацевтический агент и/или белок или пептид, которые могут опосредовать связывание антитела или участка антитела с другой молекулой (такой как коровая область стрептавидина или полигистидиновая метка).
Один тип производных антител получают перекрестной сшивкой двух или нескольких антител (одного типа или разных типов, например, для создания биспецифичных антител). Подходящие агенты для перекрестной сшивки включают гетеробифункциональные агенты, имеющие две различных реакционноспособных группы, разделенные соответствующим спейсером (например, м-малеимидобензоил-N-гидроксисукцинимидный эфир), или гомобифункциональные агенты (например, дисукцинимидилсуберат). Такие линкеры доступны от Pierce Chemical Company, Rockford, IL.
Подходящие детектируемые агенты, с помощью которых можно получить производные антитела или участка антитела по изобретению, включают флуоресцентные соединения. Примеры детектируемых флуоресцентных агентов включают флуоресцеин, изотиоцианат флуоресцеина, родамин, хлорид 5-диметиламин-1-нафталинсульфонила, фикоэритрин и т.п. Также можно получить производные антитела с детектируемыми ферментами, такими как щелочная фосфатаза, пероксидаза хрена, глюкозооксидаза и т.п. При получении производного антитела с детектируемым ферментом его детекцию осуществляют, добавляя дополнительные реагенты, используемые ферментом для образования детектируемого продукта реакции. Например, если детектируемым агентом является пероксидаза хрена, то добавление пероксида водорода и диаминобензидина приводит к образованию окрашенного продукта реакции, который можно детектировать. Антитело может также образовать производное с биотином и детектироваться посредством непрямого измерения связывания с авидином или стрептавидином.
7. Фармацевтические композиции
Антитело или участок антитела по изобретению можно ввести в фармацевтические композиции, пригодные для введения субъекту. Обычно фармацевтическая композиция содержит антитело или участок антитела по изобретению и фармацевтически приемлемый носитель. Используемый здесь термин «фармацевтически приемлемый носитель» включает все возможные растворители, дисперсионные среды, оболочки, антибактериальные и противогрибковые агенты, изотонические и задерживающие абсорбцию агенты и т.п., которые являются физиологически совместимыми. Примеры фармацевтически приемлемых носителей включают один или более из перечисленных далее веществ: вода, солевой раствор, солевой раствор, забуференный фосфатом, декстроза, глицерин, этанол и т.п., а также их комбинации. Во многих случаях желательно включить в композицию изотонические агенты, например сахара, многоатомные спирты, такие как маннит, сорбит, или хлорид натрия. Фармацевтически приемлемые носители могут дополнительно содержать минорные количества вспомогательных веществ, таких как увлажняющие агенты или эмульгаторы, консерванты или буферы, которые увеличивают время хранения или эффективность антитела или участка антитела.
Антитела и участки антител по изобретению можно включить в фармацевтическую композицию, подходящую для парентерального введения. Антитело или участки антител можно приготовить в качестве раствора для инъекций, содержащего, например, 0,1-250 мг/мл антитела. Раствор для инъекций может состоять или из жидкой, или из лиофилизированной лекарственной формы в прозрачном или темном флаконе, ампуле или предварительно заполненном шприце. Буфером может быть L-гистидин, приблизительно 1-50 мМ (оптимально, 5-10 мМ), при рН 5,0-7,0 (оптимально рН 6,0). Другие подходящие буферы включают, но не ограничены этим, сукцинат натрия, цитрат натрия, фосфат натрия или фосфат калия. Хлорид натрия можно использовать для модификации токсичности раствора в концентрации 0-300 мМ (оптимально 150 мМ для жидкой лекарственной формы). В лиофилизированную лекарственную форму можно включить криопротекторы, главным образом, 0-10% сахарозы (оптимально 0,5-1,0%). Другие подходящие криопротекторы включают трегалозу и лактозу. В лиофилизированную лекарственную форму можно включить наполнители, главным образом, 1-10% маннита (оптимально 24%). Как в жидкие, так и в лиофилизированные лекарственные формы можно включить стабилизаторы, главным образом, 1-50 мМ L-метионин (оптимально 5-10 мМ). Можно включить другие подходящие наполнители, в том числе глицин, аргинин, а также 0-0,05% полисорбата-80 (оптимально 0,005-0,01%). Дополнительные поверхностно-активные вещества включают, но не ограничены этим, поверхностно-активные вещества полисорбат-20 и BRIJ.
В одном аспекте фармацевтическая композиция включает антитело в дозировке примерно 0,01 мг/кг-10 мг/кг. В другом аспекте дозировки антитела включают приблизительно 1 мг/кг при введении через неделю или приблизительно 0,3 мг/кг при введении каждую неделю. Опытный практикующий врач может определить корректную дозировку и схему введения субъекту.
Композиции по данному изобретению могут находиться в различных формах. Они включают, например, жидкие, мягкие и твердые лекарственные формы, такие как жидкие растворы (например, растворы для инъекций и инфузий), дисперсии или суспензии, таблетки, пилюли, порошки, липосомы и суппозитории. Форма зависит от предлагаемого способа введения и терапевтического применения. Типичные композиции представлены в форме растворов для инъекций или инфузий, таких как композиции, аналогичные композициям, используемым для пассивной иммунизации человека другими антителами. Одним способом введения является парентеральный (например, внутривенный, подкожный, внутрибрюшинный, внутримышечный). В одном аспекте антитело вводят внутривенной инфузией или инъекцией. В другом аспекте антитело вводят внутримышечной или подкожной инъекцией.
Терапевтические композиции обычно должны быть стерильными и стабильными в условиях производства и хранения. Композиции могут быть составлены в виде растворов, микроэмульсий, дисперсий, липосом или других упорядоченных структур, подходящих для высокой концентрации лекарственных соединений. Стерильные растворы для инъекций можно приготовить включением действующего вещества (т.е. антитела или участка антитела) в необходимом количестве в соответствующий растворитель с одним из вышеперечисленных ингредиентов или их комбинацией, как указано, с последующей стерилизацией фильтрованием. Обычно дисперсии приготавливают включением действующего вещества в стерильный носитель, который содержит базовую дисперсионную среду и требуемые другие ингредиенты из вышеперечисленных. В случае стерильных, модифицированных порошков для приготовления стерильных растворов для инъекций предпочтительными способами приготовления являются вакуумная сушка и сушка распылением, дающие порошок действующего ингредиента с любым дополнительным желательным ингредиентом из его предварительного стерилизованного фильтрацией раствора. Надлежащую текучесть раствора можно поддерживать, например, использованием покрытия, такого как лецитиновое покрытие, поддержанием требуемого размера частиц в случае дисперсии и использованием поверхностно-активных веществ. Пролонгированная абсорбция композиций для инъекций может быть достигнута включением в композицию агента, который задерживает абсорбцию, например, солей моностеарата и желатина.
Антитела и участки антител по настоящему изобретению можно вводить различными способами, известными в данной области; одним путем/способом введения является подкожная инъекция, внутривенная инъекция или инфузия. Для опытного специалиста будет ясно, что путь и/или способ введения будут варьировать в зависимости от желаемых результатов. В некоторых вариантах осуществления изобретения действующее вещество может быть приготовлено с носителем, который будет препятствовать быстрому высвобождению соединения, как, например, в препарате с контролируемым высвобождением, включающим имплантаты, трансдермальные пластыри и микроинкапсулированные системы доставки. Можно использовать биодеградируемые биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Многие способы приготовления таких составов запатентованы и, в общем, известны специалистам в данной области. См., например, издание Sustained and Controlled Release Drug Delivery Systems. J.R.Robinson ed. Marcel Dekker, Inc., New York, 1978, полное содержание которого включено в настоящее описание путем ссылки.
В некоторых вариантах осуществления антитело или участок антитела по изобретению можно вводить перорально, например, с инертным разбавителем или усваиваемым съедобным носителем. Соединение (и другие ингредиенты при желании) также могут быть заключены в желатиновую капсулу с твердой или мягкой оболочкой, спрессованы в таблетки или введены непосредственно в пищу субъекта. Для перорального терапевтического введения соединения могут быть включены в состав с эксципиентами и использованы в форме таблеток для приема внутрь, защечных таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, облаток и т.п. Для введения соединения по изобретению способом, отличным от парентерального, может быть необходимо покрытие соединения оболочкой из материала, препятствующего его инактивации, или введение соединения совместно с таким материалом.
В композиции также можно ввести дополнительные действующие вещества. В некоторых вариантах осуществления антитело или участок антитела по изобретению введены в фармацевтический состав и/или вводятся совместно с одним или несколькими из дополнительных терапевтических агентов, которые используют для лечения расстройств, при которых активность IL-12, TNFα или IL- 18 наносит ущерб. Например, антитело к IL-12, антитело к TNFα или антитело к IL-18 или участок антитела по изобретению могут входить в фармацевтический состав и/или вводиться совместно с одним или несколькими дополнительными антителами, которые связывают другие мишени (например, антителами, которые связывают другие цитокины или связывают молекулы на клеточной поверхности). Кроме того, одно или более антител по изобретению можно использовать в комбинации с одним или несколькими из вышеупомянутых терапевтических агентов. В таких способах комбинированной терапии можно предпочтительно использовать низкие дозы вводимых терапевтических агентов, таким образом, избегая возможной токсичности или осложнений, ассоциированных с различными способами монотерапии. Опытному специалисту в данной области будет ясно, что при использовании антител по изобретению, в качестве части комбинированной терапии, могут быть желательны более низкие дозировки антитела по сравнению с тем, когда субъекту вводят только одно антитело (например, в результате применения комбинированной терапии можно получить синергетический терапевтический эффект, который, в свою очередь, позволяет использование более низкой дозировки антитела для достижения желаемого терапевтического эффекта).
Следует понимать, что антитела по изобретению или их антигенсвязывающие участки можно использовать по отдельности или в комбинации с дополнительным агентом, например, терапевтическим агентом, причем указанный дополнительный агент, например, терапевтический агент, выбран опытным специалистом на основе его предполагаемой области применения. Например, дополнительный агент может быть терапевтическим агентом, который, как известно в данной области, полезен для лечения заболевания или состояния, для лечения которого используют антитело по настоящему изобретению. Дополнительный агент также может представлять собой агент, который придает полезное свойство терапевтической композиции, например, агент, который влияет на вязкость композиции.
Следует также понимать, что комбинации, которые будут включены в это изобретение, представляют собой комбинации, которые пригодны для предполагаемой области применения. Указанные ниже агенты являются иллюстративными и не ограничивают изобретение. Комбинации, которые являются частью этого изобретения, могут представлять собой антитела по настоящему изобретению и, по меньшей мере, один дополнительный агент, выбранный из приведенных ниже списков. Комбинация может также включать более одного дополнительного агента, например, два или три дополнительных агента, если комбинация составлена таким образом, что получаемая композиция может выполнять предполагаемую функцию.
Некоторыми комбинациями являются нестероидные противовоспалительные средства (НПВС), которые включают лекарственные соединения, такие как ибупрофен. Другими комбинациями являются кортикостероиды, включая преднизолон; хорошо известные побочные эффекты применения стероидов можно снизить или даже устранить, снижая требуемую дозу стероидов при лечении пациентов в комбинации с антителами по этому изобретению. Неограничивающие примеры терапевтических агентов от ревматоидного артрита, с которыми можно комбинировать антитело или участок антитела по изобретению, включают следующие соединения: цитокин-супрессирующие противовоспалительные соединения (CSAID); антитела, полученные против, или антагонисты других цитокинов или факторов роста человека, например, TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF и PDGF. Антитела по изобретению или их антигенсвязывающие участки можно комбинировать с антителами к молекулам клеточной поверхности, таким как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80 (B7.1), CD86 (B7.2), CD90, или их лигандами, включая CD154 (gp39 или CD40L).
Некоторые комбинации терапевтических агентов могут создавать помехи на разных этапах аутоиммунного и последующего воспалительного каскада; примеры включают антагонисты TNF, такие как химерные, гуманизированные антитела к TNF или антитела человека к TNF, D2E7 (патентная заявка США с серийным номером 08/599226, поданная 9 февраля 1996 года, полное содержание которой включено в настоящее описание путем ссылки), cA2 (Remicade™), CDP 571, фрагменты антител к TNF (например, CDP870), и растворимые р55- и р75-рецепторы TNF, их производные (p75TNFRIgG (Enbrel™) или p55TNFRIgG (Lenercept)), растворимый рецептор IL-13 (sIL-13), а также ингибиторы TNFα-конвертирующего фермента (TACE); аналогичным образом, ингибиторы IL-1 (например, ингибиторы интерлейкин-1-конвертирующего фермента, такие как Vx740 или IL-IRA и т.д.) могут быть эффективными по той же причине. Другие комбинации включают интерлейкин 11, антитело к P7s и гликопротеиновый лиганд р-селектина (PSGL). Другие комбинации включают других ключевых участников аутоиммунного ответа, которые могут действовать параллельно с, в зависимости от или согласовано с функцией IL-12; в частности, включая антагонисты IL-18, в том числе антитела к IL-18 или растворимые рецепторы IL-18, или IL-18-связывающие белки. Было показано, что IL-12 и IL-18 имеют перекрывающиеся, но отличающиеся функции, и комбинация антагонистов к этим двум цитокинам может быть более эффективной. Еще одна комбинация включает неистощающие ингибиторы CD4. Другие комбинации включают антагонисты костимуляторного пути CD80 (B7.1) или CD86 (B7.2), включая антитела, растворимые рецепторы или антагонистические лиганды.
Антитела по изобретению или их антигенсвязывающие участки можно комбинировать с агентами, такими как метотрексат, 6-МР, азатиоприн, сульфасалазин, месалазин, олсалазина хлорохинин/гидроксихлорохин, пеницилламин, ауротиомалат (внутримышечно и перорально), азатиоприн, кохицин, кортикостероиды (перорально, ингаляцией и местные инъекции), агонисты β-2-адренорецептора (сальбутамол, тербуталин, салметерол), ксантины (теофиллин, аминофиллин), кромогликат, недокромил, кетотифен, ипратропиум и окситропиум, циклоспорин, FK506, рапамицин, микофенолята мофетил, лефлуномид, НПВС, например, ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэстеразы, аденозиновые агонисты, антитромботические средства, ингибиторы системы комплемента, адренергетики, агенты, препятствующие прохождению сигнала от провоспалительных цитокинов, таких как TNFα или IL-1 (например, ингибиторы IRAK, NIK, IKK, p38 или MAP киназы), ингибиторы IL-lβ-конвертирующего фермента (например, Vx740), антитело к P7s, гликопротеиновый лиганд р-селектина (PSGL), ингибиторы TNFα-конвертирующего фермента (TACE), ингибиторы Т-клеточных сигнальных путей, такие как ингибиторы киназ, ингибиторы металлопротеиназ, сульфасалазин, азатиоприн, 6-меркаптопурины, ингибиторы ангиотензин-конвертирующего фермента, растворимые рецепторы цитокинов и их производные (например, растворимые р55- и р75-рецепторы TNF и их производные p75TNFRIgG (Enbrel™) и p55TNFRIgG (Lenercept)), sIL-1RI, sIL-1RII, sIL-6R, растворимый рецептор IL-13 (sIL-13)) и противовоспалительные цитокины (например, IL-4, IL-10, IL-11, IL-13 и TGFβ). Другие комбинации включают метотрексат или лефлуномид и в случае ревматоидного артрита средней тяжести или тяжелого - циклоспорин.
Неограничивающие примеры терапевтических агентов против воспалительных заболеваний кишечника, с которыми можно комбинировать антитела или участки антител по изобретению, включают следующие соединения: буденозид, фактор роста эпидермиса, кортикостероиды, циклоспорин, сульфасалазин, аминосалицилаты, 6-меркаптопурин, азатиоприн, метронидазол, ингибиторы липоксигеназы, месаламин, олсалазин, балсалазид, антиоксиданты, ингибиторы тромбоксана, антагонисты рецептора IL-1, моноклональные антитела к IL-1α, моноклональные антитела к IL-6, факторы роста, ингибиторы эластазы, пиридинил-имидазольные соединения, антитела, полученные против, или антагонисты других цитокинов или факторов роста человека, например, TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF и PDGF. Антитела по изобретению или их антигенсвязывающие участки можно комбинировать с антителами к молекулам клеточной поверхности, таким как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD90, или их лигандами. Антитела по изобретению или их антигенсвязывающие участки также можно комбинировать с агентами, такими как метотрексат, циклоспорин, FK506, рапамицин, микофенолята мофетил, лефлуномид, НПВС, например, ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэстеразы, аденозиновые агонисты, антитромботические средства, ингибиторы системы комплемента, адренергетики, агенты, препятствующие прохождению сигнала от провоспалительных цитокинов, таких как TNFα или IL-1 (например, ингибиторы IRAK, NIK, IKK, p38 или MAP киназы), ингибиторы IL-lβ-конвертирующего фермента (например, Vx740), антитело к P7s, гликопротеиновый лиганд р-селектина (PSGL), ингибиторы TNFα-конвертирующего фермента, ингибиторы Т-клеточных сигнальных путей, такие как ингибиторы киназ, ингибиторы металлопротеиназ, сульфасалазин, азатиоприн, 6-меркаптопурины, ингибиторы ангиотензин-конвертирующего фермента, растворимые рецепторы цитокинов и их производные (например, растворимые р55- и р75-рецепторы TNF, sIL-1RI, sIL-1RII, sIL-6R, растворимый рецептор IL-13 (sIL-13)) и противовоспалительные цитокины (например, IL-4, IL-10, IL-11, IL-13 и TGFβ).
Примеры терапевтических агентов против болезни Крона, с которыми можно комбинировать антитело или антигенсвязывающий участок, включают следующие соединения: антагонисты TNF, например, антитела к TNF, D2E7 (патентная заявка США с серийным номером 08/599226, поданная 9 февраля 1996 года, полное содержание которой включено в настоящее описание путем ссылки), cA2 (Remicade™), CDP 571, фрагменты антител к TNF (например, CDP870), конструкции TNFR-Ig (p75TNFRIgG (Enbrel™) и p55TNFRIgG (Lenercept)), антитело к P7s, гликопротеиновый лиганд р-селектина (PSGL), растворимый рецептор IL-13 (sIL-13) и ингибиторы PDE4. Антитела по изобретению или их антигенсвязывающие участки можно комбинировать с кортикостероидами, например, буденозидом и дексаметазоном. Антитела по изобретению или их антигенсвязывающие участки также можно комбинировать с агентами, такими как сульфосалазин, 5-аминосалициловая кислота и олсалазин, и агентами, которые нарушают синтез или действие провоспалительных цитокинов, таких как IL-1, например, ингибиторы IL-1-конвертирующего фермента (например, Vx740) и IL-1ra. Антитела по изобретению или их антигенсвязывающие участки можно также использовать с ингибиторами Т-клеточных сигнальных путей, например, ингибиторами тирозиновых киназ, 6-меркаптопуринами. Антитела по изобретению или их антигенсвязывающие участки можно комбинировать с IL-11.
Неограничивающие примеры терапевтических агентов против рассеянного склероза, с которыми можно комбинировать антитела или участки антител по изобретению, включают следующие соединения: кортикостероиды, преднизолон, метилпреднизолон, азатиоприн, циклофосфамид, циклоспорин, метотрексат, 4-аминопиридин, тизанидин, IFNβ1a (Avonex; Biogen), IFNβ1b (Betaseron; Chiron/Berlex), Сополимер 1 (Сор-1; Copaxone; Teva Pharmaceutical Industries Inc.), гипербарический кислород, иммуноглобулин для внутривенного введения, кладрибин, антитела, полученные против или антагонисты других цитокинов или факторов роста человека, например, TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF и PDGF. Антитела по изобретению или их антигенсвязывающие участки можно комбинировать с антителами к молекулам клеточной поверхности, таким как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80, CD86, CD90, или их лигандами. Антитела по изобретению или их антигенсвязывающие участки также можно комбинировать с агентами, такими как метотрексат, циклоспорин, FK506, рапамицин, микофенолята мофетил, лефлуномид, НПВС, например, ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэстеразы, аденозиновые агонисты, антитромботические средства, ингибиторы системы комплемента, адренергетики, агенты, препятствующие прохождению сигнала от провоспалительных цитокинов, таких как TNFα или IL-1 (например, ингибиторы IRAK, NIK, IKK, p38 или MAP киназы), ингибиторы IL-lβ-конвертирующего фермента (например, Vx740), антитело к P7s, гликопротеиновый лиганд р-селектина (PSGL), ингибиторы TACE, ингибиторы Т-клеточных сигнальных путей, такие как ингибиторы киназ, ингибиторы металлопротеиназ, сульфасалазин, азатиоприн, 6-меркаптопурины, ингибиторы ангиотензин-конвертирующего фермента, растворимые рецепторы цитокинов и их производные (например, растворимые р55- и р75-рецепторы TNF, sIL-1RI, sIL-1RII, sIL-6R, растворимый рецептор IL-13 (sIL-13)) и противовоспалительные цитокины (например, IL-4, IL-10, IL-11, IL-13 и TGFβ).
Примеры терапевтических агентов против рассеянного склероза, с которыми можно комбинировать антитела или их антигенсвязывающие участки, включают IFNβ, например, IFNβla и IFNβ1b, копаксон, кортикостероиды, ингибиторы IL-1, ингибиторы TNF и антитела к лиганду CD40 и CD80.
Фармацевтические композиции по изобретению могут включать «терапевтически эффективное количество» или «профилактически эффективное количество» антитела или участка антитела по изобретению. «Терапевтически эффективное количество» относится к количеству, эффективному в дозах и в течение периодов времени, необходимых для достижения желаемого терапевтического результата. Терапевтически эффективное количество антитела или участка антитела может варьировать в соответствии с факторами, такими как состояние болезни, возраст, пол и вес субъекта, а также способность антитела или участка антитела вызывать желаемый ответ у индивидуума. Терапевтически эффективное количество также представляет собой количество, при котором любые токсические или вредные эффекты антитела или участка антитела перевешиваются терапевтически благоприятными эффектами. «Профилактически эффективное количество» относится к количеству, эффективному в дозах и в течение периодов времени, необходимых для достижения желаемого профилактического результата. Обычно, поскольку профилактическую дозу используют у субъектов до заболевания или на ранней его стадии, профилактически эффективное количество будет меньше терапевтически эффективного количества.
Схемы приема лекарственного средства можно подбирать для получения оптимального желаемого ответа (например, терапевтического или профилактического ответа). Например, можно вводить одну дозу болюсом, можно вводить несколько дробных доз в течение периода времени или дозу можно пропорционально снижать или повышать в зависимости от нужд терапевтической ситуации. В некоторых вариантах осуществления изобретения особенно предпочтительно составление парентеральных композиций в виде стандартной лекарственной формы для простоты введения и однообразия дозировки. Используемый в настоящем описании термин стандартная лекарственная форма относится к физически дискретным единицам, пригодным в качестве единичных доз для субъектов-млекопитающих, получающих лечение; каждая единица содержит определенное количество действующего соединения, рассчитанное для получения желаемого терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Характеристики стандартных лекарственных форм по изобретению диктуются и прямо зависят от (а) уникальных характеристик действующего соединения и определенного терапевтического или профилактического эффекта, который предполагается получить, и (б) ограничений, присущих способу изготовления лекарственных форм такого действующего соединения для лечения чувствительности у субъектов.
Примерный неограничивающий интервал для терапевтически или профилактически эффективного количества антитела или участка антитела по изобретению составляет 0,1-20 мг/кг, или 1-10 мг/кг, или 0,3-1 мг/кг. Следует отметить, что дозировка может варьировать в зависимости от типа и остроты состояния, требующего лечения. Кроме того, следует понимать, что для любого определенного субъекта конкретные схемы приема должны подбираться с течением времени в соответствии с нуждами субъекта и профессиональным суждением специалиста, который осуществляет введение или руководит введением композиций, и что приведенные в настоящем описании диапазоны дозировок являются только примерными и не предназначены для ограничения объема или применения заявленной композиции.
8. Применение антител по изобретению
8.1 Общие варианты применения антитела к IL-12
Вследствие своей способности связывать IL-12, антитела к IL-12 или их участки по изобретению можно использовать для детекции IL-12, в одном аспекте - hIL-12 (например, в образце культурального материала, в одном аспекте, в биологическом образце, таком как сыворотка или плазма), с помощью стандартного иммуноаналитического метода, такого как твердофазный иммуноферментный анализ (ELISA), радиоиммуноанализ (RIA) или иммуногистохимический анализ ткани. Изобретение относится к способу детекции IL-12 в биологическом образце, включающему контактирование образца с антителом или участком антитела по изобретению и детекцию либо антитела (или участка антитела), связанного с IL-12, либо несвязанного антитела (или участка антитела), для детекции таким путем IL-12 в образце. Антитело прямо или непрямо метят детектируемым веществом для облегчения детекции связанного или несвязанного антитела. Подходящие детектируемые вещества включают различные ферменты, простетические группы, флуоресцентные материалы, люминесцентные материалы и радиоактивные материалы. Примеры подходящих ферментов включают пероксидазу хрена, щелочную фосфатазу, β-галактозидазу или ацетилхолинэстеразу; примеры подходящих комплексов простетических групп включают стрептавидин/биотин и авидин/биотин; примеры подходящих флуоресцентных материалов включают умбеллиферон, флуоресцеин, изотиоцианат флуоресцеина, родамин, дихлортриазиниламинофлуоресцеин, дансилхлорид или фикоэритрин; пример люминесцентного материала включает люминол; а примеры подходящих радиоактивных материалов включают 125I, 131I, 35S или 3H. Детекция IL-12 может применяться в диагностике, например, в диагностике состояний, ассоциированных с увеличенным уровнем IL-12, и/или может применяться для идентификации субъекта, в отношении которого лечение антителом к IL-12 может оказать благоприятный эффект.
В качестве альтернативы мечению антитела анализ IL-12 в образце можно осуществлять с помощью конкурентного иммуноанализа, в котором используют стандарты rhIL-12, меченные детектируемым веществом, и немеченые антитела против IL-12, такие как антитело к hIL-12. В данном анализе объединяют образец, меченые стандарты rhIL-12 и антитело к hIL-12 и определяют количество меченого стандарта rhIL-12, связанного с немеченым антителом. Количество hIL-12 в образце обратно пропорционально количеству меченого стандарта rhIL-12, связанного с антителом к hIL-12.
Антитела или участки антител по изобретению способны нейтрализовать активность IL-12 in vitro и in vivo, в одном аспекте активность hIL-12. Соответственно, антитела или участки антител по изобретению можно использовать для ингибирования активности IL-12, например, в культуре клеток, содержащей hIL-12, y человека или других млекопитающих, имеющих IL-12, с которыми антитела по изобретению имеют перекрестную реактивность (например, приматов, таких как павиан, яванский макак и макак резус). В одном аспекте изобретение относится к выделенному антителу человека или его антигенсвязывающему участку, которое нейтрализует активность IL-12 человека и, по меньшей мере, одного дополнительного IL-12 приматов, выбранных из группы, состоящей из IL-12 павиана, IL-12 игрунки, IL-12 шимпанзе, IL-12 яванского макака и IL-12 макака резус, но не нейтрализует активность IL-12 мыши. В одном аспекте IL-12 представляет собой IL-12 человека. Например, антитело или участок антитела по изобретению можно добавить в культуральную среду в культуре клеток, содержащих или предположительно содержащих IL-12, для ингибирования активности IL-12 в культуре.
В другом аспекте изобретение относится к способу ингибирования активности IL-12 y субъекта, страдающего от расстройства, при котором активность IL-12 наносит ущерб. IL-12 вовлечен в патофизиологию широкого спектра расстройств (Windhagen et al, (1995) J. Exp. Med. 182:1985-1996; Morita et al. (1998) Arthritis and Rheumatism. 41:306-314; Bucht et al., (1996) Clin. Exp. Immunol. 103:347-367; Fais et al. (1994) J. Interferon Res. 14:235-238; Pyrronchi et al., (1997) Am. J. Path. 150:823-832; Monteleone et al., (1997) Gastroenterology. 112:1169-1178; и Berrebi et al., (1998) Am. J. Path 152:667-672; Pyrronchi et al. (1997) Am. J. Path. 150:823-832; полное содержание которых включено в настоящее описание путем ссылки). Изобретение относится к способам ингибирования активности IL-12 у субъекта, страдающего от такого расстройства, причем способ включает введение субъекту антитела или участка антитела по изобретению, так что ингибируется активность IL-12 у субъекта. В одном аспекте IL-12 представляет собой IL-12 человека, а субъектом является человек. В качестве альтернативы субъектом может быть млекопитающее, имеющее экспрессию IL-12, с которым антитело по изобретению перекрестно реактивно. Помимо того, субъект может представлять собой млекопитающее с введенным hIL-12 (например, в результате введения hIL-12 или экспрессии трансгенного hIL-12). Антитело по изобретению можно вводить человеку для терапевтических целей. Более того, антитело по изобретению можно вводить млекопитающему животному, имеющему экспрессию IL-12, с которым антитело перекрестно реактивно, для ветеринарных целей или как животной модели болезни человека. Относительно последнего такие животные модели можно использовать для оценки терапевтической эффективности антител по изобретению (например, для тестирования доз и динамики при введении).
Предполагается, что используемый в настоящем описании термин «расстройство, при котором активность IL-12 наносит ущерб», включает заболевания и другие расстройства, для которых было показано, что присутствие IL-12 у субъекта, страдающего от расстройства, отвечает или предположительно отвечает за патофизиологию расстройства или является фактором, усугубляющим расстройство. Соответственно, расстройство, при котором активность IL-12 наносит ущерб, представляет собой расстройство, при котором ожидается, что ингибирование активности IL-12 уменьшает симптомы и/или замедляет развитие расстройства. Такие расстройства могут быть обнаружены, например, по повышению концентрации IL-12 в биологической жидкости субъекта, страдающего от расстройства (например, по повышению концентрации IL-12 в сыворотке, плазме, синовиальной жидкости и т.п. субъекта), которое можно определить, например, с помощью антитела к IL-12, как описано выше. Существует множество примеров расстройств, при которых активность IL-12 наносит ущерб. В одном аспекте антитела или их антигенсвязывающие участки можно использовать в терапии для лечения заболеваний или расстройств, описанных в настоящем документе. В другом аспекте антитела или их антигенсвязывающие участки можно использовать для изготовления лекарственного препарата для лечения заболеваний или расстройств, описанных в настоящем документе. Применение антител и участков антител по изобретению в лечении нескольких неограничивающих конкретных расстройств ниже обсуждается более подробно.
Интерлейкин 12 играет критическую роль в патологии, ассоциированной с рядом заболеваний, включающих иммунные и воспалительные элементы. Эти заболевания включают, но не ограничены этим, ревматоидный артрит, остеоартрит, ювенильный артрит, артрит Лайма, псориатический артрит, реактивный артрит, спондилоартропатию, системный волчаночный эритематоз, болезнь Крона, язвенный колит, воспалительное заболевание кишечника, инсулинозависимый сахарный диабет, тироидит, астму, аллергические заболевания, псориаз, дерматит склеродермы, атопический дерматит, болезнь «трансплантат против хозяина», отторжение трансплантата органов, острое или хроническое иммунное заболевание, ассоциированное с трансплантацией органов, саркоидоз, атеросклероз, диссеминированную внутрисосудистую коагуляцию, болезнь Кавасаки, болезнь Грейва, нефротический синдром, синдром хронической усталости, гранулематоз Вегенера, пурпуру Геноха-Шенлейна, микроваскулит почек, хронический активный гепатит, увеит, септический шок, синдром токсического шока, септический синдром, кахексию, инфекционные заболевания, паразитарные заболевания, синдром приобретенного иммунодефицита, острый поперечный миелит, хорею Хантингтона, болезнь Паркинсона, болезнь Альцгеймера, инсульт, первичный билиарный цирроз, гемолитическую анемию, злокачественные новообразования, сердечную недостаточность, инфаркт миокарда, болезнь Аддисона, спорадическую полигландулярную недостаточность I типа и полигландулярную недостаточность II типа, синдром Шмидта, синдром (острой) дыхательной недостаточности у взрослых, алопецию, гнездовую алопецию, серонегативную артропатию, артропатию, болезнь Рейтера, псориатическую артропатию, артропатию при язвенном колите, энтеропатический синовит, артропатию, ассоциированную с хламидиозом, иерсиниозом и сальмонеллезом, спондилоартропатию, атероматозную болезнь/атеросклероз, атопическую аллергию, аутоиммунное буллезное заболевание, обыкновенную пузырчатку, эксфолиативную пузырчатку, пемфигоид, линейный IgA зависимый буллезный дерматоз, аутоиммунную гемолитическую анемию, гемолитическую анемию с положительной реакцией Кумбса, приобретенную пернициозную анемию, ювенильную пернициозную анемию, миалгический энцефалит/синдром хронической усталости, хронический мукокожный кандидоз, гигантоклеточный артериит, первичный склерозирующий гепатит, криптогенный аутоиммунный гепатит, синдром приобретенного иммунодефицита, заболевания, связанные с приобретенным иммунодефицитом, гепатит С, общий вариабельный иммунодефицит (общую вариабельную гипогаммаглобулинемию), дилатационную кардиомиопатию, женское бесплодие, угасание функции яичников, преждевременное угасание функции яичников, фиброз легких, криптогенный фиброзный альвеолит, поствоспалительную интерстициальную болезнь легких, интерстициальную пневмонию, интерстициальную болезнь легких, ассоциированную с заболеванием соединительной ткани, болезнь легких, ассоциированную со смешанным заболеванием соединительной ткани, интерстициальную болезнь легких, ассоциированную с системным склерозом, интерстициальную болезнь легких, ассоциированную с ревматоидным артритом, болезнь легких, ассоциированную с системным волчаночным эритематозом, болезнь легких, ассоциированную с дерматомиозитом/полимиозитом, болезнь легких, ассоциированную с болезнью Шегрена, болезнь легких, ассоциированную с анкилозирующим спондилитом, диффузную болезнь легких при васкулите, болезнь легких, ассоциированную с гемосидерозом, интерстициальную болезнь легких, вызываемую лекарственными соединениями, радиационный фиброз, облитерирующий бронхиолит, хроническую эозинофильную пневмонию, лимфоцитарную инфильтрирующую болезнь легких, постинфекционную интерстициальную болезнь легких, подагрический артрит, аутоиммунный гепатит, аутоиммунный гепатит 1-го типа (классический аутоиммунный или волчаночный гепатит), аутоиммунный гепатит 2-го типа (гепатит с антителами к печеночно-почечным микросомам (LKM)), аутоиммунную гипогликемию, инсулинорезистентность типа В с acanthosis nigricans, гипопаратироидизм, острое иммунологическое заболевание, ассоциированное с трансплантацией органов, хроническое иммунологическое заболевание, ассоциированное с трансплантацией органов, остеоартроз, первичный склерозирующий холангит, идиопатическую лейкопению, аутоиммунную нейтропению, болезнь почек NOS, гломерулонефрит, микроваскулит почек, болезнь Лайма, дискоидный волчаночный эритематоз, мужское бесплодие, идиопатическое или NOS, аутоиммунную реакцию на сперму, рассеянный склероз (все подтипы), инсулинозависимый сахарный диабет, симпатическую офтальмию, легочную гипертонию, вторичную к заболеванию соединительной ткани, синдром Гудпасчера, легочную манифестацию узелкового полиартериита, острую ревматическую лихорадку, ревматоидный спондилит, болезнь Стилла, системный склероз, болезнь Такаясу/артериит, аутоиммунную тромбоцитопению, идиопатическую тромбоцитопению, аутоиммунное заболевание щитовидной железы, гипертиреоидизм, аутоиммунный тиреоидит (болезнь Хашимото), атрофический аутоиммунный гипотиреоидизм, первичную микседему, факогенный увеит, первичный васкулит и витилиго. Антитела человека и участки антител по изобретению можно использовать для лечения аутоиммунных заболеваний, в частности, ассоциированных с воспалением, включая ревматоидный спондилит, аллергию, аутоиммунный диабет и аутоиммунный увеит.
В некоторых аспектах антитела по изобретению или их антигенсвязывающие участки используют для лечения ревматоидного артрита, болезни Крона, рассеянного склероза, инсулинозависимого сахарного диабета и псориаза.
8.2 Применение антител к IL-12 при ревматоидном артрите
Предполагается, что интерлейкин-12 играет роль в воспалительных заболеваниях, таких как ревматоидный артрит. У пациентов с ревматоидным артритом в синовии детектируется индуцируемая мРНК IL-12p40, и было показано, что IL-12 присутствует в синовиальной жидкости пациентов с ревматоидным артритом (смотри, например, Morita et al, (1998) Arthritis and Rheumatism 41: 306-314, полное содержание которой включено в настоящее описание путем ссылки). Было найдено, что IL-12-положительные клетки присутствуют в подлежащем слое синовия пациентов с ревматоидным артритом. Антитела человека и участки антител по изобретению можно использовать для лечения, например, ревматоидного артрита, ювенильного ревматоидного артрита, артрита Лайма, ревматоидного спондилита, остеоартрита и подагрического артрита. Обычно антитело или участок антитела вводят системно, хотя в случае некоторых расстройств может быть выгодно местное введение антитела или участка антитела. Антитело или участок антитела по изобретению также можно вводить совместно с одним или несколькими дополнительными терапевтическими агентами, пригодными для лечения аутоиммунных заболеваний.
В случае мышиной модели ревматоидного артрита, индуцируемого коллагеном артрита (CIA), лечение мышей антителами к IL-12 (крысиными моноклональными антителами к мышиному IL-12, C17.15) до артрита значительно подавляло его возникновение и снижало частоту возникновения и тяжесть протекания заболевания. Лечение моноклональными антителами к IL-12 после начала артрита снижало тяжесть его течения, но более позднее лечение мышей моноклональными антителами к IL-12 после начала заболевания оказывало минимальный эффект на тяжесть заболевания.
8.3 Применение антител к IL-12 при болезни Крона
Интерлейкин-12 также играет роль в воспалительной болезни кишечника, болезни Крона. Повышенная экспрессия IFN-γ и IL-12 наблюдается в слизистой кишечника пациентов с болезнью Крона (см., например, Fais et al., (1994) J. Interferon Res. 14:235-238; Pyrronchi et al., (1997) Amer. J. Pathol. 150:823-832; Monteleone et al., (1997) Gastroenterology 112:1169-1178; Berrebi et al., (1998) Amer. J. Pathol. 152:667-672, полное содержание которых включено в настоящее описание путем ссылки). Было показано, что антитела к IL-12 подавляют заболевание в мышиной модели колита, например, индуцируемого TNBS колита у мышей, нокаутных по IL-2, и недавно это было показано для мышей, нокаутных по IL-10. Соответственно, антитела и участки антител по изобретению можно использовать для лечения воспалительных болезней кишечника.
8.4 Применение антител к IL-12 при рассеянном склерозе
Интерлейкин-12 является ключевым медиатором при рассеянном склерозе. Экспрессию индуцируемой мРНК IL-12p40 или самого IL-12 можно наблюдать в очагах склероза у пациентов с рассеянным склерозом (Windhagen et al., (1995) J. Exp. Med 182:1985-1996, Drulovic et al., (1997) J. Neurol. Sci. 147:145-150, полное содержание которых включено в настоящее описание путем ссылки). Хронические пациенты с прогрессирующим рассеянным склерозом имеют повышенный уровень IL-12 в кровотоке. Исследования Т-клеток и антигенпредставляющих клеток (АРС) у пациентов с рассеянным склерозом выявили самоподдерживающиеся серии иммунных реакций в качестве причины прогрессирующего рассеянного склероза, приводящей к иммунному ответу Th1-типа. Повышенная секреция IFN-γ из Т-клеток приводит к увеличению продукции IL-12 антигенпредставляющими клетками, который поддерживает цикл, приводя к хронической активации Th1-типа иммунного ответа и заболеванию (Balashov et al., (1997) Proc. Natl. Acad. Sci. 94:599-603, полное содержание которой включено в настоящее описание путем ссылки). Роль IL-12 в рассеянном склерозе исследовали с использованием экспериментальных моделей рассеянного склероза на мышах и крысах (аллергического энцефаломиелита (ЕАЕ) мышей и крыс). В возвратно-ремиттирующей ЕАЕ-модели множественного склероза у мышей предварительное лечение моноклональными антителами к IL-12 откладывало паралич и улучшало клинические показатели. Лечение моноклональными антителами к IL-12 на пике паралича или в течение последующего периода ремиссии улучшало клинические показатели. Соответственно, антитела или их антигенсвязывающие участки по изобретению могут служить для ослабления симптомов, ассоциированных с рассеянным склерозом, у людей.
8.5 Применение антител к IL-12 при инсулинозависимом сахарном диабете
Интерлейкин-12 вовлечен в качестве важного медиатора инсулинозависимого сахарного диабета (ИЗСД). ИЗСД индуцировали у NOD-мышей (диабетических без ожирения) путем введения IL-12, а антитела к IL-12 служили защитой в адоптивной трансферной модели ИЗСД. При начале ИЗСД у пациентов часто наблюдается так называемый «период медового месяца» (клиническая ремиссия), в течение которого сохраняется функция некоторых остаточных островковых клеток. Эти остаточные островковые клетки продуцируют инсулин и регулируют уровень глюкозы в крови лучше вводимого инсулина. Лечение таких пациентов на ранней стадии диабета с помощью антитела к IL-12 может предупредить дальнейшее разрушение островковых клеток, таким образом сохраняя эндогенный источник инсулина.
8.6 Применение антител к IL-12 при псориазе
Интерлейкин-12 является ключевым медиатором псориаза. Псориаз представляет собой острое и хроническое поражение кожи, которое ассоциировано с TH1-типом профиля экспрессии цитокинов. (Hamid et al. (1996) J. Allergy Clin. Immunol. 1:225-231; Turka et al. (1995) Mol. Med. 1690-699, полное содержание которых включено в настоящее описание путем ссылки). мРНК IL-12p35 и IL-12p40 детектировали в образцах кожи людей, больных псориазом. Соответственно, антитела или их антигенсвязывающие участки по изобретению могут служить для лечения хронических заболеваний кожи, таких как псориаз.
8.7 Общие варианты применения антител к IL-18
Благодаря их способности связывать IL-18, антитела к IL-18 или их участки по изобретению можно использовать для детекции IL-18, в одном аспекте - hIL-18 (например, в образце культурального материала, в одном аспекте, в биологическом образце, таком как сыворотка или плазма), с помощью стандартного иммуноаналитического метода, такого как твердофазный иммуноферментный анализ (ELISA), радиоиммуноанализ (RIA) или иммуногистохимический анализ ткани. Изобретение относится к способу детекции IL-18 в биологическом образце, включающему контактирование образца с антителом или участком антитела по изобретению и детекцию либо антитела (или участка антитела), связанного с IL-18, либо несвязанного антитела (или участка антитела), для детекции таким путем IL-18 в образце. Антитело прямо или непрямо метят детектируемым веществом для облегчения детекции связанного или несвязанного антитела. Подходящие детектируемые вещества включают различные ферменты, простетические группы, флуоресцентные материалы, люминесцентные материалы и радиоактивные материалы. Примеры подходящих ферментов включают пероксидазу хрена, щелочную фосфатазу, β-галактозидазу или ацетилхолинэстеразу; примеры подходящих комплексов простетических групп включают стрептавидин/биотин и авидин/биотин; примеры подходящих флуоресцентных материалов включают умбеллиферон, флуоресцеин, изотиоцианат флуоресцеина, родамин, дихлортриазиниламинофлуоресцеин, дансилхлорид или фикоэритрин; пример люминесцентного материала включает люминол; а примеры подходящих радиоактивных материалов включают 125I, 131I, 35S или 3H. Детекция IL-18 может быть полезна в диагностике, например, для диагностики состояний, ассоциированных с увеличенным уровнем IL-18, и/или может быть полезной для идентификации субъекта, на которого лечение антителом к IL-18 может оказать благоприятный эффект.
В качестве альтернативы мечению антитела анализ IL-18 в образце можно осуществлять с помощью конкурентного иммуноанализа, в котором используют стандарты rhIL-18, меченные детектируемым веществом, и немеченые антитела к IL-18, такие как антитело к hIL-18. В данном анализе объединяют образец, меченые стандарты rhIL-18 и антитело к hIL-18 и определяют количество меченого стандарта rhIL-18, связанного с немеченым антителом. Количество hIL-18 в образце обратно пропорционально количеству меченого стандарта rhIL-18, связанного с антителом к hIL-18.
Антитела или участки антител по изобретению способны нейтрализовать активность IL-18 in vitro и in vivo, в одном аспекте активность hIL-18. Соответственно, антитела или участки антител по изобретению можно использовать для ингибирования активности IL-18, например, в культуре клеток, содержащей hIL-18, y человека или других млекопитающих, имеющих IL-18, с которыми антитела по изобретению имеют перекрестную реактивность (например, приматов, таких как павиан, яванский макак и макак резус). В одном аспекте изобретение относится к выделенному антителу человека или его антигенсвязывающему участку, которое нейтрализует активность IL-18 человека и, по меньшей мере, одного дополнительного IL-18 приматов, выбранных из группы, состоящей из IL-18 павиана, IL-18 игрунки, IL-18 шимпанзе, IL-18 яванского макака и IL-18 макака резус, но не нейтрализует активность IL-18 мыши. В одном аспекте IL-18 представляет собой IL-18 человека. Например, антитело или участок антитела по изобретению можно добавить в культуральную среду культуры клеток, содержащих или предположительно содержащих IL-18, для ингибирования активности IL-18 в культуре.
В другом аспекте изобретение относится к способу ингибирования активности IL-18 y субъекта, страдающего от расстройства, при котором активность IL-18 наносит ущерб. Интерлейкин 18 играет критическую роль в патологии, ассоциированной с множеством заболеваний, включающих иммунные и воспалительные элементы.
Предполагается, что используемый в настоящем описании термин «расстройство, при котором активность IL-18 наносит ущерб» включает заболевания и другие расстройства, для которых было показано, что присутствие IL-18 у субъекта, страдающего от расстройства, отвечает или предположительно отвечает за патофизиологию расстройства, или является фактором, усугубляющим расстройство. Соответственно, расстройство, при котором активность IL-18 наносит ущерб, представляет собой расстройство, при котором ожидается, что ингибирование активности IL-18 уменьшает симптомы и/или замедляет развитие расстройства. Такие расстройства могут быть обнаружены, например, по повышению концентрации IL-18 в биологической жидкости субъекта, страдающего от расстройства (например, по повышению концентрации IL-18 в сыворотке, плазме, синовиальной жидкости и т.п. субъекта), которое можно определить, например, с помощью антитела к IL-18, как описано выше. Существует множество примеров расстройств, при которых активность IL-18 наносит ущерб. В одном аспекте антитела или их антигенсвязывающие участки можно использовать в терапии для лечения заболеваний или расстройств, описанных в настоящем документе. В другом аспекте антитела или их антигенсвязывающие участки можно использовать для изготовления лекарственного препарата для лечения заболеваний или расстройств, описанных в настоящем документе. Применение антител и участков антител по изобретению в лечении нескольких неограничивающих конкретных расстройств обсуждается более подробно ниже.
Изобретение относится к фармацевтическим композициям для лечения заболеваний или состояний, которые требуют модулирования активности IL-18. Эти заболевания или состояния включают аутоиммунные заболевания, диабет I типа, ревматоидный артрит, отторжение трансплантата, воспалительное заболевание кишечника, сепсис, рассеянный склероз, ишемическую болезнь сердца (включая сердечные приступы), ишемическое поражение мозга, хронический гепатит, псориаз, хронический панкреатит, острый панкреатит и т.п.
Соответственно, целесообразно использовать антитела к IL-18, или их антигенсвязывающие участки, или векторы, экспрессирующие их in vivo, для лечения аутоиммунных заболеваний, диабета I типа, ревматоидного артрита, отторжения трансплантата, воспалительного заболевания кишечника, сепсиса, рассеянного склероза, ишемической болезни сердца (включая сердечные приступы), ишемического поражения мозга, хронического гепатита, псориаза, хронического панкреатита, острого панкреатита и аналогичных заболеваний, которые отличаются нарушенной экспрессией IL-18, приводящей к избытку IL-18, или в случае осложнений вследствие экзогенно введенного IL-18.
8.8 Применение антител к IL-18 при поражении печени
Один аспект настоящего изобретения относится к новым средствам лечения и/или предупреждения поражения печени. Было найдено, что ингибитор IL-18 является эффективным для предупреждения и лечения поражений печени. Поэтому изобретение также относится к применению ингибитора IL-18 для изготовления лекарственного препарата для лечения и/или предупреждения поражения печени. Более конкретно изобретение относится к лечению и/или предупреждению поражений печени, вызванных алкогольным гепатитом, вирусным гепатитом, иммунным гепатитом, фульминантным гепатитом, циррозом печени и первичным билиарным циррозом.
8.9 Применение антител к IL-18 при артрите
Также по настоящему изобретению было найдено, что ингибитор IL-18 эффективен в терапии артрита. Терапевтический эффект включает снижение тяжести течения заболевания, а также предупреждение распространения заболевания. Поэтому изобретение относится к использованию ингибитора IL-18 для лечения и/или предупреждения артрита. Это открытие было неожиданным, поскольку из приведенного выше состояния уровня техники нельзя было заключить, что блокировка одного конкретного фактора, вовлеченного в артрит, а именно интерлейкина 18, приведет к ослаблению артрита или даже к излечению пораженного артритом сустава.
Термин «артрит» включает все различные типы артрита и артритических состояний, как острого, так и хронического артрита, определенных, например, на посвященной артриту странице в интернете кафедры ортопедии Университета Вашингтона. Примерами артритических состояний являются анкилозирующий спондилит, боль в спине, синдром карпального канала, синдром Элерса-Данлоса, подагра, ювенильный артрит, волчаночный эритематоз, миозит, неполный остеогенез, остеопороз, полиартериит, полимиозит, псориатический артрит, синдром Рейтера, склеродермия, артрит с заболеванием кишечника, болезнь Бехчета, детский артрит, дегенеративное заболевание суставов, фибромиалгия, инфекционный артрит, болезнь Лайма, синдром Марфана, остеоартрит, остеонекроз, болезнь Пагета, ревматическая полимиалгия, псевдоподагра, рефлекторная симпатическая дистрофия, ревматоидный артрит, ревматизм, синдром Шегрена, семейный аденоматозный полипоз и т.п.
Ревматоидный артрит вызывает воспаление выстилки суставов (синовиальной мембраны, одноклеточного слоя эпителия) и/или внутренних органов. Болезнь сохраняется в течение многих лет, обычно затрагивая ряд различных суставов по всему телу и в итоге вызывая поражение хряща, костей, сухожилий и связок. Суставами, которые могут быть затронуты ревматоидным артритом, являются, например, суставы, расположенные в шее, плечах, локтях, бедрах, запястьях, руках, коленях, щиколотках и ступнях. Во многих случаях при ревматоидном артрите воспаляются симметричные суставы.
Ревматоидный артрит встречается у примерно 1% из популяции в Соединенных Штатах, будучи распространенным среди всех этнических групп и возрастов. Во всем мире число женщин с ревматоидным артритом превышает число мужчин в три раза.
Было найдено, что введение ингибитора IL-18 значительно снижает эрозию хряща в мышиной модели артрита. Поэтому настоящее изобретение также относится к использованию ингибитора IL-18 в изготовлении лекарственного препарата для лечения и/или предупреждения разрушения хряща.
8.10 Общие варианты применения антитела к TNFα антител
Фактор некроза опухолей-α представляет собой многофункциональный провоспалительный цитокин, секретируемый в основном моноцитами/макрофагами, который оказывает эффект на липидный метаболизм, коагуляцию, инсулинорезистентность и функции эндотелия. TNFα является растворимым гомотримером белковых субъединиц весом 17 кДа. Также существует мембранносвязанный предшественних TNFα с молекулярным весом 26 кДа. Он обнаруживается в синовиальных клетках и макрофагах в тканях. Клетки помимо моноцитов или макрофагов также продуцируют TNFα. Например немоноцитарные опухолевые клеточные линии человека продуцируют TNFα, а также CD4+ и CD8+ Т-лимфоциты периферической крови и некоторые культивируемые Т- и В-клеточные линии продуцируют TNFα. Он вовлечен в развитие ревматоидного артрита (но не только его) и появляется при многих воспалительных заболеваниях. Рецепторы TNFα присутствуют на нескольких мононуклеарных клетках, в синовиальной мембране, а также на клетках периферической крови и в синовиальной жидкости. TNFα представляет собой критический воспалительный медиатор при ревматоидном артрите и поэтому может являться подходящей мишенью для специфичной иммунотерапии.
TNFα вызывает провоспалительное действие, которое приводит к поражению тканей, такому как разрушение хряща и кости, индукция молекул адгезии, индукция прокоагулирующей активности клеток васкулярного эндотелия, усиление прикрепления нейтрофилов и лимфоцитов и стимуляция высвобождения фактора активации тромбоцитов макрофагами, нейтрофилами и клетками васкулярного эндотелия. По последним данным TNFα ассоциирован с инфекциями, иммунологическими расстройствами, неопластическими патологиями, аутоиммунными патологиями и патологиями, связанными с реакцией «трансплантат против хозяина».
Полагают, что TNFα играет центральную роль в сепсисе и эндотоксиновом шоке, вызываемом грамотрицательными бактериями, включая лихорадку, недомогание, анорексию и кахексию. Эндотоксин сильно активирует продукцию и секрецию TNFα и других цитокинов моноцитами/макрофагами. TNFα и другие моноцитарные цитокины опосредуют метаболические и нейрогормональные ответы на эндотоксин. Введение эндотоксина добровольцам приводило к острому заболеванию с гриппоподобными симптомами, включая лихорадку, тахикардию, ускорение метаболизма и высвобождение стрессовых гормонов. TNFα повышен в кровотоке у пациентов, страдающих от сепсиса, вызванного грамотрицательными бактериями.
Таким образом, TNFα вовлечен в воспалительные заболевания, аутоиммунные заболевания, вирусные, бактериальные и паразитарные инфекции, злокачественные новообразования и/или нейродегенеративные заболевания и представляет собой подходящую мишень для специфической биологической терапии при заболеваниях, таких как ревматоидный артрит и болезнь Крона. Были опубликованы благоприятные эффекты при открытых исследованиях с химерным моноклональным антителом к TNFα совместно с подавлением воспаления и с успешным повторным лечением после возврата ревматоидного артрита и болезни Крона.
Было показано, что у млекопитающих нейтрализующая антисыворотка или моноклональные антитела к TNFα отменяют негативные физиологические изменения и предупреждают смертельный исход после летального воздействия в экспериментальной эндотоксемии и бактеремии. Адалимумаб (также известный под своей торговой маркой, HUMIRA®, доступной от Abbott Laboratories) представляет собой рекомбинантное моноклональное антитело человека, специфичное к TNFα. Это моноклональное антитело связывает TNFα и блокирует его взаимодействие с p55 и p75 рецепторами TNFα на клеточной поверхности. Это моноклональное антитело весьма специфично к TNFα и, по-видимому, не ингибирует активность TNFβ. В присутствии системы комплемента Ализирует поверхность клеток, экспрессирующих TNFα.
ПРИМЕРЫ
1. Выделение и очистка антител к IL-12
1.1 Стратегия очистки
После завершения продукции антител к IL-12 в культуре клеток рН среды медленно подводили до 3,5 и оставляли при таком рН в течение 1 часа, затем рН подводили до 5 и центрифугировали (при 11000×g) для удаления клеток и осажденных примесей. Супернатант после центрифугирования дополнительно осветляли на двухступенчатом наборе фильтров Cuno 90ZA с последующей фильтрацией через фильтр 0,45/0,2 мкм). После осветления осуществляли захват и дополнительную очистку антитела в процедуре из пяти стадий.
Перед хроматографией рН осветленного подкисленного клеточного культурального продукта титровали до 7 с помощью 3 н. NaOH в течение 30 минут и фильтровали.
Для экспериментального масштаба использовали колонку диаметром примерно 1,0 см и длиной примерно 21,6 см (объем слоя составляет примерно 17 мл). Колонку диаметром примерно 1,0 см и длиной примерно 15,1 см (объем слоя составляет примерно 11,9 мл) использовали ранее для получения материала для разработки системы очистки высокой степени. Колонку диаметром примерно 20 см и длиной примерно 21 см (объем слоя составляет примерно 6,6 л) использовали для объема продукта 300 л. Колонки набивали смолой MabSelect™ (GE Healthcare, кат. № 17-5199-04, № партии 302070); измеряли асимметрию пика и высоту, эквивалентную теоретической тарелке (ВЭТТ), для определения качества набивки колонки.
Колонку уравновешивали буфером: 25 мМ Tris, 100 мМ NaCl, pH 7,2. После уравновешивания на колонку наносили осветленный клеточный культуральный продукт (v=300 см/ч для начального нанесения до 35 г антитела на л смолы, затем 150 см/ч до конца нанесения, 40 г/л максимум). Затем колонку промывали 3 объемами колонки (CV) буфера для уравновешивания (v=300 см/ч), затем 3 CV буфера (20 мМ лимонной кислоты/цитрата натрия, 0,5 M NaCl, pH 6), после чего промывали дополнительными 3 CV буфера для уравновешивания. Продукт элюировали 0,1 М уксусной кислоты, 100 мМ NaCl, pH 3,5 (v=300 см/ч). Элюат с колонки собирали, начиная с первоначального подъема до 0,1 AU при А280 до 0,1 AU в выходящем хвосте элюируемого пика (проточная кювета с длиной оптического пути 2 мм), и немедленно титровали до рН 5 буфером 1,0 M Tris, pH 10.
Динамическую обменную емкость (ДОЕ) для колонки MabSelect™ можно определить либо нагружением при единой скорости потока, либо нагружением при двух скоростях потока. Нагружение при единой скорости оценивали при скорости примерно 300 см/ч в течение всего периода нагружения. Нагружение при двух скоростях потока проводили, нагружая колонку до примерно 35 мг белка на мл смолы при линейной скорости примерно 300 см/ч, затем снижая линейную скорость наполовину, что дает более большее время удерживания для последней части нагрузки. В каждом эксперименте колонку перегружали для гарантии насыщения колонки в данных условиях нагрузки. Проскок для каждого прогона фракционировали для того, чтобы определить общее количество нагруженного антитела до момента детекции 5% антитела в проскоке. Титры фракций проскока (FT) были получены ВЭЖХ-анализом на колонке Poros A™.
Для элюируемых образцов выход вычисляли с помощью УФ-спектрофотометрии при 280 нм (коэффициент экстинкции составляет 1,42 для раствора 1 мг/мл с использованием кюветы с длиной оптического пути 1 см). Титры нагрузки определяли ВЭЖХ-анализом на колонке Poros A™. Для оценки чистоты, степени удаления БКХ и вымываемого белка А проводили эксклюзионную ВЭЖХ, БКХ-ELISA и на основе белка A ELISA.
Элюат после смолы MabSelect™ титровали до pH 8±0,1 с помощью Tris-буфера, 1 M, pH 10 и затем разводили водой до 6,5±0,5 мСм/см. Разведенный материал перемешивали в течение одного часа, а затем фильтровали через фильтр для удаления липидов (Cuno™) и фильтр 0,45/0,2 мкм.
Для проточной хроматографии на колонке Q Sepharose™ в экспериментальном масштабе использовали колонку диаметром примерно 1,0 см и длиной примерно 29 см (объем слоя - 22,8 мл). Колонку диаметром примерно 20 см и длиной примерно 29,5 см (объем слоя составляет 9,27 л) использовали для масштаба 300 л. Колонки набивали смолой Q Sepharose™ FF (GE Healthcare, кат. № 17-0510-04, № партии 296307 для масштаба 300 л, № партии 303189 для экспериментального масштаба); измеряли асимметрию пика и ВЭТТ для определения качества набивки колонки.
Смолу уравновешивали буфером 25 мМ Tris, 50 мМ NaCl, pH 8. Хроматографию проводили в режиме проскока, при котором примеси адсорбируются на смоле, а антитела проходят сквозь колонку. Нанесение на колонку проводили на скорости 150 см/ч, а сбор проскока (FTW) начинали, когда A280 превышала 0,2 AU. Образцы FTW отбирались через интервалы, соответствующие нанесению 30, 50, 80, 90 и 100 г белка на л смолы. Затем колонку промывали буфером для уравновешивания и продолжали сбор FTW до возвращения A280 до оптической плотности (OD) 0,2 AU. FTW после колонки Q Sepharose™ немедленно разбавляли равным объемом 1,7 M (NH4)2SO4, 50 мМ фосфата натрия, pH 7 (SR-343) для подготовки к нанесению на колонку Phenyl Sepharose™ HP. Этот раствор фильтровали через фильтр 0,2 мкм и маркировали «нанос на колонку Phenyl Sepharose™ HP».
Выход вычисляли с помощью УФ-спектрофотометрии при 280 нм (коэффициент экстинкции составляет 1,42 для раствора 1 мг/мл с использованием кюветы с длиной оптического пути 1 см). Для оценки чистоты, степени удаления БКХ и вымываемого белка А проводили эксклюзионную ВЭЖХ, БКХ-ELISA и ELISA на основе белка А.
Для высокоэффективной хроматографии на колонке Phenyl Sepharose™ HP в экспериментальном масштабе использовали колонку диаметром примерно 1,0 см и длиной примерно 15,6 см (объем слоя - 12,3 мл). Колонку диаметром примерно 20 см и длиной примерно 15,5 см (объем слоя составляет 4,87 л) использовали для масштаба 300 л. Колонки набивали смолой Phenyl Sepharose™ HP (GE Healthcare, Piscatway, NJ, кат. № 17-1082-04, № партии 298138); измеряли асимметрию пика и ВЭТТ для определения качества набивки колонки.
Смолу уравновешивали в 25 мМ фосфата натрия, 0,85 M сульфата аммония, pH 7. Максимальная нагрузка по белку на этой стадии была ≥40 г белка на литр смолы (v=75 см/ч). После наноса колонку промывали 3 объемами колонки 20 мМ фосфата натрия, 1,1 M (NH4)2SO4, pH 7 (SR-290). Продукт элюировали ступенчатым градиентом, используя 15 мМ фосфата натрия, pH 7, 0,5 M сульфата аммония при линейной скорости 37,5 см/ч. Элюат с колонки собирали, начиная с первоначального подъема до 0,1 AU при А280 до 0,2 AU в выходящем хвосте элюируемого пика. Агрегаты и другие примеси оставались связанными на смоле и удалялись с ХГВ-колонки промыванием водой или 0,5 М NaOH.
Выход вычисляли с помощью УФ-спектрофотометрии при 280 нм (коэффициент экстинкции составляет 1,42 для раствора 1 мг/мл с использованием кюветы с длиной оптического пути 1 см). Для оценки чистоты, степени удаления БКХ и вымываемого белка А проводили эксклюзионную ВЭЖХ, БКХ-ELISA и ELISA на основе белка А.
Удаление вирусов фильтрацией через фильтр Ultipor DV20™ не оценивали ни в случае экспериментального масштаба, ни в случае масштабирования в лабораторных условиях, вследствие ограничений по размеру. Вместо этого фильтр Ultipor DV50™ использовали в масштабе продукта 300 л для получения материала для доклинических исследований. В экспериментальном масштабе продукт, элюируемый после хроматографии на колонке Phenyl Sepharose™ HP, использовали напрямую в финальной операции ультрафильтрации и диафильтрации.
На этой стадии UF/DF использовали регенерируемый целлюлозный ультрафильтр с порогом отсечения (MWCO) 30 кДа от компании Millipore. Перед проведением операции систему ультрафильтрации обеззараживали 1 М NaOH и промывали водой.
Фильтрат после DV50™ сначала концентрировали до 30 мг белка/мл. Проводили непрерывную диафильтрацию 2 объемами (DV) 5 мМ гистидина, 5 мМ метионина, 0,5% сахарозы, 2% (масс./об) маннита, pH 5,9 (буфер для диафильтрации) (SR-265). Концентрат дополнительно концентрировали до 40 г/л, затем диафильтровали дополнительными 6 DV буфера для диафильтрации. Концентрат дополнительно концентрировали до ≈75 г/л. Затем продукт удаляли из системы ультрафильтрации и промывали ее буфером для диафильтрации для сбора продукта, удерживаемого системой. Объединяли концентрат и смыв, получая диафильтрованный продукт антитела с концентрацией примерно 65 г/л. Этот продукт после фильтрации через фильтр 0,2 мкм был готов для финальной фасовки по флаконам.
1.2 Анализ чистоты продукта
Эксклюзионная ВЭЖХ. Чистоту антител оценивали с помощью эксклюзионной хроматографии, эксклюзионной ВЭЖХ.
ВЭЖХ-анализ на колонке Poros A. Титры антител культурального продукта, наноса на MabSelect™ и образцов фракций проскока определяли количественным захватывающим анализом на колонке Poros A™.
БКХ-ELISA. Уровень белков клеток-хозяев оценивали с помощью ELISA на белки клеток-хозяев. Получали сэндвич БКХ между двумя специфичными антителами в твердофазном иммуноферментном анализе (ELISA).
Планшет покрывали по 100 мкл/лунку смеси аффинно-очищенных козьих антител к клеткам СНО (по 6 мкг/мл каждого в 50 мМ бикарбоната натрия, pH 9,4) в течение 1 часа при 37°С и качании 80 об./мин; затем выливали содержимое планшета и блокировали неспецифические сайты раствором казеина (300 мкг/лунка) в течение 1 часа при 37°С и качании 80 об./мин. После блокирования планшет промывали буфером для промывания (1X PBS, 0,1% Triton X-100, pH 9). Образцы для построения стандартной кривой приготавливали серийными разведениями аликвоты с концентрацией 5,2 мг/мл белков клеток-хозяев СНО. Разбавителем для всех реагентов является казеин, нагретый до 37°С и обработанный ультразвуком в течение 2 мин, если не указано иное. Концентрации для стандартной кривой составляли 300, 200, 133, 89, 59, 40, 26 и 18 нг/мл. Стандарт антител разбавляли в 5 раз и использовали в анализе в качестве контроля. Для того чтобы результаты анализа считались принятыми, вычисленное значение для контроля должно находится в диапазоне 45-76 нг БКХ/мл. Образцы разводили таким образом, чтобы вычисленные значения попадали в диапазон стандартной кривой. Стандарты, контроль и образцы наносили на планшет в дупликатах (100 мкл/лунку). Планшет инкубировали при 37°С в течение 1 часа при качании 80 об./мин. После инкубации образцов планшет промывали буфером и наносили по 100 мкл/лунку биотинилированных козьих антител к клеткам СНО, разведенных до 3 мкг/мл. Планшет инкубировали при 37°С и качании 80 об./мин в течение 1 часа, а затем промывали. Добавляли по 100 мкл/лунку конъюгата нейтравидина с пероксидазой хрена (HRP) и планшет инкубировали при 37°С и качании 80 об./мин в течение 1 часа. Проводили финальную промывку и проявляли планшет, добавляя по 100 мкл/лунку колориметрического субстрата для HRP, K Blue, на 7 минут при качании на 3-й скорости на качалке для микротитровочных планшетов от компании Lab-line при комнатной температуре. Реакцию останавливали добавлением по 100 мкл/лунку 2 М фосфорной кислоты и измеряли поглощение при 450 нм. Интенсивность цвета была пропорциональна количеству БКХ, присутствующих в тестируемом образце.
Белок A-ELISA. Освобождение от белка А оценивали, используя аналитический набор от компании Cygnus Technologies, Inc. (набор для иммуноферментного анализа для измерения белка А в образцах, содержащих иммуноглобулин человека, кат. № F050H). Стандарты, реагенты и планшеты были предоставлены в наборе. Образцы разводили до 1 мг/мл в 1Х PBS и денатурировали при 100°С в течение 5 минут в денатурирующем буфере (50 мкл денатурирующего буфера на 200 мкл образца). Образцы центрифугировали при 6000×g в течение 5 минут для того, чтобы осадить денатурированное антитело. Во все лунки добавляли по 100 мкл биотинилированных антител к белку А и 50 мкл супернатанта из денатурированных образцов, контролей и стандартов. Планшет инкубировали в течение 1 часа при комнатной температуре и качании при 180 об/мин. Содержимое лунок отсасывали и планшет промывали вручную четыре раза по 300 мкл промывочного раствора. В каждую лунку добавляли конъюгат стрептавидина и щелочной фосфатазы (100 мкл) и планшет инкубировали при комнатной температуре в течение 1 часа при комнатной температуре и качании при 180 об./мин. После промывания планшета, как описано выше, в лунки добавляли по 100 мкл колориметрического субстрата щелочной фосфатазы и планшет инкубировали в течение 30 минут при комнатной температуре и качании при 180 об/мин. Измеряли поглощение при 405 и 492 нм. Если поглощение для образца 16 нг/мл было <1,2, то планшет инкубировали в течение дополнительных 30 минут и повторно измеряли поглощение. Интенсивность цвета была пропорциональна количеству белка А, присутствующему в тестируемом образце.
1.3 Результаты стратегии очистки
Хроматография на основе белка А. Для захвата антител к IL-12 и снижения примесей, связанных с продуктом и процессом (таких как одноцепочечные и двухцепочечные фрагменты легкой цепи, белки клеток-хозяев СНО (БКХ), ДНК и т.п.), использовали хроматографию на смоле MabSelect™ на основе белка А. Данные по выделению в экспериментальном масштабе и в масштабе биореактора (300 л) свидетельствовали о хорошем выходе белка и освобождении от БКХ (таблицы 1 и 2). Типичная хроматограмма для выделения в масштабе биореактора 300 л представлена на фиг. 4.
Итоговый выход и чистота продукта для нового процесса в экспериментальном масштабе
** НО - не определено.
Итоги для нового процесса в масштабе 300 л
** НО - не определено.
*** НП - не применимо.
Данные, приведенные в таблице 3, демонстрируют, что динамическая обменная емкость при хроматографии на смоле MabSelect™ зависела от скорости нагружения, конкретнее от времени удерживания. При нагружении при постоянной линейной скорости 300 см/ч (время удерживания 3,4 минуты), ДОЕ составляла 44,3 мг белка на мл смолы. Стратегия нагружения при двух скоростях потока (300 см/ч до 35 г/л, далее переключение на 150 см/ч) приводило к 17%-му увеличению ДОЕ до 51,7 мг белка на мл смолы. Это увеличение ДОЕ достигалось за счет удвоения времени удерживания для последней порции нагрузки. Теоретически, в начале нагружения колонки связывание осуществляется преимущественно на поверхности носителя, сайты на которой являются легкодоступными. Это позволяет использовать более высокую скорость с минимальным влиянием на кинетику связывания. После того как все легкодоступные сайты становятся занятыми, белкам необходимо диффундировать в поры для связывания с менее доступными сайтами. Кинетически это более медленный процесс, и поэтому скорость потока необходимо снизить для максимизации связывания.
Эффект скорости потока на ДОЕ колонки MabSelect™
эксперимента
Количество двойной легкой цепи снижалось с 0,5% до 0,2% (по данным эксклюзионной ВЭЖХ) в результате введения промежуточной стадии промывки. Проводили оценку нескольких буферов, включая 0,5 M NaCl, 25 мМ ацетата натрия, 0,5 M NaCl, pH 5,0 или pH 5,5 и 20 мМ лимонной кислоты/цитрата натрия, 0,5 M NaCl, pH 6. Данные эксклюзионной ВЭЖХ и ДСН-ПААГЭ (фиг. 5) показывают хорошее удаление низкомолекулярных (LMW) частиц во всех экспериментах. При промывании при рН 6 наблюдалось аналогичное удаление LMW частиц относительно промывания при более низком рН, в то время как 95%-ный выход белка был сравним с проведением процесса без промежуточной промывочной стадии.
Проточная хроматография на смоле Q Sepharose™. Колонку Q Sepharose™ FF использовали для снижения отрицательно заряженных примесей, связанных с продуктом и процессом, таких как ДНК и белки клеток-хозяев. Эта и последующие стадии составляют стадии высокой степени очистки в общем процессе.
До хроматографии приготовление образца для нанесения начинали с подведения рН и проводимости элюата со смолы MabSelect™. рН элюата подводили с рН 5 до рН 8, используя буфер 1 М Tris, pH 10; затем немедленно понижали проводимость с примерно 15 мСм до 7 мСм водой. После того как проводимость элюата со смолы подходила к 7 мСм/см, начиналось выпадение осадка, и этот процесс оставляли на 1 час. Выпавший в осадок материал удаляли на фильтре для удаления липидов или глубинном фильтре 30ZA (Cuno™), за которым следовала фильтрация через фильтр 0,45/0,2 мкм. Выход белка после этой стадии приготовления препарата для нанесения составлял 96,3% согласно УФ-поглощению при 280 нм, что указывало на то, что большинство материала, выпавшего в осадок, не было антителами. Это также было подтверждено с помощью ДСН-ПААГЭ-анализа выпавшего осадка (фиг. 6).
Хроматографию на колонке Q Sepharose™ FF проводили в режиме проскока. Типичная хроматограмма показана на фигуре 7. При нанесении 80 г антитела на л смолы в масштабе биореактора (300 л) не наблюдалось видимого проскока БКХ (таблица 4). При нагрузке 90 г антитела на л смолы уровень БКХ удваивался в проскоке (FTW), что указывало на то, что смола достигала своей обменной емкости. Уровень БКХ продолжал увеличиваться при нагрузке до 100 г антитела на л смолы (таблица 4). Это представляет собой значительное улучшение относительно существующего способа изготовления антител. Максимальная нагрузка составляла 50 г антитела на л смолы. Данная нагрузка представляет 60%-ное увеличение обменной емкости для операции на Q Sepharose™. Увеличение обменной емкости является следствием использования для стадии захвата аффинной смолы, такой как смола на основе белка А, вместо катионообменника, что приводит к более чистому потоку сырья для операции на колонке Q Sepharose™.
Выход белка обычно высокий для этой стадии. Данные как для этой стадии очистки в экспериментальном масштабе, так и в масштабе биореактора (300 л) давали сравнимые выходы для этой стадии (96% и 93%) (таблицы 1 и 2). Снижение содержания БКХ (97% и 85%) также достигалось в двух масштабах выделения (таблицы 1 и 2).
Эффект количества наносимого белка на освобождение от БКХ на QFF-колонке
(нг/мл)*
(мг/мл)
(нг/мг)
** 100%-ное нагружение = нагружение 100 г антитела на л смолы.
ХГВ-хроматография. ХГВ-хроматографию использовали для удаления агрегированных и фрагментированных молекул антител из интактных антител, исходя из их отличий по гидрофобности. В случае антител к IL-12 агрегаты являются более гидрофобными, чем мономеры, следовательно, сильнее связываются с ХГВ-колонкой. При элюции колонки 0,5 М сульфата аммония мономерные антитела элюируются, в то время как агрегаты остаются связанными с колонкой и смываются с колонки только водой. В отличие от этого фрагментированные молекулы антител или низкомолекулярные частицы являются менее гидрофобными, чем интактные антитела и, следовательно, не связываются сильно со ХГВ смолой. Большинство LMW частиц элюируются с колонки до основного пика. Поскольку предшествующая стадия промывки на MabSelect™ способна удалить основное количество низкомолекулярных частиц из технологического потока, то процесс ХГВ был введен в основном для удаления агрегированных антител, вымытого белка А, остаточных БКХ и других примесей в продукте и появляющихся в процессе выделения, для достижения характеристик финального продукта. Типичная хроматограмма приведена на фиг. 8.
Данные после очистки с помощью ХГВ в экспериментальном масштабе и в масштабе 300 л показывали выход ≥90% и хорошее удаление агрегатов (чистота выше 99%) (см. таблицы 1 и 2). После процесса ХГВ содержание вымываемого белка А в материале из проскока после Q-колонки снизилось с 8,21 до 0,65 нг/мг антитела (ч./млн) (см. таблицу 1).
По сравнению с современным способом изготовления (например, катионообменным захватом) способ, основанный на аффинном захвате на основе белка А, позволял очистку антител к IL-12 из культуры клеток СНО с более высоким выходом и лучшим удалением БКХ.
2. Выделение и очистка антител к TNFα
2.1. Стратегия очистки.
Осветление продукта клеточной культуры. В этом примере в качестве исходного материала использовали культуральную среду клеток на 13 день ферментирования и осветленный культуральный материал на 15 день ферментирования. Культуральную среду центрифугировали при 3000 об./мин в течение 30 мин на центрифуге Beckman Coulter Allegra™ 6R. Собранный супернатант фильтровали через фильтр для удаления липидов (CUNO ZeraPlus® BC0030A DELI в одноразовом картридже BioCap™ 30) при скорости потока 20 мл/мин. Осветленный материал затем аликвотили и хранили при -80°С. Замороженный материал затем размораживали и фильтровали через целлюлозно-ацетатный фильтр Corning®, 0,22 мкм перед нанесением на колонку. Культуральную среду центрифугировали на тарельчатом сепараторе и дополнительно фильтровали через глубинный фильтр и фильтр для удаления липидов. Фильтрат хранили при 4°С перед нанесением на колонку. Процесс осветления проводили при комнатной температуре.
Хроматография на основе белка А. Колонки 10 мл (1,6×5 см) и 40,2 мл (1,6×20 см) набивали смолой MabSelect™ (GE Healthcare). Для проведения хроматографии использовали хроматографическую систему AKTA Explorer™. Набивку колонки проводили в 0,5 М NaCl. В таблице 5 представлены условия хроматографии. Фракции элюируемых пиков объединяли и оставляли на 1 час перед нейтрализацией до рН 8,0 3 М троламина. Процесс проводили при комнатной температуре.
Условия проведения хроматографии на основе белка А
для образца
Приготовления материала для нанесения на Q-колонку. Нейтрализованный элюат после двух процедур очистки на основе белка А объединяли и разбавляли приблизительно в 0,5~1,0 раз водой Milli-Q до проводимости 4,5~5,5 мСм/см (25°C). Разбавленный образец фильтровали через глубинный фильтр (CUNO Zeta Plus BioCap® BC0030A30ZA) при скорости потока 20 мл/мин с последующей фильтрацией через целлюлозно-ацетатный фильтр 0,45 мкм (Corning, Inc.) и затем через целлюлозно-ацетатный фильтр 0,22 мкм (Corning, Inc.). После чего образцы были готовы для наноса на Q-колонку.
Анионообменная хроматография на Q Sepharose™. Колонки 60,3 мл (1,6×30 см) и 40,2 мл (1,6×20 см) набивали смолой Q Sepharose™ Fast Flow (GE Healthcare) и проводили хроматографию с помощью хроматографической системы AKTA Explorer™. В таблице 6 представлены условия проведения хроматографии. Процесс проводили при 12°С. Собирали образцы проскока для хроматографической очистки смолы Phenyl Sepharose™ HP.
Условия проведения хроматографии на Q-сефарозе
Хроматография на Phenyl Sepharose™ HP. Колонку 30,2 мл (1,6×15 см) набивали смолой Phenyl Sepharose™ HP (GE Healthcare) и проводили хроматографию с помощью хроматографической системы AKTA Explorer™. Проскок после Q-колонки разбавляли буфером 2,2 М (NH4)2SO4, 40 мМ NaH2PO4 в соотношении 1:1 для получения проводимости 147±11 мСм/см для нанесения на колонку Phenyl Sepharose™ HP. При элюции собирали основной пик. В таблице 7 представлены условия проведения хроматографии. Процесс проводили при 12°С.
Условия проведения хроматографии на Phenyl Sepharose™ HP
2.2. Анализ чистоты образцов
pH. Калибровку рН-метра осуществляли, используя два раствора рН-стандартов (рН 4 и 7 или рН 7 и 10) непосредственно перед использованием. Измеряемые значения находились в калибруемом диапазоне. Использовали рН-метр Corning Pinnacle 545.
Проводимость. Проводимость измеряли при 25°С, используя кондуктометр CDM210 от Radiometer Analytical.
УФ-спектрофотометрия при 280 нм. Измеряли поглощение при 280 нм (А280) в УФ-спектре, используя спектрофотометр UV8453 от Agilent. Используемый коэффициент экстинкции для Адалимумаба составлял 1,39 г/л*см.
ВЭЖХ на колонке Poros A. Концентрацию антител определяли с помощью ВЭЖХ на колонке Poros A (на основе белка А). Образец разводили, чтобы получить показания в пределах калибровочной кривой. ВЭЖХ-систему Shimadzu оснащали колонкой Poros A ImmunoDetection sensor cartridge (Applied Biosystems, Foster City, CA). Операции с колонкой осуществляли при комнатной температуре. Хроматографию проводили при скорости потока 2 мл/мин. Температуру лотка автоматического инжектора устанавливали на 4°С. Наблюдали за поглощением при 280 нм. Буфером А являлся 1Х PBS. Буфером В являлись 0,1 М уксусной кислоты и 150 мМ хлорида натрия. Наносили образец и элюировали Адалимумаб, используя 100% буфер В.
ВЭЖХ на WCX-10. Проводили анализ с помощью ВЭЖХ на WCX-10 (слабом катионообменнике). ВЭЖХ-систему Shimadzu оснащали аналитической колонкой Dionex ProPac WCX-10 и предколонкой (Dionex Corporation, Sunnyvale, CA). Манипуляции с двумя колонками осуществляли при 30°С. Скорость в системе составляла 1 мл/мин. Температуру лотка автоматического инжектора устанавливали на 4°С. Наблюдали за поглощением при 280 нм. Буфером А был двухосновный фосфат натрия, 10 мМ, рН 7,5, а буфером В был двухосновный фосфат натрия, 10 мМ/хлорид натрия, 500 мМ, рН 5,5. Наносили образец и элюировали Адалимумаб, используя градиент, указанный ниже.
Эксклюзионная хроматография (эксклюзионная ВЭЖХ). Проводили анализ с помощью эксклюзионной хроматографии. Образец разводили, чтобы получить показания в пределах стандартной кривой. ВЭЖХ-систему Shimadzu оснащали колонкой Superose™ 6 10/300 GL (GE Healthcare). Операции с колонкой осуществляли при комнатной температуре. Хроматографию проводили при скорости потока 0,5 мл/мин. Температуру лотка автоматического инжектора устанавливали на 4°С. Наблюдали за поглощением при 214 нм. Буфером А был двухосновный фосфат натрия, 20 мМ/хлорид натрия, 150 мМ. Наносили образец и осуществляли хроматографическое разделение Адалимумаба в изократических условиях, используя 100% буфер А.
БКХ-ELISA. БКХ-ELISA проводили, как описано выше. Образец разводили, чтобы получить показания в пределах калибровочной кривой.
Белок А-ELISA. Анализ концентрации вымываемого белка А проводили, как указано выше. Наборы для иммуноферментного анализа для измерения белка А в образцах, содержащих иммуноглобулин человека (кат. № F050H), включая буфер для разбавления образцов (кат. № I028), были приобретены от Cygnus Technologies, Inc. Для денатурации образцов использовали блочный нагреватель (тип 17600 Dry-Bath, Barnstead/Thermolyne). Для инкубации образцов использовали инкубатор (Max 4000, Barnstead/Lab-Line). Для измерения поглощения при 405 нм и 495 нм использовали планшетный спектрофотометр(Spectramax Plus, Molecular Devices).
ДСН-ПААГЭ. Образцы разводили в 1Х PBS-буфере до желаемой концентрации, затем к каждому разведенному образцу добавляли равный объем 2Х буфера для нанесения (Invitrogen™ Novex® Tris-Glycine SDS Sample Buffer (2X), кат. № LC2676). Для ДСН-ПААГЭ в восстанавливающих условиях в каждый образец добавляли одну десятую восстанавливающего агента (Invitrogen™ NaPAGE® Sample Reducing Agent (10X), кат. № NP0004). В каждую лунку геля (Invitrogen™ 12% Tris-Glycine Gel) наносили по 20 мкл каждого приготовленного образца. Форез проводили в 1Х Tris-глицин-ДСН-буфере для электрофореза (разведенного из 10Х Tris-глицин-ДСН-буфера из ABC Storage Room) при постоянном напряжении 125 В и 35 мА в течение 108 минут. Для окрашивания геля в течение 2 часов использовали SimpleBlue™ SafeStain (Invitrogen™, кат. № LC6060) и краситель отмывали водой Milli-Q до появления четких полос. В этом исследовании в качестве маркера использовали стандарты молекулярных масс SeeBlue® Plus Prestained Standard (1X) (Invitrogen™, кат. № LC5925). Каждый приготовленный образец наносили, исходя из равного общего количества антитела.
2.3. Результаты стратегии очистки
Динамическая обменная емкость смолы MabSelect™. Динамическую обменную емкость смолы в данных условиях можно оценить, перегружая колонку и анализируя полученный проскок продукта. Обычно максимальная обменная емкость необходима для определения нагрузки, соответствующей 10% проскоку, и затем для снижения этого параметра на 10-20% для запаса надежности, чтобы гарантированно перекрыть неточность измерений в ходе процесса и вымывание белка А с течением времени. Точка 10% проскока для смолы MabSelect™ составляет 37,4 г антитела на л смолы (фиг. 9). Это позволяет предложить максимальную обменную емкость смолы 32 г/л смолы при скорости потока 400 см/ч при исследуемых условиях. В этом примере использовали нагрузку 32 г/л.
Выход очищенного антитела. Для исследования выхода и качества продукта проводили два эксперимента. Культуральную среду осветляли, как описано выше. Фильтраты наносили на колонку MabSelect™ и разделяли, как описано выше. рН элюатов (рН 4,06) был выше рН, достаточного для успешного снижения содержания/инактивации вирусов (рН 3,5), поэтому рН пула элюатов подводили до рН 3,5 разведенной в 10 раз ледяной уксусной кислотой (J.T. Baker 9522-03). На стадии хроматографии на Q Sepharose™ в случае первого эксперимента наносили 30 г/л и 40 г/л - во втором эксперименте для исследования способности процесса удалять примеси.
В таблице 8 перечислены выходы после стадий очистки антител в этих 2 экспериментах и процесса очистки, в котором не используется белок А («AY-04»).
Выход антител после очистки в процессе, в котором используется белок А, и процессе AY-04
Белки клеток-хозяев (БКХ) являются основными примесями, генерируемыми клетками СНО. Помимо примесей из культурального материала белок А может вымываться в продукт из носителя смолы на основе белка А в качестве примеси, связанной с процессом выделения. Хороший способ очистки должен удалять БКХ и вымываемый белок А.
Удаление БКХ. Культуральный материал наносили на колонку (2,6×20 см) со смолой MabSelect™. Уровень БКХ измеряли в элюате, как было описано выше, и сравнивали с элюатом со смолы Fractogel™ S в процессе AY-04. Данные указывают на то, что хроматография на смоле MabSelect™ удаляла 99,9% из нанесенных БКХ, а хроматография на Fractogel™ S в процессе AY04 удаляла 88~93% нанесенных БКХ. Как ожидалось, аффинная смола на основе белка А лучше удаляла БКХ, чем катионообменная смола Fractogel™ S.
Вымываемый белок А. Для детекции белка А, вымываемого из носителя смолы, использовали коммерческий набор для ELISA (Cygnus Technologies, Inc) для определения содержания белка А. Количество вымываемого белка А в ходе аффинной стадии составляло приблизительно 6 нг/мг антитела в элюате. После очистки высокой степени на колонках Q Sepharose™ и Phenyl HP, содержание вымываемого белка значительно снижалось до приблизительно 0,02 нг/мг.
ДСН-ПААГЭ. ДСН-ПААГЭ в денатурирующих восстанавливающих условиях проводили для сравнения промежуточных отличий между процессом выделения на основе белка А и процессом AY-04. Наносили по 2 мкг каждого антитела. По гелю никаких видимых различий не наблюдалось (фиг. 10).
Исследование рН при элюции со смолы MabSelect™. В случае аффинной смолы на основе белка А антитело связывается при нейтральном рН и элюируется в кислых условиях. Поскольку уменьшение количества/инактивация вирусов низким рН является весьма эффективной и широко используется в процессах очистки моноклональных антител, стадию уменьшения количества/инактивации вирусов можно упростить, оставляя кислый элюат со смолы MabSelect™ на достаточное время. Исследовали эффект рН элюции на выход антитела и качество продукта. Элюция при рН около 3,2 была выбрана в качестве рН элюции со смолы MabSelect™, исходя из максимального выхода и приемлемого качества продукта в отношении процентного содержания мономеров и всех вариантов лизина при этом рН.
На фиг. 11 продемонстрировано, что был получен выход, по меньшей мере, 90% для элюции в диапазоне рН от 2,5 до 3,8, а значительное падение выхода возникало при рН 4,0. Это позволяет предположить, что элюирующий буфер с рН выше 4 не может достаточно эффективно элюировать антитела со смолы MabSelect™.
Влияние на агрегацию антител. Все уровни мономеров антитела (Адалимумаба) в элюатах после MabSelect™ были выше 92% (фиг. 12). Они все соответствовали технологическим границам регулирования (содержание мономеров по эксклюзионной ВЭЖХ ≥92%) хроматографии на смоле Fractogel™ в процессе AY-04 при рН элюирующего буфера в диапазоне от 2,5 до 3,8, хотя более высокое значение рН при элюции генерировало меньшее количество агрегатов. Время выдерживания элюата в кислых условиях в течение 1-3 часов существенно не влияло на агрегацию антител.
3. Определение концентрации белков клеток-хозяев в композициях антител к IL-12
Эта процедура описывает методику тестирования для определения остаточной концентрации белков клеток-хозяев в образцах антител к IL-12. Использовали твердофазный иммуноферментный анализ (ELISA) для образования сэндвича белков клеток-хозяев (антигенов) между двумя слоями специфических антител. За этим следовало блокирование неспецифических сайтов связывания казеином. Затем инкубировали белки клеток-хозяев, в ходе чего молекулы антигенов захватывались первым антителом (покрывающим антителом). Затем добавляли второе антитело (биотинилированное антитело к белкам клеток-хозяев), которое фиксировало антиген (белки клеток-хозяев). Добавляли нейтравидин, конъюгированный с HRP, который связывал биотинилированные антитела к белкам клеток-хозяев. За этим следовало добавление субстрата K blue. Хромогенный субстрат гидролизовался связанным антителом, конъюгированным с ферментом, давая синий цвет. Реакцию останавливали 2 М H3PO4, которая меняла цвет на желтый. Интенсивность окрашивания прямо пропорциональна количеству связанного антигена в лунке.
Приготовление 50 мМ бикарбоната натрия (буфера для покрытия поверхности антителами), рН 9,4. В химический 1-л стакан добавляют: 900 мл воды Milli-Q; 4,20±0,01 г бикарбоната натрия. Перемешивают до полного растворения. Подводят рН до 9,4 с помощью 1 н. NaOH. Переносят в колбу 1 л для измерения объема и доводят объем водой Milli-Q. Перемешивают переворачиванием до гомогенного состояния. Фильтруют через стерильный фильтр 0,22 мкм. Хранят при номинальной температуре 4°С до 7 дней от даты приготовления раствора.
Приготовление 0,104 M Na2HPO4×7H2O, 1,37 M NaCl, 0,027 M KCl, 0,0176 M KH2PO4, pH 6,8-6,9 (10X PBS). Добавляют приблизительно 400 мл воды Milli-Q в стеклянный лабораторный стакан. Добавляют 13,94±0,01 г Na2HPO4×7H2O. Добавляют 40,0±0,1 г NaCl. Добавляют 1,00±0,01 г KCl. Добавляют 1,20±0,01 г KH2PO4. Перемешивают до гомогенного состояния. Переносят в 500-мл колбу для измерения объема. Доводят до объема водой Milli-Q. Перемешивают, переворачивая колбу. Фильтруют через стерильный фильтр 0,20 мкм. Хранят при комнатной температуре до 7 дней.
Приготовление 1Х PBS+0,1% Triton X-100, pH 7,40 : (буфер для промывания планшетов). В 4-литровом градуированном цилиндре смешивают 400 мл 10X PBS (стадия 5.2) с 3500 мл воды Milli-Q. Проверяют рН и подводят (если необходимо) до 7,40±0,05 с помощью 1 н. HCl или 1 н. NaOH. Доводят до объема водой Milli-Q. Закрывают цилиндр парафильмом и перемешивают переворачиванием до гомогенного состояния. Переносят во флягу объемом 4 л. Отбирают 4 мл 1Х PBS и выливают. Добавляют 4 мл Triton X-100 к 3996 мл 1X PBS. Помещают на мешалку и перемешивают до полного растворения. Необходимое для приготовления буфера для разбавления количество буфера для промывания планшетов фильтруют через стерильный фильтр 0,22 мкм. Хранят при комнатной температуре до 7 дней.
Приготовление смеси «покрывающих» антител: аффинно очищенные козьи антитела к СНО 599/626/748 (партия № G11201, 1,534 мг/мл) (ВАЖНО: исходные фасовки хранят при номинальной температуре -80°С во флаконах). Приготовление аликвот. На один планшет берут одну аликвоту в момент использования. Непосредственно перед использованием разводят смесь антител до конечной концентрации 4 мкг/мл в холодном бикарбонате натрия, 50 мМ, как указано ниже. Например, добавляют 31 мкл смеси покрывающих антител к 11969 мкл холодного «покрывающего» буфера. Аккуратно перемешивают переворачиванием.
Приготовление смеси биотинилированных козьих антител к белкам клеток-хозяев, 599/626/748 (партия № G11202, 0,822 мг/мл) (ВАЖНО: исходные фасовки хранят при номинальной температуре -80°С во флаконах). Приготовление аликвот. На один планшет берут одну аликвоту в момент использования. Непосредственно перед использованием разводят смесь биотинилированных антител до конечной концентрации 1 мкг/мл в казеине при 37±2°C, как указано ниже. Например, добавляют 14,6 мкл смеси биотинилированных антител к 11985 мкл казеина при 37±2°C. Аккуратно перемешивают переворачиванием.
Приготовление нейтравидина-HRP. Приготавливают раствор из сухих новых партий (2 мг/флакон) с концентрацией 1 мг/мл, как указано ниже: добавляют во флакон 400 мкл воды Milli-Q, затем добавляют 1600 мкл 1Х PBS до общего объема 2 мл. Мягко перемешивают на вортексе. Хранят при номинальной температуре -20°C. Приготавливают аликвоты желаемого объема, так чтобы использовать 1 аликвоту на планшет. Аликвоты приготавливают в полипропиленовых пробирках. Проводят качественную оценку новых партий для определения рабочих концентраций. Указывают срок годности препарата как 6 месяцев с момента приготовления. Например, если было определено, что рабочая концентрация составляет 0,2 мкг/мл, то рабочий раствор приготавливают следующим образом. Непосредственно перед использованием размораживают аликвоту нейтравидина-HRP при комнатной температуре. Разбавляют раствор нейтравидина 1 мг/мл до 0,1 мг/мл (100 мкг/мл) казеином при 37±2°C. Например, разводят в 10 раз, добавляя 50 мкл нейтравидина к 450 мкл казеина. Мягко перемешивают на вортексе. Дополнительно разбавляют раствор 100 мкг/мл до 0,2 мкг/мл казеином при 37±2°C. Например, разводят в 500 раз, добавляя 24 мкл нейтравидина (100 мкг/мл) к 11976 мкл казеина. Мягко перемешивают на вортексе.
Приготовление 2 М фосфорной кислоты (стоп-раствора). Готовят раствор 2 М фосфорной кислоты из концентрированной фосфорной кислоты, как указано ниже. Исходя из % содержания фосфорной кислоты, указанной на маркировке, плотности (1,685 г/мл) и молярного веса (98 г/моль), вычисляют объем концентрированной фосфорной кислоты, необходимый для приготовления 500 мл фосфорной кислоты с концентрацией 2 М. Добавляют вычисленный, как описано выше, объем фосфорной кислоты в колбу. Доводят объем водой Milli-Q и перемешивают переворачиванием до гомогенного состояния. Хранят при комнатной температуре до 6 месяцев от даты приготовления.
Приготовление буфера для разбавления (казеина, разведенного в 100 раз в 1Х PBS + 0,1% Triton X100, pH 7,4). Разводят казеин при 37±2°C в 100 раз в профильтрованном через стерильный фильтр 0,22 мкм 1X PBS+0,1% Triton X100, pH 7,4 (приготовление описано выше). Например, добавляют 1 мл казеина при 37±2°C к 99 мл профильтрованного через стерильный фильтр 0,22 мкм 1X PBS+0,1% Triton X100, pH 7,4. Хорошо перемешивают. При каждом использовании приготавливают свежий раствор.
Приготовление стандартов. Стандарты белков клеток-хозяев (антигенные стандарты) (партия № G11203, 1,218 мг/мл) (ВАЖНО: исходные растворы хранят при номинальной температуре -80°C в аликвотах по 70 мкл). Аликвоту размораживают при комнатной температуре. Серийные разведения выполняют в полипропиленовых пробирках в буфере для разбавления.
Приготовление образцов. В полипропиленовых пробирках разводят образцы финального продукта до 24 мг/мл в буфере для разбавления. Указывают концентрацию. ВАЖНО: используют растворы, указанные ниже, для приготовления образцов с добавленным стандартом и для приготовления растворов 12 мг/мл, упомянутых ниже. В полипропиленовых микропробирках дополнительно разводят растворы 24 мг/мл в буфере для разбавления. Каждый из приготовленных растворов 12 мг/мл вносят в лунки планшета в трех повторах (трипликатах), всего 6 лунок.
Приготовление стандарта. В полипропиленовой микропробирке приготавливают стандарт (раствор БКХ) 10 нг/мл из стандартного раствора 20 нг/мл, приготовленного выше, 2-кратным разведением буфером для разбавления. Вносят в три лунки планшета раствор стандарта 10 нг/мл (положительный контроль). Используют стандартный раствор 20 нг/мл из стадии 6.1 для добавления образцов с добавленным стандартом.
Приготовление образцов добавленным стандартом (БКХ). В полипропиленовых микропробирках к 300 мкл образцов финального продукта с концентрацией 24 мг/мл добавляют 300 мкл стандарта с концентрацией 20 нг/мл (6.1). Каждый из приготовленных растворов образцов с добавленным стандартом вносят в лунки планшета в трипликатах, всего 6 лунок.
Приготовление контроля. Перед использованием в тестировании необходимо устанавливать контрольный диапазон для каждого нового контрольного концентрированного раствора. Концентрированный контрольный раствор: приготавливают аликвоты по 150 мкл из партии концентрата лекарственного соединения ABT-874 и хранят при номинальной температуре -80°С до трех лет.
Приготовление рабочего контроля. Размораживают аликвоту контрольного раствора при комнатной температуре. В полипропиленовых пробирках разводят контрольный раствор до концентрации 24 мг/мл в буфере для разбавления. В полипропиленовых микропробирках дополнительно разводят контрольный раствор 24 мг/мл буфером для разбавления до 12 мг/мл. Приготавливают одно разведение и вносят контроль в 3 лунки планшета.
Процедура проведения ELISA. Заполняют флакон устройства для промывания планшетов буфером для промывания планшетов (см. стадию 5.3, 1X PBS + 0,1% Triton X-100). Запускают устройство для промывания планшетов. Проверяют следующие параметры: должны быть установлены следующие параметры: тип планшета: 1 для каждого цикла (всего 5 циклов), объем: 400 мкл, время выдержки: 10 с, время аспирации: 4 с.
Процедура анализа. Для сорбции антител на поверхности лунок (покрытия антителами) в лунки планшетов добавляют по 100 мкл на лунку смеси покрывающих козьих антител с концентрацией 4 мкг/мл в холодном бикарбонате натрия, 50 мМ. Стучат по боковой стороне планшета для равномерного распределения покрывающего раствора по дну лунок, закрывают липкой пленкой и инкубируют при номинальной температуре 4°C и качании на качалке для планшетов (или аналогичном устройстве) при скорости 3 в течение 18 часов ± 1 час. После инкубации в течение ночи планшеты вынимают из холодильника и оставляют для уравновешивания до комнатной температуры. Вытряхивают покрывающий раствор из планшета и промокают его на фильтровальной бумаге. Неспецифическое связывание блокируют, добавляя по 300 мкл на лунку казеина при 37±2°C, закрывают липкой лентой и инкубируют при 37±2°C и качании на качалке для планшетов Lab-line Environ (или аналогичном устройстве) при скорости 80±5 об./мин в течение 1 часа. В течение инкубации лунок в блокирующем растворе приготавливают стандарты, образцы, контроль, стандарт и образцы с добавленным стандартом. Планшет промывают 5 раз буфером для промывания. Промокают планшет на фильтровальной бумаге. Используя 8-канальную пипетку, в лунки планшета в трипликатах вносят (по 100 мкл на лунку) стандарты, образцы, стандарт, образцы с добавленным стандартом и контроль. Во все пустые лунки на планшете вносят по 100 мкл на лунку буфера для разбавления, которые будут служить в качестве контроля фона. Планшет закрывают липкой пленкой и инкубируют при 37±2°C и качании на качалке для планшетов Lab-line Environ (или аналогичном устройстве) при скорости 80±5 об./мин в течение 1 часа. Заполняют шаблон для использования в качестве руководства при помещении планшета в плашечный спектрофотометр.
Установка параметров плашечного спектрофотометра. Заполняют шаблон, вводя концентрации для стандартов. Не вводят факторы разведения для образцов, контроля, стандарта или образцов с добавленным стандартом. Маркируют лунки, содержащие буфер для разбавления, как контроль фона, для вычитания его из всех лунок. Промывают планшет 5 раз буфером для промывания. Промокают планшет на фильтровальной бумаге. Добавляют по 100 мкл на лунку биотинилированного козьего антитела. Закрывают липкой пленкой и инкубируют при 37±2°C и качании на качалке для планшетов Lab-line Environ (или аналогичном устройстве) при скорости 80±5 об./мин в течение 1 часа. Промывают планшет 5 раз буфером для промывания. Промокают планшет на фильтровальной бумаге. Добавляют по 100 мкл на лунку раствора конъюгата нейтравидина с HRP. Закрывают липкой пленкой и инкубируют при 37±2°C и качании на качалке для планшетов Lab-line Environ (или аналогичном устройстве) при скорости 80±5 об./мин в течение 1 часа. Промывают планшет 5 раз буфером для промывания. Промокают планшет на фильтровальной бумаге. Добавляют по 100 мкл на лунку холодного субстрата K-Blue, закрывают липкой пленкой и инкубируют при комнатной температуре в течение 10 минут (время засекают после добавления субстрата в первый ряд) при скорости 3 на качалке для микротитровочных планшетов Lab-line (или аналогичном устройстве). Реакцию останавливают, добавляя по 100 мкл на лунку 2 М фосфорной кислоты (стадия 5.7). Помещают планшет на качалку при скорости 3 на 3-5 минут. Измеряют поглощение при 450 нм.
Вычисления и анализ данных. ВАЖНО: для расчетов принимаются только образцы, стандарты, образцы с добавленным стандартом и контроль, значения оптической плотности для которых входят в количественный предел практического обнаружения (2,5 нг/мл стандарта) стандартной кривой и удовлетворяют критериям % CV (коэффициента вариации) или % разности, указанным ниже. Если OD образца ниже стандарта 2,5 нг/мл, то результат следует указывать как «ниже 2,5 нг/мл». Эту величину затем следует разделить на концентрацию разбавленного образца (12 мг/мл) для указания величины в нг/мг. Если концентрация белков клеток-хозяев в образце высока, что дает величины для образцов (без или добавленным стандартом), выходящие за верхний предел стандартной кривой, то результат следует указывать как «выше 100 нг/мл». Эту величину затем следует разделить на концентрацию разбавленного образца (12 мг/мл) для указания величины в нг/мг. Величину для образца следует считать нулевой для вычисления % возвращения стандарта, когда получаемая величина для образца меньше 2,5 нг/мл стандарта.
Стандартная кривая. В шаблон протокола следует ввести стандартные концентрации. Для эмпирического подбора кривой использовали квадратичную кривую. Коэффициент смешанной корреляции должен быть равен 0,99, а % CV между лунками в трипликатах должен быть равен 20%. Если этот критерий не выполняется, то один стандарт (1 уровень, 3 лунки) можно исключить. Если исключается стандарт 1,25 нг/мл, то принимаются только образцы и образцы с добавленным стандартом, оптическая плотность которых попадает в диапазон оптической плотности для концентраций между 2,5 нг/мл и 100 нг/мл (оставшиеся точки стандартной кривой). Кроме того, для трипликатов каждого уровня стандартов, если одна лунка очевидно загрязнена или показывает низкое связывание, ее можно исключить. Если лунку исключают из уровня стандартов, то оставшиеся повторы должны иметь % разности = 20%. % CV для наименее концентрированного стандарта, который имеет OD, близкую к фону планшета, должен быть равен 30%. Если одну лунку исключают, то % разности для оставшихся повторов должен быть равен 35%. Если исключают наименее концентрированный стандарт, то принимаются только образцы и образцы с добавленным стандартом, имеющие оптическую плотность, которая попадает в диапазон оптической плотности для оставшихся точек стандартной кривой.
Образцы. % CV должен быть равен 20% между лунками в трипликатах. Необходимо указывать % CV между лунками в трипликатах. Одну лунку из каждого разведения образца можно исключить. Оставшиеся повторы должны иметь % разности = 20%. ВАЖНО: если величина OD образца без добавленного стандарта меньше величины OD стандарта 2,5 нг/мл, то критерий % разности не применяется для результатов образца без добавления стандарта. Смотри приведенные выше вычисления.
Актуальную концентрацию белков клеток-хозяев в нг/мг из среднего значения нг/мл вычисляют следующим образом: концентрация белков клеток-хозяев СНО (нг/мг) = среднее значение для «результата образца без добавленного стандарта (нг/мл)»/концентрация разведенного образца (12 мг/мл).
Стандарты. % CV должен быть равен 20%. Необходимо указывать % CV. Одну лунку из положительного контроля можно исключить. Оставшиеся точки должны иметь % разницы = 20%. Смотри приведенные выше вычисления. Концентрацию белков клеток-хозяев указывают в нг/мл. Этот результат будет использоваться для вычисления % возвращения стандарта. Полученная концентрация стандарта (нг/мл) должна составлять ± 20% от теоретической концентрации стандарта. Указывают результат и указывают достоверность или недостоверность анализа. Если результат для стандарта не находится в пределах 20% от теоретического значения, то анализ необходимо повторить. Средняя концентрация стандарта (нг/мл)×100 должна представлять собой 100±20% от 10 нг/мл.
Образцы с добавленным стандартом. % CV должен быть равен 20% между лунками в трипликатах. Необходимо указывать % CV между лунками в трипликатах. Одну лунку из каждого разведения образца с добавленным стандартом можно исключить. Оставшиеся повторы должны иметь % разницы = 20%. Смотри приведенные выше вычисления. Указывают «результат для образца с добавленным стандартом» для каждого разведения в нг/мл. Необходимо указывать % разницы между дупликатами разведений. % разницы между разведениями должен быть равен 25%. Эти результаты будут использоваться для вычисления % возвращения стандарта.
Вычисляют % возвращения стандарта для каждого набора разведений, используя следующую формулу: % возвращения стандарта = величина для образца с добавленным стандартом - величина образца без добавленного стандарта Х 100 величина для стандарта. ВАЖНО: (1) Если величина OD для образца без добавленного стандарта меньше величины для стандарта 2,5 нг/мл, то эту величину следует принимать за 0 при вычислении % возвращения стандарта. % возвращения стандарта должен составлять 100±50% (50%-150%) для каждого разведения для каждого образца. Указывают результаты и достоверность/недостоверность анализа.
Контроль. % CV должен быть равен 20% между лунками в трипликатах. Указывают результат % CV. Одну лунку из контроля можно опустить. Оставшиеся повторы должны иметь % разницы = 20%. Смотри приведенные выше вычисления. Концентрацию белков клеток-хозяев в контроле указывают в нг/мл. Концентрацию белков клеток-хозяев в нг/мг вычисляют, как указано ниже: белок клеток-хозяев (нг/мг) = результат для белков клеток-хозяев в контроле в нг/мл.
4. Определение концентрации белка А в композициях антитела к IL-12
В этом ELISA планшеты покрывали куриными антителами к белку А и инкубировали. Сайты неспецифического связывания блокировали казеином в PBS. Планшеты промывали 1X PBS+0,1% Triton X-100 для удаления несвязанного материала. Образцы и стандарты белка А (Cys-rprotein A) разводили в 1X PBS с 4,1% Triton X и 10% казеина. Растворы денатурировали нагреванием при 95±2°C, отделяя белок А от ABT-874. Затем растворы добавляли к планшету и инкубировали. Несвязанный материл отмывали 1X PBS+0,1% Triton X-100. В лунки микротитровочного планшета добавляли биотинилированные куриные антитела к белку А и инкубировали. Планшет промывали для удаления несвязанного материла и добавляли конъюгат нейтравидина с пероксидазой хрена.
Нейтравидин будет связывать биотинилированные куриные антитела к белку А, которые связаны с лунками. Планшет повторно промывают для удаления несвязанного нейтравидина и в лунки планшета добавляют субстрат K-Blue (тетраметилбензидин (TMB)). Субстрат гидролизуется связанным нейтравидином, давая синий цвет. Реакцию останавливают фосфорной кислотой, в результате чего цвет меняется на желтый. Интенсивность желтого цвета в лунках прямо пропорциональна концентрации белка А, присутствующего в лунках.
Приготовление реагентов и растворов. Казеин во флаконах необходимо прогреть до 37±2°C, обработать ультразвуком и разделить на аликвоты. Аликвоты необходимо хранить при номинальной температуре 4°C. При проведении анализа необходимое число аликвот казеина следует прогреть до 37±2°C. Буфер для покрытия поверхности антителами и субстрат используют холодными (непосредственно перед использованием вынимают из холодильника на 4°C).
50 мМ бикарбоната натрия (буфер для покрытия поверхности антителами), рН 9,4. В химический стакан объемом 1 л добавляют: 900 мл воды Milli-Q и 4,20±0,01 г бикарбоната натрия. Перемешивают до полного растворения. Подводят рН до 9,4 с помощью 1 н. NaOH. Переносят в 1-л колбу для измерения объема и доводят объем водой Milli-Q. Перемешивают переворачиванием до гомогенного состояния. Фильтруют через стерильный целлюлозно-ацетатный фильтр 0,22 мкм. Хранят при номинальной температуре 4°С до 7 дней от даты приготовления раствора.
0,104 M Na2HPO4×7H2O, 1,37 M NaCl, 0,027 M KCl, 0,0176 M KH2PO4, pH 6,8-6,9 (10X PBS): добавляют приблизительно 400 мл воды Milli-Q в стеклянный лабораторный стакан. Добавляют 13,94±0,01 г Na2HPO4 × 7H2O. Добавляют 40,0±0,1 г NaCl. Добавляют 1,00±0,01 г KCl. Добавляют 1,20±0,01 г KH2PO4. Перемешивают до гомогенного состояния. Переносят в колбу 500 мл для измерения объема. Доводят до объема 500 мл водой Milli-Q. Перемешивают переворачиванием колбы. Фильтруют через стерильный целлюлозно-ацетатный фильтр 0,20 мкм. Хранят при комнатной температуре до 7 дней.
1Х PBS+0,1% Triton X-100, pH 7,40 (буфер для промывания планшетов). В 4-литровом градуированном цилиндре смешивают 400 мл 10X PBS (смотри выше) с 3500 мл воды Milli-Q. Проверяют рН и подводят (если необходимо) до 7,40±0,05 с помощью 1 н. HCl или 1 н. NaOH. Доводят до объема водой Milli-Q. Закрывают цилиндр парафильмом и перемешивают переворачиванием до гомогенного состояния. Переносят во флягу объемом 4 л. Отбирают 4 мл 1Х PBS и выливают. Добавляют 4 мл Triton X-100 к 3996 мл 1X PBS. Помещают на мешалку и перемешивают до полного растворения. Хранят при комнатной температуре до 7 дней.
Куриные антитела к белку А для покрытия поверхности лунок планшета. Перед использованием достают одну аликвоту антител на один планшет. Для качественной оценки новых партий куриных антител к белку А может быть необходимо совместно с ними использовать и качественно оценивать конъюгированные с биотином куриные антитела к белку А (приготавливаемые из этой же партии антител для покрытия лунок). Непосредственно перед использованием разводят смесь антител в холодном бикарбонате натрия (50 мМ) до концентрации, определенной в ходе качественной оценки. Например, если в ходе качественной оценки было определено, что концентрация антител для покрытия лунок должна составлять 6 мкг/мл, и если исходная концентрация составляет 3000 мкг/мл, то добавляют 24 мкл антитела для покрытия лунок к 11976 мкл холодного буфера для покрытия лунок антителами. Мягко перемешивают переворачиванием.
Биотинилированные куриные антитела к белку А. Перед использованием достают одну аликвоту антител на один планшет. Для качественной оценки новых партий конъюгированных с биотином куриных антител к белку А может быть необходимо использовать и качественно оценивать их совместно с такой же партией куриных антител к белку А (из которых их приготавливали). Непосредственно перед использованием разводят смесь антител в казеине при 37±2°C до концентрации, определенной в ходе качественной оценки биотинилированного антитела. Например, если в ходе качественной оценки было определено, что концентрация биотинилированных антител для внесения в лунки должна составлять 4 мкг/мл, и если исходная концентрация составляет 1000 мкг/мл, то добавляют 48 мкл биотинилированных антител к 11952 мкл казеина при 37±2°C. Мягко перемешивают переворачиванием.
Нейтравидин-HRP. Приготавливают раствор из сухих новых партий (2 мг/флакон) с концентрацией 1 мг/мл, как указано ниже: добавляют во флакон 400 мкл воды Milli-Q, затем добавляют 1600 мкл 1Х PBS до общего объема 2 мл. Мягко перемешивают на вортексе. Хранят при номинальной температуре -80°C. Приготавливают аликвоты желаемого объема, так чтобы использовать 1 аликвоту на планшет. Аликвоты приготавливают в полипропиленовых пробирках. Указывают срок годности препарата как 6 месяцев с момента приготовления. Например, если было определено, что рабочая концентрация составляет 0,1 мкг/мл, то рабочий раствор приготавливают следующим образом. Непосредственно перед использованием размораживают аликвоту нейтравидина-HRP при комнатной температуре. Разбавляют раствор нейтравидина 1 мг/мл до 0,01 мг/мл (10 мкг/мл) казеином при 37±2°C. Например, разводят в 10 раз, добавляя 50 мкл нейтравидина к 450 мкл казеина. Мягко перемешивают на вортексе, повторно разводят в 10 раз, добавляя 100 мкл разведенного в 10 раз нейтравидина к 900 мкл казеина. Мягко перемешивают на вортексе. Дополнительно разводят раствор 10 мкг/мл до 0,1 мкг/мл в казеине при 37±2°C. Например, разводят в 100 раз, добавляя 120 мкл нейтравидина (10 мкг/мл) к 11880 мкл казеина. Мягко перемешивают, переворачивая пробирку несколько раз.
Стоп-раствор (используют закупленный 1 н. раствор фосфорной кислоты). Хранят при комнатной температуре до 1 года от даты покупки. Буфер для разбавления (1Х PBS+4,1% Triton X100+10% казеина, pH 7,4). Добавляют 86 мл 1Х PBS+0,1% Triton X100, pH 7,4, в стакан или колбу, добавляют 4 мл Triton X100 и 10 мл блокирующего раствора казеина в PBS и перемешивают до растворения/смешивания. Для растворения Triton может понадобиться от 20 до 30 минут. Это соответствует раствору 1Х PBS+4,1% Triton X100+10% казеина, pH 7,4. Фильтруют через целлюлозно-ацетатный стерильный фильтр 0,22 мкм. При каждом использовании приготавливают свежий раствор. Этого количества раствора достаточно для одного планшета.
Стандарты белка А (стандарты антигена). ВАЖНО: концентрированные растворы хранят в аликвотах по 70 мкл при номинальной температуре -20°C. Размораживают аликвоту на льду. Проводят серийные разведения в соответствии с примерами в таблице ниже, в полипропиленовых пробирках в буфере для разбавления (см. выше), используя концентрации, указанные на СОА изготовителя: например, если СОА указывает, что исходная концентрация составляет 2,1 мг/мл (2100000 нг/мл), тогда образцы размораживают на льду. В полипропиленовых микроцентрифужных пробирках разводят образцы финального продукта до 20 мг/мл в буфере для разбавления (указан выше). Приготавливают 2 отдельных разведения. Указывают концентрацию. Используют растворы ниже для приготовления образцов с добавленным стандартом и для приготовления растворов 10 мг/мл. В полипропиленовых пробирках дополнительно разводят растворы 20 мг/мл до 10 мг/мл в буфере для разбавления.
Приготовление стандарта. В полипропиленовой микропробирке приготавливают стандарт (раствор белка А) 0,296 нг/мл из стандартного раствора 0,593 нг/мл, приготовленного выше на стадии 6.1, путем 2-кратного разведения в буфере для разбавления. Выполняют одно разведение. Вносят в три лунки планшета раствор стандарта (белка А) 0,296 нг/мл. Для добавления к образцам используют стандартный раствор 0,593 нг/мл из стадии 6.1.
Приготовление образцов с добавленным стандартом. В полипропиленовых микроцентрифужных пробирках к 500 мкл каждого из образцов финального продукта с концентрацией 20 мг/мл добавляют 500 мкл раствора стандарта с концентрацией 0,593 нг/мл. Оставляют для денатурации. Каждый из приготовленных растворов образцов с добавленным раствором положительного контроля вносят в лунки планшета в трипликатах, всего 6 лунок.
Приготовление контроля. Получают партию лекарственного соединения ABT-874. Приготавливают аликвоты по 150 мкл и хранят при номинальной температуре -80°С до трех лет с момента приготовления аликвот.
Рабочий контроль. Размораживают аликвоту контрольного раствора на льду. В полипропиленовых микроцентрифужных пробирках разводят контрольный раствор до концентрации 10 мг/мл в буфере для разбавления, чтобы получить конечный объем 1000 мкл. Приготавливают одно разведение. Оставляют для денатурации. Вносят контроль в 3 лунки планшета.
Денатурация. Для контроля фона добавляют 1000 мкл буфера для разбавления в микроцентрифужные пробирки, по числу равные числу лунок для контроля фона, которые будут на планшете. Крышки пробирок можно закрепить парафильмом для предупреждения их открывания в ходе нагрева, или на них можно поставить второй штатив для того, чтобы крышки остались закрытыми. Прогревают 15 минут стандарты, образцы без добавленного стандарта, образцы с добавленным стандартом, стандарт, контроль фона и контроль при 95°С±2°C. В ходе охлаждения удаляют парафильм с пробирок, если его использовали. Позволяют пробиркам остыть в течение 15 минут и центрифугируют в течение 5 минут при скорости приблизительно 10000 об./мин. Переносят 700 мкл супернатанта в микропробирки для нанесения на планшет. Необходимо стараться не задеть осадок тритона/белков.
Инструкция по использованию устройства для промывания планшетов и водяной бани. Заполняют флакон устройства для промывания планшетов буфером для промывания планшетов (см. стадию 5.3, 1X PBS+0,1% Triton X-100). Запускают устройство для промывания планшетов. Проверяют следующие параметры: должны быть установлены следующие параметры: тип планшета: 1 для каждого цикла (всего 4 цикла): скорость аспирации: 10 мм/с; объем: 400 мкл; время выдержки: 5 с; время аспирации: 6 с. Включают и устанавливают температуру водяной бани на 95°C. Оставляют водяную баню для уравновешивания температуры 95±2°C на, по меньшей мере, 30 минут.
Процедура анализа: можно использовать технологическую карту в качестве руководства для контроля стадий по мере их выполнения. Кроме того, необходимо записывать все оборудование, используемое в анализе. Аликвоты казеина, которые предполагается использовать в день проведения анализа, должны быть помещены на 37±2°C. Буфер для покрытия поверхности антителами и субстрат используют холодными. Стандарты, образцы, контроль, стандарт и образцы с добавленным стандартом приготавливают перед и в течение инкубации лунок в блокирующем растворе. Приготовление разведений, перенос в микропробирки, 15-минутная денатурация, 15-минутное охлаждение, центрифугирование в течение 5 минут и перенос в микропробирки могут занять время, превышающее 1-часовую блокирующую инкубацию. Необходимо обеспечить, по меньшей мере, 40-минутный запас времени перед блокированием планшетов. Образцы, образцы с добавленным стандартом, стандарты, контроль, стандарт анализа и контроль фона наносят на планшет горизонтально, начиная с ряда В до G, используя 12-канальную пипетку. Стандарты наносят, начиная с высокой до низкой концентрации. Покрытие лунок антителами, добавление биотинилированных антител, добавление нейтравидина, добавление субстрата и добавление стоп-раствора осуществляют вертикально, начиная со 2-ной колонки до 11-ной колонки.
Планшеты покрывают 100 мкл на лунку покрывающих антител в холодном бикарбонате натрия, 50 мМ. Стучат по боковой стороне планшета для равномерного распределения покрывающего раствора по дну лунок, закрывают липкой пленкой и инкубируют при номинальной температуре 4°C при качании на качалке для планшетов (или аналогичном устройстве) на скорости 3.
После инкубации в течение ночи планшеты вынимают из холодильника и оставляют для уравновешивания до комнатной температуры. Вытряхивают покрывающий раствор из планшета и промокают его на фильтровальной бумаге. Неспецифическое связывание блокируют, добавляя по 300 мкл на лунку казеина при 37±2°C, закрывают липкой лентой и инкубируют при 37±2°C и качании на качалке для планшетов Lab-line Environ (или аналогичном устройстве) при скорости 80±5 об./мин в течение 1 часа.
Стандарты, образцы, контроль, стандарт и образцы с добавленным стандартом приготавливают перед или в течение инкубации лунок в блокирующем растворе. Планшет промывают 4 раза буфером для промывания. Промокают планшет на фильтровальной бумаге. Используя 8-канальную пипетку, вносят в лунки планшета в трипликатах (по 100 мкл на лунку) денатурированные стандарты, образцы, стандарты, образцы с добавленными стандартами, контроли фона и контроль. Краевые лунки планшета не используют, добавляя в них необработанный буфер для разбавления. Планшет закрывают липкой пленкой и инкубируют при 37±2°C и качании на качалке для планшетов Lab-line Environ (или аналогичном устройстве) при скорости 80±5 об./мин в течение 1 часа. Заполняют шаблон для использования в качестве руководства при помещении планшета в плашечный спектрофотометр.
Установка параметров плашечного спектрофотометра. Промывают планшет 4 раза буфером для промывания. Промокают планшет на фильтровальной бумаге. Добавляют 100 мкл на лунку биотинилированных антител. Закрывают липкой пленкой и инкубируют при 37±2°C и качании на качалке для планшетов Lab-line Environ (или аналогичном устройстве) при скорости 80±5 об./мин в течение 1 часа.
Промывают планшет 4 раза буфером для промывания. Промокают планшет на фильтровальной бумаге. Добавляют 100 мкл на лунку раствора конъюгата нейтравидина с HRP. Таймер включают сразу после добавления нейтравидина в последний ряд. Закрывают липкой пленкой и инкубируют при 37±2°C и качании на качалке для планшетов Lab-line Environ (или аналогичном устройстве) при скорости 80±5 об./мин в течение 30 минут. Промывают планшет 4 раза буфером для промывания. Промокают планшет на фильтровальной бумаге. Добавляют 100 мкл на лунку холодного субстрата K-Blue, закрывают липкой пленкой и инкубируют при комнатной температуре в течение 10 минут (таймер включают сразу после добавления субстрата в первый ряд) при скорости 3 на качалке для микротитровочных планшетов Lab-line (или аналогичном устройстве). Реакцию останавливают, добавляя 100 мкл на лунку 1 н. фосфорной кислоты. Помещают планшет на качалку при скорости 3 на 3 минуты. Измеряют поглощение при 450 нм.
Вычисления и анализ данных. ВАЖНО: для расчетов принимаются только образцы, стандарты, образцы с добавленным стандартом и контроль, значения оптической плотности для которых входят в количественный предел практического обнаружения стандартной кривой и удовлетворяют критериям % CV (коэффициента вариации) или % разности, указанным ниже. Если OD образца меньше нижней границы стандартной кривой, то результат следует указывать как «ниже 0,18 нг/мл» (анализ LOQ). Эту величину затем следует разделить на концентрацию разбавленного образца (10 мг/мл) для указания величины в нг/мг. Если концентрация белка А высока, что дает величины для образцов (без и/или с добавленным стандартом), выходящие за верхний предел стандартной кривой (2 нг/мл), то образец следует дополнительно разбавить, чтобы величина оптической плотности попадала в область стандартной кривой. Эту величину затем следует разделить на концентрацию разбавленного образца для указания величины в нг/мг. Для вычисления % возвращения стандарта вычитают величину образца без добавленного стандарта (нг/мл) из величины для образца с добавленным стандартом (нг/мл), даже если величина для образца без добавленного стандарта (нг/мл) находится ниже стандартной кривой. Если величина является отрицательной или выходит за границу измеряемого диапазона, тогда для вычисления % возвращения стандарта величину для образца без добавленного стандарта принимают за ноль.
Стандартная кривая. В шаблон протокола следует ввести стандартные концентрации. Для эмпирического подбора кривой используют квадратичную кривую. Коэффициент смешанной корреляции должен быть равен 0,99, а % CV между лунками в трипликатах должен быть равен 20%. Если этот критерий не выполняется, то один стандарт (1 уровень, 3 лунки) можно исключить. Если исключить точку 0,18 нг/мл, то принимаются только образцы и образцы с добавленным стандартом, оптическая плотность которых попадает в диапазон оптической плотности для концентраций между 0,26 нг/мл и 2 нг/мл (оставшиеся точки стандартной кривой). Кроме того, для трипликатов каждого уровня стандартов, если одна лунка очевидно загрязнена или показывает низкое связывание, ее можно исключить. Если лунку исключают из уровня стандартов, то оставшиеся повторы должны иметь % разности = 20%. % CV для наименее концентрированного стандарта, который имеет OD, близкую к фону планшета, должен быть равен 30%. Если одну лунку исключают, то % разности для оставшихся повторов должен быть равен 35%. Если исключают наименее концентрированный стандарт, то принимаются только образцы и образцы с добавленным стандартом, имеющие оптическую плотность, которая попадает в диапазон оптической плотности для оставшихся точек стандартной кривой.
% разницы вычисляют, как указано ниже: % разницы = (поглощение (результат для разведения 1 - результат для разведения 2)/среднее значение)×100%. Анализ необходимо повторить, если стандарты не удовлетворяют приведенным выше критериям. Указывают величины % CV и/или % разницы и коэффициента смешанной корреляции стандартной кривой для результатов анализа.
Образцы. % CV должен быть равен 20% между лунками в трипликатах. Необходимо указывать % CV между лунками в трипликатах. Одну лунку из каждого разведения образца можно исключить. Оставшиеся повторы должны иметь % разности = 20%. ВАЖНО: если величина OD образца без добавленного стандарта меньше величины OD наименее концентрированного стандарта, то критерий % разности не применяется для результатов образца без добавленного стандарта. Смотри приведенные выше вычисления.
Указывают «результат образца без добавленного стандарта» для каждого разведения в нг/мл. Эти величины будут использоваться при вычислении % возвращения стандарта. Вычисляют среднее «результата образца без добавленного стандарта (нг/мл)» и % разности между разведениями. Указывают результаты. % разницы между разведениями должен быть равен 25%. Вычисляют актуальную концентрацию белка А в нг/мг из средней величины (нг/мл) следующим образом: белок А (нг/мг) = среднее значение для «результата образца без добавленного стандарта (нг/мл)»/концентрацию разведенного образца (10 мг/мл). Указывают результат.
Стандарты. % CV должен быть равен 20% между лунками в трипликатах. Необходимо указывать % CV. Одну лунку из стандарта можно исключить. Оставшиеся точки должны иметь % разницы = 20%. Смотри приведенные выше вычисления. Концентрацию белка А указывают в нг/мл. Этот результат будет использоваться для вычисления % возвращения стандарта. Полученная концентрация стандарта (нг/мл) должна составлять ±20% от теоретической концентрации стандарта. Указывают результат и указывают достоверность или недостоверность анализа. Если результат для стандарта не находится в пределах 20% от теоретического значения, то анализ необходимо повторить. Средняя концентрация стандарта (нг/мл)×100 = должна представлять собой 100±20% от 0,296 нг/мл.
Образцы с добавленным стандартом. % CV должен быть равен 20% между лунками в трипликатах. Необходимо указывать % CV между лунками в трипликатах. Одну лунку из каждого разведения образца с добавленным стандартом можно исключить. Оставшиеся повторы должны иметь % разницы = 20%. Смотри приведенные выше вычисления. Указывают «результат для образца с добавленным стандартом» для каждого разведения в нг/мл. Указывают % разницы между дупликатами разведений. % разницы между разведениями должен быть равен 25%. Эти результаты будут использоваться для вычисления % возвращения стандарта. Вычисляют % возвращения стандарта для каждого набора разведений, используя следующую формулу: % возвращения стандарта = величина для образца с добавленным стандартом - величина образца без добавленного стандарта Х 100 величина стандарта. ВАЖНО: для вычисления % возвращения стандарта вычитают величину для образца без добавленного стандарта (нг/мл) из величины образца с добавленным стандартом (нг/мл), даже если величина для образца без добавленного стандарта (нг/мл) находится ниже стандартной кривой. Если величина является отрицательной или выходит за границу измеряемого диапазона, тогда для вычислении % возвращения стандарта величину для образца без добавленного стандарта принимают за ноль. % возвращения стандарта должен составлять 100±50% (50-150%) для каждого разведения для каждого образца. Указывают результаты и достоверность/недостоверность анализа.
Контроль. % CV должен быть равен 20% между лунками в трипликатах. Указывают результат % CV. Одну лунку из контроля можно исключить из анализа. Оставшиеся повторы должны иметь % разницы = 20%.
В настоящем описании приведены ссылки на различные публикации, полное содержание которых включено в настоящий документ путем ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА АНТИТЕЛА ПРОТИВ IL-18 ИЛИ ЕГО АНТИГЕНСВЯЗЫВАЮЩЕЙ ЧАСТИ (ВАРИАНТЫ) | 2009 |
|
RU2514657C2 |
| ИНАКТИВАЦИЯ ВИРУСА ПРИ ОЧИСТКЕ АНТИТЕЛ | 2009 |
|
RU2551237C2 |
| ВЫДЕЛЕНИЕ И ОЧИСТКА АНТИТЕЛ ПРОТИВ IL-13 С ПРИМЕНЕНИЕМ АФФИННОЙ ХРОМАТОГРАФИИ С БЕЛКОМ А | 2010 |
|
RU2603055C2 |
| СПОСОБЫ И КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ ОЧИЩЕННЫЕ РЕКОМБИНАНТНЫЕ ПОЛИПЕПТИДЫ | 2014 |
|
RU2671481C2 |
| Способ очистки фолликулостимулирующего гормона | 2020 |
|
RU2803653C1 |
| Способ очистки фолликулостимулирующего гормона | 2020 |
|
RU2802582C1 |
| ГЕТЕРОДИМЕРНОЕ БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО ПРОТИВ TNFα/ПРОТИВ IL-17A, ПО СТРУКТУРЕ НАПОМИНАЮЩЕЕ ПРИРОДНОЕ АНТИТЕЛО, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2019 |
|
RU2781816C1 |
| СПОСОБ ХРОМАТОГРАФИИ В РЕЖИМЕ СЛАБОГО РАСПРЕДЕЛЕНИЯ | 2006 |
|
RU2457214C2 |
| СПОСОБЫ И КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ ОЧИЩЕННЫЕ РЕКОМБИНАНТНЫЕ ПОЛИПЕПТИДЫ | 2014 |
|
RU2793783C1 |
| ОЧИСТКА АНТИТЕЛА | 2007 |
|
RU2466740C2 |







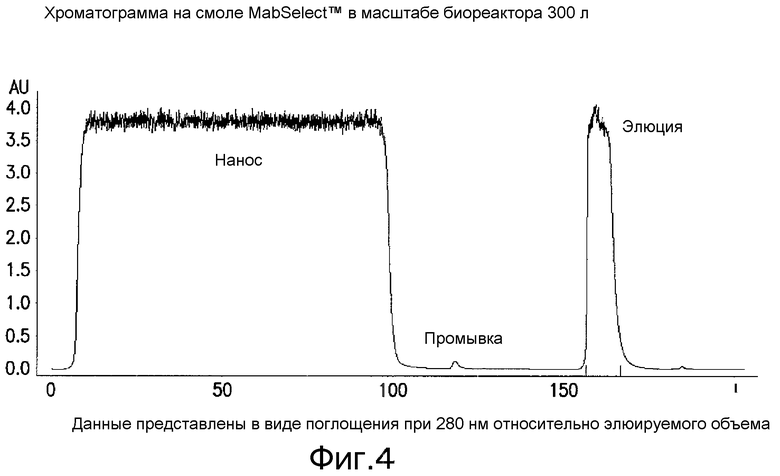
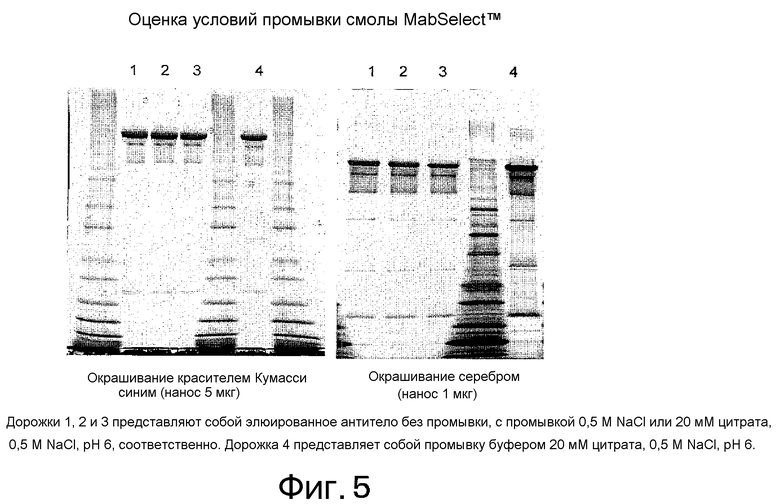
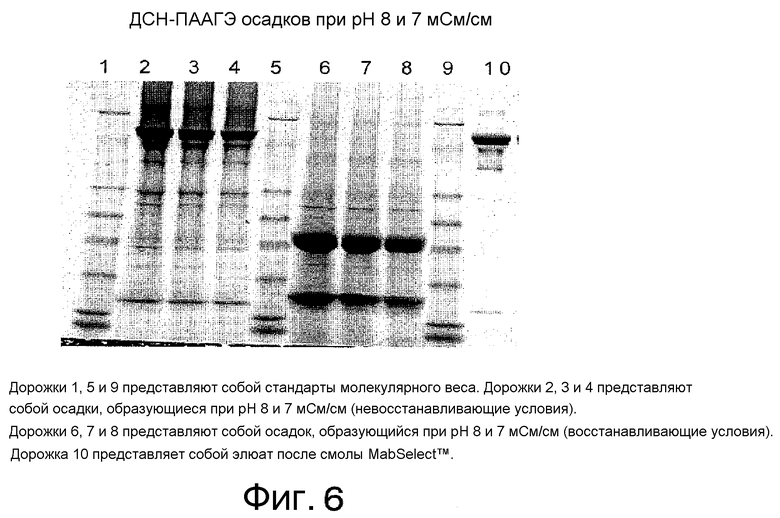

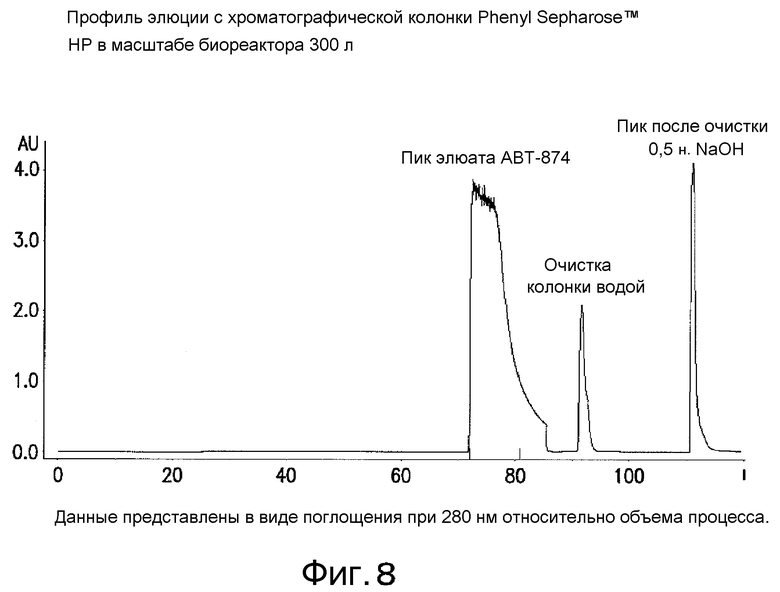
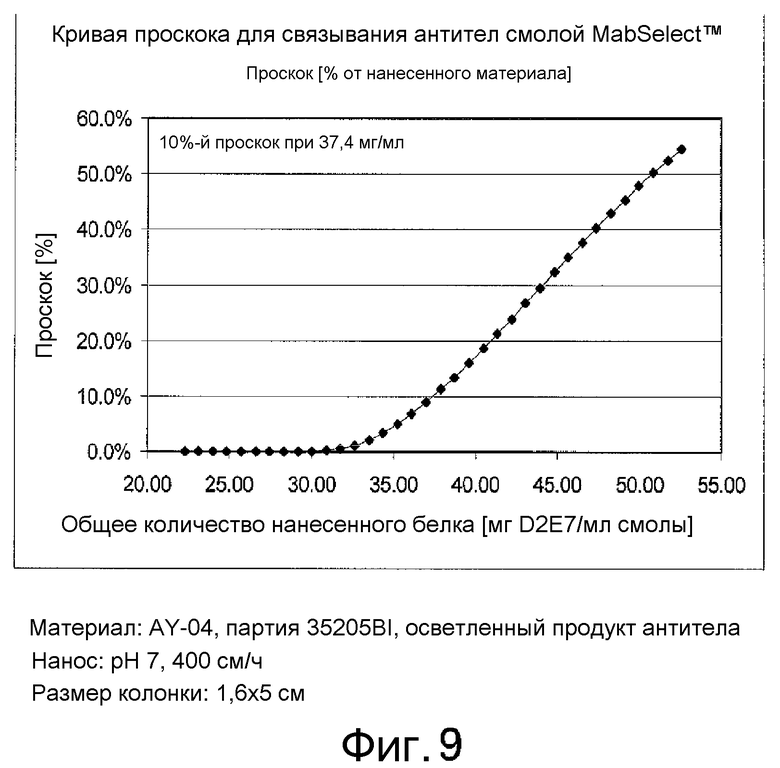
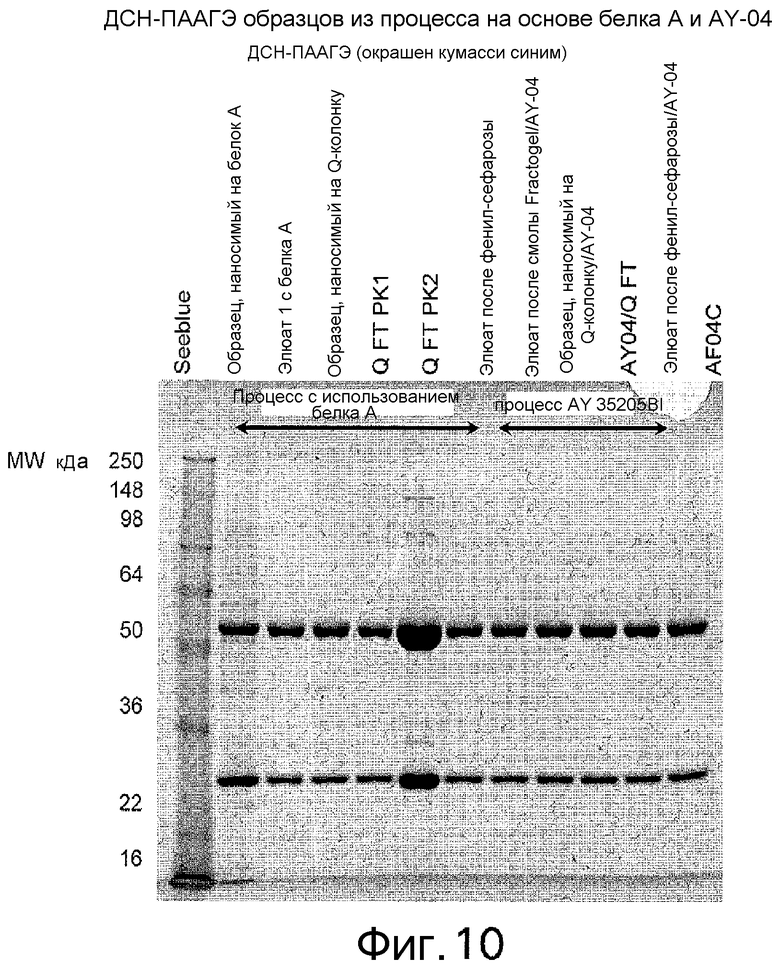
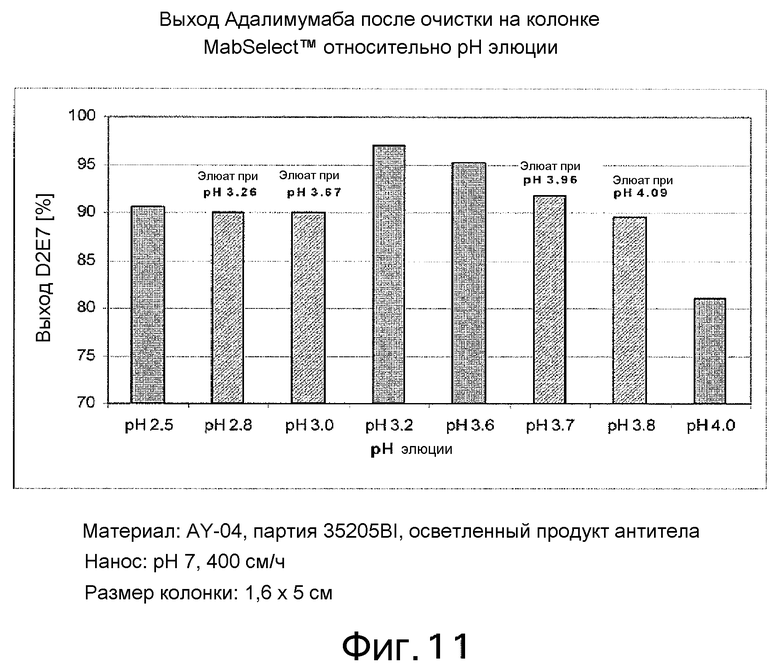

Изобретение относится к биотехнологии и представляет собой способ получения препарата антитела или его антигенсвязывающего участка с уменьшенным содержанием белков клеток-хозяев (БКХ) из смеси-образца. Предложенное изобретение может быть использовано для получения препарата антитела. Способ включает доведение pH до значений 3-4 для образования первичного выделенного образца. Далее доводят pH первичного выделенного образца до значений 6-8. Приводят первичный выделенный образец в контакт со смолой для аффинной хроматографии на основе белка A. Вымывают смолу для афинной хроматографии буферным раствором. Собирают образец после аффинной хроматографии. Приводят образец после аффинной хроматографии в контакт с ионообменной смолой и собирают образец после ионообмена. Приводят образец после ионообмена в контакт со смолой для хроматографии гидрофобных взаимодействий (ХГВ) и собирают образец после ХГВ. Предложенное изобретение позволяет получить препарат антитела или его антигенсвязывающего участка с уменьшенным содержанием БКХ. 24 з.п. ф-лы, 12 ил., 8 табл., 4 пр.
1. Способ получения препарата антитела или его антигенсвязывающего участка с уменьшенным содержанием белков клеток-хозяев (БКХ) из смеси-образца, содержащей антитело или его антигенсвязывающий участок и, по меньшей мере, один БКХ, причем указанный способ включает:
(a) доведение pH в указанной смеси-образце, в результате чего образуется первичный выделенный образец, причем pH указанной смеси-образца подводят до значений от примерно 3 до примерно 4 для образования первичного выделенного образца;
(b) доведение pH указанного первичного выделенного образца до значений от примерно 6,0 до примерно 8, за которым следует
(c) приведение первичного выделенного образца в контакт со смолой для аффинной хроматографии на основе белка A, вымывание указанной смолы для афинной хроматографии буферным раствором, выбранным из группы, состоящей из: (i) буферного раствора, содержащего 0,5 M NaCl, 25 мМ ацетата натрия, при pH 5,5; (ii) буферного раствора, содержащего 0,5 М NaCl, 25 мМ ацетата натрия, при pH 5,5; и (iii) буферного раствора, содержащего 0,5 М NaCl, 20 мМ лимонной кислоты/цитрата натрия при pH 6, и сбор образца после аффинной хроматографии;
(d) приведение указанного образца после аффинной хроматографии в контакт с ионообменной смолой и сбор образца после ионообмена;
(e) приведение указанного образца после ионообмена в контакт со смолой для хроматографии гидрофобных взаимодействий (ХГВ) и сбор образца после ХГВ, причем указанный образец после ХГВ содержит указанный препарат антитела или его антигенсвязывающего участка с уменьшенным содержанием БКХ.
2. Способ по п.1, в котором указанное доведение pH выполняют смешиванием подходящей кислоты с указанной смесью-образцом и в котором указанная подходящая кислота выбрана из группы, состоящей из лимонной кислоты, уксусной кислоты и каприловой кислоты.
3. Способ по п.1, в котором указанной смолой на основе белка A является смола MabSelect™.
4. Способ по п.1, в котором указанный образец после ионообмена добавляют в смолу для катионного обмена и образец после катионного обмена отбирают до добавления в хроматографию гидрофобного взаимодействия.
5. Способ по п.1, в котором указанной ионообменной смолой является катионообменная смола.
6. Способ по п.5, в котором указанная катионообменная смола содержит матрицу, содержащую заместители, где заместители выбраны из группы, состоящей из SO3 -, карбоксиметила, сульфоэтила, сульфопропила, фосфата и сульфоната.
7. Способ по п.6, в котором указанным заместителем является SO3 -.
8. Способ по п.1, в котором указанной ионообменной смолой является анионообменная смола.
9. Способ по п.8, в котором указанная анионообменная смола содержит матрицу, содержащую заместители, где заместители выбраны из группы, состоящей из диэтиламиноэтильной группы, четвертичной аминоотильной группы и четвертичной аминогруппы.
10. Способ по п.9, в котором указанным заместителем является четвертичный амин.
11. Способ по п.1, в котором указанная стадия ионообмена включает первую ионообменную стадию и вторую ионообменную стадию.
12. Способ по п.1, в котором указанная ХГВ смола содержит матрицу, содержащую заместители, где заместители состоят из одной или более гидрофобных групп.
13. Способ по п.12, в котором указанные заместители выбраны из группы, состоящей из алкильных, арильных групп и их комбинации.
14. Способ по п.11, в котором указанные заместители выбраны из группы, состоящей из фенол1,3-октокси пропан-1,2-диола, эфирной, пропильной, метильной и бутильной групп.
15. Способ по п.14, в котором указанная смола содержит матрицу, содержащую агарозу, содержащую фенильные заместители.
16. Способ по п.1, дополнительно включающий стадию фильтрации, где указанный образец ХГВ фильтруют для удаления вирусных частиц и для облегчения смены буфера.
17. Способ по п.1, в котором указанный препарат антитела или его антигенсвязывающего участка с уменьшенным содержанием БКХ содержит, либо антитело к IL-12 или его антигенсвязывающий участок, либо антитело к TNFα или его антигенсвязывающий участок.
18. Способ по п.17, в котором указанным препаратом антитела или его антигенсвязывающего участка с уменьшенным содержанием БКХ является антитело к IL-12 или его антигенсвязывающий участок.
19. Способ по п.17, в котором указанным препаратом антитела или его антигенсвязывающего участка с уменьшенным содержанием БКХ является антитело к TNFα или его антигенсвязывающий участок.
20. Способ по п.18, в котором указанным антителом к IL-12 или его антигенсвязывающим участком является гуманизированное антитело, химерное антитело или мультивалентное антитело.
21. Способ по п.18, в котором указанным антителом к TNFα или его антигенсвязывающим участком является гуманизированное антитело, химерное антитело или мультивалентное антитело.
22. Способ по п.20, в котором указанным антителом к IL-12 или его антигенсвязывающим участком является гуманизированное антитело.
23. Способ по п.21, в котором указанным антителом к TNFα или его антигенсвязывающим участком является гуманизированное антитело.
24. Способ по п.1, в котором указанный препарат по существу свободен от БКХ.
25. Способ по п.1, дополнительно включающий глубинную фильтрацию.
| ISHIHARA ET AL., Accelerated purification process development of monoclonal antibodies for shortening time to clinic, JOURNAL OF CHROMATOGRAPHY, 2007, v | |||
| Ручной станок для испытания материалов на разрыв | 1924 |
|
SU1176A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Подъемник для выгрузки и нагрузки барж сплавными бревнами, дровами и т.п. | 1919 |
|
SU149A1 |
| BRORSON KURT ET AL., Bracketed generic inactivation of rodent retroviruses by low pH treatment for monoclonal antibodies and recombinant proteins, BIOTECHNOLOGY AND | |||
Авторы
Даты
2014-06-27—Публикация
2009-10-20—Подача