Область техники
Настоящее изобретение относится к способам предотвращения осаждения во время аффинной хроматографии антител из композиции, полученной из клеточной культуры, с использованием стадий флокуляции и фильтрации перед хроматографией с аффинным захватом и дополнительных стадий полировки после стадии захвата для очистки антител.
Уровень техники
Выбор эффективных и экономичных 3'-последовательностей для очистки полипептидов, полученных с помощью технологии рекомбинантной ДНК, является решающим шагом в разработке каждого нового биофармацевтического средства, предназначенного для терапевтического использования. В недавнем прошлом потребность в крупномасштабных процессах очистки моноклональных антител (мАт) из-за их исключительно высоких терапевтических доз при медицинском использовании еще больше усилилась с использованием улучшенных методов культивирования клеток, что привело к более высокой плотности клеток и более высокой скорости экспрессии, и, следовательно, к более высокому титру, например, >10 г/л, интересующего рекомбинантного антитела. Возрастающие концентрации продукта и контаминантов в культуральных жидкостях предъявляют более высокие требования к хроматографии захвата, к предшествующим стадиям осветления образцов и к последующим полировкам. Весь последующий процесс должен: (i) управлять увеличившейся массой продукта, (ii) эффективно удалять увеличенные технологические и связанные с продуктом примеси до уровня ниже определенных критериев приемлемости, (iii) поддерживать экономический выход и (iv) обеспечивать достаточное качество мАт. Обычно на последующий процесс приходится большая часть общих затрат на производство терапевтических антител.
мАт в неочищенных фракциях обычно связаны с примесями, такими как белки клетки-хозяина (HCP), ДНК клетки-хозяина (HCDNA), эндотоксины, инсулин, вирусы, агрегаты, другие нежелательные варианты продуктов и различные продукты выщелачивания из технологических материалов. Присутствие этих примесей представляет потенциальный риск для здоровья пациентов, и, следовательно, их отсутствие в конечном продукте является нормативным требованием. Допускаются только очень низкие остаточные количества.
Классическая процедура очистки полипептидов, полученных из клеточной культуры, следует последовательности хроматографий «захват-промежуточная-полировка», сопровождаемых стадиями фильтрации, концентрирования или диализа в различных положениях нижерасположенной последовательности процессов. В последние годы в области очистки моноклональных антител были успешно внедрены платформенные подходы. Поскольку мАт представляют собой четко определенный класс гликопротеинов, обладающих общими физико-химическими свойствами, использование универсального платформенного процесса является разумным (Kelly B, 2009). Такой универсальный процесс с более или менее специфичными для продукта адаптациями может применяться ко многим моноклональным антителам, особенно к иммуноглобулинам одного и того же класса или подкласса, например IgG1 или IgG2.
Одной из наиболее частых стадий захвата, используемых для очистки моноклональных антител, является аффинная хроматография с Протеином А. Этот захват обеспечивает исключительную селективность для Fc-несущих молекул, тем самым удаляя более 99,5% контаминантов за одну стадию. Однако, помимо достоинств, следует отметить еще два недостатка. Одним из недостатков является нежелательное выщелачивание Протеина А или фрагментов Протеина А, которые, как известно, токсичны (Gagnon P, 1996). Другой недостаток - высокая стоимость смолы этого типа, особенно в промышленных масштабах, необходимых для очистки достаточных количеств терапевтических антител. Смола с Протеином А примерно в 30 раз дороже ионообменной смолы. Было подсчитано, что для последующей обработки 10 м3 клеточной культуры стоимость аффинной хроматографии с Протеином А составляет около 4-5 миллионов долларов США (Farid SS 2009).
Во многих случаях стадии захвата выполняются с неочищенными исходными материалами (загрузкой), которые могут вызвать загрязнение (накопление примесей) смолы для аффинной колонки. В отсутствие надлежащей стадии регенерации это может помешать успешному повторному использованию смолы захвата. Загрязняющие вещества в неочищенных культуральных жидкостях, такие как липиды, окислители, белки клетки-хозяина (HCP), ДНК клетки-хозяина (HCDNA), агрегаты или частицы, ионы металлов и другие вещества способствуют загрязнению смол и могут вызывать осаждение и помутнение во время элюирования при низких значениях pH. (Shukla AA, 2005). Помимо прямого воздействия на связывающие фрагменты, матрица также может быть необратимо загрязнена. Следствием этого является повышение противодавления и снижение производительности и расхода от одного цикла к другому. Эта проблема не ограничивается смолами на основе Протеина А: загрязнение хроматографических смол в течение срока их службы является общей серьезной проблемой для коммерческих биоразделений. Гидрофобные лиганды, используемые для хроматографии гидрофобного взаимодействия и смешанной хроматографии, при использовании в качестве стадий захвата для иммуноглобулинов, полученных из клеточных культур, особенно чувствительны к захвату липофильных контаминантов из культуральных жидкостей. Несмотря на сложные протоколы стадий очистки после прогона, срок службы колонки захвата ограничен и зависит от количества прогонов, рабочих условий для работы и очистки, а также состава и чистоты образца.
Чтобы осветлить и предварительно очистить сильно контаминированные культуральные жидкости, были применены стадии механического разделения, которые удаляют большую часть клеточного дебриса и агрегатов. Центрифугирование и фильтрация являются наиболее распространенными стадиями предварительной обработки, выполняемыми перед загрузкой образца на улавливающую смолу. Для больших объемов непрерывное центрифугирование выполняется с использованием сепараторов клеток с последующими стадиями фильтрации с использованием глубинных фильтров и/или микрофильтров. Полученную культуральную жидкость затем называют «осветленным супернатантом клеточной культуры» (Liu HF 2010). Хотя прямая нагрузка собранной культуральной жидкости на смолу с Протеином А является частым методом выбора (Fahrner RL, 2001), в других платформенных технологиях используются различные стадии осветления, то есть центрифугирование, глубинную фильтрацию и/или микрофильтрацию (Liu HF 2010, WO9522389, WO2001150110) для защиты улавливающей колонки. Это снижает контаминацию смолы твердыми веществами и частицами и улучшает чистоту антител в элюате захвата.
Хроматография с предварительным захватом, выполняемая в проточном режиме, в дополнение к стадиям центрифугирования/фильтрации, была успешно продемонстрирована для крупномасштабной очистки иммуноглобулинов (WO2015135884). Было обнаружено, что за счет включения дополнительной стадии анионообменной хроматографии перед хроматографией захвата можно значительно снизить общие затраты на процесс очистки. Стадия проточной анионообменной хроматографии с предварительным захватом снизила нагрузку примесей, с которыми экспонировался дорогостоящий материал для хроматографии захвата.
Мутные пулы элюирования и высокое противодавление колонки обычны во время элюирования моноклональных антител при кислом pH в хроматографии с Протеином А. Исследования связывают это явление с разделением фаз жидкость-жидкость в результате самоассоциации белков. На этот эффект влияют несколько факторов, включая pH, температуру, ионную силу и концентрацию белка. Тщательный выбор параметров процесса во время элюирования с Протеином А, включая температуру, скорость потока, буфер и соль, может снизить как мутность, так и противодавление колонки (Luo H, 2017). Аналогичные стратегии были предприняты, чтобы избежать проблем агрегации и образования частиц, которые проявляются в помутнении пула элюирования протеина А (Shukla, AA 2005). Были предложены стабилизирующие вещества, такие как соли, мочевина и аминокислоты, добавленные в буфер для элюирования, более низкая температура, адаптация значений pH промывочного и элюирующего буферов или предварительная обработка собранных клеточных культур для удаления определенных примесей, которые могут выпадать в осадок при низком pH. Среди методов предварительной обработки - анионообменная хроматография, фильтрация и кислотное осаждение контаминантов (Shukla AA, 2005).
Флокуляция - это процесс, который широко применяется в химической и пищевой промышленности, а также при очистке сточных вод. И осаждение, и флокуляция успешно используются для осветления жидкостей клеточных культур. В то время как осаждение зависит от снижения растворимости целевых растворенных веществ с целью создания твердых частиц, флокуляция - это агломерация частиц (клеток, клеточного дебриса или коллоидов в культуре клеток млекопитающих), вызванная эффектом связывания, вызванным флокулирующим агентом. Флокулянт вызывает дестабилизацию биоколлоидной суспензии, вызывая адгезию диспергированных частиц в кластеры большего размера, что приводит к увеличению среднего распределения частиц по размерам. (Felo M, 2015, Singh N, 2016). Методы флокуляции можно разделить на анионные, катионные и смешанные (Singh N, 2016).
В частности, флокулянты, такие как простые кислоты, двухвалентные катионы, поликатионные полимеры, каприловая кислота и полимеры, реагирующие на стимулы, были оценены на предмет их способности улучшать осветление культур клеток и снижать уровни ДНК, белков клетки-хозяина (HCP) и вирусов (Felo M, 2015). Примерно в течение десяти лет методы флокуляции интенсивно исследуются на предмет их полезности в крупномасштабном производстве моноклональных антител.
Флокуляция с комбинациями различных катионов и анионов в присутствии клеток, с регуляцией pH и без нее была успешно применена для очистки моноклональных антител (WO2007035283). Наиболее предпочтительной была комбинация Са2+ и фосфата. Было подчеркнуто заметное снижение HCP и мутности в пике элюирования Протеина А по сравнению с нефлокулированными контролями.
В других методах используются полиэлектролиты, такие как поливинилсульфоновая кислота, поливинилсульфонат, полистиролсульфоновая кислота, полиакриловая кислота, полилизин или полиаргинин, для осаждения примесей в собранных жидкостях клеточных культур (WO2008091740). Аналогичный метод с использованием каприловой кислоты в качестве флокулянта был разработан для осаждения контаминантов (WO2010151632).
Осаждение или флокуляция примесей часто требует дополнительных манипуляций с pH. Это было раскрыто для осаждения двухвалентными катионами, такими как Co2+ или Ni2+ (WO2008127305), и осаждения декстраном (WO2016153983).
Другой процесс флокуляции с использованием бензилированного поли(аллиламина), называемого полимером, реагирующим на стимулы, был разработан для очистки моноклонального IgG1 из клеточной культуры СНО. Стимулом было добавление фосфата натрия (Kang YK, 2013). Известны и другие соединения, действующие как реагирующие на стимулы полимеры при осветлении антител, собранных из клеточной культуры (WO2011146394).
Стадия флокуляции путем добавления аллантоина к собранным клеткам с последующим добавлением этакридина была описана как метод кондиционирования перед последующими стадиями адсорбции и хроматографии (WO2014133459).
Другой метод флокуляции использует C7-C10-жирную кислоту в комбинации с другими функциональными субстратами для осветления собранных клеточных культур (WO2014196926). Был применен аналогичный процесс, основанный на комбинации C7-C10-жирной кислоты и аллантоина (WO2015130222).
Был раскрыт более сложный метод флокуляции путем комбинации аллантоина, катионного полимера и жирной кислоты для удаления контаминантов из собранных клеток. Смесь трех флокулянтов, аллантоина, хитозана и каприловой кислоты, оказалась наиболее успешной (WO2017217930).
Был описан полный процесс очистки антител или других молекул-мишеней, включающий (i) стадию осаждения для удаления примесей, (ii) хроматографию на Протеине А с последующей (iii) одной или двумя проточными хроматографиями (WO2014004281). Осадок добавляют к собранной клеточной культуре, и он также содержит флокулянты с дополнительными элементами, реагирующими на стимул, и без них.
Применение поли(диаллилдиметиламмоний хлорида), катионного водорастворимого полимера, было исследовано для осветления собранной клеточной культуры клеток CHO, продуцирующих мАт (McNerney T, 2015). Авторы добавляли флокулянт непосредственно в культуральный бульон. Центрифугирование было исключено в пользу системы фильтрации. Было показано, что токсичный поли(диаллилдиметиламмоний хлорид) снижался до недетектируемого уровня после последующей хроматографии с захватом на Протеине А.
Был разработан крупномасштабный метод сбора культур клеток, состоящий из начальной стадии флокуляции в присутствии клеток и основанный на поли(диаллилметиламмоний хлориде) (WO2013090820). В предпочтительном методе флокуляции используются дополнительные усилители флокуляции, то есть полиэтиленгликоль и Triton X-100.
Сущность изобретения
Настоящее изобретение относится к предотвращению осаждения во время элюирования при низком pH иммуноглобулинов из клеточных культур из хроматографических сред с аффинным захватом. Изобретение также относится к способам очистки иммуноглобулина эффективным и рентабельным способом, с удовлетворительной чистотой и выходом. В частности, настоящее изобретение относится к повышению чистоты раствора иммуноглобулина, элюированного из смолы хроматографии с захватом, и, следовательно, приводит к улучшенному качеству конечного продукта.
Кроме того, настоящее изобретение обращается к аспекту повторного использования довольно дорогостоящих хроматографических материалов, в частности, к сроку службы материалов для аффинной хроматографии, используемых на стадии захвата последующего процесса, и к тому как срок службы можно увеличить при одновременном снижении технической сложности процесса очистки.
Стандартные процессы последующей хроматографии для очистки иммуноглобулинов из жидкостей клеточных культур обычно начинаются со стадии хроматографии с аффинным захватом, на которой иммуноглобулин должен быть захвачен из образца, содержащего иммуноглобулин вместе с примесями. Иммуноглобулин отделяется от примесей в основном из-за селективного связывания иммуноглобулина с аффинными лигандами смолы для хроматографии с захватом, в то время как примеси не связываются со смолой и, таким образом, оказываются в проточной фракции, тогда как иммуноглобулин оказывается в элюате.
Хроматография с аффинным захватом обычно является наиболее дорогостоящей стадией очистки иммуноглобулинов, составляющей от 40 до 50% общих затрат на последующий процесс в случае использования аффинной хроматографии с протеином А. То же самое относится к альтернативным колонкам для аффинной хроматографии, которые можно использовать в качестве стадии хроматографии с захватом при очистке иммуноглобулинов.
Существует постоянная потребность в рентабельной очистке иммуноглобулинов из больших объемов культуральной жидкости и ферментационного бульона, а также из осветленных образцов, полученных из такой жидкости или бульона. В частности, существует потребность в простых методах очистки, которые являются рентабельными, но при этом эффективными и удовлетворительными с точки зрения чистоты и выхода.
Было обнаружено, что за счет включения дополнительной стадии хроматографии перед хроматографией с захватом можно значительно снизить общие затраты на процесс очистки. Эта дополнительная стадия хроматографии снижает количество примесей, с которыми экспонируется дорогостоящий материал для хроматографии с захватом. Эта так называемая стадия «предварительной очистки» выполняется с использованием анионообменного или смешанного хроматографического материала, который является менее дорогим и более прочным по сравнению с хроматографическим материалом, используемым на последующей стадии захвата, и который легко регенерировать (WO2015135884). С целью поддержания как можно более простого процесса очистки, хроматография предварительной очистки выполняется в проточном режиме, то есть очищаемый иммуноглобулин не связывается со смолой и, таким образом, получается в проточной фракции, в то время как примеси в значительной степени удерживаются на смоле и тем самым отделяются от иммуноглобулина. Прямое соединение анионообменной колонки предварительной очистки с колонкой захвата с протеином А, так что проточная фракция стадии предварительной очистки временно не сохраняется в сборнике, а сразу же передается на смолу для хроматографии с захватом, в дальнейшем упрощает этот метод (WO2015135884).
Тем не менее, такой процесс анионообменной проточной хроматографии, используемый в качестве стадии осветления перед захватом, хотя и успешно применяется в крупномасштабном производстве, все еще подлежит дальнейшим улучшениям. Анионообменная хроматография истощает в основном отрицательно заряженные вещества, такие как HCDNA и HCP, вместе с неспецифически адсорбированными клеточными остатками, агрегатами, липидами и т.д., которые удерживаются колонкой. Однако большинство положительно заряженных HCP и незаряженных молекул могут пройти через колонку предварительной очистки. Это может привести к нежелательному помутнению пика элюирования Протеина А. Более того, из-за растущих требований, вызванных высокой плотностью клеток, сложными стратегиями подачи среды и высокими скоростями экспрессии современных культур клеток млекопитающих, требуется колонка предварительной очистки со значительными размерами, чтобы действовать как эффективный защитный экран колонки с Протеином A. Это сказывается на цене. Наконец, анионообменная смола должна подвергаться жестким и длительным процедурам очистки и регенерации. Это нежелательно при рутинном производстве, которое предпочтительно выполняется в операциях серийных партий.
В настоящем изобретении изучается возможность использования стадии флокуляции в качестве стадии предшествующей захвату для преодоления вышеупомянутых проблем предварительной хроматографической очистки. Для достижения требуемой высокой чистоты иммуноглобулина, предназначенного для терапевтического использования, после стадии флокуляции и стадии хроматографии с захватом следуют две или более стадий хроматографической полировки.
Проблема, лежащая в основе настоящего изобретения, решена путем предложения способа очистки иммуноглобулина из культуральной жидкости, который включает следующие стадии в следующем порядке: (а) добавление соединения, вызывающего флокуляцию, в культуральную жидкость;
(b) глубинную фильтрацию смеси стадии (а);
(c) аффинную хромаотграфию фильтрата, полученного на стадии (b), где иммуноглобулин связан со средой для аффинной хроматографии;
(d) промывание среды для аффинной хроматографии с использованием промывочного буфера со значением pH 5-9 и ионной силой 0,1-5 моль/л; и
(e) элюирование иммуноглобулина из смолы для аффинной хроматографии с использованием буфера для элюирования со значением pH от 2,5-4,5.
В некоторых вариантах осуществления стадия (а) включает следующие стадии
- центрифугирование и/или фильтрацию культуральной жидкости;
- добавление вызывающего флокуляцию соединения к супернатанту или фильтрату.
Флокуляция может быть выполнена путем добавления катионного соединения в качестве флокулянта. Катионное соединение может быть выбрано из группы, состоящей из соли иона двухвалентного металла, водорастворимого органического полимера и водонерастворимого органического полимера.
В некоторых вариантах осуществления соль иона двухвалентного металла представляет собой CaCl2.
В некоторых вариантах осуществления водорастворимый органический полимер представляет собой хлорид поли(диаллилдиметиламмония). В других вариантах осуществления водонерастворимый органический полимер представляет собой хитозан.
В конкретных вариантах осуществления флокуляцию проводят с поли(диаллилдиметиламмоний хлоридом) в качестве флокулянта. Более конкретно, поли(диаллилдиметиламмоний хлорид) имеет молекулярную массу от 10 кДа до 10000 кДа.
Обычно поли(диаллилдиметиламмоний хлорид) добавляют в конечной концентрации от 0,01 до 1,0% (мас./об.), предпочтительно в конечной концентрации от 0,02 до 0,1% (мас./об.), более предпочтительно в конечной концентрации от 0,03 до 0,08% (мас./об.).
В некоторых вариантах осуществления никакие другие вещества, кроме поли(диаллилдиметиламмоний хлорида), не добавляют для выполнения флокуляции.
В некоторых вариантах осуществления флокуляцию поли(диаллилдиметиламмоний хлоридом) проводят без дополнительного доведения pH или проводимости.
В конкретных вариантах осуществления флокуляцию проводят при перемешивании при комнатной температуре в течение, по меньшей мере, 5 минут, предпочтительно, по меньшей мере, 15 минут.
В предпочтительных вариантах осуществления аффинная хроматография представляет собой хроматографию на протеине А. Хроматографическая среда с Протеином A может содержать устойчивое к щелочам производное Протеина A в качестве лиганда, предпочтительно стабилизированный щелочью тетрамерный вариант домена B Протеина A, связанный с поперечно-сшитой агарозной матрицей.
В некоторых вариантах осуществления после глубинной фильтрации проводят микрофильтрацию.
Обычно аффинную хроматографию проводят по большей мере через 8 часов после глубинной фильтрации, предпочтительно по большей мере через 3 часа после глубинной фильтрации.
В некоторых вариантах осуществления культуральная жидкость получают из рекомбинантных клеток СНО, экспрессирующих иммуноглобулин. Предпочтительно иммуноглобулин представляет собой IgG1 или IgG2. Более предпочтительно, Fc-часть IgG1 или IgG2 является человеческой.
Описанный в настоящем документе способ может включать стадии, определенные в любом из предыдущих вариантов осуществления, и одну или более дополнительных стадий, следующих за аффинной хроматографией, выбранных из вирусной инактивации, ионообменной хроматографии, смешанной хроматографии, нанофильтрации и ультрафильтрации/диафильтрации.
Предпочтительно, описанный выше способ дополнительно включает следующие стадии: (f) инкубацию элюата, полученного на стадии (e) для вирусной инактивации, при низком значении pH от 2,5 до 4,5 в течение по меньшей мере 10 минут;
(g) выполнение катионообменной хроматографии;
(h) выполнение смешанной хроматографии или анионообменной хроматографии;
(i) нанофильтрацию элюата со стадии (h) или композиции, полученной из него и полученной после одной или более дополнительных стадий обработки, выполняемых после стадии (h); и
(j) ультрафильтрацию/диафильтрацию фильтрата стадии (i) или композиции, полученной из него и полученной после одной или более дополнительных стадий обработки, выполняемых после стадии (i).
Другой предпочтительный способ включает следующие стадии в следующем порядке: (а) добавление соединения, вызывающего флокуляцию, к культуральной жидкости;
(b) глубинную фильтрацию смеси стадии (а);
(c) аффинную хромаотграфию фильтрата, полученного на стадии (b), где иммуноглобулин связан со средой для аффинной хроматографии;
(d) промывание среды для аффинной хроматографии с использованием промывочного буфера со значением pH 5-9 и ионной силой 0,1-5 моль/л; и
(e) элюирование иммуноглобулина из смолы для аффинной хроматографии с использованием буфера для элюирования со значением pH от 2,5-4,5.
(f) инкубацию элюата со стадии (e) для вирусной инактивации при низком значении pH от 2,5 до 4,5 в течение по меньшей мере 10 минут;
(g) выполнение катионообменной хроматографии;
(h) выполнение смешанной хроматографии или анионообменной хроматографии;
(i) нанофильтрацию элюата со стадии (h) или композиции, полученной из него и полученной после одной или более дополнительных стадий обработки, выполняемых после стадии (h); и
(j) ультрафильтрацию/диафильтрацию фильтрата стадии (i) или композиции, полученной из него и полученной после одной или более дополнительных стадий обработки, выполняемых после стадии (i);
где стадию g) выполняют в режиме связывания-элюирования, а стадию h) - в режиме связывания-элюирования или в проточном режиме.
Изобретение также решает проблему повышения вирусной безопасности в процессе производства иммуноглобулина.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг 1: Технологические схемы обычных методов очистки иммуноглобулинов
На Фиг 1А показана универсальная схема процесса очистки иммуноглобулинов из больших объемов клеточных культур. Процесс, который начинался с осветленной массы материала, который получают после центрифугирования и/или фильтрации собранной культуральной жидкости, состоит из стадии захвата на Протеине А и двух последующих стадий полировки. Эта схема также включает две типичные стадии защиты от вирусов. Стадия вирусной инактивации выполняется путем поддержания элюата с протеином А при низком уровне pH, а стадия нанофильтрации для удаления вируса выполняется после последней стадии полировки. Заключительной стадией обычно является ультрафильтрация с тангенциальным потоком и/или диафильтрация (UF/DF-TFF) для получения желаемых концентраций иммуноглобулина и ингредиентов препарата.
На Фиг 1B показана классическая схема процесса очистки иммуноглобулинов из больших объемов клеточных культур, состоящего из трех хроматографий (например, согласно Fahrner R.L., 2001 или Kelly B, 2009). Это тот же процесс, что и на Фиг. 1A, за исключением того, что стадии полировки описаны как катионообменная хроматография (стадия полировки 1), за которой следует анионообменная хроматография (стадия полировки 2). Следует подчеркнуть, что катионообменная хроматография проводится в режиме связывания, тогда как анионообменная хроматография проводится в проточном режиме. Следует отметить, что часто применяемый эквивалентный вариант этой классической схемы заключается просто в изменении порядка стадии полировки 1 и 2.
Фиг 2: Примеры схем процесса по изобретению с использованием стадий предварительной очистки.
На Фиг 2А показана схема крупномасштабного процесса со стадией флокуляции перед захватом непосредственно во время сбора в присутствии клеток. Затем флокулированный материал удаляют центрифугированием с последующей глубинной фильтрацией и микрофильтрацией. Стадия флокуляции выполняется путем добавления катионного соединения. Осветленная культуральная жидкость загружается в колонку для хроматографии с захватом, которая представляет собой хроматографию на Протеине А. Две стадии полировки представляют собой катионообменную хроматографию (стадия полировки 1), за которой следует Смешанная хроматография (стадия полировки 2). Катионообменная хроматография проводится в режиме связывания и элюирования. Смола смешанного режима имеет положительно заряженные лиганды и может выполняться в режиме связывания и элюирования или в проточном режиме (FT). Промежуточные стадии вирусной безопасности и конечный UF/DF-TFF описаны на Фиг. 1A.
На Фиг 2В показана альтернативная схема крупномасштабного процесса, который аналогичен процессу на Фиг. 2А, за исключением того, что стадия флокуляции выполняется после разделения клеток в отсутствие клеток. Все остальные стадии описаны на Фиг. 2А.
На Фиг. 2С показана другая альтернативная схема крупномасштабного процесса, который аналогичен процессу на Фиг. 2В, за исключением того, что хроматография окончательной полировки представляет собой анионообменную хроматографию в проточном (FT) режиме. Все остальные стадии описаны на Фиг. 2B и 2A.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Используемый в настоящем описании термин «культуральная жидкость» относится к собранной культуральной жидкости, супернатанту клеточной культуры или предварительно обработанному супернатанту клеточной культуры. Культуральная жидкость может быть получена непосредственно из клетки-хозяина или организма, продуцирующего иммуноглобулин. Культуральная жидкость может быть частично осветлена или очищена центрифугированием и/или фильтрацией, например микрофильтрацией, диафильтрацией, ультрафильтрацией и глубинной фильтрацией.
Используемый в настоящем описании термин «предварительно обработанный» относится, например, к супернатанту клеточной культуры, который был приготовлен для стадии хроматографии, используемой в способе по изобретению, например, подвергая образец одной или более корректировкам, состоящим из замены буфера, разбавления, добавления солей, детергентов, хаотропных веществ или органических соединений, pH-титрования или фильтрации для доведения диапазона pH и/или проводимости и/или буферной емкости для достижения желаемых характеристик хроматографии и стабилизации иммуноглобулина. Поскольку иммуноглобулины, экспрессируемые из клеток млекопитающих, обычно секретируются в культуральную жидкость во время процесса культивирования, сбор продукта в конце процесса культивирования происходит путем отделения культуральной жидкости от клеток. Метод отделения клеток должен быть щадящим, чтобы свести к минимуму разрушение клеток, чтобы избежать увеличения клеточного дебриса и высвобождения протеаз и других молекул, которые могут повлиять на качество продукта иммуноглобулина. Обычно сбор из культур клеток млекопитающих подвергается центрифугированию с последующей фильтрацией. Адсорбционная хроматография с расширенным слоем является альтернативным методом, позволяющим избежать методов центрифугирования/фильтрации. Другая обработка образца перед очисткой с помощью хроматографических стадий может включать концентрирование и/или диафильтрацию супернатанта клеточной культуры до определенной концентрации иммуноглобулина, диапазона pH, проводимости и концентрации буферного вещества.
Используемый в настоящем описании термин «флокуляция» (синонимы «коагуляция» и «агломерация») включает реакцию кластеризации, посредством которой взвешенные твердые частицы в жидкости взаимодействуют с агентом, вызывающим флокуляцию, что приводит к образованию агрегатов или хлопьев большего размера. Термины «флокулянты» и «агенты, вызывающие флокуляцию», которые могут использоваться здесь взаимозаменяемо, могут быть катионными или анионными соединениями. Предпочтительно флокулянты представляют собой катионные соединения. Более предпочтительно флокулянты представляют собой катионные водорастворимые полимеры. «Стадия флокуляции», применяемая в настоящем изобретении, функционирует как стадия предварительной очистки перед улавливающей хроматографией. Флокуляция может выполняться либо в присутствии клеток, тогда это означает, что флокулянт непосредственно добавляют к культуральной жидкости в конце культивирования, а флокулированный материал, включая клетки, удаляют из культуральной жидкости центрифугированием и/или фильтрацией, либо флокулянт добавляют к культуральной жидкости после удаления клеток центрифугированием, а затем флокулированный материал удаляют фильтрацией.
Используемый в настоящем описании термин «катионное соединение» включает ионы металлов и катионные полимеры (поликатионы). «Катионные полимеры» могут представлять собой водорастворимые полимеры или водонерастворимые полимеры. «Водорастворимые полимеры» включают органические вещества, которые растворяются в воде и, таким образом, изменяют физические свойства водных систем. «Водонерастворимые полимеры» имеют ограниченную растворимость в воде. Они диспергируют или набухают в воде и предпочтительно содержат гидрофильные полимеры, которые действуют как флокулянты в водной суспензии. Водонерастворимые полимеры могут стать водорастворимыми при очень низком или при очень высоком pH. Катионные соединения, используемые в качестве флокулянта, выполняют множество функций в водных средах. Водорастворимые или водонерастворимые органические полимеры включают широкий спектр веществ, полученных из природных источников или в результате химического синтеза. Примерами природных водорастворимых или водонерастворимых органических полимеров являются полисахариды (например, пектин, декстран, крахмал, хитозан и гиалуроновая кислота), ксантановая камедь, каррагинан и многие другие. Примерами химически синтезированных органических полимеров являются полиэтиленгликоль (PEG), поливинилпирролидон (PVP), поливиниловый спирт (PVA), полиакриловая кислота (PPA), полиакриламид и многие другие (см. обзор Kadajii VG 2011). По ходу изобретения водорастворимые полимеры действуют как наиболее предпочтительные флокулянты.
Термины «примесь» и «контаминант» используются в настоящем описании взаимозаменяемо и относятся к любому материалу, который отличается от интересующего иммуноглобулина. Примерами могут быть компоненты сред для культивирования клеток, остатки клеток, белки клетки-хозяина, эндотоксины, вирусы, липиды, ДНК, РНК, продукты выщелачивания из технологических материалов и их агрегаты или фрагменты. В качестве примесей также рассматриваются связанные с продуктом вещества, такие как агрегаты, варианты по заряду, неправильно свернутые молекулы или фрагменты представляющего интерес иммуноглобулина, подлежащего очистке.
Термин «осаждение» относится к примесям, которые нерастворимы и/или находятся в нерастворимом состоянии. Осадки могут привести к помутнению образца.
Используемый в настоящем описании термин «хроматографические среды» или «хроматографическая среда» следует понимать как хроматографический материал или среду в форме гранул, пластинок, кристаллов, монолитов, мембран, волокон, сетки волокон или любой другой твердой фазы. «Среда» несет функциональные группы, называемые «лигандами», связанные с основным остовом, непосредственно или через спейсер, называемые «матрицей». Исключением являются смолы гель-хроматографии для эксклюзионной хроматографии, которые обычно не содержат какого-либо присоединенного лиганда. Термин «среда» не ограничивает способы по изобретению только колоночной хроматографией с использованием хроматографических смол, но также включает другие типы хроматографии, например мембранную хроматографию с использованием мембранных адсорберов. В частности, в ионообменной хроматографии изобретение включает ионообменную смолу или мембранный адсорбер для ионообменной хроматографии.
«Смола» означает любой хроматографический материал или среду в форме гранул, содержащих матрицу со связанной функциональной группой (лигандом), которая может взаимодействовать с белком или, по меньшей мере, с одним контаминантом. Исключением являются смолы гель-хроматографии для эксклюзионной хроматографии, которые обычно не содержат какого-либо присоединенного лиганда. Смолы могут поставляться в виде гранул разного размера и упаковываться в колонки. В качестве альтернативы можно приобрести предварительно заполненные колонки.
Под терминами «матрица» или «твердая фаза» подразумевается неводная матрица, к которой лиганд может прикрепляться. Представляющая интерес матрица в настоящем описании обычно представляет собой матрицу, которая включает стекло, керамику, диоксид кремния, целлюлозу, агарозу, метакрилатный полимер или полистирол.
Под «лигандом» подразумевается любая функциональная группа, которая взаимодействует с белком или по меньшей мере с одним контаминантом и которая ковалентно связана с «матрицей».
Термин «режим связывания» или «режим связывания и элюирования» относится к условиям хроматографии, в которых образец, содержащий очищаемый иммуноглобулин, наносят на хроматографическую среду, где иммуноглобулин связывается с хроматографической средой. Таким образом, иммуноглобулин остается на хроматографической среде, тогда как примеси образца могут присутствовать в несвязанной фракции, также называемой проточной фракцией. Когда стадия хроматографии проводится в режиме связывания, одна или более стадий промывания могут быть выполнены после связывания иммуноглобулина с хроматографической средой и до элюирования иммуноглобулина из среды. Для получения иммуноглобулина его затем элюируют и получают в элюате, который затем может быть дополнительно очищен на следующей стадии хроматографии, если желательно. Элюирование иммуноглобулина может быть выполнено с использованием селективных условий, позволяющих контаминантам оставаться связанными со средой во время элюирования иммуноглобулина.
Выполнение стадии хроматографии в «режиме связывания» необязательно означает, что связывается 100% представляющего интерес иммуноглобулина. В контексте настоящего изобретения «связанный с хроматографической смолой» или «связанный с хроматографической средой» означает, что по меньшей мере 50% иммуноглобулина связано, предпочтительно по меньшей мере 75% иммуноглобулина связано, более предпочтительно по меньшей мере 85% иммуноглобулина связано, и наиболее предпочтительно более 95% иммуноглобулина связано со смолой или средой.
В контексте настоящего изобретения следует понимать, что стадия хроматографии с захватом и стадия промежуточной катионообменной хроматографии выполняются в режиме связывания, при этом стадия улавливания считается первой стадией хроматографии, которая выполняется в режиме связывания. Стадия заключительной полировки в смешанном режиме хроматографии по настоящему изобретению выполняется либо в режиме связывания и элюирования, либо в проточном режиме. Кроме того, понятно, что вместо смешанной хроматографии в качестве конечной стадии полировки можно использовать анионообменную хроматографию в проточном режиме.
Термин «проточный режим» относится к условиям хроматографии, в которых образец, содержащий представляющий интерес иммуноглобулин, наносится на хроматографическую смолу или среду, где иммуноглобулин не связывается с хроматографической смолой, но в основном присутствует во фракции, которая не связана со смолой или средой и, таким образом, содержится в элюате. Разработанные промежуточные хроматографии по настоящему изобретению не используют проточный режим. Однако способы по настоящему изобретению могут быть дополнены дополнительными хроматографическими методами полировки в проточном режиме. В этом режиме примеси могут связываться со смолой или средой.
«Стадия промывания» представляет собой стадию, выполняемую в хроматографии в режиме связывания после того, как образец загружен в хроматографическую колонку, но до того, как белок будет элюирован из колонки. На стадии промывания дополнительно удаляются контаминанты, менее плотно или неспецифически связанные с матрицей, с иммуноглобулином и/или лигандом, без значительного элюирования представляющего интерес иммуноглобулина из смолы. На стадии промывания смолу промывают желаемым промывочным буфером (например, промывочный буфер пропускают через хроматографическую колонку до тех пор, пока УФ-поглощение, измеренное на выходе из колонки, не вернется к исходному уровню).
Термин «элюирование» понимается как процесс, который десорбирует представляющий интерес иммуноглобулин с хроматографической смолы путем изменения условий раствора, так что компоненты буфера конкурируют с представляющей интерес молекулой за участок лиганда на хроматографической смоле. Другой способ элюирования имеет место в аффинной хроматографии, например, с использованием Протеина А. В этом случае буфер для элюирования может изменять конформацию лиганда или иммуноглобулина, тем самым ослабляя связывание. Представляющий интерес иммуноглобулин может быть элюирован из ионообменных смол путем изменения ионной силы буфера, окружающего ионообменный материал, таким образом, что ионы буфера в подвижной фазе конкурируют с молекулой за заряженные ионные центры ионообменной смолы. Альтернативно, изменение pH влияет на амфотерный белок, и увеличение pH выше pI белка отныне предотвращает его связывание с катионообменной смолой и белок элюируется. Такой же эффект наблюдается на смоле для анионообменной хроматографии, когда pH снижается ниже pI белка. В данном контексте термин «элюирование» включает изократическое элюирование, одностадийное элюирование и градиентное элюирование с предшествующими стадиями промывания или без них. Элюирование представляющего интерес иммуноглобулина может быть проведено путем увеличения ионной силы или проводимости в подвижной фазе, на что влияет увеличение концентрации соли в буферном растворе. В качестве альтернативы может быть подходящим увеличение или уменьшение значения pH. Могут использоваться прерывистые ступенчатые градиенты, линейные градиенты, нелинейные градиенты или подходящая комбинация таких градиентов.
Буферы, подходящие для промывания и элюирования, могут быть выбраны из ацетата, цитрата, сукцината, малеата, малоната, трис-HCl, трис-ацетата, трис-глицина, фосфата, сукцината, малоната, MES, MOPS, PIPES, PHEPES, bistris, глицина и других подходящих буферов с добавлением солей, таких как фосфаты, сульфаты или хлориды, такие как NaCl или KCl. Ионная сила и концентрация соли, с помощью которых достигается элюирование, зависят от значения pH буферного раствора и pI белка. Промывочный буфер может дополнительно содержать детергент (например, полисорбат), растворитель (например, гексиленгликоль, испропанол или этанол) или полимер (например, полиэтиленгликоль). Кроме того, промывочный буфер может включать хаотропные реагенты (например, мочевину или аргинин) и/или ингибиторы протеаз (например, EDTA).
Используемый в настоящем описании термин «буфер» относится к раствору, который сопротивляется изменениям pH под действием компонентов кислотно-основного конъюгата.
Термины «иммуноглобулин» и «антитело» используются в настоящем описании взаимозаменяемо. Иммуноглобулин может быть моноклональным антителом, поликлональным антителом, полиспецифическим антителом (например, биспецифическим антителом) и их фрагментами, проявляющими желаемую антигенсвязывающую активность. Встречающиеся в природе антитела - это молекулы с различной структурой. Например, нативные антитела IgG представляют собой гетеротетрамерные гликопротеины с массой примерно 150000 дальтон, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, связанных дисульфидными связями. От N- до C-конца каждая тяжелая цепь имеет вариабельный домен (VH), также называемый вариабельным доменом тяжелой цеп, за которым следуют три или четыре константных домена (CH1, CH2, CH3 и необязательно CH4). Аналогично, от N- до С-конца каждая легкая цепь имеет вариабельный домен (VL), также называемый вариабельным доменом легкой цепи, за которым следует константный домен легкой цепи (CL). Легкая цепь антитела может быть отнесена к одному из двух типов, называемых каппа (κ) и лямбда (), на основе аминокислотной последовательности его константного домена λ.
«Фрагменты антител» включают часть полноразмерного антитела, обычно его антигенсвязывающую или вариабельную область. Примеры фрагментов антител включают фрагменты Fab, Fab', F(ab')2 и Fv; молекулы одноцепочечных антител; диантитела; линейные антитела; и полиспецифические антитела, образованные из фрагментов антител.
Предпочтительно иммуноглобулин представляет собой моноклональное антитело. Термин «моноклональное антитело», используемый в настоящем описании, относится к антителу полученному из популяции по существу гомогенных антител, т.е. индивидуальных антител составляющих популяцию, которые являются идентичными за исключением возможных естественных мутаций, которые могут присутствовать в минорных количествах. В отличие от обычных (поликлональных) препаратов антител, которые обычно включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты антигена. Модификатор «моноклональный» указывает на характер антитела, получаемого по существу из гомогенной популяции антител, и его не следует истолковывать как требующее получения антитела каким-либо конкретным способом.
Иммуноглобулин может относиться к классу мышиных IgG1, IgG2a, IgG2b, IgM, IgA, IgD или IgE, классу человеческих IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, IgD или IgE, или их комбинациям или фрагментам.
Иммуноглобулин может распознавать один или комбинацию белков, включая, помимо прочего, следующие антигены: CD2, CD3, CD4, CD8, CD11a, CD14, CD18, CD19, CD20,CD22, CD23, CD25, CD33, CD40, CD44, CD52, CD80 (B7.1), CD79b, CD86 (B7.2), CD147, CD152, IL-la, IL-1β, IL-1, IL-2, IL-3, IL-7, IL-4, IL-5, IL-8, IL-10, IL-12, IL-13, IL-23, IL23a, рецептор IL-2, рецептор IL-4, рецептор IL-6, рецептор IL-12, рецептор IL-13, субъединицы рецептора IL-18, PDGF-β и его аналоги, PLGF, VEGF, TGF, TGF-β2, TGF-p1, рецептор EGF, рецептор PLGF, рецептор VEGF, рецептор тромбоцитов gpIIb/IIIa, рецептор тромбопоэтина, рецептор апоптоза PD-1, фактор роста гепатоцитов, лиганд остеопротегерина, интерферон альфа, интерферон бета, интерферон гамма, стимулятор B-лимфоцитов BLyS, регулятор активации Т-клеток CTLA-4, фактор комплемента C5, IgE, опухолевый антиген CA125, опухолевый антиген MUC1, антиген PEM, ErbB2/HER-2, опухоле-ассоциированные эпитопы, которые присутствуют на повышенных уровнях в сыворотке крови пациентов, опухоле-ассоциированные эпитопы или белки, экспрессируемые на клетках рака груди, толстой кишки, плоскоклеточного рака, предстательной железы, поджелудочной железы, легких и/или почки и/или на клетках меланомы, глиомы или нейробластомы, некротическом ядре опухоли, интегрин альфа 4 бета 7, интегрин VLA-4, интегрины B2, интегрин α4β1 и α4β7, рецепторы TRAIL 1,2,3 и 4, RANK, лиганд RANK (RANKL), TNF-α, молекула адгезии VAP-1, молекула адгезии эпителиальных клеток (EpCAM), молекула межклеточной адгезии-3 (ICAM-3), лейкоинтегрин-адгезин, гликопротеин тромбоцитов gp IIb/IIIa, тяжелая цепь сердечного миозина, паратироидный гормон, склеростин, MHC I, карциноэмбриональный антиген (CEA), кальцитонин (связанный с геном пептид CGRP), альфа-фетопротеин (AFP), фактор некроза опухоли (TNF), рецептор Fc-y-1, бета HLA-DR 10, антиген HLA-DR, L-селектин, Калликреин, Кирин и IFN-γ.
Иммуноглобулин может представлять собой, например, афелимомаб, абциксимаб, адалимумаб, адо-трастузумаб, адуканумаб, алемтузумаб, алирокумаб, анифролюмаб, арцитумомаб, атезолизумаб, авелумаб, базиликсимаб, белимумаб, бенрализумаб, бевацизумаб, безлотоксумаб, блинатумомаб, бокозизумаб, бразикумаб, брентуксимаб, бродалумаб, бролуцизумаб, канакинумаб, каплацизумаб, капромаб, цемиплимаб, цертолизумаб, цетуксимаб, кленоликсимаб, клаудиксимаб, кризализумаб, даклизумаб, даратумумаб, деносумаб, динутуксимаб, дупилумаб, дурвалумаб, экулизумаб, эдреколомаб, элотузумаб, эмицизумаб, эптинезумаб, эренумаб, эвинакумаб, эволокумаб, фреманезумаб, форавирумаб, галканезумаб, галиксимаб, гемтузумаб, голимумаб, гуселкумаб, ибализумаб, ибритумомаб, имциромаб, идаруцизумаб, инебилизумаб, инфликсимаб, инотузумаб, ипилимумаб, иксекизумаб, келиксимаб, ланаделумаб, лебрикизумаб, лексатумумаб, маврилимумаб, меполизумаб, мирикизумаб, могамулизумаб, мосунетузумаб, муромонаб-CD3, натализумаб, нецитумумаб, ниволумаб, нофетумомаб, обинутузумаб, окрелизумаб, офатумумаб, оларатумаб, омализумаб, паливизумаб, панитумумаб, пембролизумаб, пертузумаб, полатузумаб, рамуцирумаб, ранибизумаб, равулизумаб, рестузумаб, ресанкизумаб, ритуксимаб, ромосозумаб, ровалпитузумаб, сацитузумаб, сарилумаб, сатрализумаб, секукинумаб, сирукумаб, танекумаб, тезепелумаб, тезолизумаб, тоцилизумаб, тоситумомаб, тралокинумаб, трастузумаб, тремелимумаб, ублитуксимаб, устекинумаб, и ведолизумаб.
Иммуноглобулин по изобретению предпочтительно представляет собой молекулу IgG, такую как молекула IgG1, IgG2, IgG3 или IgG4. Более предпочтительно иммуноглобулин представляет собой IgG1 или IgG2. Еще более предпочтительно, иммуноглобулин представляет собой IgG1 или IgG2, где по меньшей мере Fc-часть является человеческой. Иммуноглобулин может представлять собой химерный IgG1 мыши и человека, где Fc-часть IgG1 является человеческой. Наиболее предпочтительно химерный иммуноглобулин представляет собой ритуксимаб или инфликсимаб.
Ритуксимаб представляет собой химерное антитело против CD20, которое подробно описано, например, в WO9411026.
Инфликсимаб представляет собой химерное антитело против TNFα, которое подробно описано, например, в WO9216553.
Иммуноглобулин может быть гуманизированным IgG1 из мышиного предшественника. Наиболее предпочтительно гуманизированное антитело представляет собой трастузумаб или бевацизумаб.
Трастузумаб представляет собой гуманизированное антитело против HER2, которое подробно описано, например, в WO9222653.
Бевацизумаб представляет собой гуманизированное антитело против VEGF, которое подробно описано, например, в WO9845331.
Иммуноглобулин может быть полностью человеческим антителом IgG1 или IgG2. Наиболее предпочтительно человеческое антитело представляет собой адалимумаб (IgG1) или деносумаб (IgG2).
Адалимумаб представляет собой человеческое антитело против TNFα, которое подробно описано, например, в WO9729131.
Деносумаб представляет собой человеческое антитело против RANKL, которое подробно описано, например, в WO03002713.
В одном из вариантов осуществления иммуноглобулин представляет собой бевацизумаб, трастузумаб или деносумаб.
Моноклональные антитела в настоящем описании, в частности, включают «химерные» антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, происходящих от конкретного вида или принадлежащих к конкретному классу или подклассу антител, в то время как остальная часть цепи (цепей) идентична или гомологична соответствующим последовательностям в антителах, происходящих от другого вида или принадлежащих к другому классу или подклассу антител, а также фрагментам таких антител при условии, что они проявляют желаемую биологическую активность.
Кроме того, моноклональные антитела здесь также включают «гуманизированные» антитела. Такие антитела получают путем «гуманизации» нечеловеческих (например, мышиных) антител и содержат только минимальные последовательности, полученные из иммуноглобулина животных. Большая часть молекулы относится к последовательности человека. Остатки из гипервариабельной области человеческого антитела-реципиента заменены остатками из гипервариабельной области нечеловеческого донорного антитела, имеющего желаемые связывающие свойства.
Наконец, моноклональные антитела настоящего описания также включают полностью человеческие антитела, которые могут быть получены путем скрининга библиотеки генов человеческих антител.
В предпочтительном варианте осуществления образец получают из культуральной жидкости, которую получают из культуры рекомбинантных клеток СНО. Предпочтительно культуральная жидкость получают из культуры рекомбинантных клеток в фазе роста.
Способ по настоящему изобретению можно использовать для очистки иммуноглобулинов в малых и больших масштабах. Предпочтительно, чтобы способ осуществлялся в крупном масштабе.
«Мелкомасштабный», также обозначаемый как «лабораторный масштаб», относится к очистке образцов, содержащих менее 50 г иммуноглобулина, менее 10 г иммуноглобулина или менее 1 г иммуноглобулина. «Мелкомасштабный» также относится к процессам очистки, в которых белок, элюированный из колонки стадии захвата, составляет менее 50 г иммуноглобулина, менее 10 г иммуноглобулина или менее 1 г иммуноглобулина.
«Крупномасштабный», также называемый «производственным масштабом» или «коммерческим масштабом», относится к очистке образцов, содержащих более 50 г иммуноглобулина, более 100 г иммуноглобулина, более 200 г иммуноглобулина или более 300 г иммуноглобулина. «Крупномасштабный» также относится к процессам очистки, в которых белок, элюированный из колонки стадии захвата, составляет более 50 мкг иммуноглобулина, более 100 мкг иммуноглобулина, более 200 мкг иммуноглобулина или более 300 мкг иммуноглобулина.
Термин «дальнейшая стадия обработки» относится к любой стадии, которая обычно применяется в протоколах очистки белков, такой как фильтрация, диализ, вирусная инактивация, разведение, концентрирование, регуляция pH, регуляция проводимости, промежуточная стадия хроматографии или стадия удерживания для любой цели. Дополнительная стадия обработки может применяться между всеми стадиями хроматографии по изобретению. Промежуточная стадия хроматографии может применяться между любыми стадиями хроматографии. В частности, термин «дополнительная стадия обработки» относится к промежуточной стадии хроматографии, применяемой между хроматографией с захватом и катионообменной хроматографией. Промежуточный стадия хроматографии можно проводить с любой хроматографической средой в любом режиме. На промежуточной стадии хроматографии можно использовать любой тип хроматографии, включая колоночную хроматографию и мембранную хроматографию.
В качестве дополнительной промежуточной стадии или стадии полировки также могут использоваться другие типы хроматографии. Например, хроматография на анионообменной колонке и хроматография на анионообменной мембране могут использоваться в качестве стадии полировки, наиболее предпочтительным является проточный режим. Другая возможность заключается в применении хроматографии на гидроксиапатите, в частности, на керамическом гидроксиапатите в режиме связывания.
Первый аспект изобретения относится к способу предотвращения осаждения в ходе аффинной хроматографии с захватом иммуноглобулина из культуральной жидкости, причем способ включает следующие стадии в следующем порядке:
(а) добавление соединения, вызывающего флокуляцию, к культуральной жидкости;
(b) глубинную фильтрацию смеси стадии (а);
(c) аффинную хромаотграфию фильтрата, полученного на стадии (b), где иммуноглобулин связан со средой для аффинной хроматографии;
(d) промывание среды для аффинной хроматографии с использованием промывочного буфера со значением pH 5-9 и ионной силой 0,1-5 моль/л; и
(e) элюирование иммуноглобулина из смолы для аффинной хроматографии с использованием буфера для элюирования со значением pH от 2,5-4,5.
Стадия предварительной очистки: Флокуляция
В экспериментах, которые привели к настоящему изобретению, было обнаружено, что бесклеточный материал сбора (осветленный супернатант) все еще содержит несколько веществ, которые вместе с очищаемым иммуноглобулином прочно связываются с улавливающей смолой. Это влияет на повторное использование смолы и качество иммуноглобулина после элюирования из улавливающей смолы. Это можно улучшить с помощью дополнительной хроматографии предварительной очистки на основе анионообменной хроматографии в проточном режиме (WO2015135884). Несмотря на заметное снижение уровней HCDNA и HCP, все еще существует потребность в дальнейших улучшениях. Было замечено, что элюат с Протеином А все еще имеет тенденцию к помутнению, которое вызвано примесями, а не самим иммуноглобулином. Низкий pH, необходимый для элюирования, относительное количество примесей и высокие концентрации белка способствуют помутнению. Помимо мутных пулов для элюирования также наблюдалось повышенное противодавление колонки. Лучше всего это объясняет повышенная вязкость. Кроме того, колонка для анионообменной хроматографии предварительной очистки является нежелательным фактором стоимости из-за относительно большого размера, необходимого для очень высокой нагрузки контаминантов. Последнее усиливается за счет увеличения времени ферментации, необходимого для более высокого титра моноклональных антител и, следовательно, для экономичного производства. Поскольку фильтрующий эффект анионообменной смолы ограничивается в основном задерживанием отрицательно заряженных молекул, а некоторые из вызывающих помутнение примесей все еще проскальзывают, возникла потребность в более простой и более эффективной стратегии очистки перед захватом. Согласно результатам настоящего изобретения, введение подходящего метода флокуляции предварительной очистки неожиданно представляет собой хорошее решение для быстрой и простой очистки собранной культуральной жидкости. За счет удаления дополнительных примесей разработанный метод флокуляции улучшает чистоту образца, снижает критические загрязнения, которые способствуют помутнению во время элюирования среды для захвата с низким pH, и защищает дорогостоящую аффинную колонку. Способ флокуляции по настоящему изобретению является простым, быстрым, без потерь продукта и по разумной цене. Более того, оказалось, что метод флокуляции может быть выполнен либо (i) до того, как клетки будут удалены из культуральной жидкости, что означает в присутствии клеток, либо (ii) после того, как клетки были удалены из культуральной жидкости, что означает отсутствие клеток. Чистота иммуноглобулина до и после стадии с Протеином А сопоставима для обоих методов. В первом методе флокулированный материал, который также включает клетки, отделяется центрифугированием, а супернатант дополнительно очищается с помощью системы фильтрации. В последнем методе клетки осаждают центрифугированием, а супернатант подвергается флокуляции. Затем система фильтрации удаляет флокулированный материал. В простейшем случае система фильтрации состоит из глубинного фильтра. Однако более предпочтительной является последовательная система глубинного фильтра и микрофильтра. В ходе масштабного и полномасштабного производства предпочтительным методом оказалась флокуляция после разделения клеток. Когда флокуляция проводилась непосредственно в культуре клеток, удаление хлопьев, содержащих всю клеточную массу, из ферментера и сепаратора занимало очень много времени.
Было известно большое количество различных методов флокуляции с использованием различных флокулянтов, которые экспериментально доказали свою эффективность при осветлении культур клеток млекопитающих, экспрессирующих моноклональные антитела. Большинство методов требуют комбинации веществ и/или дальнейших манипуляций с культуральной жидкостью, например адаптации pH. Кроме того, во многих опубликованных методах вместо стадии центрифугирования используется флокуляция. Напротив, настоящее изобретение объединяет три метода оптимального осветления культуральной жидкости в следующем порядке: 1) разделение клеток центрифугированием или фильтрацией, 2) флокуляция и 3) глубинная фильтрация.
Когда pH культуральной жидкости меньше, чем pI очищаемого антитела, антитело несет чистый положительный заряд. В этих условиях катионный электролит может флокулировать или осаждать примеси, остаточные клетки и клеточный дебрис и оставлять антитело в растворе. Затем хлопья можно удалить центрифугированием и/или глубинной фильтрацией, необязательно с последующей микрофильтрацией.
В настоящем изобретении для индукции флокуляции используется одно катионное соединение, такое как ион двухвалентного металла, водорастворимый органический полимер или водонерастворимый органический полимер. Никаких дополнительных веществ, таких как реагирующие на стимул полимеры или соли, не требуется для выполнения стадии флокуляции по настоящему изобретению. Аналогичным образом, способ флокуляции по настоящему изобретению выполняется без дополнительного доведения pH или проводимости.
Термин «в следующем порядке» следует понимать как означающий, что упомянутые стадии процесса выполняются в указанном порядке. Дополнительные стадии процесса могут быть включены до, после и между перечисленными стадиями процесса.
Хроматографическая среда может быть одноразовой или многоразовой. В одном варианте осуществления хроматографическая смола является многоразовой. В конкретном варианте осуществления хроматографические смолы стадии (b), (c) и (d) можно использовать повторно.
Многоразовые хроматографические среды являются более экономичными по сравнению с хроматографическими средами, сконфигурированными как одноразовые. В частности, для хроматографии с захватом используются большие объемы хроматографической среды. Следовательно, особенно выгодно использовать многоразовую хроматографическую среду, например смолу для аффинной хроматографии, которую часто используют повторно для стадии захвата. Использование стадий предварительной очистки по настоящему изобретению позволяет уменьшить масштаб дорогостоящей колонки аффинного захвата и увеличить срок службы и, таким образом, снизить общую стоимость товаров.
Термин «многоразовый», используемый в настоящем описании, означает, что среда или смола сконфигурированы для повторного использования более чем в одном цикле очистки, то есть по меньшей мере 2, 5, 10, 50, 100, 200, 300, 400, 500 или более циклов очистки. Между каждым циклом хроматографическую среду или смолу можно промывать и/или регенерировать, и/или стерилизовать, и/или хранить.
В предпочтительном варианте осуществления катионное соединение, используемое в качестве флокулянта, выбирают из соли иона двухвалентного металла, водорастворимого органического полимера и водонерастворимого органического полимера. Более предпочтительны водорастворимые органические полимеры.
Соль иона двухвалентного металла может представлять собой, например, CaCl2. Водорастворимый органический полимер может представлять собой, например, поли(диаллилдиметиламмоний хлорид). Водонерастворимым органическим полимером может быть, например, хитозан. Еще более предпочтительно флокулянт представляет собой поли(диаллилдиметиламмоний хлорид).
В одном варианте осуществления водорастворимый органический полимер применяют с конечной концентрацией от 0,01 до 1,0% (мас./об.), предпочтительно от 0,02 до 0,15% (мас./об.), более предпочтительно от 0,025 до 0,090% (мас./об.). В предпочтительном варианте осуществления водорастворимый органический полимер добавляют с конечной концентрацией от 0,0375 до 0,075% (мас./об.). В другом предпочтительном варианте осуществления водорастворимый органический полимер добавляют с конечной концентрацией от 0,015 до 0,05% (мас./об.).
В предпочтительном варианте осуществления водорастворимый органический полимер, используемый для индукции флокуляции, представляет собой поли(диаллилдиметиламмоний хлорид) с молекулярной массой от 10 кДа до 10000 кДа. В другом предпочтительном варианте осуществления стадию флокуляции проводят при перемешивании при комнатной температуре в течение по меньшей мере 10 минут, по меньшей мере 15 минут или по меньшей мере 20 минут, предпочтительно по меньшей мере 30 минут. Комнатная температура в настоящем изобретении означает 15-25°C, 20-25°, предпочтительно 18-22°C. Перемешивание означает непрерывное перемешивание и/или перемешивание с использованием подходящих механических устройств.
В другом предпочтительном варианте осуществления исходный раствор поли(диаллилдиметиламмоний хлорида), добавляемый к культуральной жидкости для индукции флокуляции, имеет концентрацию 5-15% (мас./об.), предпочтительно 9-11% (мас./об.), более предпочтительно 10% (мас./об.). Наиболее предпочтительным является раствор с нейтральным pH, содержащий менее 0,1% хлорида диаллиламмония, имеющий микробное число менее 10 КОЕ/мл, и не содержащий хлорида натрия.
В одном варианте осуществления настоящего изобретения стадия флокуляции выполняется перед удалением клеток из культуральной жидкости путем добавления флокулянта непосредственно в ферментер в конце периода культивирования. Другими словами, в таких вариантах осуществления перед стадией флокуляции дальнейшее центрифугирование и/или фильтрация не происходит. Затем хлопья, включая клетки, удаляют осаждением в центрифуге, предпочтительно в тарелочном сепараторе, подходящем для больших объемов. Полученный супернатант можно дополнительно осветлить глубинной фильтрацией, необязательно с последующей микрофильтрацией.
В других вариантах осуществления стадия (а) включает следующие стадии:
(а1) центрифугирование и/или фильтрацию культуральной жидкости; и
(а2) добавление соединения, вызывающего флокуляцию, к супернатанту или фильтрату, полученному на стадии (а1).
Другими словами, стадия флокуляции выполняется после удаления клеток из культуральной жидкости путем добавления флокулянта к супернатанту после выполнения стадии центрифугирования и/или фильтрации.
Таким образом, в конкретных вариантах осуществления способ по изобретению включает следующие стадии в следующем порядке:
(а1) центрифугирование и/или фильтрация культуральной жидкости;
(а2) добавление соединения, вызывающего флокуляцию, к супернатанту или фильтрату, полученному на стадии (а1);
(b) глубинную фильтрацию смеси стадии (а2);
(c) аффинную хромаотграфию фильтрата, полученного на стадии (b), где иммуноглобулин связан со средой для аффинной хроматографии;
(d) промывание среды для аффинной хроматографии с использованием промывочного буфера со значением pH 5-9 и ионной силой 0,1-5 моль/л; и
(e) элюирование иммуноглобулина из смолы для аффинной хроматографии с использованием буфера для элюирования со значением pH от 2,5-4,5.
Предпочтительно хлопья со стадии (а2) удаляют глубинной фильтрацией, необязательно с последующей микрофильтрацией.
Предпочтительно, за исключением поли(диаллилдиметиламмоний хлорида), никаких дополнительных веществ для проведения флокуляции не добавляется. Другими словами, на стадии (а) не добавляют никаких других вызывающих флокуляцию соединений, кроме поли(диаллилдиметиламмоний хлорида).
Предпочтительно флокуляцию поли(диаллилдиметиламмоний хлоридом) проводят без дополнительной регуляции pH или проводимости. Это означает, что на стадии флокуляции и следующей стадии (стадиях) фильтрации перед аффинной хроматографией, в частности, на стадии флокуляции (а2), pH или проводимость не доводят.
Таким образом, в конкретном варианте осуществления способ по изобретению включает следующие стадии в следующем порядке:
(а1) центрифугирование и/или фильтрация культуральной жидкости;
(а2) добавление соединения, вызывающего флокуляцию, к супернатанту или фильтрату, полученному на стадии (а1);
(b) глубинную фильтрацию смеси стадии (а2);
(c) аффинную хромаотграфию фильтрата, полученного на стадии (b), где иммуноглобулин связан со средой для аффинной хроматографии;
(d) промывание среды для аффинной хроматографии с использованием промывочного буфера со значением pH от 5 до 9 и ионной силой от 0,1 до 5,0 моль/л; и
(e) элюирование иммуноглобулина из смолы для аффинной хроматографии с использованием буфера для элюирования со значением pH от 2,5 до 4,5.
где, за исключением поли(диаллилдиметиламмоний хлорида), никакие другие вещества не добавляются для выполнения флокуляции; и
где флокуляцию поли(диаллилдиметиламмоний хлоридом) проводят без дополнительной регуляции pH или проводимости.
Стадия хроматографии с аффинным захватом: хроматография на Протеине А
Под термином «стадия захвата» понимается первая стадия хроматографии, проводимая в режиме связывания. Стадия захвата для очистки иммуноглобулина из культуральных жидкостей обычно выполняется как стадия аффинной хроматографии. Протеин А или его производные или аналоги в основном используются для аффинного захвата. Согласно настоящему изобретению аффинная хроматография успешно применялась для захвата иммуноглобулинов. Термин «аффинная хроматография» для настоящего изобретения означает метод селективного связывания иммуноглобулина из культуральной жидкости на основе высокоспецифичного взаимодействия между лигандом и иммуноглобулином.
Используемый в настоящем описании термин «аффинная хроматография с иммуноглобулинсвязывающим белком/пептидом» относится к аффинной хроматографии, в которой в качестве лигандов используются рекомбинантные белки микробного происхождения (например, Staphylococcus aureus, Streptococcus, Peptostreptococcus magnus) или их варианты, или синтетические пептиды, которые могут быть микробного происхождения со способностью связываться с иммуноглобулинами. Типичные связывающие иммуноглобулин белки могут представлять собой Протеин A, Протеин G, Протеин L или Протеин A/G. Помимо этого связывающие белки из белков микробного происхождения или пептиды, полученные из рецептора Fc гамма A (FcR-IIIA), также являются примерами аффинных лигандов. Предпочтительно иммуноглобулин-связывающий белок или пептид представляет собой Протеин A. Лиганды могут включать один или более доменов E, D, A, B и C Протеина A. Более предпочтительно лиганды включают домен B Протеина A или сконструированного белка Z. Примером смолы, использующей в качестве лиганда пептид 14 кДа, полученный рекомбинантно с Saccharomyces cerevisiae, является IgSelect (GE Healthcare). Этот лиганд, о котором нет дополнительной информации, был специально разработан для обеспечения высокой аффинности ко всем подклассам человеческого IgG-Fc.
Используя стадию аффинной хроматографии с Протеином А в качестве стадии захвата после стадии предварительной очистки флоккуляции, способ по настоящему изобретению обеспечивает рентабельный способ очистки иммуноглобулинов, используя при этом значительную специфичность связывания аффинной хроматографии с Протеином А при очистке иммуноглобулинов.
В предпочтительном варианте осуществления изобретение относится к способу очистки иммуноглобулина из образца, содержащего иммуноглобулин и по меньшей мере одну примесь, причем способ включает следующие стадии в следующем порядке:
(а) добавление соединения, вызывающего флокуляцию, к культуральной жидкости;
(b) глубинную фильтрацию смеси стадии (а);
(c) хроматографию с протеином A фильтрата, полученного на стадии (b), с, где иммуноглобулин связан со средой хроматографии с Протеином A;
(d) промывание хроматографической среды с Протеином A с использованием промывочного буфера со значением pH от 5 до 9 и ионной силой от 0,1 до 5,0 моль/л; и
(e) элюирование иммуноглобулина из смолы для аффинной хроматографии с использованием буфера для элюирования со значением pH от 2,5-4,5.
В предпочтительном варианте осуществления смола для хроматографии с Протеином А, используемая на стадии улавливания, содержит устойчивое к щелочам производное Протеина А в качестве лиганда, связанного с агарозой с высокой степенью поперечных связей. В более предпочтительном варианте осуществления устойчивое к щелочам производное протеина A представляет собой стабилизированный щелочью тетрамерный вариант домена B Протеина A.
Чтобы сделать смолу для аффинной хроматографии с Протеином А более устойчивой к жестким условиям очистки и обеспечить защиту от эффектов перекрестной контаминации между циклами, в настоящее время обычно используют улучшенные аффинные смолы для Протеина А, содержащие лиганды, специально разработанные для обеспечения устойчивости к щелочам, высокой связывающей способностью и низким выщелачиванием лиганда. Однако одним из основных недостатков этих улучшенных смол является то, что они значительно дороже обычных смол для Протеина А. Важным преимуществом способа по настоящему изобретению является то, что можно использовать как обычные смолы для Протеина А, так и продукты смолы для Протеина А более нового поколения. Поскольку смолы для Протеина A экспонируются с меньшим содержанием примесей, обычные и более дешевые смолы для Протеином A становятся приемлемыми, несмотря на их ограничение довольно мягкими условиями регенерации. Однако в результате стадии предварительной очистки по настоящему изобретению и независимо от выбранной смолы для Протеина А можно использовать как обычные смолы, так и смолы нового поколения в течение более длительного срока службы. Кроме того, благодаря тому, что очистка колонки с Протеином А становится легче, процесс также становится более экономичным.
Примеры обычных смол для Протеина A, которые могут использоваться для целей изобретения, могут включать, но не ограничиваются ими, Unosphere SUPrA (Bio-Rad), Protein A Ceramic HyperD F (Pall Corporation), Poros MabCapture A (Applied Biosystems), ProSep HC, ProSep Ultra и ProSep Ultra Plus (EMD Millipore), Протеин A-сефароза FF, рПротеин A-сефароза FF, rmp Протеин A-сефароза FF, IgSelect, MAbSelect, MAbSelect SuRe, MAbSelect SuRe LX, MabSelect Xtra, мАт GESelect PrismA (Healthcare), Praesto A, Praesto AP, Praesto APc, Praesto Jetted A50 (Purolite Life Sciences) и Toyopearl рПротеин A (Tosoh Bioscience).
При использовании в настоящем описании термин «Протеин A» охватывает Протеин A, выделенный из его природного источника, Протеин A, полученный синтетическим или биосинтетическим способом (например, путем пептидного синтеза или рекомбинантными методами), и его варианты, которые сохраняют способность связывать белки, которые содержат CH2/CH3 и/или Fc-области. Предпочтительно можно использовать смолы с высокой связывающей способностью и/или щелочной стабильностью. Например, можно использовать Протеин A, производное Протеина A или стабилизированную щелочью аффинную среду, производную Протеина A. Предпочтительно можно использовать стабилизированные щелочью лиганды на основе Протеина А (E.coli, Saccharomyces cerevisiae). Стабилизированный щелочью лиганд, производный Протеина А, может быть присоединен к агарозной матрице, имеющей высокую степень поперечных связей, предпочтительно иммобилизованный с помощью химически стабильной тиоэфирной связи. Одним из примеров является MabSelect SuRef от GE Healthcare Life Sciences, который может быть быстро и эффективно очищен после прогона с добавлением до 0,5 М NaOH. Стабилизированный щелочью лиганд MabSelect SuRe является производным B-домена Протеина A и по существу не имеет связывающего домена VH3, что обеспечивает более высокое pH элюирования. Предпочтительным продуктом является MabSelect SuRe LX, который имеет более высокую связывающую способность, чем MabSelect SuRe.
Одна или более стадий промывания между загрузкой образца на аффинную колонку с Протеином A и элюированием иммуноглобулина из колонки с Протеином A могут быть включены с использованием специального промывочного буфера (буферов). Промывочный буфер представляет собой буфер, используемый для удаления примесей из смолы с протеином A без удаления значительных количеств представляющего интерес иммуноглобулина, связанного с Протеином A. Промывочный буфер может содержать соль и детергент (например, полисорбат); соль и растворитель (например, гексиленгликоль); соль высокой концентрации (например, Трис-буфер высокой молярности); или соль и полимер (например, полиэтиленгликоль). Кроме того, промывочный буфер может включать хаотропные реагенты (например, мочевину или аргинин) и/или ингибиторы протеаз (например, EDTA). Наконец, промывочный буфер может иметь более низкое pH в качестве буфера для загрузки и/или более высокое pH в качестве буфера для элюирования.
Для элюирования представляющего интерес иммуноглобулина из колонки с Протеином А применяется буфер для элюирования. Предпочтительно буфер для элюирования имеет низкое pH и тем самым нарушает взаимодействия между Протеином А и представляющим интерес иммуноглобулином, изменяя конформацию белка. Предпочтительно элюирующий буфер с низким pH имеет pH в диапазоне от примерно 2 до примерно 5, наиболее предпочтительно в диапазоне от примерно 3 до примерно 4. Примеры буферов, которые будут контролировать pH в этом диапазоне, включают фосфатный, ацетатный, цитратный, глициновый и аммониевый буферы, а также их комбинации.
Такими предпочтительными буферами являются цитратный и ацетатный буферы, наиболее предпочтительно буферы с цитратом натрия или ацетатом натрия. Предусмотрены другие буферы для элюирования, включая буферы с высоким pH (например, имеющие pH 9 или более) или буферы, содержащие соединение или композицию, такую как MgCl2 (2 мМ), для элюирования представляющего интерес иммуноглобулина.
Смолу для аффинной хроматографии с Протеином А можно регенерировать с помощью 0,1-0,5 NaOH, предпочтительно внутри колонки (очистка на месте).
Промежуточная/полирующая стадия хроматографии: катионообменная хроматография
Описанный в настоящем документе способ может дополнительно включать стадию катионообменной хроматографии.
Катионообменная хроматография основана на взаимодействии заряд-заряд между белками в образце и зарядами, иммобилизованными на смоле. В катионообменной хроматографии связываемые молекулы заряжены положительно, а иммобилизованные функциональные группы (лиганды) заряжены отрицательно. Обычно используемые катионообменные смолы - это S-смолы (сульфонат), смолы SP (сульфопропил), смолы SiB (сульфоизобутил), смолы SE (сульфоэтил) и смолы CM (карбоксиметил).
Однако в целом стадию катионообменной хроматографии можно проводить со всеми общими коммерчески доступными катионообменными смолами или мембранами. Катионообменные смолы можно использовать в виде предварительно набитых колонок или мембран, на которых фиксируется функциональная группа, например сульфоновая кислота. В качестве альтернативы, смолы могут быть приобретены в виде массы материала, а колонки могут быть набиты пользователем. Нет никаких особых ограничений в отношении вместимости и размеров колонок, кроме обычных. Специалист в данной области знает количество катионообменной смолы и размер используемой колонки. Это зависит от общего масштаба процесса.
Типичные коммерчески доступные продукты включают, например, Macro-Prep High S, Macro-Prep CM, Unosphere Rapid S, Unosphere Rapid S40, Nuvia S и Nuvia HR-S (Bio-Rad, Калифорния, США), Toyopearl CM, Toyopearl SP, Toyopearl Sulfate 650 F и Toyopearl GigaCap S (Tosoh Bioscience, Германия), Millipore ProRes S, Fractogel EMD COO-, Fractogel EMD SO3-, Fractogel EMD SE Hicap, Eshmuno CPX (Merck KGaA, Германия), Biosepra CM Ceramic, Biosepra S Ceramic HyperD, S HyperCel (Pall Corperation, Нью-Йорк, США), Poros HS, Poros XS (Applied Biosystems, Германия), BioPro IEX SmartSep S, BioPro IEX S75 (YMC Europe), Praesto SP, Praesto Jetted SP35 (Purolite Life Sciences, Europe), CM-сефароза FF, SP-сефароза FF, S-сефароза FF, SP-сефароза HP, SP-сефароза XL, большие гранулы SP-сефарозы, CM-сефадекс, Capto S, Capto SP ImpRes и Source S (все GE Healthcare, Германия).
Обычно катионообменную хроматографию проводят с использованием буферов при значениях pH от 4 до 7.
Предпочтительные катионообменные смолы по настоящему изобретению представляют собой сильные катионообменники с использованием сульфонатных, сульфопропильных или сульфоизобутильных лигандов. Наиболее предпочтительны сульфонатные или сульфопропильные лиганды, связанные с жесткими матрицами, такими как агароза, имеющая высокую степень поперечных связей, например Nuvia HR-S или поли(стиролвинилбензол), например Poros 50 HS или полиметакрилат, например Фрактогель EMD SO3-. Наиболее предпочтительной катионообменной смолой является Poros HS 50 с сульфопропильными (-CH2CH2CH2SO3-) лигандами, связанными с поперечно-сшитой поли(стиролдивинилбензольной) матрицей.
Катионообменная хроматография может быть уравновешена буфером, имеющим pH от примерно pH 4 до примерно pH 8. Концентрация буфера может составлять от 10 до 100 мМ, предпочтительно от 20 до 50 мМ.
Примерами буферов, используемых для катионообменной хроматографии, являются лимонная кислота, молочная кислота, янтарная кислота, муравьиная кислота, бутандиовая кислота, уксусная кислота, малоновая кислота, глицин, MES, PIPES, фосфат, бистрис или их смеси.
Стадия катионообменной хроматографии может разделять заряженные варианты иммуноглобулина и может истощать остаточные белки клетки-хозяина, ДНК, агрегаты, фрагменты, вирусы, эндотоксины, флокулянты и выщелоченный Протеин А.
Иммуноглобулин может связываться со смолой при значении pH ниже изоэлектрической точки (pI) иммуноглобулина и при низкой проводимости.
Изоэлектрическая точка или pI белка относится к pH, при котором белок имеет общий суммарный заряд, равный нулю, то есть pH, при котором белок имеет равное количество положительных и отрицательных зарядов. Определение pI может быть выполнено согласно методикам, разработанным в предшествующем уровне техники, таким как изоэлектрическое фокусирование.
Низкая проводимость означает менее 2 мСм/см.
Для элюирования может использоваться увеличение ионной силы буфера для элюирования, обеспечиваемое либо одной стадией, либо градиентом. Примеры солей, используемых при элюировании при катионообменной хроматографии, представляют собой хлоридные соли, сульфатные соли, фосфатные соли, цитратные соли, формиатные соли или ацетатные соли. Предпочтительно используются NaCl или KCl. Ионная сила может быть увеличена до 1М.
В качестве альтернативы можно использовать повышение pH буфера для элюирования, обеспечиваемое либо за одну стадию, либо за счет градиента.
Предпочтительным вариантом осуществления катионообменной хроматографии является рабочий диапазон pH от 4 до 6, более предпочтительно диапазон pH от 4,5 до 5,5. В качестве буферных веществ могут использоваться либо карбоновые кислоты, либо аминокислоты, наиболее предпочтительны лимонная кислота или глицин.
В другом предпочтительном варианте осуществления элюирование иммуноглобулина, связанного с катионообменной смолой, осуществляется путем изменения значения pH, то есть увеличения pH. Этого можно достичь с помощью градиента от низкого pH до высокого pH, обеспечиваемого смешиванием двух различных буферных растворов. Предпочтительны цитратные буферы для низкого pH и фосфатные буферы для высокого pH. В предпочтительном варианте осуществления градиент pH формируется путем смешивания цитратного буфера с pH примерно от 5 до 6 с фосфатным буфером с pH примерно от 7 до 9. Буферы могут быть приготовлены с использованием натриевых солей кислот в концентрации от 10 до 50 мМ. Предпочтительный диапазон градиента pH составляет от 5 до 7,5. В другом предпочтительном варианте осуществления градиент pH формируется путем смешивания глициновых буферов с pH 8,7 и pH 10,5. Необязательно доводят pH пула для элюирования, например с использованием уксусной кислоты перед загрузкой в последнюю хроматографическую колонку.
В качестве альтернативы для элюирования можно использовать увеличение как pH, так и ионной силы буфера для элюирования, обеспечиваемое либо за одну стадию, либо градиентом.
В одном варианте осуществления элюат после хроматографии на Протеине А подвергают катионообменной хроматографии.
Обычно элюат после хроматографии на Протеине А подвергается стадии вирусной инактивации с последующей катионообменной хроматографией.
Таким образом, в некоторых вариантах осуществления способ по изобретению может включать следующие стадии в следующем порядке:
(а) добавление соединения, вызывающего флокуляцию, к культуральной жидкости;
(b) глубинную фильтрацию смеси стадии (а);
(c) аффинную хромаотграфию фильтрата, полученного на стадии (b), где иммуноглобулин связан со средой для аффинной хроматографии;
(d) промывание среды для аффинной хроматографии с использованием промывочного буфера со значением pH от 5 до 9 и ионной силой от 0,1 до 5,0 моль/л; и
(e) элюирование иммуноглобулина из смолы для аффинной хроматографии с использованием буфера для элюирования со значением pH от 2,5 до 4,5.
(f) инкубация элюата со стадии (e) для вирусной инактивации при низком значении pH от 2,5 до 4,5 в течение по меньшей мере 10 минут; и
(g) выполнение катионообменной хроматографии.
Смолу для катионообменной хроматографии можно регенерировать с помощью 1M NaCl для 3-5 объемов колонки. Кроме того, может быть применена процедура очистки на месте, включающая следующие стадии: (а) промывание 1-5 объемами колонки 1 М NaOH, 1 М NaCl, (b) промывание 1-5 объемами колонки 1 М уксусной кислоты или TFA, (c) повторное уравновешивание.
Cтадия полировки: Смешанная хроматография
Способ по изобретению может дополнительно включать стадию смешанной хроматографии в качестве стадии полировки, то есть ее проводят в последовательности (в виде одной или в виде одной из более стадий) после аффинной хроматографии.
Среды, называемые смешанными средами или смолами, представляют собой хроматографические среды, содержащие функциональные группы, состоящие либо из заряженных гидрофобных ионообменных лигандов, либо из кристаллических минералов, таких как гидроксиапатит или фторапатит. Вместо «смешанной хроматографии» иногда использовали термин «мультимодальная хроматография» или в связи с конкретной процедурой «хроматография с индукцией гидрофобного заряда». Смешанная хроматография - это взаимодействие, по меньшей мере, двух принципов: гидрофобного взаимодействия и ионного обмена или металл-аффинного взаимодействия и ионного обмена. Смешанная хроматография обеспечивает менее предсказуемую селективность, которую невозможно воспроизвести с помощью метода хроматографии в одном режиме, такого как ионообменная хроматография или хроматография гидрофобного взаимодействия, соответственно. Положительно заряженные гидрофобные лиганды относятся к группе анионообменника смешанного режима (например, CaptoAdhere), а отрицательно заряженные лиганды относятся к группе катионообменника смешанного режима (например, Capto MMC). Некоторые смешанные среды имеют цвиттерионный характер (например, Bakerbond ABx). Другие среды смешанного режима содержат гидрофобные лиганды, которые ионизируются и превращаются из незаряженных в положительно заряженные за счет снижения pH (например, MEP HyperCel). Наконец, гидроксиапатитные и фторапатитные среды обладают более сложными функциями смешанного режима, поскольку содержат положительно заряженные ионы кальция и отрицательно заряженные фосфатные группы.
В предпочтительном варианте осуществления смешанная хроматография, используемая в качестве стадии полировки, использует смолу, имеющую гидрофобную и анионообменную функции. Более предпочтительными являются смолы смешанного типа, содержащие положительно заряженные лиганды N-бензил-N-метилэтаноламина, которые связаны с агарозной матрицей, имеющей высокую степень поперечных связей.
В некоторых вариантах осуществления способ включает следующие стадии в следующем порядке: (а) добавление соединения, вызывающего флокуляцию, к культуральной жидкости;
(b) глубинную фильтрацию смеси стадии (а);
(c) аффинную хроматографию фильтрата, полученного на стадии (b), где иммуноглобулин связан со средой для аффинной хроматографии;
(d) промывание среды для аффинной хроматографии с использованием промывочного буфера со значением pH от 5 до 9 и ионной силой от 0,1 до 5,0 моль/л; и
(e) элюирование иммуноглобулина из смолы для аффинной хроматографии с использованием буфера для элюирования со значением pH от 2,5 до 4,5.
(f) инкубацию элюата со стадии (e) для вирусной инактивации при низком значении pH от 2,5 до 4,5 в течение по меньшей мере 10 минут;
(g) выполнение катионообменной хроматографии; и
(h) проведение смешанной хроматографии.
Предпочтительно, чтобы стадия смешанной хроматографии следовала за катионообменной хроматографией. Более предпочтительно, стадия смешанной хроматографии после катионообменной хроматографии выполняется со средой, содержащей положительно заряженные лиганды. Более предпочтительно, положительно заряженный лиганд представляет собой N-бензил-N-метилэтаноламин, и лиганд связан с агарозой, имеющей высокую степень поперечных связей.
Следующие условия могут применяться при загрузке положительно заряженной смолы для смешанной хроматографии связывания и элюирования: pH от 6 до pH 9, предпочтительно pH от 7,0 до 8,5; проводимость от 0,5 до 10 мСм/см, предпочтительно от 1 до 4 мСм/см. Можно использовать одну или более стадий промывания. Условия зависят от pI иммуноглобулина и могут быть специально отрегулированы в соответствии с желаемым разделением.
Наиболее предпочтительной смолой смешанного режима, используемой на стадии (d) полировки, является CaptoAdhere (GE Healthcare Life Science).
Предпочтительные условия загрузки для хроматографии CaptoAdhere в режиме связывания могут быть следующими: смолу уравновешивают 0,5 М Na-фосфатом, pH 8,2, а затем 20 мМ Na-фосфатом, pH 8,2. Образец (катионообменный пул) доводят до pH 8-8,5 и проводимости 1-4 мСм/см и загружают в колонку. После промывания уравновешивающим буфером 20 мМ Na-фосфат, pH 8,2, представляющий интерес иммуноглобулин может быть элюирован из смолы CaptoAdhere, например, 20 мМ Na-фосфатом, pH 5-7, предпочтительно pH 5,5-6,5.
В качестве альтернативы хроматография CaptoAdhere может быть проведена в проточном режиме. Таким образом, pH и ионная сила должны быть отрегулированы таким образом, чтобы иммуноглобулин не связывался с лигандом смешанного режима, в то время как остаточные контаминанты, подлежащие удалению (ДНК, агрегаты, выщелоченный белок A, белки клетки-хозяина), оставались связанными. Условия зависят от pI иммуноглобулина. Предпочтительно фосфатные или трис-буферы используются в диапазоне pH от 6,5 до 8,5, более предпочтительно от pH 7 до 8. Электропроводность регулируется солью, например NaCl, или концентрацией буфера. Наиболее предпочтительным является Na-фосфатный буфер в диапазоне концентраций от 10 до 50 мМ с добавлением NaCl в диапазоне концентраций от 50 до 200 мМ. Следует учитывать, что высокие концентрации соли, хотя и десорбируют ионное взаимодействие, способствуют гидрофобному взаимодействию с лигандом.
Регенерация (очистка на месте) смолы смешанного режима может выполняться при низком pH, высоком содержании соли и высоком pH, например, с использованием 10 до 200 мМ лимонной кислоты, 0,5-2 М NaCl и от 10 до 1 М NaOH.
Предпочтительная процедура регенерации выполняется путем последовательного промывания растворами A-D: раствор A: 100 мМ лимонная кислота, 2 М NaCl; Раствор B: 2M NaCl; Раствор C: 1M NaOH; Раствор D: 10 мМ NaOH. Хранение смолы может быть выполнено в Растворе D.
В другом предпочтительном варианте осуществления способ изобретения включает следующие стадии в следующем порядке:
- добавление соединения, вызывающего флокуляцию, в культуральную жидкость;
- глубинную фильтрацию;
- аффинную хроматографию, где иммуноглобулин связывается со средой для аффинной хроматографии;
- промывание среды для аффинной хроматографии с использованием промывочного буфера со значением pH от 5 до 9 и ионной силой от 0,1 до 5,0 моль/л;
- элюирование иммуноглобулина из смолы для аффинной хроматографии с использованием буфера для элюирования со значением pH от 2,5 до 4,5; и
- сильную катионообменную хроматографию, при которой иммуноглобулин связывается со смолой для сильной катионообменной хроматографии, и получение иммуноглобулина в элюате путем десорбции иммуноглобулина из смолы для сильной катионообменной хроматографии; и
- положительно заряженная Смешанная хроматография; где смола уравновешена фосфатным буфером с pH от 8 до 8,5, иммуноглобулин связывается с положительно заряженной смолой для смешанной хроматографии, а элюирование иммуноглобулина выполняется фосфатным буфером с pH от 5 до 7.
Стадия полировки: Анионообменная хроматография
Способ по изобретению может дополнительно включать стадию анионообменной хроматографии в качестве стадии полировки, то есть ее проводят в последовательности (в виде одной или в виде одной или более стадий) после аффинной хроматографии.
Среды, называемые анионообменными средами или смолами, представляют собой хроматографические среды, содержащие функциональные группы, состоящие из положительно заряженных ионообменных лигандов. Среда для анионообменной хроматографии может быть сильной или слабой анионообменной хроматографической средой, включая анионообменные мембраны.
В анионообменной хроматографии связываемые молекулы заряжены отрицательно, а иммобилизованные функциональные группы (лиганды) заряжены положительно. Обычно используемыми средами для анионообменной хроматографии являются Q-среда (лиганды четвертичные амины), смолы TMAE (триметиламиноэтильные лиганды) и смолы DEAE (диэтиламиноэтильные лиганды). Однако, как правило, стадию анионообменной хроматографии можно проводить с использованием всех обычных коммерчески доступных анионообменных сред. Анионообменная среда может использоваться в виде предварительно набитых колонок или мембран. В качестве альтернативы, смолы могут быть приобретены в виде массы материала, а колонки могут быть набиты пользователем. Никаких особых ограничений по вместимости и размерам колонок, кроме обычных, нет. Специалисту в данной области известно количество среды для анионообменной хроматографии и размер используемой колонки. Это зависит от общего масштаба процесса.
В частности, было обнаружено, что среда для сильной анионообменной хроматографии эффективна для удаления остаточных примесей.
Предпочтительно использовать среду сильной анионообменной хроматографии, содержащую лиганд, выбранный из группы, состоящей из четвертичных аминоэтильных (QAE) фрагментов, четвертичных аммонийных фрагментов и триметиламмонийных фрагментов.
Типичные среды сильной анионообменной хроматографии, которые можно использовать для цели изобретения, содержат функциональные группы, такие как четвертичные аминоэтильные (QAE) части, смолы включают, например, Toyopearl QAE (доступный от Tosoh Bioscience, Германия), Selectacel QAE (четвертичное аминоэтильное производное целлюлозы, доступное от Polysciences Inc., Пенсильвания, США), QAE Sephadex (доступный от GE Healthcare, Германия) и другие; четвертичные аммонийные (Q) фрагменты, смолы включают, например, Q Sepharose XL, Q Sepharose FF, Q Sepharose HP, Q Sepharose CL-4B, Q Sepharose Big Beads, Source Q, Resource Q, Capto Q, Capto Q ImPres (все доступны от GE Healthcare, Германия), Poros HQ (Applied Biosystems , Германия), Q HyperCel, Biosepra Q Ceramic HyperD (доступен от Pall, Нью-Йорк, США) Macro Prep High Q (Bio-Rad, Калифорния, США), Toyopearl Super Q (доступен от Tosoh Bioscience, Германия), UNOsphere Q (доступны от Bio-Rad, Калифорния, США), BioPro IEX SmartSep Q (YMC Europe), Praesto Q, Praesto Jetted Q35 (Purolite Life Sciences, Европа), триметиламмонийметильные (TMAE) включают, например, Fractogel EMD TMAE (Merck KgaA, Германия) и триметиламмонийные смолы включают, например, Nuvia Q (доступный от Bio-Rad, Калифорния, США).
Более предпочтительно, анионообменная хроматография может быть сильной анионообменной хроматографией, которая выполняется с использованием смолы для сильной анионообменной хроматографии, содержащей -N(CH3)3+ (триметиламмоний), связанный с агарозой, имеющей высокую степень поперечных связей (например, Capto Q, доступный от GE Health Care, Германия), или носитель со схожими характеристиками.
В некоторых вариантах осуществления способ включает следующие стадии в следующем порядке: (а) добавление соединения, вызывающего флокуляцию, к культуральной жидкости;
(b) глубинную фильтрацию смеси стадии (а);
(c) аффинную хроматографию фильтрата, полученного на стадии (b), где иммуноглобулин связан со средой для аффинной хроматографии;
(d) промывание среды для аффинной хроматографии с использованием промывочного буфера со значением pH от 5 до 9 и ионной силой от 0,1 до 5,0 моль/л; и
(e) элюирование иммуноглобулина из смолы для аффинной хроматографии с использованием буфера для элюирования со значением pH от 2,5 до 4,5;
(f) инкубацию элюата со стадии (e) для вирусной инактивации при низком значении pH от 2,5 до 4,5 в течение по меньшей мере 10 минут;
(g) проведение катионообменной хроматографии; и
(h) проведение анионообменной хроматографии.
Другой предпочтительный вариант осуществления включает анионообменную хроматографию в проточном режиме после стадии катионообменной хроматографии в режиме связывания.
Таким образом, в предпочтительном варианте осуществления настоящего изобретения предложен способ, включающий следующие стадии в следующем порядке:
- добавление соединения, вызывающего флокуляцию, к культуральной жидкости;
- глубинную фильтрацию;
- аффинную хроматографию, где иммуноглобулин связывается со средой для аффинной хроматографии;
- промывание среды для аффинной хроматографии с использованием промывочного буфера со значением pH от 5 до 9 и ионной силой от 0,1 до 5,0 моль/л;
- элюирование иммуноглобулина из смолы для аффинной хроматографии с использованием буфера для элюирования со значением pH от 2,5 до 4,5; и
- сильную катионообменную хроматографию, где иммуноглобулин связывается со смолой для сильной катионообменной хроматографии, и получение иммуноглобулина в элюате путем десорбции иммуноглобулина из смолы для сильной катионообменной хроматографии; и
- сильную анионообменную хроматографию; где иммуноглобулин не связывается со смолой для сильной анионообменной хроматографии, и получение иммуноглобулина в элюате.
Наиболее предпочтительной смолой для анионообменной хроматографии является Capto Q (GE Health Care, Германия). Предпочтительные условия загрузки для хроматографии Capto Q в проточном режиме могут быть следующими: смолу уравновешивают 25 мМ Трис-буфером, pH 8, и хроматографию проводят с тем же буфером.
Предпочтительная процедура регенерации выполняется путем последовательного промывания растворами A-C: раствор A: 2M NaCl; Раствор B: 1M NaOH; Раствор C: 10 мМ NaOH. Хранение смолы можно проводить в растворе C.
Глубинная фильтрация
Кроме того, способ по настоящему изобретению может включать одну или более стадий глубинной фильтрации. В отличие от мембранных фильтров, которые разделяют, удерживая частицы на поверхности мембраны, глубинные фильтры состоят из матрицы волокон или гранул, причем разделение происходит по всей матрице, а не на ее поверхности.
Примеры глубинных фильтров включают, но не ограничиваются ими, серию Pall SXL (например, фильтрующие капсулы SXLP700416 и SXLPDE2408SP, серию Pall HP (например, PDD1, PDE2, PDH4, PDK5, PEKM) (Pall Corporation), серию Millistak (например, XOHC, FOHC), DOHC, AlHC и BlHC Pod), серии HC-Pro, серии Clarisolve (например, 40 MS) (EMD Millipore) или серию Zeta Plus (90ZB08, 30ZA/60ZA, 60ZN90ZA, delipid, капсулы с фильтрами VR07 и VR05) (3М).
Предпочтительно глубинный фильтр состоит из предварительно экстрагированного неорганического вспомогательного фильтрующего материала, целлюлозы и системы смолы, которая придает сильный положительный заряд фильтрующей матрице, как, например, Zeta Plus от 3M, Великобритания.
Другой предпочтительный фильтрующий модуль представляет собой гибридный очиститель Emphaze AEX (3M), который представляет собой глубинный фильтр с функциями анионного обмена.
Наиболее предпочтительными глубинными фильтрами, используемыми в настоящем изобретении, являются фильтрующие капсулы серий PDE2, PDH4 и P700 от Pall Corporation.
Параметры процесса для выполнения глубинной фильтрации включают объемную нагрузку от 100 до 2000 л/м2, предпочтительно от 200 до 1500 л/м2, более предпочтительно ниже 1200 л/м2 и наиболее предпочтительно от 400 до 1000 л/м2, давление от 0,2 до 2 бар, предпочтительно от 0,4 до 0,6 бар и комнатную температуру.
В другом варианте осуществления очистка может включать одну или более стадий фильтрации, предшествующих первой стадии хроматографии. В предпочтительном варианте осуществления очистка может включать одну стадию центрифугирования и одну или более стадий фильтрации. В другом предпочтительном варианте осуществления первой стадии хроматографии предшествует глубинная фильтрация, а стадия микрофильтрации выполняется после флокуляции. В более предпочтительном варианте осуществления первой стадии хроматографии предшествуют стадия разделения клеток, стадия флокуляции, стадия глубинной фильтрации и стадия микрофильтрации. Дополнительные стадии фильтрации с использованием положительно и/или отрицательно заряженных мембран могут быть включены в серию фильтрации, осветляющую образец после флокуляции и перед стадией хроматографии с захватом. Модули фильтров, объединяющие различные материалы, заряженные и незаряженные, также входят в предпочтительный вариант осуществления.
Предпочтительно фильтр глубинной фильтрации содержит более одного слоя. Например, двухслойный фильтр может использоваться для глубинной фильтрации.
Ультрафильтрация, вирусная фильтрация, микрофильтрация
Кроме того, способ по изобретению может включать одну или более стадий микрофильтрации, ультрафильтрации и/или нанофильтрации. Ультрафильтрация - это форма мембранной фильтрации, при которой давление прижимает жидкость к полупроницаемой мембране. Взвешенные твердые вещества и растворенные вещества с высокой молекулярной массой задерживаются, в то время как вода и растворенные вещества с низкой молекулярной массой проходят через мембрану. Ультрафильтрация - это широко используемый метод разделения, очистки и концентрирования растворов макромолекул, особенно растворов белков. Ультрафильтрацию можно комбинировать с диафильтрацией. Этот режим подходит для замены буфера, удаления солей и других микрочастиц из раствора путем многократного или непрерывного разбавления и повторного концентрирования. Ультрафильтрация может выполняться с помощью уложенных друг на друга мембран в системе фильтрации с тангенциальным или поперечным потоком (TFF или TF-UF), особенно для обработки больших объемов образцов. В качестве альтернативы для ультрафильтрации обычно используются системы с полыми волокнами. Размер отсечки мембраны составляет от 1 до 300 кДа. Для иммуноглобулинов типичные значения отсечки для мембран ультрафильтрации составляют 10-100 кДа. В рамках настоящего изобретения предпочтительна отсечка по молекулярной массе 30 или 50 кДа для УФ-мембран.
Микрофильтрация - это метод фильтрации частиц с использованием мембран с размером пор примерно от 0,1 до 10 мкм. Для стерильной фильтрации, которая предъявляет особые требования к окружающей среде, используются стерилизованные микрофильтры с размером пор примерно 0,2 мкм. Использование дополнительных предварительных фильтров с большими размерами пор (0,45 мкм, 3 мкм) является обычным явлением. Это предотвращает уменьшение потока из-за быстрой блокировки фильтров с небольшим размером пор.
Наконец, в биофармацевтическом производстве нанофильтрация преимущественно используется для фильтрации вирусов и необходима для безопасности терапевтических белков, продуцируемых в культурах клеток млекопитающих. Стадии нанофильтрации обычно выполняются в конце нисходящего потока, ближе к заполнению основной части очищенного иммуноглобулина. Размер пор часто используемых нанофильтров составляет от 15 до 35 нм (Planova, Asahi Kasei, Япония; или Viresolve, EMD-Millipore, Германия).
В рамках настоящего изобретения термины «нанофильтрация» и «вирусная фильтрация» используются как синонимы.
В настоящем изобретении предложен дополнительный способ очистки иммуноглобулина из культуральной жидкости, содержащей иммуноглобулин и, по меньшей мере, одну примесь, где способ включает следующие стадии в следующем порядке:
- центрифугирование и/или фильтрацию культуральной жидкости;
- добавление вызывающего флокуляцию соединения к супернатанту или фильтрату;
- глубинную фильтрацию;
-микрофильтрацию;
- аффинную хроматографию, где иммуноглобулин связывается со средой для аффинной хроматографии;
- промывание среды для аффинной хроматографии с использованием промывочного буфера со значением pH от 5 до 9 и ионной силой от 0,1 до 5,0 моль/л; и
- элюирование иммуноглобулина из смолы для аффинной хроматографии с использованием буфера для элюирования со значением pH от 2,5 до 4,5.
В предпочтительном варианте осуществления изобретения процесс очистки включает одну или более стадий ультрафильтрации/диафильтрации и/или нанофильтрации. Эти стадии фильтрации могут быть выполнены с использованием имеющихся в продаже фильтрующих устройств, например доступных в Pall Corporation, GE Healthcare, EMD-Millipore или Sartorius.
В дополнительном варианте осуществления способ включает дополнительную стадию нанофильтрации элюата, полученного в результате аффинной хроматографии или стадии полировки, или композиции, полученной оттуда и полученной после одной или более дополнительных стадий обработки, выполняемых после упомянутой стадии хроматографии. Предпочтительно для нанофильтрации могут применяться фильтры, которые способны задерживать парвовирусы, наиболее предпочтительно с размером пор 15-35 нм.
В некоторых вариантах осуществления в настоящем изобретении предложен способ очистки иммуноглобулина из культуральной жидкости, содержащей иммуноглобулин и по меньшей мере одну примесь, где способ включает следующие стадии в следующем порядке:
- добавление соединения, вызывающего флокуляцию, к культуральной жидкости;
- глубинную фильтрацию;
- аффинную хроматографию, где иммуноглобулин связывается со средой для аффинной хроматографии;
- промывание среды для аффинной хроматографии с использованием промывочного буфера со значением pH от 5 до 9 и ионной силой от 0,1 до 5,0 моль/л;
- элюирование иммуноглобулина из смолы для аффинной хроматографии с использованием буфера для элюирования со значением pH от 2,5 до 4,5;
- катионообменную хроматографию, где иммуноглобулин связывается с катионообменной хроматографической смолой, и получение иммуноглобулина в элюате путем десорбции иммуноглобулина из катионообменной хроматографической смолы;
- смешанную хроматографию, где иммуноглобулин либо связан со смолой для смешанной хроматографии, и получение иммуноглобулина в элюате путем десорбции белка из смолы для смешанной хроматографии, либо без связывания со смолой для смешанной хроматографии, и получение иммуноглобулина в элюате; и
- фильтрацию элюата через вирусный фильтр, необязательно с последующей стадией ультрафильтрации/диафильтрации.
В дополнительных вариантах осуществления в настоящем изобретении предложен способ очистки иммуноглобулина из культуральной жидкости, содержащей иммуноглобулин и по меньшей мере одну примесь, причем способ включает следующие стадии в следующем порядке:
- добавление соединения, вызывающего флокуляцию, к культуральной жидкости;
- глубинную фильтрацию;
- аффинную хроматографию, где иммуноглобулин связывается со средой для аффинной хроматографии;
- промывание среды для аффинной хроматографии с использованием промывочного буфера со значением pH от 5 до 9 и ионной силой от 0,1 до 5,0 моль/л;
- элюирование иммуноглобулина из смолы для аффинной хроматографии с использованием буфера для элюирования со значением pH от 2,5 до 4,5;
- катионообменную хроматографию, где иммуноглобулин связывается с катионообменной хроматографической смолой, и получение иммуноглобулина в элюате путем десорбции иммуноглобулина из катионообменной хроматографической смолы;
- анионообменную хроматографию, где иммуноглобулин не связывается со смолой для анионообменной хроматографии, и получение иммуноглобулина в элюате; и
- фильтрацию элюата через вирусный фильтр, необязательно с последующей стадией ультрафильтрации/диафильтрации.
В предпочтительном варианте осуществления в изобретении предложен способ очистки иммуноглобулина из культуральной жидкости, содержащей иммуноглобулин и по меньшей мере одну примесь, причем способ включает следующие стадии в следующем порядке:
- добавление соединения, вызывающего флокуляцию, в культуральную жидкость;
- глубинную фильтрацию смеси;
- аффинную хроматографию фильтрата, где иммуноглобулин связывается со средой для аффинной хроматографии;
- промывание среды для аффинной хроматографии с использованием промывочного буфера со значением pH от 5 до 9 и ионной силой от 0,1 до 5,0 моль/л;
- элюирование иммуноглобулина из смолы для аффинной хроматографии с использованием буфера для элюирования со значением pH от 2,5 до 4,5;
- катионообменную хроматографию, где иммуноглобулин связывается с катионообменной хроматографической смолой, и получение иммуноглобулина в элюате путем десорбции белка из катионообменной хроматографической смолы;
- хроматографию смешанного режима, где иммуноглобулин связывается со смолой для хроматографии смешанного режима, и получение иммуноглобулина в элюате путем десорбции белка из смолы для хроматографии смешанного режима;
- нанофильтрацию; и
- ультрафильтрацию/диафильтрацию.
В дополнительных предпочтительных вариантах осуществления в настоящем изобретении предложен способ очистки иммуноглобулина из культуральной жидкости, содержащей иммуноглобулин и по меньшей мере одну примесь, причем способ включает следующие стадии в следующем порядке:
- добавление соединения, вызывающего флокуляцию, к культуральной жидкости;
- глубинную фильтрацию;
- аффинную хроматографию, где иммуноглобулин связывается со средой для аффинной хроматографии;
- промывание среды для аффинной хроматографии с использованием промывочного буфера со значением pH от 5 до 9 и ионной силой от 0,1 до 5,0 моль/л;
- элюирование иммуноглобулина из смолы для аффинной хроматографии с использованием буфера для элюирования со значением pH от 2,5 до 4,5;
- катионообменную хроматографию, где иммуноглобулин связывается с катионообменной хроматографической смолой, и получение иммуноглобулина в элюате путем десорбции иммуноглобулина из катионообменной хроматографической смолы;
- анионообменную хроматографию, где иммуноглобулин не связывается со смолой для анионообменной хроматографии, и получение иммуноглобулина в элюате; и
- нанофильтрацию; и
- ультрафильтрацию/диафильтрацию.
Вирусная инактивация (V10)
Удаление вирусов и/или инактивация требуются при способе получения рекомбинантного белкового лекарственного средства, такого как моноклональное антитело, полученное с помощью клеточной культуры, из-за возможности случайной контаминации вирусами из исходного материала или на стадиях получения. В результате существует значительный нормативный спрос на вирусную безопасность каждого производственного процесса, что приводит к получению биологического терапевтического белка, полученного из клеточных культур.
Стадия вирусной инактивации происходит после хроматографии с аффинным захватом, поддерживая элюат при низком pH. Преимущество достигается за счет элюирования при низком pH из аффинной матрицы. В такой водной кислотной среде многие вирусы, особенно вирусы с оболочкой, нестабильны и распадаются.
Низкое pH означает значения pH от 2 до 5, предпочтительно от 2,5 до 4,5, более предпочтительно от 3 до 4.
В предпочтительном варианте осуществления время инкубации для вирусной инактивации составляет от 10 минут до 2 часов, более предпочтительно от 30 минут до 90 минут, наиболее предпочтительно от 45 минут до 75 минут.
В предпочтительном варианте осуществления вирусную инактивацию проводят при комнатной температуре при перемешивании, и после инкубации pH повышают.
В настоящем изобретении предложен способ очистки иммуноглобулина из культуральной жидкости, содержащей иммуноглобулин и по меньшей мере одну примесь, причем способ включает следующие стадии в следующем порядке: (a1) отделение клеток от культуральной жидкости путем седиментации;
(а) добавление соединения, вызывающего флокуляцию, к культуральной жидкости;
(b) глубинную фильтрацию смеси стадии (а);
(c) аффинную хроматографию фильтрата, полученного на стадии (b), где иммуноглобулин связан со средой для аффинной хроматографии;
(d) промывание среды для аффинной хроматографии с использованием промывочного буфера со значением pH от 5 до 9 и ионной силой от 0,1 до 5,0 моль/л; и
(e) элюирование иммуноглобулина из смолы для аффинной хроматографии с использованием буфера для элюирования со значением pH от 2,5 до 4,5.
(f) инкубацию элюата со стадии (e) для вирусной инактивации при низком pH от 2,5 до 4,5 в течение по меньшей мере 10 минут;
(g) катионообменную хроматографию элюата после вирусной инактивации на стадии (f) или композиции, полученной из него и полученной после одной или более дополнительных стадий обработки, выполняемых после стадии (f), где иммуноглобулин связан со смолой для катионообменой хроматографии и получение иммуноглобулина в элюате путем десорбции белка из смолы для катионообменной хроматографии;
(h) смешанную хроматографию элюата, полученного на стадии (g), или композиции, полученной из него и полученной после одной или более дополнительных стадий обработки, выполненных после стадии (g), где иммуноглобулин связан со смолой для хроматографии смешанного режима и получение иммуноглобулина в элюате путем десорбции белка из смолы для смешанной хроматографии;
(i) нанофильтрацию элюата, полученного на стадии (h), или композиции, полученной из него и полученной после одной или более дополнительных стадий обработки, выполненных после стадии (h); и
(j) ультрафильтрацию/диафильтрацию фильтрата стадии (i) или композиции, полученной из него и полученной после одной или более дополнительных стадий обработки, выполняемых после стадии (i).
В дополнительных вариантах осуществления стадия h) выглядит следующим образом:
(h) Смешанная хроматография элюата, полученного на стадии (g), или композиции, полученной из него и полученной после одной или более дополнительных стадий обработки, выполненных после стадии (g), где иммуноглобулин не связывается со смолой смешанной хроматографии, и получение иммуноглобулина в элюате из смолы для смешанной хроматографии.
Или, в качестве альтернативы, вместо смешанной хроматографии может использоваться анионообменная хроматография, и стадия h) выглядит следующим образом:
(h) анионообменная хроматография элюата, полученного на стадии (g), или композиции, полученной из него и полученной после одной или более дополнительных стадий обработки, выполненных после стадии (g), где иммуноглобулин не связывается со смолой анионообменной хроматографии, и получение иммуноглобулина в элюате из смолы для анионообменной хроматографии.
В предпочтительном варианте осуществления ультрафильтрация/диафильтрация является последней стадией очистки иммуноглобулина, и никаких дополнительных хроматографий до стадий (c), (g) и (h) не проводят.
ПРИМЕРЫ
Способы очистки иммуноглобулинов по изобретению подтверждаются и проиллюстрированы ссылкой на следующие примеры. Следует подчеркнуть, что эти примеры ни в коем случае не следует рассматривать как ограничивающие объем изобретения.
Пример 1: Иммуноглобулины и клеточные культуры
Способы по изобретению не зависят ни от конкретных антител, ни от конкретных клеток-хозяев, используемых для экспрессии иммуноглобулинов. То же самое верно для способа экспрессии и выбранных условий культивирования, которые были оптимизированы для получения максимального выхода собираемых клеток. Различные моноклональные антитела были использованы при разработке способов по настоящему изобретению. Они были успешно очищены в различных масштабах согласно способам по изобретению. Большинство выбранных экспериментов, представленных в таблицах, были выполнены с бевацизумабом, гуманизированным антителом IgG1 против VEGF. Кроме того, были проведены некоторые другие эксперименты с трастузумабом, гуманизированным антителом против HER2, IgG1 и с деносумабом, полностью человеческим антителом против RANKL IgG2. Все три антитела рекомбинантно экспрессировали в клетках СНО, которые наращивали в культурах с подпиткой разного масштаба. Большинство экспериментов по флокуляции на стадии разработки проводились с культуральными жидкостями из лабораторного объема 10 л или пилотного объема 100 л или 200 л. Производственный масштаб и максимальный объем культивирования, использованные в примерах, составляли 5000 л. Некоторые эксперименты выполняли с использованием меньшего производственного масштаба - 1000 л. Если не указано иное, масштаб всегда относится к объему культуры.
Пример 2: Сравнение различных флокулянтов (Таблицы 1-3)
Эксперименты по флокуляции, приведенные в Таблицах 1-3, проводили в различных сериях с использованием экспериментального масштаба (100 л) культуры клеток СНО, продуцирующих гуманизированные антитела подкласса IgG1 (бевацизумаб). Титр антитела составлял от 1,16 до 1,52 г/л. Флокулянты добавляли к 20мл-аликвотам культурального бульона в конце ферментации перед разделением клеток. Испытывали три разных катионных вещества в разных концентрациях. 1) pDADMAC=поли(диаллилдиметиламмоний хлорид), 2) хитозан и 3) хлорид кальция. pDADMAC приобретали в виде 10% (мас./об.) раствора (EMD Millipore). Хитозан приобретали в виде твердого вещества (Sigma) и растворяли 1% (мас./об.) в 0,1 М уксусной кислоте. Рабочий диапазон pH хитозана составляет от 4,5 до 5. Хлорид кальция добавляли, используя исходный водный раствор.
Эксперименты проводили в следующей последовательности стадий:
- Отбор аликвоты 20 мл из ферментационного бульона
- Добавление флокулянта
- Инкубация 15 мин при комнатной температуре при перемешивании
- Центрифугирование при 4600 об/мин/10 мин (настольная центрифуга Thermo Scientific)
- Микрофильтрация (ПВДФ, 0,2 мкм, EMD Millipore)
- Анализ на мутность, HCDNA и HCP.
Чтобы оценить прямое влияние различных флокулянтов в различных концентрациях, глубинную фильтрацию не проводили. На стадии центрифугирования удаляли хлопья, клетки и клеточный дебрис. Последующей микрофильтрацией удаляли оставшиеся частицы. Для контролей (нулевые значения) флокулянт не добавляли, и инкубацию не проводили. Однако перед анализом образцы центрифугировали и фильтровали. Методом ВЭЖХ на основе Протеина А определяли концентрации антител.
Таблица 1a: Влияние флокуляции с pDADMAC на снижение HCDNA и мутность
Таблица 1b: Влияние флокуляции с хитозаном на снижение HCDNA и мутность
Таблица 1c: Влияние флокуляции с CaCl2 на снижение HCDNA и мутность
Таблицы 1a-1c показывают результаты флокуляции по снижению HCDNA и мутности с использованием трех различных флокулянтов. HCDNA определяли с помощью набора для высокочувствительного анализа дцДНК Quant-iT™ (Thermo Fisher) и кПЦР (PrepSEQ™ Residual DNA Sample Preparation Kit и resDNASEQ™ Quantitative CHO DNA Kit, Thermo Fisher). Измерения мутности проводили на турбидиметре Hach 2100Q и выражали в нефелометрических единицах формазина (FNU). Прибор измерял свет, рассеянный образцом под углом 90 градусов к падающему инфракрасному свету.
В Таблице 1а показано влияние pDADMAC до 0,09% (мас./об.). Уже при самой низкой концентрации (0,025% мас./об.) HCDNA почти полностью удаляли (снижение 99,9%, три порядка величины). Снижение мутности на 87% может быть достигнуто с использованием 0,075% (мас./об.) pDADMAC. Дальнейшее снижение мутности не могло быть достигнуто при более высокой концентрации pDADMAC в этом эксперименте.
Результаты с хитозаном, как показано в Таблице 1b, показали эффективное удаление HCDNA, однако при более высоких концентрациях, необходимых для pDADMAC. Снижение примерно на 91,5% было получено при 0,4% (мас./об.). Что касается снижения мутности, было измерено снижение не более чем на 19%.
Результаты экспериментов с CaCl2 показаны в Таблице 1c. Также для этого флокулянта было получено очень эффективное снижение HCDNA. Снижение 99% было измерено при 70 мМ и снижение на 99,9% при 120 мМ CaCl2. Снижение мутности было больше для хитозана, но ниже для pDADMAC. Может быть достигнуто снижение примерно на 63% при 120 мМ. Более высокие концентрации CaCl2 не тестировались.
Выводы (Таблицы 1a-c): Начальная концентрация HCDNA (т.е. контроли без флокуляции) составляла 62,9 мкг/мл супернатанта клеточной культуры и 51,1 мг/г IgG, соответственно. Потери общего белка или антител не детектировали для всех тестируемых флокулянтов и концентраций. Аналогичным образом не наблюдали увеличения разрыва клеток, вызванного флокуляцией. Удивительно, но очевидно, что HCDNA мало влияет, если вообще влияет, на мутность. Например, с помощью 0,4% (мас./об.) хитозана примерно 91,5% HCDNA было флокулировано и удалено, тогда как мутность практически не уменьшилась и осталась на уровне 82% от контроля (Таблица 1b). Для снижения как HCDNA, так и мутности лучше всего подходит флокулянт pDADMAC.
Таблица 2a: Влияние флокуляции с pDADMAC на снижение HCP
Таблица 2b: Влияние флокуляции с хитозаном на снижение HCP
Таблица 2c: Влияние флокуляции с хлоридом кальция на снижение HCP
Таблицы 2a-2c показывают результаты флокуляции по снижению HCP с использованием трех различных флокулянтов. HCP измеряли с помощью CHO HCP ELISAKit, 3G (технологии Cygnus).
В Таблице 2а показано влияние pDADMAC на удаление HCP. Даже при самой высокой испытанной концентрации (0,09% мас./об.) снижение составило всего примерно 10,8%.
Как показано в Таблице 2b, влияние хитозана в качестве флокулянта на снижение HCP было незначительным. Наилучшее снижение составило примерно 8,1% при 0,2% (мас./об.).
Лучшее снижение HCP было получено в экспериментах с CaCl2, как показано в таблице 2c. Снижение 29,1% измеряли при 70 мМ. Более высокие концентрации могут привести к лучшему восстановлению, однако их не тестировали.
Выводы (Таблицы 2a-c): Начальные концентрации HCP составляли от 1,4 до 2,3 мг/мл. По массе это примерно в 20-40 раз больше, чем нагрузка HCDNA. Опять же, очевидно, что HCP также мало влияет на мутность. Например, 0,075% (мас./об.) pDADMAC снижает мутность примерно на 87% (Таблица 1a), в то время как снижение HCP составило только примерно 9% (Таблица 2a). Для снижения HCP за счет флокуляции CaCl2 был лучшим. В Таблицах 3a-3c ниже суммированы благоприятные концентрации трех флокулянтов, испытанных на снижение HCDNA, мутности и HCP.
Таблица 3a: Благоприятные концентрации различных флокулянтов для снижения HCDNA
Таблица 3b: Благоприятные концентрации различных флокулянтов для снижения мутности
Таблица 3c: Благоприятные концентрации различных флокулянтов для снижения HCP
Все три флокулянта были способны эффективно удалять HCDNA благодаря своей катионной природе. Поскольку первоначальная проблема настоящего изобретения была в основном связана с мутностью, наблюдаемой в пулах элюирования с Протеином А, pDADMAC был выбран в качестве наиболее подходящего флокулянта. Этот полимер можно использовать при более низких концентрациях и неожиданно приводит к почти полному удалению HCDNA уже в самой низкой испытанной концентрации.
Пример 3: Дальнейшие эксперименты по флокуляции с pDADMAC (Таблицы 4-6)
В последующих более расширенных сериях испытаний влияние pDADMAC на снижение HCDNA и мутность было исследовано в параллельных экспериментах с использованием образцов из шести различных культур клеток, экспрессирующих бевацизумаб. Методы испытаний были такими же, как описано в Примере 2. Диапазоны нефлокулированных супернатантов (контрольные) составляли от 44,3 до 62,9 мкг/мл HCDNA, от 19,9 до 29,1 мутности FNU и от 1,24 до 2,14 мг/мл HCP. Титр антител составлял от 1,16 до 1,52 мг/мл. Были протестированы пять различных концентраций pDADMAC и рассчитаны средние значения снижения в %.
Таблица 4a: Влияние концентрации pDADMAC на снижение HCDNA в различных партиях клеточных культур
% Снижения
[% мас./об.]
0
99,99
99,99
100
100
100
0
99,91
99,98
done
99,98
99,98
0
99,96
99,99
99,99
99,99
99,99
0
99,99
100
100
100
100
0
100
100
100
100
100
0
99,96
100
100
100
100
Результаты, приведенные в Таблице 4а, еще раз подтверждают высокий потенциал катионного полимера pDADMAC в отношении флокуляции HCDNA. Уже при самой низкой испытанной концентрации (0,025% мас./об.) было получено почти 100% снижение во всех шести культурах клеток. Практически количественное удаление HCDNA на ранней стадии последующей обработки очень выгодно и облегчает последующую фильтрацию и улавливающую хроматографию.
Снижение мутности является наиболее важным требованием при разработке стадий предварительной очистки. В случае нескольких культур клеток, экспрессирующих антитела IgG1 или IgG2 (например, бевацизумаб, трастузумаб и деносумаб), в концентрированных растворах, элюируемых из колонки для хроматографии с захватом, возникает помутнение. В экспериментах по настоящему изобретению было обнаружено, что уменьшение мутности на стадии предварительной очистки предотвращает также помутнение после хроматографии с захватом, если стадии процесса выполняются без перерыва. Повторного появления помутнения в пулах для элюирования протеина А не наблюдалось.
Таблица 4b: Влияние концентрации pDADMAC на снижение мутности в различных партиях культур клеток
% Снижения
0
18,86
69,64
80,18
89,61
89,86
0
48,24
83,92
87,19
87,64
0
69,24
70,79
87,97
88,83
88,32
0
61,12
72,93
90,76
91,25
90,44
0
17,79
26,92
75,91
84,71
85,10
Результаты, представленные в Таблице 4b, подтверждают использование pDADMAC в качестве флокулянта. При 0,05% (мас./об.) среднее снижение в культурах клеток было выше 80%. При концентрации 0,075% (мас./об.) среднее снижение составило примерно 88%. Более высокие концентрации (0,09% мас./об.) не давали дальнейшего увеличения.
В другом исследовании оценивали флокуляцию pDADMAC (без последующей глубинной фильтрации) для первичного осветления потоков питательных веществ для культур клеток с высокой плотностью. В отличие от предыдущих экспериментов, образцы клеточных культур представляли собой аликвоты выбранной шкалы ферментации на 1000 л (плотность клеток 9,3 × 106 клеток/мл), экспрессирующих бевацизумаб.
Эксперименты проводили в следующей последовательности стадий:
- Отбор аликвоты 40 мл из ферментационного бульона (пробирки на 50 мл),
- Добавление флокулянта в разных концентрациях,
- Инкубация 15 мин при комнатной температуре и осторожном перемешивании,
- Центрифугирование при 3000 об/мин/2000g/5 мин,
- Микрофильтрация (фильтр Millex, 0,2 мкм, EMD Millipore),
- Немедленный анализ мутности,
- Последующий анализ концентрации моноклональных антител, HCDNA и HCP.
Таблица 5 суммирует результаты этого исследования. Мутность измеряли на турбидиметре Hach 2100Q и, в отличие от предыдущих экспериментов, выражали в нефелометрических единицах мутности (NTU). Прибор измеряет рассеянный свет от образца под углом 90 градусов к падающему белому свету.
Таблица 5: Определение дозы pDADMAC
% Снижения
0
99,99
100
100
100
100
% Снижения
0
70,34
92,45
96,91
96,27
95,56
% Снижения
0
8,41
7,01
7,94
7,01
14,95
Результаты, представленные в Таблице 5, подтверждают предыдущие результаты по снижению HCDNA, мутности и HCP (см. Таблицы 1a, 2a, 4a и 4b). Оптимальная доза pDADMAC определяется как минимальная концентрация полимера, которая приводит к значительному снижению мутности супернатанта. Добавление более высоких концентраций pDADMAC может быть нецелесообразным. Более высокие концентрации могут привести только к немного более низкому уровню мутности (см. Таблицу 5, 0,1% мас./об. pDADMAC) или потенциально могут привести к небольшому снижению концентрации представляющего интерес продукта в супернатанте (не наблюдается до 0,1% мас./об. pDADMAC) или способствовать более быстрому возвращению мутности (см. Таблицу 6). Более высокие концентрации могут также привести к образованию популяции более мелких флокулянтов, которые могут прорваться через глубинные фильтры. Оптимальная концентрация pDADMAC находится в диапазоне от 0,0375 до 0,075% (мас./об.). Это относится к примерно 40-80 пг/клетку в условиях этого эксперимента. В этом диапазоне снижение HCDNA составляло 100%, снижение мутности примерно 92-97% и снижение HCP 7-8%. Следует подчеркнуть, что флокуляция не вызвала заметной потери мАт.
Дальнейший эксперимент был проведен с тем же исходным материалом, который использовался для экспериментов в Таблице 5, в котором отслеживалась стабильность мутности после выполнения флокуляции, центрифугирования и микрофильтрации. Применяли те же методы, что описаны в Примере 1. После флокуляции с тремя концентрациями pDADMAC (0,0375% мас./об., 0,075% мас./об. и 0,09% мас./об.) мутность стерильного отфильтрованного супернатанта измеряли в течение 24 часов при комнатной температуре. Путем параллельных исследований выяснилось, что центрифугирование и микрофильтрация не удаляют остаточный свободный pDADMAC. Напротив, на хроматографических стадиях (например, с Протеином А) полимер количественно удалялся. В Таблице 6 показаны результаты экспериментов по стабильности и кинетике повторного появления помутнения.
Таблица 6: Стабильность отфильтрованных культуральных жидкостей после флокуляции pDADMAC
[ч]
Удивительно, но уровень мутности увеличился через три часа, что указывает на продолжающееся осаждение. Эффект сильно зависит от концентрации pDADMAC. Увеличение мутности через 3 часа составляет 25% для 0,0375% (мас./об.), но примерно 78% для 0,09% (мас./об.). Через 24 часа мутность при наивысшей концентрации pDADMAC достигла нефлокулированных (контрольных) значений (см. Таблицу 4b). Первоначальное снижение мутности за счет флокуляции было отменено.
На основании этих результатов был сделан вывод, что 1) флокулированные и отфильтрованные супернатанты требуют быстрой дальнейшей обработки (глубинная фильтрация, хроматография на Протеине А) и 2) необходимо выбрать наименьшее эффективное количество pDADMAC. По сравнению с 0,075% (мас./об.) стабильность 0,0375% (мас./об.) супернатантов намного лучше с небольшим увеличением до 8 часов. Это приемлемое временное окно для стандартного производства.
Пример 4: Эксперименты по глубинной фильтрации с флокуляцией и без нее.
При выполнении флокуляции с 0,0375-0,075% (мас./об.) pDADMAC в ферментационных жидкостях большого объема (5000 л) сепаратор клеток, который затем удаляет хлопья и клетки, был сильно загружен, и очистка после прогона стала довольно трудоемкой. Это также верно и для ферментера, который должен быть очищен от остаточных хлопьев. Поэтому в дальнейших экспериментах были проверены альтернативные стратегии предварительной очистки для преодоления этого недостатка.
Во-первых, было исследовано, можно ли пропустить стадию флокуляции и заменить ее различными установками глубинных фильтров, включая двухступенчатую глубинную фильтрацию. Хотя несколько хорошо зарекомендовавших себя фильтровальных систем, включая фильтры предварительной очистки, были протестированы во многих комбинациях, результаты не были удовлетворительными, то есть мутность после разделения клеток и глубинной фильтрации оставалась на уровне примерно 10 FNU, и последующее осаждение в пулах для элюирования Протеина A происходило с помутнением примерно 30 FNU для лучшей настройки фильтра. Более того, глубинные фильтры не уменьшали HCDNA и HCP.
Во-вторых, было исследовано, можно ли отказаться от сепаратора после флокуляции при использовании только глубинных фильтров. Действительно, некоторые из установок фильтров осветляли флокулированную культуральную жидкость в достаточной степени с приемлемой низкой мутностью элюата (1-2 FNU). Хотя эта стратегия дает многообещающую очистку, требуемые размеры фильтров и время обработки довольно высоки и являются значительным экономическим фактором. Эта стратегия не была реализована.
Пример 5: Эксперименты по флокуляции с супернатантом бесклеточной культуры
В этом примере была разработана одна предпочтительная стратегия предварительной очистки. Порядок стадий предварительной очистки был следующим (см. также Фигуру 2B):
- Сбор культуральной жидкости,
- Разделение клеток/центрифугирование,
- Флокуляция с pDADMAC (0,0375% мас./об. - 0,075% мас./об.),
- Глубинная фильтрация,
- Микрофильтрация (0,2 мкм),
- Хроматография с Протеином А (MabSelect SuRe LX).
По сравнению с Примерами 2 и 3 флокуляцию проводили после разделения/центрифугирования клеток с последующей глубинной фильтрацией. Этот метод был выполнен с культуральной жидкостью 1 л, 10 л, 100 л и 5000 л (бевацизумаб), и несколько параметров глубинной фильтрации сравнивали и оптимизировали. Мутность супернатантов перед флокуляцией находилась в диапазоне 30-100 FNU для масштаба 5000 л.
Исследовали следующие типы глубинных фильтров:
- Pall Supercap 50 PDH4
- Pall Supercap 50 PDE2
- Pall Supercap 50 PDD1
- Pall Supercap 50 PEKM
- Pall Supercap 50 PEKX
- 3M BC25 90ZB08A
- Гибридный очиститель 3M BV8 Emphaze AEX.
Снова были проанализированы концентрации HCDNA, мутности, HCP и мАт (методы см. в предыдущих Примерах), и на основании этих результатов PEKM, PDD1 и PDE2 являются наиболее подходящими для осветления флокулированных супернатантов в приемлемой степени. Благодаря своей двухслойной конфигурации PDD1 и PDE2 показали более надежную обработку, чем PEKM (однослойный), и поэтому были предпочтительными глубинными фильтрами для удаления хлопьев. Мутность элюата за глубинными фильтрами составляла 1-2 FNU. Время фильтрации составляло от 80 до 240 мин при нагрузке 250-500 л/м2. Фильтраты как PDD1, так и PDE2 показали лишь небольшое увеличение мутности в течение 24 часов, и оба фильтрата считаются достаточно стабильными для дальнейшей обработки на Протеине A.
Заключение. Флокуляция с бесклеточным супернатантом (после разделения/центрифугирования) оказалась предпочтительной стратегией предварительной очистки и хорошо подходит для крупномасштабного производства иммуноглобулинов. Флокулированные супернатанты с мутностью 30-100 FNU могут быть успешно обработаны двухслойными глубинными фильтрами, такими как PDD1 и PDE2. В фильтры такого типа можно загружать по меньшей мере 500 л/м2. В случае надосадочных жидкостей с более высокой мутностью (>100 FNU) эффективная площадь фильтрации может быть увеличена, чтобы избежать длительного времени обработки. Окончательно выбранная концентрация pDADMAC составляла 0,0375% (мас./об.) и полностью согласуется с экспериментами мелкомасштабной флокуляции в присутствии клеток и без глубинной фильтрации (Примеры 1-3).
Пример 6: Флокуляция супернатантов клеточных культур с более высокой концентрацией IgG с использованием различных концентраций pDADMAC (Таблица 7)
В этом эксперименте сравнивали две разные мелкомасштабные культуры клеток, накапливая разные количества антитела IgG2 (деносумаб). Объемы культур составляли 10 л, и для исходного материала были объединены две культуры по 10 л. Культуру собирали через 8 и 10 дней, соответственно. Объединенная 8-дневная культура содержала 3,86 мг/мл IgG, 42,4 мкг/мл HCDNA и 0,454 мг/мл HCP. 10-дневная культура содержала 5,79 мг/мл IgG (+ 50%), 85 мкг/мл HCDNA (+ 102%) и 0,506 мг/мл HCP (+ 11%). Супернатанты клеточных культур центрифугировали (10 мин при 4600 об/мин) и флокулировали (инкубация 15 мин), как описано в Примере 1.
Таблица 7: Сравнение различных исходных материалов по снижению примесей с помощью флокуляции pDADMAC
[% мас./об.]
[нг/мл]
(% сниж.)
[мкг/мл]
(% сниж.)
[FNU]
(% сниж.)
[нг/мл]
(% сниж.)
[мкг/мл]
(% сниж.)
[FNU]
(% сниж.)
(0,00)
(0,00)
(0,00)
(0,00)
(0,00)
(0,00)
(84,66)
(-15,22)
(-164,76)
(76,95)
(2,67)
(-135,64)
(100,00)
(-0,71)
(96,39)
(100,00)
(10,67)
(96,11)
(100,00)
(13,92)
(97,30)
(100,00)
(22,67)
(97,73)
(100,00)
(22,17)
(97,25)
(100,00)
(28,38)
(98,14)
(100,00)
(16,51)
(96,71)
(100,00)
(28,76)
(98,04)
(100,00)
(24,06)
(96,62)
(100,00)
(28,00)
(97,99)
Удивительно, но две очень разные культуры вели себя довольно похоже в экспериментах по флокуляции. И снова был подтвержден высокий потенциал pDADMAC для удаления HCDNA. Уже на 0,025% pDADMAC снижение HCDNA составило 100% (примерно на 5 порядков). Глядя на мутность, снижение достигает 97-98% для 0,0375% и 0,075% pDADMAC. В этом диапазоне HCP снижались на 22% и 28%, соответственно. Удивительно, но стратегия предварительной очистки от флокуляции оказалась довольно надежной в отношении типа антитела, плотности клеток и титра моноклональных антител. Стехиометрическое дозирование для конкретных культур не требуется.
Пример 7: Влияние флокуляции на примеси после аффинного захвата с Протеином А (Таблицы 8-10)
Этот пример демонстрирует влияние флокуляции на остаточные примеси в элюирующем пуле с Протеином А. Исходными материалами были культуры клеток, экспрессирующие трастузумаб (IgG1) в экспериментальном масштабе (200 мкл, таблица 8) и бевацизумаб в полном объеме (5000 мкл, таблицы 9). Хроматографию с протеином А выполняли, как описано в Примере 8.2. Концентрация pDADMAC составляла 0,0375% (мас./об.), и глубинным фильтром был Pall Supercap 50 PDE2.
Таблица 8: Снижение примесей в элюатах Протеина А путем предшествующей флокуляции pDADMAC
(% Снижения)
(%Снижения)
(%Снижения)
+ Глубинная фильтрация
(контроль)
(0)
(0)
(0)
+ Флокуляция
+ Глубинная фильтрация
(91,5)
(48,2)
(79,5)
Концентрации IgG в элюатах с протеином А составляли 20,36 мг/мл для нефлокулированного контроля и 23,32 мг/мл для процесса флокуляции. В процессе контроля флокуляции не проводили, и супернатанты после центрифугирования непосредственно подвергали глубинной фильтрации и хроматографировали над Протеином А. Пулы элюирования Протеина А демонстрировали значительное осаждение с точки зрения мутности примерно 43 FNU в контроле. Напротив, в процессе флокуляции pDADMAC мутность сильно снижалась примерно на 80%. HCDNA снизилась более чем на 90% до очень низкого уровня 0,076 м.д., который трудно обнаружить. Остаточный HCP был более заметным, то есть 204 м.д., что отражает на 2-3 порядка более высокую нагрузку в исходном материале. Его концентрация была примерно вдвое по сравнению с контролем. Эти результаты ясно демонстрируют замечательный положительный эффект флокуляции pDADMAC на чистоту продукта в элюатах с Протеином А.
В нижеследующих Таблицах 9a и 9b показаны данные стандартного производственного контроля двух производственных партий (5000 л бевацизумаба), которые дополнительно демонстрируют удивительно высокое снижение примесей до и после хроматографии на Протеине А. Хроматографию на Протеине А проводили в двух последовательных прогонах с 50% от общего объема, чтобы уменьшить объем колонки дорогостоящей смолы. Последующие инкубации для вирусной инактивации проводили, как описано в Примере 9.3.
Таблица 9a: Крупномасштабный процесс с флокуляцией pDADMAC: концентрации HCDNA
[мг/мл]
[нг/мг]
[мг/мл]
[нг/мг]
[%]
*Хроматографию с Протеином А проводили в двух последовательных прогонах с долей 50% в каждом от общего объема;
n.d.: = не детектируемо, ниже предела детектирования метода испытаний.
Таблица 9b: Крупномасштабный процесс с флокуляцией pDADMAC: концентрации HCP
[мг/мл]
[µg/mg]
[мг/мл]
[µg/mg]
[%]
HCDNA практически не детектировали уже после флокуляции и ниже предела детектирования на последующих стадиях (Таблица 9a). Флокуляция и глубинная фильтрация снизили HCP только примерно на 15% (Таблица 9b). Однако хроматография на Протеине А благодаря своей высокой селективности в отношении IgG-Fc снижала количество примесей HCP более чем на 99,9%. Тем не менее остаточные концентрации HCP 160-270 м.д. после хроматографии на Протеине A указывают на необходимость дальнейших стадий полировки, по меньшей мере, в случае терапевтического антитела для использования человеком.
Таблица 10: Сравнение выщелоченного Протеина А для различных процессов
В экспериментах по Таблице 10 сравнивали три различных процесса для выщелоченного Протеина А в элюированных пулах Протеина А. Процесс C представляет собой способ согласно настоящему изобретению, в котором используется флокуляция pDADMAC в тех же условиях, что описаны в Примере 7/таблице 8 (200 мкл трастузумаба). Результаты двух прогонов сравнивали с ранее установленным процессом (Процесс B) с использованием анионообменной проточной хроматографии (Nuvia Q), предшествующей стадии с Протеином A. Процесс A - это дополнительный контроль без стадии предварительной очистки (кроме центрифугирования и фильтрации). Процессы A и B описаны в WO2015135884. Все процессы выполняли при комнатной температуре. Хроматографию с протеином А выполняли, как описано в Примере 8.2.
Процесс A: разделение клеток → глубинная фильтрация → микрофильтрация → Протеин A
Процесс B: разделение клеток → Глубинная фильтрация → Микрофильтрация → Анионообменная хроматография (Nuvia Q, проточная) → Протеин A (как описано в WO2015135884)
Процесс C: Разделение клеток → Флокуляция (pDADMAC) → Глубинная фильтрация → Микрофильтрация → Протеин A
Количество выщелоченного Протеина A с помощью процесса C было значительно ниже, чем с помощью процесса B, который уже представлял собой ценное улучшение для более низкого уровня выщелоченного Протеина A по сравнению с контрольным процессом A. Снижение количества выщелоченного Протеина А в процессе C составило примерно 48% по сравнению с процессом B и примерно 79% по сравнению с процессом А. Таким образом, помимо заметного снижения HCDNA и мутности, флокуляция pDADMAC дополнительно значительно снижает выщелачивание Протеина А.
Пример 8: Последующий процесс - очистка иммуноглобулина из предварительно очищенных супернатантов культур.
Ниже описаны методы, которые были разработаны в небольшом масштабе и сначала применялись для экспериментального процесса производства бевацизумаба (IgG1) в масштабе 100 л. Тот же процесс, только с небольшими изменениями, позже был успешно увеличен до 5000 л. После дальнейших небольших адаптаций этот процесс был также разработан для трастузумаба (IgG1) и денсосумаба (IgG2).
Пример 8.1: Выбор смол для хроматографии (Таблица 11)
После расширенного скрининга обычно используемых хроматографических сред для стадий улавливания, промежуточной обработки и полировки, который был описан в WO2015135884, следующие хроматографические смолы были выбраны для последующего процесса иммуноглобулинов (Таблица 11):
Таблица 11: Предпочтительные смолы для хроматографии
CEX=катионообменная хроматография; AEX=анионообменная хроматография; MMC=Смешанная хроматография.
Хроматографические циклы выполняли с помощью системы очистки Äkta Purifier System (GE Healthcare) при комнатной температуре.
Пример 8.2: Хроматография с Протеином А.
Хроматографию захвата с Протеином A выполняли с MabSelect SuRe LX (Таблица 11). Образец отбирали после глубокой фильтрации и микрофильтрации флокулированного супернатанта, как описано в Примере 5. Размер колонки составлял 20 см в диаметре на высоту слоя 10,4 см (набитый объем примерно 3,3 л). Колонку с Протеином А уравновешивали 20 мМ трис-ацетатным буфером, pH 7,2. В раствор продукта (примерно 49,5 л) загружали от 15,8 до 40,6 белка/л смолы. Колонку промывали уравновешивающим буфером (2 CV), затем 40 мМ Na-фосфата, 1,5 М NaCl, 2 М мочевины, 10 мМ EDTA, pH 7,4. Элюирование проводили 100 мМ цитратом натрия, pH 3,5. Скорость потока составляла 210 см/ч. Регенерацию смолы MabSelect SuRe LX проводили промыванием в обратном направлении последовательно (i) 0,2 М NaOH (2 CV), (ii) WFI (2 CV), 3,5% уксусной кислоты, 100 мМ Na-сульфата (2 CV). и (iii) WFI (2 CV). Колонку повторно уравновешивали для следующего прогона или хранили в 20% этаноле. Выход составлял 94-98%.
Пример 8.3: Вирусная инактивация
Как показано на Фигурах 1 и 2, стадия вирусной инактивации происходит после аффинной хроматографии на Протеине А. Преимущество достигается за счет элюирования при низком pH из аффинной матрицы. В такой водной кислотной среде многие вирусы, особенно вирусы с оболочкой, нестабильны и распадаются. Метод с использованием Протеина А, разработанный для этого изобретения, дает элюат, имеющий pH 3,5 (см. Пример 8.2). Моноклональные антитела элюировали из колонки с Протеином A в 100 мМ Na-цитратном буфере, pH 3,5, непосредственно в танк А для вирусной инактивации. Элюат разбавляли примерно в 2 раза с помощью WFI непосредственно в танке A. pH раствора контролировали и повторно доводили до 3,5 с помощью 100 мМ лимонной кислоты, если необходимо, и раствор впоследствии переносили в танк для вирусной инактивации B, где его перемешивали со скоростью 65 об/мин при температуре 20-24°C в течение 60 минут. Затем pH раствора доводили до pH 4,5 с помощью 100 мМ NaOH, обеспечивая исходные условия для последующей стадии катионообменной хроматографии.
Пример 8.4: Катионообменная хроматография на Poros 50 HS
Разделение контаминантов, таких как HCP и выщелоченный белок A, и связанных с продуктом веществ, таких как варианты заряда и агрегаты, проводили с помощью сильной катионообменной хроматографии с сульфопропильными (SP) лигандами (Таблица 11), используемыми в качестве промежуточной стадии. Набитую колонку со смолой Poros 50 HS (размер=диаметр 14 см × высота слоя 41 см, объем насадки около 6,3 л) последовательно уравновешивали (i) WFI (вода для инъекций, 2 CV) и (ii) 20 мМ цитрата натрия, pH 4,9 (2 CV). Раствор продукта, полученный после вирусной инактивации и доведения образца (pH 4,5), как описано в Примере 8.3, загружали в колонку с примерно 7,3-17,1 г белка/л смолы, тем самым пропуская через префильтр Kleenpak Nova 0,45 мкм (Pall Corporation). Колонку промывали WFI (1 CV) и уравновешивающим буфером (2 CV) перед последующим градиентным элюированием. Градиент состоит из двух частей с разной степенью изменения. Градиент был сформирован путем смешивания 20 мМ Na-цитрата, pH 4,9 (буфер A) и 40 мМ Na-фосфата, pH 7,2 (буфер B) в следующих соотношениях и последовательности: (i) 100% A (0,2 CV), (ii) линейный градиент до 40% A+60% B (2 CV); (iii) линейный градиент до 100% B (10 CV); (iv) 100% B (2 CV). Скорость потока составляла 75 см/ч во время градиента, в противном случае 150 см/ч. Элюат разделяли на фракции, чтобы обеспечить специфическое объединение. Сбор фракций во время градиентного элюирования начался, когда A280 превысило значение> 0,1 AU. Объем фракции составлял около 2 л. Всего было собрано примерно 20 фракций. Регенерацию смолы Poros 50 HS проводили последовательным промыванием (i) 1 M NaCl (2 CV) и (ii) 1 M NaOH (2 CV). После этого колонку хранили в 10 мМ NaOH. Выход в выбранном пуле составлял примерно 62-68% из-за истощения значительного количества примесей, связанных с продуктом.
Пример 8.5: Смешанная хроматография с CaptoAdhere
Заключительную стадию полировки выполняли со смолой смешанного типа CaptoAdhere, в которой используется лиганд N-бензил-N-метилэтаноламин (Таблица 11). Лиганд несет положительно заряженные группы и поэтому помимо гидрофобных взаимодействий обеспечивает также функции анионообменника. Хроматография способна уменьшить оставшиеся следы контаминантов, таких как HCDNA, HCP и основные варианты в зависимости от заряда. Остаточный выщелоченный Протиен А, агрегаты продукта и фрагменты продукта также могут быть удалены на этой стадии. Стадию полировки CaptoAdhere выполняли в режиме связывания, что дает преимущество замены буфера в выбранный конечный буфер.
pH пула Poros 50 HS, полученного после процедур, описанных в примере 8.4, доводили до pH 7,2, добавляя 100 мМ NaOH. Размер набитой колонки составлял 14 см в диаметре на 23 см высоты слоя (объем набивки примерно 3,5 л). Смолу уравновешивали 50,48 мМ Na-фосфатом, pH 7,2 (3 CV). Раствор продукта загружали в колонку с 6,3-17,8 г белка/л смолы) с последующим добавлением уравновешивающего буфера (3 CV). Элюирование проводили 50,48 мМ Na-фосфатом, pH 5. Скорость потока составляла 240 см/ч. Выход колебалась от 87 до 98%. Колонку регенерировали с помощью 2 M NaCl+100 мМ лимонной кислоты (2 CV) и 1 M NaOH (2 CV) в обратном потоке.
Пример 8.6: Анионообменная хроматография с Capto Q
Вместо смешанной хроматографии в этом примере выполняли анионообменную хроматографию Capto Q в качестве конечной стадии полировки. Анионообменную хроматографию проводилась в проточном режиме. Перед загрузкой колонок pH объединенных фракции катионообменной хроматографии доводили с помощью уксусной кислоты до pH 8. Колонку Capto Q уравновешивали буфером 25 мМ Tris, pH 8. После загрузки образца хроматографию проводили с тем же буфером. Иммуноглобулин не связывался со смолой для хроматографии и был получен в элюате.
Пример 8.7: Вирусная фильтрация
Нанофильтрация представляет собой заключительную стадию удаления вирусов и наиболее требовательный и самый надежный метод удаления вирусов, основанный на исключении размера в нанометровом диапазоне. Вирусную фильтрацию проводили непосредственно после смешанной хроматографии с использованием пула для элюирования CaptoAdhere из Примера 8.5 или проточного пула Capto Q из Примера 8.6 после доведения pH до 6,2 с помощью Na-фосфата или до pH 5 с помощью уксусной кислоты. Фильтрацию для удаления вирусов проводили при комнатной температуре с помощью устройства Viresolve Pro Modus 1.1 (EMD Millipore) с использованием диафрагменного насоса QuattroFlow 150. Фильтр Opticap XL 150 PES с размером пор 0,1 мкм (EMD Millipore) помещали перед вирусным фильтром, чтобы избежать засорения вирусного фильтра агрегатами. Фильтры кондиционировали 1,5 л буфера для состава, например 50,48 мМ Na-фосфатный буфер pH 6,2 или 18 мМ Na-ацетатный буфер pH 5,2. Установленное давление во время процесса фильтрации составляло 2±0,2 бар. После загрузки примерно 500-600 л/м2 объем примерно 0,5-1 л буфера для состава, например 50,48 мМ Na-фосфатный буфер, pH 6,2, использовали для вымывания остаточных моноклональных антител из серии фильтров. Проверку целостности вирусного фильтра проводили при давлении 3,4 бар и продолжительности теста 1 мин.
Пример 8.8: Ультрафильтрация/диафильтрация с тангенциальным потоком (TF-UF/DF)
Роль конечной стадии ультрафильтрации/диафильтрации заключается в регулировании концентрации белкового раствора и, если требуется, в выполнении замены буфера в основной массе состава лекарственного препарата. В случае если конечной стадией полировки была смешанная хроматография в режиме связывания, замена буфера уже была выполнена на уровне смешанной хроматографии, разрешенном режимом связывания (см. Пример 8.5). Кроме того, помимо буфера, посредством диафильтрации могут быть введены другие ингредиенты конечного состава, такие как поверхностно-активные вещества, стабилизаторы и/или криоконсерванты. Альтернативно, концентрированный раствор мАт дополняется непосредственно этими веществами.
Раствор нанофильтрованного продукта из Примера 8.7. собирали в танке блока UF/DF и концентрировали до примерно 40±2 г/л с использованием мембранной кассеты Omega Centrasette (Pall Corporation, отсечка 30 кДа). Давление подачи обеспечивалось диафрагменным насосом QuattroFlow 150. Трансмембранное давление устанавливали на 1 бар, а давление подачи и ретената составляли 1 и 0,6 бар, соответственно. На этой стадии не было потери мАт. В концентрированный раствор продукта добавляли полисорбат 20 и трегалозу или сорбит. Конечную общую концентрацию мАт доводили, например, до 30±2 г/л или до 80±5 г/л. Конечную микрофильтрацию (стерильную фильтрацию) проводили с фильтровальной капсулой Mini Kleenpak 0,2 мкм (Pall Corporation).
Список литературы
1. R.L. Fahrner et al., 2001 «Industrial Purification of Pharmaceutical Antibodies: Development, Operation, and Validation of Chromatography Processes», Biotechnology and Genetic Engineering Reviews 18, 301-327.
2. S.S. Farid, 2009 «Economic Drivers and Trade-Offs in Antibody Purification Processes: The future of therapeutic MAbs lies in the development of economically feasible downstream processes», BioPharm Int. Supplements, October 2, 2009.
3. M. Felo et al., 2015 «Industrial application of impurity flocculation to streamline antibody purification processes» Pharm. Bioprocess 3(2), 115-125.
4. P. Gagnon, 1996 «Purification Tools for Monoclonal Antibodies», Validated Biosystems, Inc., 1-253.
5. V. G. Kadajji and G. V. Betageri, 2011 «Water Soluble Polymers for Pharmaceutical Applications», Polymers 3, 1972-2009.
6. Y (K) Kang et al., 2013 «Development of a Novel and Efficient Cell Culture Flocculation Process Using a Stimulus Responsive Polymer to Streamline Antibody Purification Processes», Biotechnol. Bioeng. 110 (11), 2928-2937.
7. B. Kelly et al., 2009 «Downstream processing of monoclonal antibodies: Current practices and future opportunities», in: Process Scale Purification of Antibodies, edited by U. Gottschalk, John Wiley & Sons, Inc.
8. H.F. Liu, 2010 «Recovery and purification process development for monoclonal antibody production», mabs Landes Biosciences 2(5), 480-499.
9. H. Luo et al., 2017 «Liquid-liquid phase separation causes high turbidity and pressure during low pH elution process in Protein A chromatography», J. Chromatogr. A, 1488, 57-67.
10. T. McNerney et al., 2015, «PDADMAC flocculation of Chinese hamster ovary cells: Enabling a centrifuge-less harvest process for monoclonal antibodies» mAb (Amgen) 7(2), 413-427.
11. A.A. Shukla et al., 2005, «Strategies To Address Aggregation During Protein A Chromatography» BioProcess International, May 2005, 36-44.
12. N. Singh et al., 2016, «Clarification Technologies for Monoclonal Antibody Manufacturing Processes: Current State and Future Perspectives», Eur. J. Biochem. 192, 767-775.
13. WO03002713
14. WO2001150110
15. WO2007035283
16. WO2008091740
17. WO2008127305
18. WO2010151632
19. WO2011146394
20. WO2013090820
21. WO2014004281
22. WO2014133459
23. WO2014196926
24. WO2015130222
25. WO2015135884
26. WO2016153983
27. WO2017217930
28. WO9216553
29. WO9222653
30. WO9411026
31. WO9522389
32. WO9729131
33. WO9845331.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЧИСТКИ БЕЛКА СЛИЯНИЯ | 2015 |
|
RU2698654C2 |
| ХРОМАТОГРАФИЧЕСКИЙ ЛИГАНД | 2005 |
|
RU2541429C2 |
| ПОЛНОСТЬЮ ПРОТОЧНЫЙ СПОСОБ ОЧИСТКИ РЕКОМБИНАНТНЫХ БЕЛКОВ | 2019 |
|
RU2792435C2 |
| ХРОМАТОГРАФИЧЕСКИЙ ЛИГАНД | 2005 |
|
RU2396246C2 |
| ВЫДЕЛЕНИЕ И ОЧИСТКА АНТИТЕЛ ПРОТИВ IL-13 С ПРИМЕНЕНИЕМ АФФИННОЙ ХРОМАТОГРАФИИ С БЕЛКОМ А | 2010 |
|
RU2603055C2 |
| СПОСОБЫ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ЭТАПОВ ОЧИСТКИ БЕЛКА, НАХОДЯЩИХСЯ НИЖЕ ПО ПОТОКУ, С ИСПОЛЬЗОВАНИЕМ МЕМБРАННОЙ ИОНООБМЕННОЙ ХРОМАТОГРАФИИ | 2012 |
|
RU2648999C2 |
| СПОСОБ ОЧИСТКИ ФАКТОРА СВЕРТЫВАНИЯ КРОВИ VIII | 2009 |
|
RU2698392C2 |
| НОСИТЕЛЬ ДЛЯ АФФИННОЙ ХРОМАТОГРАФИИ И СПОСОБ ОЧИСТКИ БИОЛОГИЧЕСКОГО ВЕЩЕСТВА | 2016 |
|
RU2694637C1 |
| Способ очистки дигликозилированного белка интерферон-бета | 2020 |
|
RU2795430C1 |
| ИНТЕГРИРОВАННОЕ НЕПРЕРЫВНОЕ ПРОИЗВОДСТВО ТЕРАПЕВТИЧЕСКИХ БЕЛКОВЫХ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ | 2014 |
|
RU2662929C2 |
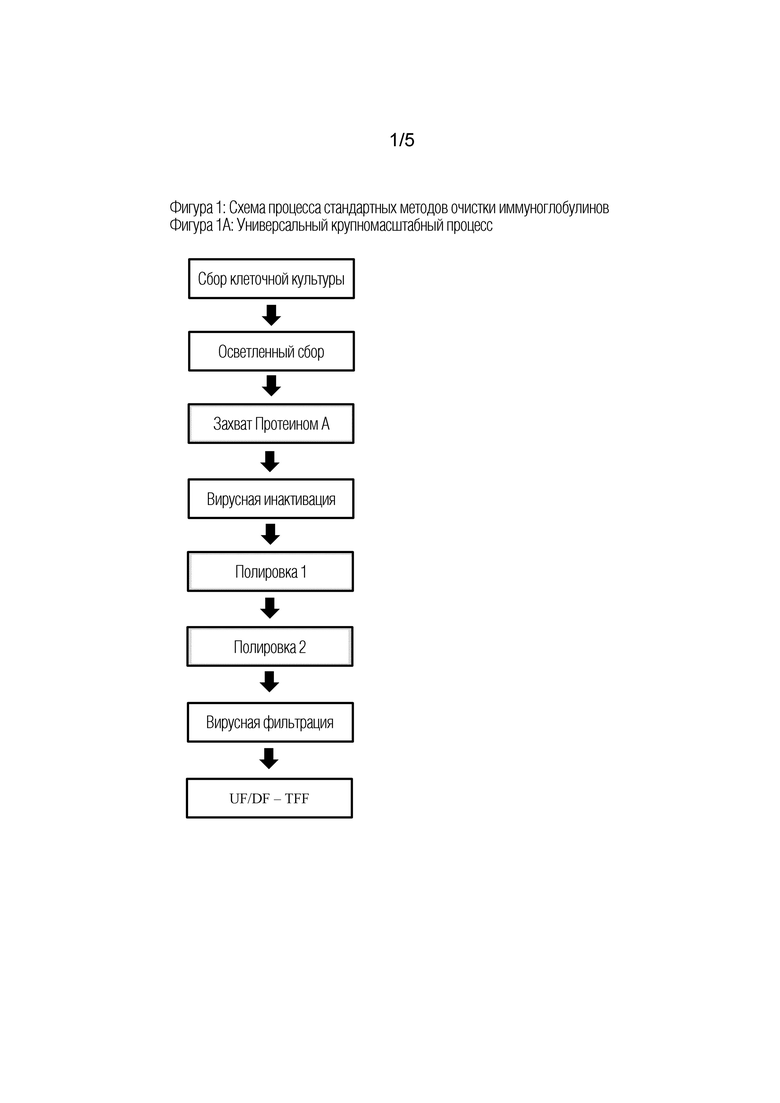
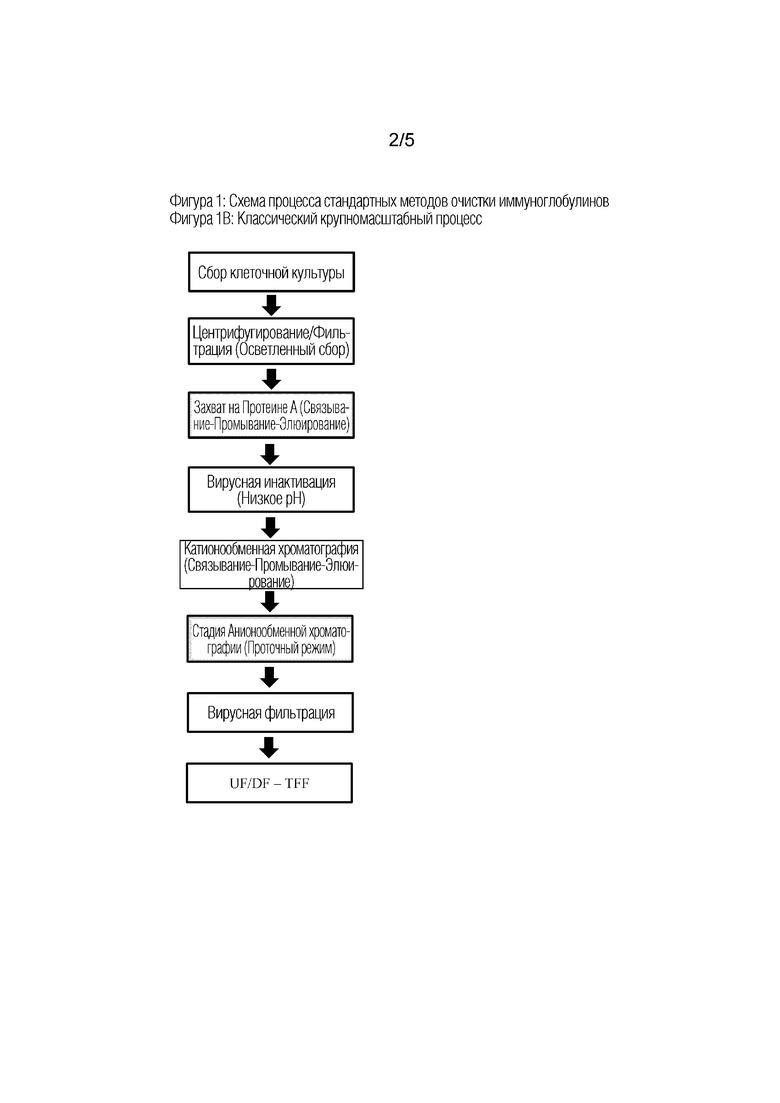
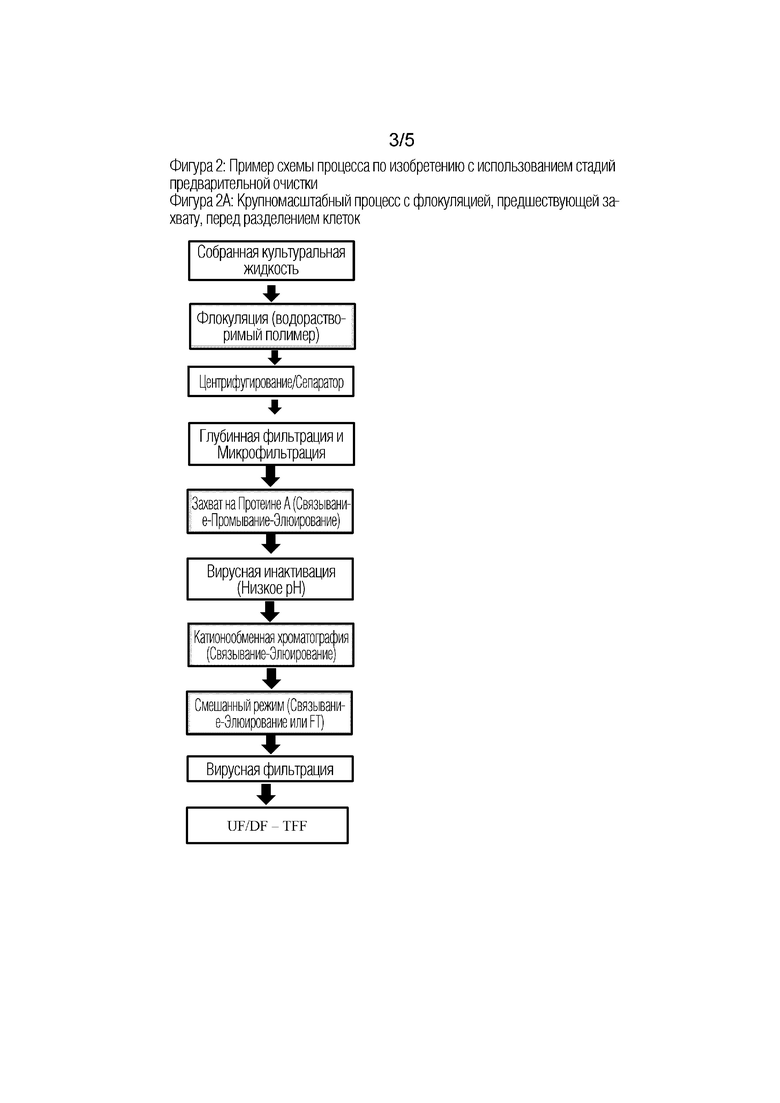
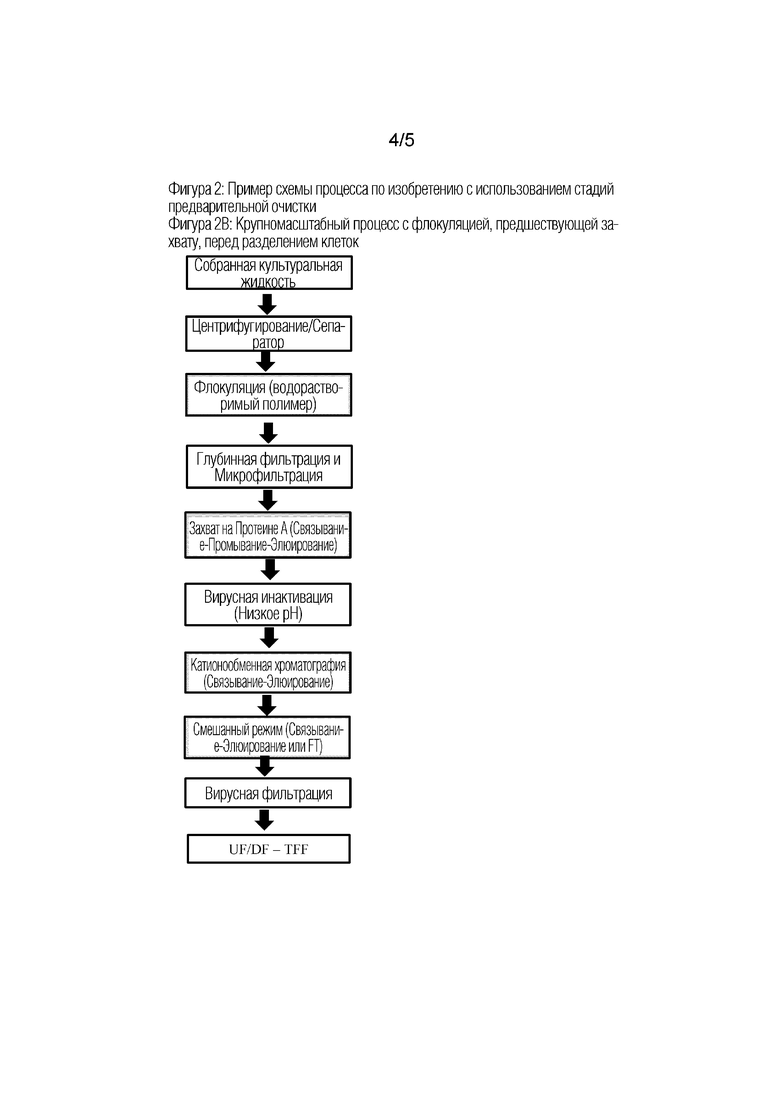
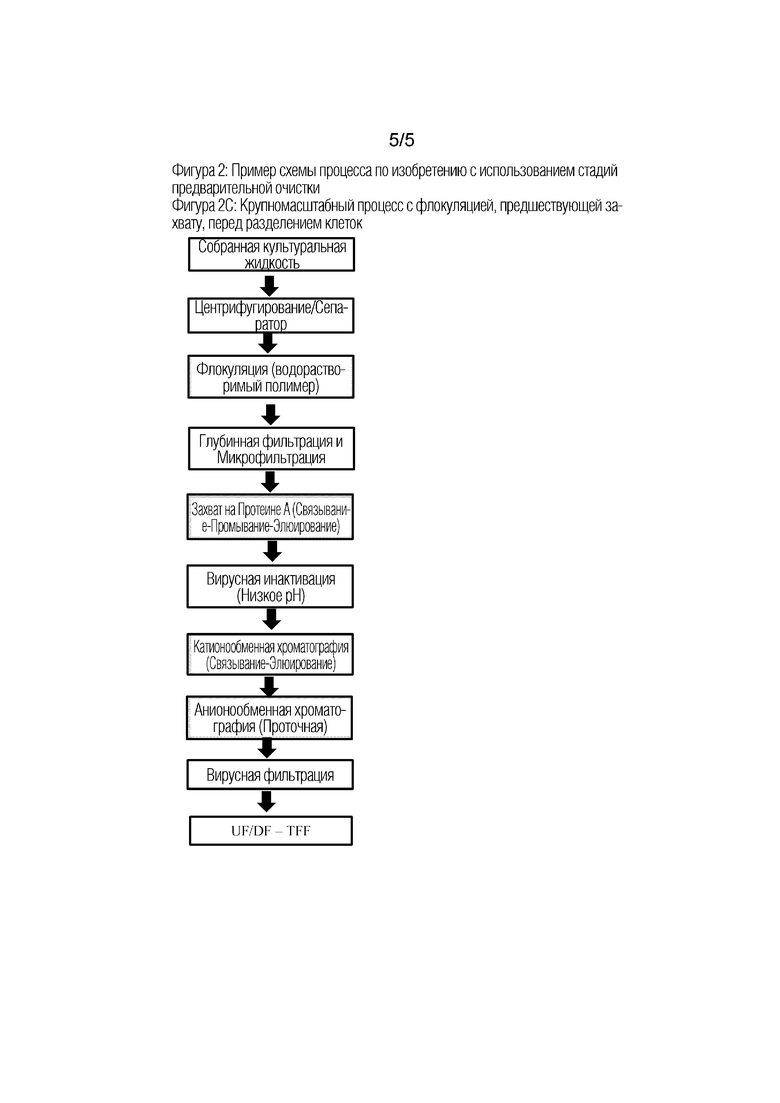
Изобретение относится к формацевтической промышленности, а именно к способу проведения аффинной хроматографии с захватом иммуноглобулина из культуральной жидкости. Способ проведения аффинной хроматографии с захватом иммуноглобулина из культуральной жидкости включает: добавление водорастворимого органического полимера, вызывающего флокуляцию, к культуральной жидкости, глубинную фильтрацию и аффинную хроматографию фильтрата полученной смеси, при этом иммуноглобулин связан со средой для аффинной хроматографии, далее проводят промывание среды для аффинной хроматографии с использованием промывочного буфера со значением pH 5-9 и ионной силой 0,1-5 моль/л и элюирование иммуноглобулина из смолы для аффинной хроматографии с использованием буфера для элюирования со значением pH 2,5-4,5, при этом водорастворимый органический полимер представляет собой поли(диаллилдиметиламмоний хлорид)с молекулярную массу 10-10000 кДа, который добавляют в конечной концентрации 0,01-1,0% мас./об. Вышеописанный способ позволяет устранить формирование осадка при аффинной хроматографии. 23 з.п. ф-лы, 5 ил., 19 табл., 16 пр.
1. Способ проведения аффинной хроматографии с захватом иммуноглобулина из культуральной жидкости, включающий следующие стадии в следующем порядке:
(а) добавление водорастворимого органического полимера к культуральной жидкости;
(b) глубинную фильтрацию смеси стадии (а);
(c) аффинную хроматографию фильтрата, полученного на стадии (b), где иммуноглобулин связан со средой для аффинной хроматографии;
(d) промывание среды для аффинной хроматографии с использованием промывочного буфера со значением pH 5-9 и ионной силой 0,1-5 моль/л; и
(e) элюирование иммуноглобулина из смолы для аффинной хроматографии с использованием буфера для элюирования со значением pH 2,5-4,5,
где водорастворимый органический полимер представляет собой поли(диаллилдиметиламмоний хлорид), где поли(диаллилдиметиламмоний хлорид) имеет молекулярную массу 10-10000 кДа, и где поли(диаллилдиметиламмоний хлорид) добавляют в конечной концентрации 0,01-1,0% мас./об.
2. Способ по п. 1, где стадия (а) включает следующие стадии:
(а1) центрифугирование и/или фильтрацию культуральной жидкости;
(а2) добавление водорастворимого органического полимера к супернатанту или фильтрату, полученному на стадии (а1).
3. Способ по п. 1, где поли(диаллилдиметиламмоний хлорид) добавляют в конечной концентрации 0,02-0,1% мас./об., предпочтительно в конечной концентрации 0,03-0,08% мас./об.
4. Способ по любому из предыдущих пунктов, где за исключением поли(диаллилдиметиламмоний хлорида) никаких других веществ для проведения флокуляции не добавляют.
5. Способ по любому из предыдущих пунктов, где флокуляцию поли(диаллилдиметиламмоний хлоридом) проводят без дополнительного доведения pH или проводимости.
6. Способ по любому из предыдущих пунктов, где флокуляцию проводят при перемешивании при комнатной температуре в течение, по меньшей мере, 5 минут, предпочтительно, по меньшей мере, 15 минут.
7. Способ по любому из предыдущих пунктов, где аффинная хроматография представляет собой хроматографию с Протеином А.
8. Способ по п. 7, где среда для хроматографии с Протеином A содержит устойчивое к щелочам производное Протеина A в качестве лиганда, предпочтительно стабилизированный щелочью вариант тетрамера домена B Протеина A, связанный с поперечно-сшитой агарозной матрицей.
9. Способ по любому из предыдущих пунктов, где фильтр для глубинной фильтрации на стадии (b) содержит более одного слоя, предпочтительно два слоя.
10. Способ по любому из предыдущих пунктов, где между стадиями (b) и (c) проводят микрофильтрацию.
11. Способ по любому из предыдущих пунктов, где стадию (c) проводят по большей мере через 8 часов после стадии (b), предпочтительно по большей мере через 3 часа после стадии (b).
12. Способ по любому из предыдущих пунктов, где культуральную жидкость получают из рекомбинантных клеток СНО, экспрессирующих иммуноглобулин.
13. Способ по любому из предыдущих пунктов, где иммуноглобулин представляет собой IgG1 или IgG2.
14. Способ по п. 13, где Fc-часть IgG1 или IgG2 является человеческой.
15. Способ очистки иммуноглобулина, включающий стадии, как определено по любому из предыдущих пунктов, и включающий одну или более дополнительных стадий после аффинной хроматографии, выбранных из вирусной инактивации, анионообменной хроматографии, катионообменной хроматографии, смешанной хроматографии, нанофильтрации и ультрафильтрации/диафильтрации.
16. Способ по п. 15, где одна или более дополнительных стадий включают: (f) инкубацию элюата стадии (е) для вирусной инактивации при низком значении pH 2,5-4,5 в течение по меньшей мере 10 минут.
17. Способ по п. 15, где одна или более дополнительных стадий включают:
(f) инкубацию элюата стадии (е) для вирусной инактивации при низком значении pH 2,5-4,5 в течение по меньшей мере 10 минут;
(g) проведение катионообменной хроматографии;
(h) проведение смешанной хроматографии или анионообменной хроматографии;
(i) нанофильтрацию элюата стадии (h) или композиции, полученной из него и полученной после одной или более дополнительных стадий обработки, выполняемых после стадии (h); и
(j) ультрафильтрацию/диафильтрацию фильтрата стадии (i) или композиции, полученной из него и полученной после одной или более дополнительных стадий обработки, выполняемых после стадии (i).
18. Способ по п. 17, где катионообменную хроматографию (g) проводят в режиме связывания-элюирования, необязательно включая одну или более стадий промывания.
19. Способ по п. 17, где смешанную хроматографию на стадии (h) проводят в режиме связывания-элюирования, необязательно включая одну или более стадий промывания.
20. Способ по п. 17, где хроматографию (h) проводят в проточном режиме.
21. Способ по п. 17, где катионообменную хроматографию на стадии (g) проводят со средой, содержащей сильную катионообменную среду, предпочтительно с сульфопропил(-CH2CH2CH2SO3-) в качестве лиганда.
22. Способ по п. 21, где сульфопропил(-CH2CH2CH2SO3-) связан с поперечно-сшитой поли(стиролдивинилбензольной) матрицей.
23. Способ по п. 17, где смешанную хроматографию на стадии (h) проводят с положительно заряженной средой для смешанной хроматографии, предпочтительно содержащей N-бензил-N-метилэтаноламин в качестве лиганда, связанной с поперечно-сшитой агарозной матрицей.
24. Способ по п. 17, где анионообменную хроматографию на стадии (h) проводят со средой, содержащей сильную анионообменную среду, предпочтительно с триметиламмонием(-N+(CH3)3) в качестве лиганда, связанной с поперечно-сшитой агарозной матрицей.
| YUN KENNETH KANG et al., "Development of a novel and efficient cell culture flocculation process using a stimulus responsive polymer to streamline antibody purification processes", BIOTECHNOLOGY AND BIOENGINEERING, (20131101), vol | |||
| Прибор, автоматически записывающий пройденный путь | 1920 |
|
SU110A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| Разрывная оболочечная пуля | 1923 |
|
SU2928A1 |
| HUI F | |||
| LIU et al., "Recovery and purification process development | |||
Авторы
Даты
2023-04-18—Публикация
2020-03-25—Подача