ОБЛАСТЬ ТЕХНИКИ
В настоящем изобретении рассматривают частицы {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты в аморфной и кристаллической формах, способы получения и их фармацевтические композиции. Также предоставлены способы их применения для лечения, профилактики или облегчения одного или более симптомов расстройства или заболевания, опосредованных CRTH2.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
CRTH2 представляет собой хемоаттрактантный рецептор, связанный с G белками, экспрессируемый на Th2 клетках, эозинофилах и базофилах (Nagata et al., J. Immunol. 1999, 162, 1278-1286; Hirai et al., J. Exp. Med. 2001, 193, 255-261). Простагландин D2 (PGD2), основной медиатор воспаления, продуцируемый тучными клетками, является естественным лигандом CRTH2. В последнее время было показано, что активация CRTH2 PGD2 вызывает миграцию и активацию Th2 клеток и эозинофилов, предполагая, что CRTH2 может играть провоспалительную роль в аллергических заболеваниях (Hirai et al., J. Exp. Med. 2001, 193, 255-261; Gervais et al., J. Allergy Clin. Immunol. 2001, 108, 982-988). Также было показано, что у пациентов с атопическим дерматитом существует повышение циркулирующих Т клеток, экспрессирующих CRTH2, которое коррелирует с тяжестью заболевания (Cosmi et al., Eur. J. Immunol. 2000, 30, 2972-2979; Iwazaki et al., J. Investigative Dermatology 2002, 119, 609-616). Роль PGD2 в развитии и поддержании аллергического воспаления дополнительно была продемонстрирована в модели астмы на мышах, показывая, что избыточная продукция PGD2 PGD2-синтазой in vivo усиливает воспаление дыхательных путей (Fujitani et al., J. Immunol. 2002, 168, 443-449). Следовательно, антагонисты CRTH2 являются потенциально применимыми для лечения расстройств или заболеваний, опосредованных CRTH2, таких как аллергический ринит, аллергическая астма, бронхоконстрикция, атопический дерматит или системные воспалительные заболевания.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Предоставлены частицы {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты, которая имеет формулу I:
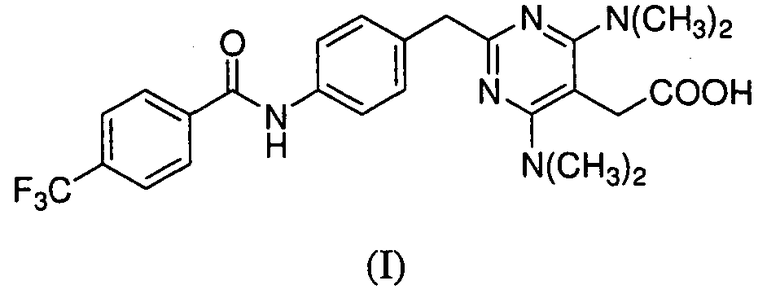
в аморфной форме или кристаллической форме I или II. Соединение формулы I было идентифицировано как антагонист CRTH2 (WO 2004/0022218).
В одном варианте осуществления изобретения частицы {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты имеют форму I, которая имеет дифрактограмму рентгеновского излучения на порошке, по существу как показано на фиг.1, или термограмму дифференциальной сканирующей калориметрии, по существу как показано на фиг.2.
В другом варианте осуществления изобретения частицы {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты имеют форму II, которая имеет дифрактограмму рентгеновского излучения на порошке, по существу как показано на фиг.6.
В еще одном варианте осуществления изобретения частицы {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты являются аморфными.
Также предоставлена фармацевтическая композиция, содержащая частицы {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты в аморфной форме, кристаллической форме I или II или их смеси, и один или более фармацевтически приемлемых носителей или вспомогательных веществ.
Дополнительно предоставлен способ для лечения, профилактики или облегчения одного или более симптомов расстройства или заболевания, опосредованных CRTH2, который включает введение частиц {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты в аморфной форме, кристаллической форме I или II или их смеси.
Кроме того, предоставлен способ для получения частиц {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты в аморфной форме или кристаллической форме I или II.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 изображена дифрактограмма рентгеновского излучения на порошке частиц {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты в кристаллической форме I.
На фиг.2 изображена термограмма дифференциальной сканирующей калориметрии (DSC) частиц кислоты формулы I в форме I.
На фиг.3 изображена термогравиметрическая (TG) термограмма частиц кислоты формулы I в форме I.
На фиг.4 изображены фотографии сканирующей электронной микроскопии (SEM) частиц кислоты формулы I в форме I при увеличении 2500 (А), 5000 (В) и 10000 (С).
На фиг.5 изображен график распределения по размеру частиц кислоты формулы I в форме I.
На фиг.6 изображена XRP дифрактограмма частиц кислоты формулы I в форме II.
На фиг.7 изображены SEM фотографии частиц кислоты формулы I в форме II при увеличении 370 (А), 2000 (В), 5500 (С) и 10000 (D).
На фиг.8 изображена XRP дифрактограмма частиц кислоты формулы I, полученных посредством фазы установления равновесия между частицами в форме I и форме II.
На фиг.9 изображена XRP дифрактограмма кислоты формулы I в аморфной форме.
На фиг.10 изображена кривая доза-ответ для {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты формулы I в анализе конкурентного связывания радиолиганда с использованием клеток, трансфицированных CRTH2.
На фиг.11 изображена кривая доза-ответ для {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты формулы I (▲), вместе с селективным антагонистом DP1 BWA 868C (■), в анализе конкурентного связывания радиолиганда с использованием клеток, трансфицированных DP1.
ПОДРОБНОЕ ОПИСАНИЕ
Для облечения понимания описания, представленного ниже, ряд терминов определен ниже.
Как используется в настоящем описании, формы единственного числа могут относиться к формам множественного числа, если особым образом не указано иначе. Обычно номенклатура, используемая в настоящем описании и лабораторных методиках в органической химии, медицинской химии и фармакологии, описанная в настоящем описании, является таковой, хорошо известной и обычно используемой в области техники. Если не указано иначе, все технические и научные термины, используемые в настоящем описании, обычно имеют такие же значения, которые, как правило, понимает обычный специалист в области техники, к которой принадлежит это описание. В случае, когда существует множество определений для термина, превалируют определения, представленные в настоящем разделе, если не указано иначе.
Термин «антирастворитель» относится к жидкости, которую добавляют к растворителю для уменьшения растворимости соединения в таком растворителе, приводя к осаждению соединения.
Термин «пациент» относится к животному, включая, но не ограничиваясь перечисленными, примата (например, человека), корову, овцу, козу, лошадь, собаку, кошку, кролика, крысу или мышь. Обычно термины «субъект» и «пациент» используются в настоящем описании взаимозаменяемо в отношении, например, субъекта млекопитающего, особенно пациента человека.
Термины «лечить», «лечение» и «процесс лечения» предназначены для включения облегчения или устранения расстройства или заболевания или одного или более симптомов, ассоциированных с расстройством или заболеванием; или облегчения или устранения причин(ы) расстройства или заболевания как такового.
Термины «предотвращать», «предотвращение» и «профилактика» относятся к способу замедления или предотвращения развития заболевания и/или его сопутствующих симптомов, предохраняя пациента от развития заболевания или уменьшения риска развития заболевания у пациента.
Термин «терапевтически эффективное количество» относится к количеству соединения, которое при введении достаточно для профилактики развития или в некоторой степени облегчения одного или больше симптомов состояния или расстройства, подвергаемого лечению. Термин «терапевтически эффективное количество» также относится к количеству соединения, которое усиливает биологический или медицинский ответ ткани, системы, животного или человека, который ищет исследователь, ветеринар, врач или клиницист.
Термин «фармацевтически приемлемый носитель», «фармацевтически приемлемое вспомогательное вещество», «физиологически приемлемый носитель» или «физиологически приемлемое вспомогательное вещество» относится к фармацевтически приемлемому материалу, композиции или носителю, такому как жидкий или твердый наполнитель, разбавитель, растворитель или инкапсулирующий материал. Каждый компонент должен быть «фармацевтически приемлемым» в смысле совместимости с другими ингредиентами фармацевтической композиции. Он также должен быть подходящим для использования в контакте с тканями или органами людей и животных без чрезмерной токсичности, раздражения, аллергического ответа, иммуногенности или других проблем или осложнений, соответствуя приемлемому соотношению польза/риск.
Термин «естественного происхождения» или «нативный» при использовании в связи с биологическими материалами, такими как молекулы нуклеиновой кислоты, полипептиды, клетки-носители и подобные, относится к материалам, которые обнаруживаются в природе и не созданы человеком. Сходным образом, «не-естественного происхождения» или «не-нативный» относятся к материалу, который не обнаруживается в природе или который был структурно модифицирован или синтезирован человеком.
Термин «CRTH2» относится к белку рецептору CRTH2 или его варианту, который способен опосредовать клеточный ответ на PGD2 in vitro или in vivo. Варианты CRTH2 включают белки, по существу гомологичные нативному CRTH2, т.е. белки, имеющие одну или больше естественных или неестественных делеций, вставок или замен аминокислот (например, производные, гомологи и фрагменты CRTH2) по сравнению с последовательностью аминокислот естественного CRTH2. Последовательность аминокислот варианта CRTH2 является на, по меньшей мере, около 80% идентичной, по меньшей мере, около 90% идентичной или, по меньшей мере, около 95% идентичной нативному CRTH2.
Термин «другой рецептор PGD2» относится к белку простаноидного рецептора, отличному от CRTH2, или его варианту, который способен опосредовать клеточный ответ на PGD2 in vivo или in vitro. «Другой рецептор PGD2» может быть селективным для PGD2, например, DP или любого одного или более другого простаноида. Варианты «другого рецептора PGD2» включают белки, по существу гомологичные соответствующим нативным простаноидным рецепторам, отличным от CRTH2, т.е. белки, имеющие одну или более естественную или неестественную делецию, вставку или замену аминокислот (например, производные, гомологи и фрагменты нативного простаноидного рецептора, отличного от CRTH2). Последовательность аминокислот нативного варианта «другого рецептора PGD2» является на, по меньшей мере, около 80% идентичной, по меньшей мере, около 90% идентичной или, по меньшей мере, около 95% идентичной соответствующему «другому рецептору PGD2».
Термин «антагонист CRTH2» относится к соединению, которое, например, частично или полностью блокирует, снижает, предотвращает, ингибирует или подавляет активность CRTH2 и/или активность одного или более других рецепторов PGD2. Термин «антагонист CRTH2» также относится к соединению, которое связывается с, замедляет активацию, инактивирует или десенсибилизирует CRTH2 или один или более других рецепторов PGD2. Антагонист CRTH2 может действовать, вмешиваясь во взаимодействие PGD2 с CRTH2 или одним или более другими рецепторами PGD2.
Термин «расстройство или заболевание, опосредованное CRTH2» и «состояние, расстройство или заболевание, опосредованное CRTH2» относится к состоянию, расстройству или заболеванию, характеризуемым несоответствующей, например, меньшей чем или большей чем нормальная активность CRTH2. Несоответствующая функциональная активность CRTH2 может возникать в результате экспрессии CRTH2 в клетках, которые обычно не экспрессируют CRTH2, увеличенной экспрессии CRTH2 или степени внутриклеточной активации, приводящей к, например, воспалительным или иммуно-связанным расстройствам или заболеваниям; или сниженной экспрессии CRTH2. Состояние, расстройство или заболевание, опосредованные CRTH2, могут быть полностью или частично опосредованы несоответствующей активностью CRTH2. В частности, состояние, расстройство или заболевание, опосредованное CRTH2, является таким, при котором модуляция CRTH2 или одного или больше рецепторов PGD2 приводит в некоторой степени к фоновому состоянию или расстройству, например, антагонист или агонист CRTH2 приводят к некоторому улучшению у, по меньшей мере, некоторых пациентов, получающих лечение.
Термин «насыпная масса после уплотнения» относится к насыпной плотности в тесно наполненном состоянии с помощью отвода жидкости, такого как сброс из контейнера, наполненного образцом заранее определенной высоты повторно для получения небольшого давления на дно контейнера. Насыпная масса после уплотнения может быть определена с использованием, например, Powder Tester PT-D (Hosokawa Micron Corporation, Osaka, Japan).
Термин «коэффициент однородности» относится к параметру, который показывает степень однородности распределения частиц по размеру и его определяют как значение, полученное делением размера частиц 60 процентиля на размер частиц 10 процентиля, которые получают из кривой распределения частиц. Когда распределение частиц по размеру становится более однородным, коэффициент однородности приближается к 1.
Частицы
В настоящем описании предоставлены частицы {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты в аморфной форме или кристаллической форме I или II. Частицы кислоты формулы I могут быть охарактеризованы с использованием ряда способов, известных специалисту в области техники, включая монокристаллическую рентгеновскую дифракцию, дифракцию рентгеновского излучения на порошке (XRPD), микроскопию (например, сканирующую электронную микроскопию (SEM)), термический анализ (например, дифференциальная сканирующая калориметрия (DSC), термический гравиметрический анализ (TGA) и микроскопия с нагревательным столиком) и спектроскопию (например, инфракрасную, Рамана, ядерный магнитный резонанс твердой фазы). Размер частиц и распределение по размеру могут быть определены обычными методами, такими как методика рассеяния лазерного излучения. Чистота частиц кислоты формулы I может быть определена стандартными аналитическими методами, такими как тонкослойная хроматография (ТЖХ), гель-электрофорез, газовая хроматография, высокоэффективная жидкостная хроматография (ВЭЖХ) и масс-спектрометрия (МС).
В одном варианте осуществления изобретения частицы {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты находятся в кристаллической форме I. В одном варианте осуществления изобретения частицы формы I имеют дифрактограмму рентгеновского излучения на порошке, по существу как показано на фиг.1. В другом варианте осуществления изобретения частицы формы I имеют характерные пики XRP дифракции при двойном угле сближения приблизительно 9,8, 13,1, 22,0 и 26,4º. В еще одном варианте осуществления изобретения частицы формы I имеют характерный пик XRP дифракции при двойном угле сближения приблизительно 9,8, 13,1, 22,0 и 26,4º. В еще одном варианте осуществления изобретения частицы формы I имеют характерный пик XRP дифракции при двойном угле сближения приблизительно 22,0º. В еще одном варианте осуществления изобретения частицы формы I имеют термограмму дифференциальной сканирующей калориметрии, по существу как показано на фиг.2. В еще одном варианте осуществления изобретения частицы формы I имеют DSC термограмму с эндотермой при пиковой температуре около 224ºС и температуре начала разложения около 220ºС. В еще одном варианте осуществления изобретения форма кристалла частиц формы I является по существу игольчатой (фиг.4). В еще одном варианте осуществления изобретения частицы формы I имеют растворимость в воде около 3 мкг/мл при комнатной температуре.
В одном варианте осуществления изобретения частицы формы I могут иметь средний размер частиц, варьирующийся от около 0,1 до около 150 мкм, от около 0,5 до около 100 мкм, от около 1 до около 50 мкм, от около 1 до около 25 мкм, от около 1 до около 20 мкм, от около 1 до около 10 мкм, от около 2 до около 10 мкм или от около 2 до около 7,5 мкм. В другом варианте осуществления изобретения частицы формы I могут иметь однородное распределение частиц по размеру, что оценивают по коэффициенту однородности, варьирующемуся от около 1 до около 20, от около 1 до около 10, от около 2 до около 5 или от около 3 до около 4. В еще одном варианте осуществления изобретения твердые частицы формы I могут иметь насыпную массу после уплотнения, варьирующуюся от около 0,1 до около 1,0, от около 0,15 до около 0,8, от около 0,2 до около 0,6, от около 0,25 до около 0,5 или от около 0,3 до около 0,4 г/мл.
Частицы с такими свойствами частиц могут быть получены непосредственно способом получения, описанным в настоящем описании. Альтернативно, частицы таких размеров могут также быть получены с использованием любого обычного способа получения частиц, такого как измельчение, микронизация или гранулирование. Частицы формы I, представленные в настоящем описании, подходят для непосредственного получения кислоты формулы I в качестве терапевтических продуктов, таким образом, упрощая процесс производства и устраняя риски, ассоциированные с обычными способами получения частиц, такие как нежелательная конверсия вещества, кристаллизующегося в различных формах.
В определенных вариантах осуществления изобретения частицы кислоты формулы I в форме I могут содержать не менее около 95%, не менее около 97%, не менее около 98%, не менее около 99% или не менее около 99,5% по массе кислоты формулы I. Частицы также могут содержать не менее около 90%, не менее около 95%, не менее около 98%, не менее около 99% или не менее около 99,5% по массе твердых частиц в форме I.
В определенных вариантах осуществления изобретения частицы кислоты формулы I в форме I могут иметь остаточное содержание органического растворителя не более около 5%, не более около 2%, не более около 1%, не более около 0,9%, не более около 0,8%, не более около 0,7%, не более около 0,6%, не более около 0,5, не более около 0,4%, не более около 0,3%, не более около 0,2%, не более около 0,1%, не более около 0,05% или не более около 0,01% по массе.
В определенных вариантах осуществления изобретения частицы кислоты формулы I в форме I могут иметь остаточное содержание метанола не более около 100000 ч./млн, не более около 10000 ч./млн, не более около 5000 ч./млн, не более около 4000 ч./млн, не более около 3000 ч./млн, не более около 2000 ч./млн, не более около 1000 ч./млн, не более около 500 ч./млн или не более около 100 ч./млн.
В другом варианте осуществления изобретения частицы {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты находятся в кристаллической форме II. Частицы формы II имеют дифрактограмму рентгеновского излучения на порошке, по существу как показано на фиг.6. Частицы формы I имеют характерный пик XRP дифракции при двойном угле сближения приблизительно 31,7º.
В одном варианте осуществления изобретения частицы формы II могут иметь средний размер частиц, варьирующийся от около 0,1 до около 150 мкм, от около 0,5 до около 100 мкм, от около 1 до около 50 мкм, от около 1 до около 25 мкм, от около 1 до около 20 мкм, от около 1 до около 10 мкм, от около 1 до около 5 мкм или от около 2 до около 5 мкм. В другом варианте осуществления изобретения частицы формы II могут иметь однородное распределение частиц по размеру, что оценивают по коэффициенту однородности, варьирующемуся от около 1 до около 20, от около 1 до около 10, от около 2 до около 5 или от около 3 до около 4. В еще одном варианте осуществления изобретения частицы формы II могут иметь насыпную массу при уплотнении, варьирующуюся от около 0,1 до около 1,0, от около 0,15 до около 0,8, от около 0,2 до около 0,6, от около 0,25 до около 0,5 или от около 0,3 до около 0,4 г/мл.
Частицы с указанными свойствами частиц могут быть получены непосредственно способом получения, описанным в настоящем описании. Альтернативно, частицы таких размеров также могут быть получены с использованием любых обычных способов, таких как измельчение, микронизация или гранулирование.
В определенных вариантах осуществления изобретения частицы кислоты формулы I в форме II могут содержать не менее около 95%, не менее около 97%, не менее около 98%, не менее около 99% или не менее около 99,5% по массе кислоты формулы I. Частицы также могут содержать не менее около 90%, не менее около 95%, не менее около 98%, не менее около 99% или не менее около 99,5% по массе частиц в форме II.
В определенных вариантах осуществления изобретения частицы кислоты формулы I в форме II могут иметь остаточное содержание органического растворителя не более около 5%, не более около 2%, не более около 1%, не более около 0,9%, не более около 0,8%, не более около 0,7%, не более около 0,6%, не более около 0,5%, не более около 0,4%, не более около 0,3%, не более около 0,2%, не более около 0,1%, не более около 0,05% или не более около 0,01% по массе.
В еще одном варианте осуществления изобретения частицы {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты являются аморфными. Аморфные частицы имеют дифрактограмму рентгеновского излучения на порошке, по существу как показано на фиг.9, которая не имеет характерных пиков XRP дифракции для частиц формы I и/или формы II. В одном варианте осуществления изобретения аморфные частицы могут содержать не менее около 95%, не менее около 97%, не менее около 98%, не менее около 99% или не менее около 99,5% по массе кислоты формулы I. В другом варианте осуществления изобретения частицы могут также содержать не менее около 90%, не менее около 95%, не менее около 98%, не менее около 99% или не менее около 99,5% по массе аморфных твердых частиц.
В определенных вариантах осуществления изобретения аморфные частицы кислоты формулы I могут иметь остаточное содержание органического растворителя не более около 5%, не более около 2%, не более около 1%, не более около 0,9%, не более около 0,8%, не более около 0,7%, не более около 0,6%, не более около 0,5%, не более около 0,4%, не более около 0,3%, не более около 0,2%, не более около 0,1%, не более около 0,05% или не более около 0,01% по массе.
Необходимо понимать, что численные значения пиков дифрактограмм рентгеновского излучения на порошке могут немного варьироваться от одного прибора к другому или от одного образца к другому, и поэтому указанные значения должны рассматриваться не как абсолютные, а с доступной вариабельностью, такой как 0,1º, которая рекомендована в Фармакопее Соединенных Штатов (страницы 387-389, 2007).
Способ получения
Также предоставлены способы для получения частиц кислоты формулы I в аморфной форме или кристаллической форме I или II. Способы включают стадию контакта кислоты формулы I с растворителем, в котором частицы кислоты формулы I в аморфной форме или кристаллической форме I или II могут быть образованы из раствора или преобразованы из одной твердой формы в другую. Способ может дополнительно включать стадию выделения, на которой частицы могут быть выделены обычным способом, таким как фильтрация и центрифугирование, с последующей промывкой растворителем и затем сушкой (например, сушка в вакуумной печи, сушка на воздухе или сушка десикантом).
Подходящие растворители для использования в получении твердых частиц в аморфной форме или кристаллической форме I или II включают, но не ограничиваются перечисленными, углеводороды, включая петролейный эфир, пентан, гексан(ы), гептан, октан, изооктан, циклопентан, циклогексан, метилциклогексан, бензол, толуол, ксилол, тетралин и кумен; хлорированные углеводороды, включая дихлорметан (ДХМ), 1,2-дихлорэтан, 1,1-дихлорэтен, 1,2-дихлорэтен, хлороформ, трихлорэтан, трихлорэтен, тетрахлорид углерода, хлорбензол и трифторметилбензол; спирты, включая метанол, этанол, изопропанол (IPA), 1-пропанол, 1-бутанол, 2-бутанол, трет-бутанол, 3-метил-1-бутанол, 1-пентанол, 2-метоксиэтанол, 2-этоксиэтанол и этиленгликоль; простые эфиры, включая диэтиловый эфир, диизопропиловый эфир, метил трет-бутиловый эфир (MTBE), дифениловый эфир, 1,2-диметоксиэтан, би(2-метоксиэтиловый)эфир, 1,1-диметоксиметан, 2,2-диметоксипропан и анизол; кетоны, включая ацетон, бутанон, метилэтилкетон (MEK), метилизопропилкетон, метилбутилкетон и метилизобутилкетон (MIBK); сложные эфиры, включая метилацетат, этилформиат, этилацетат, пропилацетат, изопропилацетат, изобутилацетат и бутилацетат; карбонаты, включая этиленкарбонат и пропиленкарбонат; амиды, включая формамид, N,N-диметилформамид (ДМФА) и N,N-диметилацетамид; нитрилы, включая ацетонитрил (ACN); сульфоксиды, такие как диметилсульфоксид (ДМСО); сульфоны, также как сульфолан; нитросоединения, такие как нитрометан и нитробензол; гетероциклы, такие как N-метилпирролидон, 2-метилтетрагидрофуран, тетрагидрофуран (ТГФ), диоксан и пиридин; карбоновые кислоты, такие как уксусная кислота, трихлоруксусная кислота и трифторуксусная кислота; фосфорамиды, такие как гексаметилфосфорамид; сульфид углерода; вода и их смеси.
Твердые частицы кислоты формулы I в кристаллической форме I могут быть получены из раствора или густой суспензии кислоты формулы I в растворителе с использованием обычных методов, включая, но не ограничиваясь перечисленными, охлаждение, замораживание, выпаривание растворителя или добавление антирастворителя.
В одном варианте осуществления изобретения способ для получения частиц формы I включает стадии (а) получения раствора кислоты формулы I в растворителе при первой температуре и (b) создания частиц формы I при второй температуре. Для ускорения образования частиц формы I способ также может включать стадию посева путем затравливания раствора кристаллами формы I перед или во время стадии (b). Способ может дополнительно включать стадию выделения, как описано в настоящем описании.
Раствор может быть получен из любых форм кислоты формулы I, включая, но не ограничиваясь перечисленными, масла, полутвердые вещества, твердые вещества (такие как аморфная форма или форма I или II) или их смеси. Раствор по стадии (а) может быть получен как насыщенный или почти насыщенный раствор при первой температуре. Насыщенный или почти насыщенный раствор может быть получен растворением достаточного количества кислоты формулы I в растворителе при температуре, которая выше, чем первая температура, так что, когда раствору позволяют остыть до первой температуры, получают насыщенный или почти насыщенный раствор. Достаточное количество кислоты формулы I может быть оценено на основании растворимости частиц формы I в растворителе при первой температуре, которая может быть определена с использованием способа, известного специалисту в области техники.
Первая температура может варьироваться от комнатной до температуры около температуры кипения растворителя, например, от около 20 до около 200ºС, от около 20 до около 150ºС или от около 20 до около 100ºС. Вторая температура может варьироваться от -100 до 100ºС, от около -50 до около 50ºС, от около -10 до около 30ºС, от около 20 до около 200ºС, от около 20 до около 150ºС или от около 20 до около 100ºС. Первая температура может быть выше или ниже или такой же, как вторая температура. Для максимального увеличения выхода и эффективности способа вторую температуру обычно устанавливают ниже, чем первая температура.
В одном варианте осуществления изобретения частицы формы I образуются путем выпаривания растворителя из раствора при второй температуре. Выпаривание растворителя может быть облегчено применением к раствору тепла и/или вакуума. В одном варианте осуществления изобретения растворителем является ацетонитрил, дихлорметан, ДМФА, 1,4-диоксан, метанол, 2-метоксиэтанол, MIBK, ацетон, 1-бутанол, MTBE, ДМСО, этанол, этилацетат, изобутилацетат, изопропилацетат, 1-пропанол, IPA, MEK, ТГФ или их смесь.
В другом варианте осуществления изобретения частицы формы I образуются путем охлаждения раствора до второй температуры. В таком случае вторую температуру устанавливают ниже, чем первая температура. В одном варианте осуществления изобретения растворителем является ДМФА, 1,4-диоксан, метанол, 2-метоксиэтанол, 1-бутанол, 1-пропанол, IPA, MEK, ТГФ или их смесь.
В еще одном варианте осуществления изобретения частицы формы I образуются путем добавления антирастворителя к растворителю при второй температуре.
Подходящие антирастворители включают, но не ограничиваются перечисленными, углеводороды, включая петролейный эфир, пентан, гексан(ы), гептан, октан, изооктан, циклопентан, циклогексан, метилциклогексан, бензол, толуол, ксилол, тетралин и кумен; хлорированные углеводороды, включая дихлорметан (ДХМ), 1,2-дихлорэтан, 1,1-дихлорэтен, 1,2-дихлорэтен, хлороформ, трихлорэтан, трихлорэтен, тетрахлорид углерода, хлорбензол и трифторметилбензол; спирты, включая изопропанол (IPA), 1-пропанол, 1-бутанол, 2-бутанол, трет-бутанол, 3-метил-1-бутанол, 1-пентанол, 2-этоксиэтанол и этиленгликоль; простые эфиры, включая диэтиловый эфир, диизопропиловый эфир, метил трет-бутиловый эфир (MTBE), дифениловый эфир, 1,2-диметоксиэтан, би(2-метоксиэтил)эфир, 1,1-диметоксиметан, 2,2-диметоксипропан и анизол; кетоны, включая бутанон, метилизопропилкетон, метилбутилкетон и метилизобутилкетон (MIBK); сложные эфиры, включая метилацетат, этилформиат, этилацетат, пропилацетат, изопропилацетат, изобутилацетат и бутилацетат; карбонаты, включая этиленкарбонат и пропиленкарбонат; нитросоединения, включая нитрометан и нитробензол; гетероциклы; сульфид углерода; вода и их смеси.
Когда в качестве пары растворитель/антирастворитель используют два растворителя, кислота формулы I имеет более высокую растворимость в растворителе, чем в антирастворителе. Необязательно, растворитель и антирастворитель в паре растворитель/антирастворитель являются, по меньшей мере, частично смешиваемыми. В одном варианте осуществления изобретения растворителем является ТГФ, метоксиэтанол, ДМСО, ДМФА или их смесь; и антирастворителем является гексан(ы), MTBE, толуол, вода или их смесь. В другом варианте осуществления изобретения парой растворитель/антирастворитель является ТГФ/гексан, ТГФ/вода, ДМФА/MTBE или ДМФА/вода.
В еще одном варианте осуществления изобретения частицы формы I получают путем добавления растворителя к антирастворителю при второй температуре. В одном варианте осуществления изобретения растворителем является ТГФ, метоксиэтанол, ДМСО, ДМФА или их смесь; и антирастворителем является гексан(ы), MTBE, толуол, изопропилацетат, вода или их смесь. В другом варианте осуществления изобретения парой растворитель/антирастворитель являются ТГФ/гексан, ТГФ/вода, 2-метоксиэтанол/гексан, ДМСО/вода или ДМФА/вода.
В другом варианте осуществления изобретения способ для получения частиц формы I включает стадии (а) получения густой суспензии кислоты формулы I в растворителе при первой температуре и (b) получение частиц формы I путем воздействия на густую суспензию второй температуры. Густая суспензия может быть получена из любых форм кислоты формулы I, включая, но не ограничиваясь перечисленными, масла, полутвердые вещества, твердые вещества (такие как аморфная форма или форма I или II) или их смеси. Способ может дополнительно включать стадию посева и/или стадию выделения, как описано в настоящем описании.
Первая и вторая температуры и растворитель являются такими, как определено в настоящем описании. В одном варианте осуществления изобретения растворителем является ацетонитрил, хлороформ, дихлорметан, ДМФА, 1,4-диоксан, метанол, 2-метоксиэтанол, MIBK, толуол, гексан(ы), ацетон, 1-бутанол, MTBE, ДМСО, этанол, этилацетат, этилформиат, гептан, изобутилацетат, изопропилацетат, 1-пропанол, IPA, MEK, ТГФ или их смесь.
В еще одном варианте осуществления изобретения способ для получения частиц формы I включает стадии (а) получения раствора кислоты формулы I в растворителе при первой температуре (b) образования густой суспензии путем охлаждения раствора до второй температуры; и (с) создания твердых частиц формы I путем воздействия на густую суспензию одного или более циклов нагревания и охлаждения. Способ может дополнительно включать стадию посева и/или стадию выделения, как описано в настоящем описании.
Первая и вторая температуры и растворитель являются такими, как определено в настоящем описании. В одном варианте осуществления изобретения растворителем является ацетонитрил, 1,4-диоксан, 2-метоксиэтанол, MIBK, ацетон, 1-бутанол, этанол, 1-пропанол, IPA, MEK, ТГФ, вода/ТГФ (3:7, об/об) или их смесь. Циклы нагревания и охлаждении могут проводиться в диапазоне температур от около -50 до около 120ºС, от около -50 до около 100ºС, от около -20 до около 80ºС, от около 0 до около 80ºС, от около 10 до около 80ºС, от около 20 до около 80ºС, от около 20 до около 60ºС или от около 20 до около 50ºС.
Частицы кислоты формулы I в кристаллической форме II могут быть получены из раствора или густой суспензии кислоты формулы I в растворителе с использованием обычных методов, включая, но не ограничиваясь перечисленными, охлаждение, замораживание, выпаривание растворителя или добавление антирастворителя.
В одном варианте осуществления изобретения способ для получения частиц формы II включает стадии (а) получения раствора кислоты формулы I в растворителе при первой температуре и (b) получения частиц формы II при второй температуре. Для ускорения образования частиц формы II способ также может включать стадию посева путем затравливания раствора кристаллами формы II перед или во время стадии (b). Способ может дополнительно включать стадию выделения, как описано в настоящем описании.
Раствор может быть получен из любых форм кислоты формулы I, включая, но не ограничиваясь перечисленными, масла, полутвердые вещества, твердые вещества (такие как аморфная форма или форма I или II) или их смеси. Раствор по стадии (а) может быть получен как насыщенный или почти насыщенный раствор при первой температуре. Насыщенный или почти насыщенный раствор может быть получен путем растворения достаточного количества кислоты формулы I в растворителе при температуре, которая выше, чем первая температура, так что, когда раствору позволяют остыть до первой температуры, получают насыщенный или почти насыщенный раствор. Достаточное количество кислоты формулы I может быть оценено на основании растворимости частиц формы II в растворителе при первой температуре, которая может быть определена с использованием метода, известного специалисту в области техники.
В одном варианте осуществления изобретения частицы формы II образуются путем выпаривания растворителя из раствора при второй температуре. Выпаривание растворителя может быть облегчено применением к раствору нагревания и/или вакуума. В одном варианте осуществления изобретения растворителем является ДМФА, 1,4-диоксан, метанол, 2-метоксиэтанол, 1-бутанол, 1-пропанол, IPA, MEK, ТГФ или их смесь.
В другом варианте осуществления изобретения частицы формы II образуются путем охлаждения раствора до второй температуры.
В еще одном варианте осуществления изобретения частицы формы II образуются путем добавления антирастворителя к растворителю при второй температуре. В одном варианте осуществления изобретения растворителем является ТГФ, метоксиэтанол, ДМСО, ДМФА или их смесь и антирастворителем является гексан(ы), MTBE, толуол, вода или их смесь.
В еще одном варианте осуществления изобретения частицы формы II образуются путем добавления раствора к антирастворителю при второй температуре. В одном варианте осуществления изобретения растворителем является ТГФ, метоксиэтанол, ДМСО, ДМФА и их смеси и антирастворителем является гексан(ы), MTBE, толуол, вода и их смеси. В другом варианте осуществления изобретения парой растворитель/антирастворитель является ДМФА/MTBE.
В другом варианте осуществления изобретения способ для получения частиц формы II включает стадии (а) получения густой суспензии кислоты формулы I в растворителе при первой температуре и (b) создания твердых частиц формы II путем воздействия на суспензию второй температуры. Густая суспензия может быть получена из любых форм кислоты формулы I, включая, но не ограничиваясь перечисленными, масла, полутвердые вещества, твердые вещества (такие как аморфная форма, или форма I или II), или их смеси. Способ может дополнительно включать стадию посева и/или стадию выделения, как описано в настоящем описании.
Первая и вторая температуры и растворитель являются такими, как описано в настоящем описании. В одном варианте осуществления изобретения растворителем является ацетонитрил, хлороформ, дихлорметан, ДМФА, 1,4-диоксан, метанол, 2-метоксиэтанол, MIBK, толуол, гексан(ы), ацетон, 1-бутанол, MTBE, ДМСО, этанол, этилацетат, этилформиат, гептан, изобутилацетат, изопропилацетат, 1-пропанол, IPA, MEK, ТГФ, вода или их смесь.
Аморфные частицы кислоты формулы I могут быть получены из раствора или густой суспензии кислоты формулы I в растворителе с использованием обычных методов, включая, но не ограничиваясь перечисленными, охлаждение, замораживание, выпаривание растворителя или добавление антирастворителя.
В одном варианте осуществления изобретения способ для получения аморфных частицы кислоты формулы I включает стадии (а) получения раствора кислоты формулы I в растворителе при первой температуре и (b) создания аморфных частиц при второй температуре. Способ может также включать стадию выделения, как описано в настоящем описании.
Раствор может быть получен из любых форм кислоты формулы I, включая, но не ограничиваясь перечисленными, масла, полутвердые вещества, твердые вещества (такие как аморфная форма или форма I или II) или их смеси. Раствор по стадии (а) может быть получен в виде насыщенного или почти насыщенного раствора при первой температуре. Насыщенный или почти насыщенный раствор может быть получен путем растворения достаточного количества кислоты формулы I в растворителе при температуре, которая выше, чем первая температура, так что, когда раствору позволяют остыть до первой температуры, получают насыщенный или почти насыщенный раствор. Достаточное количество кислоты формулы I может быть оценено на основании растворимости аморфных частиц в растворителе при первой температуре, которая может быть определена с использованием метода, известного специалисту в области техники.
В одном варианте осуществления изобретения аморфные частицы образуются при выпаривании растворителя из раствора при второй температуре. Выпаривание растворителя может быть облегчено путем применения к раствору нагревания и/или вакуума. В одном варианте осуществления изобретения растворителем является этилформиат, изобутилацетат, MTBE или их смесь.
В другом варианте осуществления изобретения аморфные частицы образуются путем охлаждения раствора до второй температуры. В одном варианте осуществления изобретения растворителем является MEK.
В еще одном варианте осуществления изобретения аморфные частицы образуются путем добавления антирастворителя к раствору при второй температуре. В одном варианте осуществления изобретения растворителем является ТГФ, метоксиэтанол, ДМСО, ДМФА или их смесь и антирастворителем является гексан(ы), MTBE, толуол, вода или их смесь. В другом варианте осуществления изобретения парой растворитель/антирастворитель является ТГФ/гексан или ДМСО/вода.
В еще одном варианте осуществления изобретения аморфные частицы образуются путем добавления раствора к антирастворителю при второй температуре. В одном варианте осуществления изобретения растворителем является ТГФ, метоксиэтанол, ДМСО, ДМФА или их смесь и антирастворилем является гексан(ы), MTBE, толуол, вода или их смесь. В другом варианте осуществления изобретения парой растворитель/антирастворитель является ТГФ/гексан или ДМСО/вода.
В еще одном варианте осуществления изобретения способ для получения аморфных частиц кислоты формулы I включает стадии (а) получения густой суспензии кислоты формулы I в растворителе при первой температуре и (b) создания аморфных частиц посредством конверсии фаз при второй температуре. Густая суспензия может быть получена из любых форм кислоты формулы I, включая, но не ограничиваясь перечисленными, масла, полутвердые вещества, твердые вещества (такие как аморфная форма или форма I или II) или их смеси. Первая и вторая температуры и растворитель являются такими, как определено в настоящем описании. В одном варианте осуществления изобретения растворителем является хлороформ, гексан(ы), MTBE, этилформиат, гептан, IPA, вода или их смесь.
Другие способы получения частиц также могут применяться для получения частиц кислоты формулы I в аморфной форме или кристаллической форме I или II, включая распылительную сушку, вальцовую сушку, лиофилизацию и кристаллизацию из расплава.
Фармацевтические композиции
Также предоставлена фармацевтическая композиция, которая включает в качестве активного фармацевтического ингредиента частицы {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты в аморфной форме или кристаллической форме I или II или ее приемлемый гидрат или сольват в комбинации с одним или более фармацевтически приемлемыми носителями или вспомогательными веществами. Выбор вспомогательного вещества, в большей степени, зависит от факторов, таких как определенный путь введения, эффект вспомогательного вещества на растворимость и стабильность активного ингредиента и природа лекарственной формы.
Фармацевтические композиции, представленные в настоящем описании, могут быть обеспечены в лекарственных формах, содержащих разовую дозу, или лекарственных формах, содержащих несколько доз. Лекарственные формы, содержащие разовую дозу, как используется в настоящем описании, относятся к физически отдельным единицам, подходящим для введения пациентам людям и животным и упакованным отдельно, как известно в области техники. Каждая разовая доза содержит заранее определенное количество активного ингредиента(ов), достаточное для обеспечения желаемого терапевтического эффекта, в сочетании с требуемыми фармацевтическими носителями или вспомогательными веществами. Примеры лекарственных форм, содержащих разовые дозы, включают ампулы, шприцы и отдельно упакованные таблетки и капсулы. Лекарственные формы, содержащие разовую дозу, могут вводиться отдельно или вместе. Лекарственные формы, содержащие несколько доз, представляют собой множество одинаковых лекарственных форм, содержащих разовую дозу, упакованных в отдельный контейнер для ведения в отдельных лекарственных формах, содержащих разовую дозу. Примеры лекарственных форм, содержащих несколько доз, включают флаконы, бутыли таблеток или капсул или бутыли пинт или галлонов.
Частицы кислоты формулы I, представленные в настоящем описании, могут быть введены отдельно или в комбинации с одним или более соединениями, представленными в настоящем описании, одним или более другими активными ингредиентами. Фармацевтические композиции, представленные в настоящем описании, могут быть рецептированы в различных лекарственных формах для перорального, парентерального и местного введения. Фармацевтические композиции также могут быть рецептированы в виде лекарственной формы с модифицированным высвобождением, включая лекарственные формы с отложенным, длительным, пролонгированным, непрерывным, пульсовым, контролируемым, ускоренным и быстрым, нацеленным, программируемым высвобождением и лекарственных формах, удерживаемых в желудке. Такие лекарственные формы могут быть получены в соответствии с обычными методами и методиками, известными специалисту в области техники (см. Remington: The Science and Practice of Pharmacy, выше; Modified-Release Drug Deliver Technology, Rathbone et al., Eds., Drugs and the Pharmaceutical Science, Marcel Dekker, Inc.: New York, NY, 2002; Vol. 126).
Фармацевтические композиции, представленные в настоящем описании, могут вводиться один раз или несколько раз с интервалами времени. Понимают, что точная дозировка и продолжительность лечения могут варьироваться в зависимости от возраста, массы и состояния пациента, получающего лечения, и могут быть определены эмпирически с использованием известных протоколов исследования или путем экстраполяции исследований in vivo или in vitro или диагностических данных. Также понимают, что для любого определенного пациента специфические схемы введения должны с течением времени корригироваться в соответствии с нуждами индивида и профессиональным мнением лица, вводящего или наблюдающего за введением композиций.
А. Пероральное введение
Фармацевтические композиции, представленные в настоящем описании, могут быть представлены в твердых, полутвердых или жидких лекарственных формах для перорального введения. Как используется в настоящем описании, пероральное введение также включает буккальное, лингвальное и сублингвальное введение. Подходящие пероральные лекарственные формы включают, но не ограничиваются перечисленными, таблетки, капсулы, пилюли, лепешки, пастилки, фармацевтические пастилки, крахмальные капсулы, шарики, лечебную жевательную резинку, гранулы, нерасфасованный порошок, шипучие или нешипучие порошки или гранулы, растворы, эмульсии, суспензии, растворы, брикеты, спреи, эликсиры и сиропы. В добавление к активному ингредиенту(ам) фармацевтические композиции могут содержать один или более фармацевтически приемлемых носителей или вспомогательных веществ, включая, но не ограничиваясь перечисленными, вяжущие вещества, наполнители, разбавители, дезинтегрирующие вещества, увлажняющие вещества, смазывающие средства, глиданты, красители, ингибиторы миграции красителя, подсластители и ароматизаторы.
Вяжущие вещества или грануляторы придают таблетке сцепляемость для обеспечения того, чтобы таблетка оставалась интактной после прессования. Подходящие вяжущие вещества или грануляторы включают, но не ограничиваются перечисленными, крахмал, картофельный крахмал и пептизированный крахмал (например, STARCH 1500); желатин; сахара, такие как сахароза, глюкоза, декстроза, патока и лактоза; натуральные и синтетические камеди, такие как акация, альгиновая кислота, альгинаты, экстракт ирландского мха, панваровая камедь, гхатти-камедь, слизь пленки isabgol, карбоксиметилцеллюлоза, метилцеллюлоза, поливинилпирролидон (PVP), вигум, арабогалактан лиственницы, порошкообразный трагакант и гуаровая камедь; целлюлозы, такие как этилцеллюлоза, ацетат целлюлозы, карбоксиметилцеллюлоза кальция, карбоксиметилцеллюлоза натрия, метилцеллюлоза, гидроксиэтилцеллюлоза (HEC), гидроксипропилцеллюлоза (HPC), гидроксипропилметилцеллюлоза (HPMC); микрокристаллические целлюлозы, такие как AVICEL-PH-101, AVICEL-PH-103, AVICEL-RC-581, AVICEL-PH-105 (FMC Corp., Marcus Hook, PA); и их смеси. Подходящие наполнители включают, но не ограничиваются перечисленными, тальк, карбонат кальция, микрокристаллическую целлюлозу, порошкообразную целлюлозу, декстраны, каолин, маннит, кремниевую кислоту, сорбит, крахмал, пептизированный крахмал и их смеси. Вяжущее вещество или наполнитель могут присутствовать в фармацевтической композиции, представленной в настоящем описании, в количестве от около 50 до около 99% по массе.
Подходящие разбавители включают, но не ограничиваются перечисленными, фосфат дикальция, сульфат кальция, лактозу, сорбит, сахарозу, инозитол, целлюлозу, каолин, маннит, хлорид натрия, сухой крахмал и порошкообразный сахар. Определенные разбавители, такие как маннит, лактоза, сорбит, сахароза и инозитол, когда присутствуют в достаточном количестве, могут придавать свойства некоторым прессуемым таблеткам, которые способствуют разложению в полости рта при жевании. Такие прессованные таблетки могут использоваться как жевательные таблетки.
Подходящие дезинтегрирующие вещества включают, но не ограничиваются перечисленными, агар; бентонит; целлюлозы, такие как метилцеллюлоза и карбоксиметилцеллюлоза; древесные изделия; натуральную губку; катионообменные смолы; альгиновую кислоту; камеди, такие как гуаровая камедь и вигум HV; цитрусовый жом; сшитые целлюлозы, такие как кроскармеллоза; сшитые полимеры, такие как кросповидон; сшитые крахмалы; карбонат кальция; микрокристаллическую целлюлозу, такую как гликолят крахмала натрия; полакрилин калия; крахмалы, такие как кукурузный крахмал, картофельный крахмал, крахмал тапиоки и пептизированный крахмал; глины; альгины; и их смеси. Количество дезинтегрирующего вещества в фармацевтической композиции, представленной в настоящем описании, варьируется от типа композиции и легко очевидно обычному специалисту в области техники. Фармацевтические композиции, представленные в настоящем описании, могут содержать от около 0,5 до около 15% или от около 1 до около 5% по массе дезинтегрирующего вещества.
Подходящие смазывающие вещества включают, но не ограничиваются перечисленными, стеарат кальция; стеарат магния; минеральное масло; легкое минеральное масло; глицерин; сорбит; маннит; гликоли, такие как бегенат глицерина и полиэтиленгликоль (PEG); стеариновую кислоту; лаурилсульфат натрия; тальк; гидрогенизированные растительные масла, включая арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; стеарат цинка; этилолеат; этиллаурат; агар; крахмал; ликоподий; диоксид кремния или силикагели, такие как AEROSIL® 200 (W.R. Grace Co., Baltimor, MD) и CAB-O-SIL® (Cabot Co. Of Boston, MA); и их смеси. Фармацевтические композиции, представленные в настоящем описании, могут содержать от около 0,1 до около 5% по массе смазывающего вещества.
Подходящие глиданты включают коллоидный диоксид кремния, CAB-O-SIL® (Cabot Co. Of Boston, MA) и тальк без асбеста. Красители включают любые одобренные, сертифицированные, водорастворимые красители FD&C и водонерастворимые красители FD&C, суспендированные на гидрате алюминия и красящие лаки и их смеси. Красящий лак представляет собой комбинацию абсорбции водорастворимой краски на водном оксиде тяжелого металла, давая нерастворимую форму краски. Ароматизаторы включают естественные ароматизаторы, экстрагированные из растений, таких как фрукты, и синтетические смеси соединений, которые дают ощущение приятного вкуса, такие как мята перечная и метилсалицилат. Подсластители включают сахарозу, лактозу, маннит, сиропы, глицерин и искусственные подсластители, такие как сахарин и аспартам. Подходящие эмульгаторы включают желатин, акацию, трагакант, бентонит и поверхностно-активные вещества, такие как моноолеат полиоксиэтиленсорбита (TWEEN® 20), моноолеат 80 полиоксиэтиленсорбита (TWEEN®80) и олеат триэтаноламина. Суспендирующие и диспергирующие агенты включают карбоксиметилцеллюлозу натрия, пектин, трагакант, Вигум, акацию, карбоксиметилцеллюлозу натрия, гидроксипропилметилцеллюлозу и поливинилпирролидон. Консерванты включают глицерин, метил и пропилпарабен, бензойную кислоту, бензоат натрия и спирт. Увлажняющие вещества включают моностеарат пропиленгликоля, моноолеат сорбита, монолаурат диэтилгликоля и лауриловый эфир полиоксиэтилена. Растворители включают глицерин, сорбит, этиловый спирт и сироп. Примеры неводных жидкостей, используемых в эмульсиях, включают минеральное масло и хлопковое масло. Органические кислоты включают лимонную и виннокаменную кислоту. Источники диоксида углерода включают бикарбонат натрия и карбонат натрия.
Необходимо понимать, что множество носителей и вспомогательных веществ может обладать несколькими функциями, даже в одной и той же композиции.
Фармацевтические композиции, представленные в настоящем описании, могут быть представлены в виде прессованных таблеток, порошков таблеток, жевательных пастилок, быстро растворяющихся таблеток, многократно прессованных таблеток или таблеток, покрытых кишечно-растворимой оболочкой, таблеток, покрытых оболочкой из сахара или пленки. Таблетки, покрытые кишечно-растворимой оболочкой, представляют собой прессованные таблетки, покрытые оболочкой из веществ, которые устойчивы к действию желудочной кислоты, но растворяются или разлагаются в кишечнике, таким образом защищая активные ингредиенты от кислого окружения желудка. Кишечнорастворимые оболочки включают, но не ограничиваются перечисленными, жирные кислоты, жиры, фенилсалицилат, воски, шеллак, аммонированный шеллак и ацетат-фталат целлюлозы. Таблетки, покрытые оболочкой из сахара, представляют собой прессованные таблетки, окруженные сахарной оболочкой, которая может быть полезной в прикрытии неприемлемого вкуса или запаха и в защите таблеток от окисления. Таблетки, покрытые пленкой, представляют собой прессованные таблетки, которые покрыты тонким слоем или пленкой водорастворимого материала. Пленочные оболочки включают, но не ограничиваются перечисленными, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу натрия, полиэтиленгликоль 4000 и ацетатфталат целлюлозы. Пленочные оболочки дают такие же общие характеристики, как и сахарные оболочки. Многократно прессованные таблетки представляют собой прессованные таблетки, полученные с помощью более чем одного цикла прессования, включая слоистые таблетки и таблетки, покрытые оттисками или покрытые оболочкой сухим способом.
Лекарственные формы таблеток могут быть получены из активного ингредиента в порошкообразной, кристаллической или гранулярной формах, отдельно или в комбинации с одним или более носителями или вспомогательных веществ, описанных в настоящем описании, включая вяжущие вещества, дезинтегрирующие вещества, полимеры с контролируемым высвобождением, смазывающие вещества, разбавители и/или красители. Ароматизирующие и подслащающие вещества являются особенно применимыми в формировании жевательных таблеток и пастилок.
Фармацевтические композиции, представленные в настоящем описании, могут быть представлены в виде мягких или твердых капсул, которые могут быть сделаны из желатина, метилцеллюлозы, крахмала или альгината кальция. Твердая желатиновая капсула, также известная как сухонаполненная капсула (DFC), состоит из двух отделов, одного насаженного на другой, таким образом полностью покрывая активный ингредиент. Мягкая эластичная капсула (SEC) представляет собой мягкую, глобулярную скорлупу, такую как желатиновая капсула, которая пластифицирована добавлением глицерина, сорбита или подобного полиола. Мягкие желатиновые капсулы могут содержать консервант для предотвращения роста микроорганизмов. Подходящие консерванты являются такими, как описано в настоящем описании, включая метил- и пропилпарабены и сорбиновую кислоту. Жидкие, полутвердые и твердые лекарственные формы, обеспечиваемые в настоящем описании, могут быть инкапсулированы в капсулу. Подходящие жидкие и полутвердые лекарственные формы включают растворы и суспензии в пропиленкарбонате, растительных маслах или триглицеридах. Капсулы, содержащие такие растворы, могут быть получены как описано в патентах США №4328245, 4409239 и 4410545. Капсулы также могут быть покрыты оболочкой, как известно специалисту в области техники, с целью модификации или длительного растворения активного ингредиента.
Фармацевтические композиции, представленные в настоящем описании, могут быть обеспечены в жидкой и полутвердой лекарственных формах, включая эмульсии, растворы, суспензии, эликсиры и сиропы. Эмульсия представляет собой двухфазную систему, в которой одна жидкость диспергирована в форме мелких глобул на всем протяжении другой жидкости, которая может быть маслом-в-воде или водой-в-масле. Эмульсии могут включать фармацевтически приемлемые неводные жидкости или растворители, эмульгирующее средство и консервант. Суспензии могут включать фармацевтически приемлемое суспедирующее средство и консервант. Водно-спиртовые растворы могут включать фармацевтически приемлемые ацетали, такие как ди(низший алкил)ацеталь низшего алкилальдегида (термин «низший» обозначает алкил, имеющий от 1 до 6 атомов углерода), например, диэтилацеталь ацетальдегида; и смешиваемый с водой растворитель, имеющий одну или больше гидроксильных групп, такой как пропиленгликоль и этанол. Эликсиры являются прозрачными, сладкими и водноспиртовыми растворами. Сиропы представляют собой концентрированные водные растворы сахара, например, сахарозы, и также могут содержать консервант. Для жидкой лекарственной формы, например, раствор в полиэтиленгликоле может быть разведен достаточным количеством фармацевтически приемлемого жидкого носителя, например, воды в степени, удобной для введения.
Другие применимые жидкие и полутвердые лекарственные формы включают, но не ограничиваются перечисленными, таковые, содержащие активный ингредиент(ы) представленный в настоящем описании, и диалкилированный моно- или полиалкиленгликоль, включая 1,2-диметоксиметан, диглим, триглим, тетраглим, диметиловый эфир полиэтиленгликоля-350, диметиловый эфир полиэтиленгликоля-550, диметиловый эфир полиэтиленгликоля-750, где 350, 550 и 750 относятся к приблизительной средней молекулярной массе полиэтиленгликоля. Такие композиции могут дополнительно включать один или больше антиоксидантов, таких как бутилированный гидрокситолуол (ВНТ), бутилированный гидроксианизол (ВНА), пропилгаллат, витамин Е, гидрохинон, гидроксикумарины, этаноламин, лецитин, цефалин, аскорбиновая кислота, яблочная кислота, сорбит, фосфорная кислота, бисульфит, метабисульфит натрия, тиодипропионовая кислота и ее сложные эфиры и дитиокарбаматы.
Фармацевтические композиции, представленные в настоящем описании для перорального введения, могут также быть представлены в форме липосом, мицелл, микросфер или наносистем. Мицеллярные лекарственные формы могут быть получены, как описано в патенте США №6350458.
Фармацевтические композиции, представленные в настоящем описании, могут быть обеспечены в виде нешипучих или шипучих гранул и порошков для восстановления в жидкие лекарственные формы. Фармацевтически приемлемые носители и вспомогательные вещества, используемые в нешипучих гранулах или порошках, могут включать разбавители, подсластители и увлажняющие средства. Фармацевтически приемлемые носители и вспомогательные вещества, используемые в шипучих гранулах или порошках, могут включать органические кислоты и источник диоксида углерода.
Красители и ароматизаторы могут быть использованы во всех вышеуказанных лекарственных формах.
Фармацевтические композиции, представленные в настоящем описании, могут быть рецептированы в виде лекарственных форм немедленного или модифицированного высвобождения, включая формы отложенного, непрерывного, пульсового, контролируемого, целевого и программируемого высвобождения.
Фармацевтические композиции, представленные в настоящем описании, могут быть совместно рецептированы с другими активными ингредиентами, которые не влияют на желаемое терапевтическое действие, или с веществами, которые дополняют желаемое действие такими как антациды, ингибиторы протоновой помпы и антагонисты рецептора H2.
В. Парентеральное введение
Фармацевтические композиции, представленные в настоящем описании, могут вводиться парентерально инъекцией, инфузией или имплантацией, местным или системным введением. Парентеральное введение, как используется в настоящем описании, включает внутривенное, внутриартериальное, внутрибрюшинное, интратекальное, внутрижелудочковое, интрауретральное, интрастернальное, интракраниальное, внутримышечное, интрасиновиальное и подкожное введение.
Фармацевтические композиции, представленные в настоящем описании, могут быть рецептированы в любых лекарственных формах, которые подходят для парентерального введения, включая растворы, суспензии, эмульсии, мицеллы, липосомы, микросферы, наносистемы и твердые формы, подходящие для растворов или суспензий в жидкости перед инъекцией. Такие лекарственные формы могут быть получены в соответствии с обычными способами, известными специалисту в области техники фармацевтических наук (см. Remington: The Science and Practice of Pharmacy выше).
Фармацевтические композиции, предназначенные для парентерального введения, могут включать один или более фармацевтически приемлемых носителей и вспомогательных веществ, включая, но не ограничиваясь перечисленными, водные носители, носители, смешиваемые с водой, неводные носители, антимикробные средства или консерванты против роста микроорганизмов, стабилизаторы, усилители растворимости, изотонические средства, буферные средства, антиоксиданты, местные анестетики, суспендирующие и диспергирующие средства, увлажняющие или эмульгирующие средства, комплексообразующие средства, комплексообразующие или хелатирующие средства, криопротекторы, лиопротекторы, загустители, средства, регулирующие рН, и инертные газы.
Подходящие водные носители включают, но не ограничиваются перечисленными, воду, солевой раствор, физиологический раствор или фосфатный буферный раствор (PBS), инъекционный раствор хлорида натрия, инъекционный раствор Рингера, изотонический раствор декстрозы для инъекций, стерильную воду для инъекций, декстроза и лактатный раствор Рингера для инъекций. Неводные носители включают, но не ограничиваются перечисленными, нелетучие масла растительного происхождения, касторовое масло, кукурузное масло, хлопковое масло, оливковое масло, арахисовое масло, масло мяты перечной, саффлоровое масло, кунжутное масло, соевое масло, гидрогенизированные растительные масла, гидрогенизированное соевое масло и среднецепочечные триглицериды кокосового масла и масла пальмовых семян. Смешиваемые с водой носители включают, но не ограничиваются перечисленными, этанол, 1,3-бутандиол, жидкий полиэтиленгликоль (например, полиэтиленгликоль 300 и полиэтиленгликоль 400), пропиленгликоль, глицерин, N-метил-2-пирролидон, диметилацетамид и диметилсульфоксид.
Подходящие антимикробные средства или консерванты включают, но не ограничиваются перечисленными, фенолы, крезолы, ртутные препараты, бензиловый спирт, хлорбутанол, метил и пропил п-гидроксибензаты, тимеросал, хлорид бензалкония, хлорид бензетония, метил- и пропилпарабены и сорбиновую кислоту. Подходящие изотонические средства включают, но не ограничиваются перечисленными, хлорид натрия, глицерин и декстрозу. Подходящие буферные средства включают, но не ограничиваются перечисленными, фосфат и цитрат. Подходящие антиоксиданты представляют собой те, которые описаны в настоящем описании, включая бисульфит и метабисульфит натрия. Подходящие местные анестетики включают, но не ограничиваются перечисленными, гидрохлорид прокаина. Подходящие суспендирующие и диспергирующие средства представляют собой таковые, как описано в настоящем описании, включая карбоксиметилцеллюлозу натрия, гидроксипропилметилцеллюлозу и поливинилпирролидон. Подходящие эмульгирующие средства включают описанные в настоящем описании, включая монолаурат полиоксиэтиленсорбита, моноолеат полиоксиэтиленсорбита 80 и олеат триэтаноламина. Подходящие комплексообразующие или хелатирующие средства включают, но не ограничиваются перечисленными, ЭДТА. Подходящие средства, регулирующие рН, включают, но не ограничиваются перечисленными, гидроксид натрия, соляную кислоту, лимонную кислоту и молочную кислоту. Подходящие комплексообразующие средства включают, но не ограничиваются перечисленными, циклодекстрины, включая альфа-циклодекстрин, бета-циклодекстрин, гидроксипропил-бета-циклодекстрин, сульфобутиловый эфир-бета-циклодекстрин и сульфобутилэфир 7-бета-циклодекстрина (CAPTISOL®, CyDex, Lenexa, KS).
Фармацевтические композиции, представленные в настоящем описании, могут быть рецептированы для разового введения или введения нескольких доз. Лекарственные композиции, содержащие разовые дозы, упакованы в ампулы, флаконы или шприцы. Парентеральные композиции, содержащие несколько доз, должны содержать антимикробное средство в бактериостатических или фунгистатических концентрациях. Все парентеральные композиции должны быть стерильными, как известно и используется в области техники.
В одном варианте осуществления изобретения фармацевтические композиции представлены в виде готовых к применению стерильных растворов. В другом варианте осуществления изобретения фармацевтические композиции представлены в виде стерильных сухих растворимых продуктов, включая лиофилизированные порошки и гиподермальные таблетки, для восстановления носителем перед использованием. В еще одном варианте осуществления изобретения представлены фармацевтические композиции в виде стерильных суспензий, готовых к употреблению. В еще одном варианте осуществления изобретения фармацевтические композиции представлены в виде стерильных сухих нерастворимых продуктов для восстановления носителем перед применением. В еще одном варианте осуществления изобретения фармацевтические композиции представлены в виде готовых к использованию стерильных эмульсий.
Фармацевтические композиции, обеспечиваемые в настоящем описании, могут быть рецептированы в виде лекарственных форм немедленного или модифицированного высвобождения, включая формы отложенного, непрерывного, пульсового, контролируемого, целевого и программируемого высвобождения.
Фармацевтические композиции могут быть рецептированы в виде суспензии, твердого вещества, полутвердого вещества или тиксотропной жидкости для введения в виде имплантируемого депо. В одном варианте осуществления изобретения фармацевтическая композиция, обеспеченная в настоящем описании, диспергирована в твердой внутренней матрице, которая окружена наружной полимерной мембраной, которая является нерастворимой в жидкостях тела, но позволяет активному ингредиенту в фармацевтических композициях диффундировать через них.
Подходящие внутренние матрицы включают полиметилметакрилат, полибутилметакрилат, пластифицированный или непластифицированный поливинилхлорид, пластифицированный нейлон, пластифицированный полиэтилентерфталат, натуральный каучук, полиизопрен, полиизобутилен, полибутадиен, полиэтилен, сополимеры этилен-винилацетата, силиконовые каучуки, полидиметилсилоксаны, сополимеры карбоната кремния, гидрофильные полимеры, такие как гидрогели сложных эфиров акриловой и метакриловой кислоты, коллаген, сшитый поливиниловый спирт и сшитый частично гидролизованный поливинилацетат.
Подходящие наружные полимерные мембраны включают полиэтилен, полипропилен, сополимеры этилена/пропилена, сополимеры этилена/этилакрилата, сополимеры этилена/винилацетата, силиконовые каучуки, полидиметилсилоксаны, неопреновые каучуки, хлорированный полиэтилен, поливинилхлорид, сополимеры винилхлорида с винилацетатом, хлорид винилидена, этилен и пропилен, иономер терфталата полиэтилена, бутилкаучук, эпихлоргидриновые каучуки, сополимер этилена/винилового спирта, терполимер этилена/винилацетата/винилового спирта и сополимер этилена/винилоксиэтанола.
С. Местное введение
Фармацевтические композиции, представленные в настоящем описании, могут вводиться местно на кожу, отверстия или слизистые оболочки. Местное введение, как используется в настоящем описании, включает (интра)дермальное, конъюнктивальное, интракорнеальное, внутриглазное, глазное, ушное, чрескожное, назальное, вагинальное, уретральное, респираторное и ректальное введение.
Фармацевтические композиции, представленные в настоящем описании, могут быть рецептированы в любых лекарственных формах, которые подходят для местного введения для локального или системного эффекта, включая эмульсии, растворы, суспензии, кремы, гели, гидрогели, мази, присыпки, повязки, эликсиры, лосьоны, суспензии, настойки, пасты, пены, пленки, аэрозоли, орошения, спреи, суппозитории, бинты, кожные пластыри. Местные композиции фармацевтических композиций, представленных в настоящем описании, также могут включать липосомы, мицеллы, микросферы, наносистемы и их смеси.
Фармацевтически приемлемые носители и вспомогательные вещества, подходящие для применения в местных композициях, представленных в настоящем описании, включают, но не ограничиваются перечисленными, водные носители, смешиваемые с водой носители, неводные носители, антимикробные средства или консерванты против роста микроорганизмов, стабилизаторы, усилители растворимости, изотонические средства, буферные средства, антиоксиданты, местные анестетики, суспендирующие и диспергирующие средства, увлажняющие или эмульгирующие средства, комплексообразующие средства, комплексоны или хелатирующие средства, усилители пенетрации, криопротектанты, лиопротектанты, сгущающие средства и инертные газы.
Фармацевтические композиции также могут вводиться местно посредством электропорирования, ионофореза, фонофореза, сонофореза и микроигольчатых или безигольчатых инъекций, таких как POWDERJECTTM (Chiron Corp., Emeryville, CA) и BIOJECTTM (Bioject Medical Technologist Inc., Tualatin, OR).
Фармацевтические композиции, представленные в настоящем описании, могут быть представлены в форме мазей, кремов и гелей. Подходящие мазевые носители включают масляные или углеводородные основы, включая такие как жир, бензоинированный жир, оливковое масло, хлопковое масло и другие масла, белый вазелин; эмульгируемые или абсорбирующие основы, такие как гидрофильный вазелин, сульфат гидроксистеарина и безводный ланолин; основы, удаляемые водой, такие как гидрофильная мазь; водорастворимые мазевые основы, включая полиэтиленгликоли различной молекулярной массы; основы эмульсий или эмульсии вода-в-масле (W/O) или эмульсии масло-в-воде (O/W), включая цетиловый спирт, глицерилмоностеарат, ланолин и стеариновую кислоту (см. Remington: The Science and Practice of Pharmacy выше). Такие носители являются смягчающими веществами, но обычно требуют добавления антиоксидантов и консервантов.
Подходящие кремовые основы могут быть маслом-в-воде или водой-в-масле. Кремовые носители могут быть смываемыми водой и содержать масляную фазу, эмульгатор и водную фазу. Масляная фаза также называется «внутренней» фазой, которая обычно включает вазелин и жирный спирт, такой как цетиловый или стеариловый спирт. Водная фаза обычно, хотя не обязательно, превосходит масляную фазу в объеме и обычно содержит увлажнитель. Эмульгатор в композиции крема может быть неионным, анионным, катионным или амфотерным поверхностно-активным веществом.
Гели являются полутвердыми системами типа суспензии. Монофазные гели содержат органические макромолекулы, распределенные по существу гомогенно на всем протяжении жидкого носителя. Подходящие гелеобразующие средства включают сшитые полимеры акриловой кислоты, такие как карбомеры, карбоксиполиалкилены, Carbopol®; гидрофильные полимеры, такие как полиэтиленоксиды, сополимеры полиоксиэтилена-полиоксипропилена и поливиниловый спирт; полимеры целлюлозы, такие как гидроксипропилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилметилцеллюлоза, фталат гидроксипропилметилцеллюлозы и метилцеллюлоза; камеди, такие как трагакант и ксантановая камедь; альгинат натрия и желатин. С целью получения однородного геля могут быть добавлены диспергирующие средства, такие как спирт или глицерин, или гелеобразующие средства могут быть диспергированы растиранием, механическим смешиванием и/или перемешиванием.
Фармацевтические композиции, представленные в настоящем описании, могут вводиться ректально, уретрально, вагинально или перивагинально в формах суппозиториев, пессариев, бужей, компрессов или припарок, паст, порошков, повязок, кремов, пластырей, контрацептивов, мазей, растворов, эмульсий, суспензий, тампонов, гелей, пен, спреев или спринцеваний. Такие лекарственные формы могут быть получены с использованием обычных способов, как описано в Remington: The Science and Practice of Pharmacy выше.
Ректальные, уретральные и вагинальные суппозитории являются твердыми телами для вставления в отверстия тела, которые являются твердыми при обычной температуре, но тают или размягчаются при температуре тела с высвобождением активного ингредиента(ов) внутри отверстий. Фармацевтически приемлемые носители, используемые в ректальных и вагинальных суппозиториях, включают носители, такие как вещества, повышающие жесткость, которые дают температуру плавления около температуры тела, при рецептировании с фармацевтическими композициями, представленными в настоящем описании; и антиоксиданты, как описано в настоящем описании, включая бисульфит и метабисульфит натрия. Подходящие носители включают, но не ограничиваются перечисленными, масло какао (какао-масло), глицерин-желатин, карбовакс (полиоксиэтиленгликоль), спермацет, парафин, белый и желтый воск и соответствующие смеси моно-, ди- и триглицеридов жирных кислот, гидрогели, такие как поливиниловый спирт, гидроксиэтилметакрилат, полиакриловая кислота; желатин с глицерином. Могут быть использованы комбинации различных носителей. Ректальные и вагинальные суппозитории могут быть получены методом прессования или литья. Обычная масса ректального и вагинального суппозитория составляет от около 2 до 3 г.
Фармацевтические композиции, представленные в настоящем описании, могут вводиться офтальмологически в формах растворов, суспензий, мазей, эмульсий, гелеобразующих растворов, порошков для растворов, гелей, глазных вставок и имплантатов.
Фармацевтические композиции, представленные в настоящем описании, могут вводиться интраназально или путем ингаляции в респираторный тракт. Фармацевтические композиции могут быть представлены в форме аэрозоля или раствора для введения с использованием контейнера под давлением, насоса, спрея, пульверизатора, такого как пульверизатор с использованием электрогидродинамики для получения сверхмелкого распыления, или небулайзера, отдельно или в комбинации с подходящим пропеллентом, таким как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан. Фармацевтические композиции могут также быть представлены в виде сухого порошка для вдыхания, отдельно или в комбинации с инертным носителем, таким как лактоза или фосфолипиды; и назальных капель. Для интраназального применения порошок может включать биоадгезивное средство, включая хитозан или циклодекстрин.
Растворы или суспензии для использования в контейнере под давлением, насосе, спрее, пульверизаторе или небулайзере могут быть рецептированы и содержать этанол, водный этанол или подходящий альтернативный агент для диспергирования, растворения или продления высвобождения активного ингредиента, представленного в настоящем описании, пропеллента в виде растворителя; и/или поверхностно-активного вещества, такого как триолеат сорбита, олеиновая кислота или олигомолочная кислота.
Фармацевтические композиции, представленные в настоящем описании, могут быть микронизированы до размера, подходящего для доставки путем ингаляции, например, 50 микрометров или меньше или 10 микрометров или меньше. Частицы таких размеров могут быть получены с использованием измельчающего метода, известного специалисту в области техники, такого как измельчение спиральной струей, измельчение в мельнице с псевдоожиженным слоем, обработка суперкритической жидкостью до получения наночастиц, гомогенизация при высоком давлении или распылительная сушка.
Капсулы, блистеры и картриджи для использования в ингаляторе или инсуффляторе могут быть рецептированы как содержащие порошковую смесь фармацевтических композиций, представленных в настоящем описании; подходящую порошковую основу, такую как лактоза или крахмал; и модификатор характеристик, такой как l-лейцин, маннит или стеарат магния. Лактоза может быть безводной или в форме моногидрата. Другие подходящие вспомогательные вещества включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу. Фармацевтические композиции, представленные в настоящем описании для ингаляционного/интраназального введения могут дополнительно включать подходящий ароматизатор, такой как ментол и левоментол, или подсластители, такие как сахарин или сахарин натрия.
Фармацевтическая композиция, представленная в настоящем описании для местного введения, может быть рецептирована для немедленного высвобождения или модифицированного высвобождения, включая отложенное, непрерывное, пульсовое, контролируемое, целевое и программируемое высвобождение.
D. Модифицированное высвобождение
Фармацевтические композиции, представленные в настоящем описании, могут быть рецептированы в виде лекарственных форм модифицированного высвобождения. Как используется в настоящем описании, термин «модифицированное высвобождение» относится к лекарственной форме, в которой скорость или место высвобождения активного ингредиента(ов) отличаются от таковых лекарственной формы немедленного высвобождения при введении таким же путем. Лекарственные формы модифицированного высвобождения включают лекарственные формы отложенного, длительного, пролонгированного, непрерывного, ударного или пульсового, контролируемого, ускоренного и быстрого, нацеленного, программируемого высвобождения и лекарственные формы, удерживаемые в желудке. Фармацевтические композиции в лекарственных формах модифицированного высвобождения могут быть получены с использованием множества устройств и методов модифицированного высвобождения, известных специалисту в области техники, включая, но не ограничиваясь перечисленными, устройства с контролируемым высвобождением на основе матрицы, устройства с осмотическим контролируемым высвобождением, устройства с контролируемым высвобождением из множества частиц, ионообменные смолы, кишечные оболочки, многослойные оболочки, микросферы, липосомы и их комбинации. Скорость высвобождения активного ингредиента(ов) также может быть модифицирована, варьируя размеры частиц и полиморфизм активного ингредиента(ов).
Примеры модифицированного высвобождения включают, но не ограничиваются перечисленными, описанные в патентах США № 3845770, 3916899, 3536809, 3598123, 4008719, 5674533, 5059595, 5591767, 5120548, 5073543, 5639476, 5354556, 5639480, 5733566, 5739108, 5891474, 5922356, 5972891, 5980945, 5993855, 6045830, 6087324, 6113943, 6197350, 6248363, 6264970, 6267981, 6376461, 6419961, 6589548, 6613358 и 6699500.
1. Устройства контролируемого высвобождения на основе матрицы
Фармацевтические композиции, представленные в настоявшем описании, в лекарственной форме модифицированного высвобождения могут быть получены с использованием устройства с контролируемым высвобождением на основе матрицы, известного специалисту в области техники (см. Takada et al. In “Encyclopedia of Controlled Drug Delivery”, Vol. 2, Mathiowitz ed., Wiley, 1999).
В одном варианте осуществления изобретения фармацевтические композиции, представленные в настоящем описании, в лекарственной форме модифицированного высвобождения рецептируют с использованием устройства разрушаемой матрицы, которая представляет собой полимеры, набухающие в воде, разлагаемые или растворимые полимеры, включая синтетические полимеры и естественные полимеры и производные, такие как полисахариды и белки.
Материалы, применимые в получении разлагаемой матрицы, включают, но не ограничиваются перечисленными, хитин, хитозан, декстран и поллулан; агаровую камедь, гуммиарабик, камедь карайя, камедь плодоворожкового дерева, трагакант, каррагенаны, гхатти-камедь, гуаровую камедь, ксантановую камедь и склероглюкан; крахмалы, такие как декстрин и мальтодекстрин; гидрофильные коллоиды, такие как пектин; фосфатиды, такие как лецитин; альгинаты; альгинат пропиленгликоля; желатин; коллаген; и целлюлозы, как этилцеллюлоза (ЕС), метилэтилцеллюлоза (МЕС), карбоксиметилцеллюлоза (СМС), СМЕС, гидроксиэтилцеллюлоза (НЕС), гидроксипропилцеллюлоза (НРС), ацетат целлюлозы (СА), пропионат целлюлозы (СР), бутират целлюлозы (СВ), бутират ацетата целлюлозы (САВ), САР, САТ, гидроксипропилметилцеллюлоза (НРМС), НРМСР, HPMCAS, тримеллитат ацетата гидроксипропилметилцеллюлозы (НРМСАТ) и этилгидроксиэтилцеллюлоза (ЕНЕС); поливинилпирролидон; поливиниловый спирт; поливинилацетат; сложные эфиры глицерина и жирных кислот; полиакриламид; полиакриловая кислота; сополимеры этакриловой кислоты или метакриловой кислоты (EURAGIT®, Rohm America, Inc., Piscataway, NJ); поли(2-гидроксиэтилметакрилат); полилактиды; сополимеры L-глютамовой кислоты и этил L-глютамата; разлагаемые сополимеры молочной кислоты-гликолевой кислоты; поли-D-(-)-3- гидроксимасляная кислота; и другие производные акриловой кислоты, такие как гомополимеры и сополимеры бутилметакрилата, метилметакрилат, этилметакрилат, этилакрилат, (2-диметиламиноэтил)метакрилат и хлорид (триметиламиноэтил)метакрилата.
В другом варианте осуществления изобретения фармацевтические композиции рецептируют с неразлагаемой матрицей. Активный ингредиент(ы) растворяется или диспергируется в инертной матрице и высвобождается при введении преимущественно посредством диффузии из инертной матрицы. Материалы, подходящие для использования в виде неразлагаемой матрицы, включают, но не ограничиваются перечисленными, нерастворимые пластики, такие как полиэтилен, полипропилен, полиизопрен, полиизобутилен, полибутадиен, полиметилметакрилат, полибутилметакрилат, хлорированный полиэтилен, поливинилхлорид, сополимеры метилакрилата-метилметакрилата, сополимеры этилена-винилацетата, сополимеры этилена/пропилена, сополимеры этилена/этилакрилата, сополимеры винилхлорида с винилацетатом, хлорид винилидена, этилен и пропилен, иономер терфталата полиэтилена, бутиловый каучук, эпихлоргидриновый каучук, сополимер этилена/винилового спирта, терполимер этилена/винилацетата/винилового спирта и сополимер этилена/винилоксиэтанола, поливинилхлорид, пластифицированный нейлон, пластифицированный полиэтилентерфталат, естественный каучук, силиконовые каучуки, полидиметилсилоксаны, сополимеры карбоната кремния и; гидрофильные полимеры, такие как этилцеллюлоза, ацетат целлюлозы, кросповидон и сшитый частично гидролизованный поливинилацетат; и жирные соединения, такие как карнаубский воск, микрокристаллический воск и триглицериды.
В системе матрицы с контролируемым высвобождением желаемая кинетика высвобождения может быть контролируемой, например, посредством типа используемого полимера, вязкости полимера, размера частиц полимера и/или активного ингредиента(ов), соотношения активного ингредиента(ов) и полимера и других вспомогательных веществ в композиции.
Фармацевтические композиции, представленные в настоящем описании, в лекарственной форме модифицированного высвобождения могут быть получены методами, известными специалисту в области техники, включая непосредственное прессование, сухое или влажное гранулирование с последующим прессованием, гранулирование из расплава с последующим прессованием.
2. Осмотические устройства с контролируемым высвобождением
Фармацевтические композиции, представленные в настоящем описании, в лекарственной форме с модифицированным высвобождением могут быть получены с использованием осмотического устройства с контролируемым высвобождением, включая однокамерную систему, двухкамерную систему, асимметричную мембранную методику (АМТ) и экструдирующую базовую систему (ECS). В общем, такие устройства имеют по меньшей мере два компонента: (а) ядро, которое содержит активный ингредиент(ы), и (b) полупроницаемую мембрану с, по меньшей мере, одним отверстием для доставки, в которой инкапсулировано ядро. Полупроницаемая мембрана контролирует приток воды к ядру из водного окружения использования так, чтобы вызвать высвобождение лекарственного средства выдавливанием через отверстие(я) для доставки.
В добавление к активному ингредиенту(ам) ядро осмотического устройства необязательно включает осмотическое средство, которое создает движущую силу для переноса воды из окружающей среды в ядро устройства. Одним классом осмотических средств являются набухающие в воде гидрофильные полимеры, которые также называются «осмополимеры» и «гидрогели», включая, но не ограничиваясь перечисленными, гидрофильные полимеры винила и акрила, полисахариды, такие как альгинат кальция, полиэтиленоксид (РЕО), полиэтиленгликоль (PEG), полипропиленгликоль (PPG), поли(2-гидроксиэтилметакрилат), поли(акриловую) кислоту, поли(метакриловую)кислоту, поливинилпирролидон (PVP), сшитый PVP, поливиниловый спирт (PVA), сополимеры PVA/PVP, сополимеры PVA/PVP с гидрофобными мономерами, такими как метилметакрилат и винилацетат, гидрофильные полиуретаны, содержащие крупные блоки РЕО, кроскармеллозу натрия, каррагенан, гидроксиэтилцеллюлозу (НЕС), гидроксипропилцеллюлозу (НРС), гидроксипропилметилцеллюлозу (НРМС), карбоксиметилцеллюлозу (СМС) и карбоксиэтилцеллюлозу (СЕС), альгинат натрия, поликарбофил, желатин, ксантановую камедь и гликолят крахмала натрия.
Другим классом осмотических средств являются осмогены, которые способны впитывать воду для воздействия на градиент осмотического давления через барьер окружающих оболочек. Подходящие осмогены включают, но не ограничиваются перечисленными, неорганические соли, такие как сульфат магния, хлорид магния, хлорид кальция, хлорид натрия, хлорид лития, сульфат калия, фосфаты калия, карбонат натри, сульфит натрия, сульфат натрия, хлорид калия и сульфат натрия; сахара, такие как декстроза, фруктоза, глюкоза, инозитол, лактоза, мальтоза, манит, раффиноза, сорбит, сахароза, трегалоза и ксилит; органические кислоты, такие как аскорбиновая кислота, бензойная кислота, фумаровая кислота, лимонная кислота, малеиновая кислота, себациновая кислота, сорбиновая кислота, адипиновая кислота, эдетовая кислота, глютамовая кислота, п-толуолсульфоновая кислота, янтарная кислота и виннокаменная кислота; мочевина; и их смеси.
Осмотические средства с различными скоростями растворения могут использоваться для воздействия на то, как быстро активный ингредиент(ы) исходно выделяется из лекарственной формы. Например, аморфные сахара, такие как Mannogeme EZ (SPI Pharma, Lewes, DE), могут использоваться для обеспечения более быстрой доставки в течение первых нескольких часов для соответствующего получения желаемого терапевтического эффекта и постепенно и непрерывно высвобождать остальное количество для поддержания желаемого уровня терапевтического или профилактического эффекта в течение длительного периода времени. В таком случае активный ингредиент(ы) высвобождается с такой скоростью, чтобы замещать метаболизируемое и экскретируемое количество активного ингредиента.
Ядро также может включать широкое множество других вспомогательных веществ и носителей, как описано в настоящем описании для усиления введения лекарственной формы или для обеспечения стабильности или обработки.
Материалы, применимые в получении полупроницаемой мембраны, включают различные степени производных акрила, винила, эфиров, полиамидов, полиэфиров и целлюлозы, которые являются проницаемыми для воды и нерастворимыми в воде при физиологически важных рН или способные становиться нерастворимыми в воде при химических изменениях, таких как сшивки. Примеры подходящих полимеров, применяемых в получении оболочки, включат пластифицированные, непластифицированные и усиленный ацетат целлюлозы (СА), диацетат целлюлозы, триацетат целлюлозы, пропионат СА, нитрат целлюлозы, бутират ацетата целлюлозы (САВ), этилкарбамат СА, САР, метилкарбамат СА, сукцинат СА, триметиллат ацетата целлюлозы (САТ), диметиламиноацетат СА, этилкарбонат СА, хлорацетат СА, этилоксалат СА, метилсульфонат СА, бутилсульфонат СА, п-толуолсульфонат СА, ацетат агара, триацетат амилозы, ацетат бета-глюкана, триацетат бета-глюкана, диметилацетат ацетальдегида, триацетат смолы плодоворожкового дерева, гидроксилированный этиленвинилацетат, ЕС, PEG, PPG, сополимеры PEG/PPG, PVP, HEC, HPC, CMC, CMEC, HPMC, HPMCP, HPMCAS, HPMCAT, поли(акриловые)кислоты и сложные эфиры и поли(метакриловые кислоты и сложные эфиры и их сополимеры, крахмал, декстран, декстрин, хитозан, коллаген, желатин, полиалкены, полиэфиры, полисульфоны, полиэфирсульфоны, полистиролы, поливинилгалоиды, поливиниловые сложные и простые эфиры, натуральные воски и синтетические воски.
Полупроницаемыми мембранами также могут быть гидрофобные микропористые мембраны, где поры являются по существу наполненными газом и не увлажнены водной средой, но проницаемы для паров воды, как описано в патенте США №5798119. Такая гидрофобная, но проницаемая для водных паров мембрана обычно состоит из гидрофобных полимеров, таких как полиалкены, полиэтилен, полипропилен, политетрафторэтилен, производные полиакриловой кислоты, полиэфиры, полисульфоны, полиэфирсульфоны, полистеролы, поливинилгалоиды, фторид поливинилидена, поливиниловые сложные и простые эфиры, натуральные воски и синтетические воски.
Впускное отверстие(я) на полупроницаемой мембране может быть образовано после покрытия оболочкой путем механического или лазерного сверления. Впускное отверстие(я) также может быть образовано на месте путем разрушения пробки из водорастворимого материала или путем разрыва тонкой части мембраны над впадинами в ядре. Кроме того, впускные отверстия могут быть образованы во время процесса покрытия оболочкой, как в случае асимметричных мембранных оболочек типа, описанного в патентах США №5612059 и 5698220.
Общее количество высвобождаемого активного ингредиента(ов) и скорость высвобождения могут по существу модулироваться с помощью толщины и пористости полупроницаемой мембраны, состава ядра и количества, размера и расположения впускных отверстий.
Фармацевтические композиции в осмотических лекарственных формах с контролируемым высвобождением могут также включать дополнительные обычные вспомогательные вещества, как описано в настоящем описании, для обеспечения показателей или обработки композиции.
Осмотические лекарственные формы с контролируемым высвобождением могут быть получены в соответствии с обычными методами и методиками, известными специалисту в области техники (см. Remington: The Science and Practice of Pharmacy, выше; Santus и Baker, J. Controlled Release 1995, 35, 1-21; Verma et al., Drug Development and Industrial Pharmacy 2000, 26, 695-708; Verma et al., J. Controlled Release 2002, 79, 7-27).
В определенных вариантах осуществления изобретения фармацевтические композиции, представленные в настоящем описании, рецептированы в виде АМТ лекарственных форм с контролируемым высвобождением, которые включают асимметричную осмотическую мембрану, которая покрывает ядро, содержащее активный ингредиент(ы) и другие фармацевтически приемлемые вспомогательные вещества. См. патент США №5612059 и WO 2002/17918. АМТ лекарственные формы с контролируемым высвобождением могут быть получены в соответствии с обычными методами и методиками, известными специалисту в области техники, включая прямое прессование, сухое гранулирование, влажное гранулирование и метод нанесения покрытия окунанием.
В определенном варианте осуществления изобретения фармацевтические композиции, представленные в настоящем описании, рецептированы в виде ESC лекарственных форм с контролируемым высвобождением, которые включают осмотическую мембрану, которая покрывает ядро, содержащее активный ингредиент(ы), гидроксилэтилцеллюлозу и другие фармацевтически приемлемые вспомогательные вещества.
3. Устройства с контролируемым высвобождением множества частиц
Фармацевтические композиции, представленные в настоящем описании, в лекарственной форме с модифицированным высвобождением могут быть представлены в устройствах по контролируемому высвобождению множества частиц, которые включают множество частиц, гранул или шариков, варьирующиеся от около 10 мкм до около 3 мм, от около 50 мкм до около 2,5 мм или от около 100 мкм до 1 мм в диаметре. Такое множество частиц может быть получено способами, известными специалисту в области техники, включая влажное и сухое гранулирование, экструзию/сферонизацию, роллерное уплотнение, замораживание расплава и покрытие оболочкой посеянных ядер путем распыления. См., например, Multiparticulate Oral Drug Delivery; Marcel Dekker: 1994; и Pharmaceutical Pelletization Technology; Marcel Dekker: 1989.
Другие вспомогательные вещества, как описано в настоящем описании, могут быть смешаны с фармацевтическими композициями для улучшения обработки и образования множества частиц. Полученные частицы могут сами по себе составлять устройство с множеством частиц или могут быть покрыты оболочкой из различных пленкообразующих материалов, таких как кишечно-растворимые полимеры, полимеры, набухающие в воде и растворимые в воде. Множества частиц могут быть дополнительно представлены в виде капсулы или таблетки.
4. Направленное введение
Фармацевтические композиции, представленные в настоящем описании, также могут быть рецептированы для нацеливания на определенные ткани, рецепторы или другие области тела пациента, получающего лечение, включая системы введения, основанные на липосомах, высвобожденных эритроцитах и антителах. Примеры включают, но не ограничиваются перечисленными, патенты США №6316652, 6274552, 6271359, 6253872, 6139865, 6131570, 6120751, 6071495, 6060082, 6048736, 6039975, 6004534, 5985307, 5972366, 5900252, 5840674, 5759542 и 5709874.
Способы применения
В одном варианте осуществления изобретения представлен способ лечения, профилактики или облегчения одного или более симптомов расстройства или заболевания, ассоциированного с CRTH2 и/или одним или более другими рецепторами PGD2, путем введения пациенту, имеющему или предположительно имеющему такое состояние или заболевание, терапевтически эффективного количества частиц {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты в аморфной форме или кристаллической форме I или II.
В других вариантах осуществления изобретения представлен способ лечения, профилактики или облегчения одного или более симптомов заболевания или расстройства, отвечающего за модуляцию CRTH2 и/или одного или более других рецепторов PGD2, включающий введение пациенту, имеющему или предположительно имеющему такое состояние или заболевание, терапевтически эффективного количества частиц {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты в аморфной форме или кристаллической форме I или II.
В еще одном варианте осуществления изобретения представлен способ лечения, профилактики или облегчения одного или больше симптомов заболевания или расстройства, опосредованного CRTH2 и/или одним или более другими рецепторами PGD2, включающий введение пациенту, имеющему или предположительно имеющему такое состояние или заболевание терапевтически эффективного количества частиц {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты в аморфной форме или кристаллической форме I или II.
В еще одном варианте осуществления изобретения представлен способ для лечения, профилактики или облегчения одного или более симптомов заболевания, связанного с эозинофилами, включающий введение пациенту, имеющему или предположительно имеющему такое состояние или заболевание, терапевтически эффективного количества частиц {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты в аморфной форме или кристаллической форме I или II.
В еще одном варианте осуществления изобретения представлен способ для лечения, профилактики или облегчения одного или более симптомов заболевания, связанного с базофилами, включающий введение пациенту, имеющему или предположительно имеющему такое состояние или заболевание, терапевтически эффективного количества частиц {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты в аморфной форме или кристаллической форме I или II.
В еще одном варианте осуществления изобретения представлен способ для лечения, профилактики или облегчения одного или более симптомов воспалительного заболевания, включающий введение пациенту, имеющему или предположительно имеющему такое состояние или заболевание, терапевтически эффективного количества частиц {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты в аморфной форме или кристаллической форме I или II.
Расстройства и заболевания, излечимые частицами, представленными в настоящем описании, включают, но не ограничиваются, (1) воспалительные или аллергические заболевания, включая системную анафилаксию и расстройства гиперчувствительности, атопический дерматит, крапивницу, лекарственные аллергии, аллергии на укусы насекомых, пищевую аллергию (включая глютеновую болезнь и подобные) и мастоцитоз; (2) воспалительные заболевания кишечника, включая болезнь Крона, язвенный колит, илеит и энтерит; (3) васкулиты и синдром Бехчета; (4) псориаз и воспалительные дерматозы, включая дерматит, экзему, атопический дерматит, аллергический контактный дерматит, крапивницу, вирусные кожные патологии, включая возникающие в результате папилломавируса человека, ВИЧ или RLV инфекцию, бактериальные, грибные и другие паразитарные кожные патологии и кожную красную волчанку; (5) астму и респираторные аллергические заболевания, включая аллергическую астму, астму, вызванную физическими нагрузками, аллергический ринит, средний отит, аллергический конъюнктивит, гиперчувствительные заболевания легких и хронические обструктивные болезни легких; (6) аутоиммунные заболевания, включая артрит (включая ревматоидный и псориатический), системную красную волчанку, диабет I типа, миастению гравис, рассеянный склероз, болезнь Грейвса и гломерулонефрит; (7) отторжение трансплантата (включая отторжение аллотрансплантата и болезнь «трансплантат-против-хозяина»), например, отторжение кожного трансплантата, отторжение трансплантата солидных органов, отторжение трансплантата костного мозга; (8) лихорадку; (9) сердечно-сосудистые заболевания, включая острую сердечную недостаточность, гипотензию, гипертензию, стенокардию, инфаркт миокарда, кардиомиопатию, застойную сердечную недостаточность, атеросклероз, ишемическую болезнь сердца, рестеноз и сосудистый стеноз; (10) заболевания сосудов головного мозга, включая травматическое повреждение головного мозга, инсульт, ишемически-реперффузионное повреждение и аневризму; (11) рак молочной железы, кожи, предстательной железы, шейки матки, матки, яичников, яичек, мочевого пузыря, легких, печени, гортани, полости рта, толстой кишки и желудочно-кишечного тракта (например, пищевода, желудка, поджелудочной железы), головного мозга, щитовидной железы, крови и лимфатической системы; (12) фиброз, заболевания соединительной ткани и саркоидоз, (13) половые и репродуктивные состояния, включая эректильную дисфункцию; (14) заболевания желудочно-кишечного тракта, включая гастрит, язвы, тошноту, панкреатит и рвоту; (15) неврологические расстройства, включая болезнь Альцгеймера; (16) расстройства сна, включая бессонницу, сонливость, синдром апноэ во сне и синдром Пиквика; (17) боль; (18) заболевания почек; (19) заболевания глаз, включая глаукому; и (20) инфекционные заболевания, включая ВИЧ.
В определенных вариантах осуществления изобретения заболевание выбирают из группы, состоящей из астмы, аллергической астмы, астмы, индуцированной физической нагрузкой, аллергического ринита, круглогодичного аллергического ринита, сезонного аллергического ринита, атопического дерматита, контактной гиперчувствительности, контактного дерматита, конъюнктивита, аллергического конъюнктивита, эозинофильного бронхита, пищевой аллергии, эозинофильного гастроэнтерита, воспалительного заболевания кишечника, язвенного колита, болезни Крона, мастоцитоза, гипер IgE синдрома, системной красной волчанки, псориаза, акне, рассеянного склероза, отторжения трансплантата, реперфузионного повреждения, хронического обструктивного заболевания легких, синдрома Чарга-Стросса, синусита, базофильного лейкоза, хронической крапивницы, базофильного лейкоцитоза, псориаза, экземы, ХОБЛ (хронической обструктивной болезни легких), артрита, ревматоидного артрита, псориатического артрита и остеоартрита.
В определенных вариантах осуществления изобретения заболеванием является астма, астма, индуцированная физической нагрузкой, аллергический ринит, атопический дерматит, хронические обструктивные болезни легких или аллергический конъюнктивит.
В определенных вариантах осуществления изобретения заболеванием является синдром Чарга-Стросса или синусит.
В зависимости от заболевания, подвергаемого лечению, и состояния пациента твердые частицы или композиции, представленные в настоящем описании, могут вводиться пероральным, парентеральным (например, внутримышечным, интраперитонеальным, внутривенным путем, ICV, инъекцией или инфузией в цистерну, подкожной инъекцией или имплантатом), ингаляционным, назальным, вагинальным, ректальным, сублингвальным или местным (например, трансдермальным или местным) путями введения и могут быть рецептированы отдельно или вместе в подходящих лекарственных формах с фармацевтически приемлемыми носителями, добавками и носителями, подходящими для каждого пути введения. Также представлено введение твердых частиц, представленных в настоящем описании, в композициях депо, в которых активный ингредиент высвобождается в течение заранее определенного периода времени.
В лечении, профилактике или облегчении одного или более симптомов астмы, аллергического ринита, экземы, псориаза, атопического дерматита, лихорадки, сепсиса, системной красной волчанки, диабета, ревматоидного артрита, рассеянного склероза, атеросклероза, отторжения трансплантата, воспалительных заболеваний кишечника, рака или других состояний, заболеваний или расстройств, ассоциированных с CRTH2 и/или одним или более рецепторами PGD2, соответствующий уровень дозировки обычно составляет от около 0,001 до 100 мг на кг массы тела пациента в сутки (мг/кг в сутки), от около 0,01 до около 75 мг/кг в сутки, от около 0,1 до около 50 мг/кг в сутки, от около 0,5 до около 25 мг/кг в сутки или от около 1 до около 20 мг/кг в сутки, которые можно вводить в разовой или нескольких дозах. В этом диапазоне дозировка может составлять от 0,005 до 0,05, от 0,05 до 0,5 или от 0,5 до 5,0, от 1 до 15, от 1 до 20 или от 1 до 50 мг/кг в сутки. В определенных вариантах осуществления изобретения уровень дозировки составляет от около 0,001 до 100 мг/кг в сутки. В определенных вариантах осуществления изобретения уровень дозировки составляет от около 0,01 до около 75 мг/кг в сутки. В определенных вариантах осуществления изобретения уровень дозировки составляет от около 0,1 до около 50 мг/кг в сутки. В определенных вариантах осуществления изобретения уровень дозировки составляет от около 0,5 до около 25 мг/кг в сутки. В определенных вариантах осуществления изобретения уровень дозировки составляет от около 1 до около 20 мг/кг в сутки.
Для перорального введения фармацевтическая композиция может быть представлена в форме таблеток, содержащих от 1,0 до 1000 мг активного ингредиента, особенно около 1, около 5, около 10, около 15, около 20, около 25, около 50, около 75, около 100, около 150, около 200, около 250, около 300, около 400, около 500, около 600, около 750, около 800, около 900 и около 1000 мг активного ингредиента для симптоматической коррекции дозы для пациента, получающего лечение. Композиции можно вводить по схеме от 1 до 4 раз в сутки, включая один, два, три раза или четыре раза в сутки.
Однако понятно, что специфический уровень дозировки и частота введения для любого определенного пациента могут варьироваться и будут зависеть от множества факторов, включая активность специфических используемых соединений, метаболическую стабильность и продолжительность действия такого соединения, возраст, массу тела, общее состояние здоровья, пол, питание, тип и время введения, скорость экскреции, комбинации лекарственных средств, тяжесть определенного состояния и организм, подвергаемый лечению.
Также в настоящем описании представлены способы модуляции CRTH2 и/или одного или более других рецепторов PGD2, включающие контакт рецептора(ов) с частицами в одной или больше твердых форм, как представлено в настоящем описании. В одном варианте осуществления изобретения рецептор(ы) экспрессируются клеткой.
Частицы, представленные в настоящем описании, также могут быть скомбинированы или использованы в комбинации с другими средствами, применимыми в лечении, профилактике или облегчении одного или более симптомов заболевания или состояния, для которых частицы, представленные в настоящем описании, являются применимыми, включая астму, аллергический ринит, экзему, псориаз, атопический дерматит, лихорадку, сепсис, системную красную волчанку, диабет, ревматоидный артрит, рассеянный склероз, атеросклероз, отторжение трансплантата, воспалительные заболевания кишечника, рак и патологические состояния, отмеченные выше.
Такие другие средства, или лекарственные средства, могут вводиться путем и в количестве, обычно используемых для них, одновременно или последовательно с частицами, представленными в настоящем описании. Когда частицы, представленные в настоящем описании, используются одновременно с одним или более лекарственными средствами, может использоваться фармацевтическая композиция, содержащая такие другие лекарственные средства в добавление к частицам, представленным в настоящем описании, но не обязательно. Соответственно, фармацевтические композиции, представленные в настоящем описании, включают такие, которые также содержат один или более других активных ингредиентов или терапевтических средств в добавление к частицам, представленным в настоящем описании.
Массовое соотношение частиц, представленных в настоящем описании, ко второму активному ингредиенту может варьироваться и будет зависеть от эффективной дозы каждого ингредиента. Обычно используется эффективная доза каждого. Следовательно, например, когда частицы, представленные в настоящем описании, комбинируют с НПВС, массовое соотношение твердых частиц к НПВС может варьироваться от около 1000:1 до около 1:1000 или от около 200:1 до около 1:200. Комбинации частиц, представленных в настоящем описании, и других активных ингредиентов обычно находятся в рамках вышеуказанного диапазона, но в каждом случае должна использоваться эффективная доза каждого активного ингредиента.
ПРИМЕРЫ
Частицы кислоты формулы I в следующих примерах характеризовали диффрактометрией рентгеновского излучения на порошке (XRPD), дифференциальной сканирующей калориметрией (DSC), термогравиметрией (TGA) и сканирующей электронной микроскопией (SEM).
Дифрактограмму рентгеновского излучения на порошке записывали с помощью дифрактометра рентгеновского излучения на порошке Rigaku MiniFlex (Rigaku Americas, The Woodlands, TX). Излучением было CuKa (40 кВ, 40 мА). Данные получали при комнатной температуре от 3 до 45 градусов двойном угле сближения 0,02 градуса на шаг и 0,6 секунд на шаг. Образцы получали на стеклянных держателях образцов в виде тонкого слоя порошкообразного материала без растворителя.
Дифференциальную сканирующую калориметрию проводили с использованием Mettler 850, TA 2920. Образцы помещали в герметичные алюминиевые лотки для анализов с пустым алюминиевым лотком в качестве контроля. Скорость нагревания 10º/мин использовали в диапазоне температур от 30ºС до 280ºС.
Термогравиметрический анализ также проводили на Mettler 850, TA 2920. Образцы помещали в керамический или алюминиевый лоток для образцов. Скорость нагревания 20º/мин использовали в диапазоне температур от 20ºС до 600ºС.
Пример 1
Определение растворимости {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты
Насыщенные растворы {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты формулы I в растворителях, перечисленных в таблице 1, получали из кислоты преимущественно в форме I при 25 и 50ºС. Концентрацию каждого насыщенного раствора определяли с использованием ВЭЖХ, и результаты суммированы в таблице 1.
Пример 2
Получение {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты формы I
Густую суспензию {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты в метаноле перемешивали в течение ночи при комнатной температуре. Затем частицы фильтровали, промывали гексаном и сушили.
Дифрактограмма рентгеновского излучения на порошке частиц проиллюстрирована на фиг.1. Частицы имели характерные пики XRP дифракции, выраженные в двойных углах сближения при приблизительно 9,8, 13,1, 22,0 и 26,4º, предполагая, что частицы являются кристаллическими. Как показано на фиг.4, частицы представляют собой длинные игольчатые кристаллы размером от около 1 до около 5 мкм.
Дифференциальная сканирующая калориметрическая термограмма частиц проиллюстрирована на фиг.2. Частицы имеют эндотерму с пиковой температурой 223,8ºС и температурой начала разложения 220,2ºС.
Термограмма термогравиметрического анализа частиц в форме I показана на фиг.3. Частицы являются очень стабильными и не проявляют существенной потери массы до разложения около 200ºС.
Средний размер частиц и распределение по размеру частиц в форме I измеряли с использованием Microtrac S3000 (Microtrac Inc., Montgomeryville, PA). Результаты показаны на фиг.5 и суммированы в таблице 2. Частицы в форме I имеют средний размер частиц (MV) 6,495 мкм и коэффициент однородности 3,24.
Пример 3
Получение {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты в форме II
Раствор {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты (50 мг) в ДМФА (0,5 мл) получали из кислоты преимущественно в форме I. Затем раствор добавляли к 8 мл МТВЕ при комнатной температуре. После перемешивания при комнатной температуре в течение дополнительных 15 минут, смесь становилась густой суспензией. Затем частицы фильтровали, промывали гексаном и сушили.
Дифрактограмма рентгеновского излучения на порошке частиц проиллюстрирована на фиг.6. Частицы имели характерные пики XRP дифракции, выраженные в двойном угле сближения приблизительно 31,7º, предполагая, что частицы находятся в кристаллической форме (форма II), которая отличается от формы I. Кристаллические характеристики частиц формы II показаны на фиг.7.
Пример 4
Уравновешивание фаз
На основании растворимости {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты в различных растворителях, как определено в примере 1, частицы кислоты преимущественно в форме I подвергали воздействию растворителей, перечисленных в таблице 3, при 25 или 50ºС в течение достаточного периода времени. Частицы фильтровали и сушили и затем анализировали с использованием XRPD. Результаты суммированы в таблице 3.
Пример 5
Уравновешивание фаз между формой I и формой II
Частицы формы II получали в виде густой суспензии, как описано в примере 2. Коротко, раствор {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты (50 мг) в ДМФА (0,5 мг) добавляли к 8 мл МТВЕ для получения густой суспензии частиц формы II. Частицы формы I (20 мг) затем добавляли к суспензии и полученную суспензию перемешивали в течение ночи при комнатной температуре. Затем частицы фильтровали, промывали гексаном и сушили. Частицы анализировали с использованием XRPD. Дифрактограмма XRP показана на фиг.8, указывая, что частицы после уравновешивания фаз имели форму I.
Пример 6
Образование частиц посредством выпаривания растворителя
На основании растворимости {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты в различных растворителях, как определено в примере 1, кислоту преимущественно в форме I растворяли в системе растворителей, перечисленных в таблице 4. Растворителю позволяли испаряться из раствора при 25 или 50ºС. Полученные частицы получали фильтрацией и анализировали с использованием XRPD. Результаты суммированы в таблице 4.
Пример 7
Образование частиц посредством добавления антирастворителя
Насыщенные растворы кислоты формулы I в растворителях, перечисленных в таблице 5, получали из кислоты преимущественно в форме I. Затем к насыщенным растворам добавляли антирастворитель для получения осаждения. ТГФ, 2-метоксиэтанол, ДМСО и ДМФА использовали в качестве растворителей для растворения частиц формы I, тогда как гексан, МТВЕ, толуол и воду использовали в качестве антирастворителей. Полученные частицы собирали фильтрованием и анализировали с использованием XRPD. Результаты суммированы в таблице 5.
Пример 8
Образование частиц при добавлении обратного антирастворителя
Насыщенные или почти насыщенные растворы кислоты формулы I в растворителях, перечисленных в таблице 6, получали из кислоты, преимущественно в форме I. Затем растворители, каждый, добавляли к большему количеству смешиваемого антирастворителя. ТГФ, 2-метоксиэтанол, ДМСО и ДМФА использовали в качестве растворителей для растворения твердых частиц, тогда как гексан, MTBE, толуол и воду использовали в качестве антирастворителей. Полученные частицы собирали фильтрацией и анализировали с использованием XRPD. Результаты суммированы в таблице 6.
Пример 9
Образование частиц посредством холодного гашения
Насыщенные растворы кислоты формулы I в растворителях, перечисленных в таблице 7, получали из кислоты преимущественно в форме I при около 30-50ºС. Растворы гасили холодом на бане ацетон/лед. Полученные частицы собирали фильтрацией и анализировали с использованием XRPD. Результаты суммированы в таблице 7.
Пример 10
Частицы при кристаллизации с циклами нагревания и охлаждения
Насыщенные растворы кислоты формулы I в растворителях, перечисленных в таблице 8, получали из кислоты, преимущественно в форме I, при около 30-50ºС. Растворы медленно охлаждали с использованием программируемой циркулирующей бани до получения густой суспензии. Затем полученную густую суспензию сначала нагревали до 50ºС в течение 2 часов, с последующим охлаждением до 25ºС в течение 2 часов. Такой процесс нагревания и охлаждения повторяли в течение ночи. Полученные частицы затем собирали фильтрацией и анализировали с использованием XRPD. Результаты суммированы в таблице 8.
Пример 11
Анализ конкурентного связывания радиолиганда
Способность связывания и селективность аминных солей 4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты, представленной в настоящем описании, оценивали с использованием анализа конкурентного связывания радиолиганда со стабильно-трансфицированными клеточными линиями, экспрессирующими CRTH2 или DP1.
Простагландин D2 и 13,14-дигидро-15-кето PGD2 получали от Cayman Chemical (Ann Arbor, MI). Меченный радиоактивной меткой PGD2 (5,6,8,9,12,14,15-3Н(N)) со специфической активностью 160 Ки/ммоль получали от PerkinElmer (Boston, MA). Среду для культур клеток RPMI 1640, буфер HEPES, фосфатный буферный раствор (PBS), L-глутамин и раствор пенициллин-стрептомицина получали от Mediatech (Herndon, VA). Эмбриональную сыворотку телят (FCS) получали от Cambrex (Walkersville, MD). Пуромицин получали от Invitrogen (San Diego, CA). Поли(этиленимин) (PEI) получали от Acros Organics (Morris Plains, NJ). Очищенные моноклональные крысиные античеловеческие антитела к CRTH2 (BM16), Rat IgG2a, κ, (клон R35-95) и козьи антикрысиные Ig-FITC получали от Becton Dickinson Biosciences (San Diego, CA). BSA (фракция V) и азид натрия получали от Sigma Chemical Company (St. Louis).
Стабильные клеточные линии CRTH2 и DP1 создавали в соответствии с методикой, описанной Sugimoto et al. (J. Pharm. Exp. Therap. 2003, 305, 347-352). Такие клеточные линии держали в культуральной среде RPMI 1640, содержащей буфер HEPES (25 мМ), FCS (10%), L-глутамин (2 мМ), пенициллин (10 МЕ/мл), стрептомицин (100 мкг/мл) и пуромицин (1 мкг/мл).
Поверхностную экспрессию CRTH2 на трансфицированных клеточных линиях отслеживали периодически в течение культивирования и перед каждым анализом конкурентного связывания радиолиганда. Клетки, экспрессирующие CRTH2, и нетрансфицированные клетки инкубировали на льду или с очищенными анти-CRTH2 антителами (клон ВМ16) или с изотиповыми контрольными антителами (Rat IgG2a,κ) в течение 15 мин. Затем клетки промывали в 2 мл буфера FACS (PBS, содержащий 1% BSA (фракция V) и 0,1% азид натрия. Клетки впоследствии инкубировали на льду с FITC-конъюгированными антикрысиными антителами (козьи антикрысиные Ig-FITC). После промывания холодным буфером FACS клетки анализировали с использованием анализатора FACScan II и программного обеспечения CellQuest, оба от Becton Dickinson (Mountain View, CA).
Функциональность клеток, трансфицированных рецепторами, также оценивали непосредственным измерением мобилизации кальция в ответ на PGD2, как описано (Sugimoto et al., J.Pharm.Exp.Therap. 2003, 305, 347-352; Sugimoto et al., Eur.J.Pharmacol. 2005, 524, 30-37).
Анализы связывания радиолиганда проводили в соответствии с методами Sugimoto et al. (J.Pharm.Exp.Therap. 2003, 305, 347-352; Eur.J.Pharmacol. 2005, 524, 30-37). Тестируемые соединения растворяли в ДМСО в концентрации 100 мМ в виде основного раствора. Серийные разведения от 10 мкМ получали в связывающем буфере перед анализом. Трансфицированные клетки ресупендировали в связывающем буфере (50 мМ Tris-HCl, 40 мМ MgCl2 и 0,1% альбумина бычьей сыворотки при рН 7,4) в концентрации 4×106/мл при комнатной температуре. Затем трансфицированные клетки сеяли в U-донные полипропиленовые 96-луночные планшеты (Fisher) путем добавления 50 мкл суспензии клеток, с последующим добавлением 10 мкл 3H-PGD2, 10 мкл раствора тестируемого соединения в ряде разведений концентрации или контроля, 30 мкл связывающего буфера для доведения окончательного объема до 100 мкл. Окончательная концентрация 3H-PGD2 в каждой ячейке составляла 1 нМ. После инкубации в течение 1 часа при комнатной температуре с аккуратным встряхиванием, суспензию клеток переносили в фильтровальные планшеты (Millipore, MA), которые предварительно увлажняли 0,5% буфером PEI. Осадки клеток промывали три раза связывающим буфером, и планшетам позволяли высохнуть на воздухе. Сцинтиллятор (50 мкл; MicroscintTM 20, Perkin Elmer, Boston, MA) добавляли к каждой ячейке и радиоактивность подсчитывали на TopCount (Packard Bioscience, Meriden, CT). Анализ данных проводили с использованием графической программы PrizmTM (GraphPad Software Inc., San Diego, CA). Как показано на фиг.10 и 11, {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусная кислота формулы I имела высокое сродство и селективно связывалась с CRTH2.
Примеры, указанные выше, представлены для того, чтобы дать обычному специалисту в области техники полное описание и разъяснение, как создавать и применять варианты осуществления изобретения, и не предназначены для ограничения рамок описания. Модификации вышеописанных вариантов осуществления описания, которые очевидны специалисту в области техники, находятся в рамках следующей формулы изобретения. Все публикации, патенты и патентные заявки, указанные в этой спецификации, включены в настоящее описание в виде ссылок, как будто каждая такая публикация, патент или патентная заявка были специфически и отдельно представлены для включения в настоящее описание в виде ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| АМИНОВЫЕ СОЛИ АНТАГОНИСТА CRTH2 | 2008 |
|
RU2468013C2 |
| 2-S-БЕНЗИЛЗАМЕЩЕННЫЕ ПИРИМИДИНЫ В КАЧЕСТВЕ АНТАГОНИСТОВ CRTH2 | 2008 |
|
RU2491279C2 |
| АЛКИЛТИОПИРИМИДИНЫ В КАЧЕСТВЕ АНТАГОНИСТОВ CRTH2 | 2008 |
|
RU2491280C2 |
| ПРОИЗВОДНЫЕ ИМИДАЗО[1,2-C]ПИРИМИДИНИЛУКСУСНОЙ КИСЛОТЫ | 2005 |
|
RU2373208C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ ИНГИБИТОРА MAGL | 2017 |
|
RU2799564C2 |
| БИЦИКЛИЧЕСКИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ПРОТИВОВОСПАЛИТЕЛЬНЫХ АГЕНТОВ | 2006 |
|
RU2426733C2 |
| СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ АНТАГОНИСТОВ CRTH2 | 2009 |
|
RU2503672C2 |
| ПРОЛЕКАРСТВА ПИРИДОНАМИДОВ, ПРИМЕНЯЕМЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ НАТРИЕВЫХ КАНАЛОВ | 2014 |
|
RU2692766C1 |
| ПОЛИМОРФНАЯ ФОРМА [5-ФТОР-3-({ 2-[(4-ФТОРБЕНЗОЛ) СУЛЬФОНИЛ]ПИРИДИН-3-ИЛ} МЕТИЛ)-2-МЕТИЛИНДОЛ-1-ИЛ]-УКСУСНОЙ КИСЛОТЫ | 2015 |
|
RU2751319C2 |
| ПОЛИМОРФНАЯ ФОРМА [5-ФТОР-3-({ 2-[(4-ФТОРБЕНЗОЛ) СУЛЬФОНИЛ]ПИРИДИН-3-ИЛ} МЕТИЛ)-2-МЕТИЛИНДОЛ-1-ИЛ]-УКСУСНОЙ КИСЛОТЫ | 2015 |
|
RU2702343C2 |
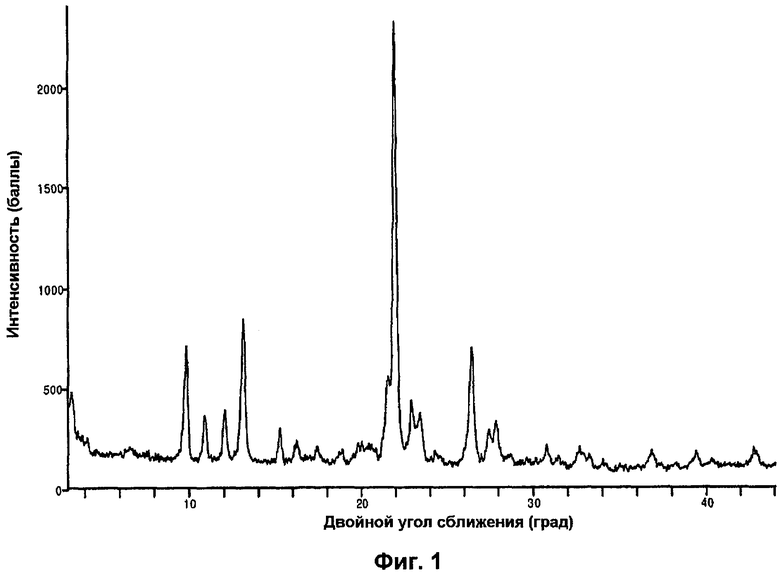
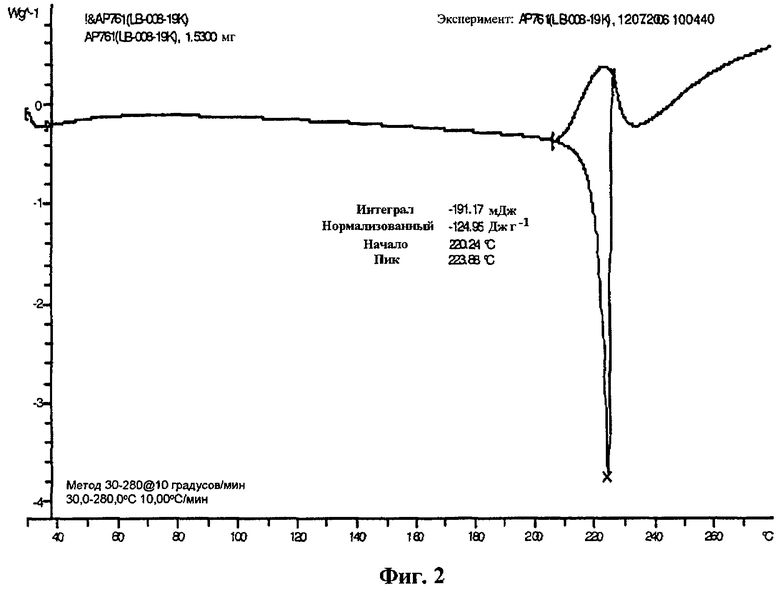
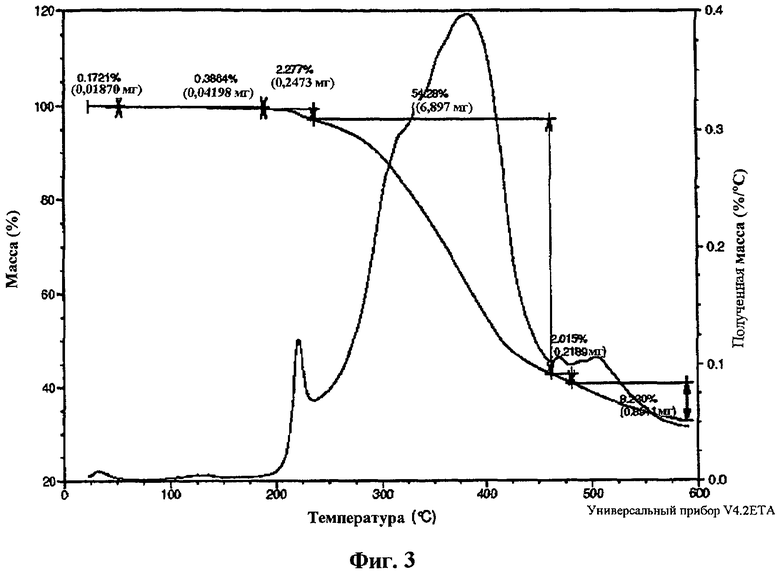



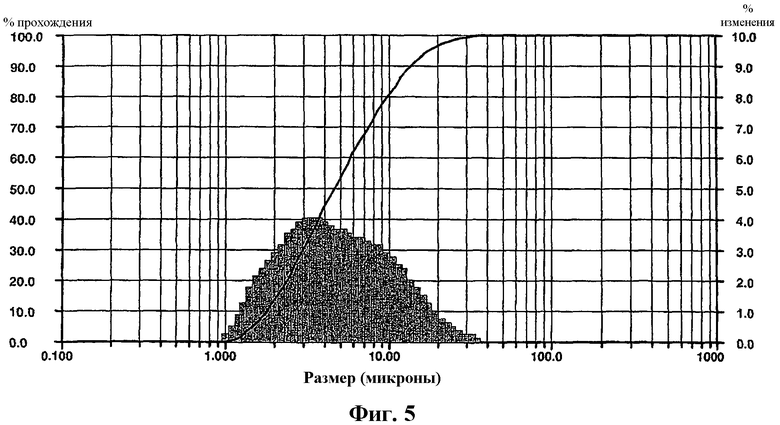
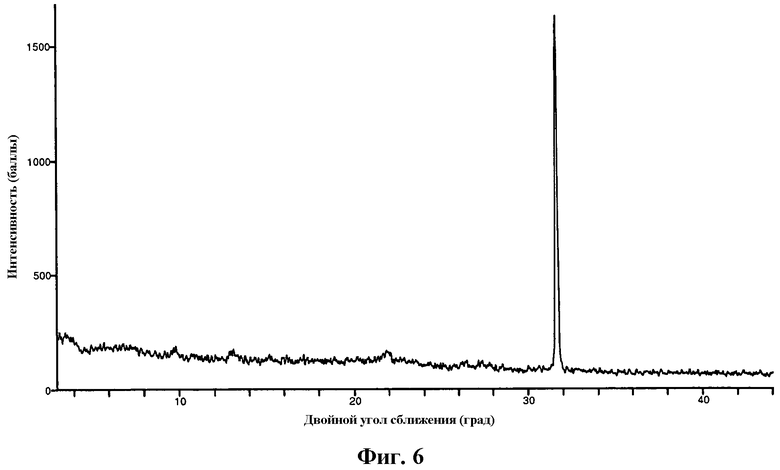




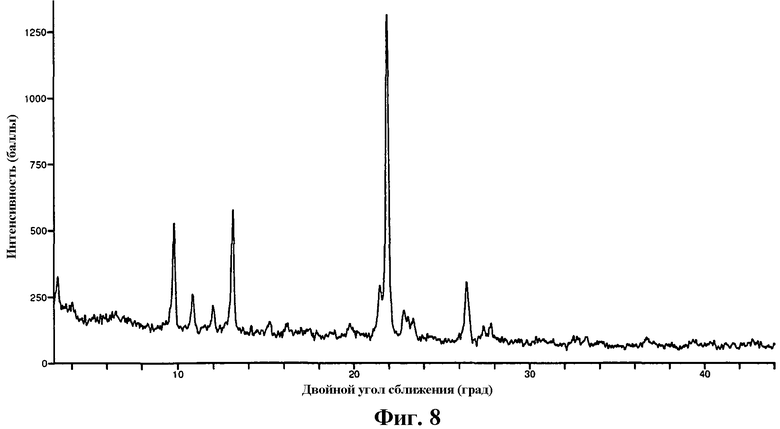
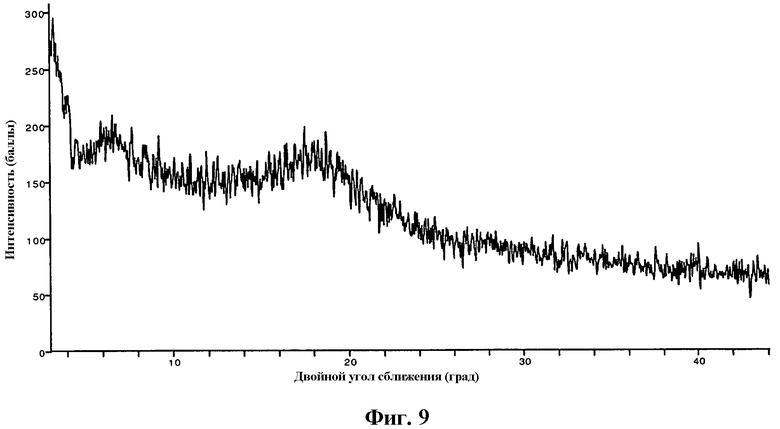
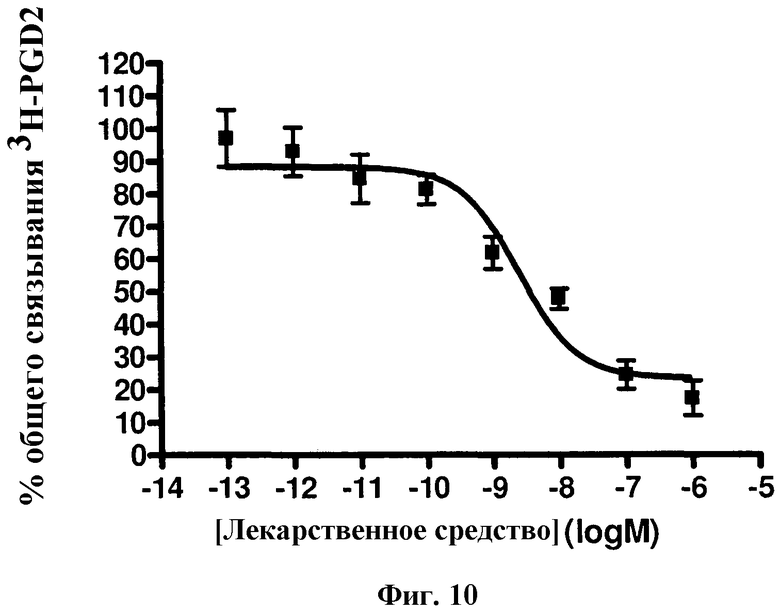
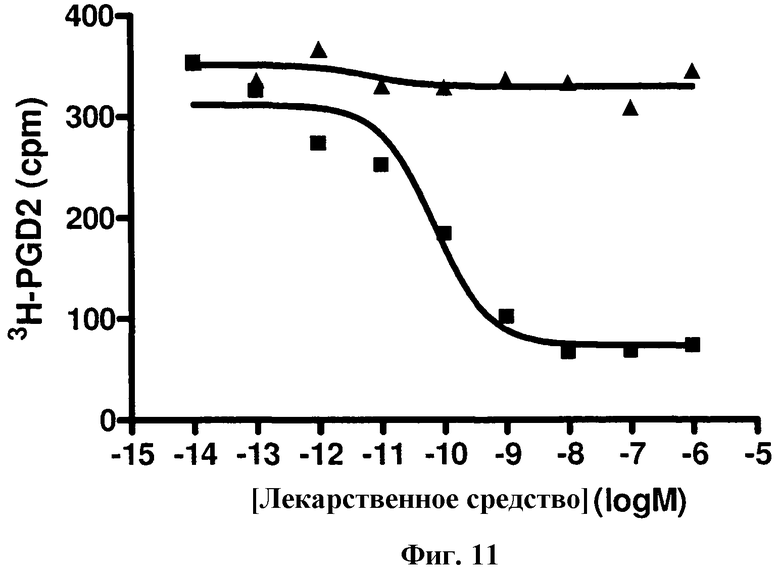
Изобретение относится к новым кристаллическим формам I, II и аморфной форме {4,6-бис(диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусной кислоты. Изобретение также относится к фармацевтической композиции, содержащей кристаллическую форму I соединения, и к применению кристаллической формы I для лечения, профилактики или облегчения одного или более симптомов заболевания, опосредованного CRTH2, связанного с эозинофилами, базофилами, где заболевание выбрано из астмы, аллергической астмы, астмы, индуцированной физическими нагрузками, аллергического ринита, круглогодичного аллергического ринита, сезонного аллергического ринита, атопического дерматита, контактной гиперчувствительности. 7 н. и 9 з.п. ф-лы, 11 ил., 8 табл., 11 пр.
1. {4,6-бис(Диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусная кислота формулы I
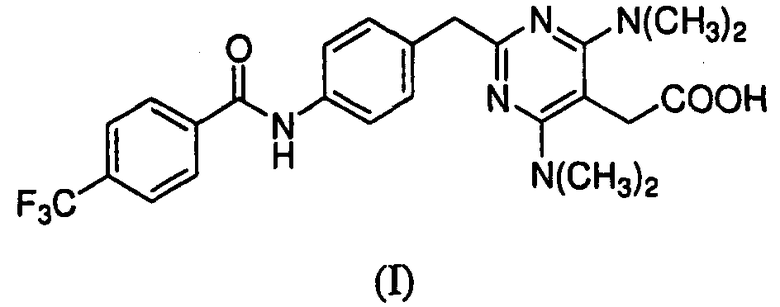
в кристаллической игольчатой форме I; где кристаллическая форма характеризуется дифрактограммой рентгеновского излучения на порошке, полученной с использованием источника излучения CuKα, с пиками, соответствующими углам 2θ приблизительно 9,8, 13,1, 22,0 и 26,4°; и термограммой дифференциальной сканирующей калориметрии с эндотермой при пиковой температуре около 224°С и температуре начала разложения около 220°С.
2. Кристаллическая форма по п.1, характеризующаяся дифрактограммой рентгеновского излучения на порошке, по существу, как показано на фиг.1.
3. Кристаллическая форма по п.1, характеризующаяся термограммой дифференциальной сканирующей калориметрии, по существу, как показано на фиг.2.
4. Кристаллическая форма по п.1, имеющая растворимость в воде около 3 мкг/мл при комнатной температуре.
5. {4,6-бис(Диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусная кислота формулы I:
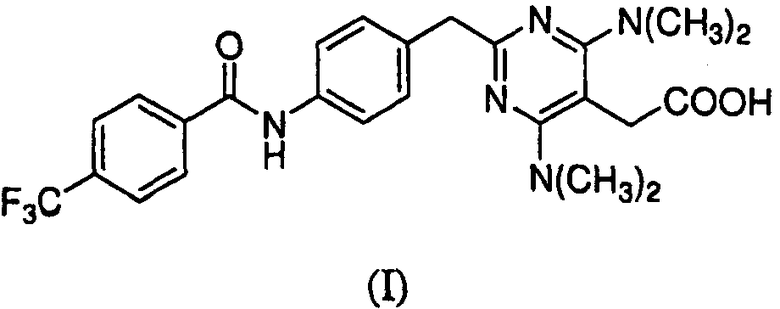
в кристаллической форме II; где кристаллическая форма характеризуется дифрактограммой рентгеновского излучения на порошке, полученной с использованием источника излучения CuKα, с пиком, соответствующим углу 2θ приблизительно 31,7.
6. Кристаллическая форма по п.5, характеризующаяся дифрактограммой рентгеновского излучения на порошке, по существу, как показано на фиг.6.
7. {4,6-бис(Диметиламино)-2-(4-(4-(трифторметил)бензамидо)бензил)пиримидин-5-ил}уксусная кислота формулы I:
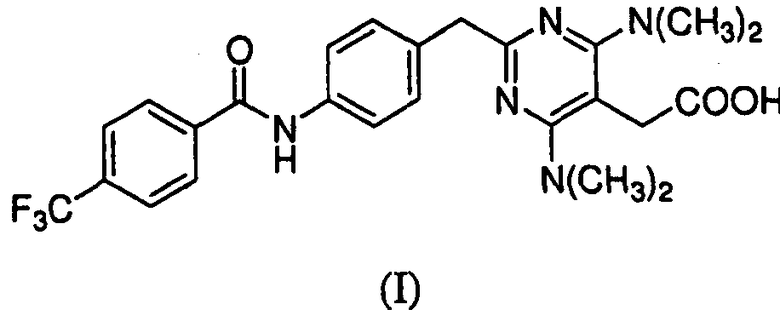
в аморфной форме; где аморфная форма характеризуется дифрактограммой рентгеновского излучения на порошке, полученной с использованием источника излучения CuKα, по существу, как показано на фиг.9.
8. Фармацевтическая композиция с активностью антагониста CRTH2, содержащая кристаллическую форму по п.1 в терапевтически эффективном количестве и фармацевтически приемлемый носитель.
9. Фармацевтическая композиция по п.8, где композиция приготовлена для перорального, назального, бронхиального или местного введения.
10. Фармацевтическая композиция по п.8 или 9, где композиция приготовлена в виде лекарственной формы для введения разовой дозы.
11. Применение кристаллической формы по п.1 в получении лекарственного средства для лечения, профилактики или облегчения одного или более симптомов заболевания, опосредованного CRTH2.
12. Применение кристаллической формы по п.1 в получении лекарственного средства для лечения, профилактики или облегчения одного или более симптомов заболевания, связанного с эозинофилами.
13. Применение кристаллической формы по п.1 в получении лекарственного средства для лечения, профилактики или облегчения одного или более симптомов заболевания, связанного с базофилами.
14. Применение по п.11, где заболевание, опосредованное CRTH2, представляет собой воспалительное заболевание.
15. Применение по любому из пп.11-14, где заболевание выбрано из группы, состоящей из астмы, аллергической астмы, астмы, индуцированной физическими нагрузками, аллергического ринита, круглогодичного аллергического ринита, сезонного аллергического ринита, атопического дерматита, контактной гиперчувствительности.
16. Применение по п.15, где заболеванием является астма, астма, индуцированная физическими нагрузками, аллергический ринит и атонический дерматит.
| WO 2004096777 А1, 11.11.2004 | |||
| RU 2005137403 С2, 27.05.2006. |
Авторы
Даты
2012-11-27—Публикация
2008-06-18—Подача