Изобретение относится к области медицины, в частности онкологии и молекулярной биологии, и касается способа оценки эффективности терапии рака мочевого пузыря (РМП) и набора для его осуществления.
Рак мочевого пузыря (РМП) является распространенной патологией. Ежегодно в мире диагностируется около 356000 новых случаев заболевания РМП [Ploeg, М., К.К.Aben and L.A.Kiemeney, The present and future burden of urinary bladder cancer in the world. World J Urol, 2009. 27 (3): p.289-93]. Существующие методы диагностики РМП разделяют на две группы: инвазивные и неинвазивные. К инвазивным методам диагностики относятся цистоскопия, позволяющая визуализировать опухоль и провести биопсию мочевого пузыря, а также трансуретральное ультразвуковое исследование (трансуретральная ультрасонография) [Qu, X., X.Huang, L.Wu, et al., Comparison of virtual cystoscopy and ultrasonography for bladder cancer detection: A meta-analysis. Eur J Radiol, 2010]. Все инвазивные методы связаны с дискомфортом и риском для здоровья пациента, дороговизной и сложностью выполнения.
К неинвазивным относятся обнаружение в физиологических жидкостях организма маркеров РМП, трансабдоминальная ультразвуковая томография, рентгеновская компьютерная томография, магнитно-резонансная томография, цитологическое исследование мочи или промывной жидкости [Kenney, D.M., R.D.Geschwindt, M.R.Каrу, et al., Detection of newly diagnosed bladder cancer, bladder cancer recurrence and bladder cancer in patients with hematuria using quantitative rt-PCR of urinary survivin. Tumour Biol, 2007. 28 (2): p.57-62, Van Tilborg, A.A., C.H.Bangma and E.C.Zwarthoff, Bladder cancer biomarkers and their role in surveillance and screening. Int J Urol, 2009. 16 (1): р.23-30].
Биомаркеры РМП подразделяют на следующие группы:
1. Маркеры, представляющие собой РНК генов, дифференциально экспрессирующихся в нормальных и опухолевых тканях.
2. Белковые маркеры, а также пептиды и продукты белковой деградации, специфично обнаруживаемые в моче или крови больного.
Для оценки содержания РНК-маркеров РМП используют различные методы, прежде всего микрочиповую гибридизацию и метод ПЦР в реальном времени (ПЦР-РВ) [Livak K.J., Flood S.J., Marmaro J., Giusti W., Deets K. 1995. Oligonucleotides with fluorescent dyes at opposite ends provide a quenched probe system useful for detecting PCR product and nucleic acid hybridization. PCR Methods Appl. 4, 357-362].
В качестве РНК-маркеров РМП используют:
- сурвивин (повышенный уровень мРНК обнаруживается в опухолевых тканях, моче и промывной жидкости) [Kenney, D.M., R.D.Geschwindt, M.R.Kary, et al., Detection of newly diagnosed bladder cancer, bladder cancer recurrence and bladder cancer in patients with hematuria using quantitative rt-PCR of urinary survivin. Tumour Biol, 2007. 28 (2): p.57-62];
- цитокератин 20 (повышенный уровень мРНК в моче и промывной жидкости) [Guo, В., С.Luo, С.Xun, et al., Quantitative detection of cytokeratin 20 mRNA in urine samples as diagnostic tools for bladder cancer by real-time PCR. Exp Oncol, 2009. 31 (1): p.43-7];
- гиалуронидазы (уровень мРНК повышен в моче) [Van Tilborg, A.A., C.H.Bangma and Е.С.Zwarthoff, Bladder cancer biomarkers and their role in surveillance and screening. Int J Urol, 2009. 16 (1): p.23-30];
- теломеразы (уровень мРНК повышен в моче) [Eissa, S., M.Swellam, R.Ali-Labib, et al., Detection of telomerase in urine by 3 methods: evaluation of diagnostic accuracy for bladder cancer. J Urol, 2007. 178 (3 Pt 1): p.1068-72].
Однако же, существенным недостатком всех существующих РНК-маркеров РМП является их низкая прогностическая ценность (менее 20% случаев РМП), что приводит к слабой воспроизводимости результатов и низкой клинической ценности таких тестов.
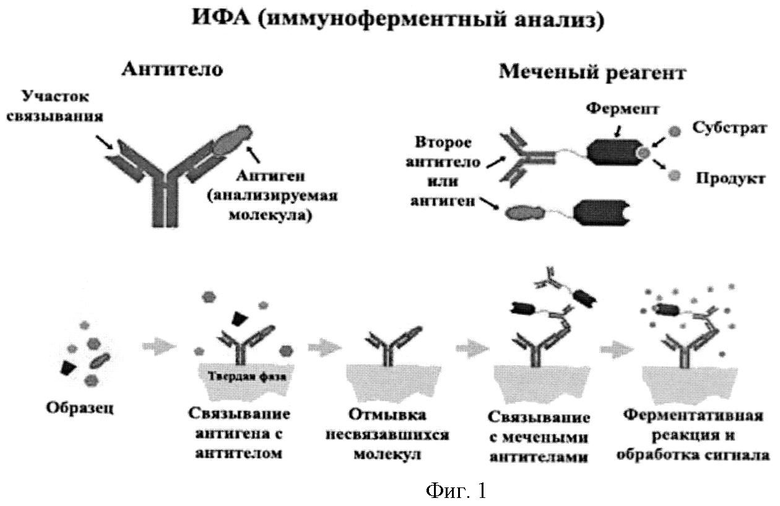
Для диагностики РМП с помощью белковых маркеров используют методы иммунохимического анализа, основанные на реакции взаимодействия специфических антител с белком-маркером. С помощью этих методов можно оценить количественное содержание белка-маркера РМП и его пространственное распределение в исследуемой ткани. Биологический образец, для которого проводится анализ белка, может быть иммобилизован на твердом носителе, например, на полимерной мембране, на которой можно иммобилизовать клетки, части клеток или белки. Этот носитель в дальнейшем гибридизуют с мечеными антителами, специфичными к исследуемому белку. Затем оценивают количество связавшихся с носителем антител. Как правило, для этого используют первичные или вторичные антитела, меченые химически связанным с ними ферментом [Voller, A., The enzyme-linked immunosorbent assay (ELISA) (theory, technique and applications). Ric Clin Lab, 1978. 8 (4): p.289-98, de Savigny, D. and A.Voller, The communication of ELISA data from laboratory to clinician. J Immunoassay, 1980. 1 (1); p.105-28]. Фермент, связанный с антителом, реагирует с соответствующим субстратом, изменяющим свои спектральные характеристики в результате реакции, с образованием химической группировки или соединения, которое может быть обнаружено с помощью спектрометрических или флуореметрических методов, или визуально. Кроме того, антитела также метят радиоизотопами, наночастицами металлов и другими веществами. На этом принципе основаны коммерчески доступные методы диагностики РМП, такие как NMP-22 (детекция в моче ядерного белка, высвобождаемого при апоптозе). Эта диагностическая тест-система может служить прототипом данного изобретения [Landman J, Chang Y, Kavaler E, Droller MJ, Liu ВС., Sensitivity and specificity of NMP-22, telomerase, and BTA in the detection of human bladder cancer. Urology. 1998 Sep; 52 (3): 398-402]. В качестве диагностических признаков в ней используют следующие критерии: 1) статистически значимое повышение уровня содержания маркера в образце РМП относительно верхней границы нормы; 2) выраженная динамика снижения уровня маркера при успешном лечении РМП не менее чем на 50%. Эта система также может быть использована для обнаружения рецидивов и прогнозирования будущего течения болезни. Вместе с тем, эта и другие доступные системы диагностики РМП, основанные на детекции белковых маркеров в физиологических жидкостях, обладают недостаточной чувствительностью (менее 25%) для эффективного применения в клинической практике.
Изобретение позволяет проводить оценку эффективности лечения рака мочевого пузыря, а также решает задачу повышения чувствительности маркеров РМП и позволяет проводить диагностику РМП с чувствительностью 89%.
Поставленная задача решается за счет определения уровня белка NUSAP1 в моче и крови испытуемого (пациента) методом иммуноферментного анализа, включающем получение образцов мочи и крови от пациента, выделение смеси белковых компонентов мочи и крови, проведение реакции иммуноферментного анализа с моноклональными и/или поликлональными антителами и/или их фрагментами против рекомбинантного белка NUSAP1 и/или его уникальных фрагментов длиной свыше 8 аминокислот и проведение диагностики путем определения содержания белка NUSAP1 в исследуемых образцах. При этом снижение уровня белка NUSAP1 в моче и крови в 1.5-5 раз после проведенной терапии по сравнению с исходным уровнем данного белка в моче и крови, выявленным до начала лечения, является показателем эффективности терапии рака мочевого пузыря.
В настоящем изобретении, в качестве маркера РМП используют продукты гена NUSAP1, обладающего высокой специфичностью экспрессии именно в клетках РМП, но не в нормальной ткани мочевого пузыря. В настоящем изобретении, в качестве показателя наличия раковых и/или предраковых изменений для РМП служит изменение содержания белка гена NUSAP1 у пациентов, больных РМП.
В ходе проведенного авторами поиска дифференциальных транскриптов с помощью анализа на микрочипах и идентификации дифференциально экспрессирующихся генов в нормальных и опухолевых образцах тканей мочевого пузыря на разных этапах злокачественного перерождения обнаружено значительное повышение содержания мРНК гена NUSAP1 уже на ранних стадиях злокачественной трансформации клеток мочевого пузыря.
Уровень мРНК гена NUSAP1 определяют при помощи следующих процедур: получение исходных образцов биоматериала, например, тканей от пациента; выделение и очистка препаратов РНК из образцов тканей; синтез кДНК на матрице РНК, определение концентрации мРНК гена NUSAP1 при помощи количественной ПЦР-амплификации с использованием матрицы кДНК; нормирование концентрации мРНК гена NUSAP1 по контрольному гену, содержание мРНК которого относительно постоянно в здоровых и раковых тканях человека, в том числе и в мочевом пузыре; проведение диагностики РМП. Например, показанием для обнаружения РМП служит уровень содержания мРНК гена NUSAP1 в тканях мочевого пузыря, превышающий 0,5% от уровня содержания в этих тканях мРНК гена бета-актина человека (АСТВ).
Олигонуклеотидные праймеры, используемые для синтеза одноцепочечной или двуцепочечной кДНК, выбирают из числа олиго(dТ)-содержащих праймеров, случайных гексамеров, или их комбинации, а также геноспецифичных праймеров.
Для амплификации кДНК используют олигонуклеотидные праймеры и зонд, подобранные таким образом, что они специфически гибридизуются с кДНК даже в присутствии в препарате примеси геномной ДНК. Возможная последовательность праймеров представлена SEQ ID NO 1-2.
Количественная реакция амплификации фрагмента гена NUSAP1 представляет собой ПЦР в реальном времени или ОТ-ПЦР в реальном времени.
В качестве контрольного гена используют ген АСТВ, кодирующий актин бета. Возможная последовательность праймеров для определения концентрации контрольного гена представлена SEQ ID NO 3-4. Последовательность кодирующей белок ДНК гена NUSAP1 представлена на SEQ ID NO 5. Последовательность белка NUSAP1 представлена на SEQ ID NO 6.
Набор праймеров для осуществления полимеразной цепной реакции для определения содержания мРНК гена NUSAP1 имеют последовательности SEQ ID NO 1-2.
В дальнейшем, при помощи иммуноферментного анализа (ИФА) с использованием моноклональных антител против белкового продукта гена NUSAP1, обнаружено также и повышенное содержание белка NUSAP1 в моче и в крови больных РМП. Всего, из 200 исследованных образцов тканей больных РМП, в 178 (89%) наблюдался уровень белкового продукта NUSAP1, в два раза и более превышающий наивысшее значение по уровню NUSAP1 для группы из 74 образцов тканей здоровых доноров.
Настоящее изобретение относится к новому маркеру для диагностики рака мочевого пузыря (РМП), который представляет собой продукт гена NUSAP1. Увеличение содержания белка NUSAP1 (продукта гена NUSAP1) в моче предположительно больного РМП человека по сравнению с содержанием белка в моче здорового человека, служит диагностическим маркером РМП. Снижение уровня белка NUSAP1 после проведенной терапии является показателем успешности проведенного лечения.
Настоящее изобретение относится к способу оценки эффективности терапии рака мочевого пузыря. Данный способ включает следующие стадии: получение образца мочи и крови от пациента, для которого проводится исследование на наличие РМП; выделение смеси белковых компонентов мочи и крови; проведение реакции иммуноферментного или другого иммунологического анализа с моноклональными или поликлональными антителами или их фрагментами против рекомбинантного белка NUSAP1 или его уникальных фрагментов длиной свыше 8 аминокислот; проведение диагностики РМП путем сравнения содержания белка NUSAP1 в моче и/или крови исследуемого пациента с концентрацией содержания белка NUSAP1 в моче и/или крови здоровых людей и больных РМП.
В данном варианте могут быть использованы химерные антитела или антитела, состоящие из одной цепи или Fab/F(аb')2-фрагменты или антиидиотипические антитела или эпитоп-связывающие фрагменты.
В данном изобретении предложены варианты способа диагностики рака мочевого пузыря методами ПЦР в реальном времени и иммуноферментного анализа (ИФА), основанными на измерении содержания мРНК гена NUSAP1 и/или его белкового продукта, а также набор для осуществления этого способа. Достоверно обнаруживаемое различие в содержании мРНК гена NUSAP1 в нормальных и опухолевых тканях или белка NUSAP1 в моче и/или крови больных РМП и здоровых людей может быть использовано для обнаружения РМП в исследуемых образцах.
В качестве образцов для проведения анализа берут биоптаты, пунктаты, в том числе материал, полученный при цистоскопии с прямой биопсией, моча и периферическая кровь.
В основе метода иммуноферментного анализа и его наиболее часто применяемой модификации (англ. enzyme-linked immunosorbent assay, ELISA) лежит принцип специфического взаимодействия между антигеном и соответствующим ему антителом. Выявление образовавшегося комплекса проводят с использованием конъюгата, который представляет собой комплекс вторичного антитела, соединенного с ферментной меткой (обычно используют пероксидазу хрена либо другие пероксидазы) или помеченного иным способом. Конъюгат может быть получен как с использованием поликлональных антител (например, кроличьи антитела против иммуноглобулинов человека), так и моноклональных антител, направленных против человеческих иммуноглобулинов определенного класса (М, G, А). В настоящем изобретении предполагается использование моноклональных и/или поликлональных антител и/или их фрагментов, полученных против рекомбинантного белка NUSAP1 и/или его уникальных фрагментов длиной свыше 8 аминокислот.
Существует несколько методов постановки реакции, однако в настоящее время наиболее часто для выявления специфических антител используется следующая схема (т.н. сэндвич-метод ИФА):
1) на лунках тест-планшета фиксируют антиген, который инкубируется с испытуемой сывороткой или плазмой крови. При наличии в них специфических антител происходит связывание их с образованием комплекса антиген-антитело;
2) в дальнейшем, при инкубации этого комплекса с конъюгатом вторичного антитела и пероксидазы хрена, происходит присоединение анти-антител к имеющимся комплексам антиген-антитело. Ферментативная реакция (цветная реакция) проходит в присутствии перекиси водорода и субстрата, представленного неокрашенным соединением, которое в процессе пероксидазной реакции (или другой ферментативной реакции) окисляется до окрашенного продукта на заключительном этапе проведения исследования. Интенсивность окрашивания прямо коррелирует с количеством выявленных специфических антител;
3) результат определения оценивают спектрофотометрически или визуально (Фиг.1).
В настоящем изобретении в качестве маркера успешности терапии РМП выступает уровень белка NUSAP1, содержание которого повышено в моче больных РМП по сравнению со здоровыми донорами, не имеющими злокачественных новообразований.
Настоящее изобретение проиллюстрировано со ссылкой на конкретные примеры, представляющие собой наиболее предпочтительные воплощения изобретения. Изобретение не ограничивается описанными воплощениями, но включает любые альтернативы, модификации или эквиваленты, допустимые с учетом сущности и объема изобретения.
Изобретение иллюстрируют чертежи.
Фигура 1. Схема иммунофлуоресцентного анализа.
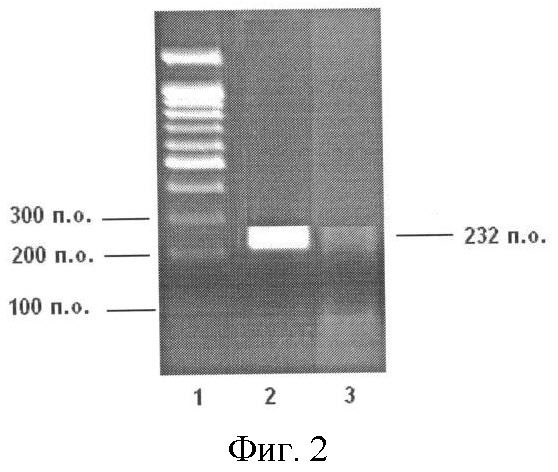
Фигура 2. Электрофоретическое разделение в 1,5%-ном агарозном геле продукта ПЦР-РВ (35 циклов ПЦР) - транскрипта гена NUSAP1 (размер 232 п.н.), 1-я дорожка - маркер молекулярных масс ДНК от 100 до 1500 п.н., 2-я дорожка - транскрипт гена NUSAP1 ожидаемого размера в опухолевых тканях, 3-я дорожка - в нормальных тканях мочевого пузыря.
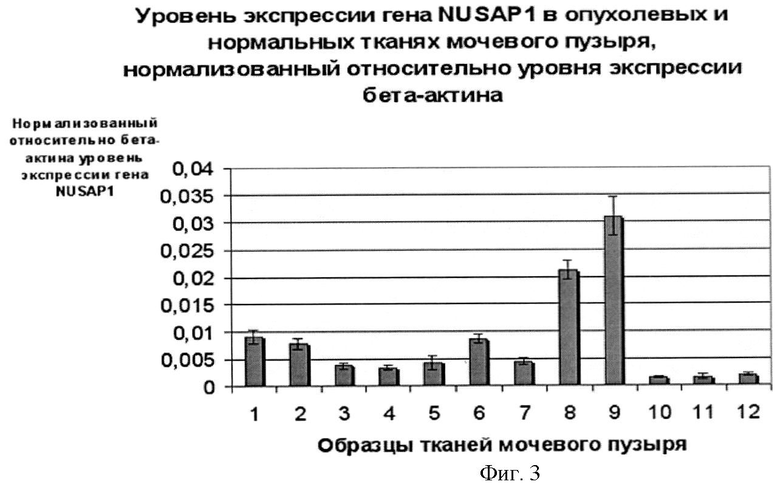
Фигура 3. Относительный уровень экспрессии гена NUSAP1 в опухолевых и нормальных тканях мочевого пузыря, измеренный путем ПЦР-РВ после нормализации его экспрессии относительно экспрессии гена АСТВ в тех же образцах тканей. Образцы №№1-9 - опухолевые ткани мочевого пузыря, 10-12 - нормальные (не имеющие злокачественной трансформации) ткани мочевого пузыря.
Изобретение иллюстрируют примеры.
Пример 1. Определение уровня мРНК гена NUSAP1 в нормальных и раковых тканях мочевого пузыря.
1) Образцы тканей
Образцы тканей различных гистологических типов ПРМП (Т), морфологически нормальные ткани, прилегающие к опухолям (т.н. условные нормы (N), а также нормальные ткани мочевого пузыря (NB) от скоропостижно скончавшихся доноров собраны и охарактеризованы независимо двумя различными группами сотрудников ФГУ МНИОИ им. П.А.Герцена Росмедтехнологии и факультета фундаментальной медицины МГУ им. М.В.Ломоносова). Клинический диагноз установлен с учетом данных ретроспективного анализа первичной медицинской документации больных, цито- и гистологических исследований биоптатов, полученных при цистоскопии, а также образцов тканей мочевого пузыря, полученных после трансуретральной резекции и операционного материала. Образцы тканей мочевого пузыря (опухоль, условно-нормальная ткань) получены непосредственно после удаления опухоли. Каждый образец хранят в растворе RNALater Reagent (QIAGEN), стабилизирующем молекулы РНК, при температуре -70°С. Все опухолевые образцы охарактеризованы согласно международной системе клинико-морфологической классификации опухолей ТНМ, где Т (tumor) - Т0-Т4 - категории, отражающие увеличение размера и/или местного распространения первичной опухоли, N (nodules) - N0-N3 - категории, отражающие различную степень поражения метастазами регионарных лимфатических узлов; M (metastasis) - М0-М1 - характеризует отдаленные метастазы. Все возможные комбинации ТНМ объединяют в более крупные группы - стадии, отражающие течение опухолевого процесса.
2) Выделение препаратов РНК из тканей
Суммарную РНК выделяют из замороженных, хранящихся в растворе RNALater Reagent (QIAGEN) образцов опухолевых и нормальных тканей с использованием TRIZOL Reagent (Invitrogen). Основные этапы включают:
а) разрушение ткани, замороженной в жидком азоте, с использованием микродесмембратора («Sartorius», Германия) и гомогенизацию разрушенного образца в лизирующем растворе, содержащем гуанидинизотиоцианат и фенол;
б) добавление хлороформа и центрифугирование в течение 10 минут при ≤12000×g при температуре 4°С;
в) осаждение РНК из водной фазы, образующейся после центрифугирования, путем добавления изопропилового спирта и повторного центрифугирования в течение 10 минут при ≤12000×g при температуре 4°С.
Далее осадок РНК после повторного центрифугирования промывают водным 75% этиловым спиртом, высушивают и растворяют в воде, очищенной от нуклеаз.
Концентрацию РНК определяют спектрофотометрически. Качество выделенной РНК проверяют электрофорезом в 1%-ной агарозе в присутствии бромистого этидия и спектрофотометрически («Nanodrop», США).
3) Реакция обратной транскрипции
На матрице РНК, выделенной, как описано в пункте 2), синтезируют одноцепочечную кДНК. Для проведения реакции обратной транскрипции берут по 1 мкг РНК, полученной одним из двух вышеописанных методов с использованием наборов реагентов Trizol Reagent (Invitrogen) или реагентов RNeasy Mini Kit (Qiagen), предварительно обработанной не содержащей РНКаз ДНКазой I (Sigma-Aldrich), и инкубируют 5 мин при 70°С, затем помещают в лед.
На каждую пробу готовят 20 мкл смеси, содержащей:
5 м MgCl2;
1 × Буфер для обратной транскриптазы AMV, содержащий 250 мМ Tris-HCl (pH 8.3, 25°С), 250 мМ КСl, 50 мМ MgCl2 2,5 мМ спермидин и 50 мМ DTT (Promega);
100 нг гексануклеотидных праймеров;
1 мМ dNTP (Evrogen);
200 единиц обратной транскриптазы AMV (Promega).
К смеси добавляют РНК и воду до конечного объема 20 мкл и проводят реакцию при следующем температурном режиме: 25°С - 10 мин, 42°С - 60 мин, 70°С - 10 мин.
4) Подбор условий определения содержания мРНК гена NUSAP1 в образцах тканей мочевого пузыря
Для ОТ-ПЦР и ПЦР-РВ используют одинаковые праймеры NUSAP1_F (SEQ ID NO:1) и NUSAP1_R (SEQ ID NO:2) при их молярном соотношении 1:1, специфичные для разных экзонов гена NUSAP1, причем один из праймеров перекрывает границу между экзонами. Размер ампликона - 232 п.н.
Последовательности выбранных праймеров для контрольного гена: SEQ ID NO 3-4, при их молярном соотношении 1:1, размер ампликона - 145 п.н.
Для проведения ПЦР-РВ подбирают оптимальные концентрации праймеров исследуемого и контрольного генов (Фиг.2).
5) Количественная оценка содержания мРНК гена NUSAP1
Для количественных измерений используют прибор Stratagene MX3000P (США).
Протокол определения содержания мРНК методом ПЦР-РВ с использованием набора «Комплект реагентов для проведения ПЦР-РВ в присутствии SYBR Green I» или «Комплект реагентов для проведения ПЦР-РВ в присутствии EVA Green» (Синтол, Россия):
1. Готовят реакционные смеси для генов NUSAP1 и АСТВ, осторожно смешав все компоненты реакции, кроме матрицы (кДНК), из расчета 1 реакция объемом 25 мкл для каждого образца +1 дополнительная реакция по 25 мкл.
2. В 0,2 мл пробирки, предназначенные для ПЦР-РВ, добавляют по 23 мкл приготовленных реакционных смесей без матрицы.
3. Вносят по 2 мкл матрицы, плотно закрывают пробирки крышками.
4. Помещают пробирки в приборное отделение, задают названия ячеек, температурный режим для 35 циклов: 95°С - 5 мин - денатурация и активация фермента, 95°С - 20 сек - денатурация, 60°С - 20 сек - отжиг зонда и полимеризация, 72°С - 30 сек - элонгация цепей.
5. Реакции проводят в режиме относительных количественных измерений (программное обеспечение Stratagene MxPro, США).
6. После завершения реакции амплификации сохраняют данные.
7. Проводят анализ продуктов реакции с помощью гель-электрофореза в ТВЕ-буфере, содержащем 10 мг/л этидий бромида. Для этого отбирают 5 мкл продуктов амплификации (40 циклов), наносят образцы на 1.8% агарозный гель, содержащий 0.5 мг/л этидий бромида, и маркер молекулярных масс ДНК, позволяющий оценить размер продуктов амплификации (НПО «СибЭнзим»).
6) Математическая обработка данных ПЦР-РВ
Данные ПЦР-РВ переносят в виде текстового файла в Microsoft Excel и проводят математическую обработку данных. Относительное содержание мРНК гена NUSAP1-RкДНК (далее R) в опухолевых и нормальных тканях мочевого пузыря нормируют относительно содержания мРНК гена АСТВ по формуле:
R-2^(Ct(ACTB)-Ct(NUSAP1)) где Ct - пороговый цикл.
Интервал крайних значений R вычисляют с учетом рассчитанных отклонений Е для значений Ct:
Е=((Σ(x-xср)2)/(n-1))1/2,
где х - значения, полученные в результате измерения (число 1, число 2…),
xcp=Σx/n,
n - размер выборки (число повторов реакции).
Достоверность наблюдаемых изменений оценивают исходя из нормального распределения данных. Данные считают достоверными при Р<0.05, где Р - показатель статистической значимости данных (Фиг.3).
7) Результаты
В результате, для всех исследованных образцов РМП (n=26) выявлено 5-76-кратное превышение уровня мРНК гена NUSAP1 относительно нормальных образцов ткани мочевого пузыря (n=47).
Пример 2. Определение уровня белка NUSAP1 в нормальных и раковых тканях мочевого пузыря методом иммуноферментного анализа.
1) Образцы тканей
Образцы тканей различных гистологических типов РМП (Т), морфологически нормальные ткани, прилегающие к опухолям (т.н. условные нормы (N), а также нормальные ткани мочевого пузыря (NB) от скоропостижно скончавшихся доноров собраны и охарактеризованы независимо двумя различными группами сотрудников ФГУ МНИОИ им. П.А.Герцена Росмедтехнологии и факультета фундаментальной медицины МГУ им. М.В.Ломоносова). Клинический диагноз установлен с учетом данных ретроспективного анализа первичной медицинской документации больных, цито- и гистологических исследований биоптатов, полученных при цистоскопии, а также образцов тканей мочевого пузыря, полученных после трансуретральной резекции и операционного материала. Образцы тканей мочевого пузыря (опухоль, условно-нормальная ткань) получены непосредственно после удаления опухоли. Каждый образец хранят в растворе RNALater Reagent (QIAGEN), стабилизирующем молекулы РНК, при температуре -70°С. Все опухолевые образцы охарактеризованы согласно международной системе клинико-морфологической классификации опухолей ТНМ, где Т (tumor) - Т0-Т4 - категории, отражающие увеличение размера и/или местного распространения первичной опухоли, N (nodules) - N0-N3 - категории, отражающие различную степень поражения метастазами регионарных лимфатических узлов; M (metastasis) - М0-М1 - характеризует отдаленные метастазы. Все возможные комбинации ТНМ объединяют в более крупные группы - стадии, отражающие течение опухолевого процесса.
3) Выделение суммарного белка из образцов тканей мочевого пузыря.
Суммарный белок выделяют из замороженных образцов мочевого пузыря путем гомогенизации кусочков тканей, пунктатов или биоптатов в лизирующем буфере. Состав лизирующего буфера: 1XPBS (рН 7.6) буфер (1.7 mM КН2РО4 5.2 mМ Na2HPO4, 150 mМ NaCl), 8 М мочевина. Для анализа содержания исследуемого белка в крови используют фракцию плазмы. Для анализа содержания исследуемого белка в моче используют цельную мочу.
2) Для связывания антигенов (белка NUSAP1 или его фрагментов длиной свыше 8 аминокислот) с твердой фазой (носителем) проводится инкубация антигена с носителем в течение 14 часов при 4°С из расчета 100 мкл раствора антигена на ячейку в 96-луночном планшете.
3) Удаляют не связавшиеся антигены и промывают планшет 3 раза 1x PBS.
4) Блокируют неспецифичное связывание добавлением 1% BSA (100 мкл/ячейка) в 1x PBS не менее 1 часа при 37°С.
5) Удаляют BSA и промывают 3 раза 1x PBS, содержащим 0,01% твин (полисорбат).
6) Добавляют анти-сыворотку, разведенную в 1x PBS (если нужно), и инкубируют 2 часа при 37°С.
7) Промывают планшет 4 раза 1x PBS, содержащим 0,01% твин (полисорбат).
8) Добавляют конъюгат пероксидазы (или другого фермента) (50 мкл/ячейка), разведенный 1:1000 в 1% BSA, и инкубируют 1 час при 37°С.
9) Промывают планшет 4 раза 1x PBS, содержащим 0,01% твин (полисорбат).
10) Добавляют субстрат (100 мкл/ячейка).
11) Инкубируют 1-5 мин в темноте. Регистрируют изменение окраски (изменяется на синюю при протекании реакции).
12) Останавливают реакцию добавлением 25 мкл 0.1М Н2SO4/ячейка.
13) Анализируют результаты с помощью спектрофотометра при длине волны 450 нм (для тетраметилбензидинового субстрата - ТМБ).
Состав используемых буферов:
1×PBS (Phosphate-Buffered Saline):
NaCl 8 г
KCl 0.2 г
Nа2PO4 (безводный) 1.15 г
КН2РO4 (безводный) 0.2 г
dd H2O - до 100 мл.
PBS для отмывки плашек:
100 мл 1×РВS
10 мкл Твин (до конечной концентрации 0.01%)
Цитрат/ацетатный буфер (рН 6.0):
1. 500 мл 0,1 М ацетата натрия (ацетат натрия - 4,1 г, dd Н2O - до 500 мл)
2. 100 мл 0,1 М лимонной кислоты (лимонная кислота - 2,1 г, dd Н2О - до 100 мл)
Титровать раствор 1 раствором 2 до конечного рН 6.0. Хранить полученный буфер при -20°С.
Раствор ТМБ - 10 мг/мл в DMSO (хранить при 4°С).
Добавить 3 мкл H2O2 к 20 мл цитрат/ацетатного буфера. На каждые 5 мл буфера добавляется 50 мкл раствора ТМБ. При этом цвет раствора изменяется с бесцветного на синий.
7) Результаты
В результате, для всех исследованных опухолевых образцов (n=26) выявлено 6-55-кратное превышение уровня белка NUSAP1 относительно нормальных образцов ткани мочевого пузыря (n=47).
Пример 3. Определение концентрации мРНК гена NUSAP1 в моче и крови больных РМП и здоровых людей.
1) Образцы мочи и крови
Образцы крови и мочи от пациентов с диагнозом РМП, а также от здоровых доноров собраны и охарактеризованы группой сотрудников ФГУ МНИОИ им. П.А.Герцена Росмедтехнологии. Клинический диагноз установлен с учетом данных ретроспективного анализа первичной медицинской документации больных, цито- и гистологических исследований биоптатов, полученных при цистоскопии, а также образцов тканей мочевого пузыря, полученных после трансуретральной резекции и операционного материала. Кровь смешивают с раствором антикоагулянта (например, цитратом натрия, ЭДТА и др.) в соотношении 9:1 (9 частей крови и 1 часть антикоагулянта), отделяют плазму от форменных элементов крови путем центрифугирования в течение 15 минут при 1500×g и сразу же смешивают с раствором, стабилизирующим молекулы РНК (RNAlater Reagent, QIAGEN). Полученный раствор хранят при температуре -20°С. Образцы мочи смешивают с раствором RNAlater Reagent, QIAGEN, замораживают и хранят при температуре -20°С.
2) Выделение препаратов РНК из тканей
Суммарную РНК выделяют из замороженных, хранящихся в растворе RNALater Reagent (QIAGEN) образцов мочи и крови, полученных от больных и здоровых доноров, с использованием TRIZOL Reagent (Invitrogen). Основные этапы включают:
а) обработка крови и мочи лизирующим раствором, содержащим гуанидинизотиоцианат и фенол;
б) добавление хлороформа и центрифугирование в течение 10 минут при 12000×g при температуре 4°С;
в) осаждение РНК из водной фазы, образующейся после центрифугирования, путем добавления изопропилового спирта и повторного центрифугирования в течение 10 минут при 12000×g при температуре 4°С.
Далее осадок РНК после повторного центрифугирования промывают водным 75% этиловым спиртом, высушивают и растворяют в воде, очищенной от нуклеаз.
Концентрацию РНК определяют спектрофотометрически. Качество выделенной РНК проверяют электрофорезом в 1%-ной агарозе в присутствии бромистого этидия и спектрофотометрически («Nanodrop», США).
3) Реакция обратной транскрипции
На матрице РНК, выделенной, как описано в пункте 2), синтезируют одноцепочечную кДНК. Для проведения реакции обратной транскрипции берут по 1 мкг РНК, полученной одним из двух вышеописанных методов с использованием наборов реагентов Trizol Reagent (Invitrogen) или реагентов RNeasy Mini Kit (Qiagen), предварительно обработанной не содержащей РНКаз ДНКазой I (Sigma-Aldrich), и инкубируют 5 мин при 70°С, затем помещают в лед.
На каждую пробу готовят 20 мкл смеси, содержащей:
5 мM MgCl2;
1×Буфер для обратной транскриптазы AMV, содержащий 250 мМ Tris-HCl (pH 8.3, 25°С), 250 мМ КСl, 50 мМ MgCl2, 2,5 мМ спермидин и 50 мМ DTT (Promega);
100 нг гексануклеотидных праймеров;
1 мМ dNTP (Evrogen);
200 единиц обратной транскриптазы AMV (Promega).
К смеси добавляют РНК и воду до конечного объема 20 мкл и проводят реакцию при следующем температурном режиме: 25°С - 10 мин, 42°С - 60 мин, 70°С -10 мин.
4) Подбор условий определения содержания мРНК гена NUSAP1
Для ОТ-ПЦР и ПЦР-РВ используют одинаковые праймеры NUSAP1_F (SEQ ID NO: 1) и NUSAP1_R (SEQ ID NO: 2), специфичные для разных экзонов гена NUSAP1, при их молярном соотношении 1:1, причем один из праймеров перекрывает границу между экзонами. Размер ампликона - 232 п.н.
Последовательности выбранных праймеров для контрольного гена: SEQ Ю NO 3-4, размер ампликона - 145 п.н.
Для проведения ПЦР-РВ подбирают оптимальные концентрации праймеров исследуемого и контрольного генов.
5) Количественная оценка содержания мРНК гена NUSAP1
Для количественных измерений используют прибор Stratagene MX3000P (США).
Протокол определения содержания мРНК методом ПЦР-РВ с использованием набора «Комплект реагентов для проведения ПЦР-РВ в присутствии SYBR Green I» или «Комплект реагентов для проведения ПЦР-РВ в присутствии EVA Green» (Синтол, Россия):
1. Готовят реакционные смеси для генов NUSAP1 и АСТВ, осторожно смешав все компоненты реакции, кроме матрицы (кДНК), из расчета 1 реакция объемом 25 мкл для каждого образца +1 дополнительная реакция по 25 мкл.
2. В 0,2 мл пробирки, предназначенные для ПЦР-РВ, добавляют по 23 мкл приготовленных реакционных смесей без матрицы.
3. Вносят по 2 мкл матрицы, плотно закрывают пробирки крышками.
4. Помещают пробирки в приборное отделение, задают названия ячеек, температурный режим для 35 циклов: 95°С - 5 мин - денатурация и активация фермента, 95°С - 20 сек - денатурация, 60°С - 20 сек - отжиг зонда и полимеризация, 72°С - 30 сек - элонгация цепей.
5. Реакции проводят в режиме относительных количественных измерений (программное обеспечение Stratagene MxPro, США).
6. После завершения реакции амплификации сохраняют данные.
7. Проводят анализ продуктов реакции с помощью гель-электрофореза в ТВЕ-буфере, содержащем 10 мг/л этидий бромида. Для этого отбирают 5 мкл продуктов амплификации (40 циклов), наносят образцы на 1.8% агарозный гель, содержащий 0.5 мг/л этидий бромида, и маркер молекулярных масс ДНК, позволяющий оценить размер продуктов амплификации (НПО «СибЭнзим»).
6) Математическая обработка данных ПЦР-РВ
Данные ПЦР-РВ переносят в виде текстового файла в Microsoft Excel и проводят математическую обработку данных. Относительное содержание мРНК гена NUSAP1-RкДНК (далее R) в опухолевых и нормальных тканях мочевого пузыря нормируют относительно содержания мРНК гена АСТВ по формуле:
R=2Λ(Ct(ACTB)-Ct(NUSAP1)) где Ct - пороговый цикл.
Интервал крайних значений R вычисляют с учетом рассчитанных отклонений Е для значений Ct:
Е=((Σ(х-хср)2)/(n-1))1/2,
где х - значения, полученные в результате измерения (число 1, число 2…),
xcp=Σx/n,
n - размер выборки (число повторов реакции).
Достоверность наблюдаемых изменений оценивают исходя из нормального распределения данных. Данные считают достоверными при Р<0.05, где Р - показатель статистической значимости данных.
7) Результаты
В результате, для всех исследованных образцов мочи и крови, полученных от больных РМП (n=26), выявлено 9-70-кратное превышение концентрации мРНК гена NUSAP1 относительно образцов мочи и крови, полученных от здоровых доноров (n=65).
Пример 4. Определение уровня белка NUSAP1 в моче и крови больных РМП и здоровых людей методом иммуноферментного анализа.
1) Образцы мочи и крови
Образцы крови и мочи от пациентов с диагнозом РМП, а также от здоровых доноров собраны и охарактеризованы группой сотрудников ФГУ МНИОИ им. П.А.Герцена Росмедтехнологии. Клинический диагноз установлен с учетом данных ретроспективного анализа первичной медицинской документации больных, цито- и гистологических исследований биоптатов, полученных при цистоскопии, а также образцов тканей мочевого пузыря, полученных после трансуретральной резекции и операционного материала. Кровь смешивают с раствором антикоагулянта (например, цитратом натрия, ЭДТА и др.) в соотношении 9:1 (9 частей крови и 1 часть антикоагулянта) и хранят при +4°С или отделяют плазму от форменных элементов крови путем центрифугирования в течение 15 минут при 1500×g и хранят при температуре -20°С. Образцы мочи замораживают и хранят при температуре -20°С.
Для анализа содержания исследуемого белка в крови используют фракцию плазмы. Для анализа содержания исследуемого белка в моче используют цельную мочу.
2) Для связывания антигенов (белка NUSAP1 или его фрагментов длиной свыше 8 аминокислот) с твердой фазой (носителем) проводится инкубация антигена с носителем в течение 14 часов при 4°С из расчета 100 мкл раствора антигена на ячейку в 96-луночном планшете.
3) Удаляют не связавшиеся антигены и промывают планшет 3 раза 1x PBS.
4) Блокируют неспецифичное связывание добавлением 1% BSA (100 мкл/ячейка) в 1x PBS не менее 1 часа при 37°С.
5) Удаляют BSA и промывают 3 раза 1x PBS, содержащим 0,01% твин (полисорбат).
6) Добавляют анти-сыворотку, разведенную в 1x PBS (если нужно) и инкубируют 2 часа при 37°С.
7) Промывают планшет 4 раза 1x PBS, содержащим 0,01% твин (полисорбат).
8) Добавляют конъюгат пероксидазы (или другого фермента) (50 мкл/ячейка), разведенный 1:1000 в 1% BSA, и инкубируют 1 час при 37°С.
9) Промывают планшет 4 раза 1x PBS, содержащим 0,01% твин (полисорбат).
10) Добавляют субстрат (100 мкл/ячейка).
11) Инкубируют 5 мин в темноте. Регистрируют изменение окраски (изменяется на синюю при протекании реакции).
12) Останавливают реакцию добавлением 25 мкл 0.1М H2SO4/ячейка.
13) Анализируют результаты с помощью спектрофотометра при длине волны 450 нм (для тетраметилбензидинового субстрата - ТМБ).
Состав используемых буферов:
1×PBS (Phosphate-Buffered Saline):
NaCl 8 г
KCl 0.2 г
Na2PO4 (безводный) 1.15 г
KH2РO4 (безводный) 0.2 г
dd H2O - до 100 мл.
PBS для отмывки плашек:
100 мл 1×PBS
10 мкл Твин (до конечной концентрации 0.01%)
Цитрат/ацетатный буфер (рН 6.0):
1. 500 мл 0,1 М ацетата натрия (ацетат натрия - 4,1 г, dd H2O - до 500 мл)
2.100 мл 0,1 М лимонной кислоты (лимонная кислота - 2,1 г, dd H2O - до 100 мл)
Титровать раствор 1 раствором 2 до конечного рН 6.0. Хранить полученный буфер при -20°С.
Раствор ТМБ - 10 мг/мл в DMSO (хранить при 4°С).
Добавить 3 мкл Н2О2 к 20 мл цитрат/ацетатного буфера. На каждые 5 мл буфера добавляется 50 мкл раствора ТМБ. При этом цвет раствора изменяется с бесцветного на синий.
Результаты.
В результате, для всех исследованных образцов мочи и крови, полученных от больных РМП (n=26), выявлено 7-43-кратное превышение уровня белка NUSAP1 относительно образцов мочи и крови, полученных от здоровых доноров (n=65).
Пример 5.
Оценка эффективности проведенной терапии РМП по изменению уровня экспрессии гена NUSAP1 и/или белка NUSAP1 в моче и/или крови обследуемых пациентов.
Оценка эффективности проведенной терапии РМП проводится путем анализа содержания белка NUSAP1 и/или уровня экспрессии гена NUSAP1 в моче и/или крови больных РМП до начала лечения и после проведенной терапии способами, указанными в примерах 3 и 4. В результате, для всех обследованных пациентов (n=12) с установленным диагнозом РМП выявлено снижение уровня экспрессии гена NUSAP1 и уровня белка NUSAP1 в моче и крови в 1.5-5 раз после проведенной терапии по сравнению с исходным уровнем экспрессии данного гена или уровнем белка в моче и крови, выявленными до начала лечения. Это указывает на возможность использования настоящего изобретения при мониторинге эффективности проводимой противораковой терапии, причем анализ способами настоящего изобретения следует проводить до начала и после окончания курса лечения, а также при необходимости по ходу курса лечения. Снижение содержания мРНК гена NUSAP1 и/или белка NUSAP1 по ходу или по завершении курса лечения может свидетельствовать о положительных сдвигах при лечении. Дальнейшее повышение содержания мРНК гена NUSAP1 и/или белка NUSAP1 указывает на низкую эффективность лечения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИАГНОСТИКИ РАКА МОЧЕВОГО ПУЗЫРЯ С ПОМОЩЬЮ ОНКОМАРКЕРА TFDP1 (ВАРИАНТЫ) И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2011 |
|
RU2463354C1 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ТЕРАПИИ РАКА МОЧЕВОГО ПУЗЫРЯ ЧЕЛОВЕКА МЕТОДОМ ИММУНОФЕРМЕНТНОГО АНАЛИЗА | 2011 |
|
RU2468088C1 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ТЕРАПИИ РАКА МОЧЕВОГО ПУЗЫРЯ ЧЕЛОВЕКА МЕТОДОМ ПЦР В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2011 |
|
RU2469098C2 |
| СПОСОБ ДИАГНОСТИКИ РАКА МОЧЕВОГО ПУЗЫРЯ С ПОМОЩЬЮ ОНКОМАРКЕРА KIFC1 (ВАРИАНТЫ) И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2011 |
|
RU2470301C2 |
| СПОСОБ ДИАГНОСТИКИ РАКА МОЧЕВОГО ПУЗЫРЯ (ВАРИАНТЫ) И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2011 |
|
RU2469323C2 |
| Способ прогнозирования развития рецидива у больных с вирусом папилломы человека и немышечно-инвазивным раком мочевого пузыря | 2022 |
|
RU2800265C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ РЕЦИДИВНОГО ИНВАЗИВНОГО РАКА МОЧЕВОГО ПУЗЫРЯ | 2009 |
|
RU2393772C1 |
| СПОСОБ ДИАГНОСТИКИ СВЕТЛОКЛЕТОЧНОЙ ПОЧЕЧНОКЛЕТОЧНОЙ КАРЦИНОМЫ И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2012 |
|
RU2545998C2 |
| СПОСОБ ДИАГНОСТИКИ СВЕТЛОКЛЕТОЧНОЙ ПОЧЕЧНОКЛЕТОЧНОЙ КАРЦИНОМЫ И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2012 |
|
RU2545995C2 |
| СПОСОБЫ И НАБОРЫ, ИМЕЮЩИЕ ОТНОШЕНИЕ К ЗАХВАТУ CA-IX-ПОЗИТИВНЫХ ЭКЗОСОМ | 2018 |
|
RU2770592C2 |







Изобретение относится к области медицины. Предложен способ оценки эффективности терапии рака мочевого пузыря методом иммуноферментного анализа, включающий получение образцов мочи и крови от пациента, выделение смеси белковых компонентов мочи и крови, проведение реакции иммуноферментного анализа с моноклональными и/или поликлональными антителами и/или их фрагментами против рекомбинантного белка NUSAP1 и/или его уникальных фрагментов длиной свыше 8 аминокислот и определение содержания белка NUSAP1 в исследуемых образцах. Снижение уровня белка NUSAP1 в моче и крови в 1,5-5 раз после проведенной терапии по сравнению с исходным уровнем данного белка, выявленным до начала лечения, является показателем эффективности терапии рака мочевого пузыря. Изобретение обеспечивает эффективный способ оценки терапии рака мочевого пузыря методом иммуноферментного анализа по уровню белка NUSAP1 в моче и крови. 3 ил., 4 табл., 5 пр.
Способ оценки эффективности терапии рака мочевого пузыря методом иммуноферментного анализа, включающий получение образцов мочи и крови от пациента, выделение смеси белковых компонентов мочи и крови, проведение реакции иммуноферментного анализа с моноклональными и/или поликлональными антителами и/или их фрагментами против рекомбинантного белка NUSAP1 и/или его уникальных фрагментов длиной свыше 8 аминокислот и определение содержания белка NUSAP1 в исследуемых образцах, причем снижение уровня белка NUSAP1 в моче и крови в 1,5-5 раз после проведенной терапии по сравнению с исходным уровнем данного белка в моче и крови, выявленным до начала лечения, является показателем эффективности терапии рака мочевого пузыря.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Способ поддержания температурного режима в холодильных камерах | 1990 |
|
SU1739173A1 |
| LANDMAN J | |||
| et al | |||
| Машина для добывания торфа и т.п. | 1922 |
|
SU22A1 |
| Urology | |||
| Способ и аппарат для получения гидразобензола или его гомологов | 1922 |
|
SU1998A1 |
| НЕСТЕРОВ П.В | |||
| Роль лучевых и лабораторных методов исследования в диагностике рака мочевого пузыря | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
Авторы
Даты
2012-11-27—Публикация
2011-03-16—Подача