Область техники, к которой относится изобретение
Настоящее изобретение относится к области модификации белков, и конкретнее к усовершенствованному способу селективного присоединения водорастворимого полимера к N-концу белков или их аналогов. Конкретнее, настоящее изобретение относится к усовершенствованному способу пегилирования (PEGylation) r-metHuG-CSF, отличающемуся тем, что взаимодействие осуществляют в присутствии спирта-сахара, такого как, например, сорбит.
Предшествующий уровень техники
Белки для терапевтического применения в настоящее время доступны в подходящих формах в адекватных количествах, в основном, благодаря успехам в технологиях рекомбинантных ДНК. Доступность рекомбинантных белков снижает стимулы к усовершенствованию и химической модификации белков. Одной из задач такой модификации является защита белков. Химическое присоединение может эффективно препятствовать физическому контакту протеолитического фермента с самой главной цепью белка и таким образом предотвращать деградацию. Другие преимущества включают, в некоторых условиях, повышение стабильности и времени кругооборота терапевтического белка и уменьшение иммуногенности. Одним из таких способов, обычно используемых для модификации белков, является ковалентное присоединение водорастворимых полимеров.
Полиэтиленгликоль («ПЭГ» («PEG»)) является одной из таких химических групп, используемых при пегилировании терапевтических белковых продуктов. ПЭГ одобрило US PDA для использования в качестве среды или основы в пищевых продуктах, косметических средствах и фармацевтических препаратах, включая композиции для инъекций, местные, ректальные и назальные композиции. Молекулы, соединенные с ПЭГ, становятся нетоксичными, неиммуногенными, растворимыми в воде и многих органических растворителях, и поверхности, модифицированные присоединением ПЭГ, становятся гидрофильными и отталкивающими белки.
FDA одобрило некоторые пегилированные полипептиды в качестве терапевтических средств и дальнейшее продолжение клинических исследований. В 1990 получила одобрение пегадемаза (Adagen) для лечения тяжелого комбинированного иммунодефицита (SCID). Пегаспаргаза (Oncaspar), одобренная в 1994, содержит пегелированный фермент L-аспарагиназу, используется клинически в сочетании с химиотерапией для лечения острого лимфоцитарного лейкоза, острого лимфобластного лейкоза и хронического миелоидного лейкоза. В 2001 стал доступным пегинтерферон α2b (Peglntron) как средство для лечения гепатита С один раз в неделю. Пегинтерферон α2а (Pegasys), одобренный в 2002, используют как второе поколение, в котором разветвленный ПЭГ в 40 кД, конъюгированный через группу α-NH2 лизина и используемый как спейсер для интерферона α2а, повышает период полувыведения IFN-α2а с 9 до 77 часов. Пегилированная форма антагониста гормона роста человека, названная пегвизомант (Somavert), одобрена FDA в 2003 для лечения акромегалии. Доксил - пегилированная липосомная композиция доксорубицина - одобрен в 1995 для лечения саркомы Капоши. Пегфилграстим (Neulasta), одобренный в 2002, представляет собой пегилированную форму более раннего лекарственного средства филграстима (Neupogen), используемого для лечения нейтропении. Пегилирование используется в течение 20 лет и проявило себя как жизнеспособный фармацевтический инструмент. За это время достигнуты важные успехи в химии пегилирования в получении биомолекулярных терапевтических средств и в представлении о конъюгатах ПЭГ-биомолекула. Пегилирование в настоящее время принято как способ улучшения фармакокинетики и фармакодинамики белковых фармацевтических препаратов.
Получено множество активных ПЭГ. Сукцинимидилсукцинат мПЭГ и сукцинимидилкарбонат мПЭГ являются реагентами, используемыми и одобренными UD FDA. Реагенты имеют ограничение из-за образования слабой связи между группой ПЭГ и белком, потенциально нежелательных побочных реакций, загрязнений и ограничения низкомолекулярными ПЭГ. Вышеуказанные ограничения преодолеваются путем использования мПЭГ-пропиональдегида, который легче получить. ПЭГ-альдегиды инертны по отношению к воде и взаимодействуют в первую очередь с аминами. Инертность к воде желательна, но не только из-за эффективности хранения, получения и применения, но также из-за того, что в таком случае допускается постадийное связывание в водных средах молекул с поверхностями и молекул с молекулой. мПЭГ-альдегид имеет, по существу, все свойства идеального производного ПЭГ, т.е., способен взаимодействовать с нуклеофильными группами (типично амино) на белках и поверхностях; стабилен в водных средах и как таковой; легко получается и характеризуется и способен к сочетанию с белками без снижения активности белков.
В пат. США №5824784, принадлежащем Amgen, заявляется по существу гомогенное получение монопегилированного по N-концу G-CSF или его аналога и способ присоединения полиэтиленгликоля к молекуле G-CSF, где группа ПЭГ имеет одну альдегидную группу. В способе пегилирования заявляется взаимодействие G-CSF с полиэтиленгликолем в условиях восстановительного алкилирования при по существу кислотном рН для селективной активации альфа-аминогруппы в аминоконце G-CSF. Способ раскрывает добавление 5-кратного молярного избытка метоксиполиэтиленгликольальдегида со средней MW 6 кД при перемешивании к охлажденному (4°С) раствору rhG-SF (1 мл, 5 мг/мл) в 100 мМ растворе фосфата натрия, рН 5, содержащем 20 мМ NaCNBH3. Перемешивание реакционной смеси продолжают при той же температуре. Производное моно-мПЭГ-GCSF очищают ионообменной хроматографией с использованием колонки с сефарозой HP HiLoad 16/10 S и элюирования с линейным градиентом в течение 400 минут от 0% до 45% 20 мМ раствора ацетата натрия, рН 4, содержащего 1 М NaCl. Состав в % N-концевого моно-мПЭГ-GCSF, полученного восстановительным алкилированием, не раскрывается. Сравнительный анализ на стабильность N-концевого монопегилированного G-CSF, полученного за счет амидной связи (образованной с использованием N-гидроксисукцинимидилэфира карбоксиметилметоксиполиэтиленгликоля в качестве нуклеофила), и другого, полученного за счет аминной связи, в течение 8 недель дает 82% чистоту в отношении соединения с аминной связью между белком и мПЭГ-альдегидом. Результат является неожиданным, так. как аминная связь образует вещество со значительно меньшими агрегатами, чем вещество с амидной связью.
Настоящее изобретение раскрывает простой и усовершенствованный способ усиления эффективности процесса пегилирования путем добавления полиола формулы CnH2n+2On, где n равен 3-6, или углевода или его производного. При следовании примеру 2 в пат. США №5824784 неожиданно обнаружено, что добавление полиола формулы CnH2n+2On, где n равен 3-6, или углевода или его производного в буфер для пегилирования после обмена буфера от буфера для хранения на буфер для пегилирования и поддержания концентрации указанного полиола формулы CnH2n+2On, где n равен 3-6, или углевода или его производного в течение всего процесса пегилирования не только повышает выход пегилирования, но также приводит к образованию чистого монопегилированного r-metHuG-CSF с чистотой >80%, причем таким образом минимизируется образование агрегатов. Более того, добавление полиола формулы CnH2n+2On, где n равен 3-6, или углевода или его производного ведет к минимальному количеству непрореагировавшего r-metHuG-CSF по сравнению со способом, осуществляемым в их отсутствие. Kinstler et al. исследовали стабильность в жидкости rhG-CSF после ковалентного присоединения ПЭГ со средней молекулярной массой 6000 дальтон к N-концевому метионину, где ковалентное присоединение осуществляют или через алкилирование или через ацилирование. Пегилированные по N-концу конъюгаты rhG-CSF очищают катионообменной хроматографией. Физическая характеризация не показывает явных различий между молекулами rhG-CSF, конъюгированными по любому способу. Стабильность таких конъюгированных молекул в жидкости при повышенных температурах показывает, что основным путем разложения является агрегация. Конъюгация через алкилирование представляет существенное преимущество в сокращении приблизительно в 5 раз количества присутствующих агрегатов по сравнению с ацилированием. Поэтому предполагается, что повышенная агрегация, наблюдаемая в способе конъюгации ацилированием, может являться результатом нейтрализации заряда N-концевой α-аминогруппы rhG-CSF. Пагубное действие агрегации в парентеральных композициях терапевтических белков подтверждает важность минимизации такого типа деградации.
Агрегация белка и последующее осаждение в виде нерастворимых фибрил или аморфных преципитатов ответственны за ряд заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона и системный амилоидоз. Агрегация белков также является основным путем деградации для терапевтических белков, потенциально происходящей во время всех фаз получения, очистки, транспортировки, хранения и введения. Белковые агрегаты в парентерально доставляемых белковых композициях могут вызвать вредные реакции у пациентов, колеблющиеся от иммунных реакций до анафилактического шока. Всегда существует потребность иметь стабильные парентеральные препараты за счет минимизации образования агрегатов, влияющих на чистоту и активность белков в течение их сроков хранения.
Carpenter et al. исследовали агрегацию rhGCSF - белка, который быстро агрегирует и высаживается при рН 6,9 и 37°С. Обнаружено, что нативный rhGCSF обратимо образует димер в физиологических условиях, и что димерные частицы не выпадают в осадок в процессе необратимой агрегации. Термодинамический стабилизатор сахароза ингибирует агрегацию rhGCSF. Carpenter et al. допускают, что сахароза действует посредством снижения концентрации структурно расширяющихся частиц, в соответствии с гипотезой, что преимущественное исключение благоприятствует наиболее компактным частицам в группе нативного состояния.
Rujan et al. в исследовании, проведенном при физиологических рН и температуре, показали, что N-концевое присоединение к GCSF группы ПЭГ в 20 кД дает возможность для 1) предотвращения осаждения белка за счет придания растворимости агрегатам и 2) ослабления степени агрегации относительно GCSF.
Yun et al. раскрыли новое производное мПЭГ, содержащее реакционноспособную 1-метилпиридинийтолуол-4-сульфонатную группу, конъюгированную с rhGCSF и обычным интерфероном, для получения однородных монопегилированных белков, которые идентифицировали высокоэффективной вытеснительной хроматографией и масс-спектрометрией MALDI-TOF.
Агрегация представляет собой агломерацию белков, которая часто является необратимой при введении в физиологические жидкости, что ведет к инактивации или возросшей иммуногенности. Агрегация является известной проблемой белковых фармацевтических препаратов и может поставить под угрозу выход процесса выделения, ограничивать срок хранения, вызывать неудачу при получении и препятствовать применениям при новых успехах в доставке. Воздействие на белки сдвига, перемешивания и многих поверхностей является неизбежным и может вызывать агрегацию.
Концентрация белка является важной переменной для уменьшения интенсивности агрегации. Ожидается, что начальная конформация, связанная с реакцией, ведущей к агрегации, имеет первый порядок, но ожидается, что последующая агрегация ненативных состояний имеет второй или более высокий порядок процесса, поскольку частота коллизий изменяется с концентрацией. Поэтому ожидается, что агрегация ускоряется с возрастанием концентрации белка. Сорбит (D-глюцит) представляет собой полиол, обычно используемый в качестве эксципиента в жидких парентеральных биологических препаратах и даже в качестве пищевого подслащивающего вещества. Сорбит обеспечивает эффективную стабилизацию белков в жидком состоянии, и некоторые продаваемые на рынке биологические препараты содержат сорбит, включая Neulasta и Neupogen.
Углеводы, такие как сахароза, глюкоза, манноза и трегалоза, так же, как и многоатомные спирты, подобные глицерину, сорбиту и манниту, также часто используют для усиления растворимости белков. Такое действие, вероятно, опосредуется через комбинацию механизмов, включая эффекты преимущественной гидратации и увеличения поверхностного натяжения растворителя, а также слабые взаимодействия белков с поверхностью. Превосходная биосовместимость таких соединений придает им общую полезность с такой точки зрения, так как небольшое влияние на структуру белка и активность, как правило, заметно в присутствии высоких концентраций полиолов, в особенности, углеводов. Проблема растворимости белков во многих случаях аналогична проблеме складчатости белков в том отношении, что ответственность за явление несут весьма небольшие различия между комплексными термодинамическими состояниями. Из этого следует, что точное описание двух критических состояний, представляющих интерес, структуры гидратационной оболочки белка и природы межмолекулярных контактов в твердой фазе необходимо для количественной оценки растворимости определенной макромолекулы. Изменение растворимости с использованием внешних переменных предполагает, что только незначительные изменения растворителя или растворенного вещества будут достаточны для изменения растворимости белка. Добавление физиологически приемлемых соединений, таких как соли, сахара и аминокислоты, можно использовать для регуляции растворимости белка эмпирическим способом. Так как те же вещества иногда будут усиливать стабильность белка, правильная комбинация условий может привести к одному соединению, обеспечивающему стабилизацию, солюбилизацию и буферные свойства.
В дополнение к описанному выше, в технике уже известно использование органических растворителей для усиления эффективности пегилирования. В публикации РСТ № WO 02/28437 раскрывается жидкофазное пегилирование гормон роста высвобождающего фактора, которое позволяет получить региоселективно конъюгат GRF-ПЭГ с 1 молекулой ПЭГ, ковалентно связанной с α-аминогруппой Lys12, отличающееся тем, что реакцию осуществляют в специфически структурирующем растворителе спирте, и конкретнее, трифторэтаноле. Указанными преимуществами являются более высокие выходы и масштабируемость процесса пегилирования.
В другой публикации РСТ № WO 2008/051383 А2 раскрывается способ получения композиции веществ, включающий получение фармакологически активного пептида и конъюгирование пептида с фармакологически приемлемым ПЭГ посредством взаимодействия пептида с ПЭГ-альдегидом по свободной аминогруппе пептида в буферном растворе, включающем спиртовой сорастворитель. Использование способа особенно применимо для пегилирования пептидов, которые относительно нерастворимы в водной среде, типично, пептидов с растворимостью в воде ниже примерно 0,1-10 мг/мл. Другие преимущества включают ускорение реакции пегилирования и улучшенную эффективность пегилирования. Эффективность пегилирования путем восстановительного аминирования пептидных последовательностей дает преимущество от использования более гидрофобных спиртов, и наиболее выгодным для реакций восстановительного аминирования является усиление эффективности, предоставляемое фторсодержащими спиртами. Найденный как благоприятный % спиртов находится в интервале 30%-70%, об./об..
В WO 2008/051383 А2 приводятся примеры использования изопропилового спирта (IPA), трифторэтанола (TFE) и гексафторизопропилового спирта (HFIPA) в качестве сорастворителей для усиления эффективности пегилирования, причем показан повышенный выход продукта в случае пегилирования пептидов, родственных гену кальцитонина (CGRP), который относительно нерастворим в водной среде, типично, пептидов с растворимостью в воде ниже примерно 0,1-10 мг/мл. Продукт монопегилированный пептид определяют количественно, объединяя хроматограммы ОФ-ВЭЖХ, и результаты приводят в виде % пика продукта. Неожиданно 50% IPA и 50% TFE показывают 2,6-кратное возрастание выхода продукта с IPA и 4,1-кратное возрастание выхода продукта с TFE соответственно. Выходы реакций пегилирования для почти 42 испытанных пептидов CGRP показывают выходы продуктов реакции от примерно 50% до примерно 70% против менее 20%, показанных в отсутствие спиртового сорастворителя. В попытке солюбилизировать менее растворимый пептид и улучшить выходы конъюгатов различные спиртовые сорастворители испытывали в буферном растворе для реакции конъюгации.
Описанные выше способы известного уровня техники применимы для синтетических пептидов, полученных твердофазным пептидным синтезом или синтезом в фазе раствора. Однако жесткие условия, когда спирты используют в такой высокой концентрации, нельзя использовать для пегилирования белков. Кроме того, пегилирование осуществляют при концентрации 2 мг/мл в свободном от аминов буфере (10 мМ фосфата натрия, рН 6,0), в то время как в случае белков, подобных rhG-CSF, пегилирование следует осуществлять при концентрации, по меньшей мере, 5 мг/мл и при кислотном рН, достаточном для доведения реакции до завершения. Поэтому существенным элементом настоящего изобретения является использование неопасных добавок для повышения эффективности пегилирования, в особенности, белков. Также неотъемлемым ограничением известного уровня техники является работа с летучими и вредными спиртами, что ограничивает использование способов для крупномасштабного производства. Существенным элементом настоящего изобретения является неожиданный эффект повышения эффективности пегилирования и выхода продукта за счет добавления полиола или углевода, или его производного в буфер для пегилирования в присутствии подходящего восстановителя путем поддержания r-metHuG-CSF в растворенной форме. Другим элементом настоящего изобретения является разработка экономически эффективного и надежного в эксплуатации способа получения ПЭГ-r-metHuG-CSF в масштабе в граммовых количествах, в котором пегилирование осуществляют в буфере для хранения r-metHuG-CSF путем создания точной концентрации белка путем добавления полиола формулы CnH2n+2On, где n равен 3-6, или углевода или его производного, посредством регулирования рН реакционной среды для протекания реакции пегилирования и конъюгации мПЭГ-альдегида с r-metHuG-CSF, являющегося менее затратным по времени и устраняющим начальную стадию замены буфера. Еще одним элементом настоящего изобретения является уменьшение при использовании стехиометрического молярного отношения r-metHuG-CSF к ПЭГ от 1:5 до 1:2,5, где снижение затрат достигает 1,5 крат при сравнении со способом с использованием 5-молярного избытка реагента ПЭГ. Другим важным элементом настоящего изобретения является элюирование монопегилированного r-metHuG-CSF в присутствии полиола или углевода или его производного с использованием градиента соли в интервале 0-500 мМ и концентрирование собранного монопегилированного r-metHuG-CSF против буфера для хранения, состоящего, по существу, из полиола или углевода или его производного и неионогенного поверхностно-активного вещества, что характеризуется тем, что чистота концентрированного монопегилированного r-metHuG-CSF ≥99%.
Цель изобретения
Всегда существует необходимость иметь улучшенный и надежный способ, обеспечивающий улучшение выхода реакции пегилирования белков. Основной целью изобретения является способ улучшения выхода реакции пегилирования r-metHuG-CSF, включающий конъюгацию r-metHuG-CSF с ПЭГ-альдегидом по свободной аминогруппе в N-конце G-CSF в присутствии восстановителя в буферном растворе для пегилирования, включающем полиол формулы CnH2n+2On, где n равен 3-6, или углевод или его производное, где концентрация указанного полиола или углевода или его производного находится в интервале 0,1%-10%, мас./мас.. Другой целью изобретения является способ получения ПЭГ-r-metHuG-CSF в масштабе в граммовых количествах, включающий конъюгацию r-metHuG-CSF с ПЭГ-альдегидом по свободной аминогруппе в N-конце г-metHuG-CSF в присутствии восстановителя в буферном растворе для хранения, включающем полиол формулы CnH2n+2On, где n равен 3-6, или углевод или его производное, причем усовершенствованием является конъюгация r-metHuG-CSF с ПЭГ-альдегидом в буферном растворе для хранения, имеющем молярность в интервале 10 мМ-50 мМ, включающем полиол формулы CnH2n+2On, где n равен 3-6, или углевод или его производное, за счет устранения стадии замены буфера на буфер для пегилирования. Еще одной целью изобретения является способ получения ПЭГ-r-metHuG-CSP в масштабе в граммовых количествах, включающий конъюгацию r-metHuG-CSF с ПЭГ-альдегидом по свободной аминогруппе в N-конце r-metHuG-CSF в присутствии восстановителя в буферном растворе для хранения, имеющем молярность в интервале 10 мМ - 50 мМ, включающем полиол формулы CnH2n+2On, где n равен 3-6, или углевод или его производное, отличающийся тем, что ПЭГ-альдегид добавляют в стехиометрическом молярном отношении 2,5 относительно r-metHuG-CSF. Еще одной целью изобретения является способ получения ПЭГ-r-metHuG-CSF в масштабе в граммовых количествах, включающий конъюгацию r-metHuG-CSF с ПЭГ-альдегидом по свободной аминогруппе в N-конце в буферном растворе для хранения, включающем полиол формулы CnH2n+2On, где n равен 3-6, или углевод или его производное, выделение моно-ПЭГ-r-metHuG-CSF с использованием ионообменной хроматографии и элюирование и концентрирование собранного монопегилированного r-metHuG-CSF против буфера для хранения, имеющего молярность в интервале 10 мМ - 50 мМ, состоящего, по существу, из полиола формулы CnH2n+2On, где n равен 3-6, или углевода или его производного и неионогенного поверхностно-активного вещества, отличающийся тем, что чистота концентрированного монопегилированного r-metHuG-CSF составляет ≥99%.
Сущность изобретения
Настоящее изобретение относится к способу селективного пегилирования белков. Конкретнее, настоящее изобретение относится к способу улучшения выхода реакции пегилирования r-metHuG-CSF, включающему конъюгацию r-metHuG-CSF с ПЭГ-альдегидом по свободной аминогруппе в N-конце G-CSF в присутствии восстановителя в буферном растворе для пегилирования, включающем полиол формулы CnH2n+2On, где n равен 3-6, или углевод или его производное, где концентрация указанного полиола или углевода или его производного находится в интервале 0,1%-10%, мас./мас..
Настоящее изобретение также относится к способу получения повышенного выхода реакции пегилирования r-metHuG-CSF, где выход продукта реакции монопегилированного r-metHuG-CSF составляет, по меньшей мере, 80%.
Настоящее изобретение еще также относится к способу, при котором содержание непрореагировавшего r-metHuG-CSF составляет менее 5%, предпочтительно, менее 2%.
Настоящее изобретение также относится к способу получения монопегилированного r-metHuG-CSF с чистотой ≥99%.
Настоящее изобретение также относится к способу улучшения выхода реакции пегилирования r-metHuG-CSF, включающему конъюгацию r-metHuG-CSF с ПЭГ-альдегидом по свободной аминогруппе в N-конце G-CSF в присутствии восстановителя в буферном растворе для пегилирования, включающем полиол формулы CnH2n+2On, где n равен 3-6, или углевод или его производное, где концентрация указанного полиола или углевода или его производного находится в интервале 0,1%-10%, мас./мас..
Настоящее изобретение еще также относится к способу получения ПЭГ-r-metHuG-CSF в масштабе в граммовых количествах, включающему конъюгацию r-metHuG-CSF с ПЭГ-альдегидом по свободной аминогруппе в N-конце r-metHuG-CSF в присутствии восстановителя в буферном растворе для хранения, включающем полиол формулы CnH2n+2On, где n равен 3-6, или углевод или его производное, причем усовершенствованием является конъюгация r-metHuG-CSF в буферном растворе для хранения, имеющем молярность в интервале 10 мМ - 50 мМ, включающем полиол формулы CnH2n+2On, где n равен 3-6, или углевод или его производное, с ПЭГ-альдегидом с устранением стадии замены буфера на буфер для пегилирования.
Настоящее изобретение еще также относится к способу получения ПЭГ-r-metHuG-CSF в масштабе в граммовых количествах, включающему конъюгацию r-metHuG-CSF с ПЭГ-альдегидом по свободной аминогруппе в N-конце r-metHuG-CSF в присутствии восстановителя в буферном растворе для хранения, имеющем молярность в интервале 10 мМ - 50 мМ, включающем полиол формулы CnH2n+2On, где n равен 3-6, или углевод или его производное, отличающемуся тем, что ПЭГ-альдегид добавляют в стехиометрическом молярном отношении 2,5 относительно r-metHuG-CSF.
Настоящее изобретение еще также относится к способу получения ПЭГ-r-metHuG-CSF в масштабе в граммовых количествах, включающему конъюгацию r-metHuG-CSF с ПЭГ-альдегидом по свободной аминогруппе в N-конце в буферном растворе для хранения, включающем полиол формулы CnH2n+2On, где n равен 3-6, или углевод или его производное, выделение моно-ПЭГ-r-metHuG-CSF с использованием ионообменной хроматографии и элюирование и концентрированно собранного монопегилированного r-metHuG-CSF против буфера для хранения, имеющего молярность в интервале 10 мМ - 50 мМ, состоящего, по существу, из полиола формулы CnH2n+2On, где n равен 3-6, или углевода или его производного и неионогенного поверхностно-активного вещества, отличающемуся тем, что чистота концентрированного монопегилированного r-metHuG-CSF составляет ≥99%.
Краткое описание прилагаемых чертежей
Образ действия, с помощью которого можно достичь целей и реализовать преимущества изобретения, полнее выяснится из подробного описания и прилагаемых чертежей, описанных далее.
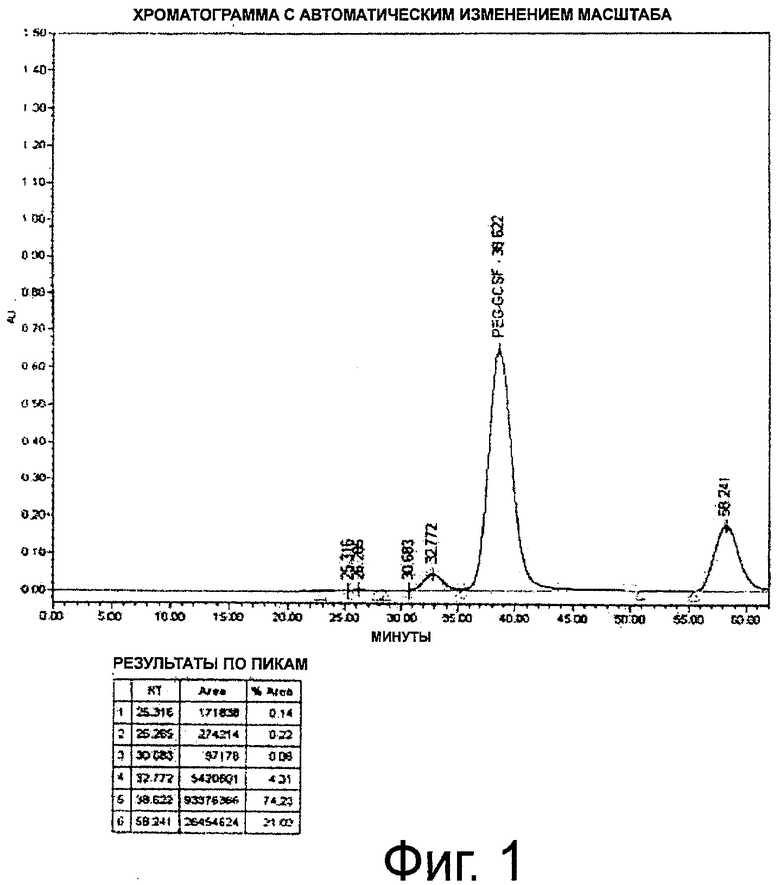
Фиг.1. Профиль 3X(SEC)-B3)KX неочищенного пегилированного r-metHuG-CSF, USV, где пегилирование осуществляют в отсутствие сорбита.
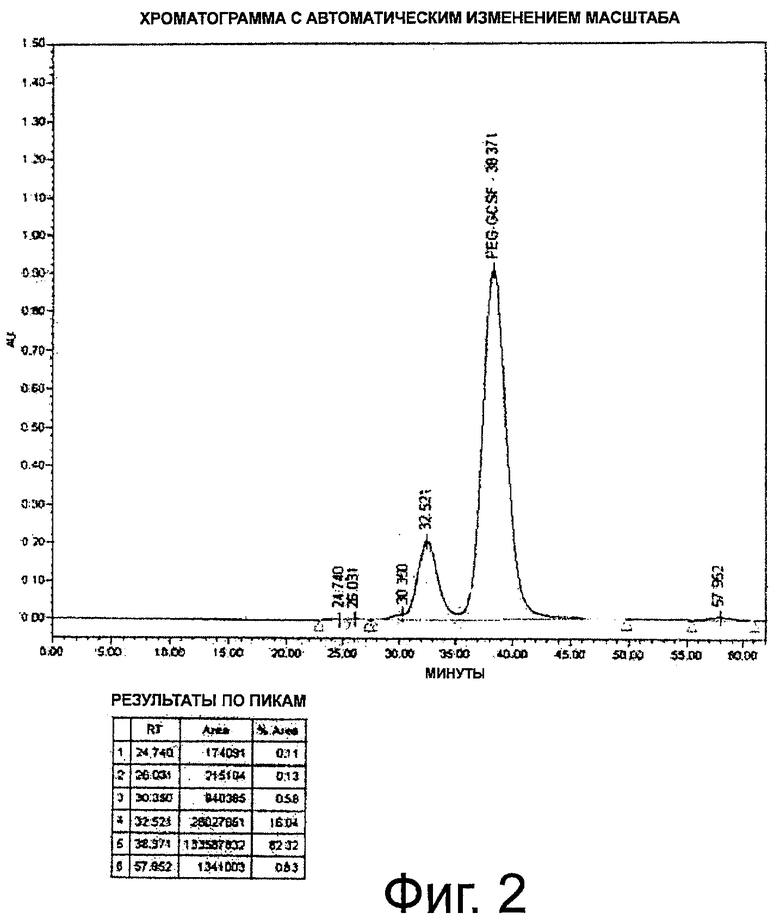
Фиг.2. Профиль ЭХ-ВЭЖХ неочищенного пегилированного r-metHuG-CSF, USV, где пегилирование осуществляют в присутствии 5% сорбита в буфере для пегилирования.
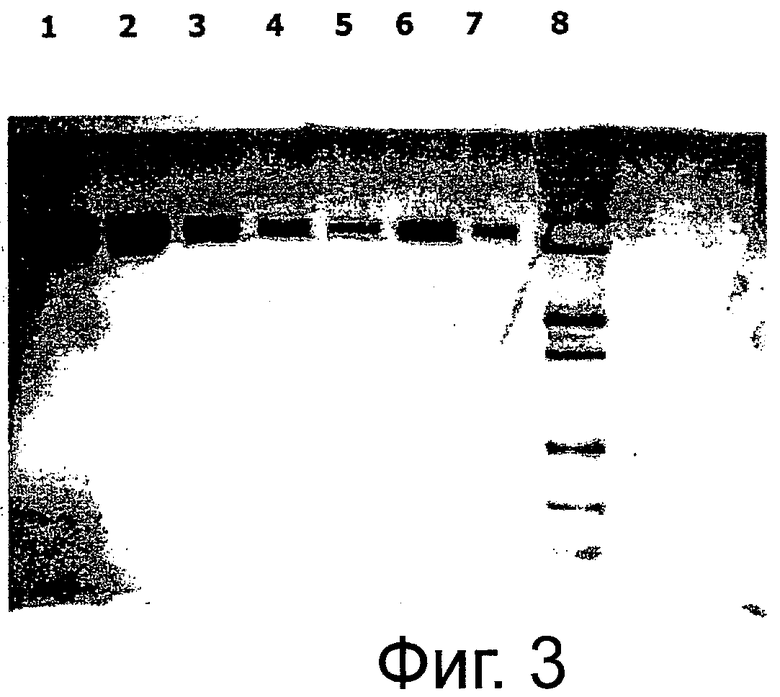
Фиг.3. Невосстанавливающий SDS-PAGE очищенного пегилированного r-metHuG-CSF, USV, при различных концентрациях; полоса 1: USV ПЭГ-GCSF (2000 нг), полоса 2: USV ПЭГ-r-metHuG-CSF (1000 нг), полоса 3: USV ПЭГ-r-metHuG-CSF (200 нг), полоса 4: USV ПЭГ-r-metHuG-CSF (40 нг), полоса 5: USV ПЭГ-r-metHuG-CSF (20 нг), полоса 6: Neulasta (200 нг), полоса 7: Neulasta (40 нг), полоса 8: белок со ступенчатой MW.
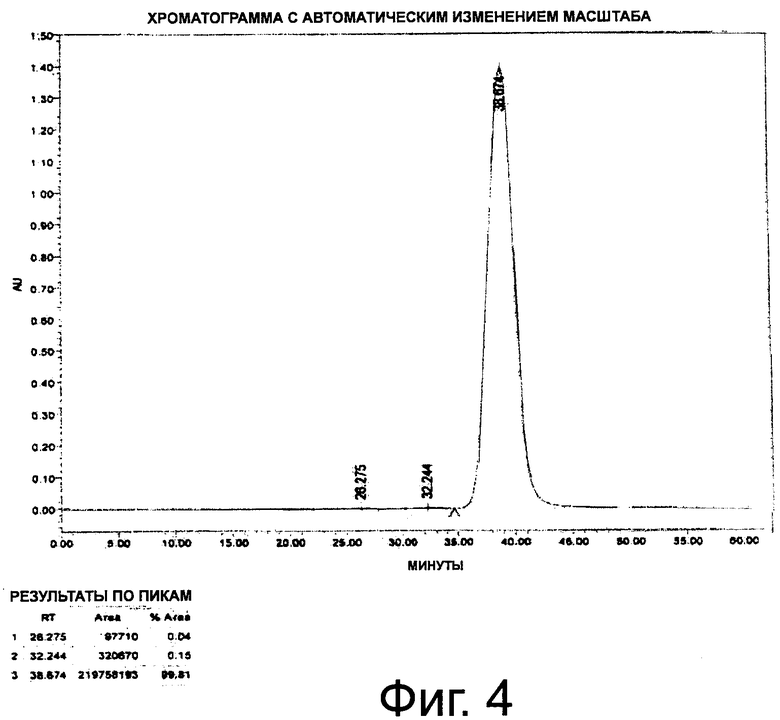
Фиг.4. Профиль ЭХ-ВЭЖХ монопегилированного r-metHuG-CSF, USV, с чистотой ≥99%.
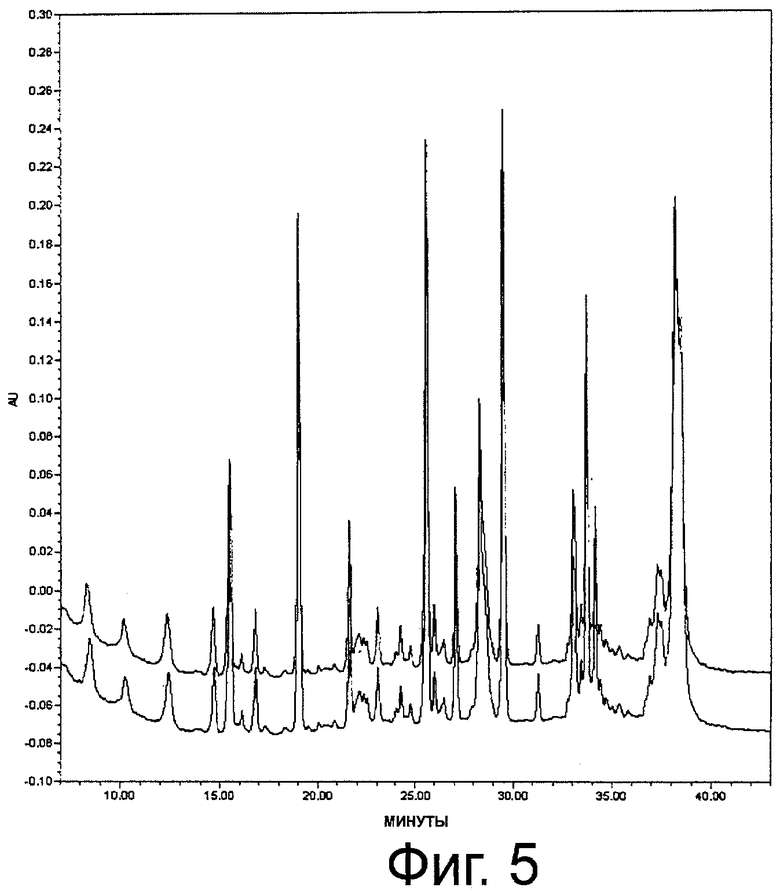
Фиг.5. Профиль ВЭЖХ пептидного картирования эндопротеазой SV8 монопегилированного r-metHuG-CSF; А: монопегилированный r-metHuG-CSF, USV, В: Neulasta.
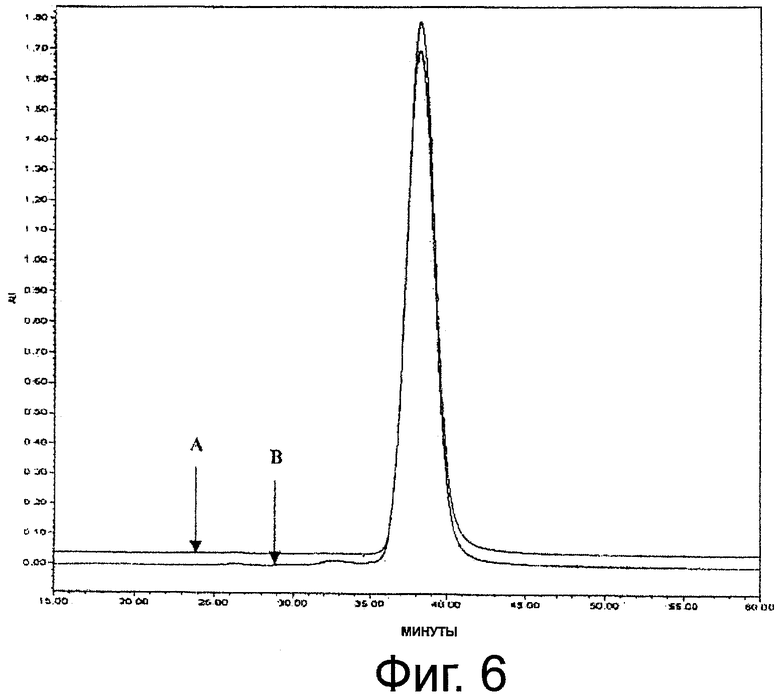
Фиг.6. Профиль ЭХ-ВЭЖХ монопегилированного r-metHuG-CSF с чистотой ≥99%; А: монопегилированный r-metHuG-CSF, USV; В: Neulasta.
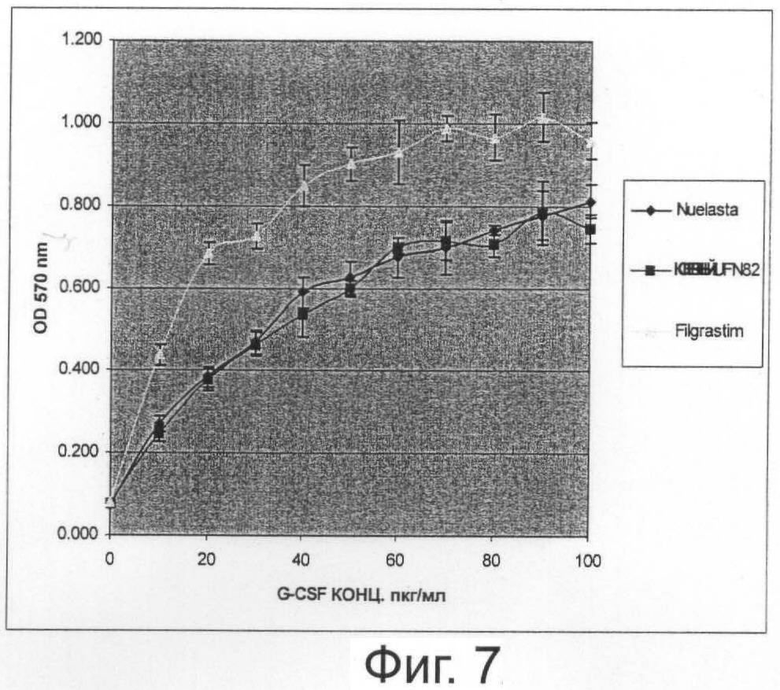
Фиг.7. График, иллюстрирующий сравнение биоактивности in vitro монопегилированного r-metHuG-CSF, USV, с Neulasta и Neupogen.
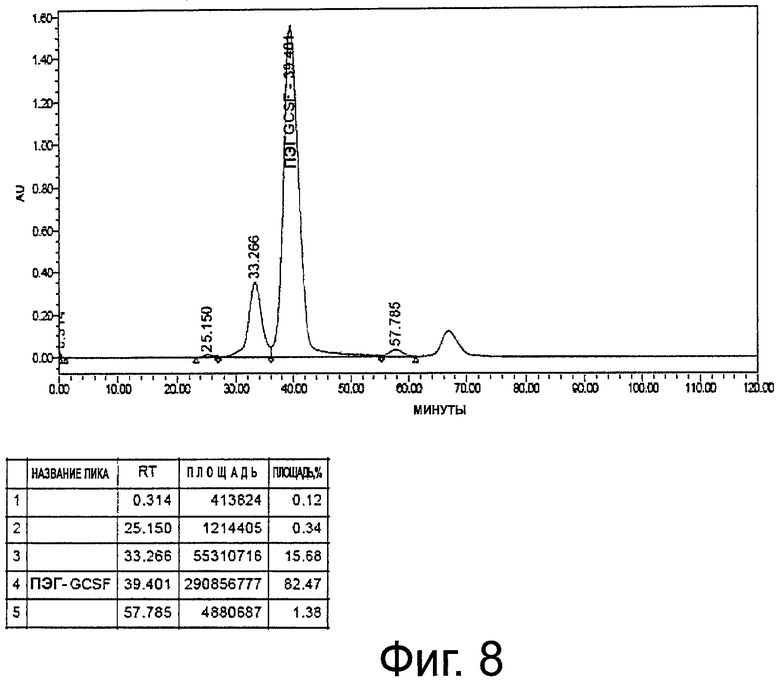
Фиг.8. Профиль ЭХ-ВЭЖХ неочищенного пегилированного r-metHuG-CSF, USV, где пегилирование осуществляют в присутствии 5% сахарозы в буфере для пегилирования.
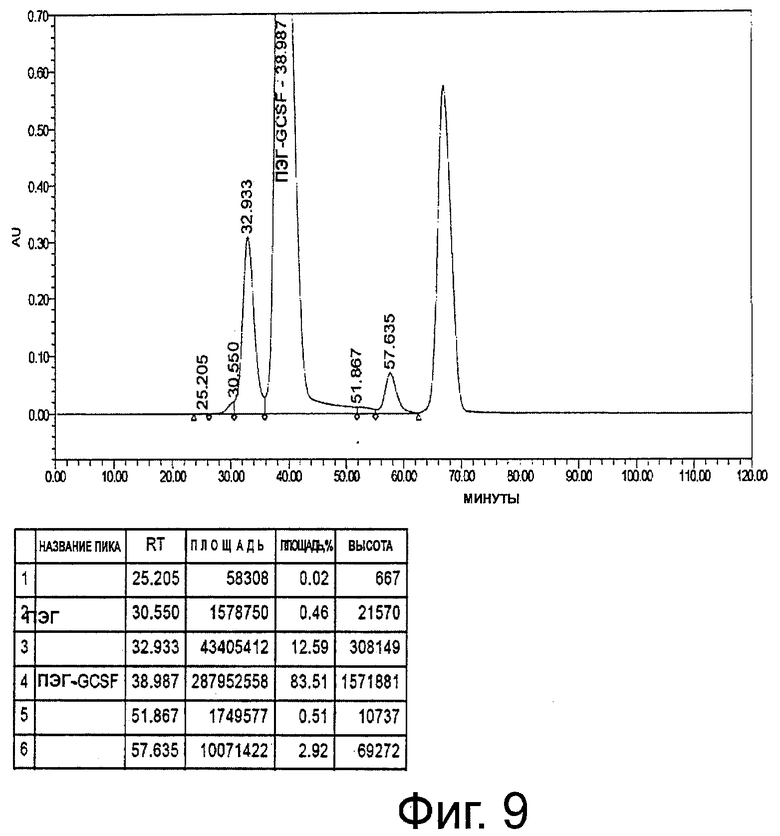
Фиг.9. Профиль ЭХ-ВЭЖХ USV неочищенного пегилированного r-metHuG-CSF B.No-0309/F (масштаб 8 г), где пегилирование осуществляют в присутствии 5% сорбита в буфере для пегилирования.
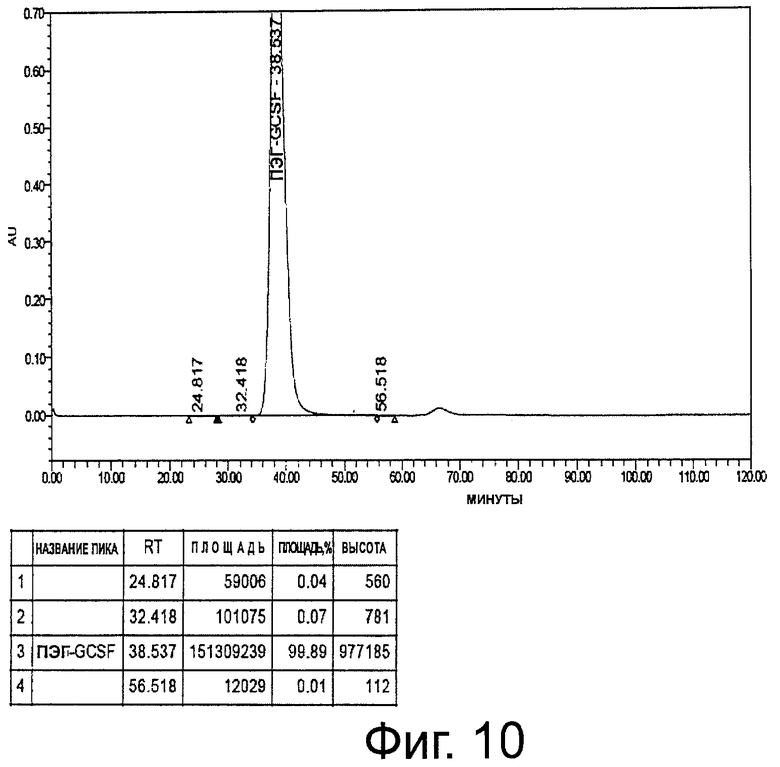
Фиг.10. Профиль ЭХ-ВЭЖХ USV монопегилированного r-metHuG-CSF с чистотой ≥99% B.No.0309/F (масштаб 8 г).
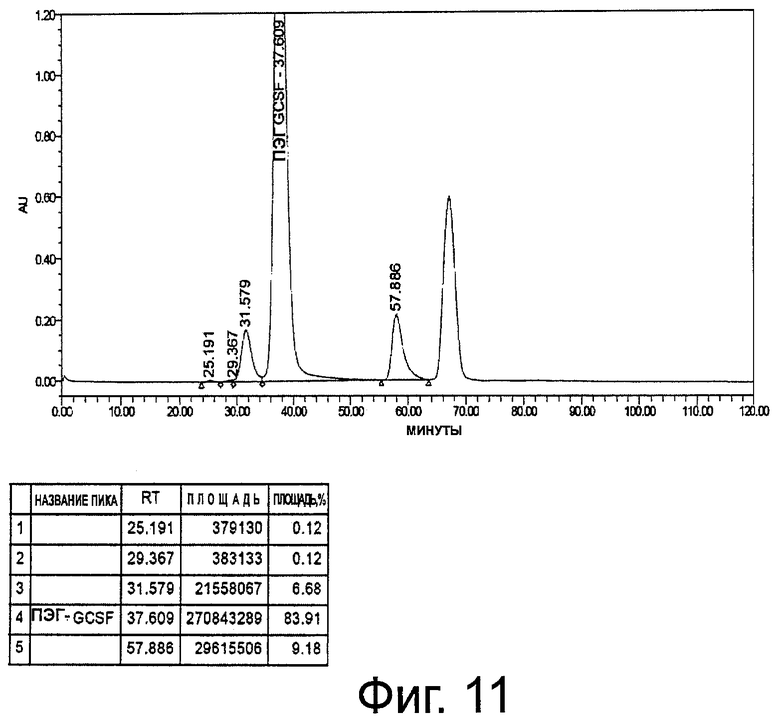
Фиг.11. Профиль ЭХ-ВЭЖХ неочищенного пегилированного r-metHuG-CSF, USV, где пегилирование осуществляют в присутствии 5% сорбита в ацетатном буфере, рН 5,0, при молярном отношении r-metHuG-CSF: мПЭГ-пропиональдегид 1:2,5.
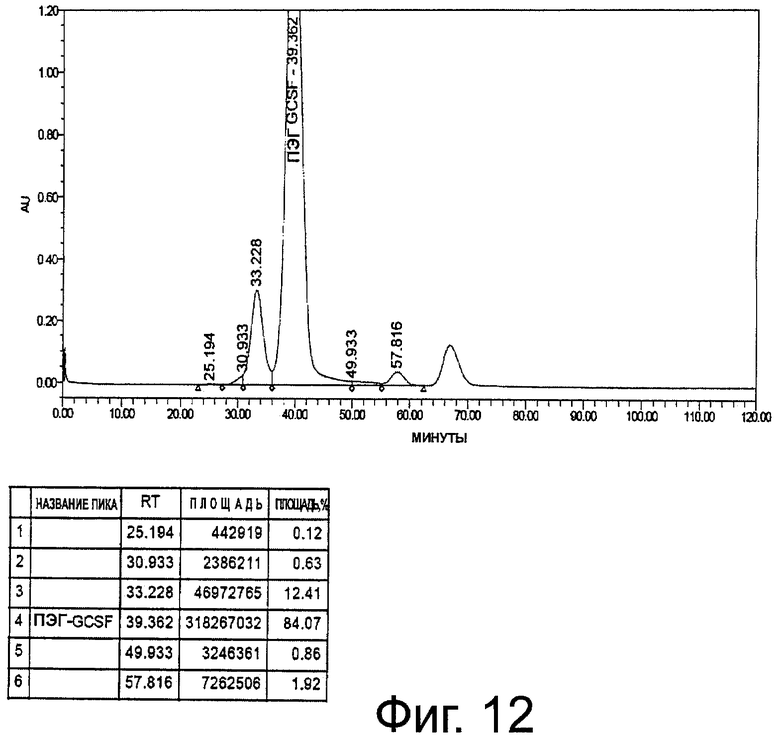
Фиг.12. Профиль ЭХ-ВЭЖХ неочищенного пегилированного r-metHuG-CSF, USV, где пегилирование осуществляют в присутствии 5% сорбита в ацетатном буфере, рН 5,0.
Подробное описание изобретения
Ковалентное присоединение полиэтиленгликоля (ПЭГ) к терапевтическому белку часто используют для увеличения периода полувыведения такого белка у пациентов, причем в то же время их иммуногенная реакция уменьшается. Сайтспецифическое пегилирование является привлекательным подходом для максимизации терапевтической ценности пегилированных лекарственных средств, поскольку такой способ дает только пегилированный изомер с оптимизированными свойствами, Аминспецифические модифицирующие агенты включают эфир ПЭГ-NHS, ПЭГ-трезилат, ПЭГ-альдегид, ПЭГ-изоцианат и некоторые другие вещества. Все они реагируют в умеренных условиях и являются весьма специфическими в отношении аминогрупп. Эфир ПЭГ-NHS вероятно является одним из более реакционноспособных агентов; однако его высокая реакционная способность может сделать реакцию пегилирования затруднительной для регулирования в крупном масштабе. ПЭГ-альдегид образует с аминогруппой имин, который затем восстанавливают до вторичного амина цианоборогидридом натрия. Цианоборогидрид натрия не восстанавливает дисульфидные связи, но этот химикат является высокотоксичным и с ним нужно осторожно обращаться, в особенности, при более низких рН, когда он становится летучим. Из-за множества остатков лизина в большинстве белков сайтспецифическое пегилирование может быть отвергнуто. Но так как реагент ПЭГ-альдегид взаимодействует с непротонированными аминогруппами, возможно направление пегилирования на аминогруппы с более низким рК посредством осуществления реакции при более низком рН. Как правило, рК альфа-аминогруппы лизиновых остатков составляет на 1-2 единицы рН меньше, чем эпсилон-аминогруппы. Пегилированием молекулы при рН 7 или ниже обычно можно добиться высокой селективности в отношении N-конца. Подход в высшей степени применим для белков, для биологической активности которых N-концевая часть, по существу, не требуется.
Одним характерным аспектом изобретения является способ улучшения выхода реакции пегилирования, включающий конъюгацию r-metHuG-CSF с ПЭГ-альдегидом по свободной аминогруппе в N-конце r-metHuG-CSF в буферном растворе для пегилирования, включающем полиол формулы CnH2n+2On, где n равен 3-6, или углевод или его производное. Неожиданно обнаружилось, что во время замены буфера концентрированного r-metHuG-CSF с концентрацией 2 мг/мл и более на буфер для пегилирования (ацетатный буфер, рН 5,0), в котором белок имеет тенденцию к выпадению в осадок, что вызывает чистую потерю 25% белка и, следовательно, приводит к пониженному выходу монопегилированного продукта, только за счет добавления в буфер для пегилирования полиола формулы CnH2n+2On, где n равен 3-6, или углевода, или его производного, результат изменяется в сторону повышения выхода пегилированного продукта и предотвращает потерю r-metHuG-CSF. Пегилированный продукт, по существу, содержит, по меньшей мере, 80% монопегилированного r-metHuG-CSF, и эффективность пегилирования составляет 98%. N-Концевой монопегилированный r-metHuG-CSF имеет чистоту, по существу, ≥99% при общем содержании примесей не более 1%.
«Буфер для пегилирования», используемый в данном описании, обозначает водные буферные растворы, полученные с любыми буферами, известными в области биохимии, которые обеспечивают буферирование от рН 4,0 до рН 6,0, с примерно рН 5, предпочтительным для осуществления сайтспецифического пегилирования r-metHuG-CSF. Такие буферы могут включать, но не ограничиваются перечисленным, ацетат, цитрат, глутамат, сорбат, сукцинат, 2-(N-морфолино)этансульфоновую кислоту (MES) или фосфат. Применимые концентрации буфера могут колебаться от 5 мМ до 100 мМ.
«Полиол» в данном описании обозначает любой полиол, выбранный из группы спиртов, полученных из углеводов, с, по меньшей мере, тремя атомами углерода. Полиолы имеют общую формулу CnH2n+2On, где n равен 3-6.
Полиолы включают, но не ограничиваются перечисленным, сорбит, маннит, эритрит, глицерин, ксилит и рибит. В определенном воплощении изобретения полиол добавляют в буфер для пегилирования в количестве 0,1%-10%, мас./мас., в частности в количестве 0,5%-5%, мас./мас.. Предпочтительно выбранный полиол также представляет собой полиол, используемый для стабилизации r-metHuG-CSF, а также композиции ПЭГ-r-metHuG-CSF.
Термин «углеводы», используемый в данном описании, обозначает любые углеводы с четырьмя или более атомами углерода, предпочтительно, 4-6 атомами углерода. В частности, предпочтительным является моносахарид, выбранный из группы, состоящей из глюкозы, фруктозы, маннозы и галактозы, или дисахарид, выбранный из группы, состоящей из лактозы, мальтозы, трегалозы и сахарозы. В определенном воплощении изобретения углевод добавляют в буфер для пегилирования в количестве 0,1%-10%, мас./мас., в частности в количестве 0,5%-5%, мас./мас..
Термин «производные», используемый в данном описании, обозначает производные, включающие метилгликозиды, глюкуроновые кислоты, аминосахара или N-ацетилглюкозамины.
«Буфер для хранения» обозначает любые водные буферные растворы, полученные с любыми буферами, известными в области биохимии, которые обеспечивают буферирование от рН 4,0 до рН 6,0, причем с примерно рН 5 предпочтительно использовать в качестве водного носителя для хранения r-metHuG-CSF, а также ПЭГ-r-metHuG-CSF. Такие буферы могут включать, но не ограничиваются перечисленным, ацетат, цитрат, глутамат, сорбат, сукцинат, 2-(N-морфолино)этансульфоновую кислоту (MES) или фосфат. Применимые концентрации буфера могут колебаться от 5 мМ до 100 мМ.
Термин «выход пегилированного продукта», используемый в данном описании, обозначает весь образовавшийся пегилированный продукт, включая монопегилированный и более высокомолекулярные димеры и агрегаты, определенные ЭХ-ВЭЖХ.
Термин «выход монопегилированного продукта», используемый в данном описании, обозначает содержание монопегилированного продукта, определенное ЭХ-ВЭЖХ.
Термин «непрореагировавший r-metHuG-CSF», используемый в данном описании, обозначает белок r-metHuG-CSF, который не прореагировал с ПЭГ-альдегидом.
Термин «r-metHuG-CSF», используемый в данном описании, обозначает рекомбинантный метионил-(колониестимулирующий фактор гранулоцитов человека) (G-CSF) - белок из 175 остатков, вырабатываемый Escherichia coli.
Термин «ПЭГ-r-metHuG-CSF», используемый в данном описании, обозначает пегилирование (продукт пегилирования) r-metHuG-CSF по N-концевому метионину реагентом ПЭГ-альдегидом с использованием восстановительного алкилирования в присутствии восстановителя в условиях, достаточных для осуществления пегилирования по N-концу.
Термин «выход реакции пегилирования», используемый в данном описании, обозначает общее количество белка, превращенного в пегилированные конъюгаты, включая смесь монопегилированного, более в.-м. димеров и агрегатов, определенных эксклюзионной ВЭЖХ.
Термин «масштаб в граммовых количествах», используемый в данном описании, обозначает осуществление пегилирования белка в масштабе, по меньшей мере, один грамм и более.
В другом аспекте настоящее изобретение относится к способу максимизации количества монопегилированного продукта, получаемого во время реакции пегилирования, причем в то же время минимизируются затраты, связанные с получением монопегилированного продукта, за счет устранения осаждения белка во время концентрирования и впоследствии, во время пегилирования, за счет только добавления полиола формулы CnH2n+2On, где n равен 3-6, или углевода или его производного перед концентрированием и впоследствии, во время замены буфера на буфер для пегилирования, где выход пегилированного продукта составляет 98% и выход монопегилированного продукта составляет, по меньшей мере, 80% против выхода пегилированного продукта 80% и выхода монопегилированного продукта 74,33% в случае контроля.
Другим аспектом настоящего изобретения является минимизация воздействия на затраты на грамм монопегилированного r-metHuG-CSF. При оптимизации способа получения белкового лекарственного средства имеются три основных соображения: высокое качество продукта (чистота, стабильность и активность), эксплуатационная надежность способа и низкая стоимость. Снижение стоимости является критическим фактором во время увеличения масштаба процесса до масштаба в граммовых количествах. Возможные вопросы во время эффективного увеличения масштаба процесса пегилирования включают большие обрабатываемые объемы при низких концентрациях белка. Поэтому концентрацию белка перед пегилированием добавляют к стоимости производства. Нельзя избежать расходов, связанных с использованием ультрафильтрации (UF) или диафильтрации (DF) или тангенциальной проточной фильтрации (TFF) для концентрирования белка. Но если устранить другие дополнительные расходы, привносимые от диафильтрации продукта до замены буфера на буфер для пегилирования, содержащий восстановитель, можно значительно уменьшить расходы на пегилирование. Также в уровне техники хорошо известно, что r-metHuG-CSF в более высокой концентрации весьма нестабилен и имеет изначальную склонность выпадать в осадок. Следовательно, предпочтительна быстрая реакция пегилирования для того, чтобы избежать нестабильности высокой концентрации белка, который нуждается в стабилизаторе и повторном образовании связей S-S, включая поверхностный Cys.
Поэтому необходимым аспектом изобретения является полное устранение второй стадии диафильтрации, причем посредством этого устраняется замена буфера на буфер для пегилирования только добавлением мПЭГ-альдегида к буферу для хранения в присутствии восстановителя, когда неожиданно обнаружено, что выход монопегилированного r-metHuG-CSF составляет еще ≥80%. Изобретение предусматривает использование ацетатного буфера, рН 5,0, который также является буфером для хранения для Neupogen, а также Neulasta. Таким образом, настоящее изобретение относится к упрощенному способу пегилирования за счет только добавления реагента мПЭГ-альдегида и цианоборогидрида натрия к коммерчески доступной композиции филграстима для достижения нужного эффекта.
В дополнение к вышеуказанному необходимому аспекту настоящего изобретения необходимо уменьшить влияние стоимости исходных материалов на получение монопегилированного r-metHuG-CSF путем оптимизации молярного отношения ПЭГ-альдегида к r-metHuG-CSF. В случае аминоспецифических модификаций параметры, которые рассматривают при разработке процедуры пегилирования, включают концентрацию белка, отношение ПЭГ к белку (в молярном выражении), температуру, рН и время реакции. Holtschlag et al. раскрывают способ оптимизации реакции пегилирования с использованием плана экспериментов по влиянию оптимизации отношения ПЭГ/белок рН и отношения восстановитель/белок на выход соответствующего монопегилированного продукта. Результаты показывают, что монопегилированный материал является наилучшим при следующих условиях: рН 6,74, молярное отношение для восстановителя 3,0 и отношение ПЭГ/белок 2,25 с выходом 78,7%. Однако когда принимают в расчет стоимость и доступность реагентов (кроме времени, требуемого для подгонки рН при производстве), условия, которые приводят как к наилучшему монопегилированному продукту, так и наименьшей стоимости, являются рН 7,0, молярное отношение для восстановителя 2,0 и отношение ПЭГ/белок 1,75 с выходом 72,1%. В настоящем изобретении неожиданно обнаружилось, что когда молярное отношение ПЭГ/белок уменьшают с 5:1 до 2,5:1, выход монопегилированного продукта все еще ≥80%, в то время как снижение стоимости на грамм продукта составляет 1,5 раза.
Treuheit et al. описывают разработку композиции для Neulasta (пегфилграстим), и аналитические методы, используемые для контроля за разложением во время таких исследований. Стабильность оценивают как функцию рН, концентрации белка, типа буфера, модификаторов тоничности и концентрации поверхностно-активного вещества как в условиях ускоренного, так и длительного хранения в состоянии покоя. Treuheit et al. раскрывают роль поверхностно-активных веществ в композициях в защите белков на различных потенциально дестабилизирующих поверхностях и изменении термодинамической конформационной стабильности белков. С другой стороны, использование поверхностно-активных веществ стабилизирует белок за счет минимизации агрегации, вызываемой замораживанием-оттаиванием, состоянием покоя при хранении, термическим стрессом и перемешиванием. Полисорбат 20 предпочтительнее полисорбата 80, поскольку он доступен из источников растительного происхождения.
Kinstler et al. (2002) представляют сайтнаправленный способ соединения белков с полиэтиленгликолем для получения по существу гомогенных производных ПЭГ-белок с одной цепью ПЭГ, конъюгированной с аминоконцом белка, посредством проведения восстановительного алкилирования белков ПЭГ-альдегидами при более низком рН. Рабочие примеры иллюстрируют условия, когда к раствору r-metHuG-CSF (5 мг/мл) в 100 мМ растворе ацетата натрия, рН 5,0, содержащему 20 мМ цианоборогидрида натрия, добавляют пятикратный молярный избыток мПЭГ-альдегида в 6 кД и реагенты перемешивают на ледяной бане. Степень модификации белка контролируют эксклюзионной ВЭЖХ с использованием колонки Bio-Sil SEC250-5, с элюированием раствором 100 мМ фосфата натрия, 100 мМ хлорида натрия, 10 мМ азида натрия, рН 6,8, при 1 мл/мин. По истечении 10 часов 92% белка превращается в монопегилированный конъюгат, рН доводят до 4,0 10 мМ HCl и все разбавляют 5-кратным количеством 1 мМ HCl. Конъюгат моно-мПЭГ-r-metHuG-CSF выделяют ионообменной хроматографией с использованием колонки с сефарозой HP HiLoad 16/10 SP, уравновешенной 20 мМ натрийацетатным буфером, рН 4,0, и элюируют с линейным градиентом 0-1 М NaCl.
Всегда существует потребность в разработке экономически эффективных способов пегилирования белков путем оптимизации стадий последующей обработки и концентрирования за счет сокращения потерь пегилированного белка в процессе. Другим элементом настоящего изобретения является неожиданная находка, когда во время выделения моно-ПЭГ-r-metHuG-CSF с использованием ионообменной хроматографии и элюирования указанного моно-ПЭГ-r-metHuG-CSF и дальнейшего концентрирования собранного монопегилированного r-metHuG-CSF против буфера для хранения, имеющего молярность в интервале 10 мМ - 50 мМ, с 5% сорбита или сахарозы и по существу, неионогенное поверхностно-активное вещество, получают монопегилированный r-metHuG-CSF с выходом ≥99%, как против стадии концентрирования, осуществляемой в отсутствие нейоногенного поверхностно-активного вещества.
Одним воплощением настоящего изобретения является способ улучшения выхода реакции пегилирования r-metHuG-CSF, включающий конъюгацию r-metHuG-CSF с ПЭГ-альдегидом по свободной аминогруппе в N-конце G-CSF в присутствии восстановителя в буферном растворе для пегилирования, включающем полиол формулы CnH2n+2On, где n равен 3-6, или углевод или его производное, где концентрация указанного полиола или углевода или его производного находится в интервале 0,1%-10%, мас./мас..
Вторым воплощением настоящего изобретения является способ получения ПЭГ-г-metHuG-CSF в масштабе в граммовых количествах, включающий конъюгацию r-metHuG-CSF с ПЭГ-альдегидом по свободной аминогруппе в N-конце G-CSF в присутствии восстановителя в буфере для хранения, включающем полиол формулы CnH2n+2On, где n равен 3-6, или углевод или его производное, причем усовершенствованием является конъюгация r-metHuG-CSF с ПЭГ-альдегидом в буфере для хранения, имеющим молярность в интервале 10 мМ - 50 мМ, включающем полиол формулы CnH2n+2On, где n равен 3-6, или углевод или его производное, с устранением стадии замены буфера на буфер для пегилирования.
Третьим воплощением настоящего изобретения является способ получения ПЭГ-r-metHuG-CSF в масштабе в граммовых количествах, включающий конъюгацию r-metHuG-CSF с ПЭГ-альдегидом по свободной аминогруппе в N-конце r-metHuG-CSF в присутствии восстановителя в буфере для хранения, имеющим молярность в интервале 10 мМ - 50 мМ, включающем полиол формулы CnH2n+2On, где n равен 3-6, или углевод или его производное, отличающийся тем, что ПЭГ-альдегид добавляют в стехиометрическом молярном отношении 2,5 относительно r-metHuG-CSF.
Четвертым воплощением настоящего изобретения является способ получения ПЭГ-r-metHuG-CSF в масштабе в граммовых количествах, включающий конъюгацию r-metHuG-CSF с ПЭГ-альдегидом по свободной аминогруппе в N-конце в буфере для хранения, включающем полиол формулы CnH2n+2On, где n равен 3-6, или углевод или его производное, выделение монопегилированного r-metHuG-CSF с использованием ионообменной хроматографии и элюирование и концентрирование собранного монопегилированного r-metHuG-CSF против буфера для хранения, имеющего молярность в интервале 10 мМ - 50 мМ, состоящего, по существу, из полиола формулы CnH2n+2On, где n равен 3-6, или углевода или его производного и неионогенного поверхностно-активного вещества, отличающийся тем, что чистота концентрированного монопегилированного r-metHuG-CSF составляет ≥99%.
Сведения, подтверждающие возможность осуществления изобретения
Пример 1
Концентрирование и диафильтрация (замена буфера) r-metHuG-CSF
Жидкий исходный раствор r-metHuG-CSF от USV (концентрация са 1,9 мг/мл, добавлен в 10 мМ раствор ацетата натрия, 5% сорбита, рН 4,0), который хранят при 2-8°С, делят на аликвоты. Затем раствор белка концентрируют до примерно 6-7 мг/мл. Образец разбавляют в два раза 100 мМ натрий-фосфатным буфером, рН 5,0, содержащим 20 мМ цианоборогидрида натрия и 5% сорбита. Разбавление и концентрирование с использованием того же буфера осуществляют 3 раза. Процедуру диафильтрации осуществляют при 4°С на ледяной бане. Затем концентрированный раствор хранят при 4°С или используют в реакции пегилирования. Извлечение, %, r-metHuG-CSF после замены буфера и концентрирования составляет примерно 95-97%.
Пример 2
Получение пегилированного r-metHuG-CSF
Диафильтрованный и оцененный количественно белок, полученный в примере 1, загружают в 250-мл стеклянную бутыль. К реакционной смеси добавляют буфер, состоящий из 100 мМ натрий-фосфатного буфера, рН 5,0, с 20 мМ цианоборогидрида натрия и с 5% сорбита или без сорбита. К полученному выше раствору белка при перемешивании добавляют метоксиполиэтиленгликольпропиональдегид (мПЭГ-альдегид; SUNBRIGHT ME-200AL от NOF Corp., Япония) в приблизительно 20 кД. Затем мПЭГ-альдегид переносят в бутыль, содержащую раствор белка. Поддерживают концентрацию белка 5 мг/мл. Затем реакционную смесь перемешивают при 2-8°С в течение ночи. Реакцию останавливают добавлением 40 мМ натрийацетатного буфера, рН 4,0, с 5% сорбита в буфере или без него (объем доводят до пятикратного от объема реакционной смеси) (фиг.1 и 2).
При осуществлении пегилирования в присутствии сорбита конверсия r-metHuG-CSF в процентах составляет ≥98%.
Пример 3
Очистка с использованием ионообменной хроматографии
Пегилированный r-metHuG-CSF, полученный в примере 2, загружают в слабую катионообменную колонку, что описано далее.
Система: система среднего давления АСТА UPC 100.
Пегилированный белок элюируют с градиентом с использованием буферной системы, описанной далее.
Буфер А: 40 мМ ацетата натрия в 5% сорбите, рН 4,0.
Буфер В: 40 мМ ацетата натрия, 5% сорбита, 0,5 М NaCl, рН 4,0.
Собирают фракции, содержащие моно-ПЭГ-r-metHuG-CSF (≥99%).
К указанным фракциям перед концентрированием добавляют полисорбат 20 (твин 20). Образец концентрируют и диафильтруют раствором 10 мМ ацетата натрия, 5% сорбита, твин 20. Достигают конечной концентрации >10 мг/мл с чистотой моно-ПЭГ-г-metHuG-CSF >99% (фиг.4). Таблица 1 иллюстрирует действие добавления 5% сорбита в буфер для пегилирования и последующего добавления твина 20 в буфер для хранения перед концентрированием.
тов
тов
ние
Монопегилированный r-metHuG-CSF, USV, характеризуют с использованием 1) невосстанавливающего SDS-PAGE очищенного пегилированного r-metHuG-CSF, USV (фиг.3), 2) профиля эксклюзионной хроматографии ВЭЖХ (ЭХ-ВЭЖХ) пегилированного r-metHuG-CSF, USV, с наложением профиля Neulasta (фиг.6), 3) анализа пептидного картирования (фиг.5), 4) биоанализа r-metHuG-CSF in vitro (фиг.7), 5) испытанием in vivo на мышах.
Пример 4
Биологическая активность
Используют клетки NFS-60 (ATCC CRL 1838), выращенные в RPMI+10% FBS, для анализа пролиферации клеток с ПЭГ-r-metHuG-CSF. Клетки высевают в 96-луночный планшет и инкубируют во влажной камере с 5% CO2 с монопегилированным GCSF USV в интервале концентраций 10-100 пг/мл в течение 72 часов при 37°С. В каждую лунку добавляют 5 мг/мл раствор МТТ, приготовленный в PBS. Планшеты инкубируют во влажной камере с 5% CO2 при 37°С в течение 4-5 час.
МТТ используют для количественного определения клеточной пролиферации и активации в ответ на ПЭГ-r-metHuG-CSF. Анализ основан на расщеплении желтой соли теразолия МТТ метаболически активными клетками до фиолетовых кристаллов формазана. Затем полученные кристаллы растворяют, добавляя подкисленный 25% раствор SDS.
Солюбилизированный продукт формазан количественно определяют спектрофотометрией с использованием спектрофотометра для ELISA при 570 нм. Увеличение числа живых клеток приводит к увеличению общей метаболической активности в образце. Увеличение непосредственно коррелирует с количеством образовавшихся фиолетовых кристаллов формазана, что контролируется поглощением.
Пример 5
Активность in vivo
Фармакокинетику и фармакодинамику пегилированного r-metHuG-CSF оценивают на самцах крыс Sprague Dawley. Подопытным животным вводят подкожно одну дозу (100 мкг/кг массы тела) пегилированного r-metHuG-CSF (USV). Образцы крови берут через 0, 1, 2, 4, 6, 8, 12, 24, 48, 72, 96, 120, 144, 168, 192 и 216 часов после введения дозы. Образцы крови делят на две аликвоты. Из одной аликвоты отделяют плазму и измеряют концентрацию r-metHuG-CSF ELISA с использованием коммерчески доступного набора. Вторую аликвоту крови подвергают оценке на абсолютное число нейтрофилов (ANC) -параметр для оценки фармакодинамической реакции. Монопегилированный r-metHuG-CSF (USV) имеет период полувыведения примерно 12 часов. Возрастание ANC достигает пика в 48 часов, и ANC возвращается к величинам до обработки в конце 168 часового периода.
Пример 6
Концентрирование и диафильтрация (замена буфера) r-metHuG-CSF в присутствии 5% сахарозы
Жидкий исходный раствор r-metHuG-CSF от USV (концентрация са 2,04 мг/мл), который хранят при 2-8°С, делят на аликвоты. Затем раствор белка концентрируют до примерно 6-7 мг/мл. Образец разбавляют в два раза 100 мМ натрий-фосфатным буфером, рН 5,0, содержащим 20 мМ цианоборогидрида натрия и 5% сахарозы. Разбавление и концентрирование с буфером осуществляют 3 раза. Конечная концентрация после диафильтрации составляет 6-7 мг/мл. Затем концентрированный раствор хранят при 4°С или передают на реакцию пегилирования. Извлечение, %, r-metHuG-CSF после замены буфера и концентрирования примерно количественное.
Пример 7
Получение пегилированного r-metHuG-CSF в присутствии 5% сахарозы
Диафильтрованный и оцененный количественно белок, полученный в примере 1, загружают в 250-мл стеклянную бутыль. К реакционной смеси добавляют буфер, состоящий из 100 мМ натрий-фосфатного буфера, рН 5,0, с 20 мМ цианоборогидрида натрия и с 5% сахарозы или без сахарозы. К полученному выше раствору белка при перемешивании добавляют метоксиполиэтиленгликольпропиональдегид (мПЭГ-альдегид; SUNBRIGHT ME-200AL от NOF Corp., Япония) в приблизительно 20 кД. Затем мПЭГ-альдегид переносят в бутыль, содержащую раствор белка. Поддерживают концентрацию белка 5 мг/мл. Затем реакционную смесь перемешивают при 2-8°С в течение ночи. Реакцию гасят добавлением 40 мМ натрийацетатного буфера, рН 4,0, с 5% сахарозы в буфере (объем доводят до пятикратного от объема реакционной смеси) (фиг.8).
Пример 8
Пегелирование в масштабе 8 граммов
A) Концентрирование и диафильтрация
Концентрируют 8 г филграстима API до 1,6 л с использованием кассеты 5-kDA. Концентрированный раствор белка диафильтруют против 100 мМ натрий-фосфатного буфера, рН 5,0, +5% сорбита. После диафильтрации раствор белка собирают в 2-л бутыль. Содержание белка оценивают с использованием УФ 280 нм.
B) Пегилирование
Концентрированный TFF раствор белка доводят до 5,5 мг/мл с использованием описанного выше буфера для диафильтрации. Затем раствор белка приводят к 5°С при перемешивании. Как только температура реакционной смеси становится ниже 7°С добавляют 5,2 г метоксиполиэтиленгликольпропиональдегида на каждый грамм белка. Добавляют 111 мл 200 мМ исходного раствора цианоборогидрида натрия на литр раствора белка для достижения 20 мМ композиции. Реакцию пегилирования осуществляют в течение 16 час при 5°С при перемешивании.
Моно-ПЭГ-r-metHuG-CSF после 16 часов взаимодействия составляет более 80% (фиг.9). По завершении реакцию останавливают, разбавляя реакционную смесь в 4 раза (об./об.) 50 мМ натрийацетатным буфером, рН 4,0, +5% сорбита, при 10°С.
C) Ионообменная хроматография
Уравновешивают 1,6 л сефарозного матрикса СМ-НР - насадку в колонке Quickscale 100 50 мМ натрийацетатным буфером, рН 4,0, +5% сорбита, при 10°С. Раствор пегилированного белка перед загрузкой разбавляют водой до достижения проводимости менее 3 мСм/см. После загрузки колонку сначала промывают буфером для уравновешивания и затем элюируют белок с использованием линейного градиента в интервале 0-500 мМ хлорида натрия. Белковые фракции с чистотой мономера более 99% собирают вместе для следующей стадии.
D) Концентрированно и диафильтрация
Добавляют 10 мл основного раствора твина 20 (3,3 мг/мл) на литр собранной фракции. Затем собранные фракции концентрируют с помощью кассеты 10 kDa до 2 мг/мл и затем диафильтруют против 10 мМ ацетатного буфера (рН 4,0)+5% сорбита + 0,0033% твина 20. После диафильтрации раствор белка концентрирован до более 10 мг/мл. Затем концентрированный раствор белка фильтруют через капсульный фильтр 0,2 мкм и достигают концентрации более 10 мг/мл и чистоты мономера более 99% (фиг.10).
Пример 9
Концентрирование, диафильтрация и пегилирование в ацетатном буфере (рН 4,0)
Концентрируют r-metHuG-CSF API в 20 мМ ацетатном буфере (рН 4,0) до 5,5 мг/мл. Затем доводят рН до 5,0 с использованием 2 М раствора ацетата натрия, рН не подогнан. Реакцию пегилирования, ионообменную хроматографию и Концентрирование выполняют так, как в процедурах примера 8 (фиг.12).
Пример 10
Концентрирование, диафильтрация и пегилирование в ацетатном буфере (рН 4,0) при отношении белок:мПЭГ-альдегид 1:2,5
Добавляют на грамм белка 2,6 г метоксиполиэтиленгликольпропиональдегида вместо 5,2 г и осуществляют реакцию в течение 20 часов. Выход моно-ПЭГ-r-metHuG-CSF в 20 мМ ацетатном буфере, рН 5,0, составляет 80%. Реакцию пегилирования, ионообменную хроматографию и концентрирование выполняют так, как в процедурах примера 8 (фиг.11).
Хотя настоящее изобретение описывается выше в связи с предпочтительными или пояснительными воплощениями, указанные воплощения не следует рассматривать как исчерпывающие или ограничивающие изобретение. Напротив, предполагается, что изобретение перекрывает все альтернативы, модификации и эквиваленты, заключенные в его сущности и объеме, что определяется прилагаемой формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Улучшенный способ получения конъюгата физиологически активного полипептида | 2013 |
|
RU2639256C2 |
| ОЧИСТКА ПЕГИЛИРОВАННЫХ ПОЛИПЕПТИДОВ | 2008 |
|
RU2476439C2 |
| ХРОМАТОГРАФИЧЕСКИЕ СПОСОБЫ | 2008 |
|
RU2464066C2 |
| СПОСОБ ОЧИСТКИ ПЕГИЛИРОВАННОГО ЭРИТРОПОЭТИНА | 2011 |
|
RU2566267C2 |
| ПРОИЗВОДНЫЕ ПОЛИЭТИЛЕНГЛИКОЛЯ, СОДЕРЖАЩИЕ АРОМАТИЧЕСКУЮ ДИАЗОГРУППУ | 2010 |
|
RU2439091C1 |
| ПОЛИЭТИЛЕНГЛИКОЛЕВОЕ ПРОИЗВОДНОЕ ПОЛИПЕПТИДОВ НЕЙРОТРОФИЧЕСКОГО ФАКТОРА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1995 |
|
RU2136694C1 |
| ДЕНДРИМЕР-ПЭГ С ЧЕТЫРЬМЯ ВЕТКАМИ ДЛЯ КОНЪЮГИРОВАНИЯ С БЕЛКАМИ И ПЕПТИДАМИ | 2006 |
|
RU2409389C2 |
| НОВЫЙ ФУНКЦИОНАЛЬНО АКТИВНЫЙ ВЫСОКООЧИЩЕННЫЙ СТАБИЛЬНЫЙ КОНЪЮГАТ ИНТЕРФЕРОНА α С ПОЛИЭТИЛЕНГЛИКОЛЕМ, ПРЕДСТАВЛЕННЫЙ ОДНИМ ПОЗИЦИОННЫМ ИЗОМЕРОМ ПЭГ-NH-ИФН, С УМЕНЬШЕННОЙ ИММУНОГЕННОСТЬЮ, С ПРОЛОНГИРОВАННЫМ БИОЛОГИЧЕСКИМ ДЕЙСТВИЕМ, ПРИГОДНЫЙ ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ, И ИММУНОБИОЛОГИЧЕСКОЕ СРЕДСТВО НА ЕГО ОСНОВЕ | 2010 |
|
RU2447083C1 |
| КОНЪЮГАТЫ БЕЛКОВ СВЕРТЫВАНИЯ КРОВИ | 2010 |
|
RU2595442C2 |
| Сайт-специфически монопегилированные аналоги эксендина и способ их получения | 2012 |
|
RU2625015C2 |
Изобретение относится к способу улучшения выхода реакции пегилирования r-metHuG-CSF, включающему конъюгацию r-metHuG-CSF с ПЭГ-альдегидом по свободной аминогруппе в N-конце r-metHuG-CSF в присутствии восстановителя в буферном растворе для пегилирования, включающем полиол формулы CnH2n+2On, где n равен 3-6, или углевод, или его производное, где концентрация указанного полиола или углевода, или его производного находится в интервале 0,1%-10%, мас./мас. 3 н. и 12 з.п. ф-лы, 12 ил., 1 табл., 10 пр.
1. Способ улучшения выхода реакции пегилирования r-metHuG-CSF, включающий конъюгацию r-metHuG-CSF с ПЭГ-альдегидом по свободной аминогруппе в N-конце r-metHuG-CSF в буферном растворе для пегилирования, включающем углевод или его производное, в присутствии восстановителя, где углевод представляет собой моносахарид, выбранный из группы, состоящей из глюкозы, фруктозы, маннозы и галактозы, или дисахарид, выбранный из группы, состоящей из лактозы, мальтозы, трегалозы и сахарозы, и где указанное производное, выбрано из группы, состоящей из метилгликозидов, глюкуроновых кислот, аминосахаров или N-ацетилглюкозаминов.
2. Способ улучшения выхода реакции пегилирования r-metHuG-CSF, включающий конъюгацию r-metHuG-CSF с ПЭГ-альдегидом по свободной аминогруппе в N-конце r-metHuG-CSF в присутствии восстановителя в буферном растворе для пегилирования, включающем углевод или его производное, где концентрация указанного углевода или его производного находится в интервале 0,1%-10%, мас./мас., где углевод представляет собой моносахарид, выбранный из группы, состоящей из глюкозы, фруктозы, маннозы и галактозы, или дисахарид, выбранный из группы, состоящей из лактозы, мальтозы, трегалозы и сахарозы, и где указанное производное, выбрано из группы, состоящей из метилгликозидов, глюкуроновых кислот, аминосахаров или N-ацетилглюкозаминов.
3. Способ по п.1 или 2, где углевод представляет собой сахарозу.
4. Способ по п.1 или 2, где ПЭГ-альдегид представляет собой метоксиполиэтиленгликольпропиональдегид в 20 кД.
5. Способ по п.1 или 2, где восстановитель выбирают из группы, состоящей из борогидрида натрия, цианоборогидрида натрия, диметиламинборана, триметиламинборана, триацетоксиборогидрида натрия и пиридинборана.
6. Способ по п.5, где восстановитель представляет собой цианоборогидрид натрия.
7. Способ по п.1 или 2, где пегилированный r-metHuG-CSF далее подвергают ионообменной хроматографии, и монопегилированный r-metHuG-CSF элюируют с линейным градиентом 0-500 мМ соли.
8. Способ по п.1 или 2, где чистота по эксклюзионной хроматографии элюированного и собранного монопегилированного r-metHuG-CSF составляет >99%.
9. Способ по п.1 или 2, где буфер для пегилирования выбирают из группы, состоящей из ацетата, цитрата, глутамата, сорбата, сукцината, 2-(N-морфолино)этансульфоновой кислоты (MES) или фосфата с молярностью 0,5 мМ - 100 мМ.
10. Способ по п.9, где буфер для пегилирования представляет собой 100 мМ фосфатный буфер, рН 5,0, с 5% сахарозой.
11. Способ получения ПЭГ-r-metHuG-CSF в масштабе в граммовых количествах, включающий конъюгацию r-metHuG-CSF с ПЭГ-альдегидом по свободной аминогруппе в N-конце r-metHuG-CSF в присутствии восстановителя в буферном растворе для хранения, имеющем молярность в интервале 10 мМ - 50 мМ, включающем полиол формулы CnH2n+20n, где n равен 3-6, или углевод или его производное, отличающийся тем, что ПЭГ-альдегид добавляют в стехиометрическом молярном отношении 2,5 относительно r-metHuG-CSF, где указанное производное выбрано из группы, состоящей из метилгликозидов, глюкуроновых кислот, аминосахаров или N-ацетилглюкозаминов.
12. Способ по п.11, где буфер для хранения выбирают из группы, состоящей из ацетата, цитрата, глутамата, сорбата, сукцината, 2-(N-морфолино)этансульфоновой кислоты (MES) или фосфата.
13. Способ по п.12, где буфер для хранения представляет собой 20 мМ ацетатный буфер, рН 5,0, с 5% сорбита.
14. Способ по п.11, где выход пегилированного продукта монопегилированного r-metHuG-CSF составляет, по меньшей мере, 80%, предпочтительно, по меньшей мере, 95%, более предпочтительно, по меньшей мере, 98%.
15. Способ по п.14, где непрореагировавший r-metHuG-CSF составляет не более 5%, предпочтительно не более 2%.
| RU 2009105696 A, 27.08.2010 | |||
| WO 2008055972 A2, 15.05.2008 | |||
| WO 9611953 A1, 25.04.1996 | |||
| WO 2008051383 A2, 02.05.2008 | |||
| PIEDMONTE ET AL: "Formulation of Neulasta(R) (pegfilgrastim)" ADVANCED DRUG DELIVERY REVIEWS, 2007, vol.60, №1, pages 50-58 | |||
| KINSTLER О В ET AL: "CHARACTERIZATION AND STABILITY OF N-TERMINALLY PEGYLATED RHG-CSF" PHARMACEUTICAL RESEARCH, 1996, vol.13, №7, 996-1002. |
Авторы
Даты
2013-01-20—Публикация
2009-05-04—Подача