Область техники
Настоящее изобретение относится к способу изготовления конъюгата, в котором физиологически активный полипептид ковалентно связывают с константной областью иммуноглобулина при помощи непептидильного полимерного линкера, содержащего две или более альдегидных групп качестве функциональных групп. Более конкретно, настоящее изобретение относится к способу эффективного изготовления конъюгата физиологически активного полипептида, характеризующемуся решением проблем низкого выхода продукта и реагентной деформации полипептида путем регулирования употребления восстановителя при его изготовлении.
Предшествующий уровень техники
В общем, физиологически активные полипептиды легко денатурировать из-за их низкой стабильности и они легко подвергаются протеолитической деградации в крови и последующему почечному или печеночному клиренсу. Поэтому белковые лекарственные средства, содержащие физиологически активные полипептиды в качестве фармацевтических ингредиентов, требуется часто вводить пациентам с целью сохранения соответствующих уровней в сыворотке и титров. Однако такое частое введение белковых лекарственных средств, большая часть которых находится в форме инъекций, причиняет боль пациентам и имеет высокую стоимость лечения. Для решения этих проблем, много усилий было направлено на улучшение стабильности белковых лекарственных средств в сыворотке и сохранение высоких уровней лекарственных средств в крови в течение продолжительного периода времени для максимизации фармацевтической эффективности лекарственных средств. Как требование к применению в качестве длительно действующих препаратов, белковые лекарственные средства должны быть изготовлены так, чтобы иметь высокую стабильность и сохранять свои титры на достаточно высоком уровне без вытекающих иммунных ответов у пациентов.
Традиционный подход к стабилизации белков и предупреждению ферментативного расщепления и почечного клиренса заключается в химической модификации поверхности белкового лекарственного средства при помощи полимера, имеющего высокую растворимость, такого как полиэтиленгликоль (здесь и далее «ПЭГ»). Путем связывания с точно определенными или различными фрагментами белка-мишени, ПЭГ делает растворимость белка более высокой, таким образом, стабилизируя белок и предупреждая гидролиз без причинения серьезных побочных эффектов (Sada et al., J. Fermentation Bioengineering 71: 137-139).
Например, в WO 2006/076471 раскрыт способ изготовления длительно действующего натрийуретического пептида В-типа (BNP) путем конъюгирования его с PEG, который связывается с рецепторами А натрийуретического пептида (NPR-A) с инициированием синтеза cGMP (циклического гуанозинмонофосфата), понижая, таким образом, артериальное давление крови. Его используют, таким образом, в лечении застойной сердечной недостаточности. В патенте США №6924264 описан способ улучшения продолжительности действия эксендина-4 in vivo путем пегилирования его остатка лизина. Однако в таком способе, несмотря на его способность улучшать время циркуляции пептидного лекарственного средства путем увеличения молекулярной массы ПЭГ, пегилирование имеет проблемы, такие как значительно сниженные титры пептидного лекарственного средства и уменьшение выхода из-за пониженной реакционной способности пептида, так как молекулярная масса ПЭГ повышается.
В WO 02/46227 раскрыты слитые белки, в которых GLP-1 (глюкагоноподобный пептид) и эксендин-4 или их аналоги конъюгируют с человеческим сывороточным альбумином или с фрагментом (Fc) иммуноглобулина, полученным путем генетической рекомбинации. В патенте США №6756480 описан слитый белок, в котором паратиреоидный гормон (РТН) или его аналог связывают с Fc. Хотя эти способы можно оценивать в качестве решения проблем пегилирования, таких как низкий выход и неспецифичность, было показано, что их эффект в увеличении in vivo периода полувыведения целевых пептидов не бывает значительным, вопреки ожиданию, и кроме того в некоторых случаях слитые белки имеют низкие титры. Несмотря на то, что целый ряд пептидильных линкеров используют для того, чтобы максимизировать эффект увеличения периода полувыведения из сыворотки, они обладают возможностью вызывать иммунные ответы. Кроме того, пептид, имеющий дисульфидную связь, такой как BNP, имеет затруднение в практическом применении, поскольку он в высшей степени склонен вызывать неправильный фолдинг. Кроме того, пептидильный линкер с неприродным аминокислотным остатком невозможно получать посредством генетической рекомбинации.
Инсулин представляет собой пептид, секретирующийся бета-клетками поджелудочной железы у людей, и является главным в регулировании в организме уровня глюкозы в крови. Когда инсулин не секретируется должным образом или секретирующийся инсулин не действует в достаточной мере в организме, уровни глюкозы в крови невозможно контролировать, и они увеличиваются, приводя к сахарному диабету. Последний случай называют диабетом 2 типа. Случай, когда инсулин не может секретироваться из поджелудочной железы и вызывает увеличенные уровни глюкозы в крови, однако, приводит к диабету 1 типа. Пациентов с диабетом 2 типа лечат при помощи пероральных гипогликемических агентов и некоторых из них лечат инсулином. Между тем для пациентов с диабетом 1 типа главным образом требуется инъекция инсулина.
Обычно инсулиновую терапию проводят путем введения инсулина при помощи инъекции три раза в сутки после или до каждого приема пищи. Однако длительное введение инсулина три раза в сутки является болезненным и неудобным для пациентов. Было сделано много попыток для решения этих проблем. Одна стратегия, предназначенная для увеличения просачиваемости белковых лекарственных средств через биомембраны, заключается в доставке их посредством пероральной или назальной ингаляции. Однако введение посредством пероральной или назальной ингаляции значительно ниже по эффективности доставки по сравнению с инъекцией и имеет затруднение в сохранении пептидных лекарственных средств на уровне, необходимом для in vivo активности.
В качестве альтернативной стратегии, избыточное количество лекарственного средства может быть инъецировано подкожно и абсорбировано в организм отложенным способом, для того чтобы сохранять постоянным уровень в крови даже при введении один раз в сутки. Некоторые из лекарственных средств (например, лантус, Sanofi-aventis) одобрены для коммерческого применения и в настоящее время вводятся пациентам. Отдельно было проведено исследование в направлении модифицирования инсулина жирными кислотами, чтобы сделать связывание конъюгатов инсулина сильнее и продлить продолжительность действия в месте инъекции или в крови посредством комбинирования с альбумином. Некоторые из лекарственных средств (например, левемир, NovoNordisk) одобрены для коммерческого применения. Однако эти лекарственные средства вызывают боль в месте инъекции и должны быть инъецированы один раз в сутки, что по-прежнему представляет собой большую нагрузку для пациентов.
Для преодоления проблем, встретившихся в предыдущем уровне техники, авторы настоящего изобретения изготовили конъюгат, содержащий физиологически активный полипептид и константную область иммуноглобулина, которые соединяют, используя непептидильный полимер в качестве линкера, как стратегию для одновременного увеличения периода полувыведения из плазмы и in vivo продолжительности действия физиологически активного полипептида, такого как инсулин. Однако существует также потребность в способе изготовления конъюгата с высоким выходом и с высокой чистотой, так как компоненты конъюгата являются очень дорогостоящими. Имея в виду это обстоятельство, авторы настоящего изобретения разработали способ изготовления конъюгатов физиологически активного полипептида с пониженной стоимостью, высоким выходом и высокой чистотой, путем применения подходящих видов восстановителей в оптимальной концентрации в реакционном растворе во время взаимодействия для образования конъюгата, таким образом, завершая настоящее изобретение.
Описание изобретения
Техническая проблема
Цель настоящего изобретения заключается в предложении эффективного способа изготовления конъюгата, в котором физиологически активный полипептид ковалентно связан с константной областью иммуноглобулина при помощи непептидильного полимерного линкера, содержащего две или более альдегидных групп в качестве функциональных групп, отличающегося решением проблем низкого выхода продукта и реагентной деформации полипептида, путем применения подходящих видов восстановителей в оптимальной концентрации в реакционном растворе во время взаимодействия.
Решение проблемы
В одном аспекте для достижения упомянутой ранее цели в настоящем изобретении предложен способ изготовления конъюгата физиологически активного полипептида с непептидильным полимером и константной областью иммуноглобулина, включающий (1) взаимодействие непептидильного полимера, имеющего две или более альдегидных групп в качестве функциональных групп, с одним из физиологически активного полипептида или константной области иммуноглобулина в присутствии восстановителя в концентрации 1-20 мМ; и (2) взаимодействие реакционной смеси из (1) с другим из физиологически активного полипептида или константной области иммуноглобулина в присутствии восстановителя в концентрации 1-100 мМ.
Реакционная смесь может содержать конъюгат непептидильного полимера и физиологически активного полипептида или конъюгат непептидильного полимера и константной области иммуноглобулина, и/или реагенты, которые остаются непрореагировавшими. Поэтому способ по настоящему изобретению может дополнительно включать выделение конъюгата физиологически активного полипептида с непептидильным полимером или конъюгата иммуноглобулина с непептидильным полимером из реакционной смеси после стадии (1).
Термин «непептидильный полимер» при использовании здесь относится к биосовместимому полимеру, состоящему по меньшей мере из двух повторяющихся единиц, которые удерживаются вместе посредством случайной ковалентной связи, которая не является пептидной связью. Примеры непептидильного полимера, полезного в настоящем изобретении, включают полиэтиленгликоли, полипропиленгликоли, сополимеры этиленгликоля и пропиленгликоля, полиоксиэтилированные полиолы, поливиниловые спирты, полисахариды, декстраны, поливинилэтиловые эфиры, биоразлагаемые полимеры, такие как полимолочная кислота (PLA) и полимолочная-гликолевая кислота (PLGA), полимеры липидов, хитины, гиалуроновая кислота и их комбинации, с предпочтением к полиэтиленгликолю (ПЭГ). Их производные, которые хорошо известны в данной области техники, и производные, которые можно быстро получать, используя способы, известные в данной области техники, также входят в объем настоящего изобретения.
Как описано выше, непептидильный полимер может иметь две или более альдегидных групп в качестве функциональных групп. Таким образом, непептидильный полимер, указанный выше, может находиться сам по себе в форме двух- или многофункционального альдегида или, предпочтительно, содержать заместитель, имеющий альдегидную группу в своих двух или более спиртовых группах. Заместитель, имеющий альдегидную группу, может представлять собой ал кил альдегиды, такие как пропиональдегид или бутилальдегид. В одном предпочтительном воплощении непептидильный полимер может представлять собой ПЭГ с заместителем пропиональдегидом на каждом из его концов.
Недостатком традиционных пептидильных линкеров, используемых в слитых белках, сконструированных посредством способа слияния в рамке, является то, что они быстро расщепляются in vivo протеиназами, и, таким образом, не могут гарантировать пролонгирование периода полувыведения из сыворотки посредством носителя, вопреки ожиданиям. Однако в настоящем изобретении используют полимер, который является устойчивым к протеазе, и, таким образом, период полувыведения пептида из плазмы можно сохранять уровне, аналогичном таковому для носителя. Поэтому, при условии, что он является устойчивым in vivo к протеиназам, любой непептидильный полимер можно использовать в настоящем изобретении без ограничения. Молекулярная масса непептидильного полимера находится в диапазоне от 1 до 100 кДа и предпочтительно от 1 до 20 кДа. Кроме того, непептидильный полимер, который связывают с физиологически активным полипептидом, может представлять собой отдельный полимер или комбинацию разных полимеров. Кроме того, непептидильный полимер, полезный в настоящем изобретении, может иметь функциональные группы на своих двух или трех концах, которые можно связывать с физиологически активным полипептидом и константной областью иммуноглобулина. Предпочтительно, функциональные группы могут представлять собой альдегидные группы.
Конъюгация с ПЭГ, который обычно используют для получения длительно действующих композиций белковых лекарственных средств, повышает стабильность белков, несмотря на то, что ПЭГ с более высокими молекулярными массами демонстрируют более низкие реакционные способности с белками и, таким образом, уменьшают выход продукта. Так как выход продукта тесно связан со стоимостью продукта и промышленной применимостью, очень важно увеличивать выход продукта. ПЭГ с альдегидными группами в качестве функциональных групп можно связывать с аминогруппой, которая присутствует на N-конце или на боковой цепи остатка Lys физиологически активного полипептида или константной области иммуноглобулина. В связи с этим выход пегилирования может варьировать в зависимости от различных факторов, включая молярное отношение ПЭГ к белкам, концентрацию реакционных растворов, время взаимодействия, рН, температуру и так далее. В Chem. Biol. Drugs Des. 2007; 69; 132-138 описано пегилирование инсулина, выполненное при помощи 5 K альдегидов мПЭГ (монометокси ПЭГ) с выходом более 90%, путем регулирования различных факторов, включая молярные соотношения, время взаимодействий, рН и так далее. В US 2009/0252703 А1 сообщается, что добавление органического растворителя к реакционному раствору увеличивает выход пегилирования пептида. В WO 2010/089756 А2 раскрывается улучшение выхода пегилирования путем взаимодействия r-metHuG-CSF с ПЭГ в присутствии углевода.
Однако, когда непептидильный полимер, включая ПЭГ с двумя или более функциональными группами, используют в качестве линкера между двумя различными полипептидами, требуются взаимодействия с двумя или более стадиями, снижая, таким образом, общий выход. В частности наблюдали, что стадия второго взаимодействия (где физиологически активный полипептид или константную область иммуноглобулина, конъюгированные с непептидильным полимером, имеющим две или более функциональных групп, приводят во взаимодействие с константной областью иммуноглобулина или физиологически активным полипептидом, соответственно, в дальнейшем называют «реакцией связывания») проходит со значительно более низким выходом по сравнению со стадией первого взаимодействия, при котором физиологически активный полипептид или константную область иммуноглобулина приводят во взаимодействие с непептидильным полимером, имеющим две или более функциональных групп.
В настоящем изобретении продемонстрировано, что концентрация восстановителя при первом взаимодействии связана с выходом второй реакции связывания. Более высокие выходы реакции связывания наблюдали при более низких концентрациях восстановителя, более коротком времени взаимодействия и более низких температурах при первом взаимодействии.
При использовании здесь термин «восстановитель» относится к соединению, которое действует с восстановлением обратимой иминной двойной связи, образованной от взаимодействия между альдегидной группой непептидильного полимера и аминогруппы полипептидов (физиологически активный полипептид, константная область иммуноглобулина), образуя, таким образом, ковалентную связь, и предназначен для охватывания всех восстановителей, известных в данной области техники. Для цели настоящего изобретения восстановитель можно добавлять в реакционный раствор, в котором непептидильный полимер образует ковалентную связь с физиологически активным полипептидом или константной областью иммуноглобулина. При условии, что его обычно используют в данной области техники, любой восстановитель можно использовать в настоящем изобретении. Примеры восстановителя могут включать цианоборгидрид натрия, комплекс боран-пиридин, борогидрид натрия, комплекс боран-диметиламин, комплекс боран-триметиламин и триацетоксиборогидрид натрия, но не ограничиваются ими. Соответствующий восстановитель можно выбирать в зависимости от видов физиологически активного полипептида или константной области иммуноглобулина и растворителя для реакции.
Восстановитель используют для конъюгации физиологически активного полипептида или константной области иммуноглобулина с непептидильным полимером. Реакционный раствор может содержать восстановитель в концентрации 1-20 мМ для взаимодействия между физиологически активным полипептидом или константной областью иммуноглобулина и непептидильным полимером, и в концентрации 1-100 мМ для реакции связывания. Более предпочтительно, восстановитель можно использовать в концентрации 1-20 мМ для конъюгации между физиологически активным полипептидом или константной областью иммуноглобулина и непептидильным полимером и в концентрации 1-40 мМ для реакции связывания.
Реакцию конъюгации между физиологически активным полипептидом или константной областью иммуноглобулина и непептидильным полимером (взаимодействие стадии (1)) можно проводить в течение от 1 до 16 ч и при температуре от 0 до 25°С. Кроме того, реакцию связывания (взаимодействие стадии (2)) можно проводить в течение от 1 до 48 ч.
Предпочтительно, взаимодействие стадии (1) можно выполнять в течение от 1 до 16 ч при температуре от 0 до 25°С в присутствии восстановителя в концентрации от 1 до 20 мМ, в то время как взаимодействие стадии (2) можно выполнять в течение от 1 до 48 ч в присутствии восстановителя в концентрации от 1 до 40 мМ.
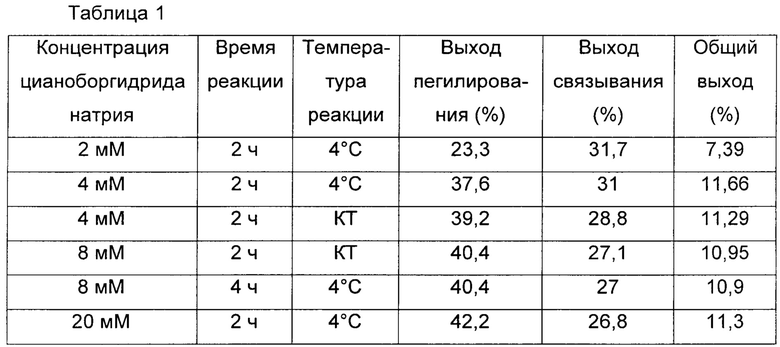
В одном предпочтительном воплощении цианоборгидрид натрия использовали в качестве восстановителя в различных условиях с целью увеличения выхода продукта, конъюгата, в котором инсулин, ПЭГ-линкер, имеющий две или более альдегидных групп в качестве функциональных групп, и константную область иммуноглобулина соединяют вместе. Обнаружили, что выход реакции связывания усиливается, когда первое взаимодействие, которое выполняют для соединения физиологически активного полипептида или константной области иммуноглобулина с непептидильным полимером, проводят в течение короткого времени при низкой температуре в присутствии восстановителя в низкой концентрации (Таблица 1).
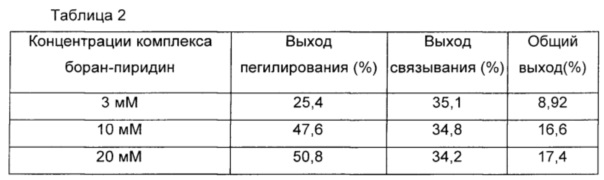
В другом предпочтительном воплощении взаимодействие выполняли при различных концентрациях восстановителя, комплекса боран-пиридин, и более высокие выходы второго взаимодействия, реакции связывания, были обнаружены после понижения концентраций восстановителя, использованного в первом взаимодействии между физиологически активным полипептидом или константной областью иммуноглобулина и непептидильным полимером. Случай, когда цианоборгидрид натрия использовали в качестве восстановителя, демонстрирует более высокие выходы по сравнению со случаем, когда использовали комплекс боран-пиридин (Таблица 2).
Кроме того, было подтверждено, что выход второго взаимодействия, реакции связывания, повышался при увеличении концентрации восстановителя.
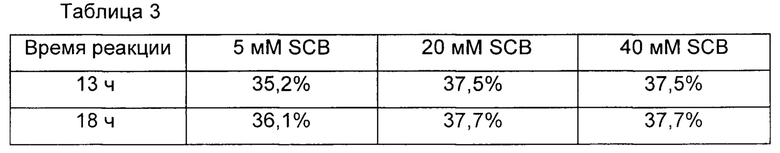
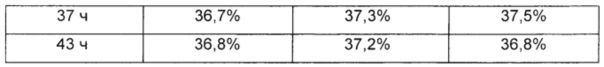
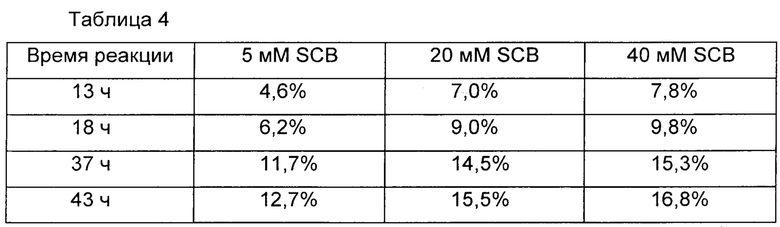
В одном предпочтительном воплощении реакцию связывания выполняли при различных концентрациях восстановителя, цианоборгидрида натрия, и улучшенные выходы реакции связывания наблюдали в присутствии высокой концентрации восстановителя. Однако очень высокая концентрация восстановителя вызывала подвергание константной области иммуноглобулина аберрации. Чтобы избежать этого, реакцию связывания выполняли в течение 13 ч в присутствии 20 мМ цианоборгидрида натрия и наблюдали, что выход реакции сохранялся на высоком уровне, и в результате аберрация константной области иммуноглобулина была минимизирована (Таблицы 3 и 4).
При использовании здесь термин «физиологически активный полипептид» относится к полипептиду, имеющему определенную физиологическую функцию in vivo в качестве общего принципа. Он имеет в целом полипептидильную структуру и демонстрирует различные биологические активности. Когда организм становится биологически аномальным в результате недостатка или избытка вещества, вовлеченного в определенную функцию, физиологически активный полипептид может регулировать генетическую экспрессию или физиологическую функцию, таким образом, корректируя нарушение. Типичным примером является белковое лекарственное средство.
Примеры физиологически активных полипептидов, которые применяют в настоящем изобретении, включают гормон роста человека, гормоны, высвобождающие гормон роста, пептиды, высвобождающие гормон роста, интерферон, рецепторы к интерферону, колониестимулирующие факторы, глюкагоноподобные пептиды (GLP-1 и так далее), оксинтомодулин, сопряженные с белком-G рецепторы, интерлейкины, рецепторы к интерлейкинам, ферменты, интерлейкин-связывающие белки, цитокин-связывающие белки, факторы, активирующие макрофаги, пептиды макрофагов, факторы В-клеток, факторы Т-клеток, белок А, ингибиторы аллергии, гликопротеины некроза клеток, иммунотоксины, лимфотоксины, фактор некроза опухоли, супрессоры опухоли, трансформирующий фактор роста, альфа-1 антитрипсин, альбумин, α-лактальбумин, аполипопротеин-Е, эритропоэтин, гликозилированный эритропоэтин, ангиопоэтины, гемоглобин, тромбин, пептиды, активирующие рецепторы тромбина, тромбомодулин, фактор крови VII, VIIa, VIII, IX и XIII, активаторы плазминогена, фибрин-связывающие пептиды, урокиназу, стрептокиназу, гирудин, белок С, С-реактивный белок, ингибитор ренина, ингибитор коллагеназы, супероксиддисмутазу, лептин, тромбоцитарный фактор роста, эпителиальный фактор роста, эпидермальный фактор роста, ангиостатин, ангиотензин, фактор роста кости, костестимулирующий белок, кальцитонин, инсулин, атриопептин, хрящевой индуцирующий фактор импульсного ответа, элкатонин, активирующий фактор соединительной ткани, ингибитор пути тканевого фактора, фолликулостимулирующий гормон, лютеинизирующий гормон, гормон высвобождения лютеинизирующего гормона, факторы роста нерва, паратиреоидный гормон, релаксин, секретин, соматомедин, инсулиноподобный фактор роста, гормон коры надпочечников, глюкагон, холецистокинин, панкреатический полипептид, гастрин-высвобождающий пептид, кортикотропинвысвобождающий фактор, тиреостимулирующий гормон, аутотоксин, лактоферрин, миостатин, антигены клеточных поверхностей, происходящие из вируса вакцинные антигены, моноклональные антитела, поликлональные антитела и фрагменты антител.
Инсулин, используемый в воплощении настоящего изобретения, представляет собой вид физиологически активных пептидов, секретирующихся из поджелудочной железы, когда уровень глюкозы в крови становится высоким, который действует для регулирования уровней глюкозы в крови, вызывая поглощение печенью, скелетными мышцами и жировой тканью глюкозы из крови и хранение ее в виде гликогена, и подавляя липолиз, метаболизм для использования жира в качестве источника энергии. Физиологически активные пептиды включают агонисты инсулина, предшественники, производные, фрагменты и варианты. Нативный инсулин, быстродействующий инсулин и длительно действующий инсулин являются предпочтительными.
Нативный инсулин представляет собой гормон, секретируемый из поджелудочной железы, и играет ключевую роль в контролировании уровней глюкозы в крови путем стимулирования клеточного поглощения глюкозы и ингибирования липолиза. Инсулин, имеющий функцию регулирования уровней глюкозы в крови, продуцируется из предшественника, проинсулина, не обладающего функцией регулирования уровней глюкозы в крови, посредством ряда процессов. Аминокислотная последовательность представляет собой следующее:
- Альфа-цепь:
Gly-Ile-Val-Glu-Gln-Cys-Cys-Thr-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn (SEQ ID NO: 1)
- Бета-цепь:
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Tyr-Thr-Pro-Lys-Thr (SEQ ID NO: 2)
Термин «агонист инсулина» при использовании здесь относится к веществу, которое может связываться in vivo с инсулиновыми рецепторами и демонстрирует такую же биологическую активность, как инсулин, независимо от структуры инсулина.
Термин «производное инсулина» при использовании здесь относится к пептиду, действия которого контролируют уровни глюкозы в крови in vivo, имеющему аминокислотную последовательность, которая имеет по меньшей мере 80% гомологии с нативным инсулином. Здесь может быть химическое замещение (например, альфа-метилирование, альфа-гидроксилирование), удаление (например, деаминирование) или модификация (например, N-метилирование, гликозилирование, жирная кислота) в тех же самых аминокислотных остатках.
При использовании здесь термин «фрагмент инсулина» относится к пептиду, имеющему функцию контролирования уровней глюкозы в крови in vivo, полученному добавлением по меньшей мере одной аминокислоты к амино- или карбоксильному концу инсулина или удалением по меньшей мере одной аминокислоты из амино- или карбоксильного конца инсулина. Добавленная аминокислота может представлять собой неприродную аминокислоту (например, D-аминокислоту).
При использовании здесь термин «вариант инсулина» относится к пептиду, имеющему аминокислотную последовательность, которая отличается от таковой нативного инсулина одним или более аминокислотными остатками, но имеющему функцию контролирования уровней глюкозы в крови in vivo.
Кроме того, способы, используемые, соответственно, для получения агонистов инсулина, фрагментов и вариантов, можно использовать независимо или в комбинации. Например, пептид инсулина, полезный в настоящем изобретении, может включать пептид, имеющий аминокислотную последовательность, которая отличается от таковой нативного инсулина одним или более аминокислотными остатками, с деаминированием на N-конечном остатке, но действующий в контролировании уровней глюкозы в крови in vivo.
При использовании здесь термин «константная область иммуноглобулина» относится к фрагменту иммуноглобулина, который не включает вариабельные области легких и тяжелых цепей, константную область 1 тяжелой цепи (CH1) и константную область легкой цепи (CL), то есть Fc-фрагмент состоит из константных областей 2 и 3 тяжелой цепи (CH2 и CH3) (или включает константную область тяжелой цепи (CH4). Возможно, Fc-фрагмент иммуноглобулина может дополнительно содержать шарнирную область. Также константная область иммуноглобулина по настоящему изобретению может представлять собой расширенный Fc-фрагмент иммуноглобулина, который содержит часть или целую константную область 1 тяжелой цепи (CH1) и/или константную область легкой цепи (CL), кроме вариабельных областей тяжелых и легких цепей иммуноглобулина, если только она показывает эффекты, по существу идентичные или превосходящие таковые нативной константной области иммуноглобулина. Кроме того, константная область иммуноглобулина по настоящему изобретению может не иметь значительной части аминокислотной последовательности, которая соответствует СН2 и/или CH3. В результате, константная область иммуноглобулина по настоящему изобретению может содержать (1) домен CH1, домен CH2, домен CH3 и домен CH4, (2) домен CH1 и домен CH2, (3) домен CH1 и домен CH3, (4) домен CH2 и домен CH3, (5) комбинацию одного или более константных доменов и шарнирной области иммуноглобулина (или неполной шарнирной области) или (6) димер каждого константного домена тяжелой цепи и константной области легкой цепи.
Константная область иммуноглобулина, включая Fc-фрагмент, представляет собой биоразлагаемый полипептид, который может быть метаболизирован in vivo, так что его можно безопасно применять в качестве носителя лекарственного средства. Кроме того, Fc-фрагмент иммуноглобулина более предпочтителен с точки зрения производства, очистки и выхода конъюгата, чем целая молекула иммуноглобулина, благодаря его относительно низкой молекулярной массе. Кроме того, так как он не содержит Fab, который демонстрирует высокую негомогенность из-за отличия аминокислотных последовательностей одного антитела от другого, только Fc-фрагмент иммуноглобулина обеспечивает конъюгат со значительно улучшенной гомогенностью и снижает возможность индуцирования антигенных свойств крови.
Константная область иммуноглобулина может иметь происхождение от людей или животных, таких как крупный рогатый скот, козы, свиньи, мыши, кролики, хомяки, крысы, морские свинки и так далее, и может иметь предпочтительно происхождение от человека. Кроме того, константная область иммуноглобулина может быть выбрана из Fc-фрагментов, полученных из IgG, IgA, IgD, IgE и IgM, или их комбинаций или их гибридов. Предпочтительно, константную область получают из IgG или IgM, которые являются наиболее часто встречающимися в крови, и наиболее предпочтительно получают из IgG, который, как известно, увеличивает периоды полувыведения из сыворотки лиганд-связывающих белков.
При использовании здесь термин «комбинация» означает, что полипептиды, кодирующие одиночные цепи константных областей иммуноглобулина (предпочтительно, Fc-фрагменты) одного и того же происхождения, связывают с одноцепочечным полипептидом другого происхождения с образованием димера или мультимера. То есть димер или мультимер можно получать комбинацией двух или более фрагментов, выбранных из группы, состоящей из фрагментов IgG Fc, IgA Fc, IgM Fc, IgD Fc и IgE Fc.
При использовании здесь термин «гибрид» означает, что последовательности, кодирующие два или более Fc-фрагментов иммуноглобулина различного происхождения, присутствуют в одноцепочечной константной области иммуноглобулина (предпочтительно, Fc-фрагменте). В настоящем изобретении возможны различные типы гибридов. Например, гибридный домен может состоять из 1-4 доменов, выбранных из группы, состоящей из CH1, CH2, CH3 и CH4 из IgG Fc, IgM Fc, IgA Fc, IgE Fc и IgD Fc, и может содержать шарнирную область.
IgG разделяют на подклассы IgG1, IgG2, IgG3 и IgG4, и настоящее изобретение может включать их комбинации или гибриды. Предпочтительными являются подклассы IgG2 и IgG4, и наиболее предпочтительным является Fc-фрагмент из IgG4, редко обладающий эффекторными функциями, такими как комплементозависимая цитотоксичность (CDC).
Константная область иммуноглобулина может иметь гликозилированную форму в той же самой степени, или в большей или меньшей степени, что и нативная форма, или может представлять собой дегликозилированную форму. Повышенное или пониженное гликозилирование или дегликозилирование фрагмента иммуноглобулина может быть достигнуто посредством обычных способов, например, посредством химического способа, ферментного способа или способа генной инженерии, использующего микроорганизмы. В данном описании изобретения, при дегликозилировании, связывание комплемента (C1q) с Fc-фрагментом иммуноглобулина становится значительно сниженным и антителозависимая цитотоксичность или комплементозависимая цитотоксичность снижается или устраняется, таким образом, не индуцируются ненужные иммунные ответы in vivo. В этом контексте, дегликозилированные или агликозилированные Fc-фрагменты иммуноглобулина являются наиболее соответствующими назначению носителей лекарственного средства. Соответственно, Fc-фрагмент иммуноглобулина, который является наиболее подходящим в качестве носителя лекарственного средства по настоящему изобретению, представляет собой агликозилированный Fc-фрагмент, полученный от IgG4 человека. Fc-фрагмент, полученный от человека, является более предпочтительным, чем Fc-фрагмент, полученный не от человека, который может действовать в качестве антигена в организме человека и вызывать нежелательные иммунные ответы, такие как образование новых антител против антигена.
Кроме того, не только константная область иммуноглобулина с нативной аминокислотной последовательностью, но также ее мутантная аминокислотная последовательность может быть включена в рамки константной области иммуноглобулина по настоящему изобретению. Термин «мутантная аминокислотная последовательность» при использовании здесь относится к полипептидам, имеющим аминокислотную последовательность, которая отличается от дикого типа в результате делеции, вставки, консервативной или неконсервативной замены одного или более аминокислотных остатков, или их комбинации. Например, аминокислотные остатки в положениях 214-238, 297-299, 318-322 или 327-331 в IgG Fc, которые, как известно, являются важными для соединения, можно использовать в качестве участков, подходящих для модификации. В настоящем изобретении можно использовать различные производные, такие как производные, полученные путем удаления участков, способных образовывать дисульфидные связи, удаление нескольких N-концевых аминокислот из нативного Fc или добавление метионина в N-конец нативного Fc. Кроме того, комплементосвязывающие участки, например, участки связывания C1q, или участки ADCC (антителозависимая клеточно-опосредованная цитотоксичность) можно исключать из нативного Fc-фрагмента для удаления эффекторной функции. Способы получения мутантных аминокислотных последовательностей константной области иммуноглобулина раскрыты в международных патентных публикациях WO 97/34631 и WO 96/32478.
Аминокислотные замены в молекуле белка или пептида, которые не изменяют активность молекулы, хорошо известны в данной области техники (H. Neurath, R.L. Hill, The Proteins, Academic Press, New York, 1979). Самые обычные замены имеют место среди аминокислотных остатков Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Thr/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu и Asp/Gly. Возможно, аминокислоты можно модифицировать путем фосфорилирования, сульфатирования, акрилирования, гликозилирования, метилирования, фарнезилирования, ацетилирования и амидирования.
Вышеупомянутые производные константной области иммуноглобулина демонстрируют такую же биологическую активность, как и константная область иммуноглобулина по настоящему изобретению, но имеют улучшенную структурную устойчивость к нагреванию, рН и так далее. Эти константные области иммуноглобулина можно получать из нативного типа, выделенного из человека или животных, таких как крупный рогатый скот, козы, свиньи, мыши, кролики, хомяки, крысы, морские свинки и так далее, или они могут представлять собой их рекомбинанты или производные, полученные из трансформированных животных клеток или микроорганизмов. Нативные константные области можно получать путем обработки протеазой всего спектра иммуноглобулинов, выделенных из образцов от человека или животного. Иммуноглобулины расщепляют на Fab и Fc папаином и на pF'c и F(ab)2 пепсином с последующей гель-хроматографией для выделения Fc или pF'c из этого.
Предпочтительной является константная область рекомбинантного иммуноглобулина человека, полученная из микроорганизма.
Предпочтительные эффекты
Как описано выше, конъюгат физиологически активного полипептида с непептидильным полимером и константной областью иммуноглобулина можно получать с высокими чистотой и выходом, а также с низкой стоимостью посредством способа по настоящему изобретению. Таким образом, способ по настоящему изобретению является полезным в промышленном отношении. Кроме того, его можно применять для создания длительно действующих композиций физиологически активных полипептидов, которые имеют улучшенный режим приема лекарственного средства.
Осуществление изобретения
Лучшее понимание настоящего изобретения может быть получено посредством следующих примеров, которые изложены для иллюстрации, но не для толкования в качестве ограничения настоящего изобретения.
ПРИМЕР 1: Пегилирование инсулина с использованием цианоборгидрида натрия в качестве восстановителя и очистка монопегилированного инсулина
Порошок инсулина растворяли в 10 мМ HCl и пегилировали на N-конце бета-цепи при помощи 3,4 K пропион-ALD2 ПЭГ (ПЭГ с двумя пропиональдегидными группами, IDB, Korea). В связи с этим, 5 мг/мл инсулина приводили во взаимодействие с ПЭГ в молярном соотношении 1:2 при температуре от 4°С до комнатной температуры (КТ) в течение 2 ч. Взаимодействие выполняли в 50 мМ натрий-цитратном буфере с рН 6,0 в 45% изопропаноле в присутствии 2-20 мМ цианоборгидрида натрия в качестве восстановителя. Реакционную смесь загружали на колонку SP-HP (GE Healthcare) с последующим элюированием буфером, содержащим цитрат натрия (рН 3,0) и 45% EtOH и использованием градиента концентрации KCl для очищения монопегилированного инсулина.
Выходы инсулина при пегилировании в соответствии с условиями применения восстановителя цианоборогидрида натрия во время изготовления конъюгата, содержащего инсулин и Fc-фрагмент иммуноглобулина, обобщены в Таблице 1, ниже.
ПРИМЕР 2: Изменения выходов конъюгата монопегилированного инсулина с Fc-фрагментом иммуноглобулина в соответствии с условиями применения цианоборгидрида натрия в качестве восстановителя в пегилировании
Для изучения выхода конъюгата инсулина с ПЭГ и Fc-фрагментом иммуноглобулина, монопегилированный инсулин, полученный в Примере 1, приводили во взаимодействие в молярном соотношении 1:1 с Fc-фрагментом иммуноглобулина при 25°С в течение 13 ч, с заданной концентрацией общего белка 20 мг/мл. Эту реакцию связывания выполняли в 100 мМ буфере HEPES (N-2-гидроксиэтилпиперазин-N-2-этансульфоновая кислота), содержащем 22 мМ фосфата калия и 10% этанола, с рН 8,2 в присутствии 20 мМ цианоборгидрида натрия в качестве восстановителя.
Реакционную смесь загружали на колонку Source 15Q (GE Healthcare) с последующим элюированием буфером Трис-HCl (рН 7,5) и использованием градиента концентрации NaCl для отделения и очистки непрореагировавшего инсулина, непрореагировавшего Fc-фрагмента иммуноглобулина, конъюгата инсулина с ПЭГ и Fc-фрагментом иммуноглобулина, и Fc-фрагмента иммуноглобулина, связанного с двумя или более фрагментами монопегилированного инсулина (инсулин-ПЭГ). Выходы конъюгата инсулина с ПЭГ и Fc-фрагментом иммуноглобулина определяли по поглощению в УФ-области при 280 нм после очистки хроматографией.
В Таблице 1 обобщены выходы реакции связывания с Fc-фрагментом иммуноглобулина в соответствии с условиями применения цианоборгидрида натрия в качестве восстановителя в пегилировании инсулина.
ПРИМЕР 3: Пегилирование инсулина с использованием комплекса боран-пиридин в качестве восстановителя и очистка монопегилированного инсулина
Порошок инсулина растворяли в 10 мМ HCl и пегилировали на N-конце бета-цепи при помощи 3,4 K пропион-ALD2 ПЭГ (ПЭГ с двумя пропиональдегидными группами, IDB, Korea). В связи с этим, 5 мг/мл инсулина приводили во взаимодействие с ПЭГ в молярном соотношении 1:2 при 4°С в течение 2 ч. Взаимодействие выполняли в 50 мМ натрий-цитратном буфере при рН 6,0 в 45% изопропаноле в присутствии 3-20 мМ комплекса боран-пиридин в качестве восстановителя. Реакционную смесь загружали на колонку SP-HP (GE Healthcare) с последующим элюированием буфером, содержащим цитрат натрия (рН 3,0) и 45% EtOH и использованием градиента концентрации KCl для очистки монопегилированного инсулина.
Выходы пегилирования инсулина в соответствии с условиями применения комплекса боран-пиридин в качестве восстановителя во время получения конъюгата, содержащего инсулин и Fc-фрагмент иммуноглобулина, обобщены в Таблице 2 ниже.
ПРИМЕР 4: Изменения выходов конъюгата монопегилированного инсулина с Fc-фрагментом иммуноглобулина в соответствии с условиями применения комплекса боран-пиридин в качестве восстановителя в пегилировании
Для изучения выхода конъюгата инсулина с ПЭГ и Fc-фрагментом иммуноглобулина монопегилированный инсулин, полученный в Примере 3, приводили во взаимодействие в молярном соотношении 1:1 с Fc-фрагментом иммуноглобулина при 25°С в течение 13 ч, с заданной концентрацией общего белка 20 мг/мл. Эту реакцию связывания выполняли в 100 мМ буфере HEPES, содержащем 22 мМ фосфата калия и 10% этанола при рН 8,2 в присутствии 20 мМ цианоборгидрида натрия в качестве восстановителя.
Реакционную смесь загружали на колонку Source 15Q (GE Healthcare) с последующим элюированием буфером Трис-HCl (рН 7,5) и использованием градиента концентрации NaCl для отделения и очистки непрореагировавшего инсулина, непрореагировавшего Fc-фрагмента иммуноглобулина, конъюгата инсулина с ПЭГ и Fc-фрагментом иммуноглобулина, и Fc-фрагмента иммуноглобулина, связанного с двумя или более фрагментами монопегилированного инсулина (инсулин-ПЭГ). Выходы конъюгата инсулина с ПЭГ и Fc-фрагментом иммуноглобулина определяли по поглощению в УФ-области при 280 нм после очистки посредством хроматографии.
В Таблице 2 обобщены выходы реакции связывания с Fc-фрагментом иммуноглобулина в соответствии с условиями применения комплекса боран-пиридин в качестве восстановителя в пегилировании инсулина.
ПРИМЕР 5: Выходы реакции связывания и образование аберранта Fc-фрагмента иммуноглобулина в соответствии с концентрацией цианоборгидрида натрия и временем реакции
Для изучения образования аберранта Fc-фрагмента иммуноглобулина в соответствии с концентрациями восстановителя и временем взаимодействия в реакции связывания монопегилированный инсулин приводили во взаимодействие в молярном соотношении 1:1 с Fc-фрагментом иммуноглобулина при 25°С в течение 13-43 ч с заданной концентрацией общего белка 20 мг/мл. Эту реакцию связывания выполняли в буфере 100 мМ HEPES, содержащем 22 мМ фосфата калия и 10% этанола, рН 8,2 в присутствии 5-40 мМ цианоборгидрида натрия.
Реакционную смесь загружали на колонку Source 15Q (GE Healthcare) с последующим элюированием буфером Трис-HCl (рН 7,5) и использованием градиента концентрации NaCl для отделения и очистки непрореагировавшего инсулина, непрореагировавшего Fc-фрагмента иммуноглобулина, конъюгата инсулина с ПЭГ и Fc-фрагментом иммуноглобулина, и Fc-фрагмента иммуноглобулина, связанного с двумя или более фрагментами монопегилированного инсулина (инсулин-ПЭГ). Выходы конъюгата инсулина с ПЭГ и Fc-фрагментом иммуноглобулина определяли по поглощению в УФ-области при 280 нм после очистки посредством хроматографии.
В Таблице 3 обобщены выходы реакции связывания с получением конъюгата, содержащего инсулин и Fc-фрагмент иммуноглобулина, в соответствии с концентрациями цианоборгидрида натрия (SCB), используемого в качестве восстановителя, и времени взаимодействий в реакции связывания.
За образованием аберрантов Fc-фрагмента иммуноглобулина в соответствии с концентрациями восстановителя в реакции связывания наблюдали при помощи жидкостной хроматографии на колонке Propac SAX-10 (DIONEX), элюируя буфером Трис-HCl (рН 8,0) и используя градиент концентрации NaCl.
В Таблице 4 представлены выходы аберрантов Fc-фрагмента иммуноглобулина в соответствии с концентрациями цианоборгидрида натрия и временем взаимодействий в реакции связывания для получения конъюгата, содержащего инсулин и Fc-фрагмент иммуноглобулина.
ПРИМЕР 6: Пегилирование Fc-фрагмента иммуноглобулина, используя цианоборгидрид натрия в качестве восстановителя, и очистка монопегилированного Fc-фрагмента иммуноглобулина
N-конец Fc-фрагмента иммуноглобулина пегилировали при помощи 5 K пропион-ALD2 ПЭГ (ПЭГ с тремя пропиональдегидными группами, NOF, Japan). В связи с этим, 10 мг/мл Fc-фрагмента иммуноглобулина приводили во взаимодействие с ПЭГ в молярном соотношении 1:2 при температуре от 4°С до комнатной температуры в течение 4,5 ч. Реакцию проводили в 100 мМ калий-фосфатном буфере с рН 6,0 в присутствии 20 мМ цианоборгидрида натрия в качестве восстановителя. Реакционную смесь загружали на колонку Source 15Q с последующим элюированием буфером Трис-HCl (рН 7,5) и использованием градиента концентрации NaCl для очистки монопегилированного инсулина.
ПРИМЕР 7: Изготовление конъюгата монопегилированного Fc-фрагмента иммуноглобулина с инсулином, используя цианоборгидрид натрия в качестве восстановителя
Для изготовления конъюгата инсулина с ПЭГ и Fc-фрагментом иммуноглобулина, монопегилированный Fc-фрагмент иммуноглобулина, полученный в Примере 6, приводили во взаимодействие с инсулином в молярном соотношении 1:4 при 4°С в течении 13 ч, с заданной концентрацией общего белка 20 мг/мл. Эту реакцию связывания выполняли в 100 мМ калий-фосфатном буфере с рН 6,0 в присутствии 20 мМ цианоборгидрида натрия в качестве восстановителя.
Реакционную смесь загружали на колонку Source 15Q (GE Healthcare) для первичной очистки. И дополнительно выполняли вторичную очистку при помощи колонки Source 15ISO (GE Healthcare) для получения конъюгата инсулина с ПЭГ и Fc-фрагментом иммуноглобулина.
Дополнительные примеры
Методика эксперимента
На стадии пегилирования (первая стадия) 6 мг/мл эксендина-4 приводили во взаимодействие с ПЭГ при температуре 4-8°С в течение приблизительно 13 часов. Взаимодействие выполняли в 100 мМ буфере HEPES с рН 7,5 в 45% изопропаноле в присутствии 8 мМ, 12 мМ и 20 мМ цианоборогидрида натрия в качестве восстановителя.
Далее, на стадии связывания (вторая реакция) монопегилированный эксендин-4, полученный как указано выше, приводили во взаимодействие в молярном соотношении 1:4 с Fc-фрагментом иммуноглобулина при 25°С в течение ночи, с заданной концентрацией общего белка приблизительно 20 мг/мл. Эту реакцию связывания выполняли в 100 мМ буфере HEPES с рН 8,2 в присутствии 20 мМ цианоборогидрида натрия в качестве восстановителя.
Выходы в реакции пегилирования (первая реакция) и в реакции связывания (вторая реакция) измеряли таким же способом, как в Примере 1 и Примере 2 из описания изобретения.
Результаты
Результаты экспериментов представлены ниже:
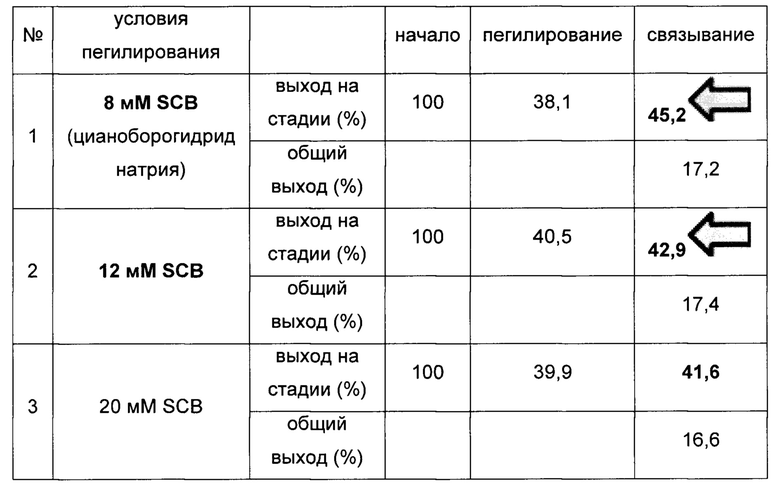
Результаты показывают, что выход в реакции связывания был превосходным (увеличение составило примерно 3,1% ((42,9-41,6)/41,6) и примерно 8,7% ((45,2-41,6)/41,6)) для экспериментов, в которых восстановитель был использован в концентрациях 8 мМ и 12 мМ, по сравнению с экспериментом, в котором восстановитель был использован в концентрации 20 мМ.
В отличие от всех процитированных экспертизой ссылок WO 2010/011096 (Д1), WO 2011/122921 (Д2), WO 2009/069983 (Д3), WO 2012/011752 (Д4) и RU 2428430 С2 (Д5), в которых рекомендована концентрация восстановителя 20 мМ, в заявленном в настоящей заявке способе используют восстановитель в концентрации, которая меньше по сравнению с известными способами (то есть меньше, чем 20 мМ) и это, тем не менее, приводит к неожиданным превосходным результатам по сравнению с результатами, получаемыми в известных способах.
Заявитель полагает, что способ получения, включающий двухстадийное образование конъюгата, в частности стадии пегилирования и связывания, нельзя рассматривать как хорошо известный в области техники. Кроме того, связь выхода в реакции связывания с первой стадией способа по п. 1 (стадией пегилирования) и второй стадией способа по п. 1 (стадией связывания) не была изучена.
По мнению заявителя, специалист в области техники, основываясь на знаниях из уровня техники, стал бы предпринимать попытки увеличить выход пегилирования путем увеличения концентрации восстановителя на первой из двух упомянутых выше стадий (то есть, на стадии пегилирования) и не стал бы предпринимать попытки уменьшить концентрацию восстановителя.
Соответственно, специалист в области техники никоим образом не был бы мотивирован и не смог бы разработать способ получения конъюгата, в котором на первой стадии используют восстановитель в концентрации, меньшей по сравнению с общеизвестной концентрацией восстановителя.
| название | год | авторы | номер документа |
|---|---|---|---|
| Улучшенный способ получения конъюгата физиологически активного полипептида с высоким выходом | 2014 |
|
RU2677796C9 |
| КОНЪЮГАТ ИНСУЛИНА С ПРИМЕНЕНИЕМ ФРАГМЕНТА ИММУНОГЛОБУЛИНА | 2011 |
|
RU2519073C1 |
| Способ получения комплекса физиологически активного полипептида | 2012 |
|
RU2624129C2 |
| ЖИДКАЯ КОМПОЗИЦИЯ ДЛИТЕЛЬНО ДЕЙСТВУЮЩЕГО КОНЪЮГАТА ИНСУЛИНА | 2013 |
|
RU2670270C2 |
| САЙТ-СПЕЦИФИЧНЫЙ КОНЪЮГАТ ИНСУЛИНА | 2014 |
|
RU2677800C2 |
| СПОСОБ РЕГУЛИРОВАНИЯ УСЛОВИЙ ДЛЯ САЙТ-СПЕЦИФИЧЕСКОГО СВЯЗЫВАНИЯ ПОЛИПЕПТИДА И НЕПЕПТИДИЛЬНОГО ПОЛИМЕРА | 2010 |
|
RU2495881C2 |
| ПОЛИПЕПТИДНЫЙ КОМПЛЕКС, СОДЕРЖАЩИЙ НЕПЕПТИДИЛЬНЫЙ ПОЛИМЕР, ОБЛАДАЮЩИЙ ТРЕМЯ ФУНКЦИОНАЛЬНЫМИ КОНЦАМИ | 2009 |
|
RU2483081C2 |
| ЖИДКАЯ КОМПОЗИЦИЯ ДЛИТЕЛЬНО ДЕЙСТВУЮЩИХ ИНСУЛИНА И ИНСУЛИНОТРОПНОГО ПЕПТИДА | 2013 |
|
RU2643766C2 |
| БЕЛКОВЫЙ КОМПЛЕКС, ПОЛУЧЕННЫЙ С ИСПОЛЬЗОВАНИЕМ ФРАГМЕНТА ИММУНОГЛОБУЛИНА, И СПОСОБ ПОЛУЧЕНИЯ ТАКОГО КОМПЛЕКСА | 2004 |
|
RU2356909C2 |
| Новый аналог инсулина и его применение | 2014 |
|
RU2676729C2 |

Изобретение относится к области биотехнологии, конкретно к получению конъюгатов физиологически активного полипептида с непептидильным полимером и константной областью иммуноглобулина, и может быть использовано в медицине для создания длительно действующих композиций физиологически активных полипептидов, которые улучшают соблюдение режима приема лекарственных средств. Способ отличается варьированием концентраций восстановителя от 1 мМ до меньше чем 20 мМ на первой стадии и от 1 до 100 мМ на второй стадии восстановительного аминирования, благодаря чему позволяет преодолеть традиционные проблемы низкого выхода модифицированного полипептида, имеющего пролонгированный профиль действия. 2 н. и 23 з.п. ф-лы, 4 табл., 7 пр.
1. Способ получения конъюгата физиологически активного полипептида с непептидильным полимером и константной областью иммуноглобулина, включающий:
1) взаимодействие непептидильного полимера, имеющего две или более альдегидных групп в качестве функциональных групп, с константной областью иммуноглобулина в присутствии восстановителя в концентрации от 1 мМ до меньше чем 20 мМ с получением конъюгата константной области иммуноглобулина с непептидильным полимером путем восстановительного аминирования и
2) взаимодействие конъюгата, полученного на стадии (1), с физиологически активным полипептидом в присутствии восстановителя в концентрации 1-100 мМ с получением конъюгата физиологически активного полипептида с непептидильным полимером и константной областью иммуноглобулина путем восстановительного аминирования, где альдегидные функциональные группы непептидильного полимера ковалентно связаны с каждой из аминогруппы физиологически активного полипептида и аминогруппы константной области иммуноглобулина, где аминогруппа присутствует на N-конце или на боковой цепи остатка Lys.
2. Способ получения конъюгата физиологически активного полипептида с непептидильным полимером и константной областью иммуноглобулина, включающий
1) взаимодействие непептидильного полимера, имеющего две или более альдегидных групп в качестве функциональных групп, с физиологически активным полипептидом в присутствии восстановителя в концентрации от 1 мМ до меньше чем 20 мМ с получением конъюгата физиологически активного полипептида с непептидильным полимером путем восстановительного аминирования; и
2) взаимодействие конъюгата, полученного на стадии (1), с константной областью иммуноглобулина в присутствии восстановителя в концентрации 1-100 мМ с получением конъюгата физиологически активного полипептида с непептидильным полимером и константной областью иммуноглобулина путем восстановительного аминирования, где альдегидные функциональные группы непептидильного полимера ковалентно связаны с каждой из аминогруппы физиологически активного полипептида и аминогруппы константной области иммуноглобулина, где аминогруппа присутствует на N-конце или на боковой цепи остатка Lys.
3. Способ по п. 1 или 2, дополнительно включающий выделение конъюгата из реакционной смеси после стадии (1).
4. Способ по п. 1 или 2, где восстановитель действует для восстановления обратимой иминной двойной связи, полученной в результате связывания между альдегидной группой непептидильного полимера и аминогруппой физиологически активного полипептида или константной областью иммуноглобулина, с образованием ковалентной связи.
5. Способ по п. 1 или 2, где восстановитель выбран из группы, состоящей из цианоборгидрида натрия, комплекса боран-пиридин, борогидрида натрия, комплекса боран-диметиламин, комплекса боран-триметиламин и триацетоксиборогидрида натрия.
6. Способ по п. 1 или 2, где восстановитель используют в концентрации от 1 до 40 мМ на стадии (2).
7. Способ по п. 1 или 2, где взаимодействие на стадии (1) выполняют в течение от 1 до 16 ч.
8. Способ по п. 1 или 2, где взаимодействие на стадии (2) выполняют в течение от 1 до 48 ч.
9. Способ по п. 1 или 2, где взаимодействие на стадии (1) выполняют при температуре от 0 до 25°С.
10. Способ по п. 1 или 2, где взаимодействие на стадии (1) выполняют в течение от 1 до 16 ч при температуре от 0 до 25°С в присутствии восстановителя в концентрации от 1 мМ до меньше чем 20 мМ и взаимодействие на стадии (2) выполняют в течение от 1 до 48 ч в присутствии восстановителя в концентрации от 1 до 40 мМ.
11. Способ по п. 1 или 2, где непептидильный полимер выбран из группы, состоящей из полиэтиленгликолей, полипропиленгликолей, сополимеров этиленгликоля и пропиленгликоля, полиоксиэтилированных полиолов, поливиниловых спиртов, полисахаридов, декстранов, поливинилэтиловых эфиров, полимолочной кислоты (PLA), полимолочной-гликолевой кислоты (PLGA), полимеров липидов, хитинов, гиалуроновой кислоты и их комбинации.
12. Способ по п. 1 или 2, где непептидильный полимер представляет собой полиэтиленгликоли.
13. Способ по п. 1 или 2, где молекулярная масса непептидильного полимера находится в диапазоне от 1 до 100 кДа.
14. Способ по п. 1 или 2, где константная область иммуноглобулина является агликозилированной.
15. Способ по п. 1 или 2, где константная область иммуноглобулина состоит из 1-4 доменов, выбранных из группы, состоящей из доменов СН1, СН2, СН3 и СН4.
16. Способ по п. 1 или 2, где константная область иммуноглобулина дополнительно содержит шарнирную область.
17. Способ по п. 1 или 2, где константная область иммуноглобулина выбрана из группы, состоящей из константных областей, полученных из IgG, IgA, IgD, IgE, IgM, или их комбинаций или гибридов.
18. Способ по п. 1 или 2, где константная область иммуноглобулина выбрана из группы, состоящей из константных областей IgG1, IgG2, IgG3, IgG4, их комбинации и их гибрида.
19. Способ по п. 1 или 2, где константная область иммуноглобулина представляет собой Fc-фрагмент IgG4.
20. Способ по п. 19, где константная область иммуноглобулина представляет собой агликозилированный Fc-фрагмент IgG4 человека.
21. Способ по п. 1 или 2, где физиологически активный полипептид выбран из группы, состоящей из гормона роста человека, гормонов, высвобождающих гормон роста, пептидов, высвобождающих гормон роста, интерферона, рецепторов к интерферону, колониестимулирующих факторов, глюкагоноподобных пептидов (GLP-1 и так далее), оксинтомодулина, сопряженных с белком-G рецепторов, интерлейкинов, рецепторов к интерлейкинам, ферментов, интерлейкин-связывающих белков, цитокин-связывающих белков, факторов, активирующих макрофаги, пептидов макрофагов, факторов В-клеток, факторов Т-клеток, белка А, ингибиторов аллергии, гликопротеинов некроза клеток, иммунотоксинов, лимфотоксинов, фактора некроза опухоли, супрессоров опухоли, трансформирующего фактора роста, альфа-1 антитрипсина, альбумина, α-лактальбумина, аполипопротеина-Е, эритропоэтина, гликозилированного эритропоэтина, ангиопоэтинов, гемоглобина, тромбина, пептидов, активирующих рецепторы тромбина, тромбомодулина, фактора крови VII, VIIa, VIII, IX и XIII, активаторов плазминогена, фибрин-связывающих пептидов, урокиназы, стрептокиназы, гирудина, белка С, С-реактивного белка, ингибитора ренина, ингибитора коллагеназы, супероксиддисмутазы, лептина, тромбоцитарного фактора роста, эпителиального фактора роста, эпидермального фактора роста, ангиостатина, ангиотензина, фактора роста кости, костестимулирующего белка, кальцитонина, инсулина, атриопептина, хрящевого индуцирующего фактора импульсного ответа, элкатонина, активирующего фактора соединительной ткани, ингибитора пути тканевого фактора, фолликулостимулирующего гормона, лютеинизирующего гормона, гормона высвобождения лютеинизирующего гормона, факторов роста нерва, паратиреоидного гормона, релаксина, секретина, соматомедина, инсулиноподобного фактора роста, гормона коры надпочечников, глюкагона, холецистокинина, панкреатического полипептида, гастрин-высвобождающего пептида, кортикотропин-высвобождающего фактора, тиреостимулирующего гормона, аутотоксина, лактоферрина, миостатина, антигенов клеточных поверхностей, происходящих из вируса вакцинных антигенов, моноклональных антител, поликлональных антител и фрагментов антител.
22. Способ по п. 1 или 2, где физиологически активный полипептид представляет собой инсулин.
23. Способ по п. 1 или 2, где стадию (1) осуществляют в присутствии восстановителя в концентрации от 1 до 12 мМ.
24. Способ по п. 1 или 2, где стадию (1) осуществляют в присутствии восстановителя в концентрации от 1 до 10 мМ.
25. Способ по п. 1 или 2, где стадию (1) осуществляют в присутствии восстановителя в концентрации от 1 до 8 мМ.
| WO 2010011096, 28.01.2010 | |||
| WO 2011122921, 06.10.2011 | |||
| WO 2009069983, 04.06.2009 | |||
| WO 2012011752, 26.01.2012 | |||
| СПОСОБ МАССОВОГО ПРОИЗВОДСТВА ОБЛАСТИ Fc ИММУНОГЛОБУЛИНА С УДАЛЕННЫМИ НАЧАЛЬНЫМИ МЕТИОНИНОВЫМИ ОСТАТКАМИ | 2006 |
|
RU2428430C2 |
Авторы
Даты
2017-12-20—Публикация
2013-03-08—Подача