Изобретение относится к медицине, в частности к фармакологии, и касается применения известного лекарственного средства 2-(2-морфолиноэтил)тио-5-этоксибензимидазол дигидрохлорида (анксиолитик афобазол) (патент РФ №2061682; Середенин С.Б., Воронин М.В., Экспер. и клин. фармакол. - 2009. - т.72, №1. - С.3-11; РЛС, 2008. - С.143-144) в качестве препарата с кардиопротективной активностью.
Известно, что ряд производных 2-меркаптобензимидазола обладает антиаритмическим действием (Чичканов Г.Г. и др., Экспер. и клин. фармакол. - 1997. - т.60, №5. - С.35-39). Ранее в НИИ фармакологии РАМН при изучении влияния афобазола и его структурных аналогов на скрининговых моделях нарушений сердечного ритма было показано, что эти соединения могут быть отнесены к I и IV классам антиаритмических лекарственных средств по классификации Vaughan Williams (Турилова А.И., Можаева Т.Я., Экспер. и клин. фармакол. - 2010. - т.73, №5. - С.8-11) и эффективны на моделях как предсердных, так и желудочковых нарушений сердечного ритма (Столярук В.Н. и др. Вестник РАМН. - 2010. - №4. - С.41-45; Столярук В.Н. и др., Вестник РАМН. - 2010. - №4. - С.49-52).
2-(2-морфолиноэтил)тио-5-этоксибензимидазол дигидрохлорид - анксиолитик афобазол, - обладает сложным механизмом анксиолитического действия, который связан с его способностью предотвращать стресс-индуцированное снижение связывания медиатора в бензодиазепиновом участке ГАМК-рецепторов (Середенин С.Б. с соавт., Вестник РАМН. - 1998. - №11. - С.3-9). Также показано, что афобазол обладает сродством к сигма1- и мелатониновым рецепторам, подавляет активность МАО-А. Помимо анксиолитической афобазол обладает и цитопротекторной активностью, в определенной мере обусловленной его сродством к сигма1-рецепторам. Последние в настоящее время рассматривают как внутриклеточное эволюционное образование, играющее важную роль в физиологической защите клетки от патологических воздействий; в связи с чем их можно позиционировать как своеобразный «ремонтный» комплекс, обеспечивающий гомеостаз клетки и тем самым поддерживающий ее жизнедеятельность (Середенин С.Б., Воронин М.В., Эксперим. и клин. фармакология. - 2009. - т.72, №1. - С.3-11). Помимо ЦНС сигма1-рецепторы достаточно широко представлены в клетках других органов и тканей организма, в том числе и миокарда (Novakova M. ef al., Gen Physiol Biophys. - 2007. - v.26. - №2. - P.110-7). В литературе имеются данные о том, что лиганды сигма1-рецепторов обладают как антиаритмической, в частности антифибрилляторной {Лишманов Ю.Б. с соавт., Эксперим. и клинич. фармакология. - 2000. - т.63, №6. - С.24-27; Маслов Л.Н. с соавт., Эксперим. и клинич. фармакология. - 1997. - т.60, №2. - С.24-26.), так и антиишемической активностью (Ai-tо С.Т. et al., Curr. Neurovasc. Res. - 2006. - V. 3, №2. - P.89-98.).
Распространенность психосоматических расстройств, в том числе кардиофобий, привела к тому, что в настоящее время в рамках психосоматической медицины выделено новое направление - психокардиология (Смулевич А.Б. с соавт., Психокардиология. - M.: изд. Мед. Инф. Агентство, 2005. - 784 с.).
В исследованиях, проведенных в рамках этого направления, показано, что уровень фобической тревоги прямо пропорционален риску развития фатальных и/или нефатальных инфарктов миокарда, злокачественных нарушений сердечного ритма и внезапной коронарной смepти (Abrams Т.Е. et al., Circ Cardiovasc Qual Outcomes. - 2009. - v.2. - P.213-220; Ehlens A. et al., Psichosom. Med. - 2000. - v.62, №5. - P.693-702; Schulman J.K. et al., Focus. - 2005. - V.3. - P.208-224. 2005, Walters K. et al., Eur. Heart J. - 2008. - V.29. - P.2981-2988). Так, например, в проспективном эпидемиологическом исследовании, в котором приняло участие 72 359 женщин (продолжительность наблюдения 12 лет), выявлена прямая корреляция между уровнем фобической тревоги и риском возникновения злокачественных нарушений ритма сердца, в том числе и внезапной коронарной смерти (Albert Ch. M. et al., Circulation. - 2005. - v.111. - P.480-487). Анализ исследования, в котором приняли участие 940 пациентов, госпитализированных по поводу диагностической коронарографии, показал статистически значимую зависимость между уровнем тревожно-фобических расстройств и риском развития злокачественных, в том числе и фатальных нарушений сердечного ритма (Watkins L.L. et al., Psy-chosom Med. - 2006. - v.68: - P.651-656).
Таким образом, внедрение в клиническую практику лекарственных средств, сочетающих в себе анксиолитическую и кардиопротективную активность, представляется весьма актуальным.
Одним из возможных путей решения данной проблемы является использование для этих целей отечественного высокоэффективного анксиолитика афобазола.
Исходя из этого, нами была систематически изучена кардиопротективная активность афобазола и показано, что данная активность афобазола реализуется преимущественно на уровне сердечной мышцы и, в частности, связана со сродством афобазола к сигма1-рецепторам, локализованным в кардиомиоцитах. Полученные данные позволяют рекомендовать применение афобазола в клинике в качестве кардиопротектора для профилактики и лечения сердечно-сосудистых расстройств у пациентов, страдающих кардиофобическими и/или астено-депрессивными синдромами, течение которых отягощено заболеваниями сердца.
Пример 1. Изучение антиишемического действия афобазола
Эксперименты проводили на белых беспородных крысах-самцах массой тела 180-200 г в дозе 10 мг/кг 1 раз в сутки в течение 7 дней (группа 2). Первое введение осуществляли сразу после окклюзии коронарной артерии. В контрольной серии экспериментов (группа 1) по аналогичной схеме вводили эквивалентный объем изотонического раствора натрия хлорида.
На восьмые сутки животных наркотизировали уретаном (1300 мг/кг, внутрибрюшинно), сердца извлекали и фиксировали в 10% растворе формалина. С помощью замораживающего микротома на двух уровнях (верхушка и середина) производили поперечные срезы сердца толщиной 10-15 микрон. Срезы окрашивали по стандартным методикам - галлоцианином-эозином и пикрофуксином по Ван-Гизону. Проводили качественную визуальную оценку микропрепаратов сердца с описанием картины поврежденной ткани. Количественную оценку осуществляли с помощью сетки Автандилова и 24-кратной лупы. Площадь инфаркта, толщину стенок желудочков и межжелудочковой перегородки, диаметр полости левого желудочка определяли на срединном срезе сердца. Кроме того, на этих срезах в условно-интактной зоне миокарда для оценки интенсивности пролиферативных процессов с помощью окулярной сетки измеряли (в условных единицах) поперечный диаметр ядер кардиомиоцитов.
Результаты исследования обрабатывали статистически с помощью критерия Шапиро-Уилкса, одномерного дисперсионного анализа с последующим сравнением с помощью критерия Даннета (критерий односторонний), критерия Манна-Уитни-Вилкоксона с учетом множественности сравнений и критерия χ2 с учетом множественности сравнений.
Показано, что у животных, которым в течение 7 дней после окклюзии коронарного сосуда в/б вводили афобазол в дозе 10 мг/кг (n=7), в отличие от контрольных животных (n=8), морфологическая картина периинфарктной зоны характеризуется высокой интенсивностью пролиферативных процессов, о чем, в частности, свидетельствует увеличение диаметра ядер кардиомиоцитов, локализованных в этой зоне. Так, если в миокарде контрольных животных количество ядер кардиомиоцитов, имеющих диаметр более двух условных единиц, составляет 17,7%, то у крыс, которые получали афобазол в дозе 10 мг/кг, этот показатель статистически значимо выше (Р<0,001) и составляет 65,5%. Можно полагать, что именно такая высокая интенсивность пролиферативных процессов, протекающих в условно-интактной зоне миокарда, привела к тому, что у этих животных площадь инфаркта статистически значимо (Р=0,0266) меньше, чем в контроле.
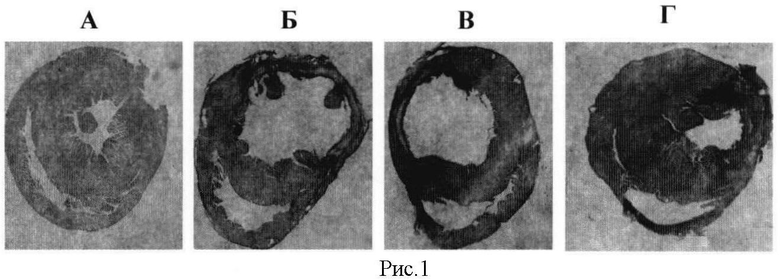
Не менее важно и то, что длительная терапия афобазолом статистически значимо препятствует постинфарктному ремоделированию левого желудочка (таблица 1, рисунок), в частности, полость левого желудочка крыс, получавших афобазол в дозе 10 мг/кг, на 21,5% меньше, чем у животных контрольной группы (Р=0,0477).
Полученные данные позволяют говорить о том, что афобазол в условиях острого инфаркта миокарда проявляет выраженное антиишемическое действие - препарат не только стимулирует репаративные процессы в сердечной мышце и уменьшает площадь ишемического поражения, но и препятствует постишемическому ремоделированию сердечной мышцы. Последнее представляется наиболее важным, так как дает все основания полагать, что у леченных афобазолом животных риск развития сердечной недостаточности в постинфарктном периоде существенно ниже.
Можно полагать, что антиишемическое действие афобазола в определенной мере связано с его сродством к сигма1-рецепторам, поскольку известно, что агонисты σ1-рецепторов обладают способностью уменьшать зону ишемического повреждения (Calvert J.W., Lefer D.J., Cardiovasc. Res. - 2009. - v.94, №7. - P.805-814.). Этот эффект агонистов σ1-рецепторов, по-видимому, комплексный и включает в себя защиту ишемизированных клеток от перегрузки ионами Са2+ (Tchedre K.T. et al., Invest. Ophthalmol. Vis. Sci. - 2007. - v.48. - E.-Abstract572), уменьшение тонического влияния симпатической нервной системы на миокард (Zhang H., Cuevas J., J. Neurophysiol. - 2002. - v.10. - P.2867-2879), подавление каскада внутриклеточных реакций, инициирующих апоптоз (Tchedre K.T., Yorio Т., Invest. Ophalmol. Visual Science. - 2008. - v.49. - P.2577-2588), в том числе, экспрессию гена bcl-2 (Yang S. et al., Anesth. Analg. - 2007. - v.104, №5. - P.1179-1184), защиту клеток миокарда от свободно-радикальной агрессии (Halliwell В., J.Neurochem. - 2006. - v.97, №6. - P.1634-1658). Также нельзя исключить, что антиишемическое действие афобазола может быть связано с его способностью подавлять активность моноаминооксидазы А (Середенин С.Б., Воронин М.В., Экспер. и клин. фармакол. - 2009. - т.72, №1. - С.3-11), поскольку известно, что гиперактивность этого фермента в кардиомиоцитах, наблюдаемая в условиях их ишемического повреждения, инициирует процессы апоптоза кардиомиоцитов и/или повреждение их мембран вследствие оксидантного стресса (Pchejetski D. et al., Circ. Res. - 2007. -v.100. - P.41-49; Kaludercic N. et al., Circ. Res. - 2010. - v.106, №1. - P.193-202).
Пример 2. Оценка вклада центральных и периферических механизмов в кардиопротективное действие афобазола.
Опыты проводили на анестезированных пентобарбиталом натрия (40 мг/кг, в/в) беспородных кошках обоего пола массой 2,9-3,8 кг. Животных интубировали и переводили на искусственную вентиляцию легких кислородно-воздушной смесью (в соотношении 1:1) из расчета 130-150 мл/мин/кг массы животного. Порог электрической фибрилляции сердца определяли повторяющимся сканированием уязвимого периода сердечного цикла серией из 20 прямоугольных импульсов постоянного тока увеличивающейся силы (длительность стимула 4 мс, частота 50 имп/с) до возникновения фибрилляции. Если фибрилляция через 60 сек самостоятельно не купировалась, животных дефибриллировали разрядом электрического тока (1,5 кВ). За порог фибрилляции принимали минимальную силу тока, стабильно вызывающую фибрилляцию желудочков (длительность более 60 сек) при повторной стимуляции. В работе использовали электростимулятор HSE Stimulator II (Hugo Sach Electronik, Германия). Дефибрилляцию производили при помощи дефибриллятора ДИ-03 (Россия). Денервацию сердца осуществляли путем удаления правого и левого звездчатых ганглиев и пересечением правого и левого блуждающих нервов.
Афобазол вводили внутривенно (в/в) в дозе 7,5 мг/кг с постоянной скоростью и в постоянном объеме 0,9% раствора хлорида натрия. Контрольным животным вводили эквивалентное количество 0,9% раствора хлорида натрия.
Показано, что после денервации сердца ЧСС статистически значимо (Р=0,011) снижалась со 145,8±8,2 уд./мин до 110,5±4,4 уд./мин, что свидетельствует о прекращении центральных тонических влияний на сердце, поскольку хорошо известно, что собственно синоатриальный узел генерирует ЧСС с меньшей частотой (Камкин А., Каменский А. (ред.) Фундаментальная и клиническая физиология. - М., Академия; 2004. - С.521-551). Порог электрической фибрилляции денервированного сердца уменьшался в 2-3 раза, что, по всей видимости, связано с уменьшением электрической стабильности кардиомиоцитов, вызванной денервацией. Так, если электрическая фибрилляции сердца у животных с интактным миокардом вызывалась силой тока 1,0-3,0 мА, то на фоне денервации порог фибрилляции снижался до 0,5-1,0 мА (табл.2).
Афобазол (7,5 мг/кг, в/в) у животных с денервированным миокардом, так же как и у животных с интактным миокардом, во всех опытах статистически значимо (Р<0,05) повышает порог электрической фибрилляции сердца - фибрилляцию не удавалось вызвать электрическими импульсами силой тока в пределах от 0,5 до 100 мА (табл.2).
Поскольку интенсивность противофибрилляторного действия афобазола не различалась у животных с интактным и денервированным миокардом, есть все основания полагать, что антиаритмическое действие препарата преимущественно обусловлено его способностью непосредственно повышать электрическую стабильность сердечной мышцы.
Пример 3. Изучение возможных механизмов кардиопротективного действия афобазола
Как уже было отмечено выше, афобазол является агонистом сигма1-рецепторов. Поскольку известно, что лиганды сигма1-рецепторов обладают антиаритмическим действием, была предпринята попытка оценить возможный вклад сигма1-рецепторов в антиаритмическое действие афобазола. Для этой цели антиаритмическое действие афобазола оценивали на фоне предварительного введения антагониста сигма1-рецепторов галоперидола. Хотя галоперидол рассматривают как неселективный антагонист сигма-рецепторов, имеются данные о том, что его аффинитет к сигма1-рецепторам в 170 раз выше, чем к сигма2-рецепторам (Klouz A. et al., Therapie. - 2001. - v.56, №5. - P.557-562).
Опыты проводили на анестезированных (уретан, 1300 мг/кг, в/в) беспородных крысах-самцах массой тела 350-400 г. Порог электрической фибрилляции сердца определяли так же, как и в примере 2. За порог фибрилляции желудочков принимали минимальную силу тока, вызывающую при двухкратном повторении фибрилляцию желудочков. В опыт отбирали только тех животных, у которых фибрилляция желудочков наступала при силе тока не более 6 мА. Афобазол вводили внутривенно (в/в) в дозе 7,5 мг/кг с постоянной скоростью и в постоянном объеме 0,9% раствора хлорида натрия. Галоперидол (Гедеон Рихтер) вводили в/в в дозе 0,5 мг/кг с постоянной скоростью и в постоянном объеме 0,9% раствора хлорида натрия.
Результаты обрабатывали статистически с использованием дисперсионного анализа для повторных изменений с дальнейшим использованием метода множественных сравнений по Ньюману-Кейлсу, критерия Стьюдента и парного теста Уилкоксона.
Показано, что на фоне предварительного введения галоперидола в дозе 0,5 мг/кг антифибрилляторное действие афобазола, введенного из расчета 7,5 мг/кг, не реализуется (табл.3). Помимо этого отмечено, что если у интактных животных на фоне афобазола происходит урежение ЧСС, то у животных, получавших галоперидол, пульс-замедляющее действие афобазола не реализуется. Различия статистически достоверны (Р=0,046).
Таким образом, полученные результаты позволяют высказать предположение о том, что антиаритмическое действие афобазола в той или иной мере связано с его сродством к сигма1-рецепторам, локализованным в кардиомиоцитах, поскольку на фоне их блокады препарат не проявляет антиаритмическую активность.
Приведенные данные свидетельствуют о том, что анксиолитик афобазол обладает выраженным кардиопротективным действием, которое реализуется на уровне кардиомиоцитов и может быть связано со сродством препарата к сигма1-рецепторам. Исходя из этого афобазол может быть рекомендован для применения в клинике в качестве кардиопротектора с целью профилактики и лечения сердечно-сосудистых расстройств у пациентов, страдающих кардиофобическими и/или астено-депрессивными синдромами, течение которых отягощено заболеваниями сердца.
Описание рисунка.
На рисунке представлены поперечные срезы левого желудочка сердца крыс с экспериментальным инфарктом миокарда: А - сердце интактного животного; Б - сердце животного через 7 дней после инфаркта миокарда (контроль); В - сердце животного с инфарктом миокарда, получавшего афобазол в дозе 5,0 мг/кг/сутки, в/б, 7 дней; Г - сердце животного с инфарктом миокарда, получавшего афобазол в дозе 10,0 мг/кг/сутки, в/б, 7 дней.
| название | год | авторы | номер документа |
|---|---|---|---|
| АГОНИСТ СИГМА-1 РЕЦЕПТОРОВ 5-этокси-2-[2-(морфолино)этилтио]-бензимидазола дигидрохлорид и/или основание - НОВОЕ СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТНОСТИ У ПАЦИЕНТОВ, СТРАДАЮЩИХ АЛКОГОЛЬНОЙ КАРДИОМИОПАТИЕЙ | 2017 |
|
RU2691636C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ АЛКОГОЛЬНОЙ КАРДИОМИОПАТИИ | 2013 |
|
RU2646454C2 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО С АНТИАРИТМИЧЕСКИМ И АНТИФИБРИЛЛЯТОРНЫМ ДЕЙСТВИЕМ | 2010 |
|
RU2477144C2 |
| Замещенные 1,2,5-триметил- и 2,2,6,6-тетраметил-4-аминопиперидины, обладающие антиишемическим действием | 2015 |
|
RU2686317C2 |
| СРЕДСТВО ДЛЯ КУПИРОВАНИЯ АБСТИНЕНТНОГО СИНДРОМА ПРИ ЗАВИСИМОСТИ ОТ ОПИАТОВ | 2012 |
|
RU2485954C1 |
| Бис(метоксибензиламиноалкил)амины, обладающие кардиотропной активностью | 2014 |
|
RU2624438C2 |
| ЭФИР ЯНТАРНОЙ КИСЛОТЫ 5-ГИДРОКСИАДАМАНТАН-2-ОНА, ПРЕПЯТСТВУЮЩИЙ РАЗВИТИЮ СЕРДЕЧНЫХ АРИТМИЙ | 2020 |
|
RU2757477C1 |
| СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ДИАБЕТА | 2013 |
|
RU2597848C2 |
| БИС(АЛКОКСИБЕНЗИЛ)АЛКАНДИАМИНЫ, ОБЛАДАЮЩИЕ КАРДИОТРОПНОЙ АКТИВНОСТЬЮ | 2021 |
|
RU2791576C2 |
| ЗАМЕЩЕННЫЕ N-[2-(1-АДАМАНТИЛАМИНО)-2-ОКСОЭТИЛ]-N-(АМИНОАЛКИЛ)АМИДЫ НИТРОБЕНЗОЙНЫХ КИСЛОТ | 2011 |
|
RU2500666C2 |
Предложено применение известного лекарственного средства 2-(2-морфолиноэтил)тио-5-этоксибензимидазол дигидрохлорида (анксиолитик афобазол) в качестве препарата с кардиопротективной активностью. Показано, что афобазол (5-10 мг/кг, в/в или в/б) на различных моделях ишемии миокарда и нарушений сердечного ритма проявляет выраженную кардиопро-тективную активность, которая реализуется преимущественно на уровне сердечной мышцы и может быть в определенной мере связана с его сродством к сигма1-рецепторам, локализованным в кардиомиоцитах. Антиаритмическое действие афобазола преимущественно обусловлено его способностью непосредственно повышать электрическую стабильность сердечной мышцы. Полученные данные дают основание рекомендовать анксиолитик афобазол для применения в клинике в качестве кардиопротектора с целью профилактики и лечения сердечно-сосудистых расстройств у пациентов, страдающих кардиофобическими и/или астено-депрессивными синдромами, течение которых отягощено заболеваниями сердца. 1 ил., 3 табл., 3 пр.
Применение 2-(2-морфолиноэтил)тио-5-этоксибензимидазол дигидрохлорида в качестве кардиопротективного средства.
| КРЫЖАНОВСКИЙ С.А | |||
| и др | |||
| Изучение антиишемического действия «афобазола» в условиях экспериментального инфаркта миокарда | |||
| - Бюллетень экспериментальной биологии и медицины, 2010, т.150, №9, сентябрь, с.284-287 | |||
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ИШЕМИЧЕСКИХ ПОРАЖЕНИЙ МОЗГА | 2004 |
|
RU2288714C2 |
| СПОСОБ КОРРЕКЦИИ ПСИХОВЕГЕТАТИВНЫХ ДИСФУНКЦИЙ И ПРОФИЛАКТИКИ НЕЙРО- И КАРДИОТОКСИЧЕСКИХ РЕАКЦИЙ ПОЛИХИМИОТЕРАПИИ У БОЛЬНЫХ ТУБЕРКУЛЕЗОМ | 2007 |
|
RU2354371C1 |
| DE 19918211 А1, 26.10.2000 | |||
| ИЗДЕЛИЕ ДЛЯ ИСПОЛЬЗОВАНИЯ В СИСТЕМЕ ПРЕДОСТАВЛЕНИЯ АЭРОЗОЛЯ БЕЗ ГОРЕНИЯ, СИСТЕМА ПРЕДОСТАВЛЕНИЯ АЭРОЗОЛЯ БЕЗ ГОРЕНИЯ И СПОСОБ ИЗГОТОВЛЕНИЯ ИЗДЕЛИЙ ДЛЯ ИСПОЛЬЗОВАНИЯ В СИСТЕМЕ ПРЕДОСТАВЛЕНИЯ АЭРОЗОЛЯ БЕЗ ГОРЕНИЯ | 2020 |
|
RU2816942C2 |
| МЕДВЕДЕВ В.Э | |||
| и | |||
Авторы
Даты
2013-02-27—Публикация
2010-11-12—Подача