Изобретение относится к области химии и медицины, а именно к биологически активным соединениям, конкретно к новой группе бис(алкоксибензил)алкандиаминов общей формулы (I)
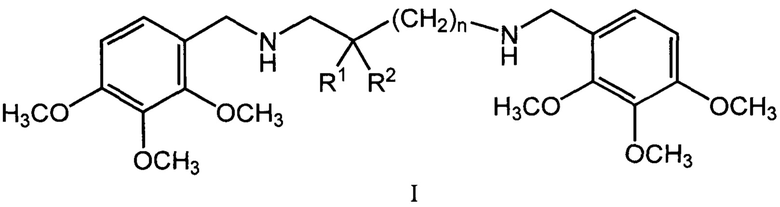
где n может иметь значения от 1 до 6, R1 и R2 могут быть атомами водорода, гидроксильными и алкильными группами, а также к физиологически приемлемым солям соединений I, предпочтительно к дигидрохлоридам общей формулы II (I*2HCl).
Заявляемые соединения обладают кардиотропной активностью.
Создание и внедрение в клиническую практику новых высокоэффективных кардиотропных лекарственных средств, сочетающих в себе антиишемические и антиаритмические свойства, является одной из наиболее приоритетных задач, стоящих перед современной кардиофармакологией. В последние годы все больший интерес вызывают лекарственные средства негемодинамического действия, механизм действия которых связан с оптимизацией метаболических процессов, протекающих как в ишемизированной, так и в условно-интактной сердечной мышце [McComick L.M. et al., Cardiovasc. Hematol. Agents Med. Chem., 2012, 10(4): 319-324; Grossman A.N. et al., Circulation, 2013, 127(9): 1040-1048; Олесова B.M. и др., Кардиология, 2013, 53(1): 66-71]. В этом плане особый интерес вызывают лекарственные средства, обладающие способностью модулировать в миокарде метаболизм свободных жирных кислот [Lopaschuk G.D. et al., Physiol. Rev., 2010, 90(1): 207-258; Lionetti V. et al., Cardiovasc. Res., 2011, 90(2): 202-209; Jaswai J.S. et al., Biochim. Biophys. Acta, 2011, 1813(7): 1333-1350]. Это связано с тем, что нарушение окисления свободных жирных кислот в ишемизированных кардиомиоцитах ответственно за формирование ишемической/постишемической дисфункции левого желудочка и/или развитие злокачественных нарушений сердечного ритма [Ingwall J.S., Cardiovasc. Res., 2009, 81(3): 412-419]. Известно, что дефицит кислорода, сопутствующий практически всем заболеваниям сердца, влечет за собой изменение метаболизма кардиомиоцитов. При этом основным источником АТФ становится анаэробный гликолиз, а аэробный синтез АТФ, осуществляемый за счет β-окисления свободных жирных кислот, снижается, что влечет за собой увеличение содержания недоокисленных свободных жирных кислот в зоне неадекватного кровоснабжения сердечной мышцы. Этот процесс получил название метаболического ремоделирования миокарда [van Bilsen М. et al., Cardiovasc. Res., 2004, 61(2): 218-226]. Имеющиеся данные о механизмах, лежащих в основе метаболического ремоделирования миокарда, позволили сформулировать теоретические подходы к медикаментозной миокардиальной цитопротекции - восстановление нормального метаболического потенциала клеток сердца, находящихся в зоне ишемии миокарда посредством подавления аномального метаболизма свободных жирных кислот в ишемизированных кардиомиоцитах [Bhandari В., Subramanian L., Recent Pat. Cardiovasc. Drug Discov., 2007, 2(1): 35-39; Fang Y.H. et al., J. Mol. Med. (Berl.), 2012, 90(1): 31-43]. Лекарственные препараты, обладающие такой активностью, получили название парциальные ингибиторы окисления жирных кислот - p-FOX ингибиторы (partial fatty acid oxidation ingibitorse).
В настоящее время в клинике применяются два p-FOX ингибитора первого поколения - препарат триметазидин (1-[(2,3,4-триметоксифенил)метил]пиперазин), блокирующий активность фермента 3-кето-ацил коэнзим А-тиолазы и тем самым подавляющий 4 фазу окисления свободных жирных кислот, и препарат ранолазин ((±)-N-(2,6-диметилфенил)-4[2-гидрокси-3(2-метоксифенокси)-пропил]-1-пиперазин ацетамид) - обратимый ингибитор NADH-дегидрогеназы митохондрий. Доклиническое изучение проходит p-FOX ингибитор второго поколения - соединение CVT-4325 [(R)-1-(2-метилбензо[d]тиазол-5-илокси)-3(4-((5-(4-(трифлуорометил)фенил)-1,2,4-оксадиазол-3-ил)метил)-пиперазин-1-ил)пропан-2-ол], блокирующий окисление свободных жирных кислот в митохондриях кардиомиоцитов [Imai М. et al., Cardiovasc. Drygs Ther., 2007, 21(1): 9-15; Partownavid P. et al., Crit. Care Med., 2012, 40(8): 24312437].
Результаты клинического применения триметазидина и ранолазина свидетельствуют о том, что эти препараты проявляют антиишемическую и антиаритмическую активность у пациентов, страдающих ишемической болезнью сердца, хронической сердечной недостаточностью, метаболическим синдромом, алкогольной кардиомиопатией и т.д. [Fragasso G. Et al., Curr. Pharm. Des., 2009, 15(8): 857-862; Ни B. et al., Clin. Cardiol., 2011, 34(6): 395-400; Zhang L. et al., J. Am. Coll. Cardiol., 2012, 59(10): 913-922; Vizzardi E. et al., J. Cardiovasc. Pharmacol. Ther., 2012, 17(4): 353-356; Sossalla S., Maier L.S., Pharmacol. Ther., 2012, 133(3): 311-323].
Исходя из изложенного, представляется своевременным и актуальным поиск лекарственных средств, потенциально обладающих свойствами pFOX-ингибиторов.
Одним из возможных подходов к решению этой проблемы является поиск кардиотропных средств в ряду представителей бис(алкоксибензил)алкандиаминов общей формулы I, сконструированных с учетом структурных элементов препаратов триметазидина, ранолазина и верапамила, а также бис(метоксибензиламиноалкил)аминов [Патент РФ №2624438].
Наиболее близкими прототипами по химическому строению являются производные бис(метоксибензиламиноалкил)аминов [Патент РФ №2624438]. Они отличаются от заявляемых веществ общей структуры I наличием триазаалканового линкера вместо диазаалканового линкера, связывающего ароматические группы.
В основу настоящего изобретения положена задача получения новых соединений с высокой антиаритмической и антиишемической эффективностью и большой широтой терапевтического действия, с целью создания препарата для лечения нарушений сердечного ритма.
Синтез и успешные результаты изучения кардиотропной активности бис(алкоксибензил)алкандиаминов I являются предметом защиты настоящего патента.
Техническим результатом настоящего изобретения является эффективное предотвращение нарушения ритма сердца и ишемических нарушений сердца при помощи бис(алкоксибензил)алкандиаминов общей формулы I.
Соединения общей формулы I в специальной и патентной литературе не описаны. В качестве примеров соединений формулы I настоящего изобретения следует назвать:
N1,N5-бис(2,3,4-триметоксибензил)-пентан-1,5-диамин (Iа),
N1,N6-бис(2,3,4-триметоксибензил)-гексан-1,6-диамин (Iб),
N1,N4-бис(2,3,4-триметоксибензил)-бутан-1,4-диамин (Iв),
1,3-бис((2,3,4-триметоксибензил)амино)пропан-2-ол (Iг),
1,3-бис((2,3,4-триметоксибензил)амино)пропана (Iд),
1,3-бис((2,3,4-триметоксибензил)амино)-2,2-диметилпропана (Iе).
В соответствии с настоящим изобретением соединения общей формулы I и II можно получить по следующей общей схеме:

где n может иметь значения от 1 до 6, R1 и R2 могут быть атомами водорода, гидроксильными и алкильными группами.
Целевые бис(алкоксибензил)алкандиамины (I) могут быть получены путем каталитического гидрирования продуктов взаимодействия 2,3,4-триметоксибензальдегида (III) с алкандиаминами (IV) в соотношении 2,1:1, соответственно, в растворах низших спиртов с использованием катализаторов гидрирования, таких как палладий, платина, никель Ренея. В качестве другого способа получения бис(метоксибензиламиноалкил)аминов (I) может быть использовано восстановление продуктов взаимодействия 2,3,4-триметоксибензальдегида (III) с алкандиаминами (IV) в соотношении 2:1 соответственно в растворах низших спиртов с помощью комплексных гидридов, таких как боргидрид натрия. В качестве спиртов в обоих случаях могут быть использованы метанол, этанол, изопропанол.
Для получения физиологически приемлемых солей присоединения кислот II бис(алкоксибензил)алкандиамины (I) можно вводить во взаимодействие с неорганическими или органическими кислотами, предпочтительно с соляной кислотой.
Соединения I представляют собой густые масла растворимые в органических растворителях. Дигидрохлориды (II) представляют собой высокоплавкие белые кристаллические вещества, хорошо растворимые в воде и нерастворимые в эфирах, например диэтиловом эфире, и ароматических растворителях, например, бензоле, толуоле.
Строение веществ общей формулы I и II подтверждено данными спектров ЯМР 1Н, а их чистота - данными элементного анализа.
Пример 1: Дигидрохлорид N1,N5-бис(2,3,4-триметоксибензил)-пентан-1,5-диамина (IIа, АЛМ-844).
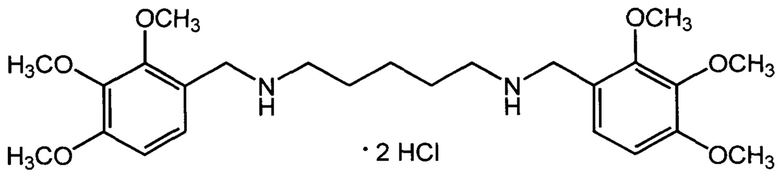
Смесь 15,1 г (77 ммоль) 2,3,4-триметоксибензальдегида и 3,6 г (35 ммоль) пентаметилендиамина в 100 мл этанола выдерживали при комнатной температуре в течение одного часа. К раствору прибавляли 1,0 г палладиевого катализатора (PdO/C, 10% Pd) и гидрировали при перемешивании при атмосферном давлении и комнатной температуре до полного поглощения водорода. Катализатор отфильтровывали, фильтрат упаривали досуха. Остаток растворяли в 150 мл ацетона, и к раствору прибавляли концентрированную соляную кислоту до кислой реакции. Осадок отфильтровывали и перекристаллизовывали из изопропанола. Выход 11,1 г (60%). Т. пл. 190-192°С (с разл). Найдено, %: С 56,22; Н 7,56; Cl 13,55; N 5,20. C25H40Cl2N2O6. Вычислено, %: С 56,07; Н 7,53; С1 13,24; N 5,23. Спектр ЯМР 1Н (DMSO, δ, м.д.): 1.35 (м, 2 Н, CH2CH2CH2NH); 1.67 (м, 4 Н, 2 CH2CH2NH); 2.82 (т, 4 Н, 2 CH2NH, J3=7.2 Гц); 3.76, 3,81 и 3.87 (3 с, по 6 Н, 6 ОСН3); 4.00 (с, 4 Н, 2 NHCH2Ar); 6.86 и 7.30 (2 д, по 2 Н, 4 ArH, J3=8.7 Гц); 9.17 (уш. с, 2 Н, 2 NH).
Пример 2: Дигидрохлорид N1,N6-бис(2,3,4-триметоксибензил)-гексан-1,6-диамина (IIб, АЛМ-845).

Получен из 2,3,4-триметоксибензальдегида и 1,6-гександиамина по описанному в примере 1 методу. Выход 59%. Т. пл. 141-143°С (с разл) (из изопропанола). Найдено, %: С 57,07; Н 7,59; Cl 12,96; N 5,36. C26H42Cl2N2O6. Вычислено, %: С 56,83; Н 7,70; Cl 12,90; N 5,10. Спектр ЯМР 1Н (DMSO, δ, м.д.): 1.30 (м, 4 Н, 2 CH2CH2CH2NH); 1.67 (м, 4 Н, 2 CH2CH2NH); 2.82 (т, 4 Н, 2 CH2NH, J3=7.2 Гц); 3.76, 3,81 и 3.87 (3 с, по 6 Н, 6 ОСН3); 3.99 (с, 4 Н, 2 NHCH2Ar); 6.85 и 7.31 (2 д, по 2 Н, 4 ArH, J3=8.7 Гц); 9.21 (уш. с, 2 Н, 2 NH).
Пример 3: Дигидрохлорид N1,N4-бис(2,3,4-триметоксибензил)-бутан-1,4-диамина (IIв, АЛМ-847).
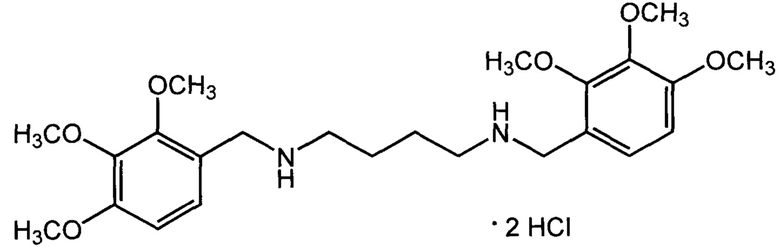
Получен из 2,3,4-триметоксибензальдегида и 1,4-бутандиамина по описанному в примере 1 методу. Выход 66%. Т. пл. 151-153°С (с разл) (из изопропанола). Найдено, %: С 55,09; Н 7,30; Cl 13,71; N 5,39. C24H38Cl2N2O6. Вычислено, %: С 55,28; Н 7,35; Cl 13,60; N 5,37. Спектр ЯМР 1Н (DMSO, δ, м.д.): 1.73 (м, 4 Н, 2 CH2CH2NH); 2.87 (м, 4 Н, 2 CH2NH); 3.76, 3,81 и 3.88 (3 с, по 6 Н, 6 ОСН3); 4.01 (с, 4 Н, 2 NHCH2Ar); 6.86 и 7.29 (2 д, по 2 Н, 4 ArH, J3=8.7 Гц); 9.21 (уш. с, 2 Н, 2.NH).
Пример 4: Дигидрохлорид 1,3-бис((2,3,4-триметоксибензил)амино)пропан-2-ола (IIг, АЛМ-850).
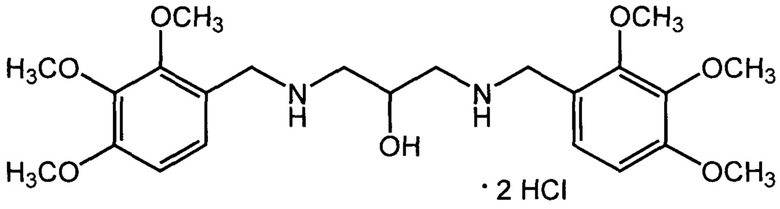
Получен из 2,3,4-триметоксибензальдегида и 1,3-диаминопропан-2-ола по описанному в примере 1 методу. Выход 60%. Т. пл. 161-163°С (с разл) (из изопропанола). Найдено, %: С 52,56; Н 7,21; Cl 13,36; N 5,22. C23H36Cl2N2O7. Вычислено, %: С 52,78; Н 6,93; Cl 13,54; N 5,35. Спектр ЯМР 1Н (DMSO, δ, м.д.): 2.89 и 3.05 (два м, по 2Н, CH2CH CH2); 3.76, 3,81 и 3.88 (3 с, по 6 Н, 6 ОСН3); 4.06 (с, 4 Н, 2 NHCH2Ar); 4.33 (м, 1 Н, СНОН); 6.25 (д, 1 Н, ОН, J3=5.2 Гц); 6.85 и 7.27 (2 д, по 2 Н, 4 ArH, J3=8.7 Гц); 9.03-9.29 (уш. м, 2 Н, 2 NH).
Пример 5: Дигидрохлорид 1,3-бис((2,3,4-триметоксибензил)амино)пропана (IIд, АЛМ-851).
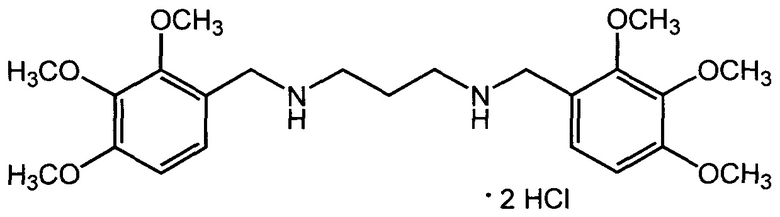
Получен из 2,3,4-триметоксибензальдегида и 1,3-пропандиамина по описанному в примере 1 методу. Выход 71%. Т. пл. 171-173°С (с разл) (из изопропанола). Найдено, %: С 54,22; Н 7,17; С1 14,06; N 5,70. C23H36Cl2N2O6. Вычислено, %: С 54,44; Н 7,15; Cl 13,97; N 5,52. Спектр ЯМР 1Н (DMSO, δ, м.д.): 2.17 (квинтет, 2 Н, CH2CH2NH, J3=6,7 Гц); 2.97 (т, 4 Н, 2 CH2NH, J3=6,7 Гц); 3.76, 3,81 и 3.88 (3 с, по 6 Н, 6 ОСН3); 4.00 (с, 4 Н, 2 NHCH2Ar); 6.86 и 7.32 (2 д, по 2 Н, 4 ArH, J3=8.7 Гц); 9.45 (уш. с, 2 Н, 2 NH).
Пример 6: Дигидрохлорид 1,3-бис((2,3,4-триметоксибензил)амино)-2,2-диметилпропана (Не, АЛМ-861).
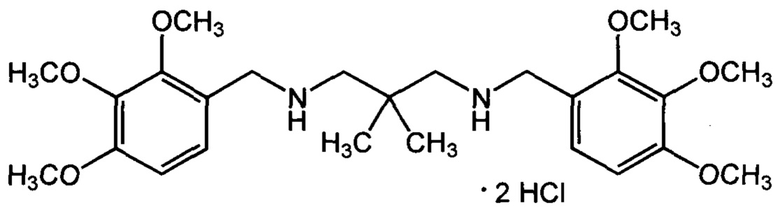
Получен из 2,3,4-триметоксибензальдегида и 2,2-диметил-пропандиамина-1,3 по описанному в примере 1 методу. Выход 58%. Т. пл. 169-173°С (с разл) (из изопропанола). Найдено, %: С 55,92; Н 7,39; Cl 12,99; N 5,39. C25H40Cl2N2O6. Вычислено, %: С 56,07; Н 7,53; Cl 13,24; N 5,23. Спектр ЯМР 1H (DMSO, δ, м.д.): 1.10 (с, 6 Н, 2 СН3); 2.89 (с, 4 Н, 2 CH2NH); 3.75, 3,81 и 3.87 (3 с, по 6 Н, 6 ОСН3); 4.07 (с, 4 Н, 2 NHCH2Ar); 6.84 и 7.42 (2 д, по 2 Н, 4 ArH, J3=8.7 Гц); 9.22 (уш. с, 2 Н, 2 NH).
Фармакологические свойства заявляемых соединений
Пример 1. LD50 заявляемых соединений
Полулетальную дозу LD50 заявляемых соединений изучали в опытах на беспородных мышах-самцах массой тела 21-24 г, полученных из ФГБУН «Научный центр биомедицинских технологий Федерального медико-биологического агентства», филиал «Столбовая». Животные имели ветеринарный сертификат и прошли карантин в виварии ФГБНУ «НИИ фармакологии имени В.В. Закусова». Животных содержали с представлением брикетированного корма ad libitum при регулируемом 12/12 световом режиме в соответствии с приказом Минздрава России №199н от 01 апреля 2016 года «Об утверждении правил надлежащей лабораторной практики» и СП 2.2.1.3218-14 «Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)» от 29 августа 2014 г. №51. Все работы с лабораторными животными были выполнены в соответствии с общепринятыми нормами обращения с животными, на основе стандартных операционных процедур, принятых в НИИ фармакологии им. В.В. Закусова, международными правилами (European Communities Council Directive of November 24,1986 (86/609/EEC)), а также в соответствии с «Правилами работы с животными», утвержденными биоэтической комиссией ФГБНУ «НИИ фармакологии имени В.В. Закусова».
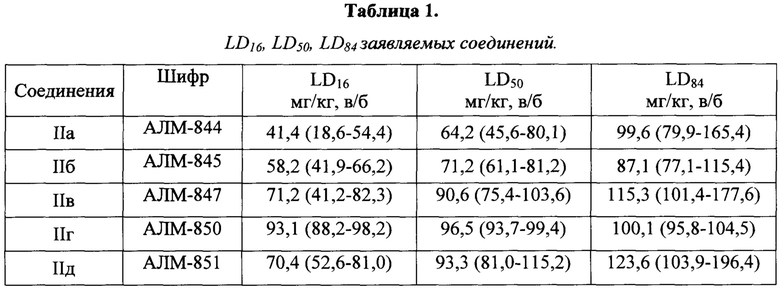
Заявляемые соединения вводили внутрибрюшинно. В качестве растворителя использовали стерильный изотонический 0,9% раствор натрия хлорида. Каждое соединение тестировали, как минимум, в пяти различных дозах, количество животных в каждой серии 6. Летальность животных оценивали через 24 часа после введения заявляемых соединений. По методу Литчфилда-Уилкоксона рассчитывали LD16, LD50 и LD84 с их доверительными 95% интервалами, (табл. 1).
Значения LD50 у заявляемых соединений находились в диапазоне от 64,2 до 93,3 мг/кг. Эти значения полулетальных доз позволяют отнести исследуемые вещества к III классу токсичности (табл. 1).
Пример 2. Результаты исследования антиишемической активности заявляемых соединений
Опыты проводили на белых беспородных крысах-самцах массой 220-250 г, полученных из ФГБУН «Научный центр биомедицинских технологий Федерального медико-биологического агентства», филиал «Столбовая». Животные имели ветеринарный сертификат и прошли карантин в виварии ФГБНУ «НИИ фармакологии имени В.В. Закусова». Животных содержали с представлением брикетированного корма ad libitum при регулируемом 12/12 световом режиме в соответствии с приказом Минздрава России №199н от 01 апреля 2016 года «Об утверждении правил надлежащей лабораторной практики» и СП 2.2.1.3218-14 «Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)» от 29 августа 2014 г. №51. Все работы с лабораторными животными были выполнены в соответствии с общепринятыми нормами обращения с животными, на основе стандартных операционных процедур, принятых в НИИ фармакологии им. В.В. Закусова, международными правилами (European Communities Council Directive of November 24,1986 (86/609/EEC)), а также в соответствии с «Правилами работы с животными», утвержденными биоэтической комиссией ФГБНУ «НИИ фармакологии имени В.В. Закусова».
Животных наркотизировали уретаном (1300 мг/кг, в/б). Острую субэндокардиальную ишемию миокарда вызывали по методу, описанному S. Yamamoto с соавторами [Yamamoto S. et al. J. Cardiovasc. Pharmacol. 2002. V. 39 (2). P. 234-241]. Для этой цели животным с помощью инъектора «Линеомат» (Россия) внутривенно со скоростью 20 мкг/кг/мин вводили неселективный агонист β-адренорецепторов изопротеренол. Об интенсивности ишемического повреждения судили по величине депрессии сегмента ST на ЭКГ (II стандартное отведение) через 5 минут от момента начала инфузии изопротеренола. В качестве регистратора использовали компьютерный электрокардиограф «Полиспектр 8/ЕХ» (Нейрософт, Россия). В качестве препарата сравнения использовался верапамил в дозе 1 мг/кг.
Все исследуемые соединения вводили внутривенно за 2 минуты до начала инфузии изопротеренола в 0,3 мл изотонического раствора натрия хлорида. Животные контрольной группы получали эквивалентный объем изотонического раствора натрия хлорида.
Полученные результаты обрабатывали статистически. Нормальность распределения оценивали с помощью критерия Шапиро-Уилка, гомогенность дисперсий -по критерию Левена.
Так как результаты имели нормальное распределение и выборочные дисперсии были гомогенны, для определения значимости различий использовали однофакторный дисперсионный анализ с последующей обработкой методом множественных сравнений по Даннету. Различия считали значимыми при Р≤0,05, критерий двухсторонний. Полученные результаты выражали в виде среднего арифметического и его стандартной ошибки.
Результаты изучения антиишемической активности заявленных соединений представлены в таблице 2. Как следует из полученных данных, соединения АЛМ-844 (1 мг/кг), АЛМ-845 (2 мг/кг), АЛМ-850 (3 мг/кг) и АЛМ-851 (3 мг/кг) при внутривенном введении проявляют значительную антиишемическую активность. Следует отметить, что заявляемые соединения по своей антиишемической активности близки к эталонному для этой модели антагонисту ионов Са2+ верапамилу.
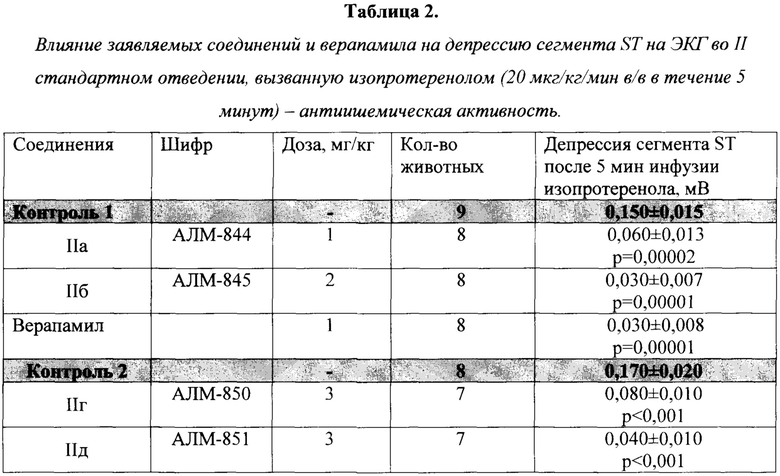
р - указано по отношению к контролю
Пример 3. Результаты исследования антиаритмической активности изучаемых соединений
3.1. Исследование антиаритмической активности заявляемых соединений на модели аконитиновой аритмии
Опыты проводили на беспородных крысах-самцах массой тела 160-180 г, полученных из ФГБУН «Научный центр биомедицинских технологий Федерального медико-биологического агентства», филиал «Столбовая». Животные имели ветеринарный сертификат и прошли карантин в виварии ФГБНУ «НИИ фармакологии имени В.В. Закусова». Животных содержали с представлением брикетированного корма ad libitum при регулируемом 12/12 световом режиме в соответствии с приказом Минздрава России №199н от 01 апреля 2016 года «Об утверждении правил надлежащей лабораторной практики» и СП 2.2.1.3218-14 «Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)» от 29 августа 2014 г. №51. Все работы с лабораторными животными были выполнены в соответствии с общепринятыми нормами обращения с животными, на основе стандартных операционных процедур, принятых в НИИ фармакологии им. В.В. Закусова, международными правилами (European Communities Council Directive of November 24, 1986 (86/609/EEC)), а также в соответствии с «Правилами работы с животными», утвержденными биоэтической комиссией ФГБНУ «НИИ фармакологии имени В.В. Закусова».
Эксперименты проводили в условиях накоза уретаном (1300 мг/кг в/б). Животным контрольной группы вводили аконитин, а животным основных групп - изучаемые соединения и аконитин. Животным основных групп за 2 минуты до инъекции аконитина в/в вводили (в 0,2-0,3 мл апирогенной воды для инъекций) исследуемые соединения. Контрольным животным по аналогичной схеме вводили 0,3 мл апирогенной воды для инъекций. Наркотизированных животных (уретан 1300 мг/кг, в/б) фиксировали в положении на спине на подогреваемом операционном столике (Kent Scientific Corporation, США). Левую бедренную вену катетеризировали для введения аконитина гидрохлорида и изучаемых соединений. Перед началом эксперимента у животных регистрировали ЭКГ (стандартные отведения, калибровочный сигнал 20 мВ, скорость записи 50 мм/сек, продолжительность записи 60 секунд). В качестве регистратора использовали компьютерный электрокардиограф «Поли-Спектр 8/В» (Россия). Затем подбирали дозу аконитина гидрохлорида (n=31, в/в, болюсом), которая во всех экспериментах в пределах 1-2 минут после окончания его введения вызывает политопную предсердно-желудочковую экстрасистолию; величина подобранной дозы 30-50 мкг/кг. После подбора дозы аконитина гидрохлорида, во всех сериях экспериментов изучаемые соединения вводили в/в (в 0,2-0,3 мл) за 2 минуты до введения аконитина гидрохлорида. Непрерывную регистрацию ЭКГ начинали за 2 минуты до начала введения аконитина гидрохлорида или исследуемых соединений и продолжали в течение 20 минут от момента окончания в/в введения аконитина гидрохлорида. Перед началом каждой из 2-ой - 7-ой серии экспериментов в тестовом режиме на 3-5 животных оценивали (подтверждали) ранее выбранную аритмогенную дозу аконитина гидрохлорида - 0,2 мг/кг.
Статистическую обработку данных, измеренных в бинарной шкале, проводили с помощью метода точной вероятности Фишера с учетом множественности сравнений.
Результаты изучения антиаритмической активности представлены в таблице 3. Как следует из полученных данных, выраженную антиаритмическую активность на данной модели, патогомоничной для антиаритмиков I класса по классификации Vaughan Williams, проявляли при внутривенном введении соединения АЛМ-844 (1 мг/кг), АЛМ-845 (2 мг/кг), АЛМ-850 (3 мг/кг) и АЛМ-851 (3 мг/кг). При этом соединения АЛМ-845 и АЛМ-851 полностью предотвращали нарушения ритма сердца крыс, а соединения АЛМ-844 и АЛМ-850 - предотвращали нарушения в 71% случаях. Во всех используемых контрольных группах нарушения ритма наблюдались у 100% животных.
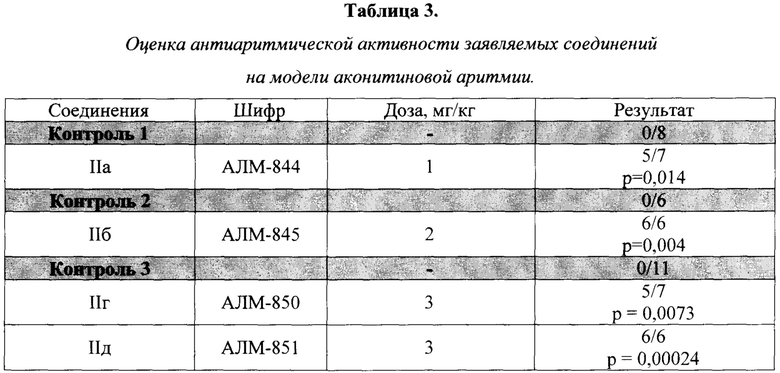
р - указано по отношению к контролю. В числителе указано количество животных, у которых в течение 10 минут после введения аконитина не развивались фатальные нарушения ритма, в знаменателе объем выборки.
3.2. Исследование антиаритмической активности заявляемых соединений на модели хлоридкальциевой аритмии
Опыты проводили на беспородных крысах-самцах массой тела 250-320 г, полученных из ФГБУН «Научный центр биомедицинских технологий Федерального медико-биологического агентства», филиал «Столбовая». Животные имели ветеринарный сертификат и прошли карантин в виварии ФГБНУ «НИИ фармакологии имени В.В. Закусова». Животных содержали с представлением брикетированного корма ad libitum при регулируемом 12/12 световом режиме в соответствии с приказом Минздрава России №199н от 01 апреля 2016 года «Об утверждении правил надлежащей лабораторной практики» и СП 2.2.1.3218-14 «Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)» от 29 августа 2014 г. №51. Все работы с лабораторными животными были выполнены в соответствии с общепринятыми нормами обращения с животными, на основе стандартных операционных процедур, принятых в НИИ фармакологии им. В.В. Закусова, международными правилами (European Communities Council Directive of November 24, 1986 (86/609/EEC)), а также в соответствии с «Правилами работы с животными», утвержденными биоэтической комиссией ФГБНУ «НИИ фармакологии имени В.В. Закусова».
Эксперимента проводили в условиях наркоза уретаном (1300 мг/кг в/б). Животные были рандомизированы в группы, количество животных в группе от 6 до 12. Животным контрольной группы вводили хлорид кальция, а животным основных групп - изучаемые соединения и хлорид кальция. Животным основных групп за 2 минуты до инъекции хлорида кальция в/в вводили (в 0,2-0,3 мл апирогенной воды для инъекций) исследуемые соединения. Контрольным животным по аналогичной схеме вводили 0,3 мл апирогенной воды для инъекций.
Наркотизированных животных (уретан 1300 мг/кг, в/б) фиксировали в положении на спине на подогреваемом операционном столике (Kent Scientific Corporation, США). Левую бедренную вену катетеризировали для введения хлорида кальция и изучаемых соединений. Перед началом эксперимента у животных регистрировали ЭКГ (стандартные отведения, калибровочный сигнал 20 мВ, скорость записи 50 мм/сек, продолжительность записи 60 секунд). В качестве регистратора использовали компьютерный электрокардиограф «Поли-Спектр 8/В» (Россия). Затем подбирали дозу хлорида кальция (n-17, в/в, болюсом), которая во всех экспериментах в пределах 1-2 минут после окончания его введения вызывает фибрилляцию желудочков сердца; величина подобранной дозы - 200-250 мг/кг. После подбора дозы хлорида кальция во всех сериях экспериментов изучаемые соединения вводили в/в (в 0,2-0,3 мл апирогенной воды для инъекций) за 2 минуты до введения хлорида кальция. Непрерывную регистрацию ЭКГ начинали за 2 минуты до начала введения хлорида кальция или исследуемых соединений и продолжали в течение 20 минут от момента окончания в/в введения хлорида кальция.
Статистическую обработку полученных данных проводили с помощью метода точной вероятности Фишера с учетом множественности сравнений.
Результаты изучения антиаритмической активности представлены в таблице 4. Выраженную антиаритмическую активность на хлоридкальциевой модели, патогомоничной для антиаритмиков IV класса по классификации Vaughan Williams, проявляли соединения АЛМ-844 (1 мг/кг), АЛМ-850 (3 мг/кг) и АЛМ-851 (3 мг/кг). Эти соединения предотвращали гибель 63-67% животных при 100%-ной гибели в контрольных группах.
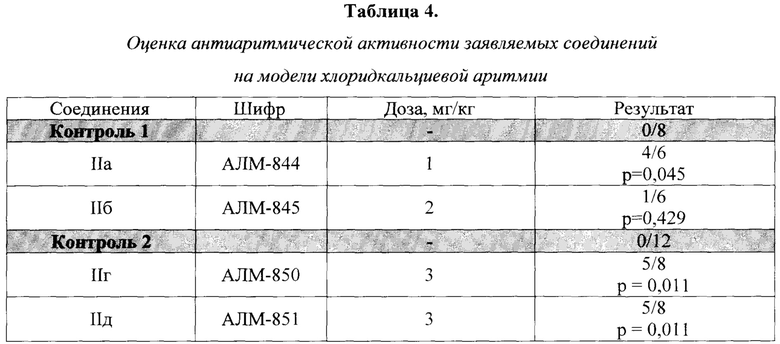
р - указано по отношению к контролю. В числителе указано количество выживших животных, в знаменателе объем выборки.
Заключение
Бис(алкоксибензил)алкандиамины общей формулы I в виде гидрохлоридов общей формулы II обладают антиишемической и антиаритмической активностью в моделях изопротереноловой ишемии, аконитиновой аритмии и хлоридкальциевой аритмии у крыс при внутривенном введении в дозах 1-3 мг/кг.
| название | год | авторы | номер документа |
|---|---|---|---|
| 2,2'-окси- и 2,2'-тио-бис(N-(2,3,4-триметоксибензил)этан-1-амины), обладающие кардиотропной активностью | 2023 |
|
RU2813348C1 |
| 1-(Метоксибензил)-4-[2-((метоксибензил)амино)этил]пиперазины, обладающие антиаритмической активностью | 2018 |
|
RU2751878C2 |
| N-бензил-N-(2-((2,3,4-триметоксибензил)амино)этан-1,2-диамины, обладающие кардиотропной активностью | 2023 |
|
RU2834294C1 |
| Органические соли N-(2,3,4-триметоксибензил)-N-{ 2-[(2,3,4-триметоксибензил)амино]этил} -1,2-этан-диамина | 2022 |
|
RU2813347C2 |
| Бис(метоксибензиламиноалкил)амины, обладающие кардиотропной активностью | 2014 |
|
RU2624438C2 |
| Кардиотропное средство с анксиолитическими и анальгетическими свойствами | 2020 |
|
RU2773018C2 |
| ВЕЩЕСТВО, ВОССТАНАВЛИВАЮЩЕЕ ФИЗИЧЕСКУЮ РАБОТОСПОСОБНОСТЬ ПОСЛЕ ОСТРОГО УТОМЛЕНИЯ | 2021 |
|
RU2784542C2 |
| Замещенные 1,2,5-триметил- и 2,2,6,6-тетраметил-4-аминопиперидины, обладающие антиишемическим действием | 2015 |
|
RU2686317C2 |
| Производные пиридинов со свойствами Epac-ингибиторов | 2023 |
|
RU2837899C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО С КАРДИОПРОТЕКТИВНОЙ АКТИВНОСТЬЮ | 2010 |
|
RU2476224C2 |
Изобретение относится к области органической химии, а именно к новым бис(алкоксибензил)алкандиаминам общей формулы I и их физиологически приемлемым солям, предпочтительно дигидрохлоридам общей формулы II (I*2НСl), исключая 1,3-бис((2,3,4-триметоксибензил)амино)пропан, обладающим кардиотропной активностью. В указанной формуле n может иметь значения от 1 до 6, R1 и R2 могут быть атомами водорода, гидроксильными и алкильными группами. Изобретение также относится к методу лечения ишемической болезни и аритмии путем введения эффективных количеств соединений общей формулы I. 3 н.п. ф-лы, 4 табл., 9 пр.
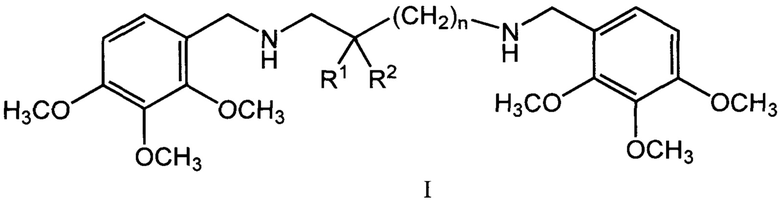
1. Бис(алкоксибензил)алкандиамины общей формулы I
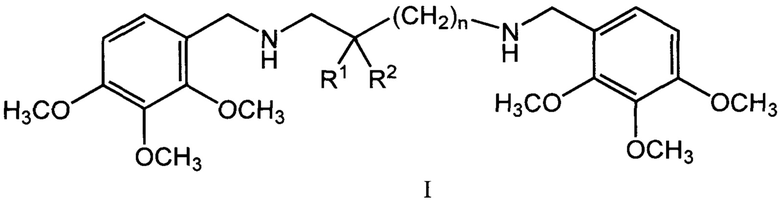 ,
,
где n может иметь значения от 1 до 6, R1 и R2 могут быть атомами водорода, гидроксильными и алкильными группами, а также физиологически приемлемые соли соединений I, предпочтительно дигидрохлориды общей формулы II (I*2НСl), исключая 1,3-бис((2,3,4-триметоксибензил)амино)пропан.
2. Соединения по п. 1, обладающие кардиотропной активностью.
3. Метод лечения ишемической болезни и аритмии путем введения эффективных количеств соединений по п. 1.
| YASAR S | |||
| ET AL., Benzylic Imidazolidinium, 3,4,5,6-Tetrahydropyrimidinium and Benzimidazolium Salts: Applications in Ruthenium-Catalyzed Allylic Substitution Reactions, EUROPEAN JOURNAL OF ORGANIC CHEMISTRY, 2008(12), pp | |||
| Коммутатор для переговорных телефонных будок | 1923 |
|
SU2142A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| BURNS M | |||
| R | |||
| ET AL., Induction of apoptosis by aryl-substituted diamines: role of | |||
Авторы
Даты
2023-03-10—Публикация
2021-02-09—Подача