Изобретение относится к химии биологически активных соединений, конкретно к новой группе замещенных 1,2,5-три- и 2,2,6,6-тетраалкил-4-аминопиперидинам формулы Ia, б:
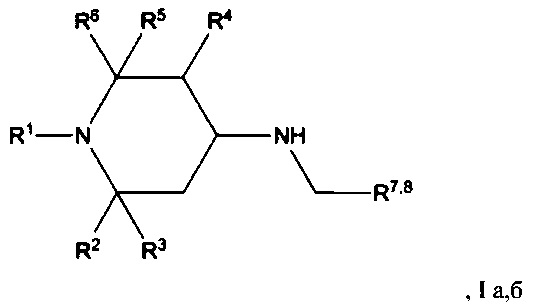
где R1, R2, R3, R4, R5, R6 могут быть водородом или алкильной группой, R7, R8 - ароматическим, гетероароматическим заместителем, и к их фармацевтически приемлемым солям присоединения кислот, предпочтительно к гидрохлоридам общей формулы (Ia, б⋅HCl).
Заявляемые соединения обладают кардиотропной, в частности, антиишемической активностью.
В настоящее время в клинике присутствует большое количество лекарственных средств для профилактики и лечения ишемической болезни сердца и сопутствующих ей осложнений. Вместе с тем, применение антиишемических лекарственных средств гемодинамического действия (органические нитраты, β-блокаторы, антагонисты кальция и др.) у пациентов, у которых ишемическая болезнь сердца протекает на фоне низких цифр артериального давления и/или низкой частоты сердечных сокращений не всегда возможно из-за высокого риска возникновения резкой гипотонии и/или резкой брадикардии. В этом плане интерес представляют антиишемические лекарственные средства метаболического действия, которые реализуют свое антиишемическое действие за счет оптимизации метаболизма ишемизированных кардиомиоцитов.
Особый интерес к этой группе лекарственных средств возник в конце XX - начале XXI века, когда было убедительно показано, что формирование большинства адаптационных ишемических синдромов (stunned myocardium, гибернация и прекондиционирование) связано с особенностями метаболизма ишемизированных кардиомиоцитов [Young L.H. et al. Am. J. Cardiol. 1999; 83(12A): 25H-30H; Guertl B. et al. Int. J. Exp. Pathol. 2000; 81(6): 349-372; Myrmel Т., Korvald C. Scand. Cardiovasc. J. 2000; 34(3): 233-241]. Известно, что в условиях ишемии миокарда основным источником АТФ является анаэробный гликолиз. При этом происходит подавление аэробного синтеза АТФ, осуществляемого за счет физиологического β-окисления свободных жирных кислот, в результате чего в зоне неадекватного кровообращения миокарда содержание недоокисленных свободных жирных кислот резко возрастает [Ussher J.R. et al. Cardiovasc. Res. 2012; 94(2): 359-369; Tousoulis D. et al. Curr. Pharm. Des. 2013; 19(9): 1587-1592]. Этот процесс получил название «метаболическое ремоделирование миокарда» [van Bilsen М. et al. Cardiovasc. Res. 2004; 61(2): 218-226]. В дальнейшем было показано, что именно дисбаланс между окислением глюкозы и свободных жирных кислот в ишемизированных кардиомиоцитах обуславливает формирование ишемической/постишемической дисфункции левого желудочка сердца, его ремоделирование и повышает риск развития злокачественных нарушений сердечного ритма [Brown D.A., O'Rourke В. Cardiovasc. Res. 2010: 88(2): 241-249; Snorek M. et al. Physiol. Res. 2012; 61(6): 567-574; Ndukwe Erlingsson U.C. et al. Bioche. Iophys. Res. Commun. 2013; 437(4): 637-641], а также инициирует процессы, ответственные за апоптоз кардиомиоцитов [Gao Х.М. et al. 2011; 50(6): 991-999].
Накопленные данные о механизмах, лежащих в основе метаболического ремоделирования миокарда, позволили сформулировать теоретические подходы к медикаментозной цитопротекции - процессу восстановления энергетического метаболизма ишемизированных кардиомиоцитов путем подавления аномального метаболизма свободных жирных кислот [Stanley W.C. Expert Opin. Investig. Drugs. 2002; 11(5): 615-629; Marzilli M. Coron. Artery Dis. 2004; Suppl. 1: S23-27; Zhou L. et al. J. Physiol. 2005; 569(Pt 3): 925-937], т.е. создание и внедрение в клинику новых лекарственных средств метаболического действия для лечения ишемических сердечно-сосудистых заболеваний.
Первоначально группа лекарственных средств, обладающих способностью подавлять аномальное β-окисление свободных жирных кислот, получила название блокаторы 3-кето-ацил коэнзим А-тиолазы, поскольку именно этот механизм лежал в основе кардиопротективного действия единственного представителя этой группы - триметазидина. Однако по мере внедрения в широкую клиническую практику ряда других препаратов метаболического действия, в частности, ранолазина, в основе кардиопротективного действия которого лежит не блокада 3-кето-ацил коэнзим А-тиолазы, а обратимое ингибирование НАДН+-дегидрогеназы митохондрий, эту группу лекарственных средств объединили под названием «парциальные ингибиторы окисления жирных кислот» - p-FOX ингибиторы (partial fatty acid oxidation ingibitorse).
В настоящее время получены убедительные клинические данные, свидетельствующие о том, что препараты этой группы - триметазидин и ранолазин, - с успехом применяются для лечения стабильной стенокардии напряжения [Vitale С. et al. Int. J. Cardiol. 2013; 168(2): 1078-1081; Codolosa J.N. et al. Vase. Health Risk Manag. 2014; 10: 353-362], хронической сердечной недостаточности [Fragasso G. et al. Int. J. Cardiol. 2013; 163(3): 320-325; Hawwa N., Menon V. Am. J. Cardiovasc. Drugs. 2013; 13(1): 5-16], диабетической и алкогольной кардиомиопатии [Драпкина О.М. с соавт. Врач. 2005; 8: 48-50., 2008; Vizzardi Е. et al. Drug Discov. Ther. 2013; 7(1): 43-45; Xu X. et al. Clin. Drug Invest. 2014; 34(4): 251-258], восстановления насосной функции сердца у пациентов, перенесших инфаркт миокарда [Xu Х.Н. et al. Zhonghua Xin Xue Guan Bing Za Zhi. 2013; 41(3): 205-259]. Помимо этого, для ранолазина показана высокая антиаритмическая активность [Yeung Е. et al. 2014. Ann. Noninvasive Elecrtocardiol. 2014; 19(4): 345-350; Fragakis N. et al. Pacing Clin. Electrophysiol. 2014; 37(10): 1412-1420].
Исходя из изложенного, представляется своевременным и актуальным поиск новых лекарственных средств, потенциально обладающих свойствами p-Fox ингибиторов. Одним из возможных подходов к решению этой проблемы является поиск кардиотропных средств в ряду новых производных замещенных три- и тетраметил-4-аминопиперидинов.
Известно, что производные пиперидина проявляют разнообразную биологическую активность, в частности, известен ряд препаратов самого разнообразного типа действия:
- Анальгетики - фентанил [F.J. Gadocki et al. US Pat. 3141823 (1964)]; промедол [Назаров И.Н., ЖОХБ 26Б 2798 (1956);
- Анестетики - мепивакаин [E. Thuresson et al. US Pat. 2799679 (1957), B.T. Ekenstram et al. Acta Chem. Scan. 11, 1183 (1957);
- Стимуляторы - метилфенидат [M. Hartman et al. US Pat. 2507631 (1950)];
- Нейролептики - галоперидол [P. Janssen et al. Belg. Pat. 577,977 (1959)];
- Антигистаминного действия - дифенилпиралин [H.K. Lawrence et al. US Pat. 2479843 (1949)];
- Антихолинергического действия - тригексфенидил [R.A. Wayne et al. US Pat. 2680115 (1954)];
- Антиаритмического действия - энкаинид [S. Dykstra et al. J. Med. Chem. 16, 1015 (1973)].
Однако, среди производных три- и тетраалкил пиперидина препаратов, обладающих антиишемической активностью, обнаружено не было.
В связи с этим поиск новых высокоэффективных антиишемических средств, лишенных побочных эффектов, остается актуальной задачей.
В основу настоящего изобретения положена задача получения новых соединений с высокой антиишемической активностью.
В соответствии с настоящим изобретением, такими веществами стали замещенные полиалкил-4-аминопиперидины - соединения общей формулы Ia, б в специальной и патентной литературе не описаны.
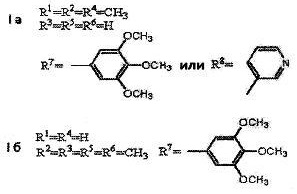
В качестве примеров соединений формулы Ia, б настоящего изобретения следует назвать:
1,2,5-триметил-N-(3,4,5-триметоксибензил)пиперидин-4-амин;
1,2,5-триметил-N-(пиридин-4-илметил)пиперидин-4-амин;
2,2,6,6-тетраметил-N-(3,4,5-триметоксибензил)пиперидин-4-амин.
В соответствии с настоящим изобретением, соединения общей формулы Ia, б можно получить по следующей схеме:
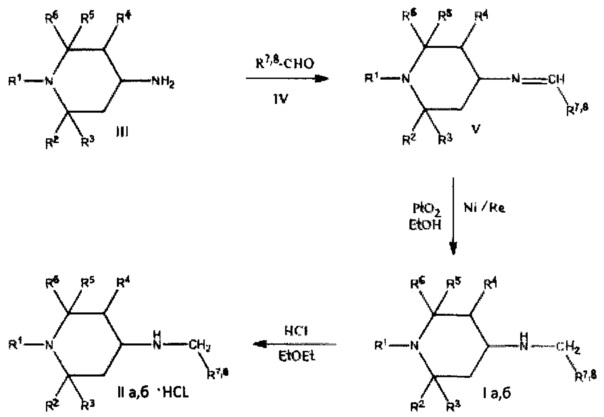
Синтез заявляемых соединений проводился, исходя из три- и тетраалкилпиперидин-4-аминов (III).
Целевые продукты получены взаимодействием выше указанных аминов с ароматическими альдегидами (IV) и последующим восстановлением полученных оснований Шиффа (V) над окисью платины и Ni/Re при комнатной температуре и атмосферном давлении в спирте. Соединения Ia, б после очистки были переведены в гидрохлориды (IIа, б) или (Ia, б⋅HCl).
Экспериментальная химическая часть
Контроль за ходом реакции и чистотой полученных продуктов проводился с помощью ГЖХ (колонка L-0,7 м  6 мм SE 30/5% Chromaton N-AW скорость N2 60 мл/мин). Спектры ЯМР 1Н сняты на приборе Brucker-AC-250. Внутренний стандарт - ТМС. Температуру плавления определяли на приборе «Böetius».
6 мм SE 30/5% Chromaton N-AW скорость N2 60 мл/мин). Спектры ЯМР 1Н сняты на приборе Brucker-AC-250. Внутренний стандарт - ТМС. Температуру плавления определяли на приборе «Böetius».
Пример 1. 1,2,5-триметил-(3,4,5-триметоксибензил)пиперидин-4-амин (IaR7).
Смесь 2,50 г (0,017 моль) 1,2,5-триметилпиперидин-4-амина т.кип. 72-75°С/8 мм рт. ст. и 3,00 г (0,015 моль) 3,4,5-триметоксибензальдегида кипятят в 40 мл сухого бензола с насадкой Дина-Старка в течение 6 часов, затем растворитель упаривают, остаток разгоняют в вакууме. Выход 1,2,5-триметил-N-(3,4,5-триметоксибензилиден)пиперидин-4-амина (VR7), 3,45 г (71,80% от теории). Т.кип. 190°С/1 мм рт. ст.
Найдено, %: С - 67,25; Н - 8,79; N - 8,60; C18H28N2O3
Вычислено, %: С - 67,25; Н - 8,75; N - 8,75.
Спектр ЯМР 1Н (СДCl3, δ, м.д.); 0,74 (3Н, д, СН3-кольца); 1,5-2,95 (7Н, м, кольца); 2,28 (3Н, с, N-СН3); 3,86 (3Н, с, ОСН3); 3,90 (6Н, с, ОСН3, ОСН3); 6,97 (2Н, с, Ar-H); 8,15 (1Н, с, СН=).
Растворяют 3,45 г (0,010 моль) 1,2,5-триметил-N-(3,4,5-триметоксибензилден)пиперидин-4-амина (VR7) в 50 мл этилового спирта, прибавляют 0,50 г (0,002 моль) окиси платины и гидрируют, интенсивно перемешивая, при атмосферном давлении. Окись платины отфильтровывают, спирт упаривают, остаток разгоняют в вакууме. Выход 1,2,5-триметил-N-(3,4,5-триметоксибензил)пиперидин-4-амина (IaR7) 2,59 г (74,60% от теории). Т.кип. 188-190°С/1 мм рт. ст.
Найдено, %: С - 67,07; Н - 9,33; N - 8,53, C18H30N2O3
Вычислено, %: С - 67,08; Н - 9,31; N - 8,69
Спектр ЯМР 1Н (СДCl3, δ, м.д.) 0,94 (3Н, д, СН3-кольца); 1,09 (3Н д, СН3-кольца); 1,51-2,70 (7Н, кольца); 2,21 (3Н, с, N-СН3-кольца); 3,66 (2Н, с, СН2); 3,80 (3Н, с, ОСН3), 3,83 (6Н, ОСН3, ОСН3); 5,56 (2Н, с, Ar-H).
К раствору 2,59 г (0,008 моль) 1,2,5-триметил-N-(3,4,5-триметоксибензил)пиперидин-4-амина в эфире прибавляют эфирный раствор хлористого водорода, осадок отфильтровывают, сушат.
Выход гидрохлорида 1,2,5-триметил-N-(3,4,5-триметоксибензил)пиперидин-4-амина (IIaR7) 3,17 г (100,00% от теории). Т.пл 160°С.
Спектр ЯМР 1Н (СДCl3, δ, м.д.) 1,09 и 1,45 (6Н, 2д, СН3СН3); 2,3-3,4 (7Н, м, кольца); 2,73 (3Н, с, N-CH3); 3,76 (3Н, с, O-СН3); 3,84 (6Н, с, ОСН3, ОСН3); 4,00 (2Н, с, СН2), 6,86 (2Н, с, Ar-H).
Пример 2. 1,2,5-триметил-N-(пиридин-3-илметил)пиперидин-4-амин (IaR8).
Смесь 2,50 г (0,017 моль) 1,2,5-триметилпиперидин-4-амина и 1,88 г (0,017 моль) никотинальдегида кипятят в 30 мл сухого бензола с насадкой Дина-Старка в течение 5 часов. Затем растворитель упаривают, остаток разгоняют в вакууме. Выход 1,2,5-триметил-N-(пиридин-3-илметилен)пиперидин-4-амина (VR8) 3,16 г (77,26% от теории), т.к. 142-145°С/1 мм рт. ст.
Найдено, %: С - 71,25; Н - 9,09; N - 18,18 C14H26N3 0,5Н2О
Вычислено, %: С - 71,33; Н - 9,12; N - 18,00
Спектр ЯМР 1Н (СДCl3, δ, м.д.) 0,74 (3Н, д, СН3-кольца); 1,14 (3Н, д, СН3-кольца); 1,50-2,95 (7Н, м, кольца); 2,29 (3Н, с, N-CH3); 7,30-8,90 (4H, м, Ру).
Растворяют 3,16 г (0,013 моль) 1,2,5-триметил-4-(пиридин-3-илметилен)пиперидин-4-амина (VR8) в 50 мл этилового спирта. Прибавляют 0,50 г (0,002 моль) окиси платины и гидрируют при атмосферном давлении. Катализатор отфильтровывают, спирт упаривают и разгоняют в вакууме. Выход 1,2,5-триметил-N-(пиридин-3-илметил)пиперидин-4-амина (IaR8) 2,40 г (75,47% от теории). т.к. 143°С/1 мм рт. ст.
Найдено, %: С - 71,77; Н - 9,95; N - 18,11; C14H23N3
Вычислено, %: С - 72,1; Н - 9,87; N - 18,02
Спектр ЯМР 1Н (СДCl3, δ, м.д.) 0,89 (3Н, д, СН3-кольца); 1,06 (3Н, д, СН3-кольца); 1,50-2,70 (7Н, м, кольца); 2,18 (3Н, с, N-СН3-кольца); 3,66 и 3,88 (2Н, 2д, СН2); 7,30-8,80 (4Н, м, Ру-Н).
К раствору 2,40 г (0,010 моль) 1,2,5-триметил-N-(пиридин-3-илметил)пиперидин-4-амина в эфире прибавляют эфирный раствор хлористого водорода. Осадок отфильтровывают, сушат. Выход гидрохлорида 1,2,5-триметил-N-(3,4,5-триметоксибензил)пиперидин-4-амина (IIaR8) 3,10 г (89,50% от теории), т.пл. 179-180°С.
Спектр ЯМР 1Н (DMSO, δ, м.д.) 1,09 и 1,36 (6Н, 2д, СН3, СН3); 1,75-3,75 (7Н, м, кольца); 2,69 (3Н, с, N-CH3); 4,38 и 4,55 (2Н, 2д, СН2); 7,8-9,3 (4Н, м, Ру-Н); 11,19 (1Н, уш. С, N+H).
Пример 3. 2,2,6,6-тетраметил-N-(3,4,5-триметоксибензил)пиперидин-4-амин (IбR7).
Смесь 2,50 г (0,016 моль) 2,2,6,6-тетраметилпиперидин-4-амина т.кип. 72-74°С/7 мм рт. ст. и 3,14 г (0,016 моль) 3,4,5-триметоксибензальдегида кипятят в 40 мл сухого бензола с насадкой Дина-Старка в течение 5 часов. Растворитель упаривают, остаток перекристаллизовывают из изопропанола. Выход 2,2,6,6-тетраметил-N-(3,4,5-триметоксибензилиден)пиперидин-4амина (VR7) 3,65 г (62,20% от теории), т.пл. 282°С.
Найдено, %: С - 67,92; Н - 9,17; N - 8,30; C19H30N2O3.
Вычислено, %: С - 68,26; Н - 8,90; N - 8,36.
Спектр ЯМР 1Н (СДCl3, δ, м.д.) 1,15 (6Н, с, СН3, СН3); 1,24 (6Н, с, СН3, СН3); 1,30-1,70 (4Н, м, кольца); 3,67 (1H, м, кольца); 3,85 (3Н, с, ОСН3); 3,88 (6Н, с, ОСН3, ОСН3); 6,95 (2Н, с, Ar-H); 8,27 (1Н, с, СН=).
Растворяют 3,50 г (0,010 моль) 2,2,6,6-тетраметил-N-(3,4,5-триметоксибензилиден)пиперидин-4-амина (VR7) в 50 мл этилового спирта. Прибавляют 1,00 г Ni/Re (Merck) и гидрируют при атмосферном давлении. Катализатор отфильтровывают, спирт упаривают. Остаток разгоняют в вакууме. Выход 2,2,6,6-тетраметил-N-(3,4,5-триметоксибензил) пиперидин-4-амина (IбR7) 2,56 г (72,72% от теории). Т.кип. 210°С/1 мм.
Найдено, %: С - 67,79; Н - 9,67; N - 8,50; C19H32N2O3.
Вычислено, %: С - 67,85; Н - 9,52; N - 8,33.
Спектр ЯМР 1Н (CDCl3, δ, м.д.) 0,84-1,90 (4Н, м, кольца); 1,07 (6Н, с, кольца); 1,13 (6Н, с, кольца); 2,93 (1Н, м, кольца); 3,72 (2Н, с, СН2); 3,76 (3Н, С, ОСН3); 3,80 (6Н, с, ОСН3, ОСН3); 6,50 (2Н, с, Ar-H).
К раствору 2,56 г (0,007 моль) 2,2,6,6-тетраметил-N-(3,4,5-триметоксибензил)пиперидин-4-амина в эфире прибавляют эфирный раствор хлористого водорода, осадок отфильтровывают, сушат. Выход гидрохлорида 2,2,6,6-тетраметил-N-(3,4,5-триметоксибензил)пиперидин-4-амина (IIбR7) 3,00 г (96,70% от теории), т.пл. 192-195°С.
Спектр ЯМР 1Н (CDCl3, δ, м.д.) 1,41 (6Н, с, СН3, СН3); 1,59 (6Н, с, СН3, СН3); 2,08 и 2,28 (4Н, м, кольца); 3,54 (1Н, м, кольца); 3,78 (3Н, с, ОСН3); 3,83 (6Н, с, ОСН3, ОСН3); 4,12 (2Н, с, СН2); 6,98 (2Н, с, Ar-H).
Экспериментальная фармакологическая часть
Используемые в экспериментальной работе мыши и крысы были получены из Филиала «Столбовая» ФГБУН НЦБМТ ФМБА России. Животных содержали в виварии, в индивидуальных клетках, в соответствии с приказом МЗ РФ №267 от 09.06.2003 «Об учреждении правил лабораторной практики» с предоставлением брикетированного корма ad libitum при регулируемом 12/12 световом режиме.
Пример 1. Острая токсичность соединений IIaR7; IIaR8; IIбR7 и прототипа триметазидина.
LD50 заявляемых соединений и препарата сравнения триметазидина определяли по стандартной методике на беспородных мышах-самцах массой 20-30 г, вещества растворяли в дистиллированной воде для инъекций и вводили внутрибрюшино в объеме 0,1 мл/10 г массы тела. По методу Литчфилда-Вилкоксона рассчитывали LD16, LD50, LD84 и их 95% доверительные интервалы.
Результаты экспериментов показали, что соединения IIaR7; IIaR8 и IIбR7; приблизительно в 1,5 раза менее токсичны, чем прототип триметазидин (таблица 1).
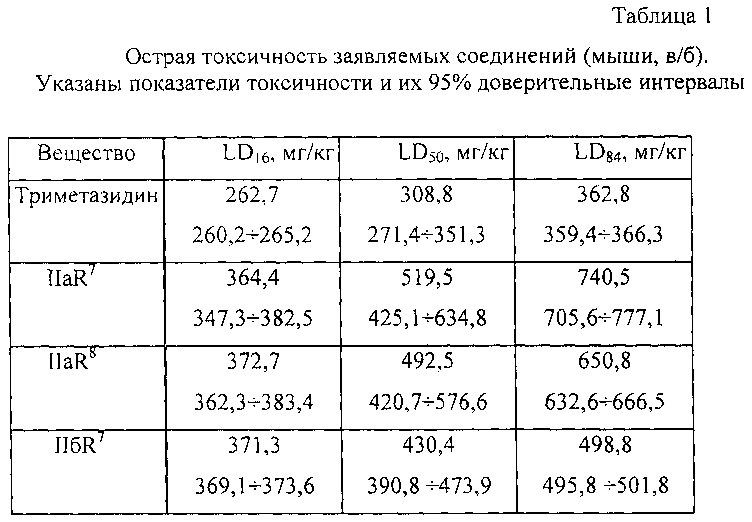
Как следует из полученных данных заявляемые соединения, так же как и прототип триметазидин, относятся к IV классу токсичности, т.е. к малотоксичным веществам.
Пример 2. Влияние заявляемых соединений на структуру ЭКГ.
В экспериментах на наркотизированных (уретан 1300 мг/кг, в/б) беспородных крысах-самцах массой 250-300 г, оценивали влияние заявляемых соединений IIaR7; IIaR8 и IIбR7 в дозе 6 мг/кг в/в на структуру ЭКГ. Заявляемые соединения растворяли в изотоническом растворе натрия хлорида. В каждой группе было по 6 животных. ЭКГ регистрировали с помощью компьютерного электрокардиографа «Полиспектр 8/ЕХ» (Нейрософт, Россия). Статистический анализ проводили с применением непараметрического дисперсионного анализа по Фридману, с дальнейшей обработкой с помощью метода множественных сравнений Даннета. Результаты выражали в виде медиан и нижнего и верхнего квартилей.
Результаты экспериментов показали, что заявляемые соединения, также как и прототип триметазидин, являются гемодинамически нейтральными соединениями и не влияют на структуру ЭКГ (табл. 2).
Пример 3. Изучение кардиопротекторного действия заявляемых соединений на модели эндокардиальной ишемии.
В экспериментах на белых беспородных крысах-самцах массой 250-300 г, наркотизированных уретаном (1300 мг/кг, в/б), по методу, описанному S. Yamamoto с соавторами (2002), вызывали острую эндокардиальную ишемию миокарда. С этой целью животным с помощью инъектора «Линеомат» (Россия) внутривенно со скоростью 20 мкг/кг/мин вводили раствор неселективного агониста β-адренорецепторов изопротеренола. Об интенсивности ишемического повреждения судили по величине депрессии сегмента ST на ЭКГ (II стандартное отведение) через 5 минут от момента начала инфузии изопротеренола. Животные были рандомизированы на 3 группы - контрольная (n=10) и две основных - соединение IIбR7 (6 мг/кг, в/в за 2 минуты до начала инфузии изопротеренола, n=6) и триметазидин (15 мг/кг, в/в, n=5). Изопротеренол, исследуемое соединение и триметазидин растворяли в изотоническом растворе натрия хлорида. ЭКГ регистрировали с помощью компьютерного электрокардиографа «Полиспектр 8/ЕХ» (Нейрософт, Россия). Статистический анализ проводили с помощью однофакторного дисперсионного анализа с дальнейшей обработкой методом множественных сравнений по Даннету.
Результаты экспериментов показали, что соединение IIбR7 (6 мг/кг, в/в за 2 минуты до инфузии изопротеренола) статистически значимо (р=0,006) препятствует вызываемой изопротеренолом депрессии сегмента ST на ЭКГ, т.е. проявляет выраженную антиишемическую активность. Препарат сравнения триметазидин (15 мг/кг, в/в) на данной модели был менее эффективен (см. чертеж).
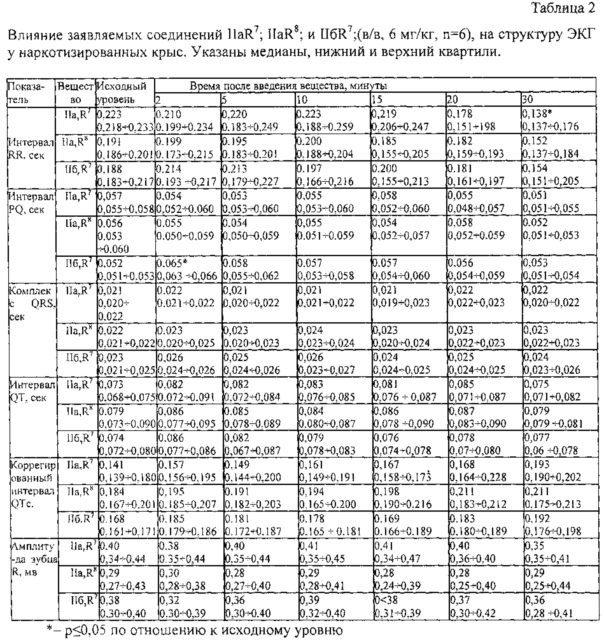
ОПИСАНИЕ ЧЕРТЕЖА
На чертеже показано влияние соединения IIбR7 (6 мг/кг, в/в) и препарата сравнения триметазидина (15 мг/кг, в/в) на депрессию сегмента ST (ЭКГ II стандартное отведение), вызываемую изопротеренолом (20 мкг/кг/мин) у наркотизированных крыс.
По оси ординат - изменение величины сегмента ST на ЭКГ во втором стандартном отведении (в мВ), по оси абсцисс - группа животных.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИС(АЛКОКСИБЕНЗИЛ)АЛКАНДИАМИНЫ, ОБЛАДАЮЩИЕ КАРДИОТРОПНОЙ АКТИВНОСТЬЮ | 2021 |
|
RU2791576C2 |
| Бис(метоксибензиламиноалкил)амины, обладающие кардиотропной активностью | 2014 |
|
RU2624438C2 |
| N-бензил-N-(2-((2,3,4-триметоксибензил)амино)этан-1,2-диамины, обладающие кардиотропной активностью | 2023 |
|
RU2834294C1 |
| 5-АМИНО-3-(2-АМИНОПРОПИЛ)-[1,2,4]ТИАДИАЗОЛЫ | 2011 |
|
RU2449997C1 |
| ПРИМЕНЕНИЕ ТРИЦИКЛИЧЕСКОГО СЕРУСОДЕРЖАЩЕГО ПРОИЗВОДНОГО 1,2-ДИГИДРОХИНОЛИНА ДЛЯ ИНГИБИРОВАНИЯ РЕПЛИКАЦИИ БЕТА-КОРОНАВИРУСОВ, ВКЛЮЧАЯ SARS-CoV-2 | 2021 |
|
RU2780247C1 |
| ДИГИДРОХЛОРИДЫ N-[β-(1,2,5-ТРИМЕТИЛ-4-АРИЛПИПЕРИДИН-4-ИЛ)ЭТИЛ]-N-АЛКИЛ-N-(3,4-ДИМЕТОКСИБЕНЗИЛ)АМИНОВ, ЯВЛЯЮЩИЕСЯ ИНГИБИТОРАМИ КАЛЬЦИЙ-КАЛЬМОДУЛИНЗАВИСИМЫХ ПРОЦЕССОВ | 1991 |
|
SU1829346A1 |
| Органические соли N-(2,3,4-триметоксибензил)-N-{ 2-[(2,3,4-триметоксибензил)амино]этил} -1,2-этан-диамина | 2022 |
|
RU2813347C2 |
| N, N', N'-ТРИЗАМЕЩЕННЫЕ ИЗОСЕЛЕНОМОЧЕВИНЫ | 2010 |
|
RU2434852C1 |
| СПОСОБЫ ПРОИЗВОДСТВА И ИСПОЛЬЗОВАНИЯ ЭТОКСИКОМБРЕТАСТАТИНОВ И ПРОЛЕКАРСТВА НА ИХ ОСНОВЕ | 2007 |
|
RU2451664C2 |
| ПРИМЕНЕНИЕ ЗАМЕЩЕННЫХ 2-(2-(4,4,6-ТРИМЕТИЛ-2-ОКСО-4Н-ПИРРОЛО[3,2,1-IJ]ХИНОЛИН-1(2Н)-ИЛИДЕН)ГИДРАЗИНИЛ)ТИАЗОЛ-4(5Н)-ОНОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРОВ СВЕРТЫВАНИЯ КРОВИ XA И XIA И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2023 |
|
RU2819271C1 |
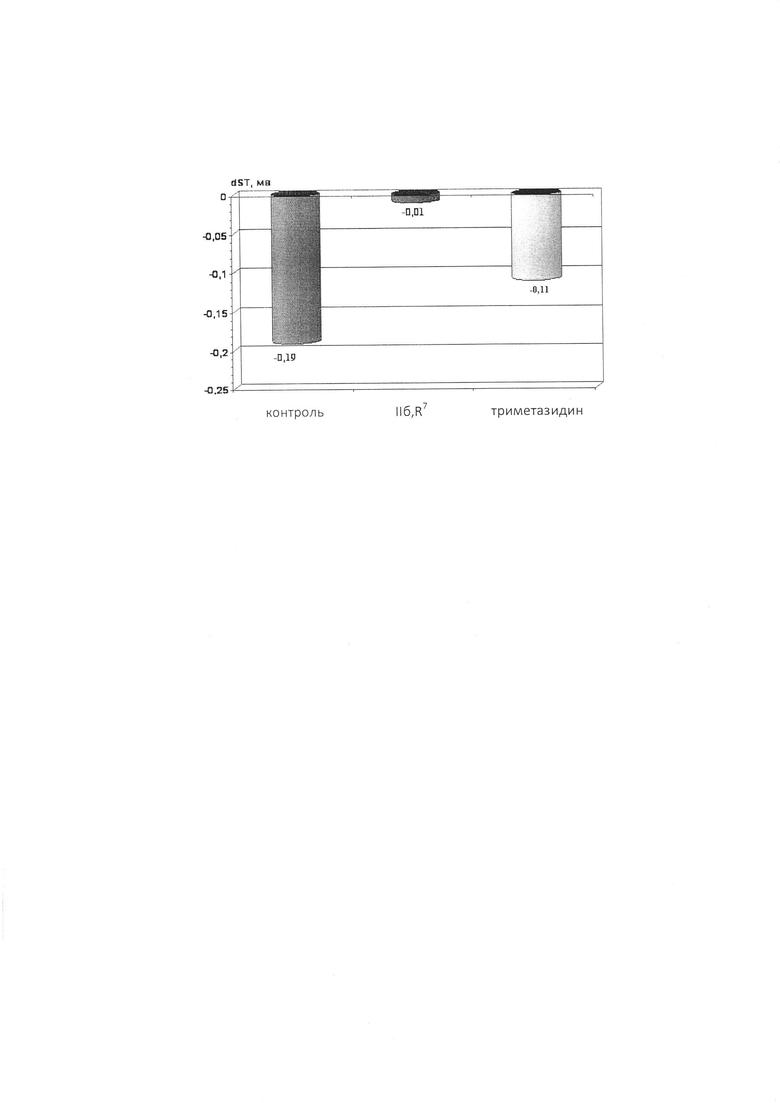
Изобретение относится к новой группе замещенных полиалкил-4-аминопиперидинов общей формулы
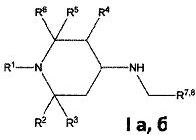
и их фармацевтически приемлемым солям, предпочтительно гидрохлоридам общей формулы (Iа, б ⋅ HCl). Заявленные соединения обладают кардиотропной, в частности антиишемической, активностью. 5 н.п. ф-лы, 1 ил., 2 табл., 6 пр.
1. Замещенные 1,2,5-триметил- и 2,2,6,6-тетраметил-4-аминопиперидины общей формулы I а, б
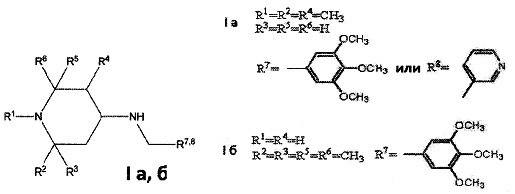
и их фармацевтически приемлемые соли присоединения кислот, предпочтительно гидрохлориды общей формулы (Iа, б ⋅ HCl).
2. 1,2,5-Триметил-N-(3,4,5-триметоксибензил)пиперидин-4-амин, обладающий кардиотропной, в частности антиишемической, активностью.
3. 1,2,5-Триметил-N-(пиридин-4илметил)пиперидин-4-амин, обладающий кардиотропной, в частности антиишемической, активностью.
4. 2,2,6,6-Тетраметил-N-(3,4,5-триметоксибензил)пиперидин-4-амин, обладающий кардиотропной, в частности антиишемической, активностью.
5. Применение соединений по пп. 1-4 в качестве кардиотропных, в частности антиишемических, средств.
| Pérez-Villanueva, J., Méndez-Lucio, O., Soria-Arteche, O., & Medina-Franco, J | |||
| L | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Activity cliffs and activity cliff generators based on chemotype-related activity landscapes | |||
| Molecular Diversity, 19(4), 1021-1035 | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| WO 2012113103 A1, 30.08.2012 | |||
| WO 2006063791 A1, 22.06.2006 | |||
| WO 2004035541 A1, 29.04.2004 | |||
| US 5854419 A, 29.12.1998 | |||
| RU 2010149166 A, 10.06.2012 | |||
| WO 2013045413 A1, 04.04.2013 | |||
| US 2904581 A1, 15.09.1959. | |||
Авторы
Даты
2019-04-25—Публикация
2015-04-24—Подача