ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка заявляет приоритет предварительной заявки на патент Соединенных Штатов Америки под номером 60/869499, которая зарегистрирована 11 декабря 2006 года и включена в описание в качестве ссылки во всей ее полноте.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к композициям производных инданона, синтезу производных инданона и способам применения производных инданона. Настоящее изобретение более конкретно относится к синтезу, композициям и способам применения соединений на основе инданона, которые являются применимыми для лечения и/или предотвращения медицинского состояния, для которого желательным является ингибитор холинэстеразы.
УРОВЕНЬ ТЕХНИКИ
Холинэстераза необходима для должного функционирования нервной системы людей. Если количество холинэстеразы снижается ниже критического уровня, нервные импульсы к мышцам могут уже не регулироваться, что приводит к серьезным последствиям и даже смерти. Термин «холинэстераза» обычно относится к одному из двух ферментов: ацетилхолинэстеразе (AСhE) и бутирилхолинэстеразе (BСhE или BuChE). Ацетилхолинэстераза (AСhE), известная также как RBC-холинэстераза, холинэстераза эритроцитов или (наиболее обычно) ацетилгидролаза ацетилхолина обнаружена в основном в крови и нервных синапсах. Бутирилхолинэстераза (BuChE), известная также как псевдохолинэстераза, холинэстераза плазмы или (наиболее обычно) ацилгидролаза ацилхолина, обнаружена в основном в печени. Оба из этих ферментов катализируют гидролиз нейротрансмиттерного ацетилхолина в холин и уксусную кислоту, реакцию, необходимую для обеспечения возможности возвращения холинергического нейрона в его состояние покоя после активации.
Ацетилхолинэстераза (AСhE) является тетрамерным белком, который катализирует гидролиз нейротрансмиттерного ацетилхолина (химически высвобождаемого нервами, которые активируют мышечные сокращения) и помогает сохранять должную передачу импульсов между нервными клетками и между нервными клетками и мышцами. Различные нейрологические и нейромышечные нарушения или заболевания включают ослабление холинергической активности. Часто наиболее эффективные лечения таких нарушений или заболеваний включают применение ингибитора холинэстеразы, который ингибирует разложение ацетилхолина. Ингибитором холинэстеразы или антихолинэстеразой является химическое соединение или лиганд, который ингибирует фермент холинэстеразу и тем самым ингибирует разложение ацетилхолина, таким образом повышая как уровень, так и продолжительность действия нейротрансмиттерного ацетилхолина. Ингибиторы ацетилхолинэстеразы применяли клинически при лечении болезни Альцгеймера или деменции типа Альцгеймера, болезни Хантингтона, болезни Пика, атаксии, тяжелой миастении (дегенеративного нервно-мышечного нарушения) и глаукомы.
Болезнь Альцгеймера или деменция типа Альцгеймера (называемая также сенильной деменцией типа Альцгеймера) является прогрессирующим заболеванием, которое убивает нервные клетки и разрушает нервные соединения в головном мозге. Заболевание характеризуется умственными изменениями, являющимися результатом повреждения ткани головного мозга. Поскольку эти изменения не могут быть визуализованы до вскрытия трупа, диагноз такого заболевания основывается на симптомах, которые имеют пациенты. Симптомы включают постепенную потерю узнавания, памяти и способности к суждению, а также расстройство настроения и поведенческие нарушения. Хотя точная причина этого заболевания до сих пор является неизвестной, исследователи обнаружили несколько факторов, которые могут способствовать развитию такого заболевания, включающие воспалительную реакцию, генетические факторы и влияния внешних условий.
Частота распространения болезни Альцгеймера по всему миру является неизвестной. Однако последние сообщения позволяют предположить, что приблизительно 4,5 миллиона американцев имеют болезнь Альцгеймера. Оценивается, что к 2050 году это число будет больше, чем 13 миллионов, поскольку люди, родившиеся в период пика рождаемости, будут иметь к этому году возраст больше 65 лет. Болезнь Альцгеймера является основной причиной деменции (потеря нормальной умственной функции) и восьмой основной причиной смерти в Соединенных Штатах Америки. Продолжительность жизни жертвы болезни Альцгеймера обычно уменьшается, хотя человек может везде прожить от 3 до 20 лет после установления диагноза.
Болезнь Альцгеймера не является обратимой, и в настоящее время не имеется лечения для этого заболевания. Фармакологические лечения, доступные в настоящее время, в основном нацелены на облегчение или ослабление симптомов заболевания. Ингибиторы холинэстеразы широко прописываются и являются единственными агентами, разрешенными FDA (Департаментом по контролю за качеством пищевых продуктов, медикаментов и косметических средств США) для лечения, поскольку они, как было показано, минимизируют и стабилизируют симптомы болезни Альцгеймера. Разрешенными FDA ингибиторами холинэстеразы являются донепезил (Aricept®), такрин (Cognex®), ривастигмин (Exelon®) и галантамин (Reminyl®). Клинические испытания показывают, что эти лекарственные средства могут стабилизировать или улучшить познавательную способность, показатели общей оценки, настроение и поведение людей, страдающих болезнью Альцгеймера. В последние годы донепезил (Sugimoto et al. US 4895841 and 5100901; Pathi et al. WO 2007077443; Parthasaradhi et al. WO 2005003092; Dubey et al. WO 2005076749; Gutman et al. WO 200009483; Sugimoto et al. J. Med. Chem. 1995, 38, 481) применяли в качестве приоритетной терапии для лечения болезни Альцгеймера.
Однако все ингибиторы AСhE, включая донепезил, при клиническом применении в настоящее время имеют значительные ограничения. Они проявляют среди пациентов значительную изменчивость в фармакокинетиках и имеют значительные взаимодействия с другими лекарственными средствами. Важная причина изменчивости в фармакокинетиках среди пациентов и взаимодействий с другими лекарственными средствами (межлекарственные взаимодействия) связана с генетически определенными различиями в метаболизме этих лекарственных средств. Все ингибиторы AСhE при клиническом применении в настоящее время подвергаются значительному печеночному метаболизму из-за действия изоферментов 3А4 цитохрома Р450, в том числе изоферментов 2D6 и 1А2, за исключением ривастигмина. Печеночный метаболизм является также ключевой детерминантой потенциала для вовлечения данного лекарственного средства в клинически значительные фармакокинетические лекарственные взаимодействия (Buffum et al. Geriatric Nursing 2005, 26, 74-78). У пациентов имеются существенные полиморфизмы CYP-изоферментов CYP2D6 и CYP1A2 (Shah, R. R. Phil. Trans. R. Soc. B. 2005, 360, 1617-1638), и показано, что этот полиморфизм существенно повышает уровни этих ингибиторов AСhE в плазме. Следовательно, слабые метаболизаторы, которые не имеют CYP2D6 и CYP1A2, могут быть особенно предрасположены к нежелательным лекарственным взаимодействиям. Кроме того, известно, что ряд лекарственных средств, которые являются субстратами для системы ферментов цитохрома Р450, в том числе диазепам, варфарин и фенитоин, взаимодействуют с этими ингибиторами АChE. Большинство описанных обычных нежелательных действий у пациентов, принимающих эти ингибиторы АСhE, включают тошноту, рвоту, диарею и судороги мышц. Другими описанными нежелательными действиями являются нарушение функции печени, аритмия, сердечно-сосудистое нарушение, тахикардия, головокружение, аномальная походка, агрессия, тревога, анорексия, делирий, спутанность сознания, нарушение сна, кашель и одышка (Iimura et al. WO 2007052541).
Большинство пациентов, страдающих болезнью Альцгеймера, являются пожилыми людьми и находятся в группе людей возраста от 55 до 85 лет. Было отмечено, что эти пациенты имеют одно или несколько нарушений здоровья, отличных от болезни Альцгеймера, и нарушения наиболее вероятно представляют собой диабет, сердечно-сосудистые проблемы (например, атеросклероз, гипертензия), хроническую боль, астму и плохое функционирование печени и почек. Наиболее нежелательными действиями, связанными с этими ингибиторами AChE, являются межлекарственные взаимодействия и склонность к сердечному заболеванию. Опосредуемые CYP метаболические пути, связанные с этими лекарственными средствами, в основном являются ответственными за эти нежелательные действия. Большинство лекарственных средств, пригодных в настоящее время для лечения диабета, сердечно-сосудистых заболеваний, астмы и хронической боли, метаболизируются ферментами CYP. Поэтому пациенты, страдающие болезнью Альцгеймера, которых лечат ингибиторами АСhE, имеют большой риск нежелательных побочных действий, вызванных межлекарственным взаимодействием. В некоторых случаях эти нежелательные действия могут становиться угрозой для жизни. Взятые вместе, эти клинические ограничения указывают на необходимость разработки безопасных терапевтических лекарственных средств для лечения болезни Альцгеймера.
Следовательно, разработка новых ингибиторов АСhЕ, которые предпочтительно не подвергаются CYP-опосредуемому метаболизму в организме, но проявляют такую же или повышенную терапевтическую требуемую активность, как и доступные в настоящее время терапии, может обеспечить эффективные и безопасные лекарственные средства для лечения болезни Альцгеймера.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым производным инданона, синтезу таких производных, композициям и способам применения производных инданона, которые являются применимыми для лечения и/или предотвращения медицинского состояния, для которого желательным является ингибитор ацетилхолинэстеразы (AChE). Настоящее изобретение относится к способам синтеза таких ингибиторов ацетилхолинэстеразы на основе инданона. Настоящее изобретение относится также к способам применения ингибиторов ацетилхолинэстеразы на основе инданона и композициям ингибиторов ацетилхолинэстеразы на основе инданона для лечения болезни Альцгеймера и других нейродегенеративных заболеваний, включающих болезнь Хантингтона, болезнь Пика, атаксию, тяжелую миастению и глаукому.
Соединения как объект изобретения обеспечивают создание следующего поколения новых ингибиторов ацетилхолинэстеразы, которые являются особенно эффективными и безопасными для лечения болезни Альцгеймера. Они являются подходящими вследствие их очень желательных метаболических, фармакокинетических и фармакологических профилей. Разработаны соединения изобретения, которые
1) проявляют ингибирующую ацетилхолинэстеразу активность;
2) преимущественно не подвергаются окислительному или опосредуемому ферментом CYP метаболизму в организме человека;
3) метаболизируются преимущественно гидролитическими ферментами, такими как эстеразы и/или пептидазы, в организме человека;
4) образуют терапевтически неактивный или минимально активный метаболит(ы), имеющий короткий период полураспада.
Таким образом, соединения изобретения проявляют хорошую ингибирующую ацетилхолинэстеразу активность, преимущественно не подвергаются опосредуемому ферментами цитохрома Р450 или окислительному метаболизму и образуют терапевтически неактивные или наименее активные метаболиты. Признаки, подобные отсутствию метаболизма, опосредуемого ферментами цитохрома Р450, и образованию терапевтически неактивных или наименее активных метаболитов соединениями рассматриваемого изобретения, могут ослаблять нежелательные побочные действия, которые порождены межлекарственным взаимодействием. Поэтому обладающие этими признаками соединения изобретения являются более эффективными и безопасными для лечения болезни Альцгеймера у человека, в том числе у пациентов, которые подвергаются многим лекарственным терапиям вследствие хронических заболеваний, например, хронической боли, диабета, сердечно-сосудистых заболеваний и астмы, и имеют плохое функционирование печени и почек.
В одном аспекте настоящее изобретение относится к производным инданона, включающим соединения структурной формулы (I)
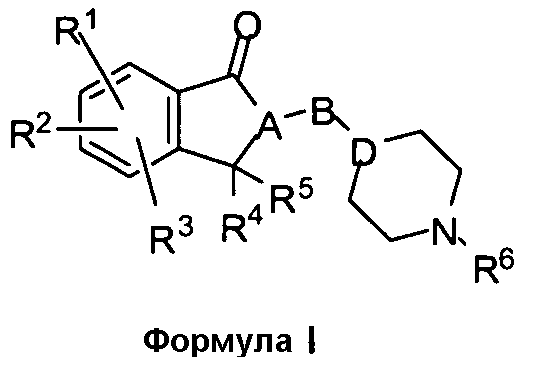
или их фармацевтически приемлемые соли, гидраты или сольваты при условии, что соединения изобретения содержат “гибкую” часть, конъюгированную непосредственно или через спейсер (соединяющую группу) с одним из заместителей R1, R2, R3, R4, R5 и R6, или вставленную в такой заместитель; где
'A' и 'D' независимо выбраны из СН или N;
'B' выбран из -(CH2)n-, -(CH2)nC(O)-, -(CH2)nC(O)O-, -(CH2)nOC(O)-, -(CH2)nS(O)(O)-, -(CH2)nNHC(O)-, O, S, -C(O), -C(O)O или -S(O)(O), где n = 1-5;
R1, R2, R3, R4, R5 и R6 независимо выбраны из водорода, алкила, замещенного алкила, арила, замещенного арила, арилалкила, замещенного арилалкила, циклоалкила, замещенного циклоалкила, циклогетероалкила, замещенного циклогетероалкила, гетероарила, замещенного гетероарила, гетероарилалкила, замещенного гетероарилалкила; предпочтительно ацилалкилоксикарбонила, ацилоксиалкилоксикарбонила, ацилалкилоксикарбониламино, ацилоксиалкилоксикарбониламино, алкокси, алкоксикарбонила, алкоксикарбонилалкокси, алкоксикарбонилалкиламино, алкилсульфинила, алкилсульфонила, алкилтио, амино, алкиламино, арилалкиламино, диалкиламино, арилалкокси, арилалкоксикарбонилалкокси, арилалкоксикарбонилалкиламино, арилоксикарбонила, арилоксикарбонилалкокси, арилоксикарбонилалкиламино, карбокси, карбамоила, карбамата, карбоната, циано, галогена, гетероарилоксикарбонила, гидрокси, фосфата, фосфоната, сульфата, сульфоната и сульфонамида; необязательно R1 и R2 или R2 и R3 вместе образуют 5- или 6-членное кольцо, которое может содержать один или несколько гетероатомов, выбранных из O, N или S, и это кольцо может быть необязательно замещено заместителями, выбранными из алкила, замещенного алкила, галогена, гидроксила и карбонила; R4 и R5 необязательно вместе образуют 5- или 6-членное кольцо, которое может содержать один или несколько гетероатомов, выбранных из O, N или S, и это кольцо может быть необязательно замещено заместителями, выбранными из алкила, замещенного алкила, галогена, гидроксила и карбонила.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к синтезу, композициям и способам применения производных инданона, которые являются применимыми для лечения и/или предотвращения медицинского состояния, для которого желательным является ингибирование холинэстеразы. Настоящее изобретение относится к соединениям, композициям и способам для фармакологического лечения болезни Альцгеймера и других нейродегенеративных заболеваний, включающих болезнь Хантингтона, болезнь Пика, атаксию, тяжелую миастению и глаукому.
ОПРЕДЕЛЕНИЯ
Если не указано особо, нижеследующие термины, применяемые в данной заявке, включая описание и формулу изобретения, имеют значения, указанные ниже. Определение стандартных химических терминов можно найти в ссылочных работах, включающих Carey and Sundberg (1992) “Advanced Organic Chemistry 3rd Ed.” Vols. A and B, Plenum Press, New York. При практическом применении настоящего изобретения будут применяться, если не оговорено особо, общепринятые способы масс-спектроскопии, химии белка, биохимии, способы рекомбинантной ДНК и фармакологии в пределах квалификации специалиста в данной области. В раскрытых в описании композициях и препаратах на практике можно применять фармацевтически приемлемые эксципиенты и соли, имеющиеся в Remington's Pharmaceutical Sciences, 18th Edition (Easton, Pennsylvania: Mack Publishing Company, 1990).
Выражение “соединения изобретения” относится к соединениям включенных в описание структурных формул (I)-(V). Соединения изобретения можно идентифицировать или по их химической структуре и/или химическому названию. Когда химическая структура и химическое название противоречат друг другу, химические структуры являются решающим фактором идентичности соединения. Соединения изобретения могут содержать один или несколько хиральных центров и/или двойных центров и поэтому могут существовать в виде стереоизомеров, таких как изомеры у двойной связи (т.е. геометрические изомеры), энантиомеры или диастереоизомеры. Согласно этому химические структуры, показанные в описании, включают все возможные энантиомеры и стереоизомеры иллюстрированных соединений, в том числе стереоизомерно чистую (индивидуальную) форму (например, геометрически чистую, энантиомерно чистую или диастереомерно чистую) и энантиомерные и стереоизомерные смеси. Энантиомерные и стереоизомерные смеси можно разделить на их индивидуальные энантиомеры или стереоизомеры с применением способов разделения или способов хирального синтеза, хорошо известных специалисту в данной области. Соединения изобретения могут также существовать в нескольких таутомерных формах, включающих енольную форму, кетоформу и их смеси. Согласно этому химические структуры, указанные в описании, включают все возможные таутомерные формы иллюстрированных соединений. Соединения изобретения включают также меченные изотопами соединения, у которых один или несколько атомов имеют атомную массу, отличную от атомной массы, обычно обнаруживаемой в природе. Примеры изотопов, которые могут быть включены в соединения изобретения, включают, но не ограничиваются перечисленным, 2H, 3H, 13C, 15N, 18O, 17О, 31P, 32P, 35S, 18F и 36Cl. Кроме того, должно быть понятно, что когда иллюстрируются частичные структуры соединений изобретения, скобки штрихов указывает место присоединения частичных структур к остальной части молекулы.
Выражение “композиция изобретения” относится по меньшей мере к одному соединению изобретения и фармацевтически приемлемому наполнителю, с которым соединение вводят пациенту. При введении пациенту соединения изобретения вводят в виде выделенной формы, которая означает форму, выделенную из синтетической органической реакционной смеси.
“Алкил” относится к насыщенному или ненасыщенному одновалентному углеводородному радикалу с разветвленной, неразветвленной или циклической цепью, образованному удалением одного атома водорода от одного атома углерода исходного алкана, алкена или алкина. Типичные алкильные группы включают, но не ограничиваются перечисленным, метил; этилы, такие как этанил, этенил, этинил; пропилы такие как пропан-1-ил, пропан-2-ил, циклопропан-1-ил, проп-1-ен-1-ил, проп-1-ен-2-ил, проп-2-ен-1-ил (аллил), циклопроп-1-ен-1-ил, циклопроп-2-ен-1-ил, проп-1-ин-1-ил, проп-2-ин-1-ил и т.д.; бутилы, такие как бутан-1-ил, бутан-2-ил, 2-метилпропан-1-ил, 2-метилпропан-2-ил, циклобутан-1-ил, бут-1-ен-1-ил, бут-1-ен-2-ил, 2-метилпроп-1-ен-1-ил, бут-2-ен-1-ил, бут-2-ен-2-ил, бута-1,3-диен-1-ил, бута-1,3-диен-2-ил, циклобут-1-ен-1-ил, циклобут-1-ен-3-ил, циклобута-1,3-диен-1-ил, бут-1-ин-1-ил, бут-1-ин-3-ил, бут-3-ин-1-ил и т.д.; и тому подобное.
В частности, предполагается, что “алкил” включает радикалы, имеющие любую степень или уровень насыщения, т.е. группы, имеющие только одинарные углерод-углеродные связи, группы, имеющие одну или несколько двойных углерод-углеродных связей, группы, имеющие одну или несколько тройных углерод-углеродных связей, и группы, имеющие смеси одинарной, двойной и тройной углерод-углеродных связей. Когда предполагается определенный уровень насыщения, применяют выражения “алканил”, “алкенил” и “алкинил”. Алкильная группа предпочтительно содержит 1-20 атомов углерода, более предпочтительно, от 1 до 10 атомов углерода.
“Алканил” относится к насыщенному алкильному радикалу с разветвленной, неразветвленной или циклической цепью, образованному удалением одного атома водорода от одного атома углерода исходного алкана. Типичные алканильные группы включают, но не ограничиваются перечисленным, метанил; этанил; пропанилы, такие как пропан-1-ил, пропан-2-ил (изопропил), циклопропан-1-ил и т.д.; бутанилы, такие как бутан-1-ил, бутан-2-ил (втор-бутил), 2-метилпропан-1-ил (изобутил), 2-метилпропан-2-ил (трет-бутил), циклобутан-1-ил и т.д.; и тому подобное.
“Алкенил” относится к ненасыщенному алкильному радикалу с разветвленной, неразветвленной или циклической цепью, имеющему по меньшей мере одну углерод-углеродную двойную связь и образованному удалением одного атома водорода от одного атома углерода исходного алкена. Группа может иметь либо цис-, либо транс-конформацию относительно двойной связи(ей). Типичные алкенильные группы включают, но не ограничиваются перечисленным, этенил; пропенилы, такие как проп-1-ен-1-ил, проп-1-ен-2-ил, проп-2-ен-1-ил (аллил), проп-2-ен-2-ил, циклопроп-1-ен-1-ил, циклопроп-2-ен-1-ил; бутенилы, такие как бут-1-ен-1-ил, бут-1-ен-2-ил, 2-метилпроп-1-ен-1-ил, бут-2-ен-1-ил, бут-2-ен-2-ил, бута-1,3-диен-1-ил, бута-1,3-диен-2-ил, циклобут-1-ен-1-ил, циклобут-1-ен-3-ил, циклобута-1,3-диен-1-ил и т.д.; и тому подобное.
“Алкинил” относится к ненасыщенному алкильному радикалу с разветвленной, неразветвленной или циклической цепью, имеющему по меньшей мере одну углерод-углеродную тройную связь и образованному удалением одного атома водорода от одного атома углерода исходного алкина. Типичные алкинильные группы включают, но не ограничиваются перечисленным, этинил; пропинилы, такие как проп-1-ин-1-ил, проп-2-ин-1-ил и т.д.; бутинилы, такие как бут-1-ин-1-ил, бут-1-ин-3-ил, бут-3-ин-1-ил и т.д.; и тому подобное.
“Ацил” относится к радикалу -C(O)R, где R представляет собой водород, алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, которые имеют указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения. Репрезентативные примеры включают, но не ограничиваются перечисленным, формил, ацетил, циклогексилкарбонил, циклогексилметилкарбонил, бензоил, бензилкарбонил и тому подобное.
“Ацилоксиалкилоксикарбонил” относится к радикалу -C(O)OCR'R”OC(O)R”', где R', R” и R”' представляют собой, каждый независимо, водород, алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, которые имеют указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения. Репрезентативные примеры включают, но не ограничиваются перечисленным -C(O)OCH2OC(O)CH3, -C(O)OCH2OC(O)CH2CH3, -C(O)OCH(CH3)OC(O)CH2CH3, -C(O)OCH(CH3)OC(O)C6H5 и тому подобное.
“Ацилалкилоксикарбонил” относится к радикалу -C(O)OCR'R”C(O)R'”, где R', R” и R''' представляют собой, каждый независимо, водород, алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, которые имеют указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения. Репрезентативные примеры включают, но не ограничиваются перечисленным, -C(O)OCH2C(O)CH3, -C(O)OCH2C(O)CH2CH3, -C(O)OCH(CH3)C(O)CH2CH3, -C(O)OCH(CH3)C(O)C6H5 и тому подобное.
“Ацилоксиалкилоксикарбониламино” относится к радикалу -NRC(O)OCR'R”OC(O)R”', где R, R', R” и R”' представляют собой, каждый независимо, водород, алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, которые имеют указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения. Репрезентативные примеры включают, но не ограничиваются перечисленным, -NHC(O)OCH2OC(O)CH3, -NHC(O)OCH2OC(O)CH2CH3, -NHC(O)OCH(CH3)OC(O)CH2CH3, -NHC(O)OCH(CH3)OC(O)C6H5 и тому подобное.
"Ацилалкилоксикарбониламино" относится к радикалу -NRC(O)OCR'R"C(O)R”', где R, R', R", и R'" представляют собой, каждый независимо, водород, алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, которые имеют указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения. Репрезентативные примеры включают, но не ограничиваются перечисленным, -NHC(O)OCH2C(O)CH3, -NHC(O)OCH2C(O)CH2CH3, -NHC(O)OCH(CH3)C(O)CH2CH3, -NHC(O)OCH(CH3)C(O)C6H5 и тому подобное.
"Ациламино" относится к "амиду", который имеет указанные в описании значения.
"Алкиламино" означает радикал -NHR, где R представляет собой алкильную или циклоалкильную группу, которая имеет указанные в описании значения и может быть необязательно замещена одним или несколькими заместителями, которые имеют указанные в описании значения. Репрезентативные примеры включают, но не ограничиваются перечисленным, метиламино, этиламино, 1-метилэтиламино, циклогексиламино и тому подобное.
"Алкокси" относится к радикалу -OR, где R представляет собой алкильную или циклоалкильную группу, которая имеет указанные в описании значения и может быть необязательно замещена одним или несколькими заместителями, которые имеют указанные в описании значения. Репрезентативные примеры включают, но не ограничиваются перечисленным, метокси, этокси, пропокси, бутокси, циклогексилокси и тому подобное.
"Алкоксикарбонил" относится к радикалу -C(O)-алкокси, где алкокси имеет указанные в описании значения.
"Алкоксикарбонилалкокси" относится к радикалу -OCR'R"C(О)-алкокси, где алкокси имеет указанные в описании значения. Аналогично вышеуказанному, R' и R" представляют собой, каждый независимо, водород, алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, которые имеют указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения. Репрезентативные примеры включают, но не ограничиваются перечисленным -OCH2C(O)OCH3, -OCH2C(O)OCH2CH3, -OCH(CH3)C(O)OCH2CH3, -OCH(C6H5)C(O)OCH2CH3, -OCH(CH2C6H5)C(O)OCH2CH3, -OC(CH3)(CH3)C(O)OCH2CH3 и тому подобное.
"Алкоксикарбонилалкиламино" относится к радикалу -NRCR'R''C(O)-алкокси, где алкокси имеет указанные в описании значения. Аналогично вышеуказанному, R, R', и R" представляют собой, каждый независимо, водород, алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, которые имеет указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения. Репрезентативные примеры включают, но не ограничиваются перечисленным -NHCH2C(O)OCH3, -N(CH3)CH2C(O)OCH2CH3, -NHCH(CH3)C(O)OCH2CH3, -NHCH(C6H5)C(O)OCH2CH3, -NHCH(CH2C6H5)C(O)OCH2CH3, -NHC(CH3)(CH3)C(O)OCH2CH3 и тому подобное.
"Алкилсульфонил" относится к радикалу -S(O)2R, где R представляет собой алкильную или циклоалкильную группу, которая имеет указанные в описании значения и может быть необязательно замещена одним или несколькими заместителями, которые имеют указанные в описании значения. Репрезентативные примеры включают, но не ограничиваются перечисленным, метилсульфонил, этилсульфонил, пропилсульфонил, бутилсульфонил и тому подобное.
"Алкилсульфинил" относится к радикалу -S(O)R, где R представляет собой алкильную или циклоалкильную группу, которая имеет указанные в описании значения и может быть необязательно замещена одним или несколькими заместителями, которые имеют указанные в описании значения. Репрезентативные примеры включают, но не ограничиваются перечисленным, метилсульфинил, этилсульфинил, пропилсульфинил, бутилсульфинил и тому подобное.
"Алкилтио" относится к радикалу -SR, где R представляет собой алкильную или циклоалкильную группу, которая имеет указанные в описании значения и может быть необязательно замещена одним или несколькими заместителями, которые имеют указанные в описании значения. Репрезентативные примеры включают, но не ограничиваются перечисленным, метилтио, этилтио, пропилтио, бутилтио и тому подобное.
"Амид или ациламино" относится к радикалу -NR'C(O)R”, где R' и R” представляют собой, каждый независимо, водород, алкил, циклоалкил, циклогетерoалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, которые имеют указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения. Репрезентативные примеры включают, но не ограничиваются перечисленным, формиламино, ацетиламино, циклогексилкарбониламино, циклогексилметилкарбониламино, бензоиламино, бензилкарбониламино и тому подобное.
"Амино" относится к радикалу -NH2.
“Арил” относится к одновалентному ароматическому углеводородному радикалу, образованному удалением одного атома водорода от одного атома углерода исходной ароматической циклической системы. Типичные арильные группы включают, но не ограничиваются перечисленным, группы, образованные из ацеантрилена, аценафтилена, ацефенантрилена, антрацена, азулена, бензола, хризена, коронена, флуорантена, фтора, гексацена, гексафена, гексалена, асимм.-индацена, симм.-индацена, индана, индена, нафталина, октацена, октафена, окталена, овалена, пента-2,4-диена, пентацена, пенталена, пентафена, перилена, феналена, фенантрена, пицена, плейадена, пирена, пирантрена, рубицена, трифенилена, тринафталина и тому подобное. Арильная группа предпочтительно содержит от 6 до 20 атомов углерода, более предпочтительно от 6 до 12 атомов углерода.
“Арилалкил” относится к ациклическому алкилу, у которого один из атомов водорода, связанных с атомом углерода, обычно концевым или sp3-атомом углерода, заменен арильной группой. Типичные арилалкильные группы включают, но не ограничиваются перечисленным, бензил, 2-фенилэтан-1-ил, 2-фенилэтен-1-ил, нафтилметил, 2-нафтилэтан-1-ил, 2-нафтилэтен-1-ил, нафтобензил, 2-нафтофенилэтан-1-ил и тому подобное. Когда предполагаются определенные алкильные части, применяют номенклатуру арилалканила, арилалкенила и/или арилалкинила. Арилалкильной группой предпочтительно является (С6-С30)арилалкил, например, алканильной, алкенильной или алкинильной частью арилалкильной группы является (С1-С10) и арильной частью является (С6-С30), более предпочтительно арилалкильной группой является (С6-С20)арилалкил, например, алканильной, алкенильной или алкинильной частью арилалкильной группы является (С1-С8) и арильной частью является (С6-С12).
"Арилалкокси" относится к радикалу -O-арилалкил, где арилалкил имеет указанные в описании значения и может быть необязательно замещен одним или несколькими заместителями, которые имеют указанные в описании значения.
"Арилалкоксикарбонилалкокси" относится к радикалу -OCR'R"C(O)-арилалкокси, где арилалкокси имеет указанные в описании значения. Аналогично вышеуказанному R' и R" представляют собой, каждый независимо, водород, алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, которые имеют указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения. Репрезентативные примеры включают, но не ограничиваются перечисленным, -OCH2C(O)OCH2C6H5, -OCH(CH3)C(O)OCH2C6H5, -OCH(C6H5)C(O)OCH2C6H5, -OCH(CH2C6H5)C(O)OCH2C6H5, -OC(CH3)(CH3)C(O)OCH2C6H5 и тому подобное.
"Арилалкоксикарбонилалкиламино" относится к радикалу -NRCR'R''C(O)-арилалкокси, где арилалкокси имеет указанные в описании значения. Аналогично вышеуказанному R, R' и R" представляют собой, каждый независимо, водород, алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, которые имеют указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения. Репрезентативные примеры включают, но не ограничиваются перечисленным, -NHCH2C(O)OCH2C6H5, -N(CH3)CH2C(O)OCH2C6H5, -NHCH(CH3)C(O)OCH2C6H5, -NHCH(C6H5)C(O)OCH2C6H5, -NHCH(CH2C6H5)C(O)OCH2C6H5, -NHC(CH3)(CH3)C(O)OCH2C6H5 и тому подобное.
"Арилоксикарбонил" относится к радикалу -C(O)-O-арил, где арил имеет указанные в описании значения и может быть необязательно замещен одним или несколькими заместителями, которые имеют указанные в описании значения.
"Арилоксикарбонилалкокси" относится к радикалу -OCR'R"C(O)-арилокси, где арилокси имеет указанные в описании значения. Аналогично вышеуказанному R' и R" представляют собой, каждый независимо, водород, алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, которые имеют указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения. Репрезентативные примеры включают, но не ограничиваются перечисленным, -OCH2C(O)OC6H5, -OCH(CH3)C(O)OC6H5, -OCH(C6H5)C(O)OC6H5, -OCH(CH2C6H5)C(O)OC6H5, -OC(CH3)(CH3)C(O)OC6H5 и тому подобное.
"Арилоксикарбонилалкиламино" относится к радикалу -NRCR'R''C(O)-арилокси, где арилокси имеет указанные в описании значения. Аналогично вышеуказанному R, R' и R” представляют собой, каждый независимо, водород, алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, которые имеют указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения. Репрезентативные примеры включают, но не ограничиваются перечисленным, -NHCH2C(O)OC6H5, -N(CH3)CH2C(O)OC6H5, -NHCH(CH3)C(O)OC6H5, -NHCH(C6H5)C(O)OC6H5, -NHCH(CH2C6H5)C(O)OC6H5, -NHC(CH3)(CH3)C(O)OC6H5 и тому подобное.
"Карбамоил" относится к радикалу -C(O)NRR, где каждая группа R представляет собой независимо водород, алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, которые имеют указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения.
"Карбамат" относится к радикалу -NR'C(О)ОR", где R' и R" представляют собой, каждый независимо, водород, алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, которые имеют указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения. Репрезентативные примеры включают, но не ограничиваются перечисленным, метилкарбамат (-NHC(O)OCH3), этилкарбамат (-NHC(O)OCH2CH3), бензилкарбамат (-NHC(O)OCH2C6H5) и тому подобное.
"Карбонат" относится к радикалу -OC(O)OR, где R представляет собой алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, которые имеют указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения. Репрезентативные примеры включают, но не ограничиваются перечисленным, метилкарбонат (-C(O)OCH3), циклогексилкарбонат (-C(O)OC6H11), фенилкарбонат (-C(O)OC6H5), бензилкарбонат (-C(O)OCH2C6H5) и тому подобное.
"Карбокси" означает радикал -C(O)OH.
"Циано" означает радикал -CN.
“Циклоалкил” относится к замещенному или незамещенному циклическому алкильному радикалу. Когда предполагается определенный уровень насыщения, применяют номенклатуру ”циклоалканил” или “циклоалкенил”. Типичные циклоалкильные группы включают, но не ограничиваются перечисленным, группы, образованные из циклопропана, циклобутана, циклопентана, циклогексана и тому подобное. В предпочтительном варианте осуществления циклоалкильной группой является (С3-С10)циклоалкил, более предпочтительно (С3-С7)циклоалкил.
“Циклогетероалкил” относится к насыщенному или ненасыщенному циклическому алкильному радикалу, в котором один или несколько атомов углерода (и любые связанные с ними атомы водорода) независимо заменены одинаковыми или разными гетероатомами. Типичные гетероатомы для замены атома(ов) углерода включают, но не ограничиваются перечисленным, N, P, O, S, Si и т.д. Когда предполагается определенный уровень насыщения, применяют номенклатуру ”циклогетероалканил” или “циклогетероалкенил”. Типичные циклогетероалкильные группы включают, но не ограничиваются перечисленным, группы, образованные из эпоксидов, имидазолидина, морфолина, пиперазина, пиперидина, пиразолидина, пирролидина, хинуклидина и тому подобное.
“Циклогетероалкоксикарбонил” относится к радикалу -С(О)-ОR, где R представляет собой циклогетероалкил, который имеет указанные в описании значения и может быть необязательно замещен одним или несколькими заместителями, которые имеют указанные в описании значения.
“Диалкиламино” означает радикал -NRR', где R и R' независимо представляют собой алкильную или циклоалкильную группу, которая имеет указанные в описании значения и может быть необязательно замещена одним или несколькими заместителями, которые имеют указанные в описании значения. Репрезентативные примеры включают, но не ограничиваются перечисленным, диметиламино, метилэтиламино, ди-(1-метилэтил)амино, (циклогексил)(метил)амино, (циклогексил)(этил)амино, (циклогексил)(пропил)амино и тому подобное.
Выражение “образованный из лекарственного средства” относится к фрагменту, который является структурно близким такому лекарственному средству. Структура фрагмента идентична лекарственному средству, за исключением того, что атом водорода, присоединенный к гетероатому (N или О) заменен ковалентной связью с другой группой (обычно прочасти). Следует отметить, что когда лекарственным средством является форма соли карбоновой, фосфоновой или фосфорной кислоты, считается, что соответствующий структурный фрагмент, образованный из такого лекарственного средства, образован из протонированной формы кислоты.
“Лекарственное средство” относится к соединению, которое проявляет терапевтическую, и/или профилактическую, и/или диагностическую полезность при введении в эффективных количествах пациенту или млекопитающему.
“Сложный эфир” относится к радикалу -С(О)OR, где R представляет собой алкил, замещенный алкил, циклоалкил, замещенный циклоалкил, циклогетероалкил, замещенный циклогетероалкил, арил, замещенный арил, арилалкил, замещенный арилалкил, гетероалкил, замещенный гетероалкил, гетероарил, замещенный гетероарил, гетероарилалкил, замещенный гетероарилалкил, которые имеют указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения. Репрезентативные примеры включают, но не ограничиваются перечисленным, метиловый сложный эфир (-C(O)OCH3), циклогексиловый сложный эфир (-C(O)OC6H11), фениловый сложный эфир (-C(O)OC6H5), бензиловый сложный эфир (-C(O)OCH2C6H5) и тому подобное.
"Простой эфир" относится к радикалу -OR, где R представляет собой алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, которые имеют указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения.
“Галоген” означает фтор, хлор, бром или йод.
“Гетероалкокси” означает радикал -О-гетероалкил, где гетероалкил имеет указанные в описании значения и может быть необязательно замещен одним или несколькими заместителями, которые имеют указанные в описании значения.
“Гетероалкил, гетероалканил, гетероалкенил, гетероалкинил” относятся к алкильной, алканильной, алкенильной и алкинильной группам соответственно, в которых один или несколько атомов углерода (и любые связанные с ними атомы водорода), каждый независимо, заменены одинаковыми или разными гетероатомными группами. Типичные гетероатомные группы включают, но не ограничиваются перечисленным, -O-, -S-, -O-O-, -S-S- , -OS-, -NR'-, =N-N=, -N=N-, -N=N-NR'-, -PH-, -P(O)2-, -O-P(O)-, -S(O)-, -S(O)2-, -SnH2- и тому подобное, где R' представляет собой водород, алкил, замещенный алкил, циклоалкил, замещенный циклоалкил, арил или замещенный арил, которые могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения.
“Гетероарил” относится к одновалентному гетероароматическому радикалу, образованному удалением одного атома водорода от одного атома исходной гетероароматической циклической системы. Типичные гетероарильные группы включают, но не ограничиваются перечисленным, группы, полученные из акридина, арсиндола, карбазола, карболина, хромана, хромена, циннолина, фурана, имидазола, индазола, индола, индолина, индолизина, изобензофурана, изохромена, изоиндола, изоиндолина, изохинолина, изотиазола, изоксазола, нафтиридина, оксадиазола, оксазола, перимидина, фенантридина, фенантролина, феназина, фталазина, птеридина, пурина, пирана, пиразина, пиразола, пиридазина, пиридина, пиримидина, пиррола, пирролизина, хиназолина, хинолина, хинолизина, хиноксалина, тетразола, тиадиазола, тиазола, тиофена, триазола, ксантена и тому подобное. Гетероарильной группой предпочтительно является 5-20-членный гетероарил, причем особенно предпочтительным является 5-10-членный гетероарил. Предпочтительными гетероарильными группами являются группы, образованные из тиофена, пиррола, бензотиофена, бензофурана, индола, пиридина, хинолина, имидазола, оксазола и пиразина.
“Гетероарилоксикарбонил” относится к радикалу -C(O)-OR, где R представляет собой гетероарил, который имеет указанные в описании значения и может быть необязательно замещен одним или несколькими заместителями, которые имеют указанные в описании значения.
“Гетероарилалкил” относится к ациклическому алкильному радикалу, в котором один из атомов водорода, связанных с атомом углерода, обычно концевым или sp3-атомом углерода, заменен гетероарильной группой. Когда предполагаются определенные алкильные части, применяют номенклатуру гетероарилалканил, гетероарилалкенил и/или гетероарилалкинил. Гетероарилалкильным радикалом предпочтительно является содержащий 6-30 углеродных членов гетероарилалкил, например, алканильная, алкенильная или алкинильная часть гетероарилалкила является 1-10-членной и гетероарильная часть является 5-20-членным гетероарилом, более предпочтительно 6-20-членным гетероарилалкилом, например, алканильная, алкенильная или алкинильная часть гетероарилалкила является 1-8-членной и гетероарильная часть является 5-12-членным гетероарилом.
“Гидрокси” означает радикал -ОН.
“Оксо” означает двухвалентный радикал =О.
Применяемый в описании термин “пациент” включает млекопитающих и не млекопитающих. Примеры млекопитающих включают, но не ограничиваются перечисленным, любого из класса млекопитающих: человека, приматов, кроме человека, таких как шимпанзе и другие виды обезьян и мартышек; сельскохозяйственных животных, таких как корова, лошади, овца, козы, свинья; домашних животных, таких как кролики, собаки и кошки; лабораторных животных, включающих грызунов, таких как крысы, мыши и морские свинки, и тому подобное. Примеры не млекопитающих включают, но не ограничиваются перечисленным, птиц, рыб и тому подобное. Термин не указывает конкретный возраст или пол.
“Фармацевтически приемлемый” означает подтвержденный или доказанный контрольным органом Федерального, или государственного, правительства, или перечисленный в Фармакопее США, или в общем признанный Фармакопеей при лечении животных и, более конкретно, человека.
“Фармацевтически приемлемая соль” относится к соли соединения изобретения, которая является фармацевтически приемлемой и обладает требуемой фармакологической активностью “родительского” соединения. Такие соли включают (1) кислотно-аддитивные соли, образованные с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное; или образованные с органическими кислотами, такими как уксусная кислота, пропионовая кислота, гексановая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, 3-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2-этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 4-толуолсульфоновая кислота, камфорасульфоновая кислота, 4-метилбицикло[2,2,2]окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 3-фенилпропионовая кислота, триметилуксусная кислота, трет-бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота и тому подобное; или (2) соли, образованные, когда кислотный протон, присутствующий в “родительском” соединении, заменяется ионом металла, например ионом щелочного металла, ионом щелочноземельного металла; или координирует с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, N-метилглюкамин и тому подобное.
“Фармацевтически приемлемый носитель” относится к разбавителю, адъюванту, эксципиенту или носителю, с которым вводят соединение изобретения.
“Фосфат” относится к радикалу -OP(O)(OR')(OR”), где R' и R” представляют собой, каждый независимо, водород, алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, которые имеют указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения.
“Фосфонат” относится к радикалу -P(O)(OR')(OR”), где R' и R” представляют собой, каждый независимо, водород, алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, которые имеют указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения.
“Предотвращение” относится к снижению риска появления заболевания или нарушения (т.е. оно не позволяет развиваться по меньшей мере одному из клинических симптомов у пациента, который может подвергаться риску заболевания или может быть предрасположен к заболеванию, но еще не испытывает или не проявляет симптомы заболевания).
“Пролекарство” относится к производному молекулы лекарственного средства, которое необходимо превратить в организме для высвобождения активного лекарственного средства. Пролекарства часто являются (хотя и необязательно) фармакологически неактивными, пока не превратятся в “родительское” лекарственное средство.
“Прочасть” относится к форме защитной группы, которая при применении для защиты функциональной группы в молекуле лекарственного средства превращает лекарственное средство в пролекарство. Обычно прочасть присоединена к лекарственному средству через связь(и), которая расщепляется ферментативным или неферментативным способом in vivo.
“Защитная группа” относится к группе атомов, которая при присоединении к реакционно-способной группе в молекуле экранирует, снижает или предотвращает такую реакционную способность. Примеры защитных групп можно найти в Green et al., “Protective Groups in Organic Chemistry”, (Wiley, 2nd ed. 1991) and Harrison et al., “Compendium of Synthetic Organic Methods”, vols. 1-8 (John Wiley and Sons, 1971-1996). Репрезентативные аминозащитные группы включают, но не ограничиваются перечисленным, формил, ацетил, трифторацетил, бензил, бензилоксикарбонил (“CBZ”), трет-бутоксикарбонил (“Boc”), триметилсилил (”TMS”), 2-триметилсилилэтансульфонил (“SES”), тритил и замещенные тритильные группы, аллилоксикарбонил, 9-флуоренилметилоксикарбонил (“FMOC”), нитровератрилоксикарбонил (“NVOC”) и тому подобное. Репрезентативные гидроксилзащитные группы включают, но не ограничиваются перечисленным, группы, у которых гидроксильная группа либо ацилирована, либо алкилирована, такие как бензиловые и триалкилсилиловые простые эфиры и аллиловые простые эфиры.
“Рацемат” относится к эквимолярной смеси энантиомеров хиральной молекулы.
“Гибкая часть” относится к части, которая содержит гидролизуемые связи, которые могут быть включены в соединения согласно изобретению и включают, но не ограничиваются перечисленным, и могут быть амидной (-NHC(O)-), сложноэфирной (-С(О)О-), карбонатной (-ОС(О)О-), фосфатной (-ОР(О)О-), сульфатной (-OS(O)(O)O-), уретановой (-NHC(O)O-), гликозидной или другими связями, которые могут расщепляться гидролазами. Гликозидная часть образуется конъюгацией группы сахара через ее аномерный атом углерода с другой группой через атом кислорода (как О-гликозидная связь) или атом серы (как S-гликозидная связь).
“Спейсер” относится к алкильной, арильной, арилалкильной, гетероалкильной и гетероарильной группе, которая необязательно замещена ацилалкилоксикарбонилом, ацилоксиалкилоксикарбонилом, ацилалкилоксикарбониламино, ацилоксиалкилоксикарбониламино, алкокси, алкоксикарбонилом, алкоксикарбонилалкокси, алкоксикарбонилалкиламино, алкилсульфинилом, алкилсульфонилом, алкилтио, амино, алкиламино, арилалкиламино, диалкиламино, арилалкокси, арилалкоксикарбонилалкокси, арилалкоксикарбонилалкиламино, арилоксикарбонилом, арилоксикарбонилалкокси, арилоксикарбонилалкиламино, карбокси, карбамоилом, карбаматом, карбонатом, циано, галогеном, гетероарилоксикарбонилом, гидрокси, фосфатом, фосфонатом, сульфатом, сульфонатом, сульфонамидом и/или в случае алкила необязательно прерывается одной или несколькими группами О, S и N(R51). R51 может быть Н, низшим алкилом и замещенным низшим алкилом.
“Замещенный” относится к группе, в которой один или несколько атомов водорода, каждый независимо, заменены одинаковым(и) или разным(и) заместителем(ями). Типичные заместители включают, но не ограничиваются перечисленным, -X, -R54, -O-, =O, -OR54, -SR54, -S, =S, -NR54R55, =NR54, -CX3, -CF3, -CN, -OCN, -SCN, -NO, -NO2, =N2, -N3, -S(O)2O-, -S(O)2OH, -S(O)2OR54, -OS(O)2O31, -OS(O)2R54, -P(O)(O-)2, -P(O)(OR14)(O31), -OP(O)(OR54)(OR55), -C(O)R54, -C(S)R54, -C(O)OR54, -C(O)NR54R55, -C(O)O-, -C(S)OR54, -NR56C(O)NR54R55, -NR56C(S)NR54R55, -NR57C(NR56)NR54R55 и -C(NR56)NR54R55, где каждый X представляет собой независимо галоген; каждый R54, R55, R56 и R57 представляет собой независимо водород, алкил, замещенный алкил, арил, замещенный арил, арилалкил, замещенный арилалкил, циклоалкил, замещенный циклоалкил, циклогетероалкил, замещенный циклогетероалкил, гетероалкил, замещенный гетероалкил, гетероарил, замещенный гетероарил, гетероарилалкил, замещенный гетероарилалкил, -NR58R59, -C(O)R58 или -S(O)2R58 или необязательно R58 и R59 вместе с атомом, к которому они оба присоединены, образуют циклогетероалкильное или замещенное циклогетероалкильное кольцо, R58 и R59 представляют собой независимо водород, алкил, замещенный алкил, арил, замещенный арил, арилалкил, замещенный арилалкил, циклоалкил, замещенный циклоалкил, циклогетероалкил, замещенный циклогетероалкил, гетероалкил, замещенный гетероалкил, гетероарил, замещенный гетероарил, гетероарилалкил, замещенный гетероарилалкил.
“Сульфат” относится к радикалу -OS(O)(O)OR, где R представляет собой водород, алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, которые имеют указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения.
“Сульфонамид” относится к радикалу -S(O)(O)NR'R”, где R' и R” представляют собой независимо водород, алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, которые имеют указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения, или необязательно R' и R” вместе с атомом, к которому они оба присоединены, образуют циклогетероалкильное или замещенное циклогетероалкильное кольцо. Репрезентативные примеры включают, но не ограничиваются перечисленным, азетидинильную, пирролидинильную, пиперидинильную, морфолинильную, 4-(NR”')-пиперазинильную или имидазолильную группу, где указанная группа может быть необязательно замещена одним или несколькими заместителями, которые имеют указанные в описании значения. R”' представляет собой водород, алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, которые имеют указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения.
“Сульфонат” относится к радикалу -S(O)(O)OR, где R представляет собой водород, алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, которые имеют указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения.
“Тио” означает радикал -SH.
“Простой тиоэфир” относится к радикалу -SR, где R представляет собой алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, которые имеют указанные в описании значения и могут быть необязательно замещены одним или несколькими заместителями, которые имеют указанные в описании значения.
Термин “лечение” любого заболевания или нарушения относится в одном варианте осуществления к уменьшению интенсивности заболевания или нарушения (т.е. к остановке или ослаблению развития заболевания или по меньшей мере одного из его клинических симптомов). В другом варианте осуществления “лечение” относится к снижению по меньшей мере одного физического параметра, который может быть незаметным для пациента. Еще в одном варианте осуществления “лечение” относится к ингибированию заболевания или нарушения, либо физически (например, стабилизации явного симптома), либо физиологически (например, стабилизации физического параметра) или обоим. Еще в одном варианте осуществления “лечение” относится к задержке начала заболевания или нарушения.
“Терапевтически эффективное количество” означает количество соединения, которое при введении пациенту для лечения заболевания является достаточным для выполнения такого лечения заболевания. “Терапевтически эффективное количество” будет варьировать в зависимости от соединения, заболевания и его тяжести, возраста, массы и т.д. подвергаемого лечению пациента, его может определить специалист в данной области без излишнего экспериментирования.
Теперь следует обратиться конкретно к предпочтительным вариантам осуществления изобретения. Хотя изобретение будет описано в связи с предпочтительными вариантами осуществления, должно быть понятно, что не предполагается ограничение изобретение этими предпочтительными вариантами осуществления. Наоборот, предполагается, что оно включает альтернативы, варианты и эквиваленты, которые могут быть включены в сущность и объем изобретения, определяемого прилагаемой формулой изобретения.
СОЕДИНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к ингибиторам ацетилхолинэстеразы на основе инданона, включающим соединения структурной формулы (I)
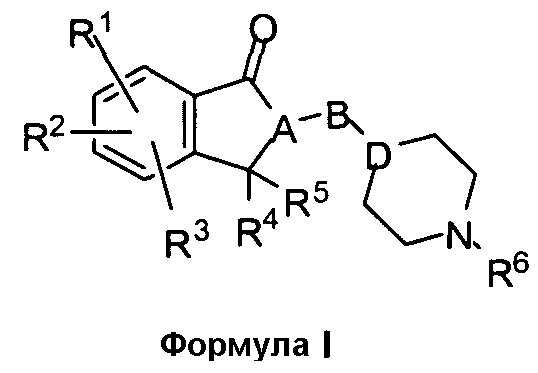
или их фармацевтически приемлемые соли, гидраты или сольваты, при условии, что соединения изобретения содержат “гибкую” часть, конъюгированную непосредственно или через спейсер с одним из заместителей R1, R2, R3, R4, R5 или R6 или вставленную в такой заместитель; где
'A' и 'D' независимо выбраны из СН или N;
'B' выбран из -(CH2)n-, -(CH2)nC(O)-, -(CH2)nC(O)O-, -(CH2)nOC(O)-, -(CH2)nS(O)(O)-, -(CH2)nNHC(O)-, O, S, -C(O), -C(O)O или -S(O)(O), где n = 1-5;
R1, R2, R3, R4, R5 и R6 независимо выбраны из водорода, алкила, замещенного алкила, арила, замещенного арила, арилалкила, замещенного арилалкила, циклоалкила, замещенного циклоалкила, циклогетероалкила, замещенного циклогетероалкила, гетероарила, замещенного гетероарила, гетероарилалкила, замещенного гетероарилалкила; предпочтительно ацилалкилоксикарбонила, ацилоксиалкилоксикарбонила, ацилалкилоксикарбониламино, ацилоксиалкилоксикарбониламино, алкокси, алкоксикарбонила, алкоксикарбонилалкокси, алкоксикарбонилалкиламино, алкилсульфинила, алкилсульфонила, алкилтио, амино, алкиламино, арилалкиламино, диалкиламино, арилалкокси, арилалкоксикарбонилалкокси, арилалкоксикарбонилалкиламино, арилоксикарбонила, арилоксикарбонилалкокси, арилоксикарбонилалкиламино, карбокси, карбамоила, карбамата, карбоната, циано, галогена, гетероарилоксикарбонила, гидрокси, фосфата, фосфоната, сульфата, сульфоната, сульфонамида; необязательно R1 и R2 или R2 и R3 вместе образуют 5- или 6-членное кольцо, которое может содержать один или несколько гетероатомов, выбранных из O, N или S, и это кольцо может быть необязательно замещено заместителями, выбранными из алкила, замещенного алкила, галогена, гидроксила и карбонила; R4 и R5 необязательно вместе образуют 5- или 6-членное кольцо, которое может содержать один или несколько гетероатомов, выбранных из O, N или S, и это кольцо может быть необязательно замещено заместителями, выбранными из алкила, замещенного алкила, галогена, гидроксила и карбонила.
В одном аспекте изобретения описаны соединения структурной формулы (II)

или их фармацевтически приемлемые соли, гидраты или сольваты, где Х может быть О, S, NH или NR8;
SP представляет собой спейсер;
'A' и 'D' независимо выбраны из СН или N;
'B' выбран из -(CH2)n-, -(CH2)nC(O)-, -(CH2)nC(O)O-, -(CH2)nOC(O)-, -(CH2)nS(O)(O)-, -(CH2)nNHC(O)-, O, S, -C(O), -C(O)O, или -S(O)(O), где n равно целому числу от 1 до 5;
R1, R2, R3, R4 и R5 независимо выбраны из водорода, алкила, замещенного алкила, арила, замещенного арила, арилалкила, замещенного арилалкила, циклоалкила, замещенного циклоалкила, циклогетероалкила, замещенного циклогетероалкила, гетероарила, замещенного гетероарила, гетероарилалкила, замещенного гетероарилалкила, ацилалкилоксикарбонила, ацилоксиалкилоксикарбонила, ацилалкилоксикарбониламино, ацилоксиалкилоксикарбониламино, алкокси, алкоксикарбонила, алкоксикарбонилалкокси, алкоксикарбонилалкиламино, алкилсульфинила, алкилсульфонила, алкилтио, амино, алкиламино, арилалкиламино, диалкиламино, арилалкокси, арилалкоксикарбонилалкокси, арилалкоксикарбонилалкиламино, арилоксикарбонила, арилоксикарбонилалкокси, арилоксикарбонилалкиламино, карбокси, карбамоила, карбамата, карбоната, циано, галогена, гетероарилоксикарбонила, гидрокси, фосфата, фосфоната, сульфата, сульфоната и сульфонамида; необязательно R1 и R2 или R2 и R3 вместе образуют 5- или 6-членное кольцо, которое может содержать один или несколько гетероатомов, выбранных из O, N или S, и это кольцо может быть необязательно замещено заместителями, выбранными из алкила, замещенного алкила, галогена, гидроксила и карбонила; R4 и R5 необязательно вместе образуют 5- или 6-членное кольцо, которое может содержать один или несколько гетероатомов, выбранных из O, N или S, и это кольцо может быть необязательно замещено заместителями, выбранными из алкила, замещенного алкила, галогена, гидроксила или карбонила;
R7 выбран из алкила, замещенного алкила, арила, замещенного арила, арилалкила, замещенного арилалкила, циклоалкила, замещенного циклоалкила, циклогетероалкила, замещенного циклогетероалкила, гетероарила, замещенного гетероарила, гетероарилалкила, замещенного гетероарилалкила; R7 и R8 вместе образуют 5- или 6-членное кольцо, которое необязательно может содержать один или несколько гетероатомов, выбранных из О, N или S, и которое может быть необязательно замещено одним или несколькими заместителями, выбранными из алкила, галогена, гидроксила, карбонила, или R7 вместе с R8 образуют 5- или 6-членные лактоны или лактамы, которые могут быть необязательно замещены одним или несколькими заместителями, выбранными из алкила, галогена, гидроксила или карбонила;
R8 выбран из алкила, замещенного алкила или R7 и R8 вместе образуют 5- или 6-членное кольцо, которое необязательно может содержать один или несколько гетероатомов, выбранных из О, N или S, и которое может быть необязательно замещено одним или несколькими заместителями, выбранными из алкила, галогена, гидроксила, карбонила; или R8 вместе с R7 образует 5- или 6-членные лактоны или лактамы, которые могут быть необязательно замещены одним или несколькими заместителями, выбранными из алкила, галогена, гидроксила или карбонила.
В другом аспекте изобретения соединения имеют структурную формулу (III)

или являются их фармацевтически приемлемыми солями, гидратами или сольватами, где Х может быть О, S, NH или NR8;
SP может быть спейсером;
'A' и 'D' независимо выбраны из СН или N;
'B' выбран из -(CH2)n-, -(CH2)nC(O)-, -(CH2)nC(O)O-, -(CH2)nOC(O)-, -(CH2)nS(O)(O)-, -(CH2)nNHC(O)-, O, S, -C(O), -C(O)O, или -S(O)(O) где n = 1-5;
R2, R3, R4, R5 и R6 независимо выбраны из водорода, алкила, замещенного алкила, арила, замещенного арила, арилалкила, замещенного арилалкила, циклоалкила, замещенного циклоалкила, циклогетероалкила, замещенного циклогетероалкила, гетероарила, замещенного гетероарила, гетероарилалкила, замещенного гетероарилалкила, ацилалкилоксикарбонила, ацилоксиалкилоксикарбонила, ацилалкилоксикарбониламино, ацилоксиалкилоксикарбониламино, алкокси, алкоксикарбонила, алкоксикарбонилалкокси, алкоксикарбонилалкиламино, алкилсульфинила, алкилсульфонила, алкилтио, амино, алкиламино, арилалкиламино, диалкиламино, арилалкокси, арилалкоксикарбонилалкокси, арилалкоксикарбонилалкиламино, арилоксикарбонила, арилоксикарбонилалкокси, арилоксикарбонилалкиламино, карбокси, карбамоила, карбамата, карбоната, циано, галогена, гетероарилоксикарбонила, гидрокси, фосфата, фосфоната, сульфата, сульфоната, сульфонамида; необязательно R2 и R3 вместе образуют 5- или 6-членное кольцо, которое может содержать один или несколько гетероатомов, выбранных из O, N или S, и это кольцо может быть необязательно замещено заместителями, выбранными из алкила, замещенного алкила, галогена, гидроксила, карбонила; R4 и R5 необязательно вместе образуют 5- или 6-членное кольцо, которое может содержать один или несколько гетероатомов, выбранных из O, N или S, и это кольцо может быть необязательно замещено заместителями, выбранными из алкила, замещенного алкила, галогена, гидроксила или карбонила;
R7 выбран из алкила, замещенного алкила, арила, замещенного арила, арилалкила, замещенного арилалкила, циклоалкила, замещенного циклоалкила, циклогетероалкила, замещенного циклогетероалкила, гетероарила, замещенного гетероарила, гетероарилалкила, замещенного гетероарилалкила; R7 и R8 вместе образуют 5- или 6-членное кольцо, которое необязательно может содержать один или несколько гетероатомов, выбранных из О, N или S, и которое может быть необязательно замещено одним или несколькими заместителями, выбранными из алкила, галогена, гидроксила, карбонила; или R7 вместе с R8 образуют 5- или 6-членные лактоны или лактамы, которые могут быть необязательно замещены одним или несколькими заместителями, выбранными из алкила, галогена, гидроксила или карбонила;
R8 выбран из алкила, замещенного алкила или R7 и R8 вместе образуют 5- или 6-членное кольцо, которое необязательно может содержать один или несколько гетероатомов, выбранных из О, N или S, и которое может быть необязательно замещено одним или несколькими заместителями, выбранными из алкила, галогена, гидроксила, карбонила; или R8 вместе с R7 образуют 5- или 6-членные лактоны или лактамы, которые могут быть необязательно замещены одним или несколькими заместителями, выбранными из алкила, галогена, гидроксила или карбонила.
В другом аспекте изобретения соединения имеют структурную формулу (IV)
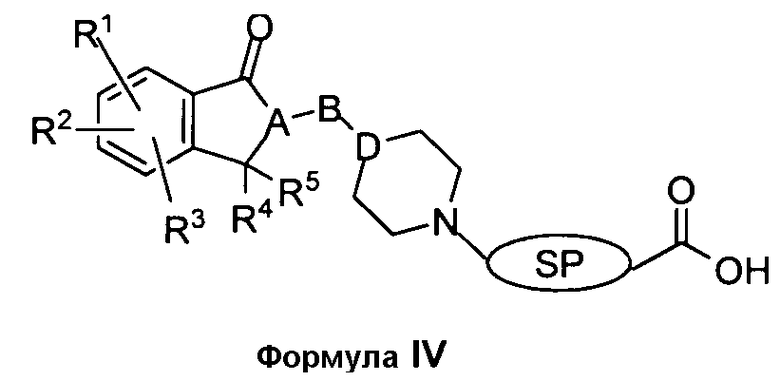
или являются их фармацевтически приемлемыми солями, гидратами или сольватами, где Х может быть О, S, NH или NR8;
SP может быть спейсером;
'A' и 'D' независимо выбраны из СН или N;
'B' выбран из -(CH2)n-, -(CH2)nC(O)-, -(CH2)nC(O)O-, -(CH2)nOC(O)-, -(CH2)nS(O)(O)-, -(CH2)nNHC(O)-, O, S, -C(O), -C(O)O, или -S(O)(O), где n равно целому числу от 1 до 5;
R1, R2, R3, R4 и R5 независимо выбраны из водорода, алкила, замещенного алкила, арила, замещенного арила, арилалкила, замещенного арилалкила, циклоалкила, замещенного циклоалкила, циклогетероалкила, замещенного циклогетероалкила, гетероарила, замещенного гетероарила, гетероарилалкила, замещенного гетероарилалкила, предпочтительно ацилалкилоксикарбонила, ацилоксиалкилоксикарбонила, ацилалкилоксикарбониламино, ацилоксиалкилоксикарбониламино, алкокси, алкоксикарбонила, алкоксикарбонилалкокси, алкоксикарбонилалкиламино, алкилсульфинила, алкилсульфонила, алкилтио, амино, алкиламино, арилалкиламино, диалкиламино, арилалкокси, арилалкоксикарбонилалкокси, арилалкоксикарбонилалкиламино, арилоксикарбонила, арилоксикарбонилалкокси, арилоксикарбонилалкиламино, карбокси, карбамоила, карбамата, карбоната, циано, галогена, гетероарилоксикарбонила, гидрокси, фосфата, фосфоната, сульфата, сульфоната, сульфонамида; необязательно R1 и R2 или R2 и R3 вместе образуют 5- или 6-членное кольцо, которое может содержать один или несколько гетероатомов, выбранных из O, N или S, и это кольцо может быть необязательно замещено заместителями, выбранными из алкила, замещенного алкила, галогена, гидроксила, карбонила; R4 и R5 необязательно вместе образуют 5- или 6-членное кольцо, которое может содержать один или несколько гетероатомов, выбранных из O, N или S, и это кольцо может быть необязательно замещено заместителями, выбранными из алкила, замещенного алкила, галогена, гидроксила и карбонила.
Еще в одном аспекте изобретения соединения имеют структурную формулу (V)

или являются их фармацевтически приемлемыми солями, гидратами или сольватами, где Х может быть О, S, NH или NR8;
SP может быть спейсером;
'A' и 'D' независимо выбраны из СН или N;
'B' выбран из -(CH2)n-, -(CH2)nC(O)-, -(CH2)nC(O)O-, -(CH2)nOC(O)-, -(CH2)nS(O)(O)-, -(CH2)nNHC(O)-, O, S, -C(O), -C(O)O, или -S(O)(O), где n = 1-5;
R2, R3, R4, R5 и R6 независимо выбраны из водорода, алкила, замещенного алкила, арила, замещенного арила, арилалкила, замещенного арилалкила, циклоалкила, замещенного циклоалкила, циклогетероалкила, замещенного циклогетероалкила, гетероарила, замещенного гетероарила, гетероарилалкила, замещенного гетероарилалкила; предпочтительно ацилалкилоксикарбонила, ацилоксиалкилоксикарбонила, ацилалкилоксикарбониламино, ацилоксиалкилоксикарбониламино, алкокси, алкоксикарбонила, алкоксикарбонилалкокси, алкоксикарбонилалкиламино, алкилсульфинила, алкилсульфонила, алкилтио, амино, алкиламино, арилалкиламино, диалкиламино, арилалкокси, арилалкоксикарбонилалкокси, арилалкоксикарбонилалкиламино, арилоксикарбонила, арилоксикарбонилалкокси, арилоксикарбонилалкиламино, карбокси, карбамоила, карбамата, карбоната, циано, галогена, гетероарилоксикарбонила, гидрокси, фосфата, фосфоната, сульфата, сульфоната, сульфонамида; необязательно R2 и R3 вместе образуют 5- или 6-членное кольцо, которое может содержать один или несколько гетероатомов, выбранных из O, N или S, и это кольцо может быть необязательно замещено заместителями, выбранными из алкила, замещенного алкила, галогена, гидроксила, карбонила; R4 и R5 необязательно вместе образуют 5- или 6-членное кольцо, которое может содержать один или несколько гетероатомов, выбранных из O, N или S, и это кольцо может быть необязательно замещено заместителями, выбранными из алкила, замещенного алкила, галогена, гидроксила и карбонила.
Соединения данного изобретения, раскрытые в описании, могут иметь одну или несколько следующих характеристик или свойств:
(а) соединения изобретения могут обладать ингибирующей холинэстеразу активностью;
(b) соединения изобретения могут обладать ингибирующей ацетилхолинэстеразу активностью;
(с) соединения изобретения могут обладать ингибирующей бутирилхолинэстеразу активностью;
(d) соединения согласно изобретению могут содержать по меньшей мере одну гидролизуемую связь, которая может быть расщеплена неокислительным образом гидролитическим ферментом(ами);
(е) первичные метаболиты соединений являются результатом неокислительного метаболического пути;
(f) первичный метаболит(ы), независимо от электрофизиологических свойств “родительского” лекарственного средства, имеет или может иметь незначительную ингибирующую активность у канала IKr (HERG) при нормальной терапевтической концентрации “родительского” лекарственного средства в плазме (например, концентрация метаболита должна быть по меньшей мере в пять раз выше, чем нормальная терапевтическая концентрация “родительского” соединения до того, как наблюдают активность у канала IKr);
(g) соединения изобретения, а также их метаболиты не вызывают или могут уменьшить случаи метаболического межлекарственного взаимодействия (взаимодействия лекарственного средства с лекарственным средством) (DDI) при введении с другими лекарственными средствами;
(h) соединения изобретения, а также их метаболиты при испытании по существу не увеличивают величины функционирования печени (LFT) при введении их отдельно;
(i) пероральная биологическая доступность соединений может согласовываться с пероральным введением стандартных фармакологических пероральных препаратов; однако соединения и их композиции можно также вводить с применением любой системы доставки, которая обеспечивает постоянные и регулируемые уровни их в крови на протяжении времени.
В одном аспекте изобретение относится к соединениям, имеющим любые две или более указанных выше идентичных характеристик или свойств. В другом аспекте изобретение относится к соединениям, имеющим по меньшей мере любые три или более указанных выше идентичных свойств или характеристик. Еще в одном аспекте соединения и их композиции имеют любую комбинацию от четырех до семи указанных выше идентичных характеристик или свойств. Соединения изобретения предпочтительно имеют все девять характеристик или свойств.
Первичный метаболит(ы) соединения изобретения, независимо от электрофизиологических свойств “родительского” лекарственного средства, предпочтительно имеет незначительную ингибирующую активность у канала IKr (HERG) при нормальной терапевтической концентрации лекарственного средства в плазме. Другими словами, концентрация метаболита может быть в пять раз выше, чем нормальная терапевтическая концентрация “родительского” соединения до того, как наблюдают активность у канала IKr. Концентрация метаболита предпочтительно может быть по меньшей мере в десять раз выше, чем нормальная терапевтическая концентрация “родительского” соединения до того, как наблюдают активность у канала IKr.
Соединения согласно изобретению могут в основном метаболизироваться эндогенными гидролитическими ферментами посредством гидролизуемых связей, введенных в их структуры. Первичные метаболиты, являющиеся результатом этого метаболического пути, являются водорастворимыми и не имеют или проявляют уменьшенное число случаев DDI при введении с другими медикаментами (лекарственными средствами). Неограничивающими примерами гидролизуемых связей, которые можно включить в соединения согласно изобретению, являются амидная, сложноэфирная, карбонатная, фосфатная, сульфатная, карбамидная, уретановая, гликозидная или другие связи, которые могут расщепляться гидролазами.
Дополнительные модификации раскрытых в описании соединений может легко осуществить специалист в данной области. Таким образом, аналоги и соли указанных в качестве примеров соединений находятся в пределах объема рассматриваемого изобретения. Зная соединения рассматриваемого изобретения, специалист в данной области может применять известные способы для синтеза этих соединений из доступных субстратов. Применяемый в данной заявке термин “аналоги” относится к соединениям, которые являются по существу такими же, как другое соединение, но которые могут быть модифицированы, например, присоединением дополнительных боковых групп. Термин “аналог”, применяемый в данной заявке, может относиться также к соединениям, которые являются по существу такими же, как другое соединение, но которые имеют атомное или молекулярное замещение в некоторых положениях в соединении.
Рассматриваемое изобретение далее относится к выделенным энантиомерным соединениям и содержащим эти соединения композициям. Выделенные энантиомерные формы соединений изобретения являются по существу свободными друг от друга (т.е. находятся в энантиомерном избытке). Другими словами, “R”-формы соединений по существу свободны от “S”-форм соединений и находятся таким образом в энантиомерном избытке относительно “S”-форм. И, наоборот, “S”-формы соединений по существу свободны от “R”-форм соединений и находятся таким образом в энантиомерном избытке относительно “R”-форм. В одном варианте осуществления изобретения выделенные энантиомерные соединения имеют по меньшей мере приблизительно 80% энантиомерный избыток. Так, например, соединения имеют по меньшей мере приблизительно 90% энантиомерный избыток, предпочтительно, по меньшей мере приблизительно 95% энантиомерный избыток, более предпочтительно, по меньшей мере приблизительно 97% энантиомерный избыток или еще более предпочтительно, по меньшей мере 99% или больше, чем 99% энантиомерный избыток.
Синтез соединений изобретения
Соединения изобретения можно получать посредством синтетических способов, иллюстрированных на схемах 1-12. Для специалиста в данной области должно быть понятно, что предпочтительный синтетический путь к соединениям изобретения будет состоять из присоединения или включения “гибких” частей в производные инданона формул (I)-(V). В данной области описаны многочисленные способы синтеза аналогов инданона (см., например, Fillion, E. et al., J. Org. Chem. 2005, 70, 1316-1327; Sugimoto, H. et al., J. Med. Chem. 1995, 38, 4821-4829). Для синтеза инданона в данной области известны другие способы, которые легко доступны специалисту в данной области. “Гибкие” части, присоединенные к их спейсерам, являются коммерчески доступными или их можно получить установленными методиками (см, например, Green et al., "Protective Groups in Organic Chemistry" (Wiley, 4rd ed., 2006); Harrison et al. "Compendium of Synthetic Organic Methods", vols. 1-8 (John Wiley and Sons, 1971-1996); "Beilstein Handbook of Organic Chemistry", Frankfurt, Germany; Feiser et al., "Reagents for Organic Synthesis", Volumes 1-45, Karger, 1991; March, Advanced Organic Chemistry", Wiley Interscience, 4th ed., 1991; Larock "Comprehensive Organic Transformations", Wiley-VCH Publishers, 2nd ed., 1999; Paquette, "Encyclopedia of Reagents for Organic Synthesis", John Wiley and Sons, 1st ed., 1995).
Согласно этому исходные вещества, применимые для получения соединений изобретения, и их промежуточные продукты являются коммерчески доступными или их можно получить хорошо известными синтетическими способами. Другие способы синтеза инданонов, раскрытых в описании, либо описаны в данной области, либо будут легко очевидны специалисту в данной области ввиду ссылок, представленных выше, и их можно применять для синтеза соединений изобретения. Согласно этому способы, представленные выше в схемах, являются иллюстративными, а не подробными.
Один общий способ синтеза соединений формул (I)-(V) описан на схеме 1. Подходящий инданон (1) применяют в качестве исходного структурного блока. Ряд замещенных, в том числе функционализированных, инданонов является коммерчески доступным от хорошо известных фирм-продавцов, подобных Sigma-Aldrich, Acros, Alfa-Aesar. Многие инданоны, имеющие общую структуру (1), можно также получить с применением способов, описанных в литературе (Premsagar et al. J. Org. Chem. 1981, 46, 2974-2976; Eaton et al. J. Org. Chem. 1973, 38, 4071-4073). Требуемые производные инданона, имеющие структуру (5), можно получить из подходящего инданона (1). В последние годы был разработан ряд способов синтеза производных инданона типа (5) с применением инданонов типа (1) (Sugimoto et al. J. Med. Chem. 1992, 35, 4542-4548; Sugimoto et al. US 4895841 and 5100901; Pathi et al. WO 2007077443; Parthasaradhi et al. WO 2005003092; Dubey et al. WO 2005076749; Gutman et al. WO 200009483; Radhakrishnan et al. US 20040158070; Reddy et al. US 20040143121; Iimura et al. US 6252081; Lensky, US 5606064). В типичной реакции подходящий инданон (1) конденсируют с подходящим 4-формилпиперидином (2) в присутствии сильного основания, подобного диизопропиламиду лития (LDA), трет-бутоксиду калия или гидроксиду калия, с получением инданона (3), который после восстановления с применением стандартных условий гидрирования дает требуемое производное инданона (5). Для превращения (3) в (5) можно применять стандартные условия гидрирования, подобные водороду в присутствии катализатора оксида платины, палладия-на-угле, никеля Ренея или оксида рутения. Формилпиперидиновый структурный блок (2) можно получить следующим описанным способом (Abe et al. Tetrahedron 2001, 57, 2701-2710; Miwa et al. Synlett 1994, 2, 109; Chen et al. EP 441517). Требуемый инданон (5) можно также синтезировать из инданона (1) реакцией с подходящим пиперидином (4) в присутствии сильного основания, подобного диизопропиламиду лития. Пиперидиновые структурные блоки (4) можно получить из изонипекотата с применением стандартных методик, хорошо известных в данной области (Abe et al. Tetrahedron 2001, 57, 2701-2710).


Другой общий способ синтеза соединений формулы (II) начинается с подходящего инданона (5) и проводится ступенчатым способом, как показано на схеме 2. Инданон (5) можно превратить в производное с подходящим спейсером, имеющим “гибкую” часть (8), в стандартных условиях алкилирования, хорошо известных в данной области, с получением соответствующего производного инданона (7). Производное инданона (5), имеющее подходящую защитную группу, такую как бензил, можно получить из соединения (1) ступенчатым способом, описываемым для синтеза соединения (7), как показано на схеме 1. Структурные блоки (8) можно получить с применением стандартных способов, хорошо известных в данной области. В типичной реакции удаление защитной N-бензильной группы соединения (5) в стандартных условиях гидрирования с применением палладия-на-угле в качестве катализатора дает соответствующий дебензилированный инданон (6), который после реакции с галогеналкилом или бензилпроизводным, имеющим “гибкую” часть, в присутствии слабого основания, подобного диизопропилэтиламину, в полярном апротонном растворителе, подобном ацетонитрилу, DCM или ДМФА, дает требуемое соединение, имеющее общую структуру (7).

Другой общий способ синтеза соединений формулы (III) описан на схеме 3. Инданон (5), имеющий свободную фенольную гидроксильную группу, можно подвергнуть реакции с подходящим спейсером, имеющим “гибкую” часть (8), в стандартных условиях алкилирования, хорошо известных в данной области, с получением соответствующего производного инданона (10). Производное инданона (5), имеющее свободную фенольную гидроксильную группу, можно получить из соответствующего инданона (5) с фенольной гидроксильной группой, защищенной подходящей защитной группой, подобной МОМ, TBS, BOC, PMB, ступенчатым способом, как иллюстрировано на схеме 1. В типичной реакции инданон (5), содержащий защитную группу МОМ, в кислотных условиях с применением трифторуксусной кислоты (TFA) или хлорида водорода (HCl) в растворителе, подобном дихлорметану (DCM), дает соответствующий инданон (9), который после реакции с галогеналкилом или бензилпроизводным, содержащим “гибкую” часть, в присутствии слабого основания, подобного карбонату калия или карбонату цезия, в ацетоне или ДМФА дает требуемое соединение, имеющее общую структуру (10).
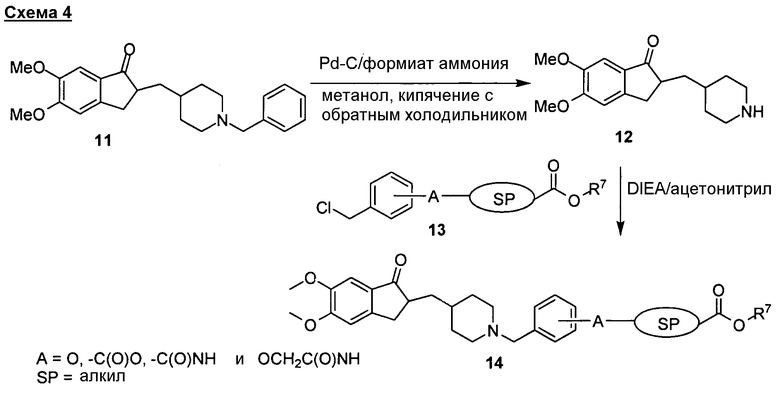
В другом общем способе соединения формул (IV) и (V) можно синтезировать из соединений, имеющих общие формулы (II) и (III), гидролизом концевых сложноэфирных групп в стандартных условиях, хорошо известных в данной области.
По одному способу выбранные производные инданона, имеющие формулу (II), получали, как описано на схеме 4. Исходное N-бензилзащищенное производное инданона (11) получали с применением описанных способов, как иллюстрировано на схеме 1. Защитную бензильную группу удаляли обработкой соединения (11) палладием-на-угле и формиатом аммония в метаноле при кипячения с обратным холодильником в течение двух часов с получением продукта почти с количественным выходом. Дебензилированный инданон 12 подвергали реакции с подходящим бензилхлоридом (13), имеющим “гибкую” часть, в присутствии слабого основания DIEA при температуре от комнатной до 70°С в течение 3-5 час, получая при этом требуемое производное инданона (14) с хорошим выходом. Структурные блоки бензилхлориды (13) получали, как иллюстрировано на схемах 7-10.

По другому способу выбранные производные инданона, имеющие формулу (III), получали, как описано на схеме 5. Инданон (11) обрабатывали этантиолатом натрия в ДМФА приблизительно при 70°С с получением соответствующего инданона (15) с выходом выше 90% (Eur. J. Org. Chem. 2003, 9, 1681-1686). Инданон (15) алкилировали подходящим алкилгалогенидом, имеющим концевую сложноэфирную группу (17), в стандартных условиях с применением карбоната калия в ацетоне с хорошими выходами продуктов.
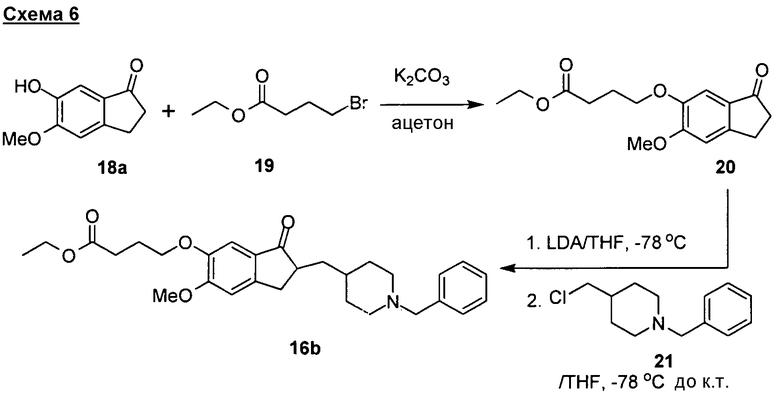
По другому способу выбранные производные инданона, имеющие формулу (III), получали, как описано на схеме 6. Исходный 6-гидрокси-5-метоксиинданон (18а) получали из ванилина (33а) четырехстадийным способом, как иллюстрировано на схеме 11. Инданон (18а) подвергали реакции с этил-4-бромбутаноатом (19) в стандартных условиях алкилирования с получением соответствующего производного инданона (20), как описано для синтеза инданона (16), иллюстрируемого на схеме 5. Инданон (20) обрабатывали хлорметилпиперидином (21) в присутствии сильного основания диизопропиламида лития (LDA) в безводном ТГФ при -78°С с получением требуемого инданона (16b).
Синтез структурных блоков, содержащих “гибкую” часть (13а-d), описан на схеме 7. Хлорметилзамещенные бензойные кислоты (23) и (24) нагревали с этанолом при температуре кипения с обратным холодильником в присутствии каталитических количеств концентрированной серной кислоты в течение 5-8 час, получая при этом соответствующие сложные эфиры (13а) и (13с) соответственно. Аналогично этому, хлорметилзамещенные бензоаты (13b) и (13d) получали в идентичных условиях реакции с применением изопропанола почти с количественными выходами.
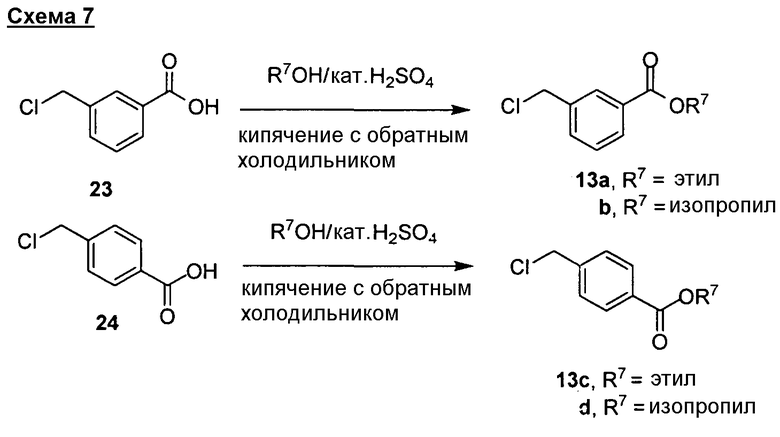
Структурные блоки (13е), (13f) и (13g) получали, как описано на схеме 8. Хлорметилзамещенную бензойную кислоту (23) сочетали с 4-аминобутаноатом (26) с применением стандартных условий сочетания пептидов и образованием сложного эфира (13е). 4-Хлорметилзамещенные производные бензойной кислоты (13f) и (13g) также получали в идентичных условиях реакции с применением этил-3-аминопропаноата (25) и эфира аминокислоты (26), соответственно, с хорошими выходами.
Сложноэфирные структурные блоки (13h и i) получали, как описано на схеме 9. Фенолы (27) алкилировали эфирами подходящих бромалкилкарбоновых кислот (28) нагреванием в ацетоне в присутствии слабого основания карбоната калия с получением соответствующих сложных эфиров (29) с хорошими выходами. Эфиры (29) обрабатывали тионилхлоридом в стандартных условиях реакции с получением требуемых сложноэфирных структурных блоков (13h и 13i) с хорошими выходами.

Сложноэфирные структурные блоки (13j) получали в три стадии, как описано на схеме 10. Промежуточный продукт (31) получали с хорошим выходом реакцией этилового эфира бета-аланина (25) с хлорацетилхлоридом (30) в присутствии слабого основания триэтиламина (ТЕА) в DCM. Хлоралкиловый сложный эфир (31) сочетали с фенолом (27) в стандартных условиях реакции с применением слабого основания карбоната калия в ацетоне при температуре кипения с обратным холодильником, получая при этом соединение 32, которое после обработки тионилхлоридом давало требуемый сложноэфирный структурный блок (13j) с общим хорошим выходом.
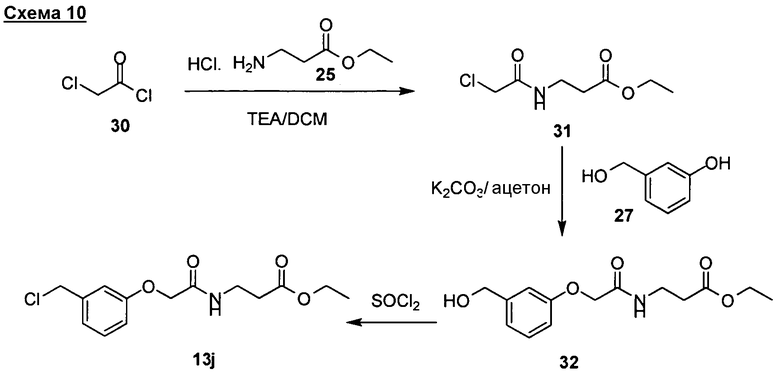
Инданоновые структурные блоки (18) получали, как описано на схеме 11. Коммерчески доступный ванилин (33а) подвергали реакции с реагентом Виттига (34) в толуоле при температуре кипения с обратным холодильником с получением соответствующего ненасыщенного сложного эфира (35а) в виде смеси цис- и транс-изомеров. Сложный эфир (35а) подвергали гидрированию с применением катализатора палладия-на-угле в метаноле с получением насыщенного сложного эфира (36а). Сложный эфир (36а) гидролизовали с применением водного гидроксида калия в ТГФ, получая при этом карбоновую кислоту, которая после циклизации в присутствии концентрированной серной кислоты давала требуемый 6-гидроксииндан-1-он (18а) с общим хорошим выходом. Аналогично этому, 5-гидроксииндан-1-он (18b) получали из коммерчески доступного структурного блока изованилина (33b) с общими хорошими выходами.
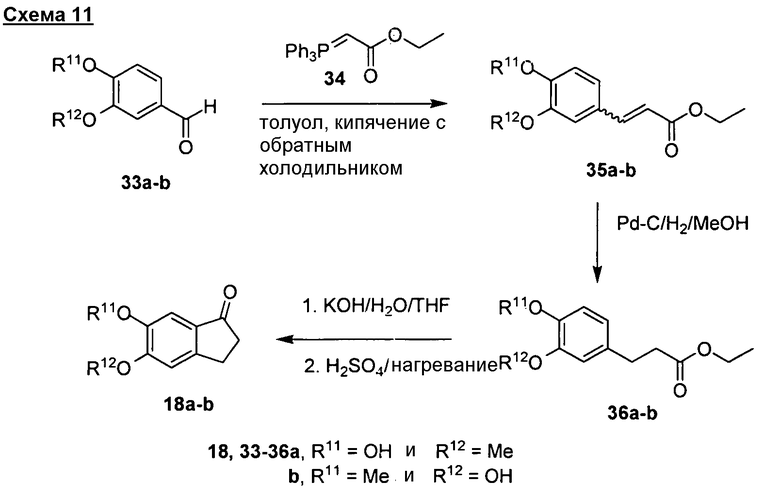
N-Бензилзамещенное производное пиперидина (21) получали, как описано на схеме 12. Коммерчески доступный 4-гидроксиметилпиперидин (38) бензилировали бензилбромидом (39) с применением слабого основания DIEA в ацетонитриле, получая при этом соответствующее бензилированное производное (40). N-Бензилпиперидин (40) обрабатывали тионилхлоридом с получением требуемого N-бензил-4-хлорметилпиперидина (21) с общим хорошим выходом.
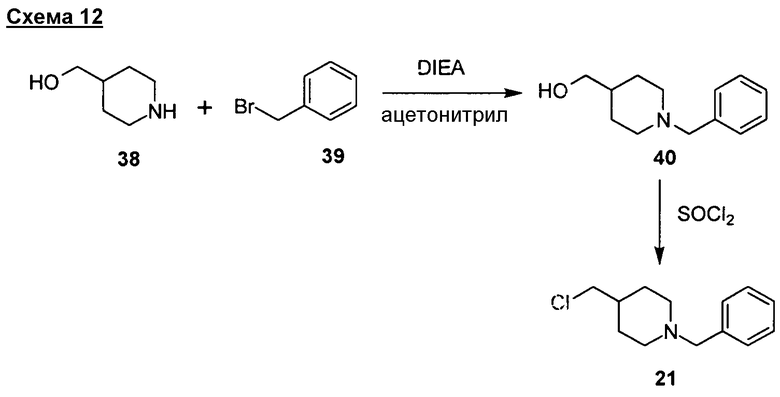
ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ СОЕДИНЕНИЙ СТРУКТУРНЫХ ФОРМУЛ
Настоящее изобретение относится к способам лечения болезни Альцгеймера. Настоящее изобретение относится также к способам лечения и предотвращения таких заболеваний, как болезнь Хантингтона, болезнь Пика, атаксия, тяжелая миастения и глаукома.
Согласно изобретению, соединение и/или композицию, содержащую соединение структурных формул (I)-(V), можно вводить пациенту, предпочтительно человеку, страдающему болезнью Альцгеймера. Кроме того, в некоторых вариантах осуществления соединения и/или композиции изобретения можно вводить пациенту, предпочтительно человеку, в качестве лечебной или профилактической меры против болезни Хантингтона, болезни Пика, атаксии, тяжелой миастении и глаукомы.
Таким образом, специалист в данной области может легко испытывать и применять соединения и/или композиции, содержащие соединение(я) структурных формул (I)-(V), для лечения медицинского состояния, для которого желательно ингибирование холинэстеразы.
ВВЕДЕНИЕ ДЛЯ ТЕРАПЕВТИЧЕСКОГО/ПРОФИЛАКТИЧЕСКОГО ЛЕЧЕНИЯ
Соединения и/или композиции, содержащие соединение(я) структурных формул (I)-(V), можно преимущественно применять в медицине для людей. Как описано подробно выше, соединения и композиции, содержащие соединение(я) структурных формул (I)-(V), являются применимыми для лечения болезни Альцгеймера, болезни Хантингтона, болезни Пика, атаксии, тяжелой миастении и глаукомы.
При применении для лечения или предотвращения указанных выше заболеваний или нарушений соединения и/или композиции изобретения можно вводить или наносить по отдельности или в комбинации с другими агентами. Соединения и/или композиции изобретения можно также вводить или наносить по отдельности или в комбинации с другими фармацевтически активными агентами, включающими другие соединения и/или композиции изобретения.
Настоящее изобретение относится к способам лечения и/или предотвращения введением пациенту терапевтически эффективного количества композиции и/или соединения изобретения. Пациентом может быть животное, более предпочтительно млекопитающее и наиболее предпочтительно человек.
Настоящие соединения и/или композиции изобретения, которые содержат одно или несколько соединений и/или композиций изобретения, предпочтительно вводят перорально. Соединения и/или композиции изобретения можно также вводить любым другим общепринятым путем, например, инфузией или инъекцией болюса, абсорбцией через эпителиальные или слизистые выстилки (например, слизистую оболочку полости рта, ректальную и кишечную слизистую оболочку и т.д.). Введение может быть системным или локальным. Известны различные системы доставки (например, капсулирование в липосомах, микрочастицы, микрокапсулы, капсулы и т.д.), которые можно применять для введения соединения и/или композиции изобретения. Способы введения включают, но не ограничиваются перечисленным, внутрикожный, внутримышечный, внутрибрюшинный, внутривенный, подкожный, интраназальный, эпидуральный, пероральный, сублингвальный, интраназальный, интрацеребральный, интравагинальный, трансдермальный, ректальный, ингаляцией или местный, особенно в уши, нос, глаза или кожу.
В особенно предпочтительных вариантах осуществления соединения и/или композиции изобретения можно доставить посредством систем со стойко поддерживаемым высвобождением, предпочтительно пероральных систем со стойко поддерживаемым высвобождением. В одном варианте осуществления можно применять насос (см. Langer, supra; Sefton, 1987, CRC Crit. Ref Biomed. Eng. 14: 201; Saudek et al., 1989, N. Engl. J. Med. 321: 574).
В другом варианте осуществления можно применять полимерные материалы (см. "Medical Applications of Controlled Release", Langer and Wise (eds.), Wiley, New York (1984); Ranger and Peppas, 1983, J. Macromol. Sci. Rev. Macromol Chem. 23: 61; см. также Levy et al., 1985, Science 228: 190; During et al., 1989, Ann. Neurol. 25: 351; Howard et al., 1989, J. Neurosurg. 71: 105). В предпочтительном варианте осуществления полимерные материалы применяют для пероральной доставки со стойко поддерживаемым высвобождением. Предпочтительные полимеры включают натриевую соль карбоксиметилцеллюлозы, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу и гидроксиэтилцеллюлозу (наиболее предпочтительно, гидроксипропилметилцеллюлозу). В данной области описаны другие предпочтительные простые эфиры целлюлозы (Bamba et al., Int. J. Pharm., 1979, 2, 307).
В другом варианте осуществления для перорального введения со стойко поддерживаемым высвобождением применяют препараты с энтеросолюбильным покрытием. Предпочтительные материалы для покрытия включают полимеры с рН-зависимой растворимостью (т.е. рН-регулируемое высвобождение), полимеры с медленной или рН-зависимой скоростью набухания, растворения или разрушения (т.е. регулируемое по времени высвобождение), полимеры, которые разрушаются ферментами (т.е. регулируемое ферментами высвобождение), и полимеры, которые образуют тонкие слои, которые разрушаются повышением давления (т.е. регулируемое давлением высвобождение).
Еще в одном варианте осуществления для перорального введения со стойко поддерживаемым высвобождением применяют осмотические системы доставки (Verma et al., Drug Dev. Ind. Pharm., 2000, 26: 695-708). В предпочтительном варианте осуществления для систем пероральной доставки со стойко поддерживаемым высвобождением применяют системы осмотической доставки OROS®, продаваемые Alza Corporation of Mountain View, California (см. например, Theeuwes et al., U.S. Pat. No. 3845770; и Theeuwes et al., U.S. Pat. No. 3916899).
Еще в одном варианте осуществления систему со стойко поддерживаемым высвобождением можно поместить вблизи от мишени доставки соединений и/или композиции изобретения, так что требуется только часть системной дозы (см., например, Goodson, in "Medical Applications of Controlled Release", supra, vol. 2, pp. 115-138 (1984)). Можно также применять другие системы со стойко поддерживаемым высвобождением, обсуждаемые в публикации Langer, 1990, Science 249: 1527-1533.
Соединения и/или композиции, содержащие соединение(я) структурных формул (I)-(V) изобретения, могут расщепляться или химически и/или ферментативно. Один или несколько ферментов, присутствующих в желудке, полости кишечника, ткани кишечника, крови, печени, головном мозге или любой другой подходящей ткани млекопитающего могут ферментативно расщеплять соединения и/или композиции изобретения.
КОМПОЗИЦИИ ИЗОБРЕТЕНИЯ
Настоящая композиция содержит терапевтически эффективное количество одного или нескольких соединений изобретения, предпочтительно в очищенной форме, вместе с подходящим количеством фармацевтически приемлемого наполнителя, который обеспечивает форму препарата для подходящего введения пациенту. При введении пациенту соединения изобретения и фармацевтически приемлемые наполнители предпочтительно являются стерильными. Вода является предпочтительным наполнителем, когда соединение изобретения вводят внутривенно. В качестве жидких наполнителей, особенно для инъецируемых растворов, можно также применять физиологические растворы и водные растворы декстрозы и глицерина. Подходящие фармацевтические наполнители включают также эксципиенты, такие как крахмал, глюкоза, лактоза, сахароза, желатин, мальт, рис, мука, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, высушенное сепарированное молоко, глицерин, пропиленгликоль, вода и тому подобное. Настоящие агенты или рН-буферные агенты. Кроме того, можно применять вспомогательные, стабилизирующие, загущающие, смазывающие или красящие агенты.
Фармацевтические композиции, содержащие соединение изобретения, можно изготовить посредством общепринятого способа смешивания, растворения, гранулирования, растирания в порошок для изготовления драже и эмульгирования, капсулирования, захвата или лиофилизации. Фармацевтические композиции можно изготовить общепринятым способом с применением одного или нескольких физиологически приемлемых носителей, разбавителей, эксципиентов или вспомогательных средств, которые облегчают переработку соединений изобретения в препараты, которые можно применять фармацевтически. Подходящая форма препарата зависит от выбранного пути введения.
Настоящие композиции могут быть в форме растворов, суспензий, эмульсии, таблеток, пилюль, гранул и капсул, капсул, содержащих жидкости, порошков, препаратов со стойко поддерживаемым высвобождением, суппозиториев, эмульсий, аэрозолей, спреев, суспензий или любой другой форме, подходящей для применения. В одном варианте осуществления фармацевтически приемлемым наполнителем является капсула (см. например, Grosswald et al., U.S. Pat. No. 5698155). В данной области описаны другие примеры подходящих фармацевтических наполнителей (см. Remington's Pharmaceutical Sciences, Philadelphia College of Pharmacy and Science, 17th Edition, 1985). Предпочтительные композиции изобретения изготавливают для пероральной доставки, особенно для перорального введения со стойко поддерживаемым высвобождением.
Композиции для пероральной доставки могут быть в форме, например, таблеток, лепешек, водных или масляных суспензий, гранул, порошков, эмульсий, капсул, сиропов или эликсиров. Перорально вводимые композиции могут содержать один или несколько необязательных агентов, например подслащивающие агенты, такие как фруктоза, аспартам или сахарин; корригенты, такие как мята, винтергриновое масло или вишневые окрашивающие агенты, и консерванты, для получения фармацевтического приятного на вкус препарата. Кроме того, когда композиции имеют форму таблетки или пилюли, на них можно наносить покрытия для задержки дезинтеграции и абсорбции в желудочно-кишечном тракте, чтобы тем самым обеспечить стойко поддерживаемое действие на протяжении продолжительного периода времени. Селективно проницаемые мембраны, окружающие осмотически активно движущееся соединение, также являются подходящими для перорально вводимых соединений изобретения. В этих последних платформах жидкость из среды, окружающей капсулу, впитывается движущимся соединением, которое набухает с вытеснением агента или композиции агента через отверстия. Эти платформы доставки могут обеспечивать по существу профиль доставки нулевого порядка, в противоположность заостренным профилям препаратов с немедленным высвобождением. Можно также применять материал для задержки времени высвобождения, такой как моностеарат глицерина или стеарат глицерина. Пероральные композиции могут включать стандартные наполнители, такие как маннит, лактоза, крахмал, стеарат магния, натриевая соль сахарина, целлюлоза, карбонат магния и т.д. Такие наполнители предпочтительно являются наполнителями фармацевтической категории.
Для пероральных жидких препаратов, таких как, например, суспензии, эликсиры и растворы, подходящие носители, эксципиенты или разбавители включают воду, физиологический раствор, алкиленгликоли (например, пропиленгликоль), полиалкиленгликоли (например, полиэтиленгликоль), масла, спирты, слабокислотные буферы с рН между 4 и 6 (например, ацетат, цитрат, аскорбат при концентрации от приблизительно мМ до приблизительно 50 мМ) и т.д. Кроме того, можно добавить корригенты, консерванты, красящие агенты, соли желчной кислоты, ацилкамитины и тому подобное.
Можно также предположить применение композиций для введения через другие пути. Для трансбуккального введения композиции могут быть в форме таблеток, лепешек и т.д., изготовленных общепринятым способом. Жидкие лекарственные препараты, подходящие для применения с распылителями и устройствами для жидких спреев и устройствами для аэрозолей EHD, обычно включают соединение изобретения с фармацевтически приемлемым наполнителем. Фармацевтически приемлемым наполнителем предпочтительно является жидкость, такая как спирт, вода, полиэтиленгликоль или перфторуглерод. Можно необязательно добавлять другое вещество для изменения аэрозольных свойств раствора или суспензии соединений изобретения. Это вещество предпочтительно является жидкостью, такой как спирт, гликоль, полигликоль или жирная кислота. Другие способы изготовления жидких лекарственных растворов или суспензий, подходящих для применения в аэрозольных устройствах, являются известными специалистам в данной области (см., например, Biesalski, U.S. Pat. No. 5112598; Biesalski, U.S. Pat. No. 5556611). Соединение изобретения можно также изготовить в составе ректальных или вагинальных композиций, таких как суппозитории или удерживающие клизмы, например суппозитории, содержащие общепринятые основы, такие как какао-масло или другие глицериды. Помимо описанных ранее препаратов соединение изобретения можно также изготовить в виде препарата-депо. Такие долгодействующие препараты можно вводить имплантацией (например, подкожно или внутримышечно) или внутримышечной инъекцией. Так, например, соединение изобретение можно включить в состав препарата с подходящими полимерными или гидрофобными веществами (например, в виде эмульсии в приемлемом масле) или ионообменными смолами или в виде слаборастворимых производных, например в виде слаборастворимой соли.
Когда соединение изобретения является кислотным, его можно включить в любые из вышеописанных препаратов в виде свободной кислоты, фармацевтически приемлемой соли, сольвата или гидрата. Фармацевтически приемлемые соли по существу сохраняют активность свободной кислоты, их можно получить реакцией с основаниями, и они имеют тенденции быть более растворимыми в водных и других протонных растворителях, чем соответствующая форма свободной кислоты.
СПОСОБЫ ПРИМЕНЕНИЯ И ДОЗЫ
Соединение изобретения или его композиции обычно применяют в количестве, эффективном для достижения предполагаемой цели при применении для лечения болезни Альцгеймера, болезни Хантингтона, болезни Пика, атаксии, тяжелой миастении и глаукомы. Соединения формул (I), (II), (III), (IV) или (V) и композиции, содержащие соединение формулы (I), (II), (III), (IV) или (V), вводят или наносят в терапевтически эффективном количестве.
Количество соединения изобретения, которое будет эффективным при лечении конкретного раскрытого в описании заболевания или состояния, будет зависеть от природы нарушения или состояния и может быть определено стандартными клиническими методиками, известными в данной области, как описано ранее. Кроме того, можно необязательно применять анализы in vitro или in vivo для помощи при определении оптимальных диапазонов доз. Количество вводимого соединения изобретения будет конечно зависеть от, среди других факторов, подвергаемого лечению субъекта и массы субъекта, тяжести болезни, способа введения и оценки прописывающего соединение врача. Например, доза может быть доставлена в фармацевтической композиции введением один раз, многократными нанесениями или стойко поддерживаемым высвобождением. В предпочтительном варианте осуществления соединения изобретения доставляют пероральным введением препарата со стойко поддерживаемым высвобождением. В этом варианте осуществления соединения изобретения предпочтительно вводят два раза в день (более предпочтительно, один раз в день). Дозирование можно повторять периодически, дозу можно вводить отдельно или в комбинации с другими лекарственными средствами и дозирование можно продолжать так долго, как требуется для эффективного лечения патологического состояния или нарушения.
Соединения и/или композиции, содержащие соединение(я) структурных формул (I)-(V), для фармакологического лечения болезни Альцгеймера, болезни Хантингтона, болезни Пика, атаксии, тяжелой миастении и глаукомы, можно вводить в диапазоне от 0,1 мг до 500 мг, предпочтительно от 1 мг до 100 мг в день в виде одной или нескольких доз, более предпочтительно 5 мг, 10 мг, 15 мг, 20 мг, 25 мг, 35 мг или 50 мг в день и наиболее предпочтительно 25 мг.
Соединения изобретения предпочтительно испытывают in vitro и in vivo на требуемую терапевтическую или профилактическую активность перед применением для людей. Можно также показать, что соединения изобретения являются эффективными и безопасными с применением систем животных моделей.
Терапевтически эффективная доза соединения изобретения, раскрытого в описании, предпочтительно обеспечит терапевтическую пользу, не вызывая значительную токсичность. Токсичность соединений изобретения можно определить с применением стандартных фармацевтических методик и такую токсичность может легко установить специалист в данной области. Отношение между токсичным и терапевтическим действиями дозы является терапевтическим индексом. Соединение изобретения будет предпочтительно проявлять особенно высокие терапевтические индексы при лечении заболевания и нарушений. Доза соединения изобретения, раскрытого в описании, будет предпочтительно в диапазоне циркулирующих концентраций, которые включают эффективную дозу с низкой токсичностью или без токсичности.
КОМБИНИРОВАННАЯ ТЕРАПИЯ
В некоторых вариантах осуществления настоящего изобретения соединения изобретения можно применять в комбинированной терапии по меньшей мере с одним другим терапевтическим агентом. Соединение изобретения и терапевтический агент могут действовать аддитивно или, более предпочтительно, синергически. В предпочтительном варианте осуществления композицию, содержащую соединение изобретения, вводят одновременно с введением другого терапевтического агента, который может быть частью той же композиции. В другом варианте осуществления композицию, содержащую соединение изобретения, вводят до или после введения другого терапевтического агента.
ПРИМЕРЫ
Изобретение далее описывается нижеследующими примерами, в которых подробно описывается получение соединений и композиций изобретения и анализы для применения соединений и композиций изобретения. Специалисту в данной области должно быть очевидно, что на практике могут быть осуществлены многие модификации, как веществ, так и способов, не выходящие за пределы объема изобретения.
Ниже в примерах следующие аббревиатуры имеют следующие значения. Если аббревиатура не определена, она имеет ее обычно принятое значение.
AcOH = уксусная кислота
Aтм = атмосфера
Cbz = карбобензилокси
DCМ = дихлорметан
DMAP = 4-N,N-диметиламинопиридин
ДМФА = N,N-диметилформамид
ДМСO = диметилсульфоксид
г = грамм
час = часы
л = литр
ЖХ/МС = жидкостная хроматография/масс-спектроскопия
M = молярный
мл = миллилитр
ммоль = миллимоли
нM = наномолярный
мкM = микромолярный
ТBS = трет-бутилдиметилсилил
ТEA = триэтиламин
ТГФ = тетрагидрофуран
ТFA = трифторуксусная кислота
Пример 1
Синтез 5,6-диметокси-2-(пиперидин-4-илметил)-2,3-дигидро-1H-инден-1-она 12
(Схема 4)
К перемешиваемой суспензии палладия, 10 мас.% на активированном угле (4 г), в метаноле (25 мл) при комнатной температуре в атмосфере азота добавляли раствор инданона 11 (0,01 моль, 4,1 г) в метаноле (25 мл) с последующим добавлением формиата аммония (0,07 моль, 4,40 г). Образовавшуюся смесь кипятили с обратным холодильником в течение 3 час. Мониторинг развития реакции проводили ТСХ. Реакционную смесь охлаждали до комнатной температуры и фильтровали через слой Celite®. Фильтрат концентрировали на роторном испарителе и остаток разбавляли DCM (150 мл). Раствор в DCM промывали водой, сушили над безводным сульфатом натрия (Na2SO4) и выпаривали растворитель. Остаток растирали с гексаном с получением требуемого инданона 12 в виде белого твердого вещества с выходом 97% (2,80 г). 1H ЯМР (400 MГц, CDCl3): δ 1,16-0,92 (3H, м); 1,58-1,40 (3H, м); 1,70-1,64 (1Н, м); 2,51-2,39 (4H, м); 2,77 (1Н, ушир. с); 2,92-2,87 (2H, м); 3,05-2,09 (1Н, м); 3,67 (3H, с); 3,74 (3H, с); 6,66 (1Н, с); 6,92 (1Н, с). МС (EСI): m/z = 290,20 (M+H+).
Пример 2
Этил-3-((4-((5,6-диметокси-1-оксо-2,3-дигидро-1H-инден-2-ил)метил)пиперидин-1-ил)метил)бензоат 14a (Схема 4)
К перемешиваемому раствору инданона 12 (0,001 моль) и DIEA (0,002 моль) в безводном ацетонитриле (10 мл) добавляли раствор галогенида 13а (0,0012 моль) в безводном ацетонитриле (2 мл) при комнатной температуре. Образовавшуюся смесь нагревали при 55-60°С в течение 12 час. Мониторинг развития реакции проводили ТСХ. Реакционную смесь концентрировали на роторном испарителе и остаток разбавляли этилацетатом (50 мл). Образовавшийся раствор в этилацетате промывали водой, сушили над безводным сульфатом натрия (Na2SO4) и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле с применением градиента от 0 до 100% этилацетата и гексана, получая при этом указанный в заголовке инданон 14а с выходом 74% (0,33 г). 1H ЯМР (400 MГц, CDCl3): δ 1,33-1,28 (3H, м); 1,37 (3H, т, J=7,2 Гц); 1,51-1,42 (1Н, м); 1,73-1,62 (2H, м); 1,99-1,85 (3H, м); 2,69-2,65 (2H, м); 2,88-2,83 (2H, ушир. т); 3,24-3,17 (1Н, м); 3,52 (2H, с); 3,88 (3H, с); 3,93 (3H, с); 4,35 (2H, кв, J=7,2 Гц); 6,83 (1Н, с); 7,14 (1Н, с); 7,36 (1Н, тд, J=7,6, 2,4 Гц); 7,52 (1Н, ушир. д); 7,91 (1Н, дд, J=7,6, 1,2 Гц); 7,94 (1H, м). МС (ESI): m/z = 452,30 (M+H+).
Пример 3
Изопропил-3-((4-((5,6-диметокси-1-оксо-2,3-дигидро-1H-инден-2-ил)метил)пиперидин-1-ил)метил)бензоат 14b синтезировали реакцией соединений 12 и 13b согласно методике, описанной для 14а в примере 2 (схема 4). Инданон 14b выделяли в виде бесцветной густой жидкости с выходом 81% (0,37 г). 1H ЯМР (400 MГц, CDCl3): δ 1,33-1,28 (3H, м); 1,35 (6H, д, J=6,4 Гц); 1,51-1,40 (1Н, м); 1,72-1,62 (2H, м); 2,00-1,85 (3H, м); 2,68-2,65 (2H, м); 2,88-2,83 (2H, ушир. т); 3,23-3,17 (1Н, м); 3,51 (2H, с); 3,87 (3H, с); 3,93 (3H, с); 5,22 (1Н, квинтет, J=6,0 Гц); 6,83 (1Н, с); 7,14 (1Н, с); 7,35 (1Н, тд, J=7,6, 2,4 Гц); 7,51 (1Н, ушир. д); 7,89 (1Н, дд, J=7,6, 1,2 Гц); 7,92 (1Н, ушир. с). МС (ESI): m/z = 466,30 (M+H+).
Пример 4
Этил-4-((4-((5,6-диметокси-1-оксо-2,3-дигидро-1H-инден-2-ил)метил)пиперидин-1-ил)метил)бензоат 14c синтезировали реакцией соединений 12 и 13с согласно методике, описанной для 14а в примере 2 (схема 4). Инданон 14с выделяли в виде бесцветной густой жидкости с выходом 95% (0,42 г). 1H ЯМР (400 MГц, CDCl3): δ 1,35-1,27 (3H, м); 1,38 (3H, т, J=7,2 Гц); 1,54-1,42 (1Н, м); 1,74-1,64 (2H, м); 2,01-1,87 (3H, м); 2,72-2,66 (2H, м); 2,88-2,83 (2H, ушир. т); 3,26-3,19 (1Н, м); 3,53 (2H, с); 3,89 (3H, с); 3,95 (3H, с); 4,36 (2H, кв, J=7,2 Гц); 6,84 (1Н, с); 7,16 (1Н, с); 7,38 (2H, д, J=8,4 Гц); 7,98 (2H, д, J=8,4 Гц). МС (ESI): m/z = 452,30 (M+H+). МС (ESI): m/z = 452,20 (M+H+).
Пример 5
Изопропил-4-((4-((5,6-диметокси-1-оксо-2,3-дигидро-1H-инден-2-ил)метил)пиперидин-1-ил)метил)бензоат 14d синтезировали реакцией соединений 12 и 13d согласно методике, описанной для 14а в примере 2 (схема 4). Инданон 14d выделяли в виде бесцветной густой жидкости с выходом 73% (0,34 г). 1H ЯМР (400 MГц, CDCl3): δ 1,33-1,26 (3H, м); 1,35 (6H, д, J=6,4 Гц); 1,55-1,42 (1Н, м); 1,74-1,64 (2H, м); 2,00-1,87 (3H, м); 2,72-2,66 (2H, м); 2,88-2,83 (2H, ушир. т); 3,25-3,19 (1Н, м); 3,53 (2H, с); 3,89 (3H, с); 3,95 (3H, с); 5,24 (1Н, квинтет, J=6,4 Гц); 6,84 (1Н, с); 7,16 (1Н, с); 7,38 (2H, д, J=8,0 Гц); 7,97 (2H, д, J=8,0 Гц). МС (ESI): m/z = 466,30 (M+H+). МС (ESI): m/z = 466,30 (M+H+).
Пример 6
Этил-4-(3-((4-((5,6-диметокси-1-оксо-2,3-дигидро-1H-инден-2-ил)метил)пиперидин-1-ил)метил)бензамидо)бутаноат 14e синтезировали реакцией соединений 12 и 13e согласно методике, описанной для 14а в примере 2 (схема 4). Инданон 14е выделяли в виде бесцветной густой жидкости с выходом 80% (0,43 г). 1H ЯМР (400 MГц, CDCl3): δ 1,23 (3H, т, J=7,2 Гц); 1,36-1,26 (3H, м); 1,55-1,42 (1Н, м); 1,74-1,63 (2H, м); 1,98-1,86 (5H, м); 2,43 (2H, т, J=6,8 Гц); 2,71-2,65 (2H, м); 2,87-2,83 (2H, ушир. т); 3,25-3,19 (1Н, м); 3,51-3,47 (2H, м); 3,52 (2H, с); 3,89 (3H, с); 3,94 (3H, с); 4,11 (2H, кв, J=7,2 Гц); 6,56 (1Н, ушир. триплет), 6,84 (1Н, с); 7,15 (1Н, с); 7,37 (2H, д, J=8,4 Гц); 7,72 (2H, д, J=8,4 Гц). МС (ESI): m/z = 537,40 (M+H+).
Пример 7
Этил-3-(4-((4-((5,6-диметокси-1-оксо-2,3-дигидро-1H-инден-2-ил)метил)пиперидин-1-ил)метил)бензамидо)пропаноат 14f синтезировали реакцией соединений 12 и 13f согласно методике, описанной для 14а в примере 2 (схема 4). Инданон 14f выделяли в виде бесцветной густой жидкости с выходом 82% (0,42 г). 1H ЯМР (400 MГц, CDCl3): δ 1,27 (3H, т, J=7,2 Гц); 1,40-1,31 (3H, м); 1,55-1,42 (1Н, м); 1,74-1,63 (2H, м); 2,00-1,87 (3H, м); 2,71-2,63 (4H, м); 2,89-2,84 (2H, ушир. т); 3,26-3,19 (1Н, м); 3,52 (2H, с); 3,89 (3H, с); 3,95 (3H, с); 4,17 (2H, кв, J=7,2 Гц); 6,84 (1Н, с); 7,15 (1Н, с); 7,36 (2H, т, J=7,6 Гц); 7,46 (1Н, д, J=7,6 Гц); 7,63 (1Н, д, J=7,6 Гц); 7,70 (1Н, ушир. с). МС (ESI): m/z = 523,40 (M+H+).
Пример 8
Этил-4-(4-((4-((5,6-диметокси-1-оксо-2,3-дигидро-1H-инден-2-ил)метил)пиперидин-1-ил)метил)бензамидо)бутаноат 14g синтезировали реакцией соединений 12 и 13g согласно методике, описанной для 14а в примере 2 (схема 4). Инданон 14g выделяли в виде бесцветной густой жидкости с выходом 65% (0,34 г). 1H ЯМР (400 MГц, CDCl3): δ 1,23 (3H, т, J=7,2 Гц); 1,40-1,27 (3H, м); 1,55-1,42 (1Н, м); 1,74-1,64 (2H, м); 1,92-1,83 (3H, м); 1,96 (2H, т, J=6,8 Гц), 2,43 (2H, т, J=7,2 Гц); 2,71-2,67 (2H, м); 2,89-2,84 (2H, ушир. т); 3,26-3,19 (1Н, м); 3,51 (2H, кв, J=6,8 Гц); 3,53 (2H, с); 3,90 (3H, с); 3,95 (3H, с); 4,12 (2H, кв, J=6,8 Гц); 6,53 (1Н, ушир. с); 6,85 (1Н, с); 7,16 (1Н, с); 7,38 (2H, д, J=8,4 Гц); 7,72 (2H, д, J=8,4 Гц). МС (ESI): m/z = 537,40 (M+H+).
Пример 9
Этил-2-(3-((4-((5,6-диметокси-1-оксо-2,3-дигидро-1H-инден-2-ил)метил)пиперидин-1-ил)метил)фенокси)ацетат 14h синтезировали реакцией соединений 12 и 13h согласно методике, описанной для 14а в примере 2 (схема 4). Инданон 14h выделяли в виде бесцветной густой жидкости с выходом 71% (0,34 г). 1H ЯМР (400 MГц, CDCl3): δ 1,21 (3H, т, J=7,2 Гц); 1,40-1,25 (4H, м); 1,66-1,55 (2H, м); 1,90-1,79 (3H, м); 2,63-2,59 (2H, м); 2,86-2,77 (2H, м); 3,19-3,14 (1Н, м); 3,38 (2H, с); 3,81 (3H, с); 3,87 (3H, с); 4,18 (2H, кв, J=7,2 Гц); 4,53 (2H, с); 6,71-6,68 (1Н, м); 6,78 (с, 1Н); 6,86-6,83 (2H, м); 7,07 (1Н, с); 7,13 (1Н, т, J=8,4 Гц). МС (ESI): m/z = 482,30 (M+H+).
Пример 10
Этил-4-(4-((4-((5,6-диметокси-1-оксо-2,3-дигидро-1H-инден-2-ил)метил)пиперидин-1-ил)метил)фенокси)бутаноат 14i синтезировали реакцией соединений 12 и 13i согласно методике, описанной для 14а в примере 2 (схема 4). Инданон 14i выделяли в виде бесцветной густой жидкости с выходом 32% (0,16 г). 1H ЯМР (400 MГц, CDCl3): δ 1,25 (3H, т, J=7,2 Гц); 1,38-1,27 (3H, м); 1,55-1,40 (1Н, м); 1,73-1,63 (2H, м); 1,95-1,86 (3H, м); 2,09 (2H, квинтет, J=7,6 Гц); 2,50 (2H, т, J=7,6 Гц); 2,71-2,65 (2H, м); 2,89-2,85 (2H, м); 3,25-3,18 (1Н, м); 3,42 (2H, с); 3,89 (3H, с); 3,95 (3H, с); 3,98 (2H, т, J=6,0 Гц); 4,13 (2H, кв, J=7,2 Гц); 6,82 (2H, д, J=8,4 Гц); 6,84 (1Н, с); 7,15 (1Н, с); 7,20 (2H, д, J=8,4 Гц). МС (ESI): m/z = 510,30 (M+H+).
Пример 11
Этил-3-(2-(3-((4-((5,6-диметокси-1-оксо-2,3-дигидро-1H-инден-2-ил)метил)пиперидин-1-ил)метил)фенокси)ацетамидо)пропаноат 14j синтезировали реакцией соединений 12 и 13j согласно методике, описанной для 14а в примере 2 (схема 4). Инданон 14j выделяли в виде бесцветной густой жидкости с выходом 40% (0,22 г). 1H ЯМР (400 MГц, CDCl3): δ 1,23 (3H, т, J=7,2 Гц); 1,36-1,26 (3H, м); 1,55-1,42 (1Н, м); 1,74-1,63 (2H, м); 1,98-1,86 (3H, м); 2,43 (2H, т, J=6,8 Гц); 2,71-2,65 (2H, м); 2,87-2,83 (2H, ушир. т); 3,25-3,19 (1Н, м); 3,51-3,47 (2H, м); 3,51 (2H, кв, J=6,8 Гц); 3,89 (3H, с); 3,94 (3H, с); 4,11 (2H, кв, J=7,2 Гц); 4,43 (2H, с); 6,71-6,68 (1Н, м); 6,78 (1Н, с); 6,86-6,83 (2H, м); 7,07 (1Н, с); 7,13 (1Н, т, J=8,4 Гц). МС (ESI): m/z = 553,40 (M+H+).
Пример 12
2-((1-Бензилпиперидин-4-ил)метил)-6-гидрокси-5-метокси-2,3-дигидро-1H-инден-1-он 15 (схема 5)
Раствор инданона 11 (0,005 моль, 1,90 г) и этантиолата натрия (0,025 моль, 2,10 г) в безводном ДМФА (20 мл) нагревали при 60°С в течение 5 час. Мониторинг развития реакции проводили ТСХ. Реакционную смесь охлаждали до комнатной температуры и выливали в охлажденную льдом воду (100 мл). Образовавшуюся смесь экстрагировали этилацетатом (50 мл) и водный слой нейтрализовывали 0,5 н. HCl (до рН приблизительно 7). Затем осадок отделяли фильтрованием, промывали водой (15 мл × 3) и сушили в вакууме, получая при этом указанный в заголовке инданон 15 в виде белого твердого вещества с выходом 43% (0,80 г). 1H ЯМР (400 MГц, CDCl3): δ 1,40-1,31 (3H, м); 1,55-1,42 (1Н, м); 1,74-1,63 (2H, м); 2,00-1,86 (3H, м); 2,70-2,63 (2H, м); 2,92-2,87 (2H, м); 3,22-3,16 (1Н, м); 3,50 (2H, с); 3,91 (3H, с); 4,80 (1Н, ушир. с); 6,90 (1Н, с); 7,17 (1Н, с); 7,25 (1Н, м); 7,31-7,30 (4H, м). МС (ESI): m/z = 366,20 (M+H+).
Пример 13
трет-Бутил-2-(2-((1-бензилпиперидин-4-ил)метил)-6-метокси-3-оксо-2,3-дигидро-1H-инден-5-илокси)aцeтaт 16a (схема 5)
К перемешиваемому раствору инданона 15 (0,001 моль) в ацетоне (20 мл) добавляли безводный карбонат калия (0,002 моль, 0,27 г) с последующим добавлением трет-бутилбромацетата 17а (0,0015 моль, 0,29 г). Образовавшуюся смесь кипятили с обратным холодильником в течение 5-8 час. Мониторинг развития реакции проводили ТСХ. Реакционную смесь охлаждали до комнатной температуры и фильтровали. Осадок промывали ацетоном (15 мл × 2) и объединенный фильтрат концентрировали на роторном испарителе. Остаток разбавляли этилацетатом (50 мл), промывали водой (25 мл × 2), сушили над безводным сульфатом натрия (Na2SO4) и растворитель выпаривали. Сырой продукт очищали колоночной хроматографией на силикагеле с применением 0-100% градиента этилацетата и гексана, получая при этом чистый требуемый инданон 16а в виде бесцветной густой жидкости с выходом 81% (0,38 г). 1H ЯМР (400 MГц, CDCl3): δ 1,37-1,19 (3H, м); 1,45 (9H, с); 1,70-1,60 (2H, м); 1,95-1,84 (3H, м); 2,67-2,59 (3H, м); 2,87-2,84 (2H, м); 3,17-3,07 (1Н, м); 3,46 (2H, с); 3,86 (3H, с); 4,62 (2H, с); 6,68 (1Н, м); 7,15-7,14 (1Н, м); 7,24-7,19 (1Н, м); 7,28-7,24 (4H, м). МС (ESI): m/z = 480,30 (M+H+). МС (ESI): m/z = 480,30 (M+H+).
Пример 14
Этил-4-(2-((1-бензилпиперидин-4-ил)метил)-6-метокси-3-оксо-2,3-дигидро-1H-инден-5-илокси)бутаноат 16b синтезировали реакцией соединения 15 и этил-4-бромбутирата 17b согласно методике, описанной для 16а в примере 13 (схема 5). Инданон 16b выделяли в виде белого твердого вещества с выходом 95% (0,44 г). 1H ЯМР (400 MГц, CDCl3): δ 1,25 (3H, т, J =7,2 Гц); 1,37-1,28 (3H, м); 1,55-1,42 (1Н, м); 1,80-1,60 (2H, м); 1,96-1,92 (3H, м); 2,19 (2H, квинтет, J=6,8 Гц); 2,54 (2H, т, J=7,2 Гц); 2,67-2,64 (2H, м); 2,91-2,86 (2H, м); 3,23-3,17 (1Н, м); 3,49 (2H, с); 3,87 (3H, с); 4,17-4,11 (4H, м); 6,84 (1Н, с); 7,15 (1Н, с); 7,25-7,20 (1Н, м); 7,31-7,30 (4H, м). МС (ESI): m/z = 480,30 (M+H+). МС (ESI): m/z = 480,30 (M+H+).
Инданон 16b получали также алкилированием производного инданона 20 N-бензилзамещенным пиперидинхлоридом 21 с применением LDA (схема 6). К перемешиваемому раствору LDA (0,005 моль) в безводном ТГФ (20 мл) при -78°С в атмосфере азота по каплям добавляли раствор галогенида 21 (0,005 моль, 1,10 г) в ТГФ (5 мл). Образовавшуюся смесь перемешивали при -78°С в течение 2 час и затем медленно нагревали до 0°С. Реакционную смесь гасили насыщенным раствором хлорида аммония (50 мл). Образовавшуюся смесь экстрагировали этилацетатом, промывали водой, сушили над сульфатом натрия и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле с применением 0-100% градиента этилацетата и гексана, получая при этом чистый инданон 16b с выходом 21%. 1Н ЯМР и масс-спектральные данные инданона 16b, синтезированного этим способом (схема 6), идентичны данным инданона 16b, полученного с применением способа, иллюстрируемого на схеме 5.
Пример 15
Этил-3-(2-(2-((1-бензилпиперидин-4-ил)метил)-6-метокси-3-оксо-2,3-дигидро-1H-инден-5-илокси)ацетамидо)пропаноат 16c синтезировали реакцией соединения 15 и этил-4-бромбутирата 31 согласно методике, описанной для 16a в примере 13 (схема 5). Инданон 16с выделяли в виде бесцветной густой жидкости с выходом 65% (0,33 г). МС (ESI): m/z = 523,30 (M+Η+).
Пример 16
Этил-4-(6-метокси-3-оксо-2,3-дигидро-1H-инден-5-илокси)бутаноат 20 (схема 6)
К перемешиваемому раствору 6-гидрокси-5-метокси-2,3-дигидро-1Н-инден-1-она 18а (0,01 моль, 1,78 г) в ацетоне (50 мл) добавляли карбонат калия (0,02 моль, 2,80 г). Образовавшуюся смесь кипятили с обратным холодильником в течение 2 час. После охлаждения до комнатной температуры добавляли этил-4-бромбутират. Реакционную смесь перемешивали при 60°С в течение 12 час. Мониторинг развития реакции проводили ТСХ. Реакционную смесь фильтровали и осадок промывали ацетоном (15 мл × 2). Объединенный фильтрат концентрировали на роторном испарителе и остаток разбавляли этилацетатом. Раствор в этилацетате последовательно промывали водой, насыщенным бикарбонатом натрия (NaHCO3), водой и сушили над сульфатом магния (MgSO4). После выпаривания растворителя сырой продукт очищали пропусканием через короткую колонку силикагеля с применением 0-50% градиента этилацетата и гексана в качестве элюента, получая при этом чистый инданон 20 в виде бесцветной густой жидкости с выходом 30% (0,87 г). 1H ЯМР (400 MГц, CDCl3): δ 1,21 (3H, ушир. т); 2,16 (2H, м); 2,44 (2H, м); 2,59 (2H, м); 2,96 (2H, м); 3,93 (3H, с); 4,04 (2H, ушир. т); 4,10 (2H, ушир. кв); 6,84 (1Н, м); 7,43 (1Н, с); 7,12 (1Н, с). МС (ESI): m/z = 293,20 (M+H+).
Пример 17
Этил-3-(хлорметил)бензоат 13a (схема 7)
К перемешиваемому раствору 3-(хлорметил)бензойной кислоты 23 (0,01 моль, 1,70 г) в безводном этаноле (20 мл) добавляли несколько капель (приблизительно 0,2 мл) концентрированной серной кислоты и образовавшуюся смесь кипятили с обратным холодильником в течение 12 час. Реакционную смесь концентрировали на роторном испарителе и остаток разбавляли этилацетатом (50 мл). Раствор в этилацетате промывали последовательно водой, насыщенным бикарбонатом натрия (NaHCO3), водой и сушили над безводным сульфатом магния (MgSO4). Выпаривание растворителя давало требуемый сложный эфир 13а в виде бесцветного масла с выходом 90% (1,78 г). Сложный эфир 13а применяли на следующей стадии без дополнительной очистки. 1H ЯМР (400 MГц, CDCl3): δ 1,30 (3H, т, J=7,2 Гц); 4,29 (2H, т, J=7,2 Гц); 4,83 (2H, с); 7,53 (1Н, м); 7,69 (1Н, ушир. д); 7,90 (1Н, ушир. д); 8,01 (1Н, с).
Пример 18
Изопропил-3-(хлорметил)бензоат 13b получали реакцией 3-(хлорметил)бензойной кислоты 23 с изопропанолом согласно методике, описанной для соединения 13а в примере 17 (схема 7). Бензоат 13b выделяли в виде бесцветного масла с выходом 87% (1,85 г). 1H ЯМР (400 MГц, CDCl3): δ 1,37 (6H, м); 4,62 (2H, с); 5,27 (2H, м); 7,43 (1Н, м); 7,57 (1Н, ушир. д); 7,98 (1Н, ушир. д); 8,04 (1Н, с).
Пример 19
Этил-4-(хлорметил)бензоат 13с получали реакцией 4-(хлорметил)бензойной кислоты 24 с этанолом согласно методике, описанной для соединения 13а в примере 17 (схема 7). Бензоат 13с выделяли в виде бесцветного масла с выходом 91% (1,80 г). 1H ЯМР (400 MГц, CDCl3): δ 1,37 (3H, т, J=7,2 Гц); 4,46 (2H, т, J=7,2 Гц); 4,58 (2H, с); 7,42 (1Н, м); 7,44 (1Н, ушир. д); 8,00 (1Н, ушир. д); 8,02 (1Н, с).
Пример 20
Изопропил-4-(хлорметил)бензоат 13d получали реакцией 4-(хлорметил)бензойной кислоты 24 с изопропанолом согласно методике, описанной для соединения 13а в примере 16 (схема 7). Бензоат 13d выделяли в виде бесцветного масла с выходом 89% (1,90 г). 1H ЯМР (400 MГц, CDCl3): δ 1,35 (6H, м); 4,59 (2H, с); 5,25 (2H, м); 7,42 (1Н, м); 7,44 (1Н, ушир. с); 8,00 (1Н, ушир. с); 8,02 (1Н, с).
Пример 21
Этил-4-(3-(хлорметил)бензамидо)бутаноат 13e (cхема 8)
К перемешиваемому раствору 3-(хлорметил)бензойной кислоты 24 (0,01 моль) и N-гидроксисукцинимида (0,012 моль) в ацетонитриле (25 мл) при комнатной температуре добавляли N,N-дициклогексилкарбодиимид (0,012 моль). Образовавшуюся смесь перемешивали при комнатной температуре в течение 3 час. Реакционную смесь фильтровали и осадок промывали ацетонитрилом (15 мл × 2). К объединенному фильтрату при комнатной температуре добавляли гидрохлорид этил-4-аминобутирата 26 (0,01 моль) с последующим добавлением раствора бикарбоната натрия (NaHCO3) в воде (15 мл). Образовавшуюся смесь перемешивали в течение 12 час. Реакционную смесь концентрировали на роторном испарителе и остаток разбавляли этилацетатом (50 мл). Смесь промывали водой (25 мл × 2), сушили над сульфатом натрия (Na2SO4) и растворитель выпаривали. Остаток очищали пропусканием через короткую колонку силикагеля с применением 0-50% этилацетата в гексане в качестве элюента, получая при этом требуемое соединение 13е в виде бесцветного масла с выходом 79% (2,24 г). 1H ЯМР (400 MГц, CDCl3): δ 1,24 (3H, ушир. т); 1,96 (2H, м); 2,44 (2H, м); 3,51 (2H, м); 4,13 (2H, ушир. кв); 4,60 (2H, с); 6,65 (1Н, ушир. с); 7,45 (2H, м); 7,77 (2H, м); МС (ESI): m/z = 284,0 (M+H+).
Пример 22
Этил-3-(4-(хлорметил)бензамидо)пропаноат 13f получали сочетанием 4-(хлорметил)бензойной кислоты 24 с этил-3-аминопропионатом 25 согласно методике, описанной для соединения 13е в примере 21 (схема 8). Соединение 13f выделяли в виде бесцветного масла с выходом 84% (2,26 г). 1H ЯМР (400 MГц, CDCl3): δ 1,26 (3H, т, J=7,2 Гц); 2,64 (2H, м); 3,72 (2H, м); 4,14 (2H, кв, J=7,2 Гц); 4,61 (2H, с); 6,89 (1Н, ушир. с); 7,53 (1Н, с); 7,67 (1Н, с); 7,70 (1Н, с); 7,80 (1Н, с). МС (ESI): m/z = 270,00 (M+H+).
Пример 23
Этил-4-(4-(хлорметил)бензамидо)бутаноат 13g получали сочетанием 4-(хлорметил)бензойной кислоты 24 с этил-4-аминобутиратом 26 согласно методике, описанной для соединения 13е в примере 21 (схема 8). Соединение 13g выделяли в виде бесцветного масла с выходом 89% (2,52 г). 1H ЯМР (400 MГц, CDCl3): δ 1,24 (3H, т, J=6,8 Гц); 1,96 (2H, квинт, J=7,2 Гц); 2,44 (2H, т, J=7,2 Гц); 3,52 (2H, т, J=7,2 Гц); 4,10 (2H, кв, J=6,8 Гц); 4,60 (2H, с); 6,62 (1Н, ушир. с); 7,44 (1Н, с); 7,46 (1Н, с); 7,76 (1Н, с); 7,78 (1Н, с). МС (ESI): m/z = 284,00 (M+H+).
Пример 24
Этил-2-(3-(гидроксиметил)фенокси)aцeтaт 29a (cхема 9)
К перемешиваемой суспензии карбоната калия (0,02 моль) в ацетоне (25 мл) добавляли 3-(гидроксиметил)фенол 27а (0,01 моль) и этилбромацетат 28а (0,012) и образовавшуюся смесь кипятили с обратным холодильником в течение 12 час. Реакционную смесь охлаждали до комнатной температуры и фильтровали. Фильтрат концентрировали на роторном испарителе и остаток разбавляли этилацетатом (50 мл). Раствор в этилацетате промывали последовательно водой, насыщенным бикарбонатом натрия (NaHCO3), водой и затем сушили над безводным сульфатом натрия (Na2SO4). После выпаривания растворителя сырой продукт пропускали через короткую колонку силикагеля с применением 0-50% этилацетата в гексане в качестве элюента, получая при этом чистый сложный эфир 29а в виде бесцветного масла с выходом 97% (2,03 г). 1H ЯМР (400 MГц, CDCl3): δ 1,23 (3H, т, J=6,8 Гц); 3,36 (1Н, ушир. с); 4,19 (2H, кв, J=6,8 Гц); 4,44 (2H, с); 6,74 (1Н, ушир. д); 6,87 (1Н, м); 7,18 (1Н, т, J=8 Гц). МС (ESI): m/z = 233,00 (M+Na+).
Пример 25
Этил-4-(4-(гидроксиметил)фенокси)бутаноат 29b получали реакцией 4-(гидроксиметил)фенола 27b с этил-4-бромбутиратом 28b согласно методике, описанной для соединения 29а в примере 24 (схема 9). Сложный эфир 29b выделяли в виде бесцветного масла с выходом 96% (2,26 г). 1H ЯМР (400 MГц, CDCl3): δ 1,24 (3H, т, J=7,2 Гц); 2,07 (2H, м); 2,15 (2H, т, J=7,2 Гц); 3,97 (2H, т, J=6,4 Гц); 4,10 (2H, кв, J=7,2 Гц); 4,59 (2H, с); 6,88 (1Н, с); 6,87 (1Н, с); 7,24-7,27 (2H, м).
Пример 26
Этил-2-(3-(хлорметил)фенокси)aцeтaт 13h (cхема 9)
Тионилхлорид (0,01 моль) добавляли к охлажденному льдом сложному эфиру 29а (0,005 моль) и образовавшуюся смесь перемешивали при комнатной температуре в течение 5 час. Мониторинг развития реакции проводили ТСХ. Реакционную смесь выливали в охлажденную льдом воду (50 мл). Смесь экстрагировали этилацетатом (25 мл × 2), промывали водой (25 мл), сушили над безводным сульфатом магния (MgSO4) и растворитель выпаривали. Остаток пропускали через короткую колонку силикагеля с применением 0-50% этилацетата в гексане в качестве элюента, получая при этом чистый хлорид 13h в виде бесцветного масла с выходом 86% (0,98 г). 1H ЯМР (400 MГц, CDCl3): δ 1,26 (3H, т, J=6,8 Гц); 4,27 (2H, кв, J=6,8 Гц); 4,28 (2H, с); 6,85 (1Н, ушир. д); 6,99 (1Н, м); 7,26 (1Н, м). МС (ESI): m/z = 253,10 (M+H+).
Пример 27
Этил-4-(4-(хлорметил)фенокси)бутаноат 13i получали из 29b согласно методике, описанной для соединения 13h в примере 26 (схема 9). Указанный в заголовке хлорид 13i выделяли в виде бесцветного масла с выходом 96% (1,25 г). 1H ЯМР (400 MГц, CDCl3): δ 1,24 (3H, т, J=7,2 Гц); 2,06 (2H, м); 2,18 (2H, т, J=7,2 Гц); 4,00 (2H, т, J=6,4 Гц); 4,14 (2H, кв, J=7,2 Гц); 4,54 (2H, с); 6,83 (1Н, с); 6,86 (1Н, с); 7,27 (1Н, м); 7,29 (1Н, с). МС (ESI): m/z = 258,10 (M+H+).
Пример 28
Этил-3-(2-хлорацетамидо)пропаноат 31 (cхема 10)
К перемешиваемому раствору гидрохлорида этил-3-аминопропионата 25 (0,01 моль) и триэтиламина (0,02 моль) в DCM (25 мл) при температуре ледяной бани добавляли по каплям раствор хлорацетилхлорида 30 (0,01 моль) в DCM (5 мл). Образовавшуюся смесь перемешивали при температуре ледяной бани в течение 1 час и при комнатной температуре в течение 4 час. Реакционную смесь выливали в смесь лед-холодная вода (50 мл). Смесь экстрагировали DCM (25 мл × 2), промывали водой (25 мл), сушили над сульфатом натрия (Na2SO4) и растворитель выпаривали. Остаток фильтровали через короткую колонку силикагеля с применением 0-50% этилацетата в гексане в качестве элюента, получая при этом чистый хлорамид 31 в виде светло-желтого масла с выходом 99% (1,91 г). 1H ЯМР (400 MГц, CDCl3): δ 1,16 (3H, т, J=6,4 Гц); 2,45 (2H, т, J=6,8 Гц); 3,30 (2H, кв, J=6,8 Гц); 4,01 (2H, с); 4,05 (2H, кв, J=6,4 Гц); 8,27 (1Н ушир. с).
Пример 29
Этил-3-(2-(3-(гидроксиметил)фенокси)ацетамидо)пропаноат 32 (cхема 10)
К перемешиваемой суспензии карбоната калия (0,02 моль) в ацетоне (25 мл) добавляли 3-(гидроксиметил)фенол 27а (0,01 моль) и хлорамид 31 (0,012) и образовавшуюся смесь кипятили с обратным холодильником в течение 12 час. Реакционную смесь охлаждали до комнатной температуры и фильтровали. Фильтрат концентрировали на роторном испарителе и остаток разбавляли этилацетатом (50 мл). Раствор в этилацетате промывали последовательно водой, насыщенным бикарбонатом натрия (NaHCO3), водой и затем сушили над безводным сульфатом натрия (Na2SO4). После выпаривания растворителя сырой продукт пропускали через короткую колонку силикагеля с применением 0-100% этилацетата в гексане в качестве элюента, получая при этом чистый сложный эфир 32 в виде бесцветного масла с выходом 95% (2,67 г). 1H ЯМР (400 MГц, CDCl3): δ 1,22 (3H, м); 2,52 (2H,ушир. т); 3,53 (2H, ушир. т); 3,95 (2H, ушир. с); 4,08 (2H, м); 4,52 (2H, с); 6,67-6,92 (2H, м); 6,86 (1Н, с); 7,10 (1Н, м); 7,28 (1Н, ушир. с). МС (ESI): m/z = 304,10 (M+Na+).
Пример 30
Этил-3-(2-(3-(хлорметил)фенокси)ацетамидо)пропаноат 13j (cхема 10)
Тионилхлорид (0,01 моль) добавляли к охлажденному льдом сложному эфиру 32 (0,005 моль) и образовавшуюся смесь перемешивали при комнатной температуре в течение 5 час. Мониторинг развития реакции проводили ТСХ. Реакционную смесь выливали в охлажденную льдом воду (50 мл). Смесь экстрагировали этилацетатом (25 мл × 2), промывали водой (25 мл), сушили над безводным сульфатом магния (MgSO4) и растворитель выпаривали. Остаток пропускали через короткую колонку силикагеля с применением 0-100% этилацетата в гексане в качестве элюента, получая при этом чистый хлорид 13j в виде бесцветного масла с выходом 47% (0,70 г). 1H ЯМР (400 MГц, CDCl3): δ 1,25 (3H, т, J=6,8 Гц); 2,56 (2H, т, J=6 Гц); 3,57 (2H, м); 4,05 (2H, с); 4,16 (2H, кв, J=6,8 Гц); 4,51 (2H, с); 6,79-6,82 (2H, м); 6,89 (1H, с); 7,18 (1Н, м); МС (ESI): m/z = 300,00 (M+H+).
Пример 31
Этил-3-(4-гидрокси-3-метоксифенил)акрилат 35a (схема 11)
Раствор ванилина (0,05 моль, 7,60 г) и коммерчески доступного илида Виттига этил(трифенилфосфоранилидин)ацетат (0,06 моль, 20,90 г) в толуоле (75 мл) кипятили с обратным холодильником в течение 2 час. Мониторинг развития реакции проводили ТСХ. Реакционную смесь концентрировали в вакууме и остаток растворяли в этилацетате (100 мл). Раствор в этилацетате промывали водой (50 мл × 2), сушили над сульфатом магния (MgSO4) и растворитель выпаривали. Остаток очищали хроматографией на силикагеле с применением 0-50% градиента этилацетата и гексана в качестве элюента, получая при этом указанное в заголовке соединение 35а в виде светло-желтой густой жидкости с выходом 80% (8,90 г). 1Н ЯМР (300 MГц, CDCl3): δ 1,33 (3H, т, J=9 Гц); 3,90 (3H, с); 4,25 (2H, кв, J=9 Гц); 6,30 (1Н, д, J=24 Гц); 7,01 (3H, м); 7,60 (1Н, д, J=24 Гц). 13C ЯМР (75 Гц, CDCl3): δ 13,59; 55,13; 59,67; 108,64; 114,07; 114,71; 122,26; 126,18; 144,06; 146,11; 147,27; 166,70.
Пример 32
Этил-3-(3-гидрокси-4-метоксифенил)акрилат 35b получили из изованилина согласно методике, описанной для получения соединения 35а в примере 31 (схема 11). Выделили в виде светло-желтой жидкости с выходом 75% (8,25 г). 1H ЯМР (300 MГц, CDCl3): δ 1,30 (3H, ушир. т); 3,85 (3H, с); 4,20 (2H, ушир. кв); 6,28 (1Н, д, J=24 Гц); 6,99 (1Н, м); 7,13 (1Н, м); 7,19 (1Н, с); 7,58 (1Н, д, J=24 Гц). 13C ЯМР (75 Гц, CDCl3): δ 14,01 ; 55,59; 60,15; 110,42; 112,97; 116,31; 121,50; 127,20; 144,38; 147,51; 148,59; 167,22.
Пример 33
6-Гидрокси-5-метокси-2,3-дигидро-1H-инден-1-он 18a (схема 11)
К перемешиваемой суспензии 2,00 г палладия, 10 мас.% на активированном угле, в метаноле (30 мл) добавляли соединение 35а (0,03 моль, 6,66 г) и затем подвергали гидрированию на вибраторе Парра при 41,4×104 Па (60 фунт/кв. дюйм) в течение 15 час. Реакционную смесь фильтровали через слой Celite® и фильтрат концентрировали в вакууме, получая при этом указанное в заголовке соединение с выходом 90% (6,00 г). Неочищенный сложный эфир подвергали омылению с применением 1 н. гидроксида калия в ТГФ при комнатной температуре с получением соответствующей карбоновой кислоты почти с количественным выходом. Карбоновую кислоту нагревали в концентрированной серной кислоте при 90°С в течение 4 час, получая при этом указанное в заголовке соединение в виде светло-коричневого твердого вещества с выходом 70% (3,50 г). 1H ЯМР (300 MГц, CDCl3): δ 2,67 (2H, м); 3,08 (2H, м); 3,98 (3H, с); 6,89 (1Н, с); 7,15 (1Н, с); 7,32 (1Н, с). 13C ЯМР (75 Гц, CDCl3): δ 24,59; 35,62; 55,04; 106,57; 106,86; 128,76; 145,58; 149,32; 153,85; 206,74.
Пример 34
5-Гидрокси-6-метокси-2,3-дигидро-1H-инден-1-он 18b получали из 35b согласно методике, описанной для получения соединения 18а в примере 33 (схема 11). Выделяли в виде светло-коричневого порошка с общим выходом 67% (3,55 г). 1H ЯМР (300 MГц, CDCl3): δ 2,69 (2H, м); 3,03 (2H, м); 3,92 (3H, с); 4,28 (1Н, ушир. с); 6,92 (1Н, с); 7,17 (1H, с). 13C ЯМР (75 Гц, CDCl3): δ 24,65; 35,86; 55,05; 103,68; 111,00; 127,98; 147,67; 151,32; 153,72; 206,88.
Пример 35
(1-Бензилпиперидин-4-ил)метанол 40 (схема 12)
К перемешиваемому раствору 4-(гидроксиметил)пиперидина 38 (0,01 моль) и DIEA (0,02 моль) в безводном ацетонитриле (20 мл) добавляли раствор бензилбромида 39 (0,012 моль) в безводном ацетонитриле (5 мл) при комнатной температуре. Образовавшуюся смесь нагревали при 55-60°С в течение 12 час. Мониторинг развития реакции проводили ТСХ. Реакционную смесь концентрировали на роторном испарителе и остаток разбавляли этилацетатом (50 мл). Образовавшийся раствор в этилацетате промывали водой, сушили над безводным сульфатом натрия (Na2SO4) и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле с применением градиента 0-100% этилацетата и гексана, получая при этом указанный в заголовке пиперидин 40 с выходом 98% (2,00 г). 1H ЯМР (400 MГц, CDCl3):δ 1,26-1,33 (2H, м); 1,43-1,52 (1Н, м); 1,70 (2H, ушир. д); 1,96 (2H, ушир. т); 2,90 (2H, ушир. д); 3,48 (2H, с); 3,49 (2H, с); 7,30 (5H, м). МС (ESI): m/z = 206,20 (M+H+).
Пример 36
1-Бензил-4-(хлорметил)пиперидин 21 (схема 12)
Тионилхлорид (0,01 моль) добавляли к охлажденному льдом сложному эфиру 40 (0,005 моль) и образовавшуюся смесь перемешивали при комнатной температуре в течение 5 час. Мониторинг развития реакции проводили ТСХ. Реакционную смесь выливали в охлажденную льдом воду (50 мл). Смесь экстрагировали этилацетатом (25 мл × 2), промывали водой (25 мл), сушили над безводным сульфатом магния (Na2SO4) и растворитель выпаривали. Остаток пропускали через короткую колонку силикагеля с применением 0-100% этилацетата в гексане в качестве элюента, получая при этом чистый хлорид 21 в виде бесцветного масла с выходом 66% (0,74 г). 1H ЯМР (400 MГц, CDCl3):δ 1,24-1,33 (2H, м); 1,43-1,60 (1Н, м); 1,77 (2H, ушир. д); 1,93 (2H, ушир. т); 2,92 (2H, ушир. д); 3,34 (2H, с); 3,50 (2H, с); 7,29 (5H, м). МС (ESI): m/z = 224,74 (M+ H+).
Хотя изобретение подробно представлено и описано с обращением к предпочтительному варианту осуществления и различным альтернативным вариантам осуществления, специалистам в данной области должно быть понятно, что в них могут быть сделаны различные изменения в форме и деталях, не выходящие за пределы сущности и объема изобретения. Все опубликованные патенты и публикации, относящиеся к данной заявке, таким образом включены в описание в качестве ссылки во всей их полноте.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ, СПОСОБЫ ПРИМЕНЕНИЯ И КОМПОЗИЦИИ ЦИКЛОАЛКИЛМЕТИЛАМИНОВ | 2007 |
|
RU2462451C2 |
| КОМПОЗИЦИИ, СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ АТИПИЧНЫХ НЕЙРОЛЕПТИКОВ НА ОСНОВЕ ХИНОЛИНА | 2008 |
|
RU2497819C2 |
| КОМПОЗИЦИИ, СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ ПРОИЗВОДНЫХ АРИЛПИПЕРАЗИНА | 2010 |
|
RU2506262C2 |
| КОМПОЗИЦИИ, СИНТЕЗ И СПОСОБЫ ПРИМЕНЕНИЯ ПРОИЗВОДНЫХ ФЕНИЛЦИКЛОАЛКИЛМЕТИЛАМИНА | 2012 |
|
RU2642074C2 |
| ПРОЛЕКАРСТВА ЛЕВОДОПА, КОМПОЗИЦИИ НА ИХ ОСНОВЕ И ИХ ПРИМЕНЕНИЯ | 2005 |
|
RU2365580C2 |
| ПРОИЗВОДНЫЕ N4-ФЕНИЛХИНАЗОЛИН-4-АМИНА И РОДСТВЕННЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ РЕЦЕПТОРНОЙ ТИРОЗИНКИНАЗЫ ТИПА ERBB ДЛЯ ЛЕЧЕНИЯ ГИПЕРПРОЛИФЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2006 |
|
RU2428421C2 |
| ПРОИЗВОДНЫЕ ПИРИДОПИРАЗИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ ФИЗИОЛОГИЧЕСКИХ И/ИЛИ ПАТОФИЗИОЛОГИЧЕСКИХ СОСТОЯНИЙ ПОСРЕДСТВОМ ИНГИБИРОВАНИЯ ФЕРМЕНТОВ ERK, ERK1, ERK2, PI3K, PI3Kальфа, PI3Kбета, PI3Kгамма, PI3Kдельта, PI3K-С2альфа, PI3K-С2бета, PI3K-Vps34р (ВАРИАНТЫ) | 2006 |
|
RU2515944C9 |
| СОЕДИНЕНИЯ И СПОСОБЫ ЛЕЧЕНИЯ ЛЕЙКЕМИИ | 2013 |
|
RU2672553C2 |
| НОВЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ КАК ИНГИБИТОРЫ BRD4 | 2016 |
|
RU2721120C2 |
| ИНГИБИТОРЫ ТИПА ErbB | 2006 |
|
RU2592703C9 |
Изобретение относится к новым производным инданона, которые можно преимущественно применять для лечения и/или предотвращения медицинского состояния, для которого желательно ингибирование холинэстеразы. 4 н. и 7 з.п. ф-лы, 36 пр.
1. Производное инданона структурной формулы (I)
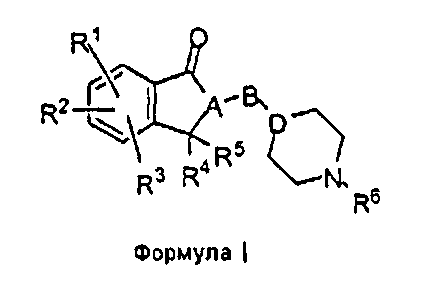
или его фармацевтически приемлемая соль,
где А и D независимо выбраны из СН;
В представляет собой -(СН2)n- и
R2 и R3 являются заместителями в положениях 5 и 6; причем
R3 представляет Н или алкокси группу;
R2 представляет алкокси группу, -O-(СН2)n-С(O)ОС1-6алкил, -O-СН2-С(O)NH-(СН2)nC(O)ОС1-6алкил и
-O-(СН2)nNHC(O)(СН2)nC(O)ОС1-6алкил;
R1, R3 и R4 представляют водород;
R6 представляет -(СН2)n-фенил, где фенил замещен заместителем, выбранным из группы, состоящей из: -С(O)ОС1-6алкила, -C(O)NH-(CH2)n-С(O)ОС1-6алкила,
-O-(СН2)n-С(O)ОС1-6 алкила, -O-CH2-C(O)NH-(CH2)nC(O)OC1-6 алкила; и n=1-3.
2. Производное инданона структурной формулы (II)

или его фармацевтически приемлемая соль, где X представляет собой О или NH;
А и D представляют СН;
В представляет собой -(СН2)n-, где n может быть целым числом от 1 до 3;
SP представляет бензил, бензил-ОС1-6алкилен-, бензил-CONHC1-6алкилен- или бензил-ОСН2С(O)NHC1-6алкилен-;
R2 и R3 являются заместителями в положениях 5 и 6; причем R1, R2 и R3 представляют С1-6алкокси группу;
R4 и R3 представляют водород;
R7 представляет собой С1-6алкил.
3. Производное инданона по п.2, представляющее собой соединение 14

где А' представляет О, С(O)O, CONH или OCH2C(O)NH, SP1 представляет С1-3алкил и R7 представляет С1-6алкил.
4. Производное инданона по п.2, которое представляет собой
5. Производное инданона структурной формулы (III)
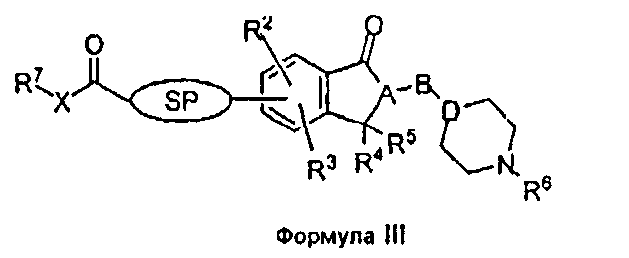
или его фармацевтически приемлемая соль, где X представляет собой О;
SP представляет собой спейсер, представляющий собой -O-(СН2)n- или оксиацетамидоалкилен;
А и D представляют СН;
В представляет собой -(СН2)n-, где n может быть целым числом от 1 до 3; и
R2 и R3 независимо представляют С1-6алкокси группу;
R4 и R5 представляют водород,
R6 представляет -(СН2)n-фенил и R7 представляет собой С1-6алкил.
6. Производное инданона по п.5, где SP представляет собой -O-СН2- или -O-(СН2)3-.
7. Производное инданона по п.5, представляющее собой соединение 16
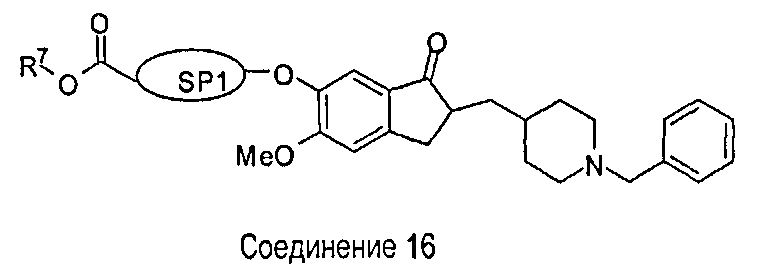
где SP1 представляет собой СН2, СН2СН2СН2 или CH2CH2CH2NHC(O)CH2.
8. Производное инданона по п.7, где SP1 представляет собой СН2СН2СН2 и R7 представляет собой этил или трет-бутил.
9. Производное инданона по п.5, представляющее собой соединение 10
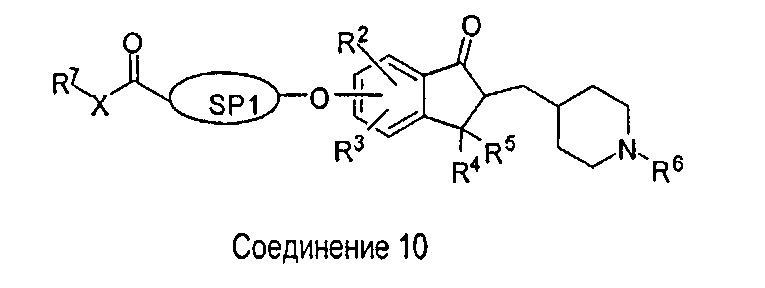
где X представляет собой О, SP1 представляет собой С1-6алкил;
R2 и R3 независимо представляют С1-6алкокси группу;
R4 и R5 представляют водород,
R6 представляет -(СН2)n-фенил и R7 представляет собой С1-6алкил.
10. Фармацевтическая композиция, ингибирующая активность холинэстеразы, содержащая соединение по любому из пп.1-9 и фармацевтически приемлемый эксципиент.
11. Фармацевтическая композиция по п.10, где эксципиент предназначен для введения через слизистую оболочку или для перорального, ректального, парентерального, чрескожного или подкожного введения.
| ПОЛИМОРФНЫЕ МОДИФИКАЦИИ ДОНЕПЕЗИЛА ГИДРОХЛОРИДА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ, СОПРОВОЖДАЮЩЕГОСЯ АКТИВНОСТЬЮ АЦЕТИЛХОЛИНЭСТЕРАЗЫ | 1997 |
|
RU2190603C2 |
| ЕР 1116716 A1, 22.06.1988 | |||
| Электронное устройство для определения мастита у коров | 1974 |
|
SU535496A1 |
| WO 2005003092 A1, 13.01.2005. | |||
Авторы
Даты
2013-04-10—Публикация
2007-12-11—Подача