Предлагаемое изобретение относится к области органической химии, конкретно к способу получения N-(1,5,3-дитиазепан-3-ил)амидов общей формулы (1)

Амиды с дитиазепановым заместителем могут найти применение в качестве биологически активных соединений [Z.Brzozowski, F.Saczewski, М.Gdaniec. Bioorganic & Medicinal Chemistry, 2003, №11, p.3673; R.B.Pawar, V.V.Mulwad. ХГС, 2004, №2, c.257], селективных сорбентов и экстрагентов благородных и драгоценных металлов (Ю.И.Муринов, В.Н.Майстренко, Н.Г.Афзалетдинова. Экстракция металлов S,N-органическими соединениями. М: Наука, 1993, 192 с).
Известен способ [В.В.Пакальнис, И.В.Зерова, С.И.Якимович и др. Гетероциклы на основе ароилуксусных альдегидов и SH-содержащих гидразидов. ЖОрХ, т.45, №2, 2009, с.296] получения 1,3,4-тиадиазепинов (2) взаимодействием гидразида 2-меркаптобензойной кислоты с ароилуксусными альдегидами при нагревании с выходами не более 56%.
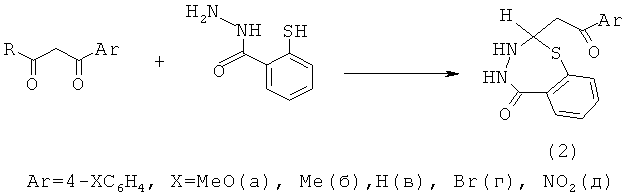
Известным способом не могут быть получены N-(1,5,3-дитиазепан-3-ил)амиды общей формулы (1).
Известен способ [W.Ried, R.Oxenius, W.Merkel. A new Principle for Preparation of Bicyclic Dithiazepine Systems. Angew. Chem. internal Edit. V.11, 1972, №6, p.511] получения 1,5,3-дитиазепиновой системы общей формулы (3) взаимодействием тетрагидропиримидинтиона с диацетиленидом ртути и арилизоцианатом в пиридине с выходами до 70%.

Известный способ не позволяет получать N-(1,5,3-дитиазепан-3-ил)-амиды общей формулы (1).
Известен способ получения 1,5,3-дитиазепановой системы общей формулы (4) [A.Tsotinis, A.Eleutheriades, L.D.Bari, G.Pescitelli. A new, stereoselective, ring-forming reaction of 1,2-ethanedithiol with N-acylated Indoles. J. Org. Chem., 2007, 72, p.8928] взаимодействием N-ацилиндолов с 1,2-этандитиолом в присутствии BF3·Et2O с выходом не более 50%.

Известным способом не могут быть получены N-(1,5,3-дитиазепан-3-ил)амиды общей формулы (1).
Таким образом, в литературе отсутствуют сведения о селективном получении N-(1,5,3-дитиазепан-3-ил)амидов формулы (1).
Предлагается новый способ селективного получения N-(1,5,3-дитиазепан-3-ил)амидов общей формулы (1).
Сущность способа заключается во взаимодействии 1,2-этандитиола [HS(CH2)2SH] с формальдегидом (CH2O, 37%-ный водный раствор) при 20°C с последующим добавлением гидразида общей формулы RC(O)NHNH2, где R=p-C5H4N, (СН3)3СО, о-CH3OC6H4 (изоникотингидразид, трет-бутилгидразинкарбоксилат, 2-метоксибензгидразид) в присутствии катализатора CuCl2·2H2O, взятыми в мольном соотношении RC(O)NHNH2: 1,2-этандитиол: формальдегид: CuCl2·2H2O=10:10:20:(0.3-0.7), предпочтительно 10:10:20:0.5, при температуре 75-85°C и атмосферном давлении в хлороформе в качестве растворителя в течение 44-52 ч. Выход N-(1,5,3-дитиазепан-3-ил)амидов (1) составляет 68-86%. Реакция протекает по схеме:

N-(1,5,3-дитиазепан-3-ил)амиды (1) образуются только лишь с участием гидразидов общей формулы RC(O)NHNH2 (изоникотингидразид, трет-бутилгидразинкарбоксилат, 2-метоксибензгидразид), формальдегида и 1,2-этандитиола. В присутствии других гидразидов (например, алкилгидразиды) целевые продукты (1) не образуются. В присутствии других α, ω-дитиолов (например, 1,4-бутандитиол, 1,6-гександитиол) или других альдегидов (например, уксусный, масляный) целевые продукты (1) не образуются. Изменение стехиометрического соотношения исходных реагентов в сторону увеличения или уменьшения содержания формальдегида или гидразида по отношению к исходному 1,2-этандитиолу приводит к снижению селективности реакции и выхода целевого продукта (1).
Проведение указанной реакции в присутствии катализатора CuCl2·2H2O больше 0.7 ммолей не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора CuCl2·2H2O менее 0.3 ммолей снижает выход (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе.
Реакции проводили при температуре 75-85°C. При температуре выше 85°C (например, 100°C) снижается селективность реакции и увеличиваются энергозатраты, а при температуре ниже 75°C (например, 40°C) снижается скорость реакции. В качестве растворителя использовали хлороформ, т.к. в нем хорошо растворимы исходные реагенты и целевые продукты.
Существенные отличия предлагаемого способа:
В предлагаемом способе в реакцию с 1,2-этандитиолом вовлекаются гидразиды, водный раствор формальдегида и каталитические количества CuCl2·2H2O. Реакция идет с селективным образованием целевых продуктов (1).
В известном способе в реакцию с 1,2-этандитиолом вовлекаются N-ацилиндолы в присутствии BF3·Et2O, позволяющие получать в условиях реакции 1,5,3-дитиазепановые системы общей формулы (4).
Предлагаемый способ обладает следующими преимуществами:
Способ позволяет получать с высокой селективностью и выходами N-(1,5,3-дитиазепан-3-ил)амиды общей формулы (1).
Способ поясняется примерами.
Пример 1. В стеклянный реактор, установленный на магнитной мешалке, помещают 10 ммоль 1,2-этандитиола, 20 ммоль формальдегида и перемешивают в течение 30 мин при комнатной температуре (~20°C). Затем в реактор добавляют 10 ммоль изоникотингидразида и 0.5 ммоль катализатора CuCl2·2H2O в 5 мл хлороформа. Реакционную смесь перемешивают 48 ч при температуре 80°C. Из реакционной массы выделяют N-(1,5,3-дитиазепан-3-ил)изоникотинамид (1а) с выходом 78%.
Другие примеры, подтверждающие способ, приведены в табл.1.
Спектральные характеристики N-(1,5,3-дитиазепан-3-ил)изоникотинамид (Ia)

Т.пл. 187-189°C. ИК-спектр, ν/см-1: 680, 1075, 1165, 1301, 1376, 1490, 1554, 1661, 1679, 2854-2924, 3188. Спектр ЯМР 1Н (δ, м.д., ДМСО-d6): 3.04 (с, 4Н, СН2(6,7)), 4.41 (с, 4Н, H2C(2,4)); 7.70 (уш.с, 2Н, НС(12,14)); 8.72 (уш.с, 2Н, НС(11,15)); 9.61 (с, 1H, NH(8)); Спектр ЯМР 13С (δ, м.д., ДМСО-d6): 36.19 (т, С(6,7)); 59.83 (т, С(2,4)); 122.00 (д, С(12,14)); 140.99 (д, С(10)); 150.60 (д, С(11,15)); 162.96 (с, С(9)). Масс-спектр, m/z (Iотн., %): 256.522 (100) [М+H]+. C10H13N3S2O. Вычислено (%): C, 47.03; Н, 5.13; N, 16.46; S, 25.11. Получено (%): С, 47.18; H, 4.94; N, 16.40; S, 25.22.
N-(1,5,3-дитиазепан-3-ил)трет-бутилкарбамат (Ib)
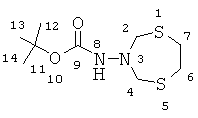
Т.пл. 130-133°C. ИК-спектр, ν/см-1: 697, 834, 1051, 1133, 1234, 1364, 1479, 1730, 2851-2967, 3188. Спектр ЯМР 1Н (δ, м.д., ДМСО-d6): 1.38 (с, 9Н, CH3(12,13,14)); 2.99 (с, 4H, CH2(6,7)), 4.20 (с, 4Н, Н2С(2,4)); 7.38 (с, 1H, NH(8)). Спектр ЯМР 13С (δ, м.д., ДМСО-d6): 27.94 (с, С(12,13,14)); 34.74 (с, C(6,7)); 79.11 (с, С(11)); 60.39 (с, C(2,4)); 153.31 (с, C(9)). Масс-спектр, m/z (Iотн., %): 289.433 (100) [М+K]+; 273.475 (11) [M+Na]+. C9H18N2S2O2. Вычислено (%): C, 43.17; H, 7.25; N, 11.19; S, 25.61. Получено (%): C, 43.18; H, 7.74; N, 10.95; S, 25.22.
N-(1,5,3-дитиазепан-3-ил)-o-метоксибензоиламид (Ic)

Т.пл. 102-105°C. ИК-спектр, ν/см-1: 740, 1005, 1100, 1265, 1370-1445, 1595, 1640, 2840, 2900, 3340. Спектр ЯМР 1Н (δ, м.д., CDCl3): 3.13 (с, 4Н, СН2(6,7)); 4.04 (с, 3H, CH3(16)), 4.34 (с, 4H, H2C(2,4)); 6.99 д (1H, Н12, J=8.4); 7.07 т (1Н, Н13, J=7.6); 7.46 т (1H, H14, J=7.6); 8.16 д (1H, Н15, J=6.4); 9.99 с (1Н, NH(8)). Спектр ЯМР 13С (δ, м.д., CDCl3): 35.32 с (C(6,7)); 56.41 с (C(16)); 63.80 с (C(2,4)); 111.51 с (C(12)); 120.50 с (C(11)); 121.29 с (C(13)); 132.30 с (C(15)); 133.36 с (C(14)); 157.57 с (C(10)); 163.46 с (C(9)). Масс-спектр, m/z (Iотн., %): 323.243 (100) [М+К]+; 307.289 (25) [M+Na]+. C12H16N2S2O2. Вычислено (%): C, 50.68; H, 5.67; N, 9.85; S, 22.55. Получено (%): C, 50.48; H, 5.74; N, 9.98; S, 23.20.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ N-(1,5,3-ДИТИАЗЕПАН-3-ИЛ)АМИДОВ | 2011 |
|
RU2482114C2 |
| СПОСОБ ПОЛУЧЕНИЯ N-(1,5,3-ДИТИАЗОЦИНАН-3-ИЛ)АМИДОВ | 2011 |
|
RU2565788C2 |
| СПОСОБ ПОЛУЧЕНИЯ N-(1,5,3-ДИТИАЗЕПИНАН-3-ИЛ)АМИДОВ | 2011 |
|
RU2481338C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-(1,5,3-ДИТИАЗОНАН-3-ИЛ)АМИДОВ | 2012 |
|
RU2518488C2 |
| СПОСОБ ПОЛУЧЕНИЯ N-(1,5,3-ДИТИАЗОЦИНАН-3-ИЛ)АМИДОВ | 2012 |
|
RU2496777C2 |
| СПОСОБ ПОЛУЧЕНИЯ N-(1,5,3-ДИТИАЗОНАН-3-ИЛ)АМИДОВ | 2012 |
|
RU2516696C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-АРИЛ -1,5,3-ДИТИАЗЕПАНОВ | 2013 |
|
RU2536132C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3-(м-, п-МЕТИЛФЕНИЛ)-1,5,3-ДИТИАЗЕПАНОВ | 2011 |
|
RU2478625C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3-АРИЛ-1,5,3-ДИТИАЗЕПАНОВ | 2013 |
|
RU2536149C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3-(о-, м-, п-НИТРОФЕНИЛ)-1,5,3-ДИТИАЗЕПАНОВ | 2011 |
|
RU2478624C2 |
Изобретение относится к области органической химии, конкретно к способу получения N-(1,5,3-дитиазепан-3-ил)амидов общей формулы (1):

который заключается в том, что 1,2-этандитиол, предварительно смешанный с водным раствором формальдегида при 20°С, подвергается взаимодействию с гидразидом общей формулы RC(O)NHNH2 [R=указанные выше] в присутствии катализатора кристаллогидрата хлорида меди CuCl2·2H2O при мольном соотношении 1,2-этандитиол: CH2O:RC(O)NHNH2:CuCl2·2H2O=10:20:10:(0.3-0.7), при 75-85°С и атмосферном давлении в течение 44-52 ч. Технический результат - разработан способ получения новых N-(1,5,3-дитиазепан-3-ил)амидов, которые могут найти применение в качестве биологически активных соединений, селективных сорбентов и экстрагентов благородных и драгоценных металлов. 1 табл., 7 пр.
Способ получения N-(1,5,3-дитиазепан-3-ил)амидов общей формулы (1):

отличающийся тем, что 1,2-этандитиол, предварительно смешанный с водным раствором формальдегида при 20°С, подвергается взаимодействию с гидразидом общей формулы RC(O)NHNH2 [R=указанные выше] в присутствии катализатора кристаллогидрата хлорида меди CuCl2∙2H2O при мольном соотношении 1,2-этандитиол :CH2O:RC(O)NHNH2:CuCl2∙2H2O=10:20:10:(0,3-0,7) при 75-85°С и атмосферном давлении в течение 44-52 ч.
| СПОСОБ ПОЛУЧЕНИЯ N-ФЕНИЛ-1,3,5-ДИТИАЗИН-5-АМИНА | 2005 |
|
RU2291151C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,4-БИС(1,3,5-ДИТИАЗИНАН-5-ИЛ)-4-ОКСОМАСЛЯНОЙ КИСЛОТЫ | 2006 |
|
RU2327693C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-МЕТИЛЕН-4H-1,3,5-ДИТИАЗИНИЛ-5(6H)АМИНА | 2005 |
|
RU2291864C1 |
Авторы
Даты
2013-04-10—Публикация
2011-08-15—Подача