Изобретение относится к синтетическим биологически активным веществам гетероциклического ряда, обладающим противомикробной активностью и представляющим собой продукты модификации сульфаниловой кислоты, а именно n-(1,5-дигидро-3-метил-8-R1-8-R2-9-гидрокси-[1,3]диоксепино[5,6-с]пиридинил-6-азо)фенилсульфокислоты и их солевые формы общей формулы I
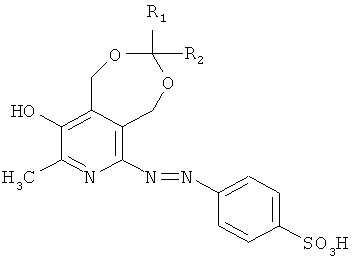
где R1, R2 выбраны из группы: атом водорода, метил, линейный, разветвленный алкил или R1, R2, которые вместе образуют спироциклоалкильную группу.
Соединения формулы (I) обладают высокой антибактериальной активностью и наиболее эффективны в отношении как грамотрицательных бактерий Proteus vulgaris, Pseudomonas aeroginosa, так и грамположительной бактерии Staphylococcus aureus, и могут найти применение в медицине и ветеринарии.
Химиотерапевтическая активность сульфаниламидных препаратов была обнаружена в начале 30-х годов. При инфекциях, вызванных чувствительными к ним микроорганизмами, сульфаниламидные препараты достаточно эффективны и относительно хорошо переносятся, а некоторые бактерии поддаются действию только сульфаниламидных препаратов [Машковский М.Д. Лекарственные средства: в 2 т. [Текст] / М.Д.Машковский - М.: Новая Волна, 2002]. Тем не менее, из-за появления микробных штаммов, устойчивых к существующим препаратам, поиск новых, более эффективных аналогов сульфаниламидов, активно продолжается. Перспективным подходом к решению этой задачи является создание эффективных и безопасных систем внутриклеточного транспорта активных веществ.
Многие активные вещества плохо преодолевают биологические барьеры вследствие высокой гидрофильности [O'Shea R. Physicochemical Properties of Antibacterial Compounds: Implications for Drug Discovery [Текст] / R.O'Shea, H.E.Moser // J. Med. Chem. - 2008. - V.51, N.10. - P.2871-2878], что отрицательно сказывается на их антибактериальной активности. В частности, сульфаниловая кислота в восемь раз активнее стрептоцида в опытах с иммобилизованными ферментами [Gale E.F. The Molecular Basis of Antibiotic Action [Текст] / E.F.Gale, E.Cundliffe, P.E.Reynolds, M.H.Richmond, М.J.Waring. - London: Wiley & Sons, 1981. - 464 p.], но при этом не проявляет антибактериальной активности вследствие низкой проницаемости через клеточные мембраны.
Ряд соединений, обладающих антибактериальной активностью, известен и среди производных пиридоксина. Известно, что 4-дезоксипиридоксин и его сложные эфиры обладают антибактериальным действием против Eimeria acervulina [Morisawa Y., Kataoka M., Watanabe T., Kitano N., Matsuzawa T. Studies on anticoccidial agents. 2. Synthesis and anticoccidial activity of pyridoxol analogs. // J. Med. Chem. - 1974. V.17, N.11. - P.1235-1237). Несмотря на низкую токсичность, антибактериальная активность вышеуказанных соединений оказалась невысокой.
Следует отметить, что описанные выше соединения, по мнению заявителя, не могут рассматриваться в качестве аналогов к заявленному техническому решению вследствие того, что они не совпадают с заявляемыми соединениями по химической структуре. Заявителем не выявлены источники, содержащие информацию о технических решениях, идентичных настоящему изобретению, что позволяет сделать вывод о его соответствии критерию «новизна».
Задача заявленного технического решения состоит в создании новых биологически активных соединений с высокой антибактериальной активностью в отношении как грамотрицательных бактерий Proteus vulgaris, Pseudomonas aeroginosa, так и грамположительной бактерии Staphylococcus aureus.
Поставленная задача решается путем синтеза противомикробных веществ общей формулы (I)
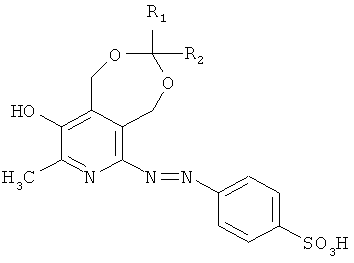
где R1, R2 выбраны из группы: атом водорода, метил, линейный, разветвленный алкил или R1, R2, которые вместе образуют спироциклоалкильную группу.
Заявляемые вещества общей формулы (I) могут применяться в виде нейтральных форм или в виде солей с катионами натрия, калия, лития, аммония, магния, кальция или другими фармакологически приемлемыми катионами.
Наиболее близкими по химическому строению и назначению к заявленному противомикробному веществу являются сульфаниловая кислота и антибактериальный препарат стрептоцид, которые были выбраны в качестве реперных соединений для сравнения антибактериальной активности.
Заявляемые вещества проявили высокую антибактериальную активность в отношении штаммов Proteus vulgaris, Pseudomonas aeroginosa, Staphylococcus aureus и могут найти применение в медицине и ветеринарии.
Заявителем не выявлены источники, в которых содержались бы сведения о влиянии отличительных признаков изобретения на достигаемый в заявленном техническом решении технический результат. Указанное новое свойство объекта обусловливает, по мнению заявителя, соответствие изобретения критерию «изобретательский уровень», так как не является очевидным для специалиста в данной области техники.
Предлагаемые в заявленном техническом решении соединения формулы (I) получали согласно нижеприведенной схеме
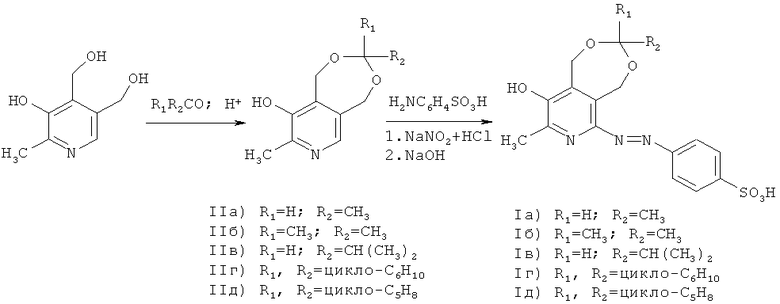
Характеристики новых соединений приведены в примерах конкретного выполнения.
Пример 1. Синтез 1,5-дигидро-3,8-диметил-[1,3]диоксепино[5,6-с]пиридин-9-ола (IIa).
Через суспензию 20 г (0.096 моль) пиридоксингидрохлорида в 300 мл уксусного альдегида, при охлаждении до 3-5°C и перемешивании, пропустили 22 г (0.603 моль) хлористого водорода. Полученную реакционную смесь перемешивали в течение 2 ч, затем осадок отфильтровали, промыли эфиром и нейтрализовали 25%-ным водным раствором поташа. Продукт отфильтровывали, сушили на воздухе и перекристаллизовывали из этилового спирта. Выход составил 65%. Т.пл. 186-186.5°C (лит. 189.5-190°C [Pat. GB 1034483, C07D 213/67. A process for the manufacture of pyridine derivatives [Текст] / ROCHE PRODUCTS LTD. - Опубл. - 29.26.1966]), ЯМР 1H (300 МГц, ацетон-d6): δ 1.31 (д, 3JHH=6 Гц, СН3, 3Н); 2.36 (с, СН3, 3Н); 4.73, 5.21 (АВ, 2JHH=-15.4 Гц, СН2); 4.74, 4.86 (АВ, 2JHH=-14.4 Гц, СН2); 5.05 (к, 3JHH=6 Гц, 1 Н); 7.74 (с, СН, 1 Н).
Пример 2. Синтез 1,5-дигидро-3,3,8-триметил-[1,3]диоксепино[5,6-с]пиридин-9-ола (IIб).
Через суспензию 20 г (96 ммоль) осушенного в вакууме водоструйного насоса коммерчески доступного пиридоксингидрохлорида (1) в 300 мл ацетона, при охлаждении до 3-5°C и перемешивании, пропускали 22 г (603 ммоль) хлористого водорода. Полученную реакционную смесь перемешивали в течение 5 ч, выдерживали 20 ч при комнатной температуре, затем осадок отфильтровали, промыли эфиром и нейтрализовали 25%-ным водным раствором поташа. Продукт отфильтровывали, сушили на воздухе и перекристаллизовывали из этилового спирта. Выход 17.9 г (выход 87%), т.пл. 184.5-186°C (лит. 184-185°C [Korytnyk W. A Seven-Membered Cyclic Ketal of Piridoxol [Текст] / W.Korytnyk // J. Org. Chem. - 1962. - V.27, N.10. - P.3724-3726]). Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.44 с (6Н, 2СН3), 2.38 с (3Н, СН3), 4.74 с (2Н, СН2), 4.86 с (2Н, СН2), 7.75 с (1Н, СН)
Пример 3. Синтез 1,5-дигидро-3-изопропил-8-метил-[1,3]диоксепино[5,6-с]пиридин-9-ола (IIв).
К раствору хлористого водорода (полученного из 10.5 г (0.095 моль) хлористого кальция и избытка конц. серной кислоты) в 50 мл абсолютного диметилсульфоксида добавили 5 г (0.024 моль) пиридоксингидрохлорида и 0.048 моль изомасляного альдегида. Реакционную массу нагревали 2 часа при 50-60°C. Затем вылили в 30 мл водного раствора 14.5 г (0,136 моль) карбоната натрия при перемешивании, и нейтрализовали разбавленным раствором хлористого водорода до pH 7. Выпавший осадок отфильтровали, маточный раствор высушили в вакууме и получившуюся маслообразную смесь промыли водой. Не растворившуюся в воде массу объединили с осадком, полученным после нейтрализации реакционной массы, и перекристаллизовали из этилового спирта. Выход 62%. Т.пл. 163.5-164°C (лит. 164-164.5°C [Pat. FR 1384099, C07D 491/04. Procédé pour la préparation de dérivés de pyridine [Текст] / Hoffmann La Roche. - Опубл. - 04.01.1965]), ЯМР 1Н (300 МГц, ацетон-d6): δ 1.31 (д, 3JHH=6 Гц, СН3, 3Н); 2.36 (с, СН3, 3 Н); 4.73, 5.21 (АВ, 2JHH=-15.4 Гц, СН2); 4.74, 4.86 (АВ, 2JHH=-14.4 Гц, CH2); 5.05 (к, 3JHH=6 Гц, 1 Н); 7.74 (с, СН, 1 Н).
Пример 4. Синтез 8-метил-1,5-дигидроспиро[[1,3]диоксепино[5,6-с]пиридин-3,1'-циклогексан]-9-ола (IIг).
В круглодонной колбе, снабженной насадкой Дина-Старка, приготовили суспензию 5 г (0.024 моль) пиридоксингидрохлорида, 1.34 г (0,007 моль) моногидрата п-толуолсульфокислоты и 0.02 моль циклогексанона в 150 мл бензола. Реакционную массу кипятили 2 ч, затем растворитель отгоняли в вакууме. К полученной смеси добавили раствор 0.32 г (0,008 моль) гидроксида натрия в 100 мл воды и нейтрализовали до pH 7 разбавленной соляной кислотой. Выпавший маслянистый осадок отфильтровали, промыли водой и смесью ацетон-гептан в соотношении 1:1 и перекристаллизовывали из этилового спирта. Т.пл.: 162-163°C (лит. 167-169°C [Pat. FR 1384099, C07D 491/04. Précédé pour la préparation de dérivés de pyridine [Текст] / Hoffmann La Roche. - Опубл. - 04.01.1965]), ЯМР 1Н (300 МГц, ДМСО-d6): δ 1,40 (м, СН2, 2Н); 1,49 (м, 2СН2, 4Н); 1,72 (м, 2CH2, 4H); 2,33 (с, СН3, 3Н); 4,71 (с, СН2, 2Н); 4,83 (с, СН2, 2Н); 7,72 (с, СН, 1Н), 8,83 (уш.с, ОН, 1Н).
Пример 5. Синтез 8-метил-1,5-дигидроспиро[[1,3]диоксепино[5,6-с]пиридин-3,1'-циклопентан]-9-ола (Iд).
Синтезируют и разрабатывают аналогично соединению (IIг), используя циклопентанон вместо циклогексанона. Т.пл.: 163-164°C, ЯМР 1Н (400 МГц, ДМСО-d6): δ 1,63(м, 2СН2, 4H); 1,81 (м, 2СН2, 4H); 2,28 (с, СН3, 3Н); 4,63 (с, СН2, 2Н); 4,76 (с, СН2, 2Н); 7,51 (с, СН, 1Н).
Пример 6. Синтез n-(1,5-дигидро-3,8-диметил-9-гидрокси-[1,3]диоксепино[5,6-с]пиридинил-6-азо)фенилсульфокислоты натриевой соли (Iа).
В колбе на 50 мл готовили раствор диазосоединения из 0.005 моль сульфаниловой кислоты, 0.35 г (0,005 моль) нитрита натрия в 50 мл (0,01 моль) 0.2 н. соляной кислоты при температуре 0-5°C. Отдельно готовили раствор 0.005 моль ацеталя IIа и 0.86 г (0,015 моль) гидроокиси калия в 15 мл воды. К раствору фенолята ацеталя по каплям при перемешивании и охлаждении до 0-5°C добавили раствор диазосоединения. Реакционную смесь перемешивали при комнатной температуре 30 минут и нейтрализовали разбавленной соляной кислотой до pH 7.5. Реакционную массу сушили в вакууме досуха, продукт перекристаллизовывали из этилового спирта. Выход 60%. Т.разл. 225-226°C. ЯМР 1Н (400 МГц, ДМСО-d6): δ 1.41 (д, 3J=5.3 Гц, СН3, 3Н); 2.32 (с, СН3, 3Н); 4.65, 5.15 (АВ-квартет, 2J=-14.9 Гц, СН2, 2Н); 5.11, 5.64 (АВ-квартет, 2J=-14.9 Гц, СН2, 2Н); 5.19 (кв, 3J=5.3 Гц, СН, 1Н); 7.74 (с, С6Н4, 4H). Вычислено C16H15N3Na2O6S×H2O: С 43.54; Н 3.88; N 9.52. Найдено: С 43.82; Н 3.28; N 9.36.
Пример 7. Синтез n-(1,5-дигидро-3,3,8-триметил-9-гидрокси-[1,3]диоксепино[5,6-с]пиридинил-6-азо)фенилсульфокислоты натриевой соли (Iб).
Синтезируют и разрабатывают аналогично соединению (Iа), используя ацеталь IIб вместо соединения IIа. Выход 70%. Т.разл. 239-240°C. ЯМР 1Н (300 МГц, ДМСО-d6): δ 1.51 (с, 2СН3, 6Н); 2.25 (с, СН3, 3Н); 4.79 (с, СН2, 2Н); 5.32 (с, СН2, 2Н); 7.69, 7.71 (АВ-квартет, 3J=8.94 Гц, С6Н4, 4Н). Вычислено C17H17N3Na2O2S×2H2O: С 43.13; Н 4.47; N 8.80. Найдено: С 42.03; Н 3.61; N 8.50.
Пример 8. Синтез n-(1,5-дигидро-3-изопропил-8-метил-9-гидрокси-[1,3]диоксепино[5,6-с]пиридинил-6-азо)фенилсульфокислоты натриевой соли (Iв).
Синтезируют и разрабатывают аналогично соединению (Iа), используя ацеталь IIв вместо соединения IIa. Выход 70%. Т.разл. 229-230°C. ЯМР 1Н (300 МГц, ДМСО-d6): δ 1.02 (д, 3J=6.8 Гц, СН3, 3Н); 1.03 (д, 3J=6.8 Гц, СН3, 3Н); 2.00 (м, СН, 1Н); 2.28 (с, СН3, 3Н); 4.61 (д, 3J=6.45 Гц, СН, 1Н); 4.61, 5.74 (АВ-квартет, 2J=-14.47 Гц, СН2, 2Н); 5.06, 5.20 (АВ-квартет, 2J=-14.56 Гц, СН2, 2Н); 7.74 (s, С6Н4, 4Н). Вычислено C18H19N3Na2O6S×2H2O: С 44.35; Н 4.76; N 8.62. Найдено: %: С 44.74; Н 4.13; N 8.40.
Пример 9. Синтез n-(8-метил-9-гидрокси-1,5-дигидроспиро[[1,3]диоксепино[5,6-с]пиридин-3,1'-циклогексил]-6-азо)фенилсульфокислоты натриевой соли (Iг).
Синтезируют и разрабатывают аналогично соединению (Ia), используя ацеталь IIг вместо соединения IIa. Выход: 38,5%. Т.разл. 220°C, ЯМР 1Н (400 МГц, ДМСО-d6): δ 1.41 (м, СН2, 2Н); 1,52 (м, 2СН2, 4Н); 1,75 (м, 2СН2, 4Н); 2,22 (с, СН3, 3Н); 4,75 (с, СН2, 2Н); 5.24 (с, СН2, 2Н); 7,65 (с, 4СН, 4Н).
Пример 10. Синтез n-(8-метил-9-гидрокси-1,5-дигидроспиро[[1,3]диоксепино[5,6-с]пиридин-3,1'-циклопентил]-6-азо)фенилсульфокислоты динатриевой соли (IIд).
Синтезируют и разрабатывают аналогично соединению (Ia), используя ацеталь IIд вместо соединения IIa. Выход: 41%, Т.разл. 220°C, ЯМР 1Н (400 МГц, ДМСО-d6): δ 1,77 (м, 2СН2, 4Н); 1,85 (м, 2СН2, 4Н); 2,16 (с, СН3, 3Н); 4,68 (с, СН2, 2Н); 5,19 (с, СН2, 2Н); 7,62 (с, 4СН, 4Н).
Пример 11. Методика изучения антибактериальной активности.
Измерение антимикробной активности проводилось на штаммах микроорганизмов: Proteus vulgaris, Pseudomonas aeroginosa, Escherichia coli, Staphylococcus aureus, которые были выделены из физиологических жидкостей людей, больных инфекционными заболеваниями. Культивирование бактерий осуществляли на стандартной питательной среде - мясопептонный агар (МПА).
Антимикробную активность исследовали при инкубировании тест-штаммов в мясопептонном бульоне в присутствии тестируемых соединений. За 12-15 ч до проведения эксперимента культуру штаммов стерильно переносили со скошенного МПА в пробирки с 5 мл МПБ для получения «ночной культуры», которую в дальнейшем разбавляли до концентрации клеток в среде 0,01 опт.ед. (λ=600 нм). Полученную суспензию разливали по пробиркам с добавлением тестируемых веществ, растворенных в 50%-ном водном растворе ДМСО, в конечной концентрации от 10-5 до 10-2 мг/мл, в качестве контроля использовали растворитель. Инкубирование приводили при 37°C в течение 6 и 12 ч. Измерение оптической плотности проводили фотометрически на спектрофотометре СФ-2000 при 600 нм. Рассчитывали процент ингибирования роста относительно контроля.
Наиболее близкими по химическому строению и назначению к заявленному противомикробному веществу являются сульфаниловая кислота и антибактериальный препарат стрептоцид, которые были выбраны в качестве реперных (соединения для сравнения антибактериальных активности) соединений.
Из представленных в таблице 1 данных следует, что заявленные вещества обладают антибактериальным действием, при этом соединение 16 ингибирует рост бактерий в 2-3 сильнее, чем стрептоцид.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ПИРИДОКСИНА С АНТИХОЛИНЭСТЕРАЗНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2550080C1 |
| Четвертичные аммониевые соединения на основе производных пентаэритрита и пиридоксина, обладающие антибактериальной активностью | 2023 |
|
RU2811203C1 |
| Четвертичные аммониевые соли на основе производных витамина В6 | 2015 |
|
RU2607522C1 |
| Ингибиторы образования конечных продуктов гликирования на основе азопроизводных фенилсульфокислот | 2016 |
|
RU2634594C1 |
| АНТИБАКТЕРИАЛЬНЫЕ СРЕДСТВА НА ОСНОВЕ ЧЕТВЕРТИЧНЫХ АММОНИЕВЫХ СОЛЕЙ | 2014 |
|
RU2561281C1 |
| Азопроизводные аминофенолов, обладающие способностью ингибировать образование конечных продуктов гликирования | 2024 |
|
RU2839138C1 |
| ПРОИЗВОДНЫЕ ПИРИДОКСИНА С НЕЛИНЕЙНЫМИ ОПТИЧЕСКИМИ СВОЙСТВАМИ | 2012 |
|
RU2501801C1 |
| ФОСФОНИЕВЫЕ СОЛИ НА ОСНОВЕ ПРОИЗВОДНЫХ ПИРИДОКСИНА | 2011 |
|
RU2466728C1 |
| БЕТА-АДРЕНОБЛОКАТОРЫ НА ОСНОВЕ ПРОИЗВОДНЫХ ПИРИДОКСИНА | 2014 |
|
RU2569900C1 |
| Способ получения производных (2-галогенпиридин-3,4-диил)диметанола | 2021 |
|
RU2768937C1 |
Изобретение относится к синтетическим биологически активным веществам гетероциклического ряда и представляет собой продукты модификации сульфаниловой кислоты, а именно n-(1,5-дигидро-3-метил-8-R1-8-R2-9-гидрокси-[1,3]диоксепино[5,6-с]пиридинил-6-азо)фенилсульфокислоты и их солевые формы общей формулы I
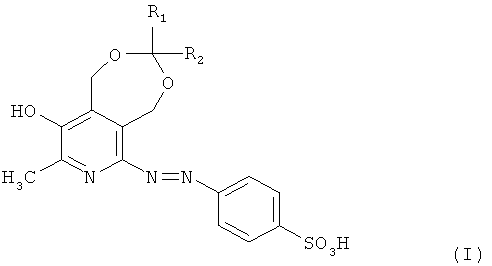
где R1, R2 выбраны из группы: атом водорода, метил, линейный, разветвленный алкил или R1 и R2 вместе образуют спироциклоалкильную группу. Соединения формулы (I) обладают высокой антибактериальной активностью, наиболее эффективны в отношении как грамотрицательных бактерий Proteus vulgaris, Pseudomonas aeroginosa, так и грамположительной бактерии Staphylococcus aureus, и могут найти применение в медицине и ветеринарии. 1 табл., 11 пр.
Производные сульфаниловой кислоты, а именно n-(1,5-дигидро-3-метил-8-R1-8-R2-9-гидрокси-[1,3]диоксепино[5,6-с]пиридинил-6-азо)фенил сульфокислоты и их солевые формы, обладающие антибактериальной активностью общей формулы I
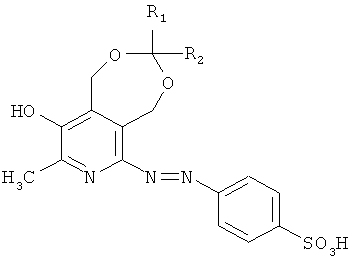
где R1, R2 выбраны из группы: атом водорода, метил, линейный, разветвленный алкил, или R1 и R2 вместе образуют спироциклоалкильную группу.
| Korytnyk W | |||
| et al, J | |||
| Medicinal Chemistry, 1973, v.16, no.6, p.638-642 | |||
| Morisawa Y | |||
| et al, J | |||
| Med | |||
| Chem., 1974, v.17, no.11, p.1235-1237. |
Авторы
Даты
2013-04-27—Публикация
2012-03-14—Подача