Настоящее изобретение относится к промышленным способам ферментации. В частности, изобретение относится к внеклеточной продукции пенообразующего средства путем ферментации.
Уровень техники
Пенообразование является обычной проблемой при аэробной подповерхностной ферментации. Пенообразование вызывается впрыскиванием газа в ферментативную среду с целью обеспечения культивируемых аэробных организмов кислородом для роста (например, бактерий, дрожжей, грибов, водорослей, культур клеток). Если ферментативная среда содержит поверхностно-активные компоненты, такие как белки, полисахариды или жирные кислоты, то пена может образовываться на поверхности среды, когда пузыри впрыскиваемого газа высвобождаются из жидкости. Пенообразование создает ряд проблем, включая нежелательное вытеснение продукта, питательных веществ и клеток в пену, и может затруднить локализацию технологического процесса. Известным способом контролировать пенообразование является применение пеногасителей, несколько типов из которых широко используются: пеногасители на основе кремнийсодержащих соединений (например, полидиметилсилоксаны), полиалкиленгликолей (например, полипропиленгликоль), жирных кислот, полиэфиров и природных масел (например, льняное масло, соевое масло). Пеногасители замещают пенообразующие компоненты на поверхности пузырей, что приводит к разрушению пены при коалесценции пузырей. Пеногасители добавляются в начале и/или в течение ферментации.
Если продукт ферментации предназначен для применения в продуктах питания, средствах личной гигиены или лекарственных препаратах, весьма желательно, чтобы продукт выделялся организмом-продуцентом в ферментативную среду (то есть, был внеклеточным, а не внутриклеточным продуктом). Это позволяет избежать необходимости в разрушении клеток физическим или химическим образом с целью высвобождения продукта для выделения. При сохранении целостности клеток, клеточный материал легко может быть отделен от продукта таким образом, что продукт очищен от внутриклеточного и генетического материала, которые обычно рассматриваются как нежелательное загрязнение. Это может оказаться особенно важным, если организм-продуцент был генетически модифицирован. Однако внеклеточная продукция может повысить степень пенообразования в ферментере, особенно если продукт усиливает образование пены или повышает ее стабильность, например, поверхностно-активное вещество биологического происхождения или гидрофобин. Применение пеногасителей представляет собой особую проблему при внеклеточной продукции подобных пенообразующих средств по двум причинам: во-первых, повышается требуемое количество пеногасителя, так как само пенообразующее средство вносит вклад в пенообразование в ферментере. Во-вторых, нет нужды удалять пеногаситель из большинства продуктов ферментации, так как он присутствует в низких концентрациях, которые не влияют на функциональность продукта. Однако, когда продуктом ферментации является пенообразующее средство, пеногаситель должен быть в сущности удален, поскольку присутствие пеногасителя в продукте нарушит функциональность последнего.
Bailey et al, Appl. Microbiol. Biotechnol. 58 (2002) pp 721-727 раскрывают продукцию гидрофобинов HFB I и HFB II с помощью ферментации трансформантов Trichoderma reesei. Для предотвращения пенообразования применялся пеногаситель (Struktol J633), а гидрофобин был очищен с применением двухфазной водной экстракции. Однако такие способы разделения, как двухфазная водная экстракция или процесс хроматографии являются дорогими и могут потребовать несовместимых с продуктами питания веществ.
Davis et al, Enzyme and Microbial Technology 28 (2001) pp 346-354 раскрывают альтернативный способ, который позволяет избежать необходимости в пеногасителе. Согласно этому способу, пену, образовавшуюся при ферментации, собирают, и продукт выделяют из нее. Данный способ был успешно применен для выделения и концентрации поверхностно-активного вещества биологического происхождения, липопептидного био-ПАВ. Однако данный способ имеет ряд недостатков: во-первых, непрерывное удаление пены может подвергнуть риску асептическую природу ферментации; во-вторых, удаление пены может повлиять на количество живых клеток (потому что некоторые клетки могут быть удалены с пеной), объем жидкости и уровень питательных веществ в ферментере, затрудняя контроль за процессом ферментации; и в третьих, экстракция продукта из пены может оказаться трудной, особенно если продукт образует очень стабильную пену. Таким образом, сохраняется потребность в усовершенствованном способе ферментации для внеклеточной продукции пенообразующих средств.
Сущность изобретения
Мы обнаружили, что при использовании определенной группы пеногасителей для подавления пенообразования в процессе внеклеточной продукции пенообразующих средств путем ферментации, пеногаситель может быть легко удален из продукта. Соответственно, прежде всего, настоящее изобретение предоставляет способ производства пенообразующего средства, включая: i) культивирование клетки-хозяина в ферментативной среде, где: клетка-хозяин выделяет пенообразующее средство в среду; и ферментативная среда содержит пеногаситель, который имеет температуру (температуру) помутнения; ii) удаление пеногасителя при температуре ферментативной среды выше температуры помутнения.
Применение пеногасителя снижает пенообразование при ферментации до минимума. Выбор пеногасителя, который имеет температуру помутнения, и подтверждение, что температура ферментативной среды превышает эту температуру помутнения, обуславливает выпадение пеногасителя в осадок в виде дисперсии. Это предусматривает простой способ, которым пеногаситель может быть удален по завершении ферментации, например, фильтрацию, центрифугирование или адсорбцию. Для сравнения, пеногасители, не имеющие температуры помутнения, требуют более сложных и/или дорогих методик разделения, таких как экстракция в водной двухфазной системе или хроматография.
Предпочтительно, на стадии i) ферментативная среда аэрируют путем впрыскивания в нее воздуха или воздуха, обогащенного кислородом.
Предпочтительно, на стадии i) температура ферментативной среды выше температуры помутнения пеногасителя.
Предпочтительно, на стадии ii) пеногаситель удаляют путем фильтрации, центрифугирования или адсорбции. Более предпочтительно, пеногаситель удаляют с помощью фильтрации в перекрестном потоке через полупроницаемую мембрану.
Предпочтительно, на стадии ii) удаляют не менее 75% пеногасителя, более предпочтительно не менее 85%, наиболее предпочтительно не менее 90%.
Предпочтительно, на стадии ii), температура ферментативной среды составляет не менее 10°C над температурой помутнения, более предпочтительно не менее 20°C над температурой помутнения, наиболее предпочтительно не менее 30°C над температурой помутнения.
Клетки-хозяева также предпочтительно удаляются из ферментативной среды на стадии ii).
Пенообразующее средство предпочтительно очищают и/или концентрируют из ферментативной среды после стадии ii), например, с помощью ультрафильтрации.
Предпочтителен пищевой пеногаситель.
Пеногаситель предпочтительно содержит не менее одного неионного поверхностно-активного вещества/полимера, такого как полиэфир, поли(алкиленгликоль), блочный сополимер этиленпропилен оксида, полиспирт на основе блочного сополимера этиленпропилен оксида, полиэфирная дисперсия на основе полипропиленгликоля или алкоксилированный сложный эфир жирной кислоты.
Предпочтительно, пенообразующее средство является пищевым.
Пенообразующее средство предпочтительно является гидрофобином, более предпочтительно гидрофобином класса II, наиболее предпочтительно HFBI либо HFBII из Trichoderma reesei.
Клетка-хозяин предпочтительно является генетически модифицированным грибом, более предпочтительно дрожжевой клеткой, наиболее предпочтительно Saccharomyces cerevisiae.
Предпочтительно, после стадии ii), весовое отношение пеногасителя к пенообразующему средству составляет менее 0,2, более предпочтительно менее 0,15, наиболее предпочтительно менее 0,1.
Подробное описание изобретения
Если не указано иное, все технические и научные термины, использованные в данном тексте, имеют то же значение, что обычно подразумевается специалистом в данной области (например, клеточных культур, молекулярной генетики, химии нуклеиновых кислот, методик гибридизации и биохимии). Стандартные методики, использованные для молекулярных и биохимических процессов, могут быть найдены в Sambrook et al., Molecular Cloning: A Laboratory Manual, 3rd ed. (2001) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., и Ausubel et al., Short Protocols in Molecular Biology (1999) 4th Ed, John Wiley & Sons, Inc. - и полной версии, озаглавленной "Текущие Протоколы в Молекулярной Биологии".
Пенообразующие средства
В контексте настоящего изобретения термин "пенообразующее средство" обозначает поверхностно-активное вещество биологического происхождения, которое способствует образованию пены и/или повышает ее стабильность путем подавления слияния пузырей.
Предпочтительно пенообразующее средство таково, что в водном растворе пенообразующее средство приводит к образованию пены с объемом газообразной фазы не менее 20%, от которых не менее 50% сохраняется при хранении 1 час при 5°C, более предпочтительно через 2 часа, наиболее предпочтительно через 4 часа, в соответствии со следующим тестом.
Готовится 80 мл водного раствора пенообразующего средства (0,5% по весу). Раствор аэрируют при сдвиговой деформации раствора в охлажденном (2°C) установленном вертикально цилиндрическом сосуде из нержавеющей стали, закрытом кожухом, с внутренними пропорциями 105 мм высоты и диаметром 72 мм. Крышка сосуда заполняет 54% внутреннего объема, оставляя 46% (180 мл) для образца. Ротор, применяемый для создания сдвиговой деформации образца, состоит из прямоугольного лопастного колеса соответствующих пропорций, чтобы задевать внутреннюю поверхность контейнера при вращении (72 мм×41,5 мм). Также к ротору прикреплены два полукруглых (диаметр 60 мм) ножевых полотна, создающие большое сдвиговое усилие, расположены под углом 45° к прямоугольному приспособлению. 80 мл раствора вливали в сосуд и закрывали крышкой. Далее раствор подвергался сдвиговой деформации при 1250 об/мин в течение 10 минут. Раствор, насыщенный газом, немедленно переливался в измерительный цилиндр. Объем пены подсчитывался в измерительном цилиндре немедленно и вновь после хранения при 5°C. Объем газообразной фазы определялся, исходя из измеренного объема пены и известного объема водной фазы (то есть, 80 мл) следующим образом:
Объем газообразной фазы=[(объем пены - 80 мл)/объем пены)]×100
Жидкость в пене со временем стекает, что приводит к образованию двух отдельных и четко выраженных слоев: пена сверху и водный раствор внизу. Однако в данном случае интерес представляет стабильность пены. Для вычисления объема газообразной фазы, объем пены рассматривается как полный объем системы, то есть, и газообразная фаза, и водная фаза, независимо от того, разделились ли они на два четко выраженных слоя. Следовательно, объем газообразной фазы дает количественный показатель устойчивости пены к потере газа. Таким образом, если начальный объем газообразной фазы составляет 50%, то после хранения объем газообразной фазы должен составить не менее 25%; если начальный объем газообразной фазы составляет 20%, то после хранения он должен быть не менее 10%.
Пенообразующие средства включают гидрофобины и поверхностно-активные вещества биологического происхождения, такие как гликолипиды (например, рамнолипиды, трегалолипиды, целлобиолипиды, софоролипиды); липопептиды и липопротеины (например, пептидолипид, серраветин, вискозин, сурфактин, субтилизин, грамицидины, полимиксины); жирные кислоты, нейтральные липиды и фосфолипиды; полимерные поверхностно-активные вещества биологического происхождения (например, эмульсан, биодисперсан, маннан-липид-протеин, липозан, углевод-протеин-липид, белок PA), дисперсные поверхностно-активные вещества биологического происхождения (везикулы и реснички, целые клетки), гликозиды (например, сапонины) и фибриллярные белки (например, фиброин). Белки молока и сои/гидролизаты белка также являются пенообразующими средствами, хотя они обычно не производятся способами ферментации. Пенообразующее средство предпочтительно не является белком молока или сои или гидролизатом белка. В особенно предпочтительном варианте осуществления изобретения, пенообразующее средство является гидрофобином.
Пенообразующие средства могут быть получены путем культивирования организмов-хозяев, которые выделяют пенообразующее средство в ферментативную среду в природе. К примеру, гидрофобины могут быть получены путем культивирования таких нитчатых грибов, как гифомицеты (например, Trichoderma), базидиомицеты и аскомицеты. Особенно предпочтительные хозяева являются микроорганизмами, используемыми в пищевой промышленности, такими как Cryphonectria parasitica, которые выделяют гидрофобин, называемый крипарин (MacCabe and Van Alfen, 1999, App. Environ. Microbiol 65: 5431-5435). Подобно этому, сурфактин может быть получен из Bacillus subtilis, а гликолипиды из, например, Pseudomanas aeruginosa, Rhodococcus erythropolis, Mycobacterium species и Torulopsis bombicola (Desai and Banat, Microbiology and Molecular Biology Reviews, Mar. 1997, pp 47-64).
Альтернативно, пенообразующие средства могут быть получены с применением рекомбинантных технологий. К примеру, клетки-хозяева, обычно микроорганизмы, могут быть изменены для экспрессии пенообразующих средств. Методики для введения конструкций нуклеиновых кислот, кодирующих пенообразующие средства (где пенообразующее средство является полипептидом) или ферменты, необходимые для продукции пенообразующих средств (где пенообразующее средство это не пептид, например, биосурфактант), в клетки-хозяева, хорошо известные в данной области техники. Рекомбинантные технологии также могут применяться для изменения последовательности ДНК пенообразующего средства или синтеза новых пенообразующих средств с требуемыми/улучшенными свойствами.
Обычно, подходящие клетка-хозяин или организм трансформируются конструкцией нуклеиновой кислоты, которая кодирует требуемое полипептидное пенообразующее средство. Нуклеотидная последовательность, кодирующая полипептид, может быть вставлена в подходящий экспрессионный вектор, кодирующий необходимые элементы для транскрипции и трансляции, и таким образом, что они будут экспрессироваться при адекватных условиях (например, в правильной ориентации и правильной рамке считывания, и с адекватной целевой и экспрессионной последовательностью). Технологии, требуемые для создания этих экспрессионных векторов, хорошо известны специалистам в данной области.
Для экспрессии последовательности, кодирующей полипептид, может применяться ряд экспрессионных систем. Они включают, но не ограничены ими, бактерии, грибы (включая дрожжи), системы клеток насекомых и системы культур клеток растений, которые были трансформированы подходящими экспрессионными векторами. Предпочтительными хозяевами являются те, которые рассматриваются как пищевые, безопасные (GRAS) организмы.
Подходящие виды грибов, включая (но не ограничиваясь) такие дрожжи, как род Saccharomyces, Kluyveromyces, Pichia, Hansenula, Candida, Schizosaccharomyces и подобные, и такие виды нитчатых грибов (но не ограничиваясь), как грибы рода Aspergillus, Trichoderma, Mucor, Neurospora, Fusarium и подобные.
Последовательности, кодирующие полипептидные пенообразующие средства, предпочтительно не менее чем на 80% идентичны на уровне аминокислот пенообразующему средству, обнаруженному в природе, более предпочтительно идентичны не менее чем на 95% или 100%. Однако специалисты в данной области могут сделать консервативные замены или другие изменения в аминокислотной последовательности, которые не снижают биологической активности пенообразующего средства.
Гидрофобины являются наиболее предпочтительным классом пенообразующих средств. Ранее, в EP1623631, мы нашли, что гидрофобины делают возможным получение пен на водной основе с отличной устойчивостью к диспропорционированию и слипанию. Так как гидрофобины представляют собой высокоэффективные пенообразующие средства, их присутствие в ферментативной среде является особенной проблемой для контроля за образованием пены.
Гидрофобины являются хорошо изученным классом белков (Wessels, 1997, Adv. Microb. Physio. 38: 1-45; Wosten, 2001, Annu Rev. Microbiol. 55: 625-646), способных к самосборке на границе раздела гидрофобной и гидрофильых фаз и имеющих консервативную последовательность:
Xn-C-X5-9-C-C-X11-39-C-X8-23-C-X5-9-C-C-X6-18-C-Xm (SEQ ID № 1),
где X представляет собой любую аминокислоту, а n и m являются независимыми целыми числами. Обычно гидрофобин имеет длину вплоть до 125 аминокислот. Остатки цистеина (C) в консервативной последовательности являются частями дисульфидных мостиков. В контексте настоящего изобретения термин гидрофобин имеет более широкое значение, включающее функционально эквивалентные белки, также демонстрирующие свойства самосборки на границе раздела гидрофобной и гидрофильых фаз, что приводит к образованию белковой пленки, такие, как белки с последовательностью:
Xn-C-X1-50-C-X0-5-C-X1-100-C-X1-100-C-X1-50-C-X0-5-C-X1-50-C-Xm (SEQ ID № 2)
или их части, также демонстрирующие свойства самосборки на границе раздела гидрофобной и гидрофильых фаз, что приводит к образованию белковой пленки. В соответствии с определением настоящего изобретения, самосборка может быть обнаружена путем адсорбции белка на тефлон и использования кругового дихроизма для установления наличия вторичной структуры (обычно, α-спиралей) (De Vocht et al., 1998, Biophys. J. 74: 2059-68).
Факт образования пленки может быть установлен путем инкубации листа тефлона в белковом растворе с последующими промывками (не менее трех) водой или буфером (Wosten et al., 1994, Embo. J. 13: 5848-54). Белковая пленка может быть наглядно представлена любым подходящим методом, таким как мечение флуоресцентным маркером или с использованием флуоресцентных антител, как точно установлено в данной области техники. Величины m и n обычно находятся в интервале от 0 до 2000, но более обычны величины m и n в целом менее чем 100 или 200. Определение гидрофобина в контексте настоящего изобретения включает слитые белки гидрофобина и другого полипептида, равно как конъюгаты гидрофобина и других молекул, таких как полисахариды.
Гидрофобины, обнаруженные к настоящему времени, как правило классифицируются как относящиеся к классу I или классу II. Оба типа были обнаружены в грибах как секретируемые белки, которые самоорганизуются на границах раздела гидрофобной фазы в амфипатическую пленку. Собранные системы гидрофобинов I класса, как правило, относительно нерастворимы, тогда как системы гидрофобинов II класса без труда растворяются в ряде растворителей. Предпочтителен гидрофобин, растворимый в воде, что подразумевает, что он не менее чем на 0,1% растворим в воде, предпочтительно не менее чем на 0,5%. Не менее чем на 0,1% растворим подразумевает, что не образуется никакого осадка гидрофобина, когда 0,1 г гидрофобина в 99,9 мл воды подвергаются центрифугированию при 30000 g в течение 30 минут при 20°C.
Также, в таких нитчатых бактериях, как Actinomycete и Streptomyces sp., были обнаружены гидрофобин-подобные белки (например, "чаплины" ("chaplins")) (WO01/74864; Talbot, 2003, Curr. Biol, 13: R696-R698). Эти бактериальные белки, в противоположность грибным гидрофобинам, могут образовывать только не более одного дисульфидного мостика, так как они могут иметь только два цистеиновых остатка. Подобные белки являются примером функциональных эквивалентов гидрофобинов с консенсусной последовательностью, приведенной в SEQ ID №№ 1 и 2, и входят в рамки настоящего изобретения.
Из более чем 16 видов грибов было клонировано более 34 генов, кодирующих гидрофобины (см. для примера WO96/41882, где приводится последовательность гидрофобинов, обнаруженных в Agaricus bisporus; и Wosten, 2001, Annu Rev. Microbiol. 55: 625-646). Для целей настоящего изобретения гидрофобины, обладающие не менее 80% идентичностью на аминокислотном уровне к гидрофобину, встречающемуся в природе, также охватываются термином «гидрофобины».
Пеногасители
Термин "пеногаситель" включает и те пеногасители, которые обычно добавляются перед тем, как наступит пенообразование, и также те, которые обычно добавляются, когда пена уже образовалась (иногда называемые пеноудаляющими добавками). Специфической группой пеногасителей, подходящих для настоящего изобретения, являются пеногасители, обладающие температурой помутнения. Температура помутнения представляет собой температуру, при которой водный раствор пеногасителя становится оптически мутным при разделении фаз (то есть, молекулы пеногасителя образуют агрегаты, рассеивающие свет), как описано на стр. 63 текста «Surfactant Aggregation and Adsorption at Interfaces», J. Eastoe, в издании Colloid Science: Principles, Methods and Applications, ed. T. Cosgrove, Blackwell Publishing, 2005.
Примеры пеногасителей, которые демонстрируют температуры помутнения, включают соединения на основе поли(алкиленгликоля) (ПАГ), такие как блочные сополимеры этилен оксид/пропилен оксида, многоатомные спирты на основе блочных сополимеров этилен оксид/пропилен оксида и полимеры простого эфира оксидов этилена и пропилена; и соединения на основе эфиров жирных кислот.
Температура помутнения зависит от состава и химической структуры поверхностно-активного вещества. К примеру, для полиоксиэтиленовых (PEO) не ионных поверхностно-активных веществ, температура помутнения повышается с увеличением содержания этилен оксида (EO) для взятой гидрофобной группы. Предпочтительно температура помутнения пеногасителя находится между 0°C и 90°C, более предпочтительно между 5°C и 60°C.
Пеногаситель предпочтительно содержит не менее одного не ионного полимерного поверхностно-активного вещества, такого как полиэфир, поли(алкиленгликоль), блочный сополимер этилен/пропилен оксида, многоатомный спирт на основе блочного сополимера этилен/пропилен оксида, дисперсия полимера простого эфира на основе полипропиленгликоля, или алкоксилированный сложный эфир жирной кислоты. Пеногасители на основе ПАГ (такие как структол (Struktol) J647, доступный от Schill and Seilacher), многоатомные спирты на основе блочных сополимеров этилен оксид/пропилен оксида (такие как Структол (Struktol) J647, доступный от Schill and Seilacher) и другие не ионные поверхностно-активные вещества пеногасители являются особенно эффективными для разрушения пены, даже в присутствии таких мощных пенообразующих средств, как гидрофобин.
Могут применяться смеси пеногасителей, в этом случае температура помутнения такой смеси определяется как самая высокая температура помутнения индивидуальных компонентов.
Некоторые распространенные коммерчески доступные пеногасители, обладающие температурой помутнения, приведены в таблице 1.
Технология ферментации и удаление пеногасителя
Ферментацию для получения пенообразующего средства осуществляют путем культивирования клетки-хозяина в жидкой ферментативной среде внутри биореактора (например, промышленного ферментера). Состав среды (например, питательные вещества, источник углерода и т.д.), температура и pH выбираются для обеспечения адекватных условий роста культуры и/или продукции пенообразующего средства. Воздух или воздух, обогащенный кислородом, обычно впрыскивают в среду, обеспечивая кислород для дыхания культуры.
Пеногаситель может быть включен в начальный состав среды и/или добавлен по мере необходимости во время ферментации. На практике распространено применение таких технологий детекции (обнаружения) пены, как измерительные зонды, которые автоматически запускают добавление пеногасителя. В настоящем изобретении, пеногаситель предпочтительно присутствует в концентрации от 0,1 до 20 г/л, более предпочтительно от 1 до 10 г/л.
Температура ферментера на стадии i), то есть, во время ферментации, может быть выше или ниже температуры помутнения пеногасителя. Предпочтительна температура ферментации над температурой помутнения пеногасителя, так как пеногаситель наиболее эффективен в вызывании коалесценции пузырей и разрушении пены при температуре над температурой помутнения. Обычно выбирается такая температура ферментера, чтобы достигались оптимальные условия роста клеток-хозяев и и/или продукции.
По окончании ферментации пеногаситель должен быть практически полностью удален, чтобы гарантировать ненарушенную функциональность пенообразующего средства. Предпочтительно, удаляют не менее 75% пеногасителя, более предпочтительно не менее 85%, наиболее предпочтительно не менее 90%. К примеру, после стадии ii) весовое соотношение пеногасителя к пенообразующему средству предпочтительно составляет менее 0,2, более предпочтительно менее 0,15, наиболее предпочтительно менее 0,1.
Удаление пеногасителя достигается обеспечением температуры ферментативной среды над температурой помутнения пеногасителя, таким образом, что пеногаситель разделяется на фазы. Разделенный на фазы пеногаситель может быть удален из ферментативной среды подходящим способом, таким как:
- фильтрация, например, тупиковая фильтрация или фильтрация в фильтр-прессе
- фильтрация в перекрестном потоке через полупроницаемую мембрану, например, микрофильтрация или ультрафильтрация
- центрифугирование
- адсорбция с применением, например, активированного угля, двуокиси кремния или диатомитовой земли в качестве адсорбента.
Удаление пеногасителя может происходить с помощью, например, одной из перечисленных техник в одну стадию. Альтернативно, техники могут быть повторены или скомбинированы. К примеру, после первой стадии фильтрации, фильтрат может быть снова нагрет (если необходимо) и вновь профильтрован.
Мы обнаружили, что пеногасителя удаляется в большей степени, если температура ферментативной среды составляет не менее 10°C над температурой помутнения, предпочтительно не менее 20°C над температурой помутнения, наиболее предпочтительно не менее 30°C над температурой помутнения.
Температура ферментативной среды не должна быть высокой настолько, что пенообразующее средство денатурирует. По этой причине, предпочтительно пенообразующее средство, устойчивое к нагреванию, например, гидрофобины. Предпочтительно, температура ферментативной среды составляет менее чем 90°C, более предпочтительно менее чем 75°C. В предпочтительном варианте осуществления, пеногаситель имеет температуру помутнения в интервале 20-30°C, а температура ферментативной среды на стадии ii) находится в интервале 40-60°C. Для сравнения, если придерживаться общепринятых технологий, такого повышения температуры ферментативной среды сознательно избегают с целью снижения до минимума возможности реакций деградации (которые могут вызвать изменение цвета и запаха), инактивации фермента, денатурации белка и потери функциональности (см. для примера стр. 7 издания "Separation Processes in the Food and Biotechnology Industries", Eds. Grandison, A. S.; Lewis, M.J.).
Предпочтительным способом отделения пеногасителя является фильтрация через полупроницаемую мембрану. Было принято считать, что проведение ферментативных сред, содержащих пеногаситель, фильтрации через полупроницаемую мембрану при температурах свыше его температуры помутнения приведет к засорению мембраны осадком пеногасителя, вызовет снижение протекания потока и последующие технологические затруднения: см. для примера Yamagiwa et al., J. Chem. Eng. Japan, 26 (1993) pp 13-18, и WO 01/014521. Таким образом, ранее считалось, что фильтрацию через полупроницаемую мембрану следует осуществлять при температурах ниже температуры помутнения. Однако мы обнаружили, что приемлемые параметры потока достигаются при проведении процедур ультрафильтрации и микрофильтрации при температуре приблизительно 25°C над температурой помутнения пеногасителя.
С целью подтверждения того, что продукт пенообразующее средство освобожден от внутриклеточного и генетического материала (которые обычно рассматриваются как нежелательные загрязнения), клетки должны быть удалены из ферментативной среды. В предпочтительном варианте осуществления, клетки отделяются от среды в то же время, когда удаляют осажденный пеногаситель, например, на стадии микрофильтрации, осуществляемой при температуре над температурой помутнения.
В альтернативном варианте осуществления, клетки могут быть удалены из среды на дополнительной стадии разделения перед удалением пеногасителя - например, с помощью фильтрации (например, тупиковой фильтрации или фильтрации в фильтр-прессе), фильтрации в перекрестном потоке через полупроницаемую мембрану, (например, микрофильтрации или ультрафильтрации), или центрифугирования - при температуре ниже температуры помутнения. В этом варианте осуществления изобретения, стадия очистки и/или концентрации (например, путем ультрафильтрации) может быть проведена (опять же, при температуре ниже температуры помутнения) после удаления клеток, но перед отделением пеногасителя. Затем среду нагревают до температуры над температурой помутнения таким образом, что пеногаситель может быть удален, как уже описано.
Как только пеногаситель и клетки были удалены из ферментативной среды, продукт пенообразующее средство может подвергаться дальнейшим очистке и концентрированию, как необходимо, например, с помощью ультрафильтрации. Если пенообразующее средство представляет собой гидрофобин, оно может быть очищено из ферментативной среды с помощью, например, технологии, описанной в WO01/57076, которая включает адсорбцию гидрофобина на поверхности и последующий контакт поверхности с поверхностно-активным веществом, таким как Tween 20, для элюции гидрофобина с поверхности. См. также Collen et al., 2002, Biochim Biophys Acta. 1569: 139-50; Calonje et al., 2002, Can. J. Microbiol. 48: 1030-4; Askolin et al., 2001, Appl Microbiol Biotechnol. 57: 124-30; и De Vries et al., 1999, Eur J Biochem. 262: 377-85.
Далее настоящее изобретение будет описано путем ссылки на следующие примеры, которые являются исключительно иллюстративными, а не ограничивающими, и фигуры, где:
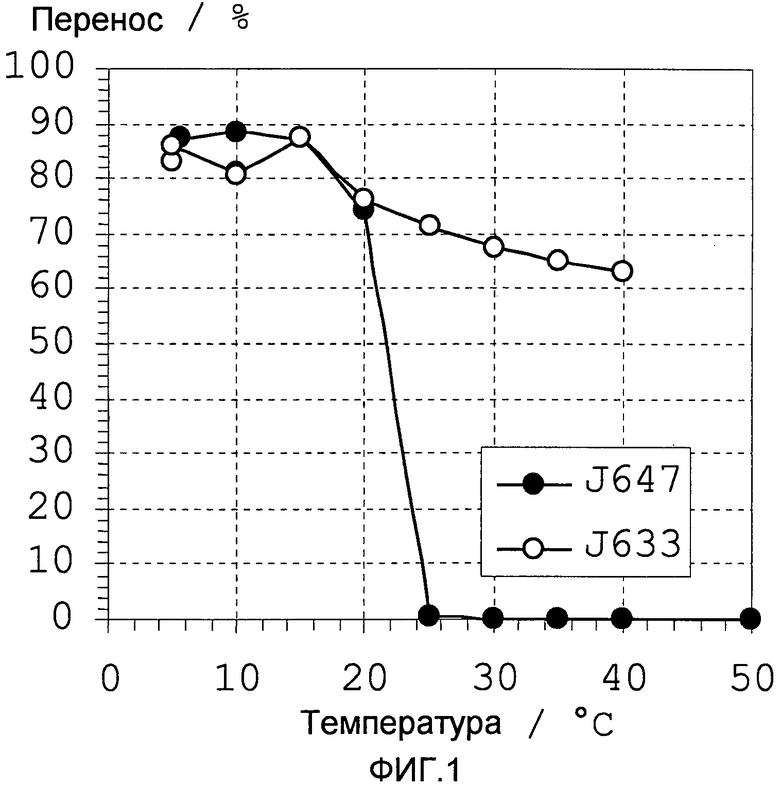
Фиг. 1 показывает % переноса как функцию температуры, для 0,2% по весу водных растворов пеногасителей Struktol J647 и J633.
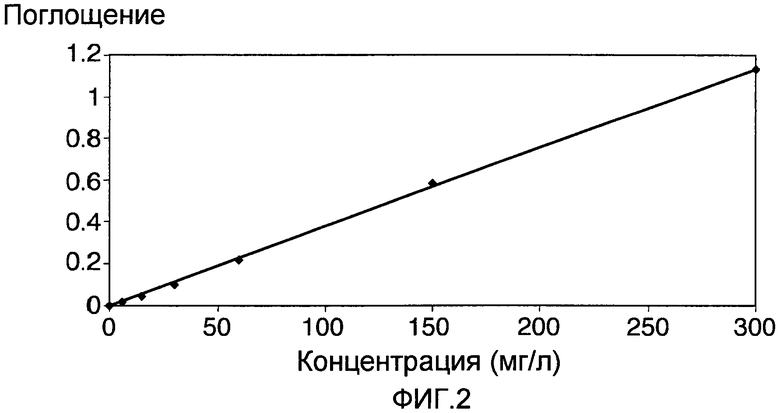
Фиг. 2 показывает калибровочную кривую, определенную в примере 2.
Примеры
Пример 1: Определение точек помутнения пеногасителей
Температуру помутнения пеногасителя измеряют следующим способом, приведенном здесь для двух коммерчески доступных пеногасителей, один из которых имеет температуру помутнения (Struktol J647), а второй не имеет (Struktol J633).
0,2% (по весу) раствор каждого пеногасителя был приготовлен в водном растворе при комнатной температуре. Образцы объемом по 20 мл переливались в цилиндрические стеклянные сосуды (Turbiscan). Образцы уравновешивались при температуре измерения в течение 1 часа в водяной бане. Мутность образцов определялась с использованием прибора Turbiscan Lab Expert (Formulaction, France). Этот прибор имеет источник света с длиной волны λ 880 нм и оптический датчик падающего света с углом обзора 180°, который измеряет процентную долю падающего света, проходящего через образец на 25 мм выше основания сосуда, содержащего образец раствора. При помутнении раствора снижается количество проходящего света. Сосуды с образцами вносились в прибор Turbiscan Lab Expert, который был установлен на требуемую температуру измерения. Коэффициент пропускания (%) определялся как функция от температуры с шагом 5°C, начиная от 5°C, результаты приведены на Фиг. 1. Для пеногасителя J647, коэффициент пропускания резко снижался с 75% до 0% между 20°C и 25°C, показывая, что в данном интервале температур была достигнута температура помутнения. Эти данные согласуются с величиной 24°C, заявленной производителем. (Если требуется более точное значение температуры помутнения, то измерения могут быть проведены с меньшим шаговым интервалом температуры, например, 1 или 2°C.) В противоположность этому, пеногаситель J633 имеет очень малые изменения мутности, так как он не имеет температуры помутнения. Следовательно, J647 представляет собой подходящий пеногаситель для применения в настоящем изобретении, тогда как J633 не подходит.
Пример 2: Удаление пеногасителя из модельного раствора
Эксперимент проводился для того, чтобы показать, что пеногасители могут быть удалены из модельных растворов путем повышения температуры раствора до величины над температурой помутнения, и удаления осадка фильтрацией. Раствор пеногасителя Struktol J647 (0,3% (вес/объем)) был приготовлен растворением аликвоты Struktol J647 весом 3,00 г в 1 литре воды Milli Q. Образцы этого раствора нагревались до температуры над температурой помутнения путем помещения в водяную баню, установленную на нужную температуру, на 1 час. Затем образцы осторожно перемешивались вращением и немедленно фильтровались.
Было проведено два различных эксперимента. Во-первых, исследовалось влияние размера пор фильтра путем применения фильтров с размером пор 0,45 мкм (Pall Life Sciences Acrodisc), 0,2 мкм, 1,20 мкм и 5,00 мкм (все Sartorius Minisart) с 2 мл шприцем при неизменной температуре раствора (50°C). Во-вторых, варьировали температуру раствора от 30°C до 70°C (то есть, от 6°C до 46°C над температурой помутнения), в то время как размер пор фильтра оставался неизменным (0,2 мкм).
Концентрации пеногасителя в фильтратах определялись с применением набора для анализа воды Lange LCK 433 для не ионных поверхностно-активных соединений. Он использует тот принцип, что не ионные поверхностно-активные соединения (такие как J647) образуют комплексы с индикатором TBPE (сложный этиловый эфир тетрабромфенолфталеина), которые могут быть выделены в дихлорметане и измерены фотометрически для определения концентрации. Сначала была построена калибровочная кривая. Раствор пеногасителя Struktol J647 (0,3% (вес/объем)) был приготовлен растворением аликвоты Struktol J647 весом 3,00 г в 1 литре воды Milli Q при 15°C. Аликвоты этого раствора разводились водой Milli Q до концентраций: 6, 15, 30, 60, 150 и 300 мг/л. Вода Milli Q использовалась как пустая проба. Образцы каждой концентрации объемом по 0,2 мл добавлялись в тестовые пробирки аналитического набора, содержащие TBPE и дихлорметан. Пробирки осторожно перемешивались в течение 2 минут, и затем были оставлены на 30 минут. Затем проводили измерения на спектрофотометре Lange DR2800 при 605 нм, согласно инструкциям к аналитическому набору. Полученный калибровочный график приведен на Фиг. 2.
Затем фильтраты были разведены в пропорции 1/10 водой Milli Q. Образцы объемом по 0,2 мл измеряли на спектрофотометре, как описано выше, и по калибровочному графику определяли концентрацию пеногасителя в каждом образце фильтратов. Количество (%)пеногасителя, оставшегося в фильтрате, было вычислено как
(измеренная концентрация в фильтрате)/(известная начальная концентрация)×100%.
Концентрации пеногасителя вплоть до 0,2 мг/л (2x10-5% вес/объем) могут быть измерены по схожей методике, с применением набора для анализа воды Lange LCK 333, и построением калибровочной кривой в соответствующем интервале концентраций. В этом случае к аналитическому набору добавляют аликвоту измеряемого образца объемом 2 мл, вместо 0,2 мл.
Результаты приведены в Таблице 2. Различие в количестве оставшегося пеногасителя между двумя измерениями с применением фильтра 0,2 мкм при 50°C (то есть, 6%) указывает на величину ошибки, связанной с данной методикой.
Данные показывают, что чем меньше размер пор фильтра, тем большее количество пеногасителя удаляют, то есть, снижают количество пеногасителя, оставшегося в растворе, как ожидалось. Касательно J647, размер пор 5,0 мкм недостаточно мал, чтобы удалить большую часть пеногасителя, тогда как применение фильтров с размером пор 0,2 мкм приводит к удалению около 90% пеногасителя. Данные также демонстрируют, что для взятого размера пор фильтра, повышение температуры раствора приводит к более эффективному удалению пеногасителя.
Пример 3. Удаление пеногасителя из модельной ферментативной среды
Для демонстрации удаления пеногасителя из типичной ферментативной среды была приготовлена модельная ферментативная среда. Сначала были приготовлены два раствора, состав которых приведен в Таблице 3. При типичной периодической ферментации с добавлением субстрата Порция 1 будет начальной средой, а Порция 2 будет подаваться постепенно через загрузочные интервалы.
Каждая порция (объемом 1 литр) автоклавировалась 20 минут при 121°C. Затем порции смешивались (50:50) для получения модельной ферментативной среды с концентрацией пеногасителя 0,6 г/л. Среда не была засеяна и не подвергалась ферментации, а анализировалась в необработанном виде. Образцы были нагреты и фильтровались для удаления пеногасителя, и измерялось количество оставшегося пеногасителя, также, как описано в примере 2. Доля оставшегося пеногасителя для каждого случая приведена в Таблице 4.
Эксперимент был повторен, но с добавлением в модельную ферментативную среду дополнительного количества пеногасителя таким образом, что начальная концентрация составила 3 г/л. Результаты приведены в Таблице 5.
Эти данные показывают, что при выборе пеногасителя, имеющего температуру помутнения, пеногаситель может быть практически полностью удален из модельной ферментативной среды простым и удобным способом.
Пример 4: Удаление пеногасителя из ферментативной среды, содержащей пенообразующее средство
Проводилась периодическая ферментация с добавлением субстрата генетически модифицированного штамма Saccharomyces cerevisiae. Штамм был модифицирован путем введения гена, кодирующего гидрофобин HFBII из гриба Trichoderma reesei (пенообразующее средство), таким образом, что достигается внеклеточная экспрессия гидрофобина во время ферментации. Ферментация проводилась в сущности как описано van de Laar T et al., в Biotechnol Bioeng. 96(3):483-94 (1997), используя глюкозу в качестве источника углерода и изменив масштаб процедуры до суммарного объема 150 литров в 300-литровом ферментационном чане. Для контроля за пенообразованием во время ферментации применялся пеногаситель Struktol J647 (вместо Struktol J673, использованного van de Laar T et al.).
По окончании ферментации, ферментативная среда была профильтрована при 15°C (то есть, ниже температуры помутнения пеногасителя J647) для удаления дрожжевых клеток.
Микрофильтрация была осуществлена на опытной установке с керамическими мембранами Kerasep с размером пор 0,1 мкм, с использованием двух объемов диафильтрации деионизованной водой. Затем среда подвергалась ультрафильтрации, вновь при 15°C, для частичной очистки HFBII. Ультрафильтрация проводилась на 1 кДа спирально-витых полимерных мембранах Synder с трансмембранным давлением 0,9 бар и четырьмя объемами диафильтрации.
Измеренная (как описано в примере 2) концентрация пеногасителя в ферментативной среде после стадии ультрафильтрации составила 0,196 г/л. Концентрация HFBII составила 0,320 г/л, измерялась методом высокоэффективной жидкостной хроматографии (ВЭЖХ) следующим образом. Образец был разведен 60% водным раствором этанола до приблизительной концентрации 200 мкг/мл до начала анализа. Разделение методом ВЭЖХ осуществляли на колонке Vydac Protein C4 (250×4,6 мм) при 30°C. Гидрофобин определялся детекцией УФ при 214 нм, а концентрация была вычислена путем сравнения с образцами с известной концентрацией HFBII, полученных от VTT Biotechnology (Espoo, Finland).
Затем среда, очищенная от клеток, нагревалась до 50°C, поддерживалась при этой температуре 30 минут и затем фильтровалась для удаления пеногасителя (размер пор 0,2 мкм), как описано в примере 2. Количества оставшегося в фильтрате пеногасителя и HFBII измерялись, как и ранее, и приведены в Таблице 6 (колонка, озаглавленная «Стадия 1»). Затем фильтрат после первой стадии вновь нагревался до 50°C, поддерживался при этой температуре еще 30 минут, и фильтровался, как ранее. Измерялись концентрации HFBII и пеногасителя в полученном фильтрате, они также приведены в Таблице 6 («Стадия 2»).
Результаты показывают, что при выборе пеногасителя, имеющего температуру помутнения, пеногаситель может быть практически полностью удален из ферментативной среды, содержащей клетки-хозяева и пенообразующее средство, простым и удобным способом.
Различные признаки и варианты осуществления настоящего изобретения, изложенные в конкретных вышеописанных разделах, применимы, в случае необходимости, к другим разделам, с внесением соответствующих поправок. Следовательно, признаки, описанные в одном разделе, могут быть скомбинированы с признаками, описанными в других разделах, в соответствующих случаях.
Все публикации, указанные в вышеизложенном описании, включены в него полностью путем ссылки. Специалистам в данной области будут очевидны различные модификации и вариации описанных методов изобретения, не выходящие из объема настоящего изобретения. Хотя изобретение было описано в связи с конкретными предпочтительными вариантами осуществления, понятно, что заявленное изобретение не ограничено такими конкретными примерами. В действительности, различные модификации описанных вариантов выполнения изобретения, очевидные специалистам в соответствующих областях техники, входят в объем прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПИВОВАРЕНИЯ | 2010 |
|
RU2531522C2 |
| ВАРИАНТЫ АЛЬФА-АМИЛАЗЫ BACILLUS LICHENIFORMIS С ПОВЫШЕННОЙ ТЕРМОСТАБИЛЬНОСТЬЮ И/ИЛИ СНИЖЕННОЙ КАЛЬЦИЕВОЙ ЗАВИСИМОСТЬЮ | 2008 |
|
RU2469087C2 |
| ВАРИАНТЫ АЛЬФА-АМИЛАЗЫ TS-23 С ИЗМЕНЕННЫМИ СВОЙСТВАМИ | 2009 |
|
RU2526516C2 |
| КОМПОЗИЦИИ ГЛЮКАНА | 2007 |
|
RU2490279C2 |
| НАПИТОК, СПОСОБ ЕГО ПОЛУЧЕНИЯ, СПОСОБ ПОЛУЧЕНИЯ ПИВА И ПЕНООБРАЗУЮЩАЯ ДОБАВКА В НАПИТОК | 1994 |
|
RU2145974C1 |
| АЭРИРОВАННЫЕ ПРОДУКТЫ С НЕПРЕРЫВНОЙ ЖИРОВОЙ ФАЗОЙ | 2008 |
|
RU2476127C2 |
| СПОСОБ ПОЛУЧЕНИЯ СУБСТАНЦИИ L-ЛИЗИН-АЛЬФА-ОКСИДАЗЫ | 2011 |
|
RU2471866C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИДКОГО МИЦЕЛИЯ ДЛЯ ИСПОЛЬЗОВАНИЯ В ОБОГАЩЕНИИ БЕЛКОМ КОРМОВ ДЛЯ ЖИВОТНЫХ | 2011 |
|
RU2498558C2 |
| ПРИМЕНЕНИЕ АКТИВНОСТИ ЭНДОГЕННОЙ ДНКАЗЫ ДЛЯ ПОНИЖЕНИЯ СОДЕРЖАНИЯ ДНК | 2012 |
|
RU2642290C2 |
| КОМПОЗИЦИЯ ПЕНОГАСИТЕЛЯ И СПОСОБЫ ЕЕ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2011 |
|
RU2495901C2 |
Изобретение относится к области биохимии. Предложен способ получения пенообразующего средства. Способ включает культивирование в ферментативной среде микроорганизма, клетки которого внеклеточно продуцирует пенообразующее средство. При этом ферментативная среда содержит пеногаситель, который имеет температуру помутнения. Затем осуществляют удаление пеногасителя при температуре ферментативной среды не менее чем на 10°C выше температуры помутнения пеногасителя. Способ позволяет упростить удаление пеногасителя из ферментативной среды. 14 з.п. ф-лы, 2 ил., 6 табл., 4 пр.
1. Способ получения пенообразующего средства, включающий:
i) культивирование микроорганизма в ферментативной среде, клетка которого внеклеточно продуцирует пенообразующее средство, а ферментативная среда содержит пеногаситель, который имеет температуру помутнения;
ii) удаление пеногасителя при температуре ферментативной среды не менее чем на 10°C выше температуры помутнения пеногасителя.
2. Способ по п.1, в котором на стадии i) ферментативную среду аэрируют путем введения в нее воздуха или воздуха, обогащенного кислородом.
3. Способ по п.1, в котором на стадии i) температура ферментативной среды выше температуры помутнения пеногасителя.
4. Способ по любому из пп.1-3, в котором на стадии ii) пеногаситель удаляют с помощью фильтрации, центрифугирования или адсорбции.
5. Способ по п.4, в котором пеногаситель удаляют путем фильтрации через полупроницаемую мембрану.
6. Способ по любому из пп.1-3, 5, в котором не менее 75% пеногасителя удаляют на стадии ii).
7. Способ по любому из пп.1-3, 5, в котором микроорганизмы удаляются из ферментативной среды на стадии ii).
8. Способ по любому из пп.1-3, 5, в котором пенообразующее средство очищают и/или концентрируют из ферментативной среды после стадии ii).
9. Способ по любому из пп.1-3, 5, в котором пеногаситель является пищевым.
10. Способ по любому из пп.1-3, 5, в котором пеногаситель содержит не менее одного неионного поверхностно активного вещества/полимера.
11. Способ согласно п.10, в котором пеногаситель представляет собой полиэфир, поли(алкиленгликоль), блочный сополимер этиленпропилен оксида, полиспирт на основе блочного сополимера этиленпропилен оксида, полиэфирную дисперсию на основе полипропиленгликоля или алкоксилированный сложный эфир жирной кислоты.
12. Способ по любому из пп.1-3, 5, 11, в котором пенообразующее средство является пищевым.
13. Способ по любому из пп.1-3, 5, 11, в котором пенообразующее средство является гидрофобином.
14. Способ по любому из пп.1-3, 5, 11, в котором микроорганизм является генетически модифицированным грибом.
15. Способ по любому из пп.1-3, 5, 11, в котором весовое отношение пеногасителя к пенообразующему средству после стадии ii) составляет менее 0,2.
| US 4931397 A, 05.06.1990 | |||
| Многоступенчатый электростатический сепаратор для отделения из раздробленной руды драгоценных металлов и редких элементов | 1956 |
|
SU114521A2 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИБИОТИКА | 1990 |
|
RU2029783C1 |
| COLLEN A | |||
| ET AL: "A novel two-step extraction method with detergent/polymer systems for primary recovery of the fusion protein endoglucanase I-hydrophobin I" // BIOCHIMICA ET BIOPHYSICA ACTA, vol.1569, no.1-3, 15 January 2002, pp.139-150 | |||
| BAILEY M.J | |||
| ET AL | |||
| Process | |||
Авторы
Даты
2013-05-10—Публикация
2008-10-16—Подача