Настоящее изобретение относится к новому применению, прежде всего к новому применению соединения из группы, включающей рапамицин и его производные.
Рапамицин представляет собой известный макролидный антибиотик, продуцируемый Streptomyces hygroscopicus. Пригодные производные рапамицина включают, например, соединения формулы I
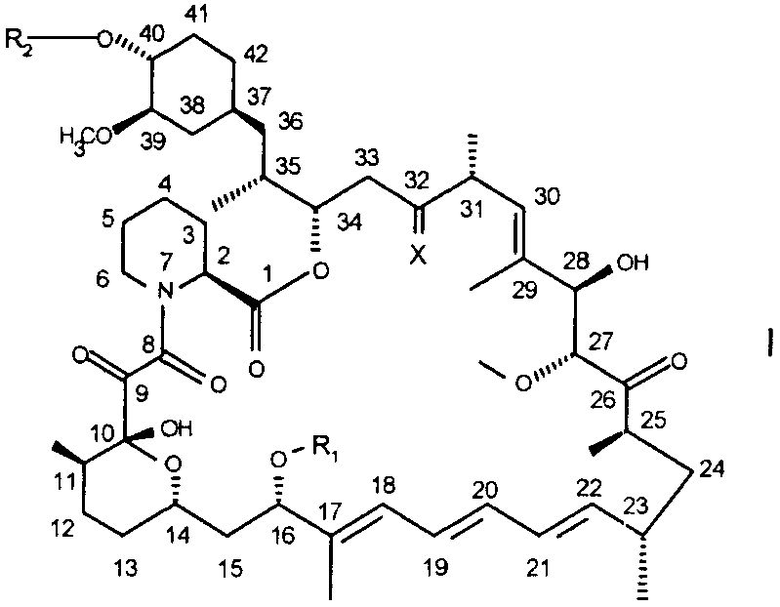
где
R1 обозначает CH3 или C3-C6алкинил,
R2 обозначает H или -CH2-CH2-OH и
X обозначает =O, (H, H) или (H, OH)
при условии, что R2 отличен от H, если X обозначает =O и R1 обозначает CH3.
Соединения формулы I описаны в WO 94/09010, WO 95/16691 или WO 96/41807, содержание которых включено в настоящее описание в качестве ссылки. Их можно получать согласно изложенным в настоящем описании методам или аналогично методам, описанным в указанных ссылках.
Предпочтительными соединениями являются 32-дезоксорапамицин, 16-пент-2-инилокси-32-дезоксорапамицин, 1 6-пент-2-инилокси-32(S)-дигидрорапамицип, 16-пент-2-инилокси-32(S)-дигидро-40-O-(2-гидроксиэтил)рапамицин и более предпочтительным является 40-O-(2-гидроксиэтил)рапамицин (обозначенный ниже в настоящем описании как соединение А), описанный в примере 8 WO 94/09010.
Было установлено, что соединения формулы I благодаря присущей им активности, например, в отношении связывания с макрофилином-12 (также обозначенный как связывающий протеин FK-506 или FKBP-12), например, как это описано в WO 94/09010, WO 95/16691 или WO 96/41807, можно применять в качестве иммунодепрессантов, например, при лечении острого отторжения аллотрансплантата. При создании настоящего изобретения было установлено, что соединения формулы I обладают выраженными антипролиферативными свойствами, благодаря чему их можно применять при химиотерапии рака, в частности плотных опухолей, прежде всего развитых плотных опухолей. В настоящее время все еще существует необходимость в разработке средств лечения злокачественных плотных опухолей, прежде всего в тех случаях, когда лечение с использованием противораковых соединений не обеспечивает регрессию или стабилизацию заболевания.
Согласно настоящему изобретению предложено:
Применение производных рапамицина для приготовления фармацевтической композиции, предназначенной для ингибирования или профилактики нарушенной регуляции ангиогенеза или для лечения заболеваний, связанных с нарушенной регуляцией ангиогенеза;
Фармацевтическая комбинация, включающая а) первый агент, представляющий собой производное рапамицина формулы I по п.1, и б) коагент, представляющий собой химиотерапевтический агент, выбранный из
II. антиандрогена или агониста гонадорелина,
III. ингибитора топоизомеразы I и
IV. алкилирующего агента или содержащего платину соединения;
Фармацевтическая комбинация, включающая а) первый агент, представляющий собой производное рапамицина формулы I по п.1, и б) коагент, представляющий собой химиотерапевтический агент, выбранный из
III. ингибитора топоизомеразы II, выбранного из антрациклина, митоксантрона и изоксантрона,
IV. агента, обладающего активностью в отношении микротрубочек или антинеопластического антиметаболита,
V. соединения, обладающего способностью воздействовать на/понижать активность протеин- или липидкиназы, или протеин- или липидфосфатазы, другого антиангиогенного соединения или соединения, индуцирующего процессы дифференцировки клеток,
VI. антагониста рецептора брадикинина 1 или ангиотензина II,
VII. ингибитора циклооксигеназы, бисфосфоната, ингибитора гистондеацетилазы, ингибитора гепараназы, модификатора биологической реакции, ингибитора убиквитина или ингибитора, блокирующего антиапоптозные пути,
VIII. ингибитора онкогенных изоформ Ras,
IX. ингибитора теломеразы, и
X. ингибитора протеазы, ингибитора матриксной металлопротеазы, ингибитора метионинаминопептидазы или ингибитора протеосомы;
Фармацевтическая комбинация, включающая а) первый агент, представляющий собой рапамицин, и б) коагент, представляющий собой химиотерапевтический агент, выбранный из ингибитора VEGF рецептора тирозинкиназы, ингибитора EGF, ErbB2, ErbB3 или ErB4 рецепторов тирозинкиназы и ингибитора PDGF рецептора;
Фармацевтическая комбинация, включающая а) первый агент, представляющий собой производное рапамицина, и б) коагент, выбранный из бусульфана, цитарабина, 6-тиогуанина, флударабина гидроксимочевины, прокарбазипа, блеомицина, метотрексата, ингибитора топоизомеразы II или соединения, которое направленно действует, понижает или ингибирует активность PDGFR или представителей семейства c-AbI, предназначенная для приготовления лекарственного средства для лечения опухолей кровеносной или лимфатической системы.
В контексте настоящего изобретения понятие «плотные опухоли» обозначает опухоли и/или метастаз (в том случае, если он возникает), отличные от рака лимфатической системы, например опухоли головного мозга и другие опухоли центральной нервной системы (например, опухоли оболочек головного мозга, спинного мозга, краниальных нервов и других отделов центральной нервной системы, например глиобластом или бластом мозгового вещества); рак головы и/или шеи; различные виды опухолей молочной железы; опухоли системы кровообращения (например, сердца, средостения и плевры, а также других находящихся в грудной клетке органов, опухоли сосудов и ткани пораженных опухолью сосудов); опухоли выделительной системы (например, почек, почечной лоханки, мочеточника, мочевого пузыря, других и неспецифических органов мочевой системы); опухолей желудочно-кишечного тракта (например, пищевода, желудка, тонкого кишечника, ободочной кишки, прямой и ободочной кишки, ректосигмоидного сращения, прямой кишки, ануса или анального канала), опухоли, поражающие печень и находящиеся внутри печени желчные каналы, желчный пузырь, другие и неспецифические отделы желчного тракта, поджелудочную железу, другие органы пищеварительной системы; опухоли головы и шеи; ротовой полости (губы, язык, десны, дно полости рта, небо и другие области рта, околоушная железа и другие части слюнных желез, миндалина, ротоглотка, носоглотка, грушевидный карман, гипофаринкс и другие участки губ, ротовой полости и глотки); опухоли репродуктивной системы (например, вульвы, влагалища, шейки матки, тела матки, яичника и других областей женских половых органов, плаценты, пениса, предстательной железы, яичек и других областей мужских половых органов); опухоли дыхательного тракта (например, носовой полости и среднего уха, вторичного синуса, гортани, трахеи, бронхов и легкого, например мелкоклеточпый рак легкого или немелкоклеточный рак легкого); опухоли скелетной системы (например, костного и суставного хряща конечностей, костного суставного хряща и других областей); кожные опухоли (например, злокачественная меланома кожи, рак кожи, не связанный с меланомой, карцинома базальных клеток кожи, плоскоклеточная карцинома кожи, мезотелиома, саркома Капоши) и опухоли, поражающие другие ткани, включая периферические нервы и автономную нервную систему, соединительную и мягкую ткань, забрюшинное пространство и брюшину, глаз и прилежащие органы, щитовидную железу, надпочечник и другие эндокринные железы и связанные с ними структуры, злокачественный опухолевый метастаз и неспецифическую злокачественную опухоль лимфатических узлов, злокачественный опухолевый метастаз дыхательной и пищеварительной систем и злокачественный метастаз в других областях.
Если выше или ниже в настоящем описании упоминаются опухоль, заболевание, связанное с опухолью, карцинома или рак, то при этом подразумеваются альтернативно или дополнительно также метастазы в указанном органе или ткани и/или в других областях, в которых имеются опухоль и/или метастазы.
В настоящем описании также охарактеризованы:
1.6. Способ лечения заболевания, связанного с нарушением ангиогенеза у пациента, нуждающегося в таком лечении, заключающийся в том, что пациенту вводят терапевтически эффективное количество рапамицина или его производного, например CCI779, АВТ578 или соединения формулы I.
1.7. Способ ингибирования или контроля нарушением ангиогенеза у пациента, нуждающегося в таком лечении, заключающийся в том, что пациенту вводят терапевтически эффективное количество рапамицина или его производного, например CCI779, АВТ578 или соединения формулы I.
1.8. Способ повышения активности химиотерапевтического агента или преодоления устойчивости к химиотерапевтическому агенту у пациента, нуждающегося в этом, заключающийся в том, что пациенту вводят терапевтически эффективное количество рапамицина или его производного, например CCI779, АВТ578 или соединения формулы I, либо одновременно с введением химиотерапевтического агента, либо после такого введения.
1.9. Способ по п.1.8, где химиотерапевтический агент представляет собой ингибитор путей трансдукции сигнала, который направлен либо на клетки-хозяева, либо на процессы, участвующие в образовании опухоли и/или образовании метастазов, или которые используются опухолевыми клетками для пролиферации, выживания, дифференцировки или развития устойчивости к лекарственным средствам.
1.10. Указанный выше способ, согласно которому рапамицин или его производное, например CCI779, АВТ578, или соединение формулы I, вводят периодически. CCI779 представляет собой производное рапамицина, а именно 40-[3-гидрокси-2-(гидроксиметил)-2-метилпропаноат]рапамицин или его фармацевтически приемлемую соль, и он описан, например, в патенте US 5362718. АВТ578 представляет собой 40-замещенное производное рапамицина, в котором дополнительно восстановлен диеновый фрагмент.
Примеры заболеваний, связанных с нарушением ангиогенеза, включают (но не ограничиваясь ими), например, опухолевые заболевания, например плотные опухоли. Считается, что ангиогенез является предпосылкой для развития опухолей, размер которых превышает определенный диаметр, например приблизительно 1-2 мм.
Кроме того, в настоящем описании охарактеризованы:
2.1. Соединение формулы I, предназначенное для применения согласно способу по указанным выше пп.1.1-1.5.
2.2. Рапамицин или его производное, например CCI779, АВТ578 или соединение формулы I, предназначенные для применения согласно любому из способов по указанным выше пп.1.6-1.10 или указанному ниже п.7.
3.1. Соединение формулы I для приготовления фармацевтической композиции, предназначенной для применения согласно любому из способов по указанным выше пп.1.1-1.5.
3.2. Рапамицин или его производное, например CCI779, АВТ578 или соединение формулы I, для приготовления фармацевтической композиции, предназначенной для применения согласно любому из способов по указанным выше пп.1.6-1.10 или указанному ниже п.7.
4.1. Фармацевтическая композиция, предназначенная для применения согласно любому из способов по указанным выше пп.1.1-1.5, содержащая соединение формулы I наряду с одним или несколькими фармацевтически приемлемыми разбавителями или носителями.
4.2 Фармацевтическая композиция, предназначенная для применения согласно любому из способов по указанным выше пп.1.6-1.10 или указанному ниже п.7, содержащая рапамицин или его производное, например CCI779, АВТ578 или соединение формулы I, например соединение А, наряду с одним или несколькими фармацевтически приемлемыми разбавителями или носителями.
5.1. Фармацевтическая композиция, содержащая а) первый агент, представляющий собой рапамицин или его производное, например CCI779, АВТ578 или соединение формулы I, например соединение А, и б) коагент, представляющий собой химиотерапевтический агент, например указанный ниже агент.
5.2. Фармацевтическая композиция, содержащая необходимое для обеспечения синергетического терапевтического действия количество а) первого агента, представляющего собой рапамицин или его производное, например CCI779, АВТ578 или соединение формулы I, например соединение А, и б) коагента, представляющего собой химиотерапевтический агент, выбранный из соединений, указанных ниже в разделе (IV) или (V).
6. Способ как он указан выше, заключающийся в совместном введении, например одновременно или последовательно, терапевтически эффективного количества рапамицина или его производного, например CCI779, АВТ578 или соединения формулы I, например соединения А, и второго лекарственного средства, представляющего собой указанный выше химиотерапевтический агент.
7. Способ лечения лимфопролиферативных нарушений, возникающих после трансплантации, или лимфатического рака, например для лечения развития опухоли или симптомов, связанных с ростом опухоли у пациента, который нуждается в этом, заключающийся в том, что пациенту вводят одновременно или последовательно рапамицин или его производное, например CCI779, АВТ578 или соединение формулы I, например соединение А, и второе лекарственное средство, представляющее собой, например, указанный выше химиотерапевтический агент.
Понятие «лимфатический рак» обозначает опухоли кровеносной и лимфатической систем (например, болезнь Ходжкина, неходжкинскую лимфому, лимфому Беркитта, лимфомы, связанные со СПИДом, злокачественные иммунопролиферативные заболевания, множественную миелому и злокачественные неоплазмы клеток плазмы, лимфоидную лейкемию, миелоидную лейкемию, острую или хроническую лимфоцитарную лейкемию, моноцитарную лейкемию, другие виды лейкемий определенных типов клеток, лейкемию клеток неопределенного типа, другие и неопределенные злокачественные неоплазмы лимфоидной, гематопоэтической и родственных им тканей, например диффузную крупноклеточную лимфому, лимфому Т-клеток или лимфому кожных Т-клеток).
Понятие «химиотерапевтический агент» обозначает, в частности, любой химиотерапевтический агент, отличный от рапамицина или его производного. Оно включает (но не ограничиваясь ими):
I. ингибитор ароматазы,
II. антиэстроген, антиандроген (прежде всего в случае рака предстательной железы) или агонист гонадорелина,
III. ингибитор топоизомеразы I или ингибитор топоизомеразы II,
IV. агент, обладающий активностью в отношении микротрубочек, алкилирующий агент, антинеопластический антиметаболит или содержащее платину соединение,
V. соединение, обладающее способностью воздействовать на/понижать активность протеин- или липидкиназы или протеин- или липидфосфатазы, другое антиангиогенное соединение или соединение, индуцирующее процессы дифференцировки клеток,
VI. рецептор брадикинина 1 или антагонист ангиотензина II,
VII. ингибитор циклооксигеназы, бисфосфонат, ингибитор деацетилазы гистона, ингибитор гепараназы (препятствует разложению гепарансульфата), например PI-88, модификатор биологической реакции, предпочтительно лимфокин или интерфероны, например интерферон γ, ингибитор убиквитина или ингибитор, блокирующий антиапоптозные пути,
VIII. ингибитор онкогенных изоформ Ras, например H-Ras, K-Ras или N-Ras, или ингибитор фарнезилтрансферазы, например L-744,832 или DK8G557,
IX. ингибитор теломеразы, например теломестатин,
X. ингибитор протеазы, например ингибитор матричной металлопротеазы, ингибитор метионинаминопептидазы, например бенгамид или его производное, или ингибитор протеосомы, например PS-341.
В контексте настоящего описания понятие «ингибитор ароматазы» обозначает соединение, которое ингибирует производство эстрогена, т.е. превращение субстратов, представляющих собой андростенедион и тестостерон, соответственно в эстрон и эстрадиол. Понятие включает (но не ограничиваясь ими) стероиды, прежде всего атаместан, экземестан и форместан, а также, в частности, нестероиды, прежде всего аминоглутетимид, роглетимид, пиридоглутетимид, трилостан, тестолактон, кетоконазол, ворозол, фадрозол, апастрозол и летрозол. Экземестан можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком AROMASIN™. Форместан можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком LENTARON™. Фадрозол можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком AFEMA™. Анастрозол можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком ARIMIDEX™. Летрозол можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком FEMARA™ или FEMAR™. Аминоглутетимид можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком ORIMETEN™. Композицию по изобретению, содержащую химиотерапевтический агент, который представляет собой ингибитор ароматазы, можно применять, в частности, для лечения опухолей, позитивных в отношении рецепторов гормона, например опухолей молочной железы.
В контексте настоящего описания понятие «антиэстроген» относится к соединениям, которые препятствуют действию эстрогена на уровне рецептора эстрогена. Это понятие включает (но не ограничиваясь ими) тамоксифен, фулвестрант, ралоксифен и гидрохлорид ралоксифена. Тамоксифен можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком NOLVADEX™. Гидрохлорид ралоксифена можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком EVISTA™. Фулвестрант можно применять в виде композиции, которая описана в патенте US 4659516, или можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком FASLODEX™. Композицию по изобретению, содержащую химиотерапевтический агент, который представляет собой антиэстроген, можно применять, в частности, для лечения опухолей, позитивных в отношении рецепторов гормона, например опухолей молочной железы.
В контексте настоящего описания понятие «антиандроген» обозначает любую субстанцию, которая обладает способностью ингибировать биологические действия андрогенных гормонов и включает (но не ограничиваясь им) бикалутамид (CASODEX™), композицию, которую можно приготавливать, например, согласно методу, описанному в патенте US 4636505.
В контексте настоящего описания понятие «агонист гонадорелина» включает (но не ограничиваясь ими) абареликс, госерелин и ацетат госерелина. Госерелин описан в патенте US 4100274 и его можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком ZOLADEX™.
Композицию, содержащую абареликс, можно получать, например, согласно методу, описанному в патенте US 5843901.
В контексте настоящего описания понятие «ингибитор топоизомеразы I» включает (но не ограничиваясь ими) топотекан, иринотекан, 9-нитрокамптотецин и макромолекулярный конъюгат камптотецина PNU-166148 (в WO 99/17804 обозначен как соединение А1). Иринотекан можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком CAMPTOSAR™. Топотекан можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком HYCAMTIN™.
В контексте настоящего описания понятие «ингибитор топоизомеразы II» включает (но не ограничиваясь ими) антрациклины, такие как доксорубицин (включая липосомные композиции, например CAELYX™), даунорубицин, эпирубицин, идарубицин и неморубицин, антрахиноны митоксантрон и лозоксантрон и подофиллотоксины этопозид и тенипозид. Этопозид можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком ETOPOPHOS™. Тенипозид можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком VM 26-BRISTOL™. Доксорубицин можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком ADRIBLASTIN™. Эпирубицин можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком FARMORUBICIN™. Идарубицин можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком ZAVEDOS™. Митоксантрон можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком NOVANTRON™.
Понятие «агент, обладающий активностью в отношении микротрубочек», обозначает стабилизирующие микротрубочки и дестабилизирующие микротрубочки агенты, включая (но не ограничиваясь ими) таксаны, например паклитаксел и доцетаксел, винка-алкалоиды, например винбластин, прежде всего сульфат винбластина, винкристин, прежде всего сульфат винкристина и винорелбин, дискодермолиды и эпотилоны и их производные, например эпотилон Б или его производные. Паклитаксел можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком TAXOL™. Доцетаксел можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком TAXOTERE™. Сульфат винбластина можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком VINBLASTIN R.P.™. Сульфат винкристина можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком FARMISTIN™. Дискодермолид можно получать, например, согласно методу, описанному в патенте US 5010099.
В контексте настоящего описания понятие «алкилирующий агент» включает (но не ограничиваясь ими) циклофосфамид, ифосфамид, мелфалан или нитрозомочевину (BCNU или Gliadel™). Циклофосфамид можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком CYCLOSTIN™. Ифосфамид можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком HOLOXAN™.
Понятие «противоопухолевый антиметаболит» включает, но не ограничиваясь ими, 5-флуорацил, капецитабин, гемцитабин, метотрексат и эдатрексат. Капецитабин можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком XELODA™. Гемцитабин можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком GEMZAR™.
В контексте настоящего изобретения понятие «содержащее платину соединение» включает (но не ограничиваясь ими) карбоплатип, цисплатин и оксалиплатин. Карбоплатип можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком CARBOPLAT™. Оксалиплатин можно применять, например, в форме, в которой он поступает в продажу, например, под товарным знаком ELOXATIN™.
В контексте настоящего описания понятие «соединения, обладающие способностью воздействовать на/понижать активность протеин- или липидкиназы, или другие антиангиогенные соединения» включают (но не ограничиваясь ими) ингибиторы протеинтирозинкиназы и/или серии- или треонинкиназы или ингибиторы липидкиназы, например соединения, обладающие способностью воздействовать, понижать или ингибировать активность рецепторов тирозинкиназ из семейства эпидермальных факторов роста (EGFR, ErbB2, ErbB3, ErbB4, представляющих собой как гомо-, так и гетеродимеры), рецепторов тирозинкиназ из семейства сосудистых эндотелиальных факторов роста (VEGFR), рецепторов тромбоцитарного фактора роста (PDGFR), рецепторов фактора роста фибробластов (FGFR), рецептора инсулинподобного фактора роста 1 (IGF-1R), семейства рецепторов тирозинкиназы Trk, семейства рецепторов тирозинкиназы Axl, семейства рецепторов тирозинкиназы Ret, рецепторов тирозинкиназы Kit/SCFR, представителей семейства c-Abl и продуктов слияния их генов (например, BCR-Abl), представителей семейства протеинкиназ С (PKC) и семейства серин/треонинкиназ Raf, представителей семейства киназ МЕК, SRC, JAK, FAK, PDK или PI(3) или семейства киназ, родственных киназе PI(3), и/или представителей семейства зависящих от циклина киназ (CDK) и антиангиогенных соединений, обладающих другим механизмом действия, например, не связанным с ингибированием протеин- или липидкиназы.
Соединения, которые воздействуют, понижают или ингибируют активность VEGFR, представляют собой прежде всего соединения, протеины или антитела, которые ингибируют тирозинкиназный рецептор VEGF, ингибируют рецептор VEGF или связываются с VEGF и представляют собой, в частности, соединения, протеины или моноклональные антитела, которые описаны в целом и конкретно в WO 98/35958, например 1-(4-хлоранилино)-4-(4-пиридилметил)фталазин или его фармацевтически приемлемую соль, например сукцинат, или в WO 00/09495, WO 00/27820, WO 00/59509, WO 98/11223, WO 00/27819 и ЕР 0769947, которые описаны М. Prewett и др. в Cancer Research 59 (1999), с. 5209-5218, F. Yuan и др. в Proc. Natl. Acad. Sci. USA, том 93, с. 14765-14770, декабрь 1996, Z. Zhu и др. в Cancer Res. 58 (1998), с. 3209-3214 и J. Mordenti и др. в Toxicologic Pathology, том 27, №1 (1999), с. 14-21; в WO 00/37502 и WO 94/10202; Angiostatin™, описан М.S.O'Reilly и др. Cell 79 (1994), c.315-328; Endostatin™, описан M.S.O'Reilly и др. Cell 88 (1997) c. 277-285; амиды антраниловой кислоты ZD4190; ZD6474; SU5416; SU6668 или антитела к VEGF, или антитела к рецептору VEGF, например RhuMab.
В контексте настоящего описания понятие «антитело» обозначает интактные моноклональные антитела, поликлональные антитела, мультиспецифические антитела, образованные по меньшей мере из двух интактных антител, и фрагменты антител, если они обладают требуемой биологической активностью.
Соединения, которые воздействуют, понижают или ингибируют активность семейства рецепторов эпидермального фактора роста, представляют собой прежде всего соединения, протеины или антитела, которые обладают способностью ингибировать активность представителей семейства рецепторов тирозинкиназы EGF, например рецептора EGF, ErbB2, ErbB3 и ErbB4 или связываться с EGF или родственными с EGF лигандами, и они представляют собой, в частности, соединения, протеины или моноклональные антитела, которые в целом и конкретно описаны в WO 97/02266, например соединение из примера 39, или в ЕР 0564409, WO 99/03854, ЕР 0520722, ЕР 0566226, ЕР 0787722, ЕР 0837063, патенте US 5747498, WO 98/10767, WO 97/30034, WO 97/49688, WO 97/38983 и, в частности, в WO 96/30347 (например, соединение, известное под названием СР 358774), WO 96/33980 (например, соединение ZD 1839) и WO 95/03283 (например, соединение ZM105180); например трастузумаб (Herpetin®), цетуксимаб, Иресса, OSI-774, CI-1033, ЕКВ-569, GW-2016, E1.1, Е2.4, Е2.5, Е6.2, Е6.4, Е2.11, Е6.3 или Е7.6.3.
Соединения, которые воздействуют, понижают или ингибируют активность PDGFR, представляют прежде всего соединения, которые ингибируют рецептор PDGF, например производное Н-фенил-2-пиримидинамина, например иматиниб.
Соединения, которые воздействуют, понижают или ингибируют активность представителей семейства c-AbI и продуктов, образованных в результате слияния их генов, представляют собой, например, производное N-фенил-2-пиримидинамина, например иматиниб, PD 180970, AG957 или NSC 680410.
Соединения, которые воздействуют, понижают или ингибируют активность представителей семейства протеинкиназ С, Raf, MEK, SRC, JAK, FAK и PDK, или представителей семейства киназы PI(3), или представителей родственных PI(3) семейств и/или представителей семейства зависящих от циклина киназ (CDK), представляют собой прежде всего производные стауроспорипа, описанные в ЕР 0296110, например мидостаурин; примерами других соединений являются, например, UCN-01, сафингол, BAY 43-9006, бриостатин 1, перифосин; илмофосин; RO 318220 и RO 320432; GO 6976; Isis 3521 или LY333531/LY379196.
Другими антиангиогенными соединениями являются, например, талидомид (THALOMID) и TNP-470.
Соединениями, которые воздействуют, понижают или ингибируют активность протеиновых или липидных фосфатаз, являются, например ингибиторы фосфатазы 1, фосфатазы 2А, PTEN или CDC25, например, окадаевая кислота или ее производные.
Соединениями, индуцирующими процессы дифференцировки, являются, например, ретиноевая кислота, α-, γ- или δ-токоферол или α-, γ- или δ-токотриенол.
В контексте настоящего описания понятие «ингибитор циклооксигеназы» включает (но не ограничиваясь ими) целекоксиб (CelebrexR), рофекоксиб (VioxxR), эторикоксиб, валдекоксиб или 5-алкил-2-ариламинофенилуксусную кислоту, например 5-метил-2-(2'-хлор-6'-фторанилино)фенилуксусную кислоту.
В контексте настоящего описания понятие «ингибитор гистондеацетилазы» включает (но не ограничиваясь ими) MS-27-275, SAHA, пироксамид, FR-901228 или валпроевую кислоту.
В контексте настоящего описания понятие «бисфосфонаты» включает (но не ограничиваясь ими) этридоновую, клодроновую, тилудроновую, памидроновую, алендроновую, ибандроновую, ризедроновую и золедроновую кислоту. Этридоновую кислоту можно применять, например, в форме, в которой она поступает в продажу, например, под товарным знаком DIDRONEL™. Клодроновую кислоту можно применять, например, в форме, в которой она поступает в продажу, например, под товарным знаком BONEFOS™. Тилудроповую кислоту можно применять, например, в форме, в которой она поступает в продажу, например, под товарным знаком SKELID™. Памидроновую кислоту можно применять, например, в форме, в которой она поступает в продажу, например, под товарным знаком AREDIA™. Алендроновую кислоту можно применять, например, в форме, в которой она поступает в продажу, например, под товарным знаком FOSAMAX™. Ибандроновую кислоту можно применять, например, в форме, в которой она поступает в продажу, например, под товарным знаком BONDRANAT™. Ризедроновую кислоту можно применять, например, в форме, в которой она поступает в продажу, например, под товарным знаком ACTONEL™. Золедроновую кислоту можно применять, например, в форме, в которой она поступает в продажу, например, под товарным знаком ZOMETA™.
В контексте настоящего описания понятие «ингибитор матричной металлопротеазы» включает (но не ограничиваясь ими) коллагеновые ингибиторы из класса пептидомиметиков и непептидомиметиков, производные тетрациклина, например гидроксаматный ингибитор из класса пептидомиметиков батимастат и его аналоги, обладающие биологической доступностью при введении пероральным путем, маримастат, приномастат, BMS-279251, BAY 12-9566, ТАА211 или AAJ996.
Следует иметь в виду, что в каждом случае, когда цитируются заявки на патент или научные публикации, подразумевается, что объект, касающийся соединений, включен в настоящее описание в качестве ссылки. Равным образом это относится к их фармацевтически приемлемым солям, соответствующим рацематам, диастереоизомерам, энантиомерам, таутомерам, а также к соответствующим кристаллическим модификациям описанных выше соединений, если они существуют, например к сольватам, гидратам и полиморфам, указанным в настоящем описании. Соединения, применяемые в качестве действующих веществ в композициях по изобретению, соответственно можно получать и применять, как описано в процитированных документах. Под объем настоящего изобретения подпадает также композиция, содержащая более двух различных указанных выше действующих веществ, т.е. фармацевтическая композиция по настоящему изобретению может содержать три или более действующих вещества. Кроме того, основной агент и вспомогательный агент (коагент) представляют собой различные вещества.
Применимость соединений формулы I для лечения указанных выше плотных опухолей можно продемонстрировать в опытах на животных, а также в клинических опытах, например, проводимых согласно описанным ниже методам.
А. Исследования in vitro
А.1 Антипролиферативная активность в сочетании с другими агентами
Клетки линии А549, устойчивой к действию соединения А (которая характеризуется значением IC50, находящимся в диапазоне низких наномолярных концентраций), и используемые для сравнения устойчивые к действию соединения А клетки линий КВ-31 и НСТ116 (которые характеризуются значением IC50, находящимся в диапазоне микромолярных концентраций) вносят в 96-луночные планшеты (1500 клеток/лунку в 100 мкл среды) и инкубируют в течение 24 ч. Затем в различных пробирках готовят двукратные серийные разведения каждого соединения (соединения формулы I или известного химиотерапевтического агента) (начиная с концентрации, равной 8×IC50 для каждого соединения) либо индивидуально, либо в виде парных комбинаций, и соответствующие разведения вносят в лунки. Затем клетки подвергают повторной инкубации в течение 3 дней. В день 4 осуществляют окрашивание метиленовым синим и оценивают количество связанного красителя (которое пропорционально количеству выживших клеток, связывающих краситель). После этого определяют значения IC50 с помощью программы Calcusyn, которые характеризуют степень взаимодействия, а именно так называемый коэффициент неэксклюзивности комбинации (CI), где: CI ~1 означает, что взаимодействие является практически аддитивным; 0,85-0,9 означает наличие слабого синергетического действия; <0,85 означает наличие синергетического действия. Результаты этого анализа свидетельствуют о том, что соединения формулы I обладают выраженной антипролиферативной активностью при использовании в сочетании с другим химиотерапевтическим агентом. Например, для комбинаций, включающих соединение А и цисплатин, паклитаксел, гемцитабин и доксорубицин, были получены следующие значения CI, свидетельствующие о наличии синергетического действия.
Кроме того, результаты данного анализа свидетельствуют о том, что соединение А, применяемое в сочетании с гемцитабином, стимулирует уменьшение жизнеспособности клеток линии А549 и гибель клеток.
А.2 Антиангиогенная активность
По данным анализа in vitro антипролиферативной активности рапамицина или его производного, например соединения А, в отношении эндотелиальных клеток пупочной вены человека (HUVEC) значения IC50 составляют соответственно 120±22 пМ и 841±396 и >10000 пМ для стимулированной VEGF и bFGF и FBS пролиферации. Кроме того, в этом диапазоне концентраций не обнаружено заметных воздействий соединения А на стимулируемую bFGF пролиферацию здоровых фибробластов кожи человека (NHDF). Эти результаты свидетельствуют о том, что соединение А ингибирует пролиферацию HUVEC, причем оно обладает наиболее выраженной активностью в отношении индуцированной VEGF пролиферации, при которой VEGF является имеющим решающее значение проангиогенным фактором.
Б. Исследования in vivo
В описанных ниже анализах противоопухолевую активность оценивают в виде Т/С% (среднее увеличение объемов опухолей у обработанных животных, деленное на среднее увеличение объемов опухолей у контрольных животных, умноженное на 100) и % регрессий (объем опухоли минус исходный объем опухоли, деленный на исходный объем опухоли и умноженный на 100).
Б.1 Активность в отношении ксенотрансплантатов клеток линии А549 опухоли легкого человека
Фрагменты опухолей линии А549 (массой приблизительно 25 мг, полученные из линии клеток CCL 185, АТСС, Роквилл, штат Мэриленд, США) трансплантируют подкожно в левый бок бестимусных мышей линии BALB/c. Обработку начинают па 7-й или 12-й день после трансплантации опухоли. Предназначенное для тестирования соединение вводят перорально один раз в день, начиная соответственно с 7/12 дня и до 38/55 дня. Результаты этого анализа свидетельствуют о том, что при введении в суточной дозе от 0,1 до 2,5 мг/кг соединения формулы I оказывают зависящее от дозы ингибирующее действие на рост опухоли; например, в одном репрезентативном эксперименте соединение А при введении в дозе 2,5 мг/кг вызывало постоянное уменьшение роста опухоли (41%); при введении в дозе 0,5 мг/кг вызывало кратковременное уменьшение ее роста (38% на 17-й день), при этом конечная величина Т/С составляла 16%, а при введении в дозе 0,1 мг/кг рост опухоли замедлялся, при этом конечная величина Т/С составляла 43% (Т/С для контрольных животных составляет 100%).
Б.2 Активность в отношении ксенотрансплантатов человеческой эпидермоидной опухоли линии KB-31
Фрагменты опухолей линии KB-31 (массой приблизительно 25 мг, полученные от Roswell Park Memorial Institute, Буффало, штат Нью-Йорк, США) трансплантируют подкожно в левый бок бестимусных мышей линии BALB/c. Обработку начинают на 7-й или 10-й день после трансплантации опухоли. Предназначенное для тестирования соединение вводят перорально один раз в день, начиная соответственно с 7/10 дня и до 25/35 дня. Противоопухолевую активность выражают как указано выше в виде Т/С%. Результаты этого анализа свидетельствуют о том, что при введении в суточной дозе от 0,5 до 2,5 мг/кг соединения формулы I оказывают ингибирующее действие на рост опухоли; например, в одном репрезентативном эксперименте соединение А при введении в дозе 2,5 мг/кг приводило к конечной величине Т/С, составляющей 25% (Т/С для контрольных животных составляет 100%).
Б.3 Активность в отношении опухолей поджелудочной железы линии СА20948 крыс
Опухоли создают у самцов крыс линии Lewis путем подкожной инъекции в левый бок суспензии опухолевых клеток линии СА20948, полученных от крыс-доноров. Обработку начинают на 4-й день после инокуляции. Предназначенное для тестирования соединение вводят перорально один раз в день (6 раз в неделю) с 4-го по 9-15-й день после инокуляции. Противоопухолевую активность выражают, как указано выше в виде Т/С%. Результаты этого анализа свидетельствуют о том, что при введении в суточной дозе от 0,5 до 2,5 мг/кг соединения формулы I оказывают ингибирующее действие на рост опухоли; например, в одном репрезентативном эксперименте соединение А при введении в дозе 2,5 мг/кг приводило к конечной величине Т/С, составляющей 23%. В этом же эксперименте периодическое введение соединения А в дозе 5 мг/кг дважды в неделю приводило к конечной величине Т/С, составляющей 32%. Результаты этих анализов свидетельствуют о том, что соединение А по сравнению с носителями, которые используют в качестве контролей, существенно и достоверно снижает скорость роста опухоли поджелудочной железы линии СА20948 (Т/С для контрольных животных составляет 100%).
Соединения формулы I, например соединение А, тестируют с использованием других моделей опухолей согласно описанному выше методу. Например, в опытах на модели человеческой опухоли легкого линии NCI Н-596 и модели человеческой меланомы линии MEXF 989 установлено, что при введении соединения А в суточной дозе 2,5 мг/кг или 5 мг/кг конечные величины Т/С составляют соответственно 18 и 9%, доза 5 мг/кг приводит к конечным величинам Т/С, составляющим 20% (первичная опухоль) и 36% (метастазы лимфатических узлов шейки матки) при исследовании на модели меланомы линии B16/BL6 у мыши, подвергнутой ортотопической трансплантации, и 24% при исследовании на модели человеческой опухоли поджелудочной железы линии AR42J; доза 2,5 мг/кг приводит к конечным величинам Т/С, составляющим 28%, при исследовании на модели человеческой эпидермоидной опухоли линии KB-8511, резистентной к многим лекарствам (РМЛ). Выраженные противоопухолевые реакции получают также на мышах, которым трансплантируют человеческие опухоли поджелудочной железы линии AR42J, при периодическом введении соединений формулы I, например соединения А, например, каждые два дня в неделю или дважды в неделю.
Б.4 Комбинация с доксорубицином
Мышей, которым трансплантируют человеческие эпидермоидные опухоли линии KB-31, обрабатывают в течение 21 дня доксорубицином в дозе 5 мг/кг i.v. один раз в неделю, соединением А в дозе 2,5 мг/кг р.о. один раз в день или комбинацией обоих соединений. После этого мышей в группе, подвергающейся комбинированной терапии, продолжают обрабатывать только одним соединением формулы I для того, чтобы определить, может ли соединение формулы I подавлять рост опухолей, которые чувствительны к действию обычных агентов. Противоопухолевую активность выражают, как указано выше, в виде Т/С% или % регресса. Например, комбинация соединения А и доксорубицина приводит к более выраженному противоопухолевому действию (регресс составляет 74%) по сравнению с действием каждого из агентов индивидуально (соединение А, Т/С 32%; доксорубицин, регресс 44%). При лечении доксорубицином в сочетании с соединением А не происходит потери веса тела. Продолжение лечения соединением А в группе, подвергающейся комбинированной терапии, после прекращения введения доксорубицина ингибирует рост опухоли, при этом объемы опухоли в случае монотерапии с использованием доксорубицина существенно превышают объемы опухоли в группе, подвергающейся комбинированной терапии. Кроме того, через 14 дней после окончания лечения при использовании комбинации, по-видимому, достигается более высокий коэффициент излечения (8/8 опухолей), чем при применении только одного доксорубицина (3/8 опухолей).
Б.5 Комбинация с цисплатином
Мышей, которым трансплантируют человеческие опухоли легкого линии NCI Н-596, в течение 21 дня обрабатывают один раз в неделю цисплатином в дозе 2,5 мг/кг i.v., один раз в день соединением формулы I, например соединением А, в дозе 2,5 мг/кг р.о. или комбинацией обоих соединений. Противоопухолевую активность выражают, как указано выше, в виде Т/С% или % регресса. Комбинация соединения А и цисплатина оказывает более выраженное противоопухолевое действие (5% регресс) по сравнению с действием каждого из указанных агентов индивидуально (соединение А, Т/С 26%; цисплатин, Т/С 26%). Комбинация соединений не приводит к ухудшению переносимости.
Б.6 Антиангиогенная активность
Клетки линии B16/BL6 (5×104) инъецируют интрадермально в уши мышей линии C57BL/6. Через семь дней начинают обработку рапамицином или его производным, например соединением А, или носителем. Первичную опухоль и лимфатические узлы шейки матки выделяют после ежедневной обработки в течение двух недель с целью оценки плотности сосудов. Эндотелий подвергаемых перфузии сосудов визуализируют с помощью красителя для ядер клеток (Hoechst 33342, 20 мг/кг), который инъецируют i.v. незадолго перед умерщвлением мышей. Опухоли и метастазы быстро замораживают и срезы исследуют с помощью светового микроскопа, снабженного эпифлуоресцентным источником. Флуоресценцию меченных с помощью Н33342 эндотелиальных клеток используют для оценки количества и размера сосудов во всем срезе опухоли. Сосуды разделяют по группам с интервалом размера 10 мкм. Распределение размеров сосудов оценивают с помощью частотного анализа гистограмм. При введении в дозе 5 мг/кг р.о. рапамицин или его производное вызывает уменьшение плотности сосудов как в первичной опухоли (например, для соединения А Т/С составляет 50%), так и для метастазов (например, для соединения А Т/С составляет 40%) по сравнению с контролями. Рапамицин или его производное, например соединение А, изменяет также распределение размеров сосудов в метастазах.
Б.7 Комбинация с антиангиогенным агентом
Клетки линии B16/BL6 (5×104) инъецируют интрадермально в уши мышей линии C57BL/6. Через семь дней начинают обработку рапамицином или его производным, например соединением А, ингибитором тирозинкиназного рецептора VEGF, например 1-(4-хлоранилино)-4-(4-пиридилметил)фталазином или его солью, например сукцинатом, или комбинацией обоих соединений и осуществляют наблюдение соответственно за ростом и массой первичной опухоли и метастазов лимфатических узлов шейки матки. Ежедневное введение индивидуально антиангиогенного агента (100 мг/кг р.о.) или рапамицина или его производного, например соединения А (1 мг/кг р.о.), приводит к уменьшению размера первичной опухоли (конечные величины Т/С составляют соответственно: 65 и 74%, в то время как комбинация указанных двух агентов обладает синергетическим действием (Т/С 12%). Обработка индивидуально рапамицином или его производным, например соединением А, и антиангиогенным агентом приводит к уменьшению массы лимфатических узлов шейки матки (связанными с локальными метастазами) (Т/С: 75 и 34% соответственно), а обработка комбинацией позволяет еще больше уменьшать массу лимфатических узлов (Т/С 13%). Обработка лекарственными средствами существенно стимулируют прибавление веса тела по сравнению с контролем. В случае первичных опухолей результаты анализа возможного взаимодействия лекарственных средств свидетельствуют о наличии синергетического взаимодействия между соединением А и антиангиогенным агентом: (относительное действие: антиангиогенный агент/контроли = 0,66; соединение А/контроли = 0,77; соединение А и антиангиогенный агент/контроли = 0,135). Поскольку относительное действие комбинации соединение А и антиангиогенный агент/контроли меньше произведения относительного действия соединения А/контроли × относительное действие антиангиогенного агента/контроли (0,51), то этот факт свидетельствует о наличии синергизма. В случае метастазов результаты анализа также свидетельствуют о наличии синергетического взаимодействия между соединением А и антиангиогенным агентом, а именно относительное действие: антиангиогенный агент/контроли = 0,337; соединение А/контроли = 0,75; соединение А и антиангиогенный агент/контроли = 0,122. Поскольку относительное действие комбинации соединение А и антиангиогенный агент/контроли меньше произведения относительного действия соединения А/контроли × относительное действие антиангиогенного агента/контроли (0,252), то этот факт свидетельствует о наличии синергизма (dark. Breast Cancer Research Treatment; 46 (1997), с.255).
В. Клиническое исследование
B.1 Исследование в клинических условиях эффективности соединения формулы I, например соединения А, применяемого в качестве монотерапевтического средства для лечения плотных опухолей
Задача исследования: определение на основе метода, заключающегося в постепенном повышении вводимых доз, оптимальной дозы указанного соединения при пероральном введении один раз в неделю, и оценка эффективности оптимальной дозы при лечении плотных опухолей.
Исследование проводилось в 2 стадии.
Стадия 1
Основная задача: Определение оптимальной дозы соединения формулы I, например соединения А, вводимого р.о. один раз в неделю, имея в виду, что она должна представлять собой минимальную дозу, обеспечивающую пролонгированное ингибирование mTOR и уровни соединения в крови, по меньшей мере эквивалентные уровням, при которых достигается противоопухолевое действие в доклинических исследованиях in-vivo.
Дополнительная задача: оценка безопасности соединения при его индивидуальном применении пациентами, страдающими раковым заболеванием, и оценка изменений метаболической активности в опухоли.
План эксперимента: последовательным группам пациентов, каждая из которых состояла из 4 человек, страдающих злокачественными плотными опухолями, неподдающимися лечению или резистентными к стандартному терапевтическому лечению, в течение 4 недель вводят соединение формулы I, например соединение А, каждые 7 дней в различных дозах (пациентам в группе 1 вводят по 5 мг; в группе 2 вводят по 10 мг, в группе 3 вводят по 20 мг). На 4-й неделе оценивают фармакокинетический профиль и профиль ингибирования mTOR на основе данных о ингибировании киназы p70s6 в периферических лимфоцитах. Для изучения изменения метаболизма в опухоли проводят сравнительное исследование изображений, полученных методом позитронной эмиссионной томографии (ФДГ-ПЭТ) с использованием 18-фтордезоксиглюкозы (ФДГ) (перед введением 1-й дозы, после введения 3-й дозы).
Основные критерии отбора пациентов: взрослые люди с развитой стадией (III-V) плотных опухолей, неподдающихся лечению или резистентных к стандартному терапевтическому лечению. Необходимо, чтобы по меньшей мере одно опухолевое образование можно было измерять (>20 мм в одном из направлений).
Основные параметры для оценки: безопасность (побочные действия), стандартные данные биохимического и гематологического анализа сыворотки, уровни тестируемого соединения в крови, активность киназы p70-s6 лимфоцитов, изменения поглощения глюкозы в опухоли по данным ФДГ-ПЭТ.
Стадия 2
Основная задача: Изучение эффективности соединения формулы I, например соединения А, на пациентах, страдающих развитыми плотными опухолями, которым один раз в неделю вводят оптимальную дозу, определенную на стадии 1 на основе реакции опухоли.
Дополнительная задача: оценка безопасности указанного соединения, применяемого в данной дозе.
План эксперимента: 20 пациентам, имеющим прогрессирующие находящиеся на развитой стадии плотные опухоли, которые не поддаются лечению или резистентны к стандартному терапевтическому лечению, вводят соединение в дозе, рекомендованной на основе результатов исследований, проведенных на стадии 1. Общее клиническое состояние пациента оценивают еженедельно путем физических и лабораторных анализов. Изменения состояния опухоли оценивают каждые 2 месяца с помощью радиологического анализа. Сначала пациентов подвергают лечению в течение 2 месяцев. После этого продолжают их лечение, если болезнь не прогрессирует и лекарство удовлетворительно переносится.
Основные параметры для оценки: безопасность (побочные действия), стандартные данные биохимического и гематологического анализа сыворотки, размеры опухоли, которые оценивают с помощью компьютеризированного томографического сканирования (КТ) или на основе визуализации методом ядерно-магнитного резонанаса (ЯМР).
В.2 Комбинированное лечение
Для этой цели можно применять, например, открытые клинические нерандомизированные исследования с использованием возрастающих доз на пациентах, имеющих развитые плотные опухоли. Такие исследования позволяют, в частности, выявлять наличие синергизма действующих веществ, входящих в комбинацию по изобретению. Благоприятные действия в отношении пролиферативных заболеваний можно оценивать непосредственно по результатам таких исследований или на основе плана исследований, в который внесены изменения, известные специалисту в данной области. Такие исследования можно проводить, в частности, для сравнения действия монотерапии с использованием действующих веществ и действия комбинации по изобретению. В предпочтительном варианте дозу агента (а) постепенно повышают до достижения максимальной переносимой дозы, а коагент (б) вводят в фиксированной дозе. В альтернативном варианте агент (а) вводят в фиксированной дозе, дозу коагента (б) постепенно увеличивают. Каждому пациенту вводят дозы агента (а) либо ежедневно, либо с перерывами. Эффективность такого лечения в данном исследовании можно определять, например, путем радиологической оценки опухолей каждые 6 недель, например через 12, 18 или 24 недели.
В альтернативном варианте для оценки эффективности указанной в настоящем описании комбинации по изобретению можно применять исследование, проводимое вслепую с использованием плацебо в качестве контроля.
Суточные дозы, необходимые для практического осуществления способа по настоящему изобретению при использовании соединения формулы I, индивидуально, варьируются в зависимости, например, от применяемого соединения, хозяина, пути введения и серьезности подлежащего лечению состояния. Предпочтительно суточные дозы составляют приблизительно от 0,1 до 25 мг при их введении в виде однократной дозы или разделенных доз. Приемлемые суточные дозы для пациентов составляют приблизительно, например, от 0,1 до 25 мг р.о. Соединение А можно вводить любым обычным путем, в частности энтерально, например перорально, например в форме таблеток, капсул, растворов для питья, назально, в легкие (путем ингаляции) или парентерально, например в форме растворов или суспензий для инъекции. Приемлемые для перорального введения дозы лекарственного средства содержат от приблизительно 0,05 до 12,5 мг, как правило, от 0,25 до 10 мг соединения А, в сочетании с одним или несколькими фармацевтически приемлемыми разбавителями или носителями.
Комбинацию по изобретению можно применять также в сочетании с хирургическим вмешательством, умеренной продолжительной гипертермией всего организма и/или лучевой терапией.
Введение фармацевтической композиции по изобретению приводит не только к благоприятному действию, например синергетическому терапевтическому действию, например, в отношении замедления, прекращения или реверсии образования неоплазмы или к более продолжительной реакции опухоли, но также сопровождается и другими неожиданными благоприятными действиями, например меньшими побочными действиями, улучшением качества жизни или уменьшением смертности и заболеваемости по сравнению с монотерапией, при которой применяют только одно из фармацевтических действующих веществ, входящих в композицию по изобретению, в частности, при лечении опухоли, не поддающейся лечению другими химиотерапевтическими средствами, применяемыми в качестве противоопухолевых агентов. В частности, наблюдается увеличение поглощения коагента (б) тканью опухоли и клетками опухоли при его введении совместно с первым агентом (а).
Еще одним преимуществом является то, что можно применять более низкие дозы действующих веществ, входящих в композицию по изобретению, например, часто можно применять не только более низкие дозы, но и вводить их реже или использовать этот факт для уменьшения побочных действий при контроле образования неоплазмы. Это соответствует желаниям подвергающихся лечению пациентов и требованиям, которые они должны выполнять.
Согласно одному из вариантов осуществления изобретения предпочтительная фармацевтическая композиция включает
а) соединение формулы I, например соединение А, и
б) в качестве коагента одно или несколько соединений, указанных выше в разделах (II), (III) или (IV), например карбоплатин, цисплатин, паклитаксел, доцетаксел, гемцитабин или доксорубицин.
Особенно предпочтительной является обладающая синергетическим действием композиция, содержащая соединение формулы I, например соединение А, в сочетании с карбоплатином, цисплатином, паклитакселом, доцетакселом, гемцитабином или доксорубицином.
Еще одной предпочтительной фармацевтической композицией является, например, композиция, содержащая
а) рапамицин или его производное, например CCI-779, ABT578 или соединение А, и
б) в качестве коагента одно или несколько соединений, указанных выше в разделах (I) и (V)-(X), предпочтительно одно или несколько соединений, указанных выше в разделе (V).
Предпочтительной является, например, обладающая синергетическим действием композиция, содержащая рапамицин или его производное, например CCI-779, ABT578 или соединение А, в сочетании с соединением, которое воздействует, понижает или ингибирует активность представителей семейства VEGFR, EGFR, PDGFR или протеинкиназы С, например, как описано выше.
Одним из конкретных вариантов осуществления изобретения является применение композиции по изобретению для предупреждения, замедления развития или лечения рака молочной железы или для приготовления лекарственного средства, предназначенного для предупреждения, замедления развития или лечения рака молочной железы. Согласно этому варианту осуществления композиция предпочтительно содержит в качестве коагента б) ингибитор ароматазы, например ингибитор ароматазы летрозол, антиэстроген, например тамоксифен, ингибитор топоизомеразы II, например доксорубицин, или агент, обладающий активностью в отношении микротрубочек, например паклитаксел.
Другой вариант осуществления изобретения относится к применению композиции по изобретению для предупреждения, замедления развития или лечения рака легкого или для приготовления лекарственного средства, предназначенного для предупреждения, замедления развития или лечения рака легкого. Согласно этому варианту осуществления композиция предпочтительно содержит в качестве коагента б) содержащее платину соединение, например карбоплатин, или агент, обладающий активностью в отношении микротрубочек, например паклитаксел.
Еще один вариант осуществления изобретения относится к применению композиции по изобретению для предупреждения, замедления развития или лечения поджелудочной железы или для приготовления лекарственного средства, предназначенного для предупреждения, замедления развития или лечения рака поджелудочной железы. Согласно этому варианту осуществления композиция предпочтительно содержит в качестве коагента б) антинеопластический антиметаболит, например гемцитабин.
Следующий вариант осуществления изобретения относится к применению композиции по изобретению для предупреждения, замедления развития или лечения глиобластом или для приготовления лекарственного средства, предназначенного для предупреждения, замедления развития или лечения глиобластом. Согласно этому варианту осуществления композиция предпочтительно содержит в качестве коагента б) алкилирующий агент, например дихлорэтилнитромочевину (ДХНМ).
Еще один вариант осуществления изобретения относится к применению рапамицина или его производного в сочетании с химиотерапевтическим агентом для лечения рака лимфатической системы, например, как описано выше. Композиция может дополнительно содержать в качестве коагента (б) бусульфан, цитарабин, 6-тиогуанин, флударабин, гидроксимочевину, прокарбазин, блеомицин или метотрексат. В качестве коагента (б) предпочтительно применяют ингибиторы топоизомеразы II, например даунорубицин, или, в частности, соединения, которые направленно действуют, понижают или ингибируют активность PDGFR или представителей семейства c-AbI и продуктов слияния их генов, например иматиниб.
В контексте настоящего описания понятия «совместное введение» или «комбинированное введение» или т.п. включают введение выбранных терапевтических агентов одному и тому же пациенту и подразумевается, что они относятся к режимам введения, при которых агенты необязательно вводят одинаковым путем или в одно и то же время.
Одной из задач настоящего изобретения является создание фармацевтической композиции, содержащей комбинацию действующих веществ по изобретению, в количествах, которые в совокупности обладают терапевтическим действием в отношении пролиферативного злокачественного заболевания. При использовании указанной композиции первый агент а) и коагент (б) можно вводить одновременно, один после другого или раздельно в виде одной объединенной стандартной дозы или в виде двух раздельных стандартных доз. Стандартная доза может находиться также в составе фиксированной композиции.
Фармацевтические композиции, предназначенные для раздельного введения первого агента а) и коагента б) и их введения в виде фиксированной композиции по изобретению, например одной галеновой композиции, которая содержит по меньшей мере два компонента композиции а) и б), можно приготавливать известным методом и их можно вводить энтеральным, например пероральным или ректальным, путем млекопитающим (теплокровным животным), включая человека, и они содержат терапевтически эффективное количество по меньшей мере одного обладающего фармакологической активностью компонента композиции индивидуально, например, как указано выше, или в сочетании с одним или несколькими фармацевтически приемлемыми носителями или разбавителями, пригодными прежде всего для энтерального или парентерального введения.
Приемлемые фармацевтические композиции содержат, например, от приблизительно 0,1 до приблизительно 99,9%, предпочтительно от приблизительно 1 до приблизительно 60% действующих(его) веществ(а). Фармацевтические композиции для энтерального или парентерального введения, предназначенные для комбинированной терапии, представляют собой, например, стандартные формы лекарственного средства, такие как таблетки с сахарным покрытием, таблетки, капсулы или суппозитории или ампулы. Если не указано иное, их приготавливают известным методом, например с помощью общепринятых процессов смешения, грануляции, нанесения сахарного покрытия, растворения или лиофилизации. Следует иметь в виду, что не требуется, чтобы содержание конкретного компонента в каждой дозе представляло собой эффективное количество, поскольку необходимое эффективное количество действующего вещества можно обеспечивать путем введения нескольких стандартных доз.
В частности, терапевтически эффективное количество каждого из компонентов композиции по изобретению можно вводить одновременно или последовательно или в любом порядке, причем компоненты можно вводить раздельно или в виде фиксированной комбинации. Например, согласно способу по изобретению для замедления развития или лечения злокачественного пролиферативного заболевания можно (I) вводить первый агент а) в свободной форме или в форме фармацевтически приемлемой соли и (II) вводить коагент б) в свободной форме или в форме фармацевтически приемлемой соли одновременно или последовательно в любом порядке в количествах, которые в совокупности представляют собой терапевтически эффективные количества, предпочтительно в синергетически эффективных количествах, например, ежедневно или с промежутками в дозах, соответствующих указанным в настоящем описании количествам. Отдельные компоненты композиции по изобретению можно вводить индивидуально в различное время в процессе лечения или одновременно в виде разделенных доз или единых комбинированных форм. Кроме того, под понятие «введение» подпадает также применение компонента композиции в виде пролекарства, которое превращается in vivo в компонент композиции. При этом следует иметь в виду, что под объем настоящего изобретения подпадают все такие режимы одновременного или периодического введения и понятие «введение» следует интерпретировать соответствующим образом.
Эффективная доза каждого из компонентов композиции, применяемого в композиции по изобретению, может варьироваться в зависимости от используемого конкретного соединения или фармацевтической композиции, пути введения, состояния, подлежащего лечению, серьезности состояния, подлежащего лечению. Так, режим доз композиции по изобретению выбирают с учетом различных факторов, включая путь введения и почечную и печеночную функции пациента. Лечащий врач, клиницист или ветеринар легко могут определить и назначить эффективное количество индивидуальных действующих веществ, необходимых для предупреждения, реверсии или прекращения развития рассматриваемого состояния. Достижение оптимальной точности при оценке концентраций действующих веществ в диапазоне, в котором обеспечивается эффективность без токсических действий, требует разработки режима введения на основе данных о кинетике доступности действующих веществ к областям-мишеням.
Суточные дозы первого агента а) должны, конечно, варьироваться в зависимости от различных факторов, например от выбранного соединения, конкретного состояния, подлежащего лечению, и ожидаемого действия. В целом, однако, удовлетворительные результаты можно получить при введении рапамицина или его производного в суточных дозах, составляющих приблизительно 0,1-25 мг, которые вводят в виде однократной дозы или разделенных доз. Рапамицин или его производное, например соединение формулы I, можно вводить любым общепринятым путем, в частности энтерально, например перорально, например в форме таблеток, капсул, растворов для питья, или парентерально, например в форме растворов или суспензий для инъекции. Приемлемые суточные дозы для перорального введения содержат приблизительно от 0,05 до 10 мг действующего вещества, например соединения А, в сочетании по меньшей мере с одним или несколькими фармацевтически приемлемыми разбавителями или носителями.
Фадрозол можно вводить человеку перорально в дозе, варьирующейся от приблизительно 0,5 до приблизительно 10 мг/день, предпочтительно от приблизительно 1 до приблизительно 2,5 мг/день. Экземестан можно вводить человеку перорально в дозе, варьирующейся от приблизительно 5 до приблизительно 200 мг/день, предпочтительно от приблизительно 10 до приблизительно 25 мг/день или парентерально в дозе приблизительно от 50 до 500 мг/день, предпочтительно от приблизительно 100 до приблизительно 250 мг/день. Если лекарство необходимо вводить в виде раздельной фармацевтической композиции, то его можно вводить в форме, описанной в GB 2177700. Форместан можно вводить человеку парентерально в дозе приблизительно от 100 до 500 мг/день, предпочтительно от приблизительно 250 до приблизительно 300 мг/день.
Анастрозол можно вводить человеку парентерально в дозе, варьирующейся от приблизительно 0,25 до 20 мг/день, предпочтительно от приблизительно 0,5 до приблизительно 2,5 мг/день. Аминоглутемид можно вводить человеку в дозе приблизительно от 200 до 500 мг/депь.
Цитрат тамоксифена можно вводить человеку в дозе приблизительно от 10 до 40 мг/день.
Винбластин можно вводить человеку в дозе приблизительно от 1,5 до 10 мг/м2/день. Сульфат винкристина можно вводить человеку парентерально в дозе приблизительно от 0,025 до 0,05 мг/кг веса тела/неделю. Винорелбин можно вводить человеку в дозе приблизительно от 10 до 50 мг/м2/день.
Фосфат этопозида можно вводить человеку в дозе приблизительно от 25 до 115 мг/м2/день, например 56,8 или 113,6 мг/м2/день.
Тенипозид можно вводить человеку в дозе приблизительно от 75 до 150 мг приблизительно каждые две недели. Доксорубицин можно вводить человеку в дозе приблизительно от 10 до 100 мг/м2/день, например 25 или 50 мг/м2/день. Эпирубицин можно вводить человеку в дозе приблизительно от 10 до 200 мг/м2/день.
Идарубицин можно вводить человеку в дозе приблизительно от 0,5 до 50 мг/м2/день. Митоксантрон можно вводить человеку в дозе приблизительно от 2,5 до 25 мг/м2/день.
Паклитаксел можно вводить человеку в дозе приблизительно от 50 до 300 мг/м2/день. Доцетаксел можно вводить человеку в дозе приблизительно от 25 до 100 мг/м2/день.
Циклофосфамид можно вводить человеку в дозе приблизительно от 50 до 1500 мг/м2/день. Мелфалан можно вводить человеку в дозе приблизительно от 0,5 до 10 мг/м2/день.
5-Флуорацил можно вводить человеку в дозе приблизительно от 50 до 1000 мг/м2/день, например 500 мг/м2/день. Капецитабин можно вводить человеку в дозе приблизительно от 10 до 1000 мг/м2/день. Гидрохлорид гемцитабина можно вводить человеку в дозе, составляющей приблизительно 1000 мг/м2/неделю. Метотрексат можно вводить человеку в дозе приблизительно от 5 до 500 мг/м2/день.
Топотекан можно вводить человеку в дозе приблизительно от 1 до 5 мг/м2/день. Иринотекан можно вводить человеку в дозе приблизительно от 50 до 350 мг/м2/день.
Карбоплатин можно вводить человеку в дозе приблизительно от 200 до 400 мг/м2 приблизительно каждые четыре недели. Цисплатин можно вводить человеку в дозе приблизительно от 25 до 75 мг/м2 приблизительно каждые три недели. Оксалиплатин можно вводить человеку в дозе приблизительно от 50 до 85 мг/м2 каждые две недели.
Иматиниб можно вводить человеку в дозе приблизительно от 2,5 до 850 мг/день, более предпочтительно от 5 до 600 мг/день и наиболее предпочтительно от 20 до 300 мг/день.
Алендроновую кислоту можно вводить человеку в дозе приблизительно от 5 до 10 мг/день. Клодроповую кислоту можно вводить человеку, например, в дозе приблизительно от 750 до 1500 мг/день. Этридоновую кислоту можно вводить человеку в дозе приблизительно от 200 до 400 мг/день. Ибандроновую кислоту можно вводить человеку в дозе приблизительно от 1 до 4 мг каждые 3-4 недели.
Ризедроновую кислоту можно вводить человеку в дозе приблизительно от 20 до 30 мг/день. Памидроновую кислоту можно вводить человеку в дозе, варьирующейся от приблизительно 15 до 90 мг каждые 3-4 недели. Тилудроновую кислоту можно вводить человеку в дозе приблизительно от 200 до 400 мг/день.
Трастуцумаб можно вводить человеку в дозе приблизительно от 1 до 4 мг/м2/неделю.
Бикалутамид можно вводить человеку в дозе приблизительно от 25 до 50 мг/м2/день.
1-(4-хлоранилино)-4-(4-пиридилметил)фталазин или его соль, например сукцинат, можно вводить человеку в дозе приблизительно от 50 до 1500, более предпочтительно приблизительно от 100 до 750 и наиболее предпочтительно от 250 до 500 мг/день.
Рапамицин или его производное обладают хорошей переносимостью в дозах, применяемых согласно настоящему изобретению. Например, NTEL для соединения А по данным 4-недельного исследования токсичности составляет 0,5 мг/кг/день для крыс и 1,5 мг/кг/день для обезьян.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНАЦИЯ И СПОСОБ ПРЕДУПРЕЖДЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2002 |
|
RU2322981C2 |
| ИНГИБИРОВАНИЕ ИЛИ ПРОФИЛАКТИКА НАРУШЕННОЙ РЕГУЛЯЦИИ АНГИОГЕНЕЗА С ПОМОЩЬЮ ПРОИЗВОДНЫХ РАПАМИЦИНА И ФАРМАЦЕВТИЧЕСКИЕ КОМБИНАЦИИ, СОДЕРЖАЩИЕ ПРОИЗВОДНОЕ РАПАМИЦИНА | 2006 |
|
RU2445093C2 |
| ЛЕЧЕНИЕ РАКА | 2005 |
|
RU2325906C2 |
| ПРИМЕНЕНИЕ ПРОИЗВОДНОГО РАПАМИЦИНА | 2013 |
|
RU2659725C2 |
| ПРИМЕНЕНИЕ ПРОИЗВОДНОГО РАПАМИЦИНА | 2013 |
|
RU2665138C2 |
| БИОМАРКЕРЫ | 2005 |
|
RU2429297C2 |
| БИОМАРКЕР | 2005 |
|
RU2385944C2 |
| ПРОИЗВОДНОЕ РАПАМИЦИНА ИЛИ ИНГИБИТОР IMPDH ДЛЯ ЛЕЧЕНИЯ ПОЛИКИСТОЗНОГО ЗАБОЛЕВАНИЯ ПОЧЕК | 2006 |
|
RU2491933C2 |
| СТЕНТЫ С НАНЕСЕННЫМ ПОКРЫТИЕМ, СОДЕРЖАЩИМ N-{5-[4-(4-МЕТИЛПИПЕРАЗИНОМЕТИЛ)БЕНЗОИЛАМИДО]-2-МЕТИЛФЕНИЛ}-4-(3-ПИРИДИЛ)-2-ПИРИМИДИНАМИН | 2003 |
|
RU2341266C2 |
| ПЕДИАТРИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ РАССЕЯННОГО СКЛЕРОЗА | 2009 |
|
RU2562571C2 |
Предложено применение 40-O-(2-гидроксиэтил)-рапамицина для получения фармацевтической композиции, предназначенной для лечения опухоли поджелудочной железы. Показано, что 40-O-(2-гидроксиэтил)-рапамицин снижал скорость роста опухоли поджелудочной железы и проявлял антиангиогенную активность. Выраженные противоопухолевые реакции получали при периодическом введении соединения каждые два дня в неделю или дважды в неделю. 2 з.п. ф-лы.
1. Применение 40-O-(2-гидроксиэтил)-рапамицина для получения фармацевтической композиции, предназначенной для лечения опухоли поджелудочной железы.
2. Применение по п.1, где единичная доза 40-O-(2-гидроксиэтил)-рапамицина, составляющая от 0,1 до 25 мг, вводится ежедневно.
3. Применение по любому из пп.1 или 2, дополнительно включающее один или более фармацевтически приемлемый растворитель или носитель.
| US 5665772 А, 09.09.1997 | |||
| ПРОИЗВОДНЫЕ РАПАМИЦИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1996 |
|
RU2158267C2 |
| Справочник противоопухолевая терапия | |||
| / Под ред | |||
| Н.И | |||
| Переводчиковой | |||
| - М.: Медицина, 1993, с.55, 64, 121. | |||
Авторы
Даты
2013-06-10—Публикация
2011-09-22—Подача