Изобретение относится к ветеринарной вирусологии и биотехнологии.
Для современного животноводства важное экономическое значение имеют наиболее распространенные вирусные респираторно-кишечные инфекции телят и патология репродуктивных органов взрослого поголовья скота, связанные с бесплодием, ранней эмбриональной смертностью и абортами, снижением молочной продуктивности, понижением репродуктивных функций, задержкой в росте, повышением риска возникновения вторичных бактериальных инфекций и увеличением отхода, особенно среди молодняка.
В развитии этих форм патологий крупного рогатого скота доминирующими являются возбудители вирусной природы, относящиеся к различным таксономическим группам. Среди этой обширной группы вирусов малоизвестными и малоизученными являются реовирусы.
Реовирусы крупного рогатого скота относятся к роду Orthoreovirus семейства Reoviridae. Вирионы - сферические частицы диаметром 75-80 нм, с двумя капсидами: наружным и внутренним. Геном реовирусов состоит из 10 сегментов двухнитевой РНК. Название реовирусы (reo - начальные буквы слов respiratory - enteric - orphans) происходит от того, что они имеют выраженный тропизм к органам дыхания и пищеварения (Sabin A.B., 1959).
Реовирусы довольно устойчивы к физико-химическим воздействиям: не теряют своей инфекционности при нагревании их до 500С в присутствии MgCl2. На холоду пробы могут сохраняться при -200С от 8-10 мес. до 2 лет. При 40С вирус сохраняет свои инфекционные свойства в течение 2 мес. Пятикратное и выше размораживание и оттаивание не оказывает влияния на инфекционность реовирусов (Ритова, В.В., Трофимов Н.М., 1977). Они переносят широкий спектр рН (от 2,2 до 8,0), но полностью инактивируются 70% этиловым спиртом или 3% формалином при 56 0С в течение 30 минут (Stanley N.F., Dorman D.C., Pansford I., 1953).
Впервые о реовирусах, как о патогенных агентах, сообщил Sabin в 1959 году, выделив реовирус типа I от ребенка с симптомакомплексом диареи и носовых истечений. По результатам РВН и РТГА у человека и млекопитающих до сих пор обнаруживалось три родственных серотипа. Прототипным реовирусом типа I стал вирус ECHO-10 (штамм Lang). Реовирусы типов I, II и III выделены от крупного рогатого скота, лошадей, собак, кошек, мышей. По данным гибридизации РНК, вирусы серотипов I и II гомологичны на 70%, а степень гомологии между ними и вирусами серотипа II составляет лишь 10% (Gaillard R.K., Ioklik W.K., 1982). Реовирусной инфекцией поражаются многие виды животных и человек, независимо от возраста. Чаще всего инфекция носит инаппарантный, латентный характер и сопровождается длительным вирусоносительством и вирусовыделением. Реовирусы человека и животных, относящиеся к одному типу, неразличимы серологически и близко родственны по биологическим свойствам. Штаммы реовирусов человека и животных вызывают одинаковые изменения, размножаются в одних и тех же культурах ткани и вызывают аналогичные реакции у естественных хозяев. Возможны заболевания людей при заражении бычьим реовирусом 1-го типа и телят при заражении любым из серотипов вируса человека.
Реовирусную инфекцию крупного рогатого скота впервые регистрировали в США, Бельгии, ФРГ, Франции и других странах. В этих странах выявлен высокий процент серопозитивных животных. Так, например, в ФРГ доказано участие реовирусов в поражении респираторного тракта телят и установлена определенная роль их в патологии плода и новорожденных. При исследовании в РТГА сывороток крови 155 телят и парных сывороток от 62 взрослых животных, полученных из 24 хозяйств с диагнозом «грипп», было показано, что реовирусом крупного рогатого скота I-го типа реагируют 70% исследованных животных, с реовирусом II-го типа - 16% и III-го типа - 5%. В трех из 24 стад крупного рогатого скота серологическим исследованием парных сывороток было подтвежден соучастие реовирусов при остром течении инфекции (Сюрин В.Н., Самуйленко А.Я. и др. 1998; Wizigmann G., Reinhardt G., 1971).
Серологические исследования в РТГА 194 проб сывороток крови телят, в период острого течения респираторной энзоотии, проведенные в институте вирусологии Венского университета, используя в качестве антигена в РТГА реовируса типа I (штамм Lang), показали, что у 54% обследованного поголовья животных были обнаружены антитела. Причем 39 сывороток реагировали в разведении 1:32, 20 - в разведении 1:64, 12 - в разведении 1:128 и 5 - в разведении 1:256 и выше. Эти данные указывали на то, что доминирующим серотипом является реовирус типа I (Böckmann I., 1976).
Накопилось достаточно убедительных данных, свидетельствующие об этиологической роли реовирусов в патологии респираторно-кишечных инфекций молодняка крупного рогатого скота. Так, Rosen L., Abinanti F.R., Hovis I.F. (1963), при исследовании в США 154-и случаев инфекционного процесса у телят первые 2 года жизни, диагностировали у 109 животных из трех ферм реовирусные инфекции, вызванные всеми тремя типами реовирусов. Из них также преобладал тип I.
По данным Rosen L.(1962), Böckmann I., (1976), реовирусы способны обусловливать пневмоэнтериты у телят в первые 3 месяца жизни, проявляющиеся клинически диареей, ринитом, лихорадкой и пневмонией, в то же время у взрослых животных реовирусная инфекция протекает латентно и сопровождается снижением удоев у молочных коров. При обследовании скота в штате Мэриленд (США) почти каждый теленок к годовалому возрасту был инфицирован одним из серотипов бычьего реовируса (Rosen L.(1964). На основании проведенных исследований Dawson P.S. (1966) пришел к выводу, что клинически выраженная форма течения наблюдалась редко, однако соучастие реовирусов было установлено в 29 случаев из 111 регистрированных энзоотии респираторных инфекций телят.
Следует заметить, что при экспериментальном заражении телят-гнотобионтов всеми тремя серотипами наблюдалась лихорадка, кашель, истечения из носовой полости, а гистологически была обнаружена интерстициальная пневмония (Lamont P.H. et al., 1968).
Несмотря на слабую изученность реовирусной инфекции, имеются сообщения о введении реовирусного антигена в качестве компонента в поливалентную инактивированную вакцину, состоящую из вируса ПГ-3, адено- и реовирусов (Сульбо Ж., Петермани X. и др., 1973). Вакцину предлагают использовать для телят с 6-8- недельного возраста, а при отсутствии молозивных антител иммунизируют животных в недельном возрасте. Продолжительность иммунитета - около года (Perreau P., 1973).
Следует также заметить, что авторами заявляемого изобретения в условиях лаборатории вирусологии ФГБУ «ФЦТРБ-ВНИВИ» разработана «Ассоциированная вакцина против парвовирусной, реовирусной, герпесвирусной типа I инфекций и вирусной диареи-болезни слизистых оболочек крупного рогатого скота». Вакцина предназначена для специфической профилактики респираторно-кишечных инфекций молодняка и патологий репродуктивных органов взрослого поголовья скота.
Обобщая приведенный материал, следует констатировать, что в естественных условиях у крупного рогатого скота реовирусная инфекция с ярким клиническим признаком проявляется не всегда и реовирусы, в основном, участвуют в формировании острых смешанных вирусных респираторно-кишечных инфекций телят, особенно в присутствии стрессовых факторов.
Известно, что реовирусам свойственна выраженная антигенная активность: в ответ на реовирусную инфекцию появляются нейтрализующие антитела и антитела, подавляющие реакцию гемагглютинации. Все реовирусы млекопитающих обладают гемагглютинирующим свойствами по отношению к эритроцитам человека. Температурные условия при постановке РГА не влияют на титр гемагглютинина, так же как и рН в пределах от 6,0 до 8,0.
По данным зарубежных исследователей ретроспективный диагноз на реовирусную инфекцию устанавливают путем исследований парных сывороток, взятых с интервалом 3-4 недели, путем исследований их в РТГА с реовирусом типа I. Повышение титров антигемагглютининов во вторых пробах в 4 и более раза считается диагностическим. При латентной реовирусной инфекции в стаде процент животных, имеющих антитела, колеблется от 40 до 80% (Brudaker M.M., 1964; Moreno-Lopez I. 1979; Wizigmann G., Reinhardt G., 1971).
Из литературных источников известно, что, лабораторная диагностика реовирусной инфекции крупного рогатого скота осуществляется путем выделения вируса в культуре клеток и полученные результаты должны быть подтверждены обнаружением прироста антигемагглютининов или вируснейтрализующих антител в период реконвалесценции по сравнению с сыворотками крови, взятыми в острой стадии болезни.
Для выделения возбудителя используют, главным образом, фекалии, носовые и конъюнктивальные смывы, кровь, легкие и лимфатические узлы. Материал обрабатывают по общепринятой методике, подготавливая для заражения культур клеток. Выделенный цитопатогенный агент проверяют на наличие гемагглютинирующей активности по отношению к эритроцитам человека и, если таковая имеется, идентифицируют в РТГА, используя эталонные сыворотки трех серотипов реовируса. Часто серологически диагностируют смешанные инфекции: ПГ-3, ВД-БС, реовирусная инфекция и хламидиоз (Thomas L., Collins A., 1974).
Однако до настоящего времени в Российской Федерации какие-либо исследования по изучению роли реовирусов в патологии крупного рогатого скота не проводились, многие аспекты этой болезни, в частности, источники и пути передачи, вирусоносительство и вирусовыделение у естественно инфицированного крупного рогатого скота не изучены, а также широта и степень распространения реовирусной инфекции оставались вне поля зрения ветеринарной службы страны. Очевидно, что решение таких вопросов, как особенности эпизоотологии болезни и постинфекционного иммунитета, задачи, связанные с разработкой методов и средств лабораторной диагностики и, специфической профилактики реовирусной инфекции крупного рогатого скота, требует серьезного внимания.
С учетом этого положения, с целью выявления степени распространения реовирусной инфекции среди поголовья крупного рогатого скота в регионе Среднего Поволжья, нами был осуществлен серомониторинг в отношении данной инфекции путем исследования в реакции торможения гемагглютинации (РТГА) 1031 сыворотки крови, полученной из 16 хозяйств 6 районов Республики Татарстан, в которых имели место респираторно-кишечные заболевания телят и нарушение функций репродуктивных органов маточного поголовья. В качестве антигена использовали концентрированный ультрацентрифугированием инактивированный реовирус типа I штамм «Reo 1 Lang», полученный на культуре клеток Vero, с гемагглютинирующей активностью 1:512-1:1024. Из результатов проведенных исследований представленых в таблице 1 следует, что наиболее высокие титры антител в пределах 1:160-1:320 обнаруживаются как у глубокостельных коров и телок случного возраста, так и у телят. Эти данные указывают на активность реовирусной инфекции у обследованного поголовья скота. Следовательно, обобщение и анализ полученных результатов показал, что достаточно высокий процент выявления положительных реакций в диагностических титрах (1:40 и выше) у взрослого поголовья (58,9%) и у телят до трехмесячного возраста (31,5%) свидетельствует о фактах циркуляции реовируса типа I среди обследованного поголовья скота в 16 хозяйствах 6 районов Татарстана и о перспективности дальнейших широкомасштабных исследований этой неизученной в РФ вирусной инфекции.
В настоящее время ветеринарная служба РФ не располагает современными методами и средствами лабораторной диагностики, в том числе и какими-либо наборами для серологического мониторинга в отношении этой малоизвестной реовирусной инфекции крупного рогатого скота, способной поражать многих видов животных и человека, независимо от возраста и участвующая в формировании чаще всего смешанных инфекций. Поэтому проблема создания иммуноферментной тест-системы стала весьма актуальной.
Проведенный заявителем анализ уровня техники, включающий поиск по патентным и научно-техническим источникам информации и выявление источников, содержащих сведения об аналогах предлагаемого изобретения, позволил установить, что заявитель не обнаружил источники, характеризующиеся признаки, тождественными (идентичными) всем существенным признакам предлагаемого изобретения. Из выявленных аналогов - прототипа определили реакцию торможения гемагглютинации по Rosen L. 1962, как наиболее близкого по совокупности признаков по отношению к усматриваемому заявителем техническому результату отличительных признаков предлагаемой тест-системы ИФА, изложенных в независимом пункте формулы изобретения.
Во всех зарубежных странах серологическую диагностику реовирусной инфекции крупного рогатого скота и идентификацию выделенных штаммов реовирусов осуществляют по реакции торможения гемагглютинации, используя преимущественно антиген штамма «Reo 1 Lang» реовируса типа I. При помощи реакции торможения гемагглютинации практически во всех случаях естественной и экспериментальной реовирусной инфекции животных и человека удается выявить 4-х кратное или более высокое нарастание титра гомологичных антител в парных сыворотках крови
Известным решением, принятым за прототип, заявляемого метода серологической диагностики реовирусной инфекции крупного рогатого скота и контроля напряженности поствакцинального иммунитета иммуноферментной тест-системой, является реакция торможения гемагглютинации (Rosen L., 1969; - Diagnostic procedures for viral and Rickettsial infections, c.285-291: Москва «Медицина», 1974 перевод с англ.).
Сущность РТГА заключается в нейтрализации гемагглютинирующих свойств вируса специфическими антителами, содержащимися в сыворотке крови, в результате чего склеивания (агглютинации) эритроцитов не происходит и они оседают на дно, образуя плотный осадок в виде пуговки
Компоненты реакции:
- антиген реовируса;
- 0,5% взвесь эритроцитов О группы человека;
- 25% взвесь каолина;
- контрольная положительная сыворотка;
- контрольная отрицательная сыворотка.
РТГА проводят микрометодом по методике описанной Rosen L. (1972) против 4 гемагглютинирующих единиц антигена реовируса. Перед постановкой РТГА сыворотки разводят 1:5, прогревают в водяной бане (для удаления термолабильных гемагглютининов) при +58°С в течение 30 минут, обрабатывают равным объемом 25% взвеси каолина в течение 20 минут. Надосадок, после центрифугирования при 1500 об/мин в течение 10 минут, используют в реакции торможения гемагглютинации.
Недостатками прототипа - известного метода серологической диагностики реовирусной инфекции, являются:
- влияние неспецифических ингибиторов гемагглютинации, для устранения которых требуется предварительная обработка сывороток;
- сравнительно невысокая чувствительность реакции, что затрудняет выявление низких концентраций антител;
- нестабильность ингредиентов реакции, главным образом нативных эритроцитов, срок хранения которых непродолжителен (3-4 дня);
- трудоемкость и длительность данного метода, требующего для постановки одного рабочего дня, что ограничивает возможность одновременного исследования большого количества образцов сывороток крови;
- частые расхождения результатов РТГА при обследовании одних и тех сывороток в разных лабораториях из-за различий в процедуре постановки и учета реакции.
Указанные недостатки прототипа устраняются предлагаемым изобретением.
Совершенно очевидно, что современная диагностическая служба должна опираться на такие высокоспецифичные и чувствительные методы диагностики, которые позволяли бы получать воспроизводимые, достоверные и максимально качественные результаты в пределах метода, не требующих сложного инструментального оснащения, обеспеченные стандартными реагентами и признанные пригодными для проведения широкомасштабных исследований в условиях практических ветеринарных лабораторий. Этим требованиям в значительной степени отвечает твердофазный иммуноферментный анализ.
Целью изобретения является разработка иммуноферментной тест-системы как наиболее чувствительного и достоверного метода, предназначенного для серологической диагностики реовирусной инфекции крупного рогатого скота и контроля напряженности поствакцинального иммунитета.
Указанная цель достигается тем, что заявляемая тест-система содержит специфический антиген реовируса типа I штамма «Reo 1 Lang-ДЕП», инактивированный 0,08%-ным раствором 1,2-аминоэтилазиридина, представляющий собой специфический белок в концентрации 5-10 мкг/см3, адсорбированный на поверхности полистироловых лунок в карбонатно-бикарбонатном буфере с мертиолятом в конечной концентрации 0,1-0,2 мг/см3, контрольную положительную сыворотку, полученную к антигену реовируса типа I с активностью в ИФА 1:3200-1:6400, контрольную отрицательную сыворотку, конъюгат антивидовой, калий фосфорнокислый однозамещенный, калий фосфорнокислый двухзамещенный, натрий хлористый, хромоген (орто-фенилендиамин), перекись водорода, стоп-реагент и панели для постановки реакции иммуноферментного анализа. Основное преимущество предлагаемого изобретения состоит в том, что в качестве антигена используется штамм «Reo 1 Lang-ДЕП», относящийся к первому серотипу, который активно циркулирует среди поголовья скота во всех странах мира, в том числе и на территории РФ.
Согласно «Инструкции по применению тест-системы ИФА для серологической диагностики реовирусной инфекции крупного рогатого скота и определения уровня поствакцинальных антител», один комплект тест-системы рассчитан для проведения на одном планшете одновременного анализа 46 исследуемых проб сывороток крови в одном разведении (в двух повторах) и 2 контрольных сывороток (в двух повторах) или 20 исследуемых проб сывороток крови (в четырех разведениях) и 2 контрольных сывороток (в четырех разведениях). Одна тест-система рассчитана на исследование 230 проб сывороток крови в одном разведении и 100 проб в четырех разведениях.
Следовательно, заявляемое изобретение обладает существенными отличиями и характеризуется новой совокупностью признаков, позволяющей получить более высокий ожидаемый эффект, в отличие с тем результатом, который был получен при использовании метода серологической диагностики реовирусной инфекции крупного рогатого скота - прототипа.
Технико-экономическая эффективность:
- безопасность (используется инактивированный антиген);
- удобство работы (автоматизация промежуточных стадий реакций);
- использование прибора - спектрофотометра «Bio-Rad Model 680», с помощью которого за несколько секунд можно измерить поглощение света в 96 лунках планшета и получить объективные показатели оптической плотности исследуемых проб сыворотки крови, что позволяет значительно увеличить число проводимых анализов и упростить методическую процедуру выполнения ИФА.
Диагностические параметры и показатели качества разработанной тест-системы ИФА для серологической диагностики реовирусной инфекции крупного рогатого скота и контроля напряженности поствакцинального иммунитета соответствуют требованиям стандартов МЭБ (Руководство по диагностике и производству вакцин, издание МЭБ, 2004, с.21-29).
В состав предлагаемой тест-системы ИФА входят:
1. Полистироловые 96 луночные микропланшеты для иммуноферментного анализа, адсорбированные очищенным антигеном реовируса типа I, штамм «Reo 1 Lang-ДЕП», в концентрации 5-10 мкг/см3 - 5 шт.
2. Контрольная положительная сыворотка, лиофилизированная (К+), объем 0,5 см3, рабочее разведение 1:400, титр в ИФА 1:3200-1:6400-2 амп. №1
3. Контрольная отрицательная сыворотка, лиофилизированная (К-), объем 1 см3, рабочее разведение 1:400-2 фл. №2
4. Адсорбционный 0,01М карбонатно-бикарбонатный буферный раствор (0,01 М КББ рН 9.6), содержащий мертиолят в конечной концентрации 0,1-0,2 мг/см3.
5. 10-кратный концентрат фосфатно-буферного раствора с Твином-20 для промывки планшетов (ФБР-Т), 100 см3 - 2 фл. №3
6. Буфер для разведения конъюгата (БРК), объем 10 см3 - 1 фл. №4
7. Антитела диагностические против иммуноглобулинов G (IgG) крупного - рогатого скота, меченые пероксидазой хрена (Конъюгат), объем 0,2 см3 - 1 амп. №5
8. Фостфатно-цитратный буфер (ФЦБ), объем 10 см3 - 5 фл. №6
9. Хромоген, орто-фенилендиамин (ОФД), 4 мг - 5 фл. №7
10. Перекись водорода (H2O2) 3% р-р, объем 10 см3 - 1 фл. №8
11. 1М Серная кислота (Стоп-реагент), объем 50 см3- 1фл. №9
Приготовление компонентов набора.
1. Приготовление рабочих буферов
1.1. Адсорбционный 0,01М карбонатно-бикарбонатный буферный раствор (КББ рН 9,6), содержащий мертиолят в конечной концентрации 0,1-0,2 мг/см3, предназначен для растворения и сорбции антигена в лунке планшетов. Из маточного раствора берут 5 см3, добавляют еще 95 см3 дист. воды и 10-20 мг мертиолята. Этот раствор используют в реакции (0,01 М КББ рН 9.6).
1.2. Фосфатно-буферный раствор с Твином-20 предназначен для разведения контрольных, исследуемых сывороток и промывки панелей. Содержимое флакона с 10-кратным концентратом фосфатно-буферного раствора с Твином-20 доводят дистиллированной водой до 1000 см3. Рабочий раствор буфера представляет собой прозрачный раствор с рН 7,2-7,4.
1.3. Буфер для разведения конъюгата, представляет собой прозрачный фосфатно-буферный раствор без Твина с рН 7,2-7,4
1.4. Рабочий хромоген-субстратный раствор. Раствор готовят непосредственно перед использованием. Для этого 4 мг ОФД растворяют в 10 см3 фосфатно-цитратного буфера и добавляют 0,14 см3 3% раствора перекиси водорода. Раствор должен быть прозрачным и иметь светло-желтый цвет.
2. Приготовление антигена
В заявляемой тест-системе ИФА, предназначенной для выявления и количественного определения антител к реовирусу крупного рогатого скота, специфический антиген готовят используя реовирус штамм «Reo 1 Lang».
Штамм «Reo 1 Lang» реовируса, был получен в 1979 году профессором Гаффаровым Х.З. из ЦВЛ МСХ Великобритании и принятый заявителем в качестве производственного, обладает высокой биологической, антигенной и иммуногенной активностью, сохраняет свои нативные иммунобиологические свойства после инактивации, в нативном виде и после инактивации, отличаются высокой продуктивностью в чувствительных биологических системах культивирования, признан пригодным для изготовления высокочувствительных и специфичных диагностикумов.
Реовирус - РНК-содержащий вирус. Вирионы - сферические частицы диаметром 75-80 нм, с двумя капсидами: наружным и внутренним. Геном реовирусов состоит из 10 сегментов двухнитевой РНК. Штамм «Reo 1 Lang-ДЕП» реовируса, устойчив к эфиру, 1%-ной перекиси водорода, 1%-ному фенолу, 3%-ному формальдегиду, стабилен в широком интервале значений рН от 2,2 до 8,0, инактивируются 70% этиловым спиртом или 3% формалином при 56 0С в течение 30 минут. Вирус агглютинирует эритроциты человека 0-группы. В естественных условиях к вирусу восприимчив крупный рогатый скота.
Штамм «Reo 1 Lang-ДЕП» реовируса типа I крупного рогатого скота депонирован в лаборатории музей штаммов микроорганизмов особо опасных болезней (ООБ) ФГБУ «ФЦТРБ-ВНИВИ» 9 декабря 2009 года, регистрационный номер 2. Местом хранения штамма определена «Лаборатория музей штаммов микроорганизмов ООБ ФГБУ «ФЦТРБ-ВНИВИ», 420075, г. Казань, Научный городок-2.
Реовирус репродуцируют в перевиваемой культуре клеток почек зеленой мартышки (Vero) и/или в перевиваемой культуре клеток почек поросенка (РК-15), реовируссодержащий материал подвергают трехкратному замораживанию и размораживанию с последующим осветлением путем низкоскоростного центрифугирования (3000 об/мин) в течение 30 минут, инактивируют 0,08%-ным раствором 1,2-аминоэтилазиридина. С целью концентрирования антигена супернатант отбирают и подвергают дальнейшему центрифугированию при 30000 об/мин в течение 1 ч. Концентрированный антиген очищают ультрацентрифугированием при 30000 об/мин в течение 2 ч на 10-20-30% градиенте плотности сахарозы.
Пример 1. В заявляемой тест-системе антиген реовируса готовят следующим образом: реовирус репродуцируют в перевиваемой культуре клеток почек зеленой мартышки (Vero) и/или в перевиваемой культуре клеток почек поросенка (РК-15) до накопления вируса в титре 1:32-1:128 ГАЕ. Для заражения реовирусом отбирают матрасы с полным монослоем клеток Vero и/или РК-15, удаляют ростовую среду, вносят в каждый матрас по 5 см вирусного материала. Инкубируют в термостате в течение часа. После этого, не удаляя вирусный материал, вносят поддерживающую среду в объеме 150-200 см и культуру помещают в термостат. Характерность цитопатогенного действия реовируса на культуру клеток Vero и/или РК-15 (зернистость, округление и разрушение клеток) контролируют путем микроскопии матров в течение 72-96 часов после заражения, трижды замораживают при -20°С, затем с каждого матраса отбирают пробы по 5 см3 для посева на стерильность и определения титра в РГА.
Затем реовируссодержащий материал подвергают трехкратному замораживанию и размораживанию с последующим осветлением путем низкоскоростного центрифугирования (3000 об/мин) в течение 30 минут. Инактивируют вирус 0,08%-ным раствором 1,2-аминоэтилазиридина. С целью концентрирования антигена супернатант отбирают и подвергают центрифугированию при 30000 об/мин в течение 2 ч. Концентрированный антиген очищают ультрацентрифугированием при 30000 об/мин в течение 2 ч на 10-20-30% градиенте плотности сахарозы.
Осадок ресуспендируют в карбонатно-бикарбонатном буфере (рН 9,6-9,8), содержащем мертиолят в конечной концентрации 0,1-0,2 мг/см3 и используют в качестве антигена реовируса для сенсибилизации лунок полистироловых планшет. Оценку степени очистки и концентрирования антигена устанавливают по гемагглютинирующей активности, определяемой в РГА, и по показателям оптической плотности белка вирусного антигена на спектрофотометре СФ-46 ЛОМО при длинах волн 235 и 280 нм с поправкой на разведение в кювете по следующей формуле:
По формуле:
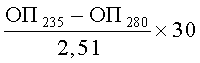
где
-ОП235; ОП280 - оптическая плотность при длине волны 235 и 280 нм, соответственно;
- 30 - разведение исследуемого образца в кювете (1:30).
По результатам шахматного титрования антигена и контрольных сывороток устанавливают в ИФА оптимальную рабочую концентрацию реовирусного антигена, которая в данном случае равняется 5-10 мкг/см3.
3. Приготовление контрольных сывороток
Изготовление контрольной положительной типоспецифической сыворотки против штамма «Reo 1 Lang-ДЕП» реовируса типа I осуществляют путем гипериммунизации клинического здорового молодняка крупного рогатого скота 6-8-месячного возраста, концентрированной, очищенной и инактивированной вирусной суспензией с гемагглютинирующей активностью не ниже 1:256-1:512.
Через 14-16 дней после последнего введения вируса у животных из яремной вены берут пробы крови, получают сыворотку и ставят реакцию торможения гемагглютинации (РТГА) и ИФА.
Сыворотку с антигемагглютинирующим титром в РТГА не ниже 1:1280 и в ИФА - 1:3200-1:6400 расфасовывают в ампулы по 0,5 мл и лиофилизируют.
Пример 2. Изготовление контрольной положительной типоспецифической сыворотки против штамма «Reo 1 Lang-ДЕП» реовируса типа I осуществляют путем гипериммунизации клинического здорового молодняка крупного рогатого скота 6-8-месячного возраста, концентрированной, очищенной и инактивированной вирусной суспензией с гемагглютинирующей активностью не ниже 1:256-1:512.
До начала иммунизации животных из яремной вены берут кровь и сыворотку проверяют на наличие антигемагглютининов к реовирусу крупного рогатого скота. В случаях отсутствия в них специфических антител, животные считаются пригодными для гипериммунизации.
Для получения иммунных сывороток используют вирусный антиген, депонированный в неполном адъюванте Фрейнда, которого готовят путем тщательного смешивания 15 см3 вазелинового масла и 5 см3 обезвоженного ланолина. Полученную смесь подвергают дробной стерилизации в водяной бане 3 дня подряд по 60 минут. Смесь антигена с адъювантом (в равном объеме) подогревают в водяной бане до +37°С, тщательно перемешивают и вводят подкожно в дозе по 2 см3. В последующем гипериммунизацию животных проводят путем трехкратного внутривенного введения инактивированной культуральной вирусной суспензии, очищенной от клеток, в возрастающих дозах 10 см3, 20 см и 30 см3 соответственно с интервалом между введениями 14-16 суток.
С целью предупреждения анафилактической реакции, начиная со второго цикла иммунизации, животному вводят по 2 см3 вируса подкожно за 40 минут до введения основной дозы вируса.
Через 14-16 дней после последнего введения вируса у животных из яремной вены берут пробы крови, получают сыворотку и ставят реакцию торможения гемагглютинации.
Производственное крововзятие допускается при наличии антител в сыворотке крови продуцента к реовирусу крупного рогатого скота не ниже 1:1280-1:2560 в РТГА. Первое крововзятие от продуцентов по объему не должно превышать 0,6 литра крови на 100 кг массы животного, а в последующем - 1,6 литра на 100 кг массы.
Кровь из яремной вены в стерильные цилиндры, смоченные физиологическим раствором, ставят в термальную комнату на 30-40 минут при температуре +37-38°С, после чего сыворотки обводят и цилиндры оставляют на 18 часов при температуре +4-6°С для отстаивания сыворотки. Затем сыворотку отбирают, добавляют мертиолят в соотношении 1:10000, определяют титр антител в РТГА и ИФА с гомологичным антигеном.
Сыворотка с антигемагглютинирующим титром в РТГА не ниже 1:1280 и в ИФА - 1:3200-1:6400 расфасовывают в ампулы по 0,5 см3 и лиофилизируют.
4. Приготовление отрицательной контрольной сыворотки
Крупный рогатый скот выдерживают в карантине в течение 2 месяцев, и исследуют сыворотки крови в ИФА. У клинически здоровых неиммунизированных животных, не содержащих при исследовании в ИФА специфических антител к реовирусу первого серотипа, проводят стерильное взятие крови из яремной вены из расчета 600 см3 крови на 100 кг массы животного. Кровь выдерживают 30 мин в термостате при +37°С, затем обводят и отстаивают при 4°С. Отстоявшуюся сыворотку сливают во флаконы в стерильных условиях, расфасовывают во флаконы по 1 см3 и лиофилизируют.
Пример 3. Стандартизация основных условий проведения исследований, заявляемой тест-системой ИФА
Влияние концентрации антигена реовируса крупного рогатого скота на результаты ИФА исследуют при содержании его 30, 15, 5, 10, 3, мкг/см3. Результаты исследований показали, что максимальное значение коэффициента специфичности отмечается при адсорбции антигена реовируса КРС в концентрации 5-10 мкг/см3. Использование других его концентраций приводит к снижению специфичности реакции.
При разработке иммуноферментных наборов, в которых для исследования используется одно разведение исследуемой сыворотки, важным является подбор условий сорбции иммунной сыворотки на сенсибилизированном антигеном планшете. Для этого в иммобилизированные антигеном лунки планшета вносят контрольные сыворотки в разведениях от 1:100 до 1:12800. Конъюгат используют в рабочем разведении 1:5000, которое определяют в предварительных экспериментах методом «шахматного» титрования.
Оптимальной концентрацией антигена и рабочими разведениями компонентов иммуноферментной тест-системы считают их конечные значения, обеспечивающие в лунках с положительной контрольной сывороткой ОП490 составляло не менее 0,7, а в лунках с отрицательным - не более 0,2. Данным условиям отвечают следующие параметры реакции: концентрация антигена - 5-10 мкг/см3, разведения контрольных сывороток - 1:400 и рабочее разведение конъюгата 1:5000. Оптимальным временем для адсорбции антигена была 18-ти часовая его инкубация при +4±1°С, для сывороток это время составляет 2 ч при +37±1°С.
Пример 4. Определение позитивно-негативного порога тест-системы ИФА.
Для учета и интерпретации результатов, полученных тест-системой ИФА, определен позитивно-негативный порог тест-системы, который находится в диапазоне <16% - ≥25%. В дальнейшем все пробы, значение Ксв. для которых было меньше ПНП, считали отрицательными, а пробы со значением Ксв. равным или превышающим этот показатель положительными.
Пример 5.
Чувствительность и специфичность тест-системы определяли на основании корреляции результатов исследований сывороток крови в РТГА и ИФА (таблица 2).
Результаты, приведенные в таблице 2, свидетельствуют о том, что диагностическая чувствительность разработанной тест-системы по отношению к РТГА составила 111:115×100%=96,5%; диагностическая специфичность 68:73×100%=93,1%; совпадаемость результатов двух методов 179:188×100%=95,2%.
В тоже время, при исследовании сывороток крови в ИФА и РТГА, полученных от заведомо негативных (клинически здоровые контрольные животные из благополучного по данному заболеванию хозяйства, n=90) и заведомо позитивных (подопытные животные, привитые «Ассоциированной вакциной против парво-, реовирусной, герпесвирусной типа I инфекций и вирусной диареи-болезни слизистых оболочек крупного рогатого скота инактивированной эмульсионной», n=90) коров, наблюдалась 100%-я совпадаемость результатов. В первом случае, все результаты исследований были отрицательными, во втором - положительными.
Воспроизводимость тест-системы ИФА определяли в 5-и повторностях как в рамках одной планшеты (набора ИФА), так и между разными наборами ИФА одной серии и наборами разных серий. Величина коэффициента вариации значений Ксв. при исследовании положительных проб (n=15) тест-системой ИФА разных серий не превышала 6,3%, а при исследовании отрицательных (n=13) - 7,4%, что соответствует рекомендуемым параметрам и не превышает 10%. При этом коэффициент корреляции результатов при исследовании положительных проб составил 0,9, а при исследовании отрицательных - 0,95.
Пример 6. Иллюстрация применения тест-системы ИФА
6.1. Подготовка биологического материала для исследования. Для анализа используют сыворотку крови крупного рогатого скота. Если анализ проводят в течение 24 ч после отбора, образцы биоматериала хранят при температуре +4°С. При более длительном хранении образцы замораживают при температуре -20°С. Перед исследованием замороженные образцы быстро (в течение 5-10 мин) нагревают в водяной бане при температуре +37°С. В случае выпадения осадка эритроцитов или белка пробы обязательно осветляют центрифугированием 10 мин при 2000g. Многократное замораживание и оттаивание образцов не допускается. Не использовать объединенные сыворотки от разных животных. Гемолизированные и проросшие сыворотки исследованию не подлежат.
6.2. Подготовка биологических компонентов тест-системы ИФА.
Контрольные отрицательную и положительную сыворотки (амп. или фл.) №1 и №2 растворяют в ФБР-Т и разводят 1:400.
Содержимое ампулы №5 с антивидовым иммунопероксидазным конъюгатом перед употреблением разводят необходимое количество в 5000 раз, например к 0,01 см3 конъюгата добавляют 50 см3 БРК.
6.3. Все исходные компоненты набора стабильны до истечения срока годности.
6.4. Проведение иммуноферментного анализа.
Иммуноферментный анализ (ИФА) проводят в непрямом твердофазном варианте с использованием компонентов, входящих в тест-систему ИФА для серологической диагностики реовирусной инфекции крупного рогатого скота и контроля напряженности поствакцинального иммунитета.
Перед началом работы планшет двукратно промывают рабочим раствором ФБР-Т в объеме 0,15 см3 на лунку.
При исследовании в одном разведении исследуемые и контрольные сыворотки используют в разведении 1:400 фосфатно-буферным раствором с твином (ФБР-Т) №4. Например, к 3,99 см3 ФБР-Т добавляют 0,01 см3 исследуемой сыворотки.
В лунки E12-F12 вносят по 0,1 см3 К+ в рабочем разведении 1:400.
В лунки G12-H12 вносят по 0,1 см3 К- в рабочем разведении 1:400.
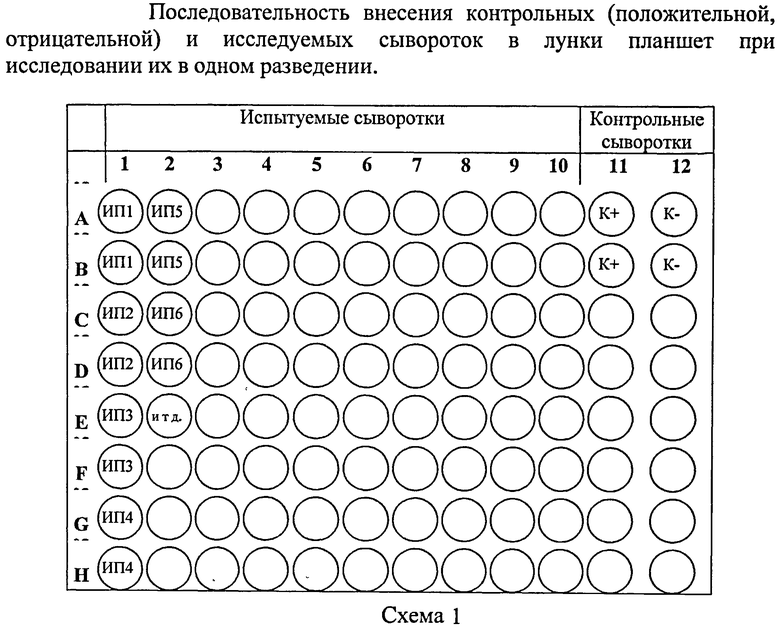
В остальные лунки планшета вносят по 0,1 см3 исследуемой пробы (ИП) сыворотки в разведении 1:400 (по две лунки на каждый образец сыворотки) по схеме 1.
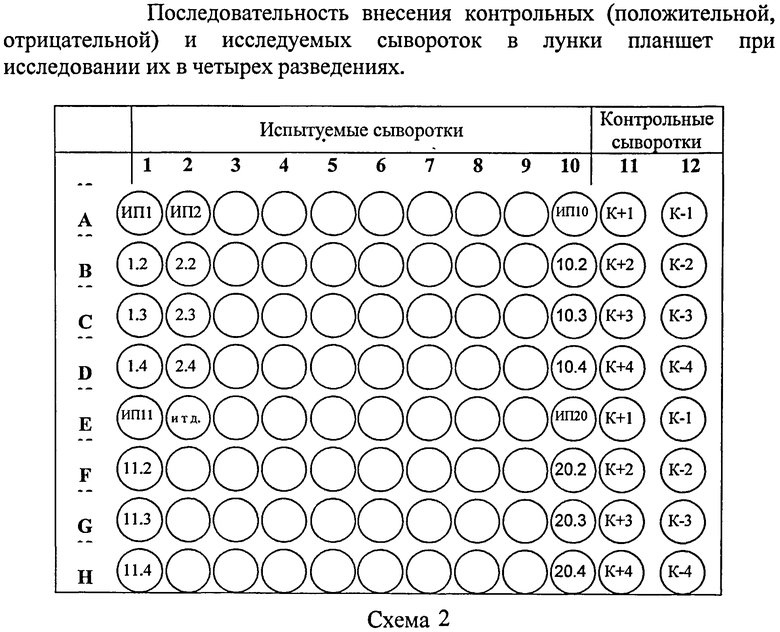
При исследовании в 4-х разведениях исследуемые и контрольные сыворотки используют в разведении 1:800.
Например, к 7,99 см3 ФБР-Т добавляют 0,01 см3 исследуемой сыворотки.
Предварительно во все лунки планшета вносят по 0,1 см3 ФБР-Т. В лунку A11 вносят по 0,1 см3 К+ в рабочем разведении 1:800.
В лунку А12 вносят по 0,1 см3 К- в рабочем разведении 1:800.
В остальные лунки вертикального ряда планшета (А1-А10) вносят по 0,1 см3 исследуемой сыворотки в разведении 1:800 и проводят последовательные двукратные разведения в четырех лунках по схеме 2.
- Закрывают планшет крышкой и инкубируют 2 ч при температуре 37°С.
- Планшет 3 раза промывают буфером ФБР-Т (по 0,15 см3 на лунку), раствор удаляют встряхиванием, с последующим постукиванием по фильтровальной бумаге до полного удаления остатков раствора со стенок и дна лунок планшета.
- В каждую лунку добавляют по 0,1 см3 рабочего раствора конъюгата.
- Планшет закрывают крышкой и инкубируют 1 ч при 37°С.
- Планшет 3 раза промывают буфером ФБР-Т.
- Вносят в каждую лунку по 0,1 см3 рабочего хромоген-субстратного раствора.
- Планшет инкубируют в темноте 5-15 мин при комнатной температуре.
- Останавливают реакцию добавлением 0,1 см3 стоп-реагента (1М H2SO4).
- После остановки реакции оптическую плотность субстратной смеси измеряют на спектрофотометре с вертикальным лучом при длине волны 490 нм (ОП490).
Пример 7. Учет и интерпретация результатов.
При спектрофотометрическом учете результатов исследований сывороток крови в одном разведении производят следующие расчеты:
- Вычисляют среднее арифметическое значение оптической плотности (ОП490) для проб К+(ОП490К+ср);
- Вычисляют среднее арифметическое значение оптической плотности (ОП490) для проб К- (ОП490К-ср);
- Вычисляют среднее арифметическое значение оптической плотности (ОП490) для каждой испытуемой пробы ИП (ОП490ИПср);
- Вычисляют коэффициент связывания (Ксв) конъюгата сывороточными антителами по формуле:
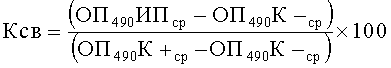

Пробу считали отрицательной, если величина Ксв менее 16%.
Если величина Ксв более 25% пробу считают положительной.
Выявленные результаты исследований сывороток в этом диапазоне (от ≥16% до <25%) считают сомнительными, и анализ следует повторить.
При учете результатов исследований сывороток крови в четырех разведениях производят расчет коэффициента специфичности, который равен отношению оптической плотности продукта реакции в лунках с контрольной положительной (ОП490К+) или исследуемой сывороткой (ОП490ИП) к оптической плотности контрольной отрицательной сыворотки (ОП490К-). Реакцию считают положительной, если коэффициент специфичности не ниже 2,1 и отрицательной, если ниже 2,1.
Обнаружение положительных проб сывороток крови в одном разведении при эпизоотологическом обследовании животных, ранее не вакцинированных против реовирусной инфекции крупного рогатого скота, свидетельствует о циркуляции в стаде возбудителя болезни.
Выявление динамики роста специфических антител в парных пробах сывороток, при исследовании образцов в четырех разведениях, позволяет диагностировать реовирусную инфекцию у исследованного поголовья.
По результатам титрования сывороток в четырех разведениях определяют напряженность иммунитета у вакцинированных животных через 2-3 недели после второй вакцинации путем деления количества проб с титром антител 1:400 и выше у вакцинированных телят 10-20 дневного возраста, а у глубокостельных коров и телок случного возраста с титром антител 1:800 и выше к общему количеству исследованных сывороток и выражают в процентах.
Проведенный нами, с использованием заявляемой тест-системой ИФА, серомониторинг в отношении реовирусной инфекции в 35 хозяйствах Республики Татарстан, Республики Башкортостан и Саратовской области отчетливо демонстрирует, что из 1378 проб сывороток крови крупного рогатого скота специфические антитела к реовирусу типа I в ИФА у 638 (46,2%) животных (таблица 3). Полученные результаты указывают на факт циркуляции этого возбудителя среди обследованного поголовья скота.
Таким образом, предлагаемая тест-система позволяем а спровадить широкомасштабные исследования малоизученной и малоизвестной в РФ реовирусной инфекции крупного рогатого скота и осуществлять оценку эффективности вакцинопрофилактики.
Источники информации
1. Ритова, В.В., Трофимов Н.М. Реовирусы и их роль в инфекционной патологии человека и животных // Вопросы вирусологии. - 1977. - 2. - С.134-141.
2. Сюрин В.Н., Самуйленко А.Я., Соловьев Б.В., Фомина Н.В., - Вирусные болезни животных. / Москва, ВНИТИБП. - 1998. - С.18-19
3. Сульбо Ж., Петермани X., Терр Ж., Брюн А., Шапюи Г., Тивро М. // В сб. «Резюме докл. 2-го Межд. симп. ВАВМИ и спец. зар. бол». Варна. - 1973. - 23 с.
4. Abinanti, F.R.:Vet.Bull32., - 1962. - 150 p.
5. Böckmann, J. Serologische erhebungen über die verbreitung von reovirusinfektionen im österreichischen mastkälberstrapel. / Wien. tierärztl. mschr. - 1976. - 63. - P. 358-360.
6. Brubaker, M.M., West, В., Ellis Human blood group influence on reovirus hemagglutinatination litres. / Proc. soc. exp. boil. (N.Y.). - 1964. - 115. - P.1118-1120.
7. Lamont, P.H., Darbyshire, J.H., u. Dawson, P.S.:J. Comp. Path. 78. - 1968. - 23 p.
8. Moreno-Lopez, J. A serosurvey of viruses during outbreaks of acute respiratory and /or enteritic disease in Swedish cattle. / Zbl.vet.med Reihe В. - 1979. - 26. - 8. - Р.634-640.
9. Perreau P. «Res. Ved. Veter», 1973. - 149. - №9. - P.1147-1162
10. Rosen, L. Reoviruses in animals other than man. / Ann. N.Y. acad. sci. - 1962. - 101. - P.461-465.
11. Rosen L. Diagnostic procedures for viral and Rickettsial infections, Москва: «Медицина». - 1974 перевод с англ. - С.285-291.
12. Rosen, L., Abinanti, F.R, u. Hovis, J.F. // Amer. J. Hyg. 77. - 1963. - P.38.
13. Sabin, A.B. Reoviruses. / Science. - 1959. - 130. - P.1387.
14. Wizigmann, G., Reinhardt G. Untersuchungen über Reovirus-Infektionen beim Rind in der Bundesrepublik Deutschlan // Zbl. vet, med. - 1971. - 18 - P.564.
15. Gaillard R.K., loklik W.K. Quantitation of the relatedness of the genjmes of reoviruses serotype 1, 2 and 3 at the gene level. // Virology., 1982. - P.123. - 152.
16. Stanley N.F., Dorman D.C., Pansford I., 1953 - Aust.I. exp. «Biol. med Sci» 1953. - V.31. - P.149-159.
17. Sharpe A.H., Fields B.N., - Pathogenesis of reovirus infection. In: The Reoviridae, ed by W.K. loklik, Plenum, New. York. - 1983. - P.229-285.
18. Thomas L., Collins A., - Veter. Rec., 1974. - 94. - №22. - Р.506-509.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНА АССОЦИИРОВАННАЯ ПРОТИВ ПАРВОВИРУСНОЙ, РЕОВИРУСНОЙ, ГЕРПЕСВИРУСНОЙ ТИПА I ИНФЕКЦИЙ И ВИРУСНОЙ ДИАРЕИ - БОЛЕЗНИ СЛИЗИСТЫХ ОБОЛОЧЕК КРУПНОГО РОГАТОГО СКОТА ИНАКТИВИРОВАННАЯ ЭМУЛЬСИОННАЯ | 2010 |
|
RU2452512C2 |
| ТЕСТ-СИСТЕМА ИФА ДЛЯ СЕРОЛОГИЧЕСКОЙ ДИАГНОСТИКИ ПАРВОВИРУСНОЙ ИНФЕКЦИИ КРУПНОГО РОГАТОГО СКОТА И ОПРЕДЕЛЕНИЯ УРОВНЯ ПОСТВАКЦИНАЛЬНЫХ АНТИТЕЛ | 2010 |
|
RU2461008C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К АНТИГЕНУ РЕОВИРУСНОГО ТЕНОСИНОВИТА КУР | 2000 |
|
RU2192012C2 |
| ИММУНОФЕРМЕНТНАЯ ТЕСТ-СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ СПЕЦИФИЧЕСКИХ АНТИТЕЛ К БАКТЕРИЯМ MORAXELLA BOVOCULI В СЫВОРОТКЕ КРОВИ КРУПНОГО РОГАТОГО СКОТА | 2018 |
|
RU2687747C1 |
| ВАКЦИНА АССОЦИИРОВАННАЯ ПРОТИВ АДЕНОВИРУСНОЙ, ГЕРПЕСВИРУСНОЙ ИНФЕКЦИЕЙ, ПАРАГРИППА-3 И ВИРУСНОЙ ДИАРЕИ-БОЛЕЗНИ СЛИЗИСТЫХ ОБОЛОЧЕК КРУПНОГО РОГАТОГО СКОТА ИНАКТИВИРОВАННАЯ ЭМУЛЬСИОННАЯ | 2012 |
|
RU2517733C1 |
| КОМПЛЕКСНАЯ ТЕСТ-СИСТЕМА ИММУНОФЕРМЕНТНОГО АНАЛИЗА (ИФА) ДЛЯ ОПРЕДЕЛЕНИЯ УРОВНЯ АНТИТЕЛ К ВИРУСНЫМ РЕСПИРАТОРНЫМ ЗАБОЛЕВАНИЯМ КРУПНОГО РОГАТОГО СКОТА | 2008 |
|
RU2371726C1 |
| Иммуноферментная тест-система для серологической диагностики анаэробной энтеротоксемии животных и контроля напряженности поствакцинального иммунитета | 2016 |
|
RU2625031C1 |
| Тест-система ИФА для серологической диагностики нодулярного дерматита крупного рогатого скота - Dermatitis nodularis bovum | 2016 |
|
RU2640192C1 |
| Способ дифференциальной экспресс-диагностики бруцеллеза крупного рогатого скота | 2016 |
|
RU2635515C1 |
| СПОСОБ ПОЛУЧЕНИЯ СТАНДАРТНОЙ ПОЛОЖИТЕЛЬНОЙ ПАНЕЛИ СЫВОРОТОК КРОВИ ДЛЯ КОНТРОЛЯ КАЧЕСТВА ИММУНОФЕРМЕНТНЫХ ТЕСТ-СИСТЕМ, ПРЕДНАЗНАЧЕННЫХ ДЛЯ ВЫЯВЛЕНИЯ СПЕЦИФИЧЕСКИХ АНТИТЕЛ К ВИРУСНЫМ РЕСПИРАТОРНЫМ ИНФЕКЦИЯМ В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ ОРГАНИЗМА КРУПНОГО РОГАТОГО СКОТА | 2008 |
|
RU2392331C2 |
Изобретение относится к области ветеринарной вирусологии и касается иммуноферментной тест-системы для серологической диагностики реовирусной инфекции крупного рогатого скота и контроля напряженности поствакцинального иммунитета. Представленная иммуноферментная тест-система содержит специфический антиген штамма «Reo 1 Lang-ДЕП» реовируса типа I, инактивированный 0,08%-ным раствором 1,2-аминоэтилазиридина, представляющий собой специфический белок в концентрации 5-10 мкг/см3, адсорбированный на поверхности полистироловых лунок в карбонатно-бикарбонатном буфере с мертиолятом в конечной концентрации 0,1-0,2 мг/см3, контрольную положительную сыворотку, полученную к антигену реовируса типа I с активностью в ИФА 1:3200-1:6400, контрольную отрицательную сыворотку, конъюгат антивидовой, калий фосфорнокислый однозамещенный, калий фосфорнокислый двухзамещенный, натрий хлористый, хромоген (орто-фенилендиамин), перекись водорода, стоп-реагент и панели для постановки реакции иммуноферментного анализа. Тест-система позволяет проводить диагностику реовирусной инфекции крупного рогатого скота с высокой чувствительностью. 2 ил., 3 табл., 7 пр.
Иммуноферментная тест-система для серологической диагностики реовирусной инфекции крупного рогатого скота и контроля напряженности поствакцинального иммунитета, отличающаяся тем, что она содержит специфический антиген штамма «Reo 1 Lang-ДЕП» реовируса типа I, инактивированный 0,08%-ным раствором 1,2-аминоэтилазиридина, представляющий собой специфический белок в концентрации 5-10 мкг/см3, адсорбированный на поверхности полистироловых лунок в карбонатно-бикарбонатном буфере с мертиолятом в конечной концентрации 0,1-0,2 мг/см3, контрольную положительную сыворотку, полученную к антигену реовируса типа I с активностью в ИФА 1:3200-1:6400, контрольную отрицательную сыворотку, конъюгат антивидовой, калий фосфорнокислый однозамещенный, калий фосфорнокислый двухзамещенный, натрий хлористый, хромоген (орто-фенилендиамин), перекись водорода, стоп-реагент и панели для постановки реакции иммуноферментного анализа.
| ШТАММ "ВНИВИП-ДЕП" ДЛЯ ПОЛУЧЕНИЯ ВАКЦИНЫ ПРОТИВ РЕОВИРУСНОГО ТЕНОСИНОВИТА КУР | 1998 |
|
RU2158304C2 |
| CN 1940535 А, 04.04.2007 | |||
| RU 2010120755 А, 10.10.2011. | |||
Авторы
Даты
2013-07-20—Публикация
2011-10-04—Подача