Настоящая заявка испрашивает приоритет международной заявки номер PCT/IB2009/050276, поданной 23 января 2009 г., которая испрашивает приоритет предварительной заявки США №61/022888, поданной 23 января 2008 г., которая включена в настоящую заявку путем отсылки.
Изобретение относится к ультразвуковым диагностическим системам визуализации и, в частности, к применению ультразвуковых диагностических систем визуализации для оценки протекания терапевтического лечения опухолей.
Международная патентная публикация WO 2006/090309 (Bruce et а1.) содержит описание метода ультразвуковой визуализации для обнаружения патологических изменений в печени с использованием ультразвукового контрастного вещества. Болюс контрастного вещества вводят в тело, и определяют время поступления контрастного вещества в печень. Когда болюс контрастного вещества проходит по кровеносным сосудам тела и начинает проявляться в конкретном органе или локализации в теле, и нарастание контраста в изображениях называют «накоплением» контрастного вещества. По мере того, как инфузия контрастного вещества выходит на постоянный уровень в локализации в теле и затем уменьшается, когда контрастное вещество выносится из локализации кровотоком, при этом, снижение называют «выведением» контрастного вещества. В вышеупомянутой патентной публикации, изобретатели используют такую особенность, как поступление кровотока в печень из двух источников, печеночной артерии и воротной вены. Поскольку кровоток во время первой, артериальной фазы кровотока сначала будет заливать HCC (гепатоцеллюлярную карциному) и метастатические патологические изменения печени, то изобретатели идентифицируют упомянутые патологические изменения посредством определения периодов времени прихода контрастного вещества в печень во время артериальной и более поздней воротной фазы кровотока. Зона раннего накопления контрастного вещества в печени может быть симптомом патологического изменения.
После того, как патологическое изменение или метастаз идентифицируют упомянутым и/или другим способом, врачом обычно назначается режим лечения. Терапия может включать в себя, например, гипер-/гипотермию, цитотоксическую химиотерапию или ингибиторы ангиогенеза. Обычно, терапия осуществляется не за один сеанс, а за несколько сеансов в течение периода нескольких недель или месяцев. При каждом сеансе терапии, врачу, как правило, желательно оценивать ход терапии для определения эффективности терапии пациента. Патологическое изменение или метастаз можно визуализировать диагностическими методами, чтобы наблюдать, например, сокращаются ли их размеры. Однако, продвижение терапии является замедленным, и, после предшествующего сеанса, происходят лишь небольшие перемены патологического изменения или метастаза. В таких случаях, желательно количественно оценивать продвижение терапии путем измерения некоторых характеристик опухоли. Одним из таких измеряемых критериев являет регрессия ангиогенеза опухоли. По мере того, как патологическое изменение или метастаз сокращается вместе некрозом ее(его) клеток, микрососуды, которые развивались для питания патологического изменения, будут обеспечивать меньшую доставку крови для патологического изменения и сами могут начать сокращение. Один из количественных способов состоит в оценке данной регрессии ангиогенеза, подавления функционирования микрососудов патологического изменения. Желательно, чтобы данные количественно измеримые критерии были воспроизводимы и нечувствительны к изменениям между последовательными процедурами визуализации, например, к изменению болюсной инъекции, минутного объема сердца пациента и настроек ультразвукового аппарата, которые могут изменяться от одного дня исследования к другому. Устранение влияния упомянутых изменений позволяет сравнивать данные измерений разных сеансов терапии. Целью настоящего изобретения является создание новых и усовершенствованных методов оценки ангиогенеза патологического изменения или метастаза в течение периода терапии опухоли.
В соответствии с принципами настоящего изобретения, получают кривые временной интенсивности накопления и выведения ультразвуковых контрастных веществ и применяют их для количественного определения ангиогенеза опухоли, получаемого в результате терапии. Изображение патологического изменения или метастаза получают посредством системы ультразвуковой визуализации, и патологию непрерывно визуализируют по мере того, как контрастное вещество накапливается в наблюдаемой ткани или наблюдаемом органе или выводится из них. Для точного измерения данного процесса желательно непрерывно получать ультразвуковые сигналы из одной и той же локализации метастаза по мере того, как контрастное вещество накапливается и выводится, чтобы из одной и той же точки патологического изменения непрерывно приходила переносимая сигналов информация для вычисления кривых временной интенсивности. В соответствии с первым аспектом настоящего изобретения, влияние дыхательного движения устраняют селекцией сбора данных по дыханию для получения кривых временной интенсивности. Предпочтительный метод селекции по дыханию является методом, основанным на анализе изображения, в котором присутствие или отсутствие анатомического ориентира в изображении, например, диафрагмы, используют для принятия решения о том, следует ли или нет применять обработку кривых временной интенсивности.
В соответствии с дополнительным аспектом настоящего изобретения, кривую временной интенсивности формируют как для ультразвуковых данных от опухоли, так и для ультразвуковых данных от нормальной ткани. Параметр времени накопления (WIT) вычисляют для каждой кривой временной интенсивности. Отношение времен накопления (WITR), формируемое из двух параметров, уменьшает колебания количественного определения времени накопления, обусловленные такими факторами, как различия болюсов, минутным объемом сердца и настройками ультразвуковой системы. Таким образом, WITR обеспечивает точный и допускающий сравнимый показатель хода терапии.
В соответствии с еще одним аспектом настоящего изобретения, выполняют взаимное вычитание кривых временной интенсивности опухоли и нормальной ткани для формирования дифференциальной кривой временной интенсивности. Форма дифференциальной кривой временной интенсивности и ее изменения со временем являются другим показателем хода терапии.
На чертежах:
Фигура 1 - блок-схема ультразвуковой диагностической системы визуализации, выполненной в соответствии с принципами настоящего изобретения.
Фигуры 2 и 3 - подробные блок-схемы последовательности операций процессора QLab, показанного на фигуре 1, в соответствии с принципами настоящего изобретения.
Фигура 4 - селекция по дыханию в процессе обработки изображения в соответствии с принципами настоящего изобретения.
Фигура 5 - изображение ROI (представляющих интерес областей) для кривых временной интенсивности в соответствии с настоящим изобретением на изображении печени, полученном в течение артериальной фазы.
Фигура 6 - изображение ROI для кривых временной интенсивности в соответствии с настоящим изобретением на изображении печени, полученном в течение более поздней воротной фазы.
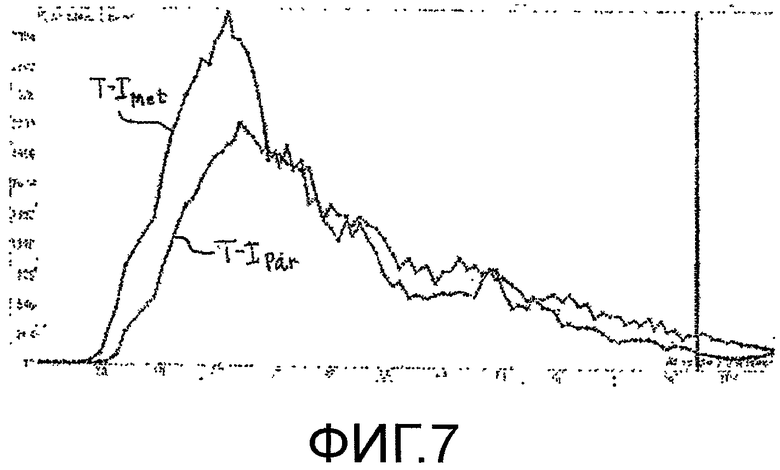
Фигура 7 - кривые временной интенсивности для метастатического поражения и нормальной паренхимы.
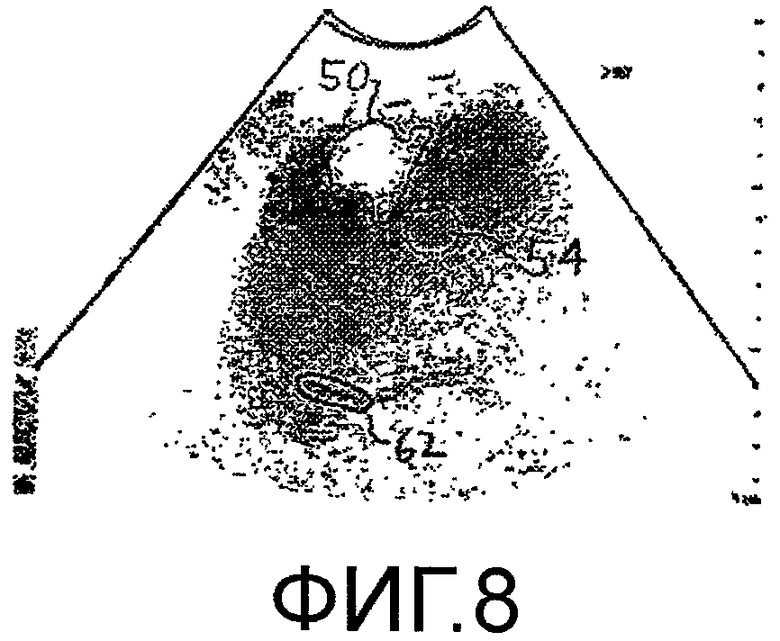
Фигура 8 - идентификация диафрагмы в ультразвуковом изображении при селекции по дыханию в соответствии с принципами настоящего изобретения.
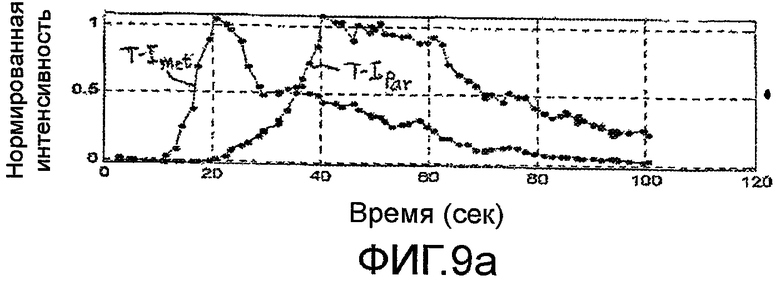
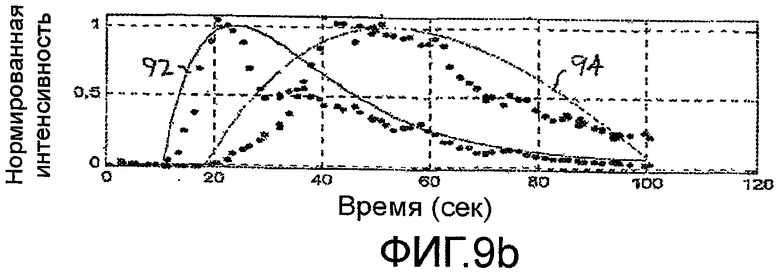
Фигуры 9a-9d - создание и вычитание кривых временной интенсивности для формирования дифференциальной кривой временной интенсивности в соответствии с принципами настоящего изобретения.
Фигура 10 - клинические результаты оценок хода лечения в соответствии с настоящим изобретением.
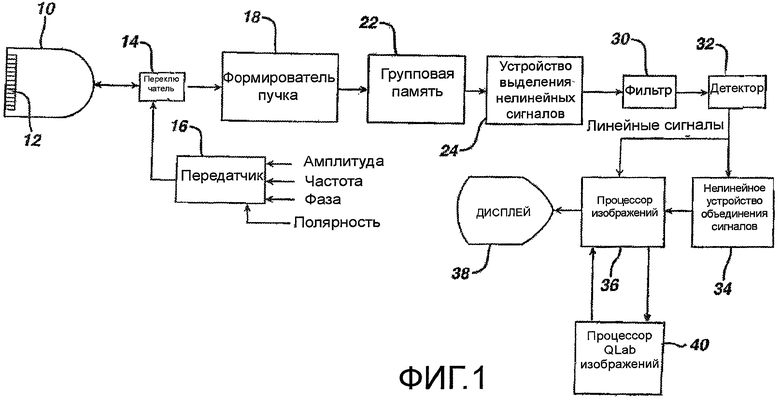
Во-первых, на фигуре 1 показано, в виде блок-схемы последовательности операций, формирование ультразвукового изображения в соответствии с принципами настоящего изобретения. Настоящая система действует посредством сканирования двух- или трехмерной области тела, визуализируемой с использованием проходящих ультразвуковых пучков. Так как каждый пучок пропускается вдоль его направленной траектории сквозь тело, пучок отражается в виде эхо-сигналов с линейными и нелинейными составляющими (с основными и высшими гармоническими частотами), соответствующими проходящим частотным составляющим. Проходящие сигналы модулируются нелинейным откликом микропузырьков контрастного вещества, встречающихся на пути пучка, вследствие чего формируются эхо-сигналы с высшими гармоническими составляющими.
В ультразвуковой системе, показанной на фигуре 1, применяется передатчик 16, который посылает волны или импульсы с выбранной модуляционной характеристикой в требуемом направлении пучка для отражения высших гармонических составляющих эхо-сигналов от рассеивающих объектов внутри тела. Передатчик реагирует на ряд параметров управления, которые определяют характеристики посылаемых пучков, включая частотные составляющие посылаемого пучка, их относительные интенсивности или амплитуды и фазу или полярность посылаемых сигналов. Передатчик связан переключателем 14 передачи/приема с элементами матричного преобразователя 12 ультразвукового датчика 10. Матричный преобразователь может быть одномерной матрицей для планарной (двумерной) визуализации или двумерной матрицей для двумерной или объемной (трехмерной) визуализации.
Матричный преобразователь 12 принимает из тела эхо-сигналы, содержащие частотные составляющие основной гармоники (линейную) и высших гармоник (нелинейные), которые находятся в пределах полосы пропускания преобразователя. Упомянутые эхо-сигналы вводятся переключателем 14 в формирователь пучка 18, который соответственно задерживает эхо-сигналы от разных элементов преобразователя, затем объединяет их для формирования последовательности линейных сигналов и сигналов высших гармоник вдоль пучка с небольших и больших глубин. В предпочтительном варианте, формирователь пучка является цифровым формирователем пучка, работающим с оцифрованными эхо-сигналами, для формирования последовательности дискретных когерентных цифровых эхо-сигналов с глубин изображения от ближней зоны до дальней зоны. Формирователь пучка может быть многолучевым формирователем пучка, который формирует, по меньшей мере, две последовательности эхо-сигналов вдоль нескольких пространственно несовпадающих принимаемых сканирующих линий в ответ на один посланный пучок, что особенно полезно для 3-мерной визуализации. Эхо-сигналы, обработанные формирователем пучка, вводятся в групповую память 22.
В ультразвуковой системе, показанной на фигуре 1, несколько волн или импульсов посылаются в направлении каждого пучка, с использованием разных методов модуляции, что приводит к приему нескольких эхо-сигналов для каждой сканируемой точки в поле изображения. Эхо-сигналы, соответствующие общей пространственной локализации, именуются в настоящей заявке группой эхо-сигналов и сохраняются в групповой памяти 22, из которой упомянутые эхо-сигналы можно совместно вызывать и обрабатывать. Эхо-сигналы группы объединяются различными способами в устройстве 24 выделения нелинейных сигналов для формирования требуемых нелинейных сигналов или сигналов высших гармоник. Например, в каждую точки в поле изображения можно посылать два импульса с разной модуляций по фазе или полярности. Когда эхо-сигналы, получающиеся в результате двух импульсов, принимаются ультразвуковой системой и аддитивно объединяются, разная модуляция приводит к тому, что основные частотные составляющие эхо-сигналов взаимно погашаются, и составляющие высших гармоник взаимно усиливаются. Тем самым, выделяются высшие гармонические составляющие эхо-сигналов. В альтернативном варианте, когда два эхо-сигнала взаимно вычитаются, усиливаются составляющие с частотой основной гармоники, и погашаются составляющие высших гармоник. Тем самым, выделяются частоты основных гармоник для построения изображения в стандартном B-режиме. Такая модуляция именуется «инверсией импульса» и может выполняться посредством фазовой, полярной или амплитудной модуляцией, как поясняется в патентах США 5706819 (Hwang et al.), 5951478 (Hwang et al.) и 5577505 (Brock Fisher et al.).
Выделенные сигналы фильтруются фильтром 30, чтобы дополнительно устранить нежелательные частотные составляющие, затем проходят детектирование детектором 32 в B-режиме или с использованием эффекта Доплера. Детектированные сигналы вводятся в нелинейное устройство 34 объединения сигналов для подавления спекл-структур в изображении. Затем сигналы обрабатываются для формирования двумерного, трехмерного, спектрального, параметрического или другого требуемого изображения в процессоре 36 изображений, и затем изображение отображается на дисплее 38. Детектированные основные (линейные) сигналы, которые не нуждаются в обработке для подавления спекл-структур, вводятся непосредственно в процессор 36 изображений для формирования и отображения изображения.
В соответствии с принципами настоящего изобретения, данные ультразвукового изображения вводятся также в процессор QLab 40 изображений для получения кривых временной интенсивности и характеристик накопления и выведения контрастного вещества. Кривые временной интенсивности и характеристики, полученные процессором QLab, вводятся обратно в процессор изображений, в котором они могут представляться в числовой или графической форме на дисплее 38 вместе с ультразвуковыми изображениями. Стандартный процессор QLab, который пригоден для получения кривых временной интенсивности, выпускается компанией Philips Healthcare, Andover, Massachusetts.
Стандартный процессор QLab создает известные кривые временной интенсивности, называемые также перфузионными кривыми или реперфузионными кривыми. Смотри патент США 5833613 (Averkiou et al.), международную патентную публикацию WO 2005/099579 (Rafter) и международную патентную публикацию WO 2005/054898 (Garg et al.) Как поясняется в приведенных публикациях, накопление контрастного вещества в точках ткани (точках в изображении) контролируется во время прихода контрастного вещества в локализацию в теле. Количество контрастного вещества в точке характеризуется интенсивностью эхо-сигналов, отражаемых от микропузырьков контрастного вещества в каждой точке, и присутствует в последовательности изображений, получаемых при маломощной передаче (с низким MI (механическим индексом) по мере того, как контрастное вещество накапливается в ткани. Кривую временной интенсивности можно сформировать по упомянутому нарастанию интенсивности контраста и его последующему снижению во время выведения контрастного вещества для каждой точки в ткани, которая отражает эхо-сигналы по временной последовательности, кадр за кадром. Количественное представление кривых временной интенсивности для всей наблюдаемой ткани можно сформировать посредством окрашивания каждого пикселя в анатомическом изображении цветом, который представляет параметр кривых временной интенсивности в каждой точке в изображении. В заявке Гарга с соавторами (Garg et al.) описано формирование параметрического изображения миокарда, при котором цвет каждого пикселя в изображении представляет максимальный уровень, достигаемый кривой временной интенсивности в каждой точке, например, миокарда. Смотри также патент США 6692438 (Skyba et al.).
При реализации настоящего изобретения, данные эхо-сигналов перфузии контрастного вещества получают из последовательности изображений по мере того, как контрастное вещество приходит в локализацию метастаза в теле, накапливается и затем выводится. Следовательно, значения интенсивности эхосигналов будут начинаться с уровня базовой линии, соответствующего отсутствию контрастного вещества, затем повышаться, проходить горизонтальный участок и снижаться, когда контрастное вещество выводится. Затем алгоритм аппроксимации кривых согласует упомянутое изменение данных с функцией ошибок, заданной выражением
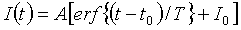
где I(t) означает линейную интенсивность в момент t, A означает максимальную интенсивность относительно смещения базовой линии, T означает временной параметр накопления, который линейно пропорционален времени накопления (например, в диапазоне от 5% до 95%), I0 означает смещение базовой линии, и t0 означает сдвиг по времени. Из аппроксимированной кривой, предпочтительно, вычитается время накопления, вместо искаженных данных изображения. В предпочтительном варианте, данные эхо-сигналов от контрастного вещества не подвергаются уплотнению данных перед упомянутой обработкой, чтобы данные сохраняли полученную линейную взаимосвязь между ними. Другой подход состоит в аппроксимации всей кривой временной интенсивности (вместо лишь ее накопительной части) подходящими математическими моделями в виде логарифмически нормального распределения, например, заданного выражением
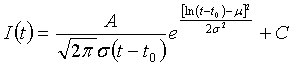
где μ и σ означают среднее значение и стандартное отклонение нормального распределения, из которого можно получить логарифмическое преобразование. Возможны изменения масштаба кривой по горизонтали посредством изменения • и ее асимметрии посредством изменения •. Площадь под кривой равна A, t0 означает сдвиг по времени, и C является смещением базовой интенсивности. Кривая, аппроксимированная логарифмически нормальным распределением, служит для вычитания времени накопления.
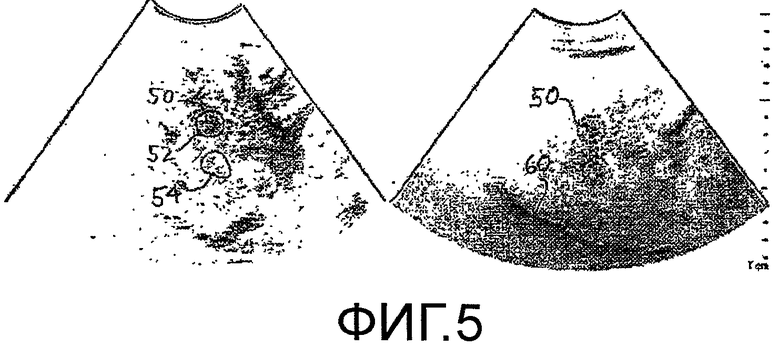
На фигуре 5 представлена одна пара изображений в последовательности кадров изображения метастаза 50 в окружающей ткани печени. Пара изображений сформирована по данным одних и тех же эхо-сигналов, где левое изображение является изображением на второй гармонике, в котором выделяется контрастное вещество, и правое изображение является изображением на основной частоте той же анатомической структуры. Когда в печень поступает контрастное вещество, снабжаемый им метастаз 50 четко выделяется в изображении на гармонике, и его границу можно очертить контурной кривой 52. Контурную кривую можно построить вручную или методом автоматической или полуавтоматической обработки, например, определением границ, пороговой обработкой или методом наращивания областей, запускаемым указанием исходной точки на границе метастаза. Следовательно, контурная кривая 52 границы определяет представляющую интерес область (ROI) метастаза в пределах его границы. Как можно видеть на правом изображении в фундаментальном B-режиме, метастаз 50 заметен менее четко, так как, при таком представлении, подавляется частотная характеристика контрастного вещества. При очерчивании ROI метастаза контурной кривой 52 границы, интенсивность контрастного вещества в метастазе во время получения изображения можно измерять объединением значений пикселей внутри границы 52 с использованием интегрирования, суммирования, усреднения или другого выбранного метода объединения.
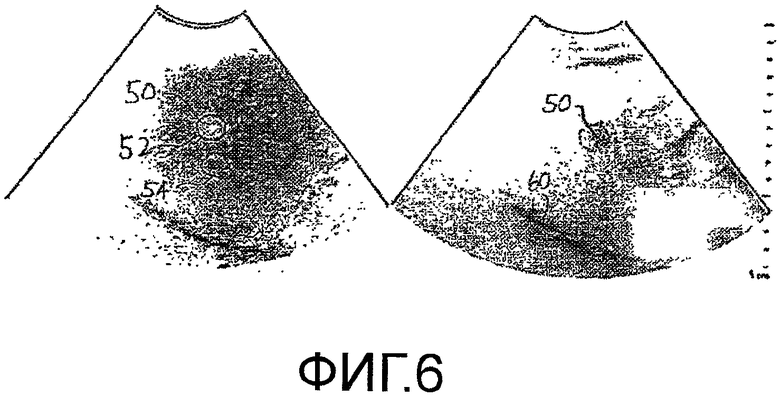
Изображения, показанные на фигуре 5, получены в течение артериальной фазы кровотока в печень. На фигуре 6 представлена пара изображений на высшей гармонике и основной частоте одной и той же ткани и метастаза 50, полученных в последней воротной фазе. Как ранее упоминалось, HCC (гепатоцеллюлярная карцинома) и метастатические патологические изменения печени обычно получают большую часть своей перфузии крови во время артериальной фазы, тогда как нормальная паренхима в печени получает большую своей перфузии крови во время воротной фазы, как показано более интенсивным затенением печени на левом изображении на фигуре 6. Для более понятного пояснения, ультразвуковые изображения в приведенном случае применения показаны черным на белом фоне полутонами, что более понятно, чем традиционное изображение белым на черном фоне.
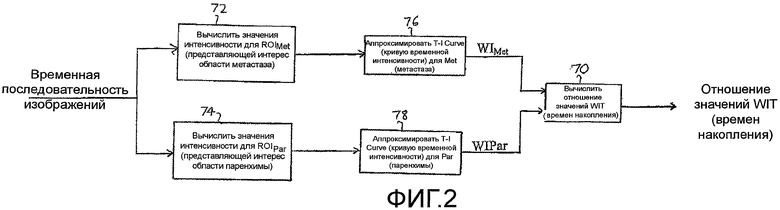
В соответствии с принципами настоящего изобретения, параметр, называемый в настоящей заявке отношением времени наполнения (WITR) вычисляется как количественная мера перфузии метастаза. Вычисление WITR выполняется, как показано на блок-схеме последовательности операций на фигуре 2. Из временной последовательности изображений метастаза или патологического изменения во время накопления и выведения контрастного вещества, как показано на фигурах 5 и 6, вычисляют значения интенсивности контрастного вещества для ROIMet метастаза 50, как показано на этапе 72. Как пояснялось выше, упомянутые значения можно вычислять посредством объединения значений пикселей ROI метастаза для каждого изображения из последовательности. На этапе 74, значения интенсивности вычисляют для ROIPar нормальной паренхимы ткани. Вычисление можно выполнять оконтуриванием области нормальной ткани, как показано контурной кривой 54 на фигурах 5 и 6, и использованием значений пикселей перфузии нормальной ткани в пределах упомянутой второй контурной кривой. Поэтому упомянутые значения являются значениями перфузии нормальной ткани. На этапе 76, кривую временной интенсивности аппроксимируют согласно значениям перфузии ROIMet, и, на этапе 78, кривую временной интенсивности временной интенсивности аппроксимируют согласно значениям перфузии ROIPar. Аппроксимация не всегда необходима, но обеспечивает более точную оценку WITR. Хотя WITR можно измерить непосредственно по данным, однако, шум в данных может помешать точности измерения, и, поэтому, предпочтительна аппроксимация кривой. На фигуре 7 показано две упомянутых кривых временной интенсивности, кривая T-IMet для ROI метастаза и кривая T-IPar для паренхимы. Временной параметр накопления WIT находят для каждой кривой, например, с использованием вышеописанных функции ошибок или логарифмически нормального распределения. Таким образом определяют временной параметр накопления как для метастаза, так и для нормальной паренхимы, WITMet и WITPar, соответственно. Затем вычисляют отношение WITR времени наполнения из двух параметров посредством деления WITMet на WITPar. Результат нормирования WITMet делением на временной параметр накопления нормальной ткани предназначен для уменьшения или исключения влияния таких переменных процедуры, как величина болюса, минутный объем сердца и настройки ультразвуковой системы, которые могут различаться для разных сеансов терапии. Следовательно, сравнимые количественные меры роста или сокращения метастаза, на которые указывает его ангиогенез, можно получать для каждого сеанса терапии в течение периода нескольких недель или месяцев, когда осуществляется лечение пациента.
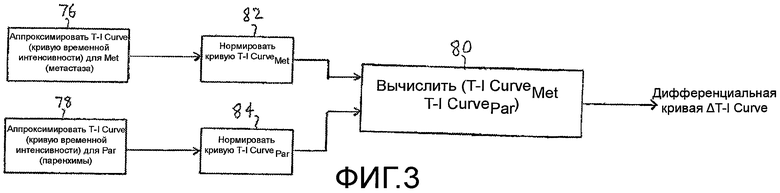
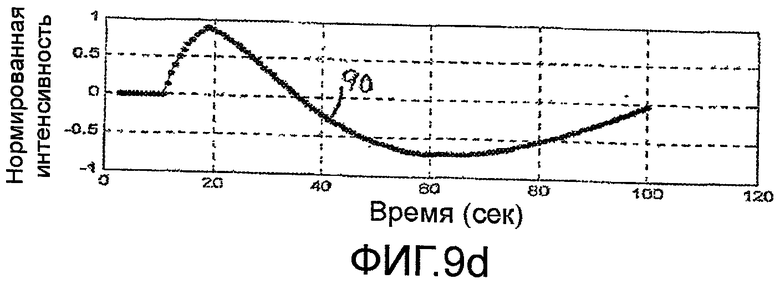
Другая количественная мера ангиогенеза метастаза, которая уменьшает или исключает влияние скорости болюсной инъекции, минутного объема сердца пациента или изменения настроек установки, показана на фигуре 3. Кривую временной интенсивности аппроксимируют для каждой из ROI метастаза и паренхимы, как показано на этапах 76 и 78. На этапах 82 и 84, диапазон изменения каждой кривой временной интенсивности нормируют. Удобный масштабный коэффициент нормирования составляет от нуля до единицы. На этапе 80 вычисляют разностную кривую временной интенсивности ΔТ-I Curve в форме разности между двумя нормированными кривыми T-I CurveMet и T-I CurvePar. Данная процедура и ее результаты показаны на фигурах 9a-9d. Точки на фигуре 9а представляют значения интенсивности перфузии метастаза (T-IMet) и нормальной паренхимы (T-IPar), полученные за второй период в сто секунд накопления и выведения кривых контрастного вещества. Два набора значений нормируют к тому же масштабу от нуля до единицы, при этом, максимальное значение интенсивности в каждом наборе данных масштабируют до уровня единицы. Приведенные кривые показывают характеристику раннего накопления контрастного вещества во время артериальной фазы для метастаза и более поздней перфузии паренхимы печени во время воротной фазы. На фигуре 9b, кривая 92 (например, функция ошибок или логарифмически нормальное распределение) аппроксимирована по значениям перфузии метастаза, и кривая 94 аппроксимирована по значениям перфузии паренхимы. На фигуре 9с показаны две кривые 92 и 94 изображены более темными линиями, без полученных значений данных интенсивности. На фигуре 9d показана кривая 90, которая является вычисленной разностной кривой ΔТ-I Curve двух кривых 92 и 94, показанных на фигуре 9с. Когда терапия опухоли успешна, и ангиогенез метастаза ослабляется в ходе лечения, кривая ΔТ-I Curve будет демонстрировать прогрессивное уплощение и будет приближаться к прямой линии. Приведенный результат является ожидаемым, так как, когда патологическое изменение исчезает, то его локализация в теле будет реагировать подобно нормальной паренхиме, и разность двух (теперь, фактически идентичных) кривых для нормальной ткани и локализации патологического изменения будет стремиться к нулю. Разностную кривую можно также выразить в виде значения такого параметра, как максимальный наклон разностной кривой. Когда максимальное значение наклона стремится к нулю (наклон отсутствует), то это указывает, что разностная кривая стремится к прямой линии.
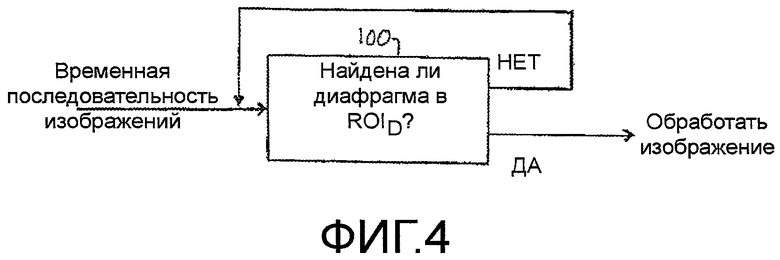
Как видно из временной шкалы графиков на фигурах 9a-9d, типичный период накопления и выведения контрастного вещества может длиться 100 секунд. Это означает, что врач, собирающий данные изображения, должен неотрывно сопровождать одно и то же изображение патологического изменения в течение 100 секунд, чтобы каждое значение интенсивности относилось к одной и той же области патологического изменения. Например, если датчик перемещается в течение сбора данных, то патологическое изменение может перемещаться из плоскости изображения, и полученные данные нельзя использовать. Даже если датчик стационарно зафиксирован к телу пациента, патологическое изменение все же может перемещаться относительно поля видения датчика из-за дыхательного движения пациента. Один из способов устранения влияния дыхательного движения заключается в селекции сбора данных по дыхательному циклу. Сигнал дыхания можно получать известными средствами, например, с помощью упругой ленты с датчиками деформации или давления вокруг груди пациента. Другой метод заключается в передаче слабых сигналов между датчиками через грудь пациента и измерении изменений импеданса груди пациента. Приведенные и другие методы могут формировать периодические сигналы дыхательного цикла и могут служить для селекции сбора изображений в одной и той же фазе дыхательного цикла. В соответствии с другим аспектом настоящего изобретения, селекцию по дыханию выполняют обработкой изображений, как показано на блок-схеме последовательности операций, приведенной на фигуре 4. Изображения на основной частоте с правой стороны на фигурах 5 и 6 показывают отчетливо затемненный области 60 внизу каждого изображения (которые были бы светлыми областями на стандартном черно-белом полутоновом ультразвуковом изображении). Показанный ориентир 60 в изображении является диафрагмой пациента на приведенных изображениях. На фигуре 8 диафрагма в изображении очерчена контурной кривой 62. В показанном примере, контурная кривая 62 повторяется в одном и том же положении на каждом изображении последовательности кадров изображения. Если анатомические детали в изображении не перемещаются относительно датчика по мере того, как получают последовательность изображений, то ориентир 60 диафрагмы будет присутствовать внутри очерченной контурной кривой 62 в каждом изображении. Однако, дыхательное движение может перемещать диафрагму 60 внутрь и за пределы контурной линии, особенно, при глубоком дыхании. Процессор 100 изображений, показанный на фигуре 4, обнаруживает упомянутое изменение поиском ориентира диафрагмы в той же самой локализации ROID, которая является контурной линией 62 в примере на фигуре 8. Когда ориентир 60 диафрагмы находится в предполагаемой локализации в изображении («Да»), изображение передается дальше для обработки и количественной оценки. Одна, если дыхательное движение приводит к перемещению ориентира 60 диафрагмы из его предполагаемой локализации ROID в изображении («Нет»), то упомянутое изображение не подвергают обработке. Приведенную процедуру применяют ко всем изображениям в последовательности, чтобы влияние дыхательного движения на изображение метастаза, на которое указывает перемещение диафрагмы, устранялось отбрасыванием таких изображений, которые не всегда совмещаются с постоянной локализацией диафрагмы. Существуют также другие возможные способы выполнения селекции по дыханию. Например, кривую временной интенсивности можно формировать по ROI, которая точно следует за частью диафрагмы, и определяют порог значений. Затем отбрасывают любое изображение, значение интенсивности которого ниже порога. Другие алгоритмы с компенсацией движения также могут определять дыхательное движение и выполнять селекцию с учетом упомянутого движения.
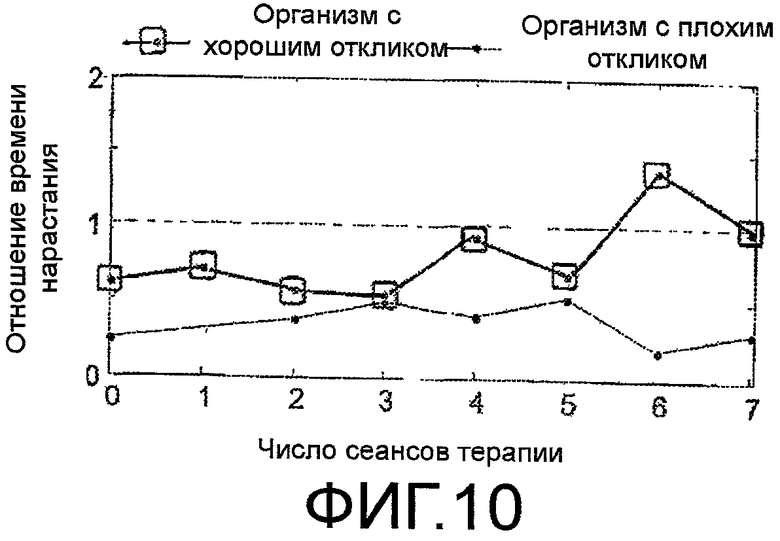
Количественные измерения в соответствии с настоящим изобретением применили в клинических условиях для контроля результатов лечения опухоли на восьми пациентах, с числом сеансов терапии от трех до пяти. Значение WITR по результатам измерений вычисляли для каждого пациента и для каждого сеанса терапии. Результаты для организма с хорошим откликом и организма с плохим откликом показаны на фигуре 10. Как показано на данном графике, WITR приближается к единице для успешно излечиваемого пациента с каждым сеансом терапии. Для пациента в группе, который, в конечном счете, не отреагировал на лечение (обозначен как организм с плохим откликом), WITR находится далеко от единицы. Из приведенного графика видно, что измерение WITR хорошо согласуется с фактическими клиническими результатами терапии и может служить биомаркером терапии.

Изобретение относится к медицинской технике, а именно к ультразвуковым диагностическим системам. Система содержит ультразвуковой датчик для получения последовательности ультразвуковых изображений по мере перфузии контрастного вещества в ткань, блок вычисления параметра времени накопления контрастного вещества для опухоли и для нормальной ткани и блок вычисления отношения параметра времени накопления для опухоли и параметра времени накопления для нормальной ткани. Во втором варианте система содержит ультразвуковой датчик для получения последовательности ультразвуковых изображений линейно зависимых данных эхо-сигнала из опухоли и окружающей ее ткани по мере перфузии, блок вычисления кривой временной интенсивности контрастного вещества для линейно зависимых данных эхо-сигнала опухоли и для данных эхо-сигнала нормальной ткани и блок вычисления разностной кривой для линейно зависимых кривых временной интенсивности для опухоли и нормальной ткани. Использование изобретения позволяет исключить влияние изменений процедуры между сеансами контроля терапии. 2 н. и 12 з.п. ф-лы, 10 ил.
1. Ультразвуковая диагностическая система визуализации для оценки протекания терапии опухолей, при этом упомянутая система содержит
ультразвуковой датчик для получения последовательности ультразвуковых изображений опухоли и окружающей ее ткани по мере перфузии контрастного вещества в ткань;
блок вычисления параметра временной интенсивности, который вычисляет параметр времени накопления контрастного вещества для опухоли и для нормальной ткани; и
блок вычисления отношения, который вычисляет отношение параметра времени накопления для опухоли и параметра времени накопления для нормальной ткани.
2. Ультразвуковая диагностическая система визуализации по п.1, в которой последовательность ультразвуковых изображений содержит данные эхо-сигнала от контрастного вещества; при этом блок вычисления параметра временной интенсивности дополнительно аппроксимирует кривую по данным эхо-сигнала от контрастного вещества.
3. Ультразвуковая диагностическая система визуализации по п.2, в которой параметр времени накопления является параметром кривой.
4. Ультразвуковая диагностическая система визуализации по п.2, в которой блок вычисления параметра временной интенсивности дополнительно аппроксимирует данные эхо-сигнала от контрастного вещества по функции ошибок.
5. Ультразвуковая диагностическая система визуализации по п.4, в которой параметр времени накопления является параметром функции ошибок.
6. Ультразвуковая диагностическая система визуализации по п.2, в которой блок вычисления параметра временной интенсивности аппроксимирует данные эхо-сигнала от контрастного вещества по математической модели.
7. Ультразвуковая диагностическая система визуализации по п.1, в которой блок вычисления параметра временной интенсивности вычисляет параметр времени накопления контрастного вещества для опухоли из ROI в последовательности изображений, которую идентифицируют вручную.
8. Ультразвуковая диагностическая система визуализации по п.1, в которой блок вычисления параметра временной интенсивности вычисляет параметр времени накопления контрастного вещества для опухоли из ROI в последовательности изображений, которую идентифицируют посредством обработки изображений.
9. Ультразвуковая диагностическая система визуализации по п.1, в которой блок вычисления параметра временной интенсивности вычисляет параметр времени накопления контрастного вещества для нормальной ткани из ROI в последовательности изображений, которую идентифицируют вручную.
10. Ультразвуковая диагностическая система визуализации для оценки протекания терапии опухолей, при этом упомянутая система содержит
ультразвуковой датчик для получения последовательности ультразвуковых изображений линейно-зависимых данных эхо-сигнала из опухоли и окружающей ее ткани по мере перфузии контрастного вещества в ткань;
блок вычисления кривой временной интенсивности, который вычисляет кривую временной интенсивности контрастного вещества для линейно-зависимых данных эхо-сигнала опухоли и для данных эхо-сигнала нормальной ткани; и
блок вычисления разностной кривой, который вычисляет разностную кривую для линейно-зависимых кривых временной интенсивности для опухоли и нормальной ткани.
11. Ультразвуковая диагностическая система визуализации по п.10, в которой последовательность ультразвуковых изображений содержит данные эхо-сигнала от контрастного вещества, при этом блок вычисления кривой временной интенсивности дополнительно аппроксимирует кривую по данным эхо-сигнала от контрастного вещества.
12. Ультразвуковая диагностическая система визуализации по п.11, в которой блок вычисления кривой временной интенсивности дополнительно аппроксимирует данные эхо-сигнала от контрастного вещества по функции ошибок.
13. Ультразвуковая диагностическая система визуализации по п.11, в которой блок вычисления кривой временной интенсивности аппроксимирует данные эхо-сигнала от контрастного вещества по математической модели.
14. Ультразвуковая диагностическая система визуализации по п.10, в которой блок вычисления кривой временной интенсивности вычисляет параметр времени накопления контрастного вещества для опухоли из ROI в последовательности изображений, которую идентифицируют вручную.
| KRIX M | |||
| et al | |||
| Low mechanical index contrast-enhanced ultrasound better reflects high arterial perfusion of liver metastases than arterial phase computed tomography | |||
| Investigative Radiology, v.39, no.4, April 2004, p.216-222 | |||
| Узкополосный отражающий интерференционный светофильтр | 1986 |
|
SU1674038A1 |
| MARUYAMA H | |||
| et al | |||
| Sonographic shift of hypervascular liver tumor on blood harmonic images with | |||
Авторы
Даты
2013-09-20—Публикация
2009-01-23—Подача