Область техники
Изобретение относится к медицине, а именно к средствам для магнитно-резонансной томографии.
Уровень техники
Неинвазивная диагностика заболеваний, в том числе ранняя диагностика, является приоритетным направлением в здравоохранении. Одним из информативных методов диагностики заболеваний является магнитно-резонансная томография (МРТ).
Большинство разновидностей МРТ, применяемых в клинической практике, основано на регистрации сигнала магнитного резонанса протонов (ядер 1Н), входящих в состав воды в организме человека. 1Н МРТ обеспечивает высокую степень анатомической детализации. В то же время, из клинической практики известно, что МРТ не всегда дает однозначную информацию о природе заболевания. В частности, в онкологии достоверное различение злокачественных новообразований и неопасных доброкачественных образований, очагов воспаления и т.п. остается нерешенной задачей [см., например: Baltzer, Р.А.Т. et al. Am. J. Roentenology, 2010, 194, 1658-1663; Shahid, H. et al. Appl. Radiol. 2016, 45, 7-13]. В связи с этим также затруднена ранняя диагностика онкологических заболеваний, так как высок риск ложноположительного результата.
Основной метод повышения информативности 1Н МРТ - использование контрастных агентов, изменяющих время релаксации протонов воды в своем окружении [Topics in Current Chemistry, Contrast Agents I, Magnetic Resonance Imaging. Krause, W. (Ed.), Springer, 2002]. Известен широкий круг контрастных препаратов, использующихся в МРТ диагностике, включая коммерчески доступные Omniscan®, Magnevist®, ProHance® и Clariscan®, представляющие собой комплексы гадолиния, а также Feridex® и Resovist®, представляющие собой водные суспензии стабилизированных магнитных наночастиц. Помимо повышения контраста изображений эти вещества позволяют оценивать перфузию.
Альтернативой проведения 1Н МРТ с контрастными агентами является регистрация сигнала других ядер, в частности, на разных стадиях клинических испытаний находятся методы, использующие изотопы 31Р, 13С, 19F, 23Na.
Дейтерий (2Н) - это природный, нерадиоактивный изотоп водорода, содержание которого в биологических объектах составляет 0,0156% от общего количества водорода.
В документе US 5042488 была показана возможность регистрации сигнала дейтерия после инъекции D2O и 1-дейтероглюкозы in vivo (в печени крысы).
В документе US 20030211036 А1 был предложен способ измерения перфузии в выбранных участках тканей с помощью изотопно-меченых соединений (например, D2O) по аналогии с парамагнитными контрастными агентами.
В документе US 20100322865 А1 описывается применение метаболических прекурсоров воды для оценки скорости метаболизма. В качестве примера метаболического предшественника HOD приводится 1,2,3,4,5,6,6-дейтерированная глюкоза. В рамках описанного изобретения осуществляется регистрация только ЯМР сигналов на дейтерии метаболической воды и алифатической цепи жирных кислот, и отсутствуют ЯМР сигналы дейтерированной глюкозы.
Из работы [Washburn et al., Nucl. Med. 1978, 19, 77-83] известно, что рацемический 1-14С-валин, а также 1-11С-валин накапливаются преимущественно в поджелудочной железе животных. В то же время, из уровня техники не известно какое-либо применение изотопно-меченых производных валина для неинвазивной диагностики заболеваний.
14С-Лейцин широко используется в биохимических научных исследованиях в качестве индикатора скорости синтеза белков (лейцин включается в состав всех белков, синтезируемых в данной ткани). Такое применение, как правило, требует инвазивного забора образцов исследуемых тканей.
Валин, лейцин и изолейцин относятся к группе аминокислот с разветвленной боковой цепью (англ. Branched-chain amino acids, ВСАА). Члены данной группы обладают определенным биохимическим сходством, поскольку могут проникать через клеточные мембраны через одни и те же транспортеры, а начальные стадии их метаболизма катализируются одними и теми же ферментами (трансаминазой и декарбоксилазой аминокислот с разветвленной боковой цепью).
Несмотря на широкое клиническое применение технологии 1Н МРТ, сохраняется потребность в разработке новых более эффективных методов МРТ-диагностики.
Раскрытие изобретения
Задачей данного изобретения является разработка нового эффективного диагностического препарата для диагностики заболеваний посредством МРТ и/или MP-спектроскопии и способа диагностики, включающего использование указанного препарата.
Технический результат данного изобретения заключается в создании нового и эффективного диагностического препарата, который может использоваться для неинвазивной диагностики заболеваний и патологических процессов, сопровождающихся локально измененным (повышенным или пониженным) уровнем поглощения клетками питательных веществ, в частности, онкологических заболеваний, методом магнитно-резонансной томографии и/или магнитно-резонансной спектроскопии на ядрах дейтерия.
Данный технический результат достигается за счет разработки диагностического препарата, совместимого с фундаментальными физическими ограничениям метода ядерного магнитного резонанса (МРТ или МР-спектроскопии). Известно, что гиромагнитное отношение ядра дейтерия в 6,5 раз меньше, чем протия. Как следствие, чувствительность регистрации сигнала дейтерия составляет примерно 0,01 (т.е. 1%) от чувствительности регистрации сигнала протия [Biological Magnetic Resonance, Volume 11, In Vivo Spectroscopy. Berliner L.J., Reuben, J. (Eds.), Springer, 1992]. Регистрация слабого сигнала может быть осуществлена путем усреднения сигнала нескольких идентичных сканирований. Однако такое усреднение требует увеличения времени съемки, причем отношение сигнал/шум растет нелинейно (пропорционально √n, где n - число сканирований; например, если съемка занимает 10 минут, и при этом отношение сигнал/шум должно быть увеличено в 10 раз, потребуется увеличение времени съемки в 100 раз, т.е. до 16 часов). При этом продолжительность съемки в живых организмах ограничена как фармакокинетикой диагностического препарата, так и практической применимостью в клинической практике (исследование не должно занимать более 1-2 часов) и необходимостью для пациента сохранять неподвижность в течение всего времени сканирования. Интенсивность сигнала магнитного резонанса также зависит от напряженности магнитного поля. Поскольку в настоящее время одобрены к клиническому применению MP-томографы с напряженностью магнитного поля не более 7Т, практически применимы только такие диагностические препараты, которые обеспечивают достаточную интенсивность сигнала при 7Т.
Таким образом, дейтерированное соединение в диагностическом препарате по изобретению должно обладать таким набором физико-химических и биологических свойств, который обеспечивает как селективное накопление дейтерия, так и поддержание его концентрации в исследуемых тканях в течение времени, достаточного для регистрации сигнала. Чем ниже достигаемая в ткани концентрация дейтерированного соединения, тем дольше необходимо усреднять сигнал и, следовательно, тем дольше дейтерированное соединение должно присутствовать в тканях, сохраняя селективное распределение. С другой стороны, увеличение дозы диагностического препарата не является универсальным решением, поскольку при этом может ускоряться его выведение (в частности, за счет превышения реабсорбционной способности почек), увеличивается риск токсичности, снижается селективность накопления в различных тканях, кроме того, доза ограничивается растворимостью.
Для большинства химических соединений, включая аминокислоты, отсутствуют данные о максимально достижимых нетоксичных концентрациях в тканях при патологии. Вследствие этого, разработка диагностического препарата, отвечающего вышеизложенным критериям, требует экспериментального подтверждения его применимости в 2Н МРТ и/или MP-спектроскопии in vivo.
Техническим результатом настоящего изобретения также является разработка нового эффективного и информативного способа диагностики заболеваний и патологических процессов, сопровождающихся локально измененным (повышенным или пониженным) уровнем поглощения клетками питательных веществ, в частности, онкологических заболеваний, методом магнитно-резонансной томографии и/или магнитно-резонансной спектроскопии на ядрах дейтерия, включающего введение диагностического препарата по изобретению, который способен накапливаться в анализируемых тканях и органах (в частности, в опухолевой такни) в концентрации, достаточной для регистрации информативной дейтериевой томограммы или 2Н-ЯМР спектра in vivo. Дополнительными техническими результатами при осуществлении изобретения являются возможность получения сведений об уровне перфузии в разных точках области сканирования, сведений о структуре опухоли, о злокачественности или доброкачественности опухоли. Еще одним дополнительным техническим результатом является возможность оценки локальной скорости метаболических процессов в области сканирования, которая, в свою очередь, позволяет оценить уровень метаболической активности и/или пролиферации клеток, скорость роста опухоли и является дополнительным параметром, повышающим надежность и достоверность диагностики.
Способ по изобретению также характеризуется тем, что осуществляется без вредного воздействия ионизирующего излучения (характерного, например, для методов визуализации KT, ПЭТ, ОФЭКТ), что в свою очередь повышает безопасность исследований, делает возможным проведение более частых повторных исследований, в частности делает метод привлекательным для педиатрии. Изобретение направлено на получение диагностической информации, сходной с методом позитронно-эмиссионной томографии или однофотонной эмиссионной компьютерной томографии (отклонение уровня или скорости накопления препарата в патологической ткани от нормы или от значений, достигаемых в окружающих частях той же ткани/того же органа), но при этом позволяет устранить риски, связанные с ионизирующим излучением радиофармпрепаратов. Кроме того, в отличие от радиофармпрепаратов для ПЭТ, производство дейтерированных препаратов по изобретению не ограничено синтезом и логистикой малых партий короткоживущих изотопов.
Указанные технические результаты обеспечиваются за счет разработки диагностического препарата, включающего дейтерированное производное природной аминокислоты с разветвленной боковой цепью и/или его фармацевтически приемлемую соль или смесь, для диагностики заболеваний методом магнитно-резонансной томографии и/или магнитно-резонансной спектроскопии на ядрах дейтерия.
Таким образом, первым аспектом изобретения является диагностический препарат, включающий по меньшей мере одно соединение, выбранное из дейтерированного производного природной аминокислоты с разветвленной боковой цепью и/или фармацевтически приемлемой соли дейтерированного производного природной аминокислоты с разветвленной боковой цепью, для диагностики заболеваний или патологических процессов методом магнитно-резонансной томографии и/или магнитно-резонансной спектроскопии на ядрах дейтерия.
В некоторых вариантах осуществления изобретения диагностический препарат дополнительно включает, по меньшей мере, одно фармацевтически приемлемое вспомогательное вещество. В некоторых частных случаях фармацевтически приемлемое вспомогательное вещество представляет собой носитель, наполнитель и/или растворитель.
В некоторых вариантах осуществления изобретения дейтерированное производное природной аминокислоты с разветвленной боковой цепью и/или его фармацевтически приемлемая соль наряду с атомами дейтерия, связанными с атомами углерода, содержит атомы дейтерия, частично или полностью замещающие подвижные атомы водорода, связанные с атомами кислорода и/или азота.
В некоторых вариантах осуществления изобретения диагностический препарат включает
- дейтерированное производное природной аминокислоты с разветвленной боковой цепью, содержащее атомы дейтерия, связанные с атомами углеродом, более чем в одном положении, или его фармацевтически приемлемую соль; или
- смесь дейтерированных производных природных аминокислот с разветвленной боковой цепью и/или их фармацевтически приемлемых солей, в которой присутствуют дейтерированные производные, содержащие атомы дейтерия в структурно неэквивалентных положениях.
В некоторых случаях осуществления изобретения дейтерированное производное природной аминокислоты с разветвленной боковой цепью представляет собой дейтерированный валин или дейтерированный лейцин или дейтерированный изолейцин.
В некоторых частных вариантах осуществления изобретения дейтерированный валин представляет собой валин-4,4,4-d3, валин-4,4,4,4',4',4'-d6, валин-3,4,4,4,4',4',4'-d7, валин-2,4,4,4,4',4',4'-d7, валин-2,3,4,4,4,4',4',4'-d8.
В некоторых частных вариантах осуществления изобретения дейтерированный лейцин представляет собой лейцин-5,5,5-d3, лейцин-5,5,5,5',5',5'-d6, лейцин-4,5,5,5,5',5',5'-d7, лейцин-3,3,5,5,5,5',5',5'-d8, лейцин-3,3,4,5,5,5,5',5',5'-d9, лейцин-2,5,5,5,5',5',5'-d7, лейцин-2,3,3,5,5,5,5',5',5'-d9, лейцин-2,4,5,5,5,5',5',5'-d8, лейцин-2,3,3,4,5,5,5,5',5',5'-d10.
В некоторых частных вариантах осуществления изобретения дейтерированный изолейцин представляет собой 2-амино-3-(CD3)пентановую кислоту, 2-амино-3-(CD3)пентановую-5,5,5-d3 кислоту, 2-амино-3-(CD3)пентановую-4,4,5,5,5-d5 кислоту, 2-амино-3-(CD3)пентановую-2,5,5,5-d4 кислоту, 2-амино-3-(CD3)пентановую-2,3,5,5,5-d5 кислоту, 2-амино-3-(CD3)пентановую-3,4,4,5,5,5-d6 кислоту, 2-амино-3-(CD3)пентановую-2,3,4,4,5,5,5-d7 кислоту, 2-амино-3-метилпентановую-5,5,5-d3 кислоту.
В некоторых случаях осуществления изобретения дейтерированное производное полностью или преимущественно представлено одним энантиомером. В некоторых частных вариантах осуществления изобретения дейтерированное производное полностью или преимущественно представлено энантиомером с конфигурацией 2S.
В некоторых других вариантах осуществления изобретения диагностический препарат включает смесь, по меньшей мере, двух разных соединений, выбранных из дейтерированного производного природной аминокислоты с разветвленной боковой цепью и/или фармацевтически приемлемой соли дейтерированного производного природной аминокислоты с разветвленной боковой цепью. В некоторых частных вариантах осуществления изобретения диагностический препарат включает смесь, по меньшей мере, двух соединений, выбранных из валина-4,4,4,4',4',4'-d6, валина-2,4,4,4,4',4',4'-d7, лейцина-5,5,5,5',5',5'-d6, лейцина-3,3-d2.
В частных случаях воплощения изобретения диагностический препарат может содержать ингибитор метаболизма аминокислот с разветвленной боковой цепью, в частности, ингибитор трансаминазы аминокислот с разветвленной боковой цепью.
Еще одним аспектом изобретения является способ диагностики заболевания или патологического процесса у субъекта, включающий следующие этапы:
- вводят субъекту диагностический препарат по изобретению;
- проводят магнитно-резонансную томографию и/или магнитно-резонансную спектроскопию на ядрах дейтерия после введения диагностического препарата спустя время, достаточное для его накопления в исследуемой ткани, для получения, соответственно, томограммы (дейтериевой томограммы) и/или ЯМР спектра(ов);
- диагностируют наличие или отсутствие заболевания на основании наблюдаемой интенсивности сигнала ядер дейтерия, отражающей уровень накопления диагностического препарата.
В предпочтительных вариантах осуществления изобретения диагностируемое заболевание или патологический процесс сопровождается локально измененным (повышенным или пониженным) уровнем поглощения клетками питательных веществ.
В некоторых вариантах осуществления изобретения патологический процесс представляет собой воспалительный процесс, инфекционный процесс, процесс, сопровождающийся активной регенерацией, заболевание, связанное с ишемией органов и тканей, реакцию отторжения трансплантата, аутоиммунное заболевание. В некоторых других вариантах осуществления изобретения заболевание представляет собой онкологическое заболевание. В некоторых частных вариантах осуществления изобретения онкологическое заболевание представляет собой солидную опухоль или метастазы опухоли, в том числе метастазы в лимфоузлах.
В некоторых вариантах осуществления изобретения наличие или отсутствие заболевания диагностируют на основании сравнения интенсивности сигнала ядер дейтерия у исследуемого субъекта с типичной интенсивностью сигнала, наблюдаемой у здоровых субъектов в соответствующей ткани или соответствующем органе. В некоторых других вариантах осуществления изобретения наличие или отсутствие заболевания диагностируют на основании сравнения интенсивности сигнала ядер дейтерия в областях, соответствующих нормальной и аномальной ткани по данным дополнительного медицинского исследования. В некоторых вариантах наличие или отсутствие заболевания диагностируют на основании комбинирования вышеуказанных сравнений.
В некоторых вариантах осуществления изобретения проводят, по меньшей мере, одно дополнительное медицинское исследование, выбранное из магнитно-резонансной томографии на ядрах, отличных от ядер дейтерия, ультразвукового исследования, компьютерной томографии, рентгенографии, пальпации, биопсии, анализа биологических жидкостей на онкомаркеры, радионуклидной диагностики и/или визуального наблюдения. В некоторых частных вариантах осуществления изобретения дополнительное медицинское исследование проводят перед проведением диагностики заболевания или патологического процесса методом магнитно-резонансной томографии и/или магнитно-резонансной спектроскопии на ядрах дейтерия, как это описано выше. В некоторых других частных вариантах осуществления изобретения дополнительное медицинское исследование проводят после проведения диагностики заболевания или патологического процесса методом магнитно-резонансной томографии и/или магнитно-резонансной спектроскопии на ядрах дейтерия, как это описано выше.
В некоторых частных вариантах осуществления изобретения наличие или отсутствие заболевания или патологического процесса диагностируют на основании сравнения дейтериевой томограммы исследуемого субъекта с изображением, полученным в результате магнитно-резонансной томографии субъекта на ядрах протия.
В некоторых частных вариантах осуществления изобретения по пространственному распределению области с повышенным накоплением диагностического препарата на дейтериевой томограмме, делается вывод о пространственной структуре опухоли.
В некоторых частных вариантах осуществления изобретения по интенсивности сигнала дейтерия на дейтериевой томограмме и/или ЯМР спектре(ах) в области повышенного накопления диагностического препарата делается вывод о злокачественности или доброкачественности опухоли.
В некоторых частных вариантах осуществления изобретения по скорости изменения интенсивности сигнала дейтерия на дейтериевой томограмме и/или ЯМР спектре(ах) после его введения делается вывод об уровне перфузии в разных точках области сканирования.
Частные варианты осуществления способа диагностики заболевания или патологического процесса у субъекта по изобретению также включают все варианты воплощения изобретения в части диагностического препарата, описанные выше.
В некоторых вариантах осуществления способа диагностики заболевания или патологического процесса у субъекта вводимый диагностический препарат включает
- дейтерированное производное природной аминокислоты с разветвленной боковой цепью, содержащее атомы дейтерия, связанные с атомами углерода, более чем в одном положении, или его фармацевтически приемлемую соль; или
смесь дейтерированных производных природных аминокислот с разветвленной боковой цепью и/или их фармацевтически приемлемых солей, в которой присутствуют дейтерированные производные, содержащие атомы дейтерия в структурно неэквивалентных положениях;
при этом на основании сравнения интенсивности сигналов ядер дейтерия в структурно неэквивалентных положениях дейтерированного(ых) производного(ых) в исследуемой области оценивают локальную скорость метаболизма природных аминокислот с разветвленной боковой цепью, что позволяет проводить более точную диагностику, в частности, оценивать скорость роста или злокачественность опухоли.
В некоторых частных случаях вышеописанных вариантов осуществления изобретения дейтерированное производное природной аминокислоты с разветвленной боковой цепью представляет собой
- смесь различных дейтерированных производных валина; или
- смесь различных дейтерированных производных лейцина; или
- смесь различных дейтерированных производных изолейцина; или
- смесь различных дейтерированных производных валина, лейцина и/или изолейцина.
В некоторых вариантах осуществления изобретения диагностический препарат вводят субъекту перорально. В некоторых других вариантах осуществления изобретения диагностический препарат вводят субъекту парентерально.
Краткое описание чертежей
Фигура 1. а) дейтериевая томограмма (слева) и 2Н спектр (справа) образца с валином-4,4,4,4',4',4'-d6; б) дейтериевая томограмма (слева) и 2Н спектр (справа) образца с лейцином-5,5,5,5',5',5'-d6.
Фигура 2. Томограммы мыши с карциномой молочной железы 4Т1 после введения 20 мг валина-4,4,4,4',4',4'-d6: а) 2Н томограммы, полученные в разные моменты времени после введения (поверхностная катушка обозначена пунктиром); б) 2Н томограмма (слева), наложение 2Н и 1Н томограмм (по центру), 1Н томограмма (срава).
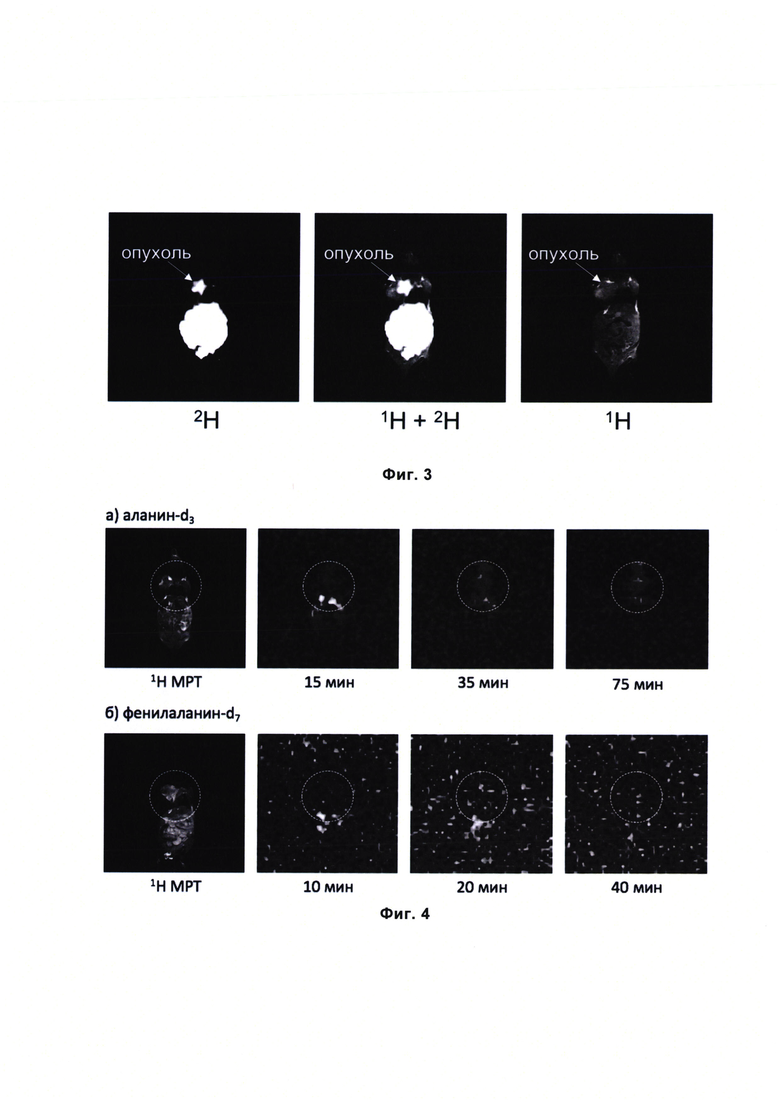
Фигура 3. Томограммы мыши с карциномой молочной железы 4Т1 через 40 мин после введения 25 мг лейцина-5,5,5,5',5',5'-d6.
Фигура 4. Томограммы мыши с карциномой молочной железы 4Т1 после введения: а) 30 мг L-аланина-3,3,3-d3; б) 10 мг L-фенилаланина-β,β,2,3,4,5,6-d7.
Определения и термины
Для лучшего понимания настоящего изобретения ниже приведены некоторые термины, использованные в настоящем описании изобретения.
В описании данного изобретения термины «включает» и «включающий» интерпретируются как означающие «включает, помимо всего прочего». Указанные термины не предназначены для того, чтобы их истолковывали как «состоит только из».
Термин «субъект» охватывает все виды млекопитающих, предпочтительно человека.
Под термином «дейтерированное производное» в данном документе понимается соединение, содержащее дейтерий, связанный с углеродом, в количестве, превышающем его природное содержание, по меньшей мере, в одном положении. В частных случаях воплощения изобретения содержание дейтерия, по меньшей мере, в одном положении, превышает 10%, в других частных случаях - 90%. Под «смесью, по меньшей мере, двух разных дейтерированных производных» понимается смесь соединений, содержащих дейтерий в разных положениях, или содержащих разное количество дейтерия в одном и том же положении. Символом «d» («D») в данном документе обозначается атом водорода, представленный изотопом 2Н в доле, превышающей его природное содержание.
Дейтерированные производные аминокислот с разветвленной боковой цепью включают валин-4,4,4-D3, валин-4,4,4,4',4',4'-D6, валин-3,4,4,4,4',4',4'-D7, валин-2,4,4,4,4',4',4'-D7, валин-2,3,4,4,4,4',4',4'-D8, лейцин-5,5,5-D3, лейцин-5,5,5,5',5',5'-D6, лейцин-4,5,5,5,5',5',5'-D7, лейцин-3,3,5,5,5,5',5',5'-D8, лейцин-3,3,4,5,5,5,5',5',5'-D9, лейцин-2,5,5,5,5',5',5'-D7, лейцин-2,3,3,5,5,5,5',5',5'-D9, лейцин-2,4,5,5,5,5',5',5'-D8, лейцин-2,3,3,4,5,5,5,5',5',5'-D10, 2-амино-3-(CD3)пентановую кислоту, 2-амино-3-(CD3)пентановую-5,5,5-d3 кислоту, 2-амино-3-(CD3)пентановую-4,4,5,5,5-d5 кислоту, 2-амино-3-(CD3)пентановую-2,5,5,5-d4 кислоту, 2-амино-3-(CD3)пентановую-2,3,5,5,5-d5 кислоту, 2-амино-3-(CD3)пентановую-3,4,4,5,5,5-d6 кислоту, 2-амино-3-(CD3)пентановую-2,3,4,4,5,5,5-d7 кислоту, 2-амино-3-метилпентановую-5,5,5-d3 кислоту.
Под термином «воксел» в данном документе понимается минимальный элемент объема области сканирования, которому соответствует определенное значение интенсивности сигнала дейтерия или определенный локальный спектр.
Под «структурно неэквивалентными положениями» в данном документе понимаются любые сочетания положений в структуре одной или нескольких природных аминокислот с разветвленной боковой цепью, обозначаемые разными символами на следующем рисунке.
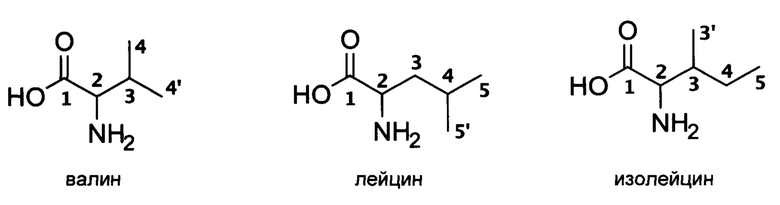
Например, структурно неэквивалентными являются положения 2 и 4 в валине-2,3,4,4,4,4',4',4'-d8; положение 2 в валине-2,4,4,4,4',4',4'-d7 и положение 4 в лейцине-4,5,5,5,5',5',5'-d7.
Используемый здесь термин «фармацевтически приемлемая соль» относится к таким солям, которые пригодны для использования в контакте с тканями человека и животных без излишней токсичности, раздражения, аллергической реакции и т.д., и отвечают разумному соотношению пользы и риска. Фармацевтически приемлемые соли аминов, карбоновых кислот, фосфонатов и другие типы соединений хорошо известны в медицине. Соли могут быть получены in situ в процессе выделения или очистки соединений изобретения, а также могут быть получены отдельно, путем взаимодействия свободной кислоты или свободного основания соединения изобретения с подходящим основанием или кислотой, соответственно. Примером фармацевтически приемлемых, нетоксичных солей кислот могут служить соли аминогруппы, образованные неорганическими кислотами, такими как соляная, фосфорная, или органическими кислотами, такими как уксусная, щавелевая, малеиновая, фумаровая, винная, янтарная, аскорбиновая, лимонная, масляная, молочная, глюконовая кислоты, или полученные другими методами, используемыми в данной области, например, с помощью ионного обмена. Типичные соли щелочных и щелочноземельных металлов содержат натрий, калий, кальций, магний и другие. Кроме того, фармацевтически приемлемые соли могут содержать, если требуется, нетоксичные катионы аммония, четвертичного аммония и амина, полученные с использованием таких противоионов, как галогениды, гидроксиды, карбоксилаты, сульфаты, фосфаты, и другие.
Диагностический препарат по изобретению может включать одно или несколько любых фармацевтически приемлемых вспомогательных веществ, подходящих для конкретной формы дозирования, в частности, любых носителей, растворителей и/или наполнителей, таких, которые могут быть введены в организм пациента совместно с соединением, составляющим суть данного изобретения, и которые не разрушают это соединение, и являются нетоксичными при введении.
Подробное раскрытие изобретения
Успешная реализация диагностики заболевания с помощью 2Н МРТ или МР-спектроскопии основывается на способности конкретного дейтерированного соединения селективно накапливаться в различных тканях и при этом создавать сигнал с интенсивностью, достаточной с точки зрения фундаментальных физических ограничений методов ядерного магнитного резонанса (гиромагнитное отношение, параметры релаксации ядер дейтерия). Интенсивность сигнала дейтерия при этом:
а) пропорциональна достигаемой в ткани концентрации дейтерия (зависит от дозы, кинетики мембранного транспорта, концентрирующей способности ткани),
б) пропорциональна квадратному корню из времени съемки (время ограничено скоростью выведения и/или метаболизма дейтерированного соединения, а также необходимостью для пациента оставаться без движения в течение всего сканирования),
в) зависит от времени релаксации T1 (определяет максимальную скорость усреднения и, следовательно, интенсивность суммарного сигнала, получаемого в единицу времени; для разных соединений различается в несколько раз: см. Biological Magnetic Resonance, Volume 11, In Vivo Spectroscopy. Berliner L.J., Reuben, J. (Eds.), Springer, 1992).
Каждое химическое соединение обладает уникальными параметрами фармакокинетики (в частности, концентрация соединения и скорость ее изменения в крови, различных органах и тканях). Фармакокинетика при этом неочевидным образом зависит от используемой дозы (в частности, превышение реабсорбционной способности почек в отношении конкретного соединения может приводить к его ускоренному выведению). При этом доза ограничена токсичностью и растворимостью данного соединения. Эксперименты, проведенные авторами, а также сведения из уровня техники показывают, что свободно диффундирующие дейтерированные соединения, такие как D2O, не демонстрирует селективного накопления в различных органах и тканях субъекта.
Авторами было обнаружено, что дейтерированные производные природных аминокислот с разветвленной боковой цепью по изобретению:
- способны селективно накапливаться в тканях животных в концентрации, достаточной для визуализации различных органов и тканей in vivo, в том числе, раковых опухолей, методом 2Н МРТ или МР-спектроскопии;
- обладают фармакокинетическими свойствами, позволяющими использовать нетоксичные дозы, и при этом успешно регистрировать 2Н МРТ и/или 2Н ЯМР спектры;
- в концентрациях, достаточных для успешной регистрации 2Н МРТ и/или 2Н ЯМР, характеризуются достаточно медленным выведением и метаболизмом, совместимыми с временными ограничениями методов дейтериевой томографии и МР-спектроскопии.
В свою очередь, это позволяет осуществлять эффективную диагностику заболеваний и патологических процессов, сопровождающихся локально измененным (повышенным или пониженным) уровнем поглощения клетками питательных веществ, в том числе, определять наличие и локализацию онкологического заболевания, посредством магнитно-резонансной томографии на ядрах дейтерия. При этом наши эксперименты показали, что другие аминокислоты, в частности, глицин-d2, L-аланин-3,3,3-d3 и L- фенилаланин-β,β,2,3,4,5,6-d7 не обладают подходящими физико-химическими и биологическими свойствами и, таким образом, не могут быть использованы для диагностики заболеваний методом 2Н МРТ или МР-спектроскопии.
Изотопно-меченые производные валина и лейцина (14С, 13С, 3Н) ранее использовались для определения скорости синтеза белков путем анализа белковой фракции, выделяемой из гомогената различных биологических тканей (см.: Attaix et al., Biochim. Biophys. Acta 1986, 882, 389-397; Goto et al., Chem. Soc. Bull, 1977, 25(7), 1574-1581). Однако в этих работах отсутствуют данные, позволяющие предположить возможность достижения концентрации валина либо лейцина, не связанного в составе белков, а также его низкомолекулярных метаболитов в тканях при патологиях, совместимой с регистрацией 2Н МРТ или ЯМР in vivo. Из данных Goto et al. также следует, что большая часть 14С-валина, накапливающегося в печени и поджелудочной железе, оказывается включенной в состав белков уже через 10 минут после введения.
Из работы [Washburn et al., Nucl. Med. 1978, 19, 77-83] известно, что в дозах до 5 мг/кг рацемический 1-14С-меченый валин накапливается в поджелудочной железе животных. При этом достигаемые в разных тканях абсолютные концентрации 14С-изотопа могут быть рассчитаны исходя из представленных данных только для дозы 0.021 мг/кг, что примерно в 500 раз меньше дозы, необходимой для реализации 2Н МРТ согласно полученным нами данным. В то же время, в литературе нет данных о максимальной достижимой концентрации валина в тканях животных при введении доз порядка 0.05-1 г/кг. Как видно из приведенных нами данных (Таблица 1), распределение дейтерия в составе метильных групп валина-4,4,4,4',4',4'-D6 в органах животного отличается от распределения радиоактивной метки, наблюдаемого для 1-14С-валина. Наблюдаемая разница в распределении является следствием двух факторов:
1) Доза валина-4,4,4,4',4',4'-D6 по изобретению более чем в 100 раз превышает максимальную изученную дозу 1-14С-валина. Эффективность накопления в исследуемой ткани зависит от отношения внутриклеточной и внеклеточной концентрации аминокислот в клетках животных или человека. Как известно из уровня техники, данное отношение зависит от внеклеточной концентрации. Так, в случае 2-аминоизомасляной кислоты и клеток тимуса мыши данное отношение падает со 100:1 до 1:1 при повышении внеклеточной концентрации от 10-6 до >10-2 ммоль/л [Helmreich, Е., Kipnis, D.M 1962, 237, 8, 2582-2589]. Таким образом, из уровня техники следовало бы ожидать резкого понижения селективности накопления и нивелирования контраста в различных тканях при увеличении дозы на два порядка (т.е. при переходе от 1-14С-валина к валину-d6). Кроме того, введение высоких доз аминокислот (например, дейтерированного валина по изобретению) in vivo приводит к непропорциональному увеличению концентрации валина в различных органах и тканях (Таблица 1).
2) Наблюдаемый в результате радиоактивного распада 1-14С-валина сигнал является суперпозицией сигналов свободного валина, валина, включенного в состав белков, и других метаболитов валина, содержащих изотоп 14С (например, 1-14С-кетоизовалериановая кислота). При этом из той же работы известно, что изотопная метка 14С быстро отщепляется в виде [14С]-СО2 (выведение в виде СО2 достигает 28% через 60 минут). С другой стороны, наблюдаемый сигнал дейтерия метильных групп в диагностическом препарате по изобретению включает в себя сигнал изобутановой кислоты (продукт декарбоксилирования, невидимый в случае 1-14С-валина) и одновременно не содержит вклада белков (параметры релаксации белков не совместимы с получением изображений в 2Н МРТ). Таким образом, диагностический препарат по изобретению и 1-14С-валин предоставляют информацию о распределении в организме различных наборов соединений.
Поскольку остатки валина-d6 в составе белков не вносят вклад в сигнал 2Н при реализации метода по изобретению, диагностический препарат на основе валина-d6 позволяет селективно визуализировать свободный валин и его низкомолекулярные метаболиты без примеси сигнала белков.
Радиоактивно-меченые производные лейцина ранее применялись для оценки скорости синтеза белков (например, 1-11С-лейцин: P.J. Hellyer et al. Neurolmage, 2017, 155, 209-216). Как и в случае с валином, времена релаксации лейцина в МРТ резко меняются при включении в состав белков, что позволяет селективно отслеживать сигнал свободного лейцина и его низкомолекулярных метаболитов (невозможно в случае методов, основанных на радиоактивной метке).
Отличительной особенностью дейтерированных производных природных аминокислот с разветвленной боковой цепью является возможность наблюдения сразу нескольких сигналов дейтерия в МРТ или МР-спектроскопии при использовании производного или смеси производных, содержащего(их) атомы дейтерия сразу в нескольких структурно неэквивалентных положениях, например, валина-2,4,4,4,4',4',4'-d7. Следует учесть, что в процессе постадийного метаболизма аминокислот с разветвленной боковой цепью структурно неэквивалентные положения последовательно меняют химический сдвиг соответствующих атомов дейтерия, а также избирательно приобретают способность обменивать дейтерий на протий воды. В отличие от методов, основанных на радиоактивных изотопах, это позволяет, помимо уровня накопления дейтерированного производного, получать информацию о локальном метаболизме аминокислот с разветвленной боковой цепью на основании разницы в отношении интенсивностей сигналов дейтерия препарата. Отношение интенсивностей сигналов ЯМР атомов дейтерия в α-положении и в разных положениях боковой цепи аминокислот(ы) с разветвленной боковой цепью в данном случае отражает различия исследуемых вокселов области сканирования в скорости трансаминирования (показано в Таблице 1) и последующего катаболизма аминокислот(ы) с разветвленной боковой цепью. Катаболизм аминокислот с разветвленной боковой цепью происходит постадийно: вначале окисляется α-положение (при этом в дейтерированном производном теряется атом дейтерия в ex-положении), затем происходит декарбоксилирование соответствующей кетокислоты, после этого начинается процесс постадийного окисления фрагмента, соответствующего положениям 3-4 валина и 3-5 лейцина или изолейцина (при этом в дейтерированном производном теряются атомы дейтерия в соответствующих положениях). Известно, что аминокислоты с разветвленной боковой цепью используются клетками для синтеза белка, а также служат важным источником энергии. Таким образом, повышенная локальная скорость метаболизма аминокислот с разветвленной боковой может свидетельствовать о локально повышенной скорости пролиферации, в частности, о росте или злокачественности опухоли или отдельных ее частей. Использование такой дополнительной диагностической информации о метаболизме аминокислот с разветвленной боковой делает метод диагностики по изобретению более достоверным. Отношение интенсивностей сигналов ЯМР атомов дейтерия в различных положениях дейтерированных производных аминокислот с разветвленной боковой цепью может измеряться как один раз за сканирование, так и несколько раз.
Массовое отношение двух различных дейтерированных производных аминокислот с разветвленной боковой цепью, входящих в состав одного диагностического препарата, может составлять от 1:1 до 1:10.
Из уровня техники известно, что разные аминокислоты обладают различной кинетикой накопления в клетках животных и человека, а также различаются в десятки раз по достигаемому в равновесном состоянии градиенту концентрации [Johnstone, R.M., Scholefield, P.G., Adv. Cancer Res. 1965, 9, 143-226]. Поведение аминокислот in vivo дополнительно осложняется гомеостазом и направленным транспортом на уровне целого организма. В частности, известно, что избыток аланина, высвобождаемого мышцами, активно поглощается печенью; в физиологической концентрации глутамин активно поглощается несколькими видами раковых опухолей. Поскольку дейтериевая томография или спектроскопия предполагает введение доз, в несколько раз превышающих физиологические, а разные органы и ткани характеризуются различной кинетикой накопления и емкостью в отношении различных аминокислот, не представляется возможным предсказать наличие селективного накопления конкретной аминокислоты без проведения прямого эксперимента.
Важным свойством дейтерированного компонента (производного аминокислоты с разветвленной боковой цепью) диагностического препарата по изобретению является достаточная устойчивость к метаболическому обмену дейтерия на протий in vivo. Такой обмен понижает концентрацию дейтериевой метки, одновременно повышая фоновый сигнал тяжелой воды (DOH), которая равномерно распределяется по организму за счет быстрой диффузии. Этот процесс приводит к снижению контрастности изображения, а также препятствует количественной оценке концентрации дейтерированного компонента путем сравнения с интенсивностью сигнала природной DOH. Проведенные нами исследования показали, что некоторые дейтерированные природные аминокислоты, в частности, глицин-2,2-d2 и L-аланин-3,3,3-d3 не могут быть использованы для получения диагностически значимых изображений по изобретению, поскольку очень быстро теряют дейтерий in vivo.
Благодаря низкому содержанию дейтерия в организме (0,015% атомов водорода), фоновые сигналы в 2Н МРТ на несколько порядков ниже, чем в 1Н МРТ. Таким образом, даже в низкой концентрации диагностического препарата его сигнал не накладывается на сигналы естественных фоновых компонентов. Разработка аналогичных методов с использованием недейтерированных диагностических препаратов на основе 1Н МРТ затруднена из-за существования большого количества фоновых сигналов естественных низкомолекулярных соединений с интенсивностью, сравнимой с максимальной достижимой интенсивностью сигнала недейтерированного диагностического препарата.
Эффективность диагностического препарата также определяется достаточным числом атомов дейтерия в структуре дейтерированного производного. Так, диагностический препарат, включающий дейтерированное производное природной аминокислоты с разветвленной боковой цепью, содержащее одну или более CD3 группы, является предпочтительным вариантом воплощения данного изобретения. Наличие таких групп позволяет проводить диагностику с использованием более низких доз диагностического препарата, что приводит к минимизации побочных эффектов.
Способ по изобретению позволяет диагностировать, в частности, наличие или отсутствие онкологического заболевания, сопровождающегося образованием солидных опухолей (как первичных, так и метастатических) и/или метастазов в лимфоузлах. Онкологические заболевания, поддающиеся диагностике с помощью дейтерированных диагностических препаратов, включают: рак молочной железы, рак легкого, рак предстательной железы, меланому, рак мозга (в том числе, метастазы опухолей другого происхождения), рак почки, рак кишечника, рак поджелудочной железы, рак яичников, рак матки, неходжкинскую лимфому, рак печени, сакромы. Помимо онкологических заболеваний способ по изобретению может быть использован в диагностике других заболеваний, характеризующихся высокой метаболической активностью или пролиферацией клеток: например, при отторжении пересаженных органов и клеток, при аутоиммунных, воспалительных или инфекционных заболеваниях, при поражениях печени, сопровождающихся активной регенерацией. Также возможна диагностика заболеваний, развивающихся вследствие нарушения кровоснабжения (ишемии) различных органов, например, сердца, мозга, почек. Нарушение кровоснабжения приводит к снижению скорости поглощения и достигаемого уровня накопления в этих органах аминокислот, в том числе, аминокислот с разветвленной боковой цепью, наблюдаемого с помощью 2Н МРТ или МР-спектроскопии.
Метод по изобретению основан на использовании дейтерированного диагностического препарата и регистрации томограмм и/или ЯМР спектров на частоте дейтерия. Авторам неизвестны примеры использования дейтерированных природных аминокислот с разветвленной боковой цепью для МРТ-диагностики заболеваний.
Известно, что 1Н МРТ сама по себе во многих случаях обладает недостаточной диагностической точностью. То же самое касается методов МРТ, основанных на измерении параметров перфузии (например, dynamic contrast-enhanced MRI). В отличие от перфузионных методов, способ диагностики по изобретению предоставляет данные о скорости мембранного транспорта и уровне накопления аминокислот с разветвленной боковой цепью в клетках, характерные для ПЭТ или ОФЭКТ, и недоступные в традиционных способах воплощения 1Н МРТ. Таким образом, способ по изобретению позволяет получить более точную диагностическую информацию. В частности, при онкологическом заболевании способ по изобретению позволяет производить оценку метаболической активности исследуемой ткани, и, как следствие, делать вывод о злокачественности или доброкачественности опухоли, оценивать ее агрессивность. Сигнал диагностического препарата по изобретению может наблюдаться в течение по меньшей мере 3-х часов (см. фигуру 2). Скорость изменения интенсивности сигнала в раковой опухоли и различных внутренних органах (поджелудочная железа, печень, почки) при повторном сканировании на протяжении до 3-х часов отражает уровень перфузии и метаболическую активность данных тканей и органов, что может использоваться при постановке более точного диагноза на основании дейтериевой томографии и/или МР-спектроскопии.
В частных случаях воплощения изобретения по пространственному распределению сигнала дейтерия диагностического препарата делают вывод о пространственной структуре опухоли.
В других частных случаях воплощения изобретения по интенсивности сигнала дейтерия в области с повышенным содержанием диагностического препарата делают вывод о степени злокачественности/агрессивности опухоли. Злокачественные опухоли характеризуются более активным метаболизмом и повышенной активностью мембранного транспорта. Следовательно, в опухолях, имеющих более высокую степень злокачественности, интенсивность сигнала дейтерия будет выше.
В других частных случаях воплощения изобретения по скорости изменения интенсивности сигнала дейтерия диагностического препарата оценивают перфузию в исследуемой области. В областях с высокой степенью перфузии скорость изменения сигнала дейтерия во времени (от момента начала накопления в опухолевой ткани до полного выведения) выше.
Диагностический препарат по изобретению вводят в количестве, эффективном для проведения диагностики. Под эффективным количеством в данном случае подразумевается такое количество соединения (дейтерированного производного природной аминокислоты с разветвленной боковой цепью и/или его фармацевтически приемлемой соли), вводимого или доставляемого пациенту, при котором с наибольшей вероятностью проявится желаемый эффект - возможность осуществления способа диагностики по изобретению методом магнитно-резонансной томографии и/или магнитно-резонансной спектроскопии на ядрах дейтерия. Ввиду фундаментальных ограничений метода дейтериевой МРТ, количество дейтерированного производного природной аминокислоты с разветвленной боковой цепью и/или его фармацевтически приемлемой соли не может быть сверхмалым и применяется в дозах более 10 мг/кг, например 0,1-1,5 г/кг. В частности, при расчете дозы препаратов для млекопитающих разных видов обычно используется не вес, а площадь поверхности тела, которая нелинейно зависит от веса. Точное требуемое количество может меняться от субъекта к субъекту в зависимости от вида млекопитающего, возраста, массы тела и общего состояния пациента, тяжести заболевания, методики введения препарата.
Из уровня техники также известно, что период полувыведения одного и того же соединения может различаться у разных видов животных (обычно период полувыведения больше у животных более крупных видов), в связи с чем оптимальное время между введением препарата и сканированием может существенно отличаться для разных млекопитающих. Оптимальное время между введением препарата и сканированием зависит от природы заболевания и исследуемой области тела субъекта. Регистрация сигнала дейтерия может осуществляться, в том числе, до окончания введения диагностического препарата и может продолжаться или повторяться, пока присутствует сигнал дейтерия в области сканирования.
Диагностический препарат по изобретению может быть введен в организм пациента любым путем введения, эффективным для проведения диагностики, например, он может быть введен перорально, парентерально, местно и т.п.
В одном из вариантов воплощения изобретения процесс диагностики включает проведение МРТ и осуществляется следующим образом:
а) в некоторых вариантах воплощения изобретения проводится МРТ на ядрах протия (1Н). Регистрация 1Н МРТ позволяет, во-первых, осуществить анатомическую привязку дейтериевого сигнала, во-вторых, идентифицировать области с подозрением на патологию, в частности, злокачественное новообразование (в других вариантах воплощения изобретения определение области проведения 2Н МРТ может быть осуществлено другими способами, в частности, посредством ультразвукового исследования, компьютерной томографии, рентгенографии, пальпации, биопсии, анализа биологических жидкостей на онкомаркеры, радионуклидной диагностики и/или визуального наблюдения);
б) вводится диагностический препарат;
в) спустя время, достаточное для накопления диагностического препарата в исследуемой ткани субъекта, проводится регистрация томограммы на частоте прецессии ядер дейтерия диагностического препарата;
г) полученные дейтериевые томограммы анализируется с целью нахождения участков с аномально высокой или низкой интенсивностью и, следовательно, отвечающих селективному накоплению диагностического препарата. В частности, возможно сравнение томограмм, полученных на 1Н и на 2Н: если аномальные участки на 1Н и 2Н совпадают, можно говорить о большей вероятности наличия патологии.
В другом варианте воплощения изобретения процесс диагностики включает проведение МР-спектроскопии на ядрах дейтерия и осуществляется следующим образом:
а) проводится 1Н МРТ, в результате чего идентифицируются области с подозрением на патологию, в частности, злокачественное новообразование (в других вариантах воплощения изобретения определение области проведения 2Н МРТ может быть осуществлено другими способами, в частности, посредством ультразвукового исследования, компьютерной томографии, рентгенографии, пальпации, биопсии, анализа биологических жидкостей на онкомаркеры, радионуклидной диагностики и/или визуального наблюдения);
б) вводится диагностический препарат;
в) спустя время, достаточное для накопления диагностического препарата в исследуемой ткани субъекта в вокселах, соответствующих области с подозрением на патологию (например, по результатам 1Н МРТ), проводится регистрация спектра дейтерия (в частности, с использованием методов локальной спектроскопии); опционально проводится регистрация спектра в соседних вокселах для сравнения интенсивности сигнала;
г) интенсивность сигнала в вокселах, соответствующих области с подозрением на патологию, сравнивается, в частности, с: (i) типичными значениями для данного органа или ткани (которые должны быть определены предварительно на здоровых субъектах) и/или (ii) интенсивностью в соседних вокселах, соответствующих тому же органу или ткани и свободных от аномалий по данным 1Н МРТ. Повышенная или пониженная интенсивность сигнала позволяет говорить о селективном накоплении диагностического препарата и, как следствие, о наличии патологии, в частности, злокачественного новообразования.
Порядок этапов «а), б), в)» в обоих вышеуказанных вариантах воплощения изобретения может быть изменен на «б), а), в)» или «б), в), а)». Также возможна параллельная регистрация сигналов 1Н и 2Н (т.е. одновременное проведение этапов «a)» и «в)»).
В частных случаях воплощения изобретения после идентификации области с подозрением на злокачественное образование выбираются отдельные вокселы, лежащие как в пределах, так и за пределами подозрительной области (в частности, может быть выбрана серия соседних вокселов, лежащих на одной линии, пересекающей границу подозрительной области). Регистрация интегрального сигнала 2Н или локальных 2Н спектров в выбранных вокселах с последующим сравнением их интенсивности позволяет быстро и с большей чувствительностью обнаруживать области накопления диагностического препарата.
МРТ изображения и MP спектры могут быть получены на любом магнитно-резонансном томографе, оснащенном оборудованием для регистрации сигнала дейтерия.
Отличительной особенностью дейтерированных производных природных аминокислот с разветвленной боковой цепью является то, что данные аминокислоты являются естественными питательными веществами и составляющими организма человека и животных. Это делает их более безопасными при использовании в качестве диагностического препарата по сравнению с неприродными аминокислотами. Исследования, проведенные авторами изобретения, свидетельствуют о хорошей переносимости диагностического препарата животными, отсутствии видимых побочных эффектов при использовании в указанных дозах. Из уровня техники известно, что аминокислоты с разветвленной боковой цепью безопасны при введении в больших дозах (LD50>5 г/кг). Учитывая эффективный катаболизм дейтерированных производных аминокислот с разветвленной боковой цепью с сопутствующим высвобождением дейтерия в виде DOH (нетоксична в очень высоких дозах, вплоть до замещения 10-30% воды в организме, а также присутствует в воде организма в концентрации около 1×10-2 моль/л), мы не ожидаем побочных эффектов, связанных с введением множественных атомов дейтерия.
В частных случаях воплощения изобретения диагностический препарат может содержать ингибитор метаболизма аминокислот с разветвленной боковой цепью, в частности, ингибитор трансаминазы аминокислот с разветвленной боковой цепью (англ. Branched-chain amino acid transaminase, ВСАТ; пример ингибитора: Hu, L.Y. et al. Bioorg. Med. Chem. Lett. 2006, 16, 9, 2337-2340). Ингибирование метаболизма аминокислот с разветвленной боковой цепью позволяет проводить более длительное томографическое исследование и/или понизить дозу диагностического препарата и/или повысить чувствительность и, как следствие, достоверность способа диагностики по изобретению. Использование в составе диагностического препарата селективного ингибитора отдельных изоформ трансаминазы аминокислот с разветвленной боковой цепью может использоваться для визуализации активности отдельных изоформ в разных участках области сканирования.
Способ по изобретению осуществляется без вредного воздействия ионизирующего излучения (характерного, например, для методов КТ, ПЭТ, ОФЭКТ), что в свою очередь повышает безопасность исследований, делает возможным проведение более частых повторных исследований, в частности делает метод привлекательным для педиатрии.
Способ диагностики по изобретению может применяться, в частности, для ранней диагностики злокачественных опухолей различной локализации, метастатических поражений, оценки ответа опухоли на лечение и заключения об эффективности проводимой терапии, для уточнения диагноза, составленного на основании результатов 1Н МРТ и/или других методов диагностики.
Способ по изобретению расширяет существующие возможности неинвазивной диагностики, в том числе, позволяет осуществлять эффективную диагностику онкологических заболеваний.
Фармацевтически приемлемые соли дейтерированных производных аминокислот с разветвленной боковой цепью обладают всеми свойствами, необходимыми для их использования в составе диагностического препарата по изобретению.
Осуществление изобретения
Возможность объективного проявления технического результата при использовании изобретения подтверждена достоверными данными, приведенными в примерах, содержащих сведения экспериментального характера, полученные в процессе проведения исследований по методикам, принятым в данной области. Сущность изобретения поясняется фигурами.
Следует понимать, что эти и все приведенные в материалах заявки примеры не являются ограничивающими и приведены только для иллюстрации настоящего изобретения.
Приведенные в данном документе примеры служат иллюстрациями принципа действия разработанного метода, и не ограничивают диапазон используемых доз, а также диапазон времени между введением диагностического препарата и регистрацией сигнала дейтерия, поскольку в зависимости от диагностируемого заболевания и природы субъекта (человек или лабораторное животное) необходимые дозы и время, необходимое для накопления препарата, могут отличаться. В частности, из уровня техники известно, что период полувыведения одного и того же соединения может различаться у разных видов животных, и что при переходе от одного вида животного к другому или к человеку дозы, как правило, масштабируются пропорционально площади поверхности тела, а не массе тела. Регистрация сигнала дейтерия может осуществляться, в том числе, до окончания введения диагностического препарата. Кроме того, приведенные параметры регистрации спектров и томограмм, включая время накопления сигнала, являются частью конкретных вариантов воплощения изобретения и могут меняться в зависимости от используемого оборудования и конкретных диагностических задач.
Синтез валина-4,4,4,4',4',4'-D6
Валин-4,4,4,4',4',4'-D6 был синтезирован из описанного в литературе комплекса никеля(II) (S)-BPB-Ni-Gly (Y.N. Belokon et al., Tetrahedron: Asymmetry 1998, 9, 4249-4252) согласно представленной схеме:
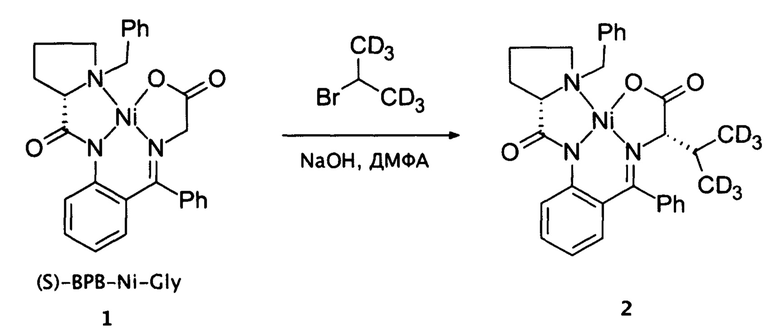
Раствор 10 г (0,02 моль) комплекса 1 в 12 мл сухого диметилформамида (ДМФА) под аргоном охлаждали до 0°С. Далее к раствору при энергичном перемешивании добавляли 1 г (0,025 моль) мелко растертого NaOH и перемешивали в течение 5 минут. Затем к раствору прибавили при 0°С по каплям 2 мл (2,62 г., 0,021 моль) изопропилбромида-d6 и перемешивали 30 мин, после чего температуру довели до комнатной и перемешивали еще 1.5 часа. По завершении реакции раствор снова охладили, затем прибавили к нему по каплям раствор уксусной кислоты (1.5 мл ледяной СН3СООН в 20 мл воды). В ходе добавления раствора уксусной кислоты комплекс 2 выпал в осадок. Полученный осадок отфильтровали и промыли водой, высушили. Комплекс 2 был получен в виде красного порошка (10.5 г, 0.019 моль, 97%).
1Н-ЯМР (400 MHz, CDCl3): δ=8.24 (d, J=8.6 Hz, 1H), 8.01 (d, J=7.4 Hz, 2H), 7.56-7.40 (m, 4H), 7.32 (t, J=7.6 Hz, 2H), 7.20-7.09 (m, 2H), 6.91 (d, J=7.6 Hz, 1H), 6.68-6.60 (m, 2H), 4.47 (d, J=12.8 Hz, 1H), 3.82 (d, J=3.2 Hz, 1H), 3.62 (d, J=12.6 Hz, 1H), 3.54-3.42 (m, 2H), 3.38-3.28 (m, 1H), 2.88-2.75 (m, 1H), 2.61-2.42 (m, 1H), 2.12-2.01 (m, 2H), 1.79-1.72 (m, 1H).
К раствору 10,5 г (0,019 моль) комплекса 2 в 17 мл метанола добавили 12 мл 12 М HCl и 18 мл воды, и затем смесь кипятили с обратным холодильником в течение 30 мин. Далее реакционную смесь упарили. Образовавшийся осадок хирального лиганда отфильтровали, промыли несколько раз водой, высушили. Лиганд был получен в виде белого порошка с выходом 81% (6,82 г). Собранный водный слой нейтрализовали 25%-ным раствором аммиака, оставшийся в растворе хиральный лиганд проэкстрагировали хлористым метиленом (3×30 мл), затем водный слой профильтровали через бумажный фильтр. Валин-d6 очистили с помощью ионообменной хроматографии. Для этого водный раствор нанесли на ионообменную смолу КУ-2 в Н+-форме (13×3 см). Сначала колонку со смолой промывали водой (300 мл), затем валин-d6 смывали с колонки 5%-ным раствором аммиака (200 мл). Полученный раствор упарили досуха, продукт перекристаллизовали в смеси воды и этанола. Валин-d6 выделили в виде белого порошка (1,37 г, 62%).
1Н-ЯМР (400 MHz, D2O): δ=3.49 (d, J=4.4 Hz, 1H), 2.16-2.10 (m, 1H).
13С-ЯМР (101 MHz, D2O) δ=174.3, 60.3, 28.6, 17.6-15.0 (m).
Синтез валина-2,4,4,4,4',4',4'-D7 (в смеси с валином-4,4,4,4',4',4'-D6)
К раствору 10 г (0,02 моль) комплекса 1 в 50 мл хлористого метилена добавили 20 эквивалентов метанола-d1 и 5 мол% триэтиламина и перемешивали в течение 18 часов при комнатной температуре. Полученный комплекс 1-D использовали на следующей стадии без очистки.
1Н-ЯМР (400 MHz, CDCl3): δ=8.30 (d, J=8.6 Hz, 1H), 8.09 (d, J=7.3 Hz, 2H), 7.62-7.49 (m, 3H), 7.44 (t, J=7.5 Hz, 2H), 7.32 (t, J=7.4 Hz, 1H), 7.23 (t, J=7.3 Hz, 1H), 7.12 (d, J=6.8 Hz, 1H), 7.05-6.95 (m, 1H), 6.82 (d, J=7.6 Hz, 1H), 6.72 (t, J=7.4 Hz, 1H), 4.50 (d, J=12.6 Hz, 1H), 3.73-3.64 (m, 2H), 3.49 (dd, J=10.7, 5.4 Hz, 1H), 3.44-3.30 (m, 1H), 2.64-2.53 (m, 1H), 2.52-2.36 (m, 1H), 2.22-2.03 (m, 2H).
Раствор 5 г (0,01 моль) комплекса 1-D в 6 мл сухого диметилформамида (ДМФА) под аргоном охлаждали до 0°С. Далее к раствору при энергичном перемешивании добавляли 0.5 г (0,0125 моль) мелко растертого NaOH и перемешивали в течение 5 минут. Затем к раствору добавляли при 0°С по каплям 1 мл (1,31 г., 0,01 моль) изопропилбромида-d6 и перемешивали 30 мин, после чего температуру довели до комнатной и перемешивали еще 1.5 часа. После завершения реакции (анализ по ТСХ) раствор снова охладили; прибавили по каплям раствор уксусной кислоты (1.5 мл ледяной СН3СООН в 20 мл воды). В ходе добавления раствора уксусной кислоты полученный комплекс 2-D выпал в осадок.
К раствору 2 г (0,004 моль) комплекса 2-D в 5 мл метанола добавили 3 мл концентрированного раствора HCl (12 М р-р) и 5 мл воды, и затем смесь кипятили с обратным холодильником в течении 30 мин. Далее реакционную смесь упарили. Образовавшийся осадок промывали водой, хиральный лиганд отфильтровали и промыли несколько раз водой. Собранный водный слой нейтрализовали 25%-ным раствором аммиака, оставшийся в растворе лиганд 3 проэкстрагировали хлористым метиленом (3×10 мл), затем водный слой профильтровали через бумажный фильтр и нанесли на ионообменную смолу КУ-2 в Н+-форме (13×3 см). Сначала колонку со смолой промывали водой (300 мл), а затем валин-d6/d7 смывали с колонки 5%-ным раствором аммиака (200 мл). Валин-d6/d7 был очищен от примеси глицина с помощью жидкостной хроматографии на силикагеле (элюент: дихлорметан-метанол-вода). Выход: 172 мг (35%).
1Н-ЯМР (400 MHz, D2O): δ=3.49 (d, J=4.4 Hz, 1H), 2.16-2.10 (m, 1H).
Отношение пиков, соответствующих изотопным формам d5, d6 и d7, составляет 6,1:49,5:44,4 по данным масс-спектрометрического анализа. Форма d5 представляет собой продукт неполного дейтерирования метильных групп. С учетом вклада изотопа 13С и равной степени дейтерирования α-положения вне зависимости от степени дейтерирования метильных групп, суммарная мольная доля α-дейтерированных форм валина в финальном продукте составляет 49%.
Синтез лейцина-5,5,5,5',5',5'-D6
1) Изобутанол-d6
В 2-горлую колбу засыпают 4.19 г магния, присоединяют обратный холодильник и подключают к водоструйному насосу для вакуумирования колбы. В течение нескольких минут колбу греют горячим воздухом. После охлаждения колбы до комнатной температуры добавляют 20 мл ТГФ и кристаллик йода, продувают аргоном и перемешивают при комнатной температуре ~10 мин. К холодильнику подсоединяют хлоркальциевую трубку и медленно (~2.5 ч) добавляют раствор изопропилбромида-d6 (22.5 г, 0.17 моль) в 68 мл ТГФ. Смесь разогревается и становится серого цвета. После прибавления всего изопропилбромида реакционную смесь греют при 50-60°С в течение 2 ч. Затем реакционную смесь охлаждают до комнатной температуры и порциями, без доступа воздуха, добавляют сухой и мелкоизмельченный параформ (5.22 г, 0.17 моль; предварительно сушат в вакууме над фосфорным ангидридом двое суток). Реакционную смесь перемешивают при 50°С 3 ч, а затем ночь при комнатной температуре. Растворитель досуха упаривают на роторном испарителе. Сухой остаток растворяют в 75 мл дихлорметана и медленно подкисляют раствором 20% серной кислоты до слабокислой среды. Органический слой отделяют, а водный 3 раза экстрагируют по 25 мл дихлорметаном. Объединенные органические экстракты промывают раствором соды и сушат над сульфатом натрия. После фильтрования органическую фазу фракционируют с дефлегматором, собирая отдельно фракции с диапазоном кипения 85-100°С и 100-115°С. Первая фракция состоит из ТГФ и продукта в соотношении 2.5:1. Во второй фракции есть небольшая примесь ТГФ. Суммарный выход: 70%. Спектр ЯМР 1Н (600 MHz, CDCl3, ppm): δ=3.37 (2Н, d, 3J=6.5 Hz, СН2), 1.94 (1Н, brs, СН).
2) Изобутилбромид-d6
Изобутанол-d6 (4.9 г, 0.06 моль) охлаждают до -10°С и медленно добавляют по каплям PBr3 (10.3 г, 0.038 моль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Изобутилбромид-d6 отгоняют из реакционной массы, собирая фракцию, кипящую 65-90°С. Дистиллят промывают водой и сушат над цеолитом. Выход: 6.6 г (73%). Спектр ЯМР 1Н (600 MHz, CDCl3, ppm): δ=3.30 (2Н, d, 3J=6.1 Hz, СН2), 1.93-1.95 (1Н, m, СН).
3) Лейцин-5,5,5,5',5',5'-D6
Лейцин-5,5,5,5',5',5'-D6 был получен аналогично валину-d6 путем замены изопропилбромида-d6 на эквивалентное количество изобутилбромида-d6. Выход конечного продукта после перекристаллизации 50%.
1Н-ЯМР (600 MHz, D2O, внутренний стандарт: метанол): δ=1.64-1.76 (3Н, m), 3.71 (1Н, dd, 3J=6.0, 8.4 Hz, СН-α).
13С-ЯМР (101 MHz, D2O, внутренний стандарт: метанол) δ=20.4 (CD3), 24.31, 40.33, 54.08, 176.24.
В приведенных ниже примерах использовался томограф Bruker BioSpec ВС70/30 USR с постоянным полем 7,05 Тл, оснащенный объемным резонатором, настроенным на частоты 1Н (передача/прием) и 2Н (передача), а также поверхностной приемной катушкой диаметром 5 см.
Для регистрации дейтериевой томограммы использовалась импульсная последовательность FLASH (Fast low angle shot). Частота возбуждения определялась по 2Н ЯМР спектру и составляла на используемом приборе: sfo1≈46.17452 МГц, прямоугольный возбуждающий импульс шириной 2560 Гц и мощностью 11.2 dB, угол отклонения FA=30°, время повторения TR=11.8 мс, время эхо ТЕ=4.07 мс, область сканирования 10 см × 10 см, матрица сканирования 50×50, толщина среза 3 см, ширина пропускания частот 12500 Гц, общее время сканирования 9 минут 34 секунды (1024 накопления).
Пример 1. Регистрация дейтериевой томограммы и 2Н ЯМР спектра образца, содержащего разбавленный раствор дейтерированного валина.
Для демонстрации принципиальной возможности регистрации дейтериевой томограммы разбавленного раствора дейтерированного валина был проведен следующий эксперимент.
Стеклянный флакон, содержащий 5 мл раствора валина-4,4,4,4',4',4'-d6 или лейцина-5,5,5,5',5',5'-d6 (5 мг) в дистиллированной воде, помещался в центре магнита томографа. Поверхностная катушка диаметром 5 см располагалась горизонтально непосредственно над флаконом.
На фигуре 1а показаны дейтериевая томограмма (слева) и 2Н спектр (справа) образца с валином-4,4,4,4',4',4'-d6.
На фигуре 1б показаны дейтериевая томограмма (слева) и 2Н спектр (справа) образца с лейцином-5,5,5,5',5',5'-d6.
Пример 2. Использование дейтериевой томографии для визуализации карциномы молочной железы мыши 4Т1 in vivo с использованием диагностического препарата, содержащего валин-4,4,4,4',4',4'-d6.
В данном примере проводились эксперименты на мышах Balb/c с привитой карциномой молочной железы 4Т1 (инъекция 5×105 клеток/60 мкл под левой передней лапой за 12 дней до эксперимента). Животному весом 20 г вводился внутрибрюшинно раствор 20 мг валина-d6 в 0.5 мл воды. Через 10 мин после введения животное обездвиживалось с помощью изофлурана, размещалось на подогреваемой кроватке в томографе. Поверхностная приемная 2Н катушка располагалась над передней частью тела животного с дорсальной стороны, как отмечено на фигуре 2 пунктиром.
На фигуре 2 видно, что со временем дейтерированное производное валина накапливается в опухолевой ткани, причем максимальная интенсивность сигнала дейтерия наблюдается около 90 минут после введения препарата. Как видно из приведенных данных, сигнал дейтерия сохраняется в течение нескольких десятков минут, таким образом, валин-d6 обладает благоприятной фармакокинетикой для практического использования в 2Н МРТ и МР-спектроскопии.
Как следует из приведенных результатов, диагностический препарат на основе дейтерированного производного валина может использоваться для неинвазивной диагностики заболеваний, включая онкологические, методом 2Н МРТ и/или МР-спектроскопии.
Пример 3. Использование дейтериевой томографии для визуализации карциномы молочной железы мыши 4Т1 in vivo с использованием диагностического препарата, содержащего лейцин-d6.
В данном примере проводились эксперименты на мышах Balb/c с привитой карциномой молочной железы 4Т1 (инъекция 5×105 клеток/60 мкл под левой передней лапой за 12 дней до эксперимента). Животному весом 20 г вводился внутрибрюшинно раствор 25 мг лейцина-5,5,5,5',5',5'-d6 в 0.8 мл воды. Через 10 мин после введения животное обездвиживалось с помощью изофлурана, размещалось на подогреваемой кроватке в томографе. Поверхностная приемная 2Н катушка располагалась над передней частью тела животного с дорсальной стороны. На фигуре 3 представлено изображение, полученное спустя 40 мин после введения препарата.
Как следует из приведенных результатов, диагностический препарат на основе дейтерированного производного лейцина может использоваться для неинвазивной диагностики заболеваний, включая онкологические, методом 2Н МРТ и/или МР-спектроскопии.
Пример 4. Использование дейтериевой томографии для визуализации карциномы молочной железы мыши 4Т1 in vivo с использованием диагностического препарата, содержащего L-аланин-3,3,3-d3 и L-фенилаланин-β,β,2,3,4,5,6-d7.
В данном примере проводились эксперименты на мышах Balb/c с привитой карциномой молочной железы 4Т1 (инъекция 5×105 клеток/60 мкл под левой передней лапой за 12 дней до эксперимента).
Животному весом 20 г вводился внутрибрюшинно раствор:
а) 30 мг L-аланина-3,3,3-d3 в 0.5 мл воды; либо
б) 10 мг L-фенилаланина-β,β,2,3,4,5,6-d7 в 1.0 мл воды (меньшая доза фенилаланина в пересчете на дейтерий обусловлена низкой растворимостью фенилаланина и, как следствие, невозможностью введения большего объема диагностического препарата без вреда для здоровья субъекта).
Через 10 мин после введения животное обездвиживалось с помощью изофлурана, размещалось на подогреваемой кроватке в томографе. Поверхностно приемная 2Н катушка располагалась над передней частью тела животного дорсальной стороны, как отмечено на фигуре 4 пунктиром.
На фигуре 4 видно, что дейтерированные производные аланина фенилаланина не накапливается в опухолевой ткани и не проявляют селективности накопления в различных органах.
Пример 5. Определение содержания валина-4,4,4,4',4',4'-d6 в тканях мышей с карциномой молочной железы 4Т1 после введения диагностического препарата в дозе, совместимой с дейтериевой томографией.
В данном примере проводились эксперименты на мышах Balb/c с привитой карциномой молочной железы 4Т1 (инъекция 5×105 клеток/60 мкл под левой передней лапой за 12 дней до эксперимента). Животному весом 20 г вводился внутрибрюшинно раствор 20 мг L-валина-d6 в 0.5 мл воды. После введения животное содержалось в отдельной клетке с доступом к пище и воде. Спустя указанное время после введения животное умерщвлялось путем дислокации шейных позвонков. Образцы органов тканей животного быстро извлекались и замораживались в жидком азоте. Замороженные образцы растирались в фарфоровой ступке при охлаждении жидким азотом. Навеску (50-200 мг) полученного таким образом порошка быстро вносили нагретую до 98°С 0.4% соляную кислоту (0.6-1.0 мл). Полученную суспензию выдерживали при 98°С 15 мин с периодическим встряхиванием. После добавления внутреннего стандарта (раствор 3-О-(CD3)-глюкозы) смесь встряхивали, центрифугировали до полного отделения твердых фракций. Раствор анализировали методом 2Н ЯМР.
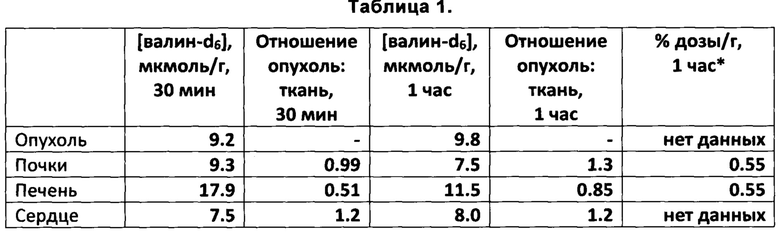
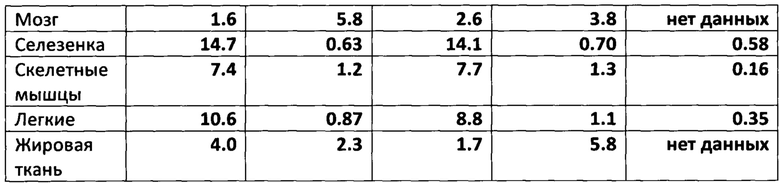
* По данным Washburn et al. (1978): процент введенной дозы DL-1-14С-валина (0.021 мг/кг) на 1 грамм соответствующей ткани здоровой крысы.
Приведенные в Таблице 1 данные свидетельствуют о селективном накоплении L-валина-d6 в различных тканях животного в диапазоне концентраций, пригодном для использования в 2Н МРТ или МР-спектроскопии. В том числе, наблюдается повышенное накопление L-валина-d6 в опухолевой ткани по сравнению с почками, сердцем, мозгом, скелетными мышцами и жировой тканью через 1 час после введения диагностического препарата.
Также из Таблицы 1 можно сделать вывод о существенном различии в достигаемых в разных органах относительных концентрациях изотопной метки: 2Н в случае L-валина-d6 (1.25 г/кг) и 14С в случае DL-1-14С-валина (0.021 мг/кг). Абсолютные концентрации валина в печени и почках крысы по данным Washburn et al. (1978), приведенным в Таблице 1, в результате введения DL-1-14С-валина (0.021 мг/кг) были увеличены не более, чем на 0.3 нмоль/г по сравнению с физиологической концентрацией свободного валина порядка 0.5 мкмоль/г [Rivera, S. et al. Biochem. J. 1988, 249, 443-449]. В наших экспериментах с валином-d6, как следует из Таблицы 1, достигается более, чем 10-кратное превышение физиологической концентрации свободного валина в тканях животного.
Пример 6. Изучение распределения и метаболизма смеси дейтерированных производных валина в тканях мышей с карциномой молочной железы 4Т1 после введения диагностического препарата в дозе, совместимой с дейтериевой томографией.
В данном примере использовался частично дейтерированный в α-положении валин-d6/d7. Суммарная мольная доля α-дейтерированных форм валина в исходном диагностическом препарате составляет 49%.
Эксперименты проводились на мышах Balb/c с привитой карциномой молочной железы 4Т1 (инъекция 5×105 клеток/60 мкл под левой передней лапой за 12 дней до эксперимента). Животному весом 20 г вводился внутрибрюшинно раствор 20 мг частично дейтерированного в α-положении валина в 0.5 мл воды. После введения животное содержалось в отдельной клетке с доступом к воде. Спустя 60 минут после введения животное умерщвлялось путем дислокации шейных позвонков. Образцы органов и тканей животного быстро извлекались и замораживались в жидком азоте. Замороженные образцы растирались в фарфоровой ступке при охлаждении жидким азотом. Навеску (около 50 мг) полученного таким образом порошка быстро вносили в нагретую до 98°С 0.4% соляную кислоту (1.0 мл). Полученную суспензию выдерживали при 98°С 15 мин с периодическим встряхиванием, затем центрифугировали. Раствор разбавляли 3 объемами ацетонитрила, через 15 минут центрифугировали, разбавляли 9 объемами воды, снова центрифугировали. Отношение изотопомеров d5, d6 и d7 валина определяли методом LC-MS/MS.
Суммарная мольная доля α-дейтерированного валина составляет: в опухоли - 12%, в мозге - 5%, в крови - 12%, в почках - 17%, в селезенке - 13%, в печени, скелетных мышцах и жировой ткани - 11%. Таким образом, к моменту достижения в опухоли приемлемой для 2Н МРТ концентрации дейтерия происходит существенная потеря дейтерия из α-положения валина, предположительно, в результате действия тканевых трансаминаз. Различия в потере дейтерия из α-положения в разных тканях указывают на разницу в соотношении скоростей мембранного транспорта и трансаминирования, что может служить дополнительной информацией, используемой при оценке метаболического статуса различных участков тканей субъекта и заключении о наличии или отсутствии патологии. Данный результат свидетельствует о возможности использования диагностического препарата, содержащего смесь различных дейтерированных производных валина или производное валина с дейтерием в нескольких неэквивалентных положениях.


Группа изобретений относится к медицине, а именно к магнитно-резонансной диагностике, и может быть использована для диагностики онкологических заболеваний у субъекта. Для этого вводят диагностический препарат, включающий дейтерированное производное природной аминокислоты с разветвленной боковой цепью и/или его фармацевтически приемлемую соль. При этом дейтерированое производное - соединение, содержащее дейтерий, связанный с атомом углерода, по меньшей мере, в одном положении, в количестве, превышающем его природное содержание. Также предложен способ диагностики онкологических заболеваний с использованием диагностического препарата. Группа изобретения позволяет осуществлять диагностику онкологических заболеваний методом магнитно-резонансной томографии и/или магнитно-резонансной спектроскопии на ядрах дейтерия. 2 н. и 24 з.п. ф-лы, 1 табл., 6 пр., 4 ил.
1. Диагностический препарат, включающий, по меньшей мере, одно соединение, выбранное из дейтерированного производного природной аминокислоты с разветвленной боковой цепью и/или фармацевтически приемлемой соли дейтерированного производного природной аминокислоты с разветвленной боковой цепью, где под дейтерированным производным понимается соединение, содержащее дейтерий, связанный с атомом углерода, в количестве, превышающем его природное содержание, по меньшей мере, в одном положении, для диагностики онкологических заболеваний методом магнитно-резонансной томографии и/или магнитно-резонансной спектроскопии на ядрах дейтерия.
2. Диагностический препарат по п. 1, который дополнительно включает, по меньшей мере, одно фармацевтически приемлемое вспомогательное вещество.
3. Диагностический препарат по п. 2, характеризующийся тем, что фармацевтически приемлемое вспомогательное вещество представляет собой носитель, наполнитель и/или растворитель.
4. Диагностический препарат по п. 1, в котором дейтерированное производное природной аминокислоты с разветвленной боковой цепью представляет собой дейтерированный валин или дейтерированный лейцин или дейтерированный изолейцин.
5. Диагностический препарат по п. 1, дополнительно содержащий ингибитор метаболизма природных аминокислот с разветвленной боковой цепью.
6. Диагностический препарат по п. 4, в котором дейтерированный валин представляет собой валин-4,4,4-d3, валин-4,4,4,4΄,4΄,4΄-d6, валин-3,4,4,4,4΄,4΄,4΄-d7, валин-2,4,4,4,4΄,4΄,4΄-d7, валин-2,3,4,4,4,4΄,4΄,4΄-d8.
7. Диагностический препарат по п. 4, в котором дейтерированный лейцин представляет собой лейцин-3,3-d2, лейцин-5,5,5-d3, лейцин-5,5,5,5΄,5΄,5΄-d6, лейцин- 4,5,5,5,5΄,5΄,5΄-d7, лейцин-3,3,5,5,5,5΄,5΄,5΄-d8, лейцин-3,3,4,5,5,5,5΄,5΄,5΄-d9, лейцин- 2,5,5,5,5΄,5΄,5΄-d7, лейцин-2,3,3,5,5,5,5΄,5΄,5΄-d9, лейцин-2,4,5,5,5,5΄,5΄,5΄-d8, лейцин- 2,3,3,4,5,5,5,5΄,5΄,5΄-d10.
8. Диагностический препарат по п. 4, в котором дейтерированный изолейцин представляет собой 2-амино-3-(СD3)пентановую кислоту, 2-амино-3-(СD3)пентановую-5,5,5-d3 кислоту, 2-амино-3-(СD3)пентановую-4,4,5,5,5-d5 кислоту, 2-амино-3- (СD3)пентановую-2,5,5,5-d4 кислоту, 2-амино-3-(СD3)пентановую-2,3,5,5,5-d5 кислоту, 2-амино-3-(СD3)пентановую-3,4,4,5,5,5-d6 кислоту, 2-амино-3-(СD3)пентановую-2,3,4,4,5,5,5-d7 кислоту, 2-амино-3-метилпентановую-5,5,5-d3 кислоту.
9. Диагностический препарат по п. 1, в котором дейтерированное производное полностью или преимущественно представлено одним энантиомером.
10. Диагностический препарат по п. 9, в котором дейтерированное производное полностью или преимущественно представлено энантиомером с конфигурацией 2S.
11. Диагностический препарат по п. 1, включающий смесь, по меньшей мере, двух разных соединений, выбранных из дейтерированных производных природных аминокислот с разветвленной боковой цепью и/или фармацевтически приемлемых солей дейтерированных производных природных аминокислот с разветвленной боковой цепью.
12. Диагностический препарат по п. 1, в котором дейтерированное производное природной аминокислоты с разветвленной боковой цепью и/или его фармацевтически приемлемая соль наряду с атомами дейтерия, связанными с атомами углерода, содержит атомы дейтерия, частично или полностью замещающие подвижные атомы водорода, связанные с атомами кислорода и/или азота.
13. Диагностический препарат по п. 1, включающий дейтерированное производное природной аминокислоты с разветвленной боковой цепью, содержащее атомы дейтерия, связанные с атомами углерода более чем в одном положении, или его фармацевтически приемлемую соль; или смесь дейтерированных производных природных аминокислот с разветвленной боковой цепью и/или их фармацевтически приемлемых солей, в которой присутствуют дейтерированные производные, содержащие атомы дейтерия в структурно неэквивалентных положениях.
14. Способ диагностики онкологических заболеваний у субъекта, включающий следующие этапы:
а) вводят субъекту диагностический препарат по любому из пп. 1-13;
б) проводят магнитно-резонансную томографию и/или магнитно-резонансную спектроскопию на ядрах дейтерия после введения диагностического препарата спустя время, достаточное для его накопления в исследуемой ткани, для получения, соответственно, томограммы и/или ЯМР спектра(ов);
в) диагностируют наличие или отсутствие заболевания на основании наблюдаемой интенсивности сигнала ядер дейтерия, отражающей уровень накопления диагностического препарата.
15. Способ по п. 14, в котором проводят, по меньшей мере, одно дополнительное медицинское исследование, выбранное из магнитно-резонансной томографии на ядрах, отличных от ядер дейтерия, ультразвукового исследования, компьютерной томографии, рентгенографии, пальпации, биопсии, анализа биологического материала субъекта на онкомаркеры, радионуклидной диагностики и/или визуального наблюдения.
16. Способ по п. 14, в котором диагностируют наличие или отсутствие онкологического заболевания на основании сравнения интенсивности сигнала ядер дейтерия у исследуемого субъекта с типичной интенсивностью сигнала, наблюдаемой у здоровых субъектов в соответствующей ткани или соответствующем органе.
17. Способ по п. 14, в котором диагностируют наличие или отсутствие онкологического заболевания на основании сравнения интенсивности сигнала ядер дейтерия в областях, соответствующих нормальной и аномальной ткани по данным дополнительного медицинского исследования.
18. Способ по п. 15, в котором используют диагностический препарат, включающий дейтерированное производное природной аминокислоты с разветвленной боковой цепью, содержащее атомы дейтерия более чем в одном положении или смесь дейтерированных производных природных аминокислот с разветвленной боковой цепью, содержащих атомы дейтерия в структурно неэквивалентных положениях, и оценивают локальную скорость метаболизма одного или нескольких дейтерированных производных природных аминокислот с разветвленной боковой цепью на основании сравнения интенсивности сигналов ядер дейтерия в структурно неэквивалентных положениях.
19. Способ по п.18, в котором на основании сравнения интенсивности сигналов ядер дейтерия в структурно неэквивалентных положениях делают вывод о росте и степени злокачественности опухоли.
20. Способ по п.18, в котором сравнение интенсивности сигналов ядер дейтерия в структурно неэквивалентных положениях проводят несколько раз в процессе проведения магнитно-резонансной спектроскопии.
21. Способ по п. 15, в котором диагностируют наличие или отсутствие онкологического заболевания на основании сравнения дейтериевой томограммы исследуемого субъекта с изображением, полученным в результате магнитно-резонансной томографии у субъекта на ядрах протия.
22. Способ по п. 14, в котором по пространственному распределению области с повышенным накоплением диагностического препарата делают вывод о структуре опухоли.
23. Способ по п. 14, в котором по интенсивности сигнала дейтерия в области повышенного накопления диагностического препарата делают вывод о злокачественности или доброкачественности опухоли.
24. Способ по п. 14, в котором по скорости изменения интенсивности сигнала дейтерия после введения делается вывод об уровне перфузии в разных участках области сканирования.
25. Способ по п. 14, в котором диагностический препарат вводят субъекту перорально.
26. Способ по п. 14, в котором диагностический препарат вводят субъекту парентерально.
| US6574496 B1, 03.06.2003 | |||
| US 20100322865 A1, 23.12.2010 | |||
| TAGLANG C., et al., Late-stage deuteration of 13C-enriched substrates for T1 prolongation in hyperpolarized 13C MRI, Chem Commun (Camb) | |||
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| ПШЕНИЧНИКОВА А.Б | |||
| и др., Методы получения дейтерированных аминокислот, Биоорганическая химия, 1995, | |||
Авторы
Даты
2020-12-17—Публикация
2018-12-29—Подача