Область, к которой относится изобретение
Изобретение относится к вакцинным композициям, содержащим хитозан и вакцину, которые вводятся птицам путем глазного введения, и к способам или программам вакцинации, включающим применение хитозана для увеличения или усиления иммунного ответа на вакцины у птиц.
Предпосылки изобретения
Вакцины представляют собой препараты антигенных материалов, вводимые субъекту для повышения устойчивости к инфекции путем индукции активного иммунитета к определенным микроорганизмам, таким как бактерии или вирусы или паразиты. Вакцины могут совместно вводиться с адъювантами для активации иммунного ответа. Примеры адъювантов включают химические и полипептидные иммуностимуляторы, которые усиливают ответ иммунной системы на антигены. Такие адъюванты могут включать, например, гидроксид алюминия, фосфат алюминия, растительные и животные масла, а также минеральные масла, бактериальные токсины, производные хитина и хитозан и тому подобные, которые вводятся с вакциной, в количестве, достаточном для усиления иммунного ответа.
Вакцины и адъюванты в целом вводятся посредством парентеральной инъекции, такой как подкожные или внутримышечные инъекции. Может также выполняться непосредственное введение на слизистую носовой полости различных видов животных. В частности, для лечения инфекций верхних дыхательных путей. Например, в Европейском патенте EP 865 297B1 описывается интраназальное совместное введение мышам белковых или полисахаридных антигенов из патогенов и хитозана в качестве адъюванта. Эти интраназальные композиции составляются в виде сухих порошков в форме микросфер, вводимых посредством аэрозолей, капель или инсуффляций, и обеспечивают возможность усиления как мукозального гуморального иммунного ответа IgA, так и системного иммунного ответа IgG после нескольких последовательных интраназальных введений.
Заявитель обнаружил, что хитозан, используемый в комбинации с птичьей вакциной в рамках одной программы вакцинации, может значительно усилить клеточно-опосредованный иммунный ответ при поддержании высоких гуморальных и системных иммунных ответов вакцинированных птиц при глазном пути введения. Кроме того, было обнаружено, что хитозан действовал на конъюнктиву птиц, что приводило к значительному увеличению персистенции вакцины внутри тканей птиц.
Краткое описание сущности изобретения
Настоящее изобретение относится к предназначенным для глазного введения птицам вакцинным композициям, которые содержат одну или более вакцин и эффективное количество адъюванта хитозана. Изобретение также относится к способу иммунизации птиц, включающему глазное введение вакцинных композиций видам птиц и к применению одной или более вакцин в комбинации с хитозаном для получения вакцинной композиции для глазного введения для эффективной иммунизации птиц против инфекционных заболеваний. Настоящее изобретение, кроме того, относится к набору для вакцинации птиц, содержащему вакцинные композиции и средство или устройство для глазного введения указанной вакцинной композиции.
Краткое описание чертежей
Фиг.1 иллюстрирует последовательность вакцинации во времени.
Фиг.2 иллюстрирует протокол «воскрешения» антигена.
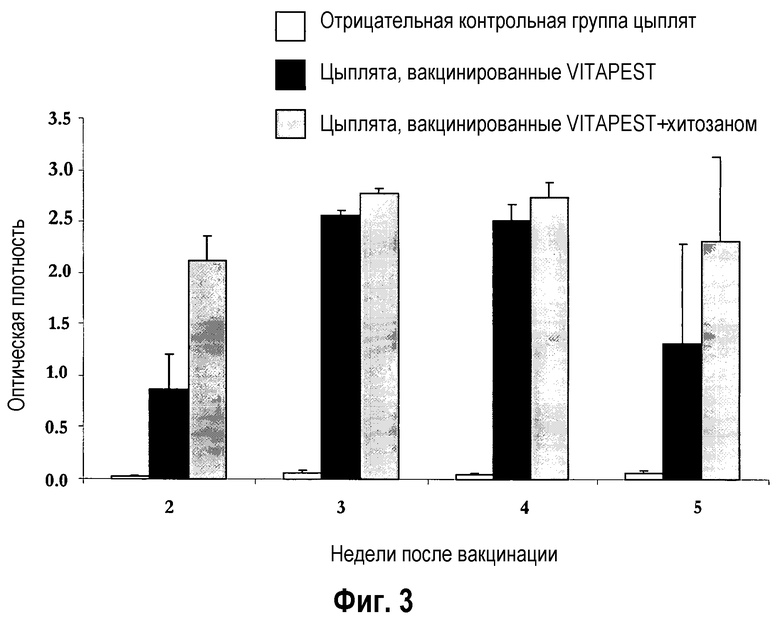
На фиг.3 показаны уровни продукции γ-интерферона (Оптическая плотность) по данным измерения от 2 до 5 недель после глазного введения CEVAC® VITAPEST L (Ceva Phylaxia, Hungary) с хитозаном или без него.
На фиг.4 показаны титры вакцинального штамма ньюкастлской болезни (ND), выраженные инфицирующей яйцо дозой (EID50), внутри птичьих тканей цыплят SPF, которые получали CEVAC® UNI L (Ceva Phylaxia, Hungary) или CEVAC® VITAPEST L, с хитозаном или без него путем глазного введения.
На фиг.5 показаны титры вакцинального штамма ньюкастлской болезни, выраженные инфицирующей яйцо дозой (EID50), внутри тканей цыплят обычных кур-несушек, которые получали CEVAC® UNI L, или CEVAC® VITAPEST L, с хитозаном или без него путем глазного введения.
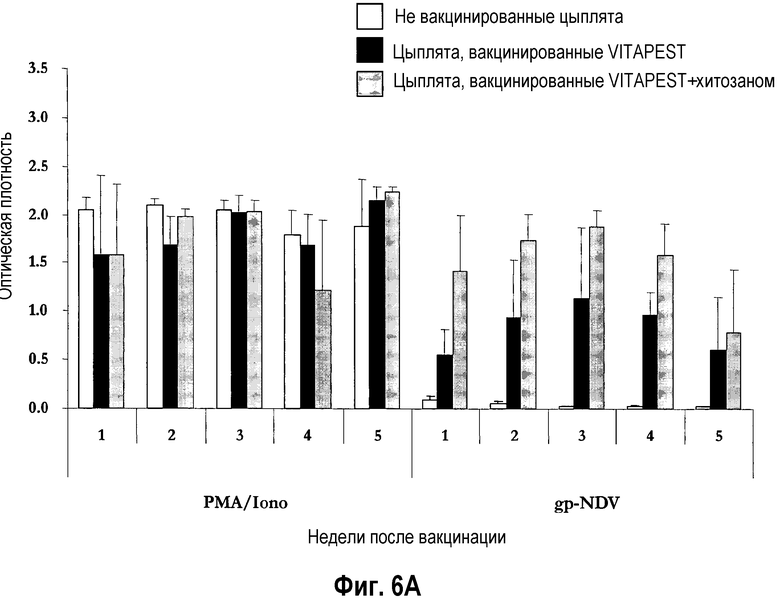
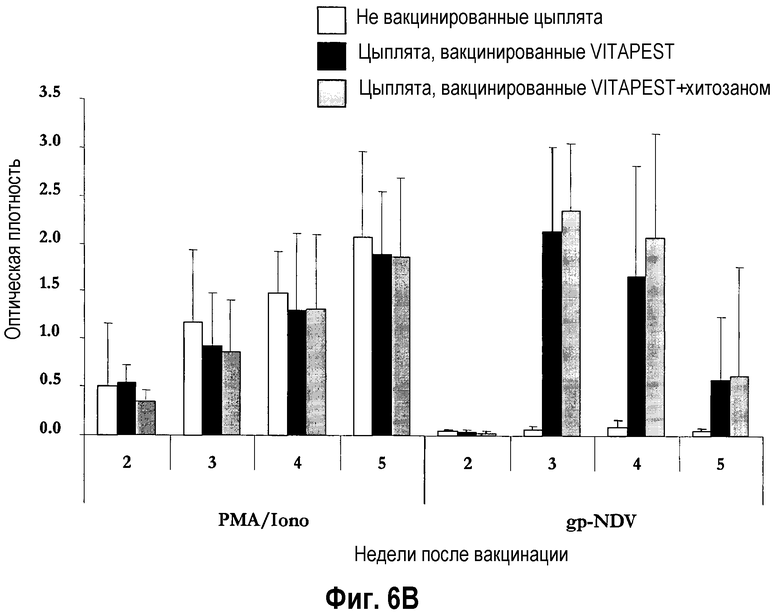
На фиг. 6A и 6B показаны иммунокомпетентность и специфический клеточно-опосредованный иммунитет после вакцинации цыплят SPF (лишенных специфических патогенов) (фиг. 6A) и цыплят обычных кур-несушек (фиг. 6B) живой вакциной против ньюкастлской болезни (NDV). Однодневных птиц вакцинировали глазным путем одной вакциной CEVAC® VITAPEST L (черные столбики) или в комбинации с хитозаном (серые столбики). Не вакцинированные животные указаны белыми столбиками. Спленоциты стимулировали митогеном PMA/иономицином (0,1 мкг/мл), «воскресшим» антигеном gp-NDV (1 мкг/мл), супернатанты стимулированных клеток собирали после 72 ч активации. Продукцию ChlFNγ определяли ELISA (иммуноферментным анализом) с захватом ChlFNγ. Результаты соответствуют средней величине ± стандартное отклонение оптической плотности (O.D.) в каждую точку времени (n=5). Средние величины ± стандартные отклонения без обычного надстрочного обозначения статистически различаются (P<0,05).
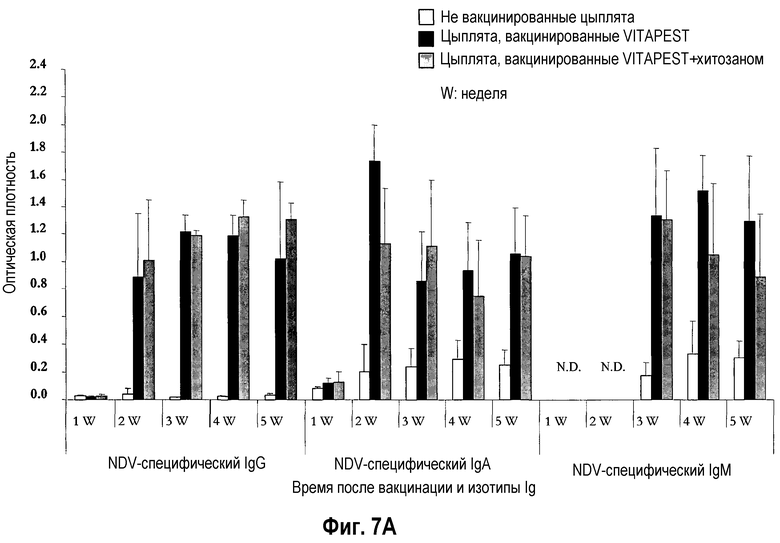
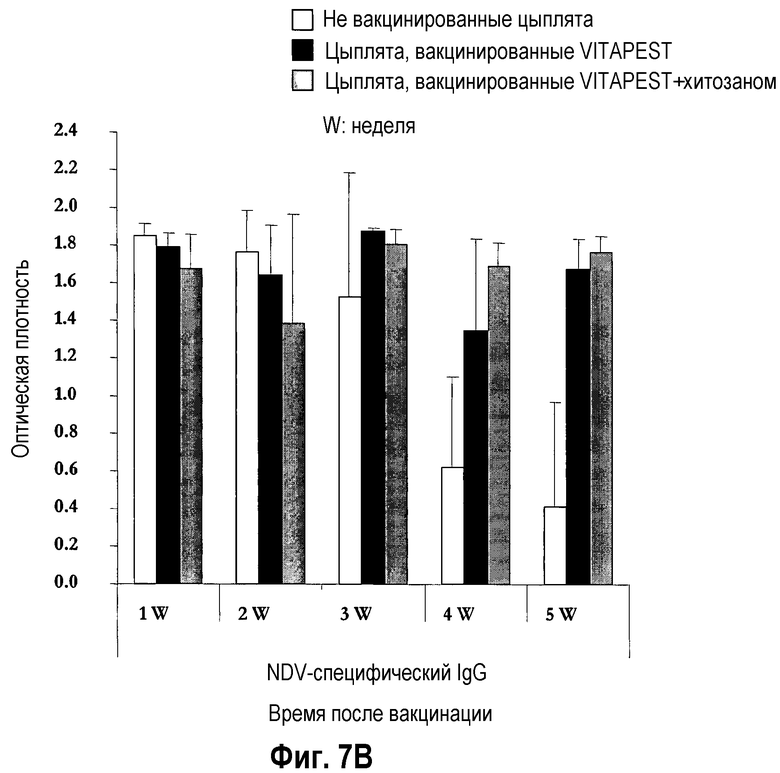
На фиг. 7A и 7B показан иммунитет, опосредованный антителами слезной жидкости, после вакцинации цыплят SPF (фиг. 7A) и цыплят обычных кур-несушек (фиг. 7B) живой вакциной против ND. Птиц вакцинировали в однодневном возрасте глазным путем одной вакциной CEVAC® VITAPEST L (черные столбики) или в комбинации с хитозаном (серые столбики). Не вакцинированные животные указаны белыми столбиками. Данные представляют среднюю величину ± стандартное отклонение величин спектральной поглощательной способности (O.D.), определяемой ELISA в определенное время после вакцинации (n=5). Образцы слезной жидкости разбавляли 1:4 для определения IgA/G м 1:32 для определения IgM. Средняя величина ± стандартное отклонение в точки времени без обычного надстрочного обозначения статистически различаются (P<0,05). N.D. = не определялось, вследствие ограниченного количества образцов, оставшегося после измерений IgA и IgG, специфичных для NDV (вируса ньюкастлской болезни).
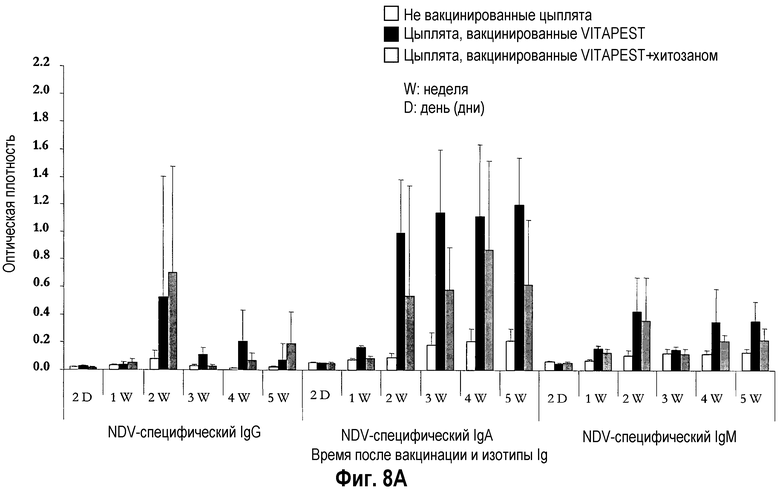
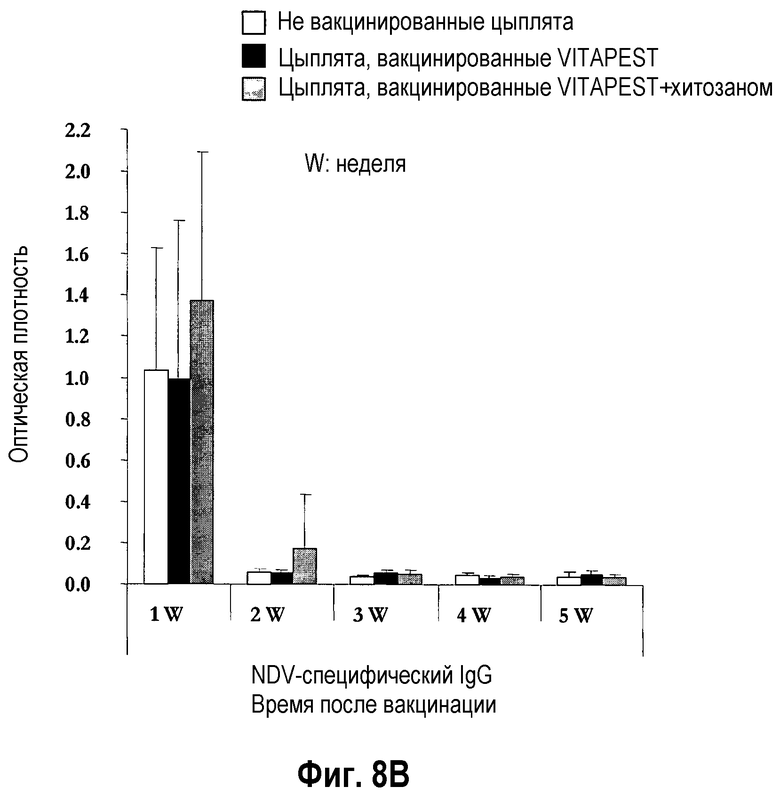
На фиг. 8A и 8B показан иммунитет, опосредованный желчными антителами, после вакцинации цыплят SPF (фиг. 8A) и цыплят обычных кур-несушек (фиг. 8B) живой вакциной против ND. Птиц вакцинировали в однодневном возрасте глазным путем одной вакциной CEVAC® VITAPEST L (черные столбики) или в комбинации с хитозаном (серые столбики). Не вакцинированные животные указаны белыми столбиками. Данные представляют среднюю величину ± стандартное отклонение величин спектральной поглощательной способности (O.D.), определяемой ELISA в определенное время после вакцинации (n=5). Образцы желчи разбавляли 1:50. Средняя величина ± стандартное отклонение в точки времени без обычного надстрочного обозначения статистически различаются (P<0,05).
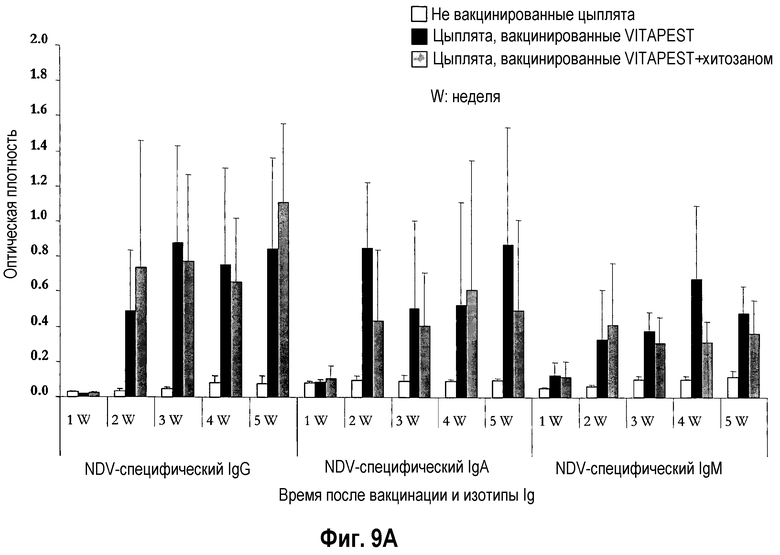
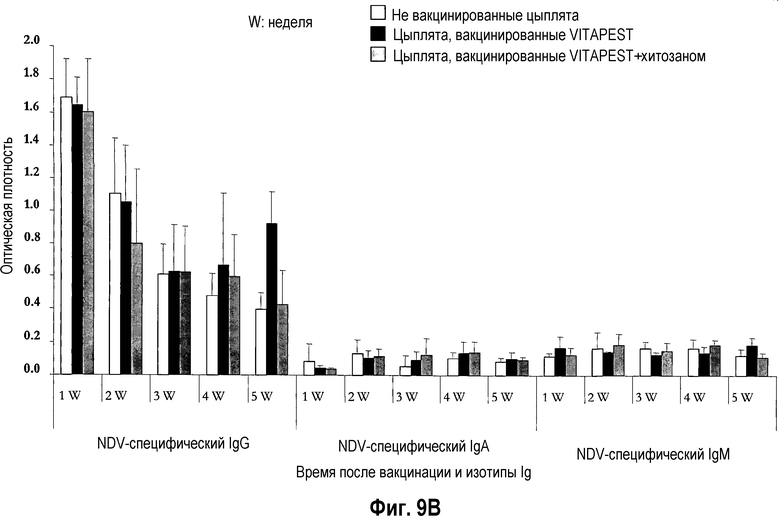
На фиг. 9A и 9B показан иммунитет, опосредованный антителами 12-перстной кишки, после вакцинации цыплят SPF (фиг. 9A) и цыплят обычных кур-несушек (фиг. 9B) живой вакциной против ND. Птиц вакцинировали в однодневном возрасте глазным путем одной вакциной CEVAC® VITAPEST L (черные столбики) или в комбинации с хитозаном (серые столбики). Не вакцинированные животные указаны белыми столбиками. Данные представляют среднюю величину ± стандартное отклонение величин спектральной поглощательной способности (O.D.), определяемой ELISA в определенное время после вакцинации (n=5). Реакцию Ig измеряли в разбавленных супернатантах культур тканей 12-перстной кишки ex vivo. Средняя величина ± стандартное отклонение в точки времени без обычного надстрочного обозначения статистически различаются (P<0,05).
Детальное описание изобретения
Настоящее изобретение относится к вакцинной композиции для глазного введения видам птиц, причем композиция содержит одну или более вакцину и эффективное адъювантное количество хитозана. Как указано выше, неожиданно было обнаружено, что после глазного совместного введения, хитозан и вакцина значительно усиливает клеточно-опосредованный иммунный ответ видов птиц и приводит к более длительному сохранению вакцины в определенных тканях вакцинированных птиц. Таким образом, вакцинные композиции по настоящему изобретению особенно эффективны для улучшения длительной защиты видов птиц против заболеваний птиц.
Термин «эффективное адъювантное количество» хорошо понятен специалистам в данной области и включает количество хитозана, которое способно стимулировать иммунный ответ против введенных в глаза антигенов, т.е. количество, которое увеличивает иммунный ответ вакцинной композиции, введенной в глаза, например, по данным измерения с точки зрении уровней продукции γ-интерферона спленоцитами и персистенции вакцины в тканях птиц. Значительные увеличения уровней продукции γ-интерферона и персистенции вакцины в тканях наблюдались в присутствии хитозана. В качестве примера, увеличение клеточной реакции может быть также доказано тестом клеточной пролиферации (измеренным включением 3H тимидина в делящиеся клетки после стимуляции «воскресшими» антигенами) измерением цитотоксической активности клеток CTL (цитотоксических Т лимфоцитов) на меченых радиоизотопом клетках-мишенях (определение высвобождения радиоизотопа в течение некоторого периода времени) или посредством теста миграции макрофагов.
В соответствии с изобретением вакцина может представлять собой любые патогенные или непатогенные для птиц микроорганизмы, такие как вирусы, бактерии, любые друге паразиты или антигены. Они могут представлять собой живые ослабленные микроорганизмы или убитые инактивированные микроорганизмы, разрушенные микроорганизмы, мутантные микроорганизмы, дефективные микроорганизмы или их комбинацию. Вакцина может также представлять собой антиген, включающий эпитопы или антигенные части структуры микроорганизма, например, вируса, бактерии или паразита, такие как препараты антигенных белков из патогенов, рекомбинантные белки, предпочтительно, вирусный антиген, такой как вирусные капсидные белки, белки клеточной стенки, пептиды или части бактериальной или паразитарной структуры, такие как полисахариды, липополисахариды и гликопротеины. Вакцина может также представлять собой ДНК или рекомбинантную ДНК, которая продуцирует антиген из патогенов в клетки, после внедрения ДНК. Антигены могут быть предоставлены в очищенной или не очищенной форме.
Когда вакцина представляет собой живой ослабленный (репликативный) микроорганизм, такой как вирус, бактерия или другой птичий патоген, то ослабленный патоген сохраняет не патогенные свойства и способен к репликации. Ослабление может обеспечиваться естественным или искусственным процессом ослабления. Искусственное ослабление в целом получается с использованием различных методик, включая пассирования у живых животных или пересевы в различных натуральных средах, включая органы, клетки, яйца с развивающимися эмбрионами, и т.д. Искусственное ослабление может быть также получено сушкой инфицированных органов, старением культур, адаптацией к низким температурам или к определенным условиям культивирования, генетическими делециями и т.д.
Вакцина может также представлять собой убитые инактивированные микроорганизмы. Получение инактивированных вирусов для вакцинации в целом достигается химическими или физическими средствами. Химическая инактивация может осуществляться обработкой вирусов, например, ферментами, формальдегидом, β-пропиолатоном, этиленимином или его производным. Полученный таким образом инактивированный вирус может быть затем нейтрализован или стабилизирован. Физическая инактивация может проводиться воздействием на вирусы высокоэнергетического излучения, такого как ультрафиолетовое световое излучение, рентгеновское излучение или γ-излучение.
Такие ослабленные или инактивированные микроорганизмы, например, вирусы, бактерии или другие птичьи паразиты могут также приобретаться в коммерческих источниках.
Вакцина может быть гомологичного (например, представлять собой куриный вирус для защиты кур) или гетерологичного (например, представлять собой индюшачий вирус для защиты кур) типа. Альтернативно, вакцинные препараты могут содержать комбинацию живых антигенов со специфическими антителами, называемые иммунокомплексными вакцинами.
В соответствии с настоящим изобретением вакцина или антиген могут быть получены из вирусов, ответственных за обычные заболевания птиц, как описано G. D. Butcher, J. P. Jacob, and F. B. Mather (PS47, Veterinary Medicine-Large Animal Clinical Sciences Department, Florida Cooperative Extension Service, Institute of Food and Agricultural Sciences, University of Florida; May 1999), такие как птичья оспа, ньюкастлская болезнь, инфекционный бронхит, перепелиный бронхит, лимфоидный лейкоз, болезнь Марека, инфекционное бурсальное заболевание, инфекционный ларинготрахеит, синдром падения яйценоскости, реовироз, инфекционный тендосиновиит, птичий энцефаломиелит, птичий ринотрахеит или птичий грипп, из бактерий, ответственных за микоплазмоз, пастереллез, сальмонеллез, бордетеллез и т.д., и/или из других птичьих паразитов, ответственных за кокцидиоз, кампилобактериоз. Предпочтительная вакцина, применяемая в вакцинной композиции по настоящему изобретению, содержит цельный ослабленный живой вирусный штамм.
Предпочтительно, вакцина получена из вируса ньюкастлской болезни (NDV) или из вируса, ответственного за болезнь Марека, т.е. вируса болезни Марека (MDV) или герпесвируса индюков (HVT). Могут также использоваться рекомбинантный HVT (rHVT) и рекомбинантный MDV (rMDV). Эти рекомбинантные вирусы были генетически модифицированы включением в геном вируса последовательности, по меньшей мере, одной гетерологичной нуклеиновой кислоты, т.е. ДНК, которая соответствует гену или его части, не идентичной последовательности нуклеиновой кислоты гена, естественно присутствующего в HVT или MDV. Альтернативно, rHVT или rMDV могут быть генетически модифицированы включением в геном вируса последовательности гомологичной нуклеиновой кислоты, т.е. ДНК, которая соответствует гену или его части, идентичной гену, естественно присутствующему в HVT или MDV.
Хитозан представляет собой производное хитина и соответствует линейному полисахариду, составленному из беспорядочно распределенных β-(1-4)-связанного D-глюкозамина (деацилированной единицы) N-ацетил-D-глюкозамина (ацилированной единицы). Хитозан выпускается промышленностью деацетилированием хитина, который представляет собой структурный элемент в наружном скелете ракообразных. Степень деацетилирования может определяться ЯМР спектроскопией. Например, степень деацетилирования выпускаемого промышленностью хитозана находится в диапазоне 60-100%.
Хитозан, используемый в вакцинных композициях по настоящему изобретению, может быть получен из хитина деацетилированием до степени более чем 40%, предпочтительно, деацетилированием от 50% до 90%, а предпочтительнее, от 70% до 95%. Такие деацетилированные хитозаны выпускаются промышленностью под торговым названием «Sea Cure+» («морское средство», хитозан глутамат, выпускаемый компанией Protan Biopolymer A/S, Drammen, Norway). Молекулярная масса хитозана может составлять от 10 кД и 500 кД, предпочтительно, от 50 кД до 300 кД, а предпочтительнее, от 100 кД до 300 кД.
В соответствии с настоящим изобретением, хитозан может использоваться в качестве эффективного адъюванта в форме монокарбоксиметилированного хитозана (MMC), также обозначаемого карбоксиметил хитозаном (CMC), или в форме гидроксихлорида хитозана (HCl хитозана). HCl хиттозан хорошо известен в данной области и выпускается, например, компанией Kraeber Gmbh & Co.
Например, концентрации HCl хитозана, используемые в вакцинных композициях, могут находиться в диапазоне от 0,1% до 5%, а предпочтительно, примерно 0,5% или примерно 1%.
Вакцинные композиции в соответствии с изобретением могут применяться при эффективной иммунизации видов птиц против инфекционных заболеваний птиц. В сущности, как указано выше, было обнаружено, что после глазного введения, эти вакцинные композиции существенно усиливают клеточно-опосредованный иммунный ответ у птиц, а также персистенцию вакцины в многочисленных тканях птиц; персистенция вакцины в тканях птиц наблюдалась через одну неделю после вакцинации, в тканях птиц, включающих легкие, селезенку, трахею, пищеварительный тракт, такие как 12-перстная кишка, поджелудочная железа и миндалины слепой кишки. Кроме того, такая персистенция сохранялась через 5 недель после вакцинации, в частности, в конъюнктиве, легких, 12-перстной кишке, поджелудочной железе и миндалинах слепой кишки.
Виды птиц, которым вакцинные композиции по настоящему изобретению можно вводить глазным путем, включают, например, кур, индюков, гусей, уток, фазанов, перепелов или голубей, а в более общем аспекте, разводимых или домашних сельскохозяйственных или декоративных птиц.
В соответствии с еще одним аспектом изобретение относится к применению вакцинных композиций, как определено в настоящем описании, в способе вакцинации птиц против птичьих инфекций, причем способ включает глазное введение птице вакцины, содержащей вакцину вместе с эффективным адъювантным количеством хитозана.
В соответствии с изобретением эффективное количество хитозана и вакцина могут вводиться отдельно или одновременно в виде глазных капель, спреев или аэрозолей. Альтернативно, хитозан и вакцина вводятся видам птиц последовательно, причем хитозан вводится перед вакциной или вслед за вакциной.
Настоящее изобретение также относится к применению эффективного количества хитозана и вакцины для получения вакцинной композиции для увеличения у птиц иммунного ответа против птичьего патогенна, где хитозан и вакцина вводятся птицам в виде глазных капель, спреев или аэрозолей, и где у птиц увеличивается клеточно-опосредованный ответ и персистенция патогена внутри птичьих тканей. Как указано выше, вакцина может представлять собой птичий паразит, вирус или бактерию. Точнее, вакцина может представлять собой живой, ослабленный микроорганизм, убитый, инактивированный микроорганизм, или цельный ослабленный, или инактивированный микроорганизм, его субъединицы, или их комбинацию. Также, в соответствии с настоящим изобретением, хитозан и вакцина могут вводиться отдельно или одновременно видам птиц. Когда хитозан и патоген вводятся последовательно, хитозан может затем вводиться перед вакциной или вслед за вакциной.
Кроме того, в соответствии с еще одним аспектом, изобретение относится к применению вакцинной композиции, определенной в настоящем описании, в способе введения клеточно-опосредованного иммунного ответа и персистенции вакцины в тканях птиц путем глазного введения видам птиц вакцинной композиции, содержащей вакцину и эффективное адъювантное количество хитозана, как определено выше в настоящем описании.
Настоящее изобретение, кроме того, относится к способу иммунизации видов птиц, включающему стадию введения в глаза видов птиц вакцинной композиции, как описано выше. Настоящее изобретение также относится к способу увеличения клеточно-опосредованного иммунитета у видов птиц и персистенции вакцины внутри тканей птиц путем введения одной или более вакцин в комбинации с эффективным количеством хитозана в глаза видов птиц. Вакцина и хитозан могут вводиться отдельно, последовательно или одновременно.
Также в соответствии со способом по стоящему изобретению, введение в глаза может выполняться посредством распыления, аэрозоля или глазных капель. Предпочтительно, такое глазное введение выполняется после снижения реактивности антитела материнского происхождения.
Наиболее предпочтительно, ревакцинация далее проводится для стимуляции иммунного ответа у птиц, которые уже подвергались вакцинации in ovo или в возрасте нескольких дней, посредством этого, вызывая более высокую стимуляцию иммунного ответа. Такая ревакцинация может проводиться в возрасте от 1 до 4 дней или последовательно или одновременно с первой иммунизацией.
Глазные вакцинные композиции в соответствии с изобретением могут составляться в виде жидкостей или сухих порошков для введения в виде аэрозолей, спреев или глазных капель. Таким образом, вакцинные композиции могут вводиться птицам распылением непосредственно на головы птиц. Альтернативно, одна или более капель вакцины может вноситься прямо в глаза каждой отдельной птицы, как у людей. Предпочтительные композиции в соответствии с изобретением составлены в виде глазных капель в форме жидкостей.
Композиции для введения в виде аэрозолей, глазных капель или спреев могут содержать один или более эксципиентов того типа, которые обычно включаются в такие композиции, например, консерванты, агенты, регулирующие вязкость, агенты, регулирующие тоничность, забуферивающие агенты, стабилизаторы, носители, адъюванты и тому подобные вещества, для получения вводимых в глаза препаратов. Для обеспечения того, чтобы хитозан оставался растворимым в водной среде, а также для обеспечения того, чтобы антиген не подвергался неблагоприятному воздействию слишком кислого pH, раствор для введения в глаза предпочтительно имеет pH в диапазоне от 5,5 до 6,5. Носители могут представлять собой любые из ряда водных буферов, хорошо известных специалистам в данной области, такие как, например, фосфатные буферы. Могут использоваться дополнительные адъюванты. Они хорошо известны в данной области и могут включать масляные эмульсии, соли или гели алюминия, такие как гидроксид алюминия или фосфат алюминия, сапонины, витамины, экстракты из бактериальной стенки, полимеры на основе полиакриловой кислоты, такие как карбополы, не ионные блок полимеры, амины жирных кислот, такие как авидин и DDA (дихлордифенилуксусная кислота), полимеры на основе декстрана, такие как декстран сульфат и DEAEдекстран (диэтиламиноэтилдекстран), биологически разлагаемые микрокапсулы, липосомы, вирусные иммунные стимуляторы, такие как MDP (мурамил дипептид), LPS (липополисахарид) и глюканы.
Настоящее изобретение также относится к продукту или набору для вакцинации птиц, содержащему средство для подачи глазных вакцинных композиций, содержащих вакцину и эффективное количество хитозана. Точнее, набора для вакцинации птиц содержит устройство подачи, адаптированное для подачи вакцинной композиции непосредственно в глаза птиц. Такое устройство подачи может, например, принимать форму устройства подачи аэрозоля, спрея или глазных капель, и может быть сконструировано для подачи только одной дозы или множества доз в глаза птиц. Набор для вакцинации птиц может содержать отдельные контейнеры, соответственно содержащие эффективное количество хитозана и вакцины. Набор для вакцинации птиц в соответствии с настоящим изобретением может, кроме того содержать технические инструкции с информацией по введению и дозировке фармацевтической композиции.
Вакцина может вводиться в количестве, эффективном для стимуляции клеточно-опосредованного иммунного ответа, и для увеличения персистенции вакцины, такой как, например, вакцинный вирусный штамм, у видов птиц. Например, вакцина может вводиться птицам в одной или более дозах, причем каждая доза содержит, например, от 105 до 108 EID50.
Современные живые вакцины обычно ограничены вследствие присутствия у вновь вылупившихся птиц некоторой защиты против патогенов, обеспеченной передачей антитела материнского происхождения (MDA), передаваемого через яичный желток, и в последующем подвергаемого резорбции и присутствует в сыворотке кур. Поэтому указанные MDA могут мешать вакцинации путем нейтрализации живых вакцин. Как следствие, иммунный ответ на вакцинацию может задерживаться и/или ограничиваться у обычных кур, как ранее наблюдалось на системном уровне.
Таким образом, вакцины в соответствии с настоящим изобретением предпочтительно вводятся после снижения реактивности MDA, посредством этого, обеспечивая возможность индукции хорошей иммунологической реакции перед вероятностью воздействия на птиц вирулентного штамма NDV. Наиболее предпочтительно, ревакцинация проводится в возрасте 2 или 3 недель, в соответствии со снижением MDA.
Как детальнее показано ниже в примерах, эксперименты по вакцинации проводились на четырех группах SPF (лишенных специфического патогена) или обычных однодневных цыплят кур-несушек (фиг. 1). Вакцинные композиции вводили всем группам цыплят глазным путем с использованием глазных капель. Группа, обозначенная как «Отрицательные цыплята», не получала никакой вакцины. Вторую и третью группы вакцинировали одной дозой CEVAC® UNI L или одной дозой CEVAC® VITAPEST L, которые обе соответствуют ослабленному вирусу ньюкастлской болезни. Хитозан также использовали в качестве адъюванта. Только цыплят из отрицательной группы и группы CEVAC® VITAPEST L вакцинировали с адъювантом или без него для подтверждения удивительного эффекта хитозана и на клеточно-опосредованный иммунитет, и на персистенцию вакцинного вируса в тканях птиц. Образцы брали каждую неделю с первой по пятую неделю. Проводили оценку и подтверждение местного иммунитета (BALT) (лимфоидной ткани, ассоциированной с бронхами).
В частности, заявитель продемонстрировал, что активация «воскресшим» антигеном особенно эффективна. В сущности, спленоциты вакцинированных цыплят собирали через 2-5 недель после вакцинации (p.v.) и вводили в контакт с белком вируса ньюкастлской болезни для оценки уровня продукции γ-интерферона (ChlFNγ). Измерение уровня γ-интерферона выполняется по оптической плотности (O.D.) с использованием набора для ELISA. Уровень продукции ChlFNγ указывает на уровень стимуляции спленоцитов у вакцинированных птиц, посредством этого указывая уровни клеточно-опосредованного иммунитета (фиг. 2).
Кроме того, в примере 3 ниже было продемонстрировано, что глазная вакцинация птиц в соответствии с настоящим изобретением, к удивлению, оказывала выраженные эффекты на клеточно-опосредованный иммунитет. Без каких-либо ограничений, положительный эффект хитозана на специфический клеточно-опосредованный иммунитет был, например, доказан против вируса ньюкастлской болезни, после глазного введения. На фиг. 3 показаны результаты определения продукции ChlFNγ в группе CEVAC® VITAPEST L и в группе CEVAC® VITAPEST L с хитозаном. Было показано, что у группы CEVAC® VITAPEST L с хитозаном был более высокий клеточно-опосредованный иммунитет, чем у группы CEVAC® VITAPEST L от второй до пятой недели после вакцинации цыплят SPF. Это различием было статистически значимым через 2 недели.
Кроме того, было продемонстрировано, что глазное введение вакцины с хитозаном в качестве адъюванта вызывало более длительную персистенцию вакцинного вирусного штамма в тканях цыплят, как у цыплят SPF, так и у цыплят обычных кур-несушек (фиг. 4). Как показано ниже в примере 2, присутствие вируса ньюкастлской болезни после глазной вакцинации цыплят SPF оценивали экспериментами PCR (полимеразной цепной реакции) в реальном масштабе времени на различных органах, т.е. конъюнктиве, легких, трахее, 12-перстной кишке, поджелудочной железе, миндалинах слепой кишки и селезенке, взятых через 1 и 5 недель после глазной вакцинации цыплят.
Репликацию вируса вакцинного штамма оценивали в указанных различных органах сначала у цыплят SPF. В первую неделю после вакцинации цыплят SPF, наблюдался одинаковый уровень вирусной репликации вируса вакцины CEVAC® UNI L и вируса вакцины CEVAC® VITAPEST L в конъюнктиве, легких и селезенке. Вирус вакцины CEVAC® UNI L реплицировался по существу в трахее при статистически значимом отличием от CEVAC® VITAPEST L. Вирус вакцины CEVAC® VITAPEST L реплицировался по существу в пищеварительном тракте, например, в 12-перстной кишке, поджелудочной железе и миндалинах слепой кишки при статистически значимом отличием от CEVAC® UNI L. На 5-ю неделю после глазной вакцинации цыплят, оба вакцинных вирусных штаммов реплицировались в конъюнктиве, но только одна курица была положительной в группе CEVAC® UNI L. Вирус вакцины CEVAC® VITAPEST L, но не вакцины CEVAC® UNI L, также реплицировался в других органах.
Аналогичным образом, заявитель доказал персистенцию вакцинного вирусного штамма у цыплят обычных кур-несушек. В частности, было показано, что уровень репликации выше у группы CEVAC® UNI L в первую неделю после глазной вакцинации цыплят. При использовании хитозана в качестве адъюванта, вирус выделяется в большем числе органов и в течение более длительного периода времени. На 5-ой неделе после глазной вакцинации цыплят, штаммы вакцинных вирусов выделяются только в конъюнктиве некоторых вакцинированных цыплят обычных кур-несушек (фиг. 5).
Наконец, заявитель продемонстрировал в описанном ниже примере 4, что гуморальный иммунитет, вызванный различными вакцинами у сельскохозяйственных птиц, не усиливался, в отличие от того, что обычно наблюдается у млекопитающих, посредством этого показывая специфический отличительный эффект вакцинной композиции с хитозаном при введении птицам глазным путем.
Изобретение иллюстрируется, но никоим образом не ограничивается, следующими примерами.
ПРИМЕРЫ
Пример 1: Материалы и методы
Пример 1.1: Цыплята
Цыплята белых легорнских кур и обычных кур-несушек SPF (SSL: сцепленные с полом при продаже) вылуплялись из яиц, поставляемых соответственно инкубаторами Lohmann VaIo (Cuxhaven, Germany) и Wijverkens hatchery (Halle, Belgium). Яйца обычных несушек получали у стаи 28-недельных производителей, которые получали следующую схему вакцинации против ND: вакцинация на 4-ой и 8-ой неделе возраста NOBILIS Clone 30 (Intervet) с последующей ревакцинацией на 18-ой неделе возраста NOBILIS Newcavac (инактивированной вакциной, Intervet). После вылупления цыплят, всех птиц содержали в изоляторах третьего уровня биологической безопасности (BSL-3), и эксперименты на животных проводили по одобрению и под наблюдением Комитетов по Биологической безопасности и Биоэтике в Институте ветеринарных и агрохимических исследований в соответствии с национальными и европейскими нормативами.
Пример 1.2: Вакцина, адъювант и штамм антигенной стимуляции
Ослабленная вакцина CEVAC®VITAPEST L и адъювант хитозан (хитозан гидрохлорид) поставлялись компанией CEVA-PHYLAXIA Veterinary Biologicals Co Ltd (Hungary). Вакцина основана на не вызывающем симптомы заболевания штамме PHY.LMV.42 (Meszaros J. Aerosol-vaccination against Newcastle disease. Deut Tierarztl Woch 1991; 98:1 17-164; Meszaros J, Szemeredi M, Tamasi G. Immunization of day-old chickens against Newcastle disease. Acta Vet Hung 1992; 40:121-127), belonging to genotype I (Czegledi A, Ujvari D, Somogyi E, Wehmann E, Werner O, Lomniczi B. Third genome size category of avian paramyxovirus serotype 1 (Newcastle disease virus) and evolutionary implications. Virus Res 2006; 120:36-48). Влагосодержание в партии вакцины восстанавливали растворением в солевом растворе с фосфатным буфером (буфер PBS) для получения 1 дозы в 50 мкл, которая соответствует ~106 EID50/дозу. Хитозан гидрохлорид представляет сой хлорид неразветвленного бинарного гетерополисахарида, состоящего из двух единиц N-ацетил-D-глюкозамина и D-глюкозамина. Он был получен частичным деацетилированием хитина, обычно приводящим к степени деацетилирования от 70% до 95%. Хитозан растворяли в буфере PBS в конечной концентрации 0,5% (масс./об.) и использовали для восстановления влагосодержания и разведения вакцины до конечной концентрации. Штамм Chimalhuacan NDV, использованный для антигеннной стимуляции, был выделен в Мексике (Calderon NL, Galindo-Muniz F, Ortiz M, Lomniczi B, Fehervari T, Paasch LH. Thrombocytopenia in Newcastle Disease: haematological evaluation and histological study of bone marrow. Acta Vet Hung 2005; 53(4):507-513). И он относится к Классу II генотипа V. Это велогенный висцеротропный штамм с ICPI (показателем внутримозговой патогенности) 1,89. Окулоназальное и непосредственное глазное заражение 105 EID50 данного штамма вызывает 100% смертность в пределах 3-6 дней у бройлерных цыплят SPF и получаемых в промышленном масштабе бройлерных цыплят с переданным от матери иммунитетом, подвергнутых антигенной стимуляции. В пределах 3-6-недельного возраста (личные наблюдения).
Пример 1.3: Митогены и антигены NDV
Митогены форбол 12-миристат 13-ацетат (PMA) и иономицин (Iono) закупали у компании Sigma (Belgium). «Воскресшие» антигены NDV получали из штамма NDV La Sota, как описано ранее (Lambrecht B, Gonze M, Meulemans G, van den Berg T. Assessment of the cell-mediated immune response in chickens by detection of chicken interferon-gamma in response to mitogen and recall Newcastle disease viral antigen stimulation. Avian Path 2004; 33:343-350), и называли гликопротеинами NDV (gp-NDV).
Пример 1.4: Измерение распределения и репликации вакцинного штамма в тканях
Образцы ткани брали из конъюнктивы нижнего века, которая, как было показано, более восприимчива к NDV (Nakamura K, Ohta Y, Abe Y, lmai K, Yamada M. Pathogenesis of conjunctivitis caused by Newcastle disease viruses in specific-pathogen-free chickens. Avian Path 2004; 33(3):371 -376), трахеи, легких, селезенки, поджелудочной железы, 12-перстной кишки и миндалин слепой кишки и держали в замороженном состоянии до переработки. Распределение и репликацию в тканях штамма вакцины CEVAC® VITAPEST L определяли QRRT-PCR (количественным определением обратной транскриптазы-полимеразной цепной реакцией в реальном масштабе времени), специфическим для CEVAC® VITAPEST L, которая обеспечивает возможность выявления 102 EID50 на реакцию (104,18 EID50 на 20 мг ткани). Результаты были выражены в виде титра штаммов вакцины на 20 мг ткани. Количество образца и процедура экстракции РНК обосновывались с использованием птичьего α-актина в качестве гена «домашнего хозяйства, как описано в публикации Van Borm S et al., A universal avian endogenous real-time reverse transcriptase-polymerase chain reaction control and its application to avian influenza diagnosis and quantification. Avian Dis 2007; 51:213-220.
Пример 1.5: Измерение иммунокомпетентности и специфичного для NDV клеточно-опосредованного иммунитета
Иммунокомпетентность и специфичный для NDV клеточно-опосредованный иммунитет исследовали соответственно митогенной и активацией антигенов NDV селезеночных лимфоцитов. Вкратце, селезенки в асептических условиях удаляли у цыплят, и спленоциты выделяли и активировали митогенами (0,1 мкг/мл PMA/Iono), в качестве положительного контроля возможности активации спленоцитов ex vivo, или «воскресшими антигенами» NDV (gp-NDV) (1 мкг/мл). Клеточные реакции выражали в виде величин оптической плотности (O.D.), и O.D., равную или большую чем 0,1, считали доказательством значимой активации.
Пример 1.6: Измерение специфического для NDV гуморального и местного опосредованного антителами иммунитета
Специфический для NDV гуморальный иммунитет оценивали тестом ингибирования гемагглютинации и ELISA IgG, IgA и IgM, специфических для NDV. Местный опосредованный антителами иммунитет к NDV измеряли в слезной жидкости, желчи и 12-перстной кишке с использованием ELISA.
Пример 1.7: Измерение экскреции используемого для антигенной стимуляции штамма NDV в ротоглотке и клоаке
После взятия мазков из ротоглотки и клоаки, хлопковые тампоны погружали в 1 мл буфера, используемого для взятия проб при Инфузии в мозг и сердце (37 г, растворенные в 1 литре дистиллированной воды) (Becton Dickinson Benelux, Belgium) с добавками антибиотиков (10000 МЕ/мл пенициллина, 2 мг/ил стрептомицина, 1 мг/мл гентамицина и 650 мкг/мл канамицина). Тампоны хранили при -80°C до дальнейшего анализа. Для анализа количественным определением обратной транскриптазы-полимеразной цепной реакцией в реальном масштабе времени (QRRT-PCR), РНК экстрагировали из 50 мкл жидкости, в которую были погружены тампоны с мазками, с использованием набора для экстракции вирусной РНК MagMAX 96 AI/ND viral RNA Ambion kit (Applied Biosystems, Lennik, Belgium) на процессоре магнитных частиц KingFisher (Thermo Scientific), в соответствии с протоколом изготовителя. Очищенную РНК элюировали в 50 мкл элюционного буфера.
Матричные копии гена штамма антигенной стимуляции Chimalhuacan NDV определяли количественным определением обратной транскриптазы-полимеразной цепной реакцией в реальном масштабе времени (QRRT-PCR), как описано выше, с небольшими модификациями. Вкратце, после первоначальной стадии обратной транскрипции и стадии активации hot start Taq-полимеразы, 50 циклов (95°C в течение 15 сек, 54°C в течение 34 сек, 72°C в течение 10 сек) выполняли на циклизаторе PCR в реальном масштабе времени Applied Biosystems 7500. Праймеры (M+4100 и M-4220) и зонды MGB-Taqman (M+4169FAM-TAMRA) работали на матричном гене и были синтезированы Eurogentec (Liege, Belgium). Вирусный титр каждого образца определяли относительно стандартной кривой, состоящей из общей вирусной РНК штамма Chimalhuacan NDV. Данная стандартная кривая была включена в каждый цикл. Порог чувствительности NDV QRRT-PCR, специфической для штамма Chimalhuacan NDV (R2=0,998, Эффективность=94,17%), определяли при 101 EID50 на реакцию, на основании результатов стандартной кривой. Это означает, что реакции QRRT-PCR полностью совместимы выше 102,7 EID50 на мл жидкости, в которую погружали тампоны с мазками, и возможны количественные сравнения. Результаты были выражены в виде титра штамма антигенной стимуляции на мл жидкости, в которую погружали тампоны с мазками.
Кроме того, качество образца и процедура экстракции РНК обосновывались с использованием птичьего α-актина, как описано в публикации Van Borm S et al. A universal avian endogenous real-time reverse transcriptase-polymerase chain reaction control and its application to avian influenza diagnosis and quantification. Avian Dis 2007;51:213-220.
Пример 1.8: Структура эксперимента
Два одинаковых эксперимента проводили у цыплят SPF (эксперименты I и II). В однодневном возрасте, 105 цыплят SPF делил на три группы по 35 цыплят в изоляторы BSL-3. В тот же день две группы вакцинировали окулоназальным путем одной дозой вакцины CEVAC® VITAPEST L соответственно с адъювантом в виде 0,5% хитозана или без него. Аналогичные эксперименты проводили непосредственным глазным введением (данные не показаны). Третья группа оставалась не вакцинированной и служила в качестве группы отрицательного контроля. Через 2 дня после вакцинации (p.v.), цыплят гуманно умерщвляли для взятия крови, желчи и 12-перстной кишки. С 1 по 5 неделю p.v., через недельные интервалы собирали слезную жидкость, и у тех же животных брали образцы крови, желчи и 12-перстной кишки. На 1-ой и 5-ой неделе в одном из экспериментов дополнительно брали конъюнктиву, трахею, легкие, поджелудочную железу и миндалины слепой кишки. На 3-ей и 5-ой неделях, промывные жидкости легких брали у дополнительных цыплят из каждой группы после эвтаназии инъекцией нембутала (CEVA Sante Animale). Пять птиц на группу использовали в каждую точку времени. В эксперименте II, образцы слезной жидкости, крови, селезенки, желчи и 12-перстной кишки брали на 2, 3, 4 и 5 неделе p.v.
Еще два эксперимента также проводили у цыплят обычных кур-несушек (эксперименты III и IV). В однодневном возрасте, 90 цыплят обычных кур-несушек распределяли по 3 группам по 30 цыплят каждая в изоляторах BSL-3. В тот же день, две группы вакцинировали как описано ранее; третья группа оставалась не вакцинированной и служила в качестве группы отрицательного контроля. Структура эксперимента III была аналогична эксперименту I, за исключением того, что промывную легочную жидкость собирали только на 5-ой неделе p.v. В эксперименте IV, образцы слезной жидкости, крови, селезенки, желчи и 12-перстной кишки брали на 2, 3, 4 и 5 неделях p.v. В 5-недельном возрасте, у 10 цыплят из каждой группы проводили антигенную стимуляцию 105 EID50/200 мкл штамма Chimalhuacan NDV окулоназальным путем. Птицы были субъектуально идентифицированы. После антигенной стимуляции осуществляли ежедневный мониторинг цыплят для выявления симптомов (отека головы, депрессии, прострации и неврологических признаков) и смертности. Мазки ротоглотки и клоаки брали на 2, 4, 7 и 10 дни после антигенной стимуляции (p.ch.). На 11 дни p.ch., выживших цыплят подвергали эвтаназии и брали образцы крови. Селезенку и 12-перстную кишку брали у 5 цыплят на группу.
Пример 1.9: Статистический анализ
Статистические анализы выполняли, как описано ранее, используя программное обеспечение Minitab 13 и STATA 10 (статистические программы для Windows 2000), и различия считались значимыми при P<0,05.
Пример 2: Тканевое распределение и репликация вакцинного штамма
Во всех органах проявлялся положительный сигнал амплификации (Ct<40) для эндогенного контроля амплификации α-актина, обосновывающего их адекватное качество и чистоту.
Вирус CEVAC® VITAPEST L был выявлен во всех образцах органов вакцинированных цыплят SPF на 1-ой неделе p.v. (таблица 1). Через 5 недель p.v., вакцинный штамм был выявлен только в конъюнктиве, легких, селезенке, 12-перстной кишке, поджелудочной железе и миндалинах слепой кишки некоторых цыплят. При использовании хитозана, вакцинный штамм выявлялся чаще, однако между тирами вирусов не было статистического различия. Через одну неделю после вакцинации однодневных цыплят обычных кур-несушек, вакцинные штаммы CEVAC® VITAPEST L присутствовали в нескольких образцах конъюнктивы, трахеи и 12-перстной кишки (таблица 1). При добавлении к вакцине хитозана в качестве адъюванта, он также выявлялся в некоторых образцах легких, селезенки и миндалин слепой кишки. Тем не менее, у вакцинированных обычных несушек, частоты выявления и титры были ниже, чем те, которые обнаруживались у вакцинированных цыплят SPF. Через 5 недель p.v., репликацию вакцинного вируса могла еще выявляться в конъюнктиве.
Выявление вакцинного вируса после вакцинации однодневных цыплят SPF и обычных кур-несушек вакциной CEVAC®VITAPEST L с адъювантом хитозаном или без него (соответственно эксперимент (experiment I и III)
Хитозан
(SPF)
bДанные представляют частоту (число положительных/общее число тестированных) выявления вируса в 20 мг ткани,
cДанные представляют среднюю величину ± стандартное отклонение log10 EID50 NDV в 20 мг ткани положительных цыплят.
Пример 3: Иммунокомпетентность и антигенспецифический клеточно-опосредованный иммунитет
Результаты, полученные в различные точки времени взятия проб по активации спленоцитов митогенами PMA/Iono, показали, что цыплята кур SPF и цыплята обычных кур-несушек в каждой группе были одинаково иммунокомпетентными в каждом из четырех экспериментов (O.D.>0,1), подтверждая возможность активации клеток селезенки. Действительно, хитозан не воздействовал на клеточный иммунный ответ, о чем свидетельствует отсутствие какого-либо значимого различия между двумя вакцинированными группами в экспериментах I (фиг. 6A) и IV (фиг. 6B) на цыплятах SPF и обычных кур-несушек, соответственно. Данная неизмененная иммунокомпетентность, при совместном введении живой вакцины против ND с хитозаном, была подтверждена в экспериментах II и III (данные не показаны).
У цыплят SPF (эксперимент I), штамм CEVAC® VITAPEST L был способен вызвать определяемую активацию специфического в отношении NDV клеточно-опосредованного иммунитета в пределах 1-ой недели p.v., и вакцинированная группа значимо отличалась (P<0,05) от не вакцинированной контрольной группы со 2-ой недели и далее (фиг. 6A). При добавлении хитозана, окулоназальная иммунизация вакциной CEVAC® VITAPEST L генерировала значимо более высокий антиген-специфический клеточный иммунный ответ с 1-ой по 4-ую неделю p.v. (P<0,05), что демонстрируется увеличенной продукцией ChlFNγ спленоцитами. Положительный эффект хитозана на специфический клеточно-опосредованный иммунитет у цыплят SPF был подтвержден в эксперименте II (данные не показаны).
У цыплят обычных кур-несушек (эксперимент IV), клеточно-опосредованный иммунитет, специфический в отношении NDV, наблюдался в обеих вакцинированных группах с 3-ей недели p.v. (P<0,05) (фиг. 6B). Этот NDV-специфический иммунный ответ выше, хотя и не значительно, при совместном введении хитозана с живой вакциной против ND, по сравнению с отдельно инокулированной вакциной CEVAC® VITAPEST L. Такой же результат был получен в эксперименте III (данные не показаны).
Пример 4: Гуморальный и местный опосредованный антителом иммунитет
Индукция гуморального иммунитета у вакцинированных цыплят SPF регистрировался с 1-ой недели p.v. специфическим ELISA IgM, но только со 2-ой недели p.v. тестом ингибирования гемагглютинации, а также ELISA, специфическим для IgG и IgA, с титрами, статистически отличающимися от не вакцинированных цыплят. Профиль титров специфических для NDV HI и IgG антител, полученный у цыплят обычных кур-несушек, соответствует снижению пассивного, полученного от матери иммунитета до возраста четырех недель и прогрессирующему активному вызванному вакциной первичного иммунного ответа, выявляемого с 5-ой недели p.v. (таблица 2). Ни NDV-специфический IgA, ни IgM могли быть выявлены в сыворотке обычных животных (данные не показаны). Хитозан не проявил адъювантного эффекта на гуморальный иммунный ответ ни у цыплят SPF, ни у цыплят обычных кур-несушек, как демонстрируется отсутствием каких-либо статистически значимых различий титров между двумя вакцинированными группами.
Гуморальный иммунитет после вакцинации однодневных цыплят SPF и цыплят обычных кур-несушек вакциной CEVAC® VITAPEST L с адъювантом хитозаном или без него
(соответственно эксперименты I и III)
Хитозан
Воздействие хитозана на опосредованный антителами слезной жидкости иммунитет цыплят SPF (фиг. 7A) и цыплят обычных кур-несушек (фиг. 7B) было высоко вариабельным, и различия между цыплятами, вакцинированными CEVAC® VITAPEST L с хитозаном или без (w/o) него не были статистически значимыми в каждую точку времени. Аналогичное изменение воздействий адъюванта хитозана было отмечено для связанного с легкими, опосредованного желчными и дуоденальными антителами иммунитета цыплят SPF (таблица 3, соответственно фиг. 8A и 8A). У цыплят обычных кур-несушек, специфическое для NDV IgG антитело материнского происхождения было выявлено на 1-ой неделе в желчи (фиг. 9B) и с 1-ой по 5-ую неделю возраста в 12-перстной кишке (фиг. 9B). В 5-ю неделю p.v., ответ дуоденального IgG был значительно выше у вакцинированных групп. Указывая на прогрессирующий активный вызванный вакциной первичный иммунный ответ в пищеварительном тракте. Совместное введение хитозана с вакциной против ND не оказывало значимого эффекта на иммунитет, опосредованный дуоденальными антителами.
Иммунитет, опосредованные легочными антителами, после вакцинации однодневных цыплят SPF вакциной CEVAC® VITAPEST L с адъювантом хитозаном или без него (эксперимент I).
Хитозан
Данные представляют среднюю величину ± стандартное отклонение величин спектральной поглотительной способности, определенных ELISA, в определенное время p.v. (n=5). Образцы легочной промывочной жидкости не были разведены соответственно по IgA/G и IgM. Средняя величина ± стандартное отклонение в точки времени без обычных надстрочных обозначений статистически отличаются (P<0,05).
Неизменная системная и местная реакция антител на живую вакцину против ND, введенную совместно с хитозаном была подтверждена и у цыплят SPF, и у цыплят обычных кур-несушек в повторных экспериментах II и IV (данные не показаны).
Пример 5: Защиты и повторная экскреция после антигенной стимуляции
У всех подвергнутых антигенной стимуляцией цыплят в не вакцинированной группе проявлялись клинические признаки, которые начинались в 3-й день после антигенной стимуляции (d.p.ch.), и цыплята погибали через 4-6 d.p.ch. Двое животных из группы, вакцинированной CEVAC® VITAPEST L, проявлялись клинические признаки, и один цыпленок погиб в 7-ой d.p.ch. У цыплят, вакцинированных CEVAC® VITAPEST L., совместно вводимой с хитозаном, во время эксперимента не было выявлено ни случаев заболевания, ни случаев смерти.
Выброс вируса антигенной стимуляции начинался во 2 d.p.ch. в контрольной группе, и все мазки из ротоглотки и клоаки дали положительный результат в 4 d.p.ch. (таблица 4). В каждую точку времени, выброс вируса через носоглотку и клоаку снижался вакцинацией. Кроме того, число экскретирующих птиц в группе, получающей живую вакцину против ND, вводимую совместно с хитозаном, было снижено, по сравнению с группой, получающей одну вакцину. Экскреция почти закончилась в 7-ой d.p.ch. и полностью прекратилась в 10-й d.p.ch.
Выброс штамма Chimalhuacan NDV после антигенной стимуляции вакцинированных цыплят обычных кур-несушек вакциной CEVAC®VITAPEST L с адъювантом хитозаном или без него (эксперимент IV).
Хитозан
N.D.=не определялось ввиду специфической смертности.
bДанные представляют частоту (число положительных результатов/общее число тестированных) выявления вируса в 1 мл жидкости смыва тампонов с мазками.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОГО БРОНХИТА | 2021 |
|
RU2838435C2 |
| ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОГО БРОНХИТА | 2017 |
|
RU2781143C2 |
| ИНАКТИВИРОВАННАЯ ВАКЦИНА ДЛЯ ПТИЦЫ | 2010 |
|
RU2545530C2 |
| РЕКОМБИНАНТНЫЕ ВИРУСЫ БОЛЕЗНИ МАРЕКА И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2681889C2 |
| ШТАММ ПТИЧЬЕГО РЕОВИРУСА, ВАКЦИНА, СОДЕРЖАЩАЯ УКАЗАННЫЙ РЕОВИРУС, СПОСОБ ПОЛУЧЕНИЯ ПТИЧЬИХ РЕОВИРУСОВ, СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ И СПОСОБ БОРЬБЫ С ПАТОЛОГИЯМИ ПТИЦЫ, ВЫЗЫВАЕМЫМИ ПТИЧЬИМИ РЕОВИРУСАМИ | 2000 |
|
RU2265659C2 |
| МУЛЬТИВАЛЕНТНЫЕ РЕКОМБИНАНТНЫЕ ВИРУСЫ ПТИЧЬЕГО ГЕРПЕСА И ВАКЦИНЫ ДЛЯ ИММУНИЗАЦИИ ПТИЦ | 2013 |
|
RU2766003C2 |
| ВАКЦИНА ШИРОКОГО СПЕКТРА ДЕЙСТВИЯ ПРОТИВ РЕОВИРУСА ПТИЦ | 2015 |
|
RU2701808C2 |
| РЕКОМБИНАНТНЫЕ HVT-ВЕКТОРЫ, ЭКСПРЕССИРУЮЩИЕ МНОЖЕСТВЕННЫЕ АНТИГЕНЫ ПАТОГЕНОВ ПТИЦ, И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2017 |
|
RU2752836C2 |
| ВЫЗЫВАЮЩИЕ ПЕРЕКРЕСТНЫЙ ИММУНИТЕТ ВАКЦИНЫ ПРОТИВ САЛЬМОНЕЛЛЫ | 2013 |
|
RU2679039C2 |
| МУЛЬТИВАЛЕНТНЫЕ РЕКОМБИНАНТНЫЕ ВИРУСЫ ПТИЧЬЕГО ГЕРПЕСА И ВАКЦИНЫ ДЛЯ ИММУНИЗАЦИИ ПТИЦ | 2013 |
|
RU2658439C2 |
Группа изобретений относится к области ветеринарии и предназначена для вакцинации птиц путем глазного введения. Заявленная композиция содержит один или более живых ослабленных вирусов и хитозан. Заявлено применение хитозана и одного или более живых ослабленных вирусов для изготовления композиции для иммунизации или вакцинации видов птиц посредством глазного введения. Заявлено также применение хитозана и одного или более живых ослабленных вирусов для изготовления вакцинной композиции для усиления клеточно-опосредованного иммунного ответа у птиц, для раздельного или одновременного глазного введения. Заявленный набор для вакцинации птиц содержит в дозирующем устройстве живой ослабленный вирус и хитозан в виде глазных капель, спрея или аэрозоля. 4 н. и 7 з.п. ф-лы. 13 ил., 4 табл., 5 пр.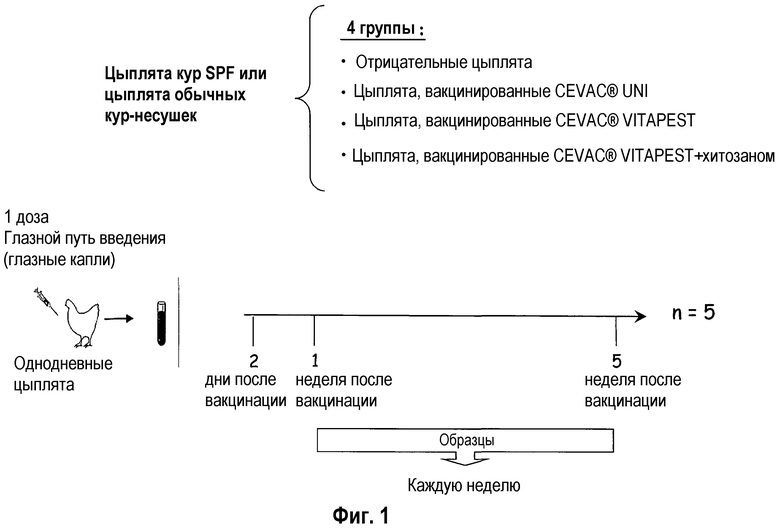
1. Композиция, содержащая один или более живых ослабленных вирусов и хитозан, для иммунизации или вакцинации видов птиц посредством глазного введения.
2. Композиция по п.1, которая вводится посредством глазных капель, спрея или аэрозоля.
3. Композиция по п.1, где вирус получен из вируса, ответственного за заболевания птиц, выбранные из птичьей оспы, ньюкаслской болезни, инфекционного бронхита, лимфоидного лейкоза, болезни Марека, инфекционного бурсального заболевания, инфекционного ларинготрахеита, реовироза, инфекционного теносиновита, птичьего энцефаломиелита, «синдрома опухшей головы», индюшачего ринотрахеита или птичьего гриппа.
4. Композиция по п.3, где живой ослабленный вирус является вирусом ньюкаслской болезни.
5. Композиция по п.1 или 2 для иммунизации или вакцинации птиц, выбранных из сельскохозяйственных разводимых или декоративных одомашненных птиц, включая кур, индюков, гусей, уток, фазанов, перепелов или голубей.
6. Композиция по п.1 или 2 для усиления клеточно-опосредованного иммунитета у видов птиц и персистенции вакцины в тканях птиц.
7. Применение хитозана и одного или более живых ослабленных вирусов для изготовления композиции для иммунизации или вакцинации видов птиц посредством глазного введения.
8. Применение хитозана и одного или более живых ослабленных вирусов для изготовления вакцинной композиции для усиления клеточно-опосредованного иммунного ответа у птиц для раздельного или одновременного глазного введения.
9. Применение по п.8, где хитозан и вирус вводятся последовательно посредством глазных капель, спреев или аэрозолей, причем хитозан вводится перед вирусом или после него.
10. Применение по любому из пп.7-9, где вирус представляет собой ослабленный вирус ньюкаслской болезни.
11. Набор для вакцинации птиц, содержащий в дозирующем устройстве живой ослабленный вирус и хитозан, как определено в любом из пп.1-6, в виде глазных капель, спрея или аэрозоля.
| US 5785975 А, 28.07.1998 | |||
| SUN BIN | |||
| Immune response of the conjunctiva associated lymphoid tissue to eye drop application of the Newcastle disease vaccine in chickens// Acta veterinaria et zootechnica sinica, 03, 1997, [Найдено 08.04.2013] [онлайн], Найдено из интернета: <URL:http://en.cnki.com.cn/Article-en/CJFDTOTAL-XMSY703.009.htm | |||
| EP 770397 B1, 21.04.2004 | |||
| US 20070248645 A1, 25.10.2007. |
Авторы
Даты
2013-11-20—Публикация
2009-09-04—Подача