Область техники, к которой относится изобретение
Настоящее изобретение в целом относится к области получения вакцин. Настоящее изобретение, в особенности, относится к мультивалентным рекомбинантным вирусам герпеса, в которые были вставлены, по меньшей мере, два чужеродных гена, и их применениям для одновременной индукции защитного иммунитета против множества болезней птиц.
Уровень техники
Мясо птицы и яйца служат важными источниками питания, потребление которого непрерывно возрастает в связи с ростом численности населения и их выгодного соотношение цены и качества. Недавняя эпидемия птичьего гриппа сосредоточила общественное внимание на здоровье домашней птицы, а также на безопасности пищевых продуктов и ее обеспечении. Проблемой технологии производства вакцин для птиц озабочены во всем мире.
В качестве птичьей вакцины против целевых патогенов обычно используют вирусные векторы, экспрессирующие патогенные белки. Вакцины, включающие такие вирусные векторы, индуцируют экспрессию чужеродных патогенных белков в инфицированных клетках, и, таким образом, индуцируют соответствующий Т-клеточный иммунитет.
Хорошо известно, что все вирусам герпеса, включая вирус герпеса индейки (HVT) и вирус болезни Марека (MDV), может постоянно жить в теле зараженного животного в состоянии латентной или хронической инфекции. Следовательно, рекомбинантные вирусы герпеса, в которые включили чужеродный ген, полученный из патогена, были разработаны для применения в качестве вакцин на основе вирусных векторов, увеличивающих продолжительность иммунитета для привитого животного.
Геномная структура HVT, его широкое применение в качестве вакцины против MDV и его способность оставаться неизменным у кур, делают этот вирус привлекательным вектором для получения рекомбинантные птичьей вакцины.
Препараты вакцин были разработаны для достижения эффективной вакцинации птиц с помощью рекомбинантного вируса герпеса, который включает ген, кодирующий чужеродный антиген. Такие вакцинные препараты позволяют проводить вакцинацию как против MDV (вектор), так и против другого заболевания птиц, посредством встроенной последовательности чужеродной ДНК.
Несмотря на то, что такие вакцинные препараты обеспечивают эффективные результаты при вакцинации птиц против многих смертельных заболеваний, между патогенами может существовать конкуренция и иммуносупрессия, если птицам вводят инъекцию с двумя или несколькими рекомбинантными вирусами герпеса, каждый из которых несет отличный ген чужеродного антигена.
Следовательно, в особенности, будет изучены мультивалентные рекомбинантные вирусы герпеса (т.е. несущие, по меньшей мере, два различных гена антигенов) для иммунизации одновременно против различных заболеваний. Однако до сих пор, рекомбинантные HVT (rHVT), экспрессирующие множественные чужеродные гены оказывались нестабильными, и все гены или часть чужеродных генов удалялись во время повторяющихся пассажей в культуре клеток. Соответственно, такие нестабильные мультивалентные вирусные векторы не могут быть применены в качестве эффективных вакцин.
Соответственно, существует необходимость в стабильных мультивалентных рекомбинантных вирусных векторах, позволяющих осуществлять совместную экспрессию чужеродных генов в инфицированных клетках.
Раскрытие изобретения
Работа, выполненная заявителем, привела к удивительной находке. Оказалось, что набор определенных сайтов встраивания в геноме вируса герпеса может быть применен для стабильного встраивания и экспрессии двух или нескольких генов антигена, тем самым обеспечивая эффективные мультивалентные вирусные векторы для вакцинации птиц. В частности, заявитель обнаружил, что некоторое число сайтов встраивания может быть одновременно применено для включения разных генов антигена, обеспечивая стабильные мультивалентные рекомбинантные вирусные векторы.
Следовательно, настоящее изобретение относится к рекомбинантному вирусу птичьего герпеса, который включает, по меньшей мере, две рекомбинантные нуклеотидные последовательности, каждая рекомбинантная нуклеотидная последовательность, кодирующая и экспрессирующая в клетках птиц антигенный пептид, в котором указанные, по меньшей мере, две рекомбинантные нуклеотидные последовательности встроены в отдельные некодирующие области вирусного генома, которые выбирают из области, расположенной между UL44 и UL45, области, расположенной между UL45 и UL46, области, расположенной между US10 и SORF3, и области, расположенной между SORF3 и US2.
В предпочтительном воплощении, одну рекомбинантную нуклеотидную последовательность встраивают в область, расположенную между UL45 и UL46, и одну рекомбинантную нуклеотидную последовательность встраивают в область, расположенную между UL44 и UL45, между US10 и SORF3 или между SORF3 и US2. Как проиллюстрировано в заявке, такие рекомбинантные конструкции вируса птичьего герпеса обеспечивают особенно стабильную и эффективную экспрессию двух соответствующих антигенных пептидов в инфицированных клетках птиц.
В особенности, преимущественно, две или несколько рекомбинантные нуклеотидные последовательности совместно экспрессируются в фибробластах эмбриона цыпленка (CEF), даже после 10-ти или более пассажей, и преимущественно даже после 15-ти пассажей.
В соответствии с изобретением, рекомбинантные нуклеотидные последовательности преимущественно находятся под контролем определенных промоторов. Промоторы преимущественно выбирают из промотора бета-актина цыпленка (Bac), промотора Pec, предраннего (ie)1 промотора мышиного цитомегаловируса (Mcmv), промотора цитомегаловируса человека (Hcmv), промотора обезьяньего вируса (SV)40 и промотора саркомы Рауса (RSV) или из любых их фрагментов, которые сохраняют активность промотора. Преимущественно, каждая рекомбинантная нуклеотидная последовательность находится под контролем отдельного промотора.
В соответствии с изобретением, чужеродные гены преимущественно выбирают из антигенного пептида птичьего парамиксовируса типа 1, и преимущественно, из белка F вируса болезни Ньюкасла (NDV), антигенного пептида вируса болезни Гамборо, преимущественно, из белка VP2 вируса инфекционного бурсита (IBDV), антигенного пептида вируса инфекционного ларинготрахеита (ILTV), преимущественно, из белка gB, антигенного пептида Mycoplasma galisepticum, преимущественно, из белка 40K, и антигенного пептида вируса птичьего гриппа, преимущественно, из поверхностного белка гемагглютинина (HA).
В предпочтительном воплощении, рекомбинантный вирус птичьего герпеса включает первую рекомбинантную нуклеотидную последовательность, кодирующую первый антигенный пептид, встроенную в некодирующую область, расположенную между UL44 и UL45, и вторую рекомбинантную нуклеотидную последовательность, кодирующую второй антигенный пептид, встроенную в некодирующую область, расположенную между UL45 и UL46, между US10 и SORF3 или между SORF3 и US2.
Еще в одном предпочтительном воплощении, рекомбинантный вирус птичьего герпеса включает первую рекомбинантную нуклеотидную последовательность, кодирующую первый антигенный пептид, встроенную в некодирующую область, расположенную между UL45 и UL46, и вторую рекомбинантную нуклеотидную последовательность, кодирующую второй антигенный пептид, встроенную в некодирующую область, расположенную между US10 и SORF3, или между SORF3 и US2.
В еще более предпочтительном воплощении, рекомбинантный вирус птичьего герпеса включает первую рекомбинантную нуклеотидную последовательность, кодирующую первый антигенный пептид, встроенную в некодирующую область, расположенную между US10 и SORF3, и вторую рекомбинантную нуклеотидную последовательность, кодирующую второй антигенный пептид, встроенную в некодирующую область, расположенную между SORF3 и US2.
Дополнительная цель изобретения относится к мультивалентной вакцине для иммунизации таких птиц, как домашняя птица, которая включает эффективное иммунизирующее количество рекомбинантного вируса птичьего герпеса изобретения. Данная вакцина может быть применена для иммунизации таких птиц, как домашняя птица.
Дополнительная цель изобретения относится к антисыворотке, направленной против вируса птичьего герпеса, полученной путем иммунизации птиц эффективным количеством рекомбинантного вируса птичьего герпеса изобретения и извлечения антисыворотки после забора крови у птицы.
Изобретение дополнительно относится к способу иммунизации птицы, включающему введение указанной птице эффективного иммунизирующего количества вакцины в соответствии с изобретением.
Изобретение дополнительно обеспечивает набор для вакцинации для иммунизации птиц, который включает эффективное количество вакцины изобретения, и средства для введения указанных компонентов указанным видам.
Изобретение может быть применено у любой птицы для вакцинации против любого патогена птиц.
Краткое описание чертежей
Фигура 1 иллюстрирует схему генома HVT. Выделено местоположение уникальной длинной области (Unique Long (UL)) 44, UL45 и UL46 и местоположение уникальной короткой области (Unique Short (US))10, SORF3 и US2. Рекомбинантные нуклеотидные последовательности могут быть вставлены в созданные с помощью ПЦР сайты SfiI между UL44 и UL45, и/или между UL45 и UL46, и/или между US10 и SORF3, и/или между SORF3 и US2.
Фигуры 2A и 2B иллюстрируют схему генома HVT, суммирующую различные кластеры нуклеотидных последовательностей и промоторов, в соответствии с конкретными воплощениями изобретения.
Фигура 3 показывает иммунофлуоресцентное окрашивание клеток CEF, инфицированных двойным рекомбинантным HVT в соответствии с воплощениями изобретения (FW129 и FW141), совместно экспрессирующим NDV-F и IBDV-VP2 (клетки, инфицированные rHVT/ND/IBD). Экспрессию белка VP2 детектировали с помощью антител к VP2 Mab (R63) и Alexa Flour 546. Экспрессию белка F детектировали с помощью анти-F #35 кроличьей сыворотки и Alexa Flour 488. Результаты показали, что обе клетки, инфицированные FW129 или FW141, экспрессируют как встроенный белок NDV-F, так и встроенный белок IBDV-VP2.
Фигуры 4A и 4B представляют результаты анализа по методу вестерн-блоттинга, показывающие экспрессию белка VP2 и/или белка F в клетках CEF, инфицированных rHVT изобретения. Как показано на фигуре 4A, полосу белка с массой 60 килодальтон (кДа) наблюдали только на дорожке с клетками, инфицированными rHVT/ND/IBD, что представляет собой ожидаемый размер белка F  . На дорожке rHVT/44-45BacVP2 (FW123) полосы не было. Как показано на фигуре 4B, белок VP2 наблюдали в районе 38-ми килодальтон (kd) на дорожках каждого rHVT/ND/IBD
. На дорожке rHVT/44-45BacVP2 (FW123) полосы не было. Как показано на фигуре 4B, белок VP2 наблюдали в районе 38-ми килодальтон (kd) на дорожках каждого rHVT/ND/IBD  . Напротив, на дорожке rHVT/45-46 PecF (FW029) полосы не было. Белок с молекулярной массой 38-kd представляет собой зрелый белок VP2 (A. A. Azad et al., 1987, Virol. 161:145-152, K. J., Fahey et al., 1985 J. Gen. Virol. 66:1479-1488). Двойные rHVT изобретения экспрессировали как NDV-F, так и IBDV-VP2.
. Напротив, на дорожке rHVT/45-46 PecF (FW029) полосы не было. Белок с молекулярной массой 38-kd представляет собой зрелый белок VP2 (A. A. Azad et al., 1987, Virol. 161:145-152, K. J., Fahey et al., 1985 J. Gen. Virol. 66:1479-1488). Двойные rHVT изобретения экспрессировали как NDV-F, так и IBDV-VP2.
Фигуры от 5A до 5D показывают результаты анализа по методу саузерн-блоттинга для проверки структуры генома очищенного FW129 (rHVT/45-46 pecF/44-45 Rsv VP2), видно на то, что двойной рекомбинантный HVT/ND/IBD изобретения имел ожидаемую геномную структуру. Конкретнее, результаты саузерн-блоттинга показали, что
- 2077-п.о. фрагмент гибридизовался с зондом VP2 в ДНК каждого двойного рекомбинантного HVT FW129 (колонки 1, 2 и 3 фигура 5A). Напротив, никакой полосы не обнаружили в p45/46Pec F (фигура 5A).
- 2744-п.о. фрагмент гибридизовался с зондом F в ДНК каждого двойного рекомбинантного HVT FW129 (колонки 1, 2 и 3 фигура 5C). В p45/46 SfiI никакой полосы не обнаружили.
- 2077-п.о. и 1228-п.о. фрагменты гибридизовались с зондом IS44/45 в ДНК каждого двойного рекомбинантного HVT FW129 (колонки 1, 2 и 3 на фигуре 5B). Для маркера молекулярных масс, HindIII гидролизата фага лямда, никакой полосы не обнаружили (колонка M на фигуре 5B).
- 2744-п.о. и 770-п.о. фрагменты гибридизовались с зондом IS45/46 в ДНК каждого двойного рекомбинантного HVT FW129 (колонки 1, 2 и 3 на фигуре 5D).
Фигуры 6A и 6B показывают результаты анализа по методу вестерн-блоттинга для проверки стабильности рекомбинантного HVT FW129 в последовательных пассажах, указывающие на то, что после 15-ти пассажей белок F и белок VP2 стабильно экспрессируются в CEF, инфицированных rHVT FW129 изобретения.
Фигуры от 7A до 7D показывают результаты анализа по методу саузерн-блоттинга для проверки стабильности рекомбинантного HVT после 15-ти пассажей (фигура 7A). Результаты саузерн-блоттинга показали, что 2077-п.о. фрагмент гибридизовался с зондом VP2 в ДНК из FW129. 2334-п.о. фрагмент гибридизовался с зондом VP2 в ДНК из FW130. Напротив, никакой полосы не детектировали с p45/46Pec F (фигура 7C). Результаты саузерн-блоттинга показали, что 2744-п.о. фрагмент гибридизовался с F-зондом в ДНК каждого двойного рекомбинантного HVT FW129 и FW130. В p45/46 SfiI никакой полосы не обнаружили (фигура 7B). Результаты саузерн-блоттинга показали, что 2077-п.о. и 1228-п.о. фрагменты гибридизовались с зондом IS44/45 в ДНК из FW129, и что 2334-п.о. и 1022-п.о. фрагменты гибридизовались с зондом IS44/45 в ДНК из FW130. 1350-п.о. фрагмент гибридизовался с зондом IS44/45 в p45/46 PecF, который не содержал ген в сайте IS44/45 (фигура 7D). Результаты саузерн-блоттинга показали, что фрагменты 2744-п.о. и 770-п.о. гибридизовались с зондом IS45/46 в ДНК каждого двойного рекомбинантного HVT FW129 и FW130. Саузерн-блот с зондом 44/45 и зондом 45/46 показал, что ген VP2 или ген F стабильно сохраняется в сайте встраивания 44/45 или 45/46, соответственно в FW129 и FW130. Данные результаты показывают, что после 15-ти пассажей белок F и белок VP2 стабильно экспрессируются в CEF, инфицированных rHVT FW129 изобретения.
Фигуры 8A и 8B показывают сравнительные результаты для анти-NDV титров (фигура 8A) и анти-IBDV титров (фигура 8B), полученных от цыплят, зараженных двойным рекомбинантным HVT (FW122, FW137, FW129, FW130, FW135), по сравнению с титрами, полученными из цыплят, зараженных одиночным рекомбинантным HVT (FW029 и FW023, соответственно).
Осуществление изобретения
Настоящее изобретение, в целом, относится к мультивалентным рекомбинантным вирусам герпеса и их применению для одновременной иммунизации птиц против, по меньшей мере, двух заболеваний. В соответствии с изобретением, последовательности чужеродной ДНК, в основном, встраивают в сайты встраивания внутри генома rHV, обеспечивая стабильные и эффективные конструкции, подходящие для применения в композициях или способах для вакцинации.
Настоящее изобретение будет более понятно при отсылке к следующим определениям:
Определения
В контексте изобретения, термин «реконструированные» или «рекомбинантные» по отношению к последовательности, обозначает последовательность, нуклеиновую кислоту или единицу, которая не существуют в природе и/или которая была разработана с помощью технологии рекомбинантной ДНК (также называемой генным клонированием или молекулярным клонированием).
Термин «рекомбинантный» по отношению к вирусу герпеса относится к вирусу герпеса, геном которого был модифицирован вставкой, по меньшей мере, одной гетерологичной нуклеиновой кислоты, т.е. нуклеиновой кислоты (например, ДНК), которая не обнаружена в природе в геноме вируса герпеса, или которая обнаружена в природе в указанном геном, но в другой форме или в другом положении. Следует понимать, что рекомбинантный вирус герпеса может быть произведен с помощью различных способов, и, будучи однажды создан, может быть воспроизведен без применения дополнительных технологии рекомбинантной ДНК. Следовательно, структура «рекомбинантного вируса герпеса» описывается в терминах ДНК-вставки.
В настоящем описании, термины «нуклеиновая кислота», «последовательность нуклеотидов» и «нуклеотидная последовательность» применяют взаимозаменяемо, и они относятся к молекуле нуклеиновой кислоты, имеющей определенную последовательность, которая может представлять собой дезоксирибонуклеотиды и/или рибонуклеотиды. Исходно, нуклеотидная последовательность может быть получена, например, с помощью рекомбинантных, энзиматических и/или химических технологий, и в дальнейшем реплицирована в клетке-хозяине или в системе in vitro. Нуклеотидная последовательность преимущественно включает открытую рамку считывания, кодирующую пептид. Нуклеотидная последовательность может содержать дополнительные последовательности, такие как терминатор транскрипции, сигнальный пептид, IRES, интрон и т.п. Предпочтительно, открытая рамка считывание в рекомбинантной нуклеиновой кислоте не содержит интрон.
Термин «нетранслируемая область», как применен в настоящем документе, относится к области нуклеотидов, которая не имеет ORF и не определяет аминокислотную последовательность белка, которую следует экспрессировать путем трансляции, или к области нуклеотидов, в которой ORF не принимает участия ни в транскрипции, ни в трансляции или ни в экспрессии белка.
Термин «птицы» предназначен для обозначения всех птиц, таких как птицы класса Aves, т.е. позвоночных животных, которые представляют собой пернатых, крылатых, двуногих, эндотермических и яйцекладущих животных. В контексте изобретения, термин птицы (avians) или птицы (avian species) относится, в частности, к птицам, представляющими экономический и/или агрономический интерес, таким как домашняя птица (такие как куры и индейки), водоплавающие птицы (такие как утки и гуси) и декоративные птицы (такие как лебеди и попугаи).
Термин «вакцина», как применен в настоящем документе, обозначает средство, которое может быть применено для того, чтобы вызывать, стимулировать, или усиливать иммунный ответ в организме.
Вирусы
Вирусы, для применения в настоящем изобретении, представляют собой такие вирусы, которые относятся, в основном, к роду вирусов птичьего герпеса.
Например, вирусы птичьего герпеса для применения в настоящем изобретении включают без ограничений вирусы герпеса индейки (HVT), вирус болезни Марека, серотип 2, предпочтительно, штамм SB1 вируса болезни Марека, серотип 2, или вирус болезни Марека, серотип 1, предпочтительно штамм CVI988/Rispens вируса болезни Марека, серотип 1. Предпочтительные вирусы герпеса изобретения получают из серотипов или штаммов, которые непатогенны для целевых птиц.
Мультивалентные рекомбинантные вирусы птичьего герпеса
Цель изобретения относится к рекомбинантным вирусам птичьего герпеса, подходящим для иммунизации птиц против, по меньшей мере, двух заболеваний, с усовершенствованной стабильностью при многократных пассажах. Авторами изобретения были установлены конкретные сайты встраивания, которые, в комбинациях, обеспечивают усовершенствованную стабильность для генов чужеродного антигена.
Цель изобретения, следовательно, относится к рекомбинантному вирусу птичьего герпеса, который включает, по меньшей мере, две рекомбинантные нуклеотидные последовательности, каждая рекомбинантная нуклеотидная последовательность, кодирующая отдельный антигенный пептид, в котором указанные, по меньшей мере, две рекомбинантные нуклеотидные последовательности встраивают в отдельные некодирующие области вирусного генома, выбираемые из области, расположенной между UL44 и UL45, области, расположенной между UL45 и UL46, области, расположенной между US10 и SORF3, и области, расположенной между SORF3 и US2.
Местоположение указанных некодирующих областей известно в этой области техники и может быть найдено, например, в работе Kingham et al. («The genome of herpesvirus of turkeys: comparative analysis with Marek’s disease viruses» – Journal of General Virology (2001) 82, 1123-1135).
Например, путем отсылки к полному геному FC126 (код доступа в Банке генов: AF291866,1), область, расположенная между UL44 и UL45, соответствует нуклеоидам 94243-94683 генома HVT, область, расположенная между UL45 и UL46 соответствует нуклеоидам 95323-95443 генома HVT, область, расположенная между US10 и SORF3 соответствует нуклеоидам 138688-138825 генома HVT, и область, расположенная между SORF3 и US2, соответствует нуклеоидам 139867-140064 генома HVT.
Нуклеиновая кислота, представляющая интерес для вставки в геном вируса герпеса, может быть гомологичной или гетерологичной по отношению к вирусу герпеса. Нуклеиновая кислота обычно кодирует антиген из патогена и может быть извлечена или получена из любого патогенного организма, способного вызывать инфекцию у птиц. Обычно, клонированные нуклеиновые кислоты получают из патогенов, которые вызывают заболевания, имеющие экономическое влияние на птицеводство. Примеры патогенов, вызывающих инфекцию у птиц, включают вирусы, бактерии, грибы, простейшие и т.п.
Таким образом, гомологичная или гетерологичная нуклеотидная последовательность для вставки в вирусный геном может представлять собой любую последовательность, кодирующую антигенный пептид птичьего возбудителя заболевания. Последовательность нуклеиновой кислоты в соответствии с настоящим изобретением может быть получена из любого источника, например, вирусного, прокариотического, эукариотического или путем синтеза. Обычно, нуклеотидные последовательности кодируют иммуногенный пептид патогена, и, предпочтительно, представляющий собой поверхностные белки, секретируемые белки или структурные белки указанного патогена или их фрагменты.
Нуклеотидная последовательность может кодировать, например, антигенный пептид, полученный из вируса птичьего гриппа, птичьего парамиксовируса типа 1, также называемого вирусом болезни Ньюкасла (NDV), птичьего метапневмовируса, вируса болезни Марека, вируса болезни Гамборо, также называемого вирусом инфекционного бурсита (IBDV), вируса инфекционного ларинготрахеита (ILVT), вируса инфекционного бронхита (IBV), Escherichia coli, видов Salmonella, Pasteurella multocida, Riemerella anatipestifer, Ornithobacterium rhinotracheale, Mycoplasma gallisepticum, Mycoplasma synoviae, микроорганизмов, относящихся к Mycoplasmas, заражающих птиц, или кокцидиев.
Преимущественно, нуклеотидные последовательности, встроенные в вирусный геном, выбирают из белка F из NDV, белка VP2 из IBDV, белка gB из ILTV, белка 40K из Mycoplasma galisepticum, и поверхностного белка гемагглютинин (HA) вируса птичьего гриппа.
Различные комбинации антигенных пептидов могут представлять большой интерес, в зависимости от нескольких факторов, таких как вид птицы, страна выращивания, условия выращивания и т.п.
Например, в воплощении, мультивалентный рекомбинантный вирус птичьего герпеса изобретения включает в своем геноме нуклеотидную последовательность, кодирующую белок F из NDV, и нуклеотидную последовательность, кодирующую белок VP2 из IBDV.
В соответствии с особым воплощением, в вирусный геном могут быть встроены три или более нуклеотидные последовательности.
Рекомбинантный вирус герпеса изобретения может экспрессировать два или более антигена из одного и того же патогена.
Гомологичные или гетерологичные нуклеотидные последовательности, которые кодируют представляющие интерес антигены, могут быть функционально связаны с промотором и в дальнейшем встроены в вирусный геном. Применяемый промотор может представлять собой как синтетический, так и природный, эндогенный или гетерологичный промотор.
Промотор не ограничивают, до тех пор, пока он может эффективно функционировать в клетках птиц, инфицированных rHVT. Следовательно, выбор промотора распространяется на любой эукариотический, прокариотический или вирусный промотор, способный направлять транскрипцию гена в клетках птиц, зараженных rHVT.
Преимущественно, промоторы выбирают из промотора бета-актина цыпленка (Bac), промотора Pec, промотора мышиного цитомегаловируса (Mcmv) ie1, промотора цитомегаловируса человека (Hcmv), промотора обезьяньего вируса (SV)40 и промотора саркомы Рауса (RSV), или любых их фрагментов, которые сохраняют активность промотора.
Последовательность нуклеиновой кислоты куриного Bac-промотора приведена в SEQ ID NO: 1, последовательность промотора Pec приведена в SEQ ID NO: 2, последовательность промотора Mcmv ie1 приведена в SEQ ID NO: 3, последовательность промотора Hcmv приведена в SEQ ID NO: 4, последовательность промотора SV40 приведена в SEQ ID NO: 5, и последовательность промотора RSV приведена в SEQ ID NO: 6.
Следует отметить, что варианты таких последовательностей, кодирующих функциональные промоторы, известны и/или могут быть сконструированы/протестированы специалистом, для применения в настоящем изобретении.
В предпочтительном рекомбинантном вирусе герпеса изобретения, по меньшей мере, одна из нуклеиновых кислот включает промотор Pec или Bac для управления экспрессией антигенного пептида.
Мультивалентная конструкция
Клонирование генов и конструирование плазмид хорошо известны специалисту в этой области техники и могут быть по существу выполнены с помощью стандартных методов молекулярной биологии (Molecular Cloning: A Laboratory Manual. 3rd Edition, Cold Spring Harbor Laboratory Press, Woodbury, N.Y. 2001).
Для того чтобы конструировать мультивалентный рекомбинантный вирус герпеса настоящего изобретения, первоначально, вирус герпеса размножают в подходящей клетке-хозяине и затем получают геномную ДНК. Хозяин и условия для размножения вируса выбирают в зависимости от обстоятельств. В качестве клеток-хозяев, предпочтительны клетки, полученные из кур, и могут быть применены клетки CEF (фибробласты куриного эмбриона), клетки куриных почек и т.п. Их можно культивировать в такой культуральной среде, как MEM Игла, культуральная среда Лейбовица-L-15/МакКоя 5A (смесь 1:1), при примерно 37oC в течение от 3-х до 4-х дней.
ДНК экстрагируют из инфицированных вирусом клеток, культивированных, как описано выше, в соответствии с традиционным способом. После денатурации в буфере для лизиса и удаления белка, ДНК экстрагируют фенолом и этанолом.
Обычно, рекомбинантные вирусы могут быть получены путем гомологичной рекомбинации между вирусным геномом и конструкцией (например, плазмидой), включающей нуклеиновую кислоту, которую предполагается вставить, фланкированную нуклеотидами из сайта встраивания, чтобы позволить рекомбинацию.
Плазмида с последовательностью сайта встраивания
Одной из возможностей для вставки чужеродного гена в одну из нетранслируемых областей вирусного генома в соответствии с изобретением может быть исходное клонирование последовательности, содержащей целевую нетранслируемую область, в плазмиду, или в другой подходящий вектор. В соответствии с изобретением, такую последовательность выбирают из последовательности области, расположенной между UL44 и UL45, последовательности области, расположенной между UL45 и UL46, последовательности области, расположенной между US10 и SORF3, и последовательности области, расположенной между SORF3 и US2.
Примеры плазмид включают pBR322, pBR325, pBR327, pBR328, pUC18, pUC19, pUC7, pUC8 и pUC9, примеры фагов включают фаг лямбда и фаг M13, и пример космид включает pHC79.
Последовательность нетранслируемой области встраивают в плазмиду в соответствии с традиционным способом клонирования. Последовательности области вставки предпочтительно имеют достаточную длину, так что после вставки нуклеиновой кислоты, последовательности, которые фланкируют нуклеиновую кислоту, имеют соответствующую длину, такую, чтобы обеспечить гомологичную рекомбинацию с вирусным геном in vivo. Предпочтительно, фланкирующие последовательности должны иметь, по меньшей мере, приблизительно 50 нуклеотидов в длину.
Для того чтобы вставить одну чужеродную последовательность или несколько чужеродных последовательностей в нетранслируемую область, в определенном сайте может быть выполнена мутация нетранслируемой области с получением нового сайта расщепления для ферментов рестрикции. Способ осуществления мутации может представлять собой традиционный способ, и может быть применен способ, обычно применяемый специалистом в этой области техники, такой как in vitro мутагенез и ПЦР. Так, в способе ПЦР, осуществляют такую мутацию, как делеция, замещение или присоединение 1-2 нуклеотидов в ПЦР праймер, и затем этот праймер применяют для создания мутации.
Плазмида, дополнительно содержащая целевую чужеродную нуклеотидную последовательность (целевые чужеродные нуклеотидные последовательности)
Нуклеотидные и промоторные последовательности, для вставки в вирус, далее встраивают в область вставки вирусного генома в плазмиде.
Более конкретно, нуклеотидные и промоторные последовательности вводят во фрагмент геномной ДНК вируса герпеса, содержащий последовательности области вставки, субклонированные в плазмиде.
При необходимости, может быть получена плазмида, которая содержит две или более последовательности чужеродной нуклеиновой кислоты, например, полученные от одного и того же или от различных патогенов, указанные последовательности фланкированы последовательностями области вставки, как описаны в настоящем документе.
Вирусный геном, включающий чужеродную нуклеотидную последовательность в сайте встраивания
Плазмиды, в которых, по меньшей мере, одна нуклеотидная последовательность встроена в нетранслируемую область, полученную как описано выше, могут быть введены в HVT-инфицированную клетку или в клетки, транфицированные геном HVT, с помощью электропорации, фосфата кальция, способа с применением липофектина или подобных способов. Если количество плазмиды, предназначенной для введения, находится в диапазоне от 0,1 до 1000 мкг, то в клетках эффективность образования рекомбинантных вирусов в результате рекомбинации между гомологичными областями HVT-ДНК и плазмидой становится высокой.
Получение мультивалентных рекомбинантных вирусов герпеса
Мультивалент изобретения может быть получен путем совместной трансфекции в той же клеточной культуре плазмиды, содержащей, как описано выше, последовательность сайта встраивания, в которую встраивают чужеродную нуклеотидную последовательность, и рекомбинантный вирус герпеса, содержащий, как описано выше, тот же сайт встраивания, свободный от чужеродной нуклеотидной последовательности, и второй сайт встраивания, в который встраивают отличную чужеродную нуклеотидную последовательность. Данная совместная трансфекция приводит к рекомбинации плазмидной ДНК в вирусный геном.
Другим способом, мультивалент изобретения может быть получен путем совместной трансфекции той же клеточной культуре двух плазмид, каждая из которых содержит отличную последовательность сайта встраивания, в которую встраивают отличную чужеродную нуклеотидную последовательность, и вирус герпеса, содержащий, как описано выше, те же сайты встраивания, свободные от чужеродной нуклеотидной последовательности. Совместная трансфекция приводит к рекомбинации обеих плазмидных ДНК в вирусный геном.
Полученный мультивалентный рекомбинантный вирус может быть выбран генотипически или фенотипически с помощью известных методик отбора, например, путем гибридизации, определения ферментативной активности, кодируемой геном, совместно интегрированным вместе с последовательностями рекомбинантных нуклеиновых кислот, или детектированием антигенного пептида, экспрессированного рекомбинантным вирусом герпеса иммунологически. Выбранный рекомбинантный вирус герпеса может быть культивирован в большом масштабе в клеточной культуре, после чего рекомбинантный вирус герпеса, содержащий пептиды, может быть собран.
Предпочтительные мультивалентные конструкции
Задача изобретения заключается в предложении мультивалентных рекомбинантных вирусов герпеса, в которых присутствуют, по меньшей мере, две чужеродные нуклеотидные последовательности, каждая из которых подходящим способом встроена в конкретный сайт встраивания, для кодирования и экспрессии соответствующих антигенных пептидов в клетках птиц.
Среди множества возможных воплощений, основанных на комбинации целевых сайтов встраивания и предпочтительных рекомбинантных нуклеотидных последовательностях, и, необязательно, на предпочтительных промоторах, заявитель неожиданно обнаружил, что конкретные комбинации демонстрируют высокий уровень стабильности, позволяющий применять их для получения усовершенствованных мультивалентных вакцин.
Основанная на этом замечании, цель изобретения заключается в предложении специфических мультивалентных рекомбинантных вирусов птичьего герпеса с высоким уровнем стабильности.
Предпочтительные мультивалентные рекомбинантные вирусы птичьего герпеса изобретения включают две рекомбинантные нуклеотидные последовательности, каждая рекомбинантная нуклеотидная последовательность, кодирующая отдельный антигенный пептид и встроенная в отдельную некодирующую область вирусного генома, выбираемую из области, расположенной между UL44 и UL45, области, расположенной между UL45 и UL46, области, расположенной между US10 и SORF3, и области, расположенной между SORF3 и US2.
Предпочтительные антигенные пептиды изобретения выбирают из белка F из NDV, белка VP2 из IBDV, белка gB из ILTV, белка 40K из Mycoplasma galisepticum и поверхностного белка HA вируса птичьего гриппа.
Преимущественно, промоторы, применяемые с нуклеотидными последовательностями, встроенными в сайт встраивания между UL44 и UL45, выбирают из промотора Pec, промотора Mcmv ie1, промотора Hcmv, промотора SV40 и промотора RSV, или из любых их фрагментов, которые сохраняют активность промотора. Действительно, заявитель неожиданно обнаружил, что Bac-промотор, встроенный между UL44 и UL45, не дает стабильной экспрессии чужеродного гена. Однако Bac-промотор, встроенный в область между UL45 и UL46, действительно обеспечивает стабильную экспрессию.
В соответствии с первым воплощением, рекомбинантный вирус птичьего герпеса включает, встроенную между UL45 и UL46 рекомбинантную нуклеотидную последовательность, кодирующую белок F из NDV, или его фрагмент, преимущественно под контролем промотора Pec, и, встроенную между UL44 и UL45 рекомбинантную нуклеотидную последовательность, кодирующую белок VP2 из IBDV или его фрагмент, преимущественно под контролем промотора SV40 (FW130).
В соответствии со вторым воплощением, рекомбинантный вирус птичьего герпеса включает в сайте встраивания между UL45 и UL46 рекомбинантную нуклеотидную последовательность, кодирующую белок F из NDV, или его фрагмент, преимущественно под контролем промотора Pec, и в сайте встраивания между UL44 и UL45 рекомбинантную нуклеотидную последовательность, кодирующую белок VP2 из IBDV или его фрагмент, преимущественно под контролем промотора RSV (FW129).
В соответствии с третьим воплощением, рекомбинантный вирус птичьего герпеса включает в сайте встраивания между UL45 и UL46 рекомбинантную нуклеотидную последовательность, кодирующую белок F из NDV, или его фрагмент, преимущественно под контролем промотора Pec, и в сайте встраивания между UL44 и UL45 рекомбинантную нуклеотидную последовательность, кодирующую белок VP2 из IBDV или его фрагмент, преимущественно под контролем промотора Mcmv ie1 (FW141).
В соответствии с четвертым воплощением, рекомбинантный вирус птичьего герпеса включает в сайте встраивания между UL45 и UL46 рекомбинантную нуклеотидную последовательность, кодирующую белок F из NDV, или его фрагмент, преимущественно под контролем промотора Pec, и в сайте встраивания между SORF3 и US2 рекомбинантную нуклеотидную последовательность, кодирующую белок VP2 из IBDV или его фрагмент, преимущественно под контролем промотора Mcmv ie1 (FW144).
В соответствии с пятым воплощением, рекомбинантный вирус птичьего герпеса включает в сайте встраивания между UL45 и UL46 рекомбинантную нуклеотидную последовательность, кодирующую белок F из NDV, или его фрагмент, преимущественно под контролем промотора Pec, и в сайте встраивания между SORF3 и US2 рекомбинантную нуклеотидную последовательность, кодирующую белок VP2 из IBDV или его фрагмент, преимущественно под контролем промотора Bac (FW146).
В соответствии с шестым воплощением, рекомбинантный вирус птичьего герпеса включает в сайте встраивания между UL44 и UL45 рекомбинантную нуклеотидную последовательность, кодирующую белок F из NDV, или его фрагмент, преимущественно под контролем промотора Pec, и в сайте встраивания между UL45 и UL46 рекомбинантную нуклеотидную последовательность, кодирующую белок VP2 из IBDV или его фрагмент, преимущественно под контролем промотора Mcmv ie1 (FW143).
В соответствии с седьмым воплощением, рекомбинантный вирус птичьего герпеса включает в сайте встраивания между UL44 и UL45 рекомбинантную нуклеотидную последовательность, кодирующую белок F из NDV, или его фрагмент, преимущественно под контролем промотора Mcmv ie1, и в сайте встраивания между UL45 и UL46 рекомбинантную нуклеотидную последовательность, кодирующую белок VP2 из IBDV или его фрагмент, преимущественно под контролем промотора Bac (FW142).
В соответствии с восьмым воплощением, рекомбинантный вирус птичьего герпеса включает в сайте встраивания между SORF3 и US2 рекомбинантную нуклеотидную последовательность, кодирующую белок F из NDV, или его фрагмент, преимущественно под контролем промотора Pec, и в сайте встраивания между UL45 и UL46 рекомбинантную нуклеотидную последовательность, кодирующую белок VP2 из IBDV или его фрагмент, преимущественно под контролем промотора Bac (FW147).
В соответствии с девятым воплощением, рекомбинантный вирус птичьего герпеса включает в сайте встраивания между UL45 и UL46 рекомбинантную нуклеотидную последовательность, кодирующую белок VP2 из IBDV, или его фрагмент, преимущественно под контролем промотора Bac, и в сайте встраивания между SORF3 и US2 рекомбинантную нуклеотидную последовательность, кодирующую белок F из NDV или его фрагмент, преимущественно под контролем промотора Mcmv ie1 (FW145).
В соответствии с десятым воплощением, рекомбинантный вирус птичьего герпеса включает в сайте встраивания между UL45 и UL46 рекомбинантную нуклеотидную последовательность, кодирующую белок VP2 из IBDV, или его фрагмент, преимущественно под контролем промотора Bac, и в сайте встраивания между SORF3 и US2 рекомбинантную нуклеотидную последовательность, кодирующую белок F из NDV или его фрагмент, преимущественно под контролем промотора SV40 (FW149).
В соответствии с одиннадцатым воплощением, рекомбинантный вирус птичьего герпеса включает в сайте встраивания между UL45 и UL46 рекомбинантную нуклеотидную последовательность, кодирующую белок F из NDV, или его фрагмент, преимущественно под контролем промотора SV40, и в сайте встраивания между SORF3 и US2 рекомбинантную нуклеотидную последовательность, кодирующую белок VP2 из IBDV или его фрагмент, преимущественно под контролем промотора Bac (FW148).
В соответствии с двенадцатым воплощением, рекомбинантный вирус птичьего герпеса включает в сайте встраивания между UL45 и UL46 рекомбинантную нуклеотидную последовательность, кодирующую белок F из NDV, или его фрагмент, преимущественно под контролем промотора Pec, и в сайте встраивания между US10 и SORF3 рекомбинантную нуклеотидную последовательность, кодирующую белок VP2 из IBDV или его фрагмент, преимущественно под контролем промотора Mcmv ie1 (FW153).
В соответствии с тринадцатым воплощением, рекомбинантный вирус птичьего герпеса включает в сайте встраивания между UL45 и UL46 рекомбинантную нуклеотидную последовательность, кодирующую белок F из NDV, или его фрагмент, преимущественно под контролем промотора Pec, и в сайте встраивания между US10 и SORF3 рекомбинантную нуклеотидную последовательность, кодирующую белок VP2 из IBDV или его фрагмент, преимущественно под контролем промотора Bac (FW154).
В соответствии с четырнадцатым воплощением, рекомбинантный вирус птичьего герпеса включает в сайте встраивания между UL45 и UL46 рекомбинантную нуклеотидную последовательность, кодирующую белок VP2 из IBDV или его фрагмент, преимущественно под контролем промотора Bac, и в сайте встраивания между US10 и SORF3 рекомбинантную нуклеотидную последовательность, кодирующую белок F из NDV, или его фрагмент, преимущественно под контролем промотора Mcmv ie1 (FW155).
В соответствии с пятнадцатым воплощением, рекомбинантный вирус птичьего герпеса включает в сайте встраивания между UL45 и UL46 рекомбинантную нуклеотидную последовательность, кодирующую белок VP2 из IBDV или его фрагмент, преимущественно под контролем промотора Bac, и в сайте встраивания между US10 и SORF3 рекомбинантную нуклеотидную последовательность, кодирующую белок F из NDV, или его фрагмент, преимущественно под контролем промотора Pec (FW156).
В соответствии с шестнадцатым воплощением, рекомбинантный вирус птичьего герпеса включает в сайте встраивания между US10 и SORF3 рекомбинантную нуклеотидную последовательность, кодирующую белок F из NDV, или его фрагмент, преимущественно под контролем промотора Pec, и в сайте встраивания между SORF3 и US2 рекомбинантную нуклеотидную последовательность, кодирующую белок VP2 из IBDV или его фрагмент, преимущественно под контролем промотора Mcmv ie1 (FW157).
В соответствии с семнадцатым воплощением, рекомбинантный вирус птичьего герпеса включает в сайте встраивания между US10 и SORF3 рекомбинантную нуклеотидную последовательность, кодирующую белок F из NDV, или его фрагмент, преимущественно под контролем промотора Mcmv ie1, и в сайте встраивания между SORF3 и US2 рекомбинантную нуклеотидную последовательность, кодирующую белок VP2 из IBDV или его фрагмент, преимущественно под контролем промотора Bac (FW158).
В соответствии с восемнадцатым воплощением, рекомбинантный вирус птичьего герпеса включает в сайте встраивания между US10 и SORF3 рекомбинантную нуклеотидную последовательность, кодирующую белок VP2 из IBDV, или его фрагмент, преимущественно под контролем промотора Bac, и в сайте встраивания между SORF3 и US2 рекомбинантную нуклеотидную последовательность, кодирующую белок F из NDV или его фрагмент, преимущественно под контролем промотора Mcmv ie1 (FW159).
В соответствии с девятнадцатым воплощением, рекомбинантный вирус птичьего герпеса включает в сайте встраивания между US10 и SORF3 рекомбинантную нуклеотидную последовательность, кодирующую белок VP2 из IBDV, или его фрагмент, преимущественно под контролем промотора Mcmv ie1, и в сайте встраивания между SORF3 и US2 рекомбинантную нуклеотидную последовательность, кодирующую белок F из NDV или его фрагмент, преимущественно под контролем промотора Pec (FW160).
В соответствии с десятым воплощением, рекомбинантный вирус птичьего герпеса включает в сайте встраивания между UL45 и UL46 рекомбинантную нуклеотидную последовательность, кодирующую белок VP2 из IBDV или его фрагмент, преимущественно под контролем промотора Mcmv ie1, и в сайте встраивания между US10 и SORF3 рекомбинантную нуклеотидную последовательность, кодирующую белок F из NDV, или его фрагмент, преимущественно под контролем промотора Pec (FW161).
Культуры клеток
Полученные рекомбинантные вирусы настоящего изобретения могут быть размножены в культурах клеток, в которых указанный рекомбинантный вирус может размножаться и расти. После того как достигают необходимого роста вируса, клетки могут быть отделены от лунок с помощью скребка или трипсина, и инфицированные клетки могут быть отделены от супернатанта центрифугированием.
В предпочтительных воплощениях изобретения, в качестве клетки-хозяина для размножения рекомбинантного вируса герпеса могут быть применены CEF, оплодотворённое яйцо, клетки куриных почек и т.п. Мультивалентные рекомбинантные вирусы настоящего изобретения могут быть культивированы в такой культуральной среде, как MEM Игла, культуральная среда Лейбовица-L-15/МакКоя 5A (смесь 1:1), примерно при 37° C в течение 3-4-х дней. Инфицированные клетки, полученные таким способом, суспендируют в культуральной среде, содержащей 10% диметилсульфоксида (DMSO), и хранят замороженными в жидком азоте.
Преимущественно, рекомбинантные мультивалентные вирусы герпеса изобретения демонстрируют высокий уровень стабильности на протяжении множества пассажей, что соответствует совместной экспрессии рекомбинантных нуклеотидных последовательностей в клетках птиц даже после 10 или более пассажей. В контексте изобретения термин «пассаж» или «пассирование клеток» означает культивирование клеток в подходящих условиях для их роста и поддержания их в живом состоянии до тех пор, пока они не достигнут от 90% до 100% слияния. Стадия пассирования заключается в переносе небольшого числа клеток из предыдущей конфлюэнтной культуры в новую культуральную среду. Аликвота из предыдущей конфлюэнтной культуры, содержащая несколько клеток, может быть разведена в большом объеме свежей среды. В случае прикрепленных культур, клетки могут быть сначала отдельны, например, с помощью смеси трипсина и ЭДТА, или любого подходящего фермента, перед применением небольшого числа отдельных клеток для посева в новой культуральной среде.
В соответствии с предпочтительными воплощениями изобретения, клетки CEF трансфицированные рекомбинантными вирусами птичьего герпеса изобретения, по-прежнему совместно экспрессируют соответствующие антигенные пептиды после, по меньшей мере, 10 пассажей. Другими словами, клетки CEF, полученные после 10 или более пассажей клеток CEF, трансфицированных рекомбинантными вирусами птичьего герпеса изобретения, и, в частности, полученные после 15 пассажей, по-прежнему содержат чужеродные нуклеотидные последовательности рекомбинантного вируса птичьего герпеса, примененные для исходной трансфекции клеток, и экспрессируют, по меньшей мере, два соответствующих антигенных пептида. В контексте изобретения, принимают, что клетки указанного пассажа по-прежнему экспрессируют антигенные пептиды, если уровень их продукции выше, чем 80% от уровня продукции первого пассажа, и, преимущественно, выше, чем 85%.
Композиции мультивалентной вакцины
Изобретение также относится к мультивалентной вакцине для иммунизации таких птиц, как домашняя птица, которая включает эффективное иммунизирующее количество мультивалентного рекомбинантного вируса птичьего герпеса изобретения.
Преимущественно, вакцины изобретения способны вызвать или стимулировать или усиливать иммунитет против, по меньшей мере, двух патогенов, выбираемых из птичьего парамиксовируса типа 1, вируса болезни Гамборо, вируса инфекционного ларинготрахеита, Mycoplasma galisepticum и вируса птичьего гриппа.
Вакцины изобретения включать иммунологически эффективное количество мультивалентного рекомбинантного вируса герпеса как описано выше, в фармацевтически приемлемом носителе.
Мультивалентный рекомбинантный вирус герпеса в соответствии с изобретением может быть предпочтительно применен в качестве живой вакцины, хотя другие альтернативы, такие как инактивированные вакцины или ослабленные вакцины, хорошо укладываются в пределы квалификации специалиста в этой области техники.
Вакцина в соответствии с настоящим изобретением может дополнительно включать подходящий растворитель, такой, например, как водный буфер или фосфатный буфер. Предпочтительно, вакцина также включает вспомогательные средства. Вспомогательные средства настоящего изобретения могут быть получены из любого числа источников, включающих различные белки и пептиды, полученные из животных (например, гормоны, цитокины, ко-стимулирующие факторы), и новые нуклеиновые кислоты, полученные из вирусов и из других источников (например, двуцепочечные РНК, CpG), и т.п., которые вводят с вакциной в количестве, достаточном для усиления иммунного ответа. Кроме того, любое число комбинаций из вышеуказанных веществ может обеспечивать иммунопотенциирующий эффект, и, следовательно, могут образовывать иммуностимулятор настоящего изобретения.
В состав вакцин настоящего изобретения могут дополнительно входить одно или несколько дополнительных вспомогательных веществ для поддержания изотоничности, физиологического pH и стабильности, например, буфер, такой как физиологический солевой раствор (0,85%), фосфатно-солевой буфер (PBS), цитратные буферы, Трис(гидроксиметиламинометан (ТРИС), Трис-солевой буфер и т.п., или антибиотик, например, неомицин или стрептомицин и т.п.
Путь введения может представлять собой любой путь, включающий пероральное, офтальмологическое (например, с помощью глазных капель) введение, глазоносовое введение с применением аэрозоля, интраназальный, клоакальное в корме, в воде или с помощью спрея, в яйце, местное введение или вакцинацию с помощью инъекции (например, внутривенной, подкожной, внутримышечной, интраорбитальной, внутриглазной, внутрикожной и/или внутрибрюшинной). Специалист легко подберет состав композиции вакцины для каждого типа пути введения.
Каждая доза вакцины может содержать подходящую дозу, достаточную, чтобы вызвать защитный иммунный ответ у птиц. Способ оптимизации таких доз хорошо известен в этой области техники. Количество антигена на дозу может быть определено с помощью известных способов с применением взаимодействий антиген/антитело, например, методом ELISA.
Вакцины изобретения могут быть введены в виде одиночных доз или многократных доз, в зависимости от протокола вакцинации.
Вакцины настоящего изобретения дополнительным выгодны тем, что они обеспечивают птицам вплоть до 80% защиты от целевого птичьего патогена через 3 недели после вакцинации.
Настоящее изобретение дополнительно относится к применению вакцины как описано выше для иммунизации птиц, таких как домашняя птица, и к способу иммунизации птиц путем введения иммунологически эффективного количества вакцины в соответствии с изобретением. Вакцина преимущественно может быть введена внутрикожно, подкожно, внутримышечно, перорально, in ovo, путем введения через слизистую оболочку или через глазоносовой путь введения.
Настоящее изобретение дополнительно относится к наборам для вакцинации для иммунизации птиц, которые включают эффективное количество мультивалентной вакцины, как описано выше, и средства для введения указанных компонентов указанным видам. Например, такой набор включает устройство для инъекций, заполненное мультивалентной вакциной в соответствии с изобретением и инструкции для внутрикожной, подкожной, внутримышечной инъекции или инъекции in ovo. Альтернативно, набор включает спрей/аэрозоль или устройство для введения глазных капель, заполненное мультивалентной вакциной в соответствии с изобретением и инструкции для глазоносового введения, перорального введения или введения через слизистую оболочку.
Теперь настоящее изобретение будет описано более подробно с отсылкой к следующим экспериментам и примерам, но это не должно быть истолковано так, что настоящее изобретение ограничено этими экспериментами и примерами.
Эксперименты
В экспериментах применяли несколько рекомбинантных вирусов герпеса (моновалентных или мультивалентных в соответствии с изобретением), обозначенных следующим образом (HVT/первый сайт встраивания-первый чужеродный ген/второй сайт встраивания-второй чужеродный ген):
FW122: HVT/45-46 Hcmv VP2 Bac F
FW123: HVT/44-45 Bac VP2,
FW125: HVT/45-46 Bac F/44-45 Hcmv VP2
FW129: HVT/45-46 PecF/44-45 Rsv VP2
FW130: HVT/45-46 PecF/44-45 SV40 VP2
FW135: HVT/45-46 sv40 F/44-45 Bac VP2
FW137: HVT/45-46 Pec F sv40 VP2
FW141: HVT/45-46 PecF/44-45 Mcmv ie1VP2
FW142: HVT/45-46 Bac VP2/44-45 Mcmv ie1 F
FW144: HVT/45-46 Pec F/87-88 Mcmv ie1 VP2
FW145: HVT/45-46 Bac VP2/87-88 Mcmv ie1 F
FW023: HVT/45-46 Bac VP2
FW029: HVT/45-46 Pec F
Эксперимент 1: Конструкция гомологичных векторов
Конструкция плазмиды существенным образом была выполнена в соответствии со стандартными методами молекулярной биологии (Molecular Cloning: A Laboratory Manual. 3rd Edition, Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y. 2001). Рестрикционные фрагменты ДНК анализировали с помощью электрофореза на агарозных гелях и очищали с помощью набора Plasmid plus Midi Kit (QIAGEN, Cat # 12945)
Конструкция p44/45d46Sfi
Основываясь на информации о гомологе gC (gCh) гена MDV серотип 1 (Coussens et al., J. Virol. 62:2373-2379, 1988) и о прилегающем к нему фрагменте BamHI-B (Японская нерассмотренная патентная публикация No. H6-292583), ДНК-фрагмент, имеющий сайт SfiI между двумя ORF UL44h и UL45h, получали с помощью ПЦР и клонировали в pUC18. Сначала, ДНК HVT получали из клеток CEF, инфицированных штаммом HVT FC126 в соответствии со способом, предложенным Lee et al. (J. Gen. Virol., 51 : 245-253, 1980). Применяя полученные HVT ДНК в качестве матрицы, проводили ПЦР с двумя парами праймеров.
Первая пара представляла собой SEQ NO: 7 (5’-CCCCGAATTCATGGAAGAAATTTCC-3’) и SEQ NO: 8 (5’-CGCGGGCCAATAAGGCCAACATCGGGACGTACATC-3’).
Вторая пара представляла собой SEQ NO: 9 (5’-GCGCGGCCTTATTGGCCTTAAATACCGCGTTTGGAG-3’) и SEQ NO: 10 (5’-CCCCAAGCTTTCAAGTGATACTGCGTGA-3’).
Применяя смесь двух полученных продуктов ПЦР в качестве матрицы, проводили еще одну ПЦР с SEQ NO.7 и SEQ NO.10 для создания фрагмента, имеющего сайт SfiI между двумя ORF, UL44h и UL45h.
Полученный фрагмент затем расщепляли в присутствии EcoRI и HindIII и лигировали с pUC18, который был расщеплен с помощью EcoRI и HindIII. Полученную плазмиду обозначили как p44/45Sfi.
Для конструкции двойного рекомбинантного HVT, в котором два гена были встроены в UL44/45 и UL45/46, соответственно, ген UL46 удаляли из p44/45Sfi. p45/46Sfi (US 7569365), расщепленный с помощью EcoRI и SfiI, лигировали с линкером dSfiI-EcoRI, и получали плазмиду p44/45d46. p44/45Sfi, расщепленный с помощью SphI и PstI, лигировали с p44/45d46, расщепленным с помощью тех же ферментов, и получали плазмиду p44/45d46Sfi.
Конструкция pHVT 87-88
HVT ДНК получали из клеток CEF, инфицированных штаммом HVT FC126 в соответствии со способом, предложенным Lee et al. (J. Gen. Virol., 51 : 245-253, 1980). Применяя полученную ДНК HVT в качестве матрицы, проводили ПЦР с двумя парами праймеров. Каждый праймер разрабатывали, основываясь на информации, полученной в Genbank X68653.1. ДНК-фрагмент, имеющий сайт SfiI между двумя ORF, US2 (HVT088) и SORF3 (HVT087), получали с помощью ПЦР и клонировали в pUC18.
Первая пара представляла собой SEQ NO.11 (5’-GGGAATTCGAAGAGCCCCCGCGGACGCATG-3’) и SEQ NO. 125’-CCGCTAGCGGCCGCAAGTTCCTTCACCATGACCAG-3’)
Вторая пара представляла собой SEQ NO.13 (5’-GCGGCCGCTAGCGGCCTTATTGGCCGTAGCATAAAGACGCAGG-3’) и SEQ NO.14 (5’-CCAAGCTTCTAGTACATATATATACATGAC-3’)
Первый полученный фрагмент расщепляли с помощью EcoRI и NheI. Второй полученный фрагмент расщепляли с помощью NheI и HindIII. Данные расщепленные фрагменты встраивали в pUC18, расщепленную с помощью EcoRI и HindIII, и получали плазмиду pHVT 87-88.
Конструкция pHVT 86-87
ДНК HVT получали из клеток CEF, инфицированных штаммом HVT FC126 в соответствии со способом Lee et al. (J. Gen. Virol., 51 : 245-253, 1980). Применяя полученную ДНК HVT в качестве матрицы, проводили ПЦР с два парами праймеров. Каждый праймер разрабатывали, основываясь на информации, полученной в Genbank X68653,1. ДНК-фрагмент, имеющий сайт SfiI между двумя ORF, US10 (HVT086) и SORF3 (HVT087), получали с помощью ПЦР и клонировали в pUC18.
Первая пара представляла собой SEQ NO.15 (5’-GGGGGAATTCATTATCCCATCTAACAGTTATATACG-3’) и SEQ NO.16 (5’-GCCGCTAGCGGCCGCCTTTATTAACAACCTTAC-3’)
Вторая пара представляла собой SEQ NO.17 (5’-GCGGCCGCTAGCGGCCTTATTGGCC GTTTATTCTATGTAAGAC-3’) и SEQ NO.18 (5’-CCCAAGCTTAAGTTCCTTCACCATG-3’)
Первый полученный фрагмент расщепляли с помощью EcoRI и NheI. Второй полученный фрагмент расщепляли с помощью NheI и HindIII. Данные расщепленные фрагменты встраивали в pUC18, расщепленную с помощью EcoRI и HindIII, и получали плазмиду pHVT 86-87.
Конструкция гомологичного вектора
Химически синтезированный промотор Mcmv ie1
Промотор Mcmv ie1 (SEQ NO.19) синтезировали, основываясь на информации о 41884191-4731 п.о., Gene Bank L06816.1, предоставленной Koszinowski, U. H. Синтезированный промотор Mcmv ie1 был разработан так, чтобы сайты BglI-PstI были добавлены перед ним и XbaI-NotI сайты были добавлены на конце.
SEQ NO.19: GGCCAATAAG GCTGCAGTAC TGAGTCATTA GGGACTTTCC AATGGGTTTT GCCCAGTACA TAAGGTCAAT AGGGGTGAAT CAACAGGAAA GTCCCATTGG AGCCAAGTAC ACTGAGTCAA TAGGGACTTT CCATTGGGTT TTGCCCAGTA CAAAAGGTCA ATAGGGGGTG AGTCAATGGG TTTTTCCCAT TATTGGCACG TACATAAGGT CAATAGGGGT GAGTCATTGG GTTTTTCCAG CCAATTTAAT TAAAACGCCA TGTACTTTCC CACCATTGAC GTCAATGGGC TATTGAAACT AATGCAACGT GACCTTTAAA CGGTACTTTC CCATAGCTGA TTAATGGGAA AGTACCGTTC TCGAGCCAAT ACACGTCAAT GGGAAGTGAA AGGGCAGCCA AAACGTAACA CCGCCCCGGT TTTCCCCTGG AAATTCCATA TTGGCACGCA TTCTATTGGC TGAGCTGCGT TCTACGTGGG TATAAGAGGC GCGACCAGCG TCGGTACCGT CGCAGTCTTC GGTCTGACCA CCGTAGAACG CAGAGCTCCT CGCTGCAGGC GGCCGCTCTA GA
Конструкция p44/45 Mcmv ie1 VP2 SPA
p44-45d46Sfi с расщепленным SfiI дефосфорилировали с помощью щелочной фосфатазы рекомбинанта S1B1 Shewanella sp. (PAP) (Funakoshi #DE110). Фрагмент лигировали с p45/46BacVP2 с расщепленным BglI, получали плазмиду p44/45d46 BacVP2. Синтезированный промотор Mcmv ie1 (BglI/XbaI) лигировали с p44/45d46 BacVP2, расщепленным с помощью EcoRV и XbaI, и p44/45d46 Bac VP2 расщепляли с помощью EcoRV и BglI, и получали p44/45d46 Mcmv ie1 VP2. Короткую синтезированную полиA сигнальную последовательность (SPA: SEQ NO.20 CTGCAGGCGGCCGCTCTAGAGTCGACAATAAAAGATCTTTATTTTCATTAGATCTGTGTGTTGGTTTTTTGTGTGGCCAATAAGGCC) интегрировали в p44/45d46 Mcmv ie1 VP2, расщепленный по SalI и SfiI, и получали гомологичную плазмиду p44/45d46 Mcmv ie1 VP2 SPA
Эксперимент 2: Очистка рекомбинантного HVT в CEF, трансфицированных каждым вектором переноса
Вирусную ДНК HVT дикого типа, штамм FC126 (wt-HVT) получали, как описано в работе Morgan et al. (Avian Diseases, 34:345-351, 1990). Вирусные ДНК FW029 (rHVT/45-46PecF) и FW023 (rHVT/45-46BacVP2) получали аналогичным способом. Первый двойной образец rHVT был таким, что клетки CEF трансфицировали полученной wt-HVT ДНК и p45/46sv40VP2 PecF (ex. FW137). Второй образец был таким, что клетки CEF трансфицировали полученной FW029 ДНК и p44/45 Mcmv ie1 VP2 (ex. FW141). Третий образец был таким, что клетки CEF трансфицировали полученной FW023 ДНК и p44/45 Mcmv ie1 F (ex. FW142). Четвертый образец был таким, что CEF трансфицировали полученной FW029 ДНК и pHVT87-88Bac VP (ex. FW144). Пятый образец был таким, что CEF трансфицировали полученной FW023 и pHVT87-88Pec F (ex. FW145). Данные полученные рекомбинантные вирусы очищали из бляшек путем окрашивания бляшек антителами против NDV-F и антителами против IBDV-VP2.
Коротко, 107 первичных клеток CEF суспендировали в 100 мкл MEF-1 (Lonza LNJVD-1004) и путем электропорации проводили совместную трансфекцию 1 мкг гомологичного вектора, например, p44/45 Mcmv ie1 F и pHVT Bac VP2, и 2 мкг ДНК HVT, например, FC126, FW029 и FW023. Электропорацию проводили с помощью «Nucleofector II». Трансфицированные клетки разводили в 20 мл среды Лейбовица L-15 (GIBCO BRL, Cat. #41300-39), среды МакКоя 5A (GIBCO BRL, Cat. #21500-061) (1:1) и 4% телячьей сыворотки (обозначают как раствор среды LM (+)), распределяли по 100 мкл на лунку в 96-луночном планшете.
Инкубировали при 37°C в 5%-ном CO2 пока бляшки не становились видимыми, клетки отделяли от планшета трипсинизацией, разводили в свежеприготовленных вторичных клетках CEF, переносили в равных объемах на два 96-луночных планшета и инкубировали в течение 3-х дней для визуализации бляшек. Затем один из двух планшетов окрашивали моноклональными антителами R63 против VP2 (ATCC #: HB-9490) в качестве первичных антител. После детекции лунки, содержавшей окрашенные рекомбинантные бляшки, клетки из соответствующей лунки другого планшета извлекали, разводили в свежих вторичных клетках CEF и переносили в равных объемах в два 96-луночных планшета для завершения первого раунда очистки. Процедуру очистки повторяли до тех пор, пока каждая из полученных бляшек не окрашивалась положительно моноклональными антителами R63. После этого, двойного rHVT-кандидата красили антителами 3-1G/5 против NDV-F (Morrison, T. G., Proc. Natl. Acad. Sci. U.S.A. 84: 1020-1024, 1987) или кроличьей сывороткой против F. Наконец, экспрессию белков из каждой бляшки кандидата rHVT подтверждали двойным IFA-окрашиванием. CEF, инфицированные каждым rHVT, фиксировали холодным ацетоном-метанолом (2:1), промывали PBS, прореагировавшим со смесью антител (разведение 1:1000 анти-F кроличья сыворотка #35 и анти-VP2 мышиные Mab R63) при 37ºС в течение 60 минут. После 3-кратного промывания с PBS, клетки взаимодействовали со смесью люминесцентных антител (разведение 1:1000 меченные Alexa Fluor488 антитела к кроличьим иммуноглобулинам и меченные Alexa Fluor488 антитела к мышиным иммуноглобулинам, поставляемые компанией «Invitrogen») при 37ºС в течение 60-ти минут. После 3-кратного промывания с PBS, их наблюдали с помощью флуоресцентного микроскопа при 400-кратном увеличении.
Экспрессию белка VP2 детектировали с помощью Mab (R63) против VP2 и Alexa Flour 546. Экспрессию белка F детектировали с помощью кроличьей сыворотки против F #35 и Alexa Flour 488. Если все бляшки экспрессировали как F, так и VP2, то мы заключали, что очистка завершена. На фигуре 3 приведены некоторые примеры двойных IFA.
Очищенный рекомбинантный HVT обозначали как rHVT/ND/IBD.
Приведенная ниже таблица 1 показывает экспрессию VP2 и белка F, полученных из разных rHVT/ND/IBD. Штамм FW023 (HVT/45-46 Bac VP2) соответствует моновалентному рекомбинантному вирусу герпеса, примененному в качестве контроля экспрессии VP2, и FW029 (HVT/45-46 PecF) соответствует моновалентному рекомбинантному вирусу герпеса, примененному в качестве контроля экспрессии белка F.
Таблица 1. Экспрессия встроенных генов NDV-F и IBDV-VP2 с помощью rHVT/ND/IBD (детекция флуоресценции)
+: детектируется, +w; слабо детектируется, -: не детектируется
Эксперимент 3: Совместная экспрессия двух белков в CEF, инфицированных двойным рекомбинантным HVT
Клетки CEF, 2X105 в 2-х мл, инфицировали рекомбинантным HVT и инкубировали при 37°C в 5%-ном CO2 в течение 3-х дней.
Затем культуру центрифугировали при 300 g в течение 3-х минут, и выпавшие в осадок клетки ресуспендировали в 100 мкл. К суспензии клеток добавляли буфер Лэммли (100 мкл). Затем полученную смесь кипятили в течение 5-ти мин, и из них 5 мкл анализировали с помощью электрофореза в 10%-ном SDS-полиакриламидном геле. Разделенные электрофорезом белки переносили с SDS-GEL на PVDF-мембрану (Immobilon-P, Millipore), которую блокировали в 1%-ном масс./об. сухом обезжиренном молоке в PBS при комнатной температуре в течение одного часа.
Для детекции F (фигура 4A), обработанную мембрану затем обрабатывали анти-F кроличьей антисывороткой #35 в 500-кратном разведении при комнатной температуре в течение одного часа, промывали три раза PBS, и инкубировали в течение одного часа с биотинилированными козьими антителами к иммуноглобулинам кролика.
Для детекции VP2 (фигура 4B), обработанную мембрану затем обрабатывали анти-VP2 Mab R63 в 500-кратном разведении при комнатной температуре в течение одного часа, промывали три раза PBS, и инкубировали в течение одного часа с биотинилированными козьими антителами к иммуноглобулинам мыши.
После промывания три раза в PBS, мембрану инкубировали в течение одного часа с комплексом авидин-щелочная фосфатаза, промывали три раза PBS и один раз TBS (Трис-солевой буфер), и обрабатывали BCIP-NBT(субстрат щелочной фосфатазы.) Как показано на фигуре 4A, полосу белка 60 килодальтон (кДа) наблюдали только на дорожке с клетками, инфицированными rHVT/ND/IBD, что представляло собой ожидаемый размер белка F  . На дорожке rHVT/44-45BacVP2 (FW123) полосы не было.
. На дорожке rHVT/44-45BacVP2 (FW123) полосы не было.
Фигура 3B показывает, что белок VP2 наблюдали в районе 38-килодальтон (kd) на дорожках с каждым rHVT/ND/IBD  . Напротив, на дорожке rHVT/PecF (FW029) полосы не было (Фиг. 1 B). 38-kd белок представляет собой зрелый белок VP2 (A. A. Azad et al., 1987, Virol. 161:145-152, K. J., Fahey et al., 1985 J. Gen. Virol. 66:1479-1488).
. Напротив, на дорожке rHVT/PecF (FW029) полосы не было (Фиг. 1 B). 38-kd белок представляет собой зрелый белок VP2 (A. A. Azad et al., 1987, Virol. 161:145-152, K. J., Fahey et al., 1985 J. Gen. Virol. 66:1479-1488).
Двойной рекомбинантный HVT в соответствии с изобретением экспрессировал как NDV-F, так и IBDV VP2.
Эксперимент 4: Проверка геномной структуры
Саузерн-блоттинг анализ
Очищенный rHVT/ND/IBD размножали на клетках CEF в одном 25-см2 флаконе для получения конфлюэнтных бляшек. Клетки извлекали из чашек соскабливанием, переносили в пробирки Falcon и центрифугировали при 300 x g в течение 5-ти мин. Собранные клетки промывали PBS, ресуспнендировали в 0,6 мл PBS и 0,4 мл буфера для лизиса (1,25% TritonX-100, 250 мМ 2-ME, и 50 мМ ЭДТА в PBS), и лизировали на вортексе в течение 3-х мин. Затем лизаты центрифугировали при 600 x g в течение 5-ти мин при комнатной температуре и супернатанты переносили в 15 мл пробирки Falcon. Вирусы собирали центрифугированием при 20400 x g в течение 20 мин. Полученные осадки затем центрифугировали в 0,33 мл раствора нуклеазы (12,5 мМ Трис-Cl (pH7,5), 1 мкг/мл ДНКазы I и 1 мкг/мл РНКазы A), инкубировали при 37°C в течение 30 мин, и разрушали путем инкубации при 55°C в течение 30 мин с 83 мкл раствора SDS-протеазы (50 мМ ЭДТА, 5% SDS, 0,5 мг/мл протеазы K, и 28,5 мМ 2-меркаптоэтанол). Полученную смесь обрабатывали дважды фенол-хлороформом, и к водной фазе добавляли NaCl в конечной концентрации, равной 0,2 M. Вирусную ДНК осаждали добавлением 2,5 объемов ледяного этанола, промывали 70%-ным этанолом и центрифугировали при 20400 x g в течение 20 мин при 4°C. После сушки на воздухе, осадки растворяли в буфере TE (10 мМ Трис-Cl (pH8,0), 1 мМ ЭДТА).
Вирусную ДНК в TE буфер расщепляли с помощью XhoI, SphI и SmaI, и разделяли с помощью электрофореза в 0,8%-ном агарозном геле. Разделенные с помощью электрофореза на одиночном геле фрагменты ДНК переносили одновременно на две нейлоновые мембраны (Molecular Cloning: A Laboratory Manual, third edition, 6,35, Sambrook, J., и Russell, D.W. Cold Spring Harbor Laboratory). После фиксирования ДНК с помощью термообработки, иммобилизованную ДНК гибридизовали с DIG-меченным зондом, «VP2-зондом» или «IS44/45-зондом», которые получали с помощью набора для синтеза DIG-меченных ПЦР-зондов (ROCHE DIAGNOSTICS, Cat. #1636090). Кроме того, вирусную ДНК в TE буфере расщепляли с помощью XhoI и SphI, и гибридизовали с DIG-меченным зондом, «F-зондом», «IS45/46-зондом» с помощью той же указанной выше методики. VP2 зонд получали с VP2 STC-F (SEQ ID NO.21) и VP2 STC-R (SEQ ID NO.22) в качестве праймеров и p45/46bacVP2-STC в качестве матрицы. F-зонд получали с F-F (SEQ ID NO.23) и F-R (SEQ ID NO.24) в качестве праймеров и p45/46PecF в качестве матрицы. IS45/46-зонд получали с 45/46-F (SEQ ID NO.25) и 45/46-R (SEQ ID NO.26) в качестве праймеров и pNZ45/46Sfi в качестве матрицы. IS44/45-зонд получали с 44/45-F (SEQ ID NO.27) и 44/45-R (SEQ ID NO.28) в качестве праймеров и pNZ44/45d46Sfi в качестве матрицы.
VP2 STC-F (SEQ ID NO.21) 5’-CACCGTCCTCAGCTTACCCACATC-3’
VP2 STC-R (SEQ ID NO.22) 5’-ACGACGGATCCTGTTGCCACTCT-3’
NDV-F-F (SEQ ID NO.23) 5’-CTAGCAGTGGCAGTTGGGAAGAT-3’
NDV-F-R (SEQ ID NO.24) 5’-GTTAAGGCAGGGGAAGTGATTTGT-3’
45/46-F (SEQ ID NO.25) 5’-GGGGAAGTCTTCCGGTTAAGGGAC-3’
45/46-R (SEQ ID NO.26) 5’-GGTGCAATTCGTAAGACCGATGGG-3’
44/45-F (SEQ ID NO.27) 5’-GTACTATAGAATGTGTTCC-3’
44/45-R (SEQ ID NO.28) 5’-GTATCCAACGCCTCAAGATC-3’
Результаты саузерн-блоттинга показали (фигуры 5A-5D), что 2077-п.о. фрагмент гибридизовался с зондом VP2 в ДНК из FW129. Напротив, никакой полосы не детектировали с p45/46Pec F.
Кроме того 2744-п.о. фрагмент гибридизовался с F-зондом в ДНК из каждого двойного рекомбинантного HVT. Никакой полосы не обнаружили в p45/46 SfiI.
2077-п.о. и 1228-п.о. фрагменты к IS44/45-зонду в ДНК из FW129. 1350-п.о. фрагмент к IS44/45-зонду в p45/46 PecF, который не был вставлен в ген в сайте IS44/45.
2744-п.о. и 770-п.о. фрагменты к IS45/46-зонду в ДНК каждого двойного рекомбинантного HVT. Фигура 5A-5D показывает, что полученные двойные рекомбинанты HVT/ND/IBD обладали ожидаемой геномной структурой.
Эксперимент 5: Стабильность рекомбинантного HVT при пассаже
Вестерн-блоттинг анализ
Двойной рекомбинантный HVT серийно пассировали (вплоть до 15 раз) на фибробластах куриных эмбрионов (CEF). Затем клеточные лизаты наносили на вестерн-блоттинг анализ. На первой панели (фигура 6A), блот прореагировал с анти-F кроличьей сывороткой (#35). На второй панели (фигура 6B) блот прореагировал с анти-VP2 Mab (R63). Контроль: неинфицированные CEF
M: Белки-стандарты (Precision Plus Protein Standards Bio Rad #161-0374)
После 15-ти пассажей, F и VP2 стабильно экспрессируются в CEF, инфицированных двойным рекомбинантным HVT. Однако FW137 не экспрессировал сигнал антигенов F и VP2 после 15-ти пассажей, указывая на то, что рекомбинантный HVT, имевший два гена в одном сайт был нестабильным.
Саузерн-блоттинг анализ
M: Маркер молекулярных масс, HindIII гидролизат фага лямбда
TP-24: перенос плазмиды p44-45d46SV40VP2
TP-25: перенос плазмиды p44-45d46RsvVP2
Каждого rHVT/ND/IBD пассировали пятнадцать раз в клетках CEF и анализировали методом саузерн-блотинга, как описано в эксперименте 4. Результаты были аналогичны результатам, полученным в эксперименте 4, что указывает на стабильность рекомбинантного вируса даже после 15-ти пассажей.
Результаты саузерн-блоттинга, приведенные на фигуре 7A показали, что 2077-п.о. фрагмент гибридизовался с зондом VP2 в ДНК из FW129. 2334-п.о. фрагмент гибридизовался с зондом VP2 в ДНК из FW130. Напротив, никакой полосы не детектировали с p45/46Pec F.
Фигура 7C показывает, что 2744-п.о. фрагмент гибридизовался с F-зондом в ДНК из каждого двойного рекомбинантного HVT. В p45/46 SfiI никакой полосы не обнаружили.
Фигура 7B показывает, что 2077-п.о. и 1228-п.о. фрагменты гибридизовались с зондом IS44/45 в ДНК из FW129, и 2334-п.о. и 1022-п.о. фрагменты гибридизовались с зондом IS44/45 в ДНК из FW130. 1350-п.о. фрагмент гибридизовался с зондом IS44/45 в p45/46 PecF, которая не содержала гена в сайте IS44/45.
Фигура 7D показывает, что 2744-п.о. и 770-п.о. фрагменты гибридизовались с IS45/46 зондом в ДНК каждого двойного рекомбинантного HVT.
Саузерн-блот с зондом 44/45 и зондом 45/46 показал, что ген VP2 или ген F стабильно поддерживается в сайте встраивания 44/45 или 45/46, соответственно, в FW129 и FW130.
Эксперимент 6: Полученный способом ELISA титр антител против NDV и IBDV в цыплятах, инокулированных двойным рекомбинантным HVT
По 3000 БОЕ/200 мкл/птицу каждой rHVT/ND/IBD инокулировали подкожно в спины десяти однодневных цыплят SPF (LineM, Биологические лаборатории Японии) с помощью шприца 20 Gauge. Через три недели после вакцинации, собирали сыворотку от вакцинированных птиц. Определяли титр антител к NDV с помощью коммерческого набора ELISA (IDEXX, набор ELISA для диагностики болезни Ньюкасла). Антитела к IBDV титровали с помощью коммерческого набора ELISA, тест-наборов для поголовной проверки наличия антител к вирусу инфекционного бурсита (IDEXX Laboratory, Inc.). Цыплятам из группы отрицательного контроля (неиммунизированным) не вводили никакой вакцины.
Фигура 8A показывает изменение титра к NDV. Фигура 8B показывает изменение титра к IBDV.
Двойной рекомбинантный HVT с двумя сайтами стабильно индуцировал как анти-NDV, так и анти-IBDV титры.
Эксперимент 7: Эффективность rHVT/ND/IBD против NDV в цыплятах SPF
Эффективность rHVT/ND/IBD (FW130, FW135, FW137, FW129) в качестве ND-вакцины оценивали, применяя тест на эффективность в качестве вакцины против болезни Ньюкасла.
3000 БОЕ/200 мкл/птицу rHVT/ND инокулировали подкожно в спины десяти однодневным цыплятам SPF (LineM, Биологические лаборатории Японии), применяя шприц 20Gauge. Через три недели после вакцинации собирали сыворотку от вакцинированных птиц и определяли титр антител к NDV с помощью коммерческого набора ELISA (IDEXX, ELISA-набор для диагностики болезни Ньюкасла).
Цыплят в группе положительного контроля вакцинировали в 14-дневном возрасте коммерческой живой вакциной NDV в соответствии с рекомендацией поставщика. Цыплятам из группы отрицательного контроля не вводили никакой вакцины.
В возрасте 43 дней (на 42 день после вакцинации), цыплят всех семи групп подвергали заражению 103EID50 из NDV-TexasGB, стандартный штамм для экспериментального заражения в Соединенных Штатах, путем внутримышечного введения в бедренную область. Зараженных цыплят наблюдали ежедневно для контроля смертности и для обнаружения любых симптомов болезни Ньюкасла.
Таблица 2. Экспериментальное заражение rHVT/ND/IBD-вакцинированных цыплят SPF вирулентным NDV
(БОЕ/
цыпленок)
(%)
Как показано в таблице 2, цыплят вакцинированные rHVT/ND/IBD изобретения, не демонстрируют никаких клинических признаков, и титр ELISA в день проведения экспериментального заражения был значительно повышен. Как ожидали, цыплята, вакцинированные как FW137 (в котором две рекомбинантные нуклеотидные последовательности встраивают в тот же сайт встраивания), так и FW135 (в котором Bac-промотор встроен между UL44 и UL45), продемонстрировали клинические признаки, и титр ELISA был низким.
Эксперимент 8: Эффективность rHVT/ND/IBD против IBDV в цыплятах SPF
Эффективность FW129 и FW141 (HVT/45-46 PecF/44-45 Mcmv ie1VP2) в качестве вакцины от IBD оценивали экспериментального заражения IBDV STC.
Исходно, 2000 БОЕ rHVT/ND/IBD инокулировали в SPF из оплодотворённого куриного яйца на день 18 или подкожно в спины однодневных цыплят SPF. В возрасте трех недель, вакцинированных цыплят экспериментально перорально заражали 103,5EID50/птицу из IBDV STC. Через одну неделю, всех цыплят взвешивали и вскрывали для извлечения фабрициевой сумки, которую осматривали для обнаружения любых патологических изменений, вызванных инфекционным бурситом.
Защиту оценивали по двум следующим критериям. (1) Отношение массы сумки к массе тушки (индекс B/B) статистически не отличался от этого отношения для невакцинированных, незараженных цыплят. (2) Не наблюдали таких пороков развития фабрициевой сумки, как отечность, кровоизлияние, желтоватый экссудат, обесцвечивание, атрофия или студенистый экссудат. Результаты суммированы в таблице 3.
Таблица 3. Экспериментальное заражение rHVT/ND/IBD-вакцинированных цыплят SPF вирулентным IBDV
Более чем 80% всех вакцинированных цыплят были защищены от заражения штаммом IBDV STC, что указывает на способность rHVT/ND/IBD индуцировать защитный иммунитет у цыплят против вирулентного IBDV.
Эксперимент 9: Исследования по заражению IBDV на 8 неделе у MDA+ цыплят
Группы:
G1: NINC (невакцинированные, не зараженные)
G2: NICC (невакцинированные, зараженные)
G3: FW141
G4: FW144
G5: FW 023 (положительный контроль)
Цыплята
MDA+ птицы (несушки), 16-17 птица/группа в каждой группе.
Три тысячи БОЕ вакцин инокулировали подкожно в спины 16-17 однодневных MDA+ цыплят. В возрасте 8-ми недель вакцинированных цыплят экспериментально заражали перорально 103 TCID50/птицу из IBDV STC. Через одну неделю, всех цыплят взвешивали и вскрывали для извлечения фабрициевой сумки, которую осматривали для обнаружения любых повреждений, вызванных инфекционным бурситом.
Защиту оценивали по двум следующим критериям. (1) Отношение массы сумки к массе тушки (индекс B/B). (2) Не наблюдали таких пороков развития фабрициевой сумки, как отечность, кровоизлияние, желтоватый экссудат, обесцвечивание, атрофия или студенистый экссудат. Результаты суммированы в нижеследующей таблице 4.
Таблица 4
Данные результаты показали, что мультивалентная вакцина изобретения вызывает эффективную защиту in vivo против IBDV.
Эксперимент 10: Исследования по заражению NDV на 8-ой неделе у MDA+ цыплят
Группа
G1: контроль заражения
G2: FW141
G3: FW144
G4: FW145
G5: FW 029 (положительный контроль)
Цыплята
MDA+ птицы (несушки), 17 птиц/группа в каждой группе.
Три тысячи БОЕ вакцин инокулировали подкожно в спины 17 однодневных MDA+ цыплят. В возрасте 8-ми недель вакцинированных цыплят экспериментально заражали 103 EID50 из NDV-TexasGB, стандартный штамм для экспериментального заражения в Соединенных Штатах, путем внутримышечного введения в бедренную область. Зараженных цыплят наблюдали ежедневно для контроля смертности и для обнаружения любых симптомов болезни Ньюкасла. Результаты представлены в таблице 5 ниже.
Таблица 5
* некоторые симптомы NDV, не приводящие к падежу
Данные результаты показали, что мультивалентная вакцина изобретения приводит к эффективной защите in vivo против NDV и IBDV. Защита была сильной и стабильной.
--->
SEQUENCE LISTING
<110> CEVA SANTE ANIMALE
<120> Multivalent recombinant avian herpes viruses and vaccines for
immunizing avian species
<130> B1326PC00
<160> 28
<170> PatentIn version 3.5
<210> 1
<211> 1506
<212> DNA
<213> artificial
<220>
<223> Bac promoter
<400> 1
tgcagctcag tgcatgcacg ctcattgccc atcgctatcc ctgcctctcc tgctggcgct 60
ccccgggagg tgacttcaag gggaccgcag gaccacctcg ggggtggggg gagggctgca 120
cacgcggacc ccgctccccc tccccaacaa agcactgtgg aatcaaaaag gggggagggg 180
ggatggaggg gcgcgtcaca cccccgcccc acaccctcac ctcgaggtga gccccacgtt 240
ctgcttcact ctccccatct cccccccctc cccaccccca attttgtatt tatttatttt 300
ttaattattt tgtgcagcga tgggggcggg gggggggggg gcgcgcgcca ggcggggcgg 360
ggcggggcca ggggcggggc ggggcgaggc ggagaggtgc ggcggcagcc aatcagagcg 420
gcgcgctccg aaagtttcct tttatggcga ggcggcggcg gcggcggccc tataaaaagc 480
gaagcgcgcg gcgggcggga gtcgctgcgc gctgccttcg ccccgtgccc cgctccgccg 540
ccgcctcgcg ccgcccgccc cggctctgac tgaccgcgtt actcccacag gtgagcgggc 600
gggacggccc ttctcctccg ggctgtaatt agcgcttggt ttaatgacgg ctcgtttctt 660
ttctgtggct gcgtgaaagc cttaaagggc tccgggaggg ccctttgtgc gggggggagc 720
ggctcggggg gtgcgtgcgt gtgtgtgtgc gtggggagcg ccgcgtgcgg ctccgcgctg 780
cccggcggct gtgagcgctg cgggcgcggc gcggggcttt gtgcgctccg cagtgtgcgc 840
gaggggagcg cggccggggg cggtgccccg cggtgcgggg ggggctgcga ggggaacaaa 900
ggctgcgtgc ggggtgtgtg cgtggggggg tgagcagggg gtgtgggcgc ggcggtcggg 960
ctgtaacccc cccctgcacc cccctccccg aagttgctga gcacggcccg gcttcgggtg 1020
cggggctccg tgcggggcgt ggcgcggggc tcgccgtgcc gggcgggggg tggcggcagg 1080
tgggggtgcc gggcggggcg gggccgcctc gggccgggga gggctcgggg gaggggcgcg 1140
gcggcccccg gagcgccggc ggctgtcgag gcgcggcgag ccgcagccat tgccttttat 1200
ggtaatcgtg cgagagggcg cagggacttc ctttgtccca aatctgtgcg gagccgaaat 1260
ctgggaggcg ccgccgcacc ccctctagcg ggcgcggggc gaagcggtgc ggcgccggca 1320
ggaaggaaat gggcggggag ggccttcgtg cgtcgccgcg ccgccgtccc cttctccatc 1380
tccagcctcg gggctgtccg cagggggacg gctgccttcg ggggggacgg ggcagggcgg 1440
ggttcggctt ctggcgtgtg accggcgggg tttatatctt cccttctctg ttcctccgca 1500
gccccc 1506
<210> 2
<211> 557
<212> DNA
<213> artificial
<220>
<223> Pec promoter
<400> 2
tgcagagtta ttaatagtaa tcaattacgg ggtcattagt tcatagccca tatatggagy 60
tccgcgttac ataacttacg gtaaatggcc cgccggctga ccgcccaacg acccccgccc 120
attgacgtca ataatgacgt atgytcccat agtaacgcca atagggactt tccattgacg 180
tcaatgggtg gagtayttac ggtaaactgc ccattggcag tacatcaagt gtatcatatg 240
ccaagtacgc cccctattga cgtcaatgac ggtaaatgga tgcagtattt tgtgcagcga 300
tgggggcggg gggggggggc gcgcgccagg cggggcgggg cggggcgagg ggcggggcgg 360
ggcgaggcgg agaggtgcgg cggcagccaa tcagagcggc gcgctccgaa agtttccttt 420
tatggcgagg cggcggcggc ggcggcccta taaaaagcga agcgcgcggc gggcgggagt 480
cgctgcgcgc tgccttcgcc ccgtgccccg ctccgccgcc gcctcgcgcc gcccgccccg 540
gctctgactg accgcgt 557
<210> 3
<211> 541
<212> DNA
<213> artificial
<220>
<223> Mcmv ie1 promoter
<400> 3
tactgagtca ttagggactt tccaatgggt tttgcccagt acataaggtc aataggggtg 60
aatcaacagg aaagtcccat tggagccaag tacactgagt caatagggac tttccattgg 120
gttttgccca gtacaaaagg tcaatagggg gtgagtcaat gggtttttcc cattattggc 180
acgtacataa ggtcaatagg ggtgagtcat tgggtttttc cagccaattt aattaaaacg 240
ccatgtactt tcccaccatt gacgtcaatg ggctattgaa actaatgcaa cgtgaccttt 300
aaacggtact ttcccatagc tgattaatgg gaaagtaccg ttctcgagcc aatacacgtc 360
aatgggaagt gaaagggcag ccaaaacgta acaccgcccc ggttttcccc tggaaattcc 420
atattggcac gcattctatt ggctgagctg cgttctacgt gggtataaga ggcgcgacca 480
gcgtcggtac cgtcgcagtc ttcggtctga ccaccgtaga acgcagagct cctcgctgca 540
g 541
<210> 4
<211> 589
<212> DNA
<213> artificial
<220>
<223> Hcmv promoter
<400> 4
gagttattaa tagtaatcaa ttacggggtc attagttcat agcccatata tggagttccg 60
cgttacataa cttacggtaa atggcccgcc ggctgaccgc ccaacgaccc ccgcccattg 120
acgtcaataa tgacgtatgt tcccatagta acgccaatag ggactttcca ttgacgtcaa 180
tgggtggagt atttacggta aactgcccat tggcagtaca tcaagtgtat catatgccaa 240
gtacgccccc tattgacgtc aatgacggta aatggcgcgc ctggcattat gcccagtaca 300
tgaccttatg ggactttcct acttggcagt acatctacgt attagtcatc gctattacca 360
tggtgatgcg gttttggcag tacatcaatg ggcgtggata gcggtttgac tcacggggat 420
ttccaagtct ccaccccatt gacgtcaatg ggagtttgtt ttggcaccaa aatcaacggg 480
actttccaaa atgtcgtaac aactccgccc cattgacgca aatgggcggt aggcgtgtac 540
ggtgggaggt ctatataagc agagctggtt tagtgaaccg tcagatcct 589
<210> 5
<211> 646
<212> DNA
<213> artificial
<220>
<223> SV40 promoter
<400> 5
gcgcagcacc atggcctgaa ataacctctg aaagaggaac ttggttaggt accttctgag 60
gcggaaagaa ccagctgtgg aatgtgtgtc agttagggtg tggaaagtcc ccaggctccc 120
cagcaggcag aagtatgcaa agcatgcatc tcaattagtc agcaaccagg tgtggaaagt 180
ccccaggctc cccagcaggc agaagtatgc aaagcatgca tctcaattag tcagcaacca 240
tagtcccgcc cctaactccg cccatcccgc ccctaactcc gcccagttcc gcccattctc 300
cgccccatgg ctgactaatt ttttttattt atgcagaggc cgaccgcctc ggcctctgag 360
ctattccaga agtagtgagg aggctttttt ggaggcctag gcttttgcaa aaagcttgat 420
tcttctgaca caacagtctc gaacttaagc cgcagaagtt ggtcgtgagg cactgggcag 480
gtaagtatca aggttacaag acaggtttaa ggagaccaat agaaactggg cttgtcgaga 540
cagagaagac tcttgcgttt ctgataggca cctattggtc ttactgacat ccactttgcc 600
tttctctcca caggtgtcca ctccagttca attacagctc ttaagg 646
<210> 6
<211> 534
<212> DNA
<213> artificial
<220>
<223> RSV promoter
<400> 6
tgcatctgct ccctgcttgt gtgttggagg tcgctgagta gtgcgcgagc aaaatttaag 60
ctacaacaag gcaaggcttg accgacaatt gcatgaagaa tctgcttagg gttaggcgtt 120
ttgcgctgct tcgcgatgta cgggccagat atacgcgtat ctgaggggac tagggtgtgt 180
ttaggcgaaa agcggggctt cggttgtacg cggttaggag tcccctcagg atatagtagt 240
ttcgcttttg catagggagg gggaaatgta gtcttatgca atactcttgt agtcttgcaa 300
catggtaacg atgagttagc aacatgcctt acaaggagag aaaaagcacc gtgcatgccg 360
attggtggaa gtaaggtggt acgatcgtgc cttattagga aggcaacaga cgggtctgac 420
atggattgga cgaaccactg aataccgcat tgcagagata attgtattta agtgcctagc 480
tcgatacaat aaacgccatt tgaccattca ccacattggt gtgcacctgg ctag 534
<210> 7
<211> 25
<212> DNA
<213> artificial
<220>
<223> primer
<400> 7
ccccgaattc atggaagaaa tttcc 25
<210> 8
<211> 35
<212> DNA
<213> artificial
<220>
<223> primer
<400> 8
cgcgggccaa taaggccaac atcgggacgt acatc 35
<210> 9
<211> 36
<212> DNA
<213> artificial
<220>
<223> primer
<400> 9
gcgcggcctt attggcctta aataccgcgt ttggag 36
<210> 10
<211> 28
<212> DNA
<213> artificial
<220>
<223> primer
<400> 10
ccccaagctt tcaagtgata ctgcgtga 28
<210> 11
<211> 30
<212> DNA
<213> artificial
<220>
<223> primer
<400> 11
gggaattcga agagcccccg cggacgcatg 30
<210> 12
<211> 35
<212> DNA
<213> artificial
<220>
<223> primer
<400> 12
ccgctagcgg ccgcaagttc cttcaccatg accag 35
<210> 13
<211> 43
<212> DNA
<213> artificial
<220>
<223> primer
<400> 13
gcggccgcta gcggccttat tggccgtagc ataaagacgc agg 43
<210> 14
<211> 30
<212> DNA
<213> artificial
<220>
<223> primer
<400> 14
ccaagcttct agtacatata tatacatgac 30
<210> 15
<211> 36
<212> DNA
<213> artificial
<220>
<223> primer
<400> 15
gggggaattc attatcccat ctaacagtta tatacg 36
<210> 16
<211> 33
<212> DNA
<213> artificial
<220>
<223> primer
<400> 16
gccgctagcg gccgccttta ttaacaacct tac 33
<210> 17
<211> 43
<212> DNA
<213> artificial
<220>
<223> primer
<400> 17
gcggccgcta gcggccttat tggccgttta ttctatgtaa gac 43
<210> 18
<211> 25
<212> DNA
<213> artificial
<220>
<223> primer
<400> 18
cccaagctta agttccttca ccatg 25
<210> 19
<211> 572
<212> DNA
<213> artificial
<220>
<223> Mcmv ie1 promoter
<400> 19
ggccaataag gctgcagtac tgagtcatta gggactttcc aatgggtttt gcccagtaca 60
taaggtcaat aggggtgaat caacaggaaa gtcccattgg agccaagtac actgagtcaa 120
tagggacttt ccattgggtt ttgcccagta caaaaggtca atagggggtg agtcaatggg 180
tttttcccat tattggcacg tacataaggt caataggggt gagtcattgg gtttttccag 240
ccaatttaat taaaacgcca tgtactttcc caccattgac gtcaatgggc tattgaaact 300
aatgcaacgt gacctttaaa cggtactttc ccatagctga ttaatgggaa agtaccgttc 360
tcgagccaat acacgtcaat gggaagtgaa agggcagcca aaacgtaaca ccgccccggt 420
tttcccctgg aaattccata ttggcacgca ttctattggc tgagctgcgt tctacgtggg 480
tataagaggc gcgaccagcg tcggtaccgt cgcagtcttc ggtctgacca ccgtagaacg 540
cagagctcct cgctgcaggc ggccgctcta ga 572
<210> 20
<211> 87
<212> DNA
<213> artificial
<220>
<223> SPA
<400> 20
ctgcaggcgg ccgctctaga gtcgacaata aaagatcttt attttcatta gatctgtgtg 60
ttggtttttt gtgtggccaa taaggcc 87
<210> 21
<211> 24
<212> DNA
<213> artificial
<220>
<223> VP2 STC-F
<400> 21
caccgtcctc agcttaccca catc 24
<210> 22
<211> 23
<212> DNA
<213> artificial
<220>
<223> VP2 STC-R
<400> 22
acgacggatc ctgttgccac tct 23
<210> 23
<211> 23
<212> DNA
<213> artificial
<220>
<223> NDV-F-F
<400> 23
ctagcagtgg cagttgggaa gat 23
<210> 24
<211> 24
<212> DNA
<213> artificial
<220>
<223> NDV-F-R
<400> 24
gttaaggcag gggaagtgat ttgt 24
<210> 25
<211> 24
<212> DNA
<213> artificial
<220>
<223> 45/46-F
<400> 25
ggggaagtct tccggttaag ggac 24
<210> 26
<211> 24
<212> DNA
<213> artificial
<220>
<223> 45/46-R
<400> 26
ggtgcaattc gtaagaccga tggg 24
<210> 27
<211> 19
<212> DNA
<213> artificial
<220>
<223> 44/45-F
<400> 27
gtactataga atgtgttcc 19
<210> 28
<211> 20
<212> DNA
<213> artificial
<220>
<223> 44/45-R
<400> 28
gtatccaacg cctcaagatc 20
<---
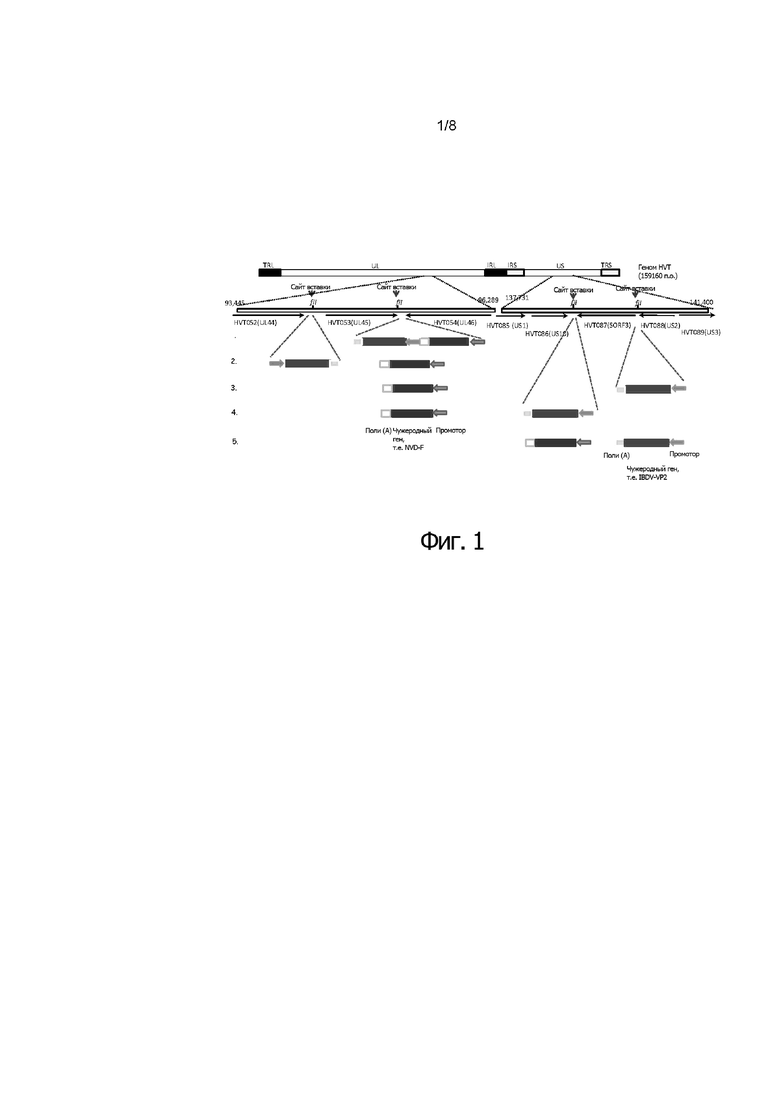


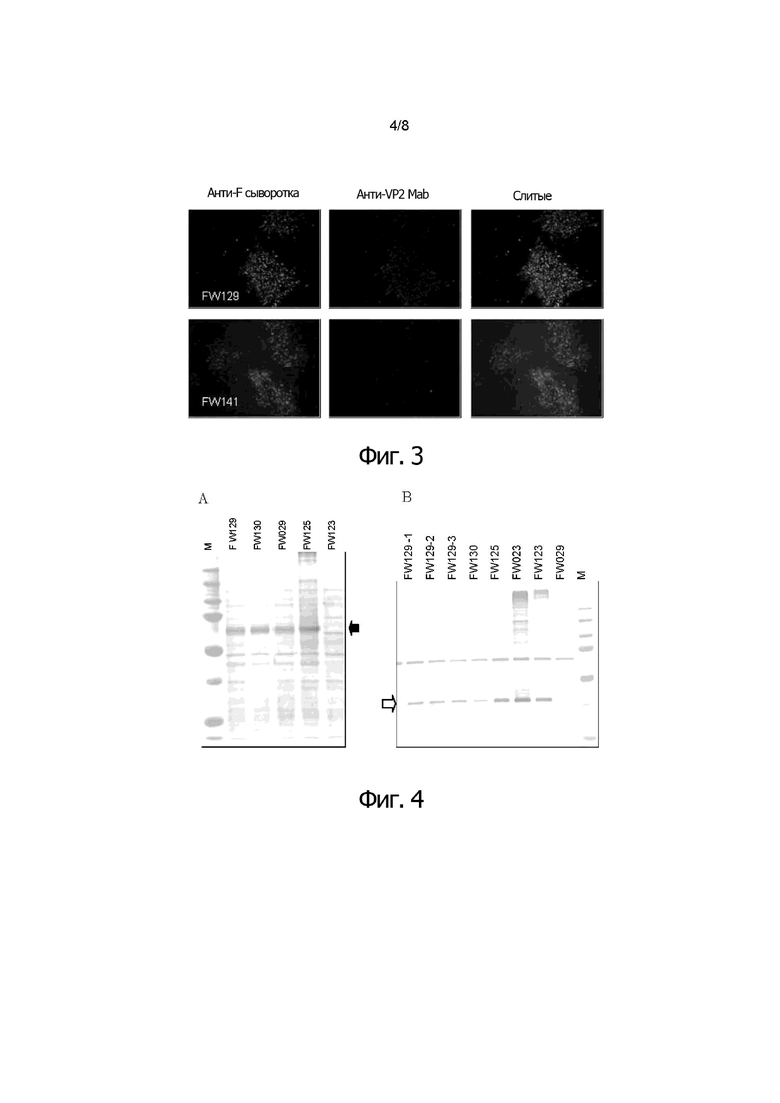

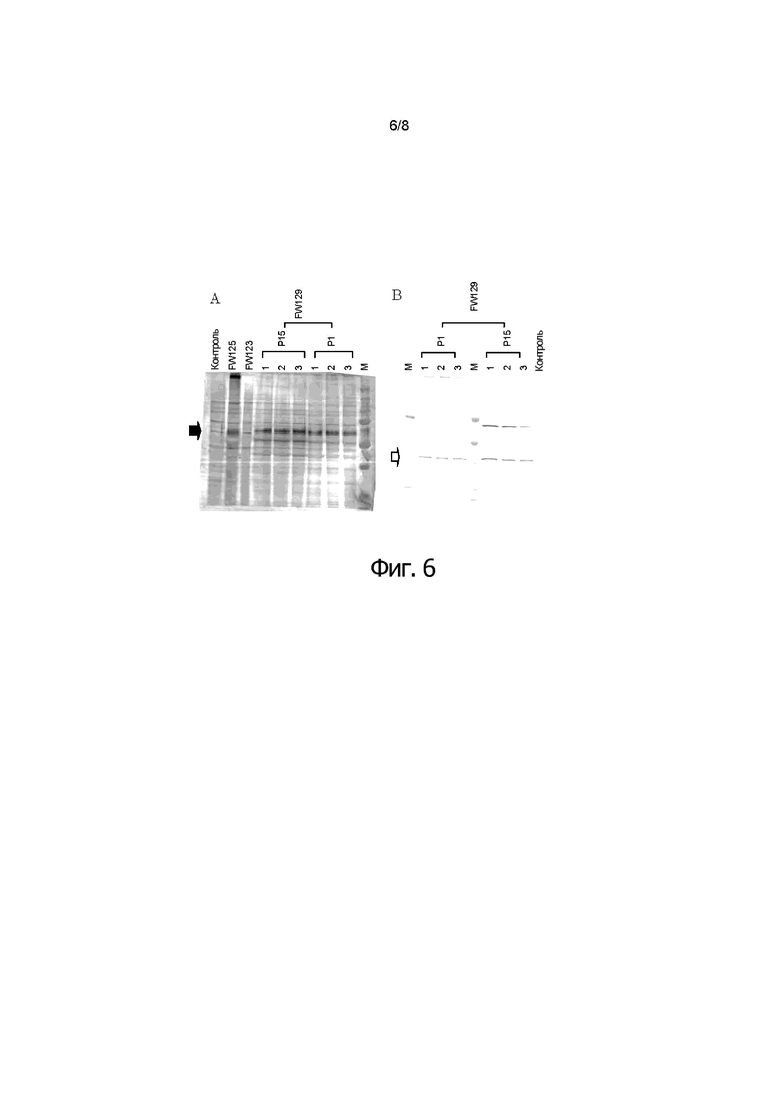
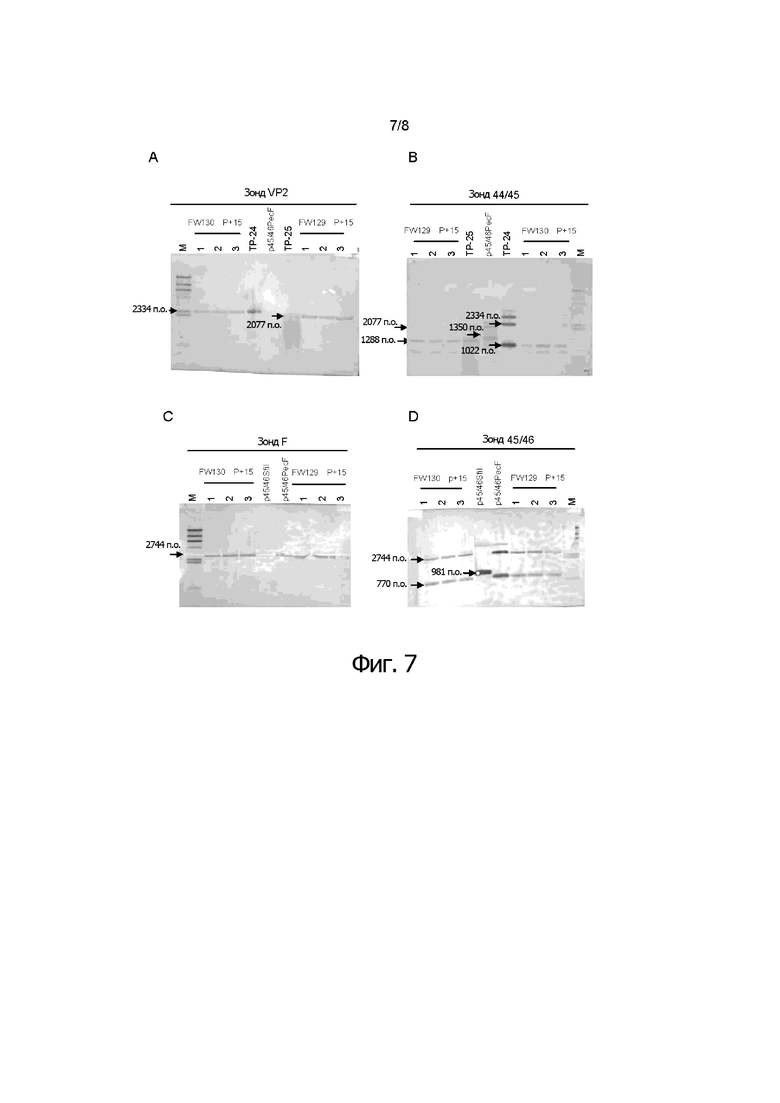
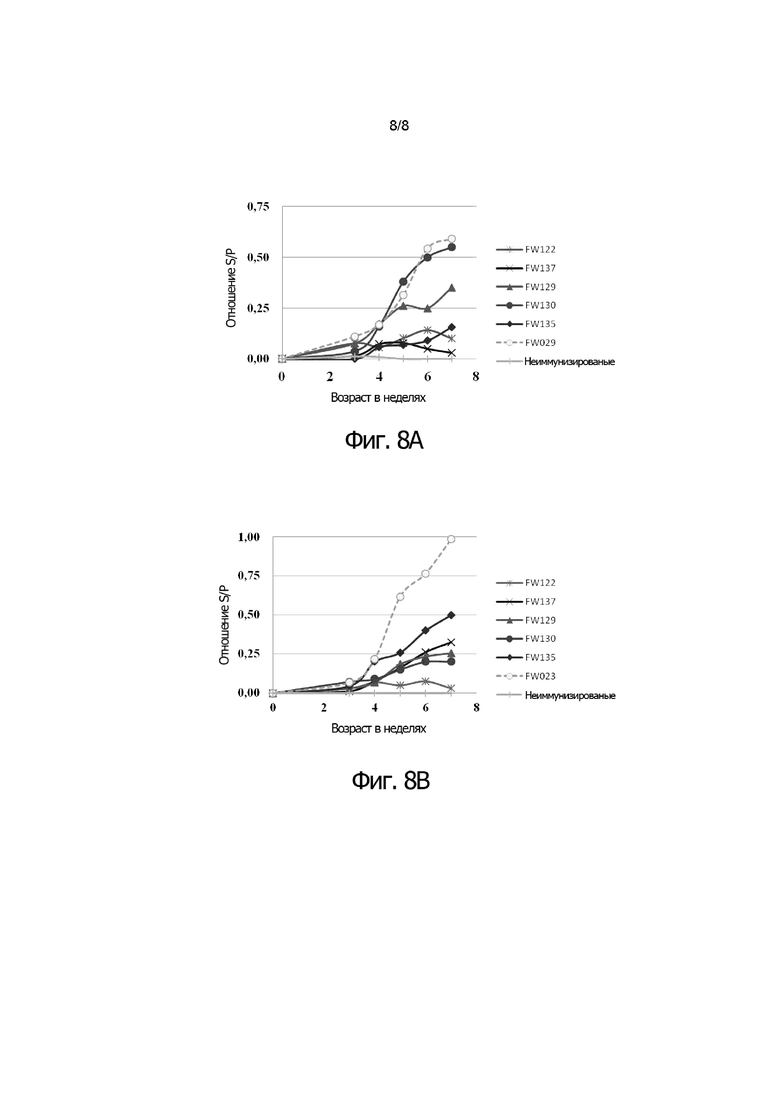
Настоящее изобретение относится к биотехнологии. Описан рекомбинантный вирус птичьего герпеса, подходящий для вакцинации птиц против вируса болезни Ньюкасла (NDV) и вируса инфекционного бурсита (IBDV), который содержит (i) рекомбинантную нуклеотидную последовательность, кодирующую белок F вируса болезни Ньюкасла или его иммуногенный фрагмент, под контролем промотора Pec, встроенные в некодирующую область вирусного генома, расположенную между UL45 и UL46; и (ii) рекомбинантную нуклеотидную последовательность, кодирующую белок VP2 вируса инфекционного бурсита или его иммуногенный фрагмент, под контролем промотора mCMV 1E1, встроенные в некодирующую область вирусного генома, расположенную между UL44 и UL45. Представлена мультивалентная вакцина против вируса болезни Ньюкасла (NDV) и вируса инфекционного бурсита (IBDV), которая включает эффективное иммунизирующее количество указанного рекомбинантного вируса птичьего герпеса. Также представлен способ вакцинации птицы против NDV и IBDV, включающий введение указанной птице мультивалентной вакцины. Также представлен набор для вакцинации для иммунизации птиц против вируса болезни Ньюкасла (NDV) и вируса инфекционного бурсита (IBDV), который включает следующие компоненты: эффективное количество указанной вакцины, и средства для введения указанных компонентов указанным птицам. 4 н. и 6 з.п. ф-лы, 8 ил., 5 табл.
1. Рекомбинантный вирус птичьего герпеса, подходящий для вакцинации птиц против вируса болезни Ньюкасла (NDV) и вируса инфекционного бурсита (IBDV), который содержит (i) рекомбинантную нуклеотидную последовательность, кодирующую белок F вируса болезни Ньюкасла или его иммуногенный фрагмент, под контролем промотора Pec, встроенные в некодирующую область вирусного генома, расположенную между UL45 и UL46; и (ii) рекомбинантную нуклеотидную последовательность, кодирующую белок VP2 вируса инфекционного бурсита или его иммуногенный фрагмент, под контролем промотора mCMV 1E1, встроенные в некодирующую область вирусного генома, расположенную между UL44 и UL45.
2. Рекомбинантный вирус птичьего герпеса по п. 1, в котором рекомбинантная нуклеотидная последовательность, встроенная в область, расположенную между UL45 и UL46, находится в той же транскрипционной ориентации как UL46, в противоположной транскрипционной ориентации к UL45.
3. Рекомбинантный вирус птичьего герпеса по п. 1, в котором промотор Pec содержит SEQ ID NO: 2.
4. Рекомбинантный вирус птичьего герпеса по п. 1, в котором промотор mCMV 1E1 содержит SEQ ID NO: 19.
5. Рекомбинантный вирус птичьего герпеса по п. 1, который представляет собой рекомбинантный вирус герпеса индейки (rHVT).
6. Рекомбинантный вирус птичьего герпеса по п. 5, в котором некодирующая область между UL44 и UL45 расположена между нуклеотидами nt94243-nt94683 вирусного генома, согласно отсылке на последовательность штамма FC126 HVT.
7. Рекомбинантный вирус птичьего герпеса по п. 5, в котором некодирующая область между UL45 и UL46 расположена между нуклеотидами nt95323-nt95443 вирусного генома, согласно отсылке на последовательность штамма FC126 HVT.
8. Мультивалентная вакцина против вируса болезни Ньюкасла (NDV) и вируса инфекционного бурсита (IBDV), которая включает эффективное иммунизирующее количество рекомбинантного вируса птичьего герпеса по п. 1.
9. Способ вакцинации птицы против NDV и IBDV, включающий введение указанной птице мультивалентной вакцины по п. 8.
10. Набор для вакцинации для иммунизации птиц против вируса болезни Ньюкасла (NDV) и вируса инфекционного бурсита (IBDV), который включает следующие компоненты:
- эффективное количество вакцины по п. 8, и
- средства для введения указанных компонентов указанным птицам.
| WO 2010119112 A1, 21.10.2010 | |||
| US 20100092510 A1, 15.04.2010 | |||
| СПОСОБ ОПРЕДЕЛЕНИЯ ЛИМФОЦИТОВ, СЕНСИБИЛИЗИРОВАННЫХ К ВАКЦИНЕ ПРОТИВ БОЛЕЗНИ МАРЕКА | 1994 |
|
RU2120126C1 |
Авторы
Даты
2022-02-07—Публикация
2013-03-29—Подача