Настоящее изобретение относится к фармацевтическим композициям, содержащим иммунизирующее количество инактивированного вируса ньюкаслской болезни и адъювант, для применения с целью защиты птицы от ньюкаслской болезни, к применению иммуногенного количества инактивированного вируса ньюкаслской болезни и адъюванта для изготовления бустерной вакцины, предназначенной для вакцинации кур или индеек, и к комплекту составных частей, которые включают контейнер, содержащий инактивированный вирус ньюкаслской болезни и адъювант для первичной вакцинации кур или индеек, и контейнер, содержащий инактивированный вирус ньюкаслской болезни и адъювант для бустерной вакцинации кур или индеек.
Коммерческое птицеводство можно ориентировочно разделить на три специализации: разведение кур-несушек, производителей и бройлеров.
Как бройлеры, так и несушки и производители, подвержены многим вирусным, бактериальным и паразитарным инфекциям. В качестве меры предупреждения их вакцинируют против многих вирусных заболеваний уже на ранней стадии их жизни. Одной из противовирусных вакцин, которая является частью стандартной схемы вакцинации у большинства фермеров, разводящих кур и индеек, является вакцина против вируса ньюкаслской болезни. Ньюкаслская болезнь является вирусным инфекционным заболеванием птиц, широко распространенным географически и являющимся причиной больших экономических потерь в птицеводческой промышленности. Этиологическим агентом этого заболевания является вирус ньюкаслской болезни (ВНБ) - прототипный вирус рода Paramyxovirus. Ньюкаслская болезнь осложняется тем, что разные изоляты и штаммы вируса могут вызывать формы заболевания, очень сильно отличающиеся по тяжести. Как правило, чем моложе куры или индейки, тем острее и тяжелее формы их заболевания. Заражение может происходить ингаляционным или алиментарным путем, а инфекционная форма вируса распространяется от одной птицы к другой.
Как указано выше, идентифицировано несколько патотипов ВНБ: велогенный, мезогенный и лентогенный. Нейротропная велогенная форма заболевания вызывается высоко патогенными штаммами ВНБ и характеризуется внезапным началом тяжелых респираторных симптомов, за которыми следуют неврологические симптомы. Инфицированные животные в большинстве случаев погибают. Висцеротропные велогенные штаммы ВНБ являются высоко патогенными, они вызывают тяжелые поражения желудочно-кишечного тракта и являются причиной высокой смертности. Мезогенные штаммы ВНБ обычно вызывают тяжелое респираторное заболевание у полностью восприимчивых птиц; как мезогенные, так и велогенные штаммы вызывают значительное снижение яйценоскости у взрослых птиц. Лентогенные штаммы ВНБ обычно вызывают заболевание в смягченной форме, которая характеризуется респираторными симптомами, особенно у молодых полностью восприимчивых птиц.
Для уменьшения экономических потерь, вызванных ньюкаслской болезнью в коммерческой птицеводческой промышленности, кур вакцинируют против этого заболевания. Обычно применяют живые вакцины, произведенные из лентогенных и мезогенных штаммов, причем мезогенная вакцина подходит только для вторичной вакцинации. Однако значительный диапазон вирулентности имеется также и в лентогенной группе. Штаммы ВНБ, применяемые в качестве живых вакцин, включают V4, Hitchner B1, F, La Sota (лентогенный) и штамм H, Mukteswar, Komarov и Roakin (мезогенный).
Как правило, продолжительность жизни бройлеров составляет только 1-12 недель. Поэтому их обычно вакцинируют живыми ослабленными вакцинами ВНБ.
Производители и бройлеры имеют значительно большую продолжительность жизни, и поэтому весьма важно их защищать против инфекционных заболеваний в течение всей жизни. Это означает, что для них были бы даже более полезными вакцины, обеспечивающие раннюю и длительную защиту.
В первые годы применения вакцинации птиц живые ослабленные вакцины были небезопасными, а для некоторых заболеваний их вообще не было. Поэтому в период с 1950 до 1960 гг. кур приходилось вакцинировать инактивированными вирусными вакцинами.
Однако такие вакцины вводили совсем без адъювантов или только с адъювантами, известными в то время (с тяжелыми побочными эффектами, неприемлемыми в настоящее время). Тогда не было реально приемлемых адъювантов.
В тот период не были известны и применяемые сейчас эмульсии типа «масло в воде» и «вода в масле».
Однако в последующие годы были разработаны безопасные живые вакцины для защиты птицы. Главным преимуществом живых вакцин против ньюкаслской болезни (НБ) является то, что их можно вводить посредством недорогих способов массового применения, таких как добавление в аэрозоль или в питьевую воду.
Кроме того, живые вакцины имеют преимущество, состоящее в том, что они являются менее дорогостоящими в расчете на дозу и обеспечивают практически немедленную защиту. Более того, они хорошо имитируют естественную инфекцию.
И наконец, живые ослабленные вакцины против НБ, вводимые посредством добавления в аэрозоль или в питьевую воду, обеспечивают хорошую местную защиту (дополнительно к системной защите).
Поэтому в современном птицеводстве живые ослабленные вакцины против ньюкаслской болезни являются теми вакцинами, которые применяют для первичной вакцинации кур или индеек.
Недостатком примирования живыми вакцинами является то, что их защита не является реально длительной, вследствие чего при необходимости приходится проводить вторую (а возможно, и третью) вакцинацию, вводя ослабленные вакцины.
Однако в последующие годы было найдено, что инактивированные вакцины, когда их вводят в качестве бустерной вакцины после первичной иммунизации живой ослабленной вакциной, имеют преимущество, состоящее в том, что они обеспечивают более длительный иммунитет у кур или индеек, примированных живыми ослабленными вакцинами.
Поэтому в настоящее время вторичную (так называемую «бустерную» вакцинацию) проводят, предпочтительно, инактивированной вакциной.
Уже много лет тому назад было показано, что такие схемы вакцинации, комбинирующие живые ослабленные и инактивированные вакцины, являются высоко эффективными (Glisson, J.R. and Kleven, S.H. 1993 Poultry vaccines. In: Peters, A.R. (Ed.), Vaccines for Veterinary Applications. Butterworth Heinemann, Oxford, UK, pp. 170-173 (1993)).
Вследствие этого современная практика вакцинации птицы заключается в следующем: против ньюкаслской болезни (фактически, и против многих других вирусных заболеваний птиц, таких как инфекционный бронхит) для первичной вакцинации применяют живые ослабленные вирусные вакцины, тогда как для индуцирования продленного ответа антител у птиц, примированных живыми ослабленными вирусными вакцинами, применяют бустерную вакцинацию инактивированными вакцинами. См., например, «Vaccination Strategies», Glisson, J.R., in Poultry Digest page 12-16, December 1999/January 2000.
Hilgers, L. A. Th., et al. еще раз подчеркивают важность современной стандартной вакцинотерапии: примирование живой вакциной и бустерная вакцинация инактивированной вакциной (например, против ньюкаслской болезни и инфекционного бронхита у кур). В указанной статье они проверяли эффекты различных адъювантов, вводимых с инактивированной бустерной вакциной (Vet. Immunol. and Immunopath. 66: 159-171 (1998).
Одним из немногих недостатков применения живых ослабленных вакцин является то, что они, индуцируя местный иммунитет, могут вызвать значительные вакцинальные реакции (в частности, проявляющиеся в дыхательных путях после аэрозольной вакцинации).
До настоящего времени этот неизбежный недостаток несколько смягчали, применяя для вакцинации очень ослабленные вирусы (в частности, для первичной вакцинации молодых животных).
Целью настоящего изобретения является предоставление путей решения этой проблемы альтернативным образом.
В настоящее время было неожиданно обнаружено, что возможна эффективная вакцинация посредством первичной и бустерной вакцинации инактивированной вакциной, при условии, что и первичная, и бустерная вакцины содержат подходящий адъювант. Это является крайне неожиданным обстоятельством, поскольку инактивированные вакцины должны вводиться парентеральным путем, при котором нельзя ожидать вообще никакой индукции местного иммунитета в трахее.
Явным преимуществом этого неожиданного эффекта является то, что животные, вакцинированные по этому режиму, почти или совсем не поражаются сторонней полевой инфекцией. Это благоприятно и для животного, и для птицевода. И, конечно, самым важным преимуществом является то, что можно полностью избежать рисков, связанных с применением живых ослабленных вирусов у очень молодых животных.
Режим первичной/бустерной вакцинации ВНБ можно применять для бройлеров, производителей и несушек. У бройлеров первичную вакцинацию проводят, предпочтительно, как можно ранее. Предпочтительно, примирование выполняют в возрасте 1-7 дней. Бустерную вакцинацию проводят, предпочтительно, через 2-12 недель после примирования. В регионах с высоким инфекционным давлением ВНБ вторая вакцинация может быть проведена через 2 недели после примирования. В более стандартной схеме вакцинации интервал между примированием и бустерной вакцинацией составлял бы 2-10 недель.
Как указано выше, в зависимости от способов производства, используемых в разных странах, во многих случаях бройлеры не достигают 10-недельного возраста.
Таким образом, предпочтительный режим вакцинации был бы следующим: бустерная вакцинация проводилась бы через 4-8 недель после примирования, а в тех случаях, когда бройлеров забивают в возрасте 5-6 недель, бустерную вакцинацию осуществляли бы примерно на 4-й неделе. Следовательно, в таких случаях первичная вакцинация проводилась бы в возрасте 1-14 дней.
Для производителей и несушек первичную вакцинацию также предпочтительно проводить в возрасте 1-7 дней, а бустерную вакцинацию можно выполнять через 2-12 недель после примирования. В этом случае, хотя и в зависимости от инфекционного давления, бустерную вакцинацию можно было бы отсрочить до 12 недель, чтобы продлить действие иммунитета на несколько дополнительных недель.
Однако, вообще говоря, предпочтительный временной интервал между примированием и бустерной вакцинацией также составляет 4-8 недель.
Таким образом, первый вариант осуществления настоящего изобретения относится к применению иммуногенного количества инактивированного вируса ньюкаслской болезни и адъюванта для получения бустерной вакцины для вакцинации кур или индеек, которые за 2-12 недель до вакцинации бустерной вакциной уже были вакцинированы первичной вакциной, содержавшей иммуногенное количество инактивированного вируса ньюкаслской болезни и адъювант.
Способы инактивации вируса ньюкаслской болезни хорошо известны в данной области. Химическую инактивацию можно осуществлять, например, хорошо известными инактивирующими соединениями, такими как формальдегид, бета-пропиолактон и биэтиленимин. Физическую инактивацию можно осуществлять, например, посредством термоинактивации или облучения рентгеновским или гамма-излучением или УФ-светом.
Количество антигена инактивированного ВНБ в вакцине, в принципе, может быть от 102 до 1010 эквивалентов доз, инфицирующих яйца (EID50). (Указаны именно эквиваленты, поскольку в вакцине вирусы были бы инактивированными и, следовательно, неспособными инфицировать яйца). Однако на практике величина 102 EID50 рассматривалась бы как низкая, эффективной она была бы только в присутствии очень сильного адъюванта. Предпочтительной дозой было бы количество от 104 до 108. Доза 1010 EID50, хотя и является подходящей, была бы невыгодной с экономической точки зрения.
Имеется много адъювантов, известных в данной области, которые подходят для комбинирования с инактивированным ВНБ (такие как гидроксид алюминия, фосфат алюминия, сапонины, растительные масла (такие как токоферол) и минеральные масла). Очень эффективными адъювантами являются эмульсии типа «масло в воде» и особенно эмульсии типа «вода в масле», далее в настоящем документе они также называются адъювантами типа «масло в воде» и адъювантами типа «вода в масле». Такие эмульсии хорошо известны в данной области. В частности, бустерная вакцина или фармацевтическое соединение, предназначенные для применения согласно настоящему изобретению, содержат адъювант типа «вода в масле». Путь введения инактивированной вакцины, в принципе, является парентеральным. Введение также может быть, например, внутримышечным или подкожным. Эти пути введения и их особенности хорошо известны в области вакцинации птицы.
Режим первичной и бустерной вакцинации ВНБ одинаково подходит для кур и индеек.
Другой вариант осуществления настоящего изобретения относится к фармацевтической композиции, содержащей иммуногенное количество инактивированного вируса ньюкаслской болезни и адъювант и предназначенной для применения при лечении ньюкаслской болезни у кур или индеек, причем указанное лечение включает стадии проведения первичной вакцинации указанных кур или индеек вакциной, содержащей иммуногенное количество инактивированного вируса ньюкаслской болезни и адъювант, и стадии проведения бустерной вакцинации указанных кур или индеек вакциной, содержащей иммуногенное количество инактивированного вируса ньюкаслской болезни и адъювант, спустя 2-12 недель после указанной первичной вакцинации.
Предпочтительно, указанная первичная и/или бустерная вакцина или указанная фармацевтическая композиция, в дополнение к ВНБ-компоненту, определенному выше, содержит один или более дополнительных антигенов, произведенных из вируса или микроорганизма, патогенного для птицы, или генетическую информацию, кодирующую указанный антиген.
Более предпочтительно, указанный вирус или микроорганизм выбирают из группы, состоящей из вируса инфекционного бронхита, вируса инфекционного бурсита (болезни Гумборо), возбудителя куриной анемии, реовируса птиц, Mycoplasma gallisepticum, вируса ринотрахеита индеек, Haemophilus paragallinarum (возбудитель острого ринита), куриного поксвируса, вируса энцефаломиелита птиц, вируса синдрома снижения несучести, вируса инфекционного ларинготрахеита, вируса герпеса индеек, видов эймерий, Ornithobacterium rhinotracheale, Pasteurella multocida, Mycoplasma synoviae, видов сальмонелл и E. coli.
Первичную и бустерную вакцину и фармацевтическую композицию можно получать и выпускать на рынок в форме суспензии или в лиофилизированной форме. Они будут дополнительно содержать фармацевтически приемлемый носитель, традиционно применяемый для таких активных компонентов. Носители могут представлять собой или включать в себя стабилизаторы, разбавители, консерванты и буферы.
Подходящими стабилизаторами являются, например, SPGA, углеводы (такие как сухое молоко, сывороточный альбумин или казеин) или продуты их разложения. Подходящими буферами являются, например, фосфаты щелочных металлов. Подходящими консервантами являются тимеросал, мертиолят и гентамицин. Разбавители включают воду, водные буферы (такие как фосфатно-солевой буфер), спирты, многоатомные спирты (такие как глицерин).
Предпочтительно, чтобы сделать вакцины и фармацевтические композиции менее зависимыми от хранения на холоду, их высушивают из замороженного состояния.
Иммуногенным количеством ВНБ является то его количество, которое индуцирует иммунную реакцию в курах или индейках, ослабляющую патологические эффекты заболевания, по сравнению с патологическими эффектами, имеющими место после инфицирования ВНБ дикого типа в неиммунизированных птицах.
Штаммы вируса НБ, подходящие для получения инактивированных вакцин ВНБ (более конкретно, маслянно-эмульсионных вакцин), включают такие штаммы, как Clone 30, Ulster 2C, Hitchner B1, La Sota, Roakin и различные вирулентные вирусы (DJ. Alexander, In Diseases of Poultry, 9th edition 1991, eds. Calnek et al., Iowa State University Press, Ames, Iowa, 496-519).
Другой вариант осуществления настоящего изобретения относится к некоторому комплекту составных частей, причем указанный комплект включает контейнер, содержащий инактивированный вирус ньюкаслской болезни и адъювант для первичной вакцинации кур или индеек, и контейнер, содержащий инактивированный вирус ньюкаслской болезни и адъювант для бустерной вакцинации кур или индеек. Указанный контейнер может представлять собой, например, классический флакон для вакцины или пробирку, или любой другой предмет из любого материала, в котором можно хранить вакцину.
Примеры
Пример 1:
Целью этого эксперимента является оценка того, индуцирует ли стратегия первичной/бустерной вакцинации инактивированным лентогенным штаммом ВНБ, приготовленным в GNE, местную защиту против проведенного местно контрольного заражения мезогенным ВНБ штамма Beaudette (GNE является стандартной эмульсией типа «вода в масле» на основе минерального масла).
1. МАТЕРИАЛЫ И МЕТОДИКИ
1.1. Постановка эксперимента
Одну (1) группу цыплят породы SPF White Leghorn (группа 1) в возрасте 3-4 недель, помещенных в изолятор, вакцинировали дважды внутримышечно (в/м), вводя в грудную мышцу эмульсионную вакцину типа «вода в масле», содержавшую приблизительно 10^7,7 EID50 инактивированного формальдегидом лентогенного штамма ВНБ на дозу, как указано в Таблице 1. Группа 2 оставалась невакцинированной. В начале эксперимента и через 6 и 8 недель после первичной вакцинации у животных обеих групп отбирали образцы крови. Спустя восемь недель после первичной вакцинации цыплят обеих групп подвергали контрольному заражению, окулярным путем вводя ВНБ штамма Beaudette. Через 3, 4 и 7 дней после контрольного заражения из ротоглотки и клоаки отбирали два мазка, которые использовали для повторного выделения вируса. Спустя 15 дней после контрольного заражения у всех животных обеих групп отбирали образцы крови.

1.2. Вакцинация
Первичная вакцинация: Только цыплята из группы 1 получали 10^7,7 EID50 инактивированного формальдегидом лентогенного штамма ВНБ на дозу в эмульсии типа «вода в масле», вводимого внутримышечно в грудную мышцу в возрасте 3-4 недель.
Бустерная вакцинация: Только животные из группы 1 получали 10^7,7 EID50 инактивированного формальдегидом лентогенного штамма ВНБ на дозу в эмульсии типа «вода в масле», вводимого внутримышечно в грудную мышцу через 6 недель после первичной вакцинации.
1.3. Контрольное заражение
Через восемь недель после первичной вакцинации всех животных из обеих групп подвергали контрольному заражению, окулярным путем вводя живой ВНБ штамма Beaudette (106,0 EID50 на животное; 100 мкл в каждый глаз в виде глазных капель).
1.4. Образцы крови
Образцы крови для серологического исследования отбирали в день первичной вакцинации и через 6 и 8 недель после нее, а также спустя 15 дней после контрольного заражения у всех цыплят из обеих групп.
1.5. Мазки
На 2-й, 3-й и 7-й день после контрольного заражения из ротоглотки и клоаки всех цыплят отбирали мазки для повторного выделения вируса. Мазки собирали в 2,5 мл 2,5% раствора Tryptose, к которому добавляли 1000 ед/1000 мкг/мл Pen/Strep.
1.6. Наблюдения клинических симптомов
В течение 15-дневного периода после контрольного заражения цыплят ежедневно обследовали для обнаружения клинических признаков инфекции ВНБ штамма Beaudette или гибели птиц. Данные записывали в форме, представленной в Приложении 1. Применяли следующую систему баллов:
0: птица здорова
1: слезотечение/кашель
2: расстройство дыхания
3: птица мертва
1.7. Анализ реакции торможения гемагглютинации (HI)
Сывороточные уровни ВНБ-специфических антител определяли посредством анализа реакции торможения гемагглютинации (HI). Серийные двукратные разбавления сывороток готовили на микротитровальных планшетах, после чего их смешивали с равным объемом раствора, содержавшего 8 гемагглютинирующих единиц антигена ВНБ в 50 мкл. После инкубации длительностью не менее 30 минут добавляли куриные эритроциты. Титры выражали в виде обратных величин наибольшего разбавления, дававшего полное торможение гемагглютинации эритроцитов (1% (об./об.) в буферном растворе соли). Образцы считали положительными в отношении торможения гемагглютинации при разбавлении, большем или равном 1:2.
1.8. Повторное выделение вируса
Повторное выделение вируса проводили посредством введения в яйца с 10-дневными эмбрионами цыплят (N=8) по 0,1 мл неразбавленных материалов образцов. После 4-6-дневной инкубации аллантоисную жидкость, выделенную из всех яиц, испытывали на присутствие ВНБ, определяя активность HA. Титр рассчитывали по методике Spaerman и Kaerber (описанной в публикации B. Bibrack and G. Whittmann, Editors, Virologische Arbeitsmethoden, Fisher Verlag, Stuttgart (1974), pp. 37-39).
2. Результаты
2.1. Наблюдаемые клинические симптомы
Наблюдения показали, что ни одна из вакцинированных птиц (группа 1) не имела клинических симптомов. Только одна птица из невакцинированной группы, подвергнутой контрольному заражению (группа 2) имела балл 1, т.е. у нее наблюдали слезотечение/кашель, начиная с 10-го дня после контрольного заражения и до конца периода наблюдений длительностью 15 дней. Ни одна из птиц не погибла.
2.2. Гемагглютинационные титры
HI-титры измеряли, используя сыворотки, полученные через 6 и 8 недель после первичной вакцинации и через 15 дней после контрольного заражения (см. Таблицу 2).
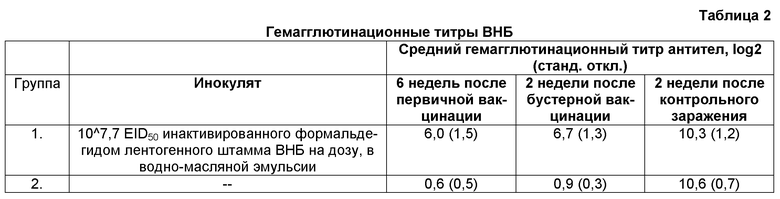
2.3. Повторное выделение вируса
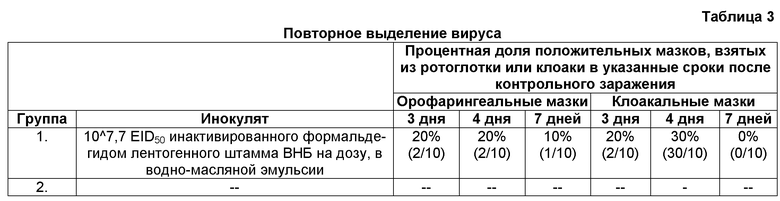
Повторное выделение вируса ВНБ штамма Beaudette проводили, используя орофарингеальные и клоакальные мазки, взятые на 3-й, 4-й и 7-й день после контрольного заражения; результаты сведены в Таблице 3.

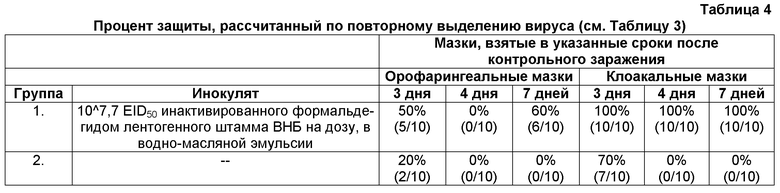
Результаты показывают, что спустя 4 и 7 дней после контрольного заражения невакцинированные контрольные животные являются незащищенными против ВНБ штамма Beaudette (см. Таблицу 4), поскольку в эти дни вирус можно было повторно выделить (см. Таблицу 3). Спустя 3 дня после контрольного заражения только 20% и 70% птиц являются защищенными, как следует из данных по повторному выделению вируса из орофарингеальных и клоакальных мазков, соответственно.
Ни в одном из образцов клоакальных мазков, взятых спустя 3, 4 и 7 дней после контрольного заражения вакцинированных птиц, вирус не был выделен (см. Таблицу 3), что указывает на то, что все эти птицы (100%) являются защищенными (см. Таблицу 4). Из орофарингеальных мазков, взятых спустя 3, 4 и 7 дней после контрольного заражения, вирус-положительными были 50% (5/10), 100% (10/10) и 40% (4/10), соответственно (см. Таблицу 3).
3. Обсуждение
Режим первичной/бустерной вакцинации инактивированным ВНБ, приготовленным в GNE, индуцирует защиту, достаточную для уменьшения заражаемости вирусом ньюкаслской болезни штамма Beaudette, вводимым окулярным путем, на что указывает снижение процентной доли положительных орофарингеальных мазков через 7 дней после контрольного заражения. Из клоакальных мазков, взятых у тех же вакцинированных птиц, вирус не был повторно выделен ни в одном из моментов времени, что указывает на защищенность этих животных.
Резюме: стратегия первичной/бустерной вакцинации инактивированным ВНБ, приготовленным в водно-масляной эмульсии, индуцирует (местную) иммунологическую защиту, достаточную для того, чтобы защищать цыплят от средневирулентного ВНБ штамма Beaudette.
Пример 2:
Целью этого эксперимента является оценка того, индуцирует ли стратегия первичной/бустерной вакцинации с инактивированным лентогенным штаммом ВНБ, приготовленным в GNE, системный иммунитет против проведенного системно контрольного заражения живым ВНБ штамма Herts 33/56.
1. Материалы и методики
1.1. Постановка эксперимента
Десять цыплят породы SPF White Leghorn (Lohmann) в возрасте 3-4 недель из группы 12 животных, помещенных в изолятор, дважды вакцинировали внутримышечно (в/м), вводя в грудную мышцу 10^7,7 EID50 инактивированного формальдегидом лентогенного штамма ВНБ на дозу в водно-масляной эмульсии, как указано в Таблице 1. Остальные две птицы оставались невакцинированными. В начале эксперимента и через 6 и 8 недель после первичной вакцинации у всех животных отбирали образцы крови. Спустя восемь недель после первичной вакцинации всех цыплят подвергали контрольному заражению, внутримышечным путем вводя 0,2 мл (106,0 EID50) живого велогенного ВНБ штамма Herts 33/56. Через 3, 4 и 7 дней после контрольного заражения из ротоглотки и клоаки отбирали два мазка, которые использовали для повторного выделения вируса. Спустя 15 дней после контрольного заражения у всех животных отбирали образцы крови.
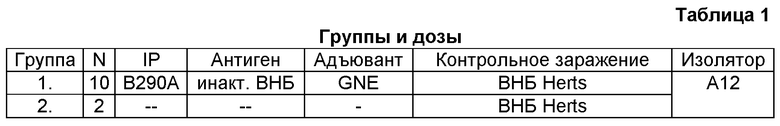
1.2. Вакцинация
Первичная вакцинация: Десять из двенадцати цыплят группы 1 в возрасте 3-4 недель получали 0,5 мл вакцины, вводившейся в грудную мышцу.
Бустерная вакцинация: Те же десять животных через 6 недель после первичной вакцинации получали 0,5 мл вакцины, вводившейся в грудную мышцу.
1.3. Контрольное заражение
Через восемь недель после первичной вакцинации всех животных подвергали заражению, вводя в мышцу ноги 0,2 мл живого велогенного ВНБ штамма Herts 33/56 (106,0 EID50 на одного цыпленка).
1.4. Образцы крови
У всех цыплят обеих групп в день первичной вакцинации и через 6 и 8 дней после нее, а также через 15 дней после контрольного заражения отбирали образцы крови для серологического анализа.
1.5. Мазки
На 2-й, 3-й и 7-й день после контрольного заражения из ротоглотки и клоаки всех цыплят отбирали мазки для повторного выделения вируса. Каждый мазок собирали в 2,5 мл 2,5% раствора Tryptose, к которому добавляли 1000 ед/1000 мкг/мл Pen/Strep.
1.6. Наблюдения клинических симптомов
В течение 15-дневного периода после контрольного заражения цыплят ежедневно обследовали для обнаружения клинических признаков инфекции ВНБ или гибели птиц. Применяли следующую систему баллов:

1.7. Анализ реакции торможения гемагглютинации (HI)
Сывороточные уровни ВНБ-специфических антител определяли посредством анализа реакции торможения гемагглютинации (HI). Серийные двукратные разбавления сывороток готовили на микротитровальных планшетах, после чего их смешивали с равным объемом раствора, содержавшего 8 гемагглютинирующих единиц антигена ВНБ в 50 мкл. После инкубации длительностью не менее 30 минут добавляли куриные эритроциты. Титры выражали в виде обратных величин наибольшего разбавления, дававшего полное торможение гемагглютинации эритроцитов (1% (об./об.) в буферном растворе соли). Образцы считали положительными в отношении торможения гемагглютинации при разбавлении, большем или равном 1:2.
1.8. Повторное выделение вируса
Повторное выделение вируса проводили посредством введения в яйца с 10-дневными эмбрионами (N=8) по 0,1 мл неразбавленных материалов образцов. После 4-6-дневной инкубации аллантоисную жидкость, выделенную из всех яиц, испытывали на присутствие ВНБ, определяя активность HA. Титр рассчитывали по методике Spaerman и Kaerber (описанной в публикации B. Bibrack and G. Whittmann, Editors, Virologische Arbeitsmethoden, Fisher Verlag, Stuttgart (1974), pp. 37-39).
2. Результаты
2.1. Наблюдаемые клинические симптомы
Наблюдения показали что ни одна из 10 вакцинированных птиц не имела клинических симптомов. Одна из двух невакцинированных птиц через 3 дня после контрольного заражения имела балл 1, т.е. у нее наблюдались клинические признаки ньюкаслской болезни, а через 4 дня после контрольного заражения она имела балл 2, т.е. она погибла вследствие контрольного заражения вирусом НБ. Другая невакцинированная птица через три дня после контрольного заражения имела балл 1, но к вечеру того же дня оценка сменилась на два балла.
2.2. Гемагглютинационные титры
HI-титры измеряли, используя сыворотки, полученные через 6 и 8 недель после первичной вакцинации и через 15 дней после контрольного заражения (см. Таблицу 2).
2.3. Повторное выделение вируса
Повторное выделение вируса ВНБ штамма Herts проводили, используя орофарингеальные и клоакальные мазки, взятые на 3-й, 4-й и 7-й день после контрольного заражения; результаты сведены в Таблице 3.

Результаты показывают, что невакцинированные контрольные животные, подвергнутые заражению, являются незащищенными против ВНБ штамма Herts.
Все вакцинированные птицы, подвергнутые контрольному заражению, являются защищенными против ВНБ штамма Herts.
Обсуждение
Режим первичной/бустерной вакцинации инактивированным ВНБ, приготовленным в водно-масляной эмульсии, индуцирует полную системную защиту, достаточную для того, чтобы защищать цыплят от вирулентного ВНБ штамма Herts.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ХИТОЗАН, ДЛЯ ГЛАЗНОГО ВВЕДЕНИЯ ВАКЦИНЫ (ВАКЦИН) ПТИЦАМ | 2009 |
|
RU2498818C2 |
| РЕКОМБИНАНТНЫЕ HVT-ВЕКТОРЫ, ЭКСПРЕССИРУЮЩИЕ МНОЖЕСТВЕННЫЕ АНТИГЕНЫ ПАТОГЕНОВ ПТИЦ, И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2017 |
|
RU2752836C2 |
| КОМПОЗИЦИИ В ВИДЕ СУХОГО ПОРОШКА И СИСТЕМЫ ДЛЯ ВАКЦИНАЦИИ ДОМАШНЕЙ ПТИЦЫ | 2007 |
|
RU2450828C2 |
| АССОЦИИРОВАННАЯ КУЛЬТУРАЛЬНАЯ СУХАЯ ВИРУСВАКЦИНА ПРОТИВ НЬЮКАСЛСКОЙ БОЛЕЗНИ И ОСПЫ ПТИЦ | 2005 |
|
RU2295357C1 |
| ВАКЦИНА ДЛЯ ЗАЩИТЫ ПТИЦЫ ОТ QХ-ПОДОБНОГО ВИРУСА ИНФЕКЦИОННОГО БРОНХИТА И СПОСОБ ЕЕ ИСПОЛЬЗОВАНИЯ | 2009 |
|
RU2568053C2 |
| РЕКОМБИНАНТНЫЙ ВИРУС БОЛЕЗНИ НЬЮКАСТЛА, ЭКСПРЕССИРУЮЩИЙ Н5 ГЕМАГЛЮТИНИН ВИРУСА ПТИЧЬЕГО ГРИППА (AVIAN INELUENZA) | 2007 |
|
RU2441070C2 |
| Штамм "ВНИИЗЖ G7" вируса ньюкаслской болезни птиц для изготовления биопрепаратов для диагностики и специфической профилактики ньюкаслской болезни птиц | 2024 |
|
RU2821028C1 |
| ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОГО БРОНХИТА | 2021 |
|
RU2838435C2 |
| ВАКЦИННЫЙ ПРЕПАРАТ ДЛЯ ПРОФИЛАКТИКИ АДЕНОВИРУСНОГО ГЕПАТИТА С ВКЛЮЧЕНИЯМИ - ГИДРОПЕРИКАРДИТА КУР | 2002 |
|
RU2233175C2 |
| ВАКЦИНА АССОЦИИРОВАННАЯ ПРОТИВ НЬЮКАСЛСКОЙ БОЛЕЗНИ, РЕОВИРУСНОГО ТЕНОСИНОВИТА И МЕТАПНЕВМОВИРУСНОЙ ИНФЕКЦИИ ПТИЦ ИНАКТИВИРОВАННАЯ ЭМУЛЬСИОННАЯ | 2011 |
|
RU2480238C1 |
Группа изобретений относится к фармацевтическим композициям, содержащим иммунизирующее количество инактивированного вируса ньюкаслской болезни и адъювант. Способ вакцинации кур или индеек против ньюкаслской болезни характеризуется тем, что он включает стадию проведения первичной вакцинации указанных кур или индеек вакциной, содержащей иммуногенное количество инактивированного вируса ньюкаслской болезни и адъювант типа «вода в масле», и стадию проведения бустерной вакцинации спустя 2-12 недель после указанной первичной вакцинации указанных кур или индеек вакциной, содержащей иммуногенное количество инактивированного вируса ньюкаслской болезни и адъювант типа «вода в масле». Комплект для вакцинации кур или индеек против ньюкаслской болезни включает контейнер, содержащий инактивированный вирус ньюкаслской болезни и адъювант типа «вода в масле» для первичной вакцинации кур или индеек, и контейнер, содержащий инактивированный вирус ньюкаслской болезни и адъювант типа «вода в масле» для бустерной вакцинации, осуществляемой указанным способом. Указанная вакцина может содержать один или более дополнительных антигенов, произведенных из вируса или микроорганизма, патогенного для птицы. Группа изобретений обеспечивает повышение эффективности вакцинации. 2 н. и 1 з.п. ф-лы, 8 табл., 2 пр.
1. Способ вакцинации кур или индеек против ньюкаслской болезни, характеризующийся тем, что он включает стадию проведения первичной вакцинации указанных кур или индеек вакциной, содержащей иммуногенное количество инактивированного вируса ньюкаслской болезни и адъювант типа «вода в масле», и стадию проведения бустерной вакцинации спустя 2-12 недель после указанной первичной вакцинации указанных кур или индеек вакциной, содержащей иммуногенное количество инактивированного вируса ньюкаслской болезни и адъювант типа «вода в масле».
2. Способ по п. 1, отличающийся тем, что указанная вакцина содержит один или более дополнительных антигенов, произведенных из вируса или микроорганизма, патогенного для птицы, или генетическую информацию, кодирующую указанный антиген, причем указанный вирус или микроорганизм выбирают из группы, состоящей из вируса инфекционного бронхита, вируса инфекционного бурсита (болезни Гумборо), возбудителя куриной анемии, реовируса птиц, Mycoplasma gallisepticum, вируса ринотрахеита индеек, Haemophilus paragallinarum (возбудитель острого ринита), куриного поксвируса, вируса энцефаломиелита птиц, вируса синдрома снижения несучести, вируса инфекционного ларинготрахеита, вируса герпеса индеек, видов эймерий, Ornithobacterium rhinotracheale, Pasteurella multocida, Mycoplasma synoviae, видов сальмонелл и E. coli.
3. Комплект для вакцинации кур или индеек против ньюкаслской болезни, характеризующийся тем, что он включает контейнер, содержащий инактивированный вирус ньюкаслской болезни и адъювант типа «вода в масле» для первичной вакцинации кур или индеек, и контейнер, содержащий инактивированный вирус ньюкаслской болезни и адъювант типа «вода в масле» для бустерной вакцинации, осуществляемой способом по п. 1.
| AWA D N ET AL: "The potential role of an inactivated thermostable vaccine in the control of Newcastle disease in traditionally free-roaming poultry in Central and West Africa.", TROPICAL ANIMAL HEALTH AND PRODUCTION MAR 2009, vol | |||
| Механический грохот | 1922 |
|
SU41A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| HILGERS L A TH ET | |||
Авторы
Даты
2015-04-10—Публикация
2010-11-30—Подача