Область техники, к которой относится изобретение
[001] Это изобретение относится в основном к области биологии и химии. В частности, изобретение направлено на биосенсоры на основе флуоресцентных белков.
Уровень техники
[002] Флуоресцентные белки семейства GFP (Green Fluorescent Protein, GFP), включая собственно GFP из медузы Aequorea victoria (avGFP), его мутанты и гомологи, сегодня широко известны благодаря их интенсивному использованию в качестве флуоресцентных маркеров in vivo в биомедицинских исследованиях (Lippincott-Schwartz et al. (2003) Science 300(5616):87-91 и Chudakov et al. Physiol Rev. 2010 90(3):1103-63).
[003] Флуоресцентные белки способны к флуоресценции при облучением светом подходящей длины волны. Флуоресцентные свойства этих белков обусловлены взаимодействием двух или более аминокислотных остатков, формирующих хромофор, а не флуоресценцией какого-либо одного аминокислотного остатка.
[004] GFP гидромедузы Aequorea aequorea (синоним A. victoria) был описан как часть биолюминесцентной системы медузы, где GFP играет роль вторичного эммитера, преобразовывающего синий свет от фотобелка экворина в зеленый свет (Johnson et al. (1962) J Cell Comp Physiol., 60:85-104). кДНК, кодирующая A. victoria GFP была клонирована (Prasher et al. (1992) Gene, 111(2):229-33). Оказалось, что этот ген может быть гетерологично экспрессирован в практически любом организме благодаря уникальной способности GFP автокаталитически образовывать хромофор (Chalfie et al. (1994) Science 263:802-805). Эти сведения открыли широкие перспективы для использования GFP в клеточной биологи в качестве генетически кодируемой флуоресцирующей метки.
[005] GFP был использован в широком спектре приложений, включая исследование экспрессии генов и локализацию белков (Chalfie et al. (1994) Science 263:802-805, и Heim et al. (1994) Proc. Nat. Acad. Sci., 91:12501-12504), как инструмент для визуализации внутриклеточного распределения органелл (Rizzuto et al. (1995) Curr. Biology, 5:635-642), для визуализации транспорта белков по секреторному пути (Kaether et al. (1995) FEBS Letters, 369:267-271).
[006] Были проведены многочисленные исследования для улучшения свойств avGFP (Aequorea victoria GFP) и для получения вариантов GFP, пригодных и оптимизированных для различных исследовательских целей. Была проведена оптимизация генетического кода avGFP (codon usage) для повышения уровня экспрессии в клетках млекопитающих ("гуманизированный" GFP, Haas et al. (1996) Current Biology, 6:315-324; Yang et al. (1996) Nucleic Acids Research, 24:4592-4593). Были получены различные мутанты GFP, в том числе "усиленный зеленый флуоресцентный белок" (EGFP), имеющий две аминокислотные замены: F64L и S65T (Heim et al. (1995) Nature 373:663-664). Другие мутанты являются синим, голубым и желто-зеленым спектральными вариантами avGFP и содержат замены аминокислотных остатков, формирующих хромофор, и/или остатков, формирующих окружение хромофора.
[007] Позднее гомологи GFP были клонированы из коралловых полипов семейства Anthozoa (Matz et al. (1999) Nature Biotechnol. 17: 969-973), рачков-копепод (Shagin et al. (2004) Mol Biol Evol., 21(5):841-850), ланцетников (Bomati et al., BMC Evolutionary Biology 2009, 9:77). Сегодня семейство GFP-подобных белков включает сотни флуоресцентных и окрашенных гомологов GFP. Сходство этих белков с GFP варьирует от 80-90% до менее чем 25% идентичности аминокислотной последовательности.
[008] Были получены кристаллические структура avGFP дикого типа, GFP S65T мутанта и ряда гомологов GFP (Ormo et al. (1996) Science 273: 1392-1395; Wall et al. (2000) Nat Struct Biol, 7:1133-1138; Yarbrough et al. (2001) Proc Natl Acad Sci USA 98:462-467; Prescott et al. (2003) Structure (Camb), 11:275-284; Petersen et al. (2003) J Biol Chem, 278:44626-44631; Wilmann et al. (2005) J Biol Chem, 280:2401-2404; Remington et al. (2005) Biochemistry, 44, 202-212; Quillin et al. (2005) Biochemistry, 44:5774-5787). Было постулировано, что все члены семейства обладают общей 3D структурой (GFP-подобным доменом), представляющей собой так называемый "бочонок" из 11 бета-слоев, образующих компактную встречно-параллельную структуру, внутри которой располагается альфа-спираль, содержащая хромофор. Хромофор формируется внутри GFP-подобного домена путем окислительной циклизации трех консервативных аминокислотных остатков в центральном регионе альфа-спирали (Cody et al. (1993) Biochemistry 32: 1212-1218). Положения аминокислотных остатков, формирующих хромофор, соответствует Ser65-Tyr66-Gly67 региону avGFP. Эти аминокислотные остатки легко могут быть идентифицированы у любого GFP-подобного белка путем выравнивания его последовательности с последовательностью avGFP.
[009] Флуоресцентные белки представляют собой уникальное семейство структурно родственных белков, которые способны формировать хромофор автокаталитически без привлечения внешних субстратов или кофакторов. Под действием индуцирующего света, хромофор производит флуоресценцию, легко детектируемую с помощью современного лабораторного оборудования (спектрофлуориметр, флуоресцентный микроскоп, флуоресцентно-активируемый клеточный сортер, планшетный флуориметр).
[010] Процесс автокаталитического формирования хромофора белков с различными спектральными свойствами подробно описан в ряде статей и включает несколько химических реакций (Heim et al. (1994) Proc Natl Acad Sci USA. 91:12501-12504; Ormo et al. (1996) Science. 273:1392-1395; Yang et al. (1996) Nat Biotechnol. 14:1246-1251; Brejc et al. (1997) J. Proc Natl Acad Sci USA. 94:2306-2311; Palm et al. (1997) Nat Struct Biol. 4:361-365; Gurskaya et al. (2001) BMC Biochem. 2:6; Gross et al. (2000) Proc Natl Acad Sci USA. 97:11990-11995; Wall et al. (2000) Nat Struct Biol. 7:1133-1138; Yarbrough et al. (2001) J. Proc Natl Acad Sci USA. 98:462-467; Pakhomov et al. (2008) Chem. Biol., 15:755-764; Quillinet et al. (2005) Biochemistry 44:5774-5787; Yampolsky et al. (2005) Biochemistry 44: 5788-5793; Shu et al. (2006) Biochemistry 45:9639-9647; Kikuchi et al. (2008) Biochemistry 47:11573-11580; Yampolsky et al., (2009) Biochemistry, 48 (33):8077-8082).
[011] GFP-подобные белки широко используют для создания генетически-кодируемых биосенсоров (Prinz et al., Proteomics 2008, 8, 1179-1196). Исследование внутриклеточных процессов с помощью таких биосенсоров становятся все более популярным, так как только такие сенсоры могут дать информацию об изменении исследуемого параметра непосредственно в живой системе. Генетически-кодируемые биосенсоры востребованы как в фундаментальных исследованиях сигнальных путей организма, так и при тестировании токсических и лекарственных препаратов на модельных клеточных линиях или организмах. Генетически кодируемые биосенсоры относятся к классу безреагентных и многоразовых сенсоров, в отличие от химических индикаторов биологически активных субстанций, требующих экзогенно добавляемых красителей, субстратов или кофакторов.
[012] Биосенсоры на основе флуоресцентных белков представляют собой химерные белки, в состав которых входит сенсорный домен - белок, белковый домен или полипептид, чувствительный к изменению определенного параметра клетки, например, изменению концентрации какого-либо соединения, иона или молекулы (ионов кальция, перекиси водорода, ионов водорода и т.д.). В качестве сигнальной части биосенсора используют GFP-подобные белки.
[013] Одним из типов биосенсоров являются так называемые транслокационные сенсоры, в которых сенсорный домен, связываясь с тестируемым соединением, индуцирует изменение клеточной локализации белка (например, транслокацию из цитоплазмы на плазменную мембрану, из цитоплазмы в ядро или наоборот). Детектируемым параметром в таких биосенсорах является изменение локализации флуоресцентного сигнала в клетке.
[014] Другой тип - спектральные биосенсоры, способные в ответ на появление в среде тестируемого соединения изменять конформацию сенсорного домена. Это изменение в свою очередь вызывает изменение конформации и спектральных свойств входящего в состав биосенсора GFP-подобного белка. В таких биосенсорах часто используют варианты GFP-подобных белков, подвергнутые круговой пермутации (Suslova et al. (2005) Trends Biotechnol. 23(12):605-13; Griesbeck, (2004) Curr Opin Neurobiol., 14(5):636-641; Bunt et al. (2004) Int Rev Cytol., 237:205-277).
[015] Создание пермутированных GFP-подобных белков необходимо для увеличения подвижности хромофорного окружения и, следовательно, для большей лабильности спектральных свойств белка. Круговая пермутация флуоресцентных белков описана (Topell S. et al. (2002) Methods in Molecular Biology. 183:31-48). Например, для круговой пермутации avGFP в его первичную структуру вносится разрыв в область между 144 и 149 аминокислотами, нативные N- и С-концы оперативно совмещаются при помощи полипептидного линкера. Новые N- и С-концы находятся в непосредственной близости от хромофора и могут влиять на его микроокружение. Круговая пермутация производится на уровне нуклеиновой кислоты путем оперативного сшивания 3'- и 5'-концов нуклеотидной последовательности, кодирующей флуоресцентный белок, и внесения разрыва в последовательность между кодонами, кодирующими новые N- и С-концевые аминокислоты. Методы для получения таких конструкций хорошо известны специалистам в данной области. В результате круговой пермутации кпФБ (круговой пермутант флуоресцентного белка) приобретает способность реагировать на конформационные перестройки в области новых N- и С-концов изменением спектра флуоресценции (сенсоры с использованием обычных флуоресцентных белков оказались малочувствительными). Эффективность биосенсоров на основе кпФБ, полученных из avGFP, была продемонстрирована на примере сенсора на ионы кальция (Nagai et al., (2001) Proc Natl Acad Sci USA. 98(6):197-202) и пероксид водорода (Belousov et al., (2006) Nature Method. 4:281-286).
[016] Одним из важнейших и изученных липидных вторичных мессенджеров является фосфатидилинозитол-3,4,5-трифосфат (PIP3), для детекции которого востребованы генетически-кодируемые биосенсоры. PIP3 представляет собой фосфорилированное производное фосфатидилинозитола (PI), отрицательно заряженного фосфолипида, минорного компонента цитоплазматической стороны клеточной мембраны эукариотических клеток. Фосфатидилинозитол представляет собой глицерофосфолипид, содержащий скелет глицерола, замещенный двумя остатками жирных кислот и полярной инозитольной группой через остаток фосфорной кислоты. Инозитол в составе фосфатидилинозитола может быть фосфорилирован с образованием фосфатидилинозитол фосфата (PIP), фосфатидилинозитол бифосфата (PIP2) и фосфатидилинозитол трифосфата (PIP3). PIP, PIP2 и PIP3 называют фосфоинозитидами.
[017] Внутриклеточная передача сигнала с участием фосфорилированных форм фосфатидилинозитола (PI), фосфоинозитидов, происходит в ответ на активацию рецепторов на плазматической мембране (ПМ), таких как тирозинкиназные рецепторы (Bae et al. (2000) The Journal of biological chemistry 275: 10527-31; Bäumer et al. (2008) The Journal of biological chemistry 283:7864-76), рецепторы, сопряженные с G-белком (Xu et al. (2007) The Journal of cell biology 178:141-53), и интегрины (Kolanus et al. (1997) Current opinion in cell biology 9:725-31).
[018] Различные формы фосфоинозитидов находятся во всех внутриклеточных мембранах и участвуют в регуляции многих сигнальных процессов, как правило, через привлечение белков с фосфоинозитид-взаимодействующими доменами. Эти домены отличаются друг от друга по специфичности к разным формам фосфоинозитидов (Várnai et al. (2006) Biochimica et biophysica acta 1761:957-67). Pl и фосфоинозитиды могут быть фосфорилированы фосфатидилинозитолкиназами и дефосфорилированы липидными фосфатазами. Фосфатидилинозитол-3-киназы (PI-3K) фосфорилирует фосфатидилинозитол-4,5-дифосфат с образованием PIP3, который в дальнейшем может быть дефосфорилирован липидной фосфатазой PTEN (Tamguney et al. (2007) Journal of cell science 120:4071-9).
[019] Образование в мембране PIP3 может быть обнаружено с помощью химерных флуоресцентных белков, таких как GFP, оперативно слитых с фосфоинозитид-чувствительными белковыми доменами PI-3K (Cantley LC (2002) Science 296:1655-1657). В частности, было разработано несколько транслокационных биосенсоров для детекции PIP3 с использованием доменов протеинкиназы Akt, тирозин киназы Брутона (Bruton's tyrosine kinase, Btk) и основного рецептора для фосфоинозитида-1 (GRP1), описанных Varnai et al. (1999; J Biol Chem 274:10983-10989); Venkateswarlu et al. (1998; Biochem J 335:139-146), Watton и Downward (1999; Cirr Biol 9:433-436); Sato et al. (2003; Nat Cell Biol 5:1016-1022). Транслокационный биосенсор BtkPH-GFP (Varnai et al. (1999) J Biol Chem 274:10983-10989), являющийся химерным белком, состоящим из РН (pleckstrin homology)-домена Btk (1-117 аминокислоты Btk), оперативно связанным своим С-концом с N-концом EGFP, принят Заявителем в качестве аналога.
[020] BtkPH-GFP транслоцируется из цитоплазмы к мембране в ответ на появление PIP3 и позволяет по изменению распределения интенсивности флуоресценции между цитоплазмой и мембраной оценивать пространственно-временной характер действия липидных протеинкиназ и фосфатаз.
[021] Другим важным вторичным мессенджером является пероксид водорода (Н2O2), который действует путем специфичного обратимого окисления редокс-активных тиоловых групп в остатках цистеинов некоторых белков. Предполагают, что внутриклеточные сигнальные эффекты Н2О2 осуществляются в соответствии с моделью компартментализованной окислительно-восстановительной передачи сигнала, когда белок-мишень и источник Н2O2 находятся в непосредственной близости друг от друга.
[022] Для детекции пероксида водорода описан флуоресцентный биосенсор Hyper, разработанный Заявителем (принят Заявителем в качестве ближайшего аналога).
[023] Hyper представляет собой химерный белок, состоящий из регуляторного домена белка OxyR E.coli, реагирующего с пероксидом водорода и интегрированного в пептидную цепь OxyR пермутированного желтого флуоресцентного белка cpYFP. Hyper представляет собой конструкцию, в которой cpYFP соединен с двумя фрагментами чувствительного к Н2O2 домена OxyR посредством коротких пептидных линкеров. Нуклеотидные последовательности, кодирующие фрагменты белка OxyR и cpYFP, оперативно сшиты между собой с использованием линкерных последовательностей. Линкерные последовательности - нуклеотидные последовательности, кодирующие одну или несколько аминокислот, используются для повышения подвижности частей химерного белка относительно друг друга и способствуют более успешному формированию правильной 30-структуры (Belousov et al. (2006), Nature Methods; 3(4):281-286).
[024] Разработанные на сегодняшний день биосенсоры могут быть использованы для мониторинга одного из клеточных параметров. Однако в большом числе случаев востребованным является одновременный мониторинг нескольких клеточных параметров. Однако на сегодняшний день многопараметрических биосенсоров не разработано.
[025] В частности, известно, что генерация пероксида водорода NADPH-оксидазами и сигнализация с участием липидов являются кооперативными процессами. Сборка компонентов комплекса NADPH-оксидазы на мембране и ее активация зависят от появления продуктов активности PI-3K (Kanai et al. (2001) Nature cell biology 3:675-8). H2O2, продуцируемый NADPH-оксидазами, окисляет тиолат в активном центре фосфатазы PTEN и тем самым увеличивает время жизни продуктов PI-3K (Dröge et al. (2002) Physiological reviews 82:47-95).
[026] Так как липидная и окислительно-восстановительная сигнализация, как правило, взаимосвязаны, то технология одновременного наблюдения за появлением PIP3 и продукцией Н2О2 является высоко востребованной, однако биосенсоров для одновременного мониторинга продукции Н2O2 и PIP3 в клетках до сих пор не было создано.
Раскрытие изобретения
[027] Таким образом, изобретательской задачей было создание двупараметрического флуоресцентного биосенсора, позволяющего проводить одновременный мониторинг продукции Н2O2 и активности PI-3K (продукции PIP3) в живой клетке.
[028] Заявителем было установлено, что химерный белок с аминокислотной последовательностью SEQ ID NO:02, содержащий аминокислотную последовательность РН-домена протеинкиназы Btk с заменой Е41К (то есть заменой остатка глутаминовой кислоты в положении 41 на остаток лизина), оперативно связанную своим С-концом с N-концом биосенсора Hyper через короткий полипептидный линкер, позволяет осуществлять одновременную детекцию изменений концентрации Н2О2 и PIP3 в живой клетке.
[029] Таким образом, предметом изобретения является охарактеризованный выше химерный белок с SEQ ID NO:02, являющийся флуоресцентным биосенсором для одновременной детекции пероксида водорода и фосфатидилинозитол-3,4,5-трифосфата в живых клетках, в том числе в клетках живого организма.
[030] Другим объектом изобретения является выделенная нуклеиновая кислота (НК) с последовательностью SEQ ID NO:1, которая кодирует указанный выше флуоресцентный биосенсор с последовательностью SEQ ID NO:02.
[031] Выделенные нуклеиновые кислоты, последовательности которых отличаются от представленных нуклеотидных последовательностей вследствие вырожденности генетического кода, также входят в рамки настоящего изобретения.
[032] В настоящем изобретении также предусмотрены генетические конструкции для амплификации и экспрессии заявленной НК: векторы, включающие нуклеиновую кислоту по настоящему изобретению, а также кассеты экспрессии.
[033] Кроме того, в настоящем изобретении предусмотрены клетки, стабильные клеточные линии, трансгенные животные и трансгенные растения, включающие нуклеиновые кислоты, векторы или экспрессионные кассеты по настоящему изобретению.
[034] Кроме того, в настоящем изобретении предусмотрены наборы, включающие нуклеиновые кислоты, векторы или экспрессионные кассеты по настоящему изобретению.
[035] Заявитель подтверждает, что ему не известен химерный белок, выделенная нуклеиновая кислота и связанные с ними другие объекты изобретения из предшествующего уровня техники.
[036] Указанные выше аналоги являются условными, так как отличаются от предусмотренного биосенсора по назначению.
[037] Химерный белок - биосенсор не имеет также известного из уровня техники близкого структурного аналога. Также полученный Заявителем близкий по структуре химерный белок с аминокислотной последовательностью SEQ ID NO:03, кодируемый нуклеиновой кислотой с последовательностью SEQ ID NO:4, вообще не обнаружил свойств двупараметрического биосенсора (см. данные Примера 2).
Краткое описание фигур
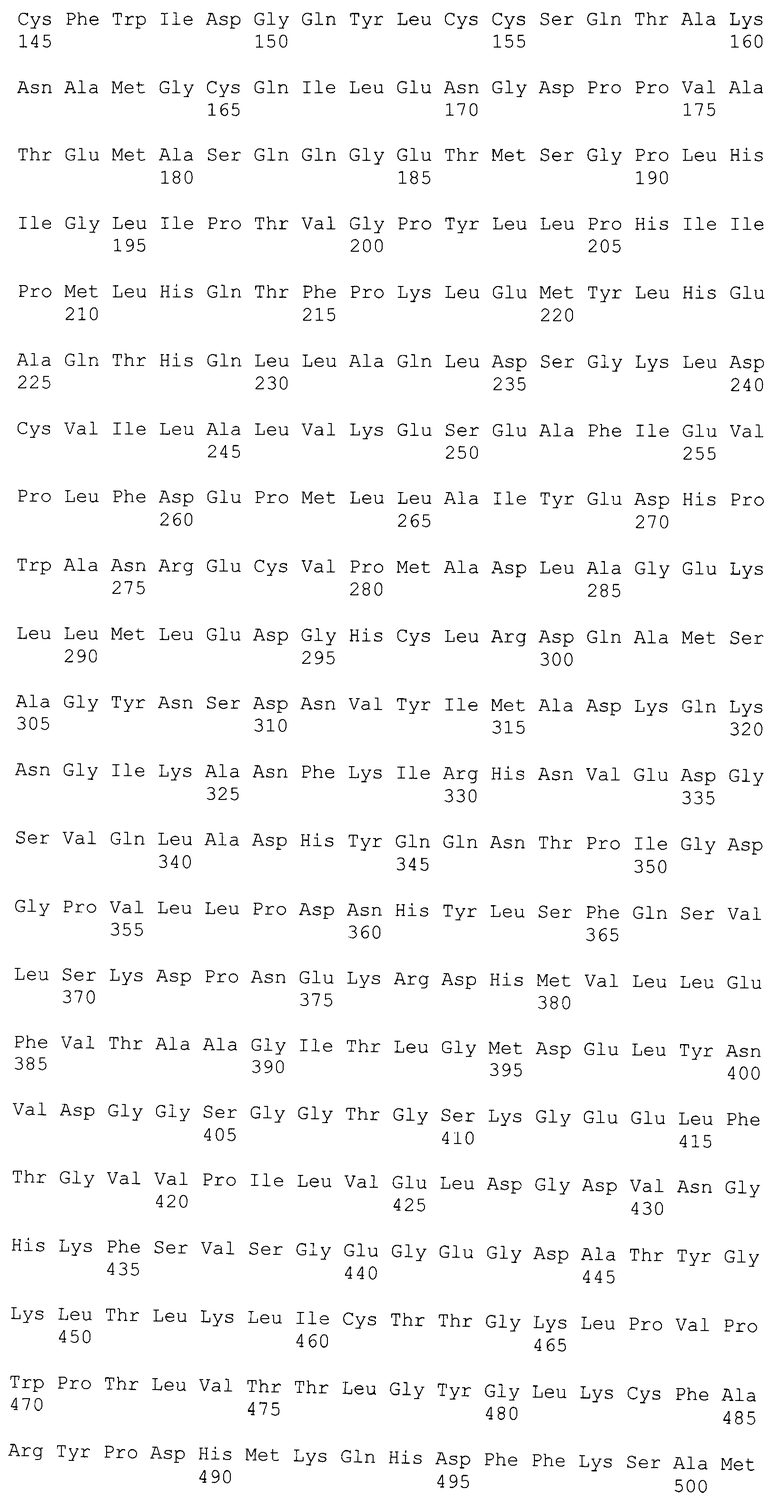
[038] Фиг.1 показывает принципиальную схему строения биосенсора (от N-конца к С-концу белка) для одновременной детекции пероксида водорода и PIP3. Линией обозначен полипептидный линкер, связывающий РН-домен протеинкиназы Btk и Hyper.
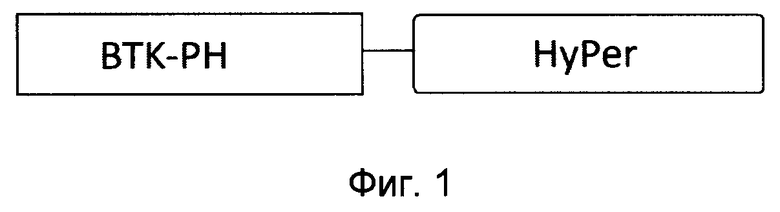
[039] Фиг.2 показывает серию флуоресцентных микрофотографий клеток NIH-3Т3, экспрессирующих pBtkPH-E41K-HyPer, отражающих динамику изменения концентрации Н2О2 и PIP3 у цитоплазматической поверхности ПМ в ответ на стимуляцию клеток PDGF. Клетки стимулировали PDGF (10 нг/мл). Соответствующие временные точки в минутах отмечены на каждом изображении. Верхний ряд серии изображений является ратиометрическим и представляет внутриклеточное распределение отношения F500/F420, отражающее изменения концентрации Н2O2. Средний и нижний ряды изображений демонстрирует внутриклеточное распределение BtkPH-E41K-HyPer в двух каналах детекции флуоресценции. На первом изображении из верхнего ряда обведены отдельные клетки и пронумерованы 1-4. Масштабная линейка 15 мкм.
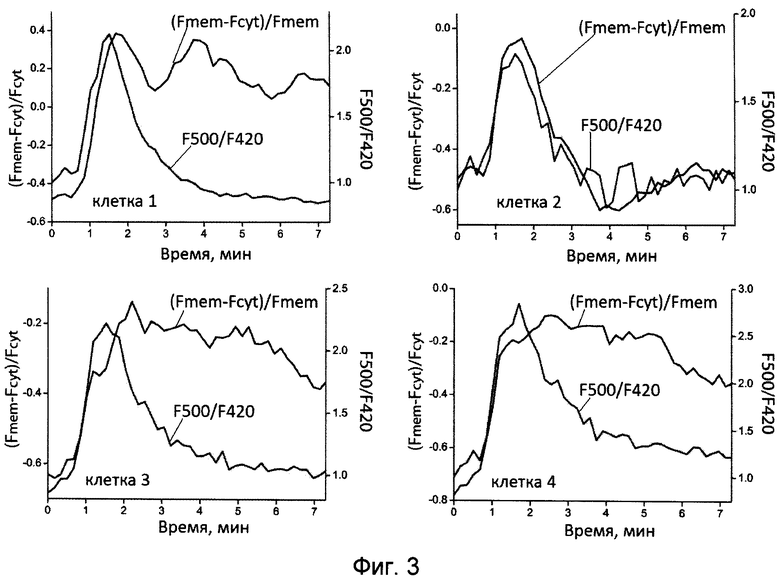
[040] Фиг.3 показывает графики, отражающие активацию PI-3K и изменение концентрации Н2O2 в каждой отдельной клетке, представленной на Фиг.2. Отношение F500/F420 отражает изменение концентрации Н2O2, отношение (Fmem-Fcyt)/Fmem отражает транслокацию биосенсора на мембрану.
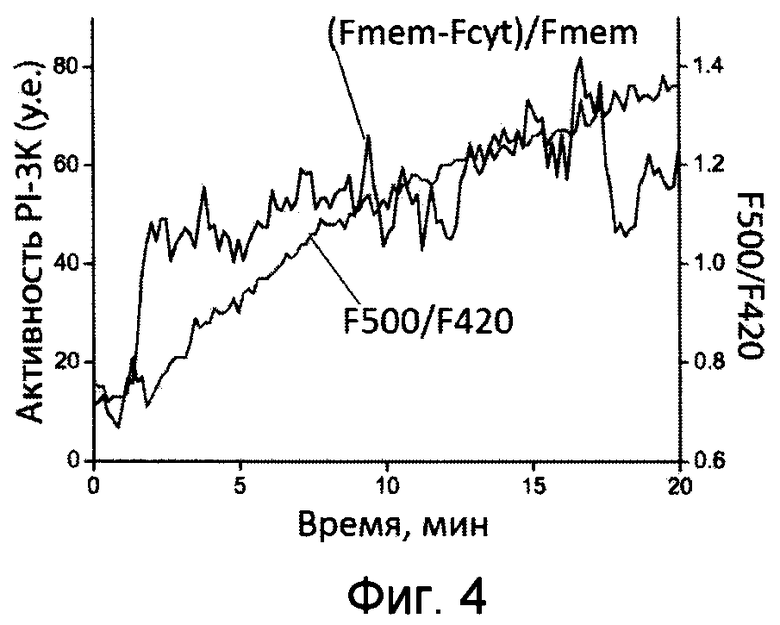
[041] Фиг.4 показывает динамику изменения концентрации Н2O2 и PIP3 у цитоплазматической поверхности плазматической мембраны Тн-лимфоцитов при формировании иммунологического синапса (ИС).
Осуществление изобретения
[042] Как указано выше, настоящее изобретение направлено на выделенные молекулы нуклеиновых кислот, которые кодируют двупараметрический флуоресцентный биосенсор, позволяющий проводить одновременную детекцию изменения концентрации пероксида водорода и фосфатидилинозитол-3,4,5-трифосфата в живых клетках. Заявленный биосенсор является химерным белком, включающим РН-домен протеинкиназы Btk с заменой Е41К, оперативно связанный через короткий полипептидный линкер с биосенсором, на пероксид водорода Hyper. Также обеспечиваются векторы и кассеты экспрессии, включающие нуклеиновую кислоту настоящего изобретения. Кроме того, обеспечиваются клетки, стабильные клеточные линии, трансгенные животные и трансгенные растения, включающие нуклеиновые кислоты, векторы или экспрессионные кассеты настоящего изобретения. Также обеспечиваются выделенные рекомбинантные белки, кодируемые нуклеиновыми кислотами настоящего изобретения.
[043] Указанные нуклеиновые кислоты применяются во многих приложениях и методах, в частности, для одновременного мониторинга изменений концентрации пероксида водорода и фосфатидилинозитол-3,4,5-трифосфата внутри живых клеток и выявления клеток, в которых произошла активация продукции переоксида водорода и PIP3.
[044] Для более полного раскрытия вышеперечисленных характеристик настоящего изобретения ниже предлагается детальное описание изобретения, кратко сформулированного выше, в виде различных объектов его воплощения.
Белок-биосенсор
[045] В настоящем документе предусмотрен двупараметрический флуоресцентный биосенсор.
[046] Заявленный биосенсор обладает способностью к детектируемой флуоресценции, которая может быть зарегистрирована с помощью визуального скрининга, спектрофотометрии, спектрофлуориметрии, флуоресцентной микроскопии, с помощью FACS или другим общепринятым способом для регистрации флуоресценции. В отсутствие пероксида водорода, заявленный биосенсор имеет максимум (пик) эмиссии в диапазоне от 500 нм до 550 нм, например, 520 нм, и два пика возбуждения флуоресценции; первый в диапазоне 400-450 нм (например, 420 нм) и второй в диапазоне 470-510 нм (например, 500 нм).
[047] Предусмотренный в настоящем документе флуоресцентный биосенсор является двупараметрическим биосенсором, который благодаря связывающему РН-домену протеинкиназы Btk транслоцируется на плазматическую мембрану эукариотических клеток при связывании с PIP3 и детектируемо изменяет спектральные характеристики флуоресценции при связывании с пероксидом водорода.
[048] При появлении пероксида водорода заявленный биосенсор переходит в окисленное состояние. При окислении биосенсора меняется интенсивность флуоресценции при возбуждении светом с длиной волны 500 нм (F500) к интенсивности флуоресценции при возбуждении светом с длиной волны 420 нм (F420). Для нужд настоящего изобретения соотношение «F500/F420» является сигналом биосенсора на перекись водорода.
[049] При экспрессии в клетке хозяине НК настоящего изобретения происходит накопление заявленного биосенсора в цитоплазме клеток. При появлении PIP3 заявленный биосенсор меняет внутриклеточную локализацию, то есть транслоцируется, из цитоплазмы клеток на ее плазменную мембрану. Для нужд настоящего изобретения изменение внутриклеточной локализации биосенсора является его сигналом на PIP3. Изменение внутриклеточной локализации биосенсора можно отслеживать по локализации флуоресцентного сигнала в клетке с помощью флуоресцентной микроскопии.
[050] Предусмотренный в настоящем документе флуоресцентный биосенсор является химерным белком, структура которого показана на Фиг.1. Методы получения химерных белков хорошо известны в данной области и подробно описаны в разделе «Молекулы нуклеиновых кислот», infra.
[051] Входящие в состав многопараметрического биосенсора по изобретению белок Hyper и РН-домен оперативно связаны друг с другом, с помощью полипептидного линкера (Фиг.1). Длина и состав аминокислот линкера может быть различен. Например, длина линкера может быть от 1 аминокислотного остатка до 100 аминокислотных остатков, чаще 10-50 аминокислотных остатков, например 20, 25, 30, 33, 35, 40, 45 аминокислотных остатков. Последовательность аминокислот линкера может варьировать в широких пределах, так как в большинстве случаев не влияет на функционирование химерного белка.
[052] Специфические биосенсоры, представляющие интерес, включают биосенсор, имеющий аминокислотную последовательность SEQ ID No:2.
[053] Также обеспечиваются белки, которые по существу сходны с указанным выше специфическим белком, где по существу сходны означает, что эти белки имеют аминокислотную последовательность, идентичную последовательности исходного белка, по крайней мере, на 85% идентичности, обычно, по крайней мере, 90% и чаще, по крайней мере, 95%, (например, 95% и выше; 96% и выше, 97% и выше; 98% и выше: 99% и выше или 100% идентичности последовательности).
[054] Например, мутантные варианты биосенсора могут быть получены с использованием стандартных методов молекулярной биологии, как подробно описано в разделе "молекулы нуклеиновых кислот" ниже. Примеры обеспечивают общие приемы, и использование стандартных способов, так что специалисты, квалифицированные в данной области, могут легко получить большой ряд дополнительных мутантов и проверить, было ли изменено биологическое (например, биохимическое, спектральное, и т.д.) свойство. Например, интенсивность флуоресценции может быть измерена с использованием спектрофлуориметра при различных длинах волн возбуждения.
[055] Мутанты могут сохранять свойства исходного белка или могут иметь биологические свойства, отличные от форм исходного белков. Термин "биологические свойства" белков настоящего изобретения относится, но не лимитирован, спектральными свойствами, такими как максимум возбуждения флуоресценции, максимум испускания, максимальный коэффициент экстинкции, яркость (например, по сравнению с референсным белком), фотостабильность и подобные; биохимические свойства, такие как in vivo и/или in vitro стабильность (например, полупериод распада); скорость созревания, склонность к агрегации и склонность к олигомеризации и другие подобные свойства (по сравнению с референсным белком). Мутации включают единичные аминокислотные замены, делеции и инсерции одной или более аминокислот, укорочение или удлинение N-конца, укорочение или удлинение С- конца и тому подобное.
[056] Белки настоящего изобретения присутствуют в среде, отличной от их естественной среды; например, они рекомбинантны. Белки настоящего изобретения могут находиться в выделенном состоянии, что означает, что белки по существу свободны от других белков и других биологических молекул, присутствующих в естественной среде, таких как олигосахариды, нуклеиновые кислоты и их фрагменты и т.п., где термин "по существу свободны" в этом случае означает, что меньше чем 70%, обычно меньше чем 60% и чаще меньше чем 50% композиции, содержащей выделенный белок, представляет собой некоторые другие биологические молекулы, встречающиеся в природе. В некоторых воплощениях, белки присутствуют в по существу очищенной форме, где "по существу очищенная форма" означает очищенная, по меньшей мере, на 95%, обычно, по меньшей мере, на 97% и чаще, по меньшей мере, на 99%.
[057] Заявленные белки могут быть получены искусственным путем, например, экспрессией рекомбинантной нуклеиновой кислоты, кодирующей последовательность, белка, представляющего интерес, в соответствующем хозяине, как описано ниже. Для очистки белка могут применяться любые обычные методики, где подходящие методы очистки белка описаны в Guide to Protein Purification (Deuthser ed., Academic Press, 1990). Например, лизат может быть приготовлен из исходного источника и очищен с использованием ВЭЖХ, вытеснительной хроматографии, гель-электрофореза, афинной хроматографии и т.п.
Молекулы нуклеиновых кислот
[058] Настоящее изобретение обеспечивает молекулы нуклеиновых кислот, кодирующие флуоресцентный биосенсор для одновременной детекции пероксида водорода и активности PI-3K внутри живых клеток, имеющий аминокислотную последовательность SEQ ID NO:02. Специфическим примером НК по данному изобретению является нуклеиновая кислота с последовательностью нуклеотидов, показанная в SEQ ID NO:01.
[059] Как здесь используется, молекула нуклеиновой кислоты представляет собой молекулу ДНК, такую как геномная ДНК или кДНК, или молекулу РНК, такую как молекула мРНК. Как здесь используется, термин "кДНК" относится к нуклеиновым кислотам, которые обладают размещением элементов последовательности, найденным в нативных зрелых мРНК, где элементы последовательности представляют собой экзоны и 5' и 3' некодирующие области.
[060] Молекула нуклеиновой кислоты, кодирующая флуоресцентный биосенсор, может быть синтезирована из подходящих нуклеозидтрифосфатов или выделена из биологических источников.
[061] Оба метода основаны на хорошо известных в данной области протоколах. Например, доступность информации о последовательности аминокислот или информации о нуклеотидной последовательности дает возможность изготовить выделенные молекулы нуклеиновых кислот по настоящему изобретению с помощью олигонуклеотидного синтеза. В случае использования информации о последовательности аминокислот, может быть синтезировано несколько нуклеиновых кислот, отличающихся друг от друга вследствие вырожденности генетического кода. Методы выбора вариантов кодонов для требуемого хозяина хорошо известны в данной области. Синтетические олигонуклеотиды могут быть приготовлены с помощью фосфорамидитного метода, и полученные конструкты могут быть очищены с помощью хорошо известных в данной области методов, таких как высокоэффективная жидкостная хроматография (ВЭЖХ), или других методов, как описано, например, в Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd Ed., (1989) Cold Spring Harbor Press, Cold Spring Harbor, NY, и пo инструкции, описанной, например, United States Dept. of HHS, National Institute of Health (NIH) Guidelines for Recombinant DNA Research.
[062] Части нуклеиновой кислоты, кодирующие различные элементы (белковые домены, белки, линкерные полипептиды), могут быть встроены в полилинкер вектора, таким образом, что между различными частями не будет стоп-кодонов в рамке считывания и не будет сбоек рамки считывания. Альтернативно, желательная нуклеотидная последовательность может быть собрана из фрагментов с помощью ДНК-лигазы или ПЦР с праймерами, содержащими части, комплементарные концевым последовательностям соединяемых фрагментов. Нуклеиновая кислота, кодирующая биосенсор или его фрагмент, может быть выделена любым из многих известных методов.
[063] Кроме того, также обеспечиваются вырожденные варианты нуклеиновых кислот, которые кодируют биосенсор настоящего изобретения. Вырожденные варианты нуклеиновых кислот включают замены кодонов нуклеиновой кислоты на другие кодоны, кодирующие те же самые аминокислоты. В частности, вырожденные варианты нуклеиновых кислот создают для увеличения экспрессии в клетке-хозяине. В этом воплощении кодоны нуклеиновой кислоты, которые не являются предпочтительными или являются менее предпочтительными в генах клетки-хозяина, заменены кодонами, которые обильно представлены в кодирующих последовательностях генов в клетке-хозяине, где указанные замененные кодоны кодируют ту же самую аминокислоту.
[064] Заявленные нуклеиновые кислоты могут быть выделены и получены по существу в очищенной форме. По существу очищенная форма означает, что нуклеиновые кислоты являются, по меньшей мере, приблизительно на 50% чистыми, обычно, по меньшей мере, приблизительно на 90% чистыми и обычно являются "рекомбинантными", то есть они фланкированы одним или более нуклеотидами, с которыми обычно не связаны в хромосоме, встречающейся в природе в ее естественном организме-хозяине.
[065] Изменения или различия в нуклеотидной последовательности между высоко сходными нуклеотидными последовательностями могут представлять нуклеотидные замены в последовательности, которые возникают в процессе нормальной репликации или дупликации. Другие замены могут быть специально рассчитаны и вставлены в последовательность для определенных целей таких, как изменение кодонов определенных аминокислот или нуклеотидной последовательности регуляторного региона. Такие специальные замены могут быть произведены in vitro с помощью различных технологий мутагенеза или получены в организмах-хозяевах, находящихся в специфических селекционных условиях, которые индуцируют или отбирают эти изменения. Такие специально полученные варианты последовательности могут быть названы "мутантами" или "производными" исходной последовательности.
[066] Мутантные или производные нуклеиновые кислоты могут быть получены на матричной нуклеиновой кислоте, выбранной из вышеописанных нуклеиновых кислот, путем модификации, делеции или добавления одного или более нуклеотидов в матричной последовательности или их комбинации, для получения варианта матричной нуклеиновой кислоты. Модификации, добавления или делеции могут быть выполнены любым способом, известным в данной области (см., например, Gustin et al., Biotechniques (1993) 14:22; Barany, Gene (1985) 37:111-123; и Colicelli et al., Mol. Gen. Genet. (1985) 199:537-539, Sambrook et al., Molecular Cloning: A Laboratory Manual, (1989), CSH Press, pp.15.3-15.108), включая подверженный ошибкам ПЦР (error-prone PCR), shuffling, олигонуклеотид-направленный мутагенез, ПЦР со сборкой, парный ПЦР мутагенез, мутагенез in vivo, кассетный мутагенез, рекурсивный множественный мутагенез, экспоненциальный множественный мутагенез, сайт-специфический мутагенез, случайный мутагенез, генное реассемблирование (gene reassembly), генный сайт-насыщающий мутагенез (GSSM), искусственную перестройку с легированием (SLR) или их комбинации. Модификации, добавления или делеции могут быть также выполнены методом, включающим рекомбинацию, рекурсивную рекомбинацию последовательностей, фосфотиоат-модифицированный мутагенез ДНК, мутагенез на урацил-содержащей матрице, мутагенез с двойным пропуском, точечный восстановительный по рассогласованию мутагенез, мутагенез штамма, дефицитного по восстановлениям, химический мутагенез, радиоактивный мутагенез, делетационный мутагенез, рестрикционно-избирательный мутагенез, рестрикционный мутагенез с очисткой, синтез искусственных генов, множественный мутагенез, создание химерных множественных нуклеиновых кислот и их комбинации.
[067] Также предусмотрены вектор и другие конструкции нуклеиновой кислоты, содержащие заявленные нуклеиновые кислоты.
[068] Подходящие векторы включают вирусные и невирусные векторы, плазмиды, космиды, фаги и т.д., предпочтительно плазмиды, и используются для клонирования, амплификации, экспрессии, переноса и т.д. последовательности нуклеиновой кислоты настоящего изобретения в подходящего хозяина. Выбор подходящего вектора является понятным для квалифицированного специалиста в данной области, множество таких векторов доступно коммерчески. Для приготовления конструкции полноразмерную нуклеиновую кислоту или ее часть обычно вставляют в вектор посредством соединения ДНК-лигазой с расщепленным ферментами рестрикции сайту в векторе.
[069] Альтернативно, желательная нуклеотидная последовательность может быть вставлена гомологичной рекомбинацией in vivo, обычно, присоединением гомологичных участков к вектору на флангах желательной нуклеотидной последовательности. Гомологичные участки добавляют легированием олигонуклеотидов или полимеразной цепной реакцией с использованием праймеров, включающих, например, как гомологичные участки, так и часть желательной нуклеотидной последовательности.
[070] Также предусмотрены кассеты экспрессии или системы, используемые для получения заявленных флуоресцентных биосенсоров или для репликации заявленных молекул нуклеиновой кислоты.
[071] В экспрессионном векторе или кассете экспрессии заявленная нуклеиновая кислота является оперативно связанной с регуляторной последовательностью, которая может включать промоторы, энхансеры, терминаторы, операторы, репрессоры и индукторы и обеспечивает инициацию считывания РНК (транскрипции) в клетке-хозяине. В экспрессионном векторе или кассете экспрессии нуклеиновая кислота настоящего изобретения может быть также связана с сигналами терминации транскрипции, функциональным в клетке-хозяине. Методы изготовления кассет экспрессии или систем для экспрессии желаемого продукта известны специалистам, квалифицированным в данной области.
[072] Кассета экспрессии может существовать, как внехромосомный элемент или может быть включена в геном клетки в результате введения указанной кассеты экспрессии в клетку. Для экспрессии генный продукт, кодируемый нуклеиновой кислотой по изобретению, экспрессируется в любой удобной системе экспрессии, включая, например, бактериальные системы, дрожжевые клетки, клетки насекомых, земноводных или млекопитающих.
[073] Клеточные линии, которые устойчиво экспрессируют белки настоящего изобретения, могут быть получены способами, известными в данной области (например, котрансфекцией с селектируемым маркером, таким как dhfr, gpt, неомицин, гигромицин, что делает возможным выявление и выделение трансфецированных клеток, которые содержат ген, включенный в геном).
[074] Вышеописанные системы экспрессии могут использоваться в прокариотических или эукариотических хозяевах. Для получения белка могут использоваться клетки-хозяева, такие как Е. coli, В. subtilis, S. cerevisiae, клетки насекомого в комбинации с бакуловирусными векторами, или другие эукариотические клетки, например, COS 7, НЕК 293, СНО, ооциты Xenopus и т.д. Если для репликации и/или экспрессии нуклеиновых кислот изобретения используется любая вышеупомянутая клетка-хозяин или другие подходящие клетки-хозяева или организмы, то полученная реплицированная нуклеиновая кислота, экспрессированный белок или полипептид находятся в рамках притязания изобретения как продукт клетки-хозяина или организма.
Трансформанты
[075] Нуклеиновые кислоты настоящего изобретения могут быть использованы для получения трансформатов, включая трансгенные организмы или клеточные линии с сайт-специфичными генными изменениями. Трансгенные клетки по настоящему изобретению содержат одну или более нуклеиновых кислот по настоящему изобретению в качестве трансгена.
[076] Для целей изобретения может быть использована любая приемлемая клетка-хозяин, включая прокариотические (например, Escherichia coli, Streptomyces sp., Bacillus subtilis, Lactobacillus acidophilus, и т.д.) или эукариотические клетки-хозяева.
[077] Трансгенный организм по настоящему документу может быть прокариотическим или эукариотическим организмом, включая бактерии, цианобактирии, грибы, растения и животные, в которых одна или больше клеток организма содержат гетерогенную нуклеиновую кислоту по настоящему документу, введенную посредством вмешательства человека такими способами как технологии трансгеноза, которые известны в данной области.
[078] Выделенная нуклеиновая кислота настоящего изобретения может быть введена в хозяина способами, известными в данной области, например инфицированием, трансфекцией, трансформацией или трансконъюгацией.
[079] Способы переноса молекулы нуклеиновой кислоты (то есть ДНК) в такие организмы широко известны и описаны в источниках, приведенных в настоящем документе в качестве ссылки, таких как Sambrook et al. (Molecular Cloning: A Laboratory Manual, 3nd Ed., (2001) Cold Spring Harbor Press, Cold Spring Harbor, NY). В одном воплощении трансгенный организм может быть прокариотическим организмом. Способы трансформации прокариотических хозяев хорошо известны в данной области (например, см. Sambrook et al. Molecular Cloning: A Laboratory Manual, 2nd edition (1989) Cold Spring Harbor Laboratory Press и Ausubel et al., Current Protocols in Molecular Biology (1995) John Wiley & Sons, Inc).
[080] В другом воплощении трансгенными организмами могут быть грибы, например дрожжи. Дрожжи широко используются как носители для экспрессии гетерогенного гена (например, см. Goodey et. al. Yeast biotechnology, DR Berry et al., eds, (1987) Allen and Unwin, London, pp.401-429 и King et al Molecular and Cell Biology of Yeasts, E F Walton and G T Yarronton, eds, Blackie, Glasgow (1989) pp.107-133). Доступно несколько типов дрожжевых векторов, включая интегративные векторы, которые требуют рекомбинации с геномом хозяина для их поддержания, и автономно реплицирующиеся плазмидные векторы.
[081] Другими организмами хозяевами могут быть животные. Трансгенные животные могут быть получены способами трансгеноза, известными в данной области и описанными в ссылках, например, Pinkert, Transgenic Animal Technology: a Laboratory Handbook, 2nd edition (2203) San Diego: Academic Press; Gersenstein and Vintersten, Manipulating the Mouse Embryo: A Laboratory Manual, 3rd ed, (2002) Nagy A. (Ed), Cold Spring Harbor Laboratory; Blau et al., Laboratory Animal Medicine, 2nd Ed., (2002) Fox J.G., Anderson L.C., Loew F.M., Quimby F.W. (Eds), American Medical Association, American Psychological Association; Gene Targeting: A Practical Approach by Alexandra L. Joyner (Ed.) Oxford University Press; 2nd edition (2000).
[082] Например, трансгенные животные могут быть получены гомологичной рекомбинацией, где изменяется эндогенный локус. Альтернативно, конструкция нуклеиновой кислоты включается в геном случайным образом. Векторы для устойчивого включения в геном включают плазмиды, ретровирусы и другие животные вирусы, YAC и т.п. Нуклеиновые кислоты могут быть введены в клетку непосредственно или опосредованно, введением в клетки-предшественники, путем намеренной генетической манипуляции, такой как микроинъекция или инфицирование рекомбинантным вирусом или рекомбинантным вирусным вектором и т.п.
[083] Термин «генетическая манипуляция» не включает классическое скрещивание или оплодотворение in vitro, а предпочтительно является направленным на введение рекомбинантных молекул нуклеиновых кислот. Эти молекулы нуклеиновой кислоты могут быть включены в хромосому, или являться внехромосомными реплицирующимися ДНК. Конструкции ДНК для гомологичной рекомбинации будут содержать, по меньшей мере, часть нуклеиновой кислоты по настоящему изобретению, где ген имеет желательную генетическую модификацию (модификации) и включает области гомологии с целевым локусом. Конструкциям ДНК для произвольного включения не обязательно содержать область гомологии с медиатором рекомбинации. Легко могут быть включены маркеры для положительной и отрицательной селекции. Способы получения клеток, имеющих целевые генные модификации, с помощью гомологической комбинации известны в данной области. Для различных способов трансфекции клеток млекопитающих см. Keown et al., Meth. Enzymol. (1990) 185:527-537.
[084] Для эмбриональных стволовых (ЭС) клеток могут быть использованы ЭС клеточные линии, или эмбриональные клетки могут быть получены непосредственно от хозяина, такого как мышь, крыса, морская свинка и т.д. Такие клетки выращиваются на подходящем фибропласт-питающем слое или в присутствии фактора ингибирования лейкемии (LIF). Трансформированные ЭС или эмбриональные клетки могут быть использованы для получения трансгенных животных, с помощью подходящего способа, описанного в данной области. Трансгенные животные могут быть любыми животными, не относящимися к человеку, включая млекопитающих, не относящихся к человеку (например, мышь, крыса), птиц или амфибий и т.д., и использованы в функциональном исследовании, скрининге лекарственного средства и т.п.
[085] Также могут быть получены трансгенные растения. Способы получения трансгенных растительных клеток и растений описаны в патентах США №№5767367; 5750870; 5739409; 5689049; 5689045; 5674731; 5656466; 5633155; 5629470; 5595896; 5576198; 5538879; 5484956; раскрытия которых включены в настоящий документ в качестве ссылки. Способы получения трансгенных растений также рассмотрены в Plant Biochemistry and Molecular Biology (eds. Lea and Leegood, John Wiley & Sons) (1993) pp.275-295 и в Plant Biotechnology and Transgenic Plants (eds. Oksman-Caldentey and Barz), (2002) p.719. Например, эмбриогенные эксплантаты, содержащие соматические клетки, могут использоваться для получения трансгенного хозяина. После сбора клеток или тканей экзогенная ДНК, представляющая интерес, вводится в растительные клетки, при этом для такого введения известен ряд различных способов. При наличии выделенных протопластов возникает возможность для введения нуклеиновых кислот через ДНК-опосредованные протоколы передачи генов, включая инкубацию протопластов с очищенной ДНК, такой как плазмида, содержащая целевую экзогенную последовательность, представляющую интерес, в присутствии поливалентных катионов (например, PEG или PLO); или электропорацию протопластов в присутствии выделенной ДНК, включающей целевую экзогенную последовательность. Протопласты, которые успешно включили экзогенную ДНК, затем отбирают, выращивают в каллус и, в конечном счете, при наличии подходящих количеств и соотношений стимулирующих факторов, таких как ауксины и цитокины, в трансгенное растение. Могут использоваться другие подходящие способы получения трансгенных растений, такие как применение "генной пушки", или Agrobacterium-опосредованная трансформация, которые доступны для квалифицированных специалистов в данной области.
Способы применения
[086] Биосенсоры настоящего изобретения являются генетически кодируемыми флуоресцентными белками, меняющими спектральные свойства в присутствии перекиси водорода и внутриклеточную локализацию в присутствии PIP3. Они могут быть использованы для одновременного мониторинга продукции перекиси водорода и PIP3 внутри живых клеток при различных биологических процессах.
[087] Для осуществления мониторинга должна быть получена нуклеиновая кислота, кодирующая биосенсор. Получение таких конструкций очевидно для любого специалиста в данной области. Полученная конструкция должна быть встроена в кассету экспрессии (или вектор), обеспечивающую временную или постоянную экспрессию этой нуклеиновой кислоты в клетках-хозяевах. Вектор или кассета экспрессии может содержать элементы, обеспечивающие адресную доставку конструкции в интересующие клетки, или находится в составе частиц, обеспечивающих адресную доставку. После трансфекции клеток вектором и по истечении времени, необходимого для наработки в клетках продукта экспрессии, может быть осуществлен мониторинг продукции перекиси водорода и PIP3 в данных клетках.
[088] Биосенсоры настоящего изобретения находят использование в скрининге препаратов, вызывающих активацию определенных белковых каскадов, например, активацию тирозинкиназ или PI-3K в клеточных линиях. Примером применения биосенсоров могут служить автоматизированные скрининги множества клеток, описанные, например, в патенте США №5989835.
[089] Заявленные биосенсоры также находят применение как метки продукции перекиси водорода и PIP3 in vivo для трансгенных животных. Например, экспрессия заявленного белка может сопровождаться тканеспецифичными промоторами, где такие способы находят применение в исследованиях для генной терапии, таких как тестирование эффективности лекарственных препаратов на животных моделях. Типичное применение флуоресцентных биосенсоров у трансгенных животных, которое поясняет такие применения, описано в W0 00/02997.
Наборы
[090] Также обеспечиваются в соответствии с настоящим изобретением наборы для использования при осуществлении одного или более вышеописанных применений. В предпочтительных воплощениях наборы обычно включают нуклеиновую кислоту, кодирующую биосенсор, предпочтительно с элементами для экспрессии биосенсора в клетке-хозяине. Например, наборы могут включать экспрессионный вектор, включающий нуклеиновую кислоту, кодирующую заявленный белок. Компоненты наборов обычно присутствуют в соответствующей среде для хранения, такой как водный или буферный раствор, обычно в соответствующей емкости. В отдельных воплощениях набор включает множество различных векторов, каждый из которых кодирует заявленный белок, где векторы предназначены для экспрессии в различных средах и/или при различных условиях. Например, для конститутивной экспрессии, набор включает вектор, имеющий сильный промотор для экспрессии в клетках млекопитающих, и вектор с ослабленным промотором. Могут быть так же включены векторы с множественными клонированными сайтами для выборочной вставки промотора и/или векторы для экспрессии в различных организмах, и т.д.
[091] В дополнение к описанным выше компонентам, заявленные наборы будут дополнительно включать инструкции для осуществления заявленных способов. Эти инструкции могут присутствовать в заявленных наборах в различных формах (например, в печатном варианте или на электроном носителе в виде текстового и/или графического файла) в количестве, одна или более.
[092] Следующие примеры приведены в иллюстративных целях, не ограничивающих объем изобретения.
Примеры
[093] Пример 1
[094] Создание конструктов pBtkPH-HyPer и BtkPH-E41 К-HyPer, кодирующих биосенсор для одновременной детекции пероксида водорода и активности PI-3K.
[095] Для создания конструкта pBtkPH-HyPer, кодирующего биосенсор по изобретению, нуклеотидную последовательность, кодирующую РН-домен тирозинкиназы Btk (Bruton's tyrosine kinase), амплифицировали с матрицы pEGFP-BtkPH (Balla и Várnai (2002) Science's STKE: signal transduction knowledge environment 2002:13) с помощью праймеров Pr1 (SEQ ID NO:05) и Pr2 (SEQ ID NO:06). Далее продукт амплификации очищали, обрабатывали эндонуклеазами рестрикции Nhel и BamHI (SibEnzime) и клонировали в вектор pHyPer-dMito (Evrogen), предварительно обработанный теми же эндонуклеазами рестрикции, вместо нуклеотидной последовательности, кодирующей двойной сигнал транспорта в митохондрии (MTS, Mitochondrial Targeting Signal).
[096] Верность последовательности полученного экспрессионного конструкта проверяли определением его нуклеотидной последовательности (секвенирование) с последующим анализом результата с помощью пакета программ DNAStar. Нуклеотидная и аминокислотная последовательности белка показаны в SEQ ID NO:03 и SEQ ID NO:04, соответственно.
[097] Для внесения мутации (Е41К) был проведен направленный мутагенез последовательности, кодирующей BtkPH-домен, с помощью праймеров Рr3 (SEQ ID NO:07) и Pr4 (SEQ ID NO:08), содержащих соответствующую точечную замену, по методике «overlap-extention PCR».
[098] Верность последовательности полученного экспрессионного конструкта проверяли определением его нуклеотидной последовательности (секвенирование) с последующим анализом результата с помощью пакета программ DNAStar. Нуклеотидная и аминокислотная последовательности белка показаны в SEQ ID NO:01 и SEQ ID NO:2, соответственно.
[099] Пример 2
[0100] Одновременная детекция продукции Н2O2 и PIP3 в клетках NIH-3T3 при активации PDGFR с помощью биосенсоров, кодируемых конструктами BtkPH-HyPer и BtkPH-E41K-HyPer.
[0101] Работа биосенсоров BtkPH-HyPer (SEQ ID NO:03, 04) и BtkPH-E41K-HyPer (SEQ ID NO:01, 02), полученных как описано в примере 1, была исследована в клетках линии NIH-3T3 в ответ на стимуляцию ростовым фактором PDGF.
[0102] Клетки NIH-3T3 культивировали в среде DMEM (ПанЭко) с 10% фетальной бычьей сывороткой (РАА Laboratories) с 1% пенициллина и стрептомицина, 2 мМ глутамина в атмосфере с 5% СО2 при 37°С.
[0103] Клетки трансфецировали с помощью реагента для трансфекции FuGENE 6 (Roche) в соответствии с инструкцией производителя. Для трансфекции клеток использовали соотношение FuGENE 6 (мкл): плазмидная ДНК (нг)=3:2.
[0104] Клетки NIH-3T3 за 48 часов до эксперимента рассаживали в чашки для конфокальной микроскопии диаметром 35 мм из расчета 2-3x104 клеток на чашку и трансфецировали. За 3-4 часа до начала микроскопии среду в конфокальных чашках с трансфецированными клетками NIH-3T3 заменяли на предварительно прогретую до 37°С среду MEM (Sigma), не содержащую сыворотки. Во время эксперимента к клеткам добавляли ростовый фактор PDGF до конечной концентрации 10 нг/мл.
[0105] Конфокальная микроскопия клеток, экспрессирующих различные варианты Hyper, осуществлялась на конфокальном сканирующем флуоресцентном микроскопе Carl Zeiss LSM 510-МЕТА. Использовали иммерсионный масляный объектив НСХ PL АРО Ibd.BL 63х 1.4NA. Флуоресценцию возбуждали последовательно с помощью лазеров 488 нм и 405 нм и детектировали в интервале 500-520 нм в двух каналах, соответствующих двум пикам возбуждения хромофора cpYFP в Hyper.
[0106] Микроскопию осуществляли с помощью флуоресцентного микроскопа Leica DMI 6000, оборудованного иммерсионным масляным объективом НСХ Р2 ApoLambda blue 63*1.4, ртутной лампой 120W НХР (Osram) в качестве источника света, CCD-камерой Photometries CoolSNAP HQ и герметичной камерой для поддержания постоянной температуры. Детекцию флуоресценции проводили последовательно в двух каналах, соответствующих двум пикам возбуждения хромофора cpYFP (420 нм и 500 нм), эмиссия 510 нм. Для канала, соответствующего протонированной форме хромофора cpYFP (420 нм), использовали фильтры EFW - возбуждение ВР 427/10 (CFP), эмиссия ВР 542/27 (YFP). Для депротонированной формы хромофора cpYFP (500 нм) фильтры - возбуждение ВР 504/12 (YFP); эмиссия ВР 542/27 (YFP). Для детекции флуоресценции в красной области спектра использовали набор фильтров ТХ2 (возбуждение ВР 560/40, эмиссия ВР 645/75). Серии изображений снимали в режиме 1 кадр в 10 или 30 сек. После снятых первых 2-5 кадров к клеткам добавляли Н2О2 или ростовые факторы и продолжали съемку. Полученные серии изображений анализировали с помощью программы Leica Application Suite Advanced Fluorescense (LAS AF). Конечную обработку и обсчет изображений осуществляли с помощью программы ImageJ (EMBL) и Excel (Microsoft).
[0107] Для получения результирующей серии изображений, отражающей динамику изменения концентраций Н2О2, необходимо «поделить» покадрово серию изображений, полученных в канале возбуждения флуоресценции при 488 (500) нм, на серию изображений в канале 405 (420) нм. Предварительно каждую серию изображений необходимо обработать, вычтя из каждого кадра значение фона.
[0108] Изображения были переведены в формат 32 бит. Для серии, соответствующей каналу возбуждения в 405/420 нм, был установлен порог минимального значения для исключения фоновых значений.
[0109] Затем серию изображений канала возбуждения 488/500 нм покадрово делили на обработанную серию изображений канала 405/420 нм.
[0110] В результате получили серию изображений, каждый пиксель которой соответствует значению отношения каналов. Результирующая серия изображений была окрашена в псевдоцвета "Ratio". Данные для построения кривой, отражающей динамику изменения сигнала Hyper, получали, выделяя область интереса (ОИ) внутри клетки в результирующем изображении. Полученные данные далее обрабатывали в Excel (Microsoft) или OriginLab.
[0111] В ответ на стимуляцию ростовым фактором PDGF фибробластов, экспрессирующих BtkPH-HyPer, наблюдалось увеличение отношения F500/F420, что свидетельствует о повышении концентрации эндогенного Н2О2 в клетке. Однако в тех же клетках не было обнаружено транслокации BtkPH-HyPer на плазматическую мембрану. То есть сконструированный биосенсор BtkPH-HyPer не детектировал продукцию PIP3 и не проявлял свойств двупараметрического биосенсора.
[0112] Добавление PDGF (10 нг/мл) к фибробластам NIH-3T3, экспрессирующим BtkPH-E41K-HyPer, инициировало транслокацию биосенсора на плазматическую мембрану и приводило к росту соотношения F500/F420, что отражает активацию PI-3K и рост концентрации Н2O2 в области ПМ (Фиг.2 и Фиг.3). Биосенсор BtkPH-Е41К-Hyper позволял осуществлять одновременную детекцию продукции Н2O2 и PIP3 в клетке за счет изменения спектральных свойств белка Hyper и транслокации к ПМ.
[0113] Степень транслокации была рассчитана по формуле T=(Fmem-Fcyto)/Fcyto (где Fmem - интенсивность флуоресценции на ПМ, Fcyto - интенсивность флуоресценции в цитоплазме).
[0114] Пример 3
[0115] Одновременная детекция PIP3 и продукции Н202 Тн-лимфоцитах при активации TCR с помощью биосенсора, кодируемого конструктом BtkPH-Е41К-Hyper.
[0116] BtkPH-E41K-HyPer, полученный как описано в примере 1, был использован для изучения липидной и окислительно-восстановительной сигнализации в человеческих CD4+ Т-хэлперных лимфоцитах в процессе формирования иммунологического синапса.
[0117] Т-хэлперные (ТH) лимфоциты человека были изолированы из лейкоцитарных фильтров здоровых доноров. Сначала лимфоциты были очищены с помощью центрифугирования в градиенте плотности при 450 g в течение 30 мин при комнатной температуре (Ficoll-Paque PLUS, Amersham Biosciences), оставшиеся красные кровяные клетки были лизированы с помощью буфера (155 мМ NH4Cl, 10 мМ КНСО3, 0.1 мМ ЭДТА (рН 7.3)). Далее лимфоциты были ресуспендированы в PBS, содержащем 0,5% БСА. CD4+ ТH-лимфоциты были изолированы с помощью CD4+ negative isolation kit (Invitrogen) по методике (Bogeski et al. (2010) Differential redox regulation of ORAI ion channels: a mechanism to tune cellular calcium signaling. Science signaling 3:24).
[0118] Наивные ТH-лимфоциты были трансфецированы через 4 часа после выделения с помощью электропоратора Nucleofector II (Lonza, программа U-014) и Human Т cell Nucleofector kit (Lonza) в соответствии с инструкцией производителя. Для электропорации использовали 1 мкг ДНК на один миллион клеток.
[0119] ТH-лимфоциты через 24-48 часов после трансфекции были посажены (в течение 10 мин, 37°С) на чашки со стеклянным дном для микроскопии, покрытые поли-L-орнитином (0,1 мг/мл).
[0120] Микроскопию Тн-лимфоцитов проводили при 37°С на широкоформатном микроскопе Zeiss Cell Observer HS, оборудованном 40x Fluar oil lense (N.A. 1.3), LED флуоресцентным источником света (Colibri, Zeiss). Были использованы фильтры CFP, YFP dual-band pinkel set (55HE, Zeiss). Детекцию флуоресценции проводили при возбуждении 420 нм и 505 нм и эмиссии 515 нм.
[0121] Во время активации Т-лимфоцит поляризуется и формирует плотный контакт, т.н. иммунологический синапс (ИС), с АПК (антигенпрезентирующей клеткой). Формирование ИС моделировали с помощью инкубации клеток с шариками, покрытыми антителами анти-СD3/анти-СD28 (Quintana et al. (2007) Т cell activation requires mitochondrial translocation to the immunological synapse. Proc Natl Acad Sci USA 104:14418-23). Известно, что формирование ИС приводит к активации PI-3K и, как следствие, повышению концентрации PIP3 и в области ИС, и в остальных частях ПМ (Costello et al. (2002) Sustained and dynamic inositol lipid metabolism inside and outside the immunological synapse. Nature immunology 3:1082-9; Harriague и Bismuth (2002) Imaging antigen-induced PI3K activation in T cells. Nature immunology 3:1090-6.). Также известно, что активация TCR способствует продукции АФК в клетке.
[0122] В описанном эксперименте наблюдали мгновенное и значительное перераспределение флуоресцентного биосенсора в область ИС на ранних этапах формирования контакта: большая часть индикатора локализовалась в области ИС и оставалась там в течение всего эксперимента (до 1 ч).
[0123] По изменению отношения F500/F420 в процессе активации клеток формирование ИС сопровождалось быстрым ростом концентрации Н2О2 через 1 мин после транслокации биосенсора в ИС (Фиг.4).
[0124] Таким образом, разработанный биосенсор способен одновременно детектировать пространственно-временной характер продукции Н2O2 и PIP3 в различных типах клеток.
Определения
[0125] Различные термины, относящиеся к биологическим молекулам настоящего изобретения, используются выше в описании, а также в формуле изобретения.
[0126] Как здесь используется, термин "флуоресцентный белок" означает белок, относящийся к семейству GFP-подобных белков, который обладает способностью к флуоресценции; например, он может проявлять низкую, среднюю или интенсивную флуоресценцию при облучении светом с подходящей для возбуждения длиной волны. Флуоресцентное свойство этих белков представляет собой такое свойство, которое является результатом работы хромофора, образующегося путем автокаталитической циклизации трех или более аминокислотных остатков в полипептидной цепи. Как таковые флуоресцентные белки настоящего изобретения не включают белки, которые обладают флуоресценцией за счет отдельных флуоресцирующих остатков, таких как триптофан, тирозин и фенилаланин.
[0127] Как здесь используется, термин "avGFP" относится к зеленому флуоресцентному белку из медузы Aequorea victoria, включая варианты avGFP, известные из уровня техники, сконструированные для обеспечения большей интенсивности флуоресценции или флуоресценции в других цветовых областях. Раскрыта последовательность дикого типа avGFP (Prasher et al. (1992) Gene 111:229-33).
[0128] Как здесь используется, термин "флуоресцентный белок, подвергнутый круговой пермутации" или "кпФБ" относится к белку, полученному из флуоресцентного белка (например, из avGFP) с помощью генно-инженерной модификации нуклеиновой кислоты, в результате которой С- и N-концы исходного флуоресцентного белка оказываются оперативно слиты, а новые С- и N-концы формируются вблизи хромофора. Круговая пермутация не влияет на формирование «бочонка» GFP-подобного домена и формирование активного (способного к флуоресценции) хромофора. Круговая пермутация приводит к тому, что кпФБ приобретает способность менять спектральные характеристики при конформационных изменениях белковых доменов или полипептидов, оперативно слитых с его С- и N-концами.
[0129] Как здесь используется, "флуоресцентные свойства" или "спектральные свойства" относятся к коэффициенту молярной экстинкции при подходящей длине волны, к квантовому выходу флуоресценции, форме спектра возбуждения флуоресценции или спектра испускания, длине волны, соответствующей максимуму возбуждения флуоресценции, и длине волны, соответствующей максимуму испускания, отношению амплитуды возбуждения флуоресценции при двух разных длинах волн, отношению амплитуды испускания при двух разных длинах волн, времени жизни возбужденного состояния, и анизотропии оптических свойств. Измеряемая разница может быть определена как количество любого количественного флуоресцентного свойства, например, интенсивность флуоресценции при определенной длине волны, или интегральная флуоресценция на всем спектре испускания.
[0130] Как здесь используется, термин "флуоресцентный биосенсор" означает химерный белок, в состав которого входит функциональный флуоресцентный белок, например кпФБ.
[0131] Как здесь используется, термин "выделенный" означает молекулу или клетку, которые находятся в среде, отличной от среды, в которой молекула или клетка находятся в естественных условиях.
[0132] Как здесь используется, термин "функциональный" означает, что нуклеотидная или аминокислотная последовательность может функционировать для указанного испытания или задачи.
[0133] Как здесь используется, термин "мутант" или "производное" относятся к белку, раскрытому в настоящем изобретении, в котором одна или более аминокислот добавлены и/или замещены и/или удалены (делетированы) и/или вставлены (инсертированы) в N-конец и/или С-конец, и/или в пределах нативных аминокислотных последовательностей белков настоящего изобретения. Как здесь используется, термин "мутант" относится к молекуле нуклеиновой кислоты, которая кодирует мутантный белок. Кроме того, термин "мутант" здесь относится к любому варианту, который короче или длиннее белка или нуклеиновой кислоты.
[0134] Ссылка на нуклеотидную последовательность, "кодирующую" полипептид, означает, что с нуклеотидной последовательности в ходе трансляции и транскрипции мРНК продуцируется этот полипептид. При этом может быть указана как кодирующая цепь, идентичная мРНК и обычно используемая в списке последовательностей, так и комплементарная цепь, которая используется как матрица при транскрипции. Как очевидно для любого специалиста в данной области техники, термин также включает любые вырожденные нуклеотидные последовательности, кодирующие одинаковую аминокислотную последовательность. Нуклеотидные последовательности, кодирующие полипептид, включают последовательности, содержащие интроны.
[0135] Термин "оперативно связанный" или ему подобный при описании химерных белков относится к полипептидным последовательностям, которые находятся в физической и функциональной связи одна с другой. В наиболее предпочтительных воплощениях, функции полипептидных компонентов химерной молекулы не изменены по сравнению с функциональными свойствами выделенных полипептидных компонентов. Как очевидно для любого специалиста в данной области техники, нуклеотидные последовательности, кодирующие химерный белок, включающий "оперативно связанные" компоненты (белки, полипептиды, линкерные последовательности, белковые домены и т.д.), состоят из фрагментов, кодирующих указанные компоненты, где эти фрагменты ковалентно связаны таким образом, что в ходе трансляции и транскрипции нуклеотидной последовательности продуцируется полноразмерный химерный белок. Иными словами, фрагменты соединены таким образом, что в местах их соединения отсутствуют 'сбойки' рамки считывания и стоп-кодоны.
[0136] Как здесь используется, термин «среда» по отношению к биосенсору означает любую среду, в которой этот биосенсор может функционировать. Для выделенного белка это может быть любой буферный раствор, в котором этот сенсор сохраняет функциональность. Для белка, экспрессированного в клетке, это цитоплазма или внутриклеточный компартмент, в котором биосенсор локализован.
[0137] Как здесь используется, термины «перекись водорода» и «пероксид водорода» относятся к молекуле, имеющей формулу Н2О2.








Изобретение относится к области биотехнологии и касается химерного белка, нуклеиновой кислоты, кодирующей такой белок, кассеты экспрессии и эукариотической клетки-хозяина. Представленный химерный белок с SEQ ID NO:02 является флуоресцентным биосенсором, сконструирован на основе белка НуРеr и мутанта РН-домена тирозинкиназы Btk. Представленные изобретения позволяют проводить одновременный мониторинг продукции пероксида водорода и фосфатидилинозитол-3,4,5-трифосфат в живой клетке. 4 н.п. ф-лы, 4 ил., 3 пр.
1. Химерный белок, являющийся флуоресцентным биосенсором, для одновременной детекции пероксида водорода и фосфатидилинозитол-3,4,5-трифосфата (PIP3) в живой клетке, имеющий аминокислотную последовательность SEQ ID NO:02.
2. Нуклеиновая кислота, кодирующая флуоресцентный биосенсор, охарактеризованный в п.1.
3. Кассета экспрессии, содержащая (а) регион инициации транскрипции, функциональный в клетке-хозяине; (б) нуклеиновую кислоту по п.2 и (в) регион терминации транскрипции, функциональный в клетке-хозяине, которая будучи интегрированной в геном клетки или при введении в клетку в виде внехромосомного элемента способна обеспечить экспрессию белка по п.1.
4. Эукариотическая клетка-хозяин, содержащая кассету экспрессии, охарактеризованную в п.3, в виде внехромосомного элемента или элемента, интегрированного в геном, и продуцирующая биосенсор, кодируемый нуклеиновой кислотой по п.2.
| Peter Varnai et al., Phosphatidylinositol 3-Kinase-dependent Membrane Association of the Bruton's Tyrosine Kinase Pleckstrin Homology Domain Visualized in Single Living Cells, THE JOURNAL OF BIOLOGICAL CHEMISTRY, 1999, Vol.274, No | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| БИОСЕНСОР ДЛЯ ДЕТЕКЦИИ ПЕРОКСИДА ВОДОРОДА В ЖИВЫХ КЛЕТКАХ, ОБЛАДАЮЩИЙ ПОВЫШЕННОЙ УСТОЙЧИВОСТЬЮ К ИЗМЕНЕНИЯМ pH | 2009 |
|
RU2434943C2 |
| УСТРОЙСТВО ДЛЯ СВЧ-КОНВЕКТИВНОЙ СУШКИ ДИЭЛЕКТРИЧЕСКИХ МАТЕРИАЛОВ | 1998 |
|
RU2141179C1 |
| US 20040180378 A1, 16.09.2004. | |||
Авторы
Даты
2013-11-20—Публикация
2012-06-27—Подача