1. Область изобретения
Данное изобретение относится в основном к области биологии и химии. В частности, изобретение направлено на биосенсоры для детекции пероксида водорода, сконструированные на базе флуоресцентных белков.
2. Уровень техники
Флуоресцентные белки, включая зеленый флуоресцентный белок (Green Fluorescent Protein, GFP), его мутанты и гомологи, сегодня широко известны благодаря их интенсивному использованию в качестве флуоресцентных маркеров in vivo в биомедицинских исследованиях, что детально рассмотрено Lippincott-Schwartz и Patterson в Science (2003) 300(5616): 87-91.
Флуоресцентные белки - это белки, которые способны к флуоресценции при облучении светом подходящей длины волны. Флуоресцентные свойства этих белков обусловлены взаимодействием двух или более аминокислотных остатков, а не флуоресценцией какого-либо одного аминокислотного остатка.
GFP гидромедузы Aequorea aequorea (синоним A.victoria) был описан Johnson et al. в J Cell Comp Physiol. (1962), 60: 85-104, как часть биолюминесцентной системы медузы, где GFP играет роль вторичного эммитера, преобразовывающего синий свет от фотобелка экворина в зеленый свет. кДНК, кодирующая A.victoria GFP, была клонирована Prasher et al. (Gene (1992), 111(2): 229-33). Оказалось, что этот ген может быть гетерологично экспрессирован в практически любом организме благодаря уникальной способности GFP самостоятельно образовывать хромофор (Chalfie et al., Science 263 (1994), 802-805). Эти сведения открывают широкие перспективы для использования GFP в клеточной биологии, в качестве генетически кодируемой флуоресцирующей метки.
GFP был использован в широком спектре приложений, включая исследование экспрессии генов и локализацию белков (Chalfie et al., Science 263 (1994), 802-805, and Heim et al. in Proc. Nat. Acad. Sci. (1994), 91: 12501-12504), как инструмент для визуализации внутриклеточного распределения органелл (Rizzuto et al., Curr. Biology (1995), 5: 635-642), для визуализации транспорта белков по секреторному пути (Kaether and Gerdes, FEBS Letters (1995), 369: 267-271).
Были проведены многочисленные исследования для улучшения свойств GFP и для производства GFP-реактивов, пригодных и оптимизированных для различных исследовательских целей. Были разработаны новые версии GFP, такие как ДНК "гуманизированного" GFP, белковый продукт которой имеет повышенный синтез в клетках млекопитающих (Haas, et al., Current Biology (1996), 6: 315-324; Yang, et al., Nucleic Acids Research (1996), 24: 4592-4593). Один такой гуманизированный белок, мутант GFP, представляет собой "усиленный зеленый флуоресцирующий белок" (EGFP), имеющий две аминокислотные замены: F64L и S65T (Heim et al., Nature 373 (1995), 663-664). Другие мутанты являются синими, циановыми и желто-зелеными спектральными вариантами GFP. Сегодня GFP-подобные белки включают более 120 флуоресцентных и окрашенных гомологов GFP. Сходство этих белков с GFP варьирует от 80-90% до менее чем 25% идентичности аминокислотной последовательности. Исследование внутриклеточных процессов с помощью генетически кодируемых нанобиосенсоров становятся все более популярным, так как только такие сенсоры могут дать информацию об изменении исследуемого параметра непосредственно в живой системе. Такие биосенсоры могут быть использованы как в фундаментальных исследованиях сигнальных путей организма, так и при тестировании токсических и лекарственных препаратов на модельных клеточных линиях или организмах. В сравнении с химическими и физическими методами регистрации биологически активных субстанций биосенсорами, требующими экзогенно добавляемых красителей, субстратов или кофакторов, генетически кодируемые нанобиосенсоры относятся к классу безреагентных и многоразовых сенсоров. Наиболее эффективным подходом к разработке генетически кодируемых сенсоров стало использование флуоресцентных белков в качестве передатчиков информации (Suslova and Chudakov, Trends Biotechnol. 23(12) (2005), 605-13. Флуоресцентные белки представляют собой уникальное семейство - структурно родственных белков, которые способны формировать хромофор автокаталитически без привлечения внешних субстратов или кофакторов. Под действием индуцирующего света хромофор производит флуоресценцию, легко детектируемую с помощью современного лабораторного оборудования (спектрофлуориметр, флуоресцентный микроскоп, флуоресцентно-активируемый клеточный сортер, планшетный флуориметр). Один из наиболее перспективных подходов основан на использовании флуоресцентных белков, подвергнутых т.н. круговой пермутации (кпФБ). N и С-концы таких белков соединены друг с другом, а новые N и С-концы сформированы вблизи хромофора флуоресцентного белка. В результате круговой пермутации кпФБ приобретает способность реагировать на конформационные перестройки в области новых N и С-концов изменением спектра флуоресценции (наносенсоры с использованием обычных флуоресцентных белков оказались малочувствительными). Эффективность кпФБ на основе зеленого флуоресцентного белка (GFP) из Aequorea victoria была продемонстрирована на примере сенсора на ионы кальция (Nagai et al., Proc Nati Acad Sci USA. 98(6) (2001), 197-202. кпФБ был также использован для изготовления сенсора на пероксид водорода (Belousov et. al., Nat Methods.(2006); 3(4), 281-286). К основным недостаткам кпФБ на основе GFP из Aequorea victoria является их низкая рН стабильность. Биосенсор для детекции пероксида водорода HyPer был создан путем встраивания последовательности ДНК, кодирующей кпФБ, полученный из желтого флуоресцентного белка EYFP, в последовательность ДНК, кодирующую регуляторный домен белка OxyR, с последующей экспрессией в прокариотических и эукариотических клетках. Интенсивность возбуждения протонированной формы хромофора кпФБ в составе HyPer падает с увеличением показателя рН среды, в то время как интенсивность возбуждения депротонированной формы хромофора растет с увеличением показателя рН. Таким образом увеличение показателя рН среды действует на флуоресценцию HyPer так же, как увеличение концентрации H2O2. Наибольшее изменение интенсивностей возбуждения HyPer в зависимости от рН наблюдается в области 6,5-8, что близко к физиологическим значениям. рК хромофора cpYFP в составе HyPer составляет 8,5 (Belousov et. al., Nat Methods.(2006); 3(4), 281-286).
3. Раскрытие изобретения
Настоящее изобретение обеспечивает выделенные молекулы нуклеиновых кислот, кодирующих новый флуоресцентный биосенсор для детекции пероксида водорода, обладающий улучшенными показателями устойчивости к изменениям рН среды. В некоторых воплощениях нуклеиновая кислота настоящего изобретения получена методами генной инженерии. В некоторых воплощениях выделенные нуклеиновые кислоты настоящего изобретения кодируют флуоресцентный биосенсор для детекции пероксида водорода (SEQ ID NO: 02), флуоресцентная основа которого представляет собой зеленый флуоресцентный белок из Aequorea macrodactila, подвергнутый круговой пермутации, как в SEQ ID NO: 04 (cp-macGFP). Молекулы нуклеиновых кислот, которые отличаются от представленных нуклеотидных последовательностей вследствие вырожденности генетического кода, также входят в рамки настоящего изобретения. В других воплощениях также обеспечиваются векторы, включающие нуклеиновую кислоту настоящего изобретения. Кроме того, настоящее изобретение обеспечивает кассеты экспрессии, включающие нуклеиновую кислоту настоящего изобретения и регуляторные элементы, необходимые для экспрессии нуклеиновой кислоты в выбранной клетке-хозяине. Кроме того, также обеспечиваются клетки, стабильные клеточные линии, трансгенные животные и трансгенные растения, включающие нуклеиновые кислоты, векторы или экспрессионные кассеты настоящего изобретения. В других воплощениях обеспечиваются функциональные флуоресцентные биосенсоры настоящего изобретения, которые кодируются нуклеиновыми кислотами, указанными выше. Кроме того, обеспечиваются набор, содержащий нуклеиновые кислоты, или векторы, или экспрессионные кассеты, включающие указанные нуклеиновые кислоты настоящего изобретения.
Краткое описание чертежей
Фигура 1 показывает принципиальную схему строения биосенсора для детекции пероксида водорода.
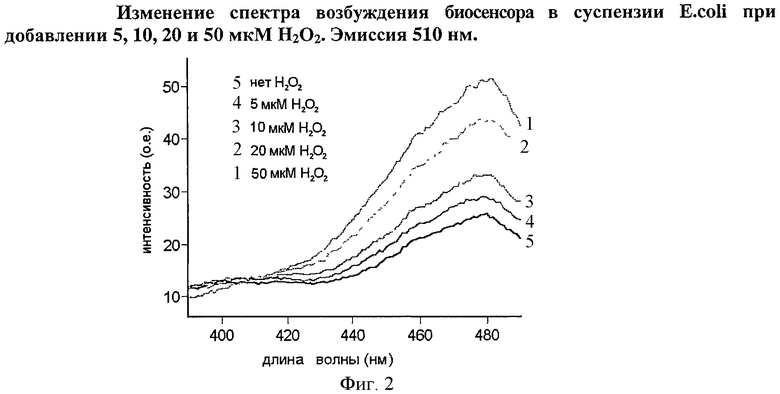
Фигура 2 иллюстрирует зависимость спектра возбуждения флуоресценции биосенсора, экспрессируемого в цитоплазме клеток E.coli от концентрации добавленного пероксида водорода.
Фигура 3 иллюстрирует график зависимости флуоресценции биосенсора для детекции пероксида водорода от изменений рН среды.
Фигура 4 иллюстрирует нуклеотидную и аминокислотную последовательности биосенсора для детекции пероксида водорода SEQ ID NO: 01 и SEQ ID NO: 02 соотвественно.
Фигура 5 иллюстрирует нуклеотидную и аминокислотную последовательности зеленого флуоресцентного белка из Aequorea macrodactila, подвергнутого круговой пермутации, SEQ ID NO: 03 и SEQ ID NO: 04 соотвественно.
4. Осуществление изобретения
Для более полного раскрытия вышеперечисленных характеристик настоящего изобретения ниже предлагается детальное описание изобретения, кратко сформулированного выше, в виде ссылок на воплощения, некоторые из которых проиллюстрированы дополнительными чертежами. При этом следует отметить, что прилагаемые чертежи иллюстрируют лишь типичные воплощения настоящего изобретения и, следовательно, не должны быть восприняты в качестве ограничения объема изобретения, которое может допускать другие в равной степени эффективные воплощения.
Если подвести итог вышеуказанному, настоящее изобретение направлено на молекулы нуклеиновых кислот, которые кодируют биосенсор для детекции пероксида водорода (SEQ ID NO: 02), флуоресцентная основа которого представляет собой зеленый флуоресцентный белок из Aequorea macrodactila, подвергнутый круговой пермутации, как в SEQ ID NO: 04 (cp-macGFP). Молекулы нуклеиновых кислот, представляющие интерес, получены методами генной инженерии. Белок, представляющий интерес, включает биосенсор для детекции пероксида водорода, имеющий аминокислотную последовательность, показанную в SEQ ID NO: 1. Также обеспечиваются клетки-хозяева, стабильные клеточные линии и трансгенные организмы, содержащие указанные молекулы нуклеиновых кислот. Указанные белковые и нуклеотидные композиции применяются в приложениях детекции пероксида водорода внутри живых клеток.
Молекулы нуклеиновых кислот
Настоящее изобретение обеспечивает молекулы нуклеиновых кислот, кодирующие флуоресцентный биосенсор для детекции пероксида водорода, имеющий аминокислотную последовательность SEQ ID NO: 2. Как здесь используется, молекула нуклеиновой кислоты - это молекула ДНК, такая как геномная ДНК или кДНК молекула, или молекула РНК, такая как молекула мРНК. Как здесь используется, термин "кДНК" относится к нуклеиновым кислотам, которые обладают размещением элементов последовательности, найденным в нативных зрелых видах мРНК, где элементы последовательности - это экзоны и 5' и 3' некодирующие области. Молекула нуклеиновой кислоты, кодирующая флуоресцентный биосенсор, может быть синтезирована из подходящих нуклеозидтрифосфатов или выделена из биологических источников. Оба метода основаны на хорошо известных в данной области протоколах. Например, доступность информации о последовательности аминокислот или информации о нуклеотидной последовательности дает возможность изготовить выделенные молекулы нуклеиновых кислот настоящего изобретении с помощью олигонуклеотидного синтеза. В случае информации о последовательности аминокислот несколько нуклеиновых кислот, отличающихся друг от друга вследствие вырожденности генетического кода, может быть синтезировано. Методы выбора вариантов кодонов для требуемого хозяина хорошо известны в данной области. Синтетические олигонуклеотиды могут быть приготовлены с помощью фосфорамидитного метода, и полученные конструкты могут быть очищены с помощью методов, хорошо известных в данной области, таких как высокоэффективная жидкостная хроматография (ВЭЖХ), или других методов, как описано, например, в Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd Ed., (1989) Cold Spring Harbor Press, Cold Spring Harbor, NY, и по инструкции, описанной в, например, United States Dept. of HHS, National Institute of Health (NIH) Guidelines for Recombinant DNA Research. Длинные двухцепочечные молекулы ДНК настоящего изобретения могут быть синтезированы за следующие стадии: несколько меньших фрагментов с необходимой комплементарностью, которые содержат подходящие концы, способные к когезии с соседним фрагментом, могут быть. Соседние фрагменты могут быть сшиты с помощью ДНК-лигазы или метода, основанного на ПЦР. Нуклеиновая кислота, кодирующая биосенсор или его фрагмент, может быть выделена любым из многих известных методов. Кроме того, также обеспечиваются вырожденные варианты нуклеиновых кислот, которые кодируют биосенсор настоящего изобретения. Вырожденные варианты нуклеиновых кислот включают замены кодонов нуклеиновой кислоты на другие кодоны, кодирующие те же самые аминокислоты. В частности, вырожденные варианты нуклеиновых кислот создаются, чтобы увеличить экспрессию в клетке-хозяине. В этом воплощении кодоны нуклеиновой кислоты, которые не являются предпочтительными или являются менее предпочтительными в генах клетки-хозяина, заменены кодонами, которые обильно представлены в кодирующих последовательностях генов в клетке-хозяине, где указанные замененные кодоны кодируют ту же самую аминокислоту. Особенный интерес представляют гуманизированные версии нуклеиновых кислот настоящего изобретения. Как здесь используется, термин "гуманизированный" относится к заменам, сделанным в последовательности нуклеиновой кислоты для оптимизации кодонов для экспрессии белка в клетках млекопитающих (человека) (Yang et al., Nucleic Acids Research (1996) 24: 4592-4593). См. также Патент США №5795737, который описывает гуманизацию белков, раскрытие которого здесь включено ссылкой. Примеры вырожденных вариантов, представляющих интерес, описаны более подробно в экспериментальной части, ниже. Заявленные нуклеиновые кислоты могут быть выделены и получены по существу в очищенной форме. По существу очищенная форма означает, что нуклеиновые кислоты являются по меньшей мере приблизительно на 50% чистыми, обычно по меньшей мере приблизительно на 90% чистыми, и обычно являются "рекомбинантными", то есть фланкированы одним или более нуклеотидов, с которыми она обычно не связана в хромосоме, встречающейся в природе в ее естественном организме-хозяине. Также обеспечиваются вектор и другие конструкции нуклеиновой кислоты, содержащие заявленные нуклеиновые кислоты. Подходящие векторы включают вирусные и невирусные векторы, плазмиды, космиды, фаги и т.д., предпочтительно плазмиды, и используются для клонирования, амплификации, экспрессии, переноса и т.д., последовательности нуклеиновой кислоты настоящего изобретения в подходящего хозяина. Выбор подходящего вектора является понятным для квалифицированного специалиста в данной области, и много таких векторов доступны коммерчески. Для приготовления конструкции полноразмерная нуклеиновая кислота или ее часть обычно вставляются в вектор посредством прикрепления ДНК-лигазой к расщепленному ферментами рестрикции сайту в векторе. Альтернативно, желательная нуклеотидная последовательность может быть вставлена гомологичной рекомбинацией in vivo, обычно, присоединением гомологичных участков к вектору на флангах желательной нуклеотидной последовательности. Гомологичные участки добавляются лигированием олигонуклеотидов или полимеразной цепной реакцией с использованием праймеров, включающих, например, как гомологичные участки, так и часть желательной нуклеотидной последовательности. Также обеспечиваются кассеты экспрессии или системы, использованные inter alia для получения заявленных хромогенных или флуоресцентных белков или химерных белков на их основе или для репликации заявленных молекул нуклеиновой кислоты. Кассета экспрессии может существовать как внехромосомный элемент или может быть включена в геном клетки в результате введения указанной кассеты экспрессии в клетку. Для экспрессии генный продукт, кодируемый нуклеиновой кислотой изобретения, экспрессируется в любой удобной системе экспрессии, включая, например, бактериальные системы, дрожжевые, насекомых, земноводных или клетки млекопитающих. В экспрессионном векторе указанная нуклеиновая кислота является функционально связанной с регуляторной последовательностью, которая может включить промоторы, энхансеры, терминаторы, операторы, репрессоры и индукторы. Методы изготовления кассет экспрессии или систем для экспрессии желаемого продукта известны специалистам, квалифицированным в данной области. Клеточные линии, которые устойчиво экспрессируют белки настоящего изобретения, могут быть выбраны способами, известными в данной области (например, котрансфекция с селектируемым маркером, таким как dhfr, gpt, неомицин, гигромицин, что делает возможным выявление и выделение транфецированных клеток, которые содержат ген, включенный в геном). Вышеописанные системы экспрессии могут использоваться в прокариотических или эукариотических хозяевах. Для получения белка могут использоваться клетки-хозяева, такие как E.coli, B.subtilis, S.cerevisiae, клетки насекомого в комбинации с бакуловирусными векторами, или клетки высшего организма, такого как позвоночные, например COS 7 клетки, HEK 293, CHO, ооциты Xenopus и т.д. Если используется любая вышеупомянутая клетка-хозяин или другие подходящие клетки-хозяева или организмы для репликации и/или экспрессии нуклеиновых кислот изобретения, то полученная реплицированная нуклеиновая кислота, экспрессированный белок или полипептид находятся в рамках притязания изобретения как продукт клетки-хозяина или организма. Продукт может быть выделен подходящим способом, известным в данной области. Также обеспечиваются короткие фрагменты ДНК заявленных нуклеиновых кислот, которые применяются как праймеры для ПЦР, гибридизационные скрининговые пробы и т.д. Длинные фрагменты ДНК применяются для получения кодируемых полипептидов, как ранее описано. Однако для использования в геометрических реакциях амплификации, таких как геометрическая ПЦР, используется пара коротких фрагментов ДНК, то есть праймеров. Точная последовательность праймера не является критической для изобретения, но для большинства применений праймеры будут гибридизоваться с заявленной последовательностью в условиях строгости, как известно в данной области. Предпочтительно выбрать пару праймеров, которые дадут продукт амплификации по меньшей мере приблизительно из 50 нуклеотидов, предпочтительно по меньшей мере приблизительно из 100 нуклеотидов, и могут простираться на полную последовательность нуклеиновой кислоты. Алгоритмы отбора последовательностей праймеров обычно известны и доступны в коммерческих пакетах программ. Праймеры для амплификации гибридизуются с комплементарными цепочками ДНК и будут затравлять встречные реакции амплификации. Молекулы нуклеиновых кислот настоящего изобретения также могут применяться для определения экспрессии гена в биологическом образце. Способ, в котором исследуются клетки на наличие специфических нуклеотидных последовательностей, таких как геномная ДНК или РНК, хорошо отработан в данной области. Кратко, выделяют ДНК или мРНК из образца клетки. мРНК может быть амплифицирована ОТ-ПЦР с использованием обратной транскриптазы для формирования комплементарной цепочки ДНК, с последующей амплификацией с помощью полимеразной цепной реакции с использованием праймеров, специфических для заявленных последовательностей ДНК. Альтернативно, образец мРНК отделяют с помощью гель-электрофореза, переносят на подходящий носитель, например нитроцеллюлозу, нейлон и т.д., и затем тестируют фрагментом заявленной ДНК в качестве пробы. Могут также использоваться другие способы, такие как анализы сшивания олигонуклеотидов, гибридизация in situ и гибридизация ДНК-пробами, иммобилизованными на твердый чип. Обнаружение мРНК, гибридизующейся с заявленной последовательностью, указывает на экспрессию гена в образце.
Белки
Также обеспечивается в соответствии с заявленным изобретением флуоресцентный биосенсор. Заявленный биосенсор флуоресцентный обладает способностью к детектируемой флуоресценции. Заявленный биосенсор обладает зеленой флуоресценцией, то есть он имеет пики возбуждения флуоресценции в диапазоне от приблизительно 350 до 500 нм, тогда как пик эмиссии заявленного биосенсора лежит в пределах от приблизительно 470 до 550 нм.
Трансформанты
Нуклеиновые кислоты настоящего изобретения могут быть использованы для получения трансформатов, включая трансгенных организмов или сайт-специфичных генных изменений в клеточных линиях. Трансгенные клетки, заявленные в изобретении, содержат одну или более нуклеиновых кислот, заявленных по настоящему изобретению, в качестве трансгена. Для целей изобретения любая приемлемая клетка-хозяин может быть использована, включая прокариотические (например, Escherichia coli, Streptomyces sp., Bacillus subtilis, Lactobacillus acidophilus и т.д.) или эукариотические клетки-хозяева. Трансгенный организм, заявленный по изобретению, может быть прокариотическим или эукариотическим организмом, включая бактерии, цианобактирии, грибы, растения и животные, в которых одна или больше клеток организма содержат гетерогенную нуклеиновую кислоту, заявленную по изобретению, введенную посредством вмешательства человека, такими способами как технологии трансгеноза, которые известны в данной области. Выделенная нуклеиновая кислота настоящего изобретения может быть введена в хозяина способами, известными в данной области, например инфицированием, трансфекцией, трансформацией или трансконъюгацией. Способы переноса молекулы нуклеиновой кислоты (то есть ДНК) в такие организмы широко известны и обеспечиваются в ссылках, таких как Sambrook et al. (Molecular Cloning: A Laboratory Manual, 3nd Ed., (2001) Cold Spring Harbor Press, Cold Spring Harbor, NY). В одном воплощении трансгенный организм может быть прокариотическим организмом.
Способы трансформации прокариотических хозяев хорошо описаны в данной области (например, см. Sambrook et al. Molecular Cloning: A Laboratory Manual, 2nd edition (1989) Cold Spring Harbor Laboratory Press и Ausubel et al., Current Protocols in Molecular Biology (1995) John Wiley & Sons, Inc). В другом воплощении трансгенными организмами могут быть грибы, например дрожжи. Дрожжи широко используются как носители для экспрессии гетерогенного гена (например, см. Goodey et al., Yeast biotechnology, D R Berry et al., eds, (1987) Allen and Unwin, London, pp. 401-429) и King et al. Molecular and Cell Biology of Yeasts, E F Walton and G T Yarronton, eds, Blackie, Glasgow (1989) pp. 107-133). Несколько типов дрожжевых векторов доступны, включая интегративные векторы, которые требуют рекомбинации с геномом хозяина для их поддержки, и автономно реплицирующиеся плазмидные векторы. Другой организм хозяина является животным. Трансгенные животные могут быть получены трансгенными способами, известными в данной области, и обеспечиваются в ссылках, таких как Pinkert, Transgenic Animal Technology: a Laboratory Handbook, 2nd edition (2203) San Diego: Academic Press; Gersenstein and Vintersten, Manipulating the Mouse Embryo: A Laboratory Manual, 3rd ed, (2002) Nagy A. (Ed), Cold Spring Harbor Laboratory; Blau et al., Laboratory Animal Medicine, 2nd Ed., (2002) Fox J.G., Anderson L.C., Loew F.M., Quimby F.W. (Eds), American Medical Association, American Psychological Association; Gene Targeting: A Practical Approach by Alexandra L. Joyner (Ed.) Oxford University Press; 2nd edition (2000). Например, трансгенные животные могут быть получены гомологичной рекомбинацией, где изменяется эндогенный локус. Альтернативно, конструкция нуклеиновой кислоты включается случайным образом в геном. Векторы для устойчивого включения включают плазмиды, ретровирусы и другие животные вирусы, YAC и т.п. Нуклеиновые кислоты могут быть введены в клетку непосредственно или опосредованно, введением в прекурсор клетки, путем намеренной генетической манипуляции, такой как микроинъекция или инфицирование рекомбинантным вирусом или рекомбинантным вирусным вектором и т.п. Термин «генетическая манипуляция» не включает классическое скрещивание или оплодотворение in vitro, а предпочтительно является направленным на введение рекомбинантных молекул нуклеиновых кислот. Эти молекулы нуклеиновой кислоты могут быть включены в хромосому, или они являются внехромосомными реплицирующими ДНК. Конструкции ДНК для гомологичной рекомбинации будут содержать по меньшей мере часть нуклеиновой кислоты настоящего изобретения, где ген имеет желательную генетическую модификацую(ции) и включает области гомологии с целевым локусом. Конструкциям ДНК для произвольного включения не обязательно содержать область гомологии с медиатором рекомбинации. Легко могут быть включены маркеры для положительной и отрицательной селекции. Способы получения клеток, имеющих целевые генные модификации, через гомологическую комбинацию известны в данной области. Для различных способов трансфекции клеток млекопитающих, см. Keown et al., Meth. Enzymol. (1990) 185: 527-537. Для эмбриональных стволовых (ЭС) клеток могут быть использованы ЭС клеточные линии, или эмбриональные клетки могут быть получены непосредственно от хозяина, такого как мышь, крыса, морская свинка и т.д. Такие клетки выращиваются на подходящем фибропласт-питающем слое или в присутствии фактора ингибирования лейкемии (LIF). Трансформированные ЭС или эмбриональные клетки могут быть использованы для получения трансгенных животных с помощью подходящего способа, описанного в данной области. Трансгенные животные могут быть любыми животными, не относящимися к человеку, включая млекопитающее, не относящееся к человеку (например, мышь, крыса), птица или амфибия и т.д., и использованы в функциональном исследовании, скрининге лекарственного средства и т.п. Характерные примеры использования трансгенных животных включают те, которые описанные ниже. Также могут быть получены трансгенные растения. Способы получения трансгенных растительных клеток и растений описаны в патентах США №№5767367; 5750870; 5739409; 5689049; 5689045; 5674731; 5656466; 5633155; 5629470; 5595896; 5576198; 5538879; 5484956; раскрытия которых включены сюда ссылкой. Способы получения трансгенных растений также рассмотрены в Plant Biochemistry and Molecular Biology (eds. Lea and Leegood, John Wiley & Sons) (1993) pp.275-295 и в Plant Biotechnology and Transgenic Plants (eds. Oksman-Caldentey and Barz), (2002) 719 p. Например, эмбриогенные эксплантаты, содержащие соматические клетки, могут использоваться для получения трансгенного хозяина. После сбора клеток или тканей экзогенная ДНК, представляющая интерес, вводится в растительные клетки, при этом известен для такого введения ряд различных способов. При наличии выделенных протопластов возникает возможность для введения через ДНК-опосредованные протоколы передачи гена, включая инкубацию протопластов с очищенной ДНК, такой как плазмида, содержащая целевую экзогенную последовательность, представляющую интерес, в присутствии поливалентных катионов (например, PEG или PLO); или электропорацию протопластов в присутствии выделенной ДНК, включающей целевую экзогенную последовательность. Протопласты, которые успешно включили экзогенную ДНК, затем отбираются, выращиваются в каллус и в конечном счете вводятся в трансгенное растение при контакте с подходящими количествами и отношениями стимулирующих факторов, таких как ауксины и цитокины. Другие подходящие способы получения растения могут использоваться, такие как применение "генной пушки", или Agrobacterium-опосредованная трансформация, которые доступны для квалифицированных специалистов в данной области. Следующие примеры предлагаются в качестве иллюстративных, но не ограничивающих.
Примеры
Пример 1
Получение биосенсора для детекции пероксида водорода с улучшенной pH-стабильностью.
Фрагмент (80-305 a.o.) OxyR был амплифицирован с геномной ДНК E.coli с помощью праймеров np1 и пр2 и заклонирован в вектор pQE-30 (Qiagen) по сайтам BamHI и HindIII. Затем с помощью праймеров пр3 и пр4 были амплифицированы фрагменты с 80 а.о. по 205 а.о. и с помощью пр5 и пр6 фрагменты с 206 а.о. по 305 а.о. В качестве флуоресцентного ядра для биосенсора был использован флуоресцентный белок гидроида Aequorea macrodactyla, macGFP. Этот белок обладает двумя пиками поглощения (398 и 480 нм) и пиком эмиссии 510 нм. Выбор macGFP был обусловлен тем, что, как правило, хромофоры зеленых флуоресцентных белков не обладают такой выраженной pH-зависимостью, как хромофоры желтых флуоресцентных белков. Клонированный в pQE-30 и экспресированный в клетках E.coli XLlBlue macGFP обладал недостаточной флуоресценцией, в т.ч. потому, что хромофор не достаточно быстро формировался при 37°С. Для улучшения флуоресцентных свойств белка провели случайный мутагенез (прA1 и прB2) и по результатам скрининга был отобран клон Mut2-3 с заменами S65C, N144S, F220L, F223S, K238R, который обладал самой яркой флуоресценцией, быстро созревающим хромофором и не олигомеризовался. На основе Mut2-3 был получен круговой пермутант macGFP (cp-macGFP). Для этого фрагмент macGFP A (1-145 а.о.) был амплифицирован с помощью прA1 и прA2, фрагмент B (145-239 а.о.) с помощью прВ1 и прВ2. прА2 и прВ1 имели комплиментарный участок, кодирующий линкер между исходными C- и N-концами пермутанта, и амплифицированные с помощью этих праймеров фрагменты могут отжигаться друг на друга в комплиментарной области. Фрагменты A и B экстрагировали из реакционной смеси для ПЦР, смешивали и проводили 3-5 циклов. После этого в реакционную смесь добавляли концевые для пермутанта праймеры прA1 и прB2, содержащие рестрикционные сайты BamHI и HindIII, и проводили еще несколько циклов реакции. Кроме прA2 и прB2 для амплификации всего гена cp-macGFP использовали прA2' и прB2', содержащие вырожденные последовательности в областях концевых линкеров. Все четыре праймера сочетали попарно. Таким образом достигали эффекта случайного мутагенеза концевых линкеров. Полученную таким образом библиотеку круговых пермутантов macGFP клонировали в вектор pEN-30 (Qiagen) по сайтам BamHI и HindIII. pEN-30 не содержит последовательности из 4-х гистидинов, которые, предположительно, могли повлиять на фолдинг пермутированного белка. В результате круговой пермутации macGFP потерял способность к флуоресценции, поэтому провели случайный мутагенез самого белка и C-концевых последовательностей, которые в дальнейшем стали линкерами между С-концом cp-macGFP и C-концевым фрагментом OxyR. Отобрали наиболее яркие клоны 2, 6 и 7, у которых флуоресценция появлялась раньше, чем у остальных: клон 2: (Ser-Ala-Gly)-cp-macGFP-(His-Gly); клон 6: (Ser-Ala-Gly)-cp-macGFP-(Ser-Asp); клон 7: (Ser-Ala-Gly)-cp-macGFP-(His-Asn). В качестве флуоресцентного ядра для конструирования сенсора использовали смесь всех трех клонов (2-го, 6-го и 7-го), подвергнутую предварительно случайному мутагенезу (кроме участка первого линкера, который остался неизменным по отношению к HyPer). Объединение двух фрагментов ДНК OxyR с ДНК cp-macGFP проводили методом «overlap extention», причем cp-macGFP был предварительно подвергнут случайному мутагенезу (пр9 и пр10). Полученную после случайного мутагенеза и «overlap extention» библиотеку фрагментов клонировали в pQE-30 по сайтам BamHI и HindIII и экспрессировали в E.coli. Из полученной таким образом библиотеки клонов сенсора OxyR-macGFP клоны для дальнейшей работы отобрали по следующим критериям: способность формировать хромофор при экспрессии в E.coli на 37°C и высокий динамический диапазон (при полном окислении пик 480 нм увеличивается в 1,5 раз и более). По вышеуказанным критериям были отобраны клоны 2, 3 и 4. Из них клон 3 (хромофор: 65Cys-66Tyr-67Gly: линкер B: His-Gly) обладал максимальным динамическим диапазоном, т.е. при полном окислении пик, соответствующий депротонированной форме хромофора, увеличивался в 2 раза. Но этот клон не достаточно быстро формировал хромофор при 37°C. Клон 3 был взят в качестве исходного для следующего раунда случайного мутагенеза (пр9 и пр10). Из полученной в результате библиотеки был отобран клон 3.3, обладающий, помимо замен исходного клона 3, заменами I68V (классическая замена, ускоряющая созревание хромофора) и K52R. При полном окислении пик, соответствующий депротонированной форме хромофора клона 3,3, увеличивался в 2,2 раза. Кроме того, хромофор этого белка формировался при 37°C. Для этого белка произвели измерение рН-зависимости.
Пример 2
Измерение pH-стабильности клона 3.3.
Клетки E.coli, экспрессирующие клон 3.3, осаждали 20 минут при скорости 4000 об/мин на холоду (4 C°) и суспендировали в буфере I (125 мМ NaCl, 40 мМ Tris-HCl, 5 мМ 2-меркаптоэтанола, pH 7,5) из расчета 1,5 мл буфера I на осадок, полученный из 50 мл клеток в жидкой LB. Затем клетки разрушали ультразвуком с помощью прибора Sonic Dismembrator (Fisher Scientific), мощность 10 Вт, центрифугировали 10 мин при скорости 12000 об/мин и температуре 4 C°. Супернатант переносили в пробирки с предварительно уравновешенной буфером I металл-афинной смолой TALON (Clontech) из расчета 500 мкл смолы на 1000-1200 мкл супернатанта. Пробирки помещали в шейкер (скорость 40 об/мин) и инкубировали 20-25 мин. После этого смолу промывали 3-4 раза 1000 мкл буфера I. Для элюции использовали буфер II (125 мМ NaCl, 40 мМ Tris-HCl, 5 мМ 2-меркаптоэтанола, 200 мМ имидазола, pH 7,5). Элюцию проводили 20-25 мин в шейкере, белок с 500 мкл смолы элюировали 300-350 мкл буфера II. Все манипуляции осуществляли на холоду, все буферы и смолу предварительно охлаждали, выделенный белок хранили на 4 C° до 24 часов. Аликвоту очищенного белка, смешанного с 1 мл буфера, помещали в кювету для флуориметра. Использовали набор буферов с pH 5,8; 6,0; 6,4; 7,0; 7,5; 7,8; 8,0; 8,3; 8,8; 9,0; 10,0. Для белка в каждом буфере снимали спектр возбуждения с 380 нм до 490 нм при эмиссии 510 нм. Затем строили график зависимости интенсивности спектра возбуждения хромофора в депротонированной форме (480 нм) от показателя pH буфера. По сравнению с HyPer (Pk 8,6) флуоресценция клона 3.3 имеет pK 6,4 (Фигура 3). pK - величина pH, при которой интенсивность флуоресценции хромофора составляет 50% от максимальной. Таким образом, при физиологических pH хромофор белка OxyR-cpmacGFP гораздо ярче, чем хромофор HyPer. В диапазоне pH 6,8-7,8 флуоресценция HyPer изменяется в 5 раз, тогда как клона 3.3 - в 1,3 раза. В диапазоне 7,5-8 клон 3.3 меняет интенсивность флуоресценции в 1,09 раз (против 1,7 раз в HyPer), что делает его идеальным сенсором для изменений уровня пероксида водорода в матриксе митохондрий. Таким образом, клон 3.3 имеет существенно лучшие показатели pH-стабильности по сравнению с HyPer. Именно этот белок был выбран для дальнейшего использования в качестве биосенсора настоящего изобретения.
Пример 3
Исследование чувствительности сенсора OxyR-macGFP.
Минимальная концентрация H2O2, вызывающая изменение флуоресценции в суспензии бактериальных клеток, экспрессирующих OxyR-cpmacGFP или HyPer, составляла 5 мкМ, при концентрации 50 мкМ весь белок переходил в окисленную форму. Такие же данные были ранее получены для белка OxyR, экспресированного в Е.coli, а также для НуРег (Belousov et.al., Nat Methods.(2006); 3(4), 281-286). Это говорит о том, что связанный с регулятороным доменом OxyR cp-macGFP, по всей видимости, не влияет на фолдинг OxyR и не влияет на чувствительность OxyR к H2O2.
Все публикации и патентные заявки, цитируемые в настоящем описании, вводятся в настоящее описание посредством ссылки, как если бы каждая отдельная публикация или патентная заявка была конкретно и отдельно введена посредством ссылки. Цитирование любой публикации приводится в соответствии с контекстом и интерпретацией по настоящему изобретению и не должно истолковываться как признание любой такой публикации прототипом данного изобретения.
Определения
Различные термины, относящиеся к биологическим молекулам настоящего изобретения, используются выше и также в описании, и в формуле изобретения. Как здесь используется, термин "флуоресцентный биосенсор" означает белок, который обладает способностью к флуоресценции; например, он может проявлять низкую, среднюю или интенсивную флуоресценцию при облучении светом с подходящей для возбуждения длиной волны. Флуоресцентное свойство этого белка представляет собой такое свойство, которое является результатом работы хромофора, образующегося путем автокаталитической циклизации двух или более аминокислотных остатков в полипептидной цепи. Как таковые флуоресцентные биосенсоры настоящего изобретения не включают белки, которые обладают флуоресценцией за счет отдельных флуоресцирующих остатков, таких как триптофан, тирозин и фенилаланин. Флуоресцентное свойство этих белков изменяет свои спектральные характеристики при взаимодействии с пероксидом водорода. Как здесь используется, термин "GFP" относится к зеленому флуоресцентному белку из Aequorea victoria, включая варианты GFP, известные из уровня техники, сконструированные для обеспечения большей флюоресценции или флуоресценции в других цветовых областях. Последовательность дикого типа GFP была раскрыта в Prasher et al. (1992, Gene 111: 229-33). Как здесь используется, термин "выделенный" означает молекулу или клетку, которые находятся в среде, отличной от среды, в которой молекула или клетка находятся в естественных условиях. Как здесь используется, "скорость созревания" относится к скорости формирования зрелого флуоресцентного белка (то есть флуоресцентного белка, способного продуцировать флуоресценцию) после трансляции. Скорость созревания можно охарактеризовать полупериодом созревания. Было показано, что созревание флуоресцентного белка включает две стадии: (1) Фолдинг белка, что означает формирование белковых бета-слоев с центральной альфа-спиралью, содержащей аминокислоты, которые будут формировать хромофор. Эта стадия обычно характеризуется константой скорости примерно 10(-2)s(-1) или полупериодом от нескольких секунд до десятков секунд; (2) Созревание хромофора, когда белковая цепь подвергается циклизации и дегидротации. Эта стадия обычно характеризуется константой скорости примерно 10(-4)s(-1) или полупериодом длиной в несколько минут. Таким образом, эта более медленная стадия является лимитирующей в созревании зеленого флуоресцентного белка (Reid BG, Flynn GC. Biochemistry. 1997 V.36(22), PP.6786-6791).






Изобретение относится к области биотехнологии, а именно к выделенной нуклеиновой кислоте, кодирующей белок с активностью флуоресцентного биосенсора для детекции пероксида водорода, экспрессионному вектору, который содержит данную нуклеиновую кислоту, клетке E.coli, продуцирующей белок, кодируемый данной нуклеиновой кислотой, и выделенному белку, с активностью флуоресцентного биосенсора для детекции пероксида водорода. Выделенный белок с активностью флуоресцентного биосенсора для детекции пероксида водорода имеет аминокислотную последовательность, представленную в виде SEQ ID NO: 2. Экспрессионный вектор содержит нуклеиновую кислоту, кодирующую белок с активностью флуоресцентного биосенсора для детекции пероксида водорода, под контролем регуляторных элементов, необходимых для экспрессии нуклеиновой кислоты в клетке-хозяине. Клетка E.coli модифицирована за счет введения в нее нуклеиновой кислоты, кодирующей белок с активностью флуоресцентного биосенсора для детекции пероксида водорода, функционально связанной с регуляторной последовательностью. Предложенное изобретение применяется для детекции пероксида водорода внутри живых клеток. 4 н.п. ф-лы, 5 ил.
1. Выделенная нуклеиновая кислота, кодирующая белок с активностью флуоресцентного биосенсора для детекции пероксида водорода, имеющий аминокислотную последовательность, представленную в виде SEQ ID NO: 2.
2. Экспрессионный вектор, который содержит нуклеиновую кислоту по п.1 под контролем регуляторных элементов, необходимых для экспрессии нуклеиновой кислоты в клетке-хозяине.
3. Клетка Е.соli, продуцирующая белок, кодируемый нуклеиновой кислотой по п.1, за счет введения в нее нуклеиновой кислоты по п.1, функционально связанной с регуляторной последовательностью.
4. Выделенный белок с активностью флуоресцентного биосенсора для детекции пероксида водорода, имеющий аминокислотную последовательность, представленную в виде SEQ ID NO: 2.
| BELOUSOV V.V | |||
| ET AL., Genetically encoded fluorescent indicator for intracellular hydrogen peroxide, Nat Methods., 2006, v.3, no.4, p.281-6 | |||
| CHUDAKOV D.M | |||
| ET AL., Fluorescent proteins as a toolkit for in vivo imaging, Trends Biotechnol | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| LUO W.X | |||
| ET AL., Variants of green fluorescent protein GFPxm, Mar Biotechnol (NY), 2006, v.8, no.5, pp.560-566. | |||
Авторы
Даты
2011-11-27—Публикация
2009-05-12—Подача