Область техники, к которой относится изобретение
Изобретение относится к применению соединений, которые, как обнаружено, активны при ингибировании каспазы-3 и поэтому применимы для регуляции апоптоза путем предотвращения запрограммированной гибели клеток при лечении заболеваний и дисфункций, характеризующихся дефектом в регуляции физических механизмов апоптоза и, следовательно, ранней гибелью клеток.
Уровень техники
Одной из таких дисфункций типично является алопеция. Жизненный цикл волосяного фолликула по существу представлен тремя последовательными фазами: анагеном (рост), катагеном (регрессия) и телогеном (фаза покоя). По окончании последней фазы цикл начинается снова. Биологическая основа такого явления находится в способности стволовых клеток фолликулла выходить, в альтернативных фазах, из их состояния бездействия. Во время роста фолликула и выработки волоса активность факторов роста регулирует пролиферацию, дифференцировку и доминанты выживаемости. Вместо этого фаза регрессии характеризуется активацией молекулярных путей, которые вызывают апоптоз клеток фолликулов.
Различные клеточные популяции в волосяном фолликуле обладают различной восприимчивостью к явлению апоптоза. В частности, эпителиальные клетки и меланоциты являются наиболее чувствительными к явлению апоптоза, в то время как представляется, что дермальные фибробласты, некоторые кератиноциты и некоторые меланоциты, выбранные для выживания, являются более устойчивыми. Жизненный цикл волоса и его развитие зависят от факторов роста, которые регулируют коммуникационные сигналы между эпителием и мезенхимными клетками фолликула. Такие молекулярные факторы принадлежат к следующим белковым семействам: BMP (костный морфогенный белок), TGF-бета, EGF, FGF, IGF, нейротрофин, TNF и Wnt.
Апоптоз, также называемый запрограммированной гибелью клеток, представляет собой сложный биологический процесс, который регулируется на генном уровне и который играет решающую роль в гомеостазе тканей, где он противодействует пролиферативному (митотическому) действию, проявляемому факторами роста. С морфологической точки зрения клетка при апоптозе претерпевает быстрое уменьшение объема, сопровождаемое уплотнением и утратой контакта с окружающими клетками. На уровне ядра наблюдают дизагрегацию, разрушение мембраны и конденсацию и фрагментацию хроматина в фрагменты в примерно 200 пар оснований.
Каспазы - каталитические ферменты являются белковым компонентом, существенным как для активации, так и для осуществления процесса апоптоза. У человека идентифицировано 10 каспаз (в действительности, они имеют номера от 1 до 10). Каспазы представляют собой каталитические ферменты, которые проявляют протеазную активность и функционируют как в качестве эффекторов при демонтаже клеток, типичном для апоптоза, так и в качестве инициаторов такого явления после активации сигналами проапоптоза.
Каспаза-3 (также известная как СРР32, Yama или апопаин) является одним из основных эффекторов апоптоза.
В условиях бездействия в большинстве клеток каспаза-3 существует в неактивной форме (профермент), которая, после проапоптозной стимуляции, активируется каспазой-8 или каспазой-9. Это зависит от типа апоптозного стимула, полученного клеткой. Поэтому апоптоз рассматривается как имеющий центральную роль в регуляции регрессии волосяного фолликула (Effects of finasteride on apoptosis and regulation of the human hair cycle, Keane et al., Journal of Cutaneous Medicine and Surgery, vol.6, no.1, January 2002).
Раскрытие изобретения
Неожиданно обнаружилось, что некоторые соединения, используемые как одни, так и в сочетании, могут оказывать ингибирующее действие на каспазу-3, имеют сильную апоптозную активность и могут противодействовать потере воолос.
Согласно изобретению, на самом деле первичное применение таких соединений, обладающих специфической активностью ингибирования каспазы-3, относится к расстройствам волосистой части кожи головы, характеризующимся избыточным клеточным функциональным циклом, таким как алопеция, вызванная химиотерапией, гнездная алопеция, андрогенная алопеция и телоген с выпадением волос (telogen effluvium).
Осуществление изобретения
В этом отношении данное изобретение относится к применению зеаксантина и/или рутина как таковых или также в сочетании со спермидином как активной основы в фармацевтической, пищевой или косметической композиции, подходящей для ингибирования активности фермента каспазы-3, и, следовательно, для регуляции апоптоза посредством предотвращения запрограммированной гибели клеток, для каждого показания, при котором применимо такое ингибирующее действие. Особое отношение имеется к лечению алопеции у людей через ингибирование каспазы.
Изобретение также относится к фармацевтической, пищевой или косметической композиции, подходящей для ингибирования активности фермента каспазы-3, и, следовательно, для регуляции апоптоза посредством предотвращения запрограммированной гибели клеток, отличающейся включением в качестве активной основы зеаксантина и/или рутина как таковых или также в сочетании со спермидином, составленной с любым эксципиентом, подходящим для местного или системного (предпочтительно, перорального) введения.
Экспериментальное исследование, описанное далее в данном описании, в действительности неожиданно показывает, что возможно получить ингибирование апоптозной активности каспазы-3 релевантным путем за счет использования соединений по настящему изобретению.
Поэтому показаниями для такой фармацевтической, пищевой или косметической композиции по изобретению являются, в основном, лечение расстройств волосистой части кожи головы, характеризующихся избыточным клеточным функциональным циклом, таких как алопеция, вызванная химиотерапией, гнездная алопеция, андрогенная алопеция и телоген с выпадением волос.
Изобретение относится к применению в качестве активных ингредиентов соединений зеаксантина или рутина по отдельности или в паре друг с другом, каждого в паре со спермидином или обоих в сочетании со спермидином.
В одном воплощении композиция по изобретению включает зеаксантин или рутин.
В другом воплощении композиция по изобретению включает зеаксантин и рутин. В соответствующем воплощении композиция по изобретению включает 2 мг зеаксантина и 2,5 мг рутина.
В предпочтительном воплощении композиция по изобретению включает зеаксантин, рутин и спермидин. В соответствующей форме предпочтительного осуществления композиция по изобретению включает зеаксантин, рутин и спермидин в массовом соотношении приблизительно 8:5:1, соответственно. В другой форме предпочтительного осуществления композиция по изобретению включает зеаксантин, рутин и спермидин в массовом соотношении приблизительно 4:5:1, соответственно.
В другом воплощении композиция по изобретению включает активную основу, которая состоит из рутина и спермидина. В соответствующем воплощении композиция по изобретению включает рутин и спермидин в массовом соотношении приблизительно 5:1.
В другом воплощении композиция по изобретению включает зеаксантин и спермидин. В соответствующем воплощении композиция по изобретению включает зеаксантин и спермидин в массовом соотношении приблизительно 4:1.
В одном воплощении композиция по изобретению включает эксципиенты для местного применения для волосистой части кожи головы. Подходящие концентрации выбирают из следующих: 0,0005-1%, мас/мас, зеаксантина, 0,0005-1%, мас./мас, рутина и 0,0001-1%, мас./мас, гидрохлорида спермидина.
В другом воплощении композиция по изобретению включает эксципиенты для системного введения, предпочтительно, перорального. В предпочтительном воплощении композиция для перорального введения, в том числе, таблетка, включает 2 мг зеаксантина, 2,50 мг рутина и 0,50 мг тригидрохлорида спермидина.
Приведенные далее примеры иллюстрируют изобретение без ограничения каким-либо путем его объема притязаний.
Пример 1
Пищевая добавка в таблетках для перорального применения с зеаксантином, рутином, спермидином, служащими донорами серы соединениями (сульфированные аминокислоты, метилсульфонилметан), витаминами и минералами
Каждая таблетка содержит указанное далее.
Пример 2
Пищевая добавка в твердых капсулах с зеаксантином, рутином и спермидином
Каждая капсула содержит указанное далее.
Пример 3
Пищевая добавка в таблетках для перорального применения с зеаксантином, рутином, спермидином, изофлавонами сои, сухим экстрактом Emblica officinalis, ресвератролом, витаминами и минералами
Каждая таблетка содержит указанное далее.
Пример 4
Не выделяющий пузырьков газа гранулированный препарат для немедленного применения на основе соединений доноров серы (метилсульфонилметан) и зеаксантина
Каждая доза содержит указанное далее.
Пример 5
Таблетки пищевой добавки для перорального применения с зеаксантином, рутином, спермидином, L-аргинином, Ajuga reptans, кверцетином, витаминами и минералами
Каждая таблетка содержит указанное далее.
Масло бурачника (омега-6-полиненасыщенные
Дигидрат двухосновного
Пример 6
Пищевая добавка в таблетках для перорального применения с молочными кислотами и питательными веществами, применимая для восстановления баланса при осыпании с волосистой части головы
Каждая таблетка содержит указанное далее.
Пример 7
Гель для укладки волос с зеаксантином, рутином, спермидином
Пример 8
Укрепляющий волосы безвоздушный мусс с зеаксантином, рутином и спермидином
Пример 9
Укрепляющий волосы лосьон с зеаксантином, рутином и спермидином
Пример 10
Восстанавливающий структуру волос кондиционер с зеаксантином, рутином и спермидином
Пример 11
Маска-гель против потери волос с зеаксантином, рутином и спермидином
«Сополимер акрилоиламмония-
Пример 12
Укрепляющий волосы шампунь с зеаксантином, рутином и спермидином
Пример 13
Гель для укладки волос с зеаксантином, рутином, спермидином и изофлавонами сои
Пример 14
Укрепляющий волосы безвоздушный мусс с зеаксантином, рутином, спермидином и изофлавонами сои
Пример 15
Укрепляющий волосы лосьон с зеаксантином, рутином спермидином и изофлавонами сои
Пример 16
Восстанавливающий структуру волос кондиционер с зеаксантином, рутином, спермидином и изофлавонами сои
Пример 17
Маска-гель против потери волос с зеаксантином, рутином, спермидином и изофлавонами сои
Пример 18
Укрепляющий волосы шампунь с зеаксантином, рутином, спермидином и изофлавонами сои
Пример 19
Укрепляющий волосы шампунь с зеаксантином, рутином и спермидином
Пример 20
Укрепляющий волосы лосьон с зеаксантином, рутином и спермидином
Пример 21
Укрепляющий волосы шампунь с зеаксантином и спермидином
Пример 22
Укрепляющий волосы безвоздушный мусс с рутином и спермидином (без зеаксантина)
Пример 23
Укрепляющий волосы лосьон с зеаксантином и рутином
Краткое описание чертежей
Теперь описывается экспериментальное исследование действий изобретения с обращением к фигурам 1-4 с прилагаемыми диаграммами.
Фигуры показывают диаграммы относительного процентного изменения апоптозной активности каспазы-3 в присутствии активных ингредиентов по изобретению, как подробно описано ниже.
Аббревиатуры на диаграммах имеют значения, указанные далее в таблице А.
Экспериментальное исследование
Материалы и методы
Активность каспазы-3
Активность каспазы-3 оценивают с использованием колориметрического теста ApoTargetTMCaspase-3/CPP32 с DEVD-pNA в качестве субстрата (BioSource International, Camarillo, СА). DEVD-pNA состоит из хромоформной группы (п-нитроанилид (pNA)) и синтетического тетрапептида (DEVD-Asp-Glu-Val-Asp), который представляет собой консенсусную последовательность для протеолитического разрыва, катализируемого каспазой-3. Тест осуществляют, обстоятельно следуя указаниям изготовителя, с использованием равного количества общего белка (200 мкг) для каждого образца.
Каждый образец испытывают дважды. Активность оценивают, измеряя поглощение при 405 нм (на диаграммах Абс.405 нм) автоматическим спектрометром для прочтения 96-луночных планшетов (MPT Reader DV990 BVG), что осуществляют двойным прочтением для каждой лунки.
Лизис клеток
Клеточный лизис представляет собой метод, применяемый для экстракции всех белков в анализируемых культивированных клетках. Существуют различные протоколы лизиса: один, используемый в экспериментах, описанных в данном описании, состоит в использовании сильно денатурирующего буфера (буфер для лизиса, имеющийся в наборе для испытания на активность каспазы-3). После инкубации с различными активными ингредиентами буфер для лизиса помещают на клеточные пластинки, затем используют скребок прямо по слою клеток, чтобы способствовать сбору их наибольшего возможного количества. Затем используют экстракцию белка с инкубацией на льду (4°C) в течение 10 минут. Клеточный дебрис осаждают центрифугированием при 10000×g в течение 1 минуты. Лизаты возвращают и замораживают при -80°C. Анализ белка: метод Лоури-Чикальтеу
Используют спектрометр для определения концентрации белков, измеряя поглощение монохроматического света веществом. Полученная величина является функцией числа молекул, сталкивающихся со световым лучом, которое, в свою очередь, зависит от двух факторов: толщины слоя раствора, через который проходит луч (как, правило, используют кювету толщиной один сантиметр) и концентрации проверяемого вещества. Для того, чтобы осуществить определение, строят калибровочную кривую, которая передает изменение поглощения как функцию известного количества белка в стандартных условиях анализа. Точки должны, без ошибки эксперимента, лежать на линии, проходящей через начало координат. Откладывая величину поглощения неизвестного образца по оси Y стандартной кривой можно определить соответствующую концентрацию образца по оси X. Определение повторяют как для образцов, так и для стандартной кривой. Стандартную кривую строят с использованием BSA.
Спектрофотометрическое измерение поглощения осуществляют при длине волны 605 нм для продукта взаимодействия между реагентом Фолина-Чикальтеу, раствором натриевых солей вольфрамовой, молибденовой и фосфорной кислот и спиртовыми группами тирозинов белка в присутствии ионов Cu2+. Химической основой образования окраски является восстановление реагента Фолина-Чикальтеу, выполненное ионами меди.
Оценка антиапоптозной активности зеаксантина, рутина и спермидина: ингибирование активации фермента каспазы-3
Антиапоптозное действие активных ингредиентов по изобретению зеаксантина, рутина и спермидина исследуют на клетках HFDPC-c (PromoCell®), поддерживаемых в культуре в присутствии среды для роста фолликульных дермальных сосочков, следуя указаниям изготовителя (PromoCell®).
Активность каспазы 3 оценивают с использованием колориметрического анализа ApoTargetTMCaspase-3/CPP32, и концентрацию белка оценивают с использованием метода Лоури-Чикальтеу и стандарта BSA, как описано выше.
Результаты
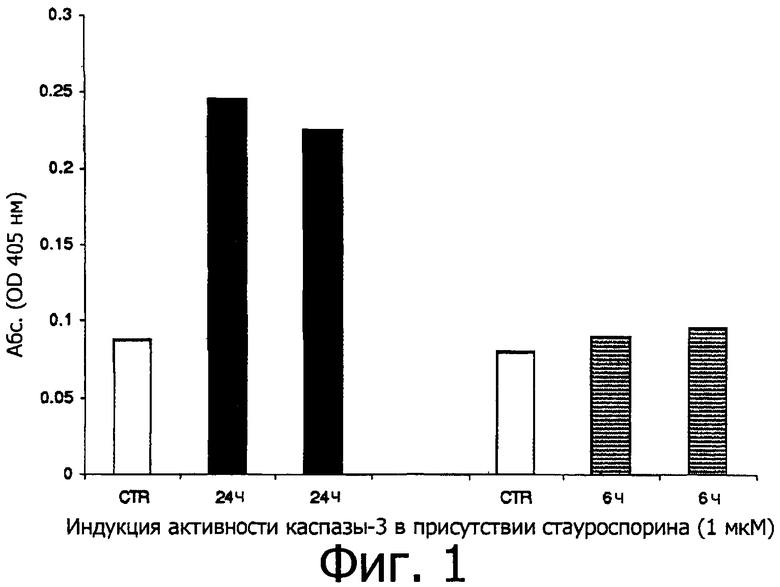
В клетках HFDPC-c индукцию апоптоза, свидетельством которой является возрастание активности каспазы-3, получают путем 24-часовой инкубации клеток со стауроспорином (1 мкМ), как показано на фигуре 1.
Активность различных активных ингредиентов по изобретению оценивают, добавляя их в различных концентрациях, как указано далее в таблице А, в среду для выращивания клеток сразу же после добавления стауроспорина (1 мкМ). В данном случае инкубацию также поддерживают в течение 24 часов.
По окончании инкубации планшеты, в которых культивировали клетки, выкладывают на слой льда, промывают один раз в холодном PBS и инкубируют в буфере для лизиса. После лизиса осуществляют анализ белка и тест на активность каспазы-3.
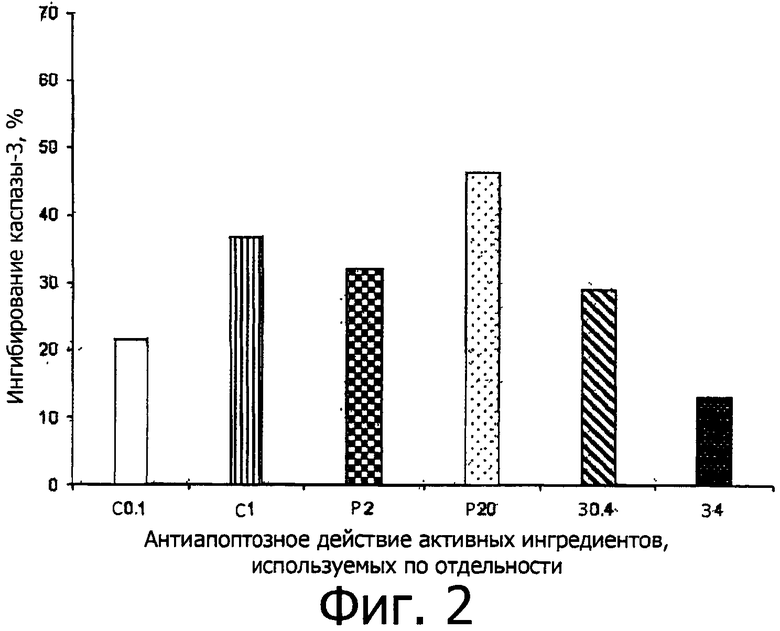
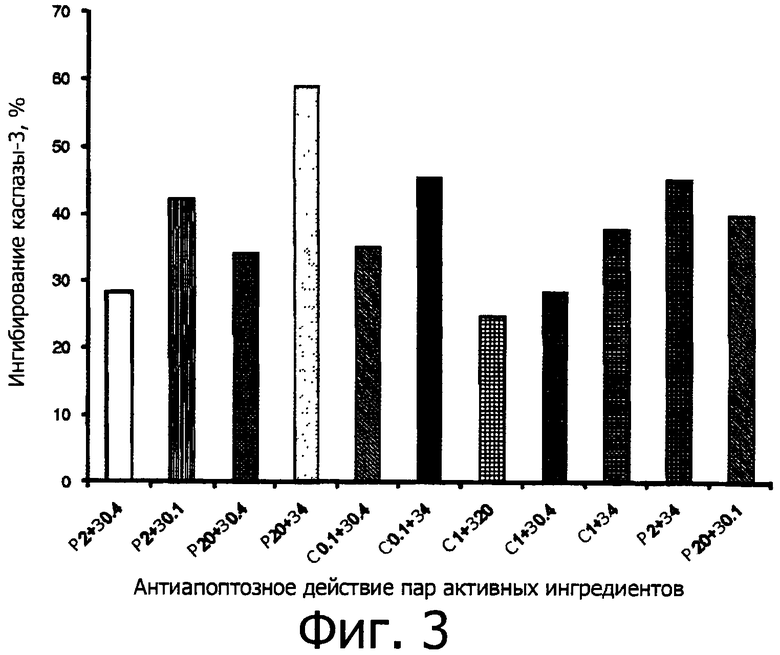
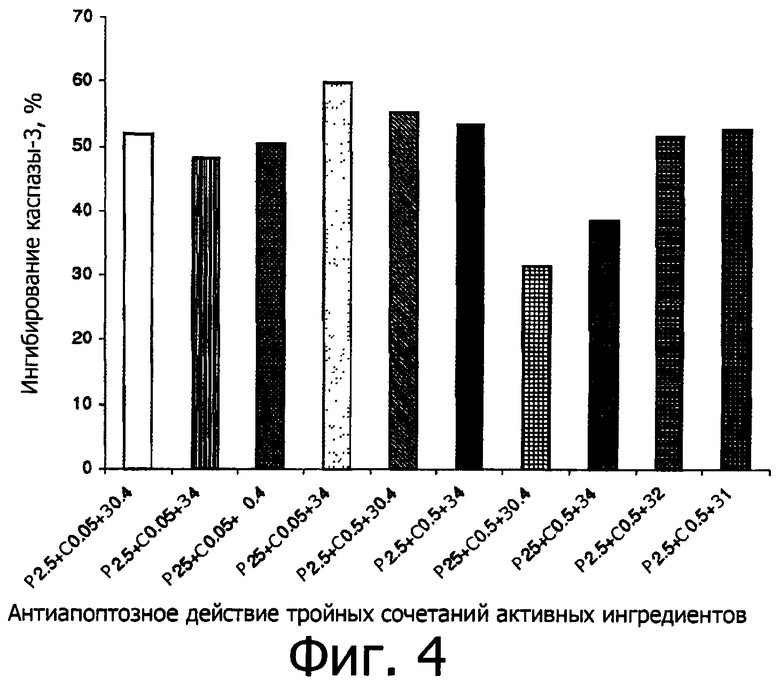
Влияние на активность каспазы-3 оценивают после инкубации с активными ингредиентами, используемыми по отдельности одновременно, как показано на фигуре 2, и в различных их сочетаниях, как показано на фигуре 3 (пары) и фигуре 4 (по три).
В таблице В приводится изменение, в процентах, активности каспазы-3, полученное для отдельных активных ингредиентов и их сочетаний относительно 100% активности в случае 1 мкМ стауроспорина.
В колонке «Активный ингредиент», например, Р2 показывает рутин в концентрации 2,2 мкМ; Р20 показывает рутин в концентрации 22 мкМ; и т.д., как указано выше в таблице А. Например, Р2+С1+З4 показывает тройную комбинацию, в которой рутин присутствует в концентрации 2,2 мкМ; спермидин присутствует в концентрации 1 мкМ; зеаксантин присутствует в концентрации 80 мкМ. Комбинации Р2+С1+З4 соответствует: рутин=2,5 мг чистого активного ингредиента; спермидин - 0,5 мг чистого активного ингредиента; зеаксантин=4 мг чистого активного ингредиента, при относительном массововм соотношении Р:С:З=5:1:8. Подобным образом, C1+Р2+З2 соответствует сочетанию: рутин=2,5 мг чистого активного ингредиента; спермидин=0,5 мг чистого активного ингредиента; зеаксантин=2 мг чистого активного ингредиента, при относительном массововм соотношении Р:С:З=5:1:4.
СТ = стауроспорин, З = зеаксантин, Р = рутин, С = тригидрохлорид спермидина
Обсуждение
Обратившись к приведенной выше таблице В и диаграммам для детальной оценки активности, можно увидеть следующее.
- Некоторые пары активных ингредиентов (такие как, например, пара С0,1+З4) более эффективны и превосходны по своей антиапоптозной активности оносительно отдельных активных ингредиентов в той же концентрации, демонстрируя синергию.
Среди испытанных пар наивысшая величина % ингибирования каспазной активности отмечается для пары зеатаксин+рутин (см. Р20+З4, обеспечивает 59,0% ингибирование).
- В случае тройных сочетаний активность триады Р+С+З особенно ощутима в виду того, что зеатаксин, добавленный к паре Р+С, улучшает % ингибирования каспазной активности соизмеримо даже при низкой концентрации, см., например, случай З0,4 (50,4% ингибирование) и З4 (59,79% ингибирование) в тройном сочетании с парой Р20+С0,1.
Следовательно, синергия наблюдается среди активных ингредиентов даже независимо от их повышенной концентрации.
Клиническое исследование для лечения андрогенной алопеции и телогена с выпадением волос
Обоснование
По приведенным выше оценкам композицию по изобретению подвергают клиническому исследованию для оценки ее способности регулировать старение клеток и процессы апоптоза в волосяных фолликулах, запускающие потерю волос у людей.
При трихологических заболеваниях, таких как андрогенная алопеция, телоген с выпадением волос и гнездная алопеция, различные клеточные компоненты, которые составляют волосяной фолликул, претерпевают апоптозный процесс, вызванный изменением клеточных регулирующих механизмов, включая системы обмена клеточных переходов (messages) (щелевые контакты) и инициацию каспазного пути в ДНК.
Такое преждевременное старение дермальных сосочков фолликула, спровоцированное окислительным стрессом, объединяется с различными специфическими факторами, и в частности, с взаимодействием фолликулярных андрогенных рецепторов при андрогенной алопеции по мужскому и женскому типу.
Материалы и методы
Открытое клиническое испытание проводят и осуществляют на 50 субъектах (26 женщин, 24 мужчины), страдающих от телогена с выпадением волос и андрогенной алопеции по мужскому и женскому типу. Здоровых добровольцев в возрасте от 20 до 45 лет, страдающих от андрогенной алопеции и телогена с выпадением волос, набирают согласно стандартизированным критериям включения и исключения для такого типа испытания (отсутствие заболеваний внутренних органов и эндокринных заболеваний, беременности, предположения о лекарственных средствах в области эндокринологии или зависимости от эндокринологических терапий, одновременного системного или местного трихологического лечения в течение менее шести месяцев).
Исследование осуществляют открытым путем через введение таблеток композиции по изобретению, содержащих Р2+С1+З2, что соответствует составу рутин=2,5 мг чистого активного ингредиента; тригидрохлорид спермидина=0,5 мг чистого активного ингредиента; зеатаксин=2 мг чистого активного ингредиента, с массовым соотношением Р:С:З=5:1:4.
Каждый субъект получает необходимую дозировку в течение 3 месяцев лечения.
Харктеристики субъектов на время набора приводятся в таблице С.
Клиническая оценка
Осуществляют дерматологическую клиническую оценку субъектов для того, чтобы установить диагноз и степень андрогенного и телогенного облысения, и определяют количественный показатель улучшения или ухудшения, начиная со времени набора, или базовую линию, до промежуточного и конечного контроля, соответственно:
Т0=базовая линия;
T1=промежуточный контроль;
Т2=конечный контроль.
Оценку осуществляют согласно стандартизированной шкале, используемой в большинстве клинических испытаний такого типа:
сильное ухудшение (-3),
сильное улучшение (+3),
хорошее ухудшение (-2),
хорошее улучшение (+2),
слабое ухудшение (-1),
слабое улучшение (+1),
нет изменений (0).
Параметрами, используемыми для клинической оценки, являются процентная оценка анагена дерматоскопией, диаметр стержня волоса и испытание на вытягивание для оценки меры отделения волоса от кожи головы. Процент фолликул в стадии анагена оценивают методом дерматоскопии, и рассматривают наиболее достоверные и наименее инвазивные. Диаметр стержня волоса измеряют при Т0, T1 и Т2. Диаметр волоса показывает клиническое состояние развития андрогенного облысения, где уменьшение является одним из патогномонических симптомов. Диаметр волоса также является показателем состояния дистресса фолликул для установления апоптозного процесса в дермальных сосочках и эпителиальных компонентах матрикса.
Возрастание в фазе анагена: при наличии трихологической патологии фаза анагена в волосяных фолликулах имеет склонность становиться короче из-за модификации механизмов регуляции хронометража цикла развития волос. Сокращение анагена определяет быстрый переход фолликула в прогрессирующие фазы гибели клеток (катаген, телоген), индуцируемые клеточными апоптозными процессами (главным образом, через индукцию каспазного пути).
По такой причине возрастание в фазе анагена в ходе трихологической терапии является четким показателем положительного действия используемых веществ на жизнь клеток волосяных фолликул.
Наконец, оценка в испытании на вытягивание показывает серьезность потери волос, учитывая числа волос, собранных после определенного тягового усилия оператора: волосы, которые имеют наименьшее сцепление с дермальным и эпидермальным слоями, удаляются. Чем больше количество удаленных волос при каждом вытягивании, тем серьезнее потеря волос. Снижение числа волос, вытянутых за испытание, показывает уменьшение потери волос.
Наконец, осуществляют оценку любых побочных действий на кожу или системных побочных действий путем дерматологического обследования и любых других исследований, считающихся необходимыми
Результаты
Итог по средним данным, полученным для базовой линии (Т0), приводится в следующей таблице D.
Итог по средним данным, полученным в промежуточный момент (T1), приводится в следующей таблице Е.
Итог по средним данным, полученным в конечный момент (Т2), приводится в следующей таблице F.
Результаты показывают улучшение по всем оцениваемым параметрам у пациентов, получавших лечение композицией по изобретению.
В частности:
Увеличение диаметра стержня волоса является статистически значимым, изменяясь от среднего значения 0,5 мм (среднее) при Т0 до 0,8 мм (среднее) при Т2 - показатель стимулирующего воздействия удлинения фазы анагена дермальных сосочков (увеличение диаметра стержня волоса на 62%). Такой результат получен у 85% субъектов, которых лечили по изобретению. Также интересно отметить, что положительная реакция является достаточно быстрой: оценку клинического улучшения 70% и у 35 субъектов из 50 (70%) получают уже при Т1.
В этом отношении средняя величина анагена у субъектов, получавших лечение, при Т0 составляла 65%, поднимаясь до 72% при T1 (+6,9%) и 84% при Т2 (+22,6%).
Заключение из дерматологической клинической оценки отражает итог полученных данных. Общее улучшение в связи с показателями, установленными как сильное улучшение и хорошее улучшение, оценивается на уровне 86% субъектов. Если умеренное улучшение также рассматривать как положительный результат, процент субъектов, которые имеют пользу от лечения, достигает 92%. Показатель оценки клинического улучшения приводится в таблице G.
Испытание на вытягивание: результаты показывают резкое снижение потери волос у 43 из 50 испытываемых субъектов (86%). Средние величины в испытании приводятся в следующей таблице Н.
Обсуждение
Данные, полученные в клиническом испытании, приведенные выше, показывают замечательное улучшение параметров, считающихся важными для оценки тяжести трихологического заболевания, а именно:
- увеличение диаметра стержня волоса,
- модификация фазы анагена,
- дерматологическое клиническое улучшение,
- улучшение при испытании на вытягивание.
Увеличение диаметра стержня волоса бесспорно существенно у 86% испытываемых субъектов - доказательство улучшения состояния фолликул и удлинения фазы анагена, причем также учитывается общее увеличение процента фолликул в анагене в конце лечения.
Улучшение в испытании на вытягивание равно очевидно в связи с уменьшением от среднего значения показателя 3 при Т0 до среднего значения 0 при Т2 у 86% субъектов, состояние которых оценивали в исследовании.
Наконец, у пациентов, которых лечили, не отмечают системного побочного действия.
Следовательно, композиция по изобретению представляет ценное терапевтическое средство при андрогенной алопеции и телогене с выпадением волос.
В дополнение к клиническим результатам, полученным и описанным выше, далее приводится таблица L для сравнения данных, обсуждаемых выше для композиции по изобретению (Р2+С1+З2), с соответствующими данными, полученными в аналогичном клиническом исследовании с введением композиции, соответствующей известному уровню техники (ЕР 1469843 тех же Заявителей), содержащей только 0,5 мг/таблетку спермидина как активного ингредиента, показанного в таблице L как С1.
Данное сравнение показывает существенное улучшение за счет изобретения по всем основным параметрам, описанным выше.
Изобретение относится к фармацевтической промышленности и представляет собой применение зеаксантина как такового или в сочетании с рутином, или со спремидином, или как с рутином, так и со спремидином, для лечения расстройств волосистой части кожи головы, включая вызванную химиотерапией алопецию, гнездную алопецию, андрогенную алопецию и телоген с выпадением волос. Изобретение обеспечивает расширение арсенала средств для лечения расстройств волосистой части кожи головы. 5 н. 15 з.п. ф-лы, 23 пр., 4 ил., 9 табл.
1. Применение зеаксантина как такового, или в сочетании с рутином, или со спремидином, или как с рутином, так и со спремидином, для лечения расстройств волосистой части кожи головы, включая вызванную химиотерапией алопецию, гнездную алопецию, андрогенную алопецию и телоген с выпадением волос.
2. Применение зеаксантина как такового, или в сочетании с рутином, или со спремидином, или как с рутином, так и со спремидином, для получения фармацевтической композиции для перорального или местного введения, подходящей для лечения расстройств волосистой части кожи головы, включая вызванную химиотерапией алопецию, гнездную алопецию, андрогенную алопецию и телоген с выпадением волос.
3. Применение по п.2, характеризующееся использованием в указанной композиции зеаксантина и рутина.
4. Применение по п.3, характеризующееся использованием в указанной композиции зеаксантина в количествах 0,2-10 мг и рутина в количествах 0,5-25 мг.
5. Применение по п.2, характеризующееся использованием в указанной композиции зеаксантина, рутина и спермидина.
6. Применение по п.5, характеризующееся использованием в указанной композиции зеаксантина в количествах 0,2-10 мг, рутина в количествах 0,5-25 мг и спермидина в количествах 0,05-0,5 мг.
7. Применение по п.5, характеризующееся использованием в указанной композиции зеаксантина, рутина и спермидина в массовом соотношении 4:5:1 соответственно.
8. Применение по п.2, характеризующееся использованием в указанной композиции зеаксантина и спермидина.
9. Применение по п.8, характеризующееся использованием в указанной композиции зеаксантина в количествах 0,2-10 мг и спермидина в количествах 0,05-0,5 мг.
10. Фармацевтическая композиция для лечения расстройств волосистой части кожи головы, включая вызванную химиотерапией алопецию, гнездную алопецию, андрогенную алопецию и телоген с выпадением волос, характеризующаяся включением в качестве активной основы зеаксантина как такового, или в сочетании, или с рутином, или со спермидином, или как с рутином, так и со спермидином, с эксципиентами для местного применения для волосистой части головы.
11. Композиция по п.10, характеризующаяся включением 0,0005-1% мас./мас. зеаксантина.
12. Композиция по п.10, характеризующаяся включением 0,0005-1% мас./мас. зеаксантина и 0,0001-1% мас./мас. тригидрохлорида спермидина.
13. Композиция по п.10, характеризующаяся включением 0,0005-1% мас./мас. зеаксантина, 0,0005-1% мас./мас. рутина и 0,0001-1% мас./мас. тригидрохлорида спермидина.
14. Фармацевтическая композиция для перорального или местного введения для лечения расстройств волосистой части кожи головы, включая вызванную химиотерапией алопецию, гнездную алопецию, андрогенную алопецию и телоген с выпадением волос, отличающаяся тем, что активной основой является зеаксантин как таковой.
15. Фармацевтическая композиция для перорального или местного введения для лечения расстройств волосистой части кожи головы, включая вызванную химиотерапией алопецию, гнездную алопецию, андрогенную алопецию и телоген с выпадением волос, характеризующаяся включением в качестве активной основы зеаксантина в сочетании со спермидином или как с рутином, так и со спермидином.
16. Композиция по п.15, характеризующаяся включением зеаксантина в количествах 0,2-10 мг, рутина в количествах 0,5-25 мг и спермидина в количествах 0,05-0,5 мг.
17. Композиция по п.15, характеризующаяся включением зеаксантина, рутина и спермидина в массовом соотношении 4:5:1 соответственно.
18. Композиция по п.15, характеризующаяся включением зеаксантина и спермидина.
19. Композиция по п.18, характеризующаяся включением зеаксантина в количествах 0,2-10 мг и спермидина в количествах 0,05-0,5 мг.
20. Композиция по п.15, характеризующаяся включением 2 мг зеаксантина, 2,5 мг рутина и 0,285 мг спермидина (соответствующих 0,5 мг тригидрохлорида спермидина) на стандартную форму для перорального введения.
| WO 9610387 А, 11.04.1996 | |||
| WO 2008114141 A, 25.09.2008 | |||
| US 2006264357 A1, 23.11.2006 | |||
| СТИМУЛИРУЮЩИЕ КОМПОЗИЦИИ ДЛЯ РОСТА ВОЛОС | 2001 |
|
RU2274440C2 |
Авторы
Даты
2014-01-20—Публикация
2009-10-30—Подача