Способ относится к медицине и может быть использован для выбора индивидуальных дозиметрических параметров при лазерной терапии тканей организма человека.
Фотодинамическая терапия (ФДТ) является методом лечения рака с применением света и химического вещества - фотосенсибилизатора (ФС), используемого в сочетании с молекулярным кислородом, который, в свою очередь, вызывает повреждение и гибель раковых клеток. Физический механизм ФДТ можно представить следующим образом. После внутривенного введения ФС он избирательно накапливается в опухолевых тканях. При облучении пораженного участка ткани светом определенной длины волны сенсибилизатор поглощает кванты света и затем передает энергию молекулярному кислороду в ткани, вследствие чего происходит его активация и образуется так называемый синглетный кислород. Данная возбужденная форма молекулы кислорода токсична для биоткани и разрушает опухоль. ФДТ также приводит к нарушению питания и гибели опухоли за счет повреждения ее микрососудов.
Поскольку ФДТ сопровождается непрерывной утилизацией молекулярного кислорода в фотохимических реакциях, то для максимального повреждения раковых клеток необходимо поддерживать требуемый уровень оксигенации опухолевой ткани на протяжении всего сеанса терапии. Эффективным методом устранения недостатка кислорода (гипоксии) в зоне опухоли является его дополнительная экстракция за счет лазерно-индуцированной фотодиссоциации оксигемоглобина (HbO2) [1]. При этом важно обеспечить возможность генерации кислорода на требуемой глубине в ткани, где находится опухолевый участок с ФС. Для решения этой задачи требуется знание концентрации HbO2 в ткани и распределения освещенности Ф(z,λ) по глубине z ткани и длине волны света λ.
Известны способы повышения эффективности ФДТ [2-4], основанные на контроле расхода ФС в фотохимических реакциях с участием кислорода путем сравнения спектров диффузного отражения (ДО) или флуоресценции реальной ткани с аналогичными спектрами модельных растворов с известным содержанием ФС. Однако за счет большого количества оптически активных хромофоров ткани (поглощающих и рассеивающих оптическое излучение) линия поглощения ФС в спектре отражения или флуоресценции ткани может быть сдвинута, а ее форма модифицирована по отношению к аналогичной линии для модельных растворов. Поэтому попытка интерпретировать измеряемый спектр на основе аналогичных спектров модельных образцов с конкретными оптическими параметрами не всегда правомерна.
В работе [5] предложен способ определения концентрации ФС в ткани на основе количественного анализа спектра ДО ткани с использованием закона Ламберта-Бера. Данный способ не позволяет достичь высокой точности определения концентрации ФС - коэффициент корреляции между результатами спектрального и биохимического анализов составляет всего лишь 0,77-0,88 [5]. Кроме того, он не позволяет контролировать эффективность доставки световой мощности в различные слои ткани (т.е. не решает задачу послойной дозиметрии лазерного излучения) и определять индивидуальную терапевтическую дозу облучения.
Известен ряд способов [6-8], в которых о концентрации ФС и HbO2 в ткани, а также о глубине проникновения света в ткань судят, в диффузионном приближении, по спектру ДО ткани, измеряемому с пространственным разрешением. Однако сложность необходимого экспериментального оборудования, большой динамический диапазон регистрируемых сигналов и жесткие ограничения по геометрии измерений и оптическим параметрам ткани, накладываемые диффузионным приближением, существенно затрудняют использование данных методов в клинической практике. Кроме того, данные способы не позволяют оценивать эффективность поглощения света фотосенсибилизатором и оксигемоглобином в различных слоях ткани и выбирать оптимальную терапевтическую дозу облучения.
Известен способ определения концентрации ФС в ткани, основанный на измерениях сигналов флуоресценции и диффузного отражения на расстояниях 0,65 и 1,35 мм от источника возбуждающего излучения соответственно [9]. К недостаткам данного способа следует отнести необходимость калибровочных измерений для образца с известной концентрацией ФС и влияние различия оптических параметров ткани на длинах волн возбуждающего излучения и света флуоресценции на результат измерений. Кроме того, знания одной лишь концентрации ФС недостаточно для анализа эффективности протекания фотофизических и фотохимических процессов в облучаемой ткани пациента и выбора оптимальной дозы облучения.
Известны также способы лазерной терапии биологических тканей, основанные на использовании длины волн лазерного излучения, обеспечивающих наиболее эффективное воздействие на ФС и HbO2 в слоях ткани с различной глубиной залегания [10-12]. Данные способы основаны на результатах моделирования светового поля в ткани при средних или выборочных значениях ее параметров и носят рекомендательный характер по выбору длин волн лазерного излучения. Однако эти данные непригодны для выбора оптимальных энергетических параметров лазерного воздействия, поскольку такой выбор должен осуществляться с учетом спектров поглощения света ФС и HbO2 в реально облучаемой ткани. При этом необходимо также принимать во внимание морфологические изменения ткани, вызываемые лазерным излучением. По данным экспериментальных исследований [13-15] в процессе сеанса ФДТ происходит частичное разрушение стенок кровеносных сосудов (с высвобождением гемоглобина) и существенно повышается концентрация метгемоглобина в опухолевой ткани (до 60% от общей концентрации гемоглобина), что, разумеется, влияет на выбор оптимальных спектральных и энергетических характеристик лазерного излучения.
Наиболее близким к заявляемому изобретению является способ фотодинамической терапии онкологических заболеваний [16], включающий введение фотосенсибилизатора в зону опухолевой ткани и воздействие на нее лазерным излучением одновременно на двух длинах волн. Первая длина волны совпадает с максимумом поглощения ФС, а вторая используется для фотодиссоциации оксигемоглобина с дополнительным выделением кислорода. Данный способ предполагает использование одних и тех же длин волн излучения и доз облучения для всех пациентов, что может приводить как к низкой эффективности ФДТ, так и к ряду нежелательных последствий, связанных с излишним нагревом ткани пациента и ее необратимыми изменениями (коагуляция, разрушение капилляров и т.д.).
Предлагаемое изобретение направлено на решение задач определения оптимальных для конкретного пациента параметров лазерного воздействия (дозы облучения и длины волны излучения), повышение эффективности ФДТ и минимизации побочных неблагоприятных эффектов лечения за счет контроля концентраций ФС и HbO2 в ткани и эффективности поглощения ими света в слоях ткани с различной глубиной залегания, а также за счет контроля морфологических изменений облучаемой ткани (объемного содержания кровеносных сосудов и соотношения различных форм гемоглобина).
Для решения данных задач в способе фотодинамической терапии онкологических заболеваний, включающем введение фотосенсибилизатора в зону опухолевой ткани и воздействие на нее лазерным излучением одновременно на двух длинах волн, обеспечивающих воздействие на фотосенсибилизатор и оксигемоглобин, дополнительно облучают ткань широкополосным излучением из видимого и ближнего ИК диапазонов спектра; измеряют спектр диффузного отражения ткани; по спектру диффузного отражения ткани определяют ее структурно-морфологические параметры, в числе которых концентрации кровеносных сосудов fbl и фотосенсибилизатора Cps в ткани, а также относительные содержания оксигемоглобина S и метгемоглобина CMetHb в крови; устанавливают спектр пространственной освещенности в ткани Ф(z,λ) с использованием модели переноса оптического излучения в ткани и найденных значений ее структурно-морфологических параметров; а длины волн и мощности лазерных источников, а также время лазерного воздействия на ткань, обеспечивающие наибольшее поглощение света фотосенсибилизатором и наилучшую генерацию кислорода на глубине залегания патологического участка ткани или во всей ее толще при минимальном воздействии лазерного излучения на здоровую ткань, определяют на основе распределений эффективностей поглощения света фотосенсибилизатором Kps(z,λ) и эффективности фотодиссоциации оксигемоглобина n(z,λ) по длине волны света λ и глубине ткани z, рассчитываемых на основе выражений:
Kps(z,λ)=Cpsεps(λ)Ф(z,λ),
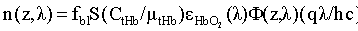
где εps и 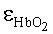
Сущность данного изобретения поясняется с помощью фиг.1-15.
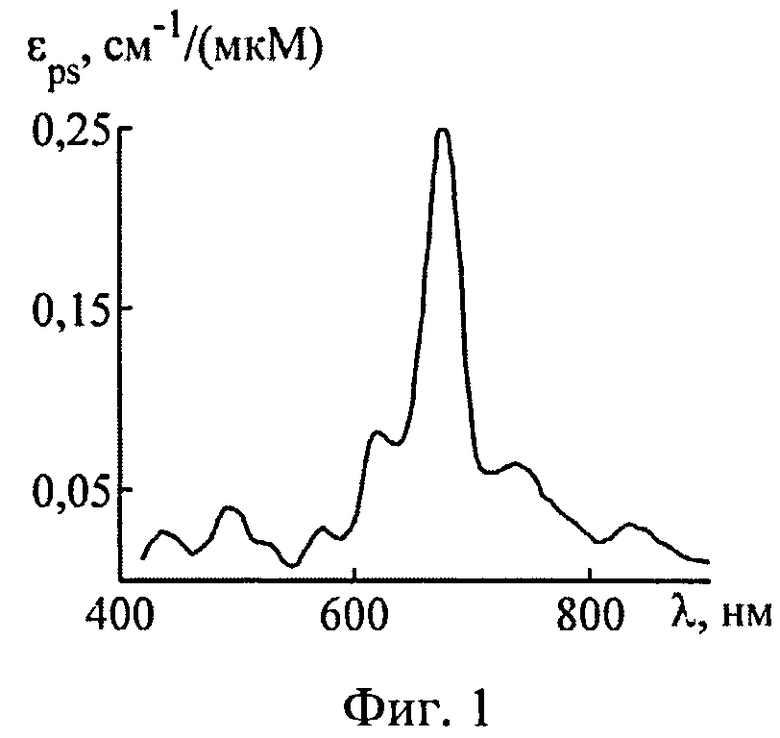
На фиг.1 представлен спектр поглощения света фотосенсибилизатором «Фотосенс».
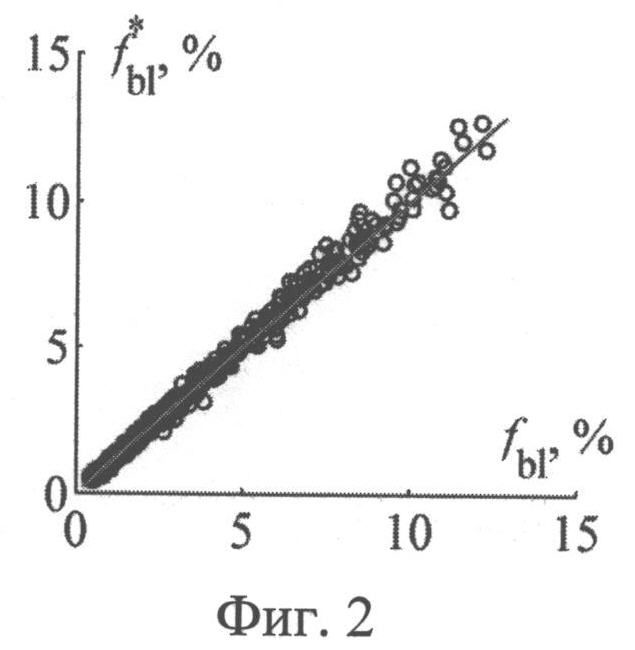
На фиг.2 представлены результаты численных экспериментов по восстановлению концентрации кровеносных сосудов в коже из спектра диффузно отраженного ею света, нормированного на λ=800 нм.
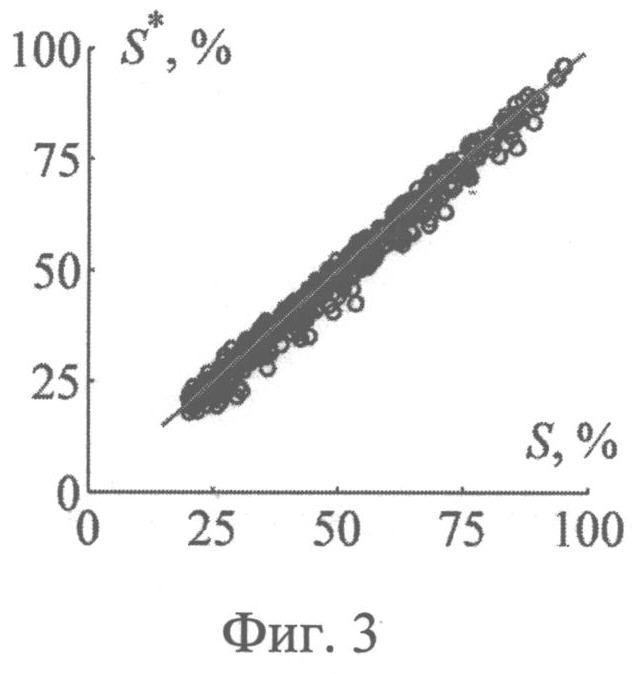
На фиг.3 представлены результаты численных экспериментов по восстановлению относительного содержания оксигемоглобина в крови (степени оксигенации крови) из спектра диффузного отражения кожи, нормированного на λ=800 нм.
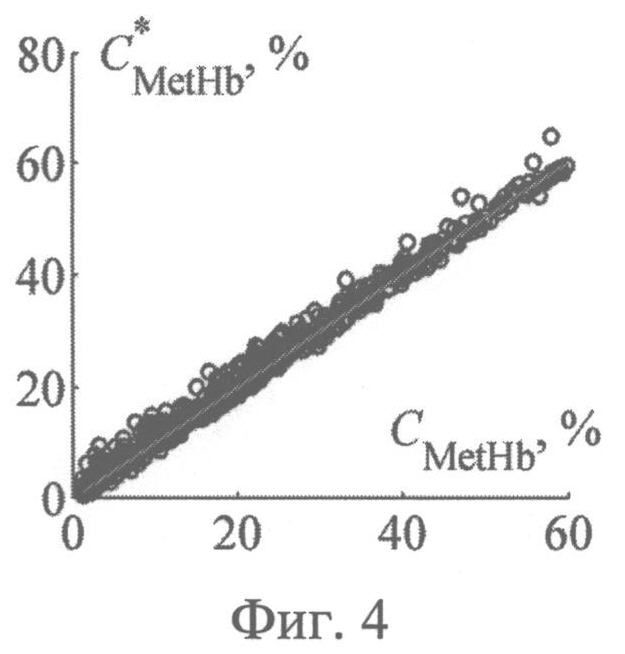
На фиг.4 представлены результаты численных экспериментов по восстановлению относительного содержания метгемоглобина в крови из спектра диффузного отражения кожи, нормированного на λ=800 нм.
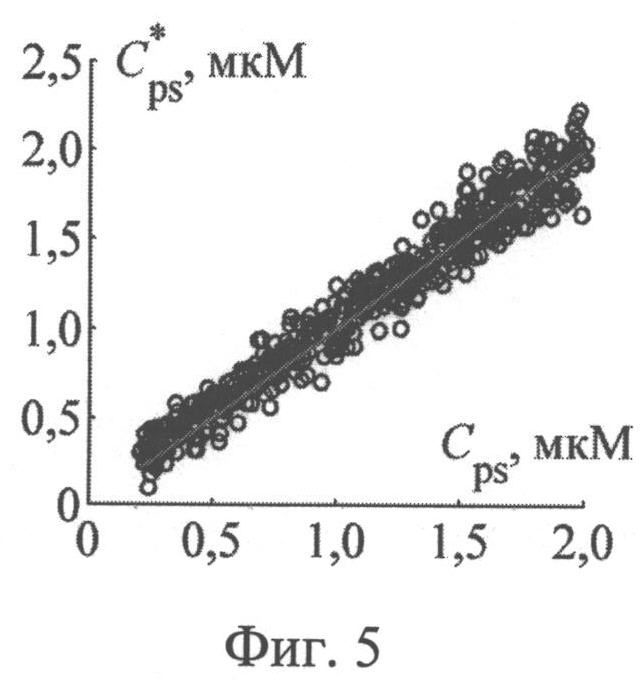
На фиг.5 представлены результаты численных экспериментов по восстановлению концентрации фотосенсибилизатора в кожной ткани из спектра диффузно-отраженного ею света, нормированного на λ=800 нм.
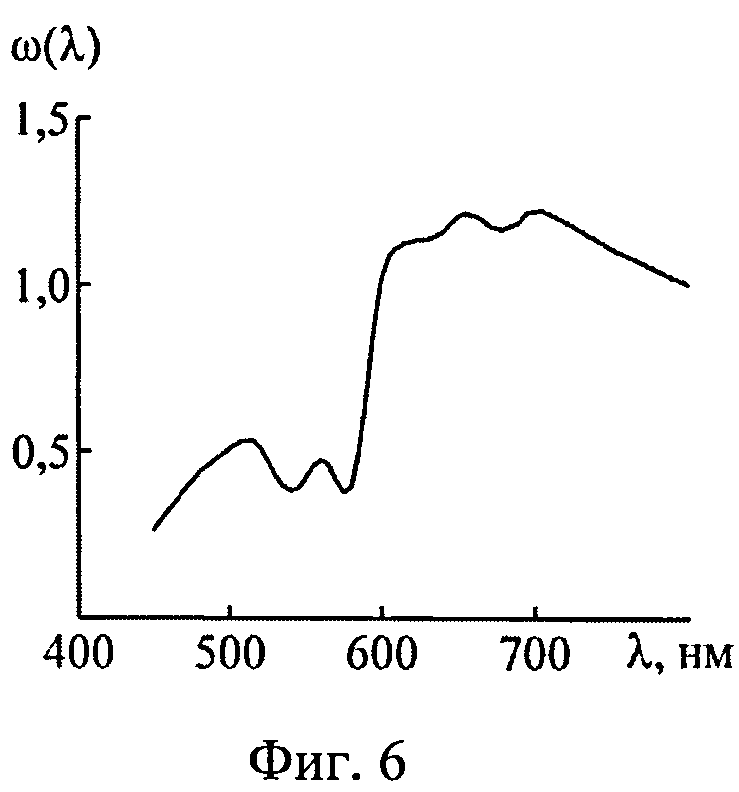
На фиг.6 представлен нормированный спектр диффузного отражения кожи, используемый для восстановления спектральной плотности излучения, поглощаемой фотосенсибилизатором и оксигемоглобином в слоях кожи с различной глубиной залегания.
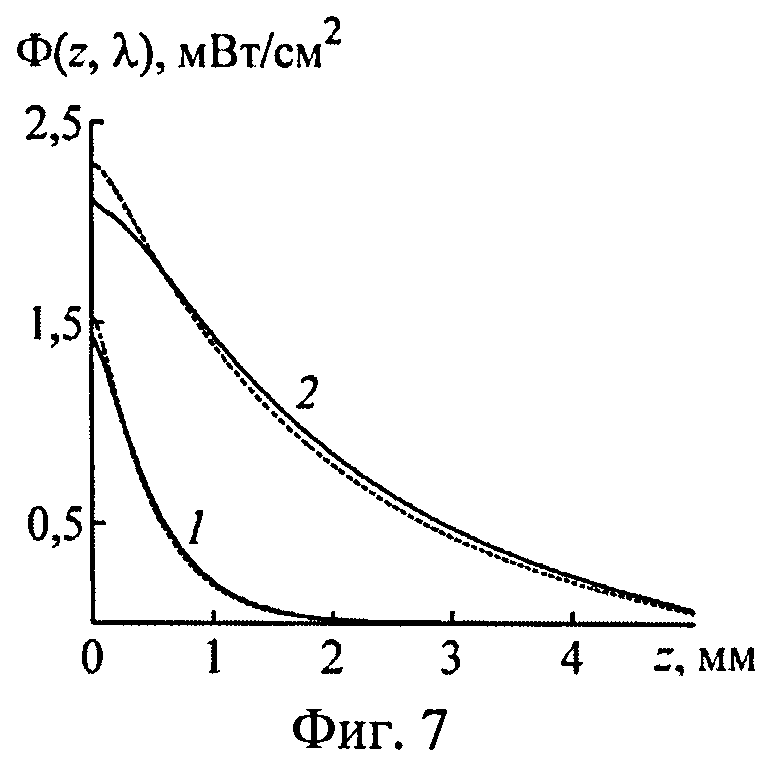
На фиг.7 представлены истинные (сплошные кривые) и восстановленные (пунктир) распределения полной освещенности по глубине кожи на λ=575 (1) и 675 нм (2).
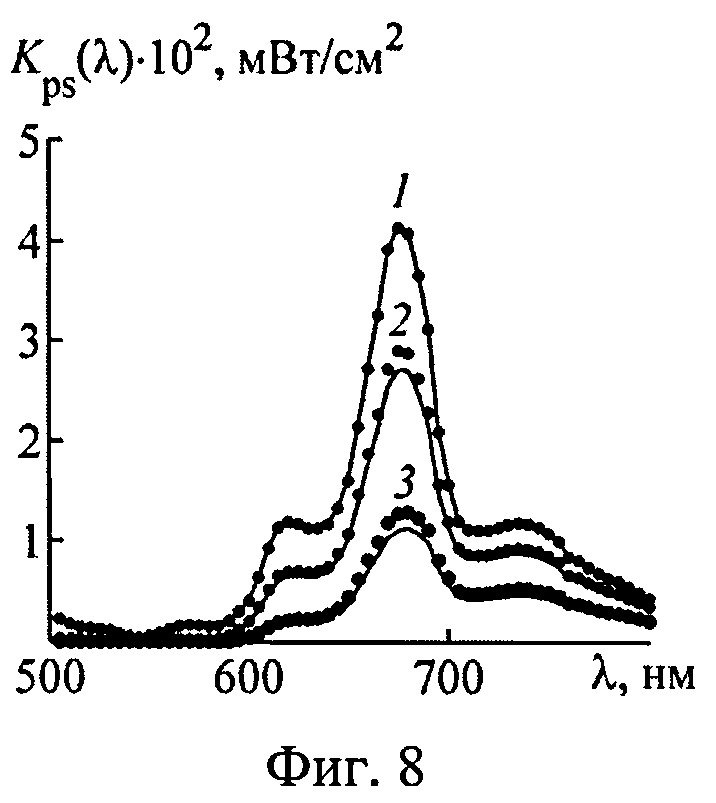
На фиг.8 представлены истинные (точки) и восстановленные (пунктир) спектральные эффективности поглощения света фотосенсибилизатором.
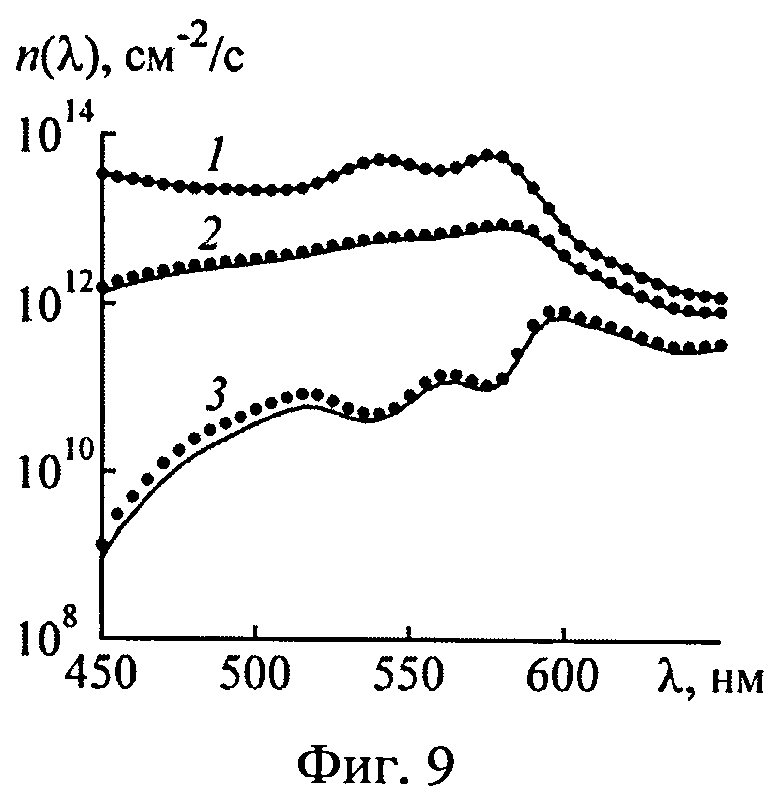
На фиг.9 представлены истинные (точки) и восстановленные (пунктир) спектры эффективности фотодиссоциации оксигемоглобина в трех слоях кожи [z1, z2]: 1-z1=0.1 мм, z2=1.0 мм; 2-z1=1.0 мм, z2=2.0 мм; 3-z1=3.0 мм, z2=5.0 мм.
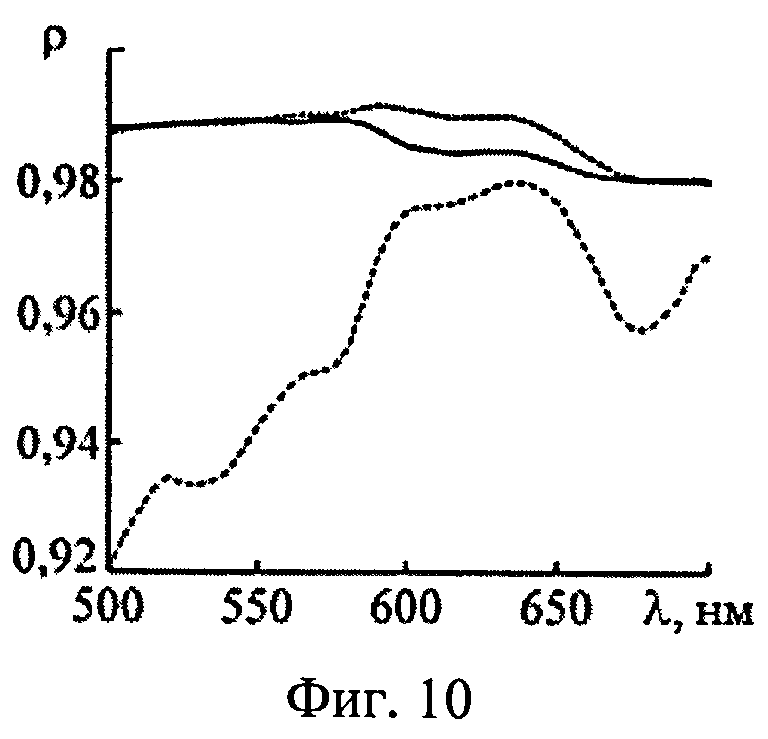
На фиг.10 представлены коэффициенты корреляции между истинными и восстановленными спектрами эффективности поглощения света фотосенсибилизатором для трех слоев ткани с различной глубиной залегания; 1-z=0.1-1.0 мм; 2-z=1.0-2.0 мм; 3-z=3.0-5.0 мм.
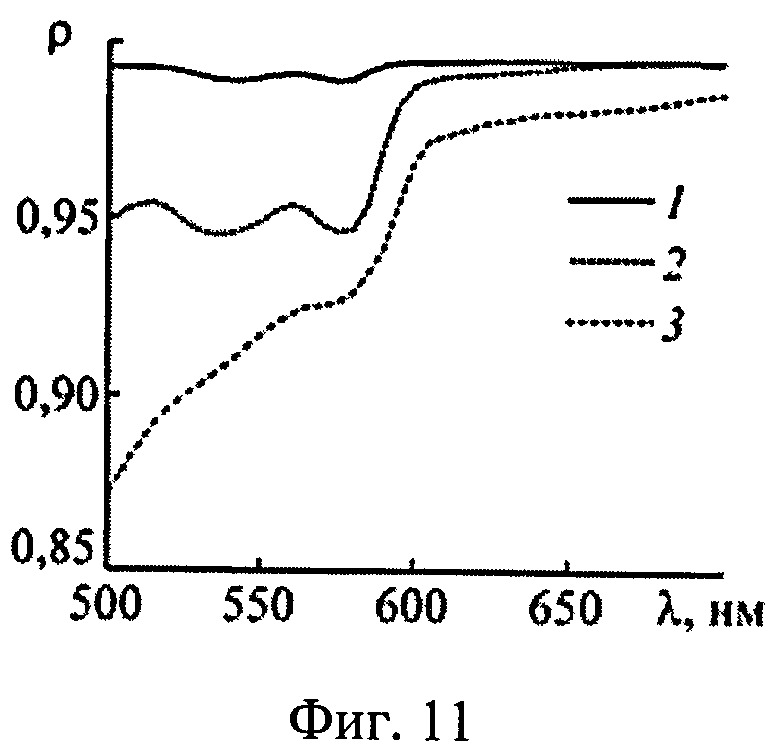
На фиг.11 представлены коэффициенты корреляции между истинными и восстановленными спектрами эффективности фотодиссоциации оксигемоглобина для трех слоев ткани с различной глубиной залегания; 1-z=0.1-1.0 мм; 2-z=1.0-2.0 мм; 3-z=3.0-5.0 мм.
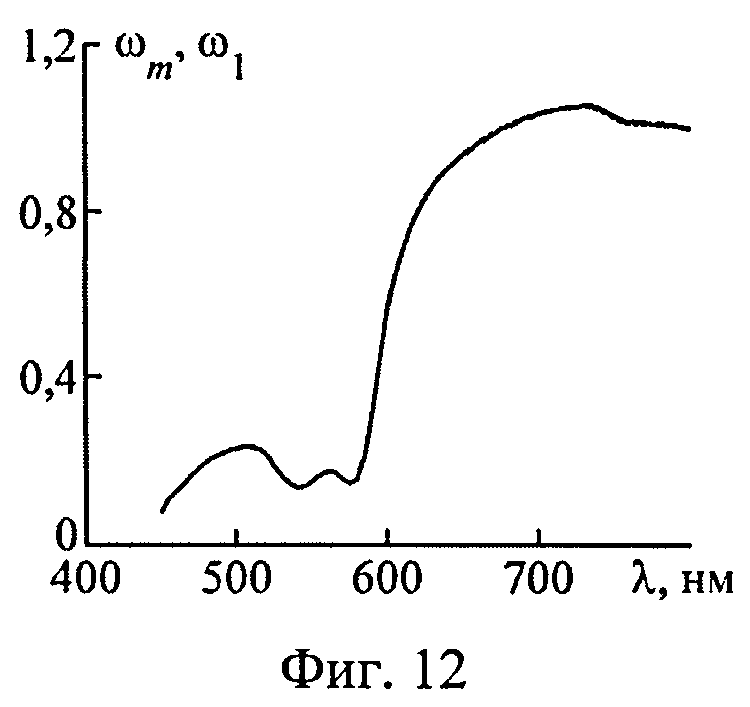
На фиг.12 представлены нормированные спектры ДО кожи, рассчитанные в рамках моделей кожи с многослойной (сплошная кривая) и однородной (пунктир) дермой.
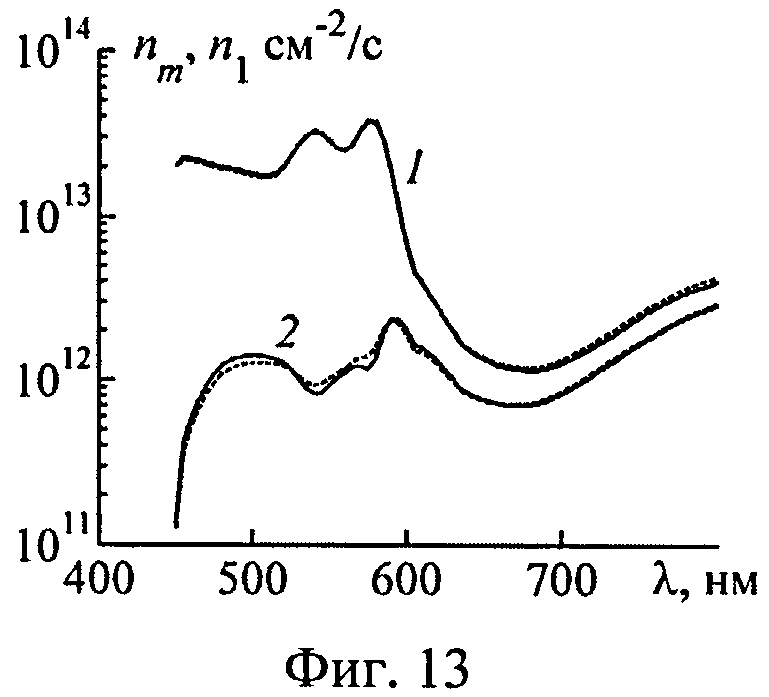
На фиг.13 представлены спектры эффективности фотодиссоциации оксигемоглобина на глубине ткани z=0.1-1.0 мм (1) и z=1.0-2.0 мм (2), рассчитанные при истинных параметрах 5-слойной среды (сплошные кривые) и восстановленных параметрах 2-слойной среды (пунктир).
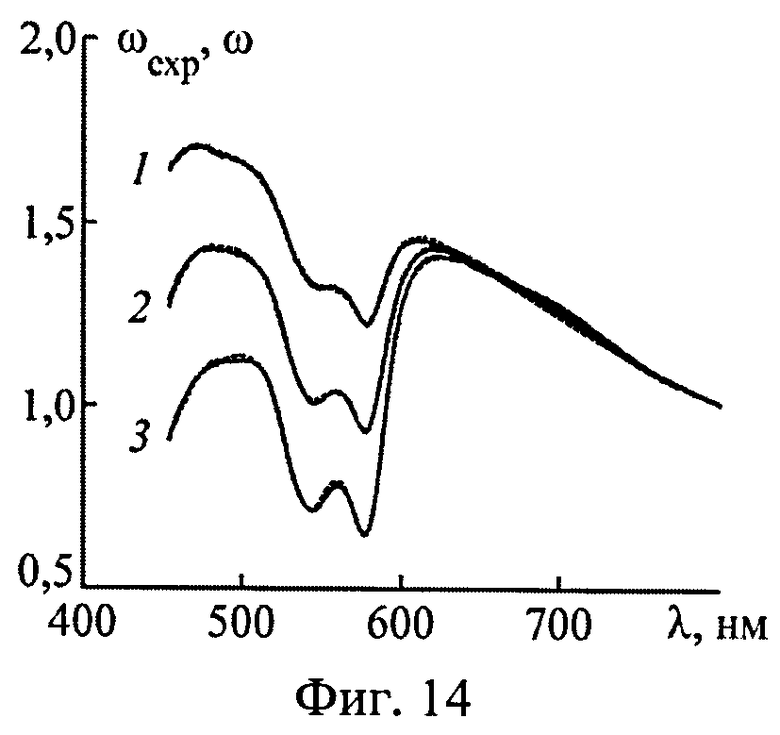
На фиг.14 представлены экспериментальные (сплошные кривые) и модельные (пунктир) спектры диффузного отражения света от кожи.
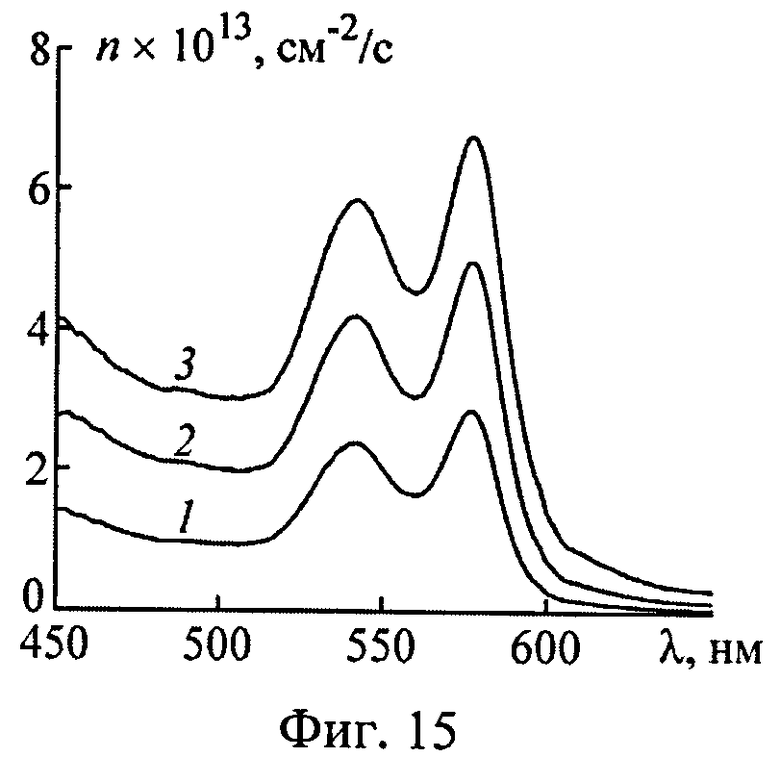
На фиг.15 представлены зависимости эффективности фотодиссоциации оксигемоглобина во всей толще дермы от длины волны возбуждающего излучения; 1-fb1=0,6% и S=54%; 2-fbl=1,6% и S=64%; 3-fbl=3,2% и S=83%.
Возможности и достоинства предлагаемого способа продемонстрируем на примере ФДТ кожной ткани. Для измерений спектра ДО кожи в данном способе можно использовать коммерчески доступные оптоволоконные спектрофотометры (производителей Avantes, Ocean Optics и др.), состоящие из источника широкополосного излучения, спектрометра и волоконно-оптического зонда. Зонд содержит пучок из семи оптических волокон с естественной плотной упаковкой (шесть осветительных волокон вокруг одного считывающего). Центральное (считывающее) волокно присоединяется к спектрометру. Шесть наружных (осветительных) волокон соединяются с источником излучения и передают свет на исследуемый объект.
Определение структурно-морфологических параметров (СМП) кожной ткани основывается на сравнении модельного и экспериментального спектров ДО ткани и подборе модельных параметров x=(xp), обеспечивающих минимум функционала:
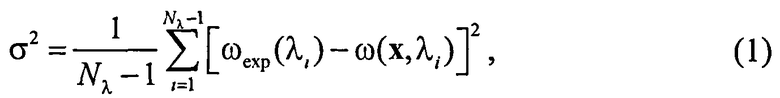
где Nλ - количество точек в измеряемых спектрах; ωexp(λi) - экспериментальный спектр ДО, определяемый путем сравнения детектируемых сигналов от ткани (P) и от белого диффузного отражателя (Pref), как
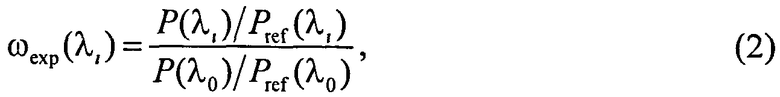
где λ0 - нормировочная длина волны; ω(x,λi) - модельный спектр ДО, определяемый как
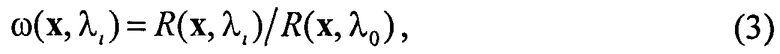
где R(x,λ) - отражательная способность (ОС) ткани, рассчитываемая в рамках оптической модели ткани (см. ниже). Под ОС среды подразумевается отношение R=P/P0, где P0 - мощность коллимированного света, падающего на среду; P - мощность диффузного излучения, выходящего с площадки на поверхности среды вне области падающего света. Нормировка (2) и (3) позволяет избавиться от влияния интенсивности излучения источника, чувствительности приемника и величины ОС опорного отражателя на точность оценок параметров СМП ткани.
Расчет спектра ОС кожной ткани будем осуществлять в рамках оптической модели, описывающей кожу в виде двухслойной среды (эпидермис и дерма) с одинаковыми параметрами светорассеяния и различными коэффициентами поглощения слоев. Роговой слой, в силу малой оптической толщины, играет крайне незначительную роль в диффузном отражении света, поэтому он условно включен в состав эпидермиса. Анатомические области дермы (сосковидная, ретикулярная, поверхностное и глубинное сплетение сосудов) не имеют ни четких физических границ, ни принципиальных морфологических различий, поэтому все они заменены одним однородным слоем. Более глубокие слои кожи (жировой слой и мышечная ткань) практически не участвуют в процессе отражения света в видимой и ближней ИК областях спектра по причине его сильного ослабления вышележащими слоями.
Полагаем, что ФС локализован в тканях дермы, где располагаются кровеносные сосуды. Тогда модельными параметрами x являются: nsk - показатель преломления кожи; Bsca - транспортный коэффициент рассеяния соединительной ткани при λ=400 нм; ρMie - доля рассеяния Ми в общем рассеянии ткани при λ=400 нм; x - параметр спектральной зависимости транспортного коэффициента рассеяния Ми; Le - толщина эпидермиса; fm - объемная концентрации меланина в эпидермисе; fbl - объемная концентрация капилляров в дерме; dv - средний диаметр капилляров; CtHb - концентрация общего гемоглобина в крови (г/л); S и CMetHb - относительные содержания оксигемоглобина (HbO2) и метгемоглобина (MetHb) в общем составе гемоглобина; Cβ - молярная концентрация бета-каротина; Cps - молярная концентрация ФС. Для параметров Le и CtHb используем фиксированные значения - Le=60 мкм, CtHb=150 г/л (средние для кожи человека). Оптические параметры кожи рассчитываются по формулам:
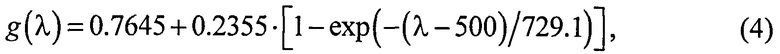
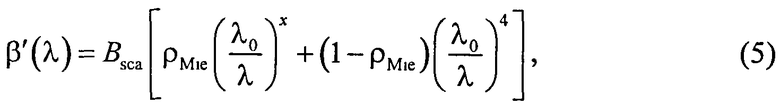
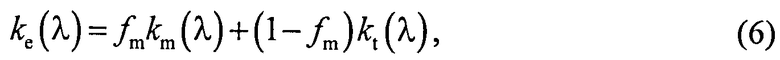
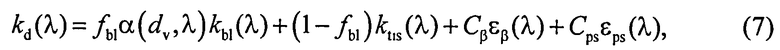
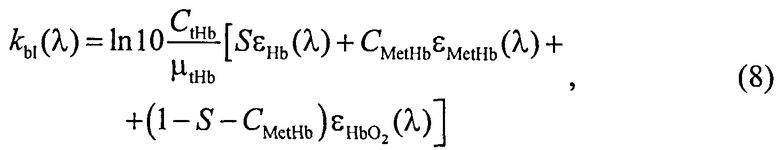
где β′ и g - транспортный коэффициент рассеяния и фактор анизотропии рассеяния эпидермиса и дермы [17]; ke и kd - коэффициенты поглощения эпидермиса и дермы; kt - коэффициент поглощения соединительной ткани [17]; kbl - коэффициент поглощения крови, учитывающий лазерно-индуцированное образование метгемоглобина в кровеносных сосудах облучаемой ткани; εHb, εHbO2, εβ и εps - молярные коэффициенты поглощения Hb, HbO2, бета-каротина и ФС в мм-1/(моль/л); µtHb=64500 г/моль - молярная масса гемоглобина; µbil=585 г/моль - молярная масса билирубина; α - поправочный коэффициент, учитывающий эффект локализованного поглощения света кровеносными сосудами [18]:
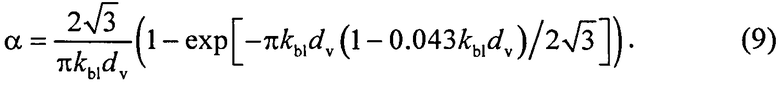
В качестве ФС рассмотрим краситель «Фотосенс» производства ГНЦ «НИОПИК», представляющий собой смесь фракций фталоцианина алюминия с различной степенью сульфирования. Оптическая плотность Фотосенса приведена в работе [19]. Максимум его молярного коэффициента поглощения εps приходится на λ=675 нм и, по данным работы [3], составляет 0,25 см-1/(мкМ). Зависимость εps(λ), полученная с учетом этих данных, представлена на фиг.1.
Исходя из результатов численных расчетов ОС кожи методом Монте-Карло, связь ОС с оптическими параметрами кожи аппроксимируется следующим выражением:
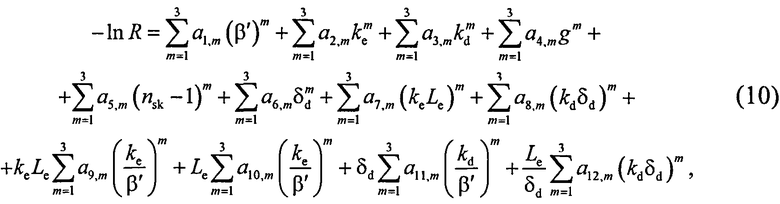
где a
i,m - коэффициенты аппроксимации; 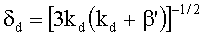
Таким образом, алгоритм восстановления модельных параметров из спектра ДО кожи, измеряемого на расстоянии от области посылки возбуждающего излучения, основан на подборе результатов расчета спектра ДО кожи по формулам (4)-(10) под экспериментальные данные методом минимизации невязки (1). Точность восстановления важных для ФДТ модельных параметров (fbl, S, CMetHb, Cps) оценивалась на основе результатов численного расчета спектров ДО кожи методом МК. Расчет выполнялся для 70 значений λ, равномерно распределенных на отрезке [450 нм, 800 нм], при следующем разбросе модельных параметров: fm=1-10%, fbl=0.4-14%, dv=5-90 мкм, S=20-98%, CMetHb=1-60%, Cβ=0.2-5.0 мкМ, Cps=0.2-2.0 мкМ, Bsca=4-11 мм-1, ρMie=0.1-0.6, x=0.5-1.0, nsk=1.4-1.5.
Значения параметров fbl, S, CMetHb и Cps, полученные путем обращения 550 случайных реализации спектра ДО кожи, смоделированных методом МК, представлены на фиг.2-5 в зависимости от соответствующих им известных значений. Коэффициенты корреляции между точными и восстановленными значениями fbl, S, CMetHb, Cps составляют соответственно 0.996, 0.991, 0.994, 0.980. Среднеквадратические погрешности восстановления данных параметров - Δfbl=0.26%, ΔS=2.4%, ΔCMetHb=1.7%, ΔCps=0.1 мкМ. Таким образом, сигналы диффузного света, регистрируемые при рассматриваемой измерительной базе (0.83 мм), обладают достаточной для практики чувствительностью к содержанию метгемоглобина в крови и к дополнительному экзогенному хромофору ткани - фотосенсибилизатору.
Для расчета пространственной освещенности в многослойной среде используем следующий метод. Полагаем, что исследуемая среда состоит из плоскопараллельных однородных слоев конечной толщины, не ограниченных в горизонтальном направлении, причем показатель преломления слоев одинаков или меняется плавно от одного слоя к другому. Рассеивающие и поглощающие свойства слоев характеризуются оптической толщиной τi, альбедо однократного рассеяния ωi и индикатрисой рассеяния pi(µ) или ее средним косинусом gi. Разделим мысленно каждый физический слой среды на множество тонких (виртуальных) слоев с однократным рассеянием. Световой поток на нижней границе i-го виртуального слоя представим суперпозицией трех составляющих: падающего коллимированного Fi, падающего диффузного 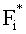
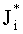
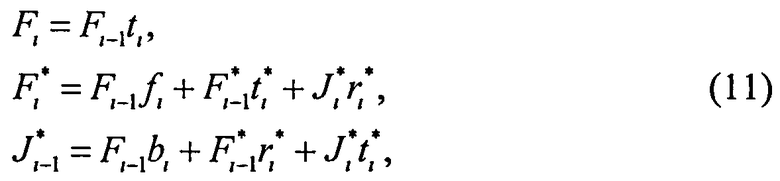
где ti - коэффициент коллимированного пропускания i-го слоя; fi и bi - коэффициенты рассеяния вперед и назад (по отношению к направлению падающего излучения) слоя при его освещении коллимированным излучением; 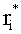
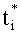

где Δτi - оптическая толщина слоя; µ0 - направляющий косинус падающего излучения, отсчитываемый от оси z, направленной внутрь среды, µ0>0. Для расчета коэффициентов fi и bi воспользуемся формулами для интенсивности излучения, однократно рассеянного слоем вперед Ii и назад Si, при его освещении с направления µ0 единичным потоком [20]:
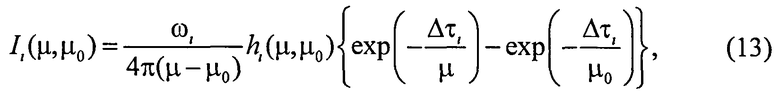
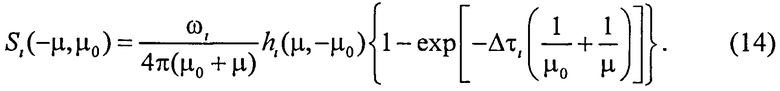
Здесь ωi - альбедо однократного рассеяния; µ - направляющий косинус рассеянного излучения (µ>0);
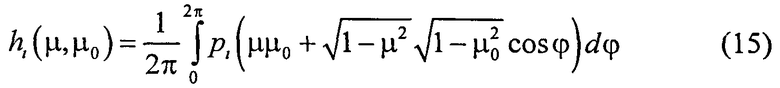
- азимутально-усредненная индикатриса рассеяния; φ - азимут, отсчитываемый от произвольного направления в горизонтальной плоскости.
Коэффициенты fi и bi представляют собой отношения полусферических рассеянных потоков (в переднюю и заднюю полусферы) к падающему на слой потоку и рассчитываются путем интегрирования функций (13), (14) по телесному углу:

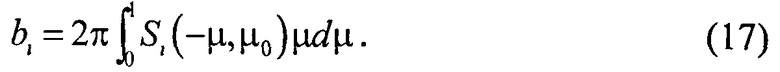
Для коэффициентов диффузного пропускания 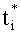
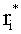
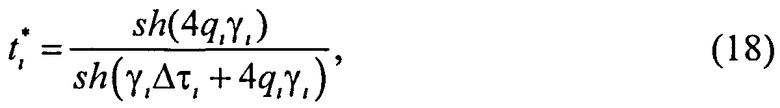

где 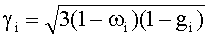
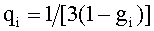
При известных коэффициентах ti, fi, bi, 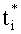
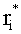
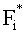
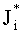
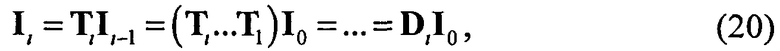
где 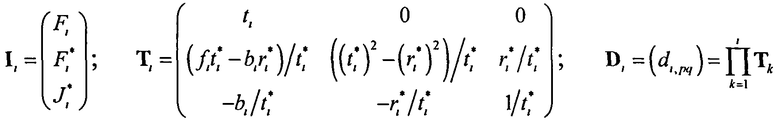 ; i=1, …, n; p, g=1, 2, 3. Пересчитывая матрицу Di от слоя к слою как Di=TiDi-1, можно связать характеристики поля излучения внутри среды и на ее поверхности:
; i=1, …, n; p, g=1, 2, 3. Пересчитывая матрицу Di от слоя к слою как Di=TiDi-1, можно связать характеристики поля излучения внутри среды и на ее поверхности:
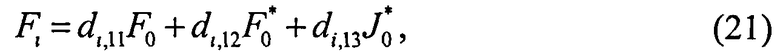
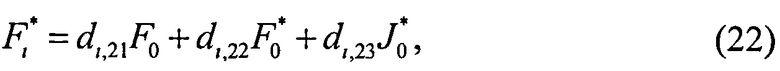
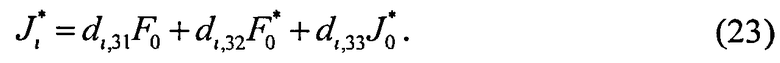
Поток излучения от внешнего источника (F0 или 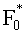
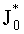
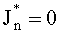
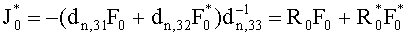
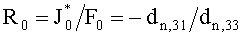
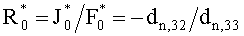
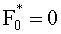
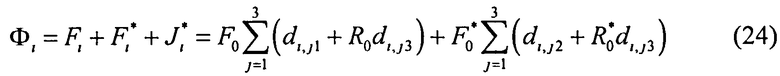
Учтем теперь отражение света от поверхности среды. Пусть rs и 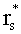
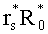
Согласно (24) внешнее коллимированное излучение создает в слое i среды освещенность Фi0=F0Ki, где 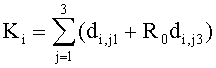
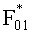
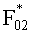
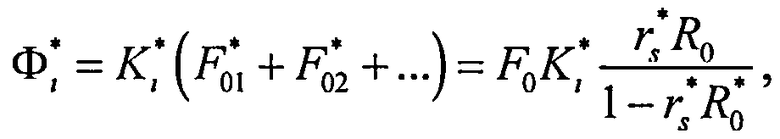
где 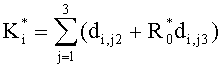
Таким образом, выражение для полной освещенности слоя имеет вид:
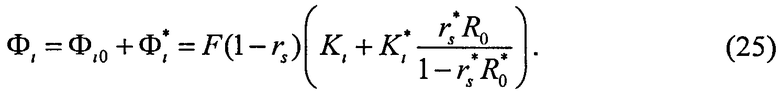
Таким образом, предлагаемый метод позволяет сравнительно просто и быстро рассчитывать пространственную освещенность в многослойной среде. Последовательность выполняемых при этом операций включает: 1) виртуальное разбиение среды на тонкие слои с оптической толщиной Δτ; 2) нахождение матриц Ti (i=1, …, n), связывающих световые потоки в соседних тонких слоях, по формулам (12)-(20) (количество вычисляемых матриц Ti равно количеству физических слоев среды); 3) последовательное перемножение матриц Ti для всех тонких слоев, начиная с самого верхнего слоя, с попутным вычислением коэффициентов 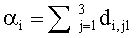
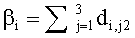
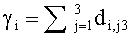
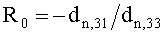
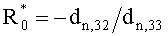
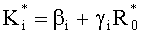
Зная концентрации хромофоров ткани и распределение освещенности по ее глубине, можно определить и световые мощности, поглощаемые хромофорами ткани в ее слоях с различной глубиной залегания. Рассмотрим пример определения эффективности поглощения света фотосенсибилизатором Kps(z,λ) и эффективности фотодиссоциации оксигемоглобина n(z,λ). Функция Kps(z,λ) представляет собой суммарную мощность излучения, поглощенную ФС в единичном объеме среды, при единичной освещенности ее поверхности:
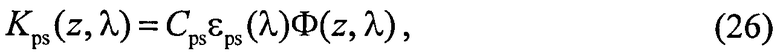
где Cps и εps - молярная концентрация и коэффициент поглощения ФС; Ф(z,λ) - распределение плотности излучения с длиной волны λ по глубине z ткани (пространственная освещенность), Вт/м2. Под функцией n(z,λ), см-3/с понимается количество молекул кислорода, образующихся в единицу времени в единице объема ткани на глубине z, при единичной освещенности поверхности ткани монохроматическим светом:
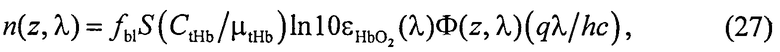
где h - постоянная Планка; c - скорость света в среде; q - квантовый выход фотодиссоциации, который при возбуждении HbO2 светом с λ=300-650 нм составляет примерно 3-5% [22].
Пусть сигнал диффузного света измеряют при диаметрах круговых осветительной и приемной площадок на поверхности среды 0.8 мм и расстоянии между их центрами 0.83 мм. Спектр ДО кожной ткани ω(λ)=R(λ)/R(800 нм), отвечающий такой геометрии измерений, представлен на фиг.6. Данный спектр рассчитан методом Монте-Карло для случайной комбинации модельных параметров (xp): fm=1,85%, fbl=3.84%, dv=32.2 мкм, S=82.5%, CMetHb=11.4%, Cβ=0.47 мкМ, Cps=1.04 мкМ, Bsca=6.46 мм-1, ρMie=0.19, x=0.94, nsk=1.45. Модельные параметры (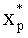
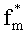
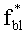
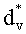
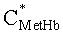
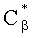
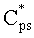
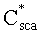
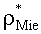
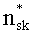
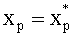
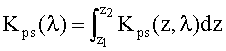
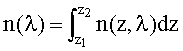
Аналогичные численные эксперименты проведены для 550 реализации модельных параметров. Спектры Kps(λ) и n(λ), восстановленные из ω(λ), сравнивались с аналогичными известными спектрами, отвечающими реальному световому режиму в среде. Коэффициенты корреляции между истинными и восстановленными спектрами Kps(λ) и n(λ) приведены на фиг.10 и 11. Видно, что предлагаемый способ позволяет с высокой степенью достоверности определять спектры Kps(λ) и n(λ) в слоях ткани с глубиной залегания до 2.0-2.5 мм при всем разбросе оптических параметров ткани. Для более глубоких слоев можно получать корректные оценки спектральных особенностей поглощения света ФС и HbO2 (например, положение максимума поглощения), однако абсолютные величины Kps(λ) и n(λ) в ряде случаев (например, при высокой пигментации кожи) могут определяться с большими погрешностями. Это обстоятельство не является ограничением предлагаемого метода, а связано с конечной глубиной проникновения света в ткань. Для получения информации о глубоких слоях ткани следует дополнить рассматриваемые измерения ω(λ) ближним ИК диапазоном. При этом придется учесть дополнительные хромофоры ткани - воду и липиды, поглощающие излучение с λ>900 нм. В остальном алгоритм обработки ω(λ) остается без изменений.
Представленные выше результаты получены в приближении модели кожной ткани с тонким верхним слоем (эпидермис) и полубесконечным однородным нижним слоем (дерма). Такая модель, несмотря на свою простоту, хорошо описывает экспериментальные спектры ДО кожи и позволяет выполнять оценки некоторых среднеобъемных параметров эпидермиса и дермы. Однако реальное строение кожи намного сложнее, чем это предполагается в используемой модели. В составе дермы выделяют несколько анатомических областей (слоев) с различным содержанием кровеносных сосудов. В связи с этим возникает вопрос - насколько корректно связь спектра ДО кожи с характеристиками светового поля в ее многослойной дерме воспроизводится в рамках используемой модели? Для ответа на поставленный вопрос рассмотрим более реалистичную модель кожи человека, предложенную в работе [23]. В исходном варианте модель представлена в виде геометрических толщин L слоев кожи и их оптических параметров (коэффициента поглощения k, коэффициента рассеяния β, фактора анизотропии рассеяния g) на λ1=337 нм и λ2=633 нм. Предполагая, что основными поглотителями света в коже являются меланин, Hb и HbO2, по заданным коэффициентам поглощения каждого слоя на λ1 (изобестическая точка спектров поглощения Hb и HbO2) несложно получить концентрации меланина fm и капилляров fbl в соответствующих слоях (см. табл.2). Степень оксигенации крови S во всех слоях дермы положим равной 70%, концентрацию общего гемоглобина в крови CtHb - 150 г/л, диаметр капилляров dv - 10 мкм. Фоновое поглощение ткани соответствует экспериментальным данным [17]. Суммарный коэффициент поглощения каждого из слоев рассчитывается по формулам (7), (8) при Cβ=0, Cps=0 и CMetHb=0. Для расчета β(λ) и g(λ) в диапазоне λ=450-800 нм используем соответственно степенную А(λ2/λ)v и линейную B+Cλ функции с коэффициентами A, v, B и C, полученными для каждого слоя ткани по соответствующим им значениям β и g на λ1 и λ2 (табл.2). Показатель преломления всех слоев кожи полагаем одинаковым - 1,45.
Спектр ДО кожи с многослойной дермой ωm(λ), рассчитанный методом МК, приведен на фиг.12. Интерпретация этого спектра выполнялась в приближении модели кожи с однородной дермой. Параметры данной модели, восстановленные из спектра ωm(λ), имеют следующие значения: fmDe=0,84 мкм, fbl=5,13%, dv=12,5 мкм, S=68%, β′(λ0))=7,59 мм-1, ρMie=0,95, x=1,97, nsk=1,37. Видно, что восстановленные значения содержания меланина в эпидермисе, степени оксигенации крови и диаметра капилляров достаточно близки к соответствующим значениям для 5-слойной модели кожи. Восстановленный параметр fbl примерно равен средней по глубине многослойной дермы концентрации капилляров - 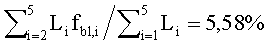
Рассмотрим результаты восстановления характеристик светового поля внутри многослойной ткани по спектру диффузно-отражаемого ею света. Физической основой такого восстановления является зависимость глубины проникновения света в ткань от λ. Зондирующее излучение с различной λ проникает в различные слои ткани и поэтому содержит информацию о данных слоях. Спектры эффективности фотодиссоциации оксигемоглобина nm(λ) на различных глубинах в ткани, рассчитанные методом МК при значениях параметров ткани из табл.2, приведены на фиг.13. Аналогичные спектры n1(λ), рассчитанные в рамках 2-слойной модели кожи, также приведены на фиг.13. Расчет n1(λ) выполнялся при значениях модельных параметров, восстановленных из ωm(λ). Различие между спектрами n1(λ) и nm(λ) не превышает погрешности восстановления n1(λ), предсказанной на основе модели кожи с однородной дермой, и не является принципиальным для практики.
Таким образом, можно заключить, что для определения пространственной освещенности в многослойной дерме и спектров действия света на ее хромофоры можно с успехом использовать модель кожной ткани с однородной дермой. Причиной этому является оптическая эквивалентность данных сред, т.е. спектрально-пространственные характеристики светового поля внутри и вне многослойной среды можно в точности воспроизвести в рамках модели однородной среды.
Разработанный способ определения эффективности фотодиссоциации HbO2 в тканях in vivo опробован на коже нескольких добровольцев. В экспериментах использовался оптоволоконный спектрофотометр Avantes с диаметрами светоподводящего и светопринимающего волокон 0.4 мм. Структурно-морфологические параметры кожи, найденные по спектру ее ДО в приближении двухслойной среды, использовались для расчета оптических параметров среды и глубинного распределения в ней освещенности Ф(z,λ). Спектр эффективности фотодиссоциации HbO2 рассчитывался по формуле (27) в соответствии с восстановленными значениями модельных параметров (fbl, S) и пространственной освещенности Ф(z,λ).
В качестве примера на фиг.14 представлены экспериментальные ωexp(λ) и подобранные в рамках модели ω(λ) спектры ДО безымянного пальца трех добровольцев. Спектры эффективности фотодиссоциации HbO2 во всей толще дермы, восстановленные из ωexp(λ), представлены на фиг.15. Видно, что количество молекулярного кислорода O2, высвобождаемое из кровеносных сосудов дермы в окружающую ткань, зависит от СМП ткани и при одной и той же дозе облучения может различаться в несколько раз. В целом эффективность генерации O2 на длине волны максимального поглощения света HbO2 (λmax=577 нм) для одного и того же анатомического участка кожи разных добровольцев различается в 2-3 раза. Для различных анатомических участков вариации n(λmax) еще более существенны - значения n(λmax) для кожи пальца, ладони и переносицы добровольцев различаются в 10 и более раз. Очевидно, что это обстоятельство необходимо учитывать при проведении сеансов лазерной терапии для того, чтобы повысить эффективность генерации O2 и избежать нежелательных последствий лазерного воздействия, связанных с излишним нагревом ткани пациента и ее необратимыми изменениями (коагуляция ткани, разрушение капилляров и т.д.).
Таким образом, предлагаемый способ позволяет контролировать концентрации эндогенных и экзогенных хромофоров ткани (капилляров, оксигемоглобина, метгемоглобина, фотосенсибилизатора) и эффективности поглощения ими света в слоях ткани с различной глубиной залегания. Это, в свою очередь, позволяют учитывать индивидуальные особенности ткани пациента и выбирать оптимальные для него лазерные источники и индивидуальную дозу облучения при ФДТ, обеспечивающие наибольшее поглощение света фотосенсибилизатором и наилучшую генерацию кислорода на глубине залегания патологического участка ткани или во всей ее толще при минимальном воздействии лазерного излучения на здоровую ткань. Таким образом, можно повысить эффективность и снизить продолжительность сеансов лазерной терапии, избежать побочных неблагоприятных эффектов и стандартизовать методы лечения больных с одинаковой патологией.
Литература
1. Асимов P.M., Асимов М.М., Рубинов А.Н. Лазерно-индуцированная оксигенация биотканей: новая технология устранения тканевой гипоксии в раковых опухолях // Лазерная медицина. 2008. Т. 12, №1. С.9-14.
2. Simultaneous measurement of photosensitizer absorption and fluorescence in patient undergoing photodynamic therapy / A.A. Stratonnikov [et. al.] // Proc. SPIE. 2002. V.4613. P.162-173.
3. Использование спектроскопии обратного диффузного отражения света для мониторинга состояния тканей при фотодинамической терапии / Стратонников A.A. [и др.] // Квантовая электроника. 2006. Т.36, №12. С.1103-1110.
4. Патент № US 2011/0270056 A1, A61B 6/00, A61M 37/00, 03.11.2011.
5. Optical measurement of photosensitizer concentration in vivo / M.R. Austwick [et. al.] // J. Innovat. Opt. Health. Sci. 2011. V.4, №.2. P.97-111.
6. The control of photosensitizer in tissue during photodynamic therapy by means of absorption spectroscopy / A.A. Stratonnikov [et. al.] // Proc. SPIE. 1996. V.2924. P.49-60.
7. Loschenov V.В., Konov V.I., Prokhorov A.M. Photodynamic therapy and fluorescence diagnostics // Laser Physics. 2000. V.10, №6. P.1188-1207.
8. Broadband reflectance measurements of light penetration, blood oxygenation, hemoglobin concentration, and drug concentration in human intraperitoneal tissues before and after photodynamic therapy / H.W. Wang [et. al.] // J. Biomed. Opt. 2005. V.10, №1. P.014004-1-13.
9. Noninvasive measurement of fluorophore concentration in turbid media with a simple fluorescence/reflectance ratio technique / R. Weersink [et. al.] // Appl. Opt. 2001. V.40, №34. P.6389-6395.
10. Асимов M.M., Королевич А.Н., Константинова Е.Э. Кинетика оксигенации кожной ткани под воздействием низкоинтенсивного лазерного излучения // Журн. прикл. спектр. 2007. Т.74, №1. С.120-125.
11. Патент RU 2438733 С1, A61N 5/06, 10.01.2012.
12. Патент RU 2484861 C2, A61N 5/06, 20.06.2013.
13. Methemoglobin formation during laser induced photothermolysis of vascular skin lesions / L.L. Randeberg [et. al.] // Lasers Surg. Med. 2004. V.34, №5. P.414-419.
14. Флуоресценция фотосенсибилизатора на основе индотрикарбоцианинового красителя при фотохимиотерапии / M.П. Самцов [и др.] // Журн. прикл. спектр. 2011. Т.78, №1. С.121-127.
15. Laser treatment of port wine stains: therapeutic outcome in relation to morphological parameters / E.I. Fiskerstrand [et. al.] // British J. Dermatol. 1996. V.134, №6. P.1039-1043.
16. Б.М. Джагаров, Э.А. Жаврид, Ю.П. Истомин, В.Н. Чалов. Двухцветная лазерная фотодинамическая терапия // Журнал прикладной спектроскопии. 2001. Т.68. С.151-153.
17. Jacques S.L. Origins of tissue optical properties in the UVA, visible, and NIR // Advances in Optical Imaging and Photon Migration. 1996. V.2. P.364-369.
18. Барун В.В., Иванов А.П. Оценка вклада локализованного поглощения света кровеносными сосудами в оптические свойства биологической ткани // Оптика и спектр. 2004. V.96, №6. Р.1019-1024.
19. Model S.S., Savelieva T.A., Linkov K.G. System for determining the concentration and visualization of the spatial distribution of photosensitizers based on tetrapyrrole compounds in the tissues of the human ocular fundus // Proc. SPIE. 2013. V.8699. P.86990 E-1-6.
20. Liou K.N. An introduction to atmospheric radiation. Second edition. New York, London: Academic Press, 2002. P.290-292.
21. Отражение и пропускание света слоем большой оптической толщины / Э.П. Зеге [и др.] // Журн. прикл. спектроск. 1979. Т.30, №5. С.900-907.
22. Лепешкевич С.В., Коновалова Н.В., Джагаров Б.М. Исследование методом лазерной кинетической спектроскопии бимолекулярных стадий реакции оксигенации α- и β-субъединиц гемоглобина человека в R-состоянии // Биохимия. 2003. Т.68, №5. С.676-685.
23. Тучин В.В. Исследование биотканей методами светорассеяния // Усп. физ. наук. 1997. Т.167, №5. С.517-539.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ ФИЗИКО-БИОЛОГИЧЕСКИХ ПАРАМЕТРОВ КОЖИ И КОНЦЕНТРАЦИЙ ПРОИЗВОДНЫХ ГЕМОГЛОБИНА В КРОВИ | 2013 |
|
RU2545814C1 |
| СПОСОБ ЛОКАЛЬНОГО ПОВЫШЕНИЯ КОНЦЕНТРАЦИИ МОЛЕКУЛЯРНОГО КИСЛОРОДА В ДЕРМЕ КОЖНОЙ ТКАНИ | 2011 |
|
RU2484861C2 |
| СПОСОБ ПОВЫШЕНИЯ КОНЦЕНТРАЦИИ МОЛЕКУЛЯРНОГО КИСЛОРОДА В ДЕРМЕ КОЖНОЙ ТКАНИ | 2011 |
|
RU2484860C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИЙ ПРОИЗВОДНЫХ ГЕМОГЛОБИНА В БИОЛОГИЧЕСКИХ ТКАНЯХ | 2013 |
|
RU2517155C1 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2010 |
|
RU2438733C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ ГЕМОГЛОБИНА В БИОЛОГИЧЕСКИХ ТКАНЯХ | 2012 |
|
RU2501522C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ БИЛИРУБИНА | 2012 |
|
RU2511747C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ ПРОИЗВОДНЫХ ГЕМОГЛОБИНА В КРОВИ | 2013 |
|
RU2536217C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ОПТИМАЛЬНЫХ ЭНЕРГЕТИЧЕСКИХ ПАРАМЕТРОВ ЛАЗЕРНО-ИНДУЦИРОВАННОЙ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ДИСПЛАЗИИ И РАКА ШЕЙКИ МАТКИ | 2023 |
|
RU2815258C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ОПТИЧЕСКИХ И БИОФИЗИЧЕСКИХ ПАРАМЕТРОВ БИОТКАНИ | 2012 |
|
RU2510506C2 |
Изобретение относится к медицине и может быть использовано для выбора индивидуальных дозиметрических параметров при лазерной терапии тканей организма человека. Облучают ткань широкополосным излучением из видимого и ближнего ИК диапазонов спектра. Измеряют спектр диффузного отражения ткани. По спектру диффузного отражения ткани определяют ее структурно-морфологические параметры, в числе которых концентрация кровеносных сосудов fbl и фотосенсибилизатора Cps в ткани, а также относительные содержания оксигемоглобина S и метгемоглобина CMetHb в крови. Устанавливают спектр пространственной освещенности в ткани Ф(z, λ) с использованием модели переноса оптического излучения в ткани и найденных значений ее структурно-морфологических параметров. Длины волн и мощности лазерных источников, а также время лазерного воздействия на ткань, обеспечивающие наибольшее поглощение света фотосенсибилизатором и наилучшую генерацию кислорода на глубине залегания патологического участка ткани или во всей ее толще при минимальном воздействии лазерного излучения на здоровую ткань, определяют на основе распределений эффективностей поглощения света фотосенсибилизатором Kps(z, λ) и эффективности фотодиссоциации оксигемоглобина n(z, λ) по длине волны света λ и глубине ткани z, рассчитываемых на основе выражений:
Kps(z, λ)=Cpsεps(λ)Ф(z, λ),

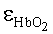
Способ фотодинамической терапии онкологических заболеваний, включающий введение фотосенсибилизатора в зону опухолевой ткани и воздействие на нее лазерным излучением одновременно на двух длинах волн, обеспечивающих воздействие на фотосенсибилизатор и оксигемоглобин, отличающийся тем, что дополнительно облучают ткань широкополосным излучением из видимого и ближнего ИК диапазонов спектра; измеряют спектр диффузного отражения ткани; по спектру диффузного отражения ткани определяют ее структурно-морфологические параметры, в числе которых концентрации кровеносных сосудов fbl и фотосенсибилизатора Cps в ткани, а также относительные содержания оксигемоглобина S и метгемоглобина CMetHb в крови; устанавливают спектр пространственной освещенности в ткани Ф(z, λ) с использованием модели переноса оптического излучения в ткани и найденных значений ее структурно-морфологических параметров; а длины волн и мощности лазерных источников, а также время лазерного воздействия на ткань, обеспечивающие наибольшее поглощение света фотосенсибилизатором и наилучшую генерацию кислорода на глубине залегания патологического участка ткани или во всей ее толще при минимальном воздействии лазерного излучения на здоровую ткань, определяют на основе распределений эффективностей поглощения света фотосенсибилизатором Kps(z, λ) и эффективности фотодиссоциации оксигемоглобина n(z, λ) по длине волны света λ и глубине ткани z, рассчитываемых на основе выражений:
Kps(z, λ)=Cpsεps(λ)Ф(z, λ),
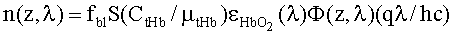 ,
,
где εps и 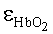 - молярные коэффициенты поглощения фотосенсибилизатора и оксигемоглобина, CtHb=150 г/л - средняя концентрация гемоглобина в крови, µtHb=64500 г/моль - молярная масса гемоглобина, h - постоянная Планка; c - скорость света в среде; q - квантовый выход фотодиссоциации оксигемоглобина.
- молярные коэффициенты поглощения фотосенсибилизатора и оксигемоглобина, CtHb=150 г/л - средняя концентрация гемоглобина в крови, µtHb=64500 г/моль - молярная масса гемоглобина, h - постоянная Планка; c - скорость света в среде; q - квантовый выход фотодиссоциации оксигемоглобина.
| ДЖАГАРОВ Б.М | |||
| и др | |||
| Двухцветная лазерная фотодинамическая терапия // Журнал прикладной спектроскопии | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| Способ получения смеси хлоргидратов опийных алкалоидов (пантопона) из опийных вытяжек с любым содержанием морфия | 1921 |
|
SU68A1 |
| Двухколейная подвесная дорога | 1919 |
|
SU151A1 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2010 |
|
RU2438733C1 |
| СПОСОБ ЛОКАЛЬНОГО ПОВЫШЕНИЯ КОНЦЕНТРАЦИИ МОЛЕКУЛЯРНОГО КИСЛОРОДА В ДЕРМЕ КОЖНОЙ ТКАНИ | 2011 |
|
RU2484861C2 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2006 |
|
RU2312689C2 |
| Вращательная цементо-обжигательная печь | 1928 |
|
SU9855A1 |
| EA 15215 B1 30.06.2011 | |||
| US 20110270056 A1 03.11.2011 | |||
| Wang H.W | |||
| et | |||
| al | |||
| Broadband reflectance measurements of light | |||
Авторы
Даты
2015-01-20—Публикация
2013-11-05—Подача