Изобретение относится к медицине, а именно к хирургии, и может быть применено в реконструктивной хирургии при эндоскопических вмешательствах, в том числе при лапароскопической герниопластике, пластике передней брюшной стенки при лечении вентральных грыж с анатомическим дефицитом, ущемленных и невправимых грыжах.
Лапароскопические вмешательства в последние годы находят все более широкое применение и их по праву считают новой главой в хирургии. Современная эндоскопическая техника позволила внести радикальные изменения и в методику хирургической коррекции наружных грыж живота. Отличаясь малой травматичностью и достаточно высокой эффективностью, они во многих случаях стали альтернативой традиционным способам грыжесечения. Применение принципа «ненатяжной» герниопластики и использование синтетических материалов в настоящее время сделало переворот в герниологии, позволив снизить количество рецидивов, но внутрибрюшное расположение синтетического импланта не является идеальным, поскольку предполагает его контакт с петлями кишечника, несет в себе опасность формирования кишечных спаек и свищей [Луцевич О.Э., Гордеев С.А., Прохоров Ю.А. Интраперитонеальная лапароскопическая герниопластика. // Материалы научной конференции «Лапароскопическая хирургия органов брюшной полости». Москва, 20-21 мая 1996. С.48-49]. С целью перитонезации синтетического протеза от органов брюшной полости необходимо сопоставить края брюшины лигатурным швом, который в большинстве случаев прорезывает брюшину. Соприкосновение сетчатого импланта с брюшной полостью вызывает спаечный процесс, приводит к длительной экссудации в ране, формированию сером, а в последствии к формированию наружных кишечных свищей. В этой связи разработан оригинальный способ применения в качестве дополнительного материала для герниопластики аллотрансплантата твердой мозговой оболочки [Зяблов В.И., Тоскин К.Д. «Применение твердой мозговой оболочки для пластики послеоперационных грыж». Хирургия, 1975; 7: 109-110; Жебровский В.В., Мохаммед Том Эльбашир. «Хирургия грыж живота и эвентраций». Симферополь: Бизнес-информ, 2002, 440 с.].
Твердая мозговая оболочка - плотное соединительнотканное образование, имеющее многослойное строение. Различная ориентация коллагеновых и эластических волокон, их извитость определяют высокую устойчивость к механическим нагрузкам и растяжимость этой ткани как в продольном, так и в поперечном направлении. Эти свойства твердой мозговой оболочки человека определили изготовление такого биотрансплантата (аллотрансплантата) и его применение в хирургии.
Прототип. Наиболее близким техническим решением, принятым за прототип, является способ получения биотрансплантата из твердой мозговой оболочки головного мозга, включающий забор материала, его консервацию и стерилизацию [Патент Украина №62905 А от 15 декабря 2003 года]. Полученный материал промывают в проточной воде на протяжении 2-х часов и трехкратно в физиологическом растворе на протяжении 3-х часов при температуре 37°С. Затем материал расправляют на твердой пластине и замораживают при температуре минус 60-70°С на протяжении суток, после чего проводят вакуумную лиофилизацию при температуре +40°C..+42°С и вакууме 10-3 мм рт.ст. на протяжении 17-19 часов. Далее материал расфасовывают в медицинскую упаковку, после чего проводят его гамма-стерилизацию в дозе 1.5 Мрад.
Недостатком указанного способа является то, что толщина полученного биотрансплантата варьирует от 0,5 до 0,8 мм, что не позволяет использовать его в лапароскопической практике. Также во время заморозки с 0,9% раствором NaCl разрушается часть клеточных структур и снижается эластичность и механическая прочность трансплантата. Это делает трансплантат ТМО более доступным для клеточных ферментов, что приводит к ускорению резорбции его в организме реципиента.
Известен способ консервирования трупной твердой мозговой оболочки человека [Авторское свидетельство SU 1407469 А1 от 07.07.1988 г.], при котором с целью снижения антигенных свойств трансплантата предлагается обработка биоматериала в 0,6 Н растворе соляной кислоты в течение 12-24 часов. После чего трансплантат отмывают в стерильном физиологическом растворе с добавлением антибиотиков. Недостатком данного способа является нарушение нативных структур белков в связи с обработкой раствором соляной кислоты.
Задача изобретения - улучшить способ изготовления биотрансплантатов твердой мозговой оболочки человека для ее использования при эндоскопических вмешательствах в реконструктивной хирургии.
Достигаемым техническим результатом является способ изготовления биосовместимого и утонченного биотрансплантата твердой мозговой оболочки (ТМО) человека, что определяет возможность его использования при эндоскопических вмешательствах. Высокая степень биосовместимости достигается за счет удаления клеточных элементов в ходе обработки ткани.
Способ изготовления биотрансплантатов ТМО для эндоскопических вмешательств в реконструктивной хирургии осуществляется следующим образом.
Получение твердой мозговой оболочки от трупов проводят на основании федерального закона Российской Федерации от 21.11.2011 №323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации", федерального закона Российской Федерации от 22.12.1992 №4180-1 «О трансплантации органов и(или) тканей человека».
1. Оценка пригодности спецдонора для заготовки твердой мозговой оболочки (ТМО)
Проводится в соответствии с действующими на территории РФ нормативно-правовыми актами. Труп считается непригодным для заготовки ТМО в случае выявления у него онкологического, инфекционного (в последние 6 месяцев), аутоиммунного заболеваний, цирроза печени, малярии (при наличии приступов в последние 3 года), язвенной болезни желудка и 12-перстной кишки (обострения в последние 6 месяцев), острых или обострений хронических воспалительных заболеваний любой локализации (в течение последнего месяца), кожных заболеваний, психических болезней, наркомании, смерти от травмы, сопровождающейся проникающими повреждениями, массивной кровопотери, отравления (за исключением отравления этиловым спиртом), асфиксии водой или рвотными массами. Забор твердой мозговой оболочки у трупов производят не позднее 24 часов после внезапной смерти. Предварительно проводится взятие цельной крови с полным ее обследованием для исключения трансмиссивных инфекций и проведения пробы на токсичность.
2. Заготовка ТМО
Заготовка ТМО осуществляется в стерильной операционной или при необходимости допускается заготовка в нестерильных условиях судебного морга с последующей стерилизацией.
В момент вскрытия трупа скальпелем выполняют дугообразный разрез кожи затылочной области. Отсепаровывается кожный лоскут. Производится циркулярный распил по наибольшему диаметру свода черепа (краниотомия) при помощи циркулярной пилы. Удаляется свод черепа. Вскрывается и выделяется твердая мозговая оболочка. Затем ТМО на 30-40 минут при комнатной температуре погружают в емкость, содержащую специальный консервирующий раствор - криоконсервант: 0,9% раствор NaCl 3,6 ml, NaHCO3 0.08 ml, КНСО3 0,08 ml, 25% sol. Glycerini 100.0 ml и Aqua Distillata до 400 ml. Затем емкость переносят в морозильник и хранят при температуре -80°С до получения данных обследования спецдонора. Использование криоконсерванта или криоограждающего раствора является необходимым условием для сохранения структурных и пластических свойств ТМО во время заморозки.
3. Изготовление трансплантата ТМО
После получения результатов анализов (ВИЧ, RW, HBsAg, HCV, Hb, общий билирубин, пробы на токсичность, бак. посев) и заключения судебно-медицинской экспертизы (отсутствие онкологического, инфекционного, аутоиммунного заболеваний, цирроза печени, язвенной болезни желудка и 12-перстной кишки, острых или обострений хронических воспалительных заболеваний любой локализации) биоматериал становится пригодным для изготовления трансплантата. ТМО размораживают путем погружения в стерильный теплый (+45°С) 0,9% раствор NaCl. Затем ножницами выкраивают биотрансплантаты в виде сферы, ½ сферы или ¼ сферы и производят их визуальную оценку.
Полученные лоскуты раскладывают на стерильные полипропиленовые сетки, интактные к тканям, помещают в пластиковые полипропиленовые пакеты и помещают в холодильную установку для замораживания при - 86°С перед сублимационной сушкой. Режим лиофилизации: при - 40°…46°С 2 часа и при +34°…36°С еще 2 часа. Данный метод позволяет получать сухие ткани без потери их структурной целостности и основных биологических свойств. При соблюдении технологии практически не наблюдается денатурация белков внутри трансплантата. Критерием оценки лиофилизации является конечный результат - остаточная влажность трансплантата, которая должна составлять 1-10% от исходного уровня влажности. Такие биотрансплантаты ТМО имеют толщину от 0,6 до 0,8 мм. Затем полученный трансплантат расщепляют с помощью ленточно-двоильной машины KS 520 SE\CE. Двоение проводят следующим образом, с помощью ручного управления устанавливается толщина 0,2-0,4 мм, подача лиофилизированного трансплантата ТМО осуществляется также вручную. Двоение происходит между лезвиями двойного ножа, отходы собираются в резервуар и отправляются на утилизацию.
Лиофилизированные трансплантаты ТМО для эндоскопических вмешательств запаивают в двойные пластиковые полипропиленовые пакеты, снабжают временной документацией, в которой указывают номер трансплантата, дату заготовки и срок хранения, и стерилизуют вместе с сателлитными образцами для бактериологического контроля. Стерилизацию производят гамма-лучами в дозе 25 тыс. Грей.
После стерилизации осуществляют бактериологический контроль готовой продукции.
4. Параметры готовой продукции
Лиофилизированные трансплантаты ТМО для эндоскопических вмешательств имеют несколько типовых размеров.
- Сфера (170×145(±5)×0,3 мм).
- Полусфера (130(±5)×80(±5)×0,3 мм).
- Четверть сферы (90×60(±5)×0,3 мм).
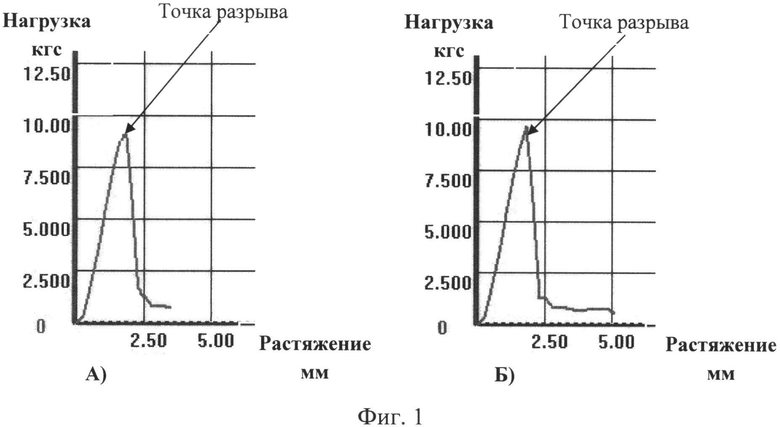
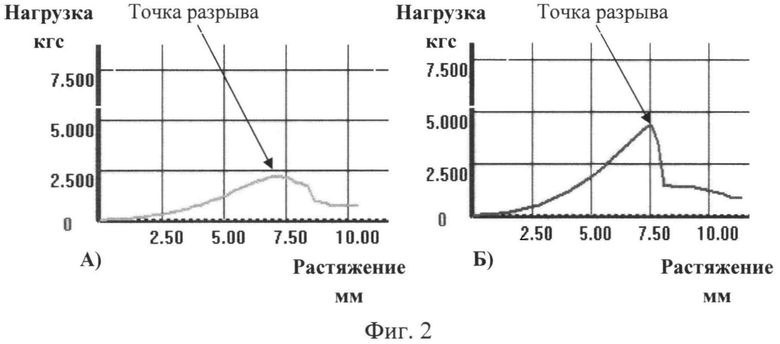
С целью определения прочностных характеристик производимой продукции ТМО подвергают разрывным нагрузкам. Проведен сравнительный анализ прочностных свойств (нагрузка на разрыв и растяжение) биотрансплантата. ТМО стандартной толщиной 0,8 мм и модифицированной толщиной 0,3 мм (фиг.1. Среднее значение нагрузки на разрыв лиофилизированных образцов трансплантатов ТМО: А) толщиной 0,3 мм; Б) толщиной 0,8 мм). Как следует из приведенных графиков, средняя величина прикладываемой нагрузки для разрыва образца лиофилизированной ТМО толщиной как 0,8 мм, так и 0,3 мм составила 9,5 кгс при растяжении не более 2 мм. Испытания ТМО на разрыв проведены также на регидратированных образцах трансплантатов (фиг.2. Среднее значение нагрузки на разрыв регидратированных образцов трансплантатов ТМО: А) толщиной 0,3 мм; Б) толщиной 0,8 мм). Для этого лиофилизированную ТМО погружали в 0,9% раствор NaCl на 30 минут, после чего проводили испытания на разрывной машине МТ-140, изготовитель: ЗАО «Метротекс».
Средняя величина прикладываемой нагрузки для разрыва образца регидратированной ТМО толщиной 0,3 мм составила 2,48 кгс при растяжении не более 7,5 мм, в то время как стандартная ТМО толщиной 0,8 мм - 4,5 кгс при том же растяжении.
Таким образом, притесняемая модификация не оказывает существенного влияния на прочность и эластичность трансплантатов ТМО для эндоскопического применения.
Контроль токсичности образцов ТМО проводился следующим образом. В лунки 6-луночного планшета помещали фрагменты ТМО и к ним добавляли суспензию фибробластов человека в среде ДМЕМ с 10% эмбриональной сыворотки крупного рогатого скота. В контрольные лунки помещали только суспензию клеток. Через трое суток визуально при малом увеличении микроскопа проводили оценку культуры. Формирование монослоя в лунках опыта и контроля происходило на 3-4 сутки. Клетки сохраняли свою морфологию. Признаков токсичности (округления клеток, вакуолизации цитоплазмы) не наблюдали. После проведения трех последовательных пассажей с коэффициентом рассева 1:2 время формирования монослоя оставалось на прежнем уровне. Все исследованные образцы были нетоксичными для клеток.
Для количественной оценки клетки выращивали в культуральных флаконах с площадью ростовой поверхности 25 см2. Во флаконы опыта помещали равные количества исследуемых образцов и добавляли одинаковое количество фибробластов. В контрольные флаконы помещали только суспензию клеток. Через 3-4 суток проводили подсчет клеток во всех флаконах и определяли индекс пролиферации (отношение количества выросших клеток к количеству посаженных). Было проведено 3 последовательных пассажа с коэффициентом рассева 1:2. Данные представлены в таблице 1.
Таким образом, образцы ТМО не оказывают токсического действия на фибробласты человека. Клетки сохраняют свою морфологию, цитоплазма остается прозрачной, границы клеток четкими. На протяжении трех последовательных пассажей не происходило снижения индекса пролиферации культуры и увеличения времени формирования монослоя.
При экспериментальном исследовании на 10 крысах при внутрибрюшной фиксации ТМО на 21 сутки после операции получили отсутствие спаечного процесса в брюшной полости при соприкосновении трансплантата с органами живота.
При толщине трансплантата ТМО 0,2-0,4 мм сохраняется его механическая прочность, биосовместимость, в то же время он становится пластичным и легко проводится через канал троакара размеров 10,0 мм, что позволяет его активно использовать при лапароскопическом доступе.
Клинические примеры
Пример 1.
Больная К., 58 лет. Поступила в НИИ СП им. Н.В.Склифосовского с жалобами на наличие грыжевого выпячивания. В 2001 году оперирована по поводу миомы матки (выполнена нижнесрединная лапаротомия). В начале 2007 года в проекции послеоперационного рубца, в нижней трети, отметила появление грыжевого выпячивания, которое с течением времени стало увеличиваться в размерах. Состояние при поступлении относительно удовлетворительное.
Локальный статус: в околопупочной области, в проекции послеоперационного рубца (в нижней трети), в положении стоя и лежа при натуживании определяется грыжевое выпячивание ~6,0×5,0 см, мягкоэластичной консистенции, свободно вправимое в брюшную полость, безболезненное при пальпации. Симптом кашлевого толчка положительный.
Больной произведена операция: видеолапароскопическая герниопластика с использованием синтетического импланта и модифицированной лиофилизированной твердой мозговой оболочки, дренирование брюшной полости.
Послеоперационный период гладкий. При контрольном УЗИ: петли тонкой кишки не расширены, стенки не утолщены, содержимое средней эхогенности. Перистальтика прослеживается во всех отделах. Свободной жидкости в брюшной полости, мягких тканях в области операции не выявлено. Дренажи из малого таза и грыжевого мешка удалены на 3 сутки. Швы сняты на 4 сутки. Раны зажили первичным натяжением. При осмотре через 1 год - рецидива грыжи нет.
Пример 2.
Больной Ч., 60 лет. Поступил в НИИ СП им. Н.В.Склифосовского с жалобами на вздутие живота, периодические схваткообразные боли в животе, задержку стула. Данные жалобы периодически возникают около месяца. Год назад больной был оперирован по поводу перфорации ободочной кишки, разлитого перитонита.
Состояние при поступлении средней степени тяжести. Живот равномерно умеренно вздут, при пальпации мягкий, незначительно болезненный в нижних отделах. Перитонеальных симптомов нет. Перистальтика выслушивается, ослаблена. Стула по стоме не было 5 дней.
Локальный статус: на передней брюшной стенке по срединной линии имеется послеоперационный рубец длиной 20 см (после перенесенной лапаротомии). В области послеоперационного рубца в положении стоя определяется грыжевое выпячивание округлой формы 17×17×5 см мягкоэластичной консистенции, безболезненное при пальпации. Симптом кашлевого толчка положительный. В положении лежа грыжевое выпячивание самостоятельно вправляется в брюшную полость, грыжевые ворота 12 см в диаметре.
При КТ брюшной полости: с уровня L3 позвонка до уровня S1 позвонка определяется расхождение прямых мышц живота. Объем брюшной полости - 3658 см3. Объем грыжевого мешка - 42 см3.
Соотношение объема грыжевого мешка к сумме объемов брюшной полости и грыжевого мешка 11%. Площадь грыжевых ворот на одном срезе - 2 см.
Больному произведена операция: срединная лапаротомия. Ликвидация сигмостомы. Восстановление непрерывности ободочной кишки. Дренирование брюшной полости. Реконструкция брюшной стенки сеткой «Ультрапро» и модифицированной лиофилизированной твердой мозговой оболочкой. Дренирование надсеточного пространства по Редону.
Послеоперационный период гладкий. При контрольном УЗИ: петли тонкой кишки не расширены, стенки не утолщены, содержимое средней эхогенности. Перистальтика прослеживается во всех отделах. Свободной жидкости в брюшной полости, мягких тканях не выявлено.
Дренажи удалены на 6-е сутки. Швы сняты на 12-е сутки. Рана зажила первичным натяжением. При осмотре через 1 год - рецидива грыжи нет.
Предлагаемый биотрансплантат был использован при герниопластике у 10 пациентов. Послеоперационный период протекал без осложнений, при инструментальных методах диагностики - воспалительных изменений мягких тканей передней брюшной стенки и жидкостных скоплений в области имплантов не выявлено; контрольный осмотр через 1 год - рецидива грыжи нет.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КОМБИНИРОВАННОЙ ЛАПАРОСКОПИЧЕСКОЙ ГЕРНИОПЛАСТИКИ | 2010 |
|
RU2435528C1 |
| СПОСОБ ГЕРНИОПЛАСТИКИ УЩЕМЛЕННЫХ ПАХОВЫХ ГРЫЖ | 2011 |
|
RU2480168C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ПУПОЧНЫХ ГРЫЖ С ДИАСТАЗОМ ПРЯМЫХ МЫШЦ ЖИВОТА | 2013 |
|
RU2536265C1 |
| СПОСОБ "НЕНАТЯЖНОЙ" КОМБИНИРОВАННОЙ РЕКОНСТРУКТИВНОЙ ГЕРНИОПЛАСТИКИ ПРИ ВЕНТРАЛЬНЫХ ГРЫЖАХ С АНАТОМИЧЕСКИМ ДЕФИЦИТОМ ТКАНЕЙ ПЕРЕДНЕЙ БРЮШНОЙ СТЕНКИ | 2010 |
|
RU2434585C1 |
| Способ фиксации сетчатого трансплантата при лапароскопической герниопластике паховой грыжи | 2019 |
|
RU2704780C1 |
| СПОСОБ ФИКСАЦИИ СЕТЧАТОГО ТРАНСПЛАНТАТА ПРИ ЛАПАРОСКОПИЧЕСКОЙ ГЕРНИОПЛАСТИКЕ ПАХОВОЙ ГРЫЖИ | 2023 |
|
RU2814607C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ КОСОЙ ПАХОВО-МОШОНОЧНОЙ ГРЫЖИ У ДЕТЕЙ | 2011 |
|
RU2464940C1 |
| СПОСОБ ГЕРНИОПЛАСТИКИ ПАХОВЫХ ГРЫЖ | 2006 |
|
RU2313289C1 |
| СПОСОБ ЛАПАРОСКОПИЧЕСКОЙ ГЕРНИОПЛАСТИКИ ПРИ ДВУСТОРОННИХ ПАХОВЫХ ГРЫЖАХ | 2014 |
|
RU2564757C1 |
| СПОСОБ ОДНОМОМЕНТНОЙ РЕКОНСТРУКЦИИ МОЛОЧНОЙ ЖЕЛЕЗЫ ПРИ РАКЕ С ИСПОЛЬЗОВАНИЕМ АЛЛОИМПЛАНТАТА НА ОСНОВЕ ТВЕРДОЙ МОЗГОВОЙ ОБОЛОЧКИ И СИЛИКОНОВОГО ЭНДОПРОТЕЗА | 2019 |
|
RU2705265C2 |
Изобретение относится к медицине, а именно к хирургии, и может быть применено в реконструктивной хирургии при эндоскопических вмешательствах. Осуществляют заготовку ткани ТМО от трупа. ТМО после заготовки погружают в консервирующий раствор. Биотрансплантаты ТМО размораживают и выкраивают лоскуты биотрансплантата требуемых размеров. Полученные лоскуты помещают в пластиковые пакеты и проводят лиофилизацию. Полученный трансплантат расщепляют, получая биотрансплантат ТМО с толщиной 0,2-0,4 мм. Техническим результатом является способ изготовления биосовместимого и утонченного биотрансплантата твердой мозговой оболочки (ТМО) человека, что определяет возможность его использования при эндоскопических вмешательствах. 3 з.п. ф-лы, 1 табл., 1 пр., 2 ил.
1. Способ изготовления биотрансплантатов твердой мозговой оболочки (ТМО), включающий заготовку ткани ТМО от трупа, изготовление биотрансплантата ТМО различной величины, лиофилизацию и стерилизацию гамма-лучами, отличающийся тем, что ТМО после заготовки на 30-40 минут при комнатной температуре погружают в консервирующий раствор и хранят при температуре -80°С до получения данных обследования донора, затем биотрансплантаты ТМО размораживают путем погружения в стерильный +45°С 0,9% раствор NaCl, затем выкраивают лоскуты биотрансплантата требуемых размеров, полученные лоскуты раскладывают на стерильные полипропиленовые сетки, интактные к тканям, помещают в пластиковые пакеты и проводят лиофилизацию до достижения остаточной влажности биотрансплантата 3-6%, после чего полученный трансплантат расщепляют, получая биотрансплантат ТМО с толщиной 0,2-0,4 мм.
2. Способ по п.1, отличающийся тем, что в качестве консервирующего раствора используют криоконсервант: 0,9% раствор NaCl 3,6 ml, MaHCO3 0.08 ml, КНСО3 0,08 ml, 25% sol. Glycerini 100.0 ml и Aqua Distillata до 400 ml.
3. Способ по п.1, отличающийся тем, что выкраивают биотрансплантаты следующих размеров: сфера 170×145(±5)×0,3 мм, или полусфера 130(±5)×80(±5)×0,3 мм, или четверть сферы 90×60(±5)×0,3 мм.
4. Способ по п.1, отличающийся тем, что трансплантат расщепляют с помощью ленточно-двоильной машины методом двоения.
| Вольтодобавочный трансформатор с бесконтактным регулированием | 1941 |
|
SU62905A1 |
| Свисток | 1928 |
|
SU12520A1 |
| СПОСОБ ПОДГОТОВКИ АУТОТРАНСПЛАНТАТА ДЛЯ ГЕРНИОПЛАСТИКИ | 2011 |
|
RU2465837C1 |
Авторы
Даты
2014-02-20—Публикация
2012-12-27—Подача