Изобретение относится к медицине, в частности, к фармакологии, и касается противосудорожного средства, представляющего собой глицин, иммобилизованный на частицах детонационного наноалмаза.
Эпилепсия является вторым по частоте встречаемости неврологическим заболеванием после инсульта [1]. Она представляет гетерогенный симптомокомплекс, хроническое заболевание, характеризующее периодическим возникновением судорог. Их причинами может быть большое число заболеваний, имеющих неврологические проявления [1]. Около 50 млн человек (до 1% населения мира) страдает эпилепсией. Ее лекарственная терапия должна обеспечивать эффективный контроль судорог, но и поддержание хорошего качества жизни, что во многом определяется не только эффективностью, но и безопасностью лечения. Известно, что примерно у 25% больных судороги не поддаются контролю основными противосудорожными препаратами. При этом монотерапия эпилепсии и других пароксизмальных состояний неэффективна в 20-30% случаев. Как правило, применяются комбинации противосудорожных средств [1-3]. Это, в свою очередь, повышает риск разнообразных, в том числе серьезных побочных эффектов, что снижает качество жизни больных. Поэтому поиск и разработка новых низкотоксичных средств для профилактики и лечения эпилепсии и других пароксизмальных состояний является крайне актуальной задачей.
Известно, что заменимая аминокислота глицин (NH2CH2COOH), являясь центральным нейромедиатором тормозного типа действия, проявляет седативное действие и улучшает метаболические процессы в тканях мозга [2]. В современной терапевтической практике глицин применяют как средство, ослабляющее влечение к алкоголю, уменьшающее явления абстиненции, депрессивные нарушения, повышенную раздражительность, нормализующее сон, а также в комплексном лечении нарушений мозгового кровообращения [2]. В основе фармакологического действия глицина лежит эффект амплификации метаболических и нейротрансмиттерных процессов, возникающих за счет усиления его эндогенного синтеза. Увеличить внутриклеточный синтез глицина можно, только используя пути передачи сигнала, обусловленные взаимодействием с рецепторными системами. Его взаимодействие с глициновыми рецепторами приводит к открытию хлорных каналов, гиперполяризации мембраны и распространению торможения. Наряду с этим, глицин способен выступать в роли аллостерического коагониста глутаматных рецепторов. Связываясь в специфическом сайте, он усиливает способность глутамата и N-метил-D-аспарата (NMDA) открывать катионный канал [4, 5].
Применяемый фармакопейный глицин назначают в виде таблеток (по 0,1 г) под язык 3-4 раза в день.
Известен глицин, иммобилизованный на частицах детонационного наноалмаза с размером 2-10 нм, применяемый в качестве связующего компонента в полимерных композитах [6, 7]. Способ его получения заключается в следующем [7]. Навеску наноалмаза помещают в реактор в постоянном токе гелия и отжигают при температуре 150-470°С в течение 3-4 ч. Далее проводят фторирование образцов наноалмаза при температуре 50-500°С в течение 1-24 ч контактированием со смесью газообразных фтора и водорода. Для получения глицина, иммобилизованного на частицах наноалмаза, фторированный наноалмаз обрабатывают ультразвуком в o-дихлорбензоле в течение 20-30 мин, добавляют гидрохлорид этилового эфира глицина (NH2CH2COOH2CH3·HCl) и несколько капель пиридина. Полученную смесь перемешивают при температуре 130-140°С в течение 8-12 ч. Образовавшийся продукт фильтруют, промывают этанолом и сушат под вакуумом при 70°С.
Дополнительной характеристикой этого вещества является размер его частиц в суспензии, равный, по данным динамического рассеяния света (ДРС), 310 нм [7].
Особенностью данного вещества является наличие на поверхности частиц наноалмаза помимо молекул глицина также атомов фтора. Хотя их количество авторами декларируется менее 1% ат., в действительности экспериментально установлено, что концентрация фтора на поверхности наноалмаза может достигать 14% ат. и более. Это обусловлено тем, что связь C-F (Eсв. = 115 ккал/г-атом) является прочной и фторпроизводные углерода инертны по отношению ко многим веществам. Поэтому при химической иммобилизации глицина на поверхность наноалмаза, содержащего атомы фтора, молекулы глицина замещаются на атомы фтора лишь частично. При этом известно, что присутствие в органическом веществе фтора и его производных повышает его токсичность и может изменять показатели микросомальной системы биотрансформации ксенобиотиков в печени [8]. Так, наличие атомов фтора в ближайшем наноструктурном аналоге наноалмаза - фуллерене (C60) - повышает его общую токсичность в 2,4-5 раз [9]. Кроме того, фтор и его соединения способны накапливаться в различных объектах окружающей среды и присутствовать в них в различных количествах [10]. Поэтому глицин, иммобилизованный на частицах наноалмаза, которые содержат атомы фтора, нежелательно использовать в медицинской практике в качестве лекарственного средства.
Получение глицина, иммобилизованного на частицах детонационного наноалмаза, не содержащих атомов фтора, с повышенной дисперсностью в суспензии, применяемого в качестве лекарственного средства, а также снижение уровня экологической и эндоэкологической опасности, упрощение и удешевление способа его получения, представляют собой актуальную и практически значимую задачу.
Целью изобретения является повышение эффективности противосудорожного действия глицина без проявления каких-либо побочных и токсических воздействий и расширение номенклатуры противосудорожных лекарственных средств.
Использование глицина, иммобилизованного на частицах детонационного наноалмаза, как противосудорожного средства в научной и патентной литературе не описано.
Поставленная цель решается с помощью описываемого в соответствии с изобретением противосудорожного средства, представляющего собой глицин, иммобилизованный на частицах детонационного наноалмаза размером 2-10 нм, не содержащих атомов фтора и имеющих оболочку толщиной до 1 нм, с содержанием глицина до 21±3% масс., и способа его получения.
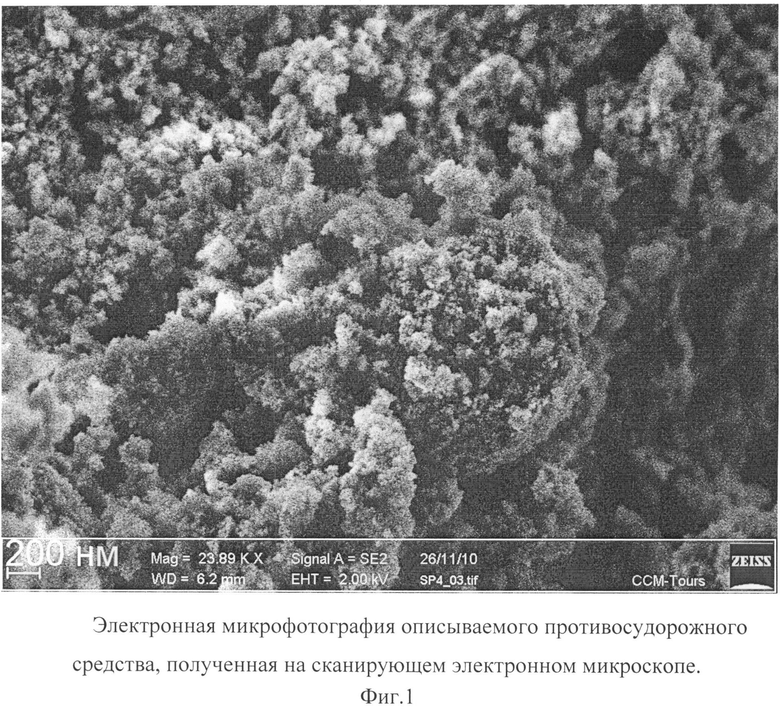
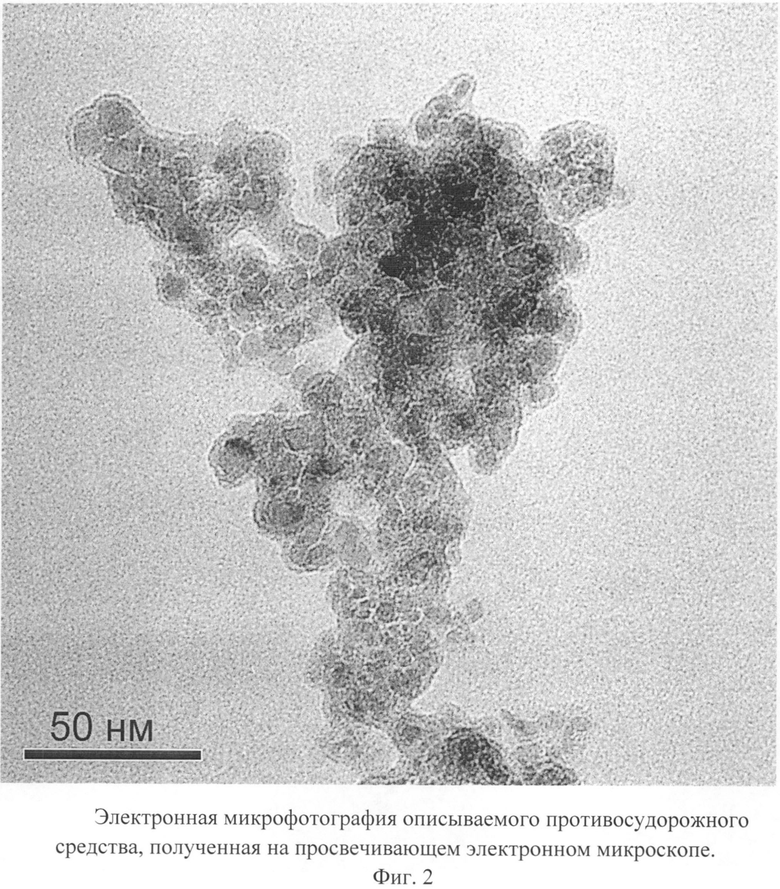
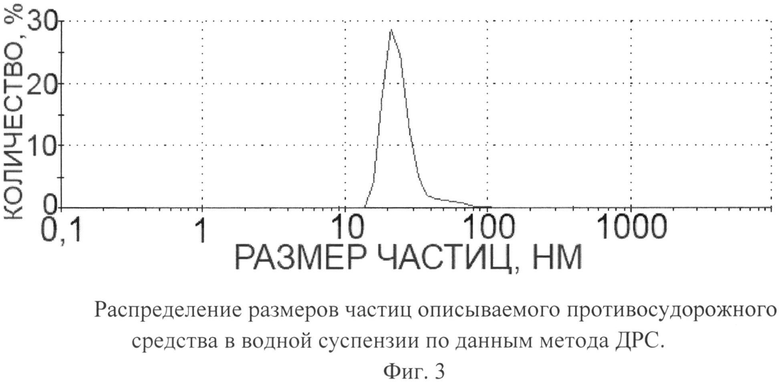
Описываемое противосудорожное средство в виде глицина, иммобилизованного на частицах детонационного наноалмаза, не содержащих на своей поверхности атомов фтора, представляет собой ультрадисперсный порошок (Фиг.1) темно-серого цвета или темно-серого цвета с зеленоватым или темно-синим оттенками с размером частиц от 2 до 10 нм, имеющих оболочку толщиной до 1 нм (Фиг.2), размером агрегатов в водной суспензии до 100 нм (Фиг.3) и содержанием глицина до 21±3% масс., входящего в состав поверхностной оболочки.
На Фиг.1 отчетливо видно наличие у описываемого противосудорожного средства ультрадисперсной структуры из частиц с размером, меньшим разрешающей способности использованного прибора (от 20 нм).
Микрофотография частиц описываемого противосудорожного средства получена на автоэмиссионном сканирующем электронном микроскопе сверхвысокого разрешения Zeiss Ultra Plus (Carl Zeiss, Германия).
На Фиг.2 видно, что размер частиц описываемого противосудорожного средства, покрытых оболочкой толщиной до 1 нм, равен 2-10 нм.
Микрофотография частиц описываемого противосудорожного средства получена на просвечивающем электронном микроскопе Jeol 1011 (JEOL, Япония).
На Фиг.3. приведена кривая распределения размеров частиц в суспензии описываемого противосудорожного средства, из которой следует, что размеры частиц в суспензии не превышают 100 нм.
Измерение распределения размера частиц описываемого противосудорожного средства в суспензии проводили методом ДРС на приборе ZetaSizer (Malvem Instruments, США). По оси абсцисс отложена логарифмическая шкала размера частиц в нм. По оси ординат - процентное содержание частиц с определенными размерами.
Элементный состав поверхности частиц описываемого противосудорожного средства по данным рентгенофотоэлектронной спектроскопии (РФЭС) приведен в табл.1.
Исследование поверхности описываемого противосудорожного средства проводили на приборе LAS-3000 (Riber, Франция), оснащенном полусферическим анализатором ОРХ-150. Для возбуждения фотоэлектронов использовали немонохроматизированное рентгеновское излучение алюминиевого анода (AlKα=1486,6 эВ) при напряжении на трубке 12 кВ и токе эмиссии 20 мА. Калибровку фотоэлектронных пиков проводили по линии углерода С 1s с энергией связи 285 эВ. Вакуум в рабочей камере составлял 6,7·10-8 Па. Для получения высокого вакуума был использован ионный насос.
Количество глицина в описываемом противосудорожном средстве определяют следующим образом. Готовят смеси наноалмаза с разным содержанием глицина. Берут навески каждой смеси равной массы. Регистрируют их ПК-спектры, выбирают на них наиболее интенсивные характеристические сигналы, которые соотносят с полосами ИК-спектра исходного глицина. Затем строят калибровочные кривые зависимости интенсивности сигнала в ИК-спектре от содержания глицина в навеске. Далее, по интенсивности выбранных характеристических полос исследуемого противосудорожного средства по калибровочным кривым определяют количественное содержание в нем глицина. По полученным данным определяют среднее значение величины содержания глицина в описываемом противосудорожном средстве.
Описываемый способ получения противосудорожного средства заключается в следующем. Детонационный наноалмаз отжигают в токе газообразного водорода при температуре 500-1200°С в течение 1-8 ч, затем подвергают жидкофазному хлорированию молекулярным хлором при фотохимическом воздействии видимым светом при температуре 50-70°С в течение 36-60 ч с последующей промывкой четыреххлористым углеродом, центрифугированием и сушкой под вакуумом. Модифицированный хлором наноалмаз растворяют в полярном растворителе с образованием суспензии. Добавляют третичный амин и глицин и обрабатывают полученную смесь ультразвуком в течение 5-60 мин с последующим выдерживанием при 50-80°С в течение 12-48 ч, центрифугированием, промывкой растворителем и сушкой. Обработку ультразвуком ведут в течение 5-60 мин, в качестве третичного амина используют триэтиламин и в качестве полярного растворителя применяют пиридин, низший алифатический спирт, водно-спиртовую смесь или воду.
Описываемое противосудорожное средство не содержит атомов фтора (табл.1), а также атомов других галогенов, в количестве, превышающем ошибку прибора (0,1% ат.), так как в процессе получения противосудорожного средства все атомы хлора заменяются на молекулы глицина и уходят с поверхности наноалмаза в виде молекул HCl.
В процессе фармакологических исследований была проведена работа по изучению специфического противосудорожного действия описываемого лекарственного средства и его безвредности в сравнении с фармакопейным глицином.
Оценку противосудорожного эффекта проводили согласно Методическим указаниям по изучению фармакологической активности веществ, изложенных в [11]. Для этого использовались две методики с различным механизмом возникновения судорог: электрошоком и химическим воздействием. Методика антагонизма с судорогами, вызванными проведением максимального электрошока (воздействие электротоком), моделирует судороги по типу Grand Mal. Методика антагонизма с коразолом (химическое воздействие) моделирует судороги по типу Petit Mal. Эти методы являются базисными моделями при поиске и изучении веществ с противосудорожной активностью.
Исследование противосудорожной активности описываемого средства проводили на беспородных белых мышах самцах массой 24-28 г.
Для получения судорог использовали сертифицированное устройство - «Rodent Shocker RS», type221 (Harvard Apparatus, GmbH, Германия). После проведения максимального электрошока у животного развивалась тоническая экстензия передних и задних конечностей, заканчивающаяся гибелью. Оценивалась способность предупреждать развитие тонической экстензии и уменьшать гибель животных.
Установлено, что проведение максимального электрошока у контрольных животных вызывал тоническую экстензию, заканчивающуюся гибелью 80% мышей и только 20% животных выжило после электрошока (табл.3). Описываемое противосудорожное средство в дозе 10 мг/кг достоверно защищало от гибели 60% мышей, а в дозе 15 мг/кг - 70% мышей после проведения максимального электрошока (табл.3). Фармакопейный глицин в дозах 10 и 15 мг/кг не влиял на судороги и не устранял гибель мышей при максимальном электрошоке - у всех животных наблюдалась тоническая экстензия и последующая гибель (табл.3).
Таким образом, описываемое противосудорожное средство в дозе 10-15 мг/кг обладает отчетливым противосудорожным действием в тесте актиального электрошока, статистически достоверно предупреждая развитие тонической экстензии и гибель животных.
Для исследования противосудорожной активности описываемого средства в тесте антагонизма, при химическом воздействии, использовали коразол, которой вводили подкожно в область шейного отдела спины. За 40 мин до введения коразола вводили описываемое средство и дистиллированную воду в качестве контроля.
Установлено, что описываемое средство в дозе 15 мг/кг вызывало статистически достоверное увеличение (в 1,54 раза) латентного периода появления первых генерализованных клонических судорог и увеличение (в 2,64 раза) продолжительности жизни животных по сравнению с контролем (табл.4). Наряду с этим, описываемое средство достоверно уменьшало в 2 раза число погибших животных (табл.4). Фармакопейный глицин в дозе 15 мг/кг не оказывал противосудорожного действия в тесте антагонизма с коразолом (табл.4).
Полученные данные свидетельствуют о наличии у описываемого противосудорожного средства в дозе 15 мг/кг выраженной противосудорожной активности в тесте антагонизма с коразолом и об отсутствии противосудорожного эффекта у фармакопейного глицина в дозе 15 мг/кг.
Исследование острой токсичности описываемого противосудорожного средства было проведено согласно Методическим указаниям по изучению острой токсичности, изложенных в [12].
При проведении эксперимента регистрировались следующие показатели: характер шерстяного покрова, изменение состояния слизистых оболочек, птоз верхнего века, повышенная уринация, повышенная дефекация, повышенная саливация, пилоэрекция, вокализация, боковое положение, ритм и глубина дыхательных движений, агрессивность, пугливость, тремор, судороги, изменение порогов болевой реакции, изменение позы, каталепсия, нарушение координации движений в тесте вращающегося стержня, удерживание в течение 5 секунд на перевернутой сетчатой платформе, перелезание с перевернутой сетчатой платформы наверх, наличие пинеального, роговичного рефлексов, седации, стереотипии и груминга, гибель животного.
Статистическая обработка результатов была осуществлена с помощью статистических пакетов “BioStat” для Windows. Рассчитывали средние показатели по группе и стандартные ошибки показателей.
Полученные результаты убедительно показывают, что описываемое противосудорожное средство при внутрибрюшинном введении мышам в дозах 75, 150 и 225 мг/кг, также как и фармакопейный глицин не вызывали признаков интоксикации и гибели животных на протяжении 14 сут. наблюдения.
В результате проведенного фармакологического исследования установлено наличие у описываемого противосудорожного средства выраженного специфического противосудорожного эффекта, превосходящего противосудорожное действие фармакопейного глицина, и отсутствие побочных эффектов и токсического действия в дозе, превышающей терапевтическую более чем в 20 раз.
Описываемое противосудорожное средство не только позволяет повысить терапевтическую эффективность фармакопейного препарата глицина, но и расширить ассортимент эффективных и безопасных противосудорожных средств.
Краткое описание графических материалов.
фиг.1. Электронная микрофотография описываемого противосудорожного средства, полученная на сканирующем электронном микроскопе.
Фиг.2. Электронная микрофотография описываемого противосудорожного средства, полученная на просвечивающем электронном микроскопе.
Фиг.3. Распределение размеров частиц описываемого противосудорожного средства в водной суспензии по данным метода ДРС.
Фиг.4. ИК-спектры смесей наноалмаза с глицином, используемых для построения калибровочных кривых. I, II, III - спектры смесей с содержанием глицина 1:1,75:2,5, соответственно. В рамках выделены характеристические пики.
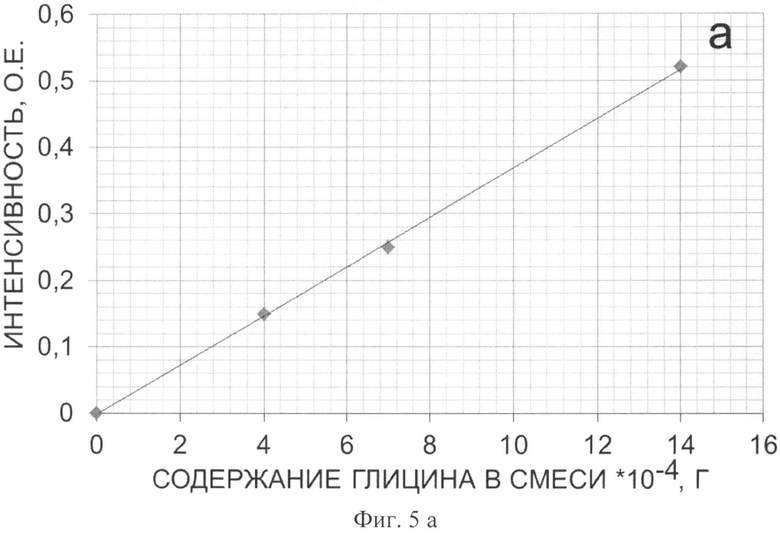
Фиг.5. Калибровочные кривые для каждой характеристической полосы ИК-спектра смеси наноалмаза с глицином, а, б, в - калибровочные кривые для полос 1407, 1332 и 504 см-1, соответственно.
Изобретение иллюстрируется следующими примерами.
Пример 1
300 мг исходного детонационного наноалмаза отжигают в токе газообразного водорода со скоростью 3,0 л/ч при температуре 1000°C в течение 6 ч. Затем отожженный наноалмаз подвергают жидкофазному хлорированию молекулярным хлором, растворенным в 40 мл CCl4 до 6% масс. Cl2. Реакцию хлорирования проводят при фотохимическом воздействии видимым светом в течение 60 ч при температуре 60°C. Затем образец промывают CCl4 с центрифугированием суспензии при 6000 об/мин и высушивают под давлением 0,1 мм. рт.ст. до постоянного веса. Затем из хлорированного наноалмаза получают суспензию, используя 40 мл водно-спиртовой смеси (вода:метанол = 1:1), в которую вносят 300 мг глицина в виде свободной аминокислоты (NH2CH2COOH) с добавлением 1 мл триэтиламина. Полученную смесь обрабатывают ультразвуком (50 Вт) в течение 60 мин и выдерживают при постоянном перемешивании при температуре 65°C в течение 30 ч. Полученный продукт промывают большим количеством этанола, центрифугируют и высушивают под вакуумом при 70°C в течение всей ночи. Остаточная влажность продукта составляет 2,2%. Выход целевого продукта составляет 279 мг (93%). Продукт представляет собой темно-серый с синеватым оттенком ультрадисперсный порошок (Фиг.1) с размерами первичных частиц 2-10 нм (Фиг.2), имеющих оболочку поверхностного слоя до 1 нм. В суспензии размер частиц порошка не превышает 100 нм (Фиг.3). Элементный состав поверхности частиц полученного продукта приведен в табл.2.
Для определения массовой доли глицина в полученном продукте готовят 3 смеси наноалмаза с глицином с содержанием последнего 1:1,75:3,5, соответственно. Для каждой смеси берут навеску массой 0,0035 г и тщательно перетирают в ступке с 0,090 г KBr. 0,070 г полученной смеси прессуют в таблетку и снимают ее ИК-спектр (Фиг.4). Характеристические полосы выбирают при 1407, 1332 и 504 см-1, соответственно, и строят для них калибровочные графики (Фиг.5). Интенсивность соответствующих характеристических полос на ИК-спектре полученного образца массой 0,0035 г составила 0,23, 0,22 и 0,10 о.е., соответственно. Из калибровочных кривых а, 6, в на Фиг.5 определяют величину содержания глицина в полученном образце, которая составляет 0,00057±8-10-5 г. Следовательно, массовая доля глицина в навеске образца составляет 21±3% масс.
Пример 2
Исследование специфической противосудорожной активности описываемого средства.
Исследование выполнено на белых беспородных половозрелых мышах-самцах массой 25-28 г. Животных разделили на 8 групп по 10 голов в каждой, всего - 80 мышей.
Животных получали из Центрального питомника лабораторных животных «Столбовая», Московская область. Содержание животных соответствовало правилам лабораторной практики при проведении доклинических исследований в РФ (ГОСТ 3 51000.3-96 и 51000.4-96), нормативному документу «Санитарные правила по устройству, оборудованию и содержанию вивариев», утвержденных Главным Государственным санитарным врачом 06.04.1973 г. №1045-73, и Приказу МЗ РФ №267 от 19.06.2003 г. «Об утверждении правил лабораторной практики» (GLP) с соблюдением Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997 г.). Животные содержались в виварии при температурном режиме 20-22°C, при световом цикле - 12 часов светлый и 12 часов темный периоды, в пластмассовых клетках T/4A размером 580×375×200 мм с верхней крышкой из нержавеющей стали и подстилкой обеспыленной из деревянной стружки. Животные содержались при постоянном доступе к корму и воде с использованием полного рациона экструдированного брикетированного корма (ГОСТ на корм P 50258-92) и питьевой воды. При проведении экспериментов учитывались требования Комиссии по проблеме этики отношения к животным Российского национального Комитета по биоэтике при Российской академии наук и этические нормы, изложенные в «Международных рекомендациях по проведению медико-биологических исследований с использованием животных» (1985 г.). Опыты проводили в первую половину дня.
Животному через специальные корниальные (глазные) электроды проводили максимальный электрошок путем нанесения электростимуляции (500/150 V/mA, 143-144 мА, 0,6 с). После проведения максимального электрошока у животного развивалась тоническая экстензия передних и задних конечностей, заканчивающаяся гибелью. Оценивалась способность описываемого противосудорожного средства предупреждать развитие тонической экстензии и уменьшать гибель животных после проведения максимального электрошока. В качестве препарата сравнения использовали фармакопейный глицин. Исследуемые вещества вводили животным однократно, внутрибрюшинно в объеме 0,1 мл на 10 г веса мыши за 40 мин до проведения максимального электрошока. Животным контрольной группы вводили дистиллированную воду. Статистическая обработка результатов осуществлялась с помощью статистических пакетов "BioStat" для Windows.
Установлено, что проведение максимального электрошока у контрольных животных вызывал тоническую экстензию, заканчивающуюся гибелью 80% мышей и только 20% животных выжило после электрошока (табл.3). Описываемое противосудорожное средство в дозе 10 мг/кг достоверно защищало от гибели 60% мышей, а в дозе 15 мг/кг - 70% мышей после проведения максимального электрошока (табл.3). Фармакопейный глицин в дозах 10 и 15 мг/кг не влиял на судороги и не устранял гибель мышей при максимальном электрошоке - у всех животных наблюдалась тоническая экстензия и последующая гибель (табл.3).
Таким образом, Противосудорожное средство в дозах 10 и 15 мг/кг обладает отчетливым противосудорожным действием в тесте актиального электрошока, статистически достоверно предупреждая развитие тонической экстензии и гибель животных.
Для исследования противосудорожной активности описываемого средства в тесте антагонизма, при химическом воздействии, использовали коразол, которой вводили подкожно в область шейного отдела спины. В связи с высокой гигроскопичностью коразола и нестабильностью действующей дозы на первом этапе исследования определялась кривая зависимости доза-эффект для коразола. Животные наблюдались в течение 60 мин после инъекции коразола с регистрацией генерализованных судорог с утратой рефлекса переворачивания и гибели животных. На основе этих данных методом пробит-анализа рассчитывалась доза, вызывающая судороги у 97% животных, которая составила 105 мг/кг (ЭД97). Оценка противосудорожных эффектов веществ по тесту антагонизма с коразолом проводилась по показателям: латентного периода появления первых генерализрванных клонических судорог, продолжительности жизни животных после введения коразола и проценту гибели животных.
Описываемое противосудорожное средство и фармакопейный глицин вводили однократно внутрибрюшинно в объеме 0,1 мл на 10 г веса мыши за 40 мин до введения коразола. Животным контрольной группы вводили дистиллированную воду. Статистическая обработка результатов была осуществлена с помощью статистических пакетов "BioStat" для Windows. Рассчитывали средние показатели по группе и стандартные ошибки показателей.
Установлено, что у контрольных животных коразол вызывал сначала генерализованные клонические судороги, затем тонические судороги и гибель животных. Судорожные проявления и гибель 100% контрольных животных наблюдались после введения коразола в дозе 105 мг/кг (табл.4). Эта доза и была использована для изучения противосудорожного эффекта описываемого средства.
Описываемое средство в дозе 15 мг/кг вызывало статистически достоверное увеличение (в 1,54 раза) латентного периода появления первых генерализованных клонических судорог и увеличение (в 2,64 раза) продолжительности жизни животных по сравнению с контролем (табл.4). Наряду с этим, описываемое средство достоверно уменьшало (в 2 раза) число погибших животных (табл.4). Фармакопейный глицин в дозе 15 мг/кг не оказывал противосудорожного действия в тесте антагонизма с коразолом (табл.4).
Полученные данные свидетельствуют о наличии выраженной противосудорожной активности в тесте антагонизма с коразолом описываемого средства в дозе 15 мг/кг (внутрибрюшинно, однократно) и об отсутствии противосудорожного эффекта у фармакопейного глицина в в дозе 15 мг/кг.
Пример 3.
Изучение побочных эффектов и токсического действия описываемого противосудорожного средства.
Исследование проводили на белых беспородных половозрелых мышах-самцах массой 20-24 г возрастом 2-3 месяца. Экспериментальные животные содержались аналогично примеру 2. Всего использовалось 42 животных - 7 групп по 6 мышей.
Регистрацию изменения поведения, рефлексов, возможных побочных эффектов, признаков интоксикации и гибели животных проводили через 1, 4, 24 ч, 4, 10 и 14 сут. после внутрибрюшинного введения описываемого противосудорожного средства в сравнении с фармакопейной субстанцией глицина в тех же дозах.
В результате исследования было установлено, что описываемое противосудорожное средство при внутрибрюшинном введении мышам в дозах 75, 150 и 225 мг/кг не вызывало признаков интоксикации и гибели животных на протяжении 14 сут. (табл.5-7). При этом описываемое противосудорожное средство также не вызывало у мышей изменения шерстяного покрова, состояния слизистых оболочек. Также отсутствовали птоз верхнего века, повышенная уринация, дефекация, саливация, пилоэрекция, вокализация, боковое положение. В пределах нормы были ритм и глубина дыхательных движений, отсутствовали агрессивность, пугливость, тремор, судороги, каталепсия, стереотипия и груминг. Не наблюдалось изменения позы. У животных были сохранены пинеальный, роговичный и болевой рефлексы. На протяжении всех 14 сут. наблюдения животные удерживались на перевернутой сетчатой платформе в течение 5 с (табл.5-7).
Список литературы
1. Р. Дж. Портер, Б.С. Мелдрум. Противоэлептические средства / В кн. Б.Г. Катцунг. Базисная и клиническая фармакология: В 2 т. Т.1. / Пер. с англ. - 2-е изд., перераб. и доп. - М.; СПб.: Изд-во Бином, Изд-во «Диалект», 2007. С.464-491.
2. М.Д. Машковский. Лекарственные средства. 16-е изд., перераб., испр. и доп. - М.: Новая волна: Издатель Умеренков, 2012. С.34-50.
3. В.Э. Колла, С.А. Шеленкова. Поиск новых противосудорожных веществ. Пермь: ПФГА, 2006. 193 с.
4. И.А. Комиссарова, Я.Р. Нарциссов. Молекулярные механизмы действия лекарственного препарата «Глицин» // Terra medica. 2001. №1. С.23-25.
5. А.Ю. Беспалов, Э.Э. Звартау. Нейропсихофармакология антагонистов NMDA-рецепторов. - СПб.: Невский Диалект, 2000. 297 с.
6. US Pat 7820130 В2, 24.11.2004.
7. Y. Liu, Zh. Gu, J.L. Margrave, V.N. Khabashesku. Functionalization of Nanoscale Diamond Powder: Fluoro-, Alkyl-, Amino-, and Amino Acid-Nanodiamond Derivatives // Chem. Mater. 2004. V.16. P.3924-3930.
8. Российская энциклопедия по охране труда. В 3 т.2-е изд., перераб. и доп. Т.3. - М.: Изд-во. НЦ ЭНАС.2007. С.181.
9. Н.Н. Каркищенко. Биомедицина, 2009. №2. С.5-26.
10. Т.И. Шалина, Л.С. Васильева. Общие вопросы токсического действия фтора // Сибирский медицинский журнал. 2009. №5. С.5-9.
11. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / под ред. Хабриева, - М.: Медицина, 2005. 235-250 с.
12. Руководство по проведению доклинических исследований лекарственных средств 4.1. ФГБУ «ЩЭМСП». - М., Изд-во Гриф и К, 2012. 244 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| СЕДАТИВНОЕ СРЕДСТВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2506075C1 |
| АНТИПСИХОТИЧЕСКОЕ СРЕДСТВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2519761C1 |
| АНТИДЕПРЕССАНТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2519759C1 |
| АНТИГИПОКСАНТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2506074C1 |
| АНКСИОЛИТИК И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2519755C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВОИНСУЛИТНЫМ ДЕЙСТВИЕМ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2521404C1 |
| АНТИОКСИДАНТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2519760C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ АЛКОГОЛИЗМА | 2014 |
|
RU2574001C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ПАРОКСИЗМАЛЬНЫХ СОСТОЯНИЙ | 2011 |
|
RU2469722C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ НАРУШЕНИЙ СНА | 2014 |
|
RU2566713C1 |

Изобретение относится к области медицины, в частности к фармакологии и фармацевтике, и касается противосудорожного средства, представляющего собой аминокислоту глицин, иммобилизованную на частицах детонационного наноалмаза размером 2-10 нм, и способа его получения. 2 н. и 2 з.п. ф-лы, 5 ил., 7 табл., 3 пр.
1. Противосудорожное средство, представляющее собой глицин, иммобилизованный на частицах детонационного наноалмаза размером 2-10 нм, имеющих оболочку толщиной до 1 нм, с содержанием глицина до (21±3) мас.%.
2. Способ получения противосудорожного средства по п.1, характеризующийся тем, что детонационный наноалмаз отжигают в токе газообразного водорода при температуре 500-1200°С в течение 1-8 ч, подвергают жидкофазному хлорированию молекулярным хлором при фотохимическом воздействии видимым светом при температуре 50-70°С в течение 36-60 ч с последующей промывкой четыреххлористым углеродом, центрифугированием и сушкой, полученный модифицированный хлором наноалмаз растворяют в полярном растворителе с образованием суспензии, добавляют третичный амин и глицин, полученную смесь обрабатывают ультразвуком с последующим выдерживанием при 50-80°С, центрифугированием, промывкой растворителем и сушкой.
3. Способ по п.2, где обработку ультразвуком ведут в течение 5-60 мин и выдерживание при 50-80°С осуществляют в течение от 12 до 48 ч.
4. Способ по п.2 или 3, где в качестве третичного амина используют триэтиламин и в качестве полярного растворителя используют пиридин, низший алифатический спирт, водно-спиртовую смесь или воду.
| Приспособление к токарно-винторезному станку для нанесения делений на укрепляемых на суппорте и перемещаемых последним прямолинейных линейках и т.п. | 1924 |
|
SU2913A1 |
| Механизм для компенсации и торможения нескольких уточных нитей на ткацких станках | 1967 |
|
SU240555A1 |
| СПОСОБ ПОЛУЧЕНИЯ ФАРМАЦЕВТИЧЕСКИХ МУЛЬТИЧАСТИЦ | 2004 |
|
RU2331410C2 |
| Способ получения искусственного состава для сообщения непрозрачности эмали, стеклу и т.п. | 1927 |
|
SU14044A1 |
| ПОЛИФУНКЦИОНАЛЬНЫЕ АМИНОКИСЛОТНЫЕ ПРОИЗВОДНЫЕ ФУЛЛЕРЕНА C | 2007 |
|
RU2462473C2 |
Авторы
Даты
2014-02-27—Публикация
2013-01-25—Подача