Изобретение относится к новым полифункциональным аминокислотным производным фуллерена С60, обладающим биологической активностью, а также к способам их получения и способу ковалентного связывания производных фуллерена с SH-содержащими белками. Кроме того, изобретение относится к применению нитроксиалкил-N-(фуллеренил)аминокислот в качестве доноров монооксида азота, а также применению нитроксиалкил-N-(фуллеренил)аминокислот в качестве вазодилататоров быстрого действия для антигипертензивной терапии. Изобретение относится также к способу ингибирования процесса метастазирования и способу усиления антилейкемической активности циклофосфамида.
Известно, что продукты эквимолярного присоединения аминокислот и пептидов к фуллерену С60 /N-(моногидрофуллеренил)замещенные аминокислоты или пептиды/ [Romanova V.S., V.A. Tsyryapkin, Yu.I. Lyakhovetsky, Z.N. Parnes M.E. Vol'pin//Russian Chem. Bull., 1994, vol.6, рр. 1090-1091] составляют особый класс органических соединений, которые можно рассматривать как потенциальные антиметаболиты, относящиеся к определенному подклассу физиологически активных веществ. Широкий спектр биологической активности аминокислотных производных фуллерена (АПФ) обусловлен уникальной структурой углеродного сфероида, его способностью переводить кислород в синглетное состояние [Tokuyama H., Nakamura S., Nakamura E. // J. Am. Chem. Soc., 1993, vol. 115, рр. 7918], проявлять мембранотропные и антирадикальные свойства [Kotelnikova R. A., Kotelnikov A. I., Bogdanov G. N., Romanova V. S., Kuleshova E. F., Parnes Z. N., Vol`pin M.E.//FEBS Letters. - 1996. 389. - P. 111-114], противовирусную активность [Фрог Е.С., Котельникова Р.А., Богданов Г.Н., Штолько В.Н., Файнгольд И.И., Кущ А.А., Федорова Н.Е., Меджидова А.А., Романова В.С.//Технологии живых систем. - 2006. 3. 2. - С. 42-46] и цитотоксическое действие [Nakamura E., Tokuyama H., Yamago S., Shiraki T., Sugiura Y. // Bull. Chem. Soc. Japan. - 1996. 69. - P. 2143-2151]. Известны предпосылки к изучению сердечно-сосудистых эффектов под влиянием производных фуллерена [Сыренский А. В., Галагудза М. М., Егорова Е. И. Артериальная гипертензия, 2004, 10 (3), 15-20.]. Именно по этой причине фуллерен С60 рассматривается в химической фармакологии как весьма перспективный носитель функциональных групп, обладающих тем или иным видом биологической активности. К их числу относятся алкилирующие группировки цитотоксического действия, антрациклины, а также доноры монооксида азота.
Исследованиями последних лет выявлены различные аспекты противоопухолевого действия экзогенных доноров NO [Коновалова Н.П. // Технологии живых систем. -2004. 1. 3.- С.42-48]. Они повышают эффективность действия известных цитостатиков, тормозят развитие метастазов экспериментальных опухолей и модулируют чувствительность лекарственно-резистентных опухолей к цитостатической терапии.
Оксид азота является уникальным внутриклеточным полифункциональным регулятором метаболизма, гомеостаза кровеносных сосудов, артериального давления и перфузии органов. Большинство экзогенных доноров оксида азота, рекомендованных для лечения ишемии миокарда и острой сердечной недостаточности, находят широкое применение в качестве вазодилататоров и ингибиторов агрегации тромбоцитов.
Достаточно обширная библиография патентов по медицинской химии фуллеренов не содержит сведений в отношении новых полифункциональных аминокислотных производных фуллерена (АПФ), содержащих биологически активные группы, пептиды или белки, способы их получения также не раскрыты.
Задачей настоящего изобретения является создание новых полифункциональных аминокислотных производных фуллерена (АПФ), обладающих ингибирующей активностью в отношении метастазов опухоли, а также усиливающих антилейкемическую активность циклофосфамида, и которые могут быть пригодны в качестве доноров монооксида азота или в качестве вазодилататоров быстрого действия для антигипертензивной терапии.
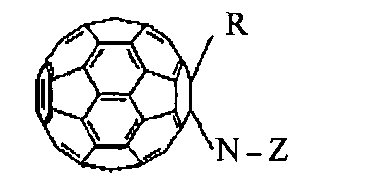
Полифункциональные аминокислотные производные фуллерена С60 в соответствии с изобретением имеют формулу (1)
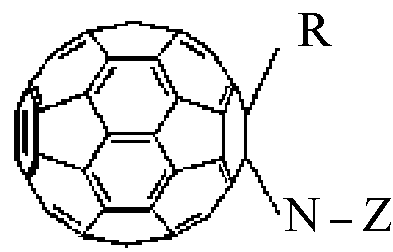
где R = Н, моно- или дигидроксиалкил, аминоалкил, галоидалкил, моно- или динитроксиалкил, малеинимид;
N-Z представляет собой фрагмент α,β,γ,ω-аминокислоты общей формулы
-NH-CmH2m-COOM или
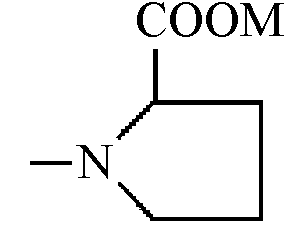
где m = 2-5, а М представляет собой нитроксиалкильную группу, алкильную группу или соль щелочного металла, или дипептид, причем алкильные группы содержат 1-6 атомов углерода.
Авторы настоящего изобретения впервые разработали способы получения АПФ путем замещения подвижного протона в моногидрофуллерениламинокислотах, а также путем этерификации карбоксила моногидрофуллеренилааминокислоты.
В соответствии с этим при взаимодействии производного моногидрофуллеренил-аминокислот с броммалеинимидом происходит замещение подвижного протона с образованием малеинимидных производных:
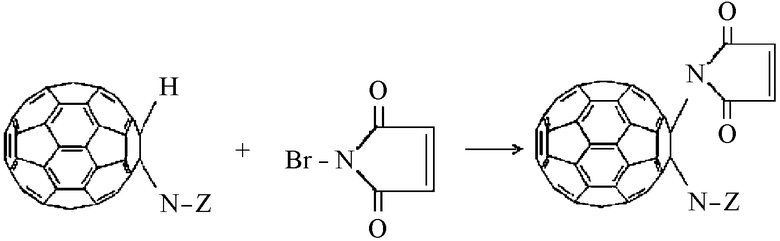
где N-Z - фрагмент синтетической или природной α, β, γ, ω-аминокислот (глицина, аланина, аргинина, серина, γ-аминомасляной, ω-аминокапроновой кислот, пролина и др.), его соль щелочного металла или низший эфир.
Подвижность протона моногидрофуллерениламинокислот обусловлена электроотрицательностью сфероида фуллерена, что определяет высокую поляризацию С-Н связи и преимущественную направленность по ней реакций электрофильного замещения:
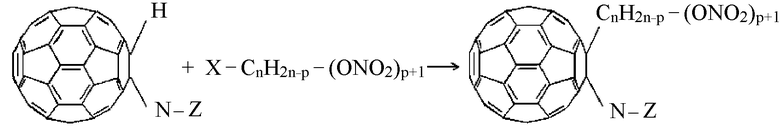
n=2-5; p=0-2
где Х = Cl-; Br-; J-.
При -N-Z представляет фрагмент синтетической или природной α, β, γ, ω-аминокислот общей формулы
-NH-CmH2m-COOM или

где m = 2-5, М представляет собой нитроксиалкильную группу, алкильную группу, где алкильные группы включают 1-6 атомов углерода, или соль щелочноземельного металла, причем в случае солей щелочных металлов аминокислот, реакция моногидрофуллерениламинокислот с нитроксилалкилгалогенидами протекает по двум реакционным центрам по уравнению:
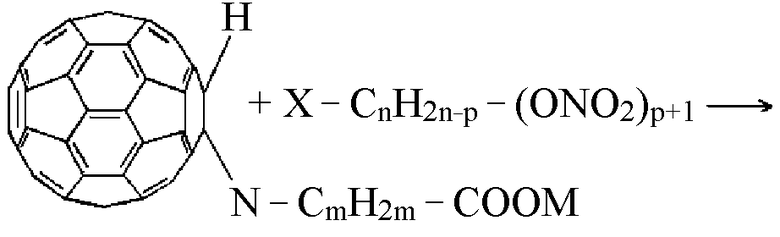
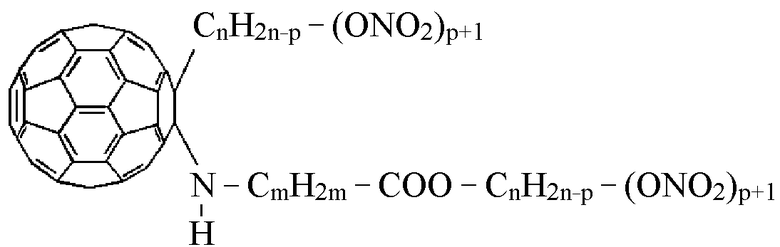
где М= К, Na; m=2-5, n=2-5.
Отмечено, что даже при небольшом увеличении значений n, m и p резко возрастает и без того высокая гидрофобность соединений. Полная утрата ими гидрофильности негативно сказывается на их мембранотропности, а следовательно, и на потенциальной биологической активности синтезированных доноров NO.
Поскольку по своей структуре АПФ можно отнести к классу антиметаболитов, нами предложены методы направленного синтеза производных фуллерена, ковалентно связанных с биологически активными пептидами и белками.
В качестве одного из них был использован карнозин (β-аланилгистидин), являющийся природным антиоксидантом мышечных и нервных тканей. Был синтезирован N-(моногидрофуллеренил)аланилгистидин, прямой аналог карнозина, содержащий сферу фуллерена.
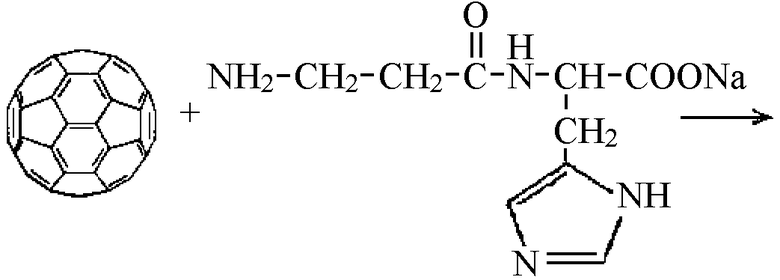
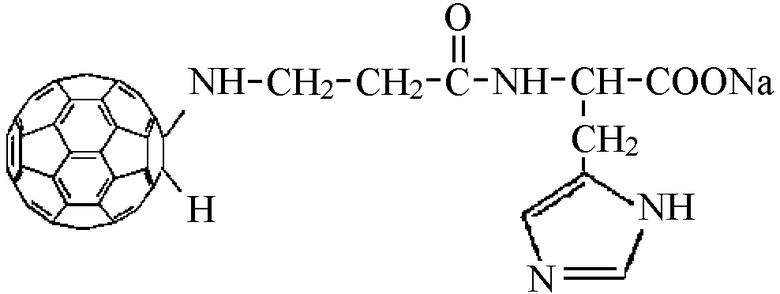
Полученное соединение отличается повышенной мембранотропностью и способностью ингибировать процесс пероксидного окисления липидов биологических мембран.
Другим примером модифицирующего действия АПФ на белки и ферменты может служить осуществленное нами ковалентное присоединение малеинимидного производного моногидрофуллеренилпролина к макромолекуле гемоглобина:
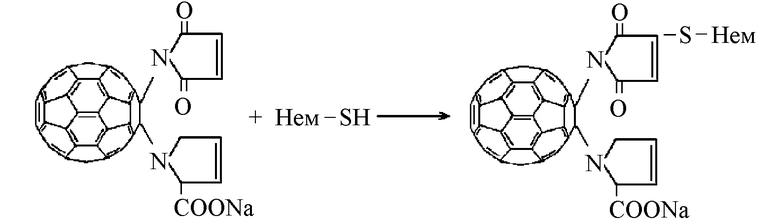
Этот метод носит универсальный характер и пригоден для введения сфероида фуллерена в любые SH-содержащие белки, обеспечивающие его трансмембранный перенос в клетку.
Исследования последних лет в области молекулярной кардиологии позволили установить важную роль оксида азота в регуляции сосудистого гомеостаза. Образование NO при биотрансформации экзогенных доноров оксида азота вызывает снижение тонуса коронарных сосудов, агрегации и адгезионной способности тромбоцитов, что способствует повышению гемодинамических характеристик и усилению кровотока.
Все полученные нитраты на основе аминокислотных производных фуллерена С60 (НАПФ) в процессе их биотрансформации генерируют монооксид азота, о чем свидетельствует их ингибирующее действие на каталитическую активность митохондриальной цитохром-С оксидазы. НАПФ-1 и НАПФ-2, структурные формулы которых представлены ниже, проявляют умеренное противоопухолевое действие и выраженную антиметастатическую активность.
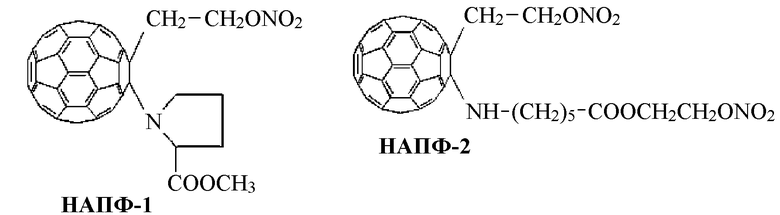
Известно, что к числу наиболее распространенных терапевтических средств для лечения заболеваний сердечно-сосудистой системы относятся препараты на основе нитроглицерина. Однако они характеризуются рядом недостатков и побочными эффектами, ограничивающими масштабы их клинического применения.
При изучении влияния нитроксиалкил-N-фуллерениламинокислотных производных, в частности НАПФ-1, на коронарную, сократительную и насосную функции изолированного сердца крыс линии Вистар было обнаружено, что НАПФ-1 является вазодилататором быстрого действия, снижающим артериальное давление и частоту сердечных сокращений и вызывающим расслабление коронарных сосудов при меньшем по сравнению с нитроглицерином (НГ) депрессивном влиянии на функцию миокарда [Писаренко О. И., Серебрякова Л. И., Студнева И. М., Цкитишвили О. В.//Бюлл. эксп. биол. мед. - 2006. 141(3) - С. 267-269]. Это означает, что соединения данного класса открывают перспективу создания оригинальных вазодилататоров для антигипертензивной терапии.
Нижеследующие примеры получения заявленных соединений и исследования их биологической активности не следует понимать как ограничивающие объем данного изобретения, а только как примеры предпочтительного воплощения изобретения.
Пример 1
Синтез метилового эфира N-нитроксиэтилфуллеренилпролина
К раствору 0,849 г (0,001М) метилового эфира N-моногидрофуллеренил пролина в пиридине прибавляли раствор 1,25 г (0,01 М) 2-хлор-нитроксиэтана в 10 мл пиридина и смесь выдерживали в течение 6 ч при комнатной температуре. Далее реакционную смесь подвергали диализу в течение 20 ч.
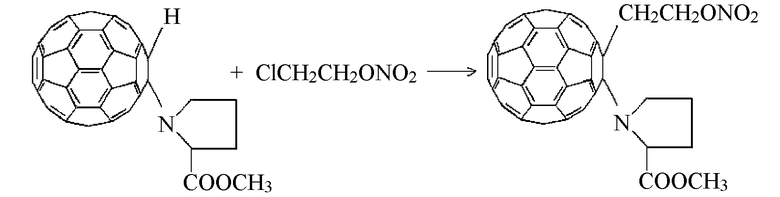
Остаток высушивали на воздухе, получая целевой продукт с близким к количественному выходом. В ИК-спектрах метилового эфира N-(нитроксифуллеренил)пролина появились полосы поглощения (1340 и 1540 см-1), соответствующие нитратной группе.
Пример 2
Синтез нитроксиэтилового эфира N-нитроксиэтилфуллеренилпролина
К раствору 0,86 г (0,001М) Na-соли N-моногидрофуллеренилпролина в 50 мл пиридина прибавляли 2,5 г (0,02 М) 2-хлор-нитроксиэтана в 20 мл пиридина и выдерживали при комнатной температуре в течение 8 ч. Затем реакционную смесь подвергали диализу в течение 20 ч. Остаток высушивали с получением целевого продукта с близким к количественному выходом.

В ИК-спектрах полученного нитроксиэтилового эфира N-(нитроксифуллеренил) пролина появились полосы поглощения (1340 и 1540 см-1), соответствующие нитратной группе.
Пример 3
Синтез натриевой соли N-[моногидрофуллеренил]-карнозина
К раствору 100 мг фуллерена С60 (0,138 ммоль) в 50 мл толуола добавляли 10-кратный избыток натриевой соли карнозина в 50 мл воды. Полученную гетерогенную систему перемешивали при нагревании при 70°С в аргоне в течение 8 часов. Затем отделяли органический слой, отгоняли растворитель, остаток растворяли в 100 мл воды и к нему добавляли 100 мл насыщенного раствора хлорида натрия. Полученный раствор подвергали диализу до полного удаления хлорида натрия (реакция отсутствия иона хлора в промывных водах). Полученный водный раствор упаривали и получали 130 мг натриевой соли N-[моногидрофуллеренил]-карнозина (выход количественный).
При гидролизе полученного продукта в 6N соляной кислоте образуется согласно HPLC-анализу эквимолярное количество (найдено 2,16±0,2 мкМ и 2,16±0,02 мкМ) β-аланина и гистидина, соответствующее расчетному значению (вычислено 2,20 мкМ).
Пример 4
Синтез метилового эфира N-[(N-малеинимидил)фуллеренил]-L-пролина
К раствору 0,849 г (0,001 моля) метилового эфира N-(моногидрофуллеренил)-L-пролина в 50 мл пиридина добавляли раствор 1,76 г (0,01 моля) броммалеинимида в 10 мл пиридина и смесь перемешивали при комнатной температуре в течение 8 часов. Затем реакционную массу подвергали диализу, остаток высушивали, получая метиловый эфир N-[(N-малеинимидил)фуллеренил]-L-пролина с количественным выходом. В ИК-спектре полученного продукта имеются характерные полосы поглощения при 1720 и 1355 см-1, подтверждающие наличие в молекуле малеинимидного фрагмента.
Пример 5
Ковалентное присоединение малеинимидного производного С 60 -пролина к макромолекулам белков
Специальная методика была разработана для ковалентного присоединения малеинимидного производного фуллеренилпролина к SH-группам белков. В качестве примера такое присоединение осуществлено к SH-группам гемоглобина и альбумина человека.
В случае гемоглобина человека осуществлялась модификация двух SH-групп, которые входят в структуру цистеина-93 в двух β-субъединицах макромолекулы гемоглобина. К раствору гемоглобина в мет-состоянии в концентрации 5×10-4 М в 0,1 М фосфатном буфере при рН=6,5 добавляли малеинимидное производное С60-пролина в трехкратном избытке по отношению к белку. Реакцию проводили в течение 30 мин при 20°С. Избыток водорастворимого малеинимидного производного фуллерена отделяли на колонке Sephadex G-15, используя в качестве элюента фосфатный буфер. В вышедшей с нулевым объемом фракции присоединение малеинимидного производного к гемоглобину контролировали спектрофотометрическим методом. Концентрацию гемоглобина определяли по характерной полосе поглощения при длине волны 407 нм (ε=7,06×105 М-1см-1), концентрацию присоединившегося малеинимидного производного фуллерена - по поглощению на длине волны 315 нм. При этом принималось, что на этой длине волны для малеинимидил-С60-пролина ε=2,10×104 М-1см-1 и для гемоглобина - ε=9,81×104 М-1см-1. В результате компьютерного моделирования суммарного спектра поглощения продукта из индивидуальных спектров поглощения гемоглобина и малеинимидного производного фуллерена получено, что в результате реакции к одной макромолекуле гемоглобина в среднем присоединяется 1,6 молекул малеинимидного производного фуллерена.
По аналогичной методике осуществлялось присоединение малеинимидного производного С60-пролина к реакционноспособной SH-группе альбумина человека. К раствору альбумина в концентрации 5×10-4 М в 0,1М фосфатном буфере при рН=6,5 добавляли малеинимидное производное С60-пролина в трехкратном избытке по отношению к белку. Реакцию проводили в течение 30 мин при 20°С. Избыток водорастворимого малеинимидного производного фуллерена отделяли на колонке Sephadex G-25, используя в качестве элюента фосфатный буфер. Хроматографию на колонке осуществляли двукратно, чтобы исключить сорбцию производного фуллерена на альбумин за счет гидрофобных взаимодействий. В вышедшей с нулевым объемом фракции присоединение малеинимидного производного к альбумину контролировали спектрофотометрическим методом. Концентрацию присоединившегося малеинимидного производного С60-пролина - спектрофотометрически, принимая для альбумина ε=3,65×104 М-1см-1 при 279 нм и ε=1,4×103 М-1см-1 при 310 нм, а для малеинимидного производного С60-пролина ε=3,30×104 М-1см-1 при 279 нм и ε=2,70×104 М-1см-1 при 310, нм. ε=3,65×104 М-1см-1 при 279 нм и ε=1,4×103 М-1см-1 при 310 нм. В результате анализа поглощения реакционной смеси после двукратной хроматографии на двух длинах волн определено, что в результате реакции к одной макромолекуле альбумина в среднем присоединяется 1,1 молекула малеинимидного производного фуллерена. В качестве контроля было определено методом амперометрического титрования, что в процессе присоединения малеинимидного производного С60-пролина к альбумину человека число свободных титруемых SH-групп в альбумине уменьшается от 1,05±0,2 до 0,1±0,2.
Пример 6
Антиметастатическая активность НАПФ-1 и НАПФ-2 и их комбинации с циклофосфамидом (ЦФ) исследовались на двух моделях метастазирующих солидных опухолей: карциноме LL и меланоме В-16 у мышей линии BDF1. В опытной и контрольной группах мышей определяли среднее число метастазов в легких и вычисляли индекс ингибирования метастазов в процентах: ИИМ= ((N0-Nk)/(Nk))×100. Статистическая обработка результатов исследования проводилась по Стьюденту. Результаты считали достоверными при p < 0,05. Полученные результаты представлены в Таблице 1.
(Экспериментальная оценка противоопухолевых препаратов в СССР и США" под редакцией З.П. Софьиной, А.Б. Сыркина (СССР), А. Голдина, А. Кляйна(США) Москва, "Медицина", 1980 г., стр. 76-86).
Антиметастатическая активность НАПФ-1 и НАПФ-2
(разовые дозы, мг/кг)
НАПФ-1 (50)
ЦФ+НАПФ-1 (30+50)
20
48
-
-
НАПФ-2 (83)
ЦФ+НАПФ-2 (30+ 83)
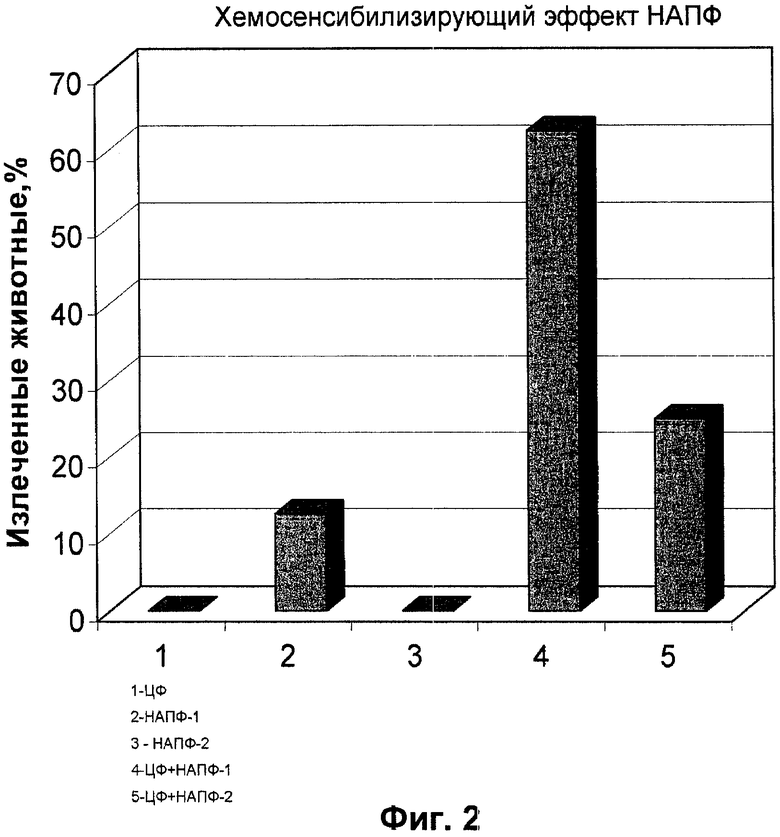
Данные в отношении противоопухолевой активности НАПФ, которая определялась в соответствии с методикой, раскрытой в «Экспериментальная оценка противоопухолевых препаратов в СССР и США» под редакцией З.П. Софьиной, А.Б. Сыркина (СССР), А. Голдина, А. Кляйна (США) Москва, "Медицина", 1980 г., стр. 73), приведены на Фиг. 1 и 2.
На Фиг.1 показано усиление антилейкемической активности (увеличение продолжительности жизни (ILS,%) мышей линии BDF-1 с лейкемией Р-388) циклофосфамида (30мг/кг; 1; 6 сутки) при его комбинации с НАПФ-1 (30 мг/кг; 1-6 сутки) и НАПФ-2 (30мг/кг; 1-6 сутки).
На Фиг.2 приведены результаты по увеличению хемосенсибилизирующего эффекта НАПФ-1 и НАПФ-2 (% излеченных мышей линии BDF-1 с лейкемией Р-388) при их комбинации с циклофосфамидом (разовые дозы и режимы введения - как на Фиг. 1).
Пример 7
В опытах in vivo крысам линии Вистар внутривенно вводили НАПФ-1 или НГ (нитроглицирин) в эквимолярных дозах (2,6 х 10-5 мМ/кг). Гемодинамику характеризовали значениями артериального давления (АД) и частоты сердечных сокращений (ЧСС). Полученные нормированные значения приведены в Таблице 2.
Влияние доноров NO на нормированные значения показателей гемодинамики у крыс в условиях in vivo
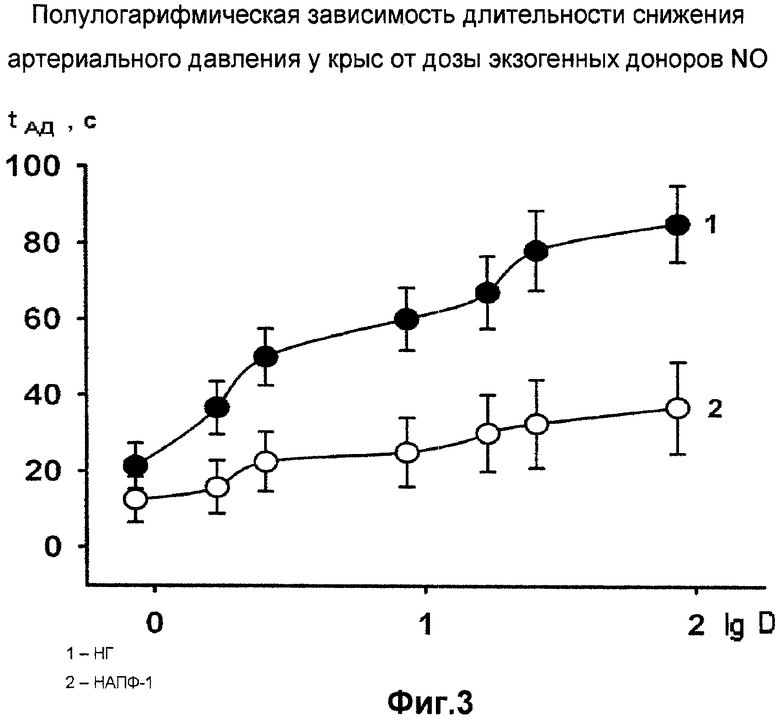
Изучено влияние внутривенного введения доноров NO на длительность снижения артериального давления у крыс в условиях in vivo (Фиг. 3). Нитроксипроизводное фуллерена в широком диапазоне концентраций слабо действует на длительность снижения артериального давления и значительно (в два-три раза) сокращает этот показатель по сравнению с нитроглицерином.
Данные получены в сериях из 6 опытов и результаты представлены на Фиг. 3.
Пример 8
Общепринятой методикой [Писаренко О.И., Шульженко В.С., Студнева И. М., Тимошин А. А. // Кардиология. - 2004. 44 (4) - с. 65-70] изучено влияние НАПФ-1 на функции левого желудочка изолированного сердца крыс и коронарных сосудов при концентрации НАПФ-1 3,5 × 10-5 М. Полученные нормированные значения давления (Д), развиваемого левым желудочком, интенсивности сокращений (ИС) и коронарного потока (КП) приведены в Таблице 3.
Изменения функциональных характеристик левого желудочка и интенсивности коронарного потока под влиянием доноров NO
Достоверность различий подтверждена критерием Стьюдента при Р<0,05.
Литература
1. Romanova V.S., V.A. Tsyryapkin, Yu.I. Lyakhovetsky, Z.N. Parnes M.E. Vol'pin. Addition of amino acids and dipeptides to fullerene C60 giving rise to monoadducts. - Russian Chem. Bull., 1994, vol.6, рр.1090-1091.
2. Tokuyama H., Nakamura S., Nakamura E. Photoinduced biochemical activity of fullerene carboxylic acid. - J. Am. Chem. Soc., 1993, vol.115, рр. 7918.
3. Kotelnikova R. A., Kotelnikov A.I., Bogdanov G. N., Romanova V. S., Kuleshova E. F., Parnes Z. N., Vol`pin M.E. Membranotropic propeties of the water soluble amino acid and peptid derivatives of fullerene C60. // FEBS Letters. - 1996. 389. - P. 111-114.
4. Фрог Е.С., Котельникова Р.А., Богданов Г.Н., Штолько В.Н., Файнгольд И.И., Кущ А.А., Федорова Н.Е., Меджидова А.А., Романова В.С. Влияние аминокислотных производных фуллерена С60 на развитие цитомегаловирусной инфекции. // Технологии живых систем. - 2006. 3. 2. - С. 42-46.
5. Nakamura E., Tokuyama H., Yamago S., Shiraki T., Sugiura Y. Biological activity of water-soluble fullerenes. Structural dependence of DNA cleavage, cytotoxicity, and enzyme inhibitory activities including HIV-protease inhibition. // Bull. Chem. Soc. Japan. - 1996. 69. - P. 2143-2151.
6. Сыренский А. В., Галагудза М. М., Егорова Е. И. Артериальная гипертензия, 2004, 10 (3), 15-20.
7. Коновалова Н.П. Доноры монооксида азота в экспериментальной химиотерапии опухолей // Технологии живых систем. -2004. 1. 3.- С.42-48.
8. Писаренко О. И., Серебрякова Л. И., Студнева И. М., Цкитишвили О. В. // Бюлл. эксп. биол. мед. - 2006. 141 (3) - С. 267 -269.
9. Писаренко О. И., Шульженко В. С., Студнева И. М., Тимошин А. А. // Кардиология. - 2004. 44 (4) - С. 65 -70.
10. «Экспериментальная оценка противоопухолевых препаратов в СССР и США» под редакцией З.П. Софьиной, А.Б. Сыркина (СССР), А. Голдина, А. Кляйна (США) Москва, "Медицина", 1980 г.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ стимуляции роста мицелия грибов базидиомицетов | 2022 |
|
RU2789886C1 |
| СЕРОСОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ ФУЛЛЕРЕНОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2477273C2 |
| СПОСОБ ПОЛУЧЕНИЯ АДДУКТОВ ФУЛЛЕРЕНА | 2010 |
|
RU2462474C2 |
| ГОМО- И ГЕТЕРО-ПОЛИАМИНОКИСЛОТНЫЕ ПРОИЗВОДНЫЕ ФУЛЛЕРЕНА C, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 2011 |
|
RU2458914C1 |
| ФОСФОРСОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ ФУЛЛЕРЕНА C И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2509083C2 |
| Применение пентааминокислотных производных фуллеренов в качестве антиоксидантов и антидиабетических средств | 2016 |
|
RU2669341C2 |
| Способ получения продуктов с антибактериальной активностью из мицелия базидиомицетов | 2022 |
|
RU2800356C1 |
| АРИЛИРОВАННЫЕ ПОЛИКАРБОКСИЛЬНЫЕ ПРОИЗВОДНЫЕ ФУЛЛЕРЕНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ КОВАЛЕНТНЫЕ КОНЪЮГАТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2567299C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ И СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКОГО ЗАБОЛЕВАНИЯ С ЕЕ ИСПОЛЬЗОВАНИЕМ | 2005 |
|
RU2323722C2 |
| НАНОАГРЕГАТЫ ВОДОРАСТВОРИМЫХ ПРОИЗВОДНЫХ ФУЛЛЕРЕНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ, КОМПОЗИЦИИ НА ОСНОВЕ НАНОАГРЕГАТОВ ВОДОРАСТВОРИМЫХ ПРОИЗВОДНЫХ ФУЛЛЕРЕНОВ, ПРИМЕНЕНИЕ НАНОАГРЕГАТОВ ВОДОРАСТВОРИМЫХ ПРОИЗВОДНЫХ ФУЛЛЕРЕНОВ И КОМПОЗИЦИЙ НА ИХ ОСНОВЕ В КАЧЕСТВЕ БИОЛОГИЧЕСКИ-АКТИВНЫХ СОЕДИНЕНИЙ, ДЛЯ ПОНИЖЕНИЯ ТОКСИЧНОСТИ И УСИЛЕНИЯ ТЕРАПЕВТИЧЕСКОГО ДЕЙСТВИЯ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, А ТАКЖЕ В КАЧЕСТВЕ ПРЕПАРАТОВ ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2012 |
|
RU2550030C2 |
Настоящее изобретение относится к новым полифункциональным аминокислотным производным фуллерена С60 формулы (1)
где R=Н, моно- или динитроксиС1-6алкил, малеинимид;
N-Z представляет собой фрагмент α,β,γ,ω-аминокислоты общей формулы 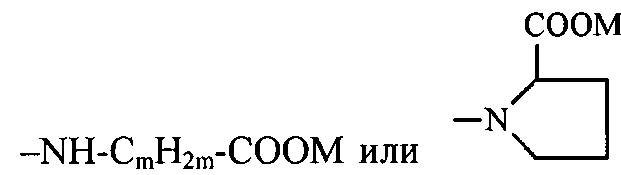 где m=2-5, а М представляет собой нитроксиС1-6алкильную группу, C1-6алкильную группу или соль щелочного металла, обладающим биологической активностью, а также к способам их получения и способу ковалентного связывания производных фуллерена с SH-содержащими белками. Кроме того, изобретение относится к применению нитроксиалкил-N-(фуллеренил)аминокислот в качестве доноров монооксида азота, а также применению нитроксиалкил-N-(фуллеренил)аминокислот в качестве вазодилататоров быстрого действия для антигипертензивной терапии. Изобретение относится также к способу ингибирования процесса метастазирования и способу усиления антилейкемической активности циклофосфамида. Заявленные нитроксиалкил-N-фуллерениламинокислотные производные влияют на коронарную, сократительную и насосную функции изолированного сердца крыс линии Вистар и являются вазодилататором быстрого действия, снижающим артериальное давление и частоту сердечных сокращений и вызывающим расслабление коронарных сосудов при меньшем по сравнению с нитроглицерином (НГ) депрессивным влиянием на функцию миокарда. Кроме того, соединения по изобретению значительно усиливают антилейкемическую активность циклофосфамида. Также соединения по изобретению показывают увеличение хемосенсибилизирующей активности в комбинации с циклофосфамидом, 9 н.п. ф-лы, 3 табл., 3 ил., 8 пр.
где m=2-5, а М представляет собой нитроксиС1-6алкильную группу, C1-6алкильную группу или соль щелочного металла, обладающим биологической активностью, а также к способам их получения и способу ковалентного связывания производных фуллерена с SH-содержащими белками. Кроме того, изобретение относится к применению нитроксиалкил-N-(фуллеренил)аминокислот в качестве доноров монооксида азота, а также применению нитроксиалкил-N-(фуллеренил)аминокислот в качестве вазодилататоров быстрого действия для антигипертензивной терапии. Изобретение относится также к способу ингибирования процесса метастазирования и способу усиления антилейкемической активности циклофосфамида. Заявленные нитроксиалкил-N-фуллерениламинокислотные производные влияют на коронарную, сократительную и насосную функции изолированного сердца крыс линии Вистар и являются вазодилататором быстрого действия, снижающим артериальное давление и частоту сердечных сокращений и вызывающим расслабление коронарных сосудов при меньшем по сравнению с нитроглицерином (НГ) депрессивным влиянием на функцию миокарда. Кроме того, соединения по изобретению значительно усиливают антилейкемическую активность циклофосфамида. Также соединения по изобретению показывают увеличение хемосенсибилизирующей активности в комбинации с циклофосфамидом, 9 н.п. ф-лы, 3 табл., 3 ил., 8 пр.
1. Полифункциональные аминокислотные производные фуллерена С60 формулы (1)
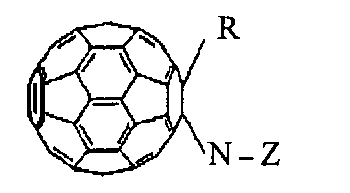
где R - Н, моно- или динитроксиС1-6алкил, малеинимид;
N-Z представляет собой фрагмент α,β,γ,ω-аминокислоты общей формулы
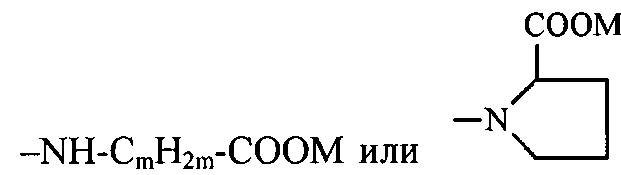
где m=2-5, а М представляет собой нитроксиС1-6алкильную группу, С1-6алкильную группу или соль щелочного металла.
2. Способ получения соединения по п.1, включающий обработку сложного алкильного эфира моногидрофуллерениламинокислоты избытком галогенпроизводного нитроксиалкила в растворе пиридина при комнатной температуре в течение 6-10 ч с последующим диализом реакционной смеси.
3. Способ получения соединений по п.1, включающий этерификацию карбоксила фуллерениламинокислоты путем обработки соли щелочного металла фуллерениламинокислоты избытком галогенпроизводного нитроксиалкила в растворе пиридина при комнатной температуре в течение 6-10 ч с последующим диализом реакционной смеси.
4. Способ ковалентного связывания производных фуллерена с SH-содержащими белками, заключающийся в том, что соответствующий белок подвергают взаимодействию с малеинимидным аминокислотным производным фуллерена С60 по п.1.
5. Применение нитроксиалкил-N-(фуллеренил)аминокислоты по п.1 в качестве донора монооксида азота.
6. Применение нитроксиалкил-N-(фуллеренил)аминокислот по п.1 в качестве вазодилататоров быстрого действия для антигипертензивной терапии.
7. Применение нитроксиалкил-N-(фуллеренил)аминокислоты по п.1 в качестве хемосенсибилизаторов в цитостатической химиотерапии опухолей.
8. Способ ингибирования процесса метастазирования, включающий введение полифункционального производного фуллерена С60 по п.1 в комбинации с цитостатиками.
9. Способ усиления антилейкемической активности циклофосфамида, заключающийся в том, что циклофосфамид вводят совместно с полифункциональными производными фуллерена С60 по п.1.
| RU 2002118282 А, 20.02.2004 | |||
| СРЕДСТВО ДЛЯ ИНГИБИРОВАНИЯ ВИЧ И ЦМВ-ИНФЕКЦИЙ И СПОСОБ ИХ ИНГИБИРОВАНИЯ | 2002 |
|
RU2196602C1 |
| RU 2213049 С1, 27.09.2003 | |||
| RU 2002118286 А, 20.02.2004 | |||
| RU 2213048 С1, 27.09.2003 | |||
| ФУЛЛЕРЕНОВОЕ ПРОИЗВОДНОЕ ГЛИКОПЕПТИДА, ОБЛАДАЮЩЕЕ АДЪЮВАНТНОЙ АКТИВНОСТЬЮ | 1997 |
|
RU2124022C1 |
| JP 2002212197 А, 31.07.2002 | |||
| Реагент для обработки глинистых буровых растворов | 1988 |
|
SU1645279A1 |
Авторы
Даты
2012-09-27—Публикация
2007-06-19—Подача