Изобретение относится к медицине, а именно к экспериментальной медицине, хирургии, и предназначено для получения модели трофических ран в эксперименте.
Выяснение закономерностей репаративной регенерации различных повреждений кожи при остром и хроническом воспалении - одна из актуальных проблем современной биологии и медицины. Известны воспроизводимые модели трофической язвы. В эксперименте на кроликах породы шиншилла отработана воспроизводимая модель трофической язвы с развитием гнойного процесса в ране. В эксперименте животные разделяются на 3 группы: 1 группа контроля - язва без лечения, 2 группа контроля -лечение язвы традиционными методами, 3 группа наблюдения - аппликация на язву оригинальной композиции, содержащей аллогенные прогениторные клетки. На 1,3,5,7,10 и 15 сутки измеряли площадь раневой поверхности, выполняли биопсию из раны. Полученный материал окрашивали гематоксилином и эозином, Ki-67, CD-95.
Оценка результатов: в группе наблюдения, начиная с 1 суток, определяется отграничение раневого дефекта с формированием демаркационного вала и выраженной лимфогистиоцитарной инфильтрацией тканей язвы. Выявлены существенные отличия по количеству носителей маркеров Ki-67, CD-95 в группах контроля и группе наблюдения. По мнению авторов, это связано с местным действием аллогенных прогениторных клеток, которые обеспечивают антибактериальный эффект в ране в фазу воспаления. Продолжительность фаз воспаления, пролиферации и эпителизации сокращается в 3-4 раза по сравнению с контролем. (Суховей Ю.Г., Цирятьева С.Б. Репаративная регенерация трофических язв при использовании аллогенных прогениторных клеток. НИИ клинической иммунологии СО РАМН Тюменский филиал. Материалы Московской международной конференции «Биотехнология и медицина», 14-17 марта 2006 http://www.cmbt.su/ms/science/science65.html)
Также явления трофических ран наблюдались при экспериментальном сахарном диабете при введении крысам аллоксана и перевязки подвздошной артерии.
Методика операции в эксперименте. Крыса неподвижно фиксировалась. Освобождался живот и внутренняя поверхность бедра от волосяного покрова. Поверхность кожи обрабатывалась спиртовым раствором хлоргексидина. Проводилась перевязка общей подвздошной артерии. Формировалась язва диаметром 1,5 см скальпелем. В дальнейшем проводился ежедневный мониторинг состояния микроциркуляции в зоне поражения с помощью доплеровской флоуметрии. На 7 сутки показатели микроциркуляции были такими же, как у больных с трофическими язвами при хронических облитерирующих заболеваниях артерий нижних конечностей [http://medical-diss.com/medicina/kompleksnoe-lecheme-bolnyh-s-troficheskimi-yazvami-pri-obliterimyuschih-zabolevaniyah-arteriy-nizhnih-konechnostey-i-sa].
Известен способ изучения влияния аллогенных дермальных фибробластов в коллагеновом геле на процессы заживления ран с выполнением экспериментального исследования на крысах. В данном эксперименте используются крысы линии Wister, самцы массой 180-200 грамм. У животных создавалась экспериментальная модель длительно незаживающей кожной раны. В условиях операционной после предварительного сбривания шерсти и обработки спины крысы раствором йода, под ингаляционным наркозом парами эфира в сочетании с внутривенной анестезией тиопенталом натрия, проводилось оперативное вмешательство. Острым путем (скальпелем) иссекался полнослойный кожный лоскут по вертебральной линии спины крысы, ближе к шейному отделу. Производилось иссечение кожи и подкожной клетчатки до фасции с формированием раны диаметром 3,5 см. Для предотвращения контракции раны и отграничения краевой эпителизации по периметру раны подшивали полихлорвиниловое кольцо диаметром 3,5 см. Кольцо фиксировали к краям раны 5-8 узловыми швами на всю толщину кожи. В центр дна раны узловым швом подшивали аутодермотрансплантат для оценки процесса эпителизации. Над кольцом фиксировали защищающую рану асептическую марлевую повязку. Животных рассаживали по одному или малыми группами для предотвращения нарушения целостности повязки [http://www.dissercat.com/contenVispolzovanie-allogennykh-fibroblastov-v-kompleksnom-lechenii-bolnykh-troficheskimi-yazvami-v].
Однако данный способ предназначен для лечения только мелких линейных порезов, не осложненных гнойно-воспалительным процессом. Используемые препараты токсичны и недостаточно эффективны. Кроме того, в этом способе невозможно контролировать течение раневого процесса под пленкой, не исключено развитие мацерации и анаэробной инфекции под газо- и водонепроницаемой пленкой.
Известен способ моделирования гнойных ран, заключающийся в том, что проводят неполное выбривание поверхности кожи для моделирования раны таким образом, чтобы остался квадратный участок волос размером 2х2 см в межлопаточной области, затем выполняют Н-образный разрез с длиной продольного сечения 2 см, в поперечном направлении два разреза длиной 2 см каждый, отсепаровывают образовавшиеся кожные лоскуты, покрытые волосами, вправо и влево с последующим раздавливанием зажимом Кохера дна раны, вворачивают внутрь раны кожные лоскуты, покрытые волосами, и накладывают герметичные узловые лигатуры за основания кожных лоскутов с последующим иссечением хирургическим путем образовавшихся швов совместно с кожными лоскутами, отступая на 2-3 мм в латеральные стороны двумя параллельными разрезами от точек выхождения лигатурных стежков [заявка РФ 93031608, 1995 г.].
Известен способ лечения инфицированных ран в эксперименте, в ходе его выполнения сначала получают модель гнойной раны следующим образом. После предварительной обработки кожи в асептических условиях, под наркозом, на выбритом от шерсти участке кожи в межлопаточной области у крыс иссекают кожу с подкожной клетчаткой в виде квадрата 2×2 см (400 мм2) по контуру. Края и дно раны раздавливают зажимом Кохера. В рану вносят марлевый тампон с взвесью суточной культуры полиантибиотикорезистентного клинического штамма золотистого стафилококка в дозе 2 млрд. микробных тел в 1 мл физиологического раствора. Рану у животных контрольной и опытной групп закрывают марлевой повязкой, смоченной изотоническим раствором, заклеивают пластырем во избежание подсыхания раны. У животных в межлопаточной области формируется абсцесс со всеми характерными признаками гнойного воспаления: отмечается отек и гиперемия кожи в области нанесения раны, припухлость, у некоторых животных выделяется гной. С целью предупреждения контракции раны, а также для стандартности условий лечения к краям раны подшивают металлическую рамку, соответствующую размерам раны. Данный способ моделирования трофической раны взят за прототип.
Учитывались следующие параметры течения раневого процесса:
наличие и характер воспалительной реакции, состояние краев и дна раны, сроки очищения раны от некротических тканей и появления грануляций, характер грануляционной ткани, сроки начала эпителизации ран. Для изучения скорости заживления ран вторичным натяжением использовали планиметрический метод Л.Н.Поповой, основанный на регистрации скорости уменьшения раневой поверхности во времени. Процент уменьшения площади раны за сутки определяли по формуле, где: S - площадь раны при предыдущем измерении; Sn - площадь раны при последующем измерении; t -число дней между предыдущим и последующим измерениями [патент РФ №2460553,2012 г.].
Этиологию и патогенез трофической язвы можно представить в виде пирамиды, на вершине которой тяжелый раневой сепсис и синдром полиорганной дисфункции, а в основании - множество врожденных и приобретенных заболеваний и травм, запускающих различные патологические процессы на тканевом (ишемия, гипоксия), микроциркуляторном (микротромбозы и сладж форменных элементов крови, экстравазация белка в перивазальное пространство с накоплением фибрина в тканях и с образованием «фибриновых манжет» вокруг капилляров, что усугубляет метаболические нарушения в тканях, стимулируя эпидермальный некроз) и клеточном (активизация лейкоцитов с выбросом ими лизосомальных ферментов) уровнях.
Дополнительно происходят локальные и системные сдвиги, формирующие синдром гипервязкости крови. В ответ на выраженную локальную гипоксию тканей в области трофической венозной язвы активируются процессы свободнорадикального перекисного окисления липидов, приводящие к системному истощению с развитием цитокинопосредованного повреждающего воздействия на ткани дистальных сегментов конечности. В результате возникновения первичного аффекта нарушается барьерная функция кожи. Повреждение ее слоев сопровождается некрозом мягких тканей и массивным экссудативным процессом. В дальнейшем происходит быстрая бактериальная контаминация трофической язвы, которая в ряде случаев может приобретать генерализованный характер (http://www.rmj.ru/articles 6924.htm).
Имеющиеся в арсенале исследователей экспериментальные модели трофических язв и ран не учитывают полностью патогенез, связанный с гемической ишемией и гипоксией на тканевом уровне, а также нарушения микроциркуляции вследствие образования микротромбозов, сладж форменных элементов крови, экстравазации белка в перивазальное пространство с накоплением фибрина в тканях и образованием «фибриновых манжет» вокруг капилляров, что вызывает метаболические нарушения в тканях, препятствуя заживлению. Наличие локальной гипоксии тканей в области трофической раны активирует процессы свободнорадикального окисления и перекисного окисления липидов, приводящие к системному истощению с развитием цитокинопосредованного повреждения тканей. Кроме того, модели трофических ран не содержат в себе нарушений барьерной функции кожи, а повреждение ее слоев происходит посредством иссечения некоторой площади и глубины ткани.
Таким образом, предложенные модели трофических ран являются по происхождению острыми ранами, в них отсутствуют основные звенья патогенеза: гипоксия и ишемия, применяемые при этом удерживающие приспособления и швы всего лишь обеспечивают несоединение краев ран, при этом характеристика периферического кровотока и микроциркуляции не изменяется и позволяет этой острой ране зажить самостоятельно.
Задачей предлагаемого изобретения является разработка способа моделирования трофической раны в эксперименте с учетом наличия локальной гипоксии и нарушения микроциркуляции.
Технический результат - повышение точности модели трофической раны за счет учета наличия локальной гипоксии и нарушения микроциркуляции.
Сущность изобретения поясняется чертежом, на котором схематично изображен предлагаемый способ.
Предлагаемый способ моделирования трофической раны в эксперименте осуществляется следующим образом. После предварительной обработки кожи в асептических условиях, под наркозом, на выбритом от шерсти участке кожи в межлопаточной области у крыс 1 иссекают кожу до поверхностной фасции в виде круга (что приближено к форме клинического проявления трофической раны) диаметром 20 мм, площадью 314 мм. По краям раны накладывают кисетный шов 2 для создания картины нарушения микроциркуляции. В целях удержания краев раны и предотвращения их сближения накладывают кожно-фасциальные узловые швы 3. На поверхности дна образованной раны производят рассечение поверхностной фасции поперечными и продольными, взаимоперпендикулярными разрезами, которые образуют ячейки 4 размерами 5×5 мм (см. чертеж).
Рану у животного закрывают марлей, смоченной антисептическим раствором, поверх накладывается асептическая повязка.
Предлагаемый способ моделирования позволяет формировать трофическую рану в эксперименте со всеми характерными для нее признаками: отек, гиперемия кожи в области раны, нарушенная микроциркуляция, локальная гипоксия, серозное отделяемое.
В доступных источниках научно-медицинской и патентной информации авторами не был найден тождественный способ моделирования трофической раны в эксперименте. Таким образом, заявляемое изобретение соответствует критерию "Новизна".
Исследованиями авторов доказано, что предлагаемый способ моделирования трофической раны в эксперименте повышает точность модели за счет учета наличия локальной гипоксии и нарушения микроциркуляции. Таким образом, заявляемое изобретение соответствует критерию "Изобретательский уровень".
Данным способом были смоделированы трофические раны на 12 экспериментальных животных (беспородных крысах). Во всех случаях был достигнут указанный технический результат.
Пример. Для моделирования трофической раны в эксперименте для оценки динамики развития воспалительных процессов - отека, гиперемии кожи и серозного отделяемого в области раны - и местных трофических нарушений - нарушения микроциркуляции и локальной гипоксии - производили предварительную обработки кожи экспериментального животного (лабораторная крыса) в асептических условиях, под наркозом, на выбритом от шерсти участке кожи в межлопаточной области иссекали кожу до поверхностной фасции в виде круга диаметром 20 мм, площадью 314 мм. Затем по краям раны наложили кисетный шов для создания картины нарушения микроциркуляции, что позволило уменьшить нормальное кровоснабжение, а именно приток артериальной крови в область моделируемой трофической раны, нарушение венозного оттока в вышеуказанной области и нарушение лимфатической дренажной функции. Данная манипуляция привела к местному отеку тканей, местной гиперемии, увеличению серозного отделяемого с поверхности смоделированной раны. Признаком гипоксии в моделируемой ране являлось изменение цвета с красного на бледно-розовый и наличие полнокровных венозных сосудов.
Для удержания краев раны и предотвращения их сближения накладывали кожно-фасциальные узловые швы. На поверхности дна образованной раны произвели рассечение поверхностной фасции поперечными и продольными, взаимоперпендикулярными разрезами, которые образовали ячейки размером 5×5 мм для создания картины трофических изменений не только кожи, но и части поверхностной фасции, а также нижележащих тканей.
Рану у животного закрывали марлей, смоченной антисептическим раствором - 4% водным раствором борной кислоты, поверх наложили и фиксировали асептическую повязку.
Предлагаемый способ легко воспроизводим и при его использовании достигается указанный технический результат. Таким образом, заявляемое изобретение соответствует критерию «Промышленная применимость».
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ моделирования трофической язвы в эксперименте | 2018 |
|
RU2688460C1 |
| Способ моделирования трофических гнойных ран в эксперименте | 2021 |
|
RU2753955C1 |
| СПОСОБ ИНФУЗИОННОЙ ТЕРАПИИ ПРИ ТРОФИЧЕСКИХ РАНАХ | 2012 |
|
RU2475242C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ТРОФИЧЕСКОЙ ЯЗВЫ ВЕНОЗНОЙ ЭТИОЛОГИИ В ЭКСПЕРИМЕНТЕ | 2016 |
|
RU2618653C1 |
| Способ моделирования инфицированной раны у крыс на фоне длительно текущего сахарного диабета | 2020 |
|
RU2735708C1 |
| СПОСОБ ЗИНАТУЛЛИНА Р.М. ОПРЕДЕЛЕНИЯ ОПТИМАЛЬНОГО ОБЪЕМА ИНФУЗИОННОЙ ТЕРАПИИ ДЛЯ ПОСТРАДАВШИХ ПРИ ОТМОРОЖЕНИЯХ В СОСТОЯНИИ АЛКОГОЛЬНОГО ОПЬЯНЕНИЯ | 2012 |
|
RU2486864C1 |
| ХИРУРГИЧЕСКИЙ СПОСОБ ЛЕЧЕНИЯ ТРОФИЧЕСКИХ РАН РАЗЛИЧНОЙ ЭТИОЛОГИИ | 2010 |
|
RU2438596C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ОБЪЕМА ИНФУЗИОННОЙ ТЕРАПИИ ПРИ ЭНЦЕФАЛОПАТИИ АЛКОГОЛЬНОГО ГЕНЕЗА | 2014 |
|
RU2547245C1 |
| КОМПЛЕКСНЫЙ СПОСОБ ЛЕЧЕНИЯ ТРОФИЧЕСКИХ И ВЯЛОТЕКУЩИХ РАН С ИСПОЛЬЗОВАНИЕМ ПОГРУЖНОЙ АУТОДЕРМОПЛАСТИКИ И РАНЕВОГО ПОКРЫТИЯ НА ОСНОВЕ ХИТОЗАНА | 2011 |
|
RU2463971C1 |
| СПОСОБ ГИЗАТУЛЛИНА Т.Р. ОПРЕДЕЛЕНИЯ ОПТИМАЛЬНОГО ОБЪЕМА ИНФУЗИОННОЙ ТЕРАПИИ ДЛЯ ПОСТРАДАВШИХ ПРИ ОТМОРОЖЕНИЯХ В СОСТОЯНИИ НАРКОТИЧЕСКОГО ОПЬЯНЕНИЯ ПРИ УПОТРЕБЛЕНИИ ДЕЗОМОРФИНА | 2012 |
|
RU2487664C1 |
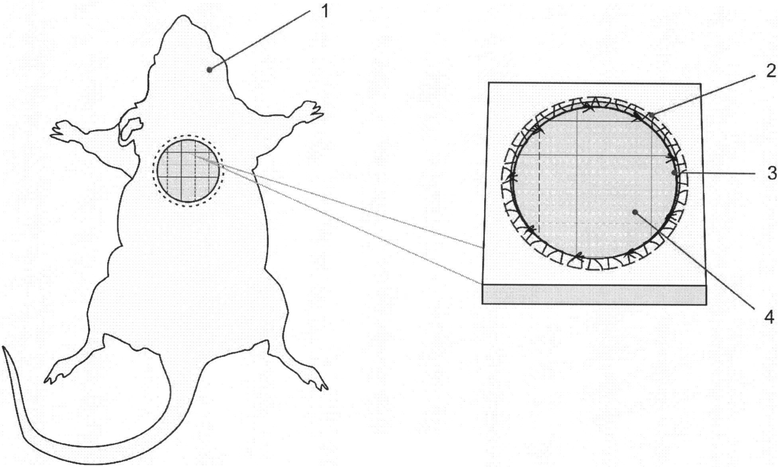
Изобретение относится к экспериментальной медицине. Иссекают кожу до поверхностной фасции в виде круга диаметром 20 мм, после чего по краям раны накладывают кисетный шов. Формируют кожно-фасциальные узловые швы. На поверхности дна раны рассекают поверхностную фасцию перпендикулярными разрезами с образованием ячеек размерами 5×5 мм. Способ позволяет моделировать трофические раны с воспроизведением условий локальной гипоксии и нарушения микроциркуляции. 1 ил., 1 пр.
Способ моделирования трофической раны, включающий иссечение кожи в межлопаточной области у крыс в виде геометрической фигуры, отличающийся тем, что иссекают кожу до поверхностной фасции в виде круга диаметром 20 мм, после чего по краям раны накладывают кисетный шов, а также кожно-фасциальные узловые швы, затем на поверхности дна образованной раны производят рассечение поверхностной фасции поперечными и продольными, взаимоперпендикулярными разрезами с образованием ячеек размером 5×5 мм.
| СРЕДСТВО ДЛЯ ЗАЖИВЛЕНИЯ КОЖНЫХ РАН ПЕРВИЧНЫМ НАТЯЖЕНИЕМ | 2004 |
|
RU2270007C2 |
| Способ моделирования инфицированной раны | 1989 |
|
SU1631576A1 |
| Способ моделирования нагноения послеоперационной раны | 1986 |
|
SU1420607A1 |
| СПОСОБ ЛЕЧЕНИЯ ИНФИЦИРОВАННЫХ РАН В ЭКСПЕРИМЕНТЕ | 2010 |
|
RU2460553C1 |
| ШАЛИМОВ С.А | |||
| Руководство по экспериментальной хирургии | |||
| - М.: Медицина, 1989 с.121-132 | |||
| СУХОВЕЙ Ю.Г | |||
| Репаративная регенерация трофических язв при использовании аллогенных прогениторных клеток | |||
| НИИ клинической иммунологии СО РАМН Тюменский | |||
Авторы
Даты
2014-03-20—Публикация
2013-01-21—Подача