Область изобретения
Настоящая группа изобретений относится к иммуногенам, иммуногенным композициям и фармацевтическим композициям, содержащим антигенный tau-пептид, который связан с иммуногенным носителем, таким как вирусоподобная частица (VLP), для лечения tau-ассоциированных неврологических расстройств или состояний, таких как болезнь Альцгеймера и умеренное когнитивное ухудшение. Изобретение также относится к способам получения этих иммуногенов, иммуногенных композиций и фармацевтических композиций и их применению в медицине.
Предшествующий уровень техники
Болезнь Альцгеймера, также называемая деменцией Альцгеймера или БА, представляет собой прогрессирующее нейродегенеративное расстройство или состояние, которое вызывает потерю памяти и серьезное психическое нарушение. БА представляет собой наиболее распространенную форму деменции, являясь причиной более половины всех деменций. По оценкам, более 26 миллионов человек по всему миру страдают от последствий БА, и ожидается, что это число увеличится в четыре раза к 2050 г. в результате старения населения (Brookmeyer et al., Alzheimer' s & Dementia 3:186-191 (2007)). Кроме потери людей и снижения качества жизни, экономические затраты общества являются огромными, учитывая, что средний пациент с БА живет от 8 до 10 лет после постановки диагноза и требует интенсивного ежедневного ухода. На ранней стадии пациенты, жалующиеся на легкую потерю памяти и спутанность сознания, характеризуются как страдающие от умеренного когнитивного ухудшения (MCI), которое в некоторых случаях прогрессирует до классических симптомов болезни Альцгеймера, приводящих к сильному ухудшению умственных и социальных способностей.
Болезнь Альцгеймера (БА) обычно характеризуется накоплением нейритных бляшек и нейрофибриллярных клубков в головном мозге, что приводит к гибели нервных клеток с последующим прогрессирующим снижением когнитивных способностей. Большинство доступных в настоящее время способов лечения БА направлены на лечение симптомов, но не обязательно останавливают развитие заболевания. Соответственно, ясно, что желательными являются новые подходы для выявления способов лечения, которые могут защитить нейроны от инвалидизирующих последствий БА.
Большинство современных терапевтических подходов в лечении БА основано на широко признанной "гипотезе амилоидного каскада". Эта концепция приписывает патофизиологическую роль амилоиду-β (Аβ) как нейро- и синаптотоксину в форме от мономерной до олигомерной, а также откладывающемуся в виде полимера в амилоидных бляшках, являющихся одним из характерных признаков патологии БА. Полагают, что моноклональные антитела против целого ряда форм Аβ являются эффективными, так как они сдвигают равновесие головной мозг-кровь в сторону крови, таким образом истощая запасы Аβ в головном мозге.
Патофизиология БА характеризуется не только отложением Аβ в сенильных бляшках, но также включает накопление нейрофибриллярных клубков (NFT). NFT представляют собой фибриллы, образованные спаренными спиральными филаментами, которые связаны вместе посредством гиперфосфорилированного тау-белка. Тау может быть случайным образом фосфорилирован различными киназами по более чем 30 различным остаткам серина и треонина (Hanger et al., J. Neurochem. 71:2465-2476 (1998)), а также нескольким остаткам тирозина (Lebouvier et al., JAD 18: 1-9 (2009)). Очевидно, при БА существует дисбаланс киназных и фосфатазных активностей, приводящий к гиперфосфорилированным формам тау-белка, которые агрегируют и накапливаются в виде NFT.
Умеренное когнитивное ухудшение (MCI) чаще всего определяют как наличие измеримого ухудшения памяти сверх обычно ожидаемого при старении, но еще не демонстрирование других симптомов деменции или БА. По-видимому, MCI представляет переходное состояние между когнитивными изменениями, связанными с нормальным старением, и ранними деменциями. Когда потеря памяти является преобладающим симптомом, тогда этот тип MCI дополнительно определяют как амнестическое MCI. Индивидуумы с этим подтипом MCI подвержены наибольшей вероятности прогрессирования до БА при скорости приблизительно 10-15% в год (Grundman M et al., Arch Neurol. 61, 59-66, 2004). Большое исследование, опубликованое в 2005 г., представляло собой первое клиническое испытание, продемонстрировавшее, что лечение пациентов с MCI может замедлить переход в БА в течение первого года испытания (Petersen RC et al., NEJM 352, 2379-2388, 2005), что означает, что эти пациенты также представляют популяцию, подходящую для терапевтического вмешательства в БА.
Недавнее исследование показало, что вакцинация против фосфорилированных тау-пептидов в модели клубков патологического тау у мышей приводила к уменьшению агрегированного тау в головном мозге и улучшениям при связанных с клубками поведенческих нарушениях (Asuni et al., J. Neurosci. 27:9115-9129 (2007)). Хотя влияние гиперфосфорилированных тау и NFT на потерю когнитивных способностей и прогрессирование БА не вполне понятно, современные представления сходятся в том, что нацеливание лишь на амилоид будет недостаточным для того, чтобы увидеть улучшение в течении заболевания, что делает необходимым поиск дополнительных или альтернативных мишеней (Oddo et al., J. Biol. Chem. 281:39413 (2006)). Поэтому для получения эффективной терапевтической вакцины против БА и MCI может быть необходим подход с активной вакциной, которая нацелена на связанные с заболеванием конформации тау-белка.
Кроме того, существует ряд заболеваний кроме БА и MCI, которые также связаны с тау-патологией или "таупатиями", которые потенциально могли бы выиграть от тау вакцины, специфически нацеленной на вовлеченные патологические формы. Эти заболевания включают в себя, например, лобно-височную деменцию, болезнь Паркинсона, болезнь Пика, прогрессирующий супрануклеарный паралич и комплекс бокового амиотрофического склероза/паркинсонизма-деменции (см., например, Spires-Jones et al., TINS 32:150-9(2009)).
Краткое изложение сущности изобретения
В настоящем изобретении предложены новые иммуногены, иммуногенные композиции и фармацевтические композиции, которые содержат по меньшей мере один антигенный тау-пептид, который способен индуцировать иммунный ответ, в частности антительные ответы, приводящие к титру антител против аутоантигена тау в его патологическом гиперфосфорилированном состоянии. Такие иммуногены, иммуногенные композиции и фармацевтические композиции демонстрируют многочисленные желательные свойства, такие как способность индуцировать иммунный ответ, в частности антительные ответы, с терапевтическим эффектом против возникновения и развития нейродегенеративных заболеваний, ассоциированных с гиперфосфорилированным тау, таких как болезнь Альцгеймера и МС1.
В одном аспекте в изобретении предложен иммуноген, содержащий по меньшей мере один антигенный тау-пептид, связанный с иммуногенным носителем, где указанный антигенный тау-пептид содержит фосфо-тау эпитоп, выбранный из pSer-396 фосфо-тау эпитопа, pThr-231/pSer-235 фосфо-тау эпитопа, pThr-231 фосфо-тау эпитопа, pSer-235 фосфо-тау эпитопа, pThr-212/pSer-214 фосфо-тау эпитопа, pSer-202/pThr-205 фосфо-тау эпитопа и эпитопа.
В одном примере указанный фосфо-тау эпитоп представляет собой pSer-396 фосфо-тау эпитоп. В другом примере указанный фосфо-тау эпитоп представляет собой pThr-231/pSer-235 фосфо-тау эпитоп. В другом примере указанный фосфо-тау эпитоп представляет собой pThr-231 фосфо-тау эпитоп. В другом примере указанный фосфо-тау эпитоп представляет собой pSer-235 фосфо-тау эпитоп. В другом примере указанный фосфо-тау эпитоп представляет собой pThr-212/pSer-214 фосфо-тау эпитоп. В другом примере указанный фосфо-тау эпитоп представляет собой pSer-202/pThr-205 фосфо-тау эпитоп.В другом примере указанный фосфо-тау эпитоп представляет собой pTyr-18 фосфо-тау эпитоп.
В другом аспекте в изобретении предложен иммуноген, содержащий по меньшей мере один антигенный тау-пептид, связанный с иммуногенным носителем, где указанный антигенный тау-пептид содержит аминокислотную последовательность, выбранную из SEQ ID NO:4, 6-26, 105 и 108-112.
В одном примере указанный антигенный тау-пептид ковалентно связан с указанным иммуногенным носителем посредством линкера, представленного формулой (G)nC, где указанный линкер находится либо на С-конце (пептид-(G)nC), либо на М-конце (С(G)n-пептид) указанного пептида, и где n равно 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10. В другом примере указанный линкер находится на N-конце указанного тау-пептида, и n равно 1 или 2. В другом примере указанный линкер находится на С-конце указанного тау-пептида, и n равно 1 или 2. В другом примере указанный антигенный тау-пептид содержит аминокислотную последовательность, выбранную из SEQ ID NO:4 и 6-13. В другом примере указанный антигенный тау-пептид состоит из аминокислотной последовательности, выбранной из SEQ ID NO:4 и 6-13. В другом примере указанный антигенный тау-пептид состоит из аминокислотной последовательности, представленной в SEQ ID NO:11.
В другом примере указанный антигенный тау-пептид содержит аминокислотную последовательность, выбранную из SEQ ID NO:14-19. В другом примере указанный антигенный тау-пептид состоит из аминокислотной последовательности, выбранной из SEQ ID NO:14-19. В другом примере указанный антигенный тау-пептид состоит из аминокислотной последовательности, представленной в SEQ ID NO:16.
В другом примере указанный антигенный тау-пептид содержит аминокислотную последовательность, выбранную из SEQ ID NO:20-24. В другом примере указанный антигенный тау-пептид состоит из аминокислотной последовательности, выбранной из SEQ ID NO:20-24. В другом примере указанный антигенный тау-пептид состоит из аминокислотной последовательности, представленной в SEQ ID NO:21.
В другом примере указанный антигенный тау-пептид содержит аминокислотную последовательность, выбранную из SEQ ID NO:105 и 108-112. В другом примере указанный антигенный тау-пептид состоит из аминокислотной последовательности, выбранной из SEQ ID NO:105 и 108-112. В другом примере указанный антигенный тау-пептид состоит из аминокислотной последовательности, представленной в SEQ ID NO:105.
В одном аспекте в настоящем изобретении предложен любой из иммуногенов, описанных в данной заявке, где указанный иммуногенный носитель представляет собой гемоцианин (такой как KLH (гемоцианин лимфы улитки)), сывороточный альбумин, глобулин, белок, экстрагированный из аскарид, или инактивированный бактериальный токсин.
В одном аспекте в настоящем изобретении предложен любой из иммуногенов, описанных в данной заявке, где указанный иммуногенный носитель представляет собой вирусоподобную частицу, выбранную из группы, состоящей из HBcAg VLP, HBsAg VLP и Qbeta VLP. В одном примере в изобретении предложена композиция, содержащая по меньшей мере два иммуногена, как описано в данной заявке. В другом примере композиция содержит по меньшей мере три иммуногена, как описано в данной заявке.
В одном примере в настоящем изобретении предложена композиция, содержащая по меньшей мере два иммуногена, как описано в данной заявке, где:
а) антигенный тау-пептид первого иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:4 и 6-13; и
б) антигенный тау-пептид второго иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:14-19.
В другом примере в настоящем изобретении предложена композиция, содержащая по меньшей мере два иммуногена, как описано в данной заявке, где:
а) антигенный тау-пептид первого иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:4 и 6-13; и
б) антигенный тау-пептид второго иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:20-24.
В другом примере в изобретении предложена композиция, содержащая по меньшей мере два иммуногена, как описано в данной заявке, где:
а) антигенный тау-пептид первого иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:14-19; и
б) антигенный тау-пептид второго иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:20-24.
В другом примере в настоящем изобретении предложена композиция, содержащая по меньшей мере два иммуногена, как описано в данной заявке, где:
а) антигенный тау-пептид первого иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:4 и 6-13; и
б) антигенный тау-пептид второго иммуногена, выбранный из SEQ ID NO:105 и 108-112.
В другом примере в настоящем изобретении предложена композиция, содержащая по меньшей мере два иммуногена, как описано в данной заявке, где:
а) антигенный тау-пептид первого иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:14-19; и
б) антигенный тау-пептид второго иммуногена выбран из SEQ ID NO:105 и 108-112.
В другом примере в настоящем изобретении предложена композиция, содержащая по меньшей мере два иммуногена, как описано в данной заявке, где:
а) антигенный тау-пептид первого иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:20-24; и
б) антигенный тау-пептид второго иммуногена, выбранный из SEQ ID NO:105 и 108-112.
В другом примере в изобретении предложена композиция, содержащая по меньшей мере три из четырех иммуногенов, как описано в данной заявке, где:
а) антигенный тау-пептид первого иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:4 и 6-13;
б) антигенный тау-пептид второго иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:14-19; и
в) антигенный тау-пептид третьего иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:20-24.
г) антигенный тау-пептид четвертого иммуногена, выбранный из SEQ ID NO:105 и 108-112.
В другом примере в изобретении предложена любая из композиций, описанных в данной заявке, где каждый из указанных антигенных тау-пептидов независимо ковалентно связан с указанным иммуногенным носителем посредством линкера, представленного формулой (G)nC, где каждый из указанных линкеров независимо находится либо на С-конце (пептид-(С)nG), либо на N-конце (С(G)n-пептид) указанного тау-пептида, и где каждое n независимо равно 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10. В другом примере в изобретении предложена любая из композиций, описанных в данной заявке, где каждый из указанных линкеров находится на N-конце тау-пептида, и где каждое n независимо равно 1 или 2.
В другом аспекте в настоящем изобретении предложена композиция, содержащая по меньшей мере три из четырех иммуногенов, где:
а) первый иммуноген содержит по меньшей мере один антигенный тау-пептид, связанный с Qbeta VLP, где указанный антигенный тау-пептид состоит из SEQ ID NO:11, и где указанный пептид ковалентно связан с указанной VLP посредством линкера, представленного формулой (G)nC, где указанный линкер находится либо на С-конце (пептид-(G)nC), либо на N-конце (С(G)n-пептид) указанного тау-пептида, и где n равно 1 или 2;
б) второй иммуноген содержит по меньшей мере один антигенный тау-пептид, связанный с Qbeta VLP, где указанный антигенный тау-пептид состоит из SEQ ID NO:16, и где указанный пептид ковалентно связан с указанной VLP посредством линкера, представленного формулой (G)nC, где указанный линкер находится либо на С-конце (пептид-(G)nC), либо на N-конце (С(G)n-пептид) указанного тау-пептида, и где n равно 1 или 2; и
в) третий иммуноген содержит по меньшей мере один антигенный тау-пептид, связанный с Qbeta VLP, где указанный антигенный тау-пептид состоит из SEQ ID NO:21, и где указанный пептид ковалентно связан с указанной VLP посредством линкера, представленного формулой (G)nC, где указанный линкер находится либо на С-конце (пептид-(G)nC), либо на N-конце (С(G)n-пептид) указанного тау-пептида, и где n равно 1 или 2.
г) четвертый иммуноген содержит по меньшей мере один антигенный тау-пептид, связанный с Qbeta VLP, где указанный антигенный тау-пептид состоит из SEQ ID NO:105, и где указанный пептид ковалентно связан с указанной VLP посредством линкера, представленного формулой (G)nC, где указанный линкер находится либо на С-конце (пептид-(G)nC), либо на N-конце (G(С)n-пептид) указанного тау-пептида, и где n равно 1 или 2.
В одном примере каждый из линкеров первого, второго и третьего иммуногенов находятся на N-конце каждого из антигенных тау-пептидов и где для каждого из указанных линкеров n равно 2.
В другом аспекте в настоящем изобретении предложена композиция, содержащая любые из иммуногенов или композиций, описанных в данной заявке, дополнительно содержащая по меньшей мере один адъювант, выбранный из квасцов, CpG-содержащих олигонуклеотидов и адъювантов на основе сапонина.
В другом аспекте в настоящем изобретении предложена фармацевтическая композиция, содержащая любые из иммуногенов или композиций, описанных в данной заявке, и фармацевтически приемлемый эксципиент. В одном примере по меньшей мере один адъювант представляет собой CpG-содержащий олигонуклеотид, выбранный из CpG 7909 (SEQ ID NO:27), CpG 10103 (SEQ ID NO:28) и CpG 24555 (SEQ ID NO:29).
В другом аспекте в настоящем изобретении предложена фармацевтическая композиция, содержащая любые из иммуногенов или композиций, описанных в данной заявке, и фармацевтически приемлемый эксципиент.
В другом аспекте в настоящем изобретении предложен способ иммунизации, включающий введение млекопитающему любого(й) из иммуногенов, композиций или фармацевтических композиций, описанных в данной заявке. Например, в одном аспекте такое введение осуществляют с использованием фармацевтически эффективной дозы любого(й) из иммуногенов, композиций или фармацевтических композиций, описанных в данной заявке.
В другом аспекте в изобретении предложен способ лечения тау-ассоциированного неврологического расстройства у млекопитающего, включающий введение указанному млекопитающему терапевтически эффективного количества любого(й) из иммуногенов, иммуногенных композиций или фармацевтических композиций, описанных в данной заявке.
В одном аспекте такое введение осуществляют с использованием фармацевтически эффективной дозы любого(й) из иммуногенов, композиций или фармацевтических композиций, описанных в данной заявке.
В другом аспекте в изобретении предложен способ лечения тау-ассоциированного неврологического расстройства у млекопитающего, включающий введение указанному млекопитающему: а) фармацевтически эффективной дозы любого(й) из иммуногенов, иммуногенных композиций или фармацевтических композиций, описанных в данной заявке; и б) фармацевтически эффективной дозы по меньшей мере одного адъюванта. В одном примере по меньшей мере один адъювант выбран из квасцов, CpG-содержащих олигонуклеотидов и адъювантов на основе сапонина. В другом примере по меньшей мере один адъювант представляет собой CpG-содержащий олигонуклеотид, выбранный из CpG 7909 (SEQ ID NO:27), CpG 10103 (SEQ ID NO:28) и CpG 24555 (SEQ ID NO:29).
В другом примере указанное неврологическое расстройство представляет собой болезнь Альцгеймера. В другом примере указанное неврологическое расстройство диагностировано как умеренное когнитивное ухудшение. В другом примере указанное неврологическое расстройство диагностировано как амнестическое MCI.
В другом примере в изобретении предложено применение любого(й) из иммуногенов, композиций или фармацевтических композиций, описанных в данной заявке, для изготовления лекарственного средства. Например, в одном аспекте такие лекарственные средства могут быть использованы для лечения тау-ассоциированного неврологического расстройства у млекопитающего. В одном примере указанное неврологическое расстройство представляет собой болезнь Альцгеймера. В другом примере указанное неврологическое расстройство диагностировано как умеренное когнитивное ухудшение (MCI). В другом примере указанное неврологическое расстройство диагностировано как амнестическое MCI.
В другом аспекте в изобретении предложено выделенное антитело, которое продуцируется в ответ на любой из способов иммунизации, описанных в данной заявке, где указанное антитело специфически связывается с гиперфосфорилированной формой человеческого тау.
В другом аспекте в изобретении предложен способ лечения тау-ассоциированного неврологического расстройства у млекопитающего, включающий введение указанному млекопитающему антитела, которое специфически связывается с гиперфосфорилированной формой человеческого тау, и где указанное антитело продуцируется в ответ на любой из способов иммунизации, описанных в данной заявке.
В другом аспекте в изобретении предложено применение любого из антител, описанных в данной заявке, для изготовления лекарственного средства для лечения тау-ассоциированного неврологического расстройства у млекопитающего. В одном примере указанное неврологическое расстройство представляет собой болезнь Альцгеймера. В другом примере указанное неврологическое расстройство диагностировано как умеренное когнитивное ухудшение (MCI). В другом примере указанное неврологическое расстройство диагностировано как амнестическое MCI.
В другом аспекте в настоящем изобретении предложен выделенный пептид, состоящий или по существу состоящий из аминокислотной последовательности, выбранной из SEQ ID NO:4, 6-26, 31-76 и 105-122. В другом аспекте в настоящем изобретении предложена выделенная нуклеиновая кислота, которая кодирует любой из указанных выделенных пептидов. В другом аспекте в настоящем изобретении предложен экспрессирующий вектор, содержащий любую из указанных нуклеиновых кислот. В другом аспекте в настоящем изобретении предложена клетка-хозяин, содержащая любой из указанных векторов экспрессии.
Краткое описание графических материалов
На Фиг.1А и 1Б представлено описание групп мышей Balb/c, которых иммунизировали подкожно, и результаты титров и селективности, как описано в Примере 5. Мышей Balb/c иммунизировали подкожно с использованием 300 мкг пептида, 100 мкг пептида-KLH или 100 мкг пептида-VLP. Где указано, 50 мкл TiterMax Gold (Alexis Biochemicals) использовали в качестве адъювантов. Разведения сыворотки, тестируемые в анализе определения антиген-специфического титра (см. Пример 13), варьировались от 1:30 до 1:7290.
На Фиг.2 представлено описание групп мышей Balb/c, которых иммунизировали, и результаты титров, как описано в Примере 5. Мышей Balb/c иммунизировали подкожно. Где указано, 50 мкл TiterMax Gold использовали в качестве адъюванта. Разведения сыворотки, тестируемые в анализе определения антиген-специфического титра (см. Пример 13), варьировались от 1:900 до 1:1968300.
На Фиг.3 представлено описание мышей Balb/c, которых иммунизировали подкожно, как описано далее в Примере 6. 100 мкг пептида использовали для первичной (prime) иммунизации и 100 мкг пептида-VLP использовали для вторичных (boosts) иммунизации (реиммунизаций). Где указано, 750 мкг квасцов (Al(ОН)3) использовали в качестве адъювантов. Разведения сыворотки, тестируемые в анализе определения антиген-специфического титра (см. Пример 13), варьировались от 1:800 до 1:1750000. н/о означает не определяли.
На Фиг.4А, 4Б и 4В показаны результаты на мышах TG4510++, которых иммунизировали внутримышечно, как описано в Примере 7. На Фиг.4А показана результаты титров для Групп 1-7, тогда как на Фиг.4Б показаны результаты титров для Групп 8-17. На Фиг.4В показаны результаты селективности для Групп 1-6. CPG представляет собой CpG-24555. Квасцы представляют собой Al(ОН)3. Разведения сыворотки, тестируемые в анализе определения антиген-специфического титра (см. Пример 13), варьировались от 1:5000 до 1:15800000. н/о означает не определяли.
На Фиг.5 представлено описание мышей, которых иммунизировали, как описано в Примере 8. Мышей Balb/c иммунизировали либо внутримышечным (в/м), либо подкожным (п/к) путем. Где указано, использовали 90 мкг пептида-VLP. Где указано, использовали 1,595 мкг квасцов (Al(ОН)3), 20 мкг CpG-24555 и 12 мкг ABISCO-100. Разведения сыворотки, тестируемые в анализе определения антиген-специфического титра (см. Пример 13), варьировались от 1:5000 до 1:15800000. Нижний предел определения стандартной кривой составлял 0,0025 мг/мл. NA означает не применимо.
На Фиг.6 представлено описание мышей, которых иммунизировали, как описано в Примере 11. Мышей Balb/c иммунизировали внутримышечно. Использовали 100 мкг пептида-VLP. Где указано, использовали 252 (750) мкг квасцов (Al(ОН)3). Разведения сыворотки, тестируемые в анализе определения антиген-специфического титра (см. Пример 13), варьировались от 1:500 до 1:2720000. н/о означает не определяли.
На Фиг.7 представлено описание мышей, которых иммунизировали, как описано в Примере 11. Мышей Balb/c иммунизировали внутримышечно. 750 мкг квасцов (Al(ОН)3) использовали в качестве адъюванта. Разведения сыворотки, тестируемые в анализе определения антиген-специфического титра (см. Пример 13), варьировались от 1:500 до 1:15800000.
На Фиг.8 представлено описание мышей, которых иммунизировали, как описано в Примере 12. Мышей TG4510-/- (однопометные животные дикого типа) иммунизировали внутримышечно. 100 мкг каждого пептида-VLP использовали для 0-х суток (первичная иммунизация) и 14-х суток (реиммунизация), как указано. Использовали указанное количество квасцов (Al(ОН)3). Сыворотки из группы 'Без обработки' объединяли. Разведения сыворотки, тестируемые в анализе определения антиген-специфического титра (см. Пример 13), варьировались от 1:5000 до 1:15800000.
На Фиг.9 представлено описание мышей, которых иммунизировали, как описано в Примере 12. Мышей TG4510-/- (однопометные животные дикого типа) иммунизировали внутримышечно. 100 мкг каждого пептида-VLP использовали для 0-х суток (первичная иммунизация) и 14-х суток (реиммунизация). Использовали без квасцов или с 504 мкг квасцов (Al(ОН)3). Селезенки собирали на 21-е сутки. Показаны количества точек на 5×105 клеток селезенки, как измерено посредством ELIspot анализа Т-клеток, секретирующих интерферон-гамма (см. Пример 14). Результаты получены из пула 3 селезенок. Пептид HBV-1 (SEQ ID NO:77) представлял собой неродственный пептид. БСА представлял собой неродственный белок, н/о означает не определяли. * означает р<0,05 против неродственного пептида или белка, в зависимости от ситуации.
На Фиг.10 показана аминокислотная последовательность тау-изоформы 2 человека, Genbank № доступа NP_005901 (SEQ ID NO:30).
Подробное описание
Определения и общие методы
Если не определено иное в данной заявке, научные и технические термины, используемые в связи с настоящим изобретением, должны иметь значения, которые обычно понятны средним специалистам в данной области. В общем, используемые номенклатура и методы клеточной и тканевой культуры, молекулярной биологии, иммунологии, микробиологии, генетики и химии белков и нуклеиновых кислот, гибридизации, аналитической химии, синтетической органической химии и медицинской и фармацевтической химии, описанные в данной заявке, представляют собой номенклатуру и методы, хорошо известные и обычно использующиеся в данной области.
Способы и методы по настоящему изобретению обычно осуществляют в соответствии с традиционными способами, хорошо известными в данной области, и как описано в различных общих и более конкретных источниках, которые цитируются и обсуждаются в настоящем описании, если не указано иное. См., например, Sambrook J. & Russell D. Molecular Cloning: A Laboratory Manual, 3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2000); Ausubel et al., Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, Wiley, John & Sons, Inc. (2002); Harlow and Lane Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1998); и Coligan et al., Short Protocols in Protein Science, Wiley, John & Sons, Inc. (2003). Ферментативные реакции и методы очистки проводят в соответствии с рекомендациями производителя, как обычно осуществляется в данной области или как описано в данной заявке.
Термин "умеренное когнитивное ухудшение (MCI)", как использовано в данной заявке, относится к категории ухудшения памяти и когнитивных способностей, которое обычно характеризуется клиническим рейтингом деменции (CDR) 0,5 (см., например, Hughes et al., Brit. J. Psychiat. 140: 566-572, 1982) и дополнительно характеризуется ухудшением памяти, но не ухудшением функции в других когнитивных областях. Ухудшение памяти предпочтительно измеряют с использованием тестов, таких как "тест способности понять основную мысль отрывка" ("paragraph test"). Пациент с диагностированным умеренным когнитивным ухудшением часто демонстрирует ухудшенную способность отсроченного припоминания. Умеренное когнитивное ухудшение в большинстве случаев связано со старением и обычно встречается у пациентов в возрасте 45 лет или старше.
Термин "деменция", как использовано в данной заявке, относится к психическому расстройству в его наиболее широком смысле, как определено в American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders (Американская ассоциация психиатров: диагностическое и статистическое руководство по психическим болезням), Fourth Edition, Washington, D.С., 1994 ("DSM-IV"). DSM-IV определяет "деменцию" как характеризующуюся множественными когнитивными расстройствами, которые включают в себя ухудшения памяти, и перечисляет различные деменции согласно предполагаемой этиологии. DSM-IV излагает общепринятый стандарт для такой диагностики, категоризации и лечения деменции и ассоциированных психических расстройств.
Термины "Тау" или "тау-белок" относятся к тау-белку, который связан со стабилизацией микротрубочек в нервных клетках и представляет собой компонент широкого спектра тау-агрегатов, например нейрофибриллярных клубков. В частности, термин "тау-белок", как использовано в данной заявке, охватывает любой полипептид, содержащий или состоящий из человеческого тау с SEQ ID NO:30, или другие человеческие изоформы с модификациями или без модификаций, или соответствующие ортологи от любых других животных. Термин "тау-белок", как использовано в данной заявке, также охватывает посттрансляционные модификации, включая, но не ограничиваясь этим, гликозилирования, ацетилирования и фосфорилирования тау-белка, как определено выше.
Термин "таупатия" относится к тау-ассоциированным расстройствам или состояниям, например, болезни Альцгеймера, прогрессирующему супрануклеарному параличу (PSP), кортико-базальной дегенерации (CBD), болезни Пика, лобно-височной деменции и паркинсонизму, ассоциированному с хромосомой 17 (FTDP-17), болезни Паркинсона, инсульту, травматическому повреждению головного мозга, умеренному когнитивному ухудшению и тому подобному.
Термины "антиген" и "иммуноген", которые, как подразумевается в данной заявке, используются взаимозаменяемо, относятся к молекуле, способной связываться антителом, В-клеточным рецептором (BCR) или Т-клеточным рецептором (TCR), если он представлен молекулами МНС.Термины "антиген" и "иммуноген", как использовано в данной заявке, также охватывают Т-клеточные эпитопы. Кроме того, антиген может распознаваться иммунной системой и/или способен индуцировать гуморальный иммунный ответ и/или клеточный иммунный ответ, приводящий к активации В- и/или Т-лимфоцитов. Однако это может потребовать, по меньшей мере в некоторых случаях, чтобы антиген содержал или был связан с Т-хелперным клеточным эпитопом и обеспечивался адъювантом. Антиген может иметь один или более эпитопов (например, В- и Т-эпитопов). Предполагают, что специфическая реакция, рассмотренная выше, указывает, что антиген будет предпочтительно реагировать, обычно высокоселективным образом, с его соответствующим антителом или TCR, а не с множеством других антител или TCR, которые могут быть индуцированы другими антигенами. Антигены, как использовано в данной заявке, также могут представлять собой смеси нескольких индивидуальных антигенов. Оба термина "антиген" и "иммуноген" охватывают, но не ограничиваются этим, полипептиды.
Термины "антигенный сайт" и термин "антигенный эпитоп", которые используются в данной заявке взаимозаменяемо, относятся к непрерывным или прерывистым участкам полипептида, которые могут быть иммуноспецифически связаны антителом или Т-клеточным рецептором в контексте молекулы МНС. Иммуноспецифическое связывание исключает неспецифическое связывание, но не всегда исключает перекрестную реактивность. Антигенные сайты обычно содержат от 5 до 10 аминокислот в пространственной конформации, которая является уникальной для антигенного сайта.
Как использовано в данной заявке, термин "фосфорилированный" в отношении аминокислотного остатка относится к присутствию фосфатной группы на боковой цепи данного остатка, где иначе обычно присутствует гидроксильная группа. Такое фосфорилирование обычно осуществляется как замена атома водорода из гидроксильной группы на фосфатную группу (-РО3Н2). Как известно специалистам в данной области, в зависимости от рН локального окружения, эта фосфатная группа может существовать в виде незаряженной, нейтральной группы (-РО3Н2), или с одинарным (-РО3Н-) или двойным (-РО3 2-) отрицательным зарядом. Аминокислотные остатки, которые могут быть обычно фосфорилированы, включают в себя боковые цепи серина, треонина и тирозина. В настоящем изобретении фосфорилированный аминокислотный остаток показан жирным шрифтом и подчеркнут.
Как использовано в данной заявке, ссылки на аминокислотные остатки обозначены однобуквенным или трехбуквенным кодом (см., например, Lehninger, Biochemistry, 2nd edition, Worth Publishers, New York, 1975, p.72).
Единственное число используется в данной заявке со ссылкой на один или более чем один (т.е. по меньшей мере одним) грамматический объект. В качестве примера, "элемент" означает один элемент или более чем один элемент. Кроме того, если иное не требуется контекстом, термины в единственном числе должны включать множественность, а термины во множественном числе должны включать единственность, если контекст явно не требует иного.
Термин "пептид" или "полипептид" относится к полимеру из аминокислот независимо от длины полимера; таким образом, фрагменты белка, олигопептиды и белки включены в определение пептида или полипептида. Этот термин также не определяет или не исключает постэкспрессионные модификации полипептидов, например полипептидов, которые включают ковалентное присоединение гликозильных групп, ацетильных групп, фосфатных групп, липидных групп и тому подобного, однозначно охвачены термином "полипептид". В данное определение также включены полипептиды, которые содержат один или более аналогов аминокислоты (включая, например, не встречающиеся в природе аминокислоты, аминокислоты, которые встречаются в природе тольно в не неродственной биологической системе, модифицированные аминокислоты из систем млекопитающих и т.д.), полипептиды с замещенными связями, а также другие модификации, известные в данной области, как природные, так и не природные.
Термин "тау-фрагмент", как использовано в данной заявке, охватывает любой полипептид, содержащий, или состоящий из, по меньшей мере 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, или 30 последовательных аминокислот тау-белка, как определено в данной заявке.
Термин "pSer-396 фосфо-тау эпитоп", как использовано в данной заявке, относится к пептиду, содержащему аминокислотную последовательность KSP (т.е. Lys-395 Ser-396 Pro-397 из человеческой тау-последовательности), где остаток серина является фосфорилированным, и где нумерация последовательности основана на человеческой тау-изоформе 2, которая предложена в виде SEQ ID NO:30. pSer-396 фосфо-тау эпитоп обычно имеет длину от примерно 3 до примерно 25 аминокислот.
Термин "pThr-231/pSer-235 фосфо-тау эпитоп", как использовано в данной заявке, относится к пептиду, содержащему аминокислотную последовательность TPPKS (SEQ ID NO:1) (т.е. Thr-231 Pro-232 Pro-233 Lys-234 Ser-235 из человеческой тау-последовательности), где каждый из остатков треонина и серина является фосфорилированным, и где нумерация последовательности основана на человеческой тау-изоформе 2, которая предложена в виде SEQ ID NO:30. Такие эпитопы обычно имеют длину от примерно 5 до примерно 25 аминокислот. pThr-231/pSer-235 фосфо-тау эпитоп также может относиться к форме этого эпитопа, который содержит фосфорилированный остаток Thr-231, но не включает фосфорилированный остаток Ser-235, или содержит фосфорилированный остаток Ser-235, но не включают фосфорилированный эпитоп Thr-231. Такие варианты этого эпитопа обычно имеют длину от примерно 3 до примерно 20 аминокислот.
Термин "pThr-212/pSer-214 фосфо-тау эпитоп", как использовано в данной заявке, относится к пептиду, содержащему аминокислотную последовательность TPS (т.е. Thr-212 Pro-213 Ser-214 из человеческой тау-последовательности), где каждый из остатков треонина и серина является фосфорилированным, и где нумерация последовательности основана на человеческой тау-изоформе 2, которая предложена в виде SEQ ID NO:30. pThr-212/pSer-214 фосфо-тау эпитоп обычно имеет длину от примерно 3 до примерно 25 аминокислот.
Термин "pSer-202/pThr-205 фосфо-тау эпитоп", как использовано в данной заявке, относится к пептиду, содержащему аминокислотную последовательность SPGT (SEQ ID NO:3) (т.е. Ser-202 Pro-203 Gly-204 Thr-205 из человеческой тау-последовательности), где каждый из остатков треонина и серина является фосфорилированным, и где нумерация последовательности основана на человеческой тау-изоформе 2, которая предложена в виде SEQ ID NO:30. pSer-202/pThr-205 фосфо-тау эпитоп обычно имеет длину от примерно 4 до примерно 25 аминокислот.
Термины "очищенный" и "выделенный", как использовано в данной заявке, являются синонимами. Например, термины "выделенный" или "очищенный" в отношении полипептида относятся к полипептиду, который в силу своего происхождения или источника получения (1) не связан с естественно ассоциированными компонентами, которые сопровождают его в его нативном состоянии, (2) является по существу свободным от других белков из того же вида, (3) экспрессируется клеткой из другого вида, или (4) не встречается в природе. Таким образом, полипептид, который синтезирован химически или синтезирован в клеточной системе, отличной от клетки, из которой он происходит в природе, будет "отделяться" от его естественно ассоциированных компонентов. Полипептид также может быть превращен по существу в свободный от естественно связанных компонентов путем выделения с использованием методов очистки белка, хорошо известных в данной области. Полипептид является "по существу чистым", "по существу гомогенным" или "по существу очищенным", когда по меньшей мере примерно от 60 до 75% образца проставляет собой один вид полипептида. Полипептид может быть мономерным или мультимерным. По существу чистый полипептид обычно может содержать примерно 50%, 60%, 70%, 80% или 90% масс./масс. полипептидного образца, более типично примерно 95%, и предпочтительно может иметь чистоту более 99%. Чистота или гомогенность белка может быть показана несколькими способами, хорошо изввестными в данной области, такими как электрофорез образца белка в полиакриламидном геле с последующей визуализацией одной полипептидной полосы при окрашивании геля красителем, хорошо известным в данной области. Для некоторых целей более высокие разрешения могут быть достигнуты с использованием HPLC (высокоэффективная жидкостная хроматография) или другого способа, хорошо известного в данной области для очистки.
Термин "тау-ассоциированное неврологическое расстройство", как использовано в данной заявке, означает любое заболевание или другое состояние в котором тау (особенно гиперфосфорилированные формы тау), как полагают, играет роль. Такие расстройства, заболевания и/или состояния обычно коррелируют с присутствием нейрофибриллярных клубков (обычно включающих гиперфосфорилированные формы тау) и включают в себя, без ограничения, болезнь Альцгеймера, MCI, лобно-височную деменцию, болезнь Пика, прогрессирующий нуклеарный паралич, кортико-базальную дегенерацию, комплекс паркинсонизма-деменции острова Гуам и другие таупатии.
Термин "антигенный тау-пептид", как использовано в данной заявке, охватывает все тау-происходящие полипептиды, такие как происходящие из млекопитающих, например человека, а также их варианты, аналоги, ортологи, гомологи и производные, и его фрагменты, которые демонстрируют "биологическую активность антигенного тау-пептида". Например, термин "антигенный тау-пептид" относится к полипептидам, содержащим, состоящим из или по существу состоящим из аминокислотной последовательности, выбранной из SEQ ID NO:1-26, 31-76 и 105-122, а также к их вариантам, гомологам и производным, демонстрирующим по существу такую же биологическую активность.
Термин "биологическая активность антигенного тау-пептида", как использовано в данной заявке, относится к способности антигенных тау-пептидов по изобретению индуцировать ауто-тау-антитела у субъекта с антагонистическим профилем, где такие ауто-антитела способны уменьшать уровень гиперфосфорилированных, патологических форм тау, но по существу не способны связываться с нормальными негиперфосфорилированными, непатологическими формами тау. Кроме того, антигенный тау-пептид, который обладает биологической активностью антигенного тау-пептида, может быть сконструирован для минимизации тау-специфического Т-клеточного ответа при введении пациенту. Специалистам в данной области будут очевидны методы, которые могут быть использованы для определения того, попадает или не попадает конкретная конструкция в объем настоящего изобретения. Такие методы включают в себя, но не ограничиваются этим, методы, описанные в разделе Примеров настоящего изобретения, а также следующие. Пептид с предполагаемой биологической активностью антигенного тау-пептида может быть проанализирован для установления иммуногенности пептида (например, для определения того, будут ли антисыворотки, индуцированные предполагаемым пептидом, связывать гиперфосфорилированные формы тау, но по существу не связывать негиперфосфорилированные, непатологические формы тау). Кроме того, пептид с предполагаемой биологической активностью антигенного тау-пептида может быть проанализирован для определения того, индуцирует ли пептид или по существу не индуцирует тау-специфический, опосредованный Т-клетками ответ.
Термин "гиперфосфорилированный" или "аномально фосфорилированный", как использовано в данной заявке, относится к тау, который содержит по меньшей мере примерно 7 (т.е. примерно 7 или более) фосфатных групп на молекулу тау (см., например, Kopke et al., J. Biol Chem 268:24374-84 (1993)). Гиперфосфорилированный тау представляет собой основной компонент нейрофибриллярных клубков (NFT) и спаренных спиральных филаментов (PHF), обнаруживаемых у пациентов с БА, и гиперфосфорилирование отвечает за потерю тау нормальной биологической активности и аутоагрегацию. Некоторые остатки тау обычно обнаруживаются фосфорилированными только в его патологических гиперфосфорилированных формах, таких как PHF и NFT. Такие остатки включают Ser-202, Thr-205, Thr-212, Ser-214, Thr-231, Ser-235, Ser-396 и/или Ser-404, Tyr-18. Поэтому тау-белки, фосфорилированные по множественным сайтам, обычно не вовлеченным в связывание тау с микротрубочками, в частности по сайтам, обнаруженным в пролин-богатых участках, фланкирующих участок связывания тау с микротрубочками и содержащих основной компонент PHF и NFT, также включены в термин "гиперфосфорилированный тау" или "аномально фосфорилированный тау".
Антигенные тау-пептиды
Тау-белок человека представляет собой ассоциированный с микротрубочками белок, который относительно широко распространен в нейронах центральной нервной системы, но менее распространен в других участках. В ткани головного мозга тау существует в виде шести различных изоформ, являющихся результатом альтернативного сплайсинга в экзонах 2, 3, и 10 гена тау. Человеческую тау-изоформу 2 (SEQ ID NO:30) используют в данной заявке в качестве сравнения для нумерации аминокислот всех тау-пептидов по настоящему изобретению. Тау обычно взаимодействует с тубулином для стабилизации микротрубочек и стимулирует сборку тубулина в микротрубочки, а также обеспечивает аксональный транспорт белков. Тау представляет собой регулируемый в процессе развития фосфобелок, обычно содержащий от 2 до 3 фосфатных групп на молекулу в его нормальном состоянии в головном мозге взрослого человека. Однако тау может быть случайным образом фосфорилирован различными киназами по более чем 30 различным остаткам, в основном по мотиву Ser/Thr-Pro (Hanger et al., J. Neurochem. 71:2465-2476 (1998)).
Антигенные тау-пептиды по настоящему изобретению обычно будут иметь небольшой размер, так что они имитируют участок целого тау-белка, в котором обнаруживается эпитоп в патологической форме тау. Как описано ранее, такие патологическое формы тау обычно характеризуется фосфорилированим по некоторым аминокислотам в тау-белке. Поэтому антигенные тау-пептиды по изобретению обычно имеют длину менее 100 аминокислот, например менее 75 аминокислот, например менее 50 аминокислот. Антигенные тау-пептиды по изобретению обычно имеют длину примерно 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или примерно 30 аминокислот. Конкретные примеры антигенных тау-пептидов по изобретению, представленные в перечне последовательностей, включают в себя пептиды, длина которых варьируется от 4 до 31 аминокислоты. Как будет очевидно специалистам в данной области, такие антигенные пептиды обычно имеют свободный N-конец и могут иметь либо карбоксилированный, либо амидированный С-конец.
Антигенные пептиды по изобретению содержат аминокислотную последовательность, происходящую из участка человеческого тау в его гиперфосфорилированной или патологической форме. В частности, такие антигенные тау-пептиды обычно будут содержать специфические фосфо-тау эпитопы, которые могут быть описаны в литературе со ссылкой на антитела, которые связывают эти эпитопы (такие как PHF1, TG3, АТ8 и/или АТ100; см., например, Hanger et al., J. Biol. Chem. 282 (32):23645-23654 (2007); Pennanen et al., Biochem. Biophys. Res. Comm. 337:1097-1101 (2005); Porzig et al., Biochem. Biophys. Res. Comm. 358:644-649 (2007)).
В настоящем изобретении были идентифицированы специфические антигенные участки человеческого тау-белка, которые при использовании отдельно или в комбинации друг с другом могут быть с пользой использованы для индукции иммунного ответа против патологических форм гиперфосфорилированного тау. Например, pSer-396 фосфо-тау эпитоп представляет собой обычно фрагмент человеческого тау, который включает фосфорилированный остаток серина Ser-396. Такие фрагменты обычно имеют длину от примерно 3 до примерно 20 аминокислот (например, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20) и включают по меньшей мере одну аминокислоту из нативной человеческой тау-последовательности как на N-концевой, так и на С-концевой стороне Ser-396. Например, pSer-396 фосфо-тау эпитоп будет обычно содержать остатки 395, 396 и 397 человеческой тау-последовательности, как представлено в SEQ ID NO:30 (т.е. Lys-395 Ser-396 Pro-397, где Ser-396 фосфорилирован). Такие pSer-396 эпитопы также могут дополнительно содержать фосфорилированный остаток серина Ser-404 нативной человеческой последовательности. Примеры тау-пептидов, содержащих pSer-396 фосфо-тау эпитоп, представлены в виде SEQ ID NO:4 и 6-13.
Кроме того, например, pThr-231/pSer-235 фосфо-тау эпитоп обычно представляет собой фрагмент человеческого тау, который включает как фосфорилированный остаток треонина ТПг-231, так и фосфорилированный остаток серина Ser-235. Альтернативно, pThr-231/pSer-235 фосфо-тау эпитоп включает только один из Thr-231 или Ser-235. Такие эпитопы обычно имеют длину от примерно 3 до примерно 20 аминокислот (например 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20) и включают по меньшей мере одну аминокислоту из нативной человеческой тау-последовательности на N-концевой стороне Thr-231 (т.е. Arg-230) и/или по меньшей мере одну аминокислоту на С-концевой стороне Ser-235 (т.е. Pro-236). Примеры тау-пептидов, содержащих pThr-231/pSer-235 эпитоп, представлены в виде SEQ ID NO:14-19.
Кроме того, например, pThr-212/pSer-214 фосфо-тау эпитоп обычно представляет собой фрагмент человеческого тау, который включает фосфорилированный остаток треонина Thr-212 и фосфорилированный остаток серина Ser-214. Такие эпитопы обычно имеют длину от примерно 3 до примерно 20 аминокислот (например 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20) и включают по меньшей мере одну аминокислоту из нативной человеческой тау-последовательности на N-концевой стороне Thr-212 (т.е. Arg-211) и по меньшей мере одну аминокислоту на С-концевой стороне Ser-214 (т.е. Leu-215). Примеры тау-пептидов, содержащих pThr-212/pSer-214 эпитоп, представлены в виде SEQ ID NO:20-24.
Кроме того, например, pSer-202/pThr-205 фосфо-тау эпитоп обычно представляет собой фрагмент человеческого тау, который включает фосфорилированный остаток треонина Ser-202 и фосфорилированный остаток треонина Thr-205. Такие эпитопы обычно имеют длину от примерно 6 до примерно 20 аминокислот (например 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20) и обычно включают по меньшей мере одну аминокислоту из нативной человеческой тау-последовательности на N-концевой стороне Ser-202 (т.е. Gly-201) и по меньшей мере одну аминокислоту на С-концевой стороне Thr-205 (т.е. Pro-206). Пример тау-пептида, содержащего pSer-202/pThr-205 эпитоп, представлен в виде SEQ ID NO:25.
Кроме того, например, pTyr-18 фосфо-тау эпитоп обычно представляет собой фрагмент человеческого тау, который включает фосфорилированный остаток тирозина Tyr-18. Такие эпитопы обычно имеют длину от примерно 6 до примерно 20 аминокислот (например 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20) и обычно включают по меньшей мере одну аминокислоту из нативной человеческой тау-последовательности на N-концевой стороне Tyr-18 (т.е. Thr-17) и по меньшей мере одну аминокислоту на С-концевой стороне Tyr-18 (т.е. Gly-19). Пример тау-пептида, содержащего pTyr-18 эпитоп, представлен в виде SEQ ID NO:112.
Антигенные тау-пептиды по настоящему изобретению также могут включать тау-пептиды, содержащие фосфо-тау эпитопы, описанные выше, включая пептиды, где небольшое число аминокислот было замещено, добавлено или делетировано, но которые сохраняют по существу такие же иммунологические свойства. В дополнение к этому, такие производные антигенные тау-пептиды могут быть дополнительно модифицированы аминокислотами, особенно на N- и С-концах, для обеспечения конформационно ограниченного антигенного тау-пептида и/или для обеспечения сочетания антигенного тау-пептида с иммуногенным носителем после осуществления подходящих химических реакций.
Антигенные тау-пептиды по изобретению также охватывают функционально активные вариантные пептиды, происходящие из аминокислотной последовательности тау, в которой аминокислоты были делегированы, вставлены или замещены без существенного снижения их иммунологических свойств, т.е. такие функционально вариантные пептиды сохраняют значительную биологическую активность антигенного тау-пептида. Обычно такие функционально вариантные пептиды имеют аминокислотную последовательность, гомологичную, предпочтительно высокогомологичную, аминокислотным последовательностям, описанным в любой из SEQ ID NO:1-26, 31-76 и 105-122.
В одном аспекте такие функционально активные вариантные пептиды демонстрируют по меньшей мере 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%-ную идентичность аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-26, 31-76 и 105-122.
Идентичность аминокислотной последовательности полипептидов может быть определена традиционно с использованием известных компьютерных программ, таких как Bestfit, FASTA или BLAST (см., например, Pearson, Methods Enzymol. 183:63-98 (1990); Pearson, Methods Mol. Biol. 132:185-219 (2000); Altschul et al., J. Mol. Biol. 215:403-410 (1990); Altschul et al., Nucelic Acids Res. 25:3389-3402 (1997)). При использовании Bestfit или любой другой программы выравнивания последовательностей для определения того, является ли конкретная последовательность, например, на 95% идентичной сравнительной аминокислотной последовательности, параметры устанавливают так, чтобы процент идентичности рассчитывался по всей длине сравнительной аминокислотной последовательности, и чтобы были допустимы пробелы в гомологии вплоть до 5% от общего числа аминокислотных остатков в сравнительной последовательности. Этот вышеуказанный способ определения процента идентичности между полипептидами применим ко всем белкам, их фрагментам или вариантам, описанным в данной заявке.
Функционально активные варианты содержат встречающиеся в природе функционально активные варианты, такие как аллельные варианты и видовые варианты, и не встречающиеся в природе функционально активные варианты, которые могут быть получены, например, методами мутагенеза или прямым синтезом.
Функционально активный вариант отличается, например, на примерно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных остатков от любого из пептидов, представленных в SEQ ID NO:1-26 и 31-76, и все еще сохраняет биологическую активность антигенного тау. Если это сравнение требует выравнивания, то последовательности выравнивают для максимальной гомологии. Сайт вариации может быть в любом месте пептида при условии, что биологическая активность является по существу аналогичной любому из пептидов, представленных в SEQ ID NO:1-26, 31-76 и 105-122.
Руководство, касающееся осуществления фенотипически молчащих аминокислотных замен, предложено в Bowie et al., Science, 247:1306-1310 (1990), где указано, что существует две основных стратегии исследования толерантности аминокислотной последовательности к изменению.
Первая стратегия эксплуатирует толерантность аминокислотных замен благодаря естественному отбору в процессе эволюции. Путем сравнения аминокислотных последовательностей у различных видов могут быть идентифицированы аминокислотные положения, которые были консервативными между видами. Эти консервативные аминокислоты, по-видимому, являются важными для функции белка. Напротив, аминокислотные положения, в которых замены были допущены естественным отбором, указывают на положения, которые не являются критическими для функции белка. Таким образом, положения, в которых допускается замена аминокислот, могут быть модифицированы при сохранении специфической иммуногенной активности модифицированного пептида.
Вторая сратегия использует генную инженерию для введения аминокислотных изменений по конкретным пложениям клонированного гена для идентификации участков, критичных для функции белка. Например, может быть использован сайт-направленный мутагенез или аланин-сканирующий мутагенез (Cunningham et al., Science, 244: 1081-1085 (1989)). Полученные вариантные пептиды затем могут быть протестированы в отношении специфической антигенной биологической активности тау.
Согласно Bowie с соавт., эти две стратегии показали, что белки являются неожиданно толерантными к аминокислотным заменам. Авторы дополнительно указывают, какие аминокислотные замены, по-видимому, допустимы в определенных аминокислотных положениях в белке. Например, наиболее закрытые или внутренние (в третичной структуре белка) аминокислотные остатки требуют неполярных боковых цепей, тогда как некоторые признаки поверхности или наружные боковые цепи обычно являются консервативными.
Способы введения мутации в аминокислоты белка хорошо известны специалистам в данной области (см., например, Ausubel (ed.), Current Protocols in Molecular Biology, John Wiley and Sons, Inc. (1994); Т.Maniatis, E.F.Fritsch and J.Sambrook, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor laboratory, Cold Spring Harbor, N.Y. (1989)).
Мутации также могут быть введены с использованием коммерчески доступных наборов, таких набор для сайт-направленного мутагенеза "QuikChange™" (Stratagene). Создание функционально активного варианта антигенного тау-пептида путем замены аминокислоты, которая по существу не влияет на функцию указанного антигенного тау-пептида, может быть осуществлено специалистом в данной области. Один тип аминокислотной замены, который может быть осуществлен в одном из пептидов согласно настоящему изобретению, представляет собой консервативную аминокислотную замену. "Консервативная аминокислотная замена" представляет собой замену, при которой аминокислотный остаток замещается другим аминокислотным остатком, имеющим группу R в боковой цепи со сходными химическими свойствами (например, зарядом или гидрофобностью). Обычно консервативная аминокислотная замена по существу не будет изменять функциональные свойства белка. В тех случаях, когда две или более аминокислотных последовательностей отличаются друг от друга консервативными заменами, процент идентичности последовательностей или степень сходства могут быть скорректированы в сторону повышения для коррекции консервативной природы замены. Способы осуществленя этой корректировки хорошо известны специалистам в данной области (см., например, Pearson, Methods Mol. Biol. 243:307-31 (1994)).
Примеры групп аминокислот, которые имеют боковые цепи со сходными химическими свойствами, включают в себя: 1) алифатические боковые цепи: глицин, аланин, валин, лейцин и изолейцин; 2) алифатические гидроксильные боковые цепи; серин и треонин; 3) амид-содержащие боковые цепи: аспарагин и глутамин; 4) ароматические боковые цепи: фенилаланин, тирозин и триптофан; 5) щелочные боковые цепи: лизин, аргинин и гистидин; 6) кислотные боковые цепи: аспаргиновая кислота и глутаминовая кислота; и 7) серо-содержащие боковые цепи: цистеин и метионин. Предпочтительные группы для консервативных аминокислотных замен представляют собой: валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин, глутамат-аспартат и аспарагин-глутамин.
Альтернативно, консервативная замена представляет собой любое изменение, имеющее положительное значение в матрице логарифмической функции правдоподобия РАМ250, описанной в Gonnet et al., Science 256:1443-45 (1992). "Умеренно консервативная" замена представляет собой любое изменение, имеющее неотрицательное значение в матрице логарифмической функции правдоподобия РАМ250.
Функционально активный вариантный пептид также может быть выделен с использованием метода гибридизации. Кратко, для получения функционально активного пептида используют ДНК, имеющую высокую гомологию с целой или с частью последовательности нуклеиновой кислоты, кодирующей интересующий пептид, полипептид или белок, например, SEQ ID NO:1-26, 31-76 и 105-122. Поэтому антигенный тау-пептид по изобретению также включает пептиды, которые являются функционально эквивалентными любой из SEQ ID NO:1-26 и 31-76 и могут кодироваться молекулой нуклеиновой кислоты, которая гибридизуется с нуклеиновой кислотой, кодирующей любую из SEQ ID NO:1-26, 31-76 и 105-122, или ее комплементом. Специалист в данной области может легко определить последовательности нуклеиновых кислот, которые кодируют пептиды, описанные в данной заявке, используя легко доступные таблицы кодонов. Как таковые, эти последовательности нуклеиновых кислот не представлены в данной заявке.
Жесткость гибридизации для нуклеиновой кислоты, кодирующей пептид, полипептид или белок, который представляет собой функционально активный вариант, представляет собой, например, 10% формамида, 5×SSPE, 1×раствора Денхардта и 1×ДНК спермы лосося (условия низкой жесткости). Более предпочтительные условия представляют собой 25% формамида, 5×SSPE, 1×раствора Денхардта и 1×ДНК спермы лосося (условия умеренной жесткости), и еще более предпочтительные условия представляют собой 50% формамида, 5×SSPE, 1×раствора Денхардта и 1×ДНК спермы лосося (условия высокой жесткости). Однако некоторые факторы, отличные от вышеописанной концентрации формамида, влияют на жесткость гибридизации, и специалист в данной области сможет соответственно выбрать эти факторы для достижения сходной жесткости.
Молекулы нуклеиновой кислоты, кодирующие функционально активный вариант, также могут быть выделены с помощью метода амплификации генов, такого как ПЦР (полимеразная цепная реакция), с использованием участка молекулы нуклеиновой кислоты ДНК, кодирующей интересующий пептид, полипептид или белок, например, любой из пептидов, представленных в SEQ ID NO:1-26, 31-76 и 105-122, в виде зонда.
Получение пептидов/белков
Полипептиды по настоящему изобретению могут быть получены из природных источников и выделены из млекопитающего, такого как, например, человек, примат, кошка, собака, лошадь, мышь или крыса. Таким образом, полипептиды по изобретению могут быть выделены из источников клеток или тканей с использованием стандартных методов очистки белка.
Альтернативно, полипептиды могут быть синтезированы химически или получены с использованием методов рекомбинантных ДНК. Например, полипептид по изобретению (например, тау-фрагмент) может быть синтезирован посредством твердофазных процедур, хорошо известных в данной области. Подходящие синтезы могут быть осуществлены с использованием процедур "Т-boc" или "F-moc". Циклические пептиды могут быть синтезированы твердофазными способами с использованием хорошо известной процедуры "F-moc" и полиамидной смолы в полностью автоматизированном аппарате. Альтернативно, специалисты в данной области знают необходимые лабораторные процедуры для осуществления процесса вручную. Методы и процедуры для твердофазного синтеза описаны в Solid Phase Peptide Synthesis: A Practical Approach by E.Atherton and R.C.Sheppard, published by IRL at Oxford University Press (1989) и Methods in Molecular Biology. Vol.35: Peptide Synthesis Protocols (ed. M.W.Pennington and B.M.Dunn), chapter 7, pp.91-171 by D. Andreau et al.
Альтернативно, полинуклеотид, кодирующий полипептид по изобретению, может быть введен в экспрессирующий вектор, который может быть экспрессирован в подходящей системе экспрессии с использованием методов, хорошо известных в данной области, с последующим выделением или очисткой интересующего экспрессированного полипептида. Множество бактериальных, дрожжевых, растительных систем экспрессии, экспрессирующих систем млекопитающих и насекомых доступны в данной области, и может быть использована любая такая система экспрессии. Возможно, полинуклеотид, кодирующий полипептид по изобретению, может быть транслирован в бесклеточной системе трансляции.
Антигенные тау-пептиды по изобретению также могут включать пептиды, которое возникают в результате существования множественных генов, альтернативных событий транскрипции, альтернативных событий сплайсинга РНК и альтернативных трансляционных и посттрансляционных событий. Полипептид может экспрессироваться в системах, например, культивируемых клетках, что приводит по существу к одинаковым посттрансляционным модификациям, присутствующим, когда полипептид экспрессируется в нативной клетке, или в системах, которые приводят к изменению или пропуску посттрансляционных модификаций, например, гликозилирования или расщепления, присутствующих при экспрессии в нативной клетке.
Полипептид по изобретению, такой как антигенный тау-полипептид, может быть получен в виде слитого белка, который содержит другие не-тау или не-тау-происходящие аминокислотные последовательности, такие как аминокислотные линкеры, или сигнальные последовательности, или иммуногенные носители, как определено в данной заявке, а также лиганды, полезные для очистки белка, такие как глутатион-3-трансфераза, гистидиновая метка и стафилококковый белок А. В слитом белке может присутствовать более чем один антигенный тау-полипептид по изобретению. Гетерологичный полипептид может быть слит, например, с N-концом или С-концом полипептида по изобретению. Полипептид по изобретению также может быть получен в виде слитого полипептида, содержащего гомологичные аминокислотные последовательности, т.е. другие тау- или тау-происходящие последовательности.
Конформационно ограниченные пептиды
Антигенные тау-пептиды по изобретению могут быть линейными или конформационно ограниченными (constrained). Как использовано в данной заявке в отношении молекулы, термин "конформационно ограниченный" означает молекулу, такую как полипептид, в которой трехмерная структура поддерживается в течение времени по существу в одном пространственном расположении. Конформационно ограниченные молекулы могут иметь улучшенные свойства, такие как повышенная аффинность, иммуногенность, метаболическая стабильность, мембранная проницаемость или растворимость. Кроме того, такие конформационно ограниченные молекулы, как ожидается, будут представлять антигенный тау-эпитоп в конформации, сходной с его нативной конформацией, индуцируя таким образом анти-тау антитела, более склонные к распознаванию собственных тау-молекул. Способы конформационного ограничения хорошо известны в данной области и включают в себя, без ограничения, образование мостиков и циклизацию.
Для введения конформационных ограничений в линейный пептид или полипептидную цепь существует несколько подходов, известных из предшествующего уровня техники. Например, образование мостиков между двумя соседними аминокислотами в пептиде приводит к локальной конформационной модификации, гибкость которой ограничена в сравнении с гибкостью регулярных пептидов. Некоторые возможности для образования таких мостиков включают введение лактамов и пиперазинонов (см., например, Giannis and Kolter, Angew. Chem. Int. Ed., 32:1244 (1993)).
Как использовано в данной заявке в отношении пептида, термин "циклический" относится к структуре, включающей внутримолекулярную связь между двумя несмежными аминокислотами или аналогами аминокислот. Циклизация может быть достигнута через ковалентную или нековалентную связь. Внутримолекулярные связи включают в себя, но не ограничиваются этим, связи скелета со скелетом, боковой цепи со скелетом, боковой цепи с боковой цепью, боковой цепи с концевой группой и конца с концом. Способы циклизации включают в себя, без ограничения, образование дисульфидной связи между боковыми цепями несмежных аминокислот или аналогов аминокислот; образование амидной связи между боковыми цепями остатков Lys и Asp/Glu; образование сложноэфирной связи между остатками серина и остатками Asp/Glu; образование лактамной связи, например, между группой в боковой цепи одной аминокислоты или ее аналога с N-концевым амином аминоконцевого остатка; и образование лизинонорлейциновых и дитирозиновых связей. Также могут быть использованы углеродные варианты дисульфидной связи, например, этенильная или этильная связь (J. Peptide Sc. 14:898-902 (2008)), а также реакции алкилирования подходящим полизамещенным электрофильным реагентом, таким как ди-, три- или тетрагалогеноалкан (PNAS, 105 (40), 15293-15298 (2008); ChemBioChem, 6:821-824 (2005)). Для включения конформационных ограничений в пептиды также могут быть использованы различные модифицированные аналоги пролина (Zhang et al., J. Med Chem., 39:2738-2744 (1996); Pfeifer and Robinson, Chem. Comm., 1977-1978 (1998)). Химические вещества, которые могут быть использованы для циклизации пептидов по изобретению, дают в результате пептиды, циклизованные посредством связи, включающей, но не ограничивающейся этим, следующие: лактамную, гидразоновую, оксимную, тиазолидиновую, тиоэфирную или сульфониевую связи.
Еще один подход к конструкции конформационно ограниченных пептидов, который описан в патентной публикации США №2004-0176283, состоит в присоединении короткой аминокислотной последовательности, представляющей интерес, к матрице для получения циклического конформационно ограниченного пептида. Такие циклические пептиды не только структурно стабилизированы своими матрицами и потому существуют в трехмерных конформациях, которые могут имитировать конформационные эпитопы на вирусах и паразитах, но они также являются более устойчивыми, чем линейные пептиды, к протеолитической деградации в сыворотке. В патентной публикации США №2004-0176283 также описан синтез конформационно ограниченных сшитых пептидов путем получения синтетических аминокислот для сочетания скелета с подходящим образом расположенными аминокислотами с целью стабилизации супервторичной структуры пептидов. Сшивание может быть достигнуто посредством амидного сочетания первичной аминогруппы ортогонально защищенного (2S,3R)-3-аминопролинового остатка с подходящим образом расположенной карбольксильной группой в боковой цепи глутамата. Этого подхода придерживались при получении конформационно ограниченных тетрапептидных повторов белка CS, где по меньшей мере один пролин был заменен на (2S,3R)-3-аминопролин, и, с целью введения карбоксильной группы в боковой цепи, глутамат был включен в качестве замены аланина.
Стратегии сшивания также включают применение реакции метатезиса с закрытием цикла Граббса с образованием "сшитых" ("stapled") пептидов, сконструированных для имитации альфа-спиральных конформаций (Angew. Int. Ed. Engl. 37:3281 (1998); JACS 122:5891 (2000)); применение полифункционализированных сахаридов; применение триптатиониновой связи (Chemistry Eu. J. 24:3404-3409 (2008)); и применение "клик"("click")-реакции азидов и алкинов, которые могут быть включены либо в виде аминокислотного остатка боковой цепи, либо расположены в скелете пептидной последовательности (Drug Disc. Today 8 (24):1128-1137 (2003)). Из литературы также известно, что ионы металлов могут стабилизировать ограниченные конформации линейных пептидов путем секвестрации определенных остатков (например, гистидина), которые координируются с катионами металлов (Angew. Int. Ed. Engl. 42:421 (2003)). Аналогично, функционализация линейной пептидной последовательности неприродной кислотной и аминной функциональной группой, или полиаминной и поликислотной функциональной группой может быть использована для получения доступа к циклизированным структурам в результате активации и образования амидных связей.
Согласно одному из воплощений антигенный тау-пептид является конформационно ограниченным благодаря образованию внутримолекулярных ковалентных связей между двумя несмежными аминокислотами антигенного тау-пептида, например, N- и С-концевыми аминокислотами. Согласно другому воплощению антигенный тау-пептид по изобретению является конформационно ограниченным благодаря ковалентному связыванию с каркасной (scaffold) молекулой. Согласно другому воплощению антигенный тау-пептид является просто ограниченным, т.е. связанным либо на одном конце (С- или N-конце), либо через другую аминокислоту, не расположенную на каком-либо конце, с каркасной молекулой. Согласно другому воплощению антигенный тау-пептид является вдвойне ограниченным, т.е. связанным как на С-, так и на N-концах с каркасной молекулой.
Каркас (также казываемый "подложкой") может представлять собой любую молекулу, которая способна уменьшать, через образование ковалентных связей, число конформации, которое может принимать антигенный тау-пептид. Примеры ограничивающих конформацию каркасов включают в себя белки и пептиды, например, липокалин-родственные молекулы, такие как тиоредоксин и тиоредоксин-подобные белки, содержащие бета-скаладчатую структуру, нуклеазы (например РНКаза А), протеазы (например, трипсин), ингибиторы протеазы (например, эглин С), антитела или их структурно жесткие фрагменты, флуоресцентные белки, такие как GFP (зеленый флуоресцентный белок) или YFP (желтый флуоресцентный белок), конотоксины, петлевые участки фибронектинового домена III типа, CTLA-4 и вирусоподобные частицы (VLP).
Другие подходящие каркасные молекулы включают в себя углеводы, такие как сефароза. Каркас может представлять собой линейную или кольцевую молекулу, например, замкнутую с образованием петли. Обычно каркас является гетерологичным по отношению к антигенному тау-пептиду. Такие конформационно ограниченные пептиды, связанные с каркасом, как полагают, являются более устойчивыми к протеолитической деградации, чем линейный пептид.
Согласно одному из воплощений каркас представляет собой иммуногенный носитель, как определено в настоящем изобретении, такой как гетерологичный белок-носитель или VLP. В другом воплощении антигенный тау-пептид является просто закрепленным на иммуногенном носителе. В другом воплощении антигенный тау-пептид является вдвойне закрепленным на иммуногенном носителе. Таким образом, антигенный тау-пептид образует конформационно ограниченную петлевую структуру, которая, как было доказано, является особенно подходящей структурой в качестве внутриклеточной молекулы распознавания.
Антигенные тау-пептиды по изобретению могут быть модифицированы для простоты конъюгирования с подложкой, например, путем добавления концевого цистеина на одном или на обоих концах и/или путем добавления линкерной последовательности, такой как двойная глициновая "голова" (head) или "хвост", линкера, заканчивающегося остатком лизина, или любого другого линкера для осуществления такой функции, известного специалистам в данной области. Для связывания полной пептидной последовательности с носителем также может быть использована биортогональная химия (такая как "клик"-реакция, описанная выше), таким образом, можно избежать любых региохимических проблем и проблем хемоселективности. Известно, что жесткие линкеры, такие как линкеры, описаные Jones с соавт. (Angew. Chem. Int. Ed. 2002, 41:4241-4244), вызывают улучшенный иммунологический ответ и также могут быть использованы.
В другом воплощении антигенный тау-пептид присоединен к поливалентной матрице, которая сама связана с носителем, таким образом увеличивая плотность антигена (см. ниже). Поливалентная матрица может представлять собой подходящим образом функционализированный полимер или олигомер, такой как (но не ограничиваясь этим) олигоглутамат или олигохитозан.
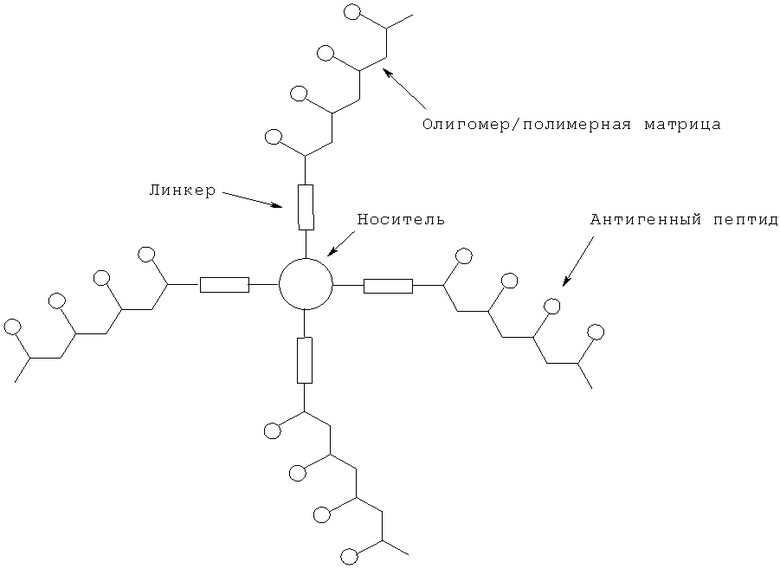
Указанный линкер может быть расположен на N-конце пептида или на С-конце пептида, или на обоих концах пептида. Указанный линкер может иметь длину от 0 до 10 аминокислот, например, длину от 0 до 6 аминокислот. Альтернативно, добавление или замещение D-стереоизомерной формы одной или более аминокислот может быть осуществлено для создания полезного производного, например, для увеличения стабильности пептида.
Типичные комбинации конъюгирований, которые все находятся в пределах объема настоящего изобретения и представляют различные воплощения, с использованием различных линкеров, представлены ниже.
Пептид-GGGGGC (SEQ ID NO:79)-каркас; Пептид-GGGGC (SEQ ID NO:80)-каркас; Пептид-GGGC (SEQ ID NO:81)-каркас; Пептид-ССС-каркас; Пептид-GC-каркас; Пептид-С-каркас; Пептид-GGGGGK (SEQ ID NO:82); Пептид-GGGGK (SEQ ID NO:83); Пептид-GGGK (SEQ ID NO:84); Пептид-GGK; Пептид-GK; Пептид-K; Пептид-GGGGSC (SEQ ID NO:85); Пептид-GGGSC (SEQ ID NO:86); Пептид-GGSC (SEQ ID NO:87); Пептид-GSC; Пептид-SC; Пептид-GGGGC (SEQ ID NO:80); Пептид-GGGC (SEQ ID NO:81); Пептид-GGC; Пептид-GC; CSGGGG (SEQ ID NO:88)-Пептид; CSGGG (SEQ ID NO:89)-Пептид; CSGG (SEQ ID NO:90)-Пептид; CSG-Пептид; CS-Пептид; CGGGG (SEQ ID NO:91)-Пептид; CGGG (SEQ ID NO:92)-Пептид; CGG-Пептид; CG-Пептид.
Типичные комбинации конъюгирований с использованием различных линкеров и вдвойне ограниченных пептидов представлены ниже, где носитель может представлять собой мономер, идентичный носителю, или отличный от носителя мономер. В примере ниже GC-линкер может быть замещен любым GK-линкером или GSC-линкером, проиллюстрированным выше, или любым другим, известным специалистам в данной области:
Носитель-CGGGGG (SEQ ID NO:93)-Пептид-GGGGGC (SEQ ID NO:79)-носитель; Носитель-CGGGG (SEQ ID NO:91)-Пептид-GGGGC (SEQ ID NO:80)-носитель; Носитель-CGGG (SEQ ID NO:92)-Пептид-GGGC (SEQ ID NO:81)-носитель; Носитель-CG-Пептид-GC-носитель; Носитель-С-Пептид-С-носитель.
В одном из воплощений концевой остаток цистеина, если он еще не присутствует в аминокислотной последовательности антигенного тау-пептида, добавляют к одному или обоим концам антигенного тау-пептида, содержащего или состоящего из любой из последовательностей, представленных в SEQ ID NO:1-26, для создания конформационно ограниченного пептида.
В другом воплощении GC-линкер, содержащий варьирующее число остатков глицина и один концевой остаток цистеина, добавляют к одному или обоим концам антигенного тау-пептида, содержащего или состоящего из любой из последовательностей, представленных в SEQ ID NO:1-26, для создания конформационно ограниченного пептида. Предпочтительно, GC-линкер содержит от 1 до 10 остатков глицина, более предпочтительно 1, 2, 3, 4 или 5 остатков глицина.
В еще одном воплощении GC-линкер, содержащий варьирующее число остатков глицина и один концевой остаток цистеина, добавляют к одному концу антигенного тау-пептида, содержащего или состоящего из любой из последовательностей, представленных в SEQ ID NO:1-26, и концевой остаток цистеина, если он еще не присутствует на другом конце антигенного тау-пептида, добавляют к другому концу антигенного пептида. Предпочтительно, GC-линкер содержит от 1 до 10 остатков глицина, более предпочтительно 1, 2, 3, 4 или 5 остатков глицина.
Иммуногенные носители
В одном из воплощений настоящего изобретения антигенный тау-пептид или полипептид по изобретению связан с молекулой иммуногенного носителя с образованием иммуногенов для протоколов вакцинации. Термин "иммуногенный носитель" в данной заявке включает такие материалы, которые обладают свойством независимо вызывать иммуногенный ответ у животного-хозяина и которые могут быть связаны (например, ковалентно связаны) с пептидом, полипептидом или белком либо непосредственно через образование пептидных или сложноэфирных связей между свободными карбоксильными, амино- или гидроксильными группами в пептиде, полипептиде или белке и соответствующими группами на иммуногенном материале-носителе, либо, альтернативно, путем образования связей через традиционную бифункциональную связывающую группу, или в виде слитого белка.
Типы носителей, используемых в иммуногенах по настоящему изобретению, будут хорошо известны специалистам в данной области. Примерами таких иммуногенных носителей являются: вирусоподобные частицы (VLP); сывороточные альбумины, такие как бычий сывороточный альбумин (БСА); глобулины; тиреоглобулины; гемоглобины; гемоцианины (особенно гемоцианин лимфы улитки (KLH)); белки, экстрагированные из аскарид, неактивированные бактериальные токсины или анатоксины, такие как столбнячный или дифтерийный токсины (ТТ и DT) или CRM197, очищенное белковое производное туберкулина (PPD); или белок D из Haemophilus influenzae (публикация РСТ № WO 91/18926) или его рекомбинантные фрагменты (например, домен 1 фрагмента С из ТТ, или транслокационный домен DT, или белок D 1/3, содержащий N-концевые аминокислоты с 100 по 110 из белка D Haemophilus influenzae (GB 9717953.5)); полилизин; полиглутаминовая кислота; сополимеры лизина и глутаминовой кислоты; сополимеры, содержащие лизин или орнитин; липосомальные носители и т.д.
В одном из воплощений иммуногенный носитель представляет собой KLH. В другом воплощении иммуногенный носитель представляет собой вирусоподобную частицу (VLP), предпочтительно рекомбинантную вирусоподобную частицу.
Термин "вирусная частица", как использовано в данной заявке, относится к морфологической форме вируса. В некоторых типах вируса он содержит геном, окруженный белковым капсидом; другие имеют дополнительные структуры, такие как оболочки, хвосты и т.д.
Термин "вирусоподобная частица" (VLP), как использовано в данной заявке, относится к нерепликативной и/или неинфекционной вирусной частице, или относится к нерепликативной и/или неинфекционной структуре, сходной с вирусной частицей, такой как капсид вируса. Термин "нерепликативная", как использовано в данной заявке, относится к неспособности реплицировать геном, входящий в состав VLP. Термин "неинфекционная", как использовано в данной заявке, относится к неспособности проникать в клетку-хозяина. В одном примере вирусоподобная частица является нерепликативной и/или неинфекционной, поскольку она не содержит весь или часть вирусного генома или геномной функции. Например, вирусоподобная частица представляет собой вирусную частицу, в которой вирусный геном был физически или химически инактивирован. Кроме того, например, вирусоподобная частица не содержит все или часть репликативных и инфекционных компонентов вирусного генома. Вирусоподобная частица может содержать нуклеиновую кислоту, отличную от генома вируса. Одним примером вирусоподобной частицы является вирусный капсид, такой как вирусный капсид соответствующего вируса, например бактериофага, такой как РНК-фаг. Термины "вирусный капсид" или "капсид" относятся к макромолекулярной сборке, состоящей из субъединиц вирусного белка. Например, может быть 60, 120, 180, 240, 300, 360 и более 360 субъединиц вирусного белка. Взаимодействия этих субъединиц могут привести к образованию вирусного капсида или структуры, подобной вирусному капсиду, с характерной повторяющейся организацией, где указанная структура является, например, сферической или тубулярной.
Как использовано в данной заявке, термин "вирусоподобная частица РНК-фага" относится к вирусоподобной частице, содержащей, или состоящей по существу из, или состоящей из оболочечных белков РНК-фага, их вариантов или фрагментов. Например, вирусоподобная частица РНК-фага может напоминать структуру РНК-фага, являясь нерепликативной и/или неинфекционной и не содержащей по меньшей мере ген или гены, кодирующие репликационный аппарат РНК-фага, а также может не содержать ген или гены, кодирующие белок или белки, отвечающие за прикрепление вируса к хозяину или проникновение вируса в хозяина. Однако это определение также должно охватывать вирусоподобные частицы РНК-фагов, в которых вышеупомянутый ген или гены еще присутствуют, но являются неактивными, и поэтому также приводят к нерепликативным и/или неинфекционным вирусоподобным частицам РНК-фага. В настоящем изобретении термин "субъединица" и "мономер" используются взаимозаменяемо и являются эквивалентными в данном контексте. Кроме того, в настоящем изобретении термин "РНК-фаг" и термин "РНК-бактериофаг" используются взаимозаменяемо.
В настоящем изобретении предложены композиции и способы индуцирования и/или усиления иммунных ответов против фосфорилированного тау у млекопитающего. Композиции по изобретению могут содержать вирусоподобную частицу (VLP), связанную по меньшей мере с одним антигенным тау-пептидом. Например, антигенный тау-пептид может быть связан с VLP с образованием упорядоченной и повторяющейся матрицы антиген-VLP. Например, в одном случае по меньшей мере 20, по меньшей мере 30, по меньшей мере 60, по меньшей мере 120, по меньшей мере 180, по меньшей мере 360, или по меньшей мере 540 пептидов, как описано в данной заявке, связаны с VLP.
Капсидная структура, образованная в результате самосборки 180 субъединиц оболочечного белка РНК-фага и возможно содержащая РНК хозяина, называется в данной заявке "VLP из оболочечного белка РНК-фага". Конкретным примером является VLP из оболочечного белка Qbeta. В этом конкретном случае VLP из оболочечного белка Qbeta может либо собираться исключительно из субъединиц СР Qbeta (образующихся посредством экспрессии гена СР Qbeta, содержащего, например, стоп-кодон ТАА, препятствующий экспрессии более длинного белка А1 через супрессию, см. Kozlovska, Т.М., et al., Intervirology 39: 9-15 (1996)), либо дополнительно содержать субъединицы белка А1 при сборке капсида. Обычно процент белка Qbeta А1 относительно СР Qbeta при сборке капсида будет ограничиваться с целью обеспечения образования капсида.
Примеры VLP, подходящих в качестве иммуногенных носителей в контексте настоящего изобретения, включают в себя, но не ограничиваются этим, капсидные белки вируса гепатита В (Ulrich, et al., Virus Res. 50: 141-182 (1998)), вируса кори (Warnes, et al., Gene 160: 173-178 (1995)), вируса Синдбис, ротавируса (патенты США №№5071651 и 5374426), вируса ящура (Twomey, et al., Vaccine 13: 1603-1610, (1995)), вируса Норуолк (Norwalk) (Jiang, X., et al., Science 250: 1580-1583 (1990); Matsui, S. М., et al., J Clin. Invest. 87: 1456-1461 (1991)), ретровирусного белка GAG (публикация РСТ № WO 96/30523), белка pI ретротранспозона Ту, поверхностного белка вируса гепатита В (публикация РСТ № WO 92/11291), вируса папилломы человека (публикация РСТ № WO 98/15631), вируса полиомы человека (Sasnauskas К., et al., Biol. Chem. 380 (3): 381-386 (1999); Sasnauskas K., et al., Generation of recombinant virus-like particles of different polyomaviruses in yeast, 3rd International Workshop "Virus-like particles as vaccines", Berlin, September 26-29 (2001)), РНК-фагов, Ty, fr фага, GA-фага, АР 205-фага и, в частности, Qbeta-фага.
Как будет очевидно специалистам в данной области, VLP, используемая в качестве иммуногенного носителя по изобретению, не ограничивается какой-либо конкретной формой. Частица может быть синтезирована химически или посредством биологического процесса, который может быть природным или неприродным. В качестве примера, этот тип воплощения включает вирусоподобную частицу или ее рекомбинантную форму. В более конкретном воплощении VLP может содержать, или альтернативно состоять из рекомбинантных полипептидов любого из вирусов, которые, как известно, образуют VLP. VLP может дополнительно содержать, или альтернативно состоять из одного или более фрагментов таких полипептидов, а также вариантов таких полипептидов. Варианты полипептидов могут иметь, например, по меньшей мере 80%, 85%, 90%, 95%, 97% или 99%-ную идентичность на аминокислотном уровне с их прототипами дикого типа. Вариантные VLP, подходящие для применения в настоящем изобретении, могут происходить из любого организма при условии, что они способны образовывать "вирусоподобную частицу" и могут быть использованы в качестве "иммуногенного носителя", как определено в данной заявке.
Предпочтительные VLP согласно изобретению включают капсидный белок или коровый и поверхностный антиген HBV (HBcAg и HBsAg соответственно) или рекомбинантные белки или их фрагменты, и оболочечные белки РНК-фагов или рекомбинантные белки или их фрагменты, более предпочтительно оболочечный белок Qbeta или рекомбинантные белки или их фрагменты.
В одном из воплощений иммуногенный носитель, используемый в комбинации с антигенным тау-пептидом по изобретению, представляет собой НВсАд белок. Примеры НВсАд белков, которые могут быть использованы в контексте настоящего изобретения, могут быть легко определены специалистом в данной области. Примеры включают в себя, но не ограничиваются этим, коровые белки HBV, описанные в Yuan et al., J. Virol. 73:10122-10128 (1999), и в публикациях РСТ №№ WO 00/198333, WO 00/177158, WO 00/214478, WO 00/32227, WO 01/85208, WO 02/056905, WO 03/024480 и WO 03/024481. HbcAg, подходящие для применения в настоящем изобретении, могут происходить из любого организма при условии, что они способны образовывать "вирусоподобную частицу" и могут быть использованы в качестве "иммуногенного носителя", как определено в данной заявке.
Варианты HbcAg, представляющие особый интерес, которые могут быть использованы в контексте настоящего изобретения, представляют собой такие варианты, в которых один или более встречающихся в природе остатков цистеина были либо делегированы, либо замещены. В данной области хорошо известно, что свободные остатки цистеина могут быть вовлечены в различные химические побочные реакции, включающие дисульфидные обмены, реакцию с химическими веществами или метаболитами, которые, например, инъецируются или образуются в комбинированной терапии с другими веществами, или прямое окисление и реакцию с нуклеотидами под действием УФ света. Таким образом, могут образовываться токсичные аддукты, особенно с учетом того факта, что HBcAgs имеют сильную тенденцию связывать нуклеиновые кислоты. Таким образом, токсичные аддукты будут распределяться между множеством видов, каждый из которых индивидуально может присутствовать в низкой концентрации, но достигают токсичных уровней, когда присутствуют вместе. В свете вышеуказанного, одно преимущество применения HBcAgs в вакцинных композициях, которые были модифицированы для удаления встречающихся в природе остатков цистеина, состоит в том, что сайты, с которыми может связываться токсичный вид при присоединении антигенов или антигенных детерминант, будут численно уменьшены или вообще элиминированы.
Кроме того, процессированная форма HBcAg, не содержащая N-концевую лидерную последовательность белка-предшественника коревого антигена гепатита В, также может быть использована в контексте изобретения, особенно когда HBcAg продуцируется в условиях, в которых процессинг не будет происходить (например, экспрессия в бактериальных системах).
Другие варианты HBcAg согласно изобретению включают в себя: 1) полипептидные последовательности, которые по меньшей мере на 80%, 85%, 90%, 95%, 97% или 99% идентичны одной из аминокислотных последовательностей HBcAg дикого типа, или ее подобласти, с использованием стандартных компьютерных алгоритмов сравнения последовательностей, 3) мутанты, укороченные по С-концу, включающие мутанты, где по меньшей мере 1, 5, 10, 15, 20, 25, 30, 34 или 35 аминокислот были удалены из С-конца, 4) мутанты, укороченные по N-концу, включающие мутанты, где по меньшей мере 1, 2, 5, 7, 9, 10, 12, 14, 15 или 17 аминокислот были удалены из N-конца, 3) мутанты, укороченные как по N-концу, так и по С-концу, включающие HBcAgs, где по меньшей мере 1, 2, 5, 7, 9, 10, 12, 14, 15 или 17 аминокислот были удалены из N-конца и по меньшей мере 1, 5, 10, 15, 20, 25, 30, 34 или 35 аминокислот были удалены из С-конца.
Еще одни вариантные белки НВсАд в пределах объема изобретения представляют собой варианты, модифицированные с целью усиления иммуногенной презентации чужеродного эпитопа, где один или более из четырех аргининовых повторов был делетирован, но в которых С-концевой цистеин сохранен (см., например, публикацию РСТ № WO 01/98333), и химерный, укороченный по С-концу HBcAg, такие как описанные в публикациях РСТ №№ WO 02/14478, WO 03/102165 и WO 04/053091.
В другом воплощении иммуногенный носитель, используемый в комбинации с антигенным тау-пептидом по изобретению, представляет собой HBsAg белок. HBsAg белки, которые могут быть использованы в контексте настоящего изобретения, могут быть легко определены специалистом в данной области. Примеры включают в себя, но не ограничиваются этим, поверхностные белки HBV, описанные в патенте США №5792463 и публикациях РСТ №№ WO 02/10416 и WO 08/020331. HBsAgs, подходящие для применения в настоящем изобретении, могут происходить из любого организма при условии, что они способны образовывать "вирусоподобную частицу" и могут быть использованы в качестве "иммуногенного носителя", как определено в данной заявке.
В еще одном воплощении иммуногенный носитель, используемый в комбинации с антигенным тау-пептидом по изобретению, представляет собой оболочечный белок Qbeta. Обнаружили, что оболочечный белок Qbeta самоорганизуется в капсиды при экспрессии в Е.coli (Kozlovska T.M. et al., GENE 137: 133-137 (1993)). Полученные капсиды или вирусоподобные частицы демонстрировали икосаэдрическую фагоподобную капсидную структуру с диаметром 25 нм и квази-симметрию Т=3. Кроме того, была разрешена кристаллическая структура бактериофага Qbeta. Капсид содержит 180 копий оболочечного белка, которые связаны в ковалентные пентамеры и гексамеры дисульфидными мостиками (Golmohammadi, R. et al., Structure 4: 5435554 (1996)), приводящими к замечательной стабильности капсида оболочечного белка Qbeta. Капсидный белок Qbeta также демонстрирует необычную устойчивость к органическим растворителям и денатурирующим агентам. Высокая стабильность капсида из оболочечного белка Qbeta является предпочтительным признаком, в частности, для его применения в иммунизации и вакцинации млекопитающих и людей в контексте настоящего изобретения
Примеры оболочечных белков Qbeta, которые могут быть использованы в контексте настоящего изобретения, могут быть легко определены специалистом в данной области. Примеры были широко описаны в публикациях РСТ №№ WO 02/056905, WO 03/024480, WO 03/024481 и включают в себя, но не ограничиваются этим, аминокислотные последовательности, описанные в базе данных PIR (Белковый информационный ресурс), №доступа VCBPQbeta в отношении СР Qbeta; №доступа ААА16663 в отношении Qbeta А1 белка; и их варианты, включающие вариантные белки, в которых N-концевой метионин отщеплен; С-концевые укороченные формы Qbeta А1, в которых отсутствуют вплоть до 100, 150 или 180 аминокислот; вариантные белки, которые были модифицированы путем удаления остатка лизина с помощью делеции или замены или путем добавления остатка лизина с помощью замены или вставки (см., например, Qbeta-240, Qbeta-243, Qbeta-250, Qbeta-251 и Qbeta-259, описанные в публикации РСТ NoWO 03/024481), и варианты, демонстрирующие по меньшей мере 80%, 85%, 90%, 95%, 97% или 99%-ную идентичность с любым из коровых белков Qbeta, описанных в данной заявке. Вариантные оболочечные белки Qbeta, подходящие для применения в настоящем изобретении, могут происходить из любого организма при условии, что они способны образовывать "вирусоподобную частицу" и могут быть использованы в качестве "иммуногенных носителей", как определено в данной заявке.
Связь
Антигенные тау-пептиды по изобретению могут быть подвергнуты сочетанию с иммуногенными носителями посредством химического конъюгирования или посредством экспрессии генетически сконструированных партнеров слияния. Сочетание не обязательно должно быть прямым, но может происходить через линкерные последовательности. В более общем смысле, в случае, когда антигенные пептиды слиты, конъюгированы или иным образом присоединены к иммуногенному носителю, спейсерные или линкерные последовательности обычно добавляют на одном или обоих концах антигенных пептидов. Такие линкерные последовательности обычно содержат последовательности, распознаваемые протеасомой, протеазами эндосом или другого везикулярного компартмента клетки.
В одном из воплощений пептиды по настоящему изобретению экспрессируются в виде слитых белков с иммуногенным носителем. Слияние пептида может осуществляться путем вставки в первичную последовательность иммуногенного носителя, или путем слияния либо с N-, либо с С-концом иммуногенного носителя. В дальнейшем, при ссылке на слитые белки пептида с иммуногенным носителем, охватываются слияние либо с концами последовательности субъединицы, либо внутренняя вставка пептида в пределах последовательности носителя. Слияние, как изложено в дальнейшем, может осуществляться путем вставки антигенного пептида в последовательность носителя, путем замены части последовательности носителя антигенным пептидом, или посредством комбинации делеции, замены или вставки.
Когда иммуногенный носитель представляет собой VLP, тогда субъединица химерный антигенный пептид-VLP будет в общем способна к самосборке в VLP. VLP-экспонирующие эпитопы, слитые с их субъединицами, также называются в данной заявке химерными VLP. Например, в ЕР 0421635 В описано применение химерных коровых антигенных частиц гепаднавируса для презентации чужеродных пептидных последовательностей в вирусоподобной частице.
Фланкирующие аминокислотные остатки могут быть добавлены к любому концу последовательности антигенного пептида, подлежащего слиянию, к любому концу последовательности субъединицы VLP, или для внутренней вставки такой пептидной последовательности в последовательность субъединицы VLP. Остатки глицина и серина являются особенно предпочтительными аминокислотами, подлежащими использованию во фланкирующих последовательностях, добавленных к пептиду, подлежащему слиянию. Остатки глицина придают дополнительную гибкость, которая может уменьшать потенциально дестабилизирующий эффект слияния чужеродной последовательности на последовательность субъединицы VLP.
В конкретном воплощении изобретения иммуногенный носитель представляет собой HBcAg VLP. Слитые белки антигенного пептида либо с N-концом HBcAg (Neyrinck, S. et al., Nature Med. 5:11571163 (1999)), либо вставки в так называемый главный иммунодоминантный участок (MIR, major immunodominant region) были описаны (Pumpens et al., Intervirology 44:98-114 (2001), публикация РСТ № WO 01/98333), и представляют собой конкретные воплощения изобретения. Встречающиеся в природе варианты HBcAg с делениями в MIR также были описаны (Pumpens et al., Intervirology 44:98-114 (2001)), и слияния с N- или С-концом, а также вставки в положение MIR, соответствующие сайту делеции по сравнению с HBcAg wt (дикого типа), представляют дополнительные воплощения изобретения. Слияния с С-концом также были описаны (Pumpens et al., Intervirology 44:98-114 (2001)). Специалист в данной области легко найдет руководство относительно того, как конструировать слитые белки, используя классические методы молекулярной биологии. Векторы и плазмиды, кодирующие HBcAg и слитые белки HBcAg и полезные для экспрессии HBcAg и слитых белков HBcAg, были описаны (Pumpens et al., Intervirology 44:98-114 (2001), Neyrinck, S. et al., Nature Med. 5:1157-1163 (1999)) и могут быть использованы для осуществления данного изобретения. Важным фактором для оптимизации эффективности самосборки и экспонирования эпитопа, подлежащего включению в MIR HBcAg, является выбор сайта для вставки, а также числа аминокислот, подлежащих делеции из последовательности HBcAg в пределах MIR (Европейский патент № ЕР 0421635; патент США №6231864) в результате вставки, или, другими словами, какие аминокислоты, образующие HBcAg, подлежат замене новым эпитопом. Например, была описана замена HBcAg аминокислот 76-80, 79-81, 79-80, 75-85 или 80-81 чужеродными эпитопами (Pumpens et al., Inte/virology 44:98-114 (2001); Европейский патент № ЕР 0421635; патент США №6231864, патентная публикация РСТ № WO 00/26385). HBcAg содержит длинный аргининовый хвост, который является несущественным для сборки капсида и способен связывать нуклеиновые кислоты. HBcAg, либо содержащий, либо не содержащий этот аргининовый хвост, оба представляют собой воплощения настоящего изобретения.
В другом конкретном воплощении изобретения иммуногенный носитель представляет собой VLP РНК-фага, предпочтительно Qbeta. Главные оболочечные белки РНК-фагов самопроизвольно собираются в VLP при экспрессии в бактериях и, в частности, в Е.coli. Были описаны слитые белковые конструкции, где антигенные пептиды были слиты с С-концом укороченной формы белка А1 из Qbeta, или вставлены в белок А1 (Kozlovska et al., Intervirology, 39:9-15 (1996)). Белок А1 образуется посредством супрессии в стоп-кодоне UGA и имеет длину 329 аминокислот, или 328 аминокислот, если принять во внимание отщепление N-концевого метионина. Отщепление N-концевого метионина перед аланином (вторая аминокислота, кодируемая геном СР Qbeta) обычно происходит в Е.coli, и так обстоит дело для N-концов оболочечных белков Qbeta. Часть гена А1, с 3' от амбер-кодона UGA кодирует удлинение СР, которое имеет длину 195 аминокислот.Вставка антигенного пептида между положением 72 и 73 удлинения СР приводит к дополнительным воплощениям изобретения (Kozlovska et al., Intervirology 39:9-15 (1996)). Слияние антигенного пептида на С-конце укороченного по С-концу белка А1 Qbeta приводит к дополнительным предпочтительным воплощениям изобретения. Например, в Kozlovska et al., Intervirology, 39:9-15 (1996) описаны слитые белки А1 Qbeta, где эпитоп слит на С-конце удлинения СР Qbeta, укороченного по положению 19.
Как описано в Kozlovska et al., Intervirology, 39:9-15 (1996), сборка частиц, экспонирующих слитые эпитопы, обычно требует присутствия как слияния белок А1-антиген, так и СР дикого типа с образованием мозаичной частицы. Однако воплощения, содержащие вирусоподобные частицы, и, таким образом, в частности, VLP из оболочечного белка РНК-фага Qbeta, которые состоят исключительно из VLP субъединиц, имеющих антигенный пептид, слитый с ними, также находятся в пределах объема настоящего изобретения.
Продукция мозаичных частиц может осуществляться различными путями. В Kozlovska et al., Intervirology 39:9-15 (1996) описано три способа, которые все могут быть использованы для осуществления изобретения. В первом подходе эффективное экспонирование слитого эпитопа на VLP опосредовано экспрессией плазмиды, кодирующей слитый белок А1 Qbeta, имеющий стоп-кодон UGA между СР и удлинением СР в штамме Е.coli, несущем плазмиду, кодирующую клонированную супрессорную тРНК UGA, которая приводит к трансляции кодона UGA в Тгр (плазмида pISM3001 (Smiley et al., Gene 134:33-40 (1993)). В другом подходе стоп-кодон гена СР модифицирован в UAA, и вторую плазмиду, экспрессирующую слияние белок А1-антиген, подвергают котрансформации. Вторая плазмида кодирует устойчивость к другому антибиотику, и точка начала репликации совместима с первой плазмидой. В третьем подходе СР и слияние белок А1-антиген кодируют в бицистронной манере, функциональным образом связывая с промотором, таким как Тгр промотор, как описано на Фиг.1 в Kozlovska et al., Intervirology, 39:9-15 (1996).
Кроме того, VLP, подходящие для слияния антигенов или антигенных детерминант, описаны в публикации РСТ № WO 03/024481 и включают бактериофаг fr, РНК-фаг MS-2, капсидный белок папилломавируса, ретротранспозон Ту, дрожжи, а также ретровирусоподобные частицы, Gag HIV2, вирус мозаики коровьего гороха (Cowpea Mosaic Virus), VLP VP2 парвовируса, HBsAg (патент США №4722840 и Европейский патент №ЕР 0020416 В1). Примеры химерных VLP, подходящих для осуществления изобретения, также представляют собой примеры, описанные в Intervirology 39:1 (1996). Другие примеры VLP, рассматриваемые для применения в настоящем изобретении, представляют собой: HPV-1, HPV-6, HPV-11, HPV-16, HPV-18, HPV-33, HPV-45, CRPV, CPOV, GAG HIV и вирус табачной мозаики. Дополнительные примеры включают VLP из SV-40, полиомавируса, аденовируса, вируса простого герпеса, ротавируса и вируса Норуолк.
Для любого рекомбинантно экспрессируемого пептида или белка, который образует часть настоящего изобретения, включая антигенный тау-пептид согласно изобретению, связанный или не связанный с иммуногенным носителем, нуклеиновая кислота, которая кодирует указанный пептид или белок, также образует аспект настоящего изобретения, равно как и экспрессирующий вектор, содержащий нуклеиновую кислоту, и клетка-хозяин, содержащая указанный экспрессирующий вектор (автономный или встроенный в хромосому). Способ рекомбинантного получения пептида или белка посредством его экспрессии в вышеупомянутой клетке-хозяине и выделение иммуногена из нее представляет другой аспект изобретения.
В другом воплощении пептид по изобретению подвергают химическому сочетанию с иммуногенным носителем, используя методы, хорошо известные в данной области. Конъюгирование может происходить с обеспечением свободного движения пептидов посредством одноточечного конъюгирования (например, либо в N-концевом, либо в С-концевом положении) или в виде фиксированной (locked down) структуры, где оба конца пептидов конъюгированы либо с иммуногенным белком-носителем, либо с каркасной структурой, такой как VLP. Такое конъюгирование может осуществляться посредством конъюгационной химии, известной специалистам в данной области, например, через остатки цистеина, остатки лизина или другие карбокси-группировки, обычно известные в качестве точек конъюгирования, таких как глутаминовая кислота или аспаргиновая кислота. Таким образом, например, для прямого ковалентного связывания можно использовать карбодиимид, глутаральдегид или (N-[y-малеимидобутирилокси]сукцинимидный сложный эфир, используя обычные коммерчески доступные гетеробифункциональные линкеры, такие как CDAP и SPDP (с использованием инструкций производителя). Примеры конъюгирования пептидов, особенно циклизированных пептидов, с белком-носителем через ацилгидразиновые пептидные производные описаны в публикации РСТ № WO 03/092714. После реакции сочетания иммуноген может быть легко выделен и очищен посредством способа диализа, способа гель-фильтрации, способа фракционирования и т.д. Пептиды, заканчивающиеся остатком цистеина (предпочтительно с линкером вне циклизированного участка), могут быть легко конъюгированы с белком-носителем посредством малеимидной химии.
Когда иммуногенный носитель представляет собой VLP, тогда несколько антигенных пептидов, имеющих либо идентичную аминокислотную последовательность, либо другую аминокислотную последовательность, могут быть подвергнуты сочетанию с одной молекулой VLP, что приводит предпочтительно к повторяющейся и упорядоченной структуре, представляющей несколько антигенных детерминант в ориентированном порядке, как описано в публикациях РСТ №№ WO 00/32227, WO 03/024481, WO 02/056905 и WO 04/007538.
В одном аспекте изобретения антигенный пептид связан с VLP посредством образования поперечных химических связей, обычно и предпочтительно с использованием гетеробифункционального кросс-линкера. В данной области известно несколько гетеро-бифункциональных кросс-линкеров. В некоторых воплощениях гетеро-бифункциональный кросс-линкер содержит функциональную группу, которая может реагировать с первыми сайтами присоединения, т.е. с аминогруппой боковой цепи остатков лизина VLP или субъединицы VLP, и другую функциональную группу, которая может реагировать с предпочтительным вторым сайтом присоединения, т.е. остатком цистеина, слитым с антигенным пептидом и возможно также доступным для реакции путем восстановления. Первая стадия этой процедуры, обычно называемая дериватизацией, представляет собой реакцию VLP с кросс-линкером. Продуктом этой реакции является активированная VLP, также называемая активированным носителем. На второй стадии непрореагировавший кросс-линкер удаляют, используя стандартные способы, такие как гель-фильтрация или диализ. На третьей стадии антигенный пептид подвергают взаимодействию с активированной VLP, и эту стадию обычно называют стадией сочетания. Непрореагировавший антигенный пептид может быть возможно удален на четвертой стадии, например, посредством диализа. В данной области известно несколько гетеро-бифункциональных кросс-линкеров. Они включают предпочтительные кросс-линкеры SMPH (Pierce), Sulfo-MBS, Sulfo-EMCS, Sulfo-GMBS, Sulfo-SIAB, Sulfo-SMPB, Sulfo-SMCC, SVSB, SIA и другие кросс-линкеры, доступные, например, от Pierce Chemical Company (Rockford, IL, США) и имеющие одну функциональную группу, реактивную в отношении аминогрупп, и одну функциональную группу, реактивную в отношении остатков цистеина. Все вышеупомянутые кросс-линкеры приводят к образованию тиоэфирной связи.
Другой класс кросс-линкеров, подходящих для осуществления изобретения, характеризуется введением дисульфидной связи между антигенным пептидом и VLP при сочетании. Предпочтительные кросс-линкеры, принадлежащие этому классу, включают в себя, например, SPDP и Sulfo-LC-SPDP (Pierce). Степень дериватизации VLP кросс-линкером может подвергаться влиянию со стороны меняющихся экспериментальных условий, таких как концентрация каждого из партнеров по реакции, избыток одного реагента над другим, рН, температура и ионная сила. Степень сочетания, т.е. количество антигенного пептида на субъединицы VLP, можно регулировать путем варьирования экспериментальных условий, описанных выше, для соответствия требованиям вакцины.
Другой способ связывания антигенных пептидов с VLP представляет собой связывание остатка лизина на поверхности VLP с остатком цистеина на антигенном пептиде. В некоторых воплощениях для сочетания с VLP может быть необходимым слияние аминокислотного линкера, содержащего остаток цистеина, в качестве второго сайта присоединения или в виде его части, с антигенным пептидом. В общем, гибкие аминокислотные линкеры являются предпочтительными. Примеры аминокислотного линкера выбраны из группы, состоящей из: (a) CGG; (б) N-концевого гамма 1-линкера; (в) N-концевого гамма 3-линкера; (г) Ig шарнирных участков; (д) N-концевых глициновых линкеров; (е) (G)kC(G)n с n=0 до 12 и k=0 до 5; (ж) N-концевой глицин-сериновые линкеры; (з) (G)kC(G)m(S)i(GGGGS)n с n = от 0 до 3, k = от 0 до 5, m = от 0 до 10, i = от 0 до 2; (и) GGC; (к) GGC-NH2; (л) С-концевого гамма 1-линкера; (м) С-концевого гамма 3-линкера; (н) С-концевых глициновых линкеров; (о) (G)nC(G)k с n = от 0 до 12 и k = от 0 до 5; (п) С-концевых глицин-сериновых линкеров; (р) (G)m(S)t(GGGGS)n(G)oC(G)k с n = от 0 до 3, k = от 0 до 5, m = от 0 до 10, t = от 0 до 2, и о=от 0 до 8. Дополнительные примеры аминокислотных линкеров представляют собой шарнирный участок иммуноглобулинов, глицин-сериновые линкеры (GGGGS)n и глициновые линкеры (G)n, все дополнительно содержащие остаток цистеина в качестве второго сайта присоединения и возможно дополнительные остатки глицина. Обычно предпочтительные примеры указанных аминокислотных линкеров представляют собой N-концевой гамма 1: CGDKTHTSPP (SEQ ID NO:94); С-концевой гамма 1: DKTHTSPPCG (SEQ ID NO:95); N-концевой гамма 3: CGGPKPSTPPGSSGGAP (SEQ ID NO:96); С-концевой гамма 3: PKPSTPPGSSGGAPGGCG (SEQ ID NO:97); N-концевой глициновый линкер: GCGGGG (SEQ ID NO:98) и С-концевой глициновый линкер: GGGGCG (SEQ ID NO:99).
Другие аминокислотные линкеры, особенно подходящие для осуществления изобретения, когда гидрофобный антигенный пептид связан с VLP, представляют собой CGKKGG (SEQ ID NO:100) или CGDEGG (SEQ ID NO:101) для N-концевых линкеров, или GGKKGC (SEQ ID NO:102) и GGEDGC (SEQ ID NO:103) для С-концевых линкеров. Для С-концевых линкеров, концевой цистеин возможно амидирован по С-концу.
В некоторых воплощениях настоящего изобретения линкеры GGCG (SEQ ID NO:104), GGC или GGC-NH2 ("NH2" означает амидирование) на С-конце пептида или CGG на его N-конце являются предпочтительными в качестве аминокислотных линкеров. В общем, остатки глицина будут встраиваться между объемистыми аминокислотами и цистеином, используемым в качестве второго сайта присоединения, во избежание возможного стерического несоответствия более объемистой аминокислоты в реакции сочетания. В другом воплощении изобретения аминокислотный линкер GGC-NH2 подвергают слиянию с С-концом антигенного пептида.
Остаток цистеина, присутствующий на антигенном пептиде, предпочтительно находится в своем восстановленном состоянии для взаимодействия с гетеро-бифункциональным кросс-линкером на активированной VLP, т.е. должны быть доступны свободный цистеин или остаток цистеина со свободной сульфгидрильной группой. В случае, когда остаток цистеина функционирует в качестве сайта связывания в окисленной форме, например, если он образует дисульфидный мостик, предпочтительным является восстановление этого дисульфидного мостика, например, с помощью DTT, ТСЕР или п-меркаптоэтанола. Низкие концентрации восстанавливающего агента сравнимы с сочетанием, как описано в публикации РСТ № WO 02/05690, тогда как более высокие концентрации ингибируют реакцию сочетания, как будет известно специалисту, и в этом случае восстановитель должен быть удален или его концентрация снижена перед сочетанием, например, посредством диализа, гель-фильтрации или HPLC с обращенной фазой.
Связывание антигенного пептида с VLP с использованием гетеро-бифункционального кросс-линкера согласно способам, описанным выше, делает возможным сочетание антигенного пептида с VLP ориентированным образом. Другие способы связывания антигенного пептида с VLP включают способы, где антигенный пептид сшит с VLP с использованием карбодиимида EDC и NHS.
В других способах антигенный пептид присоединен к VLP с использованием гомо-бифункционального кросс-линкера, такого как глутаральдегид, DSGBM [РЕО] 4, BS3, (Pierce Chemical Company, Rockford, IL, США) или другие известные гомо-бифункциональные кросс-линкеры с функциональными группами, реактивными по отношению к аминным группам или карбоксильным группам VLP.
Другие способы связывания VLP с антигенным пептидом включают способы, где VLP биотинилирована и антигенный пептид экспрессируется в виде стрептавидин-слитого белка, или способы, где и антигенный пептид, и VLP биотинилированы, например, как описано в публикации РСТ № WO 00/23955. В этом случае антигенный пептид можно сначала связывать со стрептавидином или авидином путем корректировки соотношения антигенного пептида к стрептавидину, так что свободные сайты связывания являются все еще доступными для связывания VLP, которую добавляют на следующей стадии. Альтернативно, все компоненты можно смешивать в "однореакторной" ("one pot") реакции. Другие лиганд-рецепторные пары, где растворимая форма рецептора и лиганда является доступной, и способные поперечно связываться с VLP или антигенным пептидом, могут быть использованы в качестве связывающих агентов для связывания антигенного пептида с VLP. Альтернативно, либо лиганд, либо рецептор могут быть слиты с антигенным пептидом, и таким образом опосредовать связывание с VLP, химически связанным или слитым соответственно либо с рецептором, либо с лигандом. На слияние также можно влиять посредством вставки или замены.
К одной субъединице капсида или VLP из оболочечных белков РНК-фага могут быть присоединены одна или несколько антигенных молекул, предпочтительно через экспонированные остатки лизина VLP РНК-фагов, если это стерически допустимо. Таким образом, специфическим признаком VLP из оболочечного белка РНК-фагов и, в частности, VLP из оболочечного белка Qbeta, является возможность связывать несколько антигенов на субъединицу. Это делает возможным образование плотной антигенной матрицы.
В одном из воплощений изобретения связывание и присоединение, соответственно, по меньшей мере одного антигена или антигенной детерминанты к вирусоподобной частице осуществляется посредством взаимодействия и ассоциации, соответственно, между по меньшей мере одним первым сайтом присоединения вирусоподобной частицы и по меньшей мере одним вторым сайтом присоединения антигенного пептида.
VLP или капсиды из оболочечного белка Qbeta экспонируют определенное число остатков лизина на своей поверхности, с определенной топологией с тремя остатками лизина, ориентированными внутрь капсида и взаимодействующими с РНК, и четырьмя другими остатками лизина, экспонированными на наружной поверхности капсида. Эти определенные свойства способствуют присоединению антигенов к наружной поверхности частицы, а не к внутренней поверхности частицы, где остатки лизина взаимодействуют с РНК. VLP из других оболочечных белков РНК-фага также имеют определенное число остатков лизина на своей поверхности и определенную топологию этих остатков лизина.
В другом воплощении настоящего изобретения первый сайт присоединения представляет собой остаток лизина и/или второй сайт присоединения содержит сульфгидрильную группу или остаток цистеина. В еще одном воплощении настоящего изобретения первый сайт присоединения представляет собой остаток лизина, и второй сайт присоединения представляет собой остаток цистеина. В других воплощениях антиген или антигенная детерминанта связаны через остаток цистеина с остатками лизина VLP из оболочечного белка РНК-фага, и, в частности, с VLP из оболочечного белка Qbeta.
Другим преимуществом VLP, происходящих из РНК-фагов, является их высокий выход экспрессии в бактериях, который делает возможным продукцию больших количеств материала по доступной цене. Более того, применение VLP в качестве носителей делает возможным образование надежных антигенных матриц и конъюгатов, соответственно, с регулируемой антигенной плотностью. В частности, применение VLP РНК-фагов и при этом, в частности, применение VLP из оболочечного белка РНК-фага Qbeta позволяет достичь очень высокой эпитопной плотности.
В некоторых воплощениях иммуногенные композиции могут содержать смеси иммуногенных конъюгатов, т.е. иммуногенных носителей, подвергнутых сочетанию с одним или несколькими антигенными тау-пептидами. Таким образом, эти иммуногенные композиции могут состоять из иммуногенных носителей, которые отличаются по аминокислотной последовательности. Например, могут быть получены вакцинные композиции, содержащие VLP "дикого типа" и модифицированный VLP белок, в котором один или более аминокислотных остатков были изменены (например, делегированы, вставлены или заменены). Альтернативно, может быть использован такой же иммуногенный носитель, но подвергнутый сочетанию с антигенными тау-пептидами, имеющими другие аминокислотные последовательности.
Поэтому настоящее изобретение также относится к способам получения иммуногена, включающим: 1) обеспечение антигенного тау-пептида согласно изобретению, 2) обеспечение иммуногенного носителя согласно изобретению, предпочтительно VLP, и 3) объединение указанного антигенного тау-пептида и указанного иммуногенного носителя. В одном из воплощений указанную стадию объединения осуществляют посредством образования поперечных химических связей, предпочтительно с использованием гетеробифункционального кросс-линкера.
Композиции, содержащие антигенный тау-пептид
Настоящее изобретение также относится к композициям, особенно к иммуногенным композициям, также называемым "рассматриваемыми иммуногенными композициями", содержащими антигенный тау-пептид по изобретению, предпочтительно связанный с иммуногенным носителем, более предпочтительно с VLP, еще более предпочтительно с HBsAg, HBcAg или Qbeta VLP, и возможно по меньшей мере один адъювант. Такие иммуногенные композиции, особенно приготовленные в виде фармацевтических композиций, считаются полезными для предупреждения, лечения или облегчения тау-ассоциированных расстройств, таких как болезнь Альцгеймера.
Иммуногенные композиции
В некоторых воплощениях рассматриваемая иммуногенная композиция согласно изобретению содержит антигенный тау-пептид, содержащий аминокислотную последовательность, выбранную из SEQ ID NO:1-26, 31-76 и 105-122. В некоторых воплощениях указанный антигенный тау-пептид связан с иммуногенным носителем, предпочтительно с VLP, более предпочтительно с HBsAg, HBcAg или Qbeta VLP.
Рассматриваемая иммуногенная композиция, содержащая антигенный тау-пептид согласно изобретению, может быть приготовлена различными путями, как описано более подробно ниже.
В некоторых воплощениях рассматриваемая иммуногенная композиция содержит один вид антигенного тау-пептида, например, иммуногенная композиция содержит популяцию антигенных тау-пептидов, которые по существу все имеют одинаковую аминокислотную последовательность. В других воплощениях рассматриваемая иммуногенная композиция содержит два или более различных антигенных тау-пептидов, например, иммуногенная композиция содержит популяцию антигенных тау-пептидов, члены которой могут различаться аминокислотной последовательностью.
Например, в некоторых воплощениях рассматриваемая иммуногенная композиция содержит первый антигенный тау-пептид, предпочтительно связанный с иммуногенным носителем, более предпочтительно с VLP, еще более предпочтительно с HBsAg, HBcAg или Qbeta VLP, и содержащий первую аминокислотную последовательность, выбранную из SEQ ID NO:1-26, 31-76 и 105-122; и по меньшей мере второй антигенный тау-пептид, предпочтительно связанный с иммуногенным носителем, более предпочтительно с VLP, еще более предпочтительно с HBsAg, HBcAg или Qbeta VLP, и содержащий вторую аминокислотную последовательность, предпочтительно выбранную из SEQ ID NO:1-26, 31-76 и 105-122, где вторая аминокислотная последовательность отличается от первой аминокислотной последовательности по меньшей мере 1, 2, 3, 4, 5, 6-10 или 15 аминокислотами.
В качестве другого примера, рассматриваемая иммуногенная композиция содержит первый антигенный тау-пептид, предпочтительно связанный с иммуногенным носителем, более предпочтительно с VLP, еще более предпочтительно с HBsAg, HBcAg или Qbeta VLP, и содержащий первую аминокислотную последовательность, выбранную из SEQ ID NO:1-26, 31-76 и 105-122; второй антигенный тау-пептид, предпочтительно связанный с иммуногенным носителем, более предпочтительно с VLP, еще более предпочтительно с HBsAg, HBcAg или Qbeta VLP, и содержащий вторую аминокислотную последовательность, предпочтительно выбранную из SEQ ID NO:1-26, 31-76 и 105-122, где вторая аминокислотная последовательность отличается от первой аминокислотной последовательности по меньшей мере 1, 2, 3, 4, 5, 6 до 10 или 15 аминокислотами; и по меньшей мере третий антигенный тау-пептид, предпочтительно связанный с иммуногенным носителем, более предпочтительно с VLP, еще более предпочтительно с HBsAg, HBcAg или Qbeta VLP, и содержащий третью аминокислотную последовательность, предпочтительно выбранную из SEQ ID NO:1-26, 31-76 и 105-122, где третья аминокислотная последовательность отличается и от первой, и от второй аминокислотных последовательностей по меньшей мере 1, 2, 3, 4, 5, 6 до 10 или 15 аминокислотами.
В других воплощениях рассматриваемая иммуногенная композиция содержит мультимеризованный антигенный тау-пептид, как описано выше. Как использовано в данной заявке, термины "иммуногенная композиция, содержащая антигенный тау-пептид", или "иммуногенная композиция по изобретению" или "рассматриваемая иммуногенная композиция" относятся к иммуногенной композиции, содержащей либо один вид (мультимеризованный или нет) или повторяющийся вид антигенного(ых) тау-пептида(ов), подвергнутых сочетанию или не подвергнутых сочетанию с иммуногенным носителем.
Адъюванты
В некоторых воплощениях рассматриваемая иммуногенная композиция содержит по меньшей мере один адъювант.Подходящие адъюванты включают в себя адъюванты, подходящие для применения у млекопитающих, предпочтительно у людей. Примеры известных подходящих адъювантов, которые могут быть использованы у людей, включают в себя, но не обязательно ограничиваются этим, квасцы, фосфат алюминия, гидроксид алюминия, MF59™ (4,3% масс./об. сквалена, 0,5% масс./об. полисорбата 80 (Tween 80), 0,5% масс./об. сорбитантриолеата (Span 85)), CpG-содержащие нуклеиновые кислоты (где цитозин является неметилированным), QS21 (адъювант на основе сапонина), MPL (монофосфориллипид A), 3DMPL (3-0-деацилированный MPL), экстракты из Aquilla, ISCOMS (см., например, Sjolander et al„ J. Leukocyte Biol. 64:713 (1998)); публикации РСТ №№ WO 90/03184, WO 96/11711, WO 00/48630, WO 98/36772, WO 00/41720, WO 06/134423 и WO 07/026190), LT/CT мутанты, поли(D,L-лактид-со-гликолид)ные (PLG) микрочастицы, Quil А, интерлейкины и тому подобное. Для ветеринарных применений, включающих, но не ограничивающихся экспериментами на животных, можно использовать адъювант Фрейнда, N-ацетил-мурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетил-нор-мурамил-L-аланил-D-изоглутамин (CGP 11637, называемый нор-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин (CGP 19835A, называемый МТР-РЕ) и RIBI, который содержит три компонента, экстрагированных из бактерий, монофосфориллипид А, димиколат трегалозы и скелет клеточной стенки (MPL+TDM+CWS) в эмульсии 2% сквален/Tween 80.
Другие примерные адъюванты для увеличения эффективности композиции включают в себя, но не ограничиваются этим: (1) препараты эмульсии типа масло-в-воде (с другими специфическими иммуностимулирующими агентами, такими как мурамилпептиды (см. ниже) или компоненты бактериальных клеточных стенок, или без них), такие как, например, (a) MF59™ (публикация РСТ № WO 90/14837; Глава 10 в Vaccine design: the subunit and adjuvant approach, eds. Powell & Newman, Plenum Press 1995), содержащий 5% сквалена, 0,5% Tween 80 (полиоксиэтиленсорбитан моноолеат) и 0,5% Span 85 (сорбитан триолеат) (возможно содержащий мурамилтрипептид, ковалентно связанный с дипальмитоилфосфатидилэтаноламином (МТР-РЕ)), приготовленным в виде субмикронных частиц с использованием микрофлюидизатора, (б) SAF, содержащий 10% сквалена, 0,4% Tween 80, 5% плюроник-блокированного полимера L121, и thr-MDP, либо подвергнутого микрофлюидизации в субмикронную эмульсию, либо подвергнутого встряхиванию для создания эмульсии с частицами более крупных размеров, и (в) адъювантная система RIBI™ (RAS), (Ribi Immunochem, Hamilton, MT), содержащая 2% сквалена, 0,2% Tween 80 и один или более компонентов бактериальной клеточной стенки, таких как монофосфориллипид A (MPL), димиколат трегалозы (TDM) и скелет клеточной стенки (CWS), предпочтительно MPL+CWS (DETOX™); (2) адъюванты на основе сапонина, такие как QS21, STIMULON™ (Cambridge Bioscience, Worcester, MA), Abisco® (Isconova, Швеция) или Iscomatrix® (Commonwealth Serum Laboratories, Австралия), могут быть использованы или частицы, образованные из них, такие как ISCOM (иммуностимулирующие комплексы), которые ISCOMS могут быть свободны от дополнительного детергента, например, публикация РСТ № WO 00/07621; (3) полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA); (4) цитокины, такие как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 (публикация РСТ № WO 99/44636) и т.д.), интерфероны (например, гамма-интерферон), колониестимулирующий фактор макрофагов (M-CSF), фактор некроза опухолей (TNF) и т.д.; (5) монофосфориллипид А (MPL) или 3-0-деацилированный MPL (3dMPL), например, патент Великобритании № GB-2220221 и Европейский патент № ЕР-А-0689454, возможно при существенном отсутствии квасцов при использовании с пневмококковыми сахаридами, например, публикация РСТ № WO 00/56358; (6) комбинации 3dMPL, например, с QS21 и/или эмульсиями типа масло-в-воде, например, ЕР-А-0835318, ЕР-А-0735898, ЕР-А-0761231; (7) олигонуклеотиды, содержащие CpG-мотивы [Krieg, Vaccine (2000) 19:618-622; Krieg, CurrOpin Mol Ther(2001) 3:15-24; Roman et al., Nat. Med. (1997) 3:849-854; Weiner et al., PNAS USA (1997) 94:10833-10837; Davis et al., J. Immunol (1998) 160:870-876; Chu et al., J. Exp. Med (1997) 186:1623-1631; Lipford et al., Ear. J. Immunol. (1997) 27:2340-2344; Moldoveami et al., Vaccine (1988) 16:1216-1224, Krieg et al., Nature (1995) 374:546-549; Klinman et al., PNAS USA (1996) 93:2879-2883; Ballas et al., J. Immunol, (1996) 157:1840-1845; Cowdery et al., J. Immunol (1996) 156:4570-4575; Halpern et al., Cell Immunol. (1996) 167:72-78; Yamamoto et al., Jpn. J. Cancer Res., (1988) 79:866-873; Stacey et al., J. Immunol., (1996) 157:2116-2122; Messina et al., J. Immunol, (1991) 147:1759-1764; Yi et al., J. Immunol (1991) 157:4918-4925; Yi et al., J. Immunol (1996) 157:5394-5402; Yi et al., J. Immunol, (1998) 160:4755-4761; и Yi et al., J. Immunol, (1998) 160:5898-5906; публикации РСТ №№ WO 96/02555, WO 98/16247, WO 98/18810, WO 98/40100, WO 98/55495, WO 98/37919 и WO 98/52581], т.е. содержащие по меньшей мере один динуклеотид CG, где цитозин является неметилированным; (8) простой полиоксиэтиленовый эфир или сложный полиоксиэтиленовый эфир, например, публикация РСТ № WO 99/52549; (9) поверхностно-активное вещество на основе сложного эфира полиоксиэтиленсорбитана в комбинации с октоксинолом (публикация РСТ № WO 01/21207), или поверхностно-активное вещество на основе полиоксиэтиленалкилового простого эфира или сложного эфира в комбинации по меньшей мере с одним дополнительным неионным поверхностно-активным веществом, таким как октоксинол (публикация РСТ № WO 01/21152); (10) сапонин и иммуностимулирующий олигонуклеотид (например, CpG-олигонуклеотид) (публикация РСТ № WO 00/62800); (11) иммуностимулятор и частица соли металла, например, публикация РСТ № WO 00/23105; (12) сапонин и эмульсия масло-в-воде, например, публикация РСТ № WO 99/11241; (13) сапонин (например QS21)+3dMPL+IM2 (возможно+стерин), например, публикация РСТ № WO 98/57659; (14) другие вещества, которые действуют в качестве иммуностимулирующих агентов для увеличения эффективности композиции, такие как мурамилпептиды, включающие N-ацетил-мурамил-L-треонил-D-изоглутамин (thr-MDP), N-25 ацетил-нормурамил-L-аланил-D-изоглутамин (нор-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин МТР-РЕ), (15) лиганды для toll-подобных рецепторов (TLR), природные или синтезированные (например, как описано в Kanzler et al., Nature Med. 13:1552-1559 (2007)), включая лиганды TLR3, такие как поли(1:С) и сходные соединения, такие как Hiltonol и Ampligen.
В одном из воплощений иммуногенная композиция по настоящему изобретению содержит по меньшей мере один адъювант.В конкретном воплощении указанный адъювант представляет собой иммуностимулирующий олигонуклеотид и более предпочтительно CpG-олигонуклеотид. В одном из воплощений CpG-олигонуклеотид имеет последовательность нуклеиновой кислоты 5' TCGTCGTTTTGTCGTTTTGTCGTT 3' (CpG 7909; SEQ ID NO:27). В другом воплощении CpG-олигонуклеотид имеет последовательность нуклеиновой кислоты 5' TCGTCGTTTTTCGGTGCTTTT 3' (CpG 24555; SEQ ID NO:29). Последовательность нуклеиновой кислоты иммуностимулирующего олигонуклеотид a SEQ ID NO:29 отличается от ранее описанного иммуностимулирующего олигонуклеотида (CpG 10103) 5' TCGTCGTTTTTCGGTCGTTTT3' (SEQ ID NO:28) обращением ближайшего к 3'-концу динуклеотида CG. Сходство в активности между этими двумя иммуностимулирующими олигонуклеотидами является неожиданным, поскольку ранее сообщалось, что иммуностимулирующая активность CpG-олигонуклеотидов не зависит от числа CpG-мотивов, последовательностей, фланкирующих динуклеотид CG, локализации СрС-мотива(ов) и расстояния между CpG-мотивами (Ballas et al., 1996, J. Immunol.; Hartmann et al., 2000, J. Immunol.; Klinman et al., 2003, Clin. Ехр. Immunol.). Удаление ближайшего к 3'-концу динуклеотида CG в иммуностимулирующем олигонуклеотиде CpG 24555 не приводила к отрицательному влиянию на способность этого иммуностимулирующего олигонуклеотида усиливать антиген-специфические иммунные ответы, как ожидалось из предыдущих описаний. CpG 24555 продемонстрировал сходную и в некоторых случаях повышенную иммуностимулирующую активность при сравнении с CpG 10103.
Иммуностимулирующий олигонуклеотид может быть двухцепочечным или одноцепочечным. Обычно двухцепочечные молекулы являются более стабильными in vivo, тогда как одноцепочечные молекулы имеют повышенную иммунную активность. Таким образом, в некоторых аспектах изобретения предпочтительно, чтобы нуклеиновая кислота была одноцепочечной, а в других аспектах предпочтительно, чтобы нуклеиновая кислота была двухцепочечной.
Для любой из CpG-последовательностей, описанных в данной заявке (например, CpG 24555, CpG 10103 и CpG 7909), любая из межнуклеотидных связей может представлять собой фосфоротиоатную или фосфодиэфирную связи.
Термины "нуклеиновая кислота" и "олигонуклеотид" используются в данной заявке взаимозаменяемо для обозначения множества нуклеотидов (т.е. молекул, содержащих сахар (например, рибозу или дезоксирибозу), связанный с фосфатной группой и с заменяемым органическим основанием, которое представляет собой либо замещенный пиримидин (например, цитозин (С), тимидин (Т) или урацил (U)), либо замещенный пурин (например, аденин (А) или гуанин (G)). Как использовано в данной заявке, данные термины относятся к олигорибонуклеотидам (т.е. полинуклеотиду минус фосфат) и любому другому полимеру, содержащему органическое основание. Молекулы нуклеиновых кислот могут быть получены из существующих источников нуклеиновых кислот (например, геномной или кДНК), но являются предпочтительно синтетическими (например, полученными посредством синтеза нуклеиновой кислоты).
В одном из воплощений иммуностимулирующие олигонуклеотиды могут охватывать различные химические модификации и замены по сравнению с природной РНК и ДНК, включая фосфодиэфирный межнуклеозидный мостик, β-D-рибозное (дезоксирибозное) звено и/или природное нуклеозидное основание (аденин, гуанин, цитозин, тимин, урацил). Примеры химических модификаций известны специалисту и описаны, например, в Uhlmann E. et al. (1990), Chem. Rev. 90:543; "Protocols for Oligonucleotides and Analogs", Synthesis and Properties & Synthesis and Analytical Techniques, S. Agrawal, Ed., Humana Press, Totowa, USA 1993; Crooke, S.T. et al. (1996) Annu. Rev. Pharmacol. Toxicol. 36:107-129; и Hunziker J. et al., (1995), Mod. Synth. Methods 7:331-417. Олигонуклеотид согласно изобретению может иметь одну или более модификаций, где каждая модификация расположена в конкретном фосфодиэфирном межнуклеозидном мостике и/или в конкретном β-D-(дезокси)рибозном звене и/или в конкретном положении природного нуклеозидного основания по сравнению с олигонуклеотидом такой же последовательности, которая состоит из природной ДНК или РНК.
Например, олигонуклеотиды могут содержать одну или более модификаций. Такие модификации могут быть выбраны из: а) замены фосфодиэфирного межнуклеозидного мостика, расположенного на 3'- и/или 5'-конце нуклеозида, модифицированным межнуклеозидным мостиком, б) замены фосфодиэфирного мостика, расположенного на 3'- и/или 5'-конце нуклеозида, дефосфомостиком, в) замены сахарофосфатного звена из сахарофосфатного скелета другим звеном, г) замены β-D-рибозного звена модифицированным сахарным звеном, и д) замены природного нуклеозидного основания.
Нуклеиновые кислоты также включают замещенные пурины и пиримидины, такие как С-5 пропинпиримидиновые и 7-деаза-7-замещенные пуриновые модифицированные основания (Wagner et al., 1996, Nat. Biotechnol. 14:840-4). Пурины и пиримидины включают в себя, но не ограничиваются этим, аденин, цитозин, гуанин, тимидин, 5-метилцитозин, 2-аминопурин, 2-амино-6-хлорпурин, 2,6-диаминопурин, гипоксантин и другое природные и неприродные нуклеооснования, замещенные и незамещенные ароматические группировки. Другие такие модификации хорошо известны специалистам в данной области.
Модифицированное основание представляет собой любое основание, которое химически отличается от встречающихся в природе оснований, обычно обнаруживаемых в ДНК и РНК, таких как Т, С, G, А и U, но которое имеет общие химические структуры с этими встречающимися в природе основаниями. Модифицированное нуклеозидное основание может быть выбрано, например, из гипоксантина, урацила, дигидроурацила, псевдоурацила, 2-тиоурацила, 4-тиоурацила, 5-аминоурацила, 5-(С1-С6)-алкилурацила, 5-(С2-С6)-алкенилурацила, 5-(С2-С6)-алкинилурацила, 5-(гидроксиметил)урацила, 5-хлорурацила, 5-фторурацила, 5-бромурацила, 5-гидроксицитозина, 5-(С1-С6)-алкилцитозина, 5-(С2-С6)-алкенилцитозина, 5-(С2-С6)-алкинилцитозина, 5-хлорцитозина, 5-фторцитозина, 5-бромцитозина, N2-диметилгуанина, 2,4-диамино-пурина, 8-азапурина, замещенного 7-деазапурина, предпочтительно 7-деаза-7-замещенного и/или 7-деаза-8-замещенного пурина, 5-гидроксиметилцитозина, N4-алкилцитозина, например N4-этилцитозина, 5-гидроксидезоксицитидина, 5-гидроксиметилдезоксицитидина, N4-алкилдезоксицитидина, например N4-этилдезоксицитидина, 6-тиодезоксигуанозина и дезоксирибонуклеозидов нитропиррола, С5-пропинилпиримизина и диаминопурина, например 2,6-диаминопурина, инозина, 5-метилцитозина, 2-аминопурина, 2-амино-6-хлорпурина, гипоксантина или других модификаций природного нуклеозидного основания. Этот перечень является примерным и не должен интерпретироваться как ограничивающий.
В некоторых аспектах изобретения CpG-динуклеотид из иммуностимулирующих олигонуклеотидов, описанных в данной заявке, является предпочтительно неметилированным. Неметилированный CpG-мотив представляет собой последовательность неметилированного цитозин-гуанинового динуклеотида (т.е. неметилированный 5'-цитозин, затем 3'-гуанозин, связанные фосфатной связью). В других аспектах CpG-мотивы являются метилированными. Метилированный CpG-мотив представляет собой последовательность динуклеотида метилированный цитозин-гуанин (т.е. метилированный 5'-цитозин, затем 3'-гуанозин, связанные фосфатной связью).
В некоторых аспектах изобретения иммуностимулирующий олигонуклеотид может содержать модифицированный цитозин. Модифицированный цитозин представляет собой встречающийся в природе или не встречающийся в природе аналог пиримидинового основания цитозина, который может заменить это основание без ухудшения иммуностимулирующей активности данного олигонуклеотида. Модифицированные цитозины включают в себя, но не ограничиваются этим, 5-замещенные цитозины (например 5-метил-цитозин, 5-фтор-цитозин, 5-хлор-цитозин, 5-бром-цитозин, 5-йод-цитозин, 5-гидрокси-цитозин, 5-гидроксиметил-цитозин, 5-дифторметил-цитозин и незамещенный или замещенный 5-алкинил-цитозин), 6-замещенные цитозины, М4-замещенные цитозины (например N4-этил-цитозин), 5-аза-цитозин, 2-меркапто-цитозин, изоцитозин, псевдо-изоцитозин, аналоги цитозина с конденсированными кольцевыми системами (например N,N'-пропиленцитозин или феноксазин), и урацил и его производные (например 5-фтор-урацил, 5-бром-урацил, 5-бромвинил-урацил, 4-тио-урацил, 5-гидрокси-урацил, 5-пропинил-урацил). Некоторые из предпочтительных цитозинов включают в себя 5-метил-цитозин, 5-фтор-цитозин, 5-гидрокси-цитозин, 5-гидроксиметил-цитозин и N4-этил-цитозин. В другом воплощении изобретения основание цитозина замещено универсальным основанием (например 3-нитропирролом, Р-основанием), ароматической кольцевой системой (например фторбензолом или дифторбензолом) или атомом водорода (dSpacer).
В некоторых аспектах изобретения иммуностимулирующий олигонуклеотид может содержать модифицированный гуанин. Модифицированный гуанин представляет собой встречающийся в природе или не встречающийся в природе аналог пуринового основания гуанина, который может заменить это основание без ухудшения иммуностимулирующей активности данного олигонуклеотида. Модифицированные гуанины включают в себя, но не ограничиваются этим, 7-деазагуанин, 7-деаза-7-замещенный гуанин, гипоксантин, N2-замещенные гуанины (например N2-метил-гуанин), 5-амино-3-метил-3Н,6Н-тиазоло[4,5-d]пиримидин-2,7-дион, 2,6-диаминопурин, 2-аминопурин, пурин, индол, аденин, замещенные аденины (например Мб-метил-аденин, 8-оксо-аденин), 8-замещенный гуанин (например 8-гидроксигуанин и 8-бромгуанин) и 6-тиогуанин. В другом воплощении изобретения гуаниновое основание замещено универсальным основанием (например 4-метил-индолом, 5-нитро-индолом и К-основанием), ароматической кольцевой системой (например бензимидазолом или дихлор-бензимидазолом, амидом 1-метил-1Н-[1,2,4]триазол-3-карбоновой кислоты) или атомом водорода (dSpacer).
В некоторых аспектах олигонуклеотиды могут включать модифицированные межнуклеотидные связи. Эти модифицированные связи могут быть частично устойчивы к деградации (например, стабилизированы). "Стабилизированная молекула нуклеиновой кислоты" означает молекулу нуклеиновой кислоты, которая относительно устойчива к деградации in vivo (например, посредством экзо- или эндо-нуклеазы). Стабилизация может зависеть от длины или вторичной структуры. Нуклеиновые кислоты, которые имеют длину от десятков до сотен тысяч пар оснований, относительно устойчивы к деградации in vivo. Что касается более коротких нуклеиновых кислот, то вторичная структура может стабилизировать и увеличивать их эффект. Образование структуры "стебель-петля" может стабилизировать молекулу нуклеиновой кислоты. Например, если 3'-конец нуклеиновой кислоты имеет самокомплементарность с вышележащим участком, так что он может складываться и образовывать структуру "стебель-петля", то нуклеиновая кислота может стабилизироваться и демонстрировать большую активность.
Для применения in vivo, нуклеиновые кислоты предпочтительно являются относительно устойчивыми к деградации (например, посредством эндо- и экзо-нуклеаз). Было продемонстрировано, что модификация скелета нуклеиновой кислоты обеспечивает повышенную активность нуклеиновых кислот при введении in vivo. Вторичные структуры, такие как "стебель-петли", могут стабилизировать нуклеиновые кислоты против деградации. Альтернативно, стабилизация нуклеиновых кислот может осуществляться посредством модификаций фосфатного скелета. Предпочтительная стабилизированная нуклеиновая кислота имеет по меньшей мере частичный фосфоротиоатный модифицированный скелет.Фосфоротиоаты могут быть синтезированы с использованием автоматизированных методов, в которых используют либо фосфорамидатную, либо Н-фосфонатную химию. Арил- и алкил-фосфонаты могут быть получены, например, как описано в патенте США №4469863; и алкилфосфотриэфиры (в которых заряженная кислородная группировка алкилирована, как описано в патенте США №5023243 и Европейском патенте №092574) могут быть получены посредством автоматизированного твердофазного синтеза с использованием коммерчески доступных реагентов. Способы осуществления других модификаций и замен в скелете ДНК были описаны (Uhlmann, E. and Peyman, A. (1990) Chem. Rev. 90:544; Goodchild, J. (1990) Bioconjugate Chem. 1:165). 2'-O-метил-нуклеиновые кислоты с CpG-мотивами также вызывают иммунную активацию, как и этокси-модифицированные CpG-нуклеиновые кислоты. Фактически, не было обнаружено никаких скелетных модификаций, которые полностью отменяют CpG-эффект, хотя он значительно уменьшается путем замены С на 5-метил-С. Конструкции, имеющие фосфоротиоатные связи, обеспечивают максимальную активность и защищают нуклеиновую кислоту от деградации внутриклеточными экзо- и эндо-нуклеазами. Другие модифицированные нуклеиновые кислоты включают фосфодиэфир-модифицированные нуклеиновые кислоты, комбинации фосфодиэфирной и фосфоротиоатной нуклеиновой кислоты, метилфосфонат, метилфосфоротиоат, фосфородитиоат, п-этокси и их комбинации. Каждая из этих комбинаций и их конкретные эффекты на иммунные клетки обсуждаются более подробно в отношении CpG-нуклеиновых кислот в публикациях РСТ №№ WO 96/02555 и WO 98/18810 и в пат. США №№6194388 и 6239116. Полагают, что эти модифицированные нуклеиновые кислоты могут демонстрировать большую стимулирующую активность благодаря повышенной устойчивости к нуклеазам, повышенному клеточному поглощению, повышенному связыванию белков и/или измененной внутриклеточной локализации.
Для введения in vivo, нуклеиновые кислоты могут быть связаны с молекулой, которая приводит к более высокой аффинности связывания с поверхностью целевой клетки (например дендритной клетки, В-клетки, моноцитарной клетки и природной клетки-киллера (NK)) и/или повышенному клеточному поглощению целевыми клетками с образованием "комплекса для доставки нуклеиновой кислоты". Нуклеиновые кислоты могут быть ионно или ковалентно ассоциированы с подходящими молекулами с использованием методов, которые хорошо известны в данной области. Может быть использовано множество агентов сочетания или сшивания, например, белок А, карбодиимид и N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP). Альтернативно, нуклеиновые кислоты могут быть инкапсулированы в липосомы или виросомы с использованием хорошо известных методов.
Другие стабилизированные нуклеиновые кислоты включают в себя, но не ограничиваются этим, неионные аналоги ДНК, такие как алкил- и арилфосфаты (в которых заряженный фосфонатный кислород заменен алкильной или арильной группой), фосфодиэфир и алкилфосфотриэфиры, в которых заряженная кислородная группировка является алкилированной. Нуклеиновые кислоты, которые содержат диол, такой как тетраэтиленгликоль или гексаэтиленгликоль, либо на одном, либо на обоих концах, также, как было показано, по существу устойчивы к деградации нуклеазами. В некоторых воплощениях иммуностимулирующий олигонуклеотид по изобретению может включать по меньшей мере один липофильный замещенный нуклеотидный аналог и/или пиримидин-пуриновый динуклеотид.
Олигонуклеотиды могут иметь один или два доступных 5'-конца. Можно создавать модифицированные олигонуклеотиды, имеющие два таких 5'-конца, например, путем присоединения двух олигонуклеотидов через 3'-3' связь для создания олигонуклеотида, имеющего один или два доступных 5'-конца. 3'-3'-связь может быть фосфодиэфирный, фосфоротиоатный или любой другой модифицированный межнуклеозидный мостик. Способы создания таких связей известны в данной области. Например, такие связи были описаны в Seliger, Н. et al., Oligonucleotide analogs with terminal 3'-3'- и 5'-5'-internucleotidic linkages as antisense inhibitors of viral gene expression, Nucleosides & Nucleotides (1991), 10 (1-3), 469-77 и Jiang, et al., Pseudo-cyclic oligonucleotides: in vitro and in vivo properties, Bioorganic & Medicinal Chemistry (1999), 7 (12), 2727-2735.
Кроме того, 3'-3'-связанные олигонуклеотиды, где связь между 3'-концевыми нуклеозидами не является фосфодиэфирным, фосфоротиоатным или другим модифицированным мостиком, могут быть получены с использованием дополнительного спейсера, такого как три- или тетра-этиленгликольфосфатная группировка (Durand, M. et al., Triple-helix formation by an oligonucleotide containing one (dA)12 and two (dT)12 sequences bridged by two hexaethylene glycol chains, Biochemistry (1992), 31 (38), 9197-204, пат. США №№5658738 и 5668265). Альтернативно, ненуклеотидный линкер может происходить из этандиола, пропандиола или из лишенного азотистого основания дезоксирибозного (dSpacer) звена (Fontanel, Marie Laurence et al., Nucleic Acids Research (1994), 22 (11), 2022-7) с использованием стандартной фосфорамидатной химии. Ненуклеотидные линкеры могут быть включены один или несколько раз, или объединены друг с другом, обеспечивая любое желательное расстояние между 3'-концами двух олигонуклеотидов, подлежащих связыванию.
Фосфодиэфирный межнуклеозидный мостик, расположенный на 3'- и/или 5'-конце нуклеозида, может быть заменен модифицированным межнуклеозидным мостиком, где модифицированный межнуклеозидный мостик выбран, например, из фосфоротиоатного, фосфородитиоатного, NR1R2-фосфорамидатного, боранофосфатного, α-гидроксибензилфосфонатного, фосфат-(С1-С21)-O-алкилсложноэфирного, фосфат-[(С6-С12)арил-(С1-С21)-O-алкил]сложноэфирного, (С1-С8)алкилфосфонатного и/или (С6-С12)арилфосфонатного мостиков, (С7-С12)-α-гидроксиметил-арила (например, описанного в публикации РСТ № WO 95/01363), где (С6-С12)арил, (С6-С20)арил и (С6-С14)арил возможно замещены галогеном, алкилом, алкокси, нитро, циано, и где R1 и R2 независимо друг от друга представляют собой водород, (C1-C18)-алкил, (С6-С20)-арил, (С6-С14)-арил, (С1-С8)-алкил, предпочтительно водород, (С1-С8)-алкил, предпочтительно (С1-С4)-алкил и/или метоксиэтил, или R1 и R2 образуют вместе с атомом азота, несущим их, 5-6-членное гетероциклическое кольцо, которое может дополнительно содержать дополнительный гетероатом, выбранный из группы О, S и N.
Замена фосфодиэфирного мостика расположенного на 3'- и/или 5'-конце нуклеозида дефосфомостиком (дефосфомостики описаны, например, в Uhlmann E. and Peyman А. В "Methods in Molecular Biology", Vol.20, "Protocols for Oligonucleotides and Analogs", S.Agrawal, Ed., Humana Press, Totowa 1993, Chapter 16, pp.355ff), где дефосфомостик выбран, например, из дефосфомостиков формацетальных, 3'-тиоформацетальных, метилгидроксиламинных, оксимных, метилендиметил-гидразо, диметиленсульфоновых и/или силильных групп.
Иммуностимулирующие олигонуклеотиды по изобретению возможно могут иметь химерные скелеты. Химерный скелет представляет собой скелет, который содержит более чем один тип связи. В одном из воплощений химерный скелет может быть представлен формулой: 5'-Y1N1ZN2Y2 3'. Y1 и Y2 представляют собой молекулы нуклеиновой кислоты, имеющие от 1 до 10 нуклеотидов. Каждый из Y1 и Y2 включает по меньшей мере одну модифицированную межнуклеотидную связь. Поскольку по меньшей мере 2 нуклеотида из химерных олигонуклеотидов включают модификации скелета, эти нуклеиновые кислоты являются примером одного типа "стабилизированных иммуностимулирующих нуклеиновых кислот".
Что касается химерных олигонуклеотидов, то Y1 и Y2 рассматриваются независимо друг от друга. Это означает, что каждый из Y1 и Y2 может иметь или может не иметь отличные друг от друга последовательности и различные скелетные связи в одной и той же молекуле. В некоторых воплощениях Y1 и/или Y2 имеют от 3 до 8 нуклеотидов. N1 и N2 представляют собой молекулы нуклеиновой кислоты, имеющие от 0 до 5 нуклеотидов при условии, что N1ZN2 имеет по меньшей мере 6 нуклеотидов в целом. Нуклеотиды N1ZN2 имеют фосфодиэфирный скелет и не включают нуклеиновые кислоты, имеющие модифицированный скелет. Z представляет собой иммуностимулирующий мотив нуклеиновой кислоты, предпочтительно выбранный из перечисленных в данной заявке.
Центральные нуклеотиды (N1ZN2) формулы Y1N1ZN2Y2 имеют фосфодиэфирные межнуклеотидные связи, и Y1 и Y2 имеют по меньшей мере одну, но могут иметь более чем одну или даже могут иметь все модифицированные межнуклеотидные связи. В предпочтительных воплощениях Y1 и/или Y2 имеют по меньшей мере две или от двух до пяти модифицированных межнуклеотидных связей, или Y1 имеет пять модифицированных межнуклеотидных связей, и Y2 имеет две модифицированные межнуклеотидные связи. Модифицированная межнуклеотидная связь в некоторых воплощениях представляет собой фосфоротиоатную модифицированную связь, фосфородитиоатную связь или п-этокси-модифицированную связь.
Нуклеиновые кислоты также включают в себя нуклеиновые кислоты, имеющие скелетные сахара, которые ковалентно присоединены к низкомолекулярным органическим группам, но не к гидроксильной группе в 2'-положении и не к фосфатной группе в 5'-положении. Таким образом, модифицированные нуклеиновые кислоты могут включать 2'-O-алкилированную рибозную группу. Кроме того, модифицированные нуклеиновые кислоты могут включать сахара, такие как арабиноза или 2'-фторарабиноза, вместо рибозы. Таким образом, нуклеиновые кислоты могут быть гетерогенными по составу скелета, при этом содержащими любую возможную комбинацию полимерных звеньев, связанных вместе, таких как пептид-нуклеиновые кислоты (которые имеют аминокислотный скелет с основаниями нуклеиновых кислот). В некоторых воплощениях нуклеиновые кислоты являются гомогенными по составу скелета.
Сахарофосфатное звено (т.е. β-D-рибоза и фосфодиэфирный межнуклеозидный мостик, вместе образующие Сахарофосфатное звено) из сахарофосфатного скелета (т.е. сахарофосфатный скелет состоит из сахарофосфатных звеньев) может быть заменено другим звеном, где другое звено, например, подходит для создания "морфолино-производного" олигомера (как описано, например, в Stirchak E.P. et al. (1989) Nucleic Acid Res. 17:6129-41), т.е., например, замены морфолино-производным; или для создания полиамидной нуклеиновой кислоты ("PNA"; как описано, например, в Nielsen P.E. et al. (1994) Bioconjug. Chem. 5:3-7), например, замены PNA скелетным звеном, например, 2-аминоэтилглицином. Олигонуклеотид может иметь другие углеводные скелетные модификации и замены, такие как пептидные нуклеиновые кислоты с фосфатными группами (PHONA), замкнутые (locked) нуклеиновые кислоты (LNA) и олигонуклеотиды, имеющие скелетные отрезки с алкильными линкерами или аминолинкерами. Алкильный линкер может быть разветвленным или неразветвленным, замещенным или незамещенным, и хирально чистым или представлять собой рацемическую смесь.
Р-Рибозное звено или β-D-2' -дезоксирибозное звено может быть заменено модифицированным сахарным звеном, где модифицированное сахарное звено выбрано, например, из β-D-рибозы, α-D-2'-дезоксирибозы, L-2'-дезоксирибозы, 2'-F-2' -дезоксирибозы, 2'-F-арабинозы, 2'-O-(С1-С6)алкил-рибозы, предпочтительно 2'-O-(С1-С6)алкил-рибоза представляет собой 2'-O-метилрибозу, 2'-O-(С1-С6)алкенил-рибозу, 2'-[O-(С1-С6)алкил-O-(С1-С6)алкил]-рибозу, 2'-NH2-2'-дезоксирибозу, β-D-ксило-фуранозу, α-арабинофуранозу, 2,4-дидезокси-β-D-эритро-гексо-пиранозу, и карбоциклическими сахарными аналогами (описаны, например, в Froehler J. (1992) Am. Chem. Soc. 114:8320) и/или сахарными аналогами с открытой церью (описаны, например, в Vandendriessche et al. (1993) Tetrahedron 49:7223) и/или бициклосахарными аналогами (описаны, например, в Tarkov М. et al. (1993) Helv. Chim. Acta. 76:481).
В некоторых воплощениях сахар представляет собой 2'-O-метилрибозу, особенно для одного или обоих нуклеотидов, связанных фосфодиэфирной или фосфодиэфир-подобной межнуклеозидной связью.
Олигонуклеотиды по изобретению могут быть синтезированы cte novo с использованием любой из множества процедур, хорошо известных в данной области. Например, b-цианоэтилфосфорамидатный способ (Beaucage, S.L., and Caruthers, М.Н., (1981) Tet. Let. 22:1589); нуклеозид Н-фосфонатный способ (Garegg et al., (1986) Tet. Let. 27:4051-4054; Froehler et al., (1986) Nucl. Acid Res. 14:5399-5407; Garegg et al., (1986) 27:4055-4058; Gaffney et al., (1988) Tet. Let. 29:2619-2622). Эти химические способы можно осуществлять с помощью многочисленных автоматизированных синтезаторов нуклеиновых кислот, имеющихся в продаже. Эти олигонуклеотиды называются синтетическими олигонуклеотидами. Альтернативно, Т-богатые и/или TG динуклеотиды можно продуцировать в крупном масштабе в плазмидах (см. Sambrook Т. et al., "Molecular Cloning: A Laboratory Manual", Cold Spring Harbor Laboratory Press, New York, 1989) и разделять на более мелкие сегменты или вводить целиком. Нуклеиновые кислоты могут быть получены из существующих последовательностей нуклеиновых кислот (например, геномной или кДНК) с использованием известных методов, таких как методы, в которых применяют рестрикционные ферменты, экзонуклеазы или эндонуклеазы.
Модифицированные скелеты, такие как фосфоротиоаты, могут быть синтезированы с использованием автоматизированных методов, в которых применяют либо фосфорамидатную, либо Н-фосфонатную химии. Арил- и алкил-фосфонаты могут быть получены, например, как описано в пат. США №4469863, и алкилфосфотриэфиры (в которых заряженная кислородная группировка является алкилированной, как описано в пат. США №5023243) могут быть получены с помощью автоматизированного твердофазного синтеза с использованием коммерчески доступных реагентов. Были описаны способы осуществления других модификаций и замен в скелете ДНК (например Uhlmann, E. and Peyman, A., Chem. Rev. 90:544, 1990; Goodchild, J., Bioconjugate Chem. 1:165, 1990).
Нуклеиновые кислоты, полученные таким способом, называются выделенными нуклеиновыми кислотами. "Выделенная нуклеиновая кислота" обычно относится к нуклеиновой кислоте, которая отделена от компонентов, с которыми она выделяется из клетки, из ядра, из митохондрий или из хроматина, и от любых других компонентов, которые можно рассматривать в качестве загрязнителей.
В некоторых воплощениях CpG-содержащие олигонуклеотиды могут быть просто смешаны с иммуногенными носителями согласно способам, известным специалистам в данной области (см., например, публикацию РСТ № WO 03/024480). В других воплощениях изобретения CpG-содержащие олигонуклеотиды могут быть включены в VLP (см., например, публикацию РСТ № WO 03/024481).
Примеры адъювантов в контексте настоящего изобретения включают в себя квасцы; CpG-содержащие олигонуклеотиды, такие как CpG 7909, CpG 10103 и CpG 24555; и адъюванты на основе сапонина, такие как Iscomatrix, которые могут быть использованы отдельно или в комбинации.
Поэтому в изобретении предложена иммуногенная композиция, содержащая антигенный тау-пептид, предпочтительно содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-26, 31-76 и 105-122, и по меньшей мере один адъювант. Указанный антигенный тау-пептид предпочтительно связан с иммуногенным носителем, предпочтительно с VLP, более предпочтительно с HBsAg, HBcAg или Qbeta VLP. В одном из воплощений указанный адъювант представляет собой адъювант на основе сапонина, предпочтительно Iscomatrix. В другом воплощении указанный адъювант представляет собой квасцы. В еще одном воплощении указанный адъювант представляет собой CpG-содержащий олигонуклеотид. Предпочтительно, указанный адъювант представляет собой CpG 7909 или CpG 10103. Более предпочтительно, указанный адъювант представляет собой CpG 24555.
В еще одном воплощении указанный по меньшей мере один адъювант содержит два адъюванта, предпочтительно выбранных из группы, состоящей из квасцов, адъювантов на основе сапонина и CpG-содержащих олигонуклеотидов. В предпочтительном воплощении указанные адъюванты представляют собой квасцы и CpG-содержащий олигонуклеотид, предпочтительно CpG 7909, предпочтительно CpG 10103, более предпочтительно CpG 24555. В другом предпочтительном воплощении указанные адъюванты представляют собой адъювант на основе сапонина, предпочтительно Iscomatrix, и CpG-содержащий олигонуклеотид, предпочтительно CpG 7909, предпочтительно CpG 10103, более предпочтительно CpG 24555. В другом предпочтительном воплощении указанные адъюванты представляют собой квасцы и адъювант на основе сапонина, предпочтительно Iscomatrix.
В еще одном воплощении указанный по меньшей мере один адъювант содержит три адъюванта, предпочтительно выбранных из группы, состоящей из квасцов, адъюванта на основе сапонина, предпочтительно Iscomatrix, и CpG-содержащих олигонуклеотидов, таких как CpG 7909, CpG 10103 и CpG 24555.
Препараты
В настоящем изобретении также предложены фармацевтические композиции, содержащие антигенный тау-пептид по изобретению или его иммуногенную композицию, в препарате вместе с одним или более фармацевтически приемлемым(и) эксципиентом(ами). Термин "эксципиент" используют в данной заявке для описания любого ингредиента, отличного от активного ингредиента, т.е. антигенного тау-пептида по изобретению, впоследствии подвергнутого сочетанию с иммуногенным носителем и возможно объединенного с одним или более адъювантами. Выбор эксципиента(ов) в большой степени будет зависеть от таких факторов, как конкретный способ введения, влияние эксципиента на растворимость и стабильность, и природа лекарственной формы. Как использовано в данной заявке, "фармацевтически приемлемый эксципиент" включает любой и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и замедляющие абсорбцию агенты и тому подобное, которые являются физиологически совместимыми. Некоторые примеры фармацевтически приемлемых эксципиентов представляют собой воду, физиологический раствор, забуференный фосфатами физиологический раствор, декстрозу, глицерин, этанол и тому подобное, а также их комбинации. Во многих случаях он будет предпочтительно включать изотонические агенты, например, сахара, полиспирты, такие как маннит, сорбит или хлорид натрия в композиции. Дополнительные примеры фармацевтически приемлемых веществ представляют собой увлажняющие агенты или небольшие количества вспомогательных веществ, таких как увлажняющие или эмульгирующие агенты, консерванты или буферы, который увеличивают срок хранения или эффективность активного ингредиента.
Фармацевтические композиции по настоящему изобретению и способы их получения будут совершенно очевидны специалистам в данной области. Такие композиции и способы их получения можно найти, например, в Remington' s Pharmaceutical Sciences, 19th Edition (Mack Publishing Company, 1995). Фармацевтические композиции предпочтительно изготавливают в условиях GMP (Good Manufacturing Practice, надлежащая практика организации производства).
Фармацевтическая композиция по изобретению может приготавливаться, упаковываться или продаваться нефасованной, в виде однократной дозы или в виде множества однократных доз. Как использовано в данной заявке, "однократная доза" представляет собой отдельное количество фармацевтической композиции, содержащей заданное количество активного ингредиента. Количество активного ингредиента обычно равно дозировке активного ингредиента, который вводят субъекту, или подходящей фракции такой дозировки, такой как, например, половина или одна треть такой дозировки.
Фармацевтические композиции по изобретению обычно подходят для парентерального введения. Как использовано в данной заявке, "парентеральное введение" фармацевтической композиции включает в себя любой путь введения, характеризующийся физическим проникновением в ткань субъекта и введением фармацевтической композиции через прокол в ткани, при этом обычно приводящий к прямому введению в кровоток, в мышцу или во внутренний орган. Парентеральное введение, таким образом, включает в себя, но не ограничивается этим, введение фармацевтической композиции посредством инъекции данной композиции, посредством введения композиции через хирургический разрез, посредством введения композиции через ткань-проникающую нехирургическую рану и тому подобное. В частности, считают, что парентеральное введение включает в себя, но не ограничивается этим, подкожную, внутрибрюшинную, внутримышечную, интрастернальную, внутривенную, внутриартериальную, интратекальную, интравентрикулярную, интрауретральную, внутричерепную, внутрисуставную инъекцию или инфузии; и методы диализной инфузии почек. Предпочтительные воплощения включают в себя внутривенный, подкожный, интрадермальный и внутримышечный пути.
Препараты фармацевтической композиции, подходящей для парентерального введения, обычно содержат активный ингредиент, объединенный с фармацевтически приемлемым носителем, таким как стерильная вода или стерильный изотонический физиологический раствор. Такие препараты можно изготавливать, упаковывать или продавать в форме, подходящей для болюсного введения или для непрерывного введения. Препараты для инъекций можно изготавливать, упаковывать или продавать в стандартной лекарственной форме, например, в ампулах или в многодозовых контейнерах, содержащих консервант. Препараты для парентерального введения включают в себя, но не ограничиваются этим, суспензии, растворы, эмульсии в масляных или водных носителях, пасты и тому подобное. Такие препараты могут дополнительно содержать один или более дополнительных ингредиентов, включая, но не ограничиваясь этим, суспендирующие, стабилизирующие или диспергирующие агенты. В одном из воплощений препарата для парентерального введения активный ингредиент предложен в сухой (т.е. порошковой или гранулярной) форме для разведения подходящим носителем (например, стерильной апирогенной водой) перед парентеральным введением разведенной композиции. Парентеральные препараты также включают в себя водные растворы, которые могут содержать эксципиенты, такие как соли, углеводы и буферные агенты (предпочтительно до рН от 3 до 9), но для некоторых применений они могут быть более предпочтительно приготовлены в виде стерильного неводного раствора или в виде высушенной формы, используемой в сочетании с подходящим носителем, таким как стерильная, апирогенная вода. Примерные формы для парентерального введения включают в себя растворы или суспензии в стерильных водных растворах, например, водных растворах пропиленгликоля или декстрозы. Такие лекарственные формы могут быть соответствующим образом забуферены, при желании. Другие препараты для парентерального введения, которые являются полезными, включают в себя препараты, которые содержат активный ингредиент в микрокристаллической форме или в липосомальном препарате. Препараты для парентерального введения могут быть приготовлены для немедленного и/или модифицированного высвобождения. Препараты с модифицированным высвобождением включают в себя препараты с отсроченным, замедленным, импульсным, контролируемым, нацеленным и программируемым высвобождением.
Например, в одном аспекте стерильные растворы для инъекций могут быть получены путем включения антигенного тау-пептида, предпочтительно связанного с иммуногенным носителем, в конечном счете в комбинации с одним или более адъювантами, в необходимом количестве в подходящем растворителе с одним или комбинацией ингредиентов, перечисленных выше, при необходимости, с последующей стерилизацией фильтрованием. Обычно дисперсии получают путем включения активного соединения в стерильный носитель, который содержит основную дисперсионную среду и другие необходимые ингредиенты из перечисленных выше. В случае стерильных порошков для получения стерильных растворов для инъекций предпочтительные способы получения представляют собой вакуумную сушку и лиофилизацию, которые приводят к образованию порошка активного ингредиента плюс любого дополнительного желаемого ингредиента из его заранее простерилизованного фильтрацией раствора. Надлежащую текучесть раствора можно поддерживать, например, путем применения покрытия, такого как лецитин, путем поддержания необходимого размера частиц в случае дисперсии и путем применения поверхностно-активных веществ. Пролонгированная абсорбция композиций для инъекций может достигаться путем включения в композицию агента, который замедляет абсорбцию, например, моностеаратных солей и желатина.
Примерная, неограничивающая фармацевтическая композиция по изобретению представляет собой препарат в виде стерильного водного раствора, имеющего рН, который варьируется от примерно 5,0 до примерно 6,5, и содержащего от примерно 1 мг/мл до примерно 200 мг/мл пептида по изобретению, от примерно 1 мМ до примерно 100 мМ гистидинового буфера, от примерно 0,01 мг/мл до примерно 10 мг/мл полисорбата 80, от примерно 100 мМ до примерно 400 мМ трегалозы, и от примерно 0,01 мМ до примерно 1,0 мМ динатрия EDTA дигидрата.
Антигенные тау-пептиды по изобретению также можно вводить интраназально или посредством ингаляции, обычно в форме сухого порошка (либо отдельно, в виде смеси, либо в виде смешанных частиц компонентов, например, смешанных с подходящим фармацевтически приемлемым эксципиентом) из сухого порошкового ингалятора, в виде аэрозольного спрея из контейнера под давлением, насоса, спрея, атомайзера (предпочтительно атомайзера с использованием электрогидродинамики для продукции мелкодисперсного тумана), или небулайзера, с применением или без применения подходящего пропеллента, или в виде капель в нос.
Контейнер под давлением, насос, спрей, атомайзер или небулайзер обычно содержит раствор или суспензию композиции по изобретению, содержащий, например, подходящий агент для диспергирования, солюбилизации или расширения высвобождения активного агента, и пропеллента(ов) в качестве растворителя.
Перед применением в сухом порошковом или суспензионном препарате лекарственный продукт обычно подвергают микронизации до размера, подходящего для доставки посредством ингаляции (обычно менее 5 микрон). Этого можно достичь любым подходящим способом измельчения, таким как размол в спиральной струйной мельнице, размол в струйной мельнице с псевдоожиженным слоем, сверхкритическая флюидная обработка с образованием наночастиц, гомогенизация высокого давления или распылительная сушка.
Капсулы, блистеры и картриджи для применения в ингаляторе или инсуффляторе могут быть приготовлены таки образом, чтобы содержать порошковую смесь соединения по изобретению, подходящее порошковое основание и модификатор эффективности.
Подходящий препарат раствора для применения в атомайзере с использованием электрогидродинамики для продукции мелкодисперсного тумана может содержать подходящую дозу антигенного тау-пептида по изобретению на срабатывание, и объем срабатывания может варьироваться, например, от 1 мкл до 100 мкл.
В такие препараты по изобретению, предназначенные для ингаляционного/интраназального введения, могут быть добавлены подходящие ароматизаторы, такие как ментол и левоментол, или подсластители, такие как сахарин или сахарин натрия.
Препараты для ингаляционного/интраназального введения могут быть приготовлены с возможностью немедленного и/или модифицированного высвобождения. Препараты с модифицированным высвобождением включают в себя препараты с отсроченным, замедленным, импульсным, контролируемым, нацеленным и программируемым высвобождением.
В случае сухих порошковых ингаляторов и аэрозолей, единицу дозировки определяют посредством клапана, который доставляет отмеренное количество. Единицы в соответствии с изобретением обычно расположены для введения отмеренной дозы или "пшика" композиции по настоящему изобретению. Общую суточную дозу обычно будут вводить в однократной дозе или еще чаще в виде дробных доз на протяжении суток.
Фармацевтическая композиция, содержащая антигенный тау-пептид, также может быть приготовлена для введения пероральным путем. Пероральное введение может включать глотание, так что соединение поступает в желудочно-кишечный тракт, и/или трансбуккальное, лингвальное или сублингвальное введение, с помощью которого соединение поступает в кровоток непосредственно из полости рта.
Препараты, подходящие для перорального введения, включают в себя твердые, полутвердые и жидкие системы, такие как таблетки; мягкие или твердые капсулы, содержащие мульти- или наночастицы, жидкости или порошки; лепешки (включая наполненные жидкостью); жвачки; гели; быстро диспергирующиеся лекарственные формы; пленки; овули; спреи; и трансбуккальные/мукоадгезивные пластыри.
Жидкие препараты включают в себя суспензии, растворы, сиропы и эликсиры. Такие препараты могут быть использованы в качестве наполнителей в мягких или твердых капсулах (сделанных, например, из желатина или гидроксипропилметилцеллюлозы) и обычно содержат носитель, например, воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу, или подходящее масло и один или более эмульгирующих агентов и/или суспендирующих агентов. Жидкие препараты также могут быть получены путем разведения твердого вещества, например, из саше.
Дозировки
Композиции по изобретению могут быть использованы для лечения, облегчения или предупреждения тау-ассоциированных расстройств или симптомов у субъекта при риске или страдающего от такого расстройства или симптома путем стимуляции иммунного ответа у указанного субъекта посредством иммунотерапии. Иммунотерапия может включать первичную иммунизацию с последующей дополнительной, например, одной, двумя, тремя или более реиммунизациями.
"Иммунологически эффективное количество" антигенного тау-пептида по изобретению, или его композиции, представляет собой количество, которое доставляется субъекту-млекопитающему либо в однократной дозе, либо в виде части серии, которая является эффективной для индуцирования иммунного ответа против патологических форм тау у указанного субъекта. Это количество варьируется в зависимости от состояния здоровья и физического состояния индивидуума, которого лечат, таксономической группы индивидуума, которого лечат, способности иммунной системы индивидуума вызывать гуморальные и/или клеточные иммунные ответы, препарата вакцины и других важных факторов. Ожидают, что количество будет попадать в относительно широкий диапазон, который может быть определен с помощью подходящих испытаний.
"Фармацевтически эффективная доза" или "терапевтически эффективная доза" представляет собой такую дозу, которая необходима для лечения или предупреждения, или облегчения одного или более тау-ассоциированных расстройств или симптомов у субъекта. Фармацевтически эффективная доза может зависеть от конкретного вводимого соединения, тяжести симптомов, восприимчивости субъекта к побочным эффектам, типа заболевания, используемой композиции, пути введения, типа млекопитающего, которого лечат, физических особенностей конкретного рассматриваемого млекопитающего, таких как состояние здоровья и физическое состояние, сопутствующее лечение, активность иммунной системы индивидуума, степень желаемой защиты и другие факторы, которые будут известны специалистам в области медицины. Для профилактических целей количество пептида в каждой дозе выбрано как количество, которое индуцирует иммунопротективный ответ без значительных неблагоприятных побочных эффектов в типичных вакцинах. После первичной вакцинации субъекты могут получать одну или несколько реиммунизаций, через адекватные промежутки времени.
Следует понимать, что специфический дозовый уровень для любого конкретного пациента зависит от множества факторов, включающих активность конкретного используемого соединения, возраста, массы тела, общего состояния здоровья, пола, диеты, времени введения, пути введения, скорости выделения, комбинации лекарственных средств и тяжести конкретного заболевания, которое лечат.
Например, антигенные тау-пептиды по изобретению, подвергнутые сочетанию с иммуногенным носителем, можно вводить субъекту в дозе от примерно 0,1 мкг до примерно 200 мг каждый, например, от примерно 0,1 мкгдо примерно 5 мкг, от примерно 5 мкг до примерно 10 мкг, от примерно 10 мкг до примерно 25 мкг, от примерно 25 мкг до примерно 50 мкг, от примерно 50 мкг до примерно 100 мкг, от примерно 100 мкг до примерно 500 мкг, от примерно 500 мкг до примерно 1 мг, от примерно 1 мг до примерно 10 мг, от примерно 10 мг до примерно 50 мг, или от примерно 50 мг до примерно 200 мг, с возможными реиммунизациями, проводимыми, например, через 1 неделю, 2 недели, 3 недели, 4 недели, 2 месяца, 3 месяца и/или год. В некоторых воплощениях количество антигенного тау-пептида на дозу определяют на основе массы тела. Например, в некоторых воплощениях антигенный пептид вводят в количестве от примерно 0,5 мг/кг до примерно 100 мг/кг, например, от примерно 0,5 мг/кг до примерно 1 мг/кг, от примерно 1 мг/кг до примерно 2 мг/кг, от примерно 2 мг/кг до примерно 3 мг/кг, от примерно 3 мг/кг до примерно 5 мг/кг, от примерно 5 мг/кг до примерно 7 мг/кг, от примерно 7 мг/кг до примерно 10 мг/кг, от примерно 10 мг/кг до примерно 15 мг/кг, от примерно 15 мг/кг до примерно 20 мг/кг, от примерно 20 мг/кг до примерно 25 мг/кг, от примерно 25 мг/кг до примерно 30 мг/кг, от примерно 30 мг/кг до примерно 40 мг/кг, от примерно 40 мг/кг до примерно 50 мг/кг на доза, от примерно 50 мг/кг до примерно 60 мг/кг, от примерно 60 мг/кг до примерно 70 мг/кг, от примерно 70 мг/кг до примерно 80 мг/кг, от примерно 80 мг/кг до примерно 90 мг/кг, или от примерно 90 мг/кг до примерно 100 мг/кг, или более чем примерно 100 мг/кг.
В некоторых воплощениях вводят однократную дозу антигенного тау-пептида согласно изобретению. В других воплощениях вводят многократные дозы антигенного тау-пептида согласно изобретению. Частота введения может варьироваться в зависимости от любого из множества факторов, например, тяжести симптомов, степени желаемой иммунопротекции, используется ли композиция для профилактических или куративных целей и т.д. Например, в некоторых воплощениях антигенный тау-пептид согласно изобретению вводят один раз в месяц, два раза в месяц, три раза в месяц, раз в две недели (qow), один раз в неделю (qw), два раза в неделю (biw), три раза в неделю (tiw), четыре раза в неделю, пять раз в неделю, шесть раз в неделю, через сутки (qod), один раз в сутки (qd), два раза в сутки (qid), или три раза в сутки (tid). Когда композицию по изобретению используют для профилактических целей, тогда ее обычно будут вводить как для примирующей (priming), так и для бустерной (boosting) доз. Ожидают, что бустерные дозы будут разделены адекватными промежутками времени, или предпочтительно даваться ежегодно или в то время, когда уровни циркулирующего антитела падают ниже желаемого уровня, Бустерные дозы могут состоят из антигенного тау-пептида в отсутствие первоначальной иммуногенной молекулы-носителя. Такие бустерные конструкции могут содержать альтернативный иммуногенный носитель или могут не содержать какого-либо носителя. Такие бустерные композиции могут быть приготовлены либо с адъювантом, либо без адъюванта.
Длительность введения антигенного тау-пептида согласно изобретению, например, период времени, в течение которого вводят антигенный тау-пептид, может варьироваться, в зависимости от любого из множества факторов, например, реакции пациента и т.д. Например, антигенный тау-пептид можно вводить в течение периода времени, варьирующегося от примерно одних суток до примерно одной недели, от примерно двух недель до примерно четырех недель, от примерно одного месяца до примерно двух месяцев, от примерно двух месяцев до примерно четырех месяцев, от примерно четырех месяцев до примерно шести месяцев, от примерно шести месяцев до примерно восьми месяцев, от примерно восьми месяцев до примерно 1 года, от примерно 1 года до примерно 2 лет, или от примерно 2 лет до примерно 4 лет или более.
Применения и способы лечения
В настоящем изобретении также рассматриваются различные способы лечения, которые включают введение антигенного тау-пептида согласно изобретению. Способы лечения включают способы индуцирования иммунного ответа у индивидуума на ауто-тау в его патологической(их) форме(ах) и способы предупреждения, облегчения или лечения тау-ассоциированного расстройства или симптома у индивидуума.
В одном аспекте в настоящем изобретении предложен способ лечения, предупреждения или облегчения тау-ассоциированного расстройства или симптома у субъекта, включающий введение терапевтически эффективного количества антигенного тау-пептида по изобретению, или его иммуногенной или фармацевтической композиции, указанному субъекту.
В другом аспекте в настоящем изобретении предложен способ индуцирования иммунного ответа против ауто-тау в его патологической(их) форме(ах) у субъекта, включающий введение терапевтически или иммуногенно эффективного количества антигенного тау-пептида по изобретению, или его иммуногенной или фармацевтической композиции, указанному субъекту.
"Лечить", "проведение лечения" и "лечение" относятся к способу облегчения или устранения биологического расстройства и/или по меньшей мере одного из его сопутствующих симптомов. Как использовано в данной заявке, "облегчать" заболевание, расстройство или состояние означает снижение тяжести и/или частоты появления симптомов заболевания, расстройства или состояния. Кроме того, ссылки в данной заявке на "лечение" включают в себя ссылки на куративное, паллиативное и профилактическое лечение. Указанный субъект представляет собой предпочтительно человека и может быть либо мужчиной, либо женщиной любого возраста.
Другие аспекты изобретения относятся к антигенному тау-пептиду согласно изобретению, или его иммуногенной композиции или фармацевтической композиции, для применения в качестве лекарственного средства, предпочтительно в лечении тау-ассоциированных расстройств.
В еще одном аспекте в настоящем изобретении предложено применение антигенного тау-пептида по изобретению, или его иммуногенной композиции или фармацевтической композиции, в изготовления лекарственного средства, предпочтительно для лечения тау-ассоциированного расстройства.
Настоящее изобретение дополнительно проиллюстрировано следующими примерами, которые не следует истолковывать как дополнительно ограничивающие. Содержание всех графических материалов и всех ссылок, патентов и опубликованных заявок на патент, процитированных в этом описании, прямо включено в данную заявку посредством ссылки во всей их полноте.
ПРИМЕРЫ
Были сделаны попытки обеспечения точности в отношении используемых чисел (например количеств, температуры и т.д.), но следует принимать во внимание некоторые экспериментальные ошибки и отклонения. Если не указано иное, части представляют собой части по массе, молекулярная масса представляет собой средневзвешенную молекулярную массу, температура представлена в градусах Цельсия, и давление представляет собой атмосферное или близкое к атмосферному. Как использовано в примерах ниже, следующие аббревиатуры имеют следующие значения и, если не указано иное, легко доступны от коммерческих поставщиков: DMF: диметилформамид; TFA: трифторуксусная кислота; TIPS: триизопропилсилил-трифторметансульфонат; ТСЕР: трис(2-карбоксиэтил)фосфин; mcKLH: гемоцианин лимфы улитки из морской культуры; HBTU: O-бензотриазол-N,N,N'N'-тетраметил-уроний-гексафтор-фосфат; EDTA: этилен-диамин-тетрауксусная кислота; ДМСО: диметилсульфоксид.
Пример 1: Плазмидная конструкция Qbeta
Нативный оболочечный белок Qbeta: Кодирующую последовательность, соответствующую оболочечному белку Qbeta, нуклеотиды с 1304 по 1705 из GenBank доступ # AY099114, синтезировали с помощью ДНК 2,0 (DNA 2.0, Menio Park, CA). Включали 5'-модификацию (CCatgg) для введения NcoI сайта, и 3'-модификации для введения двух стоп-кодонов и XhoI сайта (gtaTTAATGACTCGAG - SEQ ID NO:78).
Кодон-оптимизированный оболочечный белок Qbeta: Последовательность, кодирующую оболочечный белок Qbeta, также оптимизировали для экспрессии с использованием Gene Designer (Villalobos et al., BMC Bioinformatics 7:285 (2006)). Идентичные 5'- и 3'-модификации вводили в кодон-оптимизированный оболочечный белок Qbeta.
Как нативные, так и кодон-оптимизированные последовательности оболочечного белка Qbeta вводили в экспрессирующий вектор рЕТ28 с использованием традиционных способов субклонирования ДНК, включающих переваривание рестриктазами и реакции лигирования.
Пример 2: Получение синтетических тау-пептидов
Тау-пептиды (именуемые как А-1 до А-11; В-1 до В-6; С-1 до С-5; D-1; Е-1 и F1; как и фосфорилированные варианты этих пептидов - указанные как А-1Р, А-2Р, А-3Р и т.д.), представленные как SEQ ID NO:31-76, 105-107 и показанные в Таблице 5 ниже с их соответствующими наименованиями, используемыми в следующих примерах, получали следующим образом. Синтез фосфорилированных или нефосфорилированных тау-пептидов, содержащих линкерную последовательность (CGG или GGC), осуществляли с использованием технологии твердофазного синтеза на пептидном синтезаторе Symphony (Protein Technologies, Inc). Моно-защищенную аминокислоту Fmoc-Ser[PO(O-Bzl)OH]-OH, Fmoc-Thr[PO(O-Bzl)OH]-OH и Fmoc-Tyr[PO(O-Bzl)OH]-OH (EMD Chemicals, Inc) использовали для включения фосфосерина, фосфотреонина и фосфотирозина в фосфорилированные варианты этих последовательностей. Реакцию запускали путем смешивания смолы NovaSyn TGA (EMD Chemicals, Inc), содержащей первую аминокислоту, с 6,25-кратным избытком Fmoc-защищенной второй аминокислоты (1 ммоль), которую активировали с помощью 1 ммоль HBTU в течение 1 часа. Реакцию сочетания повторяли один раз для каждой аминокислоты. Удаление Fmoc-группы достигалось в 20%-ном пиперидине в DMF в течение 2×5 минут. Синтезированный пептид высвобождали со смолы путем инкубирования смолы с 5 мл раствора TFA, содержащего 2,5% TIPS и 2,5% тиоанизола, в течение 3 часов при комнатной температуре. Неочищенный пептид выделяли после фильтрации, опосредованного диэтиловым эфиром осаждения и вакуумной сушки. Очистку пептида проводили в HPLC с обращенной фазой (Waters 2525 Binary Gradient Module) с препаративной колонкой ВЕН 130 С18. Подвижная фаза состояла из 0,1% TFA в воде в качестве буфера А и 0,1% TFA в ацетонитриле в качестве буфера В. Собранные фракции, содержащие пептид, объединяли и лифилизировали под вакуумом. Приблизительно 20 мг пептида очищали из типичной инжекции 100 мг неочищенного пептида с чистотой более 95%. Все очищенные пептиды проверяли с помощью LC-MS.
Аналогично, синтезируют и очищают дополнительные тау-пептиды (SEQ ID: 108-122).
Пример 3: Qbeta-VLP: экспрессия, очистка и конъюгирование с тау-пептидами
Экспрессия Qbeta в Е.coli: Плазмиду рЕТ28, содержащую кДНК Qbeta, подвергали трансформации в компетентные клетки Е.coli BL21 (DE3). Одну колонию инокулировали в 5 мл среды 2×YT, содержащей 50 мкг/мл канамицина, при 37°С в течение ночи. Ночной инокулят разбавляли до 500 мл средой ТВ, содержащей 50 мкг/мл канамицина, выращивали до 0,8 OD600 при 250 об/мин при 37°С и индуцировали с помощью 0,4 мМ IPTG (изопропил-β-D-1-тиогалактопиранозид) в течение ночи. Клетки собирали центрифугированием при 2500 RCF (единицы относительного центробежного ускорения от англ. relative centrifuge force) в течение 15 минут. Клеточные осадки хранили при -80°С.
Очистка Qbeta VLP из Е.coli: все стадии очистки осуществляли при 4°С. Клеточный осадок, экспрессирующий Qbeta, ресуспендировали в лизирующем буфере, содержащем 25 мМ Трис рН 8,0, 150 мМ NaCl, 5 мМ EDTA, 0,1% Тритон-100, дополненном коктейлями ингибиторов протеаз (Roche). Ресуспендированный раствор пропускали через микрофлюидизатор (Microfluidics Corp.) с последующим ультрацентрифугированием. Белки осаждали путем добавления сульфата аммония до 50%-ного насыщения с последующим центрифугированием при 15000 RCF в течение 30 минут. Осадок ресуспендировали и диализовали в буфере, содержащем 25 мМ Hepes рН 7,5, 100 мМ NaCl, 1 мМ EDTA, при 4°С в течение ночи. Диализованный раствор центрифугировали и затем наносили на колонку Capto Q (GE), уравновешенную в 25 мМ HEPES рН 7,5, 100 мМ NaCl, 1 мМ EDTA. Колонку промывали и прогоняли градиент от 100 мМ NaCl до 1 М NaCl в буфере, содержащем 25 мМ HEPES рН 7,5, 1 мМ EDTA. Белок Qbeta идентифицировали с использованием SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия). Фракции, содержащие Qbeta, диализовали в 10 мМ фосфате калия, рН 7,4, 150 мМ KCl, в течение ночи и наносили на гидроксиапатитную колонку (Тип II, Bio-Rad Inc.). Колонку промывали и элюировали градиентом от 100% буфера, содержащего 10 мМ фосфата калия рН 7,5, 150 мМ KCl, до 100% буфера, содержащего 500 мМ фосфата калия, рН 7,5, 0,5М KCl. Фракции, содержащие Qbeta, объединяли, диализовали и наносили на фенильную колонку, уравновешенную в 25 мМ Трис-Cl, рН 8,0, 150 мМ NaCI, 0,7 М (NH4)2SO4. Белок элюировали градиентом от 100% буфера, содержащего 25 мМ Трис-Cl, рН 8,0, 150 мМ NaCl, 0,7 М (NH4)2SO4, до 100% буфера, содержащего 25 мМ Трис-Cl, рН 8,0, 50 мМ NaCl. Фракции, содержащие чистый Qbeta, объединяли и диализовали в PBS при 4°С в течение ночи. Концентрацию белка определяли по методу Брэдфорда.
Сочетание тау-пептидов с Qbeta VLP: Сочетание тау-пептидов с Qbeta-VLP опосредовалось через бифункциональный кросс-линкер SMPH (Сукцинимидил-6-[р-малеимидопропионамидо]гексаноат) (Thermo Scientific) (Freer et al., Virology 322 (2):360-369 (2004)). Пептид растворяли в PBS (Invitrogen), pH 7,0 содержащем 5 мМ EDTA, при 10 мг/мл и восстанавливали путем инкубирования с дисульфид-восстанавливающим гелем с иммобилизованным ТСЕР в равном объеме при комнатной температуре в течение 1 часа. Раствор пептида выделяли путем центрифугирования при 1000×g в течение 2 минут. Белок Qbeta-VLP при 2 мг/мл в PBS (Invitrogen) активировали путем инкубирования с 7 мМ SMPH в ДМСО при комнатной температуре в течение 1 часа. Дериватизированную VLP обессоливали путем пропускания через колонку Zeba Desalt Spin (Thermo Scientific) при 1000×g в течение 2 минут.Раствор активированной VLP смешивали с 10-кратным молярным избытком восстановленных пептидов при комнатной температуре в течение 2-3 часов. Реакционную смесь концентрировали и диализовали либо в PBS, либо в 25 мМ гистидине pH 7,4, содержащем 50 мМ NaCl, при 4°С в течение ночи. Концентрацию белка определяли с помощью анализа белка Coomassie Plus от Thermo Scientific.
Пример 4: Получение конъюгата пептид-KLH
Тау-пептид А-1Р с CGG-линкером (SEQ ID NO:31) конъюгировали с mcKLH (Thermo Scientific, кат.№77605) для оценки его иммуногенности у мышей. Конъюгирование было опосредовано через бифункциональный кросс-линкер SMPH (Сукцинимидил-6-[(3-малеимидопропионамидо]гексаноат) (Thermo Scientific). Пептид А-1Р при 10 мг/мл в PBS, pH 7,0, содержащем 5 мМ EDTA, сначала обрабатывали дисульфид-восстанавливающим гелем с иммобилизованным ТСЕР в равном объеме путем перемешивания при комнатной температуре в течение 1 часа. Раствор пептида выделяли путем центрифугирования при 1000×g в течение 2 минут.Активацию KLH осуществляли путем инкубирования KLH при 10 мг/мл в PBS с 200 мкл 100 мМ SMPH в ДМСО в течение 1 часа при комнатной температуре. Реакционную смесь пропускали через колонку Zeba Desalt Spin (Thermo Scientific). Собранный дериватизированный KLH затем смешивали с восстановленным А-1Р в течение 2 часов при комнатной температуре. Реакционную смесь диализовали в PBS, содержащем 0,6 М NaCl, при 4°С в течение ночи. Концентрацию белка определяли с помощью анализа белка Coomassie Plus от Thermo Scientific.
Пример 5: Исследование пептидной иммунизации в отношении иммуногенности и В-клеток памяти
Эксперимент проводили для того, чтобы определить, являются ли выбранные пептиды, показанные в Таблице 5, иммуногенными, и для того, чтобы определить, развивается ли иммунологическая память. Группы из 3 мышей Balb/c примировали пептидом или пептидом, конъюгированным с Qbeta VLP, в 0-е сутки и повторно стимулировали в 14 и 101-е сутки, тогда как некоторых мышей только примировали в 101-е сутки, как показано на Фиг.1А, 1Б и 2. Сыворотки собирали в 28, 101, 104, 108 и 115-е сутки. Сыворотки от выбранных мышей собирали на 94-е сутки. Антительные ответы от иммунизированных животных исследовали с использованием анализов определения антиген-специфических титров (как описано в Примере 13).
Результаты в отношении титров антиген-специфических IgG, которые показывают, что пептиды являются иммуногенными при использовании образцов сыворотки с 28-х суток, суммированы на Фиг.1Б. Это исследование показало, что пептиды А-1, А-1Р, В-1Р и С-1Р являются иммуногенными при иммунизации с использованием TiterMax Gold (Alexis Biochemicals) в качестве адъюванта. Первичная иммунизация пептидом А-1Р и TiterMax Gold или А-1Р, конъюгированным с Qbeta-VLP, с последующей реиммунизацией A-1P-Qbeta-VLP на 14-е сутки давала большие титры антител, чем А-1Р TiterMax "прайм-буст" группа. Первичная иммунизация и реиммунизация на 14-е сутки с помощью А-1Р, конъюгированного с KLH (полученным, как описано в Примере 4), в качестве адъюванта также давала большие титры антител, чем А-1Р TiterMax "прайм-буст" группа.
Также исследовали селективность антител, индуцированных в ответ на фосфорилированный (А-1Р, В-1Р, D-1P, С-1Р) или нефосфорилированный пептид (А-1), используемый для иммунизации. Это осуществляли путем сравнения титра антител как на фосфорилированные, так и на нефосфорилированные варианты для каждого пептида, используемого для иммунизации (см. Фиг.1Б). Вычисляли отношение специфического титра к неспецифическому титру. В этом эксперименте антительный ответ против А-1 (Группа 1) был селективным (кратность <0,1) для фосфорилированного состояния пептидов, которыми иммунизировали животных, тогда как антитела против С-1Р (Группа 5), вероятно, будут селективными (отношение титров С-1Р/С-1>7). Группа 2 (А-1Р) была не селективной.
Результаты, демонстрирующие вторичный иммунный (recall) ответ В-клеток памяти на А-1Р, показаны на Фиг.2. Группу А (первичная иммунизация А-1Р с TiterMax, реиммунизация с помощью А-1Р- Qbeta-VLP) и Группу В (первичная иммунизация и реиммунизация с помощью А-1Р- Qbeta-VLP) сравнивали с Группой С, которую примировали на 101-е сутки А-1Р, конъюгированным с Qbeta-VLP. Все три группы демонстрировали IgM ответ. IgG определяли на 104-е сутки в обеих группах, повторно стимулированных на 101-е сутки, но не ранее 7-х суток для группы, примированной на 101-е сутки. Титры 104-х суток были больше, чем титры 94-х суток. Титры IgG на 7 и 14-е сутки также были больше, чем группа, примированная на 101-е сутки (Группа С). Титры IgG для Групп А и В на 108 и 115-е сутки были одинаковыми, тогда как титр IgG для Группы С не достигал пика вплоть до 115-х суток. Эти данные свидетельствуют о долговременных антительных ответах и стимуляции В-клеток памяти.
Пример 6: Исследование первичной иммунизации пептидом и реиммунизации пептидом-VLP на иммуногенность
Эксперимент проводили для того, чтобы определить, являются выбранные пептиды из Таблицы 5 иммуногенными при первичной иммунизации пептидом с добавлением квасцов (Al(ОН)3; Alhydrogel 2% '85' , Brenntag Biosector) в качестве адъюванта, с последующей реиммунизацией пептидом, конъюгированным с Qbeta-VLP. Группы из 4 мышей Balb/c примировали в 0-е сутки и повторно стимулировали на 28 и 56-е сутки, как показано на Фиг.3. Сыворотки собирали на 70-е сутки. Антительные ответы от иммунизированных животных исследовали, используя анализ определения антиген-специфического титра (как описано в Примере 13).
Результаты суммированы на Фиг.3. В Группах 1-6, IgG антитела против пептида, используемого для иммунизации, определяли при максимальном протестированном разведении (1:1749600), показывающем сильные антительные ответы на пептидный антиген, используемый для иммунизации. В необработанной группе антитела не были определены (Группа 7). Антитела, полученные путем иммунизации с использованием пептидов D-1P и С-1Р, распознавали пептид Е-1Р. Пептиды D-1P и С-1Р полностью содержатся в Е-1Р.
Исследовали селективности антител, индуцированных фосфорилированным (А-1Р, В-1Р, D-1P, С-1Р, Е-1Р) или нефосфорилированным пептидом (А-1), используемым для иммунизации. Это осуществляли путем определения титра антител на нефосфорилированные варианты фосфорилированных пептидов и фосфорилированные варианты нефосфорилированных пептидов (см. Фиг.3). Вычисляли отношение специфического титра к неспецифическому титру. В этом эксперименте антитела против D-1P (Группа 4), С-1Р (Группа 5) и Е-1Р (Группа 6) были селективными (отношение титров >10) для фосфорилированного состояния пептидов, которыми иммунизировали животных.
Пример 7: Исследование иммунизации пептидом-VLP на иммуногенность
Эксперимент проводили для того, чтобы определить, являются ли выбранные пептиды и комбинации пептидов из Таблицы 5 иммуногенными при иммунизации в виде конъюгатов Qbeta-VLP с различными адъювантами. Как показано на Фиг.4, группы из 4 мышей TG4510+/+ (трансгенные двойные положительные, см. Ramsden et al, J. Neuroscience 25 (46):10637 (2005)) или TG4510-/- (однопометные контрольные животные дикого типа) примировали в 0-е сутки и повторно стимулировали на 56-е сутки и в любые из 28 или 29-х суток. Сыворотки собирали на 63-е сутки. Антительные ответы от иммунизированных животных исследовали, используя анализ определения титра антиген-специфических IgG, как описано в Примере 13.
Результаты образцов на 63-е сутки суммированы на Фиг.4. В каждой группе, антитела (IgG) против пептида или комбинации пептидов, используемых для иммунизации, определяли при средних титрах, варьирующихся от 7.7Е+04 до 1.58Е+06. Иммунизация тремя конъюгатами пептид-Qbeta-VLP в комбинациях 100 мкг или 10 мкг каждого индуцировала титры, сходные с иммунизацией только 100 мкг конъюгата пептид-Qbeta-VLP. Титры А-1Р, В-1Р и С-1Р из Групп 1 и 2 комбинированного дозирования составляют от 1,7 до 4,4 раз относительно релевантных групп однократного дозирования (Группы 3, 4 и 5). Титры А-1Р, В-1Р и С-1Р из Групп 11 и 12 комбинированного дозирования составляют от 0,32 до 2,8 раз относительно релевантных групп однократного дозирования (Группы 13, 14 и 15). Антитела определяли при использовании адъюванта (квасцы или CpG-24555 (предварительная заявка на патент США №61/121022, поданная 9 декабря 2008 г.) или ABISCO-100 (Isconova) с CpG-24555) или без адъюванта. В необработанных контролях антитела против пептидов не были определены.
В выбранных группах исследовали селективности антител, индуцированных фосфорилированным (А-1Р, В-1Р, D-1P, С-1Р, Е-1Р), используемым для иммунизации. Это осуществляли путем определения титра антител на нефосфорилированные варианты фосфорилированных пептидов для Групп 1-7 (Фиг.4). Вычисляли отношение специфического титра к неспецифическому титру. В этом эксперименте антитела были селективными (>10-кратное отношение титров) для В-1Р относительно В-1 во всех группах дозирования. Антитела были селективными в отношении С-1Р относительно С-1 только в Группе 6 (группа, не содержащая квасцы). Антитела были селективными в отношении А-1Р относительно А-1 в Группах 2, 3 и 6, но не в Группе 1 (иммунизация высокой дозой комбинации с добавлением квасцов в качестве адъюванта). В необработанных контролях антитела против нефосфорилированных пептидов не были определены.
Пример 8: Исследование иммунизации пептидом-VLP в отношении пути, адъюванта и изотипа
Эксперимент проводили для того, чтобы сравнить иммуногенность и изотип антител, индуцированных при использовании различных адъювантов и путей введения. Группы из 3 мышей Balb/c примировали в 0-е сутки и повторно стимулировали на 17-е сутки, как показано на Фиг.5. Сыворотки собирали на 24-е сутки. Антительные ответы от иммунизированных животных исследовали, используя анализ определения антиген-специфического титра, как описано в Примере 13.
А-1Р, конъюгированный с Qbeta-VLP, доставляли balb/c посредством подкожной или внутримышечной инъекции. Различные комбинации антигенов также тестировали с использованием внутримышечного пути. Результаты с использованием образцов на 27-е сутки суммированы на Фиг.5. Как подкожное, так и внутримышечное введение А-1Р, конъюгированного с Qbeta-VLP, и с добавлением квасцов в качестве адъюванта вызывало IgG антительный ответ. Группа внутримышечного введения дозы имела большее отношение титра А-1Р к А-1 (70), чем группа подкожного введения дозы (11). Это показывает, что путь введения может влиять на селективность ответа.
Как показано на Фиг.5, все используемые адъювантные комбинации индуцировали IgG1 и IgG2a антитела с квасцы-содержащими группами (соотношение 21 и 12 для Групп 2 и 5, соответственно), имеющими гораздо более высокое отношение IgG1 к IgG2a, чем Группы 3 (0,17) и 4 (0,17), которые не включали квасцы в качестве адъюванта. Это согласуется с известными эффектами квасцов на иммунный ответ, сдвинутый в сторону Th2 (см. Lindblad, Immunol Cell Biol. 82 (5):497-505 (2004); Marrack et al., Nature Rev. 9:287-293 (2009)). Эти результаты подразумевают, что адъюванты могут быть использованы для изменения антительных ответов на вакцины, используемые в этом примере. В необработанных контролях антитела против пептидов не были определены.
Пример 9: Иммунизация пептидом-VLP для анализа линкеров
Эксперимент проводили для того, чтобы определить, влияет ли на иммуногенность положение линкера (CGG или GGC) выбранных пептидов из Таблицы 5. Здесь использовали пептидА-1Р с линкером, который находился на N-конце (т.е. SEQ ID NO:31 - А-1Р) или на С-конце (т.е. SEQ ID NO:41 - А-11Р) пептида. Группы из 4 мышей TG4510+/+примировали в 0-е сутки и повторно стимулировали на 14-е сутки, как показано ниже в Таблице 1. Мыши обескровливали на 20-е сутки. Антительные ответы от иммунизированных животных исследовали, используя анализ определения антиген-специфического титра, как описано в Примере 13.
На основе результатов, представленных в Таблице 1, линкерная последовательность для Qbeta-VLP может быть размещена на N- (CGG) или С-конце (GGC) тау-специфической последовательности и все еще вызывать селективный в отношении фосфорилирования IgG ответ >10-кратное отношение титров, Таблица 1). Пептиды, использованные в этом эксперименте (SEQ ID NO:31 и 41), имеют одинаковую последовательность, за исключением того, что CGG-линкер является N-концевым в SEQ ID NO:31, а GGC-линкер является С-концевым в SEQ ID NO:41. Оба индуцировали сходный титр IgG в образцах на 20-е сутки. Антитела, индуцированные двумя пептидными последовательностями, были селективными, как определено из соотношений IgG титров фосфорилированного пептида против нефосфорилированного - 49 и >132, как показано в Таблице 1. В необработанных контролях на 56-е сутки антитела против пептидов не были определены (Группа 7 на Фиг.4).
Пример 10: Связывание поликлональных антител с укороченными пептидами
Эксперимент проводили для того, чтобы определить, содержали ли выбранные пептиды из Таблицы 5 иммуногенные эпитопы, присутствующие в А-1Р, В-1Р или С-1Р, на которые индуцировались антитела. Сыворотки собирали от мышей, вакцинированных А-1Р, В-1Р или С-1Р, как показано ниже в Таблице 2. Антительные ответы от иммунизированных животных исследовали, используя анализ определения антиген-специфического титра (как описано в Примере 13) со следующей модификацией в анализе данных: сигнал в два раза больше среднего значения непокрытой лунки считали положительным, тогда как сигнал ниже двухкратного среднего значения непокрытой лунки считали отрицательным.
Для того чтобы определить, будут ли антитела от животных, иммунизированных пептид-VLP конъюгатами любого из пептидов А-1Р, В-1Р или С-1Р, связываться с более короткими вариантами каждого из этих пептидов, проводили ELISA (твердофазный иммуноферментный анализ). Каждый тестируемый тау-пептид использовали в качествее планшетного антигена, и сыворотки в разведениях 1:4×104 и 1:4×105 от мышей, иммунизированных А-1Р-, В-1Р- или C-1P-VLP, тестировали для того, чтобы определить, могут ли они связываться с релевантным пептидом (см. Таблицу 3). Эти сыворотки, как было показано ранее, имеют антиген-специфические антитела. Сыворотки были от мышей, иммунизированных релевантным родительским пептидом (А-1Р для А-1Р и производных, В-1Р для В-1Р и производных, С-1Р для С-1Р и С-1Р/Е-1Р производных) (см. Таблицу 2). Каждую из антисывороток использовали в 2 разведениях (1:4×104 и 1:4×105). Если определяли связывание с пептидом, то приводили положительный результат.Если сигнал не был определен из какого-либо разведения сыворотки, то приводили отрицательный результат.Все протестированные образцы, за исключением А-5Р, А-10Р и В-2Р, имели положительные сигналы, что указывает на то, что антитела, индуцированные полноразмерными (родительскими) пептидами, также связываются с большинством более коротких протестированных производных.
Линия
Пример 11: Исследование иммунизации укороченными пептидами в отношении иммуногенности и памяти
Два эксперимента проводили для того, чтобы определить, являются ли выбранные пептиды из Таблицы 5 иммуногенными при иммунизации в виде конъюгатов Qbeta-VLP. Одно из этих исследований также использовали для того, чтобы определить, развивается ли иммунологическая память. Во избежание потенциального связывания пептидных антигенов с Т-клеточными лигандами МНС класса I и МНС класса II, тестировали более короткие варианты "родительских" пептидов А-1Р, В-1Р и С-1Р. Выбрали пептиды с длиной от 7 до 11 аминокислот, поскольку молекулы МНС класса II обычно связывают пептиды с 13-17 аминокислотами, а пептид с длиной по меньшей мере 8 аминокислот требуется для связывания МНС I (Murphy et al., Janeway's Immunobiology, Garland Science (2007)). Поэтому пептиды, имеющие 11 или меньше аминокислот, не должны индуцировать CD4 Т-клеточный ответ, ограниченный МНС класса II, а пептиды из 7 аминокислот не должны индуцировать ни CD4 Т-клеточный, ни CD8 Т-клеточный ответ, ограниченный МНС класса I. Также тестировали пептид F-1P с длиной 7 аминокислот. Группы из 3 или 6 мышей Balb/c примировали в 0-е сутки и повторно стимулировали на 14-е сутки, как показано на Фиг.6. Три группы также повторно стимулировали на 108-е сутки и три группы примировали на 108-е сутки (см. Фиг.7). Сыворотки собирали на 21-е сутки или 28-е сутки, или на 111, 115 и 122-е сутки или на 21, 105, 111, 115 и 122-е сутки. Антительные ответы от иммунизированных животных исследовали, используя анализ определения антиген-специфического титра (как описано в Примере 13).
Результаты суммированы на Фиг.6. Все конъюгаты пептид-Qbeta-VLP индуцировали антиген-специфические IgG антитела у всех мышей, протестированных в ELISA, за исключением В-5Р, при котором только 2 из 3 мышей имели определяемые антитела при разведении сыворотки 1:15800. Эти результаты показывают, что 7-11-аминокислотные тау-пептиды с CGG-линкером являются иммуногенными и могут индуцировать антитела, специфичные в отношении иммуногена.
Исследовали селективности антител, индуцированных в ответ на фосфорилированную пептидную форму, используемую для иммунизации (см. Фиг.6). Большинство этих пептидов были селективными (>10-кратное отношение титров) в отношении фосфорилированной формы пептида относительно нефосфорилированной формы. Многие из укороченных производных А-1Р, В-1Р и С-1Р не имели никакого ELISA сигнала, определяемого при использовании нефосфорилированного варианта пептида для иммунизации в качестве планшетного антигена. Селективность многих укороченных производных А-1Р, В-1Р и С-1Р равна или больше селективности родительского пептида. Активная иммунизация пептидом А-2Р без CGG-линкера, как сообщалось, уменьшает агрегированный Тау в головном мозге и замедляет развитие ассоциированных с клубочками сенсомоторных ухудшений в животной модели JNPL3 сверхэкспрессии Тау P301L (Asuni et al., J. Neurosci. 27:9115 (2007)). А-2Р, при конъюгировании с Qbeta-VLP, был иммуногенным. Однако индуцированные антитела не были селективными в отношении фосфорилированного варианта пептида (А-2Р) относительно нефосфорилированного варианта (А-2) в ELISA анализе (отношение титров А-2Р/А-21,7). В отличие от этого, эти антитела были селективными в отношении А-1Р относительно А-1 (отношение титров А-1Р/А-1>10,0). Титры, при использовании А-2Р и А-1Р в качестве ELISA антигенов, были одинаковыми. Это подразумевает, что эпитопы большинства нефосфоспецифических антител включают 12 аминокислот из пептида А-2Р, которые не содержатся в А-1Р. В этом эксперименте С-1Р имел более высокую селективность при тестировании без квасцов в качестве адъюванта, чем с квасцами (Группы 14 и 10, соответственно). Адъюванты, такие как квасцы, могут быть использованы для модификации селективности в отношении фосфорилированного пептида по сравнению с нефосфорилированным пептидом. В необработанных контролях антитела против пептидов не были определены. Эти результаты показывают, что 7-11-аминокислотные тау-пептиды с CGG-линкером могут индуцировать антитела, селективные к фосфо-пептидам.
Результаты тестирования вторичного иммунного ответа (memory recall response) в отношении А-1Р, В-1Р и С-1Р показаны на Фиг.7. Титры IgG на 111, 115 и 122-е сутки (сутки +3, +7 и +14 от последней иммунизации, соответственно) для мышей, иммунизированных пептид-Qbeta-VLP, которых примировали и повторно стимулировали в 0, 14 и 108-е сутки, сравнивали с титрами IgG от мышей, примированных на 108-е сутки. Группы 1, 2 и 3 имели большие титры IgG на 105-е сутки, через 84 суток после последней реиммунизации. По сравнению с группами, примированными на 108-е сутки (Группы 4, 5 и 6), эти группы также имели большие увеличения титра IgG между 111 и 115-ми сутками. Эти данные свидетельствуют о долговременном антительном ответе и вторичном иммунном ответе.
Пример 12: Исследование иммунизации укороченными пептидами в отношении иммуногенности и Т-клеточного ответа в комбинации с квасцами и без квасцов
Эксперимент проводили для того, чтобы определить, являются ли пептиды, происходящие из А-1Р, В-1Р и С-1Р (Таблица 5), иммуногенными при иммунизации с 100 мкг Qbeta-VLP конъюгата с 0 или 504 мкг квасцов (Аl(ОН)3) или при приеме в виде комбинации конъюгатов пептид-Qbeta-VLP с квасцами или без квасцов. Также анализировали Т-клеточные ответы в селезенке. Группы из 3 однопометных мышей TG4510-/- дикого типа примировали в 0-е сутки и повторно стимулировали на 14-е сутки, как показано на Фиг.8. Сыворотки и селезенки собирали на 21-е сутки. Антительные ответы от иммунизированных животных исследовали, используя анализ определения антиген-специфического титра (как описано в Примере 13) и ELISPOT анализ IFN-γ (как описано в Примере 14).
Титры антиген-специфических IgG показывают, что все протестированные пептиды были иммуногенными при иммунизации в виде конъюгата Qbeta-VLP с 504 мкг квасцов (Al(ОН)3) или без квасцов (см. Фиг.8). Иммунизация А-8Р, В-3Р и С-2Р в виде комбинации в целом 750 мкг квасцов до 300 мкг конъюгатов пептид-Qbeta-VLP приводила к селективному антительному ответу для всех 3 пептидов.
Селективность антител, индуцированных в ответ на фосфорилированный пептид против нефосфорилированного варианта этого пептида, используемых для иммунизации, исследовали с помощью ELISA (Фиг.8). Вычисляли отношение специфического против неспецифического титра, где большее отношение указывает на более высокую селективность. Индуцированные антитела были селективными в отношении фосфорилированной формы пептида независимо от того, были включены квасцы при первичной иммунизации и реиммунизации или нет, и независимо от того, осуществлялась иммунизация конъюгатами пептид-Qbeta-VLP отдельно или в комбинации.
Т-клеточные ответы в селезенке после иммунизации одним пептидом Qbeta-VLP анализировали с использованием ELISPOT анализа IFN-y (см. Фиг.9). Частоту Т-клеток, секретирующих IFN-y, специфичных к родительским тау-пептидам (А-1Р, В-1Р, С-1Р) и их соответствующим укороченным вариантам, анализировали на 21-е сутки, через 7 суток после последней реиммунизации пептидом Qbeta-VLP. Относительно неродственного пептидного контроля (HBV-1), никаких значительных количеств В-1Р, В-1, В-3Р, В-3, С-1Р, С-1, С-2Р или С-2 специфических IFN-γ-секретирующих Т-клеток не образовывалось после иммунизации с использованием В-3Р-Qbeta-VLP и C-2P-Qbeta-VLP либо в присутствии, либо в отсутствие квасцов. Значительные уровни (р<0,05) А-3Р-специфических IFN-γ Т-клеточных ответов были индуцированы после иммунизации с использованием А-3Р-Qbeta-VLP. Пептид А-3Р содержит предсказанный мышиный эпитоп связывания МНС класса I Kb (IVYKSPW, см. Lundegaard et al. Bioinfonnatics 24:1397-1398 (2008)), и этот эпитоп может вносить вклад в Т-клеточный ответ, который наблюдается у А-3Р-иммунизированных животных. Этот эпитоп также присутствует в А-1Р, А-1, А-2Р, А-2 и А-3. Когда пептид А-1Р укоротили до пептида длиной 7 аминокислот (А-8Р Qbeta-VLP), тогда IFN-γ специфические Т-клеточные ответы у А-8Р Qbeta-VLP-иммунизированных мышей уменьшились до фоновых уровней.
CD4 Т-хелперные клетки необходимы для образования антительных ответов с переключенным изотипом и образования В-клеток памяти (см. Murphy et al., Janway' s Immunobiology, Garland Science, (2007)). Таким образом, открытие, что IgG антительные ответы образовывались на их соответствующие пептидные эпитопы после иммунизации укороченным фосфо-тау-пептидом Qbeta-VLP, подразумевает, что CD4 Т-хелперные ответы индуцируются против вакцины. Поскольку никаких значительных уровней тау-пептид-специфических Т-клеток не образовывалось после иммунизации укороченными пептидными конъюгатами, тестировали Т-клеточный ответ на другой компонент вакцины. Анализ Т-клеточных ответов на VLP белок демонстрирует, что IFN-y специфические Т-клетки образовывались против VLP эпитопов (4-15-кратность относительно неродственного белкового контроля (БСА, Sigma Aldrich A9418).
Пример 13: Определение титра антиген-специфических антител
Следующий анализ использовали для определения антительных ответов от иммунизированных животных, как описано выше в Примерах 5-12.
Колориметрический ELISA использовали для того, чтобы определить наибольшее разведение сыворотки, который имело определяемые антиген-специфические антитела, как представлено положительным сигналом. Серийные разведения получали из образцов сыворотки и тестировали в анализе. В некоторых анализах в качестве положительных контролей или стандартов использовали моноклональные антитела, специфичные к фосфо-тау-пептиду. В качестве отрицательного контроля использовали сыворотки от невакцинированных мышей (BALB/c, TG4510+/+ или Tg4510-/-). На 96-луночные полистирольные планшеты с высоким связыванием (CoStar 9018) наносили по 100 мкл пептида, разбавленного в 0,1 М карбонате натрия, рН 8,2 (Sigma S7795) при 4°С, в течение 18-21 часов. Все пептиды были в концентрации 0,3 мкг/мл, за исключением С-1Р и С-1, которые были в концентрации 3 мкг/мл. На следующие сутки раствор для нанесения удаляли и планшеты блокировали раствором PBS (EMD OmniPure 6507), содержащим 0,05% Tween 20 (Sigma P2287) и 1% БСА (Sigma A9418), встряхивая с использованием Heildolph Titramax 1000 при 600 об/мин в течение 1 часа при комнатной температуре. Блокирующий раствор удаляли перед добавлением образцов в планшеты.
Мышиные сыворотки и моноклональные антитела, используемые в качестве стандартов, серийно разбавляли с использованием 0,5 или 1 log разведении в PBS, содержащем 0,5% Tween 20 (PBS-T). Шесть или восемь разведений, начиная с 1:500, 1:5000 или 1:15800, для образцов сыворотки, тестировали для каждого образца. Моноклональные антитела, используемые в качестве стандартов, и положительные контроли представляли собой: анти-Тау 396 (Zymed 35-5300) для А-1Р, АТ-180 (Thermo Pierce MN1040) для В-1Р; АТ-8 (Thermo Pierce MN1020) для D-1P и Е-1Р; АТ-100 (Thermo Pierce MN1060) для С-1Р. Используемые концентрации моноклональных антител для стандартной кривой представляли собой 50, 15,8, 5, 1,58, 0,5, 0,158 и 0,05 нг на лунку.
Образцы и стандарты добавляли в планшеты по 100 мкл на лунку в дублированных лунках. Планшеты инкубировали в течение 1 часа при комнатной температуре, встряхивая при 600 об/мин. Планшеты затем промывали 3 раза PBS-T и добавляли вторичное антитело (HRPO-конъюгированный IgG против мыши, Caltag #М30107), разбавленное до 1:3000 в PBS-T, в концентрации 100 мкл/лунку. Различные вторичные антитела использовали для определения IgG1 (Caltag #M32107 1:2000), IgG2a (Caltag #M32307 1:2000) и IgM (Caltag #31507 1:3000). Вторичное антитело оставляли связываться на планшетах в течение 1 часа при комнатной температуре при встряхивании. Планшеты снова промывали 3 раза PBS-T, и планшеты промокали насухо после конечной промывки. Для проявки в каждую лунку добавляли 100 мкл субстрата ТМВ (3,3',5,5'-тетраметилбензидин) Peroxidase EIA (иммуноферментный анализ с пероксидазой) (Bio-Rad #172-1067) на 11 минут при комнатной температуре. Для прекращения реакции в каждую лунку добавляли 100 мкл 1 н. серной кислоты. Поглощение считывали при 450 нм на Molecular Devices Spectramax plus 384. Пороговое значение OD вычисляли для каждого планшета, беря среднее всех лунок, обработанных PBS-T, и добавляя 3-кратное стандартное отклонение этих лунок. Если стандартное отклонение не может быть вычислено, то значение дважды PBS-T OD использовали в качестве порогового значения. Титр образца определяли из разведения первого образца со значением поглощения при 450 нм, большим, чем вычисленное пороговое значение. Для некоторых анализов стандартную кривую, основанную на разведениях релевантного положительного контрольного моноклонального антитела, использовали для вычисления концентрации титра относительно стандартной кривой. Значение наименьшего разведения или тестируемого стандарта использовали для вычислений, когда сигнал не определялся, и значение наибольшего разведения или тестируемого стандарта использовали, когда наибольшее разведение было положительным. Средние титры вычисляли, когда N был больше 2, тогда как индивидуальные значения были продемострированы, когда N было равно 1 или 2. Соотношения селективности определяли путем деления титра образца для фосфорилированного пептида на титр нефосфорилированного варианта того же пептида для каждого образца, затем усредняя соотношение для различных образцов. Значения больше 10 или меньше 0,1 считали селективными. Использование первого положительного разведения для определения селективности было наиболее консервативным способом. Использование других способов, таких как пороговая OD 1 или полумаксимальная OD, будет давать, вероятно, значения большей селективности.
Пример 14: ELISPOT анализ IFN-γ
Набор IFN-γ ELISPOT (BD Biosciences; 551083) использовали для измерения Т-клеточных ответов после иммунизации с использованием пептид-Qbeta-VLP. ELISPOT проводили на объединенных селезенках (N=3) от А-8Р, А-3Р, В-3Р, С-2Р (в присутствии низкой дозы квасцов или без квасцов)-иммунизированных мышей, а также неиммунизированных мышей. На 96-луночные ELISPOT планшеты наносили по 5 мкг/мл захватывающего (capture) антитела против мышиного IFN-γ в течение ночи при 4°С. Покрытые антителом планшеты промывали и блокировали полной средой RPMI 1640 (Invitrogen 11875-119), содержащей 10% фетальной бычьей сыворотки (VWRA15-204).
Спленоциты затем сеяли в планшеты, покрытые антителом против IFN-γ, в концентрации 500000 спленоцитов на лунку, стимулировали 10 мкг/мл пептидного или белкового антигена в течение 20-24 часов при 37°С в инкубаторе с 5% CO2. Неродственный пептидный контроль представлял собой пептид HBV-1 (SEQ ID NO:77), и бычий сывороточный альбумин (Sigma Aldrich; А9418) использовали в качестве неродственного белкового контроля для Qbeta-VLP. Стимуляцию форбол-12-миристат-13-ацетатом (0,5 мкг/мл РМА, Sigma Aldrich; P8139) и иономицином (0,5 мкг/мл, Sigma Aldrich; I0634) клеток селезенки, посеянных в концентрации 55555 и 18520 клеток на лунку, использовали в качестве положительных контролей. После 20-24-часового периода инкубации ELISPOT планшеты дважды промывали дистиллированной водой с последующими тремя дополнительными промывками промывочным буфером (1×PBS (Invitrogen 10010072), содержащим 0,05% Tween-20 (Sigma P2287)). Определение цитокина IFN-y осуществляли путем инкубации 2 мкг/мл биотинилированного детектирующего (detection) антитела против IFN-y, разбавленного в PBS, содержащем 10% FBS, в течение 2 часов при комнатной температуре, с последующей инкубацией с 1:100 стрептавидин-HRP, разбавленного в PBS с 10% FBS. После промывки планшетов 4 раза промывочным буфером и 2 раза PBS, IFN-γ точки (spots) визуализировали с использованием АЕС хромоген-субстрата (11-минутная инкубация при комнатной температуре).
IFN-γ-положительные точки сканировали, регистрировали и подсчитывали с использованием анализатора Cellular Technology ELISpot и программного обеспечения 5.0 Professional Immunospot и средних импульсов на лунку. Неродственный пептид был отрицательным контролем для пептидных антигенов, тогда как БСА был отрицательным контролем для неконъюгированных VLP. Для того чтобы считаться положительным, среднее значение пятен должно быть значительно выше (р<0,05), чем релевантный отрицательный контроль с использованием Т-критерия Стьюдента.
Пример 15: Адъювантный препарат и иммунизация
Адъюванты, использованные в конкретных примерах, описанных в данной заявке (например, Примеры 5-14), получали следующим образом. CpG-24555 готовили в 2 мг/мл концентрате в воде. Используемые квасцы представляли собой Alhydrogel "85" (Brenntag Biosector), содержащий 10 мг/мл алюминия. Alhydrogel "85" смешивали в соотношении 1:1 с 100 мкг пептида или VLP конъюгированного пептида. Обычно вплоть до 25 мкл (для внутримышечных вакцинаций) или 50 мкл (для подкожных вакцинаций) добавляли к раствору с 100 мкг VLP и немедленно встряхивали и помещали на лед. TiterMax Gold (Alexis Biochemicals) добавляли в соотношении 1:1 с растворами пептидов. 50 мкл TiterMax Gold добавляли к 50 мкл 2 мг/мл раствора пептида для 100 мкл подкожной дозы и эмульгировали в течение 10 минут при 4°С с Mixermill (SPEX Образец Ргер). 25 мкл (12 мкг) AblSCO-100 (Isconova) добавляли к 100 мкг раствора VLP-пептида и 5 мкл (10 мкг) CpG-24555, встряхивали и помещали на лед.
Иммунизацию и обработку животных, проведенную в конкретных примерах, описанных в данной заявке (например, Примеры 5-14), осуществляли согласно общепринятым способам. Для вакцинаций, вплоть до 100 мкл вакцины инъецировали подкожно в основание хвоста или 50 мкл инъецировали в одну или обе задние части передней большеберцовой мышцы. Сбор крови проводили через подчелюстную трубку или в конце через пункцию сердца. Селезенки удаляли после обескровливания и цервикальной дислокации и помещали в холодный стерильный HBBS (Invitrogen, кат. №14170) с 5% PBS и Penn/Strep (пенициллин/стрептомицин) (Invitrogen, кат. №15140-122). Селезенки растирали на сите 70 мкм (Falcon). Клетки промывали в ледяном HBBS и эритроциты лизировали с помощью лизирующего буфера АСК (Invitrogen). Спленоциты подсчитывали на Guava PCA 96 (Guava Technologies Inc.).
Пример 16: Оптимизация плотности конъюгирования рТау-пептида с Qbeta/VLP для желаемого иммунного ответа
Эксперимент проводили для того, чтобы определить, влияет ли плотность конъюгирования рТау-пептидного эпитопа с Qbeta/VLP (число пептидов на мономерную субъединицу Qbeta) на рТау-специфические антительные ответы. Различные условия сочетания, полученные путем варьирования молярного избытка SMPH и избытка рТау-пептида, использовали для продукции 8 конъюгатов pTay/VLP с различными плотностями эпитопов (Таблица 4). Группы из 5 мышей-самок BalbC (8-недельных) иммунизировали в 0-е сутки и 14-е сутки (п/к) с использованием 100 мкг каждого из конъюгатов с различной плотностью в 750 мкг квасцов (Al(ОН)3). Сыворотку собирали на 26-е сутки. Антительные ответы от иммунизированных животных исследовали, используя анализ определения антиген-специфического титра, как описано в Примере 13.
Основываясь на результатах титров на 26-е сутки, показанных в Таблице 4, плотность конъюгирования 2,3 для A-8P/QBeta давала иммунный ответ с более высоким титром, чем форма с более высокой (3,6) плотностью конъюгирования. Для различных конъюгатов В-3Р/Qbeta титры были сходными и наибольшими для форм с плотностью конъюгатов 2,2 и 3,6. Для C-2P/Qbeta, плотности конъюгирования эпитопов 2,2 и 3,5 давали сходные титры, которые были несколько выше, чем форма с плотностью конъюгирования 4,3. Результаты показывают, что плотность конъюгирования эпитопов может влиять на антительные ответы антиген-специфическим образом и что в общем условия сочетания, дающие в результате плотность конъюгирования рТау-пептидных эпитопов 2-3 на мономер Qbeta, являются предпочтительными.

В следующей таблице, и как указано ранее в данной заявке, фосфорилированные аминокислоты указаны жирным шрифтом и подчеркнуты.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНА ПРОТИВ ПЕПТИДА CH3 IGE | 2009 |
|
RU2495049C2 |
| ВАКЦИНА ПРОТИВ PCSK9 | 2010 |
|
RU2538162C2 |
| КОНЪЮГАТЫ ПЕПТИДА Melan-A, АНАЛОГА ВИРУСОПОДОБНОЙ ЧАСТИЦЫ | 2004 |
|
RU2351362C2 |
| КОНЪЮГАТ АНГИОТЕНЗИНОВОЙ ПЕПТИДНОЙ СОСТАВЛЯЮЩЕЙ С НОСИТЕЛЕМ, КОМПОЗИЦИЯ ВАКЦИНЫ, СПОСОБ ИММУНИЗАЦИИ ЖИВОТНОГО И СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ ФИЗИЧЕСКОГО НАРУШЕНИЯ, АССОЦИИРОВАННОГО С АКТИВИРУЕМОЙ РЕНИНОМ АНГИОТЕНЗИНОВОЙ СИСТЕМОЙ | 2002 |
|
RU2350622C2 |
| ВАКЦИНЫ ПРОТИВ FMDV НА ОСНОВЕ РЕКОМБИНАНТНОГО АДЕНОВИРУСНОГО ВЕКТОРА И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2725495C2 |
| Иммуногенная композиция, включающая ее вакцина, набор для приготовления вышеуказанной композиции и способ лечения заболеваний, связанных с патологией секреции гастрина | 2014 |
|
RU2664197C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ РАЗМНОЖЕНИЯ ВИЧ-1 | 2001 |
|
RU2275379C2 |
| ВАКЦИНЫ НА ОСНОВЕ ВИРУСОПОДОБНЫХ ЧАСТИЦ (VLP) СОБАЧЬЕГО ПАРВОВИРУСА (CPV) И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2710854C1 |
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ НА ОСНОВЕ АНТИГЕНА Chlamydia trachomatis (ВАРИАНТЫ) И ЕЕ ИСПОЛЬЗОВАНИЕ | 2004 |
|
RU2352356C2 |
| КОМПОЗИЦИИ РЕКОМБИНАНТНОГО CDV И ЕЕ ПРИМЕНЕНИЕ | 2011 |
|
RU2567337C2 |





























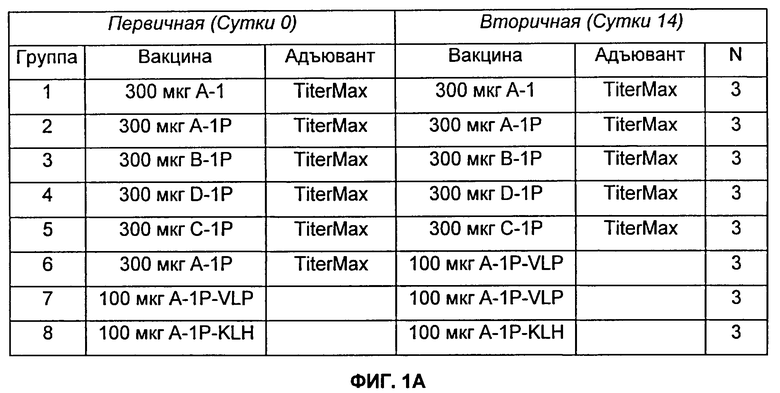
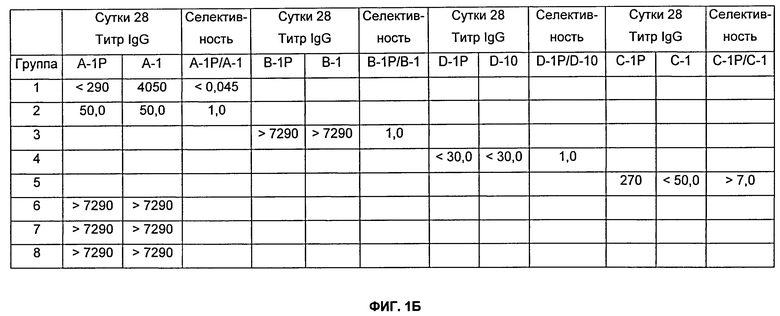
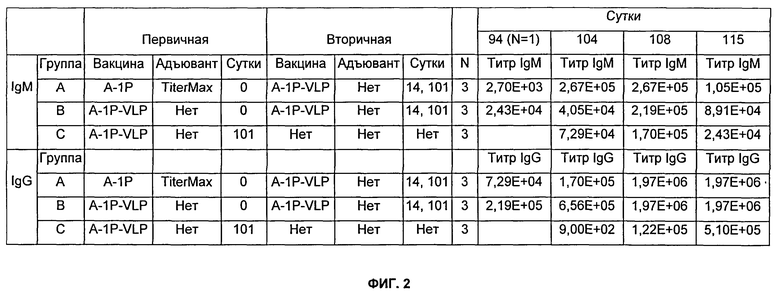
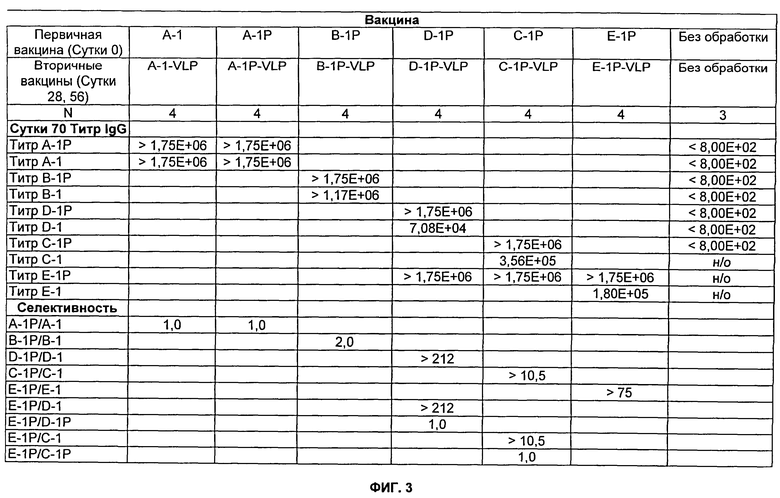
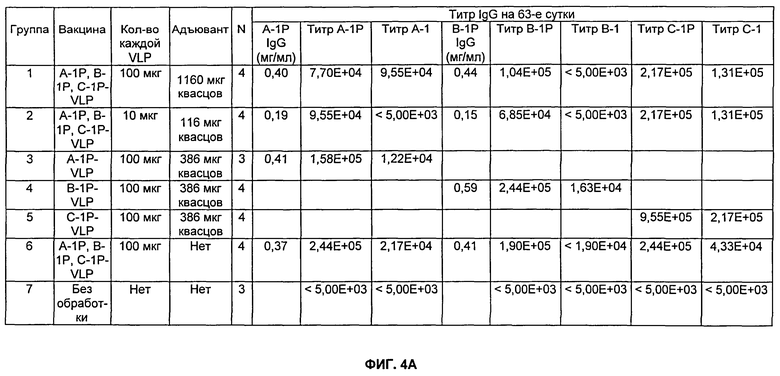
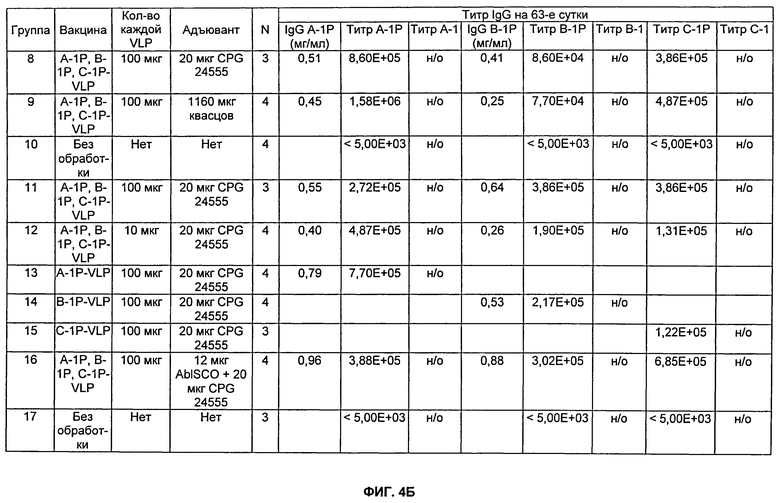
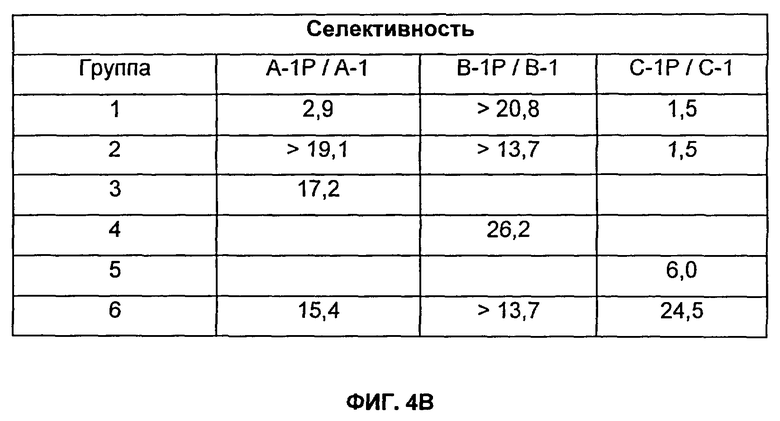
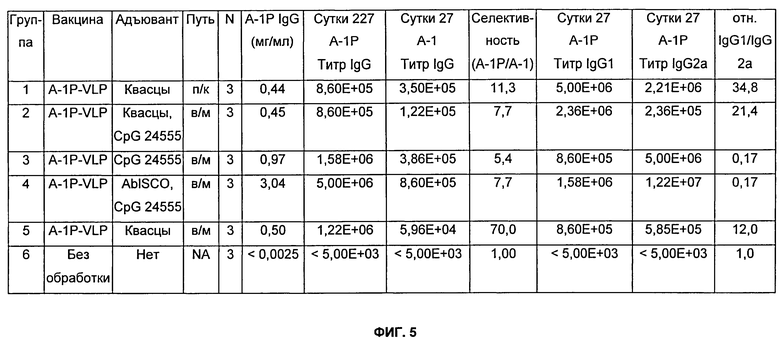
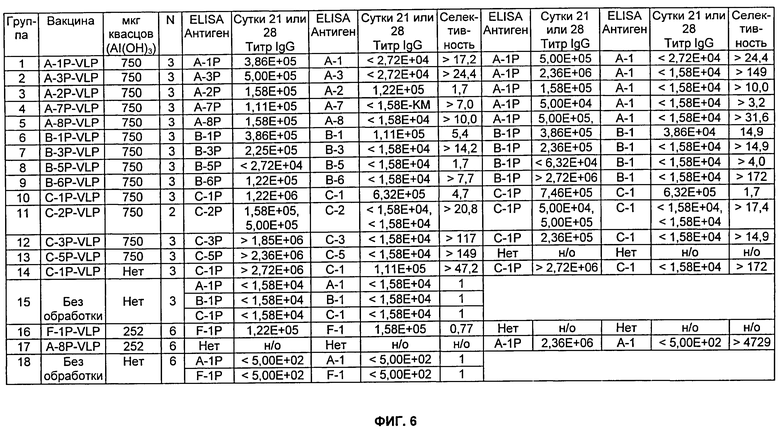
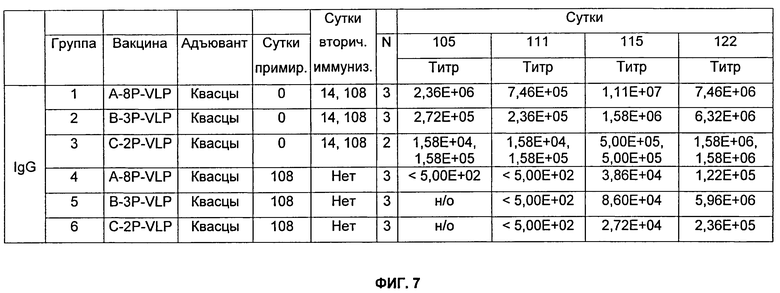
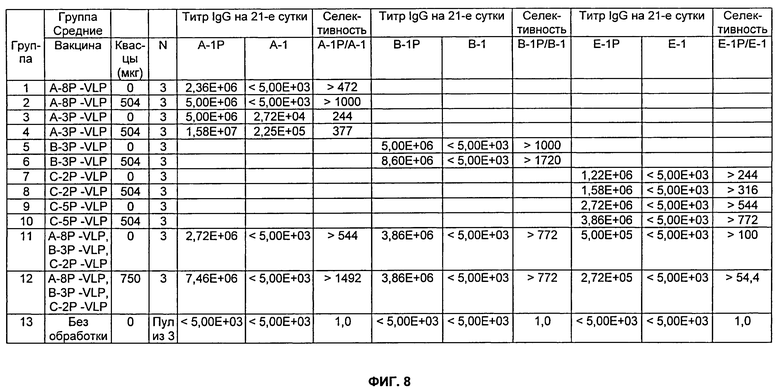

Изобретение относится к области биотехнологии, конкретно к иммуногенам на основе антигенного тау-пептида, и может быть использовано в медицине. Получают иммуноген, содержащий антигенный тау-пептид, состоящий из аминокислотной последовательности, выбранной из SEQ ID NO:6, 8-19, 21-26, 105 и 108-112, ковалентно связанный с иммуногенным носителем посредством линкера, представленного формулой (G)nC, где n равно 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10. При этом линкер может находиться либо на С-конце (пептид-(G)nC), либо на N-конце (С(G)n-пептид) пептида. На основе полученных иммуногенов создают фармацевтические композиции для лечения тау-ассоциированных неврологических расстройств. Изобретение позволяет эффективно индуцировать иммунный ответ против аутоантигена тау. 3 н. и 9 з.п.ф-лы, 10 ил., 5 табл., 16 пр.
1. Иммуноген, обладающий способностью индуцировать иммунный ответ против аутоантигена тау и содержащий антигенный тау-пептид, связанный с иммуногенным носителем, где указанный антигенный тау-пептид состоит из аминокислотной последовательности, выбранной из SEQ ID NO:6, 8-19, 21-26, 105 и 108-112, и где указанный антигенный тау-пептид ковалентно связан с указанным иммуногенным носителем посредством линкера, представленного формулой (G)nC, где указанный линкер находится либо на С-конце (пептид-(G)nC), либо на N-конце (С(G)n-пептид) указанного пептида, и где n равно 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10.
2. Иммуноген по п.1, где указанный антигенный тау-пептид состоит из аминокислотной последовательности, выбранной из SEQ ID NO:6 и 8-13.
3. Иммуноген по п.2, где указанный антигенный тау-пептид состоит из аминокислотной последовательности, представленной в SEQ ID NO:11.
4. Иммуноген по п.1, где указанный антигенный тау-пептид состоит из аминокислотной последовательности, выбранной из SEQ ID NO:14-19.
5. Иммуноген по п.4, где указанный антигенный тау-пептид состоит из аминокислотной последовательности, представленной в SEQ ID NO:16.
6. Иммуноген по п.1, где указанный антигенный тау-пептид состоит из аминокислотной последовательности, выбранной из SEQ ID NO:21-24.
7. Иммуноген по п.6, где указанный антигенный тау-пептид состоит из аминокислотной последовательности, представленной в SEQ ID NO:21.
8. Иммуноген по п.1, где указанный антигенный тау-пептид состоит из аминокислотной последовательности, выбранной из SEQ ID NO:105 и 108-112.
9. Иммуноген по п.8, где указанный антигенный тау-пептид состоит из аминокислотной последовательности, представленной в SEQ ID NO:105.
10. Иммуноген по любому из пп.1-9, где указанный иммуногенный носитель представляет собой вирусоподобную частицу, выбранную из группы, состоящей из HBcAg VLP, HBsAg VLP и Qbeta VLP.
11. Композиция, обладающая способностью индуцировать иммунный ответ против аутоантигена тау и содержащая по меньшей мере два иммуногена, каждый из которых содержит антигенный тау-пептид, связанный с иммуногенным носителем, где указанный антигенный тау-пептид ковалентно связан с указанным иммуногенным носителем посредством линкера, представленного формулой (G)nC, где указанный линкер находится либо на C-конце (пептид-(G)nC), либо на N-конце (С(G)n-пептид) указанного пептида, и где n равно 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10,
где указанная композиция содержит одну из следующих комбинаций:
(1) а) антигенный тау-пептид первого иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:6 и 8-13; и
б) антигенный тау-пептид второго иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:14-19; или
(2) а) антигенный тау-пептид первого иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:6 и 8-13; и
б) антигенный тау-пептид второго иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:21-24; или
(3) а) антигенный тау-пептид первого иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:14-19; и
б) антигенный тау-пептид второго иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:21-24; или
(4) а) антигенный тау-пептид первого иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:6 и 8-13; и
б) антигенный тау-пептид второго иммуногена выбран из SEQ ID NO:105 и 108-112; или
(5) а) антигенный тау-пептид первого иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO: 14-19; и
б) антигенный тау-пептид второго иммуногена выбран из SEQ ID NO:105 и 108-112; или
(6) а) антигенный тау-пептид первого иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:21-24; и
б) антигенный тау-пептид второго иммуногена выбран из SEQ ID NO:105 и 108-112; или
(7) а) антигенный тау-пептид первого иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:6 и 8-13;
б) антигенный тау-пептид второго иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:14-19; и
в) антигенный тау-пептид третьего иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:21-24;
г) антигенный тау-пептид четвертого иммуногена состоит из аминокислотной последовательности, выбранной из SEQ ID NO:105 и 108-112.
12. Фармацевтическая композиция для лечения тау-ассоциированных неврологических расстройств, содержащая иммуноген по любому из пп.1-10 или композицию по п.11 и фармацевтически приемлемый эксципиент.
| US 2008050383 A1, 28.02.2008 | |||
| ASUNI AYODEJI A | |||
| ET AL., Immunotherapy targeting pathological tau conformers in a tangle mouse model reduces brain pathology with associated functional improvements, JOURNAL OF NEUROSCIENCE, 2007, v.27, n.34, p.9115-9129 | |||
| WO 9822120 A1, 28.05.1998 | |||
| WO 2007118660 A2, 25.10.2007 | |||
| US 7279165 B2, 09.10.2007 | |||
| DB EBI/FASTA, |
Авторы
Даты
2014-06-10—Публикация
2010-07-20—Подача