ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к представлению новых иммуногенов, содержащих антигенный пептид IgE, предпочтительно связанный с иммуногенным носителем, для предупреждения, лечения или облегчения IgE-опосредованных расстройств. Изобретение также относится к способам изготовления этих лекарственных средств, их иммуногенных композиций и фармацевтических композиций и их применению в медицине.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
В течение последних нескольких десятилетий число аллергических заболеваний увеличилось до почти эпидемических масштабов и расчеты показывают, что 20-30% от общей численности населения во многих западных странах подвержены этим заболеваниям. Ключевая роль, которую играет IgE в инициации аллергических ответов, убедительно подтверждена. После высвобождения из В-лимфоцитов IgE связывается с высокоаффинным рецептором IgE (FceRI), представленным на тучных клетках и базофилах. Последующее поперечное сшивание соседних молекул IgE на этих клетках специфическими аллергенами затем приводит к их активации, что приводит к высвобождению целого ряда провоспалительных медиаторов (например, гистамина, лейкотриенов, простагландинов), а также ключевых цитокинов и хемокинов. Таким образом, острые локальные ответы сопровождаются рекрутингом и активацией других воспалительных клеток (например, эозинофилов, Т-лимфоцитов), тем самым усиливая аллергический каскад. Дендритные клетки, например, присутствующие в участках аллергического воспаления (например, в легких), также могут экспрессировать FceR1 и могут использовать этот рецептор для селективного и эффективного связывания аллергенов, присутствующих в иммунных комплексах, c IgE и селективного процессинга этих аллергенов для представления аллерген-специфическим Т-клеткам, таким образом обеспечивая механизм постоянной активации Т-клеток и патологических воспалительных реакций.
Большинство современных схем лечения направлены на облегчение симптомов, а не лечение причины заболевания и основаны, главным образом, на применении антигистаминных препаратов, антилейкотриенов, кромогликатов, бета-агонистов и на общих противовоспалительных соединениях, таких как кортикостероиды. Хотя некоторые из подверженных этим заболеваниям пациентов относительно хорошо контролируют свое заболевание с помощью этих лекарственных препаратов, частота их приема (часто ежедневно или даже несколько раз в день) приводит к плохому соблюдению пациентом режима и схемы лечения и последующему ухудшению заболевания. Кроме того, в некоторых случаях, таких как тяжелая астма и тяжелый атопический дерматит, существующие способы лечения являются недостаточными для контроля заболевания.
Совсем недавно моноклональное антитело (омализумаб, также названный Е25, продаваемый под торговым наименованием Xolair®; Presta et al. J Immunol. 1993 Sep 1; 151 (5):2623-32) получило одобрение от нескольких агенств по всему свету, главным образом, для лечения тяжелой астмы и ринита. Несмотря на продемонстрированную эффективность против тяжелой астмы, это антитело все же имеет некоторые недостатки. Во-первых, оно представляет собой гуманизированное мышиное моноклональное антитело и, как таковое, полностью не предотвращает иммунологические реакции у пациентов-людей, таким образом, по-видимому, поднимая некоторые проблемы безопасности. Во-вторых, доза омализумаба, используемая для лечения тяжелой астмы, основана как на массе теле, так и на уровне циркулирующего свободного IgE. Пациентам, масса тела и циркулирующий свободный IgE которых отличаются от указанного диапазона, не рекомендуется использовать это лечение. Те пациенты, которых можно лечить, могут нуждаться в получении вплоть до трех подкожных инъекций один раз в две недели. Это сильно влияет на расходы на лечение (по оценкам варьирует от 15000 до 44000 американских долларов в год на одного пациента) у а также на качество жизни пациентов, затрудняя применение в качестве эснрвной стратегии для лечения аллергий.
Альтернативой для преодоления проблем высокой стоимости и частых введений является запуск нашей собственной иммунной системы для продукции терапевтических антител посредством вакцинации.
В ходе своих исследований предыдущие исследователи в области аллергии столкнулись с рядом обстоятельств и проблем, которые должны быть приняты во внимание при разработке новых способов лечения аллергии. Одна из наиболее опасных проблем относится к вовлечению перекрестного связывания IgE в высвобождении гистаминного сигнала. Наиболее часто случается, что образование антител против IgE во время активной вакцинации способно само по себе запускать высвобождение гистамина посредством поперечного сшивания соседних IgE-рецепторных комплексов в отсутствие аллергена. Это явление называется анафилактогенностью. Действительно, многие имеющиеся в продаже моноклональные антитела против IgE, которые обычно используются в анализах для выявления IgE, являются анафилактогенными и, следовательно, непригодны и потенциально опасны при введении пациенту. Поэтому для безопасности и эффективности при пассивном введении или при индукции вакциной, антитела должны связываться в области IgE, которая способна ингибировать активности IgE, но не является анафилактической сама по себе.
Была разгадана структура константных доменов СН3-СН4 человеческого IgE, взаимодействующих с альфа-субъединицей высокоаффинного рецептора IgE FceRI (Wurzburg BA et a. (2000) Immunity 13 (3) 375-85; Garman SC et al., (2000) Nature 20; 406 (6793):259-66). В предыдущей работе также определили ряд пептидов IgE или производных пептидов или мимеотопов, считающихся полезными для индукции неанафилактогенных антител против IgE (WO 1993/005810; WO 99/67293; WO 2004/058799, WO 9731948, WO 2000/25722, WO 05/075504, US 2002/0645525, US 2004/146504 и US 2006/062782; WO 00/050461, WO 02/34288 и WO 2003/092714; Chen et al. (2008) J. Immunologic. Meth. 333:10-23; Hellman Expert Rev. Vaccines 7 (2): 193-208 (2008)). Такие домены или пептиды lgE, как правило, связаны с носителями для увеличения их иммуногенности с целью подавления аутотолерантности к IgE у индивидуума.
Следовательно, желательно создать композицию, такую как антигенный пептид IgE или комбинация нескольких из них, связанных с иммуногенным носителем, и возможно вводимую с одним или более адъювантами, способными индуцировать эффективные неанафилактогенные анти-IgE антитела у индивидуума, способные в значительной степени снижать уровни циркулирующего свободного IgE. Повышенная эффективность, как правило, приводит к следующим преимуществам: более низкие дозы, необходимые для достижения клинически полезных результатов, более низкий объем инъекции, необходимый, например, для подкожного или внутримышечного введения (по сравнению, например, с терапиями с использованием моноклональных антител), более низкая стоимость лечения, повышенные шансы успешного лечения, уменьшенная частота введения в схеме лечения, обеспечение таким образом доступа к лечению более широкой популяции пациентов, включая пациентов с более высокой массой тела и/или высокими уровнями циркулирующего IgE, а также улучшение качества жизни пациентов.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к иммуногену, содержащему антигенный пептид IgE, предпочтительно связанный с иммуногенным носителем. Указанный антигенный пептид IgE содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-430, предпочтительно из группы, состоящей из SEQ ID NO: 1-153 и 220-430, еще более предпочтительно из группы, состоящей из SEQ ID NO: 220-430. Указанный антигенный пептид IgE может быть модифицирован для целей конъюгирования, предпочтительно путем добавления остатков цистеина или лизина и/или добавления линкеров, таких как GC/GGC-линкеры. В предпочтительных воплощениях указанный антигенный пептид IgE является конформационно ограниченным, предпочтительно просто ограниченным. Указанный иммуногенный носитель представляет собой гетерологичный белок, предпочтительно вирусоподобную частицу (VLP), более предпочтительно VLP HBcAg, HBsAg или Qbeta. Изобретение также относится к способам получения такого антигенного пептида IgE, предпочтительно связанного с иммуногенным носителем.
Изобретение также относится к иммуногенным композициям, содержащим такой антигенный пептид IgE, предпочтительно связанный с иммуногенным носителемт предпочтительно к иммуногенным композициям, возможно содержащим адъювант, предпочтительно выбранный из группы, состоящей из квасцов; CpG-содержащих олигонуклеотидов, предпочтительно CpG7909 и CpG24555; и адъювантов на основе сапонина, предпочтительно Iscomatrix. Предпочтительно, указанная CpG-содержащая нуклеиновая кислота содержит одну или более модифицированных связей, предпочтительно одну или более фосфоротиоатных связей, еще более предпочтительно все межнуклеотидные связи олигонуклеотида представляют собой фосфоротиоатные связи.
Другой аспект изобретения относится к фармацевтическим композициям, содержащим антигенный пептид IgE в соответствии с изобретением или его иммуногенную композицию, а также к медицинским применениям таких композиций.
В частности, изобретение относится к антигенному пептиду IgE по изобретению или его иммуногенной или фармацевтической композиции для применения в качестве лекарственного стредства, предпочтительно для лечения, облегчения или профилактики IgE-опосредованных расстройств. Изобретение также относится к способам индукции иммунного ответа у индивидуума на собственный IgE и к способам лечения, облегчения или предупреждения IgE-опосредованных расстройств, включающим введение эффективного количества указанного антигенного пептида lgE или его иммуногенной или фармацевтической композиции.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг.1: Структурное изображение взаимодействия между областью СН3-СН4 человеческого IgE с его высокоаффинным рецептором FceRI. Показаны 4 петли (синяя, пурпурная, оранжевая и желтая), соответствующие 4 пептидам с SEQ ID NO: 165, 312, 1 и 220, соответственно.
Фиг.2. Графические изображения пептидных форматов для индукции антительных ответов на структурно определенные эпитопы человеческого IgE.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения и основные методы
Если иначе не определено в данной заявке, то научные и технические термины, используемые в связи с настоящим изобретением, имеют значения, которые обычно понятны специалистам в данной области. Как правило, номенклатура, используемая в этой связиу и методы клеточных и тканевых культур, молекулярной биологии, иммунологии, микробиологии,генетики и химии белка и нуклеиновых кислот и гибридизации, описанные в данной заявке, хорошо известны специалистам в данной области.
Способы и методы по настоящему изобретению, как правило, осуществляют в соответствии с традиционными способами, хорошо известными в данной области, и как описано в различных общих и более конкретных ссылках, которые цитируются и обсуждаются в настоящем описании, если не указано иное. См., например, Sambrook J. & Russell D. Molecular Cloning: A Laboratory Manual, 3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2000); Ausubel et al., Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, Wiley, John & Sons, Inc. (2002); Harlow and Lane Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1998); и Coligan et al., Short Protocols in Protein Science, Wiley, John & Sons, Inc. (2003). Ферментативные реакции и методы очистки осуществляют в соответствии с описаниями производителя, как обычно выполняется в данной области или как описано в данной заявке.
Номенклатура, используемая в этой связи, и лабораторные процедуры и методы аналитической химии, синтетической органической химии, а также медицинской и фармацевтической химии, описанные в данной заявке, хорошо известны и широко используются в данной области.
Во всем этом описании и формуле изобретения будет понятно, что слово "содержат" или варианты, такие как "содержит" или "содержающий", означает включение установленного целого или группы целых, но не исключение любого другого целого или группы целых. Подразумевается, что термины "включающий", "состоящий из" и "состоящий по существу из" являются взаимозаменяемыми. Когда в данном описании используются термины, означающие единственное число, тогда они означают "по меньшей мере один" или "один или более", если не указано иное. Кроме того, если иное не предусмотрено контекстом, термины в единственном числе включают множества, и термины во множественном числе включают единственное число, если содержание ясно не диктует иное.
Все публикации, патенты и патентные заявки, процитированные в данном описаниит выше или ниже, включены в данную заявкупосредством ссылки во всей своей полноте.
Основные определения:
Термин "пептид" или "полипептид" относится к полимеру из аминокислот независимо от длины полимера, таким образом, пептиды, олигопептиды и белки включены в определение полипептида. Этот термин также не описывает и не исключает постэкспрессионные модификации полипептидов, например, полипептиды, которые включают ковалентное присоединение гликозильных групп, ацетильных групп, фосфатных групп, липидных групп и тому подобного, прямо охвачены термином полипептид. В определение также включены полипептиды, которые содержат один или более аналогов аминокислоты (включая, например, не встречающиеся в природе аминокислоты, аминокислоты, которые встречаются в природе только в неродственной биологической системе, модифицированные аминокислоты из систем млекопитающих и т.д.), полипептиды с замещенными связями, а также другие модификации, известные в данной области, как природные, так и неприродные.
Термин "выделенный белок", "выделенный полипептид" или "выделенный пептид" представляет собой белок, полипептид или пептид, который в силу своего происхождения или источника получения (1) не ассоциирован с естественно ассоциированными компонентами, которые сопровождают его в его нативном состоянии, (2) свободен от других белков того же вида, (3) экспрессируются клеткой из других видов или (4) не встречаются в природе. Таким образом, пептид, который химически синтезируют или синтезируют в клеточной системе, отличной от клетки, из которой он естественно происходит, будет "отделен" от его естественно ассоциированных компонентов. Белок также может оказаться по существу свободным от естественно ассоциированных компонентов благодаря выделению с использованием методов очистки белка, хорошо известных в данной области.
Используемый в данной заявке термин "очищенный", используемый в отношении молекулы (например, пептид, полипептид или белок), означает, что концентрация молекулы, которую очищают, была увеличена относительно молекул, ассоциированных с ним в его природном окружении или окружении, в котором его продуцируют, обнаруживают или синтезируют. Природно ассоциированные молекулы включают белки, нуклеиновые кислоты, липиды и сахара, но обычно не включают водуу буферы и реагенты, добавленные для поддержания целостности или облегчения очистки очищаемой молекулы.
В некоторых воплощениях соединение является по существу чистым или очищенным, когда оно по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50% или по меньшей мере на 60% по массе свободно от органических молекул, с которыми оно ассоциировано в природе или с которыми оно ассоциировано в процессе изготовления. В некоторых воплощениях препарат состоит по меньшей мере из 70%, по меньшей мере из 75%, по меньшей мере из 90%, по меньшей мере из 95% или по меньшей мере из 99% по массе из интересующего компонента относительно его загрязнений.
По существу чистое или очищенное соединение может быть получено, например, посредством экстракции из природного источника (например, бактерий), посредством химического синтеза соединения или объединения очистки и химической модификации. По существу чистое или очищенное соединение также может быть получено, например, посредством обогащения образца, содержащего соединение, которое связывается с антителом, представляющим интерес. Чистоту можно измерить любым подходящим способом, например, посредством анализа хроматографии, масс-спектрометрии, высокоэффективной жидкостной хроматографии и т.д.
Термин "гетерологичный", используемый в данной заявке в контексте пептида или полипептида IgE, где полипептидный слитый белок IgE содержит пептид или полипептид IgE и "гетерологичный" полипептид, относится к полипептиду, отличному от пептида или полипептида IgE, например, полипептиду, который обычно не связан в природе с пептидом или полипептидом IgE. Например, гетерологичный полипептид не несет значительной идентичности аминокислотной последовательности с пептидом или полипептидом IgE, например, гетерологичный полипептид имеет менее чем примерно 50%, менее чем примерно 40%, менее чем примерно 30% или менее чем примерно 20% идентичности аминокислотной последовательности с пептидом или полипептидом IgE.
Используемый в данной заявке термин "IgE-опосредованное расстройство" или "IgE-ассоциированное расстройство" означает состояние или заболевание, которое характеризуется сверхпродукцией и/или гиперчувствительноетью к иммуноглобулину IgE. В частности, это можно истолковывать как включeниe состояний, ассоциированных с анафилактической гиперчувствительностью и атопическими аллергиями, включая, например: астму, аллергическую астму, аллергический ринит и конъюнктивит (сенную лихорадку), экзему, крапивницу, атопический дерматит и пищевые аллергии, включающие аллергию на арахис. Серьезное физиологическое состояние анафилактического шока, вызванного, например, укусами пчел, укусами змей, пищей или лекарственным препаратом, также входят в объем этого термина. Другие IgE-опосредованные расстройства включают анафилаксию, контактный дерматит, аллергическую гастроэнтеропатию, аллергический легочный аспергиллез, аллергическую пурпуру, экзему, гипер-IgE синдром (Джоба), анафилактическую гиперчувствительность, IgE миелому, воспалительное заболевание кишечника (например, болезнь Крона, неспецифический язвенный колит, неопределенный колит и инфекционный колит), крапивницу и псориаз.
Антигенный пептид IgE по изобретению
Настоящее изобретение относится к пептидам IgE и пептидам, полученным из них, которые были идентифицированы в виде участков СН3 домена IgE, способных образовывать петли, участвующие во взаимодействии СН3-СН4 области с его высокоаффинным рецептором FceRI (см. Фиг.1). Было показано, что такие пептиды IgE являются иммуногенными и неанафилактогенными.
Такие антигенные пептиды IgE могут быть использованы отдельно или в комбинации, предпочтительно, когда они конъюгированы с иммуногенным носителем, для индукции аутоантител против IgE у субъекта для лечения, предупреждения или облегчения IgE-ассоциированных расстройств.
В частности, настоящее изобретение относится к иммуногену, состоящему из, состоящему по существу из или содержащему антигенный пептид IgE, предпочтительно связанный с иммуногенным носителем.
В одном из воплощений антигенный пептид IgE по изобретению состоит из, состоит по существу из или содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-430, и его функционально активные варианты, предпочтительно выбранные из группы, состоящей из SEQ ID NO: 1-430. В другом воплощении указанный антигенный пептид IgE состоит из, состоит по существу из или содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID-NO: 1-153, и его функционально" активные варианты, предпочтительно выбранные из группы, состоящей из SEQ ID NO: 1-153. В другом воплощении указанный антигенный пептид IgE состоит из, состоит по существу из или содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 154-219, и его функционально активные варианты, предпочтительно выбранные из группы, состоящей из SEQ ID NO: 154-219. В еще одном воплощении указанный антигенный пептид IgE состоит из, состоит по существу из или содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 220-310, и его функционально активные варианты, предпочтительно выбранные из группы, состоящей из SEQ ID NO: 220-310. В еще одном воплощении указанный антигенный пептид IgE состоит из, состоит по существу из или содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 311-430, и его функционально активные варианты, предпочтительно выбранные из группы, состоящей из SEQ ID NO: 311-430.
Термин "антигенный пептид IgE" в пределах значения настоящего изобретения включает все СН3-производные пептиды IgE, предпочтительно из видов млекопитающих, более предпочтительно из человека, а также их варианты, аналоги, ортологи, гомологи и производные, а также их фрагменты, которые демонстрируют "биологическую активность антигенного пептида IgE". Предпочтительно, термин "антигенный пептид IgE" относится к пептидам, содержащим, состоящим из или состоящим по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-430, а также к их вариантам, гомологам и производным, демонстрирующим по существу такую же биологическую активность. Более предпочтительно, термин "антигенный пептид IgE" относится к пептидам, содержащим, состоящим из или состоящим по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID 1-430, более предпочтительно к пептидам, содержащим, состоящим из или состоящим по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-153 и 220-430, еще более предпочтительно к пептидам, содержащим, состоящим из или состоящим по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 220-430.
В воплощении антигенный пептид IgE по изобретению состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429 и 430.
В другом воплощении антигенный пептид IgE по изобретению состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152 и 153. Предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 88, 89, 90, 91, 92, 93, 94, 95, 96, 99, 100, 101, 102, 103, 104, 105, 106, 109, 110, 111, 112, 113, 114, 115, 118, 119, 120, 121, 122, 123, 126, 127, 128, 129, 130, 133, 134, 135, 136, 139, 140, 141, 144, 145 и 148. Более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 49, 50, 51, 52, 53, 54, 55, 56, 57, 63, 64, 65, 66, 67, 68, 69, 70, 76, 77, 78, 79, 80, 81, 82, 88, 89, 90, 91, 92, 93, 99, 100, 101, 102, 103, 109, 110, 111, 112, 118, 119, 120, 126, 127, 133 и 139. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 18, 19, 20, 21, 22, 23, 24, 25, 34, 35, 36, 37, 38, 39, 40, 49, 50, 51, 52, 53, 54, 63, 64, 65, 66, 67, 76, 77, 78, 79, 88, 89, 90, 99, 100, 101 и 109. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 18, 19, 20, 21, 22, 34, 35, 36, 37, 49, 50, 51, 63, 64 и 76. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 3, 18, 19 и 34. Наиболее предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности SEQ ID NO: 1 или 18.
В другом воплощении антигенный пептид IgE по изобретению состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218 и 219. Предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 154, 155, 156, 157, 158, 159, 160, 161, 162, 165, 166, 167, 168, 169, 170, 171, 172, 175, 176, 177, 178, 179, 180, 181, 184, 185, 186, 187, 188, 189, 192, 193, 194, 195, 196, 199, 200, 201, 202, 205, 206, 207, 210, 211, 214 и 217. Более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 154, 155, 156, 157, 158, 159, 165, 166, 167, 168, 169, 175, 176, 177, 178, 184, 185, 186, 192, 193, 199 и 200. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 154, 155, 156, 165, 166 и 175. Наиболее предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности SEQ ID NO: 154 или 165.
В другом воплощении антигенный пептид IgE по изобретению состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309 и 310. Предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 245, 246, 247, 248, 249, 250, 251, 252, 253, 256, 257, 258, 259, 260, 261, 262, 263, 266, 267, 268, 269, 270, 271, 272, 275, 276, 277, 278, 279, 280, 283, 284, 285, 286, 287, 290, 291, 292, 293, 296, 297, 298, 301, 302 и 305. Более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 225, 226, 227, 233, 234, 235, 236, 237, 238, 239, 245, 246, 247, 248, 249, 250, 256, 257, 258, 2597 2607 2667 267, 268, 269, 275, 276, 277, 283, 284 и 290. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 233, 234, 235, 236, 245, 246, 247, 256, 257 и 266. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 220, 221, 222, 233, 234 и 245. Наиболее предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности SEQ ID NO: 220 или 233.
В еще одном воплощении антигенный пептид IgE по изобретению состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429 и 430. Предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 365, 366, 367, 368, 369, 370, 371, 372, 373, 376, 377, 378, 379, 380, 381, 382, 383, 386, 387, 388, 389, 390, 391, 392, 395, 396, 397, 398, 399, 400, 403, 404, 405, 406, 407, 410, 411, 412, 413, 416, 417, 418, 421, 422 и 425. Более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 326, 327, 328, 329, 330, 331, 332, 333, 334, 340, 341, 342, 343, 344, 345, 346, 347, 353, 354, 355, 356, 357, 358, 359, 365, 366, 367, 368, 369, 370, 376, 377, 378, 379, 380, 386, 387, 388, 389, 395, 396, 397, 403, 404 и 410. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 326, 327, 328, 329, 330, 331, 340, 341, 342, 343, 344, 353, 354, 355, 356, 365, 366, 367, 376, 377 и 386. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 326, 327, 328, 340, 341 и 353. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 311, 312 и 326. Наиболее предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности SEQ ID NO: 311 или 312.
Термин "биологическая активность антигенного пептида IgE", используемый в данной заявке, относится к способности антигенных пептидов IgE по изобретению индуцировать аутоантитела против IgE у пациента с антагонистическим профилем, где такие аутоантитела способны снижать уровень циркулирующего свободного IgE, не вызывая какого-либо существенного IgE-опосредованного высвобождения воспалительных медиаторов, и в то же время по существу не способны связываться с IgE, связанным с его высокоаффинным рецептором. Специалисту в данной области очевидно, какие методы можно использовать для подтверждения того, находится ли конкретная конструкция в пределах объема настоящего изобретения. Такие методы включают, но не ограничиваются этим, методы, описанные в разделе примеров настоящей заявки, а также следующие. Предполагаемый пептид может быть проанализирован для выяснения иммуногенности конструкции в том смысле, что антисыворотки, индуцированные предполагаемым пептидом, перекрестно реагируют с нативной молекулой IgE, а также являются функциональными в блокировании высвобождения аллергического медиатора из аллергических эффекторных клеток.
Специфичность этих реакций можно подтвердить функциональными анализами, где снижение IgE можно определить количественно и/или по ингибированию дегрануляции клеток, экспрессирующих рецептор IgE, или в экспериментах с конкуренцией по блокированию активности антисыворотки самим пептидом или нативным IgE, и/или специфическими моноклональными антителами, которые, как известно, связываются с эпитопом в IgE. Методы, устанавливающие связывание с IgE-FcRI, хорошо известны специалистам в данной области.
В воплощении антигенные пептиды IgE по настоящему изобретению имеют такой размер, что они имитируют область, выбранную из целого домена IgE, в котором находится нативный эпитоп.В конкретном воплощении антигенные пептиды IgE по изобретению имеют длину менее 100 аминокислот, предпочтительно менее 75 аминокислот, более предпочтительно менее 50 аминокислот, еще более предпочтительно менее 40 аминокислот. Антигенные пептиды IgE по изобретению обычно имеют длину 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 аминокислот, предпочтительно от 4 до 20 аминокислот, например, 6-12 или 6-9 аминокислот.
Конкретные примеры антигенных пептидов IgE по изобретению представлены в перечне последовательностей и включают пептиды, длина которых варьируется от 4 до 20 аминокислот.
Антигенные пептиды по изобретению включают аминокислотную последовательность, происходящую из участка человеческого СН3 IgE, где такой производный участок человеческого СН3 либо соответствует аминокислотной последовательности природного IgE, либо соответствует варианту IgE, т.е. аминокислотной последовательности природного IgE, в которой небольшое число аминокислот было замещено, добавлено или делетировано, но которая сохраняют по существу те же иммунологические свойства. Кроме того, такой производный участок СН3 IgE может быть дополнительно модифицирован аминокислотами, особенно на N- и С-концах, для обеспечения конформационного ограничения антигенного пептида IgE и/или обеспечения сочетания антигенного пептида IgE с иммуногенным носителем после проведения соответствующей химии.
Антигенные пептиды IgE по настоящему изобретению охватывают функционально активные вариантные пептиды, происходящие из аминокислотной последовательности СН3 IgE, в которой аминокислоты были делегированы, встроены или замещены без существенного уменьшения их иммунологических свойств, т.е. такие функционально активные вариантные пептиды сохраняют существенную биологическую активность антигенного пептида IgE. Как правило, такие функционально активные вариантные пептиды имеют аминокислотную последовательность, гомологичную, предпочтительно высокогомологичную, аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-430, более предпочтительно, аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-153 и 220-430, еще более предпочтительно, аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 220-430.
В одном из воплощений такие функционально активные вариантные пептиды демонстрируют по меньшей мере 60%-, 65%-, 70%-, 75%-, 80%-, 85%-, 90%- или 95%-ную идентичность с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 1-430, более предпочтительно с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 1-153 и 220-430, еще более предпочтительно с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 220-430.
Сходство последовательностей для полипептидов, которую также называют идентичностью последовательностей, как правило, измеряют с использованием программного обеспечения для анализа последовательностей. Программное обеспечение для белкового анализа сравнивает сходные последовательности с использованием критериев сходства, определенных для различных замен, делеций и других модификаций, включая консервативные аминокислотные замены. Например, GCG содержит такие программы, как "Gap" и "Bestfit", которые могут быть использованы с параметрами по умолчанию для определения гомологии последовательностей или идентичности последовательностей между близкородственными полипептидами, такими как гомологичные полипептиды из различных видов организмов, или между белком дикого типа и его мутеином. См., например, GCG версию 6.1. Полипептидные последовательности также можно сравнивать с помощью FASTA с использованием стандартных или рекомендованных параметров, программа в GCG версии 6.1. FASTA (например, FASTA2 и FASTA3) обеспечивает выравнивание и процент идентичности областей последовательностей с наилучшим перекрыванием между заданной и поисковой последовательностями (Pearson, Methods Enzymol. 183:63-98 (1990); Pearson, Methods Mol. Biol. 132:185-219 (2000)). Альтернативный алгоритм при сравнении последовательности по изобретению с базой данных, содержащей большое число последовательностей из различных организмов, представляет собой компьютерную программу BLAST, особенно blastp или tbiastn. с использованием параметров по умолчанию. См., например, Altschul et al., J. Mol. Biol. 215:403-410 (1990); Altschul et al., Nucleic Acids Res. 25:3389-402 (1997).
Функционально активные варианты содержат природные функционально активные варианты, такие как аллельные варианты и видовые варианты и неприродные функционально активные варианты, которые могут быть получены, например, с помощью методов мутагенеза или прямым синтезом.
Например, функционально активный вариант отличается на примерно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных остатков от любого пептида, представленного в SEQ ID NO: 1-430, более предпочтительно в SEQ ID NO: 1-153 и 220-430, еще более предпочтительно в SEQ ID NO: 220-430, и все еще сохраняет биологическую активность антигенного IgE. Когда сравнение требует выравнивания, последовательности выравнивают для максимальной гомологии. Сайт варьирования может находиться в любом месте пептида, при условии, что биологическая активность по существу сходна с пептидом, представленным в SEQ ID NO: 1-430, более предпочтительно по существу сходна с пептидом, представленным в SEQ ID NO: 1-153 и 220-430, еще более предпочтительно по существу сходна с пептидом, представленным в SEQ ID NO: 220-430.
Руководство относительно того, как сделать фенотипически молчащие аминокислотные замены, предложено в Bowie et al., Science, 247: 1306-1310 (1990), в котором указано, что существуют две основные стратегии изучения устойчивости аминокислотной последовательности к изменению.
Первая стратегия использует устойчивость аминокислотных замен с помощью естественного отбора в процессе эволюции. Путем сравнения аминокислотных последовательностей у разных видов можно идентифицировать положения аминокислот, которые стали консервативными между видами. Эти консервативные аминокислоты, по-видимому, важны для функции белка. Напротив, аминокислотные положения, в которых замены были допустимыми, указывают положения, которые не являются критическими для функции белка. Таким образом, положения, допускающие аминокислотные замены, могут быть модифицированы при поддержании специфической иммуногенной активности модифицированного пептида.
Вторая стратегия использует генную инженерию для введения аминокислотных изменений в конкретных положениях клонированного гена для идентификации областей, критических для функции белка. Например, можно использовать сайт-направленный мутагенез или аланин-сканирующий мутагенез (Cunningham et al., Science, 244: 1081-1085 (1989). Полученные вариантные пептиды затем можно протестировать на специфическую антигенную биологическую активность IgE.
Согласно Bowie с соавт., эти две стратегии выявили, что белки неожиданно устойчивы к аминокислотным заменам. Авторы далее показывают, какие аминокислотные изменения, по-видимому, являются допустимыми в некоторых аминокислотных положениях в белке. Например, наиболее замаскированные или внутренние (в пределах третичной структуры белка) аминокислотные остатки требуют неполярных боковых цепей, в товремя как некоторые особенности поверхности или наружные боковые цепи, как правило, сохраняются.
Способы введения мутации в аминокислоты белка хорошо известны специалистам в данной области. См., например, Ausubel (ed.), Current Protocols in Molecular Biology, John Wiley and Sons, Inc. (1994); Т. Maniatis, E.F. Fritsch and J. Sambrook, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor laboratory, Cold Spring Harbor, N.Y. (1989)).
Мутации также можно вводить с использованием имеющихся в продаже наборов, таких как "QuikChangeTM Site-Directed Mutagenesis Kit" (Stratagene) или непосредственно синтезом пептидов. Получение функционально активного варианта к антигенному пептиду IgE посредством замены аминокислоты, которая не влияет значительно на функцию указанного антигенного пептида IgE, может буть выполнено специалистом в данной области.
Тип аминокислотной замены, которую можно осуществить в одном из пептидов в соответствии с изобретением, представляет собой консервативную аминокислотную замену. "Консервативная аминокислотная замена" представляет собой замену, при которой аминокислотный остаток замещен другим аминокислотным остатком, имеющим группу R боковой цепи) со сходными химическими свойствами (например, заряд или гидрофобность). В общем, консервативная аминокислотная замена не будет существенно изменять функциональные свойства белка. В тех случаях, когда две или более аминокислотных последовательностей отличаются друг от друга консервативными заменами, процент идентичности последовательностей или степень сходства могут быть увеличены для введения поправки в отношении консервативной природы замены. Средства для выполнения такой корректировки хорошо известны специалистам в данной области. См., например, Pearson, Methods Mol. Biol. 243:307-31 (1994).
Примеры групп аминокислот, которые имеют боковые цепи со сходными химическими свойствами, включают 1) алифатические боковые цепи: глицин, аланин, валин, лейцин и изолейцин; 2) алифатические-гидроксильные боковые цепи: серин и треонин; 3) амид-содержащие боковые цепи: аспарагин и глутамин; 4) ароматические боковые цепи: фенилаланин, тирозин и триптофан; 5) основные боковые цепи: лизин, аргинин и гистидин; 6) кислые боковые цепи: аспарагиновая кислота и глутаминовая кислота; и 7) серосодержащие боковые цепи: цистеин и метионин. Предпочтительные группы консервативных аминокислотных замен представляют собой: валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин, глутамат-аспартат и аспарагин-глутамин.
Альтернативно, консервативная замена представляет собой любое изменение, имеющее положительное значение в РАМ250 матрице логарифмического правдоподобия, раскрытой в Gonnet et al., Science 256:1443-45 (1992). "Умеренно консервативная" замена представляет собой любое изменение, имеющее неотрицательное значение в РАМ250 матрице логарифмического правдоподобия.
Функционально активный вариантный пептид также может быть выделен с использованием метода гибридизации. Кратко, ДНК, имеющую высокую степень гомологии с целой или частью последовательности нуклеиновой кислоты, кодирующей пептид, полипептид или белок, представляющий интерес, например SEQ ID NO: 1-430, используют для получения функционально активного пептида. Поэтому антигенный пептид IgE по изобретению также включает пептиды, которые функционально эквивалентны одному или более чем одному пептиду с SEQ ID NO: 1-430 и которые кодируются молекулой нуклеиновой кислоты, которая гибридизуется с нуклеиновой кислотой, кодирующей любую из SEQ ID NO: 1-430, или ее комплементом. Специалист в данной области может легко определить последовательности нуклеиновых кислоту которые кодируют пептиды по изобретению, с использованием легко доступных таблиц кодонов. Как таковые, эти последовательности нуклеиновых кислот не представлены в данной заявке.
Жесткость гибридизации для нуклеиновой кислоты, кодирующей пептид, полипептид или белок, который представляет собой функционально активный вариант, представляет собой, например, 10% формамида, 5 × SSPE, 1 × раствор Денхардта и 1 × ДНК спермы лосося (условия низкой жесткости). Более предпочтительными условиями являются 25% формамида, 5 × SSPE, 1 × раствор Денхардта и 1 × ДНК спермы лосося (условия умеренной жесткости) и еще более предпочтительные условия включают 50% формамида, 5 × SSPE, 1 × раствор Денхардта и 1 × ДНК спермы лосося (условия высокой жесткости). Однако некоторые другие факторы, чем вышеописанная концентрация формамида, влияют на жесткость гибридизации, и специалист в данной области может соответственно выбрать эти факторы для получения сходной жесткости.
Молекулы нуклеиновой кислоты, кодирующие функционально активный вариант, также могут быть выделены с помощью метода амплификации гена, такого как ПЦР (полимеразная цепная реакция), с использованием части молекулы нуклеиновой кислоты ДНК, кодирующей пептид, полипептид или белок, представляющий интерес, например, любого из пептидов, представленных в SEQ ID NO: 1-430, в качестве зонда.
Для целей настоящего изобретения следует считать, что некоторые антигенные пептиды IgE по изобретению можно использовать в комбинации. Все типы возможных комбинаций можно представить. Например, можно использовать полипептид, содержащий более чем один антигенный пептид IgE, предпочтительно выбранный из SEQ ID NO: 1-430, более предпочтительно из SEQ ID NO: 1-153 и 220-430, еще более предпочтительно из SEQ ID NO: 220-430, где один и тот же антигенный пептид IgE используют в нескольких копиях на одной и той же полипептидной молекуле, или где антигенные пептиды IgE различных аминокислотных последовательностей используют на одной и той же полипептидной молекуле; где различные антигенные пептиды IgE или копии непосредственно слиты друг с другом или разделены соответствующими линкерами. Используемый в данной заявке термин "мультимеризованный антигенный IgE (поли)пептид" относится к обоим типам комбинации, где антигенные пептиды IgE либо с разной, либо с одинаковой аминокислотной последовательностью присутствуют в одной полипептидной молекуле. Таким образом, от 2 до примерно 20 идентичных и/или различных антигенных пептидов IgE, предпочтительно 2, 3, 4, 5, 6 или 7 антигенных пептидов IgE, могут присутствовать на одной мультимеризованной молекуле антигенного полипептида IgE.
В одном аспекте изобретения иммуноген состоит из, состоит по существу из или содержит мультимеризованный антигенный пептид IgE, состоящий из, состоящий по существу из или содержащий по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-430, и его функционально активные варианты, предпочтительно выбранные из группы, состоящей из SEQ ID NO: 1-430. В одном из воплощений указанный мультимеризованный пептид IgE содержит первый антигенный пептид IgE, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-153, и второй антигенный пептид IgE, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 154-219, или SEQ ID NO: 220-310, или SEQ ID NO: 311-430. В другом воплощении указанный мультимеризованный пептид IgE содержит первый антигенный пептид IgE, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 154-219, и второй антигенный пептид IgE, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-153, или SEQ ID NO: 220-310, или SEQ ID NO: 311-430. В еще одном воплощении указанный мультимеризованный пептид IgE содержит первый антигенный пептид IgE, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 220-310, и второй антигенный пептид IgE, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-153, или SEQ ID NO: 154-219, или SEQ ID NO: 311-430. В еще одном воплощении указанный мультимеризованный пептид IgE содержит первый антигенный пептид IgE, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 311-430, и второй антигенный пептид IgE, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-153, или SEQ ID NO: 154-219, или SEQ ID NO: 220-310. В еще одном воплощении указанный мультимеризованный пептид IgE содержит первый антигенный пептид IgE, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 311-430, второй антигенный пептид IgE, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 220-310, и третий антигенный пептид IgE, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 154-219 или SEQ ID NO: 1-153.
В одном из воплощений изобретения пептид, полипептид или белок по изобретению происходит из природного источника и выделен из млекопитающего, такого как человек, примат, кошка, собака, лошадь, мышь или крыса, предпочтительно из человеческого источника. Таким образом, пептид, полипептид или белок по изобретению могут быть выделены из клеток и источников тканей с использованием стандартных методов очистки белка.
Альтернативно, пептиды, полипептиды и белки по изобретению могут быть синтезированы химически или получены с использованием методов рекомбинатных ДНК.
Например, пептид, полипептид или белок по изобретению может быть синтезирован с помощью твердофазных процедур, хорошо известных в данной области. Соответствующие синтезы можно выполнять с использованием "Т-bос" или "F-moc" процедур. Циклические пептиды могут быть синтезированы с помощью твердофазной процедуры с использованием хорошо известной "F-moc" процедуры и полиамидной смолы в полностью автоматизированном приборе. Альтернативно, специалисты в данной области обычно знают необходимые лабораторные процедуры для выполнения процесса вручную. Методы и процедуры для твердофазного синтеза описаны в 'Solid Phase Peptide Synthesis: A Practical Approach' by E. Atherton and R.C. Sheppard, published by IRL at Oxford University Press (1989) и 'Methods in Molecular Biology, Vol.35: Peptide Synthesis Protocols (ed. M.W.Pennington and В.М.Dunn), chapter 7, pp91-171 by D. Andreau et al.
Альтернативно, полинуклеотид, кодирующий пептид, полипептид или белок по изобретению, можно вводить в экспрессирующий вектор, который может экспрессироваться в подходящей системе экспрессии с использованием способов, хорошо известных в данной области, с последующим выделением или очисткой экспрессируемого пептида, полипептида или белка, представляющего интерес. Различные бактериальные дрожжевые растительные экспрессирующие системы, экспрессирующие системы млекопитающих и насекомых доступны в данной области, и любая такая экспрессирующая система может быть использована. Возможно, полинуклеотид, кодирующий пептид, полипептид или белок по изобретению можно транслировать в бесклеточной трансляционной системе.
Антигенные пептиды IgE по изобретению также могут включать такие пептиды, которые появляются в результате существования множественных генов, альтернативных транскрипционных событий, альтернативных событий РНК-сплайсинга и альтернативных трансляционных и посттрансляционных событий. Пептид можно экспрессировать в системах, например, в культивируемых клетках, что приводит по существу к таким же посттрансляционным модификациям, которые происходят, когда пептид экспрессируется в нативной клетке, или в системах, которые приводят к изменению или пропуску посттрансляционных модификаций, например, гликозилирования или расщепления, происходящих при экспрессии в нативной клетке.
Пептид, полипептид или белок по изобретению, такой как антигенный пептид IgE, может продуцироваться в виде слитого белка, который содержит другие не-IgE или не-IgE-производные аминокислотные последовательности, такие как аминокислотные линкеры или сигнальные последовательности, или иммуногенные носители, как определено в данной заявке, а также лиганды, полезные в очистке белка, такие как глутатион-S-трансфераза, гистидиновая метка и стафилококковый белок А. В слитом белке может присутствовать более чем один антигенный пептид IgE по изобретению. Гетерологичный полипептид может быть слит, например, с N-концом или С-концом пептида, полипептида или белка по изобретению. Пептид, полипептид или белок по изобретению также моет продуцироваться в виде слитых белков, содержащих гомологичные аминокислотные последовательности, т.е. другие IgE или IgE-производные последовательности.
Антигенные пептиды IgE по изобретению могут быть линейными или конформационно ограниченными. В предпочтительных воплощениях изобретения антигенный пептид IgE является конформационно ограниченным. Используемый в данной заявке в отношении молекулы термин конформационно ограниченный означает молекулу такую как пептид полипептид или белок, в которой трехмерная структура поддерживается, в значительной мере, в одном пространственном расположении во времени. Конформационно ограниченные молекулы могут иметь улучшенные свойства, такие как повышенная аффинность, метаболическая стабильность, проницаемость мембран или растворимость.
Кроме того, такие конформационно ограниченные молекулы, как ожидается, представляют эпитоп антигенного IgE в конформации, сходной с их нативной петлевой конформацией, таким образом индуцируя анти-IgE антитела, более чувствительные для распознавания интактных, нативных собственных молекул IgE или с повышенной аффинностью для распознавания собственных молекул IgE. Способы конформационного ограничения хорошо известны в данной области и включают, без ограничения, образование мостиков и циклизацию.
Существует несколько подходов, известных в предшествующем уровне техники, для введения конформационных ограничений в линейный пептид или полипептидную цепь. Например, образование мостика между двумя соседними аминокислотами в пептиде приводит к локальной конформационной модификации, гибкость которой ограничена по сравнению с регулярными пептидами. Некоторые возможности образования таких мостиков включают включение лактамов и пиперазинонов (см. обзор Giannis and Kolter, Angew. Chem. Int. Ed., 1993, 32: 1244).
Используемый в данной заявке в отношении пептида термин "циклический" относится к структуре, включая внутримолекулярную связь между двумя несоседними аминокислотами или аминокислотными аналогами. Циклизация может осуществляться посредством ковалентной или нековалентной связи. Внутримолекулярные связи включают, но не ограничивается, связи остова с остовом, боковой цепи с остовом, боковой цепи с боковой цепью, боковой цепи с концевой группой, связи конец-в-конец. Способы циклизации включают, без ограничения, образование дисульфидной связи между боковыми цепями несоседних аминокислот или аминокислотных аналогов; образование амидной связи между боковыми цепями остатков Lys и Asp/Glu; образование сложноэфирной связи между остатками серина и остатками Asp/Glu; образование лактамной связи, например, между группой боковой цепи одной аминокислоты или ее аналога с N-концевым амином амино-концевого остатка; и образование лизинонорлейциновых и дитирозиновых связей. Также можно использовать углеродные варианты дисульфидной связи, например, этенильную или этильную связь (J. Peptide Sc., 2008, 14, 898-902), а также реакции алкилирования с соответственно полизамещеным электрофильным реагентом, такие как ди-, три- или тетрагалогеноалкан (PNAS, 2008, 105 (40), 15293-15298; ChemBioChem, 2005, 6, 821-824). Для включения конфирмационных ограничений в пептиды также можно использовать различные модифицированные аналоги пролина (Zhang et al., J. Med Chem., 1996, 39: 2738-2744; Pfeifer and Robinson, Chem. Comm., 1998, 1977-1978). Химия, которую можно использовать для циклизации пептидов по изобретению, приводит к пептидам, циклизированным с помощью связи, включающей, но не ограничивающейся этим, следующие связи: лактамные, гидразоновые, оксимные, тиазолидиновые, тиоэфирные или сульфониевые связи.
Еще один подход в конструировании конформационно ограниченных пептидов, который описан в US 10/114918, представляет собой присоединение короткой аминокислотной последовательности, представляющей интерес, к матрице с получением циклического ограниченного пептида. Такие циклические пептиды не только структурно стабилизированы своими матрицами и, таким образом, создают трехмерные конформации, которые могут имитировать конформационные эпитопы на нативных белках, таких как на вирусах и паразитах или на собственных белках (аутологичные белки млекопитающих, такие как IgE), но они также более устойчивы, чем линейные пептиды, к протеолитической деградации в сыворотке. В US 10/114918 также раскрыт синтез конформационно ограниченных поперечно сшитых пептидов посредством получения синтетических аминокислот для остова, соединенных с соответствующим образом расположенными аминокислотами с целью стабилизации супервторичной структуры пептидов. Сшивание может быть достигнуто посредством амидного сочетания первичной аминогруппы ортогонально защищенного (2S, 3R)-3-aMHHonponnHOBoro остатка с соответствующим образом расположенной карбоксильной группой боковой цепи глутамата. Такой подход привел к получению конформационно ограниченных тетрапептидных повторов CS-белка, где по меньшей мере один пролин был заменен (2S, 3R)-3-аминопролином и, с целью введения карбоксильной группы боковой цепи, глутамат был введен для замены аланина.
Стратегии поперечного сшивания также включают применение реакции мутагенеза с закрытием цикла по Граббсу (Grubbs) для образования 'сшитых' (stapled) пептидов, предназначенных для имитации альфа-спиральных конформации (Angew. Int. Ed. Engl., 1998, 37, 3281; JACS, 2000, 122, 5891); применение полифункционализированных сахаридов; применение триптатиониновой связи (Chemistry Eu. J., 2008, 24, 3404-3409); применение 'click' - реакции азидов и алкинов (реакция циклоприсоединения алкинов и азидов, в которой в качестве катализатора используют одновалентную медь), которые могут быть включены либо в виде аминокислотных остатков боковой цепи, либо расположены в пределах остова пептидной последовательности (Drug Disc. Today, 2003, 8 (24), 1128-1137). В литературе также известно, что ионы металлов могут стабилизировать ограниченные конформации линейных пептидов через секвестрирование определенных остатков, например, гистидина, который образует координационную связь с катионами металлов (Angew. Int. Ed. Engl., 2003, 42, 421). Аналогично, функционализирование линейной пептидной последовательности с помощью неприродной кислоты и аминной функциональной группы, или полиамина и поликислотной функциональной группы можно использовать для обеспечения доступа к циклизированным структурам после активации и образования амидной связи.
Согласно одному воплощению антигенный пептид IgE является конформационно ограниченным благодаря образованию внутримолекулярных ковалентных связей между двумя несоседними аминокислотами антигенного пептида IgE, например, N- и С-концевыми аминокислотами. Согласно другому воплощению антигенный пептид IgE по изобретению является конформационно ограниченным благодаря образованию ковалентных связей с каркасной молекулой. Согласно еще одному воплощению антигенный пептид IgE является просто ограниченным, т.е. связанным либо по одному концу (С- или N-концу), либо через другую аминокислоту, не расположенную на каком-либо конце, с каркасной молекулой. Согласно другому воплощению антигенный пептид IgE дважды ограничен, т.е. связан как по С-, так и по N-концу с каркасной молекулой. Согласно другому воплощению антигенный пептид ограничен посредством циклизации через структурообразующий (templating) эффект гетерохиральной дипролиновой единицы (D-Pro-L-Pro) (Spath et al, 198, Helvetica Chimica Acta 81, p1726-1738). Иллюстрирующие, но неограничивающие примеры конформационно ограниченных пептидов по изобретению графически изображены на Фиг.2.
Каркас (также называемый 'платформой') может представлять собой любую молекулу, способную уменьшать, посредством образования ковалентных связей, число конформаций, которые может принять антигенный пептид IgE. Примеры конформационно ограничивающих каркасов включают белки и пептиды, например, липокалин-родственные молекулы, такие как бета-баррель, содержащие тиоредоксин и тиоредоксин-подобные белки, нуклеазы (например, РНК-азу А), протеазы (например, трипсин), ингибиторы протеаз (например, эглин С), антитела или их структурно жесткие фрагменты, флуоресцентные белки, такие как GFP или YFP, конотоксины, петлевые области домена фибронектина III типа, CTL-A4 и вирусоподобные частицы (VLPs).
Другие подходящие молекулы-платформы включают углеводы, такие как сефароза. Платформа может быть линейной или кольцевой молекулой, например, закрытой с образованием петли. Платформа является, как правило, гетерологичной в отношении антигенного пептида IgE. Считается, что такие конформационно ограниченные пептиды, связанные с платформой, являются более устойчивыми к протеолитической деградации, чем линейный пептид.
Согласно предпочтительному воплощению каркас представляет собой иммуногенный носитель, как определено в настоящей заявке, предпочтительно гетерологичный белок-носитель или VLP. В другом воплощении антигенный пептид IgE является просто ограниченным на иммуногенном носителе. В еще одном воплощении антигенный пептид IgE дважды ограничен на иммуногенном носителе. Таким образом, антигенный пептид IgE образует конформационно ограниченную петлевую структуру, которая, как оказалось, является особенно подходящей структурой в качестве внутриклеточной молекулы распознавания.
Антигенные пептиды IgE по изобретению могут быть модифицированы для облегчения конъюгирования с платформой, например, путем добавления концевого цистеина на один или оба конца и/или путем добавления линкерной последовательности, такой как двойная глициновая голова или хвост, линкер, оканчивающийся лизиновым остатком, или любой другой линкер, известный специалистам в данной области, для осуществления такой функции. Также может быть использована биоортогональная химия (такая как «click» - реакция, описанная выше) для сочетания полной пептидной последовательности с носителем, во избежание таким образом любых региохимических проблем и проблем химиоселективности. Могут быть использованы также жесткие линкеры, такие как описано в Jones et al. Angew. Chem. Int. Ed. 2002, 41: 4241-4244, которые, как известно, вызывают улучшенный иммунологический ответ.
В другом воплощении антигенный пептид IgE присоединяют к поливалентной матрице, которая сама по себе связана с носителем, увеличивая таким образом плотность антигена (см. ниже). Поливалентная матрица может представлять собой соответствующим образом функционализированный полимер или олигомер, такой как (но не ограничиваясь этим) олигоглутамат или олигохитозан.
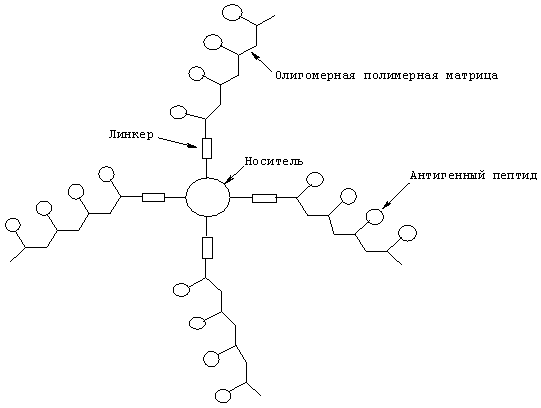
Указанный линкер может быть расположен на N-конце пептида или на С-конце пептида или на обоих концах указанного пептида. Указанный линкер может иметь длину от 0 до 10 аминокислот, предпочтительно длину от 0 до 6 аминокислот, еще более предпочтительно длину 2-3 аминокислоты. Альтернативно, добавление или замещение D-стереоизомерной формы одной или более аминокислот можно выполнить для создания полезного производного, например, для увеличения стабильности пептида.
Типичные комбинации сопряжении, которые все находятся в пределах объема настоящего изобретения и составляют различные воплощения, с использованием различных линкеров представлены ниже:
Пептид - GGGGGC - каркас
Пептид - GGGGC - каркас
Пептид - GGGС - каркас
Пептид - GGC - каркас
Пептид - GC - каркас
Пептид - С - каркас
Пептид - GGGGGK
Пептид - GGGGK
Пептид - GGGK
Пептид - GGK
Пептид - GK
Пептид - К
Пептид - GGGGSC
Пептид - GGGSC
Пептид - GGSC
Пептид - GSC
Пептид - SC
CSGGGG - Пептид
CSGGG - Пептид
CSGG - Пептид
CSG - Пептид
CS - Пептид
В одном из воплощений пептид состоит из любого антигенного пептида IgE, описанного в данной заявке, и каркас состоит из любого иммуногенного носителя, описанного в данной заявке, предпочтительно VLP.
Типичные комбинации сопряжении с использованием различных линкеров и дважды ограниченных пептидов представлены ниже, где носитель может представлять собой идентичный мономер носителя или отличающийся мономер носителя. (В примере, приведенном ниже, GC-линкер может быть замещен любым из GK-линкера или GSC-линкера, приведенных выше в качестве примера, или любым другим, известным специалистам в данной области):
Носитель - CGGGGG - Пептид - GGGGGC - носитель
Носитель - CGGGG - Пептид - GGGGC - носитель
Носитель - CGGGG - Пептид - GGGGC - носитель
Носитель - CGGG - Пептид - GGGC - носитель
Носитель - CG - Пептид - GC - носитель
Носитель - С - Пептид - С - носитель
В воплощении пептид состоит из любого антигенного пептида IgE, описанного в данной заявке, и носитель состоит из любого иммуногенного носителя, описанного в данной заявке, предпочтительно VLP.
В одном из воплощений концевой остаток цистеина, если еще не присутствует в аминокислотной последовательности антигенного пептида IgE, добавляют к одному или обоим концам любого антигенного пептида IgE из SEQ ID NO: 1-430 для создания конформационно ограниченного пептида. В предпочтительном воплощении конформационно ограниченный антигенный пептид IgE по изобретению выбран из группы, состоящей из SEQ ID NO: 1-430, и его функционально активных вариантов, предпочтительно из группы, состоящей из SEQ ID NO: 1-430, более предпочтительно из группы, состоящей из SEQ ID NO: 1-153 и 220-430, еще более предпочтительно из группы, состоящей из SEQ ID NO: 220-430. В воплощении указанный концевой остаток цистеина добавляют к С-концу указанного антигенного пептида IgE. В другом воплощении указанный концевой остаток цистеина добавляют к N-концу указанного антигенного пептида IgE. В другом воплощении концевой остаток цистеина добавляют как к С-концу, так и к N-концу указанного антигенного пептида IgE.
В другом воплощении GC-линкер, содержащий различное количество остатков глицина и один концевой остаток цистеина, добавляют к одному или обоим концам любого антигенного пептида IgE из SEQ ID NO: 1-430 для получения конформационно ограниченного пептида. Предпочтительно, GC-линкер содержит от 1 до 10 остатков глицина, более предпочтительно 1, 2, 3, 4 или 5 остатков глицина. В другом предпочтительном воплощении конформационно ограниченный антигенный пептид IgE по изобретению выбран из группы, состоящей из SEQ ID NO: 1-430, и его функционально активных вариантов, предпочтительно из группы, состоящей из SEQ ID NO: 1-430, более предпочтительно из группы, состоящей из SEQ ID NO: 1-153 и 220-430, еще более предпочтительно из группы, состоящей из SEQ ID NO: 220-430. В воплощении указанный GC-линкер добавляют к С-концу указанного антигенного пептида IgE. В другом воплощении указанный GC-линкер добавляют к N-концу указанного антигенного пептида IgE. В другом воплощении указанный GC-линкер добавляют как к С-концуг так и к N-концу указанного антигенного пептида IgE.
В еще одном воплощении GC-линкер, содержащий различное количество остатков глицина и один концевой остаток цистеина, добавляют к одному концу антигенного пептида IgE с SEQ ID NO: 1-430, и концевой остаток глицина, если он еще не присутствует на другом конце антигенного пептида IgE, добавляют к другому концу антигенного пептида. Предпочтительно, GC-линкер содержит от 1 до 10 остатков глицина, более предпочтительно 1, 2, 3, 4, или 5 остатков глицина. В еще одном предпочтительном воплощении конформационно ограниченный антигенный пептид IgE по изобретению выбран из группы, состоящей из SEQ ID NO: 1-430, и его функционально активных вариантов, предпочтительно из группы, состоящей из SEQ ID NO: 1-430, более предпочтительно из группы, состоящей из SEQ ID NO: 1-153 и 220-430, еще более предпочтительно из группы, состоящей из SEQ ID NO: 220-430. В воплощении указанный GC-линкер добавляют к С-концу указанного антигенного пептида IgE, и указанный концевой остаток цистеина добавляют к М-концу указанного антигенного пептида IgE. В другом воплощении указанный GC-линкер добавляют к N-концу указанного антигенного пептида IgE, и указанный концевой остаток цистеина добавляют к С-концу указанного антигенного пептида IgE.
В еще одном предпочтительном воплощении GC-линкер модифицируют, предпочтительно путем добавления остатка лизина с целью обеспечения сопряжения указанного линкера, связанного с указанным антигенным пептидом IgE, с каркасной молекулой. В еще более предпочтительном воплощении конформационно ограниченный антигенный пептид IgE по изобретению выбран из группы, состоящей из SEQ ID NO: 1-430, и его функционально активных вариантов, предпочтительно из группы, состоящей из SEQ ID NO: 1-430, более предпочтительно из группы, состоящей из SEQ ID NO: 1-153 и 220-430, еще более предпочтительно из группы, состоящей из SEQ ID NO: 220-430. В воплощении указанный модифицированный GC-линкер добавляют к С-концу указанного антигенного пептида IgE. В другом воплощении указанный модифицированный GC-линкер добавляют к N-концу указанного антигенного пептида IgE.
В воплощении конформационно ограниченный антигенный пептид IgE по изобретению представляет собой любой пептид, представленный в Таблице 9.
Иммуногенный носитель по изобретению
В воплощении настоящего изобретения антигенный пептид IgE или полипептид по изобретению связан с иммуногенной молекулой-носителем с образованием иммуногенов для протоколов вакцинации, предпочтительно для случаев, когда молекула-носитель связана с нативной молекулой IgE.
Термин "иммуногенный носитель" в данной заявке включает такие материалы, которые обладают свойством независимо вызывать иммуногенный ответ у животного-хозяина и которые могут быть ковалентно связаны с пептидом, полипептидом или белком либо непосредственно через образование пептидных или сложноэфирных связей между свободными карбоксильными, амино- или гидроксильными группами в указанном пептиде, полипептиде или белке и соответствующими группами на иммуногенном материале-носителе, либо, альтернативно, путем образования связи через стандартную бифункциональную связывающую группу, либо в виде слитого белка.
Типы носителей, используемых в иммуногенах по настоящему изобретению, будут понятны специалисту в данной области. Примерами таких иммуногенных носителей являются: сывороточные альбумины, такие как бычий сывороточный альбумин (БСА); глобулины; тиреоглобулины; гемоглобины; гемоцианины (в частности, гемоцианин лимфы улитки [KLH] от англ. Keyhole Limpet Hemocyanin); белки, экстрагированные из аскарид, инактивированные бактериальные токсины или анатоксины, такие как столбнячный или дифтерийный токсины (ТТ и DT) или CRM197, очищенное белковое производное туберкулина (PPD); или белок D из Haemophilus influenzae (WO 91/18926) или его рекомбинантные фрагменты (например, домен 1 фрагмента С из ТТ, или транслокационный домен DT или белок D 1/3, содержащий 100-110 N-концевых аминокислот белка D Haemophilus influenzae (GB 9717953.5); полилизин; полиглутаминовая кислота; сополимеры лизина и глутаминовой кислоты; сополимеры, содержащие лизин или орнитин; липосомальные носители и т.д.
В воплощении иммуногенным носителем является KLH. В другом воплощении иммуногенным носителем является вирусоподобная частица (VLP), предпочтительно рекомбинантная вирусоподобная частица.
Используемый в данной заявке термин "вирусоподобная частица" относится к структуре, напоминающей вирусную частицу, но которая, как было продемонстрировано, не является патогенной. В общем, у виоусоподобных частиц отсутствует по меньшей мере часть вирусного генома. Кроме того, вирусоподобные частицы часто могут продуцироваться в больших количествах в результате гетерологичной экспрессии и могут быть легко очищены. Вирусоподобная частица согласно изобретению может содержать нуклеиновую кислоту, отличную от ее генома. Типичное и предпочтительное воплощение вирусоподобной частицы согласно настоящему изобретению представляет собой вирусный капсид, такой как вирусный капсид соответствующего вируса, бактериофага или РНК-фага.
Используемый в данной заявке термин "вирусоподобная частица бактериофага" относится к вирусоподобной частице, напоминающей структуру бактериофага, не являющейся репликативной и инфекционной и лишенной по меньшей мере гена или генов, кодирующих репликативный аппарат бактериофага, и обычно также лишенной гена или генов, кодирующих белок или белки, ответственные за прикрепление вируса и внедрение в хозяина. Однако это определение должно также охватывать вирусоподобные частицы бактериофагов, в которых вышеуказанный ген или гены все же присутствуют, но являются неактивными и поэтому также приводят к нерепликативным и неинфекционным вирусоподобным частицам бактериофага.
Капсидная структура, образованная в результате самосборки 180 субъединиц оболочечного белка РНК-фага и возможно содержащая хозяйскую РНК, называется в данной заявке как "VLP оболочечного белка РНК-фага". Конкретным примером является VLP оболочечного белка Qbeta. В этом конкретном случае VLP оболочечного белка Qbeta может либо собираться исключительно из субъединиц Qbeta CP (образованных в результате экспрессии гена Qbeta CP, содержащего, например, ТАА стоп-кодон, предотвращающий любую экспрессию более длинного белка А1 посредством супрессии, см. Kozlovska, Т.М., et al., Intervirology 39: 9-15 (1996)), либо дополнительно содержать субъединицы белка А1 при сборке капсида. Как правило, процент белка Qbeta А1 относительно Qbeta CP в сборке капсида будет ограничиваться с целью обеспечения образования капсида.
Примеры VLPs, подходящих в качестве иммуногенных носителей в контексте настоящего изобретения, включают, но не ограничиваются этим, капсидные белки вируса гепатита В (Ulrich, et al., Virus Res. 50: 141-182 (1998)), вируса кори (Warnes, et аl., Gene 160: 173-178 (1995)), вируса Синдбис, ротавируса (патенты США №5071651 и 5374426), вируса ящура (Twomey, et al., Vaccine 13: 1603-1610, (1995)), норовируса (Jiang, X., et al., Science 250: 1580-1583 (1990); Matsui, S.М., et al., J Clin. Invest. 87: 1456-1461 (1991)), ретровирусного белка GAG (РСТ патентная заявка № WO 96/30523), белка pl ретротранспозона Ty, поверхностного белка гепатита вируса В (WO 92/11291), вируса папилломы человека (WO 98/15631), вируса полиомы человека (Sasnauskas К., et al., Biol. Chem. 380 (3): 381-386 (1999); Sasnauskas К., et al., Generation of recombinant virus-like particles of different polyomaviruses in yeast. 3rd Interational Workshop "Virus-like particles as vaccines". Berlin, September 26-29 (2001)), РНК-фагов, Ty, fr-фага, GA-фага, АР 205-фага и, в частности, Qbeta-фага, вируса хлоротичной пятнистости коровьего гороха, вирусов папилломы человека (HPV), вирусов папилломы крупного рогатого скота, парвовируса свиней, парвовируса, калицивирусов (например, норовируса), вируса геморрагического заболевания у кролика, VLPs корового антигена гепаднавируса животных.
Как будет очевидно специалистам в данной области, VLP, используемый в качестве иммуногенного носителя по изобретению, не ограничивается какой-либо конкретной формой. Частица может быть синтезирована химически или посредством биологического процесса, который может быть природным или неприродным. К примеру, этот тип воплощения включает вирусоподобную частицу или ее рекомбинантную форму. В более конкретном воплощении VLP может содержать или же состоять из рекомбинантных полипептидов любого вируса, для которого известно, что он образует VLP. Вирусоподобная частица может также содержать или же состоять из одного или более фрагментов таких полипептидов, а также вариантов таких полипептидов. Варианты полипептидов могут иметь, например, по меньшей мере 80%-, 85%-, 90%-, 95%-, 97%- или 99%-ную идентичность на аминокислотном уровне с их прототипами дикого типа. Вариантные VLPs, подходящие для применения в настоящем изобретении, могут быть получены из любого организма, при условии, что они способны образовывать "вирусоподобную частицу" и могут быть использованы в качестве "иммуногенного носителя", как определено в данной заявке.
Предпочтительные VLPs согласно изобретению включают капсидный белок или поверхноетный антиген HBV (HBcAg и HBsAg, соответственно), или их рекомбинантные белки или фрагменты, и оболрчечные белки РНК-фагов или их рекомбинантные белки или фрагменты, более предпочтительно, оболочечный белок Qbeta или его рекомбинантные белки или фрагменты.
В одном из воплощений иммуногенный носитель, используемый в комбинации с антигенным пептидом или полипептидом IgE по изобретению, представляет собой белок HBcAg. Примеры белков HBcAg, которые могут быть использованы в контексте настоящего изобретения, могут быть легко определены специалистом в данной области. Примеры включают, но не ограничиваются этим, коровые белки HBV, описанные у Yuan с соавт. (J. Virol. 73: 10122-10128 (1999)) и в WO 00/198333, WO 00/177158, WO 00/214478, WO WO 00/32227, WO 01/85208, WO 02/056905, WO 03/024480 и WO 03/024481. HBcAgs, подходящие для применения в настоящем изобретении, могут происходить из любого организма, при условии, что они способны образовывать "вирусоподобную частицу" и могут быть использованы в качестве "иммуногенного носителя", как определено в данной заявке.
Варианты HBcAg, представляющие особый интерес, которые могут быть использованы в контексте настоящего изобретения, представляют собой такие варианты, в которых один или более естественно присутствующих остатков цистеина либо удалены, либо замещены. В данной области хорошо известно, что свободные остатки цистеина могут быть вовлечены в целый ряд химических побочных реакций, включающих дисульфидные обмены, реакцию с химическими веществами или метаболитами, которые, например, вводят или образуются в комбинированной терапии с другими веществами, или прямое окисление и реакцию с нуклеотидами при воздействии УФ-света. Таким образом, могут образоваться токсичные аддукты, особенно, если учесть тот факт, что HBcAgs имеют сильную тенденцию связываться с нуклеиновыми кислотами. Токсичные аддукты, таким образом, будут распределяться между множеством видов, каждый из которых может присутствовать в низкой концентрации, но достигать токсичных уровней, когда находятся вместе. В свете вышеизложенного, одним из преимуществ применения HBcAgs в вакцинных композициях, которые были модифицированы для удаления естественно присутствующих остатков цистеина, является то, что количество сайтов, с которыми токсичные продукты могут связываться в случае присоединения антигенов или антигенных детерминанту будет снижено или вообще элиминировано.
Кроме того, процессированная форма HBcAg, лишенная N-концевой лидерной последовательности белка-предшественника коревого антигена гепатита В также может быть использована в контексте изобретения, особенно когда HBcAg продуцируется в условиях, когда процессинг не происходит (например, при экспрессии в бактериальных системах).
Другие варианты HBcAg согласно изобретению включают: 1) полипептидную последовательность, имеющую по меньшей мере 80%, 85%, 90%, 95%, 97% или 99% идентичности с одной из аминокислотных последовательностей НВсАд дикого типа, или ее субфрагмент, с использованием широко известных компьютерных программ, 2) мутанты с С-концевым укорочением, включающие мутанты, где 1, 5, 10, 15, 20, 25, 30, 34 или 35 аминокислот были удалены с С-конца, 2) мутанты с N-концевым укорочением, включающие мутанты, где 1, 2, 5, 7, 9, 10, 12, 14, 15, или 17 аминокислот были удалены с N-конца, 3) мутанты, укороченные как с N-конца, так и с С-конца, включают HBcAgs, где 1, 2,5, 7, 9, 10, 12, 14, 15 или 17 аминокислот были удалены с N-конца и 1, 5, 10, 15, 20, 25, 30, 34 или 35 аминокислот были удалены с С-конца.
Тем не менее, другие вариантные белки HBcAg в пределах объема изобретения представляют собой варианты, модифицированные с целью увеличения иммуногенной презентации чужеродного эпитопа, в которых один или более из четырех аргининовых повторов были делегированы, но в которых сохраняется С-концевой цистеин (см., например, WO 01/98333), и химерные HBcAg, укороченные с С-конца, такие как описано в WO 02/14478, WO 03/102165 и WO 04/053091.
В другом воплощении иммуногенный носитель, используемый в комбинации с антигенным пептидом или полипептидом IgE по изобретению, представляет собой белок HBsAg. Белки HBsAg, которые могут быть использованы в контексте настоящего изобретения, могут быть легко определены специалистом в данной области. Примеры включают, но ограничиваются этим, поверхностные белки HBV, описанные в US5792463, WO 02/10416 и WO 08/020331. HBsAgs, подходящие для применения в настоящем изобретении, могут быть получены из любого организма, при условииу что они способны образовывать "вирусоподобную частину", и могут быть использованы в качестве "иммуногенного носителя", как определено в данной заявке. Например, подтип adw (см. раздел примеров в настоящем документе).
В еще одном воплощении иммуногенный носитель, используемый в комбинации с антигенным пептидом или полипептидом IgE по изобретению, представляет собой оболочечный белок Qbeta.
Оболочечный белок Qbeta, как было обнаружено, подвергается самосборке в капсиды при экспрессии в Е.соli (Kozlovska TM. et al., GENE 137: 133-137 (1993). Полученные капсиды или вирусоподобные частицы продемонстрировали икосаэдрическую фагоподобную капсидную структуру с диаметром 25 нм и Т=3 квази-симметрией. Кроме того, была получена кристаллическая структура фага Qss. Капсид содержит 180 копий оболочечного белка, которые соединены в ковалентные пентамеры и гексамеры с помощью дисульфидных мостиков (Golmohammadi, R. et al., Structure 4: 5435554 (1996)), приводящих к замечательной стабильности капсида из оболочечного белка Qbeta. Капсидный белок Qbeta также демонстрирует необычную устойчивость к органическим растворителям и денатурирующим агентам. Высокая стабильность капсида из оболочечного белка Qbeta является полезной особенностью, в частности, для его применения в иммунизации и вакцинации млекопитающих и людей, согласно настоящему изобретению.
Примеры оболочечных белков Qbeta, которые могут быть использованы в контексте настоящего изобретения, могут быть легко определены специалистом в данной области. Примеры были всесторонне описаны в WO 02/056905, WO 03/024480, WO 03/024481 (включенных посредством ссылки во всей своей полноте) и включают, но не ограничиваются этим, аминокислотные последовательности, раскрытые в базе данных PIR, инвентарный № VCBPQbeta, относящийся к QbetaCP; инвентарный № ААА16663, относящийся к белку Qbeta Al, и его варианты, включающие варианты белков, в которых N-концевой метионин отщеплен; С-концевые укороченные формы Qbeta А1, лишенные вплоть до 100, 150 или 180 аминокислот; варианты белков, которые были модифицированы путем удаления остатка лизина посредством делеции или замены или путем добавления остатка лизина посредством замены или вставки (см., например, Qbeta-240, Qbeta-243, Qbeta-250, Qbeta-251 и Qbeta-2597 раскрытые в WO 03/024481, включенной посредством ссылки во всей своей полноте), и варианты, демонстрирующие по меньшей мере 80%, 85%, 90%, 95%, 97% или 99% идентичности с любым из коровых белков Qbeta, описанных выше. Варианты оболочечных белков Qbeta, подходящие для применения в настоящем изобретении, могут происходить из любого организма, при условии, что они способны образовывать "вирусоподобную частицу" и могут быть использованы в качестве "иммуногенных носителей", как определено в данной заявке.
Антигенные пептиды IgE по изобретению могут быть подвергнуты сочетанию с иммуногенными носителями посредством химического конъюгирования или посредством экспрессии генно-инженерных партнеров слияния. Сочетание не обязательно должно быть прямым, но может происходить через линкерные последовательности. В более общем случае, когда антигенные пептиды либо слиты, конъюгированы, либо иначе присоединены к иммуногенному носителю, спейсерные или линкерные последовательности обычно добавляют к одному или обоим концам антигенных пептидов. Такие линкерные последовательности обычно содержат последовательности, распознаваемые протеасомой, протеазами эндосом или другого везикулярного компармента клетки.
В одном из воплощений пептиды по настоящему изобретению экспрессируются в виде слитых белков с иммуногенным носителем. Слияние пептида может осуществляться путем вставки в иммуногенный носитель первичной последовательности или путем слияния с N- или С-концом иммуногенного носителя. В дальнейшем, когда речь идет о слитых белках пептида с иммуногенным носителем, охватывают также слияние с любыми концами последовательности субъединицы или внутренней вставки пептида в пределах последовательности носителя. Слияние, как об этом говорится в дальнейшем, может быть осуществлено посредством вставки антигенного пептида в последовательность носителя, посредством замещения части последовательности носителя антигенным пептидом, или посредством комбинации делеции, замены или вставок.
Когда иммуногенный носитель представляет собой VLP, тогда химерная субъединица антигенный пептид-VLP в основном будет способна к самосборке в VLP. VLP-представляющие эпитопы, слитые с их субъединицами, также называются в данной заявке химерными VLPs. Например, в ЕР 0421635 В, описано применение химерных частиц коревого антигена гепаднавируса для представления чужеродных пептидных последовательностей в вирусоподобной частице.
Фланкирующие аминокислотные остатки могут быть добавлены к любому концу последовательности антигенного пептида, подлежащего слиянию с любым концом последовательности субъединицы VLP, или для внутренней вставки такой пептидной последовательности в последовательность субъединицы VLP. Остатки глицина и серина являются особенно подходящими аминокислотами для использования во фланкирующих последовательностях, добавляемых к пептиду, подлежащему слиянию. Остатки глицина придают дополнительную гибкость, которая может уменьшить потенциально дестабилизирующий эффект слияния чужеродной последовательности с последовательностью субъединицы VLP.
В конкретном воплощении изобретения иммуногенный носитель представляет собой VLP HBcAg. Слитые белки антигенного пептида с N-концом HBcAg (Neyrinck, S. et al., Nature Med. 5: 11571163 (1999)) или вставки в так называемую основную иммунодоминантную область (MIR от англ. major immunodominant region) были описаны (Pumpens, P. and Grens, E., Intervirology 44: 98114 (2001), WO 01/98333) и представляют собой конкретные воплощения изобретения. Были описаны природные варианты HBcAg с делениями в MIR (Pumpens, P. and Grens, E., Intervirology 44: 98-114 (2001)), а слияния с N- или С-концом, а также вставки в положение MIR, соответствующее сайту делеции, по сравнению с wt HBcAg являются дополнительными воплощениями изобретения. Слияния с С-концом также были описаны (Pumpens, P. and Grens, E., Intervirology 44: 98-114 (2001)). Специалист в данной области легко найдет рекомендации, как сконструировать слитые белки с использованием классических методов молекулярной биологии. Векторы и плазмиды, кодирующие HBcAg и слитые белки HBcAg и используемые для экспрессии HBcAg и слитых белков HBcAg, были описаны (Pumpens, P. and #38; Grens, E. Intervirology 44: 98-114 (2001), Neyrinck, S. et al., Nature Med. 5: 1157-1163 (1999) и могут быть использованы в осуществлении изобретения. Важным фактором для оптимизации эффективности самосборки и экспонирования эпитопа, подлежащего встраиванию в MIR HBcAg является выбор сайта вставки, а также количество аминокислот, подлежащих делеции из последовательности HBcAg в пределах MIR (Pumpens, P. and Grens, E., Intervirology 44: 98-114 (2001); EP 0421635; патент США №6231864) после вставки, или, другими словами, какие аминокислоты, образующие HBcAg, должны быть замещены новым эпитопом. Например, была описана замена аминокислот HBcAg 76-80, 79-81, 79-80, 75-85 или 80-81 чужеродными эпитетами (Pumpens, P. and Grens, E., Intervirology 44: 98-114 (2001); EP 0421635; US 6231864, WO 00/26385). HBcAg содержит длинный аргининовый хвост (Pumpens, P. and Grens, E., Intervirology 44: 98-114 (2001), который является несущественным для сборки капсида и способным связывать нуклеиновые кислоты (Pumpens, P. and Grens, E., Intervirology 44: 98-114 (2001). HBcAg, либо содержащий, либо лишенный этого аргининового хвоста, является воплощением изобретения.
В другом конкретном воплощении изобретения иммуногенный носитель преставляет собой VLP РНК-фага, предпочтительно Qbeta. Основные оболочечные белки РНК-фагов спонтанно собираются в VLPs после экспрессии в бактериях и, в частности, в E.соli. Были описаны слитые белковые конструкции, где антигенные пептиды были слиты с С-концом укороченной формы белка А1 Qbeta или встроены в белок А1 (Kozlovska, Т.М., et al., Intervirology, 39: 9-15 (1996)). Белок А1 образуется в результате супрессии в области стоп-кодона UGA и имеет длину 329 а.к. или 328 а.к., если принимать во внимание отщепление N-концевого метионина. Отщепление N-концевого метионина перед аланином (второй аминокислотой, кодируемой геном Qbeta СР) обычно происходит в E.соli, и это характерно для N-концов оболочечных белков Qbeta. Участок гена А1, с 3' от амбер-кодона UGA кодирует удлинение СР, которое имеет длину 195 аминокислот. Вставка антигенного пептида между положением 72 и 73 удлинения СР приводит к дополнительным воплощениям изобретения (Kozlovska, Т.М., et al., Intervirology 39: 9-15 (1996). Слияние антигенного пептида на С-конце укороченного по С-концу белка А1 Qbeta приводит к дополнительным предпочтительным воплощениям изобретения. Например, Kozlovska с соавт. (Intervirology, 39: 9-15 (1996)) описывает слияния белка А1 Qbeta, где эпитоп слит по С-концу удлинения Qbeta СР, укороченного в положении 19.
Как описано у Kozlovska с соавт. (Intervirology, 39: 9-15 (1996), сборка частиц, экепонирующих слитые эпитопы, как правило, требует присутствия как слияния Al белок-антиген, так и wt СР для образования мозаичной частицы. Однако воплощения, включающие вирусоподобные частицы и при этом, в частности, VLPs оболочечного белка РНК-фага Qbeta, которые состоят исключительно из субъединиц VLP, имеющих антигенный пептид, слитый с ними, также находятся в пределах объема настоящего изобретения.
Продукцию мозаичных частиц можно осуществлять различными способами. Kozlovska с соавт., Intervirology, 39: 9-15 (1996), описали три способа, которые все могут быть использованы при осуществлении изобретения. В первом подходе эффективное экспонирование слитого эпитопа на VLPs опосредуется экспрессией плазмиды, кодирующей слияние белок А1I Qbeta, имеющее стоп-кодон UGA между СР и удлинением СР в штамме Е.соli, содержащем плазмиду, кодирующую клонированную UGA супрессорную тРНК, которая приводит к трансляции кодона UGA в Тгр (плазмида pISM3001 (Smiley В.К., et al., Gene 134: 33-40 (1993))). В другом подходе стоп-кодон гена СР модифицирован в UAA, и вторая плазмида, экспресирующая слияние белок-антиген А1, подвергается котрансформации. Вторая плазмида кодирует другую устойчивость к антибиотикам, и точка начала репликации совместима с первой плазмидой. В третьем подходе СР и слияние белок-антиген А1 кодируются бицистронным образом, функционально связанным с промотором, таким как Trp промотор, как описано на Фиг.1 в Kozlovska et al., Intervirology, 39: 9-15 (1996).
Кроме того, VLPs, подходящие для слияния антигенов или антигенных детерминант, описаны в WO 03/024481 и включают бактериофаг fr, РНК-фаг MS-2, капсидный белок папиломавируса, ретротранспозон Ту, дрожжевые, а также ретровирусоподобные частицы, Gag HIV2, мозаичный вирус коровьего гороха, парвовирус VP2 VLP, HBsAg (US 4722840, ЕР 0020416 В1). Примеры химерных VLPs, подходящих для осуществления изобретения, представляют собой также VLPs, описанные в Intervirology 39: 1 (1996). Другие примеры VLPs, предусмотренные для применения в изобретении, представляют собой: HPV-1, HPV-6, HPV-11, HPV-16, HPV-18, HPV-33, HPV-45, CRPV, COPY, GAG HIV, вирус табачной мозаики, вирусоподобные частицы SV-40, полиомавирус, аденовирус, вирус простого герпеса, ротавирус и норовирус.
Для любого рекомбинантно экспрессируемого пептида или белка, который образует часть настоящего изобретения включая антигенный пептид IgE по изобретению, связанный или не связанный с иммуногенным носителем, нуклеиновая кислота, которая кодирует указанный пептид или белок, также образует аспект настоящего изобретения, как и экспрессирующий вектор, содержащий нуклеиновую кислоту, и клетка-хозяин, содержащая экспрессирующий вектор (автономные или встроенные в хромосомы). Метод рекомбинантной продукции пептида или белка посредством его экспрессии в вышеуказанной клетке-хозяине и выделение из нее иммуногена представляет собой еще один аспект изобретения. Полноразмерная нативная молекула IgE или полноразмерная нативная последовательность ДНК, кодирующая его, не охвачены настоящим изобретением.
В другом воплощении пептид по изобретению подвергают химическому сочетанию с иммуногенным носителем с использованием методов, хорошо известных в данной области. Может иметь место конъюгация для обеспечения свободного движения пептидов через одноточечную конъюгацию (например, либо N-концевую, либо С-концевую точку) или в виде фиксированной (locked down) структуры, где оба конца пептидов конъюгированы либо с иммуногенным белком-носителем, либо с каркасной структурой, такой как VLP. Когда конъюгирование происходит посредством химического сопряжения, известного специалистам в данной области, например, через остатки цистеина, остатки лизина или другие карбокси-группировки, широко известные в качестве точек сопряжения, таких как глутаминовая кислота или аспарагиновая кислота. Таким образом, например, для прямого ковалентного сочетания можно использовать карбодиимид, глутаральдегид или (N-[y-малеимидобутирилокси]сукцинимидный сложный эфир, используя обычное, имеющиеся в продаже гетеробифункциональные линкеры, такие как CDAP и SPDP (с помощью инструкций производителей). Примеры сопряжения пептидов, в частности циклизированных пептидов, с белковым носителем через ацилгидразиновые пептидные производные описаны в WO 03/092714. После реакции сочетания иммуноген может быть легко выделен и очищен с помощью метода диализа, метода гель-фильтрации, метода фракционирования и т.д. Пептиды, оканчивающиеся цистеиновым остатком (предпочтительно с линкером вне циклизированной области), могут быть подходящим образом конъюгированы с белком-носителем посредством малеинимидной химии.
Когда иммуногенный носитель предетавляет собой VLP, тогда несколько антигенных пептидов, имеющих либо идентичную аминокислотную последовательность, либо другую аминокислотную последовательность, могут быть связаны с одной молекулой VLP, что приводит предпочтительно к повторяющейся и упорядочной структуре, презентирующей несколько антигенных детерминант ориентированным образом, как описано в WO 00/32227, WO 03/024481, WO 02/056905 и WO 04/007538.
В одном аспекте изобретения антигенный пептид связан с VLP посредством химического поперечного сшивания, обычно и предпочтительно с использованием гетеробифункционального кросс-линкера. В данной области известны несколько гетеробифункциональных кросс-линкеров. В некоторых воплощениях гетеробифункциональный кросс-линкер содержит функциональную группу, которая может реагировать с первыми сайтами присоединения, т.е. с аминогруппой боковой цепи остатков лизина VLP или субъединицы VLP, и дополнительную функциональную группу, которая может реагировать с предпочтительным вторым сайтом присоединения, т.е. остатком цистеина, слитым с антигенным пептидом и возможно также доступным для реакции восстановлением. Первая стадия процедуры, обычно называемая дериватизацией, представляет собой реакцию VLP с кросс-линкером. Продуктом этой реакции является активированная VLP, также называемая активированным носителем. На второй стадии непрореагировавший кросс-линкер удаляют с использованием обычных методов, таких как гель-фильтрация или диализ. На третьей стадии антигенный пептид подвергают взаимодействию с активированной VLP, и эту стадию обычно называют стадией сочетания. Непрореагировавший антигенный пептид возможно может быть удален на четвертой стадии, например, посредством диализа. В данной области известно несколько гетеробифункциональных кросс-линкеров. Они включают предпочтительные кросс-линкеры SMPH (сукцинимидил-6-[β-малеимидопропионамидо]гексаноат), Сульфо-MBS, Сульфо-EMCS, Сульфо-GMBS, Сульфо-SIAB, Сульфо-SMPB, Сульфо-SMCC, SVSB, SIA и другие кросс-линкеры, доступные, например, от Pierce Chemical Company (Rockford, IL, США) и имеющие одну функциональную группу, активную в отношении аминогрупп, и одну функциональную группу, активную в отношении остатков цистеина. Все упомянутые выше кросс-линкеры приводят к образованию тиоэфирной связи.
Другой класс-кросс-линкеров, подходящих для осуществления изобретения, характеризуется введением дисульфидной связи между антигенным пептидом и VLP после сочетания. Предпочтительные кросс-линкеры, относящиеся к этому классу, включают, например, SPDP и Сульфо-LC-SPDP (Pierce). На степень дериватизации VLP с кросс-линкером можно влиять путем варьирования экспериментальных условий, таких как концентрация каждого из партнеров реакции, избыток одного реагента относительно другого, рН, температура и ионная сила. Степень сочетания, т.е. количество антигенного пептида на субъединицы VLP, можно регулировать путем варьирования экспериментальных условий, описанных выше, для того, чтобы соответствовать требованиям вакцины.
Другой способ связывания антигенных пептидов с VLP заключается в соединении остатка лизина на поверхности VLP с остатком цистеина на антигенном пептиде. В некоторых воплощениях может потребоваться слияние аминокислотного линкера, содержащего остаток цистеина, в качестве второго сайта присоединения или в качестве его части с антигенным пептидом для сочетания с VLP. В общем, гибкие аминокислотные линкеры являются предпочтительными. Примеры аминокислотного линкера выбраны из группы, состоящей из: (a) CGG; (b) N-концевого гамма 1-линкера; (с) N-концевого гамма 3-линкера; (а) шарнирных областей Ig; (е) N-концевых глициновых линкеров; (f) (G) kC (G) n, где n=0-12 и k=0-5; (g) N-концевых глицин-сериновых линкеров; (h) (G) kC (G) m (S) i (GGGGS) n, где n=0-3, k=0-5, m=0-10, i=0-2; (i) GGC; (k) GGC-NH2; (I) С-концевого гамма 1-линкера; (m) С-концевого гамма 3-линкера; (n) С-концевых глициновых линкеров; (о) (G) nС (G) k, где n=0-12 и k=0-5; (р) С-концевых глицин-сериновых линкеров; (q) (G) m (S) t (GGGGS) n (G) oC (G) k, где n=0-3, k=0-5, m=0-10, 1=0-2 и о=0-8. Другие примеры аминокислотных линкеров представляют собой шарнирную область иммуноглобулинов, глицин-сериновые линкеры (GGGGS)n и глициновые линкеры (G)n, которые все дополнительно содержат остаток цистеина в качестве второго сайта присоединения и возможно дополнительные остатки глицина. Как правило, предпочтительными примерами указанных аминокислотных линкеров являются N-концевой гамма 1: CGDKTHTSPP; С-концевой гамма 1: DKTHTSPPCG; N-концевой гамма 3: CGGPKPSTPPGSSGGAP; С-концевой гамма 3: PKPSTPPGSSGGAPGGCG; N-концевой глициновый линкер: GCGGGG и С-концевой глициновый линкер: GGGGCG.
Другие аминокислотные линкеры, особенно подходящие для осуществления изобретения, когда гидрофобный антигенный пептид связан с VLP, представляют собой CGKKGG или CGDEGG для N-концевых линкеров или GGKKGC и GGEDGC для С-концевых линкеров. Для С-концевых линкеров концевой цистеин возможно амидирован на С-конце.
В некоторых воплощениях настоящего изобретения линкеры GGCG, GGC или GGC-NH2 ("NH2" означает амидирование) на С-конце пептида или CGG на его N-конце являются предпочтительными в качестве аминокислотных линкеров. В общем, остатки глицина будут встраивать между объемными аминокислотами и цистеином, который используют в качестве второго сайта присоединения, во избежание потенциального пространственного затруднения для более крупных аминокислот в реакции сочетания. В другом воплощении изобретения аминокислотный линкер GGC-NH2 подвергают слиянию с С-концом антигенного пептида.
Остаток цистеина, присутствующий на антигенном пептиде, должен в своем восстановленном состоянии реагировать с гетеробифункциональным кросс-линкером на активированной VLP, т.е. свободный цистеин или остаток цистеина со свободной сульфгидрильной группой должен быть доступным. В случае, когда остаток цистеина для функционирования в качестве связываниющего сайта находится в окисленной форме, например, если он образует дисульфидный мостик, требуется восстановление этого дисульфидного мостика с помощью, например, DTT, ТСЕР или р-меркаптоэтанола. Низкие концентрации восстановителя совместимы с реакцией сочетания, как описано в WO 02/05690, более высокие концентрации ингибируют реакцию сочетания, как известно специалисту в данной области, в этом случае восстановитель следует удалить или уменьшить его концентрацию перед реакцией сочетания, например, посредством диализа, гель-фильтрации или ВЭЖХ с обращенной фазой.
Связывание антигенного пептида с VLP с использованием гетеробифункционального кросс-линкера согласно способам, описанным выше, делает возможным сочетание антигенного пептида с VLP ориентированным образом. Другие способы связывания антигенного пептида с VLP включают способы, где антигенный пептид поперечно сшит с VLP с использованием карбодиимида EDC и NHS.
В других способах антигенный пептид присоединен к VLP с использованием гомо-бифункционального кросс-линкера, такого как глутаральдегид, DSGBM [РЕО] 4, BS3, (Pierce Chemical Company, Rockford, IL, США) или другие известные гомо-бифункциональные кросс-линкеры с функциональными группами, реактивными в отношении аминогрупп или карбоксильных группх VLP.
Другие способы связывания VLP с антигенным пептидом включают способы, где VLP является биотинилированным, и антигенный пептид экспрессируется в виде слитого со стрептавидином белка, или способы, где и антигенный пептид, и VLP являются биотинилированными, например, как описано в WO 00/23955. В этом случае антигенный пептид сначала может быть связан со стрептавидином или авидином путем корректировки отношения антигенного пептида к стрептавидину таким образом, чтобы свободные сайты связывания оставались все еще доступными для связывания VLP, который добавляют на следующей стадии. Альтернативно, все компоненты могут быть смешаны для "однореакторной" реакции. Другие лиганд-рецепторные пары, где растворимая форма рецептора и лиганда доступны и способны поперечно связываться с VLP или антигенным пептидом, могут быть использованы в качестве связывающих агентов для связывания антигенного пептида с VLP. Альтернативно, либо лиганд, либо рецептор можно подвергнуть слиянию с антигенным пептидом и, таким образом, опосредовать связывание с VLP, химически связанной или слитой либо с рецептором, либо с лигандом, соответственно. Слияние также можно осуществлять посредством вставки или замещения.
Одна или несколько антигенных молекул могут быть присоединены к одной субъединице капсида или VLP оболочечных белков РНК-фагов, предпочтительно через доступные остатки лизина VLP РНК-фагов, если это стерически допустимо. Специфическая особенность VLP оболочечного белка РНК-фагов и, в частности, QP оболочечного белка VLP заключается, таким образом, в возможности соединять несколько антигенов на субъединицу. Это позволяет образовывать плотную антигенную матрицу.
В одном из воплощений изобретения связывание и присоединение, соответственно, по меньшей мере одного антигена или антигенной детерминанты с вирусоподобной частицей осуществляется путем взаимодействия и ассоциации, соответственно, между по меньшей мере одним первым сайтом присоединения вируеоподобной частицы и по меньшей мере одним вторым сайтом присоединения антигенного пептида.
VLPs или капсиды из оболочечного белка Q демонстрирует определенное количество остатков лизина на их поверхности с определенной топологией с тремя остатками лизина, обращенными внутрь капсида и взаимодействующими с РНК и четырьмя другими остатками лизина, обращенными наружу от капсида. Эти определенные свойства способствуют присоединению антигенов к наружной стороне частицы, а не к внутренней стороне частицы, где остатки лизина взаимодействуют с РНК. VLPs других оболочечных белков РНК-фага также имеют определенное количество остатков лизина на их поверхности и определенную топологию этих остатков лизина.
В другом воплощении настоящего изобретения первый сайт присоединения представляет собой остаток лизина и/или второй сайт присоединения содержит сульфгидрильную группу или остаток цистеина. В еще одном воплощении настоящего изобретения первый сайт присоединения представляет собой остаток лизина и второй сайт присоединения представляет собой остаток цистеина. В других воплощениях изобретения антиген или антигенная детерминанта связаны через остаток цистеина с остатками лизина VLP оболочечного белка РНК-фага и, в частности, с VLP оболочечного белка Qbeta.
Другое преимущество VLPs, происходящих из РНК-фагов, заключается в их высоком выходе экспрессии в бактериях, что обеспечивает продукцию больших количеств материала по доступной цене. Более того, применение VLPs в качестве носителей обеспечивает образование надежных антигенных матриц и конъюгатов, соответственно, с варьирующей плотностью антигена. В частности, применение VLPs РНК-фагов и, таким образом, в частности, применение VLP оболочечного белка РНК-фага Qbeta позволяет добиться очень высокой плотности эпитопов.
В некоторых воплощениях изобретения иммуногенные композиции по изобретению могут содержать смеси иммуногенных конъюгатов, т.е. иммуногенные носители, связанные с одним или несколькими антигенными пептидами IgE по изобретению. Таким образом, эти иммуногенные композиции могут состоять из иммуногенных носителей, которые отличаются по аминокислотной последовательности. Например, могут быть получены вакцинные композиции, содержащие VLP "дикого типа" и модифицированный белок VLP, в котором один или более аминокислотных остатков были изменены (например, делегированы, встроены или замещены). Альтернативно, может быть использован тот же иммуногенный носитель, но связанный с антигенными пептидами IgE других аминокислотных последовательностей.
Поэтому изобретение также относится к способу получения иммуногена согласно изобретению, включающему: 1) обеспечение антигенного пептида IgE согласно изобретению, 2) обеспечение иммуногенного носителя согласно изобретению, предпочтительно VLP, и 3) объединение указанного антигенного пептида IgE и указанного иммуногенного носителя. В одном из воплощений указанную стадию объединения осуществляют посредством химического поперечного сшивания, предпочтительно через гетеробифункциональный кросс-линкер.
В воплощении антигенный пептид IgE по изобретению состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429 и 430.
В другом воплощении антигенный пептид IgE по изобретению состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152 и 153. Предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 88, 89, 90, 91, 92, 93, 94, 95, 96, 99, 100, 101, 102, 103, 104, 105, 106, 109, 110, 111, 112, 113, 114, 115, 118, 119, 120, 121, 122, 123, 126, 127, 128, 129, 130, 133, 134, 135, 136, 139, 140, 141, 144, 145 и 148. Более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 49, 50, 51, 52, 53, 54, 55, 56, 57, 63, 64, 65, 66, 67, 68, 69, 70, 76, 77, 78, 79, 80, 81, 82, 88, 89, 90, 91, 92, 93, 99, 100, 101, 102, 103, 109, 110, 111, 112, 118, 119, 120, 126, 127, 133 и 139. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательностиу выбранной из группы, состояще из SЕQ ID NО: 1, 2, 3, 4, 5, 6, 7, 8, 9, 18, 19, 20, 21, 22, 23, 24, 25, 34, 35, 36, 37, 38, 39, 40, 49, 50, 51, 52, 53, 54, 63, 64, 65, 66, 67, 76, 77, 78, 79, 88, 89, 90, 99, 100, 101 и 109. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 18, 19, 20, 21, 22, 34, 35, 36, 37, 49, 50, 51, 63, 64 и 76. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 3, 18, 19 и 34. Наиболее предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности SEQ ID NO: 1 или 18.
В другом воплощении антигенный пептид IgE по изобретению состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218 и 219. Предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 154, 155, 156, 157, 158, 159, 160, 161, 162, 165, 166, 167, 168, 169, 170, 171, 172, 175, 176, 177, 178, 179, 180, 181, 184, 185, 186, 187, 188, 189, 192, 193, 194, 195, 196, 199, 200, 201, 202, 205, 206, 207, 210, 211, 214 и 217. Более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 154, 155, 156, 157, 158, 159, 165, 166, 167, 168, 169, 175, 176, 177, 178, 184, 185, 186, 192, 193, 199 и 200. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 154, 155, 156, 165, 166 и 175. Наиболее предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности SEQ ID NO: 154 или 165.
В другом воплощении антигенный пептид IgE по изобретению состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы состоящей из SЕQ ID NО: 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309 и 310.
Предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 245, 246, 247, 248, 249, 250, 251, 252, 253, 256, 257, 258, 259, 260, 261, 262, 263, 266, 267, 268, 269, 270, 271, 272, 275, 276, 277, 278, 279, 280, 283, 284, 285, 286, 287, 290, 291, 292, 293, 296, 297, 298, 301, 302 и 305. Более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 225, 226, 227, 233, 234, 235, 236, 237, 238, 239, 245, 246, 247, 248, 249, 250, 256, 257, 258, 259, 260, 266, 267, 268, 269, 275, 276, 277, 283, 284 и 290. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 233, 234, 235, 236, 245, 246, 247, 256, 257 и 266. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 220, 221, 222, 233, 234 и 245. Наиболее предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности SEQ ID NO: 220 или 233.
В еще одном воплощении антигенный пептид IgE по изобретению состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429 и 230. Предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 365, 366, 367, 368, 369, 370, 371, 372, 373, 376, 377, 378, 379, 380, 381, 382, 383, 386, 387, 388, 389, 390, 391, 392, 395, 396, 397, 398, 399, 400, 403, 404, 405, 406, 407, 410, 411, 412, 413, 416, 417, 418, 421, 422 и 425. Более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 326, 327, 328, 329, 330, 331, 332, 333, 334, 340, 341, 342, 343, 344, 345, 346, 347, 353, 354, 355, 356, 357, 358, 359, 365, 366, 367, 368, 369, 370, 376, 377, 378, 379, 380, 386, 387, 388, 389, 395, 396, 397, 403, 404 и 410. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 326, 327, 328, 329, 330, 331, 340, 341, 342, 343, 344, 353, 354, 355, 356, 365, 366, 367, 376, 377 и 386. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 326, 327, 328, 340, 341 и 353. Еще более предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 311, 312 и 326. Наиболее предпочтительно, указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности SEQ ID NO: 311 или 312.
В воплощении настоящего изобретения антигенный пептид IgE, описанный в данной заявке, связан с иммуногенной молекулой-носителем. В воплощении указанный иммуногенный носитель выбран из группы, состоящей из любого иммуногенного носителя, описанного в данной заявке. В другом воплощении указанный иммуногенный носитель выбран из группы, состоящей из сывороточных альбуминов, таких как бычий сывороточный альбумин (БСА); глобулины; тиреоглобулины; гемоглобины; гембцианины (вчастности, гемоцианин лимфы улитки [KLH]) и вирусоподобная частица (VLPs). В предпочтительном воплощении указанный иммуногенный носитель представляет собой гемоцианин лимфы улитки или вирусоподобную частицу (VLPs). В предпочтительном воплощении указанный иммуногенный носитель представляет собой VLP, выбранную из группы, состоящей из VLP HBcAg, VLP HBsAg, VLP Qbeta или любого варианта, описанного в данной заявке. В предпочтительном воплощении указанный иммуногенный носитель представляет собой VLP Qbeta, выбранную из группы, состоящей из Qbeta СР; Qbeta A1, Qbeta-240, Qbeta-243, Qbeta-250, Qbeta-251 и Qbeta-259 (описанных в WO 03/024481).
В воплощении указанный иммуногенный носитель ковалентно связан с антигенным пептидом IgE, описанным в данной заявке, либо непосредственно, либо через линкер. В воплощении указанный иммуногенный носитель связан с антигенным пептидом IgE, описанным в данной заявке, посредством экспрессии слитого белка, описанного в данной заявке. В другом воплощении антигенный пептид IgE, описанный в данной заявке, связан с иммуногенным носителем, предпочтительно VLP, посредством химического поперечного сшивания, как описано в данной заявке, и предпочтительно с использованием гетеробифункциональных кросс-линкеров. В данной области известно несколько гетеробифункциональных кросс-линкеров. В некоторых воплощениях гетеробифункциональный кросс-линкер содержит функциональную группу, которая может реагировать с первыми сайтами присоединения, т.е. с аминогруппой боковой цепи остатков лизина VLP или субъединицы VLP, и дополнительную функциональную группу, которая может реагировать с предпочтительным вторым сайтом присоединения, т.е. остатком цистеина, слитым с антигенным пептидом, доступным для реакции восстановлением.
Следовательно, в воплощении настоящего изобретения антигенный пептид IgE, описанный в данной заявке, дополнительно содержит либо на своем М-конце, либо на своем С-конце, либо и на N-конце, и на С-конце линкер, который способен реагировать с сайтом присоединения иммуногенного носителя в химический реакции поперечного сшивания. В воплощении антигенный пептид IgE, описанный в данной заявке, дополнительно содержит на своем С-конце линкер, имеющий формулу (G)nC, где n означает целое числo, выбpaннoe из гpуппы, cocтoящeй из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, предпочтительно из группы, сострящей из 0, 1, 2, 3, 4 и 5, более предпочтительно из группы, состоящей из 0, 1, 2 и 3, наиболее предпочтительно n равно 0 или 1 (если n равно 0, то указанная формула представляет цистеин). Предпочтительно, антигенный пептид IgE, описанный в данной заявке, дополнительно содержит на своем С-конце линкер, имеющий формулу GGGC, GGC, GC или С.
В другом воплощении настоящего изобретения антигенный пептид IgE, описанный в данной заявке, дополнительно содержит на своем N-конце линкер, имеющий формулу C(G)n, где n означает целое число, выбранное из группы, состоящей из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, предпочтительно из группы, состоящей из 0, 1, 2, 3, 4 и 5, более предпочтительно из группы, состоящей из 0, 1, 2 и 3, наиболее предпочтительно n равно 0 или 1 (если n равно 0, то указанная формула представляет цистеин). Предпочтительно, антигенный пептид IgE, описанный в данной заявке, дополнительно содержит на своем N-конце линкер, имеющий формулу CGGG, CGG, CG или С.
В другом воплощении антигенный пептид IgE, описанный в данной заявке, дополнительно содержит на своем N-конце линкер, имеющий формулу GGGC, GGC, GC или С.
В другом воплощении антигенный пептид IgE, описанный в данной заявке, дополнительно содержит на своем С-конце линкер, имеющий формулу (G)nC, где n означает целое число, выбранное из группы, состоящей из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, предпочтительно из группы, состоящей из 0, 1, 2, 3, 4 и 5, более предпочтительно из группы, состоящей из 0, 1, 2 и 3, наиболее предпочтительно, n равно 0 или 1 (если n равно 0, то указанная формула представляет цистеин) и на своем N-конце линкер, имеющий формулу C(G)n, где n означает целое число, выбранное из группы, состоящей из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, предпочтительно из группы, состоящей из 0, 1, 2, 3, 4 и 5, более предпочтительно из группы, состоящей из 0, 1, 2 и 3, наиболее предпочтительно, n равно 0 или 1 (если n равно 0, то указанная формула представляет цистеин). Предпочтительно, антигенный пептид IgE, описанный в данной заявке, дополнительно содержит на своем N-конце линкер, имеющий формулу GGGC, GGC, GC или С и на своем С-конце линкер, имеющий формулу GGGC, GGC, GC или С. Более предпочтительно, антигенный пептид IgE, описанный в данной заявке, дополнительно содержит на своем N-конце цистеин ина своем С-конце цистеин.
Типичный представитель указанных антигенных пептидов IgE, дополнительно содержащих такой линкер, раскрыт в SEQ ID NO: 434, 436, 437, 438 и 439, В воплощении изобретения антигенный пептид IgE, содержащий линкер, представляет собой любой из пептидов, представленных в Таблице 9.
Остаток цистеина, добавленный к N-концу и/или С-концу антигенного пептида IgE, доступен для реакции восстановлением (химическое поперечное сшивание), обычно и предпочтительно, с использованием гетеробифункционального кросс-линкера. В данной области известно несколько гетеробифункциональных кросс-линкеров. В некоторых воплощениях антигенный пептид IgE, который дополнительно содержит линкер, описанный в данной заявке, поперечно сшит с аминогруппой боковой цепи остатков лизина VLP.
Поэтому в воплощении антигенный пептид IgE, который дополнительно содержит линкер, описанный выше, поперечно сшит с иммуногенным носителем (в частности с VLP, предпочтительно с VLP HBcAg, VLP HBsAg или VLP Qbeta. Первая стадия процедуры, обычно называемая дериватизацией, представляет собой реакцию VLP с кросс-линкером. Продуктом этой реакции является активированная VLP, также называемая активированным носителем. На второй стадии непрореагировавший кросс-линкер удаляют с помощью обычных методов, таких как гель-фильтрация или диализ. На третьей стадии антигенный пептид подвергают взаимодействию с активированной VLP, и эту стадию обычно называют стадией сочетания. Непрореагировавший антигенный пептид возможно может быть удален на четвертой стадии, например, посредством диализа. В данной области известно несколько гетеробифункциональных кросс-линкеров. Они включают предпочтительные кросс-линкеры SMPH (Сукцинимидил-6-[β-малеимидопропионамидо]гексаноат), Сульфо-MBS, Сульфо-EMCS, Сульфо-GMBS, Сульфо-SIAB, Сульфо-SMPB, Сульфо-SMCC, SVSB, SIA и другие кросс-линкеры, доступные, например, от Pierce Chemical Company (Rockford, IL, США) и имеющие одну функциональную группу, реактивную в отношении аминогрупп, и одну функциональную группу, реактивную в отношении остатков цистеина. Все вышеуказанные кросс-линкеры приводят к образованию тиоэфирной связи.
В воплощении изобретение относится к иммуногену, содержащему антигенный IgE, состоящий из или состоящий по существу из аминокислотмой последовательности SEQ ID NO: 1, 2, 3, 18, 19 или 34, наиболее предпочтительно из SEQ ID NO: 1 или 18, где указанный антигенный IgE дополнительно содержит на своем С-конце цистеин, который химически поперечно сшит с вирусоподобной частицей посредством тиоэфирной связи. В предпочтительном воплощении указанная VLP выбрана из группы, состоящей из HBcAg, HBsAg и Qbeta. Предпочтительно, указанная VLP представляет собой Qbeta, еще более предпочтительно Qbeta с SEQ ID NO: 435.
В воплощении изобретение относится к иммуногену, содержащему антигенный IgE, состоящий из или состоящий по существу из аминокислотной последовательности SEQ ID NO: 1, 2, 3, 18, 19 или 34, наиболее предпочтительно из SEQ ID NO: 1 или 18, где указанный антигенный IgE дополнительно содержит на своем N-конце цистеин, который химически поперечно сшит с вирусоподобной частицей посредством тиоэфирной связи. В предпочтительном воплощении указанная VLP выбрана из группы, состоящей из HBcAg, HBsAg и Qbeta. Предпочтительно, указанная VLP представляет собой Qbeta, еще более предпочтительно Qbeta с SEQ ID NO: 435.
В воплощении изобретение относится к иммуногену, содержащему антигенный IgE, состоящий из или состоящий по существу из аминокислотной последовательности из SEQ ID NO: 154, 155, 156, 165, 166 и 175, наиболее предпочтительно из SEQ ID NO: 154 или 165, где указанный антигенный IgE дополнительно содержит на своем С-конце цистеин, который химически поперечно сшит с вирусоподобной частицей посредством тиоэфирной связи. В предпочтительном воплощении указанная VLP выбрана из группы, состоящей из HBcAg, HBsAg и Qbeta. Предпочтительно, указанная VLP представляет собой Qbeta, еще более предпочтительно Qbeta с SEQ ID NO: 435.
В воплощении изобретение относится к иммуногену, содержащему антигенный IgE, состоящий из или состоящий по существу из аминокислотной последовательности из SEQ ID NO: 154, 155, 156, 165, 166 и 175, наиболее предпочтительно из SEQ ID NO: 154 или 165, где указанный антигенный IgE дополнительно содержит на своем N-конце цистеин, который химически поперечно сшит с вирусоподобной частицей посредством тиоэфирной связи. В предпочтительном воплощении указанная VLP выбрана из группы, состоящей из HBcAg, HBsAg и Qbeta. Пpeдпoчтитeльнo, укaзaннaя VLP пpeдcтaвляeт собой Qbeta, еще более предпочтительно Qbeta с SEQ ID NO: 435.
В воплощении изобретение относится к иммуногену, содержащему антигенный IgE, состоящий из или состоящий по существу из аминокислотной последовательности из SEQ ID NO: 220, 221, 222, 233, 234 и 245, наиболее предпочтительно из SEQ ID NO: 220 или 233, где указанный антигенный IgE дополнительно содержит на своем С-конце цистеин, который химически поперечно сшит с вирусоподобной частицей посредством тиоэфирной связи. В предпочтительном воплощении указанная VLP выбрана из группы, состоящей из HBcAg, HBsAg и Qbeta. Предпочтительно, указанная VLP представляет собой Qbeta, еще более предпочтительно Qbeta с SEQ ID NO: 435.
В воплощении изобретение относится к иммуногену, содержащему антигенный IgE, состоящий из или состоящий по существу из аминокислотной последовательности из SEQ ID NO: 220, 221, 222, 233, 234 и 245, наиболее предпочтительно из SEQ ID NO: 220 или 233, где указанный антигенный IgE дополнительно содержит на своем N-конце цистеин, который химически поперечно сшит с вирусоподобной частицей посредством тиоэфирной связи. В предпочтительном воплощении указанная VLP выбрана из группы, состоящей из HBcAg, HBsAg и Qbeta. Предпочтительно, указанная VLP представляет собой Qbeta, еще более предпочтительно Qbeta с SEQ ID NO: 435.
В воплощении изобретение относится к иммуногену, содержащему антигенный IgE, состоящий из или состоящий по существу из аминокислотной последовательности из SEQ ID NO: 311, 312 и 326, наиболее предпочтительно из SEQ ID NO: 311 или 312, где указанный антигенный IgE дополнительно содержит на своем С-конце цистеин, который химически поперечно сшит с вирусоподобной частицей посредством тиоэфирной связи. В предпочтительном воплощении указанная VLP выбрана из группы, состоящей из HBcAg, HBsAg и Qbeta. Предпочтительно, указанная VLP представляет собой Qbeta, еще более предпочтительно Qbeta с SEQ ID NO: 435.
В воплощении изобретение относится к иммуногену, содержащему антигенный IgE, состоящий из или состоящий по существу из аминокислотной последовательности из SEQ ID NO; 311, 312 и 326, наиболее предпочтительно из SEQ ID NO: 311 или 312, где указанный антигенный IgE дополнительно содержит на своем N-конце цистеин, который химически поперечно сшит с вирусоподобной частицей посредством тиоэфирной связи. В предпочтительном воплощении указанная VLP выбрана из группы, состоящей из HBcAg. HBsAg и Qbeta. Предпочтительно, указанная VLP представляет собой Qbeta, еще более предпочтительно Qbeta с SEQ ID NO: 435.
В воплощении изобретение относится к иммуногену, содержащему антигенный IgE, состоящий из или состоящий по существу из аминокислотной последовательности из SEQ ID NO: 311, 312 и 326, наиболее предпочтительно из SEQ ID NO: 311 или 312. Предпочтительно, указанный антигенный IgE дополнительно содержит на своем С-конце GC-линкер, предпочтительно линкер, имеющий формулу GGC (предпочтительно указанный антигенный пептид IgE, который содержит на своем С-конце GC-линкер состоит из или состоит по существу из аминокислотной последовательности SEQ ID NO: 457), который химически поперечно сшит с вирусоподобной частицей посредством тиоэфирной связи с использованием SMPH (Сукцинимидил-6-[β-малеимидопропионамидо]гексаноат), где указанная связь находится между остатками лизина VLP и остатком цистеина указанного С-концевого линкера. В предпочтительном воплощении указанная VLP выбрана из группы, состоящей из HBcAg, HBsAg и Qbeta. Предпочтительно, указанная VLP представляет собой Qbeta, еще более предпочтительно Qbeta с SEQ ID NO: 435.
В воплощении изобретение относится к иммуногену, содержащему антигенный IgE, состоящий из или состоящий по существу из аминокислотной последовательности из SEQ ID NO: 220, 221, 233, 234, 244 и 246, наиболее предпочтительно из SEQ ID NO: 220 или 233, который химически поперечно сшит с вирусоподобной частицей посредством тиоэфирной связи, где указанная связь находится между остатками лизина VLP и остатка цистеина указанного антигенного пептида IgE. В указанном воплощении антигенный пептид IgE, описанный в данной заявке, связан с иммуногенным носителем, предпочтительно VLP, посредством химического поперечного сшивания, как описано в данной заявке, и предпочтительно с использованием гетеробифункционального кросс-линкера. В данной области известно несколько гетеробифункциональных кросс-линкеров. В некоторых воплощениях гетеробифункциональный кросс-линкер содержит функциональную группу, которая может реагировать с первыми сайтами присоединения, т.е. с аминогруппой боковой цепи остатков лизина VLP или субъединицы VLP, и дополнительную функциональную группу, которая может реагировать с предпочтительным вторым сайтом присдединения, т.е остатком цистеина антигенного пептида, доступного для реакции восстановления. В предпочтительном воплощении указанная VLP выбрана из группы, состоящей из HBcAg, HBsAg и Qbeta. Предпочтительно, указанная VLP представляет собой Qbeta, еще более предпочтительно Qbeta с SEQ ID NO: 435.
В воплощении изобретение относится к иммуногену, содержащему антигенный IgE, состоящий из или состоящий по существу из аминокислотной последовательности SEQ ID NO: 220, который химически поперечно сшит с вирусоподобной частицей посредством тиоэфирной связи с использованием SMPH (Сукцинимидил-6-[β-малеимидопропионамидо]гексаноат) в качестве сшивающего линкера, где указанная связь находится между остатками лизина VLP и остатком цистеина указанного антигенного пептида IgE. В предпочтительном воплощении указанная VLP выбрана из группы, состоящей из HBcAg, HBsAg и Qbeta. Предпочтительно, указанная VLP представляет собой Qbeta, еще более предпочтительно Qbeta с SEQ ID NO: 435.
В конкретном воплощении, когда последовательность антигенного пептида IgE, описанного в данной заявке, содержит цистеин, тогда указанный антигенный пептид IgE ковалентно связан с иммуногенным носителем непосредственно через указанный цистеин. В указанном воплощении антигенный пептид IgE, описанный в данной заявке, связан с иммуногенным носителем, предпочтительно VLP, посредством химического поперечного сшивания, как описано в данной заявке, и предпочтительно с использованием гетеробифункционального кросс-линкера. В данной области известно несколько гетеробифункциональных кросс-линкеров. В некоторых воплощениях гетеробифункциональный кросс-линкер содержит функциональную группу, которая может реагировать с первыми сайтами присоединения, т.е. с аминогруппой боковой цепи остатков лизина VLP или субъединицы VLP, и дополнительную функциональную группу, которая может реагировать с предпочтительным вторым сайтом присоединения, т.е. остатком цистеина, слитым с антигенным пептидом, доступным для реакции восстановления. Таким образом, в некоторых воплощениях, когда последовательность антигенного пептида IgE, описанного в данной заявке, содержит цистеин, тогда указанный антигенный пептид IgE химически сшит с иммуногенным носителем посредством тиоэфирной связи, где указанная связь находится между остатками лизина иммуногенного носителя и остатком цистеина указанного антигенного IgE. В предпочтительном воплощении указанный иммуногенный носитель представляет собой VLP, предпочтительно вирусоподобную частицу Qbeta (еще более предпочтительно Qbeta с SEQ ID NO: 435).
В еще одном аспекте настоящее изобретение относится к композиции, содержащей по меньшей мере два иммуногена, описанных в данной заявке. В воплощении настоящее изобретение относится к композиции, содержащей по меньшей мере два иммуногена, где каждый из этих иммуногенов содержит описанный в данной заявке антигенный пептид IgE, связанный с иммуногенным носителем. В воплощении указанная композиция содержит два, три, четыре или пять иммуногенов по настоящему изобретению, где каждый их этих иммуногенов содержит антигенный пептид IgE, описанный в данной заявке, связанный с иммуногенным носителем.
Предпочтительно, каждый антигенный пептид IgE индивидуально связан с разными молекулами иммуногенного носителя (где каждая молекула иммуногенного носителя имеет только один тип антигенного пептида IgE, конъюгированного с ним). Показано, что в указанном воплощении антигенный пептид IgE индивидуально конъюгирован с иммуногенным носителем.
В воплощении изобретение относится к композиции, содержащей или состоящей из двух иммуногенов, где каждый из этих иммуногенов содержит описанный в данной заявке антигенный пептид IgE, связанный с иммуногенным носителем. Предпочтительно, каждый антигенный пептид IgE индивидуально конъюгирован с иммуногенным носителем.
В воплощении антигенный пептид IgE из первого иммуногена состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152 и 153, предпочтительно из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 31, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 88, 89, 90, 91, 92, 93, 94, 95, 96, 99, 100, 101, 102, 103, 104, 105, 106, 109, 110, 111, 112, 113, 114, 115, 118, 119, 120, 121, 122, 123, 126, 127, 128, 129, 130, 133, 134, 135, 136, 139, 140, 141, 144, 145 и 148, более предпочтительно из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 49, 50, 51, 52, 53, 54, 55, 56, 57, 63, 64, 65, 66, 67, 68, 69, 70, 76, 77, 78, 79, 80, 81, 82, 88, 89, 90, 91, 92, 93, 99, 100, 101, 102, 103, 109, 110, 111, 112, 118, 119, 120, 126, 127, 133 и 139, еще более предпочтительно из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 18, 19, 20, 21, 22, 23, 24, 25, 34, 35, 36, 37, 38, 39, 40, 49, 50, 51, 52, 53, 54, 63, 64, 65, 66, 67, 76, 77, 78, 79, 88, 89, 90, 99, 100, 101 и 109, еще более предпочтительно из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 18, 19, 20, 21, 22, 34, 35, 36, 37, 49, 50, 51, 63, 64 и 76, еще более предпочтительно из группы, состоящей из SEQ ID NO: 1, 2, 3, 18, 19 и 34, наиболее предпочтительно, указанный антигенный пептид IgE состоит из аминокислотной последовательности SEQ ID NO: 1 или 18.
В воплощении антигенный пептид IgE из второго иммуногена состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218 и 219, предпочтительно из группы, состоящей из SEQ ID NO: 154, 155, 156, 157, 158, 159, 160, 161, 162, 165, 166, 167, 168, 169, 170, 171, 172, 175, 176, 177, 178, 179, 180, 181, 184, 185, 186, 187, 188, 189, 192, 193, 194, 195, 196, 199, 200, 201, 202, 205, 206, 207, 210, 211, 214 и 217, более предпочтительно из группы, состоящей из SEQ ID NO: 154, 155, 156, 157, 158, 159, 165, 166, 167, 168, 169, 175, 176, 177, 178, 184, 185, 186, 192, 193, 199 и 200, еще более предпочтительно из группы, состоящей из SEQ ID NO: 154, 155, 156, 165, 166 и 175, наиболее предпочтительно, указанный антигенный пептид IgE состоит из аминокислотной последовательности SEQ ID NO: 154 или 165.
В другом воплощении антигенный пептид IgE из второго иммуногена состоит из аминокислотной посдедовательсти, выбранной из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237,238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309 и 310, предпочтительно из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 245, 246, 247, 248, 249, 250, 251, 252, 253, 256, 257, 258, 259, 260, 261, 262, 263, 266, 267, 268, 269, 270, 271, 272, 275, 276, 277, 278, 279, 280, 283, 284, 285, 286, 287, 290, 291, 292, 293, 296, 297, 298, 301, 302 и 305, более предпочтительно из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 225, 226, 227, 233, 234, 235, 236, 237, 238, 239, 245, 246, 247, 248, 249, 250, 256, 257, 258, 259, 260, 266, 267, 268, 269, 275, 276, 277, 283, 284 и 290, еще более предпочтительно из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 233, 234, 235, 236, 245, 246, 247, 256, 257 и 266, еще более предпочтительно из группы, состоящей из SEQ ID NO: 220, 221, 222, 233, 234 и 245, наиболее предпочтительно, указанный антигенный пептид IgE состоит из аминокислотной последовательности SEQ ID NO; 220 или 233.
В еще одном антигенном пептиде IgE из второго иммуногена состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399,400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429 и 430, предпочтительно из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 365, 366, 367, 368, 369, 370, 371, 372, 373, 376, 377, 378, 379, 380, 381, 382, 383, 386, 387, 388, 389, 390, 391, 392, 395, 396, 397, 398, 399, 400, 403, 404, 405, 406, 407, 410,411, 412, 413, 416, 417, 418, 421, 422 и 425, более предпочтительно из группы састоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 326, 327, 328, 329, 330, 331, 332, 333, 334, 340, 341, 342, 343, 344, 345, 346, 347, 353, 354, 355, 356, 357, 358, 359, 365, 366, 367, 368, 369, 370, 376, 377, 378, 379, 380, 386, 387, 388, 389, 395, 396, 397, 403, 404 и 410, еще более предпочтительно из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 326, 327, 328, 329, 330, 331, 340, 341, 342, 343, 344, 353, 354, 355, 356, 365, 366, 367, 376, 377 и 386, еще более предпочтительно из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 326, 327, 328, 340, 341 и 353, еще болеепредпочтительно из группы, состоящей из SEQ ID NO: 311, 312 и 326, наиболее предпочтительно, указанный антигенный пептид IgE состоит из аминокислотной последовательности SEQ ID NO: 311 или 312.
В воплощении изобретение относится к композиции, содержащей или состоящей из двух иммуногенов, где каждый из этих иммуногенов содержит антигенный пептид IgE, связанный с иммуногенным носителем, где антигенный пептид IgE из первого иммуногена состоит из аминокислотной последовательности SEQ ID NO: 1, и антигенный пептид IgE из второго иммуногена состоит из 165. В другом воплощении антигенный пептид IgE из первого иммуногена состоит из аминокислотной последовательности SEQ ID NO: 1, и антигенный пептид IgE из второго иммуногена состоит из аминокислотной последовательности SEQ ID NO: 220. В другом воплощении антигенный пептид IgE из первого иммуногена состоит из аминокислотной последовательности SEQ ID NO: 1, и антигенный пептид IgE из второго иммуногена состоит из аминокислотной последовательности SEQ ID NO: 312. Предпочтительно, каждый антигенный пептид индивидуально конъюгирован с иммуногенным носителем.
В воплощении изобретение относится к композиции, содержащей или состоящей из двух иммуногенов, где каждый из этих иммуногенов содержит описанный в данной заявке антигенный пептид IgE, связанный с иммуногенным носителем. Предпочтительно, каждый из антигенных пептидов IgE индивидуально конъюгирован с иммуногенным носителем. В воплощении антигенный пептид IgE из первого иммуногена состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 154, 155, 156, 157, 158, 159 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218 и 219, предпочтительно из группы, состоящей из SEQ ID NO: 154, 155, 156, 157, 158, 159, 160, 161, 162, 165, 166, 167, 168, 169, 170, 171, 172, 175, 176, 177, 178, 179, 180, 181, 184, 185, 186, 187, 188, 189, 192, 193, 194, 195, 196, 199, 200, 201, 202, 205, 206, 207, 210, 211, 214 и 217, более предпочтительно из группы, состоящей из SEQ ID NO: 154, 155, 156, 157, 158, 159, 165, 166, 167, 168, 169, 175, 176, 177, 178, 184, 185, 186, 192, 193, 199 и 200, еще более предпочтительно из группы, состоящей из SEQ ID NO: 154, 155, 156, 165, 166 и 175, наиболее предпочтительно, указанный антигенный пептид IgE состоит из аминокислотной последовательности SEQ ID NO: 154 или 165.
В воплощении антигенный пептид IgE из второго иммуногена состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309 и 310, предпочтительно из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 245, 246, 247, 248, 249, 250, 251, 252, 253, 256, 257, 258, 259, 260, 261, 262, 263, 266, 267, 268, 269, 270, 271, 272, 275, 276, 277, 278, 279, 280, 283, 284, 285, 286, 287, 290, 291, 292, 293, 296, 297, 298, 301, 302 и 305, более предпочтительно из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 225, 226, 227, 233, 234, 235, 236, 237, 238, 239, 245, 246, 247, 248, 249, 250, 256, 257, 258, 259, 260, 266, 267, 268, 269, 275, 276, 277, 283, 284 и 290, еще более предпочтительно из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 233, 234, 235, 236, 245, 246, 247, 256, 257 и 266, еще более предпочтительно из группы, состоящей из SEQ ID NO: 220, 221, 222, 233, 234 и 245, наиболее предпочтительно, указанный антигенный пептид IgE состоит из аминокислотной последовательности SEQ ID NO: 220 или 233.
В другом воплощении антигенный пептид IgE из второго иммуногена состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429 и 430, предпочтительно из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 365, 366, 367, 368, 369, 370, 371, 372, 373, 376, 377, 378, 379, 380, 381, 382, 383, 386, 387, 388, 389, 390, 391, 392, 395, 396, 397, 398, 399, 400, 403, 404, 405, 406, 407, 410, 411, 412, 413, 416, 417, 418, 421, 422 и 425, более предпочтительно из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 326, 327, 328, 329, 330, 331, 332, 333, 334, 340, 341, 342, 343, 344, 345, 346, 347, 353, 354, 355, 356, 357, 358, 359, 365, 366, 367, 368, 369, 370, 376, 377, 378, 379, 380, 386, 387, 388, 389, 395, 396, 397, 403, 404 и 410, еще более предпочтительно из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 326, 327, 328, 329, 330, 331, 340, 341, 342, 343, 344, 353, 354, 355, 356, 365, 366, 367, 376, 377 и 386, еще более предпочтительно из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 326, 327, 328, 340, 341 и 353, еще более предпочтительно из группы, состоящей из SEQ ID NO: 311, 312 и 326, наиболее предпочтительно, указанный антигенный пептид IgE состоит из аминокислотной последовательности SEQ ID NO: 311 или 312.
В воплощении изобретение относится к композиции, содержащей или состоящей из двух иммуногенов, где каждый из этих иммуногенов содержит антигенный пептид IgE, связанный с иммуногенным носителем, где антигенный пептид IgE из первого иммуногена состоит из аминокислотной последовательности SEQ ID NO: 165, и антигенный пептид IgE из второго иммуногена состоит из 220. В другом воплощении антигенный пептид IgE из первого иммуногена состоит из аминокислотной последовательности SEQ ID NO: 165, и антигенный пептид IgE из второго иммуногена состоит из аминокислотной последовательности SЕQ ID NO: 312. Предпочтительно, каждый антигенный пептид индивидуально конъюгирован с иммуногенным носителем.
В воплощении изобретение относится к композиции, содержащей или состоящей из двух иммуногенов, где каждый из этих иммуногенов содержит описанный в данной заявке антигенный пептид IgE, связанный с иммуногенным носителем. Предпочтительно, каждый антигенный пептид индивидуально конъюгирован с иммуногенным носителем. В воплощении антигенный пептид IgE из первого иммуногена состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309 и 310, предпочтительно из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 245, 246, 247, 248, 249, 250, 251, 252, 253, 256, 257, 258, 259, 260, 261, 262, 263, 266, 267, 268, 269, 270, 271, 272, 275, 276, 277, 278, 279, 280, 283, 284, 285, 286, 287, 290, 291, 292, 293, 296, 297, 298, 301, 302 и 305, более предпочтительно из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 225, 226, 227, 233, 234, 235, 236, 237, 238, 239, 245, 246, 247, 248, 249, 250, 256, 257, 258, 259, 260, 266, 267, 268, 269, 275, 276, 277, 283, 284 и 290, еще более предпочтительно из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 233, 234, 235, 236, 245, 246, 247, 256, 257 и 266, еще более предпочтительно из группы, состоящей из SEQ ID NO: 220, 221, 222, 233, 234 и 245, наиболее предпочтительно, указанный антигенный пептид IgE состоит из аминокислотной последовательности SEQ ID NO: 220 или 233.
В воплощении антигенный пептид IgE из второго иммуногена состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403,404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429 и 430, предпочтительно из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 365, 366, 367, 368, 369, 370, 371, 372, 373, 376, 377, 378, 379, 380, 381, 382, 383, 386, 387, 388, 389, 390, 391, 392, 395, 396, 397, 398, 399, 400, 403, 404, 405, 406, 407, 410, 411, 412, 413, 416, 417, 418, 421, 422 и 425, более предпочтительно из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 326, 327, 328, 329, 330, 331, 332, 333, 334, 340, 341, 342, 343, 344, 345, 346, 347, 353, 354, 355, 356, 357, 358, 359, 365, 366, 367, 368, 369, 370, 376, 377, 378, 379, 380, 386, 387, 388, 389, 395, 396, 397, 403, 404 и 410, еще более предпочтительно из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 326, 327, 328, 329, 330, 331, 340, 341, 342, 343, 344, 353, 354, 355, 356, 365, 366, 367, 376, 377 и 386, еще более предпочтительно из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 326, 327, 328, 340, 341 и 353, еще более предпочтительно из группы, состоящей из SEQ ID NO: 311, 312 и 326, наиболее предпочтительно, указанный антигенный пептид IgE состоит из аминокислотной последовательности SEQ ID NO: 311 или 312.
В воплощении изобретение относится к композиции, содержащей или состоящей из двух иммуногенов, где каждый из этих иммуногенов содержит антигенный пептид IgE, связанный с иммуногенным носителем, где антигенный пептид IgE из первого иммуногена состоит из аминокислотной последовательности SEQ ID NO: 220, и антигенный пептид IgE из второго иммуногена состоит из 312. Предпочтительно, каждый антигенный пептид индивидуально конъюгирован с иммуногенным носителем.
Согласно воплощению настоящего изобретения иммуноген композиции, раскрытый в данной заявке выше, связан, предпочтительно химически поперечно сшит с иммуногенным носителем либо непосредственно, либо через линкер, как описано в данной заявке. В воплощении иммуногенный носитель представляет собой гемоцианин лимфы улитки [KLH]) или вирусоподобную частицу (VLPs). В предпочтительном воплощении указанный иммуногенный носитель представляет собой VLP, выбранную из группы, состоящей из VLP HBcAg, VLP HBsAg. VLP Qbeta. или любой вариант, оаисаылый в даыной заявке. В предпочтительном воплощении указанный иммуногенный носитель представляет собой VLP Qbeta, выбранную из группы, состоящей из Qbeta СР; Qbeta A1, Qbeta-240, Qbeta-243, Qbeta-250, Qbeta-251 и Qbeta-259.
В воплощении изобретение относится к композиции, содержащей или состоящей из двух иммуногенов, где каждый из этих иммуногенов содержит описанный в данной заявке антигенный пептид IgE, связанный с иммуногенным носителем. В воплощении первый иммуноген состоит из иммуногена, содержащего антигенный IgE, состоящий из или состоящий по существу из аминокислотной последовательности из SEQ ID NO: 220,, 221, 233, 234, 244 и 246, наиболее предпочтительно из SEQ ID NO: 220 или 233, который химически поперечно сшит с вирусоподобной частицей Qbeta (более предпочтительно, Qbeta с SEQ ID NO: 435) посредством тиоэфирной связи, где указанная связь находится между остатками лизина VLP и остатком цистеина указанного антигенного пептида IgE, и второй иммуноген состоит из иммуногена, содержащего антигенный IgE, состоящий из или состоящий по существу из аминокислотной последовательности из SEQ ID NO: 311, 312 и 326, наиболее предпочтительно из SEQ ID NO: 311 или 312, где указанный антигенный IgE дополнительно содержит на своем С-конце цистеин, который химически поперечно сшит с вирусоподобной частицей Qbeta, более предпочтительно Qbeta с SEQ ID NO: 435. Предпочтительно, каждый антигенный пептид индивидуально конъюгирован с иммуногенным носителем.
В воплощении изобретение относится к композиции, содержащей или состоящей из двух иммуногенов, где каждый из этих иммуногенов содержит описанный в данной заявке антигенный пептид IgE, связанный с иммуногенным носителем. В воплощении первый иммуноген состоит из иммуногена, содержащего антигенный IgE, состоящий из или состоящий по существу из аминокислотной последовательности из SEQ ID NO: 220, 221, 233, 234, 244 и 246, наиболее предпочтительно из SEQ ID NO: 220 или 233, который химически поперечно сшит с вирусоподобной частицей Qbeta (более предпочтительно Qbeta с SEQ ID NO: 435) посредством тиоэфирной связи, где указанная связь находится между остатками лизина VLP и остатком цистеина указанного антигенного пептида IgE, второй иммуноген состоит из иммуногена, содержащего антигенный IgE, cocтoящий из или cocтoящий пo сущecтву из аминокислотной последовательности из SEQ ID NO: 1, 2, 3, 18, 19 или 34, наиболее предпочтительно из SEQ ID NO: 1 или 18, где указанный антигенный IgE дополнительно содержит на своем С-конце цистеин, который химически поперечно сшит с вирусоподобной частицей Qbeta, более предпочтительно Qbeta с SEQ ID NO: 435. Предпочтительно, каждый антигенный пептид индивидуально конъюгирован с иммуногенным носителем.
В воплощении изобретение относится к композиции, содержащей или состоящей из трех иммуногенов, где каждый из этих иммуногенов содержит описанный в данной заявке антигенный пептид IgE, связанный с иммуногенным носителем. В воплощении первый иммуноген состоит из иммуногена, содержащего антигенный IgE, состоящий из или состоящий по существу из аминокислотной последовательности из SEQ ID NO: 220, 221, 233, 234, 244 и 246, наиболее предпочтительно из SEQ ID NO: 220 или 233, который химически поперечно сшит с вирусоподобной частицей Qbeta (более предпочтительно Qbeta с SEQ ID NO: 435) посредством тиоэфирной связи, где указанная связь находится между остатками лизина VLP и остатком цистеина указанного антигенного пептида IgE, второй иммуноген состоит из иммуногена, содержащего антигенный IgE, состоящий из или состоящий по существу из аминокислотной последовательности из SEQ ID NO: 311, 312 и 326, наиболее предпочтительно из SEQ ID NO: 311 или 312, где указанный антигенный IgE дополнительно содержит на своем С-конце цистеин, который химически поперечно сшит с вирусоподобной частицей Qbeta, более предпочтительно с Qbeta с SEQ ID NO: 435, и третий иммуноген состоит из иммуногена, содержащего антигенный IgE, состоящий из или состоящий по существу из аминокислотной последовательности из SEQ ID NO: 1, 2, 3, 18, 19 или 34, наиболее предпочтительно из SEQ ID NO: 1 или 18, где указанный антигенный IgE дополнительно содержит на своем С-конце цистеин, который химически поперечно сшит с вирусоподобной частицей Qbeta, более предпочтительно с Qbeta с SEQ ID NO: 435. Предпочтительно, каждый антигенный пептид индивидуально конъюгирован с иммуногенным носителем.
В воплощении изобретение относится к композиции, содержащей или состоящей из двух иммуногенов, где каждый из этих иммуногенов содержит описанный в данной заявкеантигенный пептид IgE, индивидуально конъюгированный с иммуногенным носителем. В воплощении первый иммуноген состоит из иммуногена, содержащего антигенный пептид IgE, состоящий из или состоящий по существу из аминокислотной последовательности из SEQ ID NO: 220, 221, 233, 234, 244 и 246, наиболее предпочтительно из SEQ ID NO: 220 или 233. Предпочтительно, указанный первый антигенный пептид IgE химически сшит с вирусоподобной частицей Qbeta (более предпочтительно с Qbeta с SEQ ID NO: 435) посредством тиоэфирной связи с использованием SMPH (Сукцинимидил-6-[β-малеимидопропионамидо]гексаноат) в качестве сшивающего линкера, где указанная связь находится между остатками лизина VLP и остатком цистеина указанного антигенного пептида IgE Предпочтительно, второй иммуноген состоит из иммуногена, содержащего антигенный пептид IgE, состоящий из или состоящий по существу из аминокислотной последовательности из SEQ ID NO: 311, 312 или 326, наиболее предпочтительно из SEQ ID NO: 311 или 312. Предпочтительно, указанный второй антигенный пептид IgE дополнительно содержит на своем С-конце GC-линкер, предпочтительно линкер, имеющий формулу GGC (предпочтительно, указанный второй антигенный пептид IgE, который содержит на своем С-конце GC-линкер, состоит из или состоит по существу из аминокислотной последовательности SEQ ID NO: 457), который химически поперечно сшит с вирусоподобной частицей посредством тиоэфирной связи с использованием SMPH (Сукцинимидил-6-[β-малеимидопропионамидо]гексаноат) в качестве сшивающего линкера, где указанная связь находится между остатками лизина VLP и остатком цистеина указанного С-конца линкера. В предпочтительном воплощении указанная VLP выбрана из группы, состоящей из HBcAg, HBsAg и Qbeta. Предпочтительно, указанная VLP представляет собой Qbeta, еще более предпочтительно Qbeta с SEQ ID NO: 435.
В воплощении изобретение относится к композиции, содержащей или состоящей из двух, трех, четырех или более иммуногенов, где каждый из этих иммуногенов содержит антигенный пептид IgE, связанный с иммуногенным носителем, и где указанный антигенный пептид IgE состоит из или состоит по существу из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429 и 430. В воплощении указанные антигенные пептиды IgE связаны с одним и тем же иммуногенным носителем. В другом воплощении указанные антигенные пептиды IgE связывают с разным иммуногенным носителем и затем смешивают.
Способ получения иммуногена по изобретению
Изобретение также относится к способу получения иммуногена, описанного в данной заявке. В воплощении указанный иммуноген содержит по меньшей мере один описанный в данной заявке антигенный пептид IgE, связанный с иммуногенным носителем, описанным в данной заявке. Поэтому изобретение также относится к способу получения иммуногена, включающему стадию связывания по меньшей мере одного антигенного пептида IgE, описанного в данной заявке, с иммуногенным носителем, описанным в данной заявке. В воплощении указанное связывание осуществляют посредством химического поперечного сшивания, либо непосредственно, либо черезлиикер в частности GC-линкер (например, цистеин), как описано в данной заявке. В воплощении изобретение относится к способу получения иммуногена, включающему стадию связывания по меньшей мере одного антигенного пептида IgE, описанного в данной заявке, возможно дополнительно содержащего линкер, как описано в данной заявке, с VLP, описанной в данной заявке, где указанное связывание осуществляют посредством химического поперечного сшивания, либо непосредственно, либо через линкер, в частности GC-линкер (например, цистеин), как описано в данной заявке. В конкретном воплощении, когда последовательность антигенного пептида IgE, описанного в данной заявке, содержит цистеин, тогда указанный антигенный пептид IgE ковалентно связан с VLP непосредственно через указанный цистеин. В указанном воплощении способ включает стадию химического поперечного сшивания, как описано в данной заявке, и предпочтительно с использованием гетеробифункционального кросс-линкера (например, N-гамма-малеимидо-бутирилокси-сукцинимидного сложного эфира (GMBS) или Сукцинимидил-6-[β-малеимидопропионамидо]гексаноата (SMPH)). Поэтому в некоторых воплощениях стадия химического поперечного сшивания приводит к VLP, поперечно сшитой посредством тиоэфирной связи, где указанная связь находится между остатками лизина VLP и остатком цистеина указанного антигенного IgE. В предпочтительном воплощении указанная VLP представляет собой предпочтительно вирусоподобную частицу Qbeta (еще более предпочтительно, Qbeta с SEQ ID NO: 435). Еще одно воплощение настоящего изобретения относится к иммуногену, полученному посредством способа, описанного в данной заявке.
Композиции, содержащие антигенный пептид IgE по изобретению
Настоящее изобретение также относится к композициям, в частности иммуногенным композициям, также названным "настоящими иммуногенными композициями", содержащим антигенный пептид IgE по изобретению, предпочтительно связанный с иммуногенным носителем, более предпочтительно VLP, еще более предпочтительно VLP HBsAg, HbcAg или Qbeta, и возможно по меньшей мере один адъювант. Такие иммуногенные композиции, в частности приготовленные в виде фармацевтических композиций усчитаютея полезными для предупреждения лечения и облегчения" IgE-ассоциированных расстройств.
В некоторых воплощениях настоящая иммуногенная композиция согласно изобретению содержит антигенный пептид IgE, содержащий аминокислотную последовательность, выбранную из SEQ ID NO: 1-430, и его функционально активные варианты, предпочтительно из группы, состоящей из SEQ ID NO: 1-430, более предпочтительно из группы, состоящей из SEQ ID NO: 1-153 и 220-430, еще более предпочтительно из группы, состоящей из SEQ ID NO: 220-430. В некоторых воплощениях указанный антигенный пептид IgE связан с иммуногенным носителем, предпочтительно с VLP, более предпочтительно с VLP HBsAg, HbcAg или Qbeta.
Настоящая иммуногенная композиция, содержащая антигенный пептид IgE согласно изобретению, может быть приготовлена различными способами, как описано более детально ниже.
В некоторых воплощениях настоящая иммуногенная композиция содержит однин вид антигенного пептида IgE, например, иммуногенная композиция содержит группу антигенных пептидов IgE, которые все по существу имеют одинаковую аминокислотную последовательность. В других воплощениях настоящая иммуногенная композиция содержит два или более различных антигенных пептидов IgE, например, иммуногенная композиция содержит группу антигенных пептидов IgE, члены этой группы могут разотличаться по аминокислотной последовательности. Настоящая иммуногенная композиция может содержать от двух до примерно 20 различных антигенных пептидов IgE, например, настоящая иммуногенная композиция может содержать 2, 3, 4, 5, 6, 7, 8, 9, 10, 11-15 или 15-20 различных антигенных пептидов IgE, каждый из которых имеет аминокислотную последовательность, которая отличается от аминокислотных последовательностей других антигенных пептидов IgE.
Например, в некоторых воплощениях настоящая иммуногенная композиция содержит первый антигенный пептид IgE, предпочтительно связанный с иммуногенным носителем, более предпочтительно с VLP, еще более предпочтительно с VLP HBsAg, HbcAg или Qbeta, и содержащим первую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: SEQ ID NO: 1-430, более предпочтительно из группы, состоящей из SEQ ID NO: 1-153 и 220-430, eщe бoлee пpeдпoчтитeльнo из гpyппы, сocтоящeй из SEQ ID NO: 220-430: и по меньшей мере второй антигенный пептидантигенный пептид IgE, предпочтительно связанный с иммуногенным носителем, более предпочтительно, спредпочтительно с VLP, еще более предпочтительно, спредпочтительно с VLP HBsAg, HbcAg или Qbeta, HBsAg, HbcAg или Qbeta VLPVLP Qbeta и содержащий вторую аминокислотную последовательность, предпочтительно, выбраннпредпочтительно выбранную из группы, состоящей из SEQ ID NO: 1-430, более предпочтительно, предпочтительно из группы, состоящей из SEQ ID NO: 1-153 и 220-430, еще более предпочтительно из группы, состоящей из SEQ ID NO: 220-430; где вторая аминокислотная последовательность отличается от первой аминокислотной последовательности по меньшей мере 1, 2, 3, 4, 5, 6-10, или 15 аминокислотами. В другом воплощении первый антигенный пептид IgE содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 311-430, и указанный второй антигенный пептид IgE содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-310, предпочтительно из группы, состоящей из SEQ ID NO: 220-310, или из SEQ ID NO: 1-153, или из SEQ ID NO: 154-219, более предпочтительно из группы, состоящей из SEQ ID NO: 220-310. В еще одном воплощении первый антигенный пептид IgE содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 220-310, и указанный второй антигенный пептид IgE содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-219 и 311-430, предпочтительно из группы, состоящей из SEQ ID NO: 311-430, или из SEQ ID NO: 1-153, или из SEQ ID NO: 154-219, более предпочтительно из группы, состоящей из SEQ ID NO: 311-430. В еще одном воплощении первый антигенный пептид IgE содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-153, и указанный второй антигенный пептид IgE содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 154-430, предпочтительно из группы, состоящей из SEQ ID NO: 220-310, из SEQ ID NO: 311-430 или из SEQ ID NO: 154-219. В еще одном воплощении первый антигенный пептид IgE содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 154-219, и указанный второй антигенный пептид IgE содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-153 и 220-430, предпочтительно из группы, состоящей из SЕQ ID NO: 220-310 или из SЕQ ID NО: 1-153, или из SEQ ID NO: 311-430.
В качестве другого примера настоящая иммуногенная композиция содержит первый антигенный пептид IgE, предпочтительно связанный с иммуногенным носителем, более предпочтительно с VLP, еще более предпочтительно с VLP HBsAg, HbcAg или Qbeta, и содержащий первую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-430; второй антигенный пептид IgE, предпочтительно связанный с иммуногенным носителем, более предпочтительно с VLP, еще более предпочтительно с VLP HBsAg, HbcAg или Qbeta, и содержащий вторую аминокислотную последовательность, предпочтительно выбранную из группы, состоящей из SEQ ID NO: 1-430, где вторая аминокислотная последовательность отличается от первой аминокислотной последовательности по меньшей мере 1, 2, 3, 4, 5, 6-10 или 15 аминокислотами, и по меньшей мере третий антигенный полипептид IgE, предпочтительно связанный с иммуногенным носителем, более предпочтительно с VLP, еще более предпочтительно с VLP HBsAg, HbcAg или Qbeta, и содержащий третью аминокислотную последовательность, предпочтительно выбранную из группы, состоящей из SEQ ID NO: 1-430, где третья аминокислотная последовательность отличается от первой и второй аминокислотных последовательностей по меньшей мере 1, 2, 3, 4, 5, 6-10 или 15 аминокислотами. В другом воплощении первый антигенный пептид IgE содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 311-430; и указанные второй и третий антигенные пептиды IgE содержат аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-310, предпочтительно из группы, состоящей из SEQ ID NO: 220-310, или из SEQ ID NO: 1-153, или из SEQ ID NO: 154-219.
В еще одном воплощении первый антигенный пептид IgE содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 220-310, и указанные второй и третий антигенные пептиды IgE содержат аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-219 и 311-430, предпочтительно из группы, состоящей из SEQ ID NO: 311-430, или из SEQ ID NO: 1-153, или из SEQ ID NO: 154-219.
В других воплощениях настоящая иммуногенная композиция содержит мультимеризованный антигенный полипептид IgE, как описано выше. Используемые в данной заявке термины "иммуногенная композиция, содержащая антигенный пептид IgE" или "иммуногенная композиция по изобретению" или "настоящая иммуногенная композиция" относится к иммуногенной композиции, содержащий либо один вид (мультимеризованный или нет) или множественные виды антигенного(ых) пептида(ов) IgE, связанных или не связанных с иммуногенным носителем. Когда два или более пептидов используются для связывания с носителем, тогда пептид может быть связан с одной и той же молекулой-носителем или индивидуально связан с молекулами-носителями и затем объединен с получением иммуногенной композиции.
Другой аспект изобретения относится к способам получения иммуногена согласно изобретению, включающим сочетание антигенного пептида IgE с иммуногенным носителем. В одном воплощении указанное сочетание является химическим.
В некоторых воплощениях настоящая иммуногенная композиция содержит по меньшей мере один адъювант. Подходящие адъюванты включают адъюванты, пригодные для применения у млекопитающих, предпочтительно у людей. Примеры известных подходящих адъювантов, которые могут быть использованы у людей, включают, но не обязательно ограничиваются этим, квасцы, фосфат алюминия, гидрат окиси алюминия, MF59 (4,3% масс./об. сквалена, 0,5% масс./об. полисорбата 80 (Tween 80), 0,5% масс./об, сорбитан триолеата (Span 85)), CpG-содержащую нуклеиновую кислоту (где цитозин не метилирован), QS21 (сапониновый адъювант), MPL (монофосфориллипид А), 3DMPL (3-O-деацилированный MPL), экстракты из Aquilla, ISCOMS (см., например, Sjölander et al. (1998) J. Leukocyte Вiоl. 64:713; WO 90/03184, WO 96/11711, WO 00/48630, WO 98/36772, WO 00/41720, WO 06/134423 и WO 07/026190), LT/CT мутанты, поли(D,L-лактид-ко-гликолид) (PLG) микрочастицы, Quil А, интерлейкины и тому подобное. Для ветеринарных применений, включающих, но не ограничивающихся экспериментами на животных, можно использовать адъювантфрейнда, N-ацетил-мурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетил-нор-мурамил-L-аланил-D-изоглутамин (CGP 11637, названный какнор-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин (CGP 19835A, названный как МТР-РЕ) и RIBI, который содержит три компонента, экстрагированных из бактерий, монофосфориллипид А, трегалозы димиколат и скелет клеточной стенки (MPL+TDM+CWS) в 2% эмульсии сквален/Tween 80.
Дополнительные типичные адъюванты для увеличения эффективности композиции включают, но не ограничиваются: (1) препараты эмульсии масло-в-воде (вместе или без других специфических иммуностимулирующих агентов, таких как мурамилпептиды (см. ниже) или бактериальные компоненты клеточной стенки), такие как, например, (a) MF59™ (WO 90/14837; глава 10 в Vaccine design: the subunit and adjuvant approach, eds. Powell & Newman, Plenum Press 1995), содержащие 5% сквалена, 0,5% Tween 80 (полиоксиэтиленсорбитан моноолеат) и 0,5% Span 85 (сорбитан триолеат) (возможно содержащие мурамилтрипептид, ковалентно связанный с дипальмитоилфосфатидилэтаноламином (МТР-РЕ)), приготовленный в виде субмикронных частиц с использованием микрофлюидайзера, (б) SAF, содержащий 10% сквалана, 0,4% Tween 80, 5% плюрониковый блоксополимер L121 и thr-MDP, либо подвергнутые микрофлюидизации с получением субмикронной эмульсии, либо обработанные на вортексе с получением эмульсии с частицами крупного размера, и (в) адъювантная система RIBI™ (RAS) (Ribi Immunochem, Hamilton, MT), содержащая 2% сквалена, 0,2% Tween 80 и один или более компонентов бактериальной клеточной стенки, таких как монофосфориллипид A (MPL), трегалозы димиколат (TDM) и скелета клеточной стенки (CWS), предпочтительно MPL + CWS (DETOX™); (2) сапониновые адъюванты, такие как QS21, STIMULON™ (Cambridge Bioscience, Worcester, МА), Abisco® (Isconova, Sweden) или Iscomatrix® (Commonwealth Serum Laboratories, Australia), могут быть использованы или полученные из них частицы, такие как ISCOMs (иммуностимулирующие комплексы), когда ISCOMS лишен дополнительного детергента, например, WO 00/07621; (3) полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA); (4) цитокины, такие как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 (WO 99/44636), и т.д…), интерфероны (например, гамма интегамма-интерферон), макрофагальный колониестимулирующий фактор (M-CSF), фактор некроза опухоли опухолей (TNF) и т.д.; (5) монофосфорил липидмонофосфориллипида А (MPL) или 3-O-деацилированный MPL (3dMPL) например, GB-2220221, ЕР-А-0689454, возможно в случае фактического отсутствия квасцов при использовании с пневмококковых пневмококковыми сахаридовсахаридами, например, WO OWOOO/56358; (6) комбинации 3dMPL с, например, с QS21 и/или эмульсиями масляно-в-воднымие эмульсиями, например, ЕР-А-0835318, ЕР-А-0735898, ЕР-А-0761231; (7) олигонуклеотиды, содержащие CpG CpG-мотивы [Krieg Vaccine 2000, 19, 618-622; Krieg Curropin Mol Ther 2001 3:15-24; Roman et al., Nat. Med., 1997, 3, 849-854; Weiner et αl., PNAS USA, 1997, 94, 10833-10837; Davis et al, J. Immunol, 1998, 160, 870-876; Chu et αl., J. Exp.Med, 1997, 186, 1623-1631; Lipford et al, Ear. J. Immunol., 1997, 1623-1631; Lipford etal, Ear. J. Immunol., 1997, 27, 2340-2344; Moldoveami el al., Vaccine, 1988, 16, 1216-1224, Krieg etal., Nature, 1995, 374, 546-549; Klinman et al., PNAS USA, 1996, 93, 2879-2883; Ballas et al, J. Immunol, 1996, 157, 1840-1845; Cowdery etal, J. Immunol, 1996, 156, 4570-4575; Halpern etal, Cell Immunol, 1996, 167, 72-78; Yamamoto et al, Jpn. J. Cancer Res., 1988, 79, 866-873; Stacey et al, J. Immunol., 1996, 157, 2116-2122; Messina et al, J. Immunol, 1991, 147, 1759-1764; Yi et al, J. Immunol, 1996, 157, 4918-4925; Yi et al, J. Immunol, 1996, 157, 5394-5402; Yi et al, J. Immunol, 1998, 160, 4755-4761; и Yi et al, J. Immunol, 1998, 160, 5898-5906; международные патентные заявки WO 96/02555, WO 98/16247, WO 98/18810, WO 98/40100, WO 98/55495, WO 98/37919 и W098/52581], т.е. содержащие по меньшей мере один CG динуклеотид, где цитозин не метилирован; (8) полиоксиэтиленовый простой эфир или полиоксиэтиленовый сложный эфир, например, WO 99/52549; (9) поверхностно-активное вещество полиоксиэтиленсорбитана сложный эфир в комбинации с октоксинолом (WO 01/21207) или поверхностно-активное вещество полиоксиэтиленалкиловый простой эфир или сложный эфир в комбинации с по меньшей мере одним дополнительным неионным поверхностно-активным веществом, таким как октоксинол (WO 01/21152); (10) сапонин и иммуностимулирующий олигонуклеотид (например, CpG олигонуклеотид) (WO 00/62800); (11) иммуностимулятор и частица соли металла, например, WO 00/23105; (12) сапонин и эмульсия масло-в-воде, например, WO 99/11241; (13) сапонин (например, QS21) + 3dMPL + IM2 (возможно + стирол), например, WO 98/57659; (14) другие вещества, которые действуют в качестве иммуностимулирующих агентов для увеличения эффективности композиции, такие как мурамилпептиды, включающие N-ацетил-мурамил-L-треонил-D-изоглутамин (thr-MDP), N-25 ацетил-нор мурамил-L-аланил-D-изоглутамин (нор-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин МТР-РЕ), (15) лиганды для Тоll-подобных рецепторов (ТLR), природных или синтезированных (например, как описано в Kanzler et al 2007, Nature Medicine 13, p1552-9), включая TLR3 лиганды, такие как поли I:С и сходные соединения, такие как Hiltonol и Ampligen.
В воплощении иммуногенная композиция по настоящему изобретению содержит по меньшей мере один адъювант. В конкретном воплощении указанный адъювант представляет собой иммуностимулирующий олигонуклеотид и более предпочтительно CpG олигонуклеотид. В воплощении CpG олигонуклеотид имеет последовательность нуклеиновой кислоты 5' TCGTCGTTTTTCGGTGCTTTT 3' (ODN CpG 24555; SEQ ID NO: 431). Последовательность нуклеиновой кислоты иммуностимулирующего олигонуклеотида SEQ ID NO: 431 отличается от предварительно описанного иммуностимулирующего олигонуклеотида (ODN 10103) 5' TCGTCGTTTTTGGTCGTTTT 3' (SEQ ID NO: 432) реверсией 3' большей части CG динуклеотида. Сходство активности между этими двумя иммуностимулирующими олигонуклеотидами является неожиданным, так как ранее сообщалось, что иммуностимулирующая активность CpG олигонуклеотидов зависит от числа CpG-мотивов, последовательностей, фланкирующих CG динуклеотид, локализации СрG-мотива(ов) и расстояния между CpG-мотивами (Ballas et al., 1996, J. Immunol.; Hartmann et al., 2000, J. Immunol.; Klinman et al., 2003, Clin. Exp. Immunol.). Удаление З' большей части CG динукпеотида в иммуностимулирующем олигонуклеотиде CpG ODN 24555 (SEQ ID NO: 431) не привело к отрицательному влиянию на способность этого иммуностимулирующего олигонуклеотида увеличивать антиген-специфические иммунные ответы, как можно было бы ожидать из предыдущих описаний. CpG ODN 24555 продемонстрировал сходную и в некоторых случаях повышенную иммуностимулирующую активность по сравнению с CpG ODN 10103.
Иммуностимулирующий олигонуклеотид может быть двухцепочечным или одноцепочечным. Как правило, двухцепочечные молекулы являются более стабильными in vivo, тогда как одноцепочечные молекулы имеют повышенную иммунную активность. Таким образом, в некоторых аспектах изобретения предпочтительно, чтобы нуклеиновая кислота была одноцепочечной, а в других аспектах предпочтительно, чтобы нуклеиновая кислота была двухцепочечной.
Термины "нуклеиновая кислота" и "олигонуклеотид" используются в данной заявке взаимозаменяемо для обозначения многочиленных нуклеотидов (т.е. молекул, содержащих сахар (например, рибозу или дезоксирибозу), связанный с фосфатной группой и с обмениваемым органическим основанием, которое представляет собой либо замещенный пиримидин (например, цитозин (С), тимидин (Т) или урацил (U)), либо замещенный пурин (например, аденин (А) или гуанин (G)). Используемые в данной заявке термины относятся к олигорибонуклеотидам (т.е. полинуклеотид без фосфатной группы) и любому другому полимеру, содержащему органическое основание. Молекулы нуклеиновых кислот могут быть получены из существующих источников нуклеиновых кислот (например, геномной ДНК или кДНК), но являются предпочтительно синтетическими (например, полученными в результате синтеза нуклеиновой кислоты).
В воплощении иммуностимулирующие олигонуклеотиды могут охватывать различные химические модификации и замены по сравнению с природными РНК и ДНК, содержащими фосфодиэфирный межнуклеозидный мостик, β-D-рибозу и/или природное нуклеозидное основание (аденин, гуанин, цитозин, тимин, урацил). Примеры химических модификаций известны специалисту и описаны, например, в Uhlmann E. et al. (1990), Chem. Rev. 90:543; "Protocols for Oligonucleotides and Analogs" Synthesis and Properties & Synthesis and Analytical Techniques, S. Agrawal, Ed., Humana Press, Totowa, USA 1993; Crooke, S.T. et al. (1996) Annu. Rev. Pharmacol. Toxicol. 36:107-129; и HunzikerJ. et al., (1995), Mod. Synth. Methods 7: 331-417. Олигонуклеотид согласно изобретению может иметь одну или более модификаций, где каждая модификация локализована в конкретном фосфодиэфирном межнуклеозидном мостике и/или в конкретном β-D-рибозном звене и/или в конкретном положении природного нуклеозидного основания по сравнению с олигонуклеотидом с такой же последовательностью, которая состоит из природных ДНК или РНК.
Например, олигонуклеотиды могут содержать одну или более модификаций. Такие модификации могут быть выбраны из: а) замены фосфодиэфирного межнуклеозидного мостика, локализованного на 3'- и/или 5'-конце нуклеозида, модифицированным межнуклеозидным мостиком, б) замены фосфодиэфирного мостика, локализованного на 3'- и/или 5'-конце нуклеозида, дефосфорилированным мостиком, в) замены сахарофосфатного звена из сахарофосфатного скелета другим звеном, г) замены β-D-рибозного звена модифицированной сахарным звеном и д) замены природного нуклеозидного основания.
Нуклеиновые кислоты также включают замещенные пурины и пиримидины, такие как С-5-пропин-пиримидин и 7-деаза-7-замещенные пуриновые модифицированные основания (Wagner et al., 1996, Nat. Biotechnol. 14:840-4). Пурины и пиримидины включают, но не ограничиваются этим, аденин, цитозин, гуанин, тимидин, 5-метилцитозин, 2-аминопурин, 2-амино-6-хлоропурин, 2,6-диаминопурин, гипоксантин и другие природные и неприродные нуклеиновые основания, замещенные и незамещенные ароматические группировки. Другие такие модификации хорошо известны специалистам в данной области.
Модифицированное основание представляет собой любое основание, которое химически отличается от встречающихся в природе оснований, обычно обнаруживаемых в ДНК и РНК, таких как Т, С, G, А и U, но которые имеют общие основные химические структуры с этими встречающимися в природе основаниями. Модифицированное нуклеозидное основание может быть выбрано, например, из гипоксантина, урацила, дигидроурацила, псевдоурацила, 2-тиоурацила, 4-тиоурацила, 5-аминоурацила, 5-(С1-С6)-алкилурацила, 5-(С2-С6)-алкенилурацил, 5-(С2-С6)-алкинилурацила, 5-(гидроксиметил)урацила, 5-хлорурацила, 5-фторурацила, 5-бромурацила, 5-гидроксицитозина, 5-(С1-С6)-алкилцитозина, 5-(С2-С6)-алкенилцитозина, 5-(С2-С6)-алкинилцитозина, 5-хлорцитозина, 5-фторцитозина, 5-бромцитозина, N2-диметилгуанина, 2,4-диамино-пурина, 8-азапурина, замещенного 7-деазапурина, предпочтительно 7-деаза-7-замещенного и/или 7-деаза-8-замещенного пурина, 5-гидроксиметилцитозина, N4-алкилцитозина, например N4-этилцитозина, 5-гидроксидезоксицитидина, 5-гидроксиметилдезоксицитидина, N4-алкилдезоксицитидина, например N4-этилдезоксицитидина, 6-тиодезоксигуанозина и дезоксирибонуклеозидов нитропиррола, С5-пропинилпиримидина и диаминопурина, например 2,6-диаминопурина, инозина, 5-метилцитозина, 2-аминопурина, 2-амино-6-хлорпурина, гипоксантина или других модификаций природного нуклеозидного основания. Предполагают, что этот перечень является примерным и не должен рассматриваться в качестве ограничивающего.
В некоторых аспектах изобретения CpG динуклеотид иммуностимулирующих олигонуклеотидов, описанных в данной заявке, предпочтительно не метилирован. Неметилированный CpG-мотив представляет собой последовательность динуклеотида неметилированный цитозин-гуанин (т.е. неметилированный 5'-цитозин с последующим 3'-гуанозином и связанный фосфатной связью). В других аспектах CpG-мотивы метилированы. Метилированный CpG-мотив представляет собой последовательность динуклеотида метилированный цитозин-гуанин (т.е. метилированный 5'-цитозин с последующим 3'-гуанозином и связанный фосфатной связью).
В некоторых аспектах изобретения иммуностимулирующий олигонуклеотид может содержать модифицированный цитозин. Модифицированный цитозин представляет собой природный или неприродный аналог пиримидинового основания цитозина, который может заменять это основание без снижения иммуностимулирующей активности олигонуклеотида. Модифицированные цитозины включают, но не ограничиваются этим, 5-замещенные цитозины (например, 5-метил-цитозин, 5-фтор-цитозин, 5-хлор-цитозин, 5-бром-цитозин, 5-йод-цитозин, 5-гидрокси-цитозин, 5-гидроксиметил-цитозин, 5-дифторметил-цитозин и незамещенный или замещенный 5-алкинил-цитозин), 6-замещенные цитозины, N4-замещенные цитозины (например, N4-этил-цитозин), 5-аза-цитозин, 2-меркапто-цитозин, изоцитозин, псевдо-изоцитозин, аналоги цитозина с системами конденсированных колец (например, N,N'-пропилен-цитозин или феноксазин) и урацил и его производные (например, 5-фтор-урацил, 5-бром-урацил, 5-бромвинил-урацил, 4-тио-урацил, 5-гидрокси-урацил, 5-пропинил-урацил). Некоторые предпочтительные цитозины включают 5-метил-цитозин, 5-фтор-цитозин, 5-гидрокси-цитозин, 5-гидроксиметил-цитозин и N4-этил-цитозин. В другом воплощении изобретения основание цитозина замещено универсальным основанием (например, 3-нитропирролом, Р-основанием), ароматической кольцевой системой (например, фторбензолом или дифторбензолом) или атомом водорода (dSpacer).
В некоторых аспектах изобретения иммуностимулирующий олигонуклеотид может содержать модифицированный гуанин. Модифицированный гуанин представляет собой природный или неприродный аналог пиримидинового основания гуанина, который может заменять это основание без снижения иммуностимулирующей активности олигонуклеотида. Модифицированные гуанины включают, но не ограничиваются этим,7-деазагуанин, 7-деаза-7-замещенный гуанин, гипоксантин, N2-замещенные гуанины (например, N2-метил-гуанин), 5-амино-3-метил-3Н,6Н-тиазоло[4,5-d]пиримидин-2,7-дион, 2,6-диаминопурин, 2-аминопурин, пурин, индол, аденин, замещенные аденины (например, N6-метил-аденин, 8-оксо-аденин), 8-замещенный гуанин (например, 8-гидроксигуанин и 8-бромгуанин) и 6-тиогуанин. В другом воплощении изобретения основание гуанина замещено универсальным основанием (например, 4-метил-индолом, 5-нитро-индолом и К-основанием), ароматической кольцевой системой (например, бензимидазолом или дихлор-бензимидазолом, амидом 1-метил-1Н-[1,2,4]триазол-3-карбоновой кислоты) или атомом водорода (dSpacer).
В некоторых аспектах олигонуклеотиды могут включать модифицированные межнуклеотидные связи. Эти модифицированные связи могут быть частично устойчивыми к деградации (например, стабилизированными). "Стабилизированная молекула нуклеиновой кислоты" означает молекулу нуклеиновой кислоты, которая является относительно устойчивой к деградации in vivo (например, посредством экзо- или эндо-нуклеазы). Стабилизация может зависеть от длины вторичной структуры. Нуклеиновые кислоты, имеющие длину десятки и сотни тысяч пар оснований, являются относительно устойчивыми к деградации in vivo. Для более коротких нуклеиновых кислот вторичная структура может стабилизировать и увеличивать их эффект. Формирование структуры "стебель-петля" может стабилизировать молекулу нуклеиновой кислоты. Например, если 3'-конец нуклеиновой кислоты имеет самокомплементарность к выше лежащей области, так что он может складываться назад и образовывать структуру "стебель-петля", то нуклеиновая кислота может стать стабилизированной и проявлять большую активность.
Стабилизация нуклеиновой кислоты также может быть выполнена с помощью модификаций фосфатного остова. Олигонуклеотиды, имеющие фосфоротиоатные связи, в некоторых воплощениях могут обеспечивать максимальную активность и защищать олигонуклеотид от деградации внутриклеточными экзо- и эндонуклеазами.
Для применения in vivo, нуклеиновые кислоты являются предпочтительно относительно устойчивыми к деградации (например, эндо- и экзонуклеазами). Было показано, что модификация скелета нуклеиновой кислоты обеспечивает повышенную активность нуклеиновой кислоты при введении in vivo. Вторичные структуры, такие как стебель-петля, могут стабилизировать нуклеиновые кислоты против деградации. Альтернативно, стабилизации нуклеиновой кислоты можно достичь посредством модификаций фосфатного остова. Предпочтительная стабилизированная нуклеиновая кислота имеет по меньшей мере частичный, модифицированный фосфоротиоатами остов. Фосфоротиоаты можно химически синтезировать с использованием автоматизированных методов, использующих фосфорамидатную или Н-фосфонатную химию. Арил-и алкил-фосфонаты могут быть получены, например, как описано в патенте США №4469863; и алкилфосфотриэфиры (в которых заряженная кислородная группировка алкилирована, как описано в патенте США №5023243 и европейском патенте №092574) могут быть получены посредством автоматизированного твердофазного синтеза с использованием имеющихся в продаже реагентов. Способы получения других модификаций и замен в остове ДНК были описаны (Uhlmann, E. and Peyman, A. (1990) Chem. Rev. 90:544; Goodchild, J. (1990) Bioconjugate Chem. 1:165). 2'-O-метил-нуклеиновые кислоты с CpG-мотивами также вызывают иммунную активацию, как и этокси-модифицированные CpG нуклеиновые кислоты. Фактически, не было обнаружено никаких модификаций остова, которые полностью отменяют CpG эффект, хотя он значительно уменьшается в результате замены С на 5-метил-С. Конструкции, имеющие фосфоротиоатные связи, обеспечивают максимальную активность и защищают нуклеиновую кислоту от деградации внутриклеточными экзо- и эндонуклеазами. Другие модифицированные нуклеиновые кислоты включают фосфодиэфирные модифицированные нуклеиновые кислоты, комбинации фосфодиэфирной и фосфоротиоатной нуклеиновой кислоты, метилфосфонат, метилфосфоротиоат, фосфородитиоат, п-этокси и их комбинации. Каждая из этих комбинаций и их конкретные эффекты на иммунные клетки подробно описаны в отношении CpG нуклеиновых кислот в РСТ опубликованных патентных заявках PCT/US95/01570 (WO 96/02555) и PCT/US97/19791 (WO 98/18810) и в патентах US 6194388 В1, опубликованном 27 февраля 2001 г., и US 6239116 В1, опубликованном 29 мая 2001 г., полное содержание которых включено в данную заявку посредством ссылки. Считается, что эти модифицированные нуклеиновые кислоты могут демонстрировать большую стимулирующую активность благодаря повышенной устойчивости к нуклеазам, увеличенному клеточному поглощению, повышенному связыванию с белками и/или измененной внутриклеточной локализации.
Для введения in vivo, нуклеиновые кислоты могут быть ассоциированы с молекулой, что приводит к связыванию с более высокой аффинностью с поверхностями клеток-мишеней (например, дендритных клеток, В-клеток, моноцитов и натуральных киллеров (NK)) и/или увеличенному клеточному поглощению клетками-мишенями с образованием "комплекса для доставки нуклеиновой кислоты". Нуклеиновые кислоты могут быть связаны ионными или ковалентными связями с соответствующими молекулами с использованием методов, которые хорошо известны в данной области. Могут быть использованы разнообразные связывающие или поперечно-сшивающие агенты, например, белок А, карбодиимид и N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP). Нуклеиновые кислоты также могут быть инкапсулированы в липосомы или виросомы с использованием хорошо известных методов.
Другие стабилизированные нуклеиновые кислоты включают, но не ограничиваются этим, неионные аналоги ДНК, такие как алкил- и арил-фосфаты (в которых заряженный фосфонатный кислород заменен алкильной или арильной группой), фосфодиэфир и алкилфосфотриэфиры, в которых заряженная кислородная группировка алкилирована. Было также показано, что нуклеиновые кислоты, которые содержат диол, такие как тетраэтиленгликоль или гексаэтиленгликоль, на одном или обоих концах, в значительной степени устойчивы к деградации нуклеазами. В некоторых воплощениях иммуностимулирующий олигонуклеотид по изобретению может включать по меньшей мере один липофильный замещеный нуклеотидный аналог и/или пиримидин-пуриновый динуклеотид.
Олигонуклеотиды могут иметь один или два доступных 5'-конца. Можно создать модифицированные олигонуклеотиды, имеющие два таких 5'-конца, например, путем присоединения двух олигонуклеотидов через 3'-3'-связь с образованием олигонуклеотида, имеющего один или два доступных 5'-конца. 3'3'-Связь может представлять собой фосфодиэфирный, фосфоротиоатный или любой другой модифицированный межнуклеозидный мостик. Способы получения таких связей известны в данной области. Например, такие связи были описаны в Seliger, H. et al., Oligonucleotide analogs with terminal 3'-3' - and 5'5'-internucleotidic linkages as antisense inhibitors of viral gene expression, Nucleosides & Nucleotides (1991), 10(1-3), 469-77 и Jiang, et al., Pseudo-cyclic oligonucleotides: in vitro and in vivo properties, Bioorganic & Medicinal Chemistry (1999), 7(12), 2727-2735.
Кроме того, 3'3'-связанные ODNs, где связь между 3'-концевыми нуклеозидами не является фосфодиэфирным, фосфоротиоатным или другим модифицированным мостиком, могут быть получены с использованием дополнительного спейсера, такого как три- или тетра-этиленгликолевая фосфатная группировка (Durand, M. et al., Triple-helix formation by an oligonucleotide containing one (dA)12 and two (dT)12 sequences bridged by two hexaethylene glycol chains, Biochemistry (1992), 31(38), 9197-204, патент США №5658738 и патент США №5668265)). Альтернативно, ненуклеотидный линкер может быть получен из этандиола, пропандиола или из дезоксирибозного звена, лишенного азотистого основания (dSpacer) (Fontanel, Marie Laurence et al., Sterical Recognition by T4 polynucleotide kinase of non-nucleosidic moieties 5'-attached to oligonucleotides; Nucleic Acids Research (1994), 22(11), 2022-7), с использованием стандартной фосфорамидитной химии. Ненуклеотидные линкеры можно встроить один или несколько раз или объединить друг с другом, обкспечивая любое желательное расстояние между 3'-концами двух ODNs, которые подлежат соединению.
Фосфодиэфирный межнуклеозидный мостик, локализованный на 3'- и/или 5'-конце нуклеозида, можно заменить модифицированным межнуклеозидным мостиком, где модифицированные межнуклеозидный мостик выбран, например, из фосфоротиоатного, фосфородитионатного, NR1R2-фосфорамидатного, боранофосфатного, α-гидроксибензилфосфонатного, фосфат-(С1-С21)-O-алкилового сложноэфирного, фосфат-[(С6-С12)арил-(С1-С21)-O-алкил]сложноэфирного, (С1-С8)алкилфосфонатного и/или (С6-С12)арилфосфонатного мостиков, (С7-С12)-α-гидроксиметил-арила (например, раскрытого в WO 95/01363), где (С6-С12)арил, (С6-С20)арил и (С6-С14)арил возможно замещены галогеном, алкилом, алкокси, нитро, циано и, если R1 и R2 не зависят друг от друга, водородом, (С1-С18)-алкилом, (С6-С20)-арилом, (С6-С14)-арилом, (С1-С8)-алкилом, предпочтительно водородом, (С1-С8)-алкилом, предпочтительно (С1-С4)-алкилом и/или метоксиэтилом, или R1 и R2 образуют вместе с атомом азота, несущим их, 5-6-членное гетероциклическое кольцо, которое может дополнительно содержать дополнительный гетероатом из группы О, S и N.
Замена фосфодиэфирного мостика, локализованного на 3'- и/или 5'-конце нуклеозида, дефосфо-мостиком (дефосфо-мостики описаны, например, в Uhlmann E. and Peyman A. in "Methods in Molecular Biology", Vol. 20, "Protocols for Oligonucleotides and Analogs", S. Agrawal, Ed., Humana Press, Totowa 1993, Chapter 16, pp.355 ff), где дефосфо-мостик выбран, например, из дефосфо-мостиков формацетальных, 3'-тиоформацетальных, метилгидроксиаминных, оксимных, метилендиметил-гидразо, диметиленсульфоновых и/или силильных групп.
Иммуностимулирующие олигонуклеотиды по изобретению возможно могут иметь химерные остовы. Химерный остов представляет собой остов, который содержит более чем из один тип связи. В одном из воплощений химерный остов может быть представлен формулой: 5' Y1N1ZN2Y2 3'. Y1 и Y2 представляют собой молекулы нуклеиновой кислоты, имеющие от 1 до 10 нуклеотидов. Каждый из Y1 и Y2 включает по меньшей мере одну модифицированную межнуклеотидную связь. Поскольку по меньшей мере 2 нуклеотида химерных олигонуклеотидов включают модификации остова, эти нуклеиновые кислоты представляют собой пример одного типа "стабилизированных иммуностимулирующих нуклеиновых кислот".
Что касается химерных олигонуклеотидов, то Y1 и Y2 рассматриваются независимо друг от друга. Это означает, что каждый из Y1 и Y2 может иметь или не иметь отличные друг от друга последовательности и отличные друг от друга связи в остове в одной и той же молекуле. В некоторых воплощениях Y1 и/или Y2 имеют от 3 до 8 нуклеотидов. N1 и N2 представляют собой молекулы нуклеиновой кислоты, имеющие от 0 до 5 нуклеотидов, при условии, что N1ZN2 имеет по меньшей мере 6 нуклеотидов в общей сложности. Нуклеотиды N1ZN2 имеют фосфодиэфирный остов и не включают нуклеиновые кислоты, имеющие модифицированный остов. Z представляет собой мотив иммуностимулирующей нуклеиновой кислоты, предпочтительно выбранный из мотивов, указанных в данной заявке.
Центральные нуклеотиды (N1ZN2) формулы Y1N1ZN2Y2 имеют фосфодиэфирные межнуклеотидные связи, и Y1 и Y2 имеют по меньшей мере одну, но могут иметь более чем одну и даже могут иметь все модифицированные межнуклеотидные связи. В предпочтительных воплощениях Y1 и/или Y2 имеют по меньшей мере две или от двух до пяти модифицированных межнуклеотидных связей, или Y1 имеет пять модифицированных межнуклеотидных связей, и Y2 имеет две модифицированные межнуклеотидные связи. Модифицированная межнуклеотидная связь в некоторых воплощениях представляет собой фосфоротиоатную модифицированную связь, фосфородитионатную связь или п-этокси-модифицированную связь.
Нуклеиновые кислоты также включают нуклеиновые кислоты, имеющие сахара в остове, которые ковалентно присоединены к низкомолекулярным органическим группам, отличным от гидроксильной группы в положении 2' и отличным от фосфатной группы в положении 5'. Таким образом, модифицированные нуклеиновые кислоты могут включать 2'-O-алкилированную рибозную группу. Кроме того, модифицированные нуклеиновые кислоты могут включать сахара, такие как арабиноза или 2'-фторарабиноза, вместо рибозы. Таким образом, нуклеиновые кислоты могут быть гетерогенными по составу остова, причем содержат любую возможную комбинацию полимерных звеньев, связанных друг с другом, такую как пептид-нуклеиновые кислоты (которые имеют аминокислотный остов с основаниями нуклеиновой кислоты). В некоторых воплощениях нуклеиновые кислоты являются гомогенными по составу остова.
Сахарофосфатное звено (т.е. β-D-рибозу и фосфодиэфирный межнуклеозидный мостик, вместе образующие сахарофосфатное звено) из сахарофосфатного остова (т.е. сахарофосфатный остов состоит из сахарофосфатных звеньев) можно заменить другим звеном, где другое звено подходит, например, для создания "морфолино-производного" олигомера (как описано, например, в Stirchak E.P. et al. (1989) Nucleic Acid Res. 17:6129-41), т.е., например, замена морфолино-производным; или создать полиамидную нуклеиновую кислоту ("ПНК"; как описано, например, в Nielsen Р.E. et al. (1994) Bioconjug. Chem. 5:3-7), т.е., например, замена звеном ПНК-остова, например, 2-аминоэтилглицином. Олигонуклеотид может иметь другие модификации и замены в углеводном остове, такие как пептидные нуклеиновые кислоты с фосфатными группами (PHONA), блокированные нуклеиновые кислоты (LNA от англ. locked nucleic acids) и олигонуклеотиды, имеющие фрагметы остова с алкильными линкерами или амино линкерами. Алкильный линкер может быть разветвленным или неразветвленным, замещенным или незамещенным, хирально чистым или представлять собой рацемическую смесь.
β-Рибозное звено или β-D-2'-дезоксирибозное звено можно заменить модифицированным сахарным звеном, где указанное модифицированное сахарное звено выбрано, например, из β-D-рибозы, α-D-2'-дезоксирибозы, L-2'-дезоксирибозы, 2'-F-2'-дезоксирибозы, 2'-F-арабинозы, 2'-O-(С1-С6)алкил-рибозы, предпочтительно 2'-O-(С1-С6)-алкил-рибоза представляет собой 2'-O-метилрибозу, 2'-O-(С1-С6)алкенил-рибозу, 2'-[O-(С1-С6)алкил-O-(С1-С6)алкил]-рибозу, 2'-NН2-2'-дезоксирибозу, β-D-ксило-фуранозу, а-арабинофуранозу, 2,4-дидезокси-β-D-эритро-гексо-пиранозу и карбоциклические аналоги (описанные, например, в Froehler J. (1992) Am. Chem. Soc. 114:8320) и/или сахарные аналоги с открытой цепью (описанные, например, в Vandendriessche et al. (1993) Tetrahedron 49:7223) и/или бициклосахарные аналоги (описанные, например, в Tarkov M. et al. (1993) Helv. Chim. Acta. 76:481).
В некоторых воплощениях сахар представляет собой 2'-O-метилрибозу, в частности, для одного или обоих нуклеотидов, связанных фосфодиэфирной или фосфодиэфир-подобной межнуклеозидной связью.
Олигонуклеотиды по изобретению могут быть синтезированы cte novo с использованием любой из множества процедур, хорошо известных в данной области. Например, b-цианоэтилфосфорамидитный способ (Beaucage, S.L., and Caruthers, M.H., (1981) Tet. Let. 22:1589); нуклеозид Н-фосфонатный способ (Garegg et al., (1986) Tet. Let. 27: 4051-4054; Froehler et al., (1986) Nucl. Acid Res. 14: 5399-5407; Garegg et al., (1986) 27: 4055-4058; Gaffney et al., (1988) Tet. Let. 29: 2619-2622). Эти химические синтезы можно выполнить с помощью различных автоматизированных синтезаторов нуклеиновых кислот, имеющихся в продаже. Такие олигонуклеотиды называются синтетическими олигонуклеотидами. Альтерантивно, Т-богатые и/или TG динуклеотиды можно производить в большом масштабе в плазмидах (см. Sambrook Т. et al., "Molecular Cloning: A Laboratory Manual", Cold Spring Harbor laboratory Press, New York, 1989) и разделять на небольшие части или вводить целыми. Нуклеиновые кислоты могут быть получены из существующих последовательностей нуклеиновых кислот (например, геномной или кДНК) с использованием известных методов, таких как методы с использованием рестриктазГ -экзонуклеаз-или-эндонуклеаз.
Модифицированные остовы, такие как фосфоротиоаты, могут быть синтезированы с использованием автоматизированных методов, в которых используют фосфорамидатную или Н-фосфонатную химию. Арил- и алкил-фосфонаты могут быть получены, например, как описано в патенте США №4469863, и алкилфосфотриэфиры (в которых заряженная кислородная группировка алкилирована, как описано в патенте США №5023243) могут быть получены посредством автоматизированного твердофазного синтеза с использованием имеющихся в продаже реагентов. Способы получения других модификаций и замен в остове ДНК были описаны (например, Uhlmann, E. and Peyman, A., Chem. Rev.90:544, 1990; Goodchild, J., Bioconjugate Chem. 1:165, 1990).
Нуклеиновые кислоты, полученные таким образом, называют выделенной нуклеиновой кислотой. "Выделенная нуклеиновая кислота" обычно относится к нуклеиновой кислоте, которая отделена от компонентов, с которыми она выделяется из клетки, из ядра, из митохондрий или из хроматина и любых других компонентов, которые можно рассматривать как загрязняющие вещества.
В воплощении иммуногенная композиция по настоящему изобретению содержит по меньшей мере один адъювант, который представляет собой CpG олигонуклеотид, CpG олигонуклеотиды были описаны в различных опубликованных патентах, опубликованных патентных заявках и других публикациях, включая патенты США №№6194388; 6207646; 6214806; 6218371; 6239116 и 6339068.
Были идентифицированы различные классы CpG иммуностимулирующих олигонуклеотидов. Они упоминаются как класс А, В, С и Р и описаны более подробно ниже. Способы и композиции по изобретению охватывают применение этих различных классов CpG иммуностимулирующих олигонуклеотидов.
Любой из классов может быть подвергнут Е-модификации, которая увеличивает его эффективность. Е-модификация может представлять собой замещение 5'-концевого нуклеотида галогеном; примеры таких замещений включают, но не ограничиваются этим, замещения бром-уридином или йод-уридином. Е-модификация также может включать зaмeщение 5'-кoнцeвoгo нуклеотида этил-уридинем.
CpG иммуностимулирующие олигонуклеотиды "класса А" функционально характеризуются способностью индуцировать высокие уровни интерферона-альфа (IFN-α) из плазмоцитоидных дендритных клеток (pDC) и вызывать активацию NК-клеток, оказывая минимальные эффекты на активацию В-клеток.
С точки зрения структуры, этот класс обычно имеет стабилизированные поли-G последовательности на 5'- и 3'-концах. Он также имеет палиндромную фосфодиэфирную CpG динуклеотид-содержащую последовательность по меньшей мере из 6 нукпеотидов, например, но не обязательно, он содержит один из следующих гексамерных палиндромов: GACGTC, AGCGCT или AACGTT, описанных Yamamoto с соаторами. Yamamoto S et al. J. Immunol 148: 4072-6 (1992). CpG иммуностимулирующие олигонуклеотиды класса А и типичных последовательности этого класса были описаны в непредварительной патентной заявке США, серийный №09/672126, и опубликованной РСТ заявке PCT/USOO/26527 (WO 01/22990), которые обе поданы 27 сентября 2000 г.
В воплощении CpG олигонуклеотид "класса А" по изобретению имеет следующую последовательность нуклеиновой кислоты: 5' GGGGACGACGTCGTGGGGGGG 3' (SEQ ID NO: 440).
Некоторые неограничивающие примеры олигонуклеотидов А-класса включают:
5' G*G*G_G_A_C_G_A_C_G_T_C_G_T_G_G*G*G*G*G*G 3'; где * относится к фосфоротиоатной связи, и _ относится к фосфодиэфирной связи.
CpG иммуностимулирующие олигонуклеотиды "класса В" функционально характеризуются способностью активировать В-клетки и pDC, за исключением относительно слабой индукции IFN-α и активации NК-клеток. С точки зрения структуры, этот класс обычно может быть полностью стабилизирован фосфоротиоатными связями, но он также может иметь одну или более фосфодиэфирных связей, предпочтительно между цитозином и гуанином CpG-мотива(ов), в этом случае молекула называется полужесткой (semi-soft). В одном из воплощений CpG олигонуклеотид по настоящему изобретению представляет собой CpG олигонуклеотида класса В, представленный по меньшей мере формулой:
5' X1X2CGX3X4 3', где X1, Х2, Х3 и X4 являются нуклeотидами из воплощений X2 представляет собой аденин, гуанин или тимин. В другом воплощении Х3 представляет собой цитозин, аденин или тимин.
В другом воплощении CpG олигонуклеотид по настоящему изобретению представляет собой CpG олигонуклеотид В класса, представленный по меньшей мере формулой:
5' N1X1X2CGX3X4N2 3', где X1, X2, Х3 и Х4 являются нуклеотидами, и N представляет собой любой нуклеотид, и N1 и N2 представляют собой последовательности нуклеиновой кислоты, состоящие из примерно 0-25 нуклеотидов каждая. В одном воплощении X1X2 представляет собой динуклеотид, выбранный из группы, состоящей из GpT, GpG, GpA, ApA, ApT, ApG, CpT, CpA, CpG, TpA, ТрТ и TpG; и Х3Х4 представляет собой динуклеотид, выбранный из группы, состоящей из ТрТ, ApT, TpG, ApG, CpG, ТрС, АрС, СрС, TpA, ApA и CpA. Предпочтительно, X1X2 представляет собой GpA или GpT, и Х3Х4 представляет собой ТрТ. В других воплощениях X1 или X2, или оба представляют собой пурины, и Х3 или Х4, или оба представляют собой пиримидины, или X1X2 представляет собой GpA, и Х3 или Х4, или оба представляют собой пиримидины. В одном предпочтительном воплощении X1X2 представляет собой динуклеотид, выбранный из группы, состоящей из TpA, ApA, АрС, ApG и GpG. В еще одном воплощении Х3Х4 представляет собой динуклеотид, выбранный из группы, состоящей из ТрТ, TpA, TpG, ApA, ApG, GpA и CpA. В другом воплощении X1X2 представляет собой динуклеотид, выбранный из группы, состоящей из ТрТ, TpG, ApT, GpC, СрС, CpT, ТрС, GpT и CpG; Х3 представляет собой нуклеотид, выбранный из группы, состоящей из А и Т, и Х4 представляет собой нуклеотид, но когда X1X2 представляет собой ТрС, GpT или CpG, тогда Х3Х4 не является ТрС, ApT или АрС.
В другом предпочтительном воплощении CpG олигонуклеотид имеет последовательность 5' TCN1TX1X2CGX3X4 3'. CpG олигонуклеотиды по изобретению в некоторых воплощениях включают X1X2, выбранный из группы, состоящей из GpT, GpG, GpA и ApA, и Х3Х4, выбранный из группы, состоящей из ТрТ, CpT и ТрС.
CpG олигонуклеотидные последовательности класса В по изобретению в общих чертах описаны выше, а также раскрыты в опубликованных РСТ патентных заявках PCT/US95/01570 и PCT/US97/19791 и в US 6194388, 6207646, 6214806, 6218371, 6239116 и 6339068. Tипичныe пocлeдoвaтeльнocти включают но не ограничиваются этим, последовательности, раскрытые в этих последних заявках и патентах.
В воплощении CpG олигонуклеотид "класса В" по изобретению имеет следующую последовательность нуклеиновой кислоты:
5' TCGTCGTTTTTCGGTGCTTTT 3' (SEQ ID NO: 431), или
5' TCGTCGTTTTTCGGTCGTTTT 3' (SEQ ID NO: 432), или
5' TCGTCGTTTTGTCGTTTTGTCGTT 3' (SEQ ID NO: 433), или
5' TCGTCGTTTCGTCGTTTTGTCGTT 3' (SEQ ID NO: 441), или
5' TCGTCGTTTTGTCGTTTTTTTCGA 3' (SEQ ID NO: 442).
В любой из этих последовательностей все связи могут быть фосфоротиоатными связями. В другом воплощении в любой из этих последовательностей одна или более связей могут быть фосфодиэфирными, предпочтительно между "С" и "G" CpG-мотива, образуя полужесткий CpG олигонуклеотид. В любой из этих последовательностей 5'-Т может заменить на этил-уридин или галоген; примеры замещений галогеном включают, но не ограничиваются этим, замещения бром-уридином или йод-уридином.
Некоторые неограничивающие примеры олигонуклеотидов В-класса включают:
5' T*C*G*T*C*G*T*T*T*T*T*C*G*G*T*G*C*T*T*T*T 3',
или 5' T*C*G*T*C*G*T*T*T*T*T*C*G*G*T*C*G*T*T*T*T 3',
или 5' T*C*G*T*C*G*T*T*T*T*G*T*C*G*T*T*T*T*G*T*C*G*T*T 3',
или 5' T*C*G*T*C*G*T*T*T*C*G*T*C*G*T*T*T*T*G*T*C*G*T*T 3',
или 5' T*C*G*T*C*G*T*T*T*T*G*T*C*G*T*T*T*T*T*T*T*C*G*A 3'.
где * относится к фосфоротиоатной связи.
CpG иммуностимулирующие олигонуклеотиды "класса С" функционально характеризуются способностью активировать В-клетки и NK-клетки и индуцировать IFN-α. С точки зрения структуры, этот класс обычно включает область с одним или более иммуностимулирующими CpG-мотивами класса В и GC-богатый палиндром или околопалиндромную область, которая позволяет молекулам образовывать вторичные (например, стебель-петля) или третичные (например, димерные) структуры. Некоторые из этих олигонуклеотидов имеют как традиционную "стимулирующую" CpG последовательность, так и "GC-богатый" или "нейтрализующий В-клетки" мотив. Этот олигонуклеотиды с комбинированным мотивом оказывают иммуностимулирующие эффекты, которые находятся где то между эффектами ассоциированными с традиционными CpG олигонуклеотидами класса В (т.е. сильную индукция активации В-клеток и активации дендритных клеток (DC)), и эффектами, ассоциированными с CpG ODN класса А (т.е. сильная индукция активации IFN-α и NK-клеток, но относительно слабая индукция В-клеток и активация DC). Krieg AM et al. (1995) Nature 374:546-9; Ballas ZK et al. (1996) J Immunol 157: 1840-5; Yamamoto S et al. (1992) J Immunol 148: 4072-6.
Класс С иммуностимулирующих олигонуклеотидов с комбинированным мотивом может иметь либо полностью стабилизированные (например, все фосфоротиоатные), химерные (фосфодиэфирная центральная область), либо полужесткие (например, фосфодиэфирные в пределах CpG-мотива) остовы. Этот класс был описан в заявке на патент США №10/224523, поданной 19 августа 2002 г.
Один стимулирующий домен или мотив CpG олигонуклеотида класса С определяется формулой: 5' X1DCGHX2 3'. D представляет собой нуклеотид, отличный от С. С представляет собой цитозин. G представляет собой гуанин. Н представляет собой нуклеотид, отличный от G. Х1 и Х2 представляют собой любую последовательность нуклеиновой кислоты длиной от 0 до 10 нуклеотидов. X1 может включать CG и в этом случае имеется предпочтительно Т, непосредственно предшествующий этому CG. В некоторых воплощениях DCG представляет собой TCG. X1 имеет длину предпочтительно от 0 до 6 нуклеотидов. В некоторых воплощениях X2 не содержит поли-G или поли-А мотивов. В других воплощениях иммуностимулирующий олигонуклеотид имеет поли-Т последовательность на 5'-конце или на 3'-конце. Как использовано в данной заявке, "поли- А" или "поли-Т" относится к отрезку из четырех или более последовательных А или Т, соответственно, например, 5' АААА 3' или 5' ТТТТ 3'. Как использовано в данной заявке, "поли-G конец" относится к отрезку из четырех или более последовательных G, например, 5' GGGG 3', находящихся на 5'-конце или 3'-конце нуклеиновой кислоты. Как использовано в данной заявке, "поли-G олигонуклеотид" относится к олигонуклеотиду, имеющему формулу 5' X1X2GGGX3X4 3', где X1, X2, Х3, и Х4 представляют собой нуклеотиды, и предпочтительно по меньшей мере один из Х3 и Х4 представляет собой G. Некоторые предпочтительные конструкции домена, стимулирующего В клетки согласно этой формуле содержат TTTTTCGT'TCGT'TTCGT'TTTCGT" TTTTCG, TCGT, TTCGT, TTTCGT, TCGTCGT.
Второй мотив CpG олигонуклеотида класса С называется либо Р, либо N и располагается непосредственно с 5' относительно X1 или непосредственно с 3'относительно Х2.
N представляет собой последовательность, нейтрализующую В-клетки, которая начинается с тринуклеотида CGG и имеет длину по меньшей мере 10 нуклеотидов. Мотив, нейтрализующий В-клетки, включает по меньшей мере одну CpG последовательность, в которой CG предваряется С или за которым следует G (Krieg AM et al. (1998) Proc NatI Acad Sd USA 95: 12631-12636) или представляет собой CG, содержащую ДНК последовательность, в которой С из CG метилирован. Нейтрализующие мотивы или последовательности имеют некоторую степень иммуностимулирующей способности, когда присутствуют, в другом нестимулирующем мотиве, но когда присутствуют в окружении других иммуностимулирующих мотивов, служат для уменьшения иммуностимулирующего потенциала этих других мотивов.
Р представляет собой GC-богатый палиндром, содержащий последовательность длиной по меньшей мере в 10 нуклеотидов.
Как использовано в данной заявке, "палиндром" и эквивалентно "палиндромная последовательность" относится к инвертированному повтору, т.е. к последовательности, такой как ABCDEE'D'C'B'A', в которой А и А', В и В' и т.д. являются основаниями, способными образовывать обычные пары оснований Уотсона и Крика.
Как использовано в данной заявке, "GC-богатый палиндром" относится к палиндрому, имеющему состав оснований из по меньшей мере двух третей G и С. В некоторых воплощениях GC-богатый домент представляет собой предпочтительно 3' "домен, стимулирующий В-клетки". В случае GC-богатого палиндрома длиной 10 оснований, палиндром, таким образом, содержит по меньшей мере 8 G и С. В случае GC-богатого палиндрома длиной 12 оснований, палиндром также содержит по меньшей мере 8 G и С. В случае 14-мерного GC-обогащеннбогатого палиндрома, по меньшей мере десять оснований палиндрома являются представляют собой G's и Cs. В некоторых воплощениях GC-обогащеннбогатый палиндром сделан состоит исключительно из G's и С некоторых воплощениях GC-богатый палиндром имеет состав оснований по меньшей мере из 81% G и C. В случае такого GC-богатого талиндрома длиной 10 оснований, палиндром, таким образом, состоит исключительно из G и С. В случае такого GC-богатого палиндрома длиной 12 оснований, предпочтительно, чтобы по меньшей мере десять оснований (83%) палиндрома представляют собой G и С. В некоторых предпочтительных воплощениях GC-богатый палиндром длиной 12 оснований состоит исключительно из G и С. В случае 14-мерного GC-богатого палиндрома по меньшей мере двенадцать оснований (86%) палиндрома представляют собой G и С. В некоторых предпочтительных воплощениях GC-богатый палиндром длиной 14 оснований состоит исключительно из G и С. Цитидины (С) GC-богатого палиндрома могут быть не метилированными или они могут быть метилированными.
В общем, этот домен имеет по меньшей мере 3 С и G, более предпочтительно 4 каждого и наиболее предпочтительно 5 или более каждого. Количество С и G в этом домене не должно быть идентичным. Предпочтительно, чтобы С и G были расположены таким образом, чтобы они могли образовывать самокомплементарный дуплекс или палиндром, такой как CCGCGCGG. Он может прерываться А или Т, но предпочтительно, чтобы самокомплементарность по меньшей мере частично сохранялись, как, например, в мотивах CGACGTTCGTCG или CGGCGCCGTGCCG. Когда комплементарность не сохраняется, предпочтительно, чтобы некомплементарными парами оснований были TG. В предпочтительном воплощении имеется существует не более чем 3 последовательных оснований, которые не являются частью палиндрома, предпочтительно,, предпочтительно не более чем 2, и наиболее предпочтительно только 1. В некоторых воплощениях GC-обогащеннбогатый палиндром включает по меньшей мере одинсодерживключает по меньшей мере один тример CGG тример, по меньшей мере один тример CCG тример или по меньшей мере один тетрамер CGCG тетрамер. В других воплощениях GC-обогащеннбогатый палиндром не является CCCCCCGGGGGG или GGGGGGCCCCCC, CCCCCGGGGG или GGGGGCCCCC.
По меньшей мере один из G из GCобогащенного участка может быть замещен инозином (I). В некоторых воплащениях P включает более чем один I.
В некоторых воплощениях иммуностимулирующий олигонуклеотид имеет одну из следующих формул 5' NX1DCGHX2 3', 5' X1DCGHX2N 3', 5' PX1DCGHX2 3', 5' X1DCGHX2P 3', 5' X1DCGHX2PX3 3', 5' X1DCGHPX3 3', 5' DCGHX2PX3 3', 5' TCGHX2PX3 3', 5' DCGHPX3 3', или 5' DCGHP 3'.
В изобретении предложены другие иммуностимулирующие олигонуклеотиды, определенные формулой 5' N1PyGN2P 3'. N1 представляет собой любую последовательность длиной от 1 до 6 нуклеотидов. Рy представляет собой пиримидин. G представляет собой гуанин. N2 представляет собой любую последовательность длиной от 0 до 30 нуклеотидов. Р представляет собой GC-богатый палиндром, содержащий последовательность длиной по меньшей мере 10 нуклеотидов.
N1 и N2 могут содержать более 50% пиримидинов и более предпочтительно более 50% Т. N1 может включать CG, и в этом случае существует предпочтительно Т, непосредственно предшествующий этому CG. В некоторых воплощениях N1PyG представляет собой TCG и наиболее предпочтительно TCGN2, где N2 не является G.
N1PyGN2P может включать один или более нуклеотидов инозина (I). Либо С, либо G в N1 можно заменить инозином, но Cpl является предпочтительным, чем IpG. Для замещений инозином, таких как IpG, оптимальной активности можно достичь с использованием "полужесткого" или химерного остова, где связь между IG или CI является фосфодиэфирной. N1 может включать по меньшей мере один мотив CI, TCI, IG или TIG.
В некоторых воплощениях N1PyGN2 представляет собой последовательность, выбранную из группы, состоящей из TTTTTCG, TCG, TTCG, TTTCG, TTTTCG, TCGT, TTCGT, TTTCGT и TCGTCGT.
В воплощении CpG олигонуклеотиды "класса С" по изобретению имеют следующую последовательность нуклеиновой кислоты:
5' TCGCGTCGTTCGGCGCGCGCCG 3' (SEQ ID NO: 443), или
5' TCGTCGACGTTCGGCGCGCGCCG 3' (SEQ ID NO: 444), или
5' TCGGACGTTCGGCGCGCGCCG 3' (SEQ ID NO: 445), или
5' TCGGACGTTCGGCGCGCCG 3' (SEQ ID NO: 446), или
5' TCGCGTCGTTCGGCGCGCCG 3' (SEQ ID NO: 447), или
5' TCGACGTTCGGCGCGCGCCG 3' (SEQ ID NO: 448), или
5' TCGACGTTCGGCGCGCCG 3' (SEQ ID NO: 449), или
5' TCGCGTCGTTCGGCGCCG 3' (SEQ ID NO: 450), или
5' TCGCGACGTTCGGCGCGCGCCG 3' (SEQ ID NO: 451), или
5' TCGTCGTTTTCGGCGCGCGCCG 3' (SEQ ID NO: 452), или
5' TeGTCGTTTTCGGCGGCCGCCG 3' (SEQ ID NO: 453), или
5' TCGTCGTTTTACGGCGCCGTGCCG 3' (SEQ ID NO: 454), или
5' TCGTCGTTTTCGGCGCGCGCCGT 3' (SEQ ID NO: 455).
В любой из этих последовательностей все связи могут быть фосфоротиоатными связями. В другом воплощении в любой из этих последовательностей одна или более связей могут быть фосфодиэфирными, предпочтительно между "С" и "G" CpG-мотива, образующего полужесткий CpG олигонуклеотид.
Некоторые неограничивающие примеры олигонуклеотидов С-класса включают:
5' T*C_G*C_G*T*C_G*T*T*C_G*G*C*G*C_G*C*G*C*C*G 3', или
5' T*C_G*T*C_G*A*C_G*T*T*C_G*G*C*G*C_G*C*G*C*C*G 3', или
5' T*C_G*G*A*C_G*T*T*C_G*G*C*G*C_G*C*G*C*C*G 3', или
5' T*C_G*G*A*C_G*T*T*C_G*G*C*G*C*G*C*C*G 3', или
5' T*C_G*C_G*T*C_G*T*T*C_G*G*C*G*C*G*C*C*G 3', или
5' T*C_G*A*C_G*T*T*C_G*G*C*G*C_G*C*G*C*C*G 3', или
5' T*C_G*A*C_G*T*T*C_G*G*C*G*C*G*C*C*G 3', или
5' T*C_G*C_G*T*C_G*T*T*C_G*G*C*G*C*C*G 3', или
5' T*C_G*C_G*A*C_G*T*T*C_G*G*C*G*C_G*C*G*C*C*G 3', или
5' T*C*G*T*C*G*T*T*T*T*C*G*G*C*G*C*G*C*G*C*C*G 3', или
5' T*C*G*T*C*G*T*T*T*T*C*G*G*C*G*G*C*C*G*C*C*G 3', или
5' T*C*G*T*C_G*T*T*T*T*A*C_G*G*C*G*C*C_G*T*G*C*C*G 3', или
5' T*C_G*T*C*G*T*T*T*T*C*G*G*C*G*C*G*C*G*C*C*G*T 3'
где * относится к фосфоротиоатной связи, и _ относится к фосфодиэфирной связи.
В любой из этих последовательностей 5' Т может быть заменен этил-уридином или галогеном; примеры замещений галогеном включают, но не ограничиваются этим, замещение бром-уридином или йод-уридином.
CpG иммуностимулирующие олигонуклеотиды "класса Р" были описаны в WO 2007/095316 и характеризуются тем фактом, что они содержат дуплекс-образующие участки, такие как, например, совершенные или несовершенные палиндромы на или около обоих 5'- и 3'-концов, давая им возможность образовывать более упорядочные структуры, такие как конкатамеры. Эти олигонуклеотиды, названные олигонуклеотидами Р-класса, имеют в некоторых случаях способность индуцировать более высокие уровни секреции IFN-α, чем С-класс. Олигонуклеотиды Р-класса обладают способностью спонтанно собираться в конкатамеры in vitro и/или in vivo. He будучи связанными какой-либо конкретной теорией способа действия этих молекул, одна потенциальная гипотеза заключается в том, что это свойство обеспечивает способность олигонуклеотидов Р-класса более эффективно сшивать TLR9 внутри определенных иммунных клеток, индуцируя определенную картину иммунной активации по сравнению с ранее описанными классами CpG олигонуклеотидов.
В воплощении CpG олигонуклеотид по настоящему изобретению представляет собой CpG олигонуклеотид класса Р, содержащий 5' TLR домен активации и по меньшей мере два палиндромных участка, где один палиндромный участок представляет собой 5' палиндромный участок длиной по меньшей мере 6 нуклеотидов и связанный с 3' палиндромным участком длиной по меньшей мере 8 нуклеотидов либо непосредственно, либо через спейсер, где олигонуклеотид содержит по меньшей мере один динуклеотид YpR. В воплощении указанный олигонуклеотид не является T*C_G*T*C_G*A*C_G*T*T*C_G*G*C*G*C_G*C*G*C*C*G. В одном из воплощений CpG олигонуклеотид класса Р включает по меньшей мере один неметилированный CpG динуклеотид. В другом воплощении домен активации TLR представляет собой TCG, TTCG, TTTCG, TYpR, TTYpR, TTTYpR, UCG, UUCG, UUUCG, TTT или TTTT. В еще одном воплощении домен активации TLR находится в пределах 5' палиндромного участка. В другом воплощении домен активации TLR находится непосредственно с 5' относительно 5' палиндромного участка. В еще одном воплощении 5' палиндромный участок имеет длину по меньшей мере 8 нуклеотидов. В другом воплощении 3' палиндромный участок имеет длину по меньшей мере 10 нуклеотидов. В другом воплощении 5' палиндромный участок имеет длину по меньшей мере 10 нуклеотидов. В еще одном воплощении 3' палиндромный участок включает неметилированный CpG динуклеотид. В другом воплощении 3' палиндромный участок включает два неметилированных CpG динуклеотида. В другом воплощении 5' палиндромный участок включает неметилированный CpG динуклеотид. В еще одном воплощении 5' палиндромный участок включает два неметилированных CpG динуклеотида. В другом воплощении 5' и 3' палиндромные участки имеют значение стабильности дуплекса по меньшей мере 25. В другом воплощении 5' и 3' палиндромные участки имеют значение стабильности дуплекса по меньшей мepe 30. B другом воплащении 5' и 3' палиндромные участки дуплекса имеют значение стабильности дуплекса по меньшей мере 35. В другом воплощении 5' и 3' палиндромные участки имеют значение стабильности дуплекса по меньшей мере 40. В другом воплощении 5' и 3' палиндромные участки имеют значение стабильности дуплекса по меньшей мере 45. В другом воплощении 5' и 3' палиндромные участки имеют значение стабильности дуплекса по меньшей мере 50. В другом воплощении 5' и 3' палиндромные участки имеют значение стабильности дуплекса по меньшей мере 55. В другом воплощении 5' и 3' палиндромные участки имеют значение стабильности дуплекса по меньшей мере 60, В другом воплощении 5' и 3' палиндромные участки имеют значение стабильности дуплекса по меньшей мере 65.
В одном из воплощений два палиндромных участка соединены непосредственно. В другом воплощении два палиндромных участка соединены посредством 3'-3'-связи. В другом воплощении два палиндромных участка перекрываются на один нуклеотид. В еще одном воплощении два палиндромных участка перекрываются на два нуклеотида. В другом воплощении два палиндромных участка не перекрываются. В другом воплощении два палиндромных участка соединены спейсером. В одном из воплощений спейсер представляет собой нуклеиновую кислоту, имеющую длину в 1-50 нуклеотидов. В другом воплощении спейсер представляет собой нуклеиновую кислоту, имеющую длину в 1 нуклеотид. В другом воплощении спейсер представляет собой ненуклеотидный спейсер. В одном из воплощений ненуклеотидный спейсер представляет собой D-спейсер. В другом воплощении ненуклеотидный спейсер представляет собой линкер. В одном из воплощений олигонуклеотид имеет формулу 5' XP1SP2T 3', где X представляет домен активации TLR, P1 представляет собой палиндром, S представляет собой спейсер, P2 представляет собой палиндром, и Т представляет собой 3' хвост длиной 0-100 нуклеотидов. В одном из воплощений Х представляет собой TCG, TTCG, или TTTCG. В другом воплощении Т составляет 5-50 нуклеотидов в длину. В еще одном воплощении Т составляет 5-10 нуклеотидов в длину. В одном из воплощений S представляет собой нуклеиновую кислоту, имеющую длину в 1-50 нуклеотидов. В другом воплощении S представляет собой нуклеиновую кислоту, имеющую длину в 1 нуклеотид. В другом воплощении S представляет собой ненуклеотидный спейсер. В одном из воплощений ненуклеотидный спейсер представляет собой D-спейсер. В другом воплощении олигонуклеотид не является антисмысловым олигонуклеотидом или рибозимом. В одном воплощении В одном из воплощений P1 является А- и Т-обогащеннбогатым. В другом воплощении P1 включает по меньшей мере 4 Ts. В другом воплощении P2 представляет собой совершенный палиндром. В представляет собой совершенный палиндром. В другом воплощении Р2 является G-C-богатым. В еще одном воплощении Р2 представляет собой CGGCGCX1GCGCCG, где X1 представляет собой Т или отсутствует.
В одном из воплощений олигонуклеотид включает по меньшей мере одну фосфоротиоатную связь. В другом воплощении все межнуклеотидные связи олигонуклеотида представляют собой фосфоротиоатные связи. В другом воплощении олигонуклеотид включает по меньшей мере одну фосфодиэфир-подобную связь. В другом воплощении фосфодиэфир-подобная связь представляет собой фосфодиэфирную связь. В другом воплощении липофильная группа конъюгирована с олигонуклеотидом. В одном из воплощений липофильный группаая группа представляет собой холестерол. В воплощении СрС олигонуклеотид для применения в настоящем изобретении представляет собой CpG олигонуклеотид класса Р с 5' доменом активации TLR и по меньшей мере двумя комплементарность-содержащими участками: 5' и 3' комплементарность-содержащим участком, где каждый комплементарность-содержащий участок имеет длину по меньшей мере 8 нуклеотидов и соединены друг с другом либо непосредственно, либо через спейсер, где олигонуклеотид включает по меньшей мере один пиримидин-пуриновый (YpR) динуклеотид, и где по меньшей мере один из комплементарность-содержащих участков не является совершенным палиндромом. В одном из воплощений олигонуклеотид содержит по меньшей мере один неметилированный CpG динуклеотид. В другом воплощении домен активации TLR представляет собой TCG, TTCG, TTTCG, TYpR, TTYpR, TTTYpR, UCG, UUCG, UUUCG, TTT или TTTT. В другом воплощении домен активации TLR находится в пределах 5' комплементарность-содержащего участка. В другом воплощении домен активации TLR находится непосредственно с 5' относительно 5' комплементарность-содержащего участка. В другом воплощении 3' комплементарность-содержащий участок имеет длину по меньшей мере 10 нуклеотидов. В еще одном воплощении 5' комплементарность-содержащий участок имеет длину по меньшей мере 10 нуклеотидов. В одном из воплощений 3' комплементарность-содержащий участок включает неметилированный CpG динуклеотид. В другом воплощении 3' комплементарность-содержащий участок включает два неметилированных CpG динуклеотида. В еще одном воплощении 5' комплементарность-содержащий участок включает неметилированный CpG динуклеотид. В другом воплощении 5' комплементарность-содержащий участок включает два неметилированных CpG динуклеотида. В другом воплощении комплементарность-содержащие участки включают по меньшей мере один нуклеотидный аналог. В другом воплощении комплементарность-содержащие участки образуют внутримолекулярный дуплекс. В одном из воплощений внутримолекулярный дуплекс включает по меньшей мере одну пару оснований не-Уотсона-Крика. В другом воплощении пара оснований не-Уотсона-Крика представляет собой G-T, G-A, G-G или С-А. В одном из воплощений комплементарность-содержащие участки образуют межмолекулярные дуплексы. В другом воплощении по меньшей мере один из межмолекулярных дуплексов включает по меньшей мере одну пару оснований не-Уотсона-Крика. В другом воплощении пара оснований не-Уотсона-Крика представляет собой G-Т, G-A, G-G или С-А. В еще одном воплощении комплементарность-содержащие участки содержат ошибочное спаривание. В еще одном воплощении комплементарность-содержащие участки содержат два ошибочных спаривания. В другом воплощении комплементарность-содержащие участки содержат промежуточный нуклеотид. В другом воплощении комплементарность-содержащие участки содержат два промежуточных нуклеотида.
В одном из воплощений 5' и 3' комплементарность-содержащие участки имеют значение стабильности дуплекса по меньшей мере 25. В другом воплощении 5' и 3' комплементарность-содержащие участки имеют значение стабильности дуплекса по меньшей мере 30. В другом воплощении 5' и 3' комплементарность-содержащие участки имеют значение стабильности дуплекса по меньшей мере 35. В другом воплощении комплементарность-содержащие участки имеют значение стабильности дуплекса по меньшей мере 40. В другом воплощении комплементарность-содержащие участки имеют значение cтaбильнocти дуплeкca по мeньшeй мере 35. B другом комплементарность-содержание участки имеют значение стабильности дуплекса по меньшей мере 50. В другом воплощении комплементарность-содержащие участки имеют значение стабильности дуплекса по меньшей мере 55. В другом воплощении комплементарность-содержащие участки имеют значение стабильности дуплекса по меньшей мере 60. В другом воплощении комплементарность-содержащие участки имеют значение стабильности дуплекса по меньшей мере 65.
В другом воплощении два комплементарность-содержащих участка сщединены непосредственно. В другом воплощении два палиндромных участка соединены посредством 3'-3'-связи. В еще одном воплощении два комплементарность-содержащих участка перекрываются на один нуклеотид. В другом воплощении два комплементарность-содержащих участка перекрываются на два нуклеотида. В другом воплощении два комплементарность-содержащих участка не перекрываются. В другом воплощении два комплементарность-содержащих участка соединены с помощью спейсера. В другом воплощении спейсер представляет собой нуклеиновую кислоту, имеющую длину в 1-50 нуклеотидов. В другом воплощении спейсер представляет собой нуклеиновую кислоту, имеющую длину в 1 нуклеотид. В одном из воплощений спейсер представляет собой ненуклеотидный спейсер. В другом воплощении ненуклеотидный спейсер представляет собой D-спейсер. В еще одном воплощении ненуклеотидный спейсер представляет собой линкер.
В одном из воплощений олигонуклеотид Р-класса имеет формулу 5' XNSPT 3', где Х представляет собой домен активации TLR, N представляет собой несовершенный палиндром, Р представляет собой палиндром, S представляет собой спейсер, и Т представляет собой 3' хвост длиной 0-100 нуклеотидов. В другом воплощении Х представляет собой TCG, TTCG или TTTCG. В другом воплощении Т составляет 5-50 нуклеотидов в длину. В другом воплощении Т составляет 5-10 нуклеотидов в длину. В другом воплощении S представляет собой нуклеиновую кислоту, имеющую длину в 1-50 нуклеотидов. В другом воплощении S представляет собой нуклеиновую кислоту, имеющую длину в 1 нуклеотид. В другом воплощении S представляет собой ненуклеотидный спейсер. В другом воплощении ненуклеотидный спейсер представляет собой спейсер. B другом воплащении ненуклеотидный спейсер представляет собой линкер. В другом вопдощении олигонуклеотид не является антисмысловым олигонуклеотидом или рибозимом. В другом воплощении N является А- и Т-богатым. В другом воплощении N включает по меньшей мере 4 Т. В другом воплощении Р представляет собой совершенный палиндром. В другом воплощении Р является G-C-богатым. В другом воплощении Р представляет собой CGGCGCX1GCGCCG, где X1 представляет собой Т или отсутствует. В другом воплощении олигонуклеотид включает по меньшей мере одну фосфоротиоатную связь. В другом воплощении все межнуклеотидные связи олигонуклеотида представляют собой фосфоротиоатные связи. В другом воплощении олигонуклеотид включает по меньшей мере одну фосфодиэфир-подобную связь. В другом воплощении фосфодиэфир-подобная связь представляет собой фосфодиэфирную связь. В другом воплощении липофильная группа конъюгирована с олигонуклеотидом. В одном из воплощений липофильная группа представляет собой холестерин.
В воплощении CpG олигонуклеотиды "класса Р" по изобретению имеют следующую последовательность нуклеиновой кислоты: 5' TCGTCGACGATCGGCGCGCGCCG 3' (SEQ ID NO: 456).
В указанных последовательностях все связи могут быть фосфоротиоатными связями. В другом воплощении одна или более связей могут быть фосфодиэфирными, предпочтительно между "С" и "G" из CpG-мотива, образующего полужесткий CpG олигонуклеотид. В любой из этих последовательностей 5' Т может быть заменен этил-уридином или галогеном;
примеры замещений галогеном включают, но не ограничиваются этим, замещения бром-уридином или йод-уридином.
Неограничивающий пример олигонуклеотидов Р-класса включает:
5' T*C_G*T*C_G*A*C_G*A*T*C_G*G*C*G*C_G*C*G*C*C*G 3'
где * относится к фосфоротиоатной связи, и _ относится к фосфодиэфирной связи.
В воплощении все межнуклеотидные связи CpG олигонуклеотидов, описанных в данной заявке, представляют собой фосфодиэфирные связи ("гибкие" ("soft") олигонуклеотиды, как описано в РСТ заявке WO 2007/026190). В другом воплощении CpG олигонуклеотиды по изобретению становятся устойчивыми к деградации (например, стабилизируются). "Стабилизированный олигонуклеотид" относится к олигонуклеотиду, который является относительно устойчивым к деградации in vivo (например, экзо- или эндонуклеазами). Стабилизации нуклеиновой кислоты можно достичь посредством модификаций остова. Олигонуклеотиды, имеющие фосфоротиоатные связи, обеспечивают максимальную активность и защищают олигонуклеотиды от деградации внутриклеточными экзо- и эндонуклеазами.
Иммуностимулирующие олигонуклеотиды могут иметь химерный остов, который имеет комбинации фосфодиэфирных и фосфоротиоатных связей. Для целей настоящего изобретения химерный остов относится к частично стабилизированному остову, где по меньшей мере одна межнуклеотидная связь является фосфодиэфирной или фосфодиэфир-подобной и где по меньшей мере одна другая межнуклеотидная связь представляет собой стабилизированную межнуклеотидную связь, где по меньшей мере одна фосфодиэфирная или фосфодиэфир-подобная связь и по меньшей мере одна стабилизированная связь различаются. Когда фосфодиэфирная связь преимущественно расположена в пределах CpG-мотива, такие молекулы называют "полужесткими", как описано в РСТ заявке WO 2007/026190.
Другие модифицированные олигонуклеотиды включают комбинации фосфодиэфирных, фосфоротиоатных, метилфосфонатных, метилфосфоротиоатных, фосфородитиоатных и/или п-этокси-связей.
Поскольку боранофосфонатные связи, как сообщалось, являются стабилизированными относительно фосфодиэфирных связей, для целей химерной природы остова, боранофосфонатные связи можно классифицировать либо как фосфодиэфир-подобные, либо как стабилизированные, в зависимости от окружения. Например, химерный остов согласно настоящему изобретению может в некоторых воплощениях включать по меньшей мере одну фосфодиэфирную (фосфодиэфирную или фосфодиэфир-подобную) связь и по меньшей мере одну боранофосфонатную (стабилизированную) связь. В других воплощениях химерный остов согласно настоящему изобретению может включать боранофосфонатные (фосфодиэфирные или фосфодиэфир-подобные) и фосфоротиоатные (стабилизированные) связи. "Стабилизированная межнуклеотидная связь" означает межнуклеотидную связь, которая относительно устойчива к деградации in vivo (например, экзо- или эндонуклеазами) по сравнению с фосфодиэфирной межнуклеотидной связью. Предпочтительные стабилизированные мeжнуклeотидные связи включают, бeз огрaничeния, фосфоротиоатные, фосфородитиоатные, метилфосфонатные и метилфосфоротиоатные связи. Другие стабилизированные межнуклеотидные связи включают, без ограничения, пептидные, алкильные, дефосфо и другие связи, описанные выше.
Модифицированные остовы, такие как фосфоротиоатные, могут быть синтезированы с использованием автоматизированных методов, в которых используют либо фосфорамидатную, либо Н-фосфонатную химию. Арил- и алкил-фосфонаты могут быть получены, например, как описано в патенте США №4469863; и алкилфосфотриэфиры (в которых заряженная кислородная группировка алкилирована, как описано в патенте США №5023243 и европейском патенте №092574) могут быть получены посредством автоматизированного твердофазного синтеза с использованием имеющихся в продаже реагентов. Способы получения других модификаций и замен в остове ДНК были описаны. Uhlmann E et al. (1990) Chem Rev 90:544; Goodchild J (1990) Bioconjugate Chem 1:165. Способы получения химерных олигонуклеотидов также известны. Например, в патентах, выданных на Uhlmann с соавт., описаны такие методы.
Модифицированный ODN (олигодезоксирибонуклеотид) со смешанным остовом может быть синтезирован, как описано в РСТ заявке WO 2007/026190.
Олигонуклеотиды по изобретению также могут включать другие модификации. К ним относятся неионные аналоги ДНК, такие как алкил- и арил-фосфаты (в которых заряженный фосфонатный кислород заменен алкильной или арильной группой), фосфодиэфир и алкилфосфотриэфиры, в которых заряженная кислородная группировка алкилирована. Также было показано, что нуклеиновые кислоты, которые содержат диол, такие как тетраэтиленгликоль или гексаэтиленгликоль, либо на одном, либо на обоих концах, являются в значительной мере устойчивыми к деградации нуклеазами.
Размер CpG олигонуклеотида (т.е. количество нуклеотидных остатков по длине олигонуклеотида) также может способствовать стимулирующей активности олигонуклеотида. Для облегчения поглощения клетками CpG олигонуклеотид по изобретению предпочтительно имеет минимальную длину 6 нуклеотидных остатков. Олигонуклеотиды с любым размером более 6 нуклеотидов (даже длиной в несколько т.п.н.) способны индуцировать иммунный ответ, если присутствуют достатонные иммуностимулирующие мотивы, поскольку более длинные Олигонуклеотиды подвергаются деградации внутри клеток. В некоторых воплощениях CpG Олигонуклеотиды имеют длину от 6 до 100 нуклеотидов, предпочтительно длину от 8 до 30 нуклеотидов. В важных воплощениях нуклеиновые кислоты и олигонуклеотиды по изобретению не являются плазмидами или экспрессирующими векторами.
В воплощении CpG олигонуклеотид, описанный в данной заявке, содержит замены или модификации, напрмер, в основаниях и/или сахарах, как описано в параграфах 134-147 из WO 2007/026190.
В воплощении CpG олигонуклеотид по настоящему изобретению являются химически модифицированным. Примеры химических модификаций известны специалисту и описаны, например, в Uhlmann E. et al. (1990), Chem. Rev. 90:543, S. Agrawal, Ed., Humana Press, Totowa, USA 1993; Crooke, S.T. et al. (1996) Annu. Rev. Pharmacol. Toxicol. 36: 107-129; и HunzikerJ. etal., (1995), Mod. Synth. Methods 7: 331-417. Олигонуклеотид согласно изобретению может иметь одну или более модификаций, где каждая модификация расположена в конкретном фосфодиэфирном межнуклеозидном мостике и/или в конкретном β-D-рибозном звене, и/или в конкретном положении природного основания нуклеозида по сравнению с олигонуклеотидом с той же последовательностью, который состоит из природной ДНК или РНК.
В некоторых воплощениях изобретения CpG-содержащие нуклеиновые кислоты могут быть просто смешаны с иммуногенными носителями в соответствии с методами, известными специалистам в данной области (см., например, WO 03/024480).
В конкретном воплощении настоящего изобретения любая из вакцин, описанных в данной заявке, содержит от 2 мкг до 100 мг CpG олигонуклеотида, предпочтительно от 0,1 мг до 50 мг CpG олигонуклеотида, предпочтительно от 0,2 мг до 10 мг CpG олигонуклеотида, предпочтительно от 0,3 мг до 5 мг CpG олигонуклеотида, предпочтительно от 0,3 мг до 5 мг CpG олигонуклеотида, более предпочтительно от 0,5 до 2 мг CpG олигонуклеотида, более предпочтительно от 0,75 до 1,5 мг CpG олигонуклеотида. В предпочтительном воплощении любая из вакцин, описанных в данной заявке, содержит приблизительно 1 мг CpG олигонуклеотида.
В некоторых воплощениях изобретения CpG-содержащие нуклеиновые кислоты могут быть просто смешаны с иммуногенными носителями в соответствии с методами, известными специалистам в данной области (см., например, WO 03/024480). В других воплощениях изобретения CpG-содержащие нуклеиновые кислоты могут быть заключены в пределах VLPs (см., например, WO 03/024481).
Предпочтительные адъюванты в контексте настоящего изобретения включают квасцы; CpG-содержащие олигонуклеотиды, предпочтительно CpG 7909 (SEQ ID NO: 433) и CpG24555 (SEQ ID NO: 431); и адъюванты на основе сапонина, предпочтительно Iscomatrix, который может быть использован отдельно или в комбинации. Предпочтительно, указанная CpG-содержащая нуклеиновая кислота содержит одну или более модифицированных связей, предпочтительно одну или более фосфоротиоатных связей, еще более предпочтительно все межнуклеотидные связи олигонуклеотида являются фосфоротиоатными связями.
Поэтому в изобретении предложена иммуногенная композиция, содержащая антигенный пептид IgE, предпочтительно содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-430, более предпочтительно аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-153 и 220-430, еще более предпочтительно аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 220-430, и по меньшей мере один адъювант. Указанный антигенный пептид IgE предпочтительно связан с иммуногенным носителем, как описано в данной заявке, предпочтительно VLP, более предпочтительно VLP HBsAg, HbcAg или Qbeta. В одном из воплощений указанный адъювант представляет собой адъювант на основе сапонина, предпочтительно Iscomatrix. В другом воплощении указанный адъювант представляет собой квасцы. В еще одном воплощении указанный адъювант представляет собой CpG-содержащую нуклеиновую кислоту. Предпочтительно, указанный адъювант представляет собой CpG7909. Более предпочтительно, указанный адъювант представляет собой CpG24555. Предпочтительно, указанная CpG-содержащая нуклеиновая кислота содержит одну или более модифицированных связей, предпочтительно одну или более фосфоротиоатных связей, еще более предпочтительно все межнуклеотидные связи олигонуклеотида представляют собой фосфоротиоатные связи.
B eщe oдном воплощении укaзaнный пo мeньшeй мepe oдин aдъювaнт содержит два адъюванта, предпочтительно выбранных из группы, состоящей из квасцов, адъювантов на основе сапонина и CpG-содержащей нуклеиновой кислоте. В предпочтительном воплощении указанные адъюванты представляют собой квасцы и CpG-содержащую нуклеиновую кислоту, предпочтительно CpG7909 или CpG24555, более предпочтительно CpG24555. Предпочтительно, указанная CpG-содержащая нуклеиновая кислота содержит одну или более модифицированных связей, предпочтительно одну или более фосфоротиоатных связей, еще более предпочтительно все межнуклеотидные связи олигонуклеотида представляют собой фосфоротиоатные связи. В другом предпочтительном воплощении указанные адъюванты представляют собой адъювант на основе сапонина, предпочтительно Iscomatrix, и CpG-содержащую нуклеиновую кислоту, предпочтительно CpG7909, более предпочтительно CpG24555. Предпочтительно, указанная CpG-содержащая нуклеиновая кислота содержит одну или более модифицированных связей, предпочтительно одну или более фосфоротиоатных связей, еще более предпочтительно все межнуклеотидные связи олигонуклеотида представляют собой фосфоротиоатные связи. В другом предпочтительном воплощении указанные адъюванты представляют собой квасцы и адъювант на основе сапонина, предпочтительно Iscomatrix.
В еще одном воплощении по меньшей мере один указанный адъювант содержит три адъюванта, предпочтительно выбранных из группы, состоящей из квасцов, адъюванта на основе сапонина, предпочтительно Iscomatrix, и CpG-содержащих нуклеиновых кислот, более предпочтительно CpG7909, еще более предпочтительно CpG24555. Предпочтительно, указанная CpG-содержащая нуклеиновая кислота содержит одну или более модифицированных связей, предпочтительно одну или более фосфоротиоатных связей, еще более предпочтительно все межнуклеотидные связи олигонуклеотида представляют собой фосфоротиоатные связи.
Фармацевтические композиции по изобретению
В изобретении также предложены фармацевтические композиции, содержащие антигенный пептид IgE по изобретению или его иммуногенную композицию, в препарате вместе с одним или более фармацевтически приемлемыми эксципиентами и возможно объединенные с одним или более адъювантами (адъюванты описаны выше). Термин 'эксципиент' используется в данной заявке для описания любого ингредиента, отличного от активного ингредиента, т.е. антигенного пептида IgE по изобретению, в конечном счете связанного с иммуногенным носителем и возможно объединенного с одним или более адъювантами. Выбор эксципиента(ов) в значительной степени зависит от таких факторов, как конкретный способ введения, влияние эксципиента на растворимость и стабильность, и природа лекарственной формы. Как использовано в данной заявке, "фармацевтически приемлемый эксципиент" включает любые или все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и замедляющие поглощение агенты и тому подобное, которые являются физиологически совместимыми. Некоторыми примерами фармацевтически приемлемых эксципиентов являются вода, физиологический раствор, фосфатный буфер, декстроза, глицерин, этанол и тому подобное, а также их комбинации. Во многих случаях предпочтительно включать в композиции изотонические агенты, например, сахара, многоатомные спирты, такие как маннит, сорбит, или хлорид натрия. Дополнительные примеры фармацевтически приемлемых веществ представляют собой увлажняющие агенты или небольшие количества вспомогательных веществ, таких как смачивающие или эмульгирующие агенты, консерванты или буферы, которые увеличивают срок хранения или эффективность активного ингредиента.
Фармацевтические композиции по настоящему изобретению и способы их получения будут очевидны специалистам в данной области. Такие композиции и способы их получения можно найти, например, в Remington's Фармацевтическая Sciences, 19th Edition (Mack Publishing Company, 1995). Фармацевтические композиции предпочтительно производят в соответствии с требованиями GMP (правила организации производства и контроля качества лекарственных средств).
Фармацевтическая композиция по изобретению может приготавливаться, упаковываться или продаваться нерасфасованными, в виде однократной стандартной дозы или в виде множества однократных стандартных доз. Используемый в данной заявке термин "стандартная доза" представляет собой определенное количество фармацевтической композиции, содержащей заданное количество активного ингредиента. Количество активного инрредиента обычно равно дозировке активног инфедиентата, которую будут вводить субъекту, или удобная часть такой дозировки, такая как, например, половина или треть такой дозировки.
Любой способ введения пептидов или белков, принятый в данной области, может быть соответствующим образом использован для пептидов или белков по изобретению.
Фармацевтические композиции по изобретению обычно подходят для парентерального введения. Как использовано в данной заявке, "парентеральное введение" фармацевтической композиции включает любой путь введения, характеризующийся физическим разрывом ткани субъекта и введением фармацевтической композиции через разрыв ткани, таким образом обычно приводящим к прямому введению в кровоток, в мышцу или во внутренний орган. Парентеральное введение, таким образом, включает, но не ограничивается, введение фармацевтической композиции посредством инъекции композиции, путем нанесения композиции через хирургический разрез, путем нанесения композиции через ткань-проникающую нехирургическую рану и тому подобное. В частности, предполагается, что парентеральное введение включает, но не ограничивается этим, подкожную, внутрибрюшинную, внутримышечную, интрастернальную, внутривенную, внутриартериальную, интратекальную, внутрижелудочковую, интрауретральную, внутричерепную, внутрисуставную инъекцию или инфузии; и методы диализной инфузии в почки. Предпочтительные воплощения включают внутривенный, подкожный, внутрикожный и внутримышечный пути, еще более предпочтительные воплощения представляют собой внутримышечный или подкожный пути.
Препараты фармацевтической композиции, подходящие для парентерального введения, как правило, обычно содержат активный ингредиент, объединенный с фармацевтически приемлемым носителем, таким как стерильная вода или стерильный изотонический физиологический раствор. Такие препараты могут приготавливаться, упаковываться или продаваться в форме, подходящей для болюсного введения или для непрерывного введения. Инъецируемые препараты могут приготавливаться, упаковываться или продаваться в стандартной лекарственной форме, такой как в ампулах или в многодозовых контейнерах, содержащих консерванты. Препараты для парентерального введения включают, но не ограиичиваются этим, суспензии, растворы, эмульсии в масляных или водных носителях, пасты и тому подобное. Такие препараты могут дополнительно содержать один или более дополнительных ингредиентов, включающих, но не ограничивающихся этим, суспендирующие, стабилизирующие или диспергирующие агенты. В одном из воплощений препарата для парентерального введения активный ингредиент предложен в сухой (т.е. порошковой или гранулярной) форме для восстановления подходящим носителем (например, стерильной апирогенной водой) перед парентеральным введением восстановленной композиции. Парентеральные препараты также включают водные растворы, которые могут содержать эксципиенты, такие как соли, углеводы и буферные агенты (предпочтительно с рН от 3 до 9), но для некоторых применений они могут быть более подходящим образом приготовлены в виде стерильного неводного раствора или в сухой форме, используемой вместе с подходящим носителем, таким как стерильная, апирогенная вода. Примерные формы для парентерального введения включают растворы или суспензии в стерильных водных растворах, например, водных растворах пропиленгликоля или декстрозы. Такие лекарственные формы могут быть подходящим образом забуферены, при необходимости. Другие парентерально вводимые препараты, которые являются полезными, включают препараты, которые содержат активный ингредиент в микрокристаллической форме или в липосомальном препарате. Препараты для парентерального введения могут быть приготовлены для немедленного и/или модифицированного высвобождения. Препараты с модифицированным высвобождением включают замедленное, пролонгированное, импульсное, контролируемое, направленное и программируемое высвобождение.
Например, в одном аспекте стерильные растворы для инъекций могут быть получены путем включения пептида против IgE, предпочтительно связанного с иммуногенным носителем, в конечном счете в комбинации с одним или более адъювантами, в необходимом количестве в соответствующем растворителе с одним или комбинацией ингредиентов, перечисленных выше, при необходимости, с последующей стерилизацией фильтрованием. Как правило, дисперсии готовят путем включения активного компонента в стерильный носитель, котopый coдеpжит ocнoвную дисперсионную среду и другие необходимые ингредиенты из перечисленных выше. В случае стерильных порошков для приготовления стерильных растворов для инъекций, предпочтительные способы приготовления представляют собой вакуумную сушку и лиофилизацию, что дает порошок активного ингредиента плюс любой дополнительный желаемый ингредиент из его предварительно простерилизованного фильтрованием раствора. Подходящую текучесть раствора можно поддерживать, например, путем применения покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и путем применения поверхностно-активных веществ. Пролонгированное поглощение композиций для инъекций можно обеспечить путем включения в композицию агента, который замедляет поглощение, например, моностеаратных солей и желатина.
Примерная неограничивающая фармацевтическая композиция по изобретению представляет собой препарат в виде стерильного водного раствора, имеющего рН в диапазоне от примерно 5,0 до примерно 6,5 и содержащего от примерно 0,1 мг/мл до примерно 20 мг/мл пептида по изобретению, от примерно 1 мМ до примерно 100 мМ гистидинового буфера, от примерно 0,01 мг/мл до примерно 10 мг/мл полисорбата 80, от примерно 100 мМ до примерно 400 мМ трегалозы и от примерно 0,01 мМ до примерно 1,0 мМ дигидрата динатриевой соли EDTA.
Антигенные пептиды IgE по изобретению также можно вводить интраназально или посредством ингаляции, как правило, в форме сухого порошка (либо отдельно, либо в виде смеси, либо в виде смешанных частиц компонентов, например, смешанных с подходящим фармацевтически приемлемым эксципиентом) из ингалятора сухого порошка, в виде аэрозольного спрея из контейнера под давлением, насоса, спрея, распылителя (предпочтительно распылителя с использованием электрогидродинамики для производства мелкодисперсного тумана) или небулайзера с использованием или без использования подходящего пропеллента или в виде капель в нос.
Контейнер под давлением, насос, спрей, распылитель или небулайзер обычно содержит раствор или суспензию антитела по изобретению, содержащие, например, подходящий агент для диспергирования, солюбилизации или продления высвобождения активного агента, пропеллента(ов) в виде растворителя.
Перед применением препарата в виде сухого порошка или суспензии, лекарственный препарат обычно подвергают микронизации до размера, подходящего для доставки посредством ингаляции (как правило, менее 5 микрон). Этого можно достичь с помощью любого подходящего способа измельчения, такого как размол в спиральной струйной мельнице, размол в струйной мельнице с кипящим слоем, сверхкритическая флюидная обработка с образованием наночастиц, гомогенизация при высоком давлении или сушка распылением.
Капсулы, блистеры и картриджи для применения в ингаляторе или инсуффляторе могут быть разработаны таким образом, чтобы содержать порошковую смесь соединения по изобретению, подходящее порошковое основание и улучшитель качества (performance modifier).
Подходящий препарат в виде раствора для применения в распылителе с использованием электрогидродинамики для производства мелкодисперсного тумана может содержать подходящую дозу антигенного пептида 1дЕ по изобретению для приведения в действие и воздействующий объем может варьироваться, например, от 1 мкл до 100 мкл.
Подходящие ароматизаторы, такие как ментол и левоментол, или подсластители, такие как сахарин или сахарин натрия, могут быть добавлены в препараты по изобретению, предназначенные для ингалируемого/интраназального введения.
Препараты для ингалируемого/интраназального введения могут быть разработаны с немедленным и/или модифицированным высвобожденим. Препараты с модифицированным высвобождением включают замедленное, пролонгированное, импульсное, контролируемое, направленное и программируемое высвобождение.
В случае ингаляторов сухого порошка и аэрозолей, единицу дозирования определяют посредством клапана, который доставляет отмеренное количество. Единицы в соответствии с изобретением обычно распределяют таким образом, чтобы вводить отмеренную дозу, или "пшик", антитела по изобретению. Общую суточную дозу обычно вводят в виде разовой дозы или чаще в виде разделенных доз в течение суток.
Фармацевтическая композиция, содержащая антигенный пептид IgE, также может быть приготовлена в виде препарата для перфального введения. Пероральное введение может включать проглатывание, так что соединение поступает в желудочно-кишечный тракт, и/или трансбуккальное, лингвальное или сублингвальное введение, с помощью которого соединение поступает в кровоток непосредственно из ротовой полости.
Препараты, пригодные для перорального введения, включают твердые, полутвердые и жидкие системы, такие как таблетки; мягкие или твердые капсулы, содержащие мульти- или наночастицы, жидкости или порошки; пастилки (в том числе заполненные жидкостью); леденцы; гели; быстро диспергирующие лекарственные формы; пленки; суппозитории; спреи и трансбуккальные/мукоадгезивные пластыри.
Жидкие препараты включают суспензии, растворы, сиропы и эликсиры. Такие препараты могут быть использованы в качестве наполнителей в мягких или твердых капсулах (сделанных, например, из желатина или гидроксипропилметилцеллюлозы) и обычно содержат носитель, например, воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло и один или более эмульгирующих агентов и/или суспендирующих агентов. Жидкие препараты также могут быть получены путем растворения твердого вещества, например, из саше.
Композиции по изобретению могут быть использованы для лечения, облегчения или предупреждения IgE-опосредованных расстройств или симптомов у субъекта с риском развития такого расстройства или симптома или страдающего от такого расстройства или симптома путем стимулирования иммунного ответа у указанного субъекта посредством иммунотерапии. Иммунотерапия может включать первичную иммунизацию с последующей дополнительной, например, одной, двумя, тремя или более бустерными иммунизациями.
"Иммунологически эффективное количество" антигенного пептида IgE по изобретению или его композиции представляет собой количество, которое доставляют субъекту млекопитающему либо в виде однократной дозы, либо в виде части серий, которая является эффективной для индукции иммунного ответа против IgE у указанного субъекта. Это количество варьируется в зависимости от здоровья и физического состояния индивидуума, которого лечат, таксономической группы индивидуума, которого лечат, способности иммунной системы индивидуума синтезировать антитела, препарата вакцины и других релевантных факторов. Ожидают, что количество находится в относительно широком диапазоне, который можно определить посредством рутинных испытаний.
"Фармацевтически эффективная доза" или "терапевтически эффективная доза" представляет собой дозу, необходимую для лечения или предупреждения, или облегчения одного или более IgE-ассоциированных расстройств или симптомов у субъекта. Фармацевтически эффективная доза зависит, в том числе, от конкретного соединения для введения, тяжести симптомов, чувствительности субъекта к побочным эффектам, типа заболевания, используемой композиции, пути введения, типа млекопитающего, которого лечат, физических характеристик конкретного рассматриваемого млекопитающего, таких как здоровье и физическое состояние, сопутствующие лекарственные препараты, способность иммунной системы индивидуума синтезировать антитела, степени желаемой защиты и других факторов, которые могут быть определены специалистами в данной области. Для профилактики выбрано такое количество пептида в каждой дозе в типичных вакцинах, которое индуцирует иммунозащитный ответ без существенных вредных побочных эффектов. Вслед за первоначальной вакцинацией субъекты могут получать одну или несколько повторных бустерных иммунизации адекватно разделенных в пространстве.
Понятно, что уровень специфической дозы для конкретного пациента зависит от разных факторов, включающих активность используемого конкретного соединения, возраст, массу тела, общее состояние здоровья, пол, диету, время введения, путь введения и уровень выведения, комбинацию лекарств и тяжесть конкретного заболевания, подвергаемого лечению.
Например, антигенные пептиды IgE или фармацевтическую композицию по изобретению можно вводить субъекту в дозе от примерно 0,1 мкг до примерно 200 мг, например, от примерно 0,1 мкг до примерно 5 мкг, от примерно 5 мкг до примерно 10 мкг, от примерною мкг до примерно 25 мкг, от примерно 25 мкг до примерно 50 мкг, от примерно 50 мкг до примерно 100 мкг, от примерно 100 мкг до примерно 500 мкг, от примерно 500 мкг до примерно 1 мг, от примерно 1 мг до примерно 2 мг, с оптимальными бустерами, даваемыми, например, через 1 неделю, 2 недели, 3 недели, 4 недели, два месяца, три месяца, 6 месяцев и/или год.
B нeкоторых воплощениях вводят однократную дозу антигенного пептида IgE или фармацевтической композиции согласно изобретению. В других воплощениях вводят множественные дозы антигенного пептида IgE или фармацевтической композиции согласно изобретению. Частота введения может варьироваться в зависимости от любого из множества факторов, например, тяжести симптомов, степени желаемой иммунозащиты, независимо от того, используется композиция для профилактической или куративной целей, и т.д. Например, в некоторых воплощениях антигенный пептид IgE или фармацевтическую композицию согласно изобретению вводят один раз в месяц, два раза в месяц, три раза в месяц, один раз в две недели (qow), один раз в неделю (qw), два раза в неделю (biw), три раза в неделю (tiw), четыре раза в неделю, пять раз в неделю, шесть раз в неделю, через сутки (qod), ежесуточно (qd), два раза в сутки (qid), или три раза в сутки (tid). Когда композицию по изобретению используют для профилактических целей, тогда ее обычно вводят как для примирующей, так и бустерной доз. Ожидают, что бустерные дозы будут адекватно распределены или предпочтительно будут даваться ежегодно или в такое время, когда уровень циркулирующих антител падает ниже желаемого уровня. Бустерные дозы могут состоять из антигенного пептида IgE в отсутствие первоначальной иммуногенной молекулы-носителя. Такие бустерные конструкции могут содержать альтернативный иммуногенный носитель или могут быть в отсутствие какого-либо носителя. Такие бустерные композиции могут быть приготовлены либо с адъювантом, либо без адъюванта.
Продолжительность введения антигенного пептида IgE согласно изобретению, например, период времени, в течение которого вводят антигенный пептид IgE, может варьироваться, в зависимости от любого из множества факторов, например, реакции пациента и т.д. Например, антигенный пептид IgE можно вводить в течение периода времени, варьирующего от примерно одних сутокя до примерно одной недели, от примерно двух недель до примерно четырех недель, от примерно одного месяца до примерно двух месяцев, от примерно двух месяцев до примерно четырех месяцев, от примерно четырех месяцев до примерно шести месяцев, от примерно шести месяцев до примерно восьми месяцев, от примерно восьми месяцев до примерно 1 года или от примерно 1 года до примерно 2 лет или от примерно 2 лет до примерно 4 лет или более.
В настоящем описании также предусмотрены различные способы лечения, которые включают введение антигенного пептида IgE согласно изобретению. Настоящие способы лечения включают способы индукции иммунного ответа у индивидуума к собственному IgE и способы предупреждения, облегчения или лечения IgE-опосредованного расстройства или симптома у индивидуума.
В одном аспекте в настоящем изобретении предложен способ лечения, предупреждения или облегчения IgE-ассоциированного расстройства или симптома у субъекта, включающий введение терапевтически эффективного количества антигенного пептида IgE по изобретению или его иммуногенной или фармацевтической композиции указанному субъекту.
В другом аспекте в настоящем изобретении предложен способ индукции иммунного ответа против собственного IgE у субъекта, включающий введение терапевтически или иммуногенно эффективного количества антигенного пептида IgE по изобретению или его иммуногенной или фармацевтической композиции указанному субъекту.
"Лечить", "проведение лечения" и "лечение" относятся к способу облегчения или отмены биологического расстройства и/или по меньшей мере одного из его сопутствующих симптомов. Используемый в данной заявке термин "облегчение" заболевания, расстройства или состояния означает снижение тяжести и/или частоты встречаемости симптомов заболевания, расстройсва или состояния. Кроме того, используемые в данном описании ссылки на "лечение" включают ссылки на куративное, паллиативное и профилактичекое лечение. Указанный субъект предпочтительно является человеком и может быть мужского или женского пола, любого возраста.
Другие аспекты изобретения относятся к антигенному пептиду IgE согласно изобретению или его иммуногенной композиции или фармацевтической композиции для применения в качестве лекарственного стредства, предпочтительно в лечении, облегчении или профилактике IgE-ассоциированного расстройства.
В еще одном аспекте настоящее в изобретении предложено применение антигенного пептида IgE по изобретению или его иммуногенной композиции или фармацевтической композиции в изготовлении лекарственного стредства, предпочтительно для лечения IgЕ-опосредованного расстройства.
В некоторых аспектах применений или способов по изобретению указанное IgE-опосредованное расстройство выбрано из группы, состоящей из конъюнктивита, аллергической астмы, аллергического ринита, атопического дерматита, анафилаксии, астмы, контактного дерматита, аллергической гастроэнтеропатии, аллергического легочного аспергиллеза, аллергической пурпуры, экземы, гипер-IgE синдрома (Джоба), анафилактической гиперчувствительности, IgE миеломы, воспалительного заболевания кишечника (например, болезни Крона, пищевых аллергий, неспецифического язвенного колита, неопределенного колита, инфекционного колита), крапивницы, псориаза, предпочтительно из группы, состоящей из астмы, аллергической астмы, аллергического ринита и пищевых аллергий.
Астма представляет собой хроническое воспалительное расстройство дыхательных путей, вызывающее повторяющиеся эпизоды хрипов, одышки, сдавленности в груди и/или кашля у чувствительных индивидуумов. Специалисты в данной области выделяют различные типы астмы, включая: аллергическую астму, которая, как полагают, возникает у пациентов, имеющих развитую гиперчувствительность к аллергенам окружающей среды; астму, индуцированную лекарственными средствами, обычно вызванную чувствительностью к аспирину или другим ингибиторам ЦОГ (циклооксигеназы); астму, индуцированную физической нагрузкой; почти фатальную и гиперострую астму; ночную астму; профессиональную бронхиальную астму, обычно вызванную воздействием определенных химических веществ на рабочем месте. Таким образом, астма может быть вызвана различными стимулами, включая: находящиеся в воздухе аллергены, такие как клещи домашней пыли, пыльца, перхоть животных, споры грибов, перья … (экзогенная бронхиальная астма); неспецифические раздражители, такие как табачный дым, химические испарения, загрязнение окружающей среды, сернистый газ … (эндогенная бронхиальная астма).
Аллергический ринит обычно включает набор симптомов, включая воспалительные симптомы, преимущественно в носу, придаточных пазухах носа и глазах, которые появляются после воздействия частиц, находящихся в воздухе. Симптомы включают чихание; заложенность носа; насморк (и иногда носовое кровотечение); кашель; головную боль; зуд в носу, во рту, в глазах, в горле, на коже или любом месте которое подверглось воздействия аллергена; ухудшенное обоняние (и, таким образом, чувствительность к запахам); заложенный нос (заложенность носа); конъюнктивит; слезящиеся глаза; боль в горле и хрипы.
Аллергический ринит может быть хроническим и/или сезонным. Хронический аллергический ринит представляет собой аллергический ринит, который длится в течение года. Он обычно вызывается непрерывным воздействием аллергенов, таких как перхоть животных, споры плесени внутри помещений или клещи домашней пыли. Сезонный аллергический ринит представляет собой аллергический ринит, который наблюдается только в течение определенного времени года. Он обычно вызван аллергиями на дерево, траву и пыльцу сорняков, которые образуются сезонно.
Пищевая аллергия является гипериммунным ответом, вызванным яйцами, арахисом, молоком или какой-либо другой специфической пищей. Любая пища может вызывать аллергическую реакцию, но только некоторые продукты являются главными виновниками. У детей наиболее распространенные пищевые аллергии вызываются яйцами, арахисом, молоком, соей, лесными орехами, пшеницей, ракообразными (креветками, крабами, омарами, улитками, моллюсками). У детей старшего возраста и взрослых наиболее распространенные пищевые аллергии вызываются арахисом, лесными орехами, моллюсками, рыбой. Симптомы могут ограничиваться в основном желудком и кишечником и могут вовлекать многие части тела после переваривания или поглощения пищи. Симптомы могут включать: першение в горле, анафилаксию (тяжелую, аллергическую реакцию всего организма, которая может привести к смерти); боль в животе; диарею; тошноту; рвоту; спазмы в животе; зуд в полости рта, в горле, в глазах, на коже или в любой другой области; крапивницу; отек Квинке (отек, особенно век, лица, губ и языка); головокружение или обморок; заложенность носа; насморк; одышку; хрипы; затрудненное глотание; оральный аллергический синдром. Оральный аллергический синдром обычно включает зуд губ, языка и горла и иногда опухшие губы.
В других аспектах применений или способов по изобретению указанный субъект представляет собой млекопитающее, предпочтительно человека.
В других аспектах применений или способов по изобретению указанный субъект страдает от указанного IgE-опосредованного расстройства. Альтернативно, указанный субъект подвержен риску возникновения указанного IgE-опосредованного расстройства.
ПРИМЕРЫ
Следующие примеры представлены для того, чтобы обеспечить специалистов в данной области полным раскрытием и описанием того, как сделать и использовать настоящее изобретение, и не предназначены для ограничения объема того, что авторы изобретения рассматривают в качестве их изобретения, и не предназначены для представления того, что эксперименты ниже представляют собой все или единственные проведенные эксперименты. Были предприняты попытки обеспечить точность в отношении используемых чисел (например, количеств, температуры и т.д.), но следует учитывать некоторые экспериментальные ошибки и отклонения. Если не указано иное, то части являются частями по массе, молекулярная масса является средней молекулярной массой, температура представлена в градусах Цельсия, и давление является атмосферным или примерно атмосферным. Могут быть использованы общепринятые сокращения, например, п.о., пара(ы) оснований; т.п.о., тысяча(и) пар оснований; пкл, пиколитр(ы); с или сек, секунда(ы); мин, минута(ы); ч, час(ы); а.к., аминокислота(ы); т.п.о., тысяча(и) пар оснований; п.о., пара(ы) оснований; н.т., нуклеотид(ы); в/м, внутримышечный(но); в/б, внутрибрюшинное(но); п/к, подкожный(но); и тому подобное.
Пример 1. Выбор антигенных пептидов IgE
Была определена и опубликована структура константных доменов СН3-СН4 из человеческого IgE, взаимодействующих с альфа-субъединицей высокоаффинного рецептора IgE FceRI (Wurzburg BA et al., (2000) Immunity, 13 (3), 375-85; Garman SC et al., (2000) Nature 20, 406 (6793), 259-66). Эту структурную информацию использовали вместе с литературой, предполагая, что существуют две области, где происходит связывание, для идентификации 4 потенциальных петель в качестве ключевых точек взаимодействия и для конструирования следующих 4 пептидов, которые будут соответствовать областям, имеющим значение для взаимодействия IgE-FceRI (см. Фиг.1).
Пурпурный: ADSNPRGVSAYLSRPSP (SEQ ID NO: 312)
Синий: LWDLAPSKGTVN (SEQ ID NO: 165)
Оранжевый: STRKEEKQRNGTLTVTSTLP(SEQ ID NO: 1)
Жeлтый: QCRVTHPHLPRALMRS (SEQ ID NO: 220)
Пример 2. Получение конъюгатов Пурпурный-VLP
Пурпурный пептид (SEQ ID NO: 312), в котором концевой остаток цистеина добавляли для целей конъюгирования (последовательность ADSNPRGVSAYLSRPSPC (SEQ ID NO: 434)), синтезировали с использованием стандартного Fmoc протокола на амидной смоле CLEAR. Реакции сочетания аминокислот проводили с использованием 5-кратного избытка Fmoc-защищенной аминокислоты, активированной с помощью 1 экв. HBTU (2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат) в присутствии HOBt (гидроксибензотриазол) и NMM (N-метилморфолин). Снятие Fmoc-группы осуществляли смесью 20% пиперидин/DMF. Связанный со смолой пептид затем отщепляли и защитные группы боковой цепи удаляли одновременно с реагентом D (TFA/H2O/DODT: 89/3/8). Пептид получали со свободным N-концом и амидированным С-концом. Неочищенный пептид очищали до гомогенного состояния с помощью ВЭЖХ с использованием ВЕН 130 С18 колонки и градиента вода/ацетонитрил в присутствии 0,1% TFA. Очищенный пептид подвергали вакуумной сушке с использованием лиофилизатора. Пептид анализировали с использованием масс-спектрометрии (LC-MS) и получили удовлетворительные данные (см. ниже).
Пурпурный + Cyst (SEQ ID NO: 434) пептид конъюгировали с вирусоподобными частицами (VLP) Qp и поверхностным антигеном вируса гепатита В (HBsAg) в двух различных экспериментах по конъюгированию. Qβ, используемый в данном исследовании, продуцировали посредством ферментации бактериального штамма BL21 (DE3) e.coli, включающего плазмиду рЕТ28, кодирующую мономерный белок массой 14 кДа: MAKLETVTLGN1GKDGKQTLVLNPRGVNPTNGVASLSQAGAVPALEKRVTVSVSQP SRNRKNYKVQVKIQNPTACTANGSCDPSVTRQAYADVTFSFTQYSTDEERAFVRTE LAALLASPLLIDAIDQLNPAY (SEQ ID NO: 435). Ферментацию индуцируют при OD600 0,8 СС помощью IРТС (изопропилтиогадактозид) и позволяют ей протекать в течение ночи в terrific broth (ТВ) с канамицином. VLP, которые подвергаются самосборке в клетке-хозяине, затем очищали от клеточного осадка после ферментации с использованием способа, описанного в патентной заявке ЕР 20050105513 со следующими различиями: после разрушения клеток осветленный гомогенат обрабатывали сульфатом аммония при 50%-ном насыщении, и клеточный осадок извлекали с помощью центрифугирования. Затем осадок перерастворяли в буфере HEPES и подвергали диализу против HEPES буфера перед осуществлением первой колоночной стадии в опубликованном способе. После стадий ионообменной колонки и гидроксиапатитной колонки материал очищали с использованием дополнительной стадии анионообменной колонки и подвергали стерилизации фильтрованием для получения конечного нефасованного VLP материала, который анализировали с помощью эксклюзионной хроматографии, ПААГ-ДСН (полиакриламидный гель с додецилсульфатом натрия) и электронной микроскопии с приемлемыми результатами.
HBsAg (подтип adw), используемый в этом исследовании, приобретали у Aldevron (ND, США). HBsAg существует в виде сферических частиц с диаметром примерно 22 нм, которые состоят из нескольких копий из мономерного белка 24 кДа, погруженного в липидную бислойную везикулу. Штамм S. cerevisiae для продукции HBsAg этого типа также может быть получен из коллекции культур АТСС (Американская коллекция типовых культур).
VLP (и Qβ, и HBsAg) активировали с использованием связующего реагента N-гамма-малеимидо-бутирилокси-сукцинимидного сложного эфира (GMBS). Реагент GMBS растворяли в диметилсульфоксиде (DMSO) и добавляли к раствору VLP в не менее чем 10-кратном молярном избытке. Реакцию активации проводили в течение не менее 30 минут и раствор затем обессоливали с использованием обессоливающей колонки NAP-25 в забуференном фосфатами физиологическом растворе в модификации Дульбекко (DPBS) с 5 мМ EDTA. При необходимости, раствор белка концентрировали слегка с использованием 10 кДа spin микроконцентраторов перед последующей реакцией конъюгирования.
Перед реакцией конъюгирования пурпурный пептид растворяли в аликвоте DPBS с pH 7,4, c 5 мМ EDTA в качестве добавки. Концентрация пептидa в paствope состaвлялa 10 мг/мл. Растворенный пeптид дoбавляли аликвоту ТСЕР иммобилизованного восстановителя (Pierce Chemical), который промывали в DPBS, содержащем 5 мМ EDTA. Аликвоту пептидов инкубировали при перемешивании в присутствии ТСЕР геля в течение приблизительно 1 часа, после чего аликвоту осаждали в микроцентрифуге и твердый осадок отбрасывали. Восстановленный пептид-содержащий супернатант добавляли непосредственно к активированным VLP, которые были получены ранее.
Реакцию между VLP и восстановленными пептидами проводили в течение по меньшей мере тридцати минут при очень слабом перемешивании. В конце реакционного времени каждый образец обессоливали в PBS в модификации Дульбекко (DPBS) с использованием обессоливающих колонок NAP-10 или NAP-25 (GE Healthcare). Обессоленные конъюгированные пептиды анализировали в отношении содержания белка с использованием анализа по Брэдфорду (Coomassie Brilliant Blue, Pierce Chemical), а также ПААГ-ДСН и эксклюзионной хроматографии. Конъюгированные продукты стерилизовали фильтрованием с использованием фильтра 0,22 мкм и хранили при 2-8°С до применения. Особое внимание уделяли этим образцам во время хранения для предупреждения замораживания или воздействия экстремальных температур.
Степень конъюгирования для двух VLP-пептидных образцов измеряли с использованием ПААГ-ДСН, и увеличение молекулярной массы наблюдали в обоих образцах, что согласуется с добавлением пептида к VLP белковому мономеру. Кроме того, образец Qβ-пептида тестировали в анализе посредством эксклюзионной ВЭЖХ (с использованием колонки Tosoh PWXL5000 HPLC) и обнаружили, что он содержит собранные VLP по сравнению с неконъюгированными образцами VLP. Кроме того, образец Qβ-пептида наблюдали с использованием электронной микроскопии с использованием JEOL 1230 ТЕМ с лучом 80 кВ и обнаружили, что он содержит собранные, однородные частицы. Целостность конъюгированной частицы HBsAg-пептид тестировали с использованием ПААГ-ДСН в невосстанавливающих условиях, и поскольку белок не входил в гель, считали, что образец содержит высокомолекулярные частицы и подходит для применения in vivo.
Пример 3. Получение Оранжевого, Пурпурного, Желтого и Синего-VLP конъюгатов, а также Пурпурного-Ограниченного и Синего-Улучшенного-VLP конъюгатов
Желтый, Синий+Cyst, Пурпурный+Сyst и Оранжевый+Сyst пептиды, аминокислотные последовательности которых приведены в Таблице 2, синтезировали в соответствии с методами, известными в данной области, и в основном в соответствии с протоколом в Примере 2 следующим образом. Пептиды синтезировали с помощью пептидного синтезатора Symphony со стандартным Fmoc-протоколом на амидной смоле CLEAR, за исключением пептида Желтый, который синтезировали на предварительно нагруженной смоле Fmoc-Ser(tBU)-Wang. См. Пример 2 для деталей реакций сочетания и снятия защиты. Все пептиды сделали со свободным N-концом и амидированным С-концом, за исключением пептида Желтый, который сделали с ацетилированным N-концом и карбоксилированным С-концом. Неочищенные пептиды очищали в системе ВЭЖХ с помощью ВЕН 130 С18 колонки, как в Примере 2. Очищенные пептиды сушили в вакууме с использованием лиофилизатора. В конце пептиды анализировали с помощью LC-MS (жидкостная хроматография/масс-спектрометрия), и все пептиды дали удовлетворительные результаты (см. Таблицу 3 ниже).
Пептиды Синий-Улучшенный и Пурпурный-Ограниченный были изготовлены СЕМ Corporation (Matthews, NC, США), Пептиды изготавливали с использованием стандартных методов химии пептидов и очищали с использованием хроматографии. Очищенные пептиды анализировали с использованием LC-MS и обнаружили, что они имеют высокую степень чистоты (более 95%) (см. Таблицу 3 ниже).
Подчеркивание показывает остатки цистеина, предназначенные для конъюгирования, и двойное подчеркивание показывает GC-линкер.
Каждый пептид конъюгировали с вирусоподобной частицей (VLP) Qβ отдельными партиями. Qβ, используемый в данном исследовании, продуцировали посредством ферментации бактерий Е.соli и тщательной очистки, как в Примере 2.
VLP (концентрация белка более 1 мг/мл по методу Брэдфорда) активировали с использованием связующего реагента N-гамма-малеимидобутирилокси-сукцинимидного сложного эфира (GMBS) от Pierce Chemical, как описано в Примере 2 выше.
Перед реакцией конъюгирования каждый пептид растворяли в аликвоте забуференного фосфатами физиологического раствора в модификации Дульбекко, рН 7,4 с 5 мМ EDTA, в качестве добавки. Концентрация каждого пептида в растворе находилась в диапазоне 8-12 мг/мл, см. Таблицу 4 ниже для точных данных. Солюбилизированный пептид добавляли к аликвоте ТСЕР иммобилизованного восстановителя, как описано в Примере 2 выше. Восстановленный пептид-содержащий супернатант добавляли непосредственно к активированным VLP, полученным ранее.
Реакцию между VLPs и восстановленными пептидами проводили в течение по меньшей мере тридцати минут при слабом перемешивании. В конце реакционного времени каждый образец обессоливали в PBS в модификации Дульбекко (DPBS) с использованием обессоливающих колонок NAP-10 или NAP-25 (GE Healthcare). Обессоленные конъюгированные пептиды затем концентрировали с использованием spin концентраторов с MWCO (отсечение по молекулярной массе) 10 кДа и анализировали в отношении содержания белка с использованием анализа по Брэдфорду (Coomassie Brilliant Blue, Pierce Chemical), а также ПАА-ДСН и эксклюзионной хроматографии, см. ниже для дополнительных деталей. Конъюгированные продукты стерилизовали фильтрованием с использованием фильра 0,22 мкм и хранили при 2-8°С до применения. Особое внимание уделяли этим образцам во время хранения для предупреждения замораживания или воздействия экстремальных температур.
VLP-пептидные конъюгаты анализировали в отношении степени конъюгирования и сборки частиц, как описано в Примере 2 выше (ПААГ-ДСН, включая денситометрию, электронную микроскопию и эксклюзионную ВЭЖХ).
Пример 4: Получение Оранжевого, Пурпурного, Желтого и Синего-KLH конъюгатов, а также Пурпурного-Ограниченного и Синего-Улучшенного конъюгатов
Пептиды из Таблицы 2 конъюгировали с KLH, приобретенным у Pierce Chemical (Rockford, Illinois, США) и очищенным следующим образом. Пептиды получали, как описано в Примерах 2 и 3 выше. В качестве KLH использовали Imject малеимид-активированный KLH, поставляемый Pierce Chemical в виде лиофилизированного твердого вещества. Флаконы с этим KLH разбавляли водой с чистотой, подходящей для культивирования тканей, перед добавлением пептидов. Пептиды обрабатывали ТСЕР-гелем как описано в Примерах 2 и 3 выше, и восстановленные пептид-содержащие супернатанты добавляют непосредственно к аликвотам раствора активированного KLH и инкубировали при слабом перемешивании. Реакцию сочетания проводили в течение двух часов, после чего растворы центрифугировали для удаления твердых веществ и обессоливали с использованием, как и ранее, обессоливающих колонок с прокалыванием под действием силы тяжести. Обессоленные конъюгаты анализировали с помощью ПААГ-ДСН, анализа белка по Брэдфорду и переваривания трипсином с последующим MS-MALDI анализом. Конъюгаты стерилизовали фильтрованием с использованием фильтра 0,22 мкм и хранили при 2-8°С до применения, поскольку замораживание растворов KLH не рекомендуется.
Пример 5. Определение пептида IgE
Это исследование было нацелено на оценку того, как эффективные пептиды, конъюгированные с VLP Qbeta (как подробно описано в Примерах 2 и 3 выше), которые могут связываться с человеческим IgE, индуцировали антительный ответ. Самкам Balb/c (6-8 недель) инъецировали внутримышечно (объем 50 мкл инъецировали в каждую Tibialis anterior (переднюю большеберцовую) мышцу) на 0, 19 и 34 сутки. Вскрытие производили на 46 сутки. При вскрытии 400-600 мкл крови собирали из подвергнутых эвтаназии мышей посредством пункции сердца. Кровь оставляли для коагуляции в течение ночи и на следующий день собирали сыворотку.
Антительные ответы у иммунизированных животных исследовали для некоторых или всех следующих анализов: а) определение титра IgG, б) связывание с сывороточным свободным IgE, в) связывание с FceRI-связанным IgE, г) анализ дегрануляции и д) количественные анализы IgE.
а) Определение общего титра IgG
Краткое содержание: Колориметрический ELISA (твердофазный иммуноферментный) анализ, который определяет реципрокный титр (RT), который представляет уровни общих молекул IgG, которые характерны для вакцины. Серийные разведения готовили из образцов сывороток и тестировали в данном анализе. Образец сыворотки, полученной путем объединения образцов сывороток Се3-вакцинированных мышей, использовали в качестве положительного контроля. Balb/c neg (отр.) сыворотку из Harlan Labs использовали в качестве отрицательного контроля (собрана от 400 животных Harlan laboratories Code# R-0131D). Нанесение покрытия на планшеты для анализа: 384-луночные планшеты для анализа с высоким связыванием (Coming International Cat#3700) покрывали 25 мкл/лунку концентрата человеческого белка Се3Се4, разведенного до 1 мкг/мл с помощью 0,01 М PBS, рН 7,4 и инкубировали на шейкере при к.т. (комнатная температура) в течение 3 часов. После промывки × 2 PBS рН 7,4, планшеты блокировали с использованием 80 мкл/лунку 0,01 М PBS/1% БСА, инкубировали при к.т. в течение 1 часа перед конечной промывкой × 3 0,01 М PBS рН 7,4/0,05% Tween 20, Получение и анализ образца: На следующие сутки 8-точечное ½ log серийное разведение каждого образца готовили, начиная с разведения 1:100 (разбавитель PBS/1% БСА), 25 мкл/лунку серийного разведения переносили в двух повторах на планшет, покрытый человеческим Се3Се4, затем инкубировали при встряхивании при к.т. в течение 1,5 часов. После промывки х 3 0,01 М PBS рН 7,4/0,05% Tween 20, добавляли 25 мкл/лунку антитела для детекции общего IgG (Rabbit anti-mu IgG-Fc, Cat# A90-130A Bethyl Laboratories) 1:6000 с 0,01 М PBS рН 7,4/1% БСА, затем инкубировали при встряхивании при к.т. в течение 1 часа. После промывки × 5 0,01 М PBS рН 7,4/0,05% Tween 20, добавляли 25 мкл/лунку набора Bio-Rad козлиных антител против кролика, конъюгированных с пероксидазой хрена (Bio-Rad Cat#172-1019) 1:3000 с 0,01 М PBS рН 7,4/0,05% Tween 20 рН 7,4, затем инкубировали при встряхивании при к.т. в течение 1 часа. После промывки × 4 0,01 М PBS рН 7,4/0,05% Tween 20, затем × 1 0,01 М PBS рН 7,4 только, добавляли 25 мкл/лунку субстрата Mouse Турег HRP (Bio-Rad Cat#172-1064), затем инкубировали при к.т. в течение 30 минут. Добавляли 25 мкл/лунку 2% щавелевой кислоты, считывали поглощение при 405 нм. Анализ результатов: Значение отсечения (поглощение при 405 нм) вычисляли, беря среднее считываний повторов, полученных при наименьшей концентрации соответствующей отрицательной контрольной группы в исследовании, и умножая это значение на 2,5. Кривые титрования наносили на график для каждого тестируемого образца (титр образца против поглощение при 405 нм), и титр образца (впоследствии преобразованный в реципрокный титр) предсказывали из расчитанного значения отсечения.
б) Титр связывания свободного IgE
Краткое содержание: Анализ электрохемилюминесценции (ECL), которая генерирует реципрокный титр (РТ) и максимальное значение для представления об уровнях комплексов мышиный IgE: человеческий IgE, образующихся после инкубации серийных разведении тестируемых сывороток в течение ночи с высокой концентрацией человеческого IgE. Образец сыворотки, полученный из объединенных образцов сывороток от Се3-вакцинированных мышей, использовали в качестве положительного контроля, наряду с мышиным антителом к области Се3 домена человеческого IgE (AbDserotec 0100-0413 (Е411 (5Н2)), добавленным при 50 мкг/мл и 1 мг/мл в Balb/c neg сыворотку от Harlan Labs (собранную от 400 животных Harlan laboratories Code# R-0131D), которую также использовали отдельно в качестве отрицательного контроля. Инкубация образцов с человеческим IgE: 8-точечное ½ log серийное разведение каждого образца, включая контроли, готовили, начиная с разведения 1:3 (разбавитель 0,01 М PBS рН 7,4/1% БСА). Объемы по 10 мкл каждой концентрации образца смешивали с 10 мкл 100 мкг/мл человеческого IgE (разведенного из концентрата с использованием 0,01 М PBS рН 7,4/1% БСА), затем планшеты герметично закрывали и инкубировали в течение ночи при 4°С. Нанесение покрытия на планшеты для анализа: На следующие сутки 384-луночные планшеты для анализа (Meso-Scale Diagnostics (MSD) standard bind Cat# L11XA-1, 0370PA) покрывали 12 мкл/лунку поликлональных антител (pAb) овцы к человеческому IgE (Gentaur, ICL (Immunology Consultants Lab) Cat# SE-80A), разведенных до 1 мкг/мл с помощью 0,01 М PBS рН 7,4, затем инкубировали на шейкере при к.т. в течение 2 часов. После промывки × 3 0,01 М PBS рН 7,4 планшеты блокировали с использованием 25 мкл/лунку исходного блокирующего буфера Pierce (Pierce Biotech. Cat# 37538) и инкубировали на шейкере при к.т. в течение 40 минут перед конечной промывкой × 3 0,01 М PBS рН 7,4. Получение и анализ образца: Объемы по 20 мкл после инкубации в течение ночи смеси сывороток с человеческим IgE разбавляли 1:5 с 80 мкл/лунку 0,01 М PBS рН 7,4/1% БСА и затем 12 мкл/лунку переносили в двух повторах в MSD-покрытые планшеты для анализа. После инкубации на шейкере при к.т. в течение 2 часов планшеты промывали × 3 0,01 М PBS рН 7,4/0,05% Tween 20. Добавляли 12 мкл/лунку детектирующего антитела (pAb осла к мышиным IgG H+L Abeam Cat# ab6707, MSD SULFO-меченый с использованием MSD Cat# R91AN-1) 1:5000 с 0,01 М PBS рН 7,4/1% БСА, затем инкубировали при встряхивании при к.т. в течение 1 часа. После промывки × 3 0,01 M PBS pH 7, 4/0,05% Tween 207 добавляли 50 мкл/лунку буфера для считывания MSD Т (4х) с поверхностно-активным веществом (MSD Cat# R92TC) 1:2 с MQ водой. Планшеты считывали с использованием MSD Sector Imager 6000.
Анализ результатов: Значение отсечения (в пикселях) вычисляли, беря среднее сичтываний повторов, полученных при наименьших концентрациях соответствующей отрицательной контрольной группы в исследовании, и умножая это число на 5. Кривые титрования наносили на график для каждого тестируемого образца (титр образца против пикселей) и титр образца (впоследствии преобразованный в реципрокный титр) определяли из вычисленного значения отсечения. Максимальное значение пика кривых титрования также регистрировали.
в) Связывание с рецептор-связанным IqE
В этом анализе определяют, могут ли антитела в сыворотке от вакцинированных мышей связываться с некоторыми человеческими IgE, связанными с рецептором FceRI на поверхности клеток RBL-THE, антитела которых затем выявляют с помощью антимышиного Fc-специфического антитела, конъюгированного с фикоэритрином, и флуоресценцию измеряют с помощью проточной цитометрии. В качестве положительного контроля использовали антитела против человеческого IgE из Biodesign, разбавленные сывороткой от невакцинированных BALBc. Анализ: Замороженные клетки RBL-THE (р12 10×106 клеток/мл) оттаивали и промывали один раз буфером для анализа (PBS - 5% козьей сыворотки). 2×105 клеток/лунку в блокирующем буфере (PBS - 5% козьей сыворотки - 0,1 мг/мл мышиного Fab (ChromPure Mouse IgG, Fab-фрагмент - Jackson Immunoresearch)) сеяли в 96-луночные планшеты и инкубировали на шейкере при 4°С в течение 1 ч 30 мин. 50 мкл 4 мкг/мл человеческого IgE добавляли в лунку (разбавленного в буфере для анализа) (за исключением контрольных лунок Biodesign без IgE, только с клетками и аМо-РЕ) и планшеты инкубировали в течение 1 часа на шейкере при 4°С. Клетки промывали один раз буфером для анализа и ресуспендировали в 30 мкл античеловеческого IgE (Biodesign 10 мкг/мл, 5 мкг/мл, 2,5 мкг/мл - положительный контроль), разбавленного в 5%-ной сыворотке BALBc или с образцами сывороток от вакцинированных мышей, разбавленными 1:20, 1:40 и 1:80 в буфере для анализа. Образцы сывороток наносили в трех повторах, а контроли в двух повторах. Планшеты инкубировали на шейкере при 4°С в теуение 1 ч 30 мин, затем промывали буфером для анализа, ресуспендировали в 100 мкл козлиного антимышиного Fc-специфического-РЕ антитела (1:200 в буфере для анализа, Goat Jackson Immunoresearch) и инкубировали в течение 45 минут на шейкере при 4°С. Клетки промывали 3 раза буфером для анализа, ресуспендировали в 80 мкл 2%-ного параформальдегида в PBS и инкубировали в течение ночи при 4°С. Интенсивность флуоресценции измеряли с помощью проточной цитометрии. Анализ результатов: Среднюю интенсивность флуоресценции каждого образца использовали для анализа. Отрицательный контроль (только аМо-РЕ) усредняли и его значение вычитали из каждой лунки. Положительный контроль усредняли и каждый образец выражали в виде процента от положительного контроля (Biodesign) при соответствующем разведении сыворотки. Разведение сыворотки 1:40 затем выделяли и осуществляли дисперсионный анализ ANOVA.
г) Анализ дегрануляции
В этом анализе определяют, индуцирует ли сыворотка от вакцинированных мышей дегрануляцию клеток RBL-THE путем измерения активности фермента b-гексозаминидазы, высвобождаемого клетками RBL-THE в среду. Е25 (Xolair), разбавленный в сыворотке невакцинированных мышей BALBc, использовали в качестве отрицательного контроля (40 мкг/мл), и козлиные поликлональные антитела (Sigma), разбавленные в сыворотке невакцинированных мышей BALBc, использовали в качестве положительного контроля. Посев клеток: Замороженные RBL-THE р12 (10×106 клеток/флакон; клетки базофильного лейкоза крыс, стабильно трансфицированные человеческим FceRI) оттаивали, промывали в среде RBL-P (MEM-Earles, дополненная 15% FCS и 2 мМ L-Глутамина) и ресуспендировали в среде RBL-P при 8×105 клеток/мл вместе с 0,25 мкг/мл человеческого IgE. 8×104 клеток/лунку сеяли в 96-луночный планшет с плоским дном и инкубировали в течение 48 часов при 37°С/5% СO2. Приготовление образцов и буферов: На 3 сутки готовили буфер Тироде 1Х (NaCl 135 мМ, KCl 5 мМ, CaCl2 1,8 мМ, MgCl2 1 мМ, Глюкоза 5,6 мМ, БСА 1 мг/мл, Hepes 20 мМ, рН 7,4). Также готовили буфер Тироде-5% сыворотка BALBc, буфер Тироде-2,5% сыворотка BALBc и 1% тритон в буфере Тироде-5% сыворотка BALBc. Положительный контроль (козлиное поликлональное антитело против IgE (82 мг/мл в PBS) - Sigma, I0632) серийно разбавляли в буфере Тироде-5% сыворотка BALBc (первая лунка в бyфepe Tиpoдe-5% cывopоткa BALBc и зaтeм в буфepe Tиpоде) oт 10 мкг/мл дo 2,5 мкг/мл. Отрицательный контроль (Е25) поддерживали постоянным при 40 мкг/мл в разведенной сыворотке BALBc (разведение сыворотки 1:20, 1:40 и 1:80). Образцы тестируемой сыворотки от вакцинированных мышей тестировали при разведении сыворотки 1:20, 1:40 и 1:80. Все контроли и образцы тестируемых сывороток тестировали в трех повторах на каждом планшете. Анализ агонистов: На 3 сутки планшеты с клетками удаляли из инкубатора. 95 мкл среды удаляли из лунок и клетки промывали один раз 200 мкл буфера Тироде, промывочный буфер удаляли и добавляли 70 мкл разбавленных антител (либо положительный контроль, либо отрицательный контроль, либо тестируемый образец сыворотки). Клетки инкубировали при 37°С/5% СO2 в течение 1 часа. В конце инкубации планшеты удаляли из инкубатора и центрифугировали при 1200 об/мин в течение 5 минут для осаждения открепившихся клеток. 65 мкл супернатанта извлекали и помещали в стерильные 96-луночные планшеты. 25 мкл супернатанта тестировали на β-гексозаминидазную активность. β-Гексозаминидазная активность: 25 мкл супернатанта добавляли в 96-луночный планшет. 25 мкл 4 мМ NAGA в цитратном буфере (4 мМ N-ацетил-β-D-глюкозаминид (NAGA) (Sigma, N9376) в 50 мМ цитратном буфере, рН 4,5) добавляли во все лунки (свежеприготовленный), планшеты инкубировали в течение 1 часа при 37°С и 150 мкл 0,2 М глицина рН 10,7 добавляли для прекращения реакции. Планшеты считывали при 405 нм с помощью Envision. Анализ результатов: Дегрануляцию выражали в виде процента от общей активности β-гексозаминидазы из значений для всех лунок (обработанных 1% Тритоном X-100). % дегрануляции при разведении 1:40 затем выделяли для анализа и осуществляли дисперсионный анализ ANOVA на образцах сыворотки.
д) Анализ снижения свободного человеческого IgE
Краткое содержание: Анализ электрохемилюминесценции (ECL), который количественно определяет уровни свободного человеческого IgE, который остается после инкубации в течение ночи аликвот тестируемых сывороток с серийным разведением человеческого IgE, после чего образуются комплексы мышиный !д0:человеческий IgE. Для обеспечения точности количественного анализа человеческого IgE необходимо сначала удалить любые комплексы мышиный IgG: человеческий IgE с использованием белка G, покрытого магнитными шариками Dynabeads, которые связывают любые комплексы через Fc-область мышиного IgG. Значение для % снижения уровней человеческого IgE от значений соответствующих отрицательных контрольных групп можно рассчитать для каждого образца.
В качестве положительного контроля добавляли Xolair/E25 при 40 мкг/мл (стандартная терапевтическая доза) в Balb/c neg сыворотку из Harlan Labs (собранную от 400 животных Harlan laboratories Code# R-0131D), которую также использовали отдельно в качестве отрицательного контроля. Инкубация образцов с человеческим IgE: Объемы по 2 мкл каждой концентрации из 8-точечного ½ log серийного разведения человеческого IgE (разбавитель 0,01 М PBS рН 7,4/1% БСА) добавляли к каждому из 8×10 мкл объемов образцов тестируемых сывороток, включая положительный контроль Xolair/E25 (40 мкг/мл), IgE начинается с конечной концентрации 30 мкг/мл. Планшеты герметично закрывали и инкубировали в течение ночи при 4°С. Нанесение покрытия на планшеты для анализа: На следующие сутки 384-луночные планшеты для анализа (Meso-Scale Diagnostics (MSD) standard bind Cat# L11XA-1, 0370PA) покрывали12 мкл/лунку овечьего рАb к человеческому IgE (Gentaur, ICL (Immunology Consultants Lab) Cat# SE-80A), разбавленного до 5 мкг/мл с 0,01 М PBS рН 7,4, затем инкубировали на шейкере при к.т. в течение 2 часов. После промывки × 3 0,01 М PBS рН 7,4 планшеты блокировали с использованием 25 мкл/лунку исходного блокирующего буфера Pierce (Pierce Biotech. Cat# 37538) и инкубировали на шейкере при к.т. в течение 40 минут перед конечной промывкой × 3 0,01 М PBS рН 7,4. Приготовление образца и Dynabead: Объемы по 5 мкл смесей сывороток после ночной инкубации с человеческим IgE разбавляли 1:20 с 95 мкл/лунку 0,01 М PBS рН 7,4/1% БСА. [Примечание: также разбавляли 10 мкл разведения 1:20 дополнительно 1:2 с 0,01 PBS рН 7,4/1% БСА для тестирования в анализе связывания свободного IgE для измерения комплексов мышиный IgG: человеческий IgE перед инкубацией с шариками, покрытыми белком G]. Необходимый объем 1 × концентрации Protein G Dynabeads (Invitrogen Cat# 10004D) промывали и готовили в виде встроенного пакета, затем концентрировали × 4 посредством ресуспендирования в 0,25 × исходного объема шариков. Инкубация образца с Dynabeads: Смешанные 30 мкл каждого 1:20 образца с 15 мкл/лунку 4х шариков иккубировали при встряхивании при к.т. в течение 1 часа. Шарики из образцов удаляли с использованием планшета с магнитной мешалкой Dynal (Invitrogen Cat# 12027) и смешивали 40 мкл оставшегося образца с 20 мкл свежеприготовленной 4 × смеси шариков, инкубировали при встряхивании при к.т. в течение 1 часа. Переносили 45 мкл/лунку оставшегося образца в новые лунки и центрифугировали 1 мин при 1000 об/мин, возвращали планшеты на планшет с магнитной мешалкой и переносили 40 мкл/лунку в новые лунки. [Примечание: Использовали 30 мкл оставшегося образца для тестирования в анализе связывания свободного IgE для получения измерения комплексов мышиный IgG: человеческий IgE после инкубации с шариками, покрытыми белком G, для удаление всех комплексов]. Количественный анализ: Получали стандартную кривую 12-точечного ½ log серийного разведения человеческого IgE в 80% MSD разбавителе для анализа мышиной сыворотки /20% 0,01 М PBS рН 7,4/1% БСА, начиная с концентрации 5 мкг/мл. Разбавляли оставшийся образец после инкубации шариков 1:5 с использованием MSD разбавителя для анализа мышиной сыворотки (MSD Cat# R52BB-2). Переносили серийные разведения стандартной кривой и образцов в трех повторах при 12 мкл/лунку в MSD-покрытых лунках и инкубировали при встряхивании при к.т. в течение 2 часов. После промывания планшетов × 3 с 0,01 М PBS рН 7,4/0,05% Tween 20, добавляли 12 мкл/лунку детектирующего антитела (кроличье антитело против человеческого IgE, специфическое к эпсилон-цепи Bethyl Cat# A80-109А, MSD SULFO-меченное с использованием MSD Cat# R91AN-1) 1:300 с 0,01 М PBS рН 7,4/1% БСА, затем инкубировали при встряхивании при к.т. в течение 1 часа. После промывки × 3 с 0,01 М PBS рН 7,4/0,05% Tween 20, добавляли 50 мкл/лунку буфера считывания MSD Т (4х) с поверхностно-активным веществом (MSD Cat# R92TC) 1:2 с MQ водой. Планшеты считывали с использованием MSD Sector Imager 6000. [Примечание: Анализ связывания свободного IgE проводили вместе с этим количественным анализом для тестирования образцов до и после инкубации с шариками с использованием такого же протокола, как описано выше, за исключением ослиного детектирующего антитела при разведении 1:2000 с 0,01 М PBS рН 7,4/1% БСА и с использованием античеловеческого детектирующего антитела только для положительного контроля E25/Xolair (SULFO-меченное козлиное античеловеческое IgG MSD Cat# R32AJ-5) при разведении 1:4000 с 0,01 М PBS pFT 7,4/1% БСА]. Анализ результатов: Исходные данные (пиксели) регистрировали, строили стандартную кривую (Log концентрации человеческого IgE нг/мл против Log пикселей) и применяли ассиметричную 5-параметрическую аппроксимацию кривых. Log концентрации IgE в тестируемых образцах предсказывали из стандартной кривой и затем обратно регистрировали (anti-logged) и умножали на 200 для получения фактических концентраций оставшегося свободного IgE в нг/мл. Для каждого образца и контроля вычисляли % снижения уровня человеческого IgE по сравнению с соответствующей контрольной группой и наносили на график против человеческого IgE (нг/мл), первоначально добавленного к образцу сыворотки, на обе оси на логарифмической шкале, для получения кривой титрования.
Результаты
Результаты представлены в Таблице 5 ниже. Более конкретно и неожиданно, это исследование показало, что комбинация конъюгирований Желтого и Пурпурного Qbeta при введении внутримышечным путем при общей дозе 25 мкг конъюгата (т.е. 12,5 мкг индивидуального конъюгата) является наиболее эффективной, и даже более эффективной, чем использование каждого пептидного конъюгата в качестве одного антигена в двойной дозе. Авторы изобретения показали в этом исследовании, что эта комбинация индуцирует иммунный ответ с высокой способностью связывать свободный IgE, а также что эти антитела способны снижать уровни IgE вплоть до 80%, в зависимости от дозы стимула IgE. Эти антительные ответы были не способны связывать рецептор-занятый IgE и не вызывали дегрануляцию рецептор-экспрессирующих клеток-мишеней. Комбинирование Qbeta с адъювантами Квасцы и CPG24555 (где все межнуклеотидные связи в олигонуклеотиде представляют собой фосфоротиоатные связи) было высокоэффективным в индукции этих антительных ответов. В общем, можно заключить, что с точки зрения индукции мышиных IgG антител с высокой способностью связывать свободный человеческий IgE, Желтый пептид является наиболее перспективным пептидом при введении отдельно или в комбинации с Пурпурным или Оранжевым пептидными конъюгатами или с обоими Пурпурным и Оранжевым пептидными конъюгатами, которые вакцинировали при высокой дозе и объеме.
Желтый (высокая доза)
N/A: Не применимо
Общая доза конъюгатов составляет 25 мкг, если не вводится высокая доза, где общая доза составляет 50 мкг на инъекцию
Дозы в сутки 0, 19, 34
Партнер для конъюгирования = VLP Qbeta (вирусоподобная частица)
Адъювант: 20 мкг CPG 24555 (все межнуклеотидные связи являются фосфоротиоатными связями). Квасцы = ALhydrogel™ при 20% об./об.
Пример 6. Исследование гипериммунизации
Это исследование было нацелено на оценку эффекта быстрого режима иммунизации для индукции высокоаффинных антител против IgE. Группам из 8 самок Balb/c мышей (6-8 недель) инъецировали внутрибрюшинно и подкожно пептидные KLH-конъюгаты (как описано в Примере 4 выше) на 0, 3, 8 и 11 сутки. Комбинацию CPG7909 и Alhydrogel (Квасцы 1,3% при 20% об./об.) и неполный адъюванта Фрейнда (IFA) использовали в качестве адъювантов в этом исследовании. Все пептиды конъюгированы с KLH. Вскрытие выполняли на 22 сутки и кровь собирали как в Примере 5.
Антительные ответы у иммунизированных животных исследовали с использованием либо всех, либо некоторых из следующих анализов: а) определение титра IgG, б) связывание с сывороточным свободным IgE, в) связывание с FceRI-связанным IgE, г) анализ дегрануляции и д) количественные анализы IgE. Все анализы подробно описаны в Примере 5.
Результаты
В Таблице 6 суммированы данные из Примера 6. Общие титры в этом исследовании были примерно в 10 раз меньше, чем в VRS-IgE-008-003. Данные из этого исследования показывают, что Пурпурный, Пурпурный - ограниченный, Желтый и Оранжевый пептиды являются иммуногенными. Неожиданно, Синий пептид был очень слабым антигеном и ограничение пептида и повышенная растворимость продемонстрировала повышенную иммуногенность, показывая, что этот пептид следует ограничить для того, чтобы продемонстрировать приемлемую иммуногенность.
Общая доза конъюгатов составляет 25 мкг на инъекцию
Дозы на 0, 3, 8, 11 сутки
Партнер для конъюгирования = KLH
Адъювант: 20 мкг CPG 7909 (все межнуклеотидные связи являются фосфоротиоатными связями), Квасцы = ALhydrogel™ при 20% об./об. + IFA (неполный Фрейнд адъювант)
Пример 7. Эффективность пептидов, конъюгированных с KLH, HBsAg и Qbeta, в индукции ответа антител, которые могут связываться с человеческим IgE
Это исследование было нацелено на оценку того, насколько эффективны пептиды, конъюгированные с KLH, HBsAg и Qbeta (как описано выше в Примерах 2, 3 и 4) в индукции ответа антител, которые могут связываться с человеческим IgE. Самкам Balb/c (6-8 недель) инъецировали внутримышечно (объем 50 мкл инъецировали в каждую Tibialis anterior мышцу) на 0, 19 и 34 сутки. Вскрытие проводили на 46 сутки. При вскрытии собирали 400-600 мкл крови из подвергнутых эвтаназии мышей путем пункции сердца. Кровь оставляли для коагуляции на ночь и на следующий день собирали сыворотку.
Антительные ответы у иммунизированных животных исследовали с использованием либо всех, либо некоторых из следующих анализов: а) определение титра IgG, б) связывание с сывороточным свободным IgE, в) связывание с FceRI-связанным IgE, г) анализ дегрануляции и д) количественный анализы IgE. Все анализы подробно описаны в Примере 5.
Результаты
Это исследование показало, что пурпурный и желтый пептиды являются высокоиммуногенными. Конъюгирование пурпурного пептида с KLH, Qbeta и HBsAg обеспечивала индукцию высоких ответов антител, которые были способны связываться со свободным IgE в очень высокой степени. Эти антительные ответы не были способны связываться с рецептором, занятым IgE, и не вызывали дегрануляцию рецептор-экспрессирующих клеток-мишеней. Оба адъюванта (AbiSCO и CPG 7909 и комбинация квасцов) были эффективны в индукции высоких уровней иммунных ответов.
Общая доза коньюгатов составляет 25 мкг на инъекцию
Дозы на 0, 21 сутки
Партнер для конъюгирования = KLH, Q beta или VLP HBsAg
Адъювант: 20 мкг СРG 24555 (все межнуклеотидные связи являются фосфоротиоатными связями) + Квасцы = ALhydrogel™
при 20% об./об. или 12 мкг AbiSCO
Пример 8: Комбинация пептидных иммуногенов на KLH
Это исследование было нацелено на оценку того, насколько эффективны пептиды, конъюгированные с KLH (как описано выше в Примере 4), в индукции ответа антител, которые могут связываться с человеческим IgE. Самкам Balb/c (6-8 недель) инъецировали внутримышечно (объем 50 мкл инъецировали в каждую Tibialis anterior мышцу) на 0, 19 и 34 сутки. Вскрытие проводили на 46 сутки. При вскрытии собирали 400-600 мкл крови из подвергнутых эвтаназии мышей путем пункции сердца. Кровь оставляли для коагуляции на ночь и на следующий день собирали сыворотку.
Антительные ответы у иммунизированных животных исследовали с использованием либо всех, либо некоторых из следующих анализов: а) определение титра IgG, б) связывание с сывороточным свободным IgE, в) связывание с FceRI-связанным IgE, г) анализ дегрануляции и д) количественный анализы IgE. Все анализы подробно описаны в Примере 5.
Результаты
Это исследование показало, что комбинации Желтого и Оранжевого, Синего и Пурпурного, Желтого и Пурпурного являются высокоиммуногенными и индуцируют ответ антител, которые эффективно связываются со свободным IgE, несмотря на низкие дозы, используемые в этом исследовании из-за ограниченного количества доступных пептидов. Эти антительные ответы не были способны связывать рецептор, занятый IgE, и не вызывали дегрануляцию рецептор-экспрессирующих клеток-мишеней.
Доза для Желтого: 16 мкг на дозу
Доза для Оранжевого: 20,3 мкг на дозу
Доза для Синего: 0,5 мкг на дозу
Доза для Пурпурного: 25,3 мкг на дозу
Дозы на 0, 21 сутки
Партнер для конъюгирования = KLH
Адъювант: 12 мкг AbiSCO
Пример 9: Эффективность конъюгированной вакцины для ослабления устойчивости in vivo (животная модель)
Способность вакцин против пептидов IgE уменьшать уровни IgE in vivo оценивали на животных моделях, используя вид, естественно экспрессирующий повышенные уровни IgE (например, в результате аллергий), или экспериментально индуцируя повышенные уровни IgE с использованием опытных или реальных аллергенов для иммунизации животных. Например, мышей иммунизировали с помощью овальбумина (OVA), не содержащего эндоксин, в качестве модельного антигена, приготовленного с квасцами для индукции IgE ответа на OVA (примерная ссылка Lloyd С et al, J. Immunol 2001, 166, р2033-2040). После индукции IgE-ответов мышей вакцинировали антигенными пептидами, связанными с носителем и приготовленными с адъювантами. Могут быть использованы пептиды из гомологичных областей мышиного IgE (у мышей), гомологичные области другого вида в соответствующем виде животных, а также человеческие пептиды IgE для приматов, отличных от человека. Эффективность вакцинации в снижении уровней IgE затем можно контролировать посредством измерения уровней IgE в сыворотках до и после вакцинации. Кроме того, способность пептидов уменьшать аллергические воспалительные ответы можно измерять, стимулируя мышей интраназальным или интратрахеальным введением OVA (например, в течение 2-5 последовательных суток) и оценивая аллергический воспалительный ответ в легких путем подсчета инфильтрации субпопуляции лейкоцитов в образцах лаважа легких и гистологической оценки рекрутинга эозинофилов в легочную паренхиму, а также метаплазии бокаловидных клеток и продукции слизи (нaпpимep, Coyle A. et al. 1996 J. Exp. Med. 183, 1303-1310.).
Пример 10: Эффективность и пригодность линейных и химически ограниченных пептидов, конъюгированных с Qbeta или HBsAg, в индукции антител, которые могут связываться с человеческим IgE
Одна из проблем использования коротких линейных пептидов в качестве иммуногенов для индукции анти-IgE ответов заключается в точном представлении вторичной структуры IgE, таким образом обеспечивая, чтобы антитела, образованные в результате вакцинации, эффективно распознавали свободный, циркулирующий IgE. Химическое ограничение для введения подходящей вторичной структуры в линейные родительские аминокислотные последовательности может обеспечивать альтернативные иммуногены для индукции антительных ответов к IgE.
Анализ трехмерной структуры доменов Сε3Сε4 IgE, представленный в PDB 1F6A (Garman et al, 2000 Nature 406: p259-266), показал, что некоторые целевые последовательности на границе раздела между Cε3Cε4 и FCeRI-рецептором принимают нелинейные структуры, которые не могут быть хорошо представлены линейными последовательностями, описанными в Таблице 9. Поэтому были идентифицированы последовательности, которые были кандидатами для химического ограничения в попытке оценить способность ограниченных пептидов индуцировать анти-IgE антитела (после введения in vivo), детектируемые в анализе связывания свободного IgE.
Варианты обеих последовательностей Желтого (SEQ ID NO: 220) и Оранжевого + Cyst (SEQ ID NO: 436) отдельно ограничивали двумя различными способами: один способ включал применение «Click»-химии для введения триазольной группировки между двумя соседними атомами в пептидной последовательности. Степень ограничения, влияющая на пептидную последовательность посредством этого способа, можно регулировать путем добавления метиленовых групп к триазольной группировке (Оранжевый 046, Оранжевый 047, Желтый 043, Желтый 044 были получены этим способом). Второй способ включал циклизирование посредством матричного эффекта гетерохирального дипролинового звена (D-Pro-L-Pro), который, как отмечено в литературе, имеет потенциал индукции β-поворота (Spath et al, 1998, Helvetica Chimica Acta 81, p1726-1738); (Оранжевый 044, Оранжевый 045, Желтый 040, Желтый 041, Желтый 042 были получены этим способом). Химические структуры этих ограниченных пептидов представлены в таблице.
Несколько исследований было проведено для оценки иммунных ответов против человеческого IgE, индуцированных либо линейными, либо ограниченными пептидами различной длины, конъюгированными с HBsAg и Qbeta (конъюгирование описано в Примерах 2 и 3).
Ограниченные пептиды Оранжевый + Cyst (SEQ ID NO: 436), Желтый (SEQ ID NO: 220), Оранжевый 044, Оранжевый 045, Оранжевый 046, Оранжевый 047, Желтый 040, Желтый 041, Желтый 042, Желтый 043 и Желтый 044 конъюгировали с вирусоподобными частицами Qbeta с использованием сукцинимидил-6-[β-малеимидопропионамидо]гексаноатной (SMPH) химии с 1,5 Х молярным избытком и использовали в качестве иммуногенов у мышей. Самкам Balb/c (6-8 недель) вводили внутримышечно (50 мкл инъецировали в каждую Tibialis anterior мышцу) с антигеном и Alhydrogel плюс CpG-24555 (все межнуклеотидные связи являются фосфоротиоатными связями) адъюванты в те сутки, которые описаны ниже в Таблице 9. Сыворотки, полученные через 1 неделю после конечного бустера, тестировали в отношении активности анти-IgE антитела в анализе связывания IgE, как описано в Примере 5.
Результаты
Исследования, просуммированные в Таблице 9, показали, что линейные пептиды, полученные из пурпурного, оранжевого и желтого пептидов, конъюгированные с Qbeta и HBsAg, и доставляемые с комбинанированными адъювантами Alhydrogel и CpG24555, индуцировали ответы антител, которые были способны связываться со свободным IgE.
Кроме того, большинство ограниченных пептидных иммуногенов индуцировали антисыворотки, способные связывать свободный человеческий IgE. Неожиданно, Синий 003, 004 и 005 индуцировали только слабые анти-IgE ответы. Оранжевый 047 и Оранжевый 048 не индуцировали анти-IgE антитела выше фонового уровня.
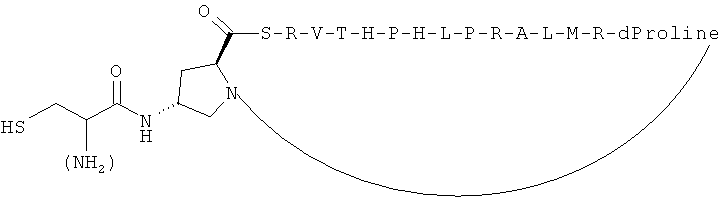
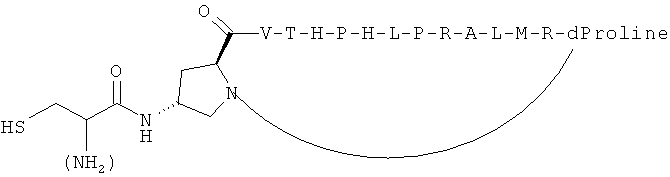
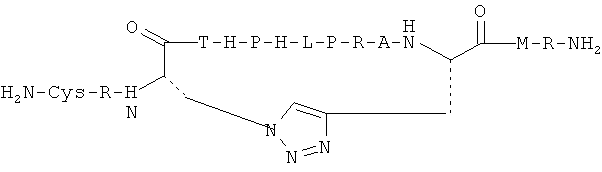
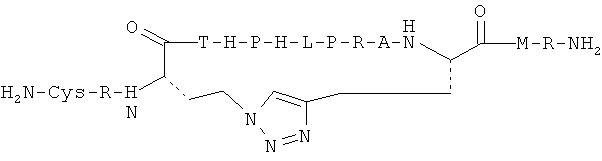
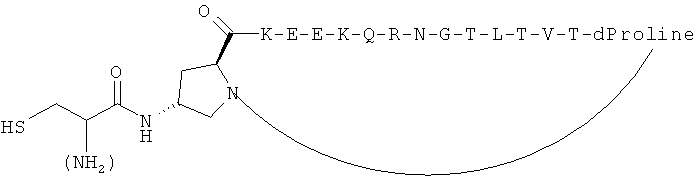
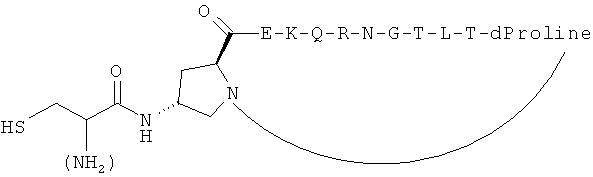
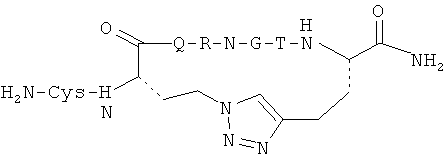
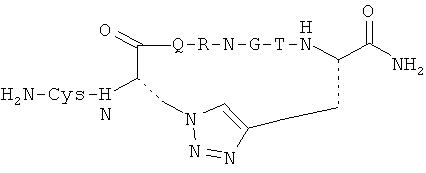
Общая доза конъюгатов составляет 25 мкг на инъекцию, вводимую два раза внутримышечно самкам мышей BALB/c на 0 и 14 сутки, кроме групп, отмеченных*, которым вводили дозы конъюгатов в 50 мкг, и групп, отмеченных^, которым вводили 3 раза дозу на 0, 14, и 28 сутки. Ограниченные пептиды и группы, отмеченные ЛЛ, вводили дозу 3 раза на 0, 21 и 42 сутки.
Партнер для конъюгирования = Q beta или VLP HBsAg (отмечены **)
Адъювант: 20 мкг CPG 24555 (все межнуклеотидные связи являются фосфоротиоатными связями) + ALhydrogel™ при 20% об./об.
ND = не определяли
Примечание - c, cgg, gcc, cdddd и kgg представляют собой линкеры, добавленные к последовательностям пептидов IgE для конъюгирования.
Пример 11: Эффективность пептидов, конъюгированных с Qbeta, HBsAg и DT, в индукции ответа антител, которые могут связываться с человеческим IgE
Это исследование было нацелено на оценку того, насколько эффективны пептиды, конъюгированные с различными носителями, такими как DT, CRM197, экзотоксин A Pseudomonas aeruginosa, HBsAg и Qbeta (как подробно описано в Примерах выше), в индукции ответа антител, которые могут связываться с человеческим IgE. Для получения DT конъюгатов дифтерийный анатоксин (концентрация 3 мг/мл) дериватизировали сукцинимидил-6-[β-малеимидопропионамидо]гексаноатом (SMPH, Thermo Fisher Scientific Inc) при 10-кратном молярном избытке. После этой стадии активации, избыток реагента SMPH удаляли с использованием обессоливающей колонки NAP-25 (GE Healthcare) в забуференном фосфатами физиологическом растворе в модификации Дульбекко (DPBS) с 5 мМ EDTA. Лиофилизированный твердый пептид затем добавляли непосредственно к малеимид-активированному дифтерийному анатоксину и инкубировали при слабом перемешивании в течение 90 минут. После этого образец наносили на обессоливающую колонку NAP-25 (GE Healthcare) и элюировали забуференным фосфатами физиологическим раствором в модификации Дульбекко (DPBS) для удаления свободного пептида. После этого раствор белка концентрировали с использованием 10 кДа spin микроконцентраторов и стерилизовали с использованием фильтра 0,22 мкм и хранили при -80°С до применения. Конъюгаты Qb-пептид и HbsAg-пептид получали следующим образом: VLPs (и Qβ, и HBsAg) активировали с использованием связывающего реагента N-гамма-малеимидо-бутирилокси-сукцинимидного эфира (GMBS) или Сукцинимидил-6-[β-малеимидопропионамидо]гексаноата (SMPH), которые оба получали от Thermo Fisher Scientific Inc. Реагент GMBS или SMPH растворяли в диметилсульфоксиде (DMSO) и добавляли к раствору VLP при не менее чем 5-кратном молярном избытке. Реакцию активации проводили в течение не менее 30 минут и раствор затем обессоливали с использованием обессоливающей колонки NAP-25 (GE Healthcare) с помощью забуференного фосфатами физиологического раствора в модификации Дульбекко (DPBS) с5 мМ EDTA. После этого соответствующее количество твердого лиофилизированного пептида добавляли непосредственно к малеимид-активированным VLP и реакцию между VLPs и пептидами проводили в течение по меньшей мере тридцати минут при слабом перемешивании. В конце реакционного времени каждый образец обессоливали в PBS в модификации Дульбекко (DPBS) с использованием обессоливающей колонки NAP-25 (GE Healthcare). Обессоленные конъюгированные пептиды анализировали на содержание белка с использованием анализа по Брэдфорду (Coomassie Brilliant Blue, Thermo Fisher Scientific Inc.) или анализа ВСА белка (бицинхониновая кислота, Thermo Fisher Scientific Inc.), а также ПААГ-ДСН и эксклюзионной хроматографии.
Самкам Ва1b/с (6-8 недель) инъецировали внутримышечно (50 мкл инъецировали в каждую Tibialis anterior мышцу) пептиды, конъюгированные с Qbeta, поверхностным антигеном вируса гепатита В (HBsAg) или дифтерийным анатоксином (DT), с ALhydrogel плюс CpG адъюванты на 0, 19 и 34 сутки, как описано ниже в Таблице 10. Сыворотки, полученные через 1 неделю после конечного бустирования, тестировали в отношении активности анти-IgE антител в анализе связывания IgE, как описано в Примере 5. Ответы представлены в Таблице 10.
Результаты
Это исследование (Таблица 10) показало, что пептиды ПУРПУРНЫЙ 001 и ЖЕЛТЫЙ 001 (последовательности, показанные в таблице 9) могли индуцировать антитела против человеческого IgE, когда они были конъюгированы с DT, Qbeta или HBsAg. Антитела против человеческого IgE индуцировали с использованием либо GMBS линкера, либо SMPH линкера.
Самок мышей BALB/c иммунизировали на 0 и 14 сутки. Сыворотку собирали и анализировали на 21 сутки.
Партнер для конъюгирования = VLP Q beta, DT или HBsAg (как в Таблице выше) с использованием либо SMPH и GMBS, как указано в Таблице выше.
Адъювант: 20 мкг CPG 24555 (все межнуклеотидные связи являются фосфоротиоатными связями) +ALhydrogel™ при 20% об./об.
Партнер для конъюгирования = Q beta VLP.
Введение дозы самкам мышей BALB/с каждые 4 недели (0, 4, 8). Образцы брали для тестирования через 7 суток после 2ой и 30ей дозы.
Доза Alhydrogel равна дозе вакцины, как выше
CpG-24555 (все межнуклеотидные связи являются фосфоротиоатными связями) вводили в дозе 100 мкг
Истощающую астивность IgE тестировали с использованием 1000 нг/мл человеческого IgE, добавленного в нормальную сыворотку BALE/с (см. подробности в Примере 5)
Пример 12: Эффективность комбинации пептидов больше, чем при использовании одиночных пептидов. конъюгированных с Qbeta, при индукции ответов антител, которые могут связываться с человеческим IgE
Несколько исследований было нацелено на оценку того, как пептиды, конъюгированные с Qbeta (как описано в Примерах выше), индуцируют ответ антител, которые связываются с человеческим IgE. Самки Balb/c (6-8 недельные) были иммунизированы путем внутримышечного введения, как описано в Примере 5, с конкретными временными деталями, как описано в таблицах. Анти-IgE ответы, активность, индуцирующая дегрануляцию, и активность в отношении истощения IgE измеряли, как подробно описано в Примере 5.
Результаты
Как показано в Таблице 11, конъюгирование пептидов (см. последовательности в таблице 9) с Qbeta индуцирует ответы антител, которые способны связываться со свободным IgE, не вызывая дегрануляции выше контрольного значения. Использование Alhydrogel в качестве единственного адъюванта является эффективным, и комбинация пурпурных пептидов и желтых пептидов индуцировала более высокие ответы антител, связывающихся с IgE. Кроме того, комбинация пептидов индуцировала ответы антител, которые были более эффективными при связывании и истощении IgE. Добавление CPG 24555 к Alhydrogel композиции увеличивало анти-IgE ответы антител без индукции активности дегрануляции.
Пример 13: Индукция анти-ауто IgE ответов мышиным гомологом ПУРПУРНОГО 001 и ЖЕЛТОГО 001
Способность вакцин против пептидов IgE индуцировать IgG анти-ауто IgE антитела и уменьшать уровни IgE in vivo оценивали у мышей с повышенными уровнями IgE (индуцированными посредством предварительной иммунизации с помощью эндоксин-свободного овальбумина (OVA) в качестве модельного антигена, приготовленного с квасцами - примерная ссылка Lloyd C et al, J. Immunol 2001, 160, р2033-2040). После индукции IgE анти-ОVА ответов, мышей вакцинировали антигенными пептидами, связанными с Qbeta носителем, и объединенными с адъювантами. Использовали пептиды из гомологичных областей мышиного IgE (мышиный желтый 001 = QCIVDHPDFPKPIVRS (SEQ ID NO: 458); мышиный пурпурный 001 = PDHEPRGVITYLIPPSPC (SEQ ID NO: 459)). Эффективность вакцинаций в снижении уровней IgE наблюдали путем измерения уровней IgE анти-OVA в сыворотке до и после вакцинации.
а) Количественный анализ овальбумин-специфического IgE
Краткое содержание: Анализ электрохемилюминесценции (ECL), который определяет концентрацию OVA-специфического мышиного IgE. OVA-специфические IgE моноклональные антитела (AbD Serotec Cat# PMP68) использовали в качестве положительного контроля с количественными 12-точечными ½ log разведениями этого стандарта (добавленного при верхней концентрации 30 мкг/мл в Balb/c neg сыворотку от Harlan Labs (собранной от 400 животных Harlan laboratories Code# R-0131D), тестируемого в каждом анализе. Эту объединенную нормальную сыворотку использовали одну в качестве отрицательного контроля. Нанесение покрытия на планшеты для анализа: 384-луночные планшеты для анализа (Meso-Scale Diagnostics (MSD) standard bind Cat# L11XA-1, 0370PA) покрывали 12 мкл/лунку крысиными рАb к мышиному IgE - Invitrogen Cat# 04700, разведенными до 15 мкг/мл с 0,01 М PBS рН 7,4, затем инкубировали на шейкере при к.т. в течение 2 часов. После промывки × 3 с 0,01 М PBS рН 7,4, планшеты блокировали с использованием 25 мкл/лунку исходного блокирующего буфера Pierce (Pierce Biotech. Cat# 37538) и инкубировали на шейкере при к.т. в течение 40 минут перед конечной промывкой × 3 с 0,01 М PBS рН 7,4. Получение и анализ образца: Каждый образец сыворотки пробу разбавляли 1 к 200 и 1 к 500 (0,01 М PBS рН 7,4/1% БСА разбавитель) и добавляли 12 мкл каждого разведения в трех повторах к покрытым MSD планшетам, с разведениями стандарта, тестируемого параллельно. После инкубации на шейкере при к.т. в течение 2 часов планшеты три раза промывали 0,01 М PBS рН 7,4/0,05% Tween 20. Добавляли 12 мкл/лунку для детекции SULFO-меченного овальбумина, 1:300 с 0,01 М PBS рН 7,4/1% БСА, затем инкубировали при встряхивании при к.т. в течение 1 часа. После промывки × 3 с 0,01 М PBS рН 7,4/0,05% Tween 20, добавляли 50 мкл/лунку буфера для считываний MSD T (4x) с поверхностно-активным веществом (MSD Cat# R92TC) 1:2 с МQ водой. Планшеты считывали с использованием MSD Sector Imager 6000. Анализ результатов: Исходные данные (пиксели) регистрировали, строили стандартную кривую (Log концентрации мышиного IgE анти-OVA нг/мл против Log пикселей) и применяли соответствующую ассиметричную 5-параметрическую аппроксимацию кривых. Log концентраций IgE в тестируемых образцах определяли из стандартной кривой и соответственно регистрировали и умножали на 200 или 500 для получения фактических концентраций IgE в нг/мл.
б) Определение общего титра IgG против мышиного IgE
Краткое содержание: Колориметрический ELISA-анализ, в котором определяют реципрокный титр (RT), для представления уровней общих молекул IgG, которые являются специфическими в отношении мышиного IgE. Серийные разведения получали из образцов сыворотки и тестировали в анализе. Крысиные рАb к мышиному IgE - Invitrogen Cat# 04700, добавленные в сыворотку Balb/c neg от Harlan Labs при 10 мкг/мл и титруемые в 8-точечном полу-log серийном разведении, использовали в качестве положительного контроля. Balb/c neg сыворотку от Harlan Labs использовали в качестве отрицательного контроля (собранного от 400 животных Harlan laboratories Code# R-0131D) вместе в объединенным образцом из отрицательной группы в исследовании (обработанной так же, как образцы). Нанесение покрытия на планшеты для анализа: 384-луночные планшеты для анализа с высоким связыванием (Corning International Cat#3700) покрывали 25 мкл/лунку концентрата мышиного IgE к OVA (AbD Serotec Cat# PMP68), разведенного до 5 мкг/мл с 0,01 с М PBS рН 7,4, и инкубировали на шейкере при к.т. в течение 2 часов. После промывки × 2 с PBS рН 7,4, планшеты блокировали с использованием 80 мкл/лунку 0,01 М PBS/1% БСА, инкубировали при к.т. в течение 1 часа перед конечной промывкой × 3 0,01 М PBS рН 7,4/0,05% Tween 20. Получение и анализ образца: 8-точечное 1/10 серийное разведение каждого образца готовили, начиная с разведения 1:10 (PBS/1% БСА разбавитель), 25 мкл/лунку серийного разведения переносили в двух повторах в покрытый мышиным IgE планшет, затем инкубировали при встряхивании при к.т. в течение 1,5 часов. После промывки × 3 с 0,01 М PBS рН 7,4/0,05% Tween 20, добавляли 25 мкл/лунку общего IgG детектирующего антитела (крысиное анти-мышиное IgG-Fc, Cat# A90-130A Bethyl Laboratories)1:6000 с 0,01 M PBS pH 7,4/1% БСА, затем инкубировали при встряхивании при к.т. в течение 1 часа. После промывки × 5 с 0,01 М PBS рН 7,4/0,05% Tween 20, добавляли 25 мкл/лунку набора Bio-Rad козлиного антикроличьего антитела, конъюгированного с пероксидазой хрена (Bio-Rad Cat# 172-1019) 1:3000 с 0,01 М PBS рН 7,4/0,05% Tween 20 рН 7,4, затем инкубировали при встряхивании при к.т. в течение 1 часа. После промывки × 4 с 0,01 М PBS рН 7,4/0,05% Tween 20, затем только × 1 с 0,01 М PBS рН 7,4, добавляли 25 мкл/лунку субстрата Mouse Typer HRP (Bio-Rad Cat# 172-1064), затем инкубировали при к.т. в течение 30 минут перед добавлением 25 мкл/лунку 2% щавелевой кислоты для прекращения реакции и измерения пошлощения при 405 нм. Анализ результатов: Кривые титрования наносили на график для каждого тестируемого образца (титр образца против поглощения при 405 нм) и титр образца (впоследствии преобразованный в реципрокный титр) определяли из значения отсечения OD 1.
Результаты
Два исследования (Таблица 12) показали, что комбинация мышиного гомолога Желтого 001 (mЖелтый - 001 = QCIVDHPDFPKPIVRS (SEQ ID NO: 458)) и мышиного гомолога Пурпурного 001 (mПурпурный - 001 = PDHEPRGVITYLIPPSPC (SEQ ID NO: 459)) может индуцировать анти-ауто IgE антительные ответы, которые могут эффективно снижать эндогенные уровни IgE (по сравнению с уровнями в VLP Qbeta иммунизированных контролях). Доказательство механизма поэтому было получено демонстрацией того, что конъюгат пептида IgE может нарушать устойчивость В-клеток к эндогенной молекуле IgE и что это коррелирует с уменьшением эндогенного уровня IgE.
BALB/c мышей сенсибилизировали овальбумином в 0 и 1 недели для повышения эндогенных уровней IgE.
Мышей вакцинировали с помощью комбинации, содержащей 200 мкг мышиного пурнурного 001 и желтого 001 (т.е. 100 мкг каждого) на 3, 7 и 11 неделю и тестировали через 1 неделю после 3ой иммунизации.
Партнер для конъюгирования = Q beta VLP использующий SMPH.
Адъювант: 20 мкг CPG 24555 (все межнуклеотидные связи являются фосфоротиоатными связями) + ALhydrogel™ при 20% об./об.
ND = не определяли
Пример 14: Вакцинация яванских макак (cvnomolgus macaque) пурпурным 014 и либо желтым 001, либо желтым 014
Способность вакцин против пептидов человеческого IgE нарушать толерантность против собственного IgE in vivo оценивали у яванских макак, вакцинированных антигенными пептидами, связанными с носителем (VLP Q beta) и приготовленных с адъювантами. Использовали пептиды человеческого IgE. Эффективность вакцинаций при индукции анти-ауто IgE иммунных ответов затем определяли путем измерения уровней IgG анти-IgE в сыворотке до и после вакцинации.
Анализ яванских макак
а) Определение общего титра IgG для IgG-специфических для следующих антигенов/VLP: домен Cε2-Cε4 IgE яванского макака, домен Cε3Cε4 человеческого IgE. индивидуальные пептиды (желтый и пурпурный). конъюгированные с KLH и Qbeta
Краткое содержание: Анализ электрохемилюминесценции (ECL), в котором определяют реципрокный титр (RT) для представления уровней общих молекул IgG, которые являются специфичными в отношении вакцины или VLP. Серийные разведения готовили из образцов сывороток и тестировали в данном анализе. Сыворотку яванского макака, добавленную вместе с гуманизированным анти-IgE моноклональным антителом (Е25, Xolair), использовали при 40 мкг/мл в качестве положительного контроля. Сыворотку яванского макака без добавок использовали в качестве отрицательного контроля. Нанесение покрытия на планшеты для анализа: 384-луночные планшеты для анализа (Meso-Scale Diagnostics (MSD), покрытые стрептавидином Cat# L21SA-1) покрывали 12 мкл/лунку биотинилированного Cε2-Cε4 IgE яванского макака или Сε3Сε4 человеческого IgE, разведенных до 1 мкг/мл с 0,01 М PBS рН 7,4/1% БСА. 384-луночные планшеты для анализа (Meso-Scale Diagnostics (MSD) standard bind CaW L11ХА-1, 0370РА) покрывали 12 мкл/лунку индивидуального пептида (конъюгированного с KLH), разведенного до 1 мкг/мл, или Qbeta, разведенного до 2-5 мкг/мл с 0,01 М PBS рН 7,4 (нет БСА). Планшеты затем инкубировали на шейкере при к.т. в течение 1 часа. После промывки × 3 с 0,01 М PBS рН 7,4, планшеты блокировали с использованием 25 мкл/лунку исходного блокирующего буфера Pierce (Pierce Biotech. Cat# 37538) и инкубировали на шейкере при к.т. в течение 40 минут перед конечной промывкой × 3 с 0,01 М PBS рН 7,4. Получение и анализ образца: 8-точечное ½ log серийное разведение каждого образца, включая контроли, готовили, начиная с разведения 1:20 (PBS/1% БСА разбавитель), 12 мкл/лунку серийного разведения переносили в лунки планшета, покрытые тестируемым антигеном/VLP, затем инкубировали при встряхивании при к.т. в течение 1 часа. После промывки × 3 с 0,01 М PBS рН 7,4/0,05% Tween 20, в планшеты добавляли (12 мкл/лунку) разведенный SULFO-меченный белок G, до 0,02 мкг/мл (разбавитель PBS/1% БСА). Планшеты инкубировали при встряхивании при к.т. в течение 1 часа, затем промывали × 3 с 0,01 М PBS рН 7,4/0,05% Tween 20. Затем добавляли 50 мкл/лунку буфера для считывания MSD Т (4х) с поверхностно-активным веществом (MSD Cat# R92TC) 1:2 с MQ водой. Планшеты считывали с использованием MSD Sector Imager 6000. Анализ результатов: Кривые титрования наносили на график для каждого тестируемого образца (титр образца против пикселей) и титр образца (впоследствии преобразованный в реципрокный титр) определяли из значения отсечения (пиксели).
б) Анализ авидности антител яванского макака
Краткое содержание: Колориметрический ELISA-анализ, в котором определяют индекс авидности (AI) для представления силы связывания общих молекул IgG, которые являются специфическими в отношении человеческого Се3Се4. Гуманизированное анти-IgE антитело Xolair (E25) добавляли в объединенную сыворотку яванского макака (полученную из Qb-VLP контрольной группы в этом исследовании) при 40 и 4 мкг/мл и титровали в 12-точечном полу-log серийном разведении в качестве положительного контроля. Сыворотку яванского макака из исследования Qb-VLP группы использовали в качестве отрицательного контроля наряду с коммерческой сывороткой яванского макака. Нанесение покрытия на планшеты для анализа: Reacti-Bind™ стрептaвидин-пoкpытые НВС прозрачные 384-луночные планшеты с блокирующим буфером SuperBlock (Eisbec Scientific Co Ltd PI15504) покрывали 12 мкл/лунку биотинилированного человеческого Cε3Cε4 при 1 мкг/мл в 0,01 М PBS рН 7,4 и инкубировали на шейкере при к.т. в течение 1 часа. После промывки х 3 с PBS рН 7,4, планшеты блокировали с использованием 25 мкл/лунку 0,01 М PBS/1% БСА, инкубировали при к.т. в течение 40 минут перед перед конечной промывкой × 3 с 0,01 М PBS рН 7,4/0,05% Tween 20. Получение и анализ образца: Образцы разбавляли с 0,01 М PBS/1% БСА. Для каждого образца получали кривую титрования и из этой кривой значение в пикселях 180000 использовали для расчета индивидуального реципрокного титра (RT) разведения для применения для каждого образца. Этот RT использовали для разведения каждого образца для обеспечения использования сходных уровней антител из каждого образца в анализе авидности. 12 мкл каждого разведенного образца добавляли в 24 лунки покрытых 384-луночных планшетов и инкубировали при встряхивании при к.т. в течение 1 часа. После промывки × 5 с 0,01 М PBS рН 7,4/0,05% Tween 20, добавляли тиоцианат аммония в планшет при различных концентрациях при 12 мкл/лунку, затем инкубировали при встряхивании в течение 15 минут при к.т. (использовали 12 концентраций тиоцианата аммония: 12, 10, 8, 7, 6, 5, 4, 3, 2, 1, 0,5 и 0 М добавляли к дублилированным образцам). После промывки х 4 с 0,01 М PBS рН 7,4/0,05% Tween 20, добавляли 12 мкл/лунку мышиного HRP-меченного антитела против человеческого IgG (Southern Biotech 9042-05) в 0,01 М PBS/1% БСА, затем инкубировали при встряхивании при к.т. в течение 1 часа. После промывки × 5 с 0,01 М PBS рН 7,4/0,05% Tween 20, добавляли 25 мкл/лунку субстрата ТМВ (Sigma P-8665), затем инкубировали при к.т. в темноте в течение 30 минут. Для прекращения реакции добавляли 25 мкл/лунку 2% щавелевой кислоты и планшеты считывали при поглощении 450 нм. Анализ результатов: % уменьшения для каждого образца для каждой концентрации тиоцианата аммония вычисляли с использованием среднего поглощения при 405 нм для образцов с 0 М тиоцианата аммония в качестве 0% уменьшения. Кривые титрования затем наносили на график для каждого тестируемого образца (% уменьшения против поглощения при 450 нм) и AI был определяли из значения отсечения 50% уменьшения.
Результаты:
Исследование (Таблица 13) показало, что комбинация Желтого 001 или Желтого 014 с Пурпурным 014 (см. последовательность в таблице 9) является иммуногенной и индуцировала анти-ауто (яванский макак) IgE и антительные ответы против человеческого IgE, которые коррелировали с ответами на специфические пептиды. Кроме того, показано, что авидность антительных ответов можно увеличить посредством введения повторной дозы яванским макакам.
Яванских макак вакцинировали с помощью 600 мкг комбинации пурпурного 014 и желтого 001 или желтого 014 (т.е. 300 мкг каждого) в 0, 4 и 8 недели и тестировали на 12 неделе.
Партнер для конъюгирования = Q beta VLP с использованием SMPH.
Адъювант: 500 мкг CPG 24555 (все межнуклеотидные связи являются фосфоротиоатными связями) + Alhydrogel™ при 600 мкг.
ND = не определяли
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНА ПРОТИВ PCSK9 | 2010 |
|
RU2538162C2 |
| АНТИГЕННЫЕ TAU-ПЕПТИДЫ И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2518291C2 |
| КОНЪЮГАТЫ ПЕПТИДА Melan-A, АНАЛОГА ВИРУСОПОДОБНОЙ ЧАСТИЦЫ | 2004 |
|
RU2351362C2 |
| Капсульные полисахариды Streptococcus pneumoniae и их конъюгаты | 2015 |
|
RU2688831C2 |
| Капсульные полисахариды Streptococcus pneumoniae и их конъюгаты | 2015 |
|
RU2743793C1 |
| Иммуногенная композиция, включающая ее вакцина, набор для приготовления вышеуказанной композиции и способ лечения заболеваний, связанных с патологией секреции гастрина | 2014 |
|
RU2664197C2 |
| ПОЛУМЯГКИЕ ИММУНОСТИМУЛИРУЮЩИЕ ОЛИГОНУКЛЕОТИДЫ С-КЛАССА | 2005 |
|
RU2393223C2 |
| КОМПОЗИЦИЯ ВИРУСОПОДОБНЫХ ЧАСТИЦ | 2013 |
|
RU2705301C2 |
| МОЛЕКУЛЯРНЫЕ МАССИВЫ АНТИГЕНОВ | 2003 |
|
RU2324704C2 |
| ИММУНОРЕГУЛЯТОРНАЯ ВАКЦИНА | 2013 |
|
RU2650709C2 |




































































































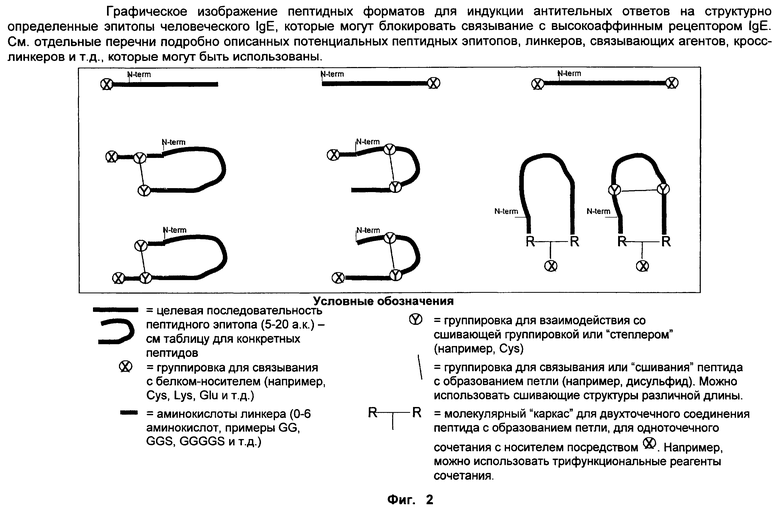
Изобретение относится к области биотехнологии и медицины. Описан иммуноген, для индукции иммунного ответа на IgE. Иммуноген содержит по меньшей мере один антигенный пептид IgE, связанный с иммуногенным носителем. В качестве иммуногенных носителей могут быть использованы вирусоподобные частицы, выбранные из группы, состоящей из HBcAg, HBsAg и Qbeta VLP. Описаны также композиции и способ предупреждения, облегчения или лечения IgE-ассоциированного расстройства у индивидуума с использованием такого иммуногена. Предложенная группа изобретений может быть использована в медицине для лечения аллергических заболеваний. 10 н. и 10 з.п. ф-лы, 2 ил., 13 табл., 14 пр.
1. Иммуноген, для индукции иммунного ответа на IgE, содержащий по меньшей мере один антигенный пептид IgE, связанный с иммуногенным носителем, где указанный антигенный пептид IgE состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 312, 311, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429, 430, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309 и 310.
2. Иммуноген по п.1, дополнительно содержащий линкер, присоединенный к указанному пептиду IgE либо:
- на своем С-конце, где указанный линкер имеет формулу (G)nC, где n означает целое число, выбранное из группы, состоящей из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, предпочтительно из группы, состоящей из 0, 1, 2, 3, 4 и 5, более предпочтительно из группы, состоящей из 0, 1, 2 и 3, наиболее предпочтительно, n равно 0 или 1 (если n равно 0, то указанная формула представляет цистеин), либо:
- на своем N-конце, где указанный линкер имеет формулу C(G)n, где n означает целое число, выбранное из группы, состоящей из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, предпочтительно из группы, состоящей из 0, 1, 2, 3, 4 и 5, более предпочтительно из группы, состоящей из 0, 1, 2 и 3, наиболее предпочтительно, n равно 0 или 1 (если n равно 0, то указанная формула представляет цистеин), либо:
- на своем С-конце, где указанный линкер имеет формулу (G)nC, где n означает целое число, выбранное из группы, состоящей из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, предпочтительно из группы, состоящей из 0, 1, 2, 3, 4 и 5, более предпочтительно из группы, состоящей из 0, 1, 2 и 3, наиболее предпочтительно, n равно 0 или 1 (если n равно 0, то указанная формула представляет цистеин), и на своем N-конце, где указанный линкер имеет формулу C(G)n, где n означает целое число, выбранное из группы, состоящей из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, предпочтительно из группы, состоящей из 0, 1, 2, 3, 4 и 5, более предпочтительно из группы, состоящей из 0, 1, 2 и 3, наиболее предпочтительно n равно 0 или 1 (если n равно 0, то указанная формула представляет цистеин).
3. Иммуноген по п.1 или 2, где указанный иммуногенный носитель представляет собой вирусоподобную частицу, выбранную из группы, состоящей из HBcAg, HBsAg и Qbeta VLP.
4. Иммуноген по п.3, где указанный антигенный пептид IgE химически сшит с указанной вирусоподобной частицей.
5. Композиция для предупреждения, облегчения или лечения IgE-ассоциированного расстройства, содержащая по меньшей мере два иммуногена по любому из пп.1-4.
6. Композиция по п.5, где указанная композиция содержит два иммуногена, и где антигенный пептид IgE из первого иммуногена состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309 и 310.
7. Композиция по п.6, где антигенный пептид IgE из второго иммуногена состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429 и 430.
8. Композиция по п.5, где указанный антигенный пептид IgE связан с иммуногенным носителем, выбранным из группы, состоящей из HBcAg VLP, HBsAg VLP и Qbeta VLP.
9. Композиция по любому из пп.5-8, где указанные антигенные пептиды IgE индивидуально конъюгированы с указанными иммуногенными носителями.
10. Композиция для предупреждения, облегчения или лечения IgE-ассоциированного расстройства, содержащая два иммуногена, где каждый из этих иммуногенов состоит из антигенного пептида IgE, индивидуально конъюгированного с вирусоподобной частицей Qbeta, где:
- первый иммуноген состоит из антигенного пептида IgE с SEQ ID NO: 220, химически сшитого с вирусоподобной частицей Qbeta с SEQ ID NO: 435 посредством тиоэфирной связи с использованием SMPH (сукцинимидил-6-[β-малеимидопропионамидо]гексаноат) в качестве сшивающего линкера, где указанная связь находится между остатком лизина вирусоподобной частицы и остатком цистеина указанного антигенного пептида IgE, и
- второй иммуноген состоит из полипептида с SEQ ID NO: 457, химически сшитого с вирусоподобной частицей Qbeta с SEQ ID NO: 435 посредством тиоэфирной связи с использованием SMPH (сукцинимидил-6-[β-малеимидопропионамидо]гексаноат) в качестве сшивающего линкера, где указанная связь находится между остатком лизина вирусоподобной частицы и остатком цистеина указанного полипептида.
11. Иммуногенная композиция для предупреждения, облегчения или лечения IgE-ассоциированного расстройства, содержащая иммуноген по любому из пп.1-4 или композицию иммуногенов по любому из пп.5-10, дополнительно содержащая по меньшей мере один адъювант, выбранный из группы, состоящей из квасцов, CpG-содержащих олигонуклеотидов и адъювантов на основе сапонина.
12. Иммуногенная композиция по п.11, где по меньшей мере один указанный адъювант представляет собой CpG-содержащий олигонуклеотид, выбранный из группы, состоящей из CpG7909 (SEQ ID NO: 433), CpG 10103 (SEQ ID NO: 432) и CpG24555 (SEQ ID NO: 431).
13. Иммуногенная композиция по п.11, где по меньшей мере один указанный адъювант представляет собой адъювант на основе сапонина, предпочтительно Iscomatrix.
14. Иммуногенная композиция для предупреждения, облегчения или лечения IgE-ассоциированного расстройства, содержащая иммуноген по любому из пп.1-4 или композицию иммуногенов по любому из пп.5-10, дополнительно содержащая по меньшей мере два адъюванта, выбранных из группы, состоящей из квасцов, CpG-содержащих олигонуклеотидов и адъювантов на основе сапонина.
15. Иммуногенная композиция по п.14, где указанные адъюванты представляют собой квасцы и CpG24555 (SEQ ID NO: 431).
16. Фармацевтическая композиция для предупреждения, облегчения или лечения IgE-ассоциированного расстройства, содержащая иммуноген по любому из пп.1-4, или композицию иммуногенов по любому из пп.5-10, или иммуногенную композицию по любому из пп.11-15 и фармацевтически приемлемый эксципиент.
17. Способ предупреждения, облегчения или лечения IgE-ассоциированного расстройства у индивидуума, включающий введение терапевтически эффективного количества иммуногена по любому из пп.1-4, или композиции иммуногенов по любому из пп.5-10, или иммуногенной композиции по любому из пп.11-15, или фармацевтической композиции по п.16.
18. Нуклеиновая кислота, кодирующая иммуноген по любому из пп.1-4.
19. Экспрессирующий вектор, содержащий нуклеиновую кислоту по п.18.
20. Клетка-хозяин для экспрессии иммуногена по любому из пп.1-4, содержащая экспрессирующий вектор по п.19.
| УСТРОЙСТВО ДЛЯ ФОРМИРОВАНИЯ ПИЛООБРАЗНО- СТУПЕНЧАТОГО НАПРЯЖЕНИЯ | 0 |
|
SU263655A1 |
| WO 9967293 A1, 29.12.1999 | |||
| WO 2004058799 A2, 15.07.2004 | |||
| Установка для термической обработки материалов | 1984 |
|
SU1195161A1 |
| ВАКЦИНА, ОБЛАДАЮЩАЯ СПОСОБНОСТЬЮ ВЫЗЫВАТЬ ИММУННЫЙ ОТВЕТ ПРОТИВ СОБСТВЕННОГО JGE ОРГАНИЗМА, СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ И СПОСОБ ИММУНИЗАЦИИ МЛЕКОПИТАЮЩЕГО ПРОТИВ ОПОСРЕДУЕМЫХ JGE АЛЛЕРГИЧЕСКИХ РЕАКЦИЙ | 1992 |
|
RU2120805C1 |
Авторы
Даты
2013-10-10—Публикация
2009-12-04—Подача