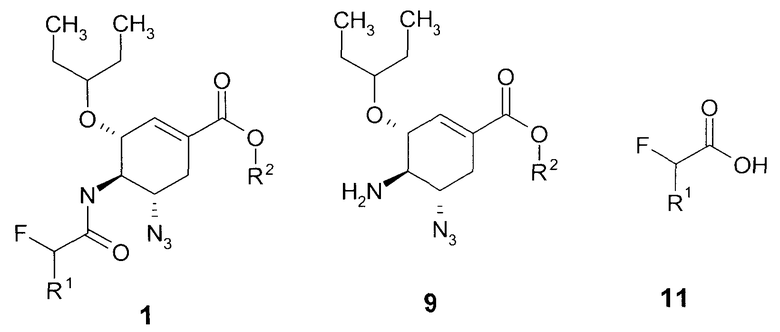
Данное изобретение относится к новым алкил (3R,4R,5S)-5-азидо-3-(1-этилпропокси)-4-(моно или дифтор ацетиламино)-циклогекс-1-енкарбоксилатам общей формулы 1, к способу их получения, к способу их применения в качестве полупродукта синтеза ингибитора нейраминидазы
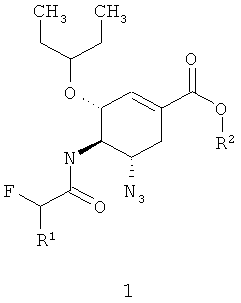
где R1=H, F; R2=C1-C3-алкил.
Известны соединения общей формулы 4, которые являются эффективными ингибиторам активности нейраминидазы (Патент РФ 2469020). Нейраминидаза (сиалидаза, ацилнейраминил гидролаза) является обычным для животных и ряда микроорганизмов ферментом. Она представляет собой гликогидролазу, которая отщепляет альфакетосидикально связанные сиаловые кислоты от гликопротеинов, гликолипидов и олигосахаридов. Многие из микроорганизмов, содержащих нейраминидазу, патогенны по отношению к человеку и другим животным, включая птицу, лошадей, свиней и тюленей. Такие патогенные организмы включают вирус гриппа. Нейраминидаза связана с патогенностью вируса гриппа. Предположительно она содействует элюированию вновь синтезированных вирионов из инфицированных клеток и движению вируса (благодаря ее гидролазной активности) через слизь респираторного тракта.
Известен способ получения алкил (3R,4R,5S)-5-азидо-3-(1-этилпропокси)-4-(моно или дифтор ацетиламино)-циклогекс-1-енкарбоксилатов общей формулы 4 исходя из алкил 4-амино-5-(трет-бутоксикарбониламино)-3-(пентан-3-илокси)циклогексен-1-карбоксилата 2 по нижеследующей схеме 1
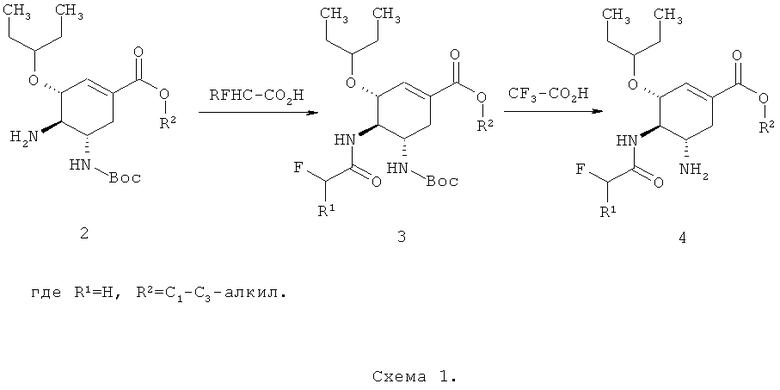
Основной недостаток этой схемы состоит в том, что исходный продукт 2, например (при R2=C2H5), получают исходя из этилового эфира озельтамивир карбоксилата 5, фосфат которого известен как Тамифлю (Oseltamivir Phosphate, Tamiflu) [J.С. Rohloff, К.М. Kent, М.J. Postich, et al. J. Org. Chem. 1998, 63, 4545], который является известным противогриппозным препаратом [https://integrity.thomson-pharma.com/integrity/xmlxsl/pk_prod_list.xml].
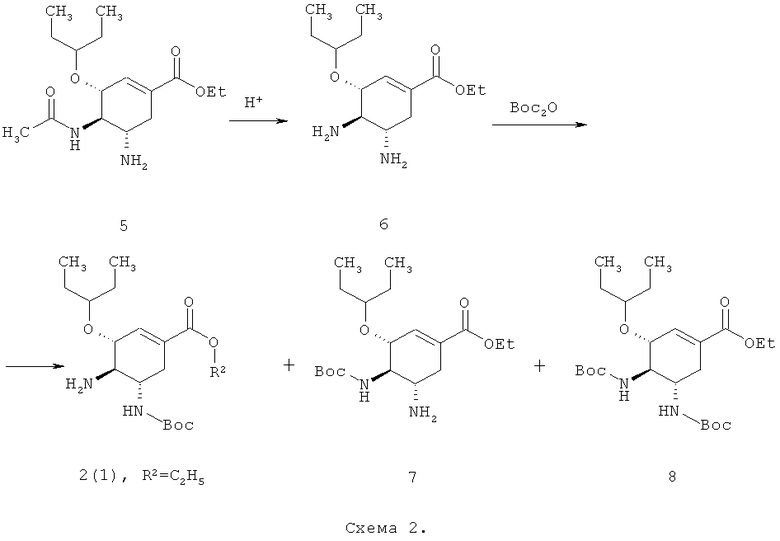
В результате гидролиза озельтамивира 5 получают этил (3R,4R,5S)-4,5-диамино-3-(пентан-3-илокси)-циклогекс-1-енкарбоксилата 6, при взаимодействии которого с Boc-ангидридом образуется три Boc-защищенных продукта 2, 7 и 8, один из которых (2) является исходным для синтеза целевых ингибиторов нейраминидазы (Схема 2). Разумеется, выделение необходимого продукта 2 из трехкомпонентной смеси не только усложняет в целом процесс получения ингибиторов нейраминидазы, но и ухудшает экономику этого процесса в основном из-за низкого выхода соединения 2.
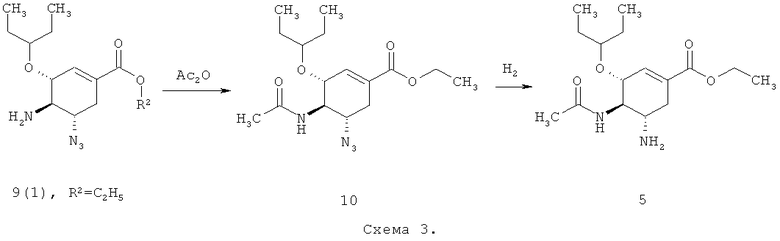
Между тем известны способы получения ингибитора нейраминидазы озельтамивира с использованием в качестве промежуточных продуктов азидов с их последующим восстановлением водородом на никеле Ренея, как в WO 1999014185 (Схема 3),
или с использованием других восстановителей, как в WO 2011021223 или WO 2009078813.
При этом ранее было неизвестно получение в процессе синтеза ингибиторов нейраминидазы алкил (3R,4R,5S)-5-азидо-3-(1-этилпропокси)-4-(моно или дифтор ацетиламино)-циклогекс-1-енкарбоксилатов общей формулы 1, или их солей, а также неизвестно использование в качестве ацилирующих агентов фтор или дифтор производных уксусной кислоты.
Предметом данного изобретения является новый алкил (3R,4R,5S)-5-азидо-3-(1-этилпропокси)-4-(моно или дифтор ацетиламино)-циклогекс-1-енкарбоксилат общей формулы 1

где R1=H, F; R2=C1-C3-алкил.
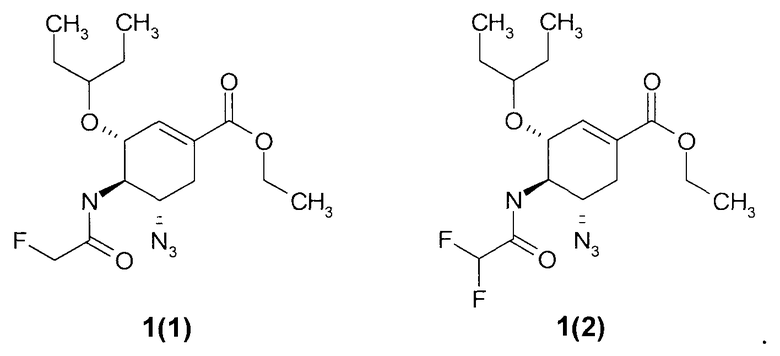
Более предпочтительными соединениями являются этил (3R,4R,5S)-5-азидо-3-(1-этилпропокси)-4-(2-фторацетиламино)-циклогекс-1-енкарбоксилат 1(1) или этил (3R,4R,5S)-5-азидо-3-(1-этилпропокси)-4-(2,2-дифторацетиламино)-циклогекс-1-енкарбоксилат 1(2)
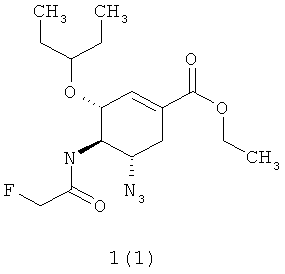
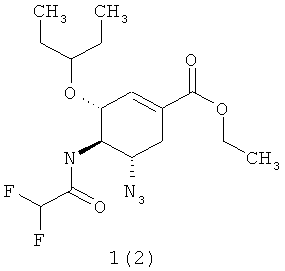 .
.
Предметом данного изобретения является способ получения соединения общей формулы 1, согласно которому алкил (3R,4R,5S)-5-азидо-4-амино-3-(1-этилпропокси)-циклогекс-1-енкарбоксилат 9 подвергают взаимодействию с фтор или дифтор производным уксусной кислотой 11 в органическом растворителе в присутствии гидрохлорида N1-((этиламино)метилен)-N3,N+-диметилпропан-1,3-диамина, 1H-бензо[d][1,2,3]триазол-1-ола и N-этил-N-изопропилпропан-2-амина
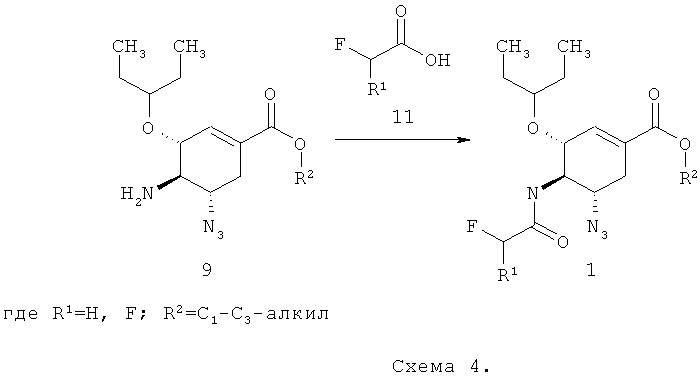
Более предпочтительным способом получения соединения общей формулы 1 является способ, согласно которому в качестве органического растворителя используют тетрагидрофуран и реакцию проводят при комнатной температуре.
Более предпочтительным способом получения соединения общей формулы 1 является способ, согласно которому в качестве алкил (3R,4R,5S)-5-азидо-4-амино-3-(1-этилпропокси)-циклогекс-1-енкарбоксилат 9 используют этил (3R,4R,5S)-5-азидо-4-амино-3-(1-этилпропокси)-циклогекс-1-енкарбоксилат 9(1).
Предметом данного изобретения является новый полупродукт синтеза ингибитора нейраминидазы формулы 15 или формулы 18, представляющий собой алкил (3R,4R,5S)-5-азидо-3-(1-этилпропокси)-4-(моно или дифтор ацетиламино)-циклогекс-1-енкарбоксилат общей формулы 1
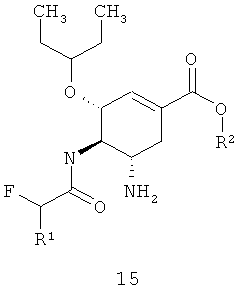
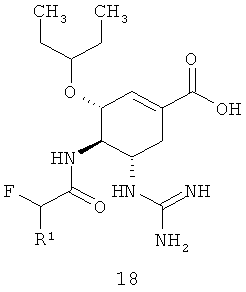
где R1=H, F; R2=C1-C3-алкил.
«Полупродукт» - промежуточное химическое соединение, полученное в результате химической переработки или неполной обработки исходных веществ на промежуточных стадиях многостадийной химической реакции и служащее исходным сырьем для получения других веществ.
Более предпочтительными полу продуктам и синтеза ингибитора нейраминидазы являются этил (3R,4R,5S)-5-азидо-3-(1-этилпропокси)-4-(2-фторацетиламино)-циклогекс-1-енкарбоксилат 1(1) или этил (3R,4R,5S)-5-азидо-3-(1-этилпропокси)-4-(2,2-дифторацетиламино)-циклогекс-1-енкарбоксилат 1(2).
Новый полупродукт синтеза ингибитора нейраминидазы, представляющий собой алкил (3R,4R,5S)-5-азидо-3-(1-этилпропокси)-4-(моно или дифтор ацетиламино)-циклогекс-1-енкарбоксилат общей формулы 1, а также новый способ его получения позволяют упростить технологическую схему синтеза ингибитора нейраминидазы и снизить себестоимость их производства, поскольку синтез исходного продукта 9, представленный ниже на схеме 5, проходит однозначно и не сопровождается, как в случае исходного продукта 2, образованием побочных продуктов:
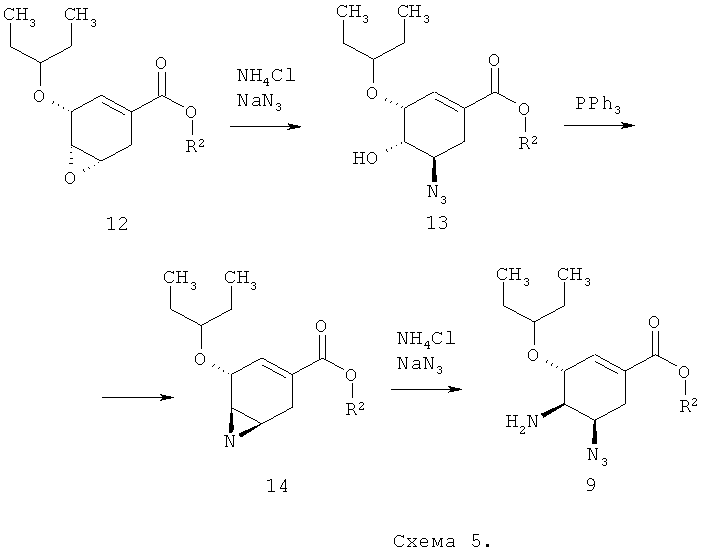
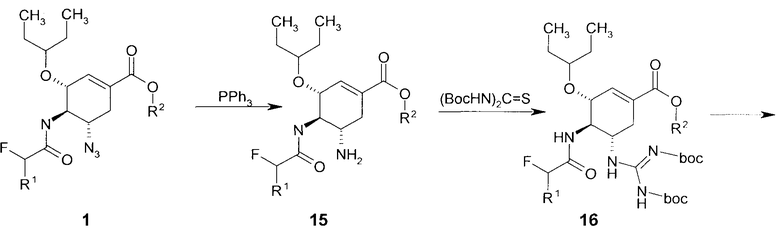
В связи с этим предметом данного изобретения также является способ получения соединения общей формулы 15 с использованием нового полупродукта синтеза ингибитора нейраминидазы, согласно которому алкил (3R,4R,5S)-5-азидо-3-(1-этилпропокси)-4-(моно или дифтор ацетиламино)-циклогекс-1-енкарбоксилат общей формулы 1 восстанавливают трифенилфосфином
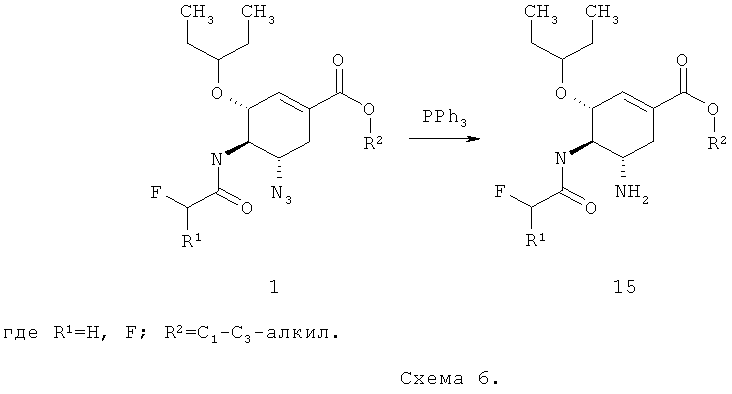
Лучшие результаты достигаются, если восстановление алкил (3R,4R,5S)-5-азидо-3-(1-этилпропокси)-4-(моно или дифтор ацетиламино)-циклогекс-1-енкарбоксилат общей формулы 1 проводят в водном тетрагидрофуране.
Также предметом данного изобретения является способ получения соединения общей формулы 18, согласно которому соединение общей формулы 15, полученное с использованием нового полупродукта синтеза ингибитора нейраминидазы по данному изобретению, подвергают дальнейшему взаимодействию, включающему следующие стадии:
(а) взаимодействие соединения общей формулы 15 с ди-Boc-тиомочевиной с образованием соединения формулы 16,
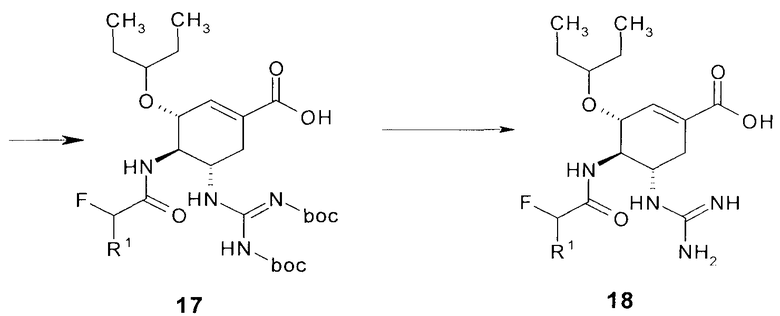
(б) гидролиз соединения формулы 16 с образование кислоты формулы 17,
(б) снятие Boc-защиты с кислоты формулы 17 с образование соединения общей формулы 18
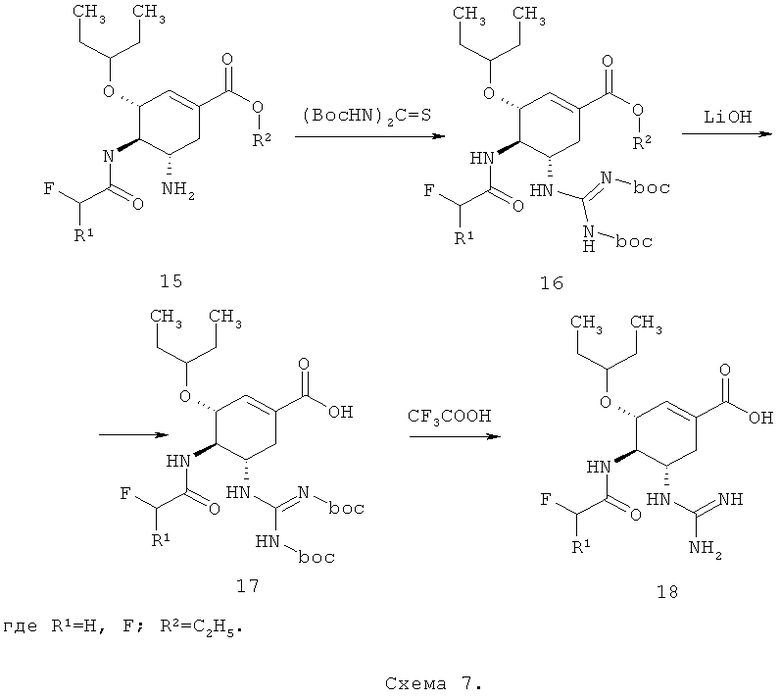
Соединения 18 также являются активными ингибиторами нейраминидазы, в том числе нейраминидазы H5N1 вируса гриппа [Заявка на патент РФ 2012119272, приоритет от 12.05.2012].
Лучшие результаты достигаются, если гидролиз соединения формулы 16 проводят в водном диоксане гидроокисью лития.
Лучшие результаты достигаются, если снятие Boc-защиты с кислоты формулы 17 проводят 30% раствором трифторуксусной кислоты в хлористом метилене.
Данное изобретение иллюстрируется, но не ограничивается следующими примерами.
Пример 1. Получение этил (3R,4R,5S)-5-азидо-3-(1-этилпропокси)-4-(2-фторацетиламино)-циклогекс-1-енкарбоксилата 1(1). К раствору 34.4 г исходного этил (3R,4R,5S)-5-азидо-4-амино-3-(1-этилпропокси)-циклогекс-1-енкарбоксилата 9(1) в 344 мл ТГФ добавляют гидрохлорид N1-((этиламино)метилен)-N3, N3-диметилпропан-1,3-диамин (26.64 г), 1H-бензо[d][1,2,3]триазол-1-ол (18.64 г), N-этил-N-изопропилпропан-2-амин (49.4 г; 66.67 мл) и затем прикалывают при охлаждении на ледяной бане 10.88 г 2-фторуксусной кислоты. Реакционную массу перемешивают при комнатной температуре в течение ночи. По окончании реакции растворитель отгоняют, полученное масло растворяют в EtOAc, промывают 5% раствором NaHCO3, сушат над Na2SO4 и в вакууме. Очистку продукта проводят методом флеш-хроматографии в системе EtOAc/Hex 1 к 1. При необходимости проводят перекристаллизацию из 5% EtOAc в гептане. Выход этил (3R,4R,5S)-5-азидо-3-(1-этилпропокси)-4-(2-фторацетиламино)-циклогекс-1-енкарбоксилата 1(1) составил 25.7 г. LC-MS (M+H)+ 357. 1H ЯМР (CDCl3), 400 МГц: 6.81 (с, 1H), 6.55 (с, 1H), 4.83 (д, J=47.2 Гц, 2H), 4.49 (д, J=8.8 Гц, 1H), 4.23 (м, 3H), 3.61 (к, J=8.4 Гц, 1H), 3.34 (м, 1H), 2.92 (м, 1H), 2.32 (м, 1H), 1.52 (м, 4H), 1.32 (т, J=6.8 Гц, 3H), 0.91 (м, 6H).
Пример 2. Получение этил (3R,4R,5S)-5-азидо-3-(1-этилпропокси)-4-(2,2-дифторацетиламино)-циклогекс-1-енкарбоксилата 1(2). К раствору 34.4 г исходного этил (3R,4R,5S)-5-азидо-4-амино-3-(1-этилпропокси)-циклогекс-1-енкарбоксилата 9(1) в 344 мл ТГФ добавляют гидрохлорид N1-((этиламино)метилен)-N3, N3-диметилпропан-1,3-диамин (26.64 г), 1H-бензо[d][1,2,3]триазол-1-ол (18.64 г), N-этил-N-изопропилпропан-2-амин (49.4 г; 66.67 мл) и затем прикапывают при охлаждении на ледяной бане 11.5 г 2,2-дифторуксусной кислоты. Реакционную массу перемешивают при комнатной температуре в течение ночи. По окончании реакции растворитель отгоняют, полученное масло растворяют в EtOAc, промывают 5% раствором NaHCO3, сушат над Na2SO4 и в вакууме. Очистку продукта проводят методом флеш-хроматографии в системе EtOAc/Hex 1 к 1. При необходимости проводят перекристаллизацию из 5% EtOAc в гептане. Выход этил (3R,4R,5S)-5-азидо-4-(2,2-дифторацетамидо)-3-(пентан-3-илокси)циклогекс-1-енкарбоксилата 1(2) составил 25.1 г. LC-MS (М+Н)+ 375. 1H ЯМР (DMSO-d6), 400 МГц: 9.03 (д, J=8 Гц, 1H), 6.65 (с, 1H), 6.29 (т, J=53.2 Гц, 1H), 4.24 (ш, 1H), 4.16 (м, 2H), 3.82 (м, 2H), 3.35 (м, 1H), 2.81 (м, 1H), 2.21 (м, 1H), 1.41 (м, 4H), 1.23 (т, J=7.2 Гц, 3H), 0.84 (т, J=7.2 Гц, 3H), 0.76 (т, J=7.2 Гц, 3H). Мезилат этил (3R,4R,5S)-5-азидо-3-(1-этилпропокси)-4-(2,2-дифторацетиламино)-циклогекс-1-енкарбоксилата 1(2)*CH3SO3H получают прибавлением метансульфоновой кислоты к раствору 1(2) в дихлорметане. При необходимости проводят дополнительную перекристаллизацию полученного мезилата.
Пример 3. Получение этил (3R,4R,5S)-5-амино-3-(1-этилпропокси)-4-(2-фторацетамидо)-циклогекс-1-енкароксилат 15(1) с использованием нового полупродукта синтеза ингибитора нейраминидазы. К раствору 2 г этил (3R,4R,5S)-5-азидо-3-(1-этилпропокси)-4-(2-фторацетиламино)-циклогекс-1-енкарбоксилата 1(1) в смеси 20 мл ТГФ и 5 мл воды добавляют 1.62 г трифенилфосфина. Реакционную массу перемешивают 3 часа при комнатной температуре и затем 3 часа при 70°C. Контроль за ходом реакции осуществляют методом LC-MS. По окончании реакции растворители отгоняют, полученное масло растворяют в небольшом количестве диэтилового эфира и отфильтровывают выпавший трифенилфосфин оксид. Остаток сушат в вакууме. Получают этил 5-амино-4-(2-фторацетамидо)-3-(пентан-3-илоки)циклогекс-1-енкарбоксилат 15(1), LC-MS (M+H)+ 331.
Пример 4. Получение этил (3R,4R,5S)-5-амино-4-(2,2-дифторацетамидо)-3-(пентан-3-илоки)циклогекс-1-енкарбоксилата 15(2) с использованием нового полупродукта синтеза ингибитора нейраминидазы. К раствору 24 г этил (3R,4R,5S)-5-азидо-3-(1-этилпропокси)-4-(2,2-дифторацетиламино)-циклогекс-1-енкарбоксилата 1(2) в смеси ТГФ и воды добавляют 10.62 г трифенилфосфина. Реакционную массу перемешивают 3 часа при комнатной температуре и затем 3 часа при 70°C. Контроль за ходом реакции осуществляют методом LC-MS. По окончании реакции растворители отгоняют, полученное масло растворяют в небольшом количестве диэтилового эфира и отфильтровывают выпавший трифенилфосфин оксид. Полученное вещество разделяют на колонке. Получают 9.8 г соединения 15(2). LC-MS (M+H)+ 349. Мезилат получают прибавлением метансульфоновой кислоты к раствору продукта 15(2) в дихлорметане. При необходимости проводят дополнительную перекристаллизацию полученного мезилата.
Пример 5. Получение (3R,4R,5S)-4-(2-фторацетамидо-5-гуанидино-3-(пентан-3-илокси)циклогексен-1-карбоновой кислоты 18(1) с использованием нового полупродукта синтеза ингибитора нейраминидазы. К раствору этил (3R,4R,5S)-5-амино-3-(1-этилпропокси)-4-(2-фторацетамидо)-циклогекс-1-енкароксилат 15(1) (46.6 г) в 466 мл ДМФА, охлажденного до -10°C, добавляют триэтиламин (78.4 г), N,N′-ди-boc-тиомочевину (41.47 г). Затем порциями, не позволяя реакционной массе разогреваться, добавляют хлорид ртути (II) (45.92 г). Полученную смесь перемешивают при охлаждении в течение 1.5 часов. По окончании реакции осадок отфильтровывают через селит, ДМФА отгоняют в вакууме, полученное масло растворяют в этилацетате, промывают 5% раствором NaHCO3, сушат над Na2SO4, фильтруют и сушат в вакууме. Полученное масло фильтруют через слой силикагеля объемом 300 мл, промывая этилацетатом. Маточный раствор сушат в вакууме, полученное масло растирают в небольшом количестве гексана. Образующийся осадок отфильтровывают, промывают гексаном и сушат на воздухе. Выход (3R,4R,5S)-этил 5-((Z)-2,3-бис(трет-бутоксикарбонил)гуанидино)-4-(2-фторацетамидо)-3-(пентан-3-илокси)циклогкс-1-енкарбоксилата 16(1) составил 48.6 г. К раствору 46.8 г (3R,4R,5S)-этил-5-((Z)-2,3-бис(трет-бутоксикарбонил)гуанидино)-4-(2-фторацетамидо)-3-(пентан-3-илокси)циклогкс-1-енкарбоксилата 16(1) в 486 мл диоксана добавляют 243 мл 5%-го раствора гидроксида лития и перемешивают реакционную массу при комнатной температуре в течение 30 минут. Затем гидроксид лития пасивируют, добавляя небольшой избыток уксусной кислоты. Растворители огоняют в вукууме (остатки воды удаляют азеотропной отгонкой с диоксаном, а уксусной кислоты - с толуолом), сухой остаток экстрагируют ацетонитрилом, объединенный экстракт сушат над Na2SO4 и в вакууме. Полученный продукт 17(1) используют в дальнейших реакциях без дополнительной очистки. Выход продукта 17(1) приближается к количественному. Полученную (3R,4R,5S)-5-((Z)-2,3-бис(трет-бутоксикарбонил)гуанидино)-4-(2-фторацетамидо)-3-(пентан-3-илокси)циклогекс-1-енкарбоновую кислоту 17(1) (45 г) растворяют в 450 мл 30%-ного раствора трифторуксусной кислоты в хлористом метилене и перемешивают при комнатной температуре в течение 12 часов. Затем хлористый метилен отгоняют в вакууме при комнатной температуре, остаток растворяют в 300 мл воды и защелачивают, прибавляя концентрированный раствор карбоната натрия. Выпавший белый осадок отфильтровывают апромывают водой, ацетоном, диэтиловым эфиром и сушат на воздухе. Получают (3R,4R,5S)-4-(2-фторацетамидо-5-гуанидино-3-(пентан-3-илокси)циклогексен-1-карбоновую кислоту 18(1), которую при необходимости перекристаллизовывают и получают продукт с содержанием основного вещества 99.1-99.5%. LC-MS (M+H)+ 345. Соединение 18(1) (приблизительно 14 г) растворяют в 140 мл диоксана и добавляют эквивалентное количество метансульфоновой кислоты. Выпавший мезилат отфильтровывают, промывают эфиром и сушат в вакууме. Выход мезилата кислоты 18(1)*CH3SO3H составляет 15,1 г с чистотой 98-99%.
Аналогичным образом получают (3R,4R,5S)-4-(2,2-дифторацетамидо-5-гуанидино-3-(пентан-3-илокси)циклогексен-1-карбоновую кислоту 18(2) и ее мезилат.
Изобретение относится к новому способу получения алкил (3R,4R,5S)-5-азидо-3-(1-этилпропокси)-4-(моно или дифтор ацетиламино)-циклогекс-1-енкарбоксилатам общей формулы 1 и к способу их использования в качестве полупродуктов в синтезе ингибитора нейраминидазы формулы 18


В указанных формулах R1=H,F; R2=C1-C3-алкил. Способ получения соединений общей формулы 1 заключается во взаимодействии алкил(3R,4R,5S)-5-азидо-4-амино-3-(1-этилпропокси)-циклогекс-1-енкарбоксилата с фтор- или дифторуксусной кислотой в тетрагидрофуране при комнатой температуре в присутствии гидрохлорида N1-((этилaминo)метилeн)-N3, N3-диметилпропан-1,3-диамина, 1H-бензо[d][1,2,3]триазол-1-ола и N-этил-N-изопропилпропан-2-амина. Соединение 18 получают восстановлением соединения общей формулы 1 трифенилфосфином в водном тетрагидрофуране с последующим взаимодействием полученного соединения с ди-Вос-тиомочевиной, гидролизом получаемого соединения гидроокисью лития в водном диоксане и снятием Вос-защиты с полученной кислоты 30% раствором трифторуксусной кислоты в хлористом метилене. Получение промежуточных продуктов общей формулы 1 с использованием в предлагаемом способе указанных реагентов и условий реакции позволяет провести процесс более целенаправленно, уменьшить количество побочных продуктов и тем самым упростить процесс получения и выделения соединений 18. 2 н. и 2 з.п. ф-лы, 5 пр.
1. Способ получения соединения общей формулы 1 взаимодействием алкил (3R,4R,5S)-5-азидо-4-амино-3-(1-этилпропокси)-циклогекс-1-енкарбоксилата формулы 9 с фтор- или дифторуксусной кислотой 11 в тетрагидрофуране при комнатой температуре в присутствии гидрохлорида N1-((этилaминo)метилeн)-N3, N3-диметилпропан-1,3-диамина, 1H-бензо[d][1,2,3]триазол-1-ола и N-этил-N-изопропилпропан-2-амина
где R1=H, F; R2=C1-C3-алкил.
2. Способ по п.1, где получаемое соединение представляет собой этил (3R,4R,5S)-5-азидо-3-(1-этилпропокси)-4-(2-фторацетиламино)-циклогекс-1-енкарбоксилат формулы 1(1) или этил (3R,4R,5S)-5-азидо-3-(1-этилпропокси)-4-(2,2-дифторацетиламино)-циклогекс-1-енкарбоксилат формулы 1(2)
3. Способ по п.1, отличающийся тем, что в качестве алкил (3R,4R,5S)-5-азидо-4-амино-3-(1-этилпропокси)-циклогекс-1-енкарбоксилата используют этил(3R,4R,5S)-5-азидо-4-амино-5-(1-этилпропокси)-циклогекс-1-енкарбоксилат формулы 9(1).
4. Способ получения соединения общей формулы 18 восстановлением соединения общей формулы 1, полученного способом по п.1, трифенилфосфином в водном тетрагидрофуране и последующим взаимодействием соединения общей формулы 15 с ди-Вос-тиомочевиной с последующим гидролизом соединения формулы 16 гидроокисью лития в водном диоксане и снятием Вос-защиты с кислоты формулы 17 30% раствором трифторуксусной кислоты в хлористом метилене
где R1=H, F; R2=C2H5.
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| RU2181357С2,20.04.2002 | |||
| US 0007531687 B2 ,12.05.2009 | |||
| WO 2009029888 A2, 05.03.2009 | |||
Авторы
Даты
2014-06-27—Публикация
2013-02-27—Подача