Предлагаемое изобретение относится к молочной промышленности и может быть использовано для приготовления кисломолочных продуктов.
Известен способ получения сухого препарата для производства кисломолочных продуктов, предусматривающий приготовление питательной среды и инокулята, заквашивание среды, наращивание клеток, получение бактериальной массы, смешивание с защитной средой, розлив во флаконы или в лотки, замораживание, сушку [RU №2129794 С1, МПК 6 А23С 9/12, C12N 1/20, опубл. 10.05.1999].
Использование монокультур пробиотических микроорганизмов снижает биотехнологические и пробиотические свойства концентрата.
Недостатком данного способа являются низкие биотехнологические и пробиотические свойства концентрата.
Наиболее близким способом к заявляемому изобретению по совокупности признаков является способ получения бактериального концентрата, включающий приготовление питательной среды, стерилизацию, охлаждение, внесение инокулята бифидобактерий и пропионово-кислых бактерий, наращивание биомассы, отделение биомассы от культуральной жидкости, розлив, замораживание, укупорку, маркировку и хранение [RU №2372782 С1, МПК А23С 9/12, опубл. 20.11.2009].
Недостатком данного способа является длительность ферментации и недостаточно высокие структурно-механические свойства полученных сгустков.
Технический результат, обеспечивающий осуществление предлагаемого изобретения, заключается в интенсификации процесса ферментации, повышении структурно-механических свойств.
Указанный технический результата при осуществлении изобретения достигается тем, что в способе получения бактериального концентрата на основе симбиоза пробиотических бактерий, включающем приготовление питательной среды, стерилизацию, охлаждение, внесение комбинированной закваски, состоящей из отдельно активизированных β-галактозидазой бифидобактерий штамм Bifidobacterium longum В 379 М и пропионово-кислых бактерий Propionibakterium Freudenreichii Shermanii subsp. AC-2503, наращивание клеток, отделение бактериальной массы от культуральной среды, смешивание ее с защитной средой, розлив, укупорку, замораживание, согласно изобретению комбинированная закваска дополнительно содержит активизированную закваску Lactobacillus acidophilus вязкой расы, при этом бактерии Bifidobacterium longum В 379 М, Propionibakterium Freudenreichii Shermanii subsp. AC-2503, Lactobacillus acidophilus берут в соотношении 9:0,7:0,3.
Отличительным признаком заявляемого способа является введение в состав комбинированной закваски активизированной бактериальной закваски ацидофильной палочки Lactobacillus acidophilus вязкой расы и выбранное соотношение бактерий, при котором обеспечиваются высокие биохимическая активность, структурно-механические и потребительские свойства.
Для осуществления заявляемого способа были проведены экспериментальные исследования.
Были изучены бифидобактерии, пропионово-кислые бактерии, ацидофильная палочка в соотношениях: 9:0,7:0,3; 9:0,3:0,7; 9:0,5:0,5. Изучение данных бактерий именно в таких соотношениях объясняется тем, что при производстве продуктов функционального питания бифидобактерии рекомендуют комбинировать с другими микроорганизмами, прежде всего с культурами, способными образовывать плотный и вязкий сгусток, например, с лактобактериями. При этом соотношение между этими микроорганизмами в продуктах должно составлять 9:1, что соответствует таковому в составе микроорганизмов толстой кишки здоровых людей.
На первом этапе исследований были выбраны оптимальная температура и соотношение. При выборе температурного режима культивирования инокулята соотношения были изучены по таким показателям, как титруемая и активная кислотность, содержание летучих жирных кислот, время сквашивания, количество жизнеспособных клеток. Результаты исследований представлены в таблице 1.
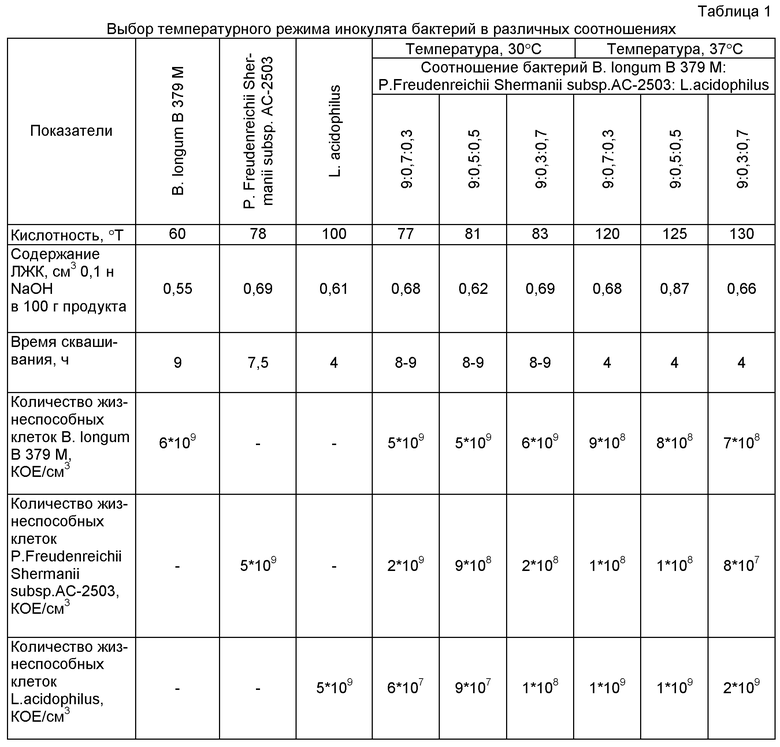
Анализ влияния температуры культивирования на свойства сгустков показал, что значительные отличия наблюдаются по показателю титруемой кислотности, продолжительности сквашивания молока. Так, при температуре культивирования, равной 30°C, сгусток формируется за 8-9 часов и характеризуется кислотностью (77-83)°Т. При температуре культивирования 37°C активность ферментации составляет 4 ч при конечной кислотности (120-130)°Т и снижается количество жизнеспособных клеток бифидобактерий до 108 КОЕ/см3.
При повышении температуры культивирования до 37°C отмечена высокая кислотность и уменьшение количества жизнеспособных клеток бифидобактерий. Это вероятно объясняется активным ростом бактерий ацидофильной палочки и накоплением молочной кислоты, что создает неблагоприятные условия для роста бифидобактерий и в связи с этим при дальнейших исследованиях микроорганизмы культивировали при 30°C.
Таким образом, температура ферментации была выбрана с учетом сбалансированного роста микроорганизмов, входящих в состав закваски.
В дальнейших исследованиях для выбора оптимального соотношения микроорганизмов были изучены структурно-механические свойства ферментированных сгустков в различных соотношениях бактерий при выбранной температуре культивирования 30°C.
Общим методом для количественной оценки течения молочных сгустков как неньютоновских жидкостей является определение коэффициента эффективной вязкости. Данные представлены в таблице 2.
L. acidophilus 9:0,7:0,3
L. acidophilus 9:0,5:0,5
L. acidophilus 9:0,3:0,7
Образцы являются неньютоновскими жидкостями, поэтому коэффициенты эффективности вязкости сгустков превышают единицу. Количественно степень восстановления структуры сгустка с соотношением бактерий 9:0,7:0,3 имеет наибольшее значение, что говорит о наибольшей восстанавливаемости структуры при нагрузке и разгрузке.
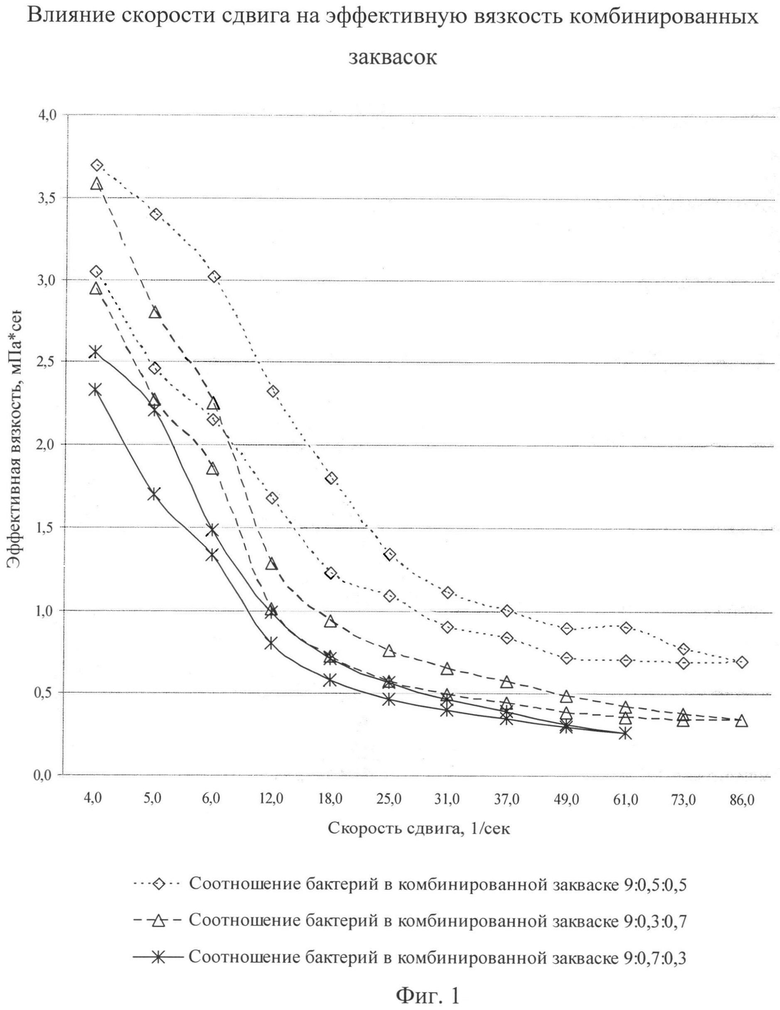
Также видимым проявлением тиксотропности является зависимость вязкости от времени, поэтому в ходе исследований были получены кривые течения в координатах «вязкость - скорость сдвига» при увеличении скорости сдвига и последующем его уменьшении. Полученные результаты представлены на фиг.1.
Как видно из фиг.1, кривые течения имеют форму петли гистерезиса. Полученные кривые не накладывались друг на друга, поэтому можно говорить о тиксотропном поведении системы во всех трех заквасках. Было установлено, что у исследованных образцов в зависимости от повышения степени разрушения способность к восстановлению структуры уменьшается. Следовательно, для исследованных образцов характерно частичное восстановление структуры сгустка. При этом отмечено, что степень восстановления структуры во всех соотношениях различна, однако структура сгустка с соотношением бактерий 9:0,7:0,3 характеризуется наибольшей устойчивостью к разрушению при механическом воздействии, т.к. значения эффективной вязкости для неразрушенной структуры и структуры, подвергшейся воздействию градиента, отличаются меньше, чем в остальных заквасках. При анализе эффективной вязкости установлено, что сгусток с соотношением бактерий 9:0,7:0,3 характеризуется наибольшими тиксотропными свойствами, поэтому имеет наибольшую способность к восстановлению структуры.
В результате исследований структурно-механических свойств соотношений можно сделать вывод, что оптимальным соотношением бифидобактерий, пропионово-кислых бактерий и бактерий ацидофильной палочки в комбинированной закваске является соотношение 9:0,7:0,03.
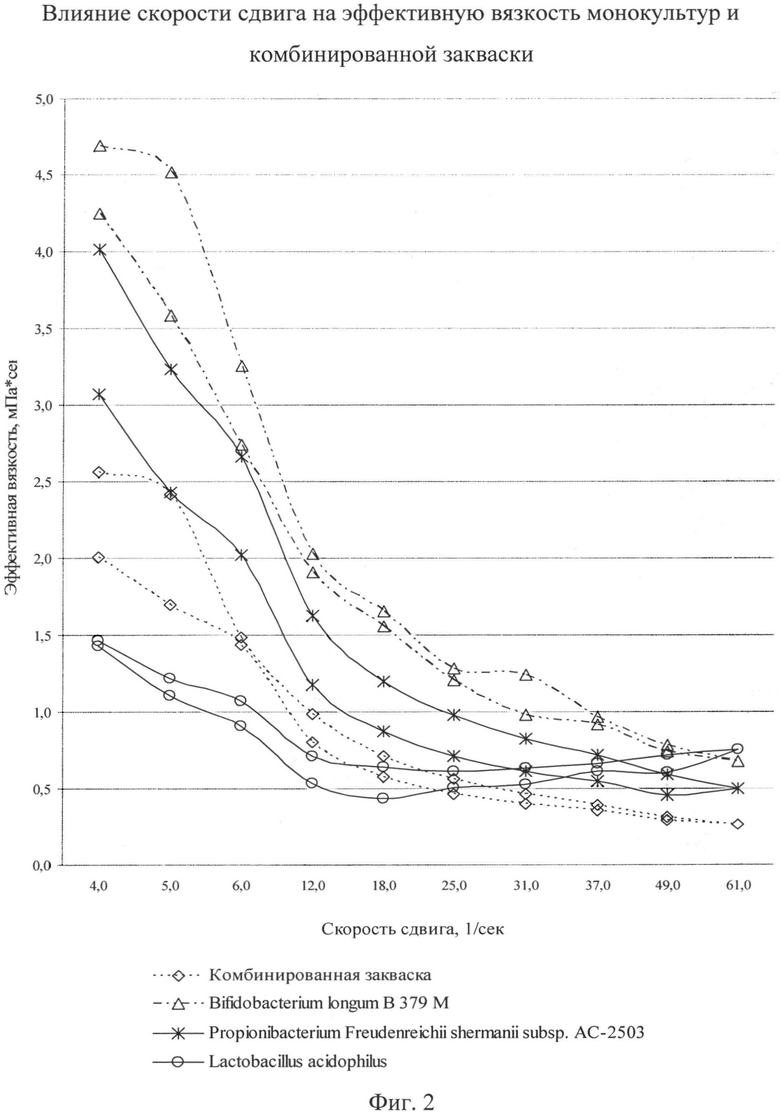
Также нами были исследованы тиксотропные свойства комбинированной закваски с оптимальным соотношением бактерий 9:0,7:0,3 и монокультур. Видимым проявлением тиксотропности является зависимость вязкости от времени, поэтому в ходе исследований были получены кривые течения в координатах «эффективная вязкость - скорость сдвига» при увеличении скорости сдвига и последующем его уменьшении. Полученные результаты представлены на фиг.2.
Как видно из фиг.2, кривые течения имеют форму петли гистерезиса. Полученные кривые не накладывались друг на друга, поэтому можно говорить о тиксотропном поведении системы в монокультурах и комбинированной закваске. Степень восстановления структуры сгустка бактерий ацидофильной палочки характеризуется наибольшей устойчивостью к разрушению при механическом воздействии, т.к. значения эффективной вязкости для неразрушенной структуры и структуры, подвергшейся воздействию градиента, отличаются меньше, чем в остальных заквасках. Это объясняется тем, что бактерии ацидофильной палочки образуют сгусток вязкой и плотной консистенции. Как видно из фиг.2, восстанавливаемость структуры сгустка комбинированной закваски выше по сравнению с восстанавливаемостью монокультур бифидобактерий и пропионово-кислых бактерий. Поэтому можно говорить о том, что использование культуры ацидофильной палочки в комбинированной закваске повышает восстанавливаемость структуры. Высокая плотность популяции при совместном культивировании бифидобактерий, пропионово-кислых бактерий и бактерий ацидофильной палочки говорит о том, что данные бактерии в процессе культивирования не угнетают друг друга.
Таким образом, оптимальное соотношение бактерий в инокуляте 9:0,7:0,3 выбрано с учетом степени восстановления структуры, приемлемой скорости ферментации, умеренной кислотности и сбалансированного содержания жизнеспособных клеток культур.
Далее представлена качественная характеристика комбинированной закваски в таблице 3.
Из таблицы 3 видно, что комбинированная закваска характеризуется в меру вязкой, однородной консистенцией, мягким кисломолочным вкусом и запахом, что обусловлено выработкой ароматических соединений и экзополисахаридов. Инокулят характеризуется улучшенными органолептическими и биотехнологическими свойствами, более активным процессом ферментации в сравнении с монокультурами и с прототипом, что имеет важное практическое значение для производителей, так как позволяет ускорить технологический процесс. Введение в комбинированную закваску бактерий ацидофильной палочки позволяет повысить структурно-механические свойства инокулята, улучшить консистенцию продукта, интенсифицировать процесс ферментации и оказывает положительное влияние при хранении инокулята.
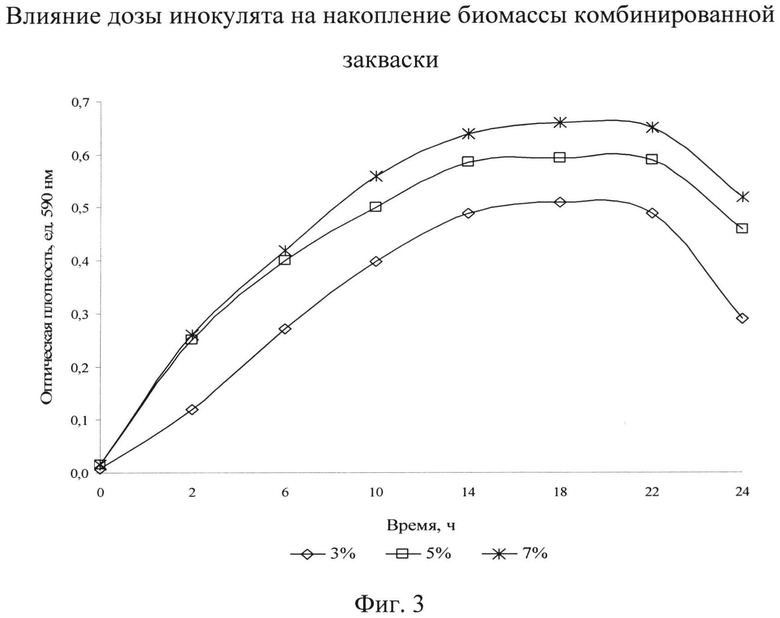
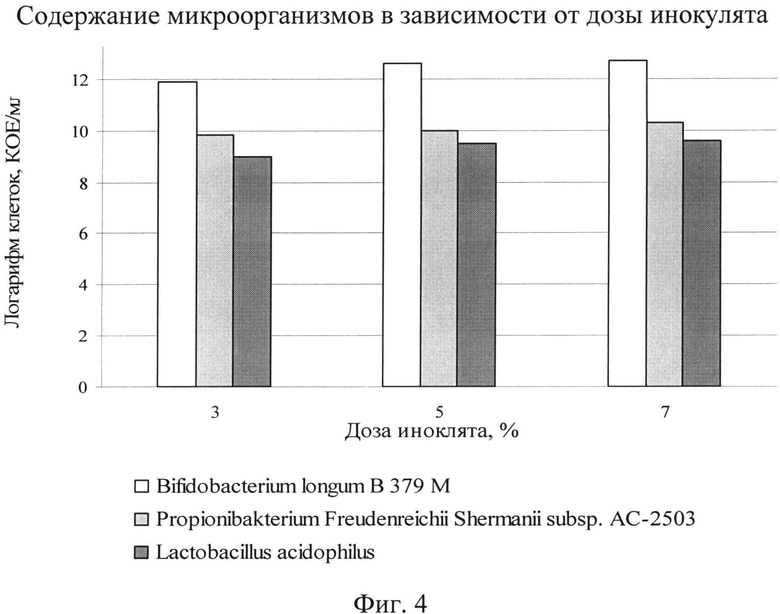
На следующем этапе исследовали влияние количества посевного материала на рост и размножение бактерий. Дозу инокулята варьировали от 3-7%. Оптимальную дозу инокулята выбирали по максимальной скорости роста бактерий, отражающей эффективность накопления биомассы и жизнеспособных клеток микроорганизмов. Зависимость роста бактерий от дозы инокулята представлена на фиг.3.
Как видно из фиг.3, с увеличением дозы инокулята интенсивность нарастания биомассы увеличивается. Так, при увеличении дозы инокулята с 3% до 5% значение оптической плотности резко возрастает. Дальнейшее повышение дозы инокулята до 7% незначительно сказывается на показаниях оптической плотности.
Наращивание биомассы сопоставимо с ростом микроорганизмов и соответственно увеличением числа клеток. Влияние дозы инокулята на количество жизнеспособных клеток в концентрате отображено на фиг.4.
Как видно из фиг.4, при дозе инокулята 5% количество клеток пропионово-кислых достигает 1010 КОЕ/см3 и количество клеток бифидобактерий - 1012 КОЕ/см3, что на порядок выше, чем при меньших дозах инокулята. Количество клеток ацидофильной палочки с увеличением дозы инокулята увеличивается, но с тем же титром. Дальнейшее увеличение дозы до 7% к значительному увеличению количества клеток не приводит.
Таким образом, оптимальной дозой выбрана доза инокулята 5% от объема питательной среды, обеспечивающая равномерные рост и размножение микроорганизмов. Увеличение массовой дозы инокулята более 5% нецелесообразно по экономическим показателям.
При получении бактериального концентрата использовали питательную среду на основе творожной сыворотки с добавлением ростовых факторов, на которой активно растут бифидобактерии и пропионово-кислые бактерии.
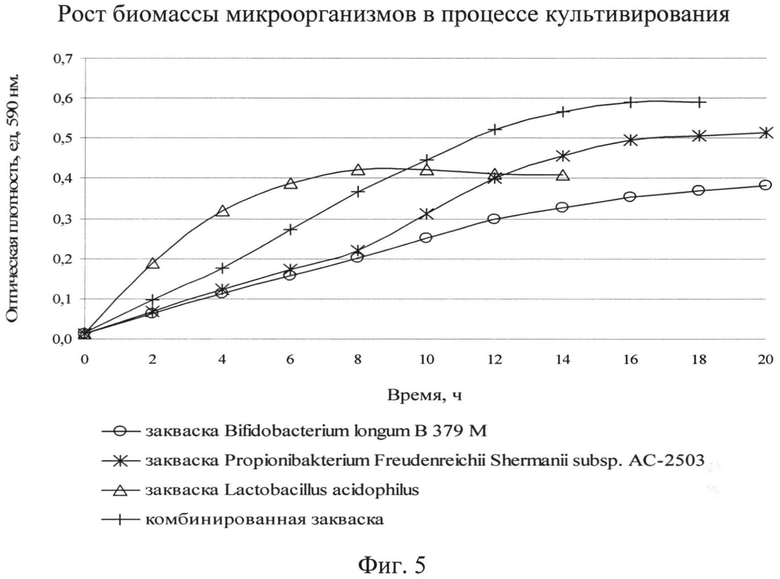
В дальнейших исследованиях дана сравнительная характеристика роста биомассы монокультур и комбинированной закваски при выбранных условиях культивирования. Данные представлены на фиг.5.
Данные, отраженные на фиг.5, показывают, что биомасса комбинированной закваски нарастает интенсивнее, процесс культивирования сокращается на 4-8 часов по сравнению с монокультурами и составляет (14-16) ч. Интенсивное накопление биомассы в сравнении с монокультурами говорит о том, что питательная среда с ростовыми культурами содержит все необходимое для роста монокультур в ассоциации при совместном культивировании.
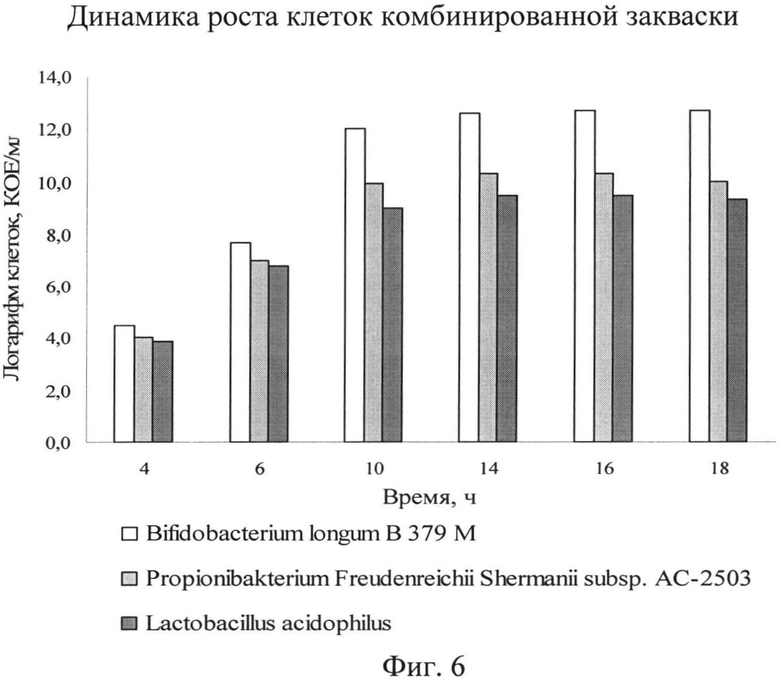
Далее на фиг.6 представлена динамика роста микроорганизмов в комбинированной закваске и в монокультурах в процессе культивирования.
Как видно на фиг.6, клетки комбинированной закваски хорошо развиваются на питательной среде, о чем свидетельствует количество клеток бифидобактерий, пропионово-кислых бактерий, бактерий ацидофильной палочки к концу процесса культивирования, которое составляет не менее 1012, 1010 и 109 КОЕ/см3 соответственно.
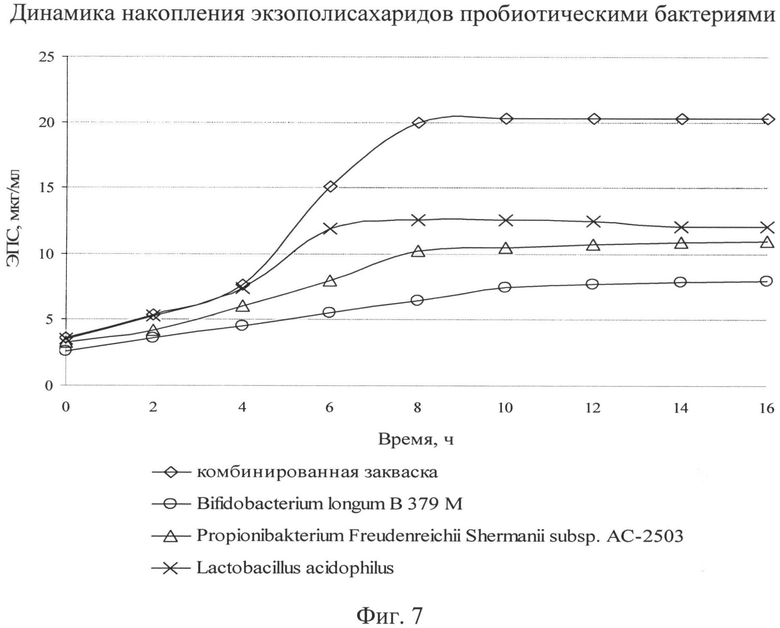
Известно, что экзополисахариды положительно влияют на консистенцию продукта, повышают гидрофильные и эмульгирующие свойства, регулируют активность микроорганизмов, выступают в роли факторов, способствующих адгезии полезных микроорганизмов на стенках кишечника. Поэтому в дальнейших исследованиях изучали биосинтез ЭПС монокультурами и их ассоциацией. В результате эксперимента определено общее количество ЭПС. Полученные результаты представлены на фиг.7.
Как видно из фиг.7, накопление экзополисахаридов бактериями различно. Синтез начинается с первых часов культивирования и продолжается на всех стадиях роста. По полученным данным видно, что наибольшее количество экзополисахаридов среди монокультур синтезируют пропионово-кислые бактерии и бактерии ацидофильной палочки, при симбиозе бактерий количество экзополисахаридов увеличивается. Различный выход экзополисахаридов можно объяснить физиологией бактерий, проявляющихся при отдельном и совместном культивировании. Известно, что экзополисахариды обладают бифидогенными свойствами, поэтому, возможно, синтезируемое количество экзополисахаридов бактериями стимулирует рост бифидобактерий, являясь для них питательным материалом, исходя из количества жизнеспособных клеток бифидобактерий в комбинированной закваске. При этом, содержание экзополисахаридов в комбинированной закваске остается на высоком уровне. Вероятно, это связано с тем, что бактерии ацидофильной палочки в начале ферментации активно синтезируют ЭПС, тем самым поддерживая рост остальных бактерий в ассоциации, затем суммарное количество ЭПС возрастает и достигает максимального количества в стационарной фазе комбинированной закваски. Синтезируемые бактериями экзополисахариды защищают от внешних воздействий, позволяя адаптироваться комбинированной закваске в условиях среды, и имеют важное значение при создании симбиозов бактерий для стимуляции их роста.
На основании проведенных исследований подобраны оптимальные условия культивирования комбинированной закваски - доза инокулята 5% от общего объема питательной среды при продолжительности культивирования 14-16 часов при температуре (30±1)°C.
В результате проведенных исследований разработана технология бактериального концентрата, обладающего хорошими структурно-механическими свойствами и высоким содержанием экзополисахаридов. Качественная характеристика бактериального концентрата представлена в таблице 4.
Полученный заявляемым способом бактериальный концентрат обладает высокими биохимическими свойствами, содержит высокое количество жизнеспособных клеток.
Известно, что для использования бактериального концентрата необходимо создать условия для продления сроков хранения микрофлоры, что определяется экономическими условиями производства. Одним из способов сохранения жизнеспособности клеток является замораживание. Также для продления сроков хранения концентратов используют защитные среды, предохраняющие от необратимых изменений как в процессе замораживания, так и при последующем хранении в нерегулируемых внешних условиях. В состав защитной среды разработанного нами концентрата входят: сахароза 1%, натрий лимоннокислый 2%, дистиллированная вода.
Поэтому на следующем этапе работы проводили замораживание полученной биомассы бактериального концентрата и изучали влияние криоанабиоза на выживаемость клеток. Стрессорное воздействие на микроорганизмы осуществляли путем замораживания биомассы микроорганизмов при температуре минус 18°C. Результаты проведенных исследований представлены в таблице 5.
Как видно из таблицы 5, при замораживании происходит незначительная гибель микробных клеток: выживаемость бифидобактерий и пропионово-кислых бактерий составляет 75%, пропионово-кислых бактерий - 67%, ацидофильной палочки - 60%. Однако, учитывая тот факт, что порядок количества клеток остается на прежнем уровне, можно сказать, что потери, вызванные криоконсервированием незначительные. Это, вероятно, можно объяснить тем, что в клетках и в среде культивирования накапливаются экзополисахариды 17,99 и 27,1 мкг/мл, соответственно. Однако необходимо учесть, что культуральная жидкость в процессе производства бакконцентрата удаляется. Следовательно, протекторное действие оказывают внутриклеточные полисахариды, которые выполняют роль естественных протекторов. Проведенные исследования свидетельствуют о протекторном действии экзополисахаридов. Также замораживание дает малую вероятность контаминации культуры, сохранение стабильности свойств микроорганизмов, а также небольшой расход материалов при подготовке концентрата к хранению.
Таким образом, заявляемый способ обеспечивает интенсификацию процесса ферментации, полученный бактериальный концентрат характеризуется высокой биохимической активностью, структурно-механическими и пробиотическими свойствами и может быть использован для производства кисломолочных продуктов.
Предлагаемый способ получения замороженного бактериального концентрата на основе симбиоза пробиотических бактерий осуществляют следующим образом.
Для приготовления питательной среды используют осветленную творожную сыворотку. Для осветления сыворотки ее нагревают до (92-95)°C, раскисляют 40% раствором аммиака до рН 6,0-6,5, выдерживают (10-15) минут и фильтруют. В подготовленную сыворотку вносят хлористый магний, натрий лимоннокислый трехзамещенный, калий фосфорнокислый однозамещенный, аскорбиновую кислоту, пептон, агар-агар, рН среды устанавливают в пределах 6,8-7,0. Готовую среду стерилизуют при 121°C в течение (30-40) минут и охлаждают до 30°C и вносят комбинированную закваску в количестве 5%, перемешивают.
Комбинированная закваска состоит из отдельно активизированных β-галактозидазой культур бифидобактерий Bifidobacterium longum В 379 М, пропионово-кислых бактерий Propionibakterium Freudenreichii Shermanii subsp. АС-2503 и активизированной бактериальной закваски ацидофильной палочки Lactobacillus acidophilus вязкой расы, взятых в соотношении 9:0,7:0,3.
Наращивание клеток бифидобактерий проводят в течение (14-16) часов при (30±1)°C. В процессе культивирования осуществляют контроль за показателем рН в пределах 6,6-7,0. По окончании процесса культивирования производят отделение бактериальной массы от культуральной жидкости центрифугированием при n=3000 об/мин, τ=15 минут.
Выход бактериальной массы составляет (1,5-2)%. Полученную бактериальную массу смешивают с защитной средой в соотношении 1:1. Затем разливают во флаконы по 1 см3 (1 доза) и замораживают в морозильной камере при температуре минус 25°C. Хранение концентрата осуществляют в морозильной камере при минус 18°C. Замороженный концентрат сохраняет активность сквашивать молоко до 10 месяцев.
Пример 1
Для приготовления питательной среды используют осветленную творожную сыворотку. Для осветления сыворотки ее нагревают до 92°C, раскисляют 40% раствором аммиака до рН 6,0, выдерживают 10 минут и фильтруют. В подготовленную сыворотку вносят хлористый магний, натрий лимоннокислый трехзамещенный, калий фосфорнокислый однозамещенный, аскорбиновую кислоту, пептон, агар-агар, рН среды устанавливают в пределах 6,8. Готовую среду стерилизуют при 121°C в течение 30 минут и охлаждают до 30°C и вносят комбинированную закваску, состоящую из отдельно активизированных β-галактозидазой культур Bifidobacterium longum В 379 М, Propionibakterium Freudenreichii Shermanii subsp. AC-2503 и активизированной бактериальной закваски Lactobacillus acidophilus вязкой расы, взятых в соотношении 9:0,7:0,3 в количестве 5%.
Наращивание клеток бифидобактерий проводят в течение 14 часов при (30±1)°C. В процессе культивирования осуществляют контроль за показателем рН в пределах 6,6. По окончании процесса культивирования производят отделение клеток от культуральной жидкости центрифугированием при n=3000 об/мин, τ=15 минут.
Полученную бактериальную массу смешивают с защитной средой в соотношении 1:1. Затем разливают во флаконы по 1 см3 (1 доза) и замораживают в морозильной камере при температуре минус 25°C. Хранение концентрата осуществляют в морозильной камере при минус 18°C. Замороженный концентрат сохраняет активность сквашивать молоко до 10 месяцев.
Пример 2
Для приготовления питательной среды используют осветленную творожную сыворотку. Для осветления сыворотки ее нагревают до 94°C, раскисляют 40% раствором аммиака до рН 6,3, выдерживают 13 минут и фильтруют. В подготовленную сыворотку вносят хлористый магний, натрий лимоннокислый трехзамещенный, калий фосфорнокислый однозамещенный, аскорбиновую кислоту, пептон, агар-агар, рН среды устанавливают в пределах 6,9. Готовую среду стерилизуют при 121°C в течение 35 минут и охлаждают до 30°C и вносят комбинированную закваску, состоящую из отдельно активизированных β-галактозидазой культур Bifidobacterium longum В 379 М, Propionibakterium Freudenreichii Shermanii subsp. AC-2503 и активизированной бактериальной закваски Lactobacillus acidophilus вязкой расы, взятых в соотношении 9:0,7:0,3 в количестве 5%.
Наращивание клеток бифидобактерий проводят в течение 15 часов при (30±1)°C. В процессе культивирования осуществляют контроль за показателем рН в пределах 6,8.
По окончании процесса культивирования производят отделение клеток от культуральной жидкости центрифугированием при n=3000 об/мин, τ=15 минут.
Полученную бактериальную массу смешивают с защитной средой в соотношении 1:1. Затем разливают во флаконы по 1 см3 (1 доза) и замораживают в морозильной камере при температуре минус 25°C. Хранение концентрата осуществляют в морозильной камере при минус 18°C. Замороженный концентрат сохраняет активность сквашивать молоко до 10 месяцев.
Пример 3
Для приготовления питательной среды используют осветленную творожную сыворотку. Для осветления сыворотки ее нагревают до 95°C, раскисляют 40% раствором аммиака до рН 6,5, выдерживают 15 минут и фильтруют. В подготовленную сыворотку вносят хлористый магний, натрий лимоннокислый трехзамещенный, калий фосфорнокислый однозамещенный, аскорбиновую кислоту, пептон, агар-агар, рН среды устанавливают в пределах 7,0. Готовую среду стерилизуют при 121°C в течение 40 минут и охлаждают до 30°C и вносят комбинированную закваску, состоящую из отдельно активизированных β-галактозидазой культур Bifidobacterium longum В 379 М, Propionibakterium Freudenreichii Shermanii subsp. AC-2503 и активизированной бактериальной закваски Lactobacillus acidophilus вязкой расы, взятых в соотношении 9:0,7:0,3, в количестве 5%.
Наращивание клеток бифидобактерий проводят в течение 16 часов при (30±1)°C. В процессе культивирования осуществляют контроль за показателем рН в пределах 7,0. По окончании процесса культивирования производят отделение клеток от культуральной жидкости центрифугированием при n=3000 об/мин, τ=15 минут.
Полученную бактериальную массу смешивают с защитной средой в соотношении 1:1. Затем разливают во флаконы по 1 см3 (1 доза) и замораживают в морозильной камере при температуре минус 25°C. Хранение концентрата осуществляют в морозильной камере при минус 18°C. Замороженный концентрат сохраняет активность сквашивать молоко до 10 месяцев.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЗАМОРОЖЕННОЙ КОНЦЕНТРИРОВАННОЙ ЗАКВАСКИ НА ОСНОВЕ СИМБИОЗА ПРОБИОТИЧЕСКИХ БАКТЕРИЙ | 2008 |
|
RU2372782C1 |
| СПОСОБ ПОЛУЧЕНИЯ БАКТЕРИАЛЬНОГО КОНЦЕНТРАТА КОНСОРЦИУМА ПРОБИОТИЧЕСКИХ МИКРООРГАНИЗМОВ | 2013 |
|
RU2544052C2 |
| Способ получения бактериального концентрата на основе симбиоза пробиотических микроорганизмов | 2021 |
|
RU2789036C2 |
| СПОСОБ ПОЛУЧЕНИЯ СЕЛЕНСОДЕРЖАЩЕЙ БИОЛОГИЧЕСКИ АКТИВНОЙ ДОБАВКИ | 2006 |
|
RU2333655C2 |
| СПОСОБ ПОЛУЧЕНИЯ БАКТЕРИАЛЬНОГО КОНЦЕНТРАТА ПРОПИОНОВО-КИСЛЫХ БАКТЕРИЙ | 2005 |
|
RU2309982C2 |
| СПОСОБ ПОЛУЧЕНИЯ СУХОГО ПРЕПАРАТА ДЛЯ ПРОИЗВОДСТВА КИСЛОМОЛОЧНЫХ ПРОДУКТОВ | 1997 |
|
RU2129794C1 |
| СПОСОБ ПРОИЗВОДСТВА ЙОДИРОВАННЫХ ПРОДУКТОВ | 2005 |
|
RU2294645C2 |
| СПОСОБ ПРОИЗВОДСТВА КВАСНОГО НАПИТКА | 2008 |
|
RU2361911C1 |
| СПОСОБ ПОЛУЧЕНИЯ КИСЛОСЛИВОЧНОГО МАСЛА С ПРОБИОТИЧЕСКИМИ СВОЙСТВАМИ | 2015 |
|
RU2608498C2 |
| СПОСОБ ПРОИЗВОДСТВА ВАРЕНО-КОПЧЕНЫХ КОЛБАС | 2008 |
|
RU2375925C1 |
Изобретение относится к биотехнологии и может быть использовано для приготовления кисломолочных продуктов. Способ предусматривает приготовление питательной среды, ее стерилизацию и охлаждение. В охлажденную питательную среду вносят комбинированную закваску, содержащую отдельно активизированные β-галактозидазой бифидобактерии штамм Bifidobacterium longum В 379 М, пропионово-кислые бактерии штамм Propionibakterium Freudenreichii Shermanii subsp. AC-2503 и активизированную бактериальную закваску Lactobacillus acidophilus вязкой расы, взятые в соотношении 9:0,7:0,3 соответственно, в количестве 5% от объема питательной среды. Культивируют в течение 14-16 часов при заданных параметрах процесса и отделяют клетки от культуральной жидкости с получением бактериальной массы. Смешивают полученную бактериальную массу с защитной средой в соотношении 1:1. Разливают, укупоривают и замораживают. Изобретение позволяет интенсифицировать процесс ферментации и повысить структурно- механические свойства сгустка. 1 з.п. ф-лы, 7 ил., 5 табл., 3 пр.
1. Способ получения замороженного бактериального концентрата на основе симбиоза пробиотических бактерий, предусматривающий приготовление питательной среды, стерилизацию, охлаждение, внесение комбинированной закваски в количестве 5%, включающей отдельно активизированные β-галактозидазой бифидобактерии штамм Bifidobacterium longum В 379 М, пропионово-кислые бактерии штамм Propionibakterium Freudenreichii Shermanii subsp. AC-2503, наращивание клеток, отделение бактериальной массы от культуральной среды, смешивание ее с защитной средой, розлив и укупорку, замораживание, отличающийся тем, что комбинированная закваска дополнительно содержит активизированную закваску Lactobacillus acidophilus вязкой расы, при этом бактерии Bifidobacterium longum В 379 М, Propionibakterium Freudenreichii Shermanii subsp. AC-2503, Lactobacillus acidophilus вязкой расы берут в соотношении 9:0,7:0,3.
2. Способ по п.1, отличающийся тем, что наращивание клеток осуществляют при температуре (30±1)°C в течение 14-16 часов.
| СПОСОБ ПОЛУЧЕНИЯ ЗАМОРОЖЕННОЙ КОНЦЕНТРИРОВАННОЙ ЗАКВАСКИ НА ОСНОВЕ СИМБИОЗА ПРОБИОТИЧЕСКИХ БАКТЕРИЙ | 2008 |
|
RU2372782C1 |
| СПОСОБ ПОЛУЧЕНИЯ БАКТЕРИАЛЬНОГО КОНЦЕНТРАТА ПРОПИОНОВО-КИСЛЫХ БАКТЕРИЙ | 2005 |
|
RU2309982C2 |
| СПОСОБ ПОЛУЧЕНИЯ СУХОГО ПРЕПАРАТА ДЛЯ ПРОИЗВОДСТВА КИСЛОМОЛОЧНЫХ ПРОДУКТОВ | 1997 |
|
RU2129794C1 |
| МУРУЕВ И.Е., Разработка технологии пробиотического бактериального концентрата, Автореф | |||
| Дис | |||
| на соискание ученой степени кандидата технических наук, Улан- Удэ, 2005 год | |||
Авторы
Даты
2014-07-27—Публикация
2013-03-26—Подача