Область изобретения
Данное изобретение относится к области биомедицинской химии. В частности, изобретение охватывает новые пептидные лиганды соматостатиновых рецепторов. Эти пептидные лиганды имеют потенциальное применение в превентивных и/или куративных терапиях, используемых при патологиях, при которых экспрессируются соматостатиновые рецепторы, а также в диагностике заболеваний, при которых экспрессируются указанные рецепторы.
Предшествующий уровень техники
Соматостатин представляет собой тетрадекапептид, первоначально изолированный в гипоталамусе [Burgus et al., Proc. Natl. Acad. Sci. USA, 1973, 70, 684-688]. Соматостатин-регулирующий механизм запускается посредством связывания с сопряженными с G-белком соматостатиновыми рецепторами sstr1, sstr2, sstr3, sstr4 и sstr5 [Patel et al., Front. Neuroendocrinol., 1999, 20, 157-198]. Они все связываются с соматостатином с наномолярной аффинностью [Patel et al., Endocrinology, 1994, 135, 2814-2817]. Пять соматостатиновых рецепторов различаются по их распределению в ткани и фармакологическим свойствам. Первое известное действие соматостатина заключается в ингибировании секреции гормона роста через рецепторы sstr2 и sstr5. Кроме того, соматостатин ингибирует секрецию глюкагона через sstr2 и секрецию инсулина через sstr5 [Strowski et al., 2000, Endocrinology, 141(1), 111-117]. Представляется, что рецептор sstr3 и в меньшей степени рецептор sstr2 вовлечены в индуцирование клеточного апоптоза [Qiu et al., 2006, Worid Gastroenterol., 12(13), 2011-2015]. Кроме того, sstr1 и sstr5 оказывают ингибиторный эффект на клеточный цикл, и sstr1 может модулировать ангиогенез [Bocci et al., Eur. J. Clin. Invest., 2007, 37(9), 700-708]. Функция sstr4 изучена в меньшей степени, хотя недавние исследования показали его потенциал в качестве терапевтической мишени при заболеваниях печени и раке предстательной железы [Jung et al., Laboratory investigation, 2006, 86, 477-489; Hansson et al., Prostate, 2002, 53(1), 50-593].
В клинической практике соматостатин используют в качестве терапевтического средства для лечения желудочно-кишечного кровотечения вследствие варикозного расширения вен пищевода и желудка и в качестве адъюванта в лечении секретирующих панкреатических фистул. Отсутствие побочных эффектов является его самым большим преимуществом. Несмотря на его биологический профиль одним из недостатков соматостатина является его короткий период полужизни в крови (менее 3 минут), что делает необходимым осуществлять непрерывную инфузию и ограничивает его применение госпитальным уровнем.
Короткий период полужизни соматостатина привел к разработке аналогов, которые имеют более высокую устойчивость к ферментативному расщеплению. Аналоги соматостатина, которые сохраняют структуру исходной молекулы, можно найти в публикациях, отражающих состояние уровня техники. Например, в патенте США 4211693А описаны аналоги соматостатина, в которых любая аминокислота фенилаланин заменена парагалогенированным или параметоксилированным фенилаланином, и в патенте США 4133782 А описаны аналоги соматостатина, в которых аминокислота триптофан в положении 8 является D-стереоизомером. Описаны также первичные аналоги с D-аминокислотами [Brown et al. J. Physiol. 1978, 277, 1-14]. Помимо этих первоначальных предложений, касающихся аналогов соматостатина на основе исходной молекулы, большинство работ, известных в данной области, относятся к аналогам из 8 или менее аминокислот [Janecka et al. 2001, J. Pept. Res., 58(2), 91-107; Pawlikowski et al., 2004, Curr. Opin. Pharmacol., 4(6), 608-613].
Октреотид стал первым аналогом, разработанным в клинической практике. Он имеет структуру с 6-аминокислотным циклом. Другие октреотидные аналоги, которые сохраняют общую структуру с 6-аминокислотным циклом (ланреотид, вапреотид, пасиреотид), можно найти в предшествующем уровне техники. Сокращение исходного 12-аминокислотного цикла соматостатина до 6-аминокислотного цикла ограничивает гибкость исходной молекулы и, следовательно, ограничивает взаимодействие с некоторыми рецепторами семейства рецепторов sstr1-sstr5. В то время как соматостатин с наномолярной аффинностью связывается с каждым из его рецепторов sstr1, sstr2, sstr3, sstr4 и sstr5, октреотид, ланреотид и вапреотид связываются с высокой аффинностью только с рецептором sstr2, с умеренной аффинностью связываются с рецептором sstr5 и с умеренно низкой аффинностью связываются с sstr3, и они не связываются с рецепторами sstr1 и sstr4 [Patel et al., Endocrinology, 1994, 135(6), 2814-2817]. В случае пасиреотида взаимодействие с рецептором sstr4 отсутствует, а аффинность к рецептору sstr2 на порядок ниже [Weckbecker et al., Endocrinology, 2002, 143, 4123-4130].
Идентификация разных профилей экспрессии пяти соматостатиновых рецепторов в органах-мишенях соматостатина объясняет ограниченную эффективность лечения октреотидом, ланреотидом и вапреотидом при патологиях, при которых рецептор sstr2 недостаточно экспрессируется [Khare et al., Faseb J., 1999, 13(2), 387-394].
Применение этих 3 аналогов было одобрено для ограниченного числа клинических применений, таких как акромегалия, метастатическая карциноидная опухоль, ВИПомы (опухоли, продуцирующие вазоактивный интестинальный белок), диарея, кровотечение из варикозных вен пищевода и периоперационная защита при хирургии поджелудочной железы. Принимая во внимание широкий круг патологий, при которых идентифицирована экспрессия соматостатиновых рецепторов [Pawlikowski et al., Neuro Endocrinol Lett, 2003, 24 (1-2), 21-27; Vaysse et al., Curr. Med. Chem., 2005, 4, 91-104; Reubi etal., Endocr. Rev., 2003, 24(4), 389-427; Kumar et al., Neuroscience, 2005, 134(2), 525-538], эти известные аналоги удовлетворяют лишь небольшую часть возможных применений.
В свете клинического интереса к аналогам соматостатина с высокой аффинностью к нескольким или всем его рецепторам и к новым применениям соматостатина и его аналогов [Tulipano et al., Eur. J. Endocrinol., 2007, 156 Suppl 1, S3-SII; Lamberts et al., Eur. J. Endocrinol., 2002, 146(5), 701-705], гетерогенная экспрессия рецепторов sstr2 и sstr5 в аденомах, секретирующих гормон роста, и их лечении биспецифическими аналогами продемонстрировала лучший контроль гиперсекреции гормона роста при лечении октреотидом и ланреотидом с.преимущественной аффинностью к рецептору sstr2 с ингибиторной концентрацией ICso, в 12-18 раз более высокой, чем в отношении рецептора sstr5 [Savenau et al., J. Clin. Endocrinol. Metab., 2001, 86, 140-145].
Таким образом, все еще существует необходимость в поиске новых синтетических аналогов соматостатина для лечения тех патологий, при которых экспрессируются соматостатиновые рецепторы sstr1, sstr2, sstr3, sstr4 или sstr5, причем таких аналогов, которые имеют более высокую стабильность в крови, чем соматостатин.
Новые аналоги соматостатина должны иметь более широкий профиль взаимодействия с соматостатиновыми рецепторами и, если возможно, универсальный профиль взаимодействия с пятью рецепторами sstr1-sstr5, или по меньшей мере специфичный в отношении тех рецепторов, с которыми аналоги, уже известные в данной области, не взаимодействуют, таких как рецепторы sstr1, sstr4 и sstr3.
Описание изобретения
Согласно настоящему изобретению предложено решение вышеупомянутых проблем. Неожиданно было обнаружено, что некоторые модификации с неприродными или дериватизированными аминокислотами улучшают избирательность или сохраняют профиль универсального взаимодействия с рецепторами sstr1, sstr2, sstr3, sstr4 и sstr5. В частности, было обнаружено, что замена фенилаланина в исходной последовательности ароматическими аминокислотами с алкильными заместителями, дериватизация аминогруппы боковой цепи лизина, замена цистеинов аллилглицинами или замена триптофана хинолилаланином приводят к получению пептидов с одной или несколькими этими модификациями, имеющих стабильность в сыворотке крови, желудочном соке и кишечной среде более высокую, чем стабильность соматостатина, и взаимодействующих с пятью рецепторами sstr1-sstr5 или комбинациями нескольких из этих рецепторов. Пептиды по настоящему изобретению также полезны для лечения, предупреждения и/или диагностики тех состояний, расстройств и/или патологий, при которых экспрессируются соматостатиновые рецепторы sstr1-sstr5.
Определения
Значения некоторых терминов и выражений, которые использованы в тексте описания данного изобретения, приведены в целях лучшего понимания настоящего изобретения.
В описании настоящего изобретения сокращения, использованные для аминокислот, подчиняются правилам Объединенной комиссии по биохимической номенклатуре Международного союза теоретической и прикладной химии и Международного биохимического союза (IUPAC-IUB Joint Commission on Biochemical Nomenclature), изложенным в Eur. J. Biochem., 1984, 138:9-37, и в J. Biol. Chem., 1989, 264:633-673. Так, например, "Gly" означает NH2-CH2-COOH, "Gly-" означает NH2-CH2-CO-, "-Gly" означает -NH-CH2-COOH, и "-Gly-" означает -NH-CH2-CO-. Таким образом, черточка, которая изображает пептидную связь, исключает ОН из 1-карбоксильной группы аминокислоты (представленной здесь в традиционной неионизированной форме), когда она расположена справа от символа, и исключает Н из 2-аминогруппы аминокислоты, когда она расположена слева от символа; обе модификации могут применяться к одному и тому же символу.
Термин "нециклическая алифатическая группа", используемый в настоящем изобретении, охватывает линейные или разветвленные алкильные, алкенильные и алкинильные группы.
Термин "алкильная группа" относится к линейной или разветвленной насыщенной группе, имеющей от 1 до 24, предпочтительно от 1 до 16, более предпочтительно от 1 до 14, еще более предпочтительно от 1 до 12, еще более предпочтительно 1, 2, 3, 4, 5 или 6 атомов углерода, которая связана с остатком молекулы посредством одинарной связи, включая, без ограничения, метил, этил, изопропил, изобутил, трет-бутил, гептил, октил, децил, додецил, лаурил, гексадецил, октадецил, амил, 2-этилгексил, 2-метилбутил, 5-метилгексил и т.п.
Термин "алкенильная группа" относится к линейной или разветвленной насыщенной группе, имеющей от 2 и 24, предпочтительно от 2 до 16, более предпочтительно от 2 до 14, еще более предпочтительно от 2 до 12, еще более предпочтительно 2, 3, 4, 5 или 6 атомов углерода, с одной или более двойными углерод-углеродными связями, которая связана с остатком молекулы посредством одинарной связи, включая, без ограничения, винильную (-СН2=СН2), аллильную (-СН2-СН=СН2), олеильную, линолеильную группу и т.п.
Термин "алкинильная группа" относится к линейной или разветвленной насыщенной группе, имеющей от 2 и 24, предпочтительно от 2 до 16, более предпочтительно от 2 до 14, еще более предпочтительно от 2 до 12, еще более предпочтительно 2, 3, 4, 5 или 6 атомов углерода, с одной или более тройными углерод-углеродными связями, предпочтительно 1, 2 или 3 сопряженными или несопряженными тройными углерод-углеродными связями, которая связана с остатком молекулы посредством одинарной связи, включая, без ограничения, этинильную группу, 1-пропинильную группу, 2-пропинильную группу, 1-бутинильную группу, 2-бутинильную группу, 3-бутинильную группу, пентинильную группу, например 1-пентинильную группу, и т.п. Алкинильные группы могут также содержать одну или более двойных углерод-углеродных связей, включая, без ограничения, бут-1-ен-3-инильную, пент-4-ен-1-инильную группу и т.п.
Термин "алициклическая группа", используемый в настоящем изобретении, охватывает, без ограничения, циклоалкильные, или циклоалкенильные, или циклоалкинильные группы.
Термин "циклоалкил" относится к насыщенной моно- или полициклической алифатической группе, имеющей от 3 до 24, предпочтительно от 3 до 16, более предпочтительно от 3 до 14, еще более предпочтительно от 3 до 12, еще более предпочтительно 3, 4, 5 или 6 атомов углерода, которая связана с остатком молекулы посредством одинарной связи, включая, без ограничения, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, метилциклогексил, диметилциклогексил, октагидроинден, декагидронафталин, додекагидронафталин и т.п.
Термин "циклоалкенил" относится к неароматической моно- или полициклической алифатической группе, имеющей от 5 до 24, предпочтительно от 5 до 16, более предпочтительно от 5 до 14, еще более предпочтительно от 5 до 12, еще более предпочтительно 5 или 6 атомов углерода, с одной или более двойными углерод-углеродными связями, предпочтительно 1, 2 или 3 сопряженными или несопряженными двойными углерод-углеродными связями, которая связана с остатком молекулы посредством одинарной связи, включая, без ограничения, циклопент-1-ен-1-ильную группу и т.п.
Термин "циклоалкинил" относится к неароматической моно- или полициклической алифатической группе, имеющей от 8 до 24, предпочтительно от 8 до 16, более предпочтительно от 8 до 14, еще более предпочтительно от 8 до 12, еще более предпочтительно 8 или 9 атомов углерода, с одной или более тройными углерод-углеродными связями, предпочтительно 1, 2 или 3 сопряженными или несопряженными углерод-углеродными тройными связями, которая связана с остатком молекулы посредством одинарной связи, включая, без ограничения, циклоокт-2-ен-1-ильную группу и т.п. Циклоалкинильные группы могут также содержать одну или более двойных углерод-углеродных связей, включая, без ограничения, циклоокт-4-ин-2-инильную группу и т.п.
Термин "арильная группа" относится к ароматической группе, имеющей от 6 до 30, предпочтительно от 6 до 18, более предпочтительно от 6 до 10, еще более предпочтительно 6 или 10 атомов углерода, содержащей 1, 2, 3 или 4 ароматических кольца, связанных посредством углерод-углеродной связи или конденсированных, включая, без ограничения, фенил, нафтил, дифенил, инденил, фенантрил или антранил, среди прочих; или к аралкильной группе.
Термин "аралкильная группа" относится к алкильной группе, замещенной ароматической группой, имеющей от 7 до 24 атомов углерода, включая, без ограничения, -(СН2)1-6-фенил, -(CH2)1-6-(1-нафтил), -(СН2)1-6-(2-нафтил), -(СН2)1-6-СН(фенил)2 и т.п.
Термин "гетероциклильная группа" относится к углеводородному кольцу, имеющему 3-10 элементов, в котором один или более атомов кольца, предпочтительно 1, 2 или 3 атомов кольца, являются элементами, иными, чем атом углерода, такими как, например, атом азота, атом кислорода или атом серы, и которое может быть насыщенным или ненасыщенным. В целях данного изобретения гетероцикл может представлять собой циклическую, моноциклическую, бициклическую или трициклическую систему, которая может включать конденсированные кольцевые системы; и в гетероциклильном радикале атомы азота, углерода или серы возможно могут быть окисленными; атом азота возможно может быть кватернизированным; и гетероциклильный радикал может быть частично или полностью насыщенным или может быть ароматическим. Более предпочтительно, термин "гетероциклический" относится к кольцу, имеющему 5 или 6 элементов. Примерами насыщенных гетероциклильных групп являются диоксан, пиперидин, пиперазин, пирролидин, морфолин и тиоморфолин. Примерами ароматических гетероциклильных групп, также известных как гетероароматические группы, являются пиридин, пиррол, фуран, тиофен, бензофуран, имидазолин, хинолеин, хинолин, пиридазин и нафтиридин.
Термин "гетероарилалкильная группа" относится к алкильной группе, которая замещена замещенной или незамещенной ароматической гетероциклильной группой, причем алкильная группа имеет от 1 до 6 атомов углерода, и ароматическая гетероциклильная группа имеет от 2 до 24 атомов углерода и от 1 до 3 атомов, иных, чем атом углерода, включая, без ограничения, -(СН2)1-6-имидазолил, -(СН2)1-6-триазолил, -(СН2)1-6-тиенил, -(CH2)1-6-фурил, -(СН2)1-6-пирролидинил и т.п.
Как известно в этой области техники, в охарактеризованных выше группах может иметь место определенная степень замещения. Таким образом, замещение может иметь место в группах по настоящему изобретению, где это в прямой форме указано. В данном описании ссылки на замещенные группы в группах по настоящему изобретению указывают на то, что указанный радикал может быть замещен в одном или более доступных положениях одним или более заместителями, предпочтительно в положениях 1, 2 или 3, более предпочтительно в положениях 1 или 2, еще более предпочтительно в положении 1. Указанные заместители включают, без ограничения, С1-C4алкил, гидроксил, С1-С4алкокси, амино, С1-С4аминоалкил, С1-С4карбонилокси, C1-С4оксикарбонил, галоген, такой как фтор, хлор, бром и йод, циано, нитро, азидо, С1-С4алкилсульфонил, тиол, С1-С4алкилтио, арилокси, например фенокси, -NRb(C=NRb)NRbRc, где Rb и Rc независимо выбраны из группы, состоящей из Н, С1-С4алкила, С2-C4алкенила, С2-С4алкинила, С3-С-10циклоалкила, С6-С18арила, С7-С17аралкила, гетероциклила, имеющего 3-10 элементов, или защитной группы аминогруппы.
Соединения по изобретению
Соединения по изобретению представляют собой соединения общей формулы (I)
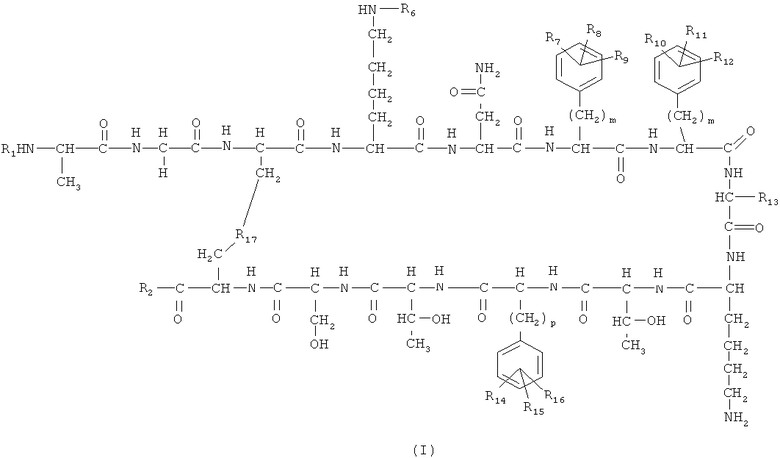
их стереоизомеры, их смеси и/или их фармацевтически приемлемые соли, где:
R1 выбран из группы, состоящей из Н, замещенной или незамещенной нециклической алифатической группы, замещенной или незамещенной алициклической группы, замещенной или незамещенной гетероциклильной группы, замещенной или незамещенной гетероарилалкильной группы, замещенной или незамещенной арильной группы, замещенной или незамещенной аралкильной группы, полиэтиленгликолевого полимера, хелатирующего агента и R5-CO-;
R2 выбран из группы, состоящей из -NR3R4, -OR3 и -SR3;
R6 выбран из группы, состоящей из Н, ацетила, трифторацетила, изопропила, пальмитоила, аллилоксикарбонила, 2-хлорбензила, формила, группы N-[1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)этил] и бензилоксикарбонила;
R7, R8, R9, R10, R11, R12, R14, R15 и R16 независимо друг от друга выбраны из группы, состоящей из Н и нециклической алифатической группы;
m означает целое число, выбранное из 0-6 при условии, что когда R7, R8 и R9 представляют Н, тогда m является иным, чем 0;
n означает целое число, выбранное из 0-6 при условии, что когда R10, R11 и R12 представляют собой Н, тогда n является иным, чем 0;
р означает целое число, выбранное из 0-6 при условии, что когда R14, R15 и R16 представляют собой Н, тогда р является иным, чем 0;
R13 выбран из группы, состоящей из L-(3-хинолил)метила, D-(3-хинолил)метила, L-(3-индолил)метила и D-(3-индолил)метила;
R17 выбран из группы, состоящей из -SS-, -СН2-СН2- и -СН=СН-;
R3 и R4 независимо выбраны из группы, состоящей из Н, замещенной или незамещенной нециклической алифатической группы, замещенной или незамещенной алициклической группы, замещенной или незамещенной гетероциклильной группы, замещенной или незамещенной гетероарилалкильной группы, замещенной или незамещенной арильной группы, замещенной или незамещенной аралкильной группы и полимера;
R5 выбран из группы, состоящей из Н, замещенной или незамещенной нециклической алифатической группы, замещенной или незамещенной алициклической группы, замещенной или незамещенной арильной группы, замещенной или незамещенной аралкильной группы, замещенной или незамещенной гетероциклильной группы и замещенной или незамещенной гетероарилалкильной группы;
при условии, что когда R6, R7, R8, R9, R10, R11, R12, R14, R15 и R16 все представляют собой Н, n, m и р равны 1 и R13 представляет собой L-(3-индолил)метил или D-(3-индолил)метил, тогда R17 не представляет собой -S-S-.
Группы R1 и R2 связаны с соответственно амино-концевой (N-концевой) и карбокси-концевой (С-концевой) группами пептидных последовательностей.
Согласно предпочтительному воплощению настоящего изобретения R1 выбран из группы, состоящей из Н, полимера общей формулы (II)
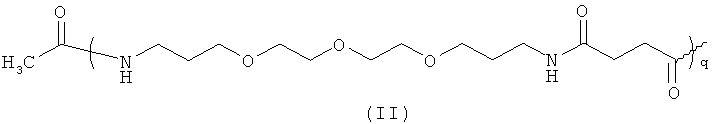
где q находится в пределах от 1 до 5, и R5-CO-, где Rs выбран из группы, состоящей из замещенного или незамещенного С1-С24алкильного радикала, замещенного или незамещенного С2-С24алкенильного радикала, замещенного или незамещенного С2-С24алкинильного радикала, замещенного или незамещенного С3-С24циклоалкильного радикала, замещенного или незамещенного С5-С24циклоалкенильного радикала, замещенного или незамещенного С8-С24цикпоалкинильного радикала, замещенного или незамещенного С6-С30арильного радикала, замещенного или незамещенного С7-С24аралкильного радикала, замещенного или незамещенного гетероциклильного радикала, имеющего 3-10 элементов в кольце, замещенного или незамещенного гетероарилалкильного радикала, имеющего от 2 до 24 атомов углерода и имеющего от 1 до 3 атомов, иных, чем атом углерода, где алкильная цепь состоит из от 1 до 6 атомов углерода. Более предпочтительно, R1 выбран из Н, ацетила, трет-бутаноила, гексаноила, 2-метилгексаноила, циклогексанкарбоксила, октаноила, деканоила, лауроила, миристоила, пальмитоила, стеароила, бегенила, олеоила и линолеоила. Еще более предпочтительно, R1 представляет собой Н, ацетил, гексаноил, октаноил, лауроил, миристоил или пальмитоил.
Согласно другому предпочтительному воплощению R1 представляет собой хелатирующий агент, возможно образующий комплекс с детектируемым элементом или радиотерапевтическим элементом. Под хелатирующим агентом имеется в виду группа, способная образовывать координационные комплексы с детектируемым элементом или радиотерапевтическим элементом. Предпочтительно, хелатирующий агент представляет собой группу, способную образовывать комплексы с ионами металлов, более предпочтительно группу, выбранную из группы, состоящей из DOTA (1,4,7,10-тетраазациклододекантетрауксусная кислота), DTPA (диэтилентриаминопентауксусная кислота), ТЕТА (триэтилентетрамин) или их производных. Хелатирующий агент может быть связан напрямую или через линкер.
Под детектируемым элементом подразумевается любой элемент, предпочтительно ион металла, отображающий детектируемое свойство in vivo диагностическим методом. Под радиотерапевтическим элементом подразумевается любой элемент, испускающий α-излучение, β-излучение или γ-излучение.
Согласно еще одному предпочтительному воплощению R2 представляет собой -NR3R4, -OR3 или -SR3, где R3 и R4 независимо выбраны из группы, состоящей из Н, замещенного или незамещенного С1-С24алкила; замещенного или незамещенного С2-С24алкенила, замещенного или незамещенного С2-С24алкинила, замещенного или незамещенного С3-С24циклоалкила, замещенного или незамещенного С5-С24циклоалкенила, замещенного или незамещенного С7-С24циклоалкинила, замещенного или незамещенного С6-С30арила, замещенного или незамещенного С7-С24аралкила, замещенного или незамещенного гетероциклила, имеющего 3-10 элементов в кольце, и замещенной или незамещенной гетероарилалкильной группы, имеющей от 2 до 24 атомов углерода и имеющей от 1 до 3 атомов, иных, чем атом углерода, где алкильная цепь состоит из от 1 до 6 атомов углерода, и полимера общей формулы (II), где q находится в пределах от 1 до 5. Возможно, R3 и R4 могут быть связаны посредством насыщенной или ненасыщенной углерод-углеродной связи, образуя цикл с атомом азота. Более предпочтительно, R2 представляет собой -NR3R4 или -OR3, где R3 и R4 независимо выбраны из группы, состоящей из Н, замещенного или незамещенного С1-С24алкила, замещенного или незамещенного С2-С24алкенила, замещенного или незамещенного С2-С24алкинила, замещенного или незамещенного С3-С10циклоалкила, замещенного или незамещенного С6-С15арила и замещенного или незамещенного гетероциклила из 3 до 10 элементов, замещенной или незамещенной гетероарилалкильной группы с кольцом, имеющим от 3 до 10 элементов, и алкильной цепью из от 1 до 6 атомов углерода и полимера общей формулы (II), где q находится в пределах от 1 до 5. Более предпочтительно, R3 и R4 выбраны из группы, состоящей из Н, метила, этила, гексила, додецила или гексадецила. Еще более предпочтительно, R3 представляет собой Н, и R4 выбран из группы, состоящей из Н, метила, этила, гексила, додецила или гексадецила. Согласно еще более предпочтительному воплощению R2 выбран из -ОН и -NH2.
Согласно еще одному предпочтительному воплощению R7, R8 и R9 одинаковые и находятся в орто-, пара-, ортоконфигурации или мета-, пара-, метаконфигурации, R10, R11 и R12 одинаковые и находятся в орто-, пара-, ортоконфигурации или мета-, пара-, метаконфигурации, и R14, R15 и R16 одинаковые и находятся в орто-, пара-, ортоконфигурации или мета-, пара-, метаконфигурации. Более предпочтительно, R7, R8, R9, R10, R11, R12, R14, R15 и R16 выбраны из группы, состоящей из Н и С1-С24алкила. Еще более предпочтительно, они выбраны из группы, состоящей из Н и С1-С6алкила, и, еще более предпочтительно, они выбраны из группы, состоящей из Н, метила и этила.
Согласно другому воплощению настоящего изобретения R1 выбран из группы, состоящей из Н, ацетила, лауроила, миристоила, пальмитоила или полимера общей формулы (II), где q находится в пределах от 1 до 5, R2 представляет собой -NR3R4 или -OR3, где R3 и R4 независимо выбраны из Н, метила, этила, гексила, додецила и гексадецила, R6 представляет собой Н, R7, R8 и R9 представляют собой метил и находятся в орто-, пара-, ортоконфигурации или мета-, пара-, метаконфигурации, m равно 0 или 1, R10, R11, R12, R14, R15 и R16 представляют собой Н, n и р равны 1, R13 выбран из группы, состоящей из L-(3-индолил)метила и D-(3-индолил)метила, и R17 представляет собой -S-S-.
Согласно другому воплощению настоящего изобретения R1 выбран из группы, состоящей из Н, ацетила, лауроила, миристоила, пальмитоила или полимера общей формулы (II), где q находится в пределах от 1 до 5, R2 представляет собой -NR3R4 или -OR3, где R3 и R4 независимо выбраны из Н, метила, этила, гексила, додецила и гексадецила, R6 представляет собой Н, R10, R11 и R12 представляют собой метил и находятся в орто-, пара-, ортоконфигурации или мета-, пара-, метаконфигурации, n равно 0 или 1, R7, R8, R9, R14, R15 и R16 представляют собой Н, m и р равны 1, R13 выбран из группы, состоящей из L-(3-индолил)метила и D-(3-индолил)метила, и R17 представляет собой -S-S-.
Согласно другому воплощению настоящего изобретения R1 выбран из группы, состоящей из Н, ацетила, лауроила, миристоила, пальмитоила или полимера общей формулы (II), где q находится в пределах от 1 до 5, R2 представляет собой -NR3R4 или -OR3, где R3 и R4 независимо выбраны из Н, метила, этила, гексила, додецила и гексадецила, R6 представляет собой Н, R14, R15 и R16 представляют собой метил и находятся в орто-, пара-, ортоконфигурации или мета-, пара, метаконфигурации, р равно 0 или 1, R7, R8, R9, R10, R11 и R12 представляют собой Н, m и n равны 1, R13 выбран из группы, состоящей из L-(3-индолил)метила и D-(3-индолил)метила, и R17 представляет собой -S-S-.
Согласно другому воплощению настоящего изобретения R1 выбран из группы, состоящей из Н, ацетила, лауроила, миристоила, пальмитоила или полимера общей формулы (II), где q находится в пределах от 1 до 5, R2 представляет собой -NR3R4 или -OR3, где R3 и R4 независимо выбраны из Н, метила, этила, гексила, додецила и гексадецила, R6 представляет собой Н, R7, R8, R9, R10, R11 и R12 представляют собой метил и находятся в орто-, пара-, ортоконфигурации или мета-, пара-, метаконфигурации, m и p равны 0 или 1, R14, R15 и R16 представляют собой Н, р равно 1, R13 выбран из группы, состоящей из L-(3-индолил)метила и D-(3-индолил)метила, и R17 представляет собой -S-S-.
Согласно другому воплощению настоящего изобретения R1 выбран из группы, состоящей из Н, ацетила, лауроила, миристоила, пальмитоила или полимера общей формулы (II), где q находится в пределах от 1 до 5, R2 представляет собой -NR3R4 или -OR3, где R3 и R4 независимо выбраны из Н, метила, этила, гексила, додецила и гексадецила, R6 представляет собой Н, R7, R8, R9, R14, R15 и R16 представляют собой метил и находятся в орто-, пара-, ортоконфигурации или мета-, пара-, метаконфигурации, m и р равны 0 или 1, R10, R11 и R12 представляют собой Н, n равно 1, R13 выбран из группы, состоящей из L-(3-индолил)метила и D-(3-индолил)метила, и R17 представляет собой -S-S-.
Согласно другому воплощению настоящего изобретения R1 выбран из группы, состоящей из Н, ацетила, лауроила, миристоила, пальмитоила или полимера общей формулы (II), где q находится в пределах от 1 до 5, R2 представляет собой -NR3R4 или -OR3, где R3 и R4 независимо выбраны из Н, метила, этила, гексила, додецила и гексадецила, R6 представляет собой Н, R10, R11, R12, R14, R15 и R16 представляют собой метил и находятся в орто-, пара-, ортоконфигурации или мета-, пара-, метаконфигурации, n и p равны 0 или 1, R7, R8 и R9 представляют собой Н, m равно 1, R13 выбран из группы, состоящей из L-(3-индолил)метила и D-(3-индолил)метила, и R17 представляет собой -S-S-.
Согласно другому воплощению настоящего изобретения R1 выбран из группы, состоящей из Н, ацетила, лауроила, миристоила, пальмитоила или полимера общей формулы (II), where q находится в пределах от 1 до 5, R2 представляет собой -NR3R4 или -OR3, где R3 и R4 независимо выбраны из Н, метила, этила, гексила, додецила и гексадецила, R6 выбран из группы, состоящей из ацетила, пальмитоила, трифторацетила, изопропила, аллилоксикарбонила, 2-хлорбензила, группы N-[1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)этил], R7, R8, R9, R10, R11, R12, R14, R15 и R16 представляют собой H, m, n и р равны 1, R13 выбран из группы, состоящей из L-(3-индолил)метила и D-(3-индолил)метила, и R17 представляет собой -S-S-.
Согласно другому воплощению настоящего изобретения R1 выбран из группы, состоящей из H, ацетила, лауроила, миристоила, пальмитоила или полимера общей формулы (II), где q находится в пределах от 1 до 5, R2 представляет собой -NR3R4 или -OR3, где R3 и R4 независимо выбраны из H, метила, этила, гексила, додецила и гексадецила, R6 представляет собой H, R7, R8, R9, R10, R11, R12, R14, R15 и R16 представляют собой H, m, n и р равны 1, R13 выбран из группы, состоящей из L-(3-хинолил)метила и D-(3-хинолил)метила, и R17 представляет собой -S-S-.
Согласно другому воплощению настоящего изобретения R1 выбран из группы, состоящей из H, ацетила, лауроила, миристоила, пальмитоила или полимера общей формулы (II), где q находится в пределах от 1 до 5, R2 представляет собой -NR3R4 или -OR3, где R3 и R4 независимо выбраны из H, метила, этила, гексила, додецила и гексадецила, R6 представляет собой H, R7, R8, R9, R10, R11, R12, R14, R15 и R16 представляют собой H, m, n и р равны 1, R13 выбран из группы, состоящей из L-(3-индолил)метила и D-(3-индолил)метила, и R17 представляет собой -СН=СН-.
Соединения по настоящему изобретению могут существовать в виде стереоизомеров или смесей стереоизомеров. Например, аминокислоты, образующие соединения по изобретению, могут иметь L-, D-конфигурацию или могут быть рацемическими независимо друг от друга. Следовательно, существует возможность получения изомерных смесей, а также рацемических смесей или диастереомерных смесей, или чистых диастереомеров или энантиомеров, в зависимости от числа асимметрических атомов углерода, по которым существуют изомеры или изомерные смеси. Предпочтительными структурами соединений по изобретению являются чистые изомеры, т.е. единственный энантиомер или диастереомер.
Например, если не указано иное, имеется в виду, что аминокислота представляет собой L- или D-изомер или рацемические или нерацемические смеси их обоих. Способы получения, описанные в настоящем документе, дают возможность специалисту в данной области техники получать каждый из стереоизомеров соединения по изобретению, выбирая аминокислоту с подходящей конфигурацией.
Фармацевтически приемлемые соли соединений по настоящему изобретению также входят в его объем. Термин "фармацевтически приемлемые соли" означает соль, которая разрешена для применения у животных и, более конкретно, у людей, и этот термин охватывает соли, образованные в результате присоединения оснований, неорганических оснований, например, без ограничения, литиевую, натриевую, калиевую, кальциевую, магниевую, марганцевую, медную, цинковую или алюминиевую соль, помимо прочих, или органических оснований, например, без ограничения, соли присоединения этиламина, диэтиламина, этилендиамина, этаноламина, диэтаноламина, аргинина, лизина, гистидина или пиперазина, помимо прочих, или соли присоединения кислот, органических кислот, например, без ограничения, ацетат, цитрат, лактат, малонат, малеат, тартрат, фумарат, бензоат, аспартат, глутамат, сукцинат, олеат, трифторацетат, оксалат, памоат или глюконат, помимо прочих, или неорганических кислот, например, без ограничения, хлорид, сульфат, борат или карбонат, помимо прочих. Природа соли не имеет значения при условии, что она является фармацевтически приемлемой. Фармацевтически приемлемые соли пептидов по изобретению могут быть получены общепринятыми способами, известными в данной области техники [Berge S.M. et al., J. Pharm. Sci. 1977, 66, 1-19].
В другом аспекте настоящее изобретение относится к соединению общей формулы (I), его стереоизомерам, их смесям и/или их фармацевтически приемлемым солям, описанным в настоящем изобретении, для лечения, предупреждения и/или диагностики тех состояний, расстройств и/или патологий, при которых экспрессируются соматостатиновые рецепторы sstr1, sstr2, sstr3, sstr4 и/или sstr5.
В более конкретном аспекте настоящее изобретение относится к соединению общей формулы (I), его стереоизомерам, их смесям и/или их фармацевтически приемлемым солям, описанным в настоящем изобретении, для лечения, предупреждения и/или диагностики состояний, расстройств и/или патологий, выбранных из группы, состоящей из акромегалии, симптоматического лечения гастроэнтеропанкреатических нейроэндокринных опухолей, диареи, рака, опухолей, нейродегенеративных заболеваний, глазных заболеваний, патологий иммунной системы, воспаления, инфекций, варикозного расширения вен пищевода, боли, заживления ран, регенерации ткани, хронического панкреатита, гипертрофической легочной остеоартропатии и тиреотрофической аденомы.
В более конкретном аспекте настоящее изобретение относится к соединению общей формулы (I), его стереоизомерам, их смесям и/или их фармацевтически приемлемым солям, как они описаны в настоящем изобретении, для лечения, предупреждения и/или диагностики состояний, расстройств и/или патологий, выбранных из группы, состоящей из акромегалии, симптоматического лечения гастроэнтеропанкреатических нейроэндокринных опухолей, диареи 3-4 степени, диареи, связанной с радиотерапевтическим и/или химиотерапевтическим лечением, симптоматического лечения карциноидного синдрома или ВИПом, эндокринного рака, рака поджелудочной железы, колоректального рака, рака молочной железы, рака яичника, рака предстательной железы, рака щитовидной железы, рака легкого, рака желудка, печеночно-клеточного рака, болезни Альцгеймера, артрита, аллергий, красной волчанки, лимфопролиферативного расстройства, диабетической ретинопатии, отека желтого пятна, офтальмопатии Грейвса, синдрома Кушинга, невропатической боли, рестеноза, ангиогенеза, гипертиреоидизма, гипотиреоидизма, гиперинсулинемии, псориаза, гиперкальциемии, болезни Педжета, кахексии и синдрома Золлингера-Эллисона.
В более конкретном аспекте лечение, предупреждение и/или диагностику соединениями по настоящему изобретению осуществляют посредством местного или системного введения, например, без ограничения, местным, пероральным или парентеральным путем. В контексте настоящего изобретения термин "парентеральный" охватывает назальный, ушной, офтальмический, вагинальный, ректальный пути введения, подкожные, интрадермальные, внутрисосудистые инъекции, например внутривенные, внутримышечные инъекции, инъекции в стекловидное тело, интраспинальные, интракраниальные, интраартикулярные, интратекальные и интраперитонеальные инъекции, а также любые иные инъекционные или инфузионные способы.
Способы получения
Соединения по изобретению, их стереоизомеры или их фармацевтически приемлемые соли могут быть синтезированы общепринятыми способами, известными в данной области техники. В одном из воплощений настоящего изобретения соединения синтезируют способами, осуществляемыми в растворе, или твердофазными способами синтеза.
Способы твердофазного синтеза описаны, например, в Stewart J.M. and Young J.D., 1984, "Solid Phase Peptide Synthesis, 2nd edition", Pierce Chemical Company, Rockford, Illinois; Bodanzsky M., and BodanzskyA., 1984 "The practice of Peptide Synthesis", Springer Verlag, New Cork; Lloyd-Williams P., Albericio F. and Giralt E. (1997) "Chemical Approaches to the Synthesis of Peptides and Proteins", CRC, Boca Raton, FL, USA. Способы синтеза в растворе и комбинации способов синтеза в растворе и твердофазных способов синтеза или ферментативного синтеза описаны в Kullmann W. et al., J. Biol. Chem., 1980, 255, 8234-8238.
В одном из воплощений настоящего изобретения соединения формулы (I) получают способом, включающим следующие стадии:
1) твердофазный синтез;
2) отщепление пептида от полимерной подложки;
3) циклизация пептида в растворе;
4) если необходимо, удаление защитных групп, предпочтительно с использованием трифторуксусной кислоты;
или, альтернативно,
1) твердофазный синтез;
2) твердофазная циклизация;
3) отщепление пептида от полимерной подложки и одновременно удаление защитных групп, предпочтительно путем обработки трифторуксусной кислотой.
Предпочтительно, С-концевую группу связывают с твердой подложкой, и способ осуществляют в твердой фазе, и, таким образом, данный способ включает реакцию сочетания аминокислоты, имеющей защищенную N-концевую группу и свободную С-концевую группу с аминокислотой, имеющей свободную N-концевую группу и С-концевую группу, связанную с полимерной подложкой; удаление защитной группы с N-концевой группы; и повторение этой последовательности столько раз, сколько необходимо для получения тетрадекапептида, с последующим конечным отщеплением синтезированного пептида от исходной полимерной подложки.
Функциональные группы боковых цепей аминокислот сохраняют защищенными подходящими временными или постоянными защитными группами на протяжении всего синтеза, и защитные группы могут быть удалены одновременно с процессом отщепления пептида от полимерной подложки или независимо от процесса отщепления пептида от полимерной подложки.
Альтернативно, твердофазный синтез может быть осуществлен с помощью конвергентной стратегии путем присоединения пептидного фрагмента к полимерной подложке или к пептидному фрагменту, ранее связанному с полимерной подложкой. Стратегии конвергентного синтеза известны в данной области и описаны в Lloyd-Williams P. et al., Tetrahedron 1993, 49, 11065-11133.
Данный способ может включать дополнительные стадии удаления защитных групп с N-концевых и С-концевых групп и/или отщепления пептида от полимерной подложки в неопределенном порядке, используя стандартные способы и условия, известные в данной области техники, после чего указанные концевые функциональные группы могут быть модифицированы. Возможная модификация N-концевых и С-концевых групп может быть осуществлена пептидом формулы (I), заякоренным на полимерной подложке, или сразу после отщепления от полимерной подложки.
Возможно, R1 может быть введен посредством взаимодействия N-концевой группы пептида по изобретению с соединением R1-Z, где R1 имеет значение, описанное выше, и Z представляет собой уходящую группу, такую как, без ограничения, тозильная группа, мезильная группа и галогеновые группы, помимо прочих; посредством реакции нуклеофильного замещения в присутствии подходящего основания и растворителя, и где указанные фрагменты имеют функциональные группы, которые не принимают участия в образовании связи N-C, защищенные подходящими временными или постоянными защитными группами. R1 может быть также введен посредством взаимодействия N-концевой группы соединения по изобретению с R5COOH или ее сложным эфиром, галогенангидридом или ангидридом.
Возможно и/или дополнительно, радикалы R2 могут быть введены посредством взаимодействия соединения HR2, где R2 представляет собой -OR3, -NR3R4 или -SR3, с комплементарным фрагментом, соответствующим пептиду формулы (I), где R2 представляет собой -ОН, в присутствии подходящего растворителя и основания, такого как, например, N,N-диизопропилэтиламин (DIEA) или триэтиламин, или добавки, такой как, например, 1-гидроксибензотриазол (HOBt) или 1-гидроксиазабензотриазол (HOAt), и дегиратирующего агента, такого как, например, карбодиимид, урониевая соль, фосфониевая соль или амидиниевая соль, помимо прочих, с получением в результате пептида по изобретению общей формулы (I), где указанные фрагменты имеют функциональные группы, которые не принимают участия в образовании связи N-C, O-С или S-C, защищенные подходящими временными или постоянными защитными группами, или, альтернативно, другие радикалы R2 могут быть введены одновременно с процессом отщепления пептида от полимерной подложки.
Специалисту в данной области техники понятно, что стадии удаления защитных групп/отщепления С-концевых и N-концевых групп и последующей их дериватизации могут быть осуществлены в любом порядке способами, известными в данной области [Smith М.В. and March J., 1999 "March's Advanced Organic Chemistry Reactions, Mechanisms and Structure", 5th Edition, John Wiley & Sons, 2001].
Термин "защитная группа" относится к группе, которая блокирует органическую функциональную группу и которая может быть удалена в контролируемых условиях. Защитные группы, их относительная реакционная способность и условия, при которых они остаются инертными, известны специалисту в данной области техники.
Примерами репрезентативных защитных групп для аминогруппы являются амидные группы, такие как ацетамидная, бензоатамидная, пивалатамидная группа, карбаматные группы, такие как бензилоксикарбонил (Cbz или Z), 2-хлорбензил (CIZ), пара-нитробензилоксикарбонил (pNZ), трет-бутилоксикарбонил (Boc), 2,2,2-трихлорэтоксикарбонил (Troc), 2-(триметилсилил)этоксикарбонил (Теос), 9-флуоренилметоксикарбонил (Fmoc) или аллилоксикарбонил (Aiioc), тритил (Trt), метокситритил (Mtt), 2,4-динитрофенил (Dnp), N-[1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)этил] (Dde), 1-(4,4-диметил-2,6-диоксо-циклогексилиден)-3-метил-бутил (ivDde), 1-(1-адамантил)-1-метилэтокси-карбонил (Adpoc), помимо прочих; предпочтительно, Вое или Fmoc.
Примерами репрезентативных защитных групп для карбоксильной группы являются сложноэфирные группы, такие как трет-бутилэфирная (tBu), аллилэфирная (All), трифенилметилэфирная (тритилэфирная, Trt), циклогексилэфирная (сНх), бензилэфирная (Bzl), ортонитробензилэфирная, паранитробензилэфирная, параметоксибензилэфирная, триметилсилилэтилэфирная, 2-фенилизопропилэфирная, флуоренилметилэфирная (Fm), 4-(N-[1-(4,4-диметил-2,6-диоксоциклогексилиден)-3-метилбутил]амино)бензилэфирная (Dmab) группа, помимо прочих. Предпочтительными защитными группами по изобретению являются сложноэфирные группы All, tBu, cHex, Bzl и Trt.
Трифункциональные аминокислоты могут быть защищены в процессе синтеза временными или постоянными защитными группами, не относящимися к защитным группам N-концевых и С-концевых групп.Описанные выше защитные группы, защищающие аминогруппу, используют для защиты аминогруппы боковой цепи лизина, боковая цепь триптофана может быть защищена описанной выше защитной группой, защищающей аминогруппу, или может быть незащищенной, боковую цепь серина и треонина защищают трет-бутилэфирной группой (tBu), боковую цепь цистеина защищают защитной группой, выбранной из группы, состоящей из тритила и ацетамидометила, и боковая цепь аспарагина может быть защищена защитной группой, выбранной из группы, состоящей из метокситритила, тритила и ксантила, или она может быть незащищенной. Предпочтительными защитными группами для трифункциональных аминокислот по изобретению являются tBu в боковых цепях серина и треонина, Вое в боковых цепях лизина, Trt в боковых цепях цистеина и Fmoc или Вое в качестве временной защитной группы N-концевой группы.
Примеры этих и других дополнительных защитных групп, их введение и их удаление описаны в литературе [Greene T.W. and Wuts P.G.M., (1999) "Protective groups in organic синтез" John Wiley & Sons, New York; Atherton B. and Sheppard R.C. (1989) "Solid Phase Peptide Synthesis: A practical approach" IRL Oxford University Press]. Термин "защитные группы" также охватывает полимерные подложки, используемые в твердофазном синтезе.
Когда синтез частично или полностью осуществляют в твердой фазе, могут быть использованы полистирольные подложки, подложки из полистирола с привитым полиэтиленгликолем и т.п., и в качестве твердофазных подложек в способе по изобретению могут быть использованы, без ограничения, смолы на основе параметилбензгидриламина (МВНА) [Matsueda G.R. et al., Peptides 1981, 2, 45-50], 2-хлортритильные смолы [Barlos К. et al., 1989 Tetrahedron Lett. 30:3943-3946; Barlos K. et al., 1989 Tetrahedron Lett. 30, 3947-3951], смолы TentaGel® (Rapp Poiymere GmbH), смолы ChemMatrix® (Matrix Innovation, Inc) и т.п., которые могут содержать или могут не содержать лабильный линкер, такой как 5-(4-аминометил-3,5-диметоксифенокси)валериановая кислота (PAL) [Aibericio F. et al., 1990, J. Org. Chem, 55, 3730-3743], 2-[4-аминометил-(2,4-диметоксифенил)]феноксиуксусная кислота (AM) [Rink H., 1987. Tetrahedron Lett. 28, 3787-3790], Wang [Wang S.S., 1973, J. Am. Chem. Soc. 95, 1328-1333] и т.п., который дает возможность отщеплять частично защищенный пептид и образовывать цикл в растворе со стадией удаления защитных групп в растворе или осуществлять твердофазную циклизацию и последующее удаление защитных групп и одновременное отщепление пептида.
Фармацевтические композиции
Соединения по изобретению можно вводить любыми способами, которые обеспечивают контакт соединения с сайтом его действия в организме млекопитающего, предпочтительно в организме человека, и в форме композиции, содержащей их.
В свете этого еще одним аспектом данного изобретение является фармацевтическая композиция, содержащая фармацевтически эффективное количество по меньшей мере одного соединения общей формулы (I), его стереоизомера, их смесей и/или их фармацевтически приемлемых солей и по меньшей мере один фармацевтически приемлемый эксципиент. Количество и природа фармацевтически приемлемых эксципиентов зависят от желаемой лекарственной формы. Фармацевтически приемлемые эксципиенты известны специалисту в данной области [Fauli i Trillo С. (1993) "Tratado de Farmacia Galenica", Luzan 5, S.A. Ediciones, Madrid]. Указанные композиции могут быть приготовлены общепринятыми способами, известными в уровне техники ["Remington: The Science and Practice of Pharmacy", 20th (2003) Genaro A.R., ed., Lippincott Williams & Wilkins, Philadelphia, US].
Фармацевтические композиции, содержащие соединения по изобретению, их стереоизомеры, их смеси- и/или их фармацевтически приемлемые соли, можно вводить любым подходящим путем, например местным, пероральным или парентеральным путем, и с этой целью они будут содержать фармацевтически приемлемые эксципиенты, необходимые для изготовления желаемой лекарственной формы.
Применения
В еще одном аспекте настоящее изобретение относится к применению соединения общей формулы (I), его стереоизомеров, их смесей и/или их фармацевтически приемлемых солей в приготовлении фармацевтической композиции для лечения, предупреждения и/или диагностики тех состояний, расстройств и/или патологий, при которых экспрессируются соматостатиновые рецепторы sstr1, sstr2, sstr3, sstr4 и/или sstr5.
В более конкретном аспекте настоящее изобретение относится к применению соединения общей формулы (I), его стереоизомеров, их смесей и/или их фармацевтически приемлемых солей в приготовлении фармацевтической композиции для лечения, предупреждения и/или диагностики состояний, расстройств и/или патологий, выбранных из группы, состоящей из акромегалии, симптоматического лечения гастроэнтеропанкреатических нейроэндокринных опухолей, диареи, рака, опухолей, нейродегенеративных заболеваний, глазных заболеваний, патологий иммунной системы, воспаления, инфекций, варикозного расширения вен пищевода, боли, заживления ран, регенерации ткани, хронического панкреатита, гипертрофической легочной остеоартропатии и тиреотрофической аденомы.
В более конкретном аспекте настоящее изобретение относится к применению соединения общей формулы (I), его стереоизомеров, их смесей и/или их фармацевтически приемлемых солей в приготовлении фармацевтической композиции для лечения, предупреждения и/или диагностики состояний, расстройств и/или патологий, выбранных из группы, состоящей из акромегалии, симптоматического лечения гастроэнтеропанкреатических нейроэндокринных опухолей, диареи 3-4 степени, диареи, связанной с радиотерапевтическим и/или химиотерапевтическим лечением, симптоматического лечения карциноидного синдрома или ВИПом, эндокринного рака, рака поджелудочной железы, колоректального рака, рака молочной железы, рака яичника, рака предстательной железы, рака щитовидной железы, рака легкого, рака желудка, печеночно-клеточного рака, болезни Альцгеймера, артрита, аллергий, красной волчанки, лимфопролиферативного расстройства, диабетической ретинопатии, отека желтого пятна, офтальмопатия Грейвса, синдрома Кушинга, невропатической боли, рестеноза, ангиогенеза, гипертиреоидизма, гипотиреоидизма, гиперинсулинемии, псориаза, гиперкальциемии, болезни Педжета, кахексии и синдрома Золлингера-Эллисона.
Определения
Сокращения, использованные в данном описании изобретения, имеют следующие значения:
Ac2O, уксусный ангидрид; АсОН, уксусная кислота; Adpoc, 1-(1-адамантил)-1-метилэтокси-карбонил; АН, аллил; Alloc, аллилоксикарбонил; Вое, трет-бутоксикарбонил; Bzl, бензил; Cbz, бензилоксикарбонил; сНх, циклогексил; CIZ, 2-хлорбензил; DCM, дихлорметан; Dde, N-[1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)этил]; DIEA, N,N'-диизопропилэтиламин; DIPCDI, диизопропилкарбодиимид; Dmab, 4-(N-[1-(4,4-диметил-2,6-диоксоциклогексилиден)-3-метилбутил]амино)бензил; DMF, N,N-диметилформамид; Dnp, 2,4-динитрофенил; DOTA, 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусная кислота; DTPA, диэтилентриаминпентауксусная кислота; ЭРИ-МС, масс-спектрометрия с электрораспылительной ионизацией; Fm, флуоренилметил; Fmoc, 9-флуоренилметоксикарбонил; HF, плавиковая кислота; НОВТ, N-гидроксибензотриазол; ВЭЖХ, высокоэффективная жидкостная хроматография; IC50, ингибирующая концентрация вещества, составляющая 50% от максимальной ингибирующей концентрации; ivDde, 1-(4,4-диметил-2,6-диоксоциклогексилиден)-3-метил-бутил; Ki, константа ингибирования лекарственного средства; М, молекулярная масса; Mtt, метокситритил; мкл, микролитр; мкмоль, микромоль; pNZ, паранитробензилоксикарбонил; ОФ-ВЭЖХ, обращеннофазная ВЭЖХ; SOM, соматостатин; tBu, трет-бутил; Теос, 2-(триметилсилил)этоксикарбонил; TFA, трифторуксусная кислота; TFE, 2,2,2-трифторэтанол; Tris, трис(гидроксиметил)аминометан; rt, время удерживания; Trt, тритил; Тгос, 2,2,2-трихлопентоксикарбонил; Z, бензилоксикарбонил; аминокислоты:
Ala (А): аланин
Asn (N): аспарагин
Cys(С): цистеин
Gly (G): глицин
Lys (К): лизин
Lys (Ac): (N-ацетил)лизин
Lys (Alloc): (N-аллилоксикарбонил)лизин
Lys (2-CI-Z): (N-2-хлорбензил)лизин
Lys (Dde): (N-1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)этил)лизин
Lys (For): (N-формил)лизин
Lys (изопропил): (N-изопропил)лизин
Lys (пальмитоил): (N-пальмитоил)лизин
Lys (Tfa): (N-трифторацетил)лизин
Lys (Z): (N-бензилоксикарбонил)лизин
Phe (F): фенилаланин
Ser (S): серин
Thr (Т): треонин
Trp (W): триптофан
Msa: 2,4,6-триметилфенилаланин или 3-мезитилаланин
Msg: 2,4,6-триметилфенилглицин или 2-мезитилглицин
Qla: 3-(3'-хинолил)аланин или β-(хинол-3-ил)-аланин
Примеры
Следующие далее конкретные примеры, приведенные в этом патентном документе, служат иллюстрацией сущности настоящего изобретения. Эти примеры включены в данный документ только в иллюстративных целях и не должны рассматриваться как ограничивающие заявленное изобретение.
Пример 1: Синтез соединения 1

Смолу помещали в реактор для синтеза, оснащенный фильтрующей пластиной и краном. С-концевой остаток вводили в 0,3 г 2-хлортритильной смолы (1,6 ммоль/г). Первую аминокислоту Fmoc-Cys(Trt)-OH (1 экв.) растворяли в 3 мл DCM и 0,15 мл DMF. Добавляли DIEA (3 экв.). Раствор с аминокислотой и основанием переносили в реактор и перемешивали в течение 45 мин. По истечении этого времени добавляли 0,24 мл МеОН, и смесь оставляли взаимодействовать в течение 10 мин. Фильтрат фильтровали и отбрасывали. Смолу промывали DCM и DMF. Фильтраты фильтровали и отбрасывали при каждой промывке. Для введения следующих аминокислот использовали 2,5 экв. Fmoc-аминокислоты, 2,5 экв. НОВТ и 2,5 экв. DIPCDI. Для осуществления реакции сочетания их оставляли взаимодействовать в течение 40-60 мин и введение аминокислоты контролировали тестированием с использованием нингидрина. Если тест с использованием нингидрина был положительным, то проводили стадию реактивации в течение 15-30 мин с 0,83 экв. НОВТ и 0,83 экв. DIPCDI. Если тест с использованием нингидрина продолжал быть положительным, то проводили повторную реакцию сочетания с 1,25 экв. Fmoc-аминокислоты, НОВТ и DIPCDI. Если тест с использованием нингидрина был отрицательным, то синтез продолжали со стадией удаления защитной группы Fmoc путем обработки 20%-ным раствором пиперидина в DMF дважды. Пепетидил-смолу промывали 5 раз DMF, отфильтровывали и фильтраты каждый раз отбрасывали, а затем вводили следующую аминокислоту. Получили 1,4 г пептидил-смолы.
1,4 г (0,43 ммоль) пептидил-смолы помещали в реактор. Добавляли 13,76 мл раствора AcOH:TFE:DCM при перемешивании с использованием магнитной мешалки и смесь оставляли взаимодействовать в течение 2 ч. Ее фильтровали в реактор с фильтровальной пластиной и фильтрат извлекали. Смолу промывали 3 раза 3,66 мл раствора AcOH:TFE:DCM, при этом фильтраты извлекали.
Готовили раствор 1,12 г (10 экв.) йода в 5,5 мл раствора AcOH:TFE:DCM. Фильтраты, извлеченные в процессе кислотного гидролиза, переносили в реактор, который содержал йодный раствор, и реакционную смесь перемешивали. Готовили раствор 2,34 г (22 экв.) тиосульфата натрия в 9,44 мл воды и добавляли его в реактор сразу после окончания окисления, при этом через 5 минут наблюдалось исчезновение окраски. Перемешивание останавливали и смесь оставляли расслаиваться до разделения фаз. Экстракцию проводили путем обработки водной фазы 3 раза DCM и органической фазы 3 раза смесью 5% лимонной кислоты:NaCl (об./масс.). Органические фракции упаривали, и остаток сушили в вакууме. Твердый остаток промывали водой на фильтровальной пластине. Получили 0,89 г окисленного и защищенного продукта.
18,94 мл реакционной смеси TFA:H2O:DCM:анизол (55:5:30:10) помещали в реактор. 0,88 г частично защищенного пептида добавляли к предыдущему раствору и полученную смесь оставляли взаимодействовать в течение 4 ч. Добавляли гептан (20,1 мл) и смесь перемешивали в течение 5 мин. Перемешивание останавливали и смесь оставляли расслаиваться. Водную фазу выливали на холодный эфир и оставляли стоять в течение 15-30 мин. Полученную суспензию фильтровали через фильтровальную пластину и фильтраты отбрасывали. Остаток промывали эфиром, отбрасывая фильтраты при каждой промывке. Твердое вещество подвергали сублимационной сушке с получением 0,63 г неочищенного продукта. Этот неочищенный продукт очищали в полупрепаративной системе, оснащенной колонкой NW50, упакованной диоксидом кремния Kromasil 10 микрон. Пептид суспендировали в 0,1 н. АсОН и добавляли смолу DOWEX, кондиционированную в 0,1 н. АсОН. Конечное ацетатное соединение выделяли фильтрованием и определяли его характеристики методом масс-спектрометрии на аппаратуре для ЭРИ-МС.
Характеристики:
ЭРИ-МС: Теоретическая М (масса)=1664,7 г/моль, экспериментальная М: (m/z): [М+2Н]+/2=833,8.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=14,08 мин; изократическое элюирование: 33% В за период времени 30 мин, rt=11,2 мин (В=0,07% TFA в ацетонитриле).
Пример 2: Синтез соединения 2

Данное соединение получали, как описано в Примере 1. Использовали 0,3 г смолы и 0,54 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1664,7 г/моль, экспериментальная М: (m/z): [M+2H]+/2=833,8.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=14,3 мин; изократическое элюирование: 33% В за период времени 30 мин, rt=12,5 мин (В=0,07% TFA в ацетонитриле).
Пример 3: Синтез соединения 3

Данное соединение получали, как описано в Примере 1. Использовали 0,3 г пептидил-смолы и 0,39 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1664,7 г/моль, экспериментальная М: (m/z): [М+2Н]+/2=834,4.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=12,42 мин; изократическое элюирование: 29,5% В за период времени 30 мин, rt=13,3 мин (В=0,07% TFA в ацетонитриле).
Пример 4: Синтез соединения

Данное соединение получали, как описано в Примере 1. Использовали 0,3 г смолы и 0,6 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1664,7 г/моль, экспериментальная М: (m/z): [М+2Н]+/2=834,1.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=12,5 мин; изократическое элюирование: 29,5% В за период времени 30 мин, rt=13,2 мин (В=0,07% TFA в ацетонитриле).
Пример 5: Синтез соединения 5
Данное соединение получали, как описано в Примере 1. Использовали 0,3 г смолы и 0,49 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1664,7 г/моль, экспериментальная М: (m/z): 20 [М+2Н]+/2=833,8.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=12,3 мин; изократическое элюирование: 29,5% В за период времени 30 мин, rt=12,3 мин (В=0,07% TFA в ацетонитриле).
Пример 6: Синтез соединения 6
Данное соединение получали, как описано в Примере 1. Использовали 0,3 г смолы и 0,5 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1664,3 г/моль, экспериментальная М: (m/z): [М+2Н]+/2=833,5.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=12,1 мин; изократическое элюирование: 29,5% В за период времени 30 мин, rt=11,45 мин (В=0,07% TFA в ацетонитриле).
Пример 7: Синтез соединения 7
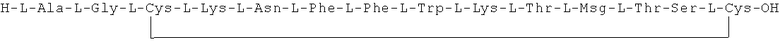
Данное соединение получали, как описано в Примере 1. Использовали 0,14 г смолы и 0,21 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1678,7 г/моль, экспериментальная М: (m/z): [M+2H]+/2=841,1.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=14,3 мин; изократическое элюирование: 33% В за период времени 30 мин, rt=14,9 мин (В=0,07% TFA в ацетонитриле).
Пример 8: Синтез соединения 8

Данное соединение получали, как описано в Примере 1. Использовали 0,14 г смолы и 0,23 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1678,7 г/моль, экспериментальная М: (m/z): 20 [M+2H]+/2=840,9.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=14,8 мин; изократическое элюирование: 35% В за период времени 30 мин, rt=11,08 мин (В=0,07% TFA в ацетонитриле).
Пример 9: Синтез соединения 9

Данное соединение получали, как описано в Примере 1. Использовали 0,14 г смолы и 0,28 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1678,7 г/моль, экспериментальная М: (m/z): [M+2H]+/2=841.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=14,1 мин; изократическое элюирование: 33% В за период времени 30 мин, rt=12,9 мин (В=0,07% TFA в ацетонитриле).
Пример 10: Синтез соединения 10
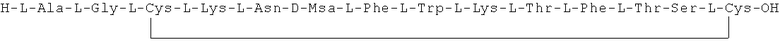
Данное соединение получали, как описано в Примере 1. Использовали 0,25 г смолы и 0,39 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1678,7 г/моль, экспериментальная М: {m/z): [М+2Н]+/2=840,7.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=14,8 мин; изократическое элюирование: 33% В за период времени 30 мин, rt=17,7 мин (В=0,07% TFA в ацетонитриле).
Пример 11: Синтез соединения 11
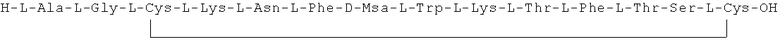
Данное соединение получали, как описано в Примере 1. Использовали 0,25 г смолы и 0,47 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1678,7 г/моль, экспериментальная М: (m/z): [М+2Н]+/2=840,7.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=15,7 мин; изократическое элюирование: 36% В за период времени 30 мин, rt=12,3 мин (В=0,07% TFA в ацетонитриле).
Пример 12: Синтез соединения 12
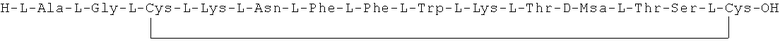
Данное соединение получали, как описано в Примере 1. Использовали 0,25 г смолы и 0,46 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1678,7 г/моль, экспериментальная М: (m/z): [М+2Н]+/2=840,8.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=13,4 мин; изократическое элюирование: 32% В за период времени 30 мин, rt=12,03 мин (В=0,07% TFA в ацетонитриле).
Пример 13: Синтез соединения 13
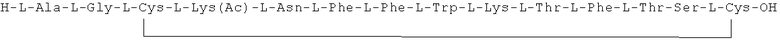
Данное соединение получали, как описано в Примере 1. Использовали 0,5 г смолы и 0,99 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1679,05 г/моль, экспериментальная М: (m/z): [M+2H]+/2=840,8
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=12,2 мин; изократическое элюирование: 31% В за период времени 30 мин, rt=11,2 мин (В=0,07% TFA в ацетонитриле).
Пример 14: Синтез соединения 14
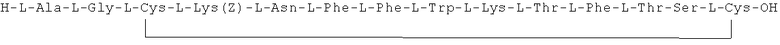
Данное соединение получали, как описано в Примере 1. Использовали 0,5 г смолы и 0,97 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1771,7 г/моль, экспериментальная М: (m/z): 20 [М+2Н]+/2=887,3.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=15,9 мин; изократическое элюирование: 36% В за период времени 30 мин, rt=14,6 мин (В=0,07% TFA в ацетонитриле).
Пример 15: Синтез соединения 15
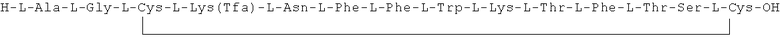
Данное соединение получали, как описано в Примере 1. Использовали 0,5 г смолы и 1 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1733,6 г/моль, экспериментальная М: (m/z): [М+2Н]+/2=867,6.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=14,4 мин; изократическое элюирование: 33% В за период времени 30 мин, rt=15,4 мин (В=0,07% TFA в ацетонитриле).
Пример 16: Синтез соединения 16

Данное соединение получали, как описано в Примере 1. Использовали 0,5 г смолы и 1,03 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1806,5 г/моль, экспериментальная М: (m/z): [М+2Н]+/2=903,8.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=16,7 мин; изократическое элюирование: 38% В за период времени 30 мин, rt=12,4 мин (В=0,07% TFA в ацетонитриле).
Пример 17: Синтез соединения 17

Данное соединение получали, как описано в Примере 1. Использовали 0,5 г смолы и 0,89 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1665,67 г/моль, экспериментальная М: (m/z): 20-[М+2Н]+2=833,7.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=12,4 мин; изократическое элюирование: 31% В за период времени 30 мин, rt=10,5 мин (В=0,07% TFA в ацетонитриле).
Пример 18: Синтез соединения 18
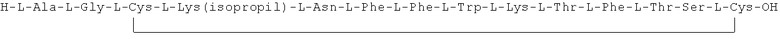
Данное соединение получали, как описано в Примере 1. Использовали 0,5 г смолы и 1,05 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1679,2 г/моль, экспериментальная М: (m/z): [М+2Н]+/2=840,7.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=11,75 мин; изократическое элюирование: 29% В за период времени 30 мин, rt=13,7 мин (В=0,07% TFA в ацетонитриле).
Пример 19: Синтез соединения 19
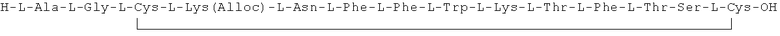
Данное соединение получали, как описано в Примере 1. Использовали 0,5 г смолы и 0,95 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1721,09 г/моль, экспериментальная М: (m/z): [М+2H]+2=861,8.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=13,3 мин; изократическое элюирование: 34% В за период времени 30 мин, rt=12,1 мин (В=0,07% TFA в ацетонитриле).
Пример 20: Синтез соединения 20

Данное соединение получали, как описано в Примере 1. Использовали 0,5 г смолы и 1,02 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1801,7 г/моль, экспериментальная М: (m/z): [M+2H]+/2=901,7.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=14,8 мин; изократическое элюирование: 34% В за период времени 30 мин, rt=13,5 мин (В=0,07% TFA в ацетонитриле).
Пример 21: Синтез соединения 21
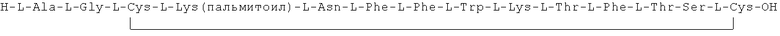
Данное соединение получали, как описано в Примере 1. Использовали 0,5 г смолы и 1,01 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1875,4 г/моль, экспериментальная М: (m/z): [М+2Н]+/2=939,4.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 5-100% В за период времени 20 мин, rt=19,1 мин; изократическое элюирование: 55% В за период времени 30 мин, rt=13,8 мин (В=0,07% TFA в ацетонитриле).
Пример 22: Синтез соединения 22

Данное соединение получали, как описано в Примере 1. Использовали 0,3 г смолы и 0,58 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1649,9 г/моль, экспериментальная М: (m/z): [М+2Н]+/2=825,6.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=8,3 мин; изократическое элюирование: 24% В за период времени 30 мин, rt=12,2 мин (В=0,07% TFA в ацетонитриле).
Пример 23: Синтез соединения 23

Данное соединение получали, как описано в Примере 1. Использовали 0,3 г смолы и 0,63 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1649,9 г/моль, экспериментальная М: (m/z): [M+2H]+/2=825,6.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-6% В за период времени 20 мин, П=8,9 мин; изократическое элюирование: 25% В за период времени 30 мин, П=11,1 мин (В=0,07% TFA в ацетонитриле).
Пример 24: Синтез соединения 24

Данное соединение получали, как описано в Примере 1. Использовали 0,4 г смолы и 0,71 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1678,7 г/моль, экспериментальная М: (m/z): [М+2Н]+/2=840,4.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=16,1 мин; изократическое элюирование: 36% В за период времени 30 мин, rt=11,4 мин (В=0,07% TFA в ацетонитриле).
Пример 25: Синтез соединения 25
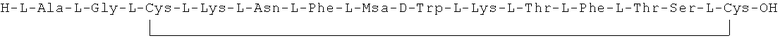
Данное соединение получали, как описано в Примере 1. Использовали 0,4 г смолы и 0,66 г неочищенного продукта получили с такими же соотношениями эквивалентов,
Характеристики:
ЭРИ-МС: Теоретическая М=1678,7 г/моль, экспериментальная М: (m/z): [М+2Н]+/2=840,6.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=16,05 мин; изократическое элюирование: 36% В за период времени 30 мин, rt=11,3 мин (В=0,07% TFA в ацетонитриле).
Пример 26: Синтез соединения 26
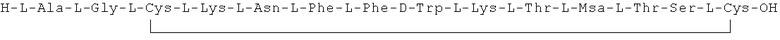
Данное соединение получали, как описано в Примере 1. Использовали 0,4 г смолы и 0,621 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1678,7 г/моль, Экспериментальная М: (m/z): [М+2Н]+/2=840,5.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=15,6 мин; изократическое элюирование: 34% В за период времени 30 мин, rt=14,6 мин (В=0,07% TFA в ацетонитриле).
Пример 27: Синтез соединения 27
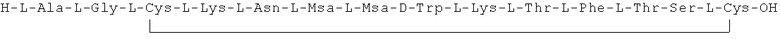
Данное соединение получали, как описано в Примере 1. Использовали 0,1 г смолы и 0,12 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1721,1 г/моль, экспериментальная М: (m/z): [M+2H]+/2=861,5.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=16,5 мин; изократическое элюирование: 37% В за период времени 30 мин, rt=16,6 мин (В=0,07% TFA в ацетонитриле).
Пример 28: Синтез соединения 28
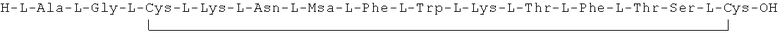
Данное соединение получали, как описано в Примере 1. Использовали 0,1 г смолы и 0,1 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1721,1 г/моль, экспериментальная М: (m/z): [М+2Н]+/2=861,4.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=15,38 мин; изократическое элюирование: 37% В за период времени 30 мин, rt=9,8 мин (В=0,07% TFA в ацетонитриле).
Пример 29: Синтез соединения 29
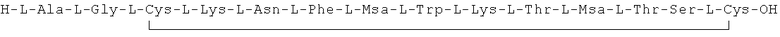
Данное соединение получали, как описано в Примере 1. Использовали 0,1 г смолы и 0,12 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1721,1 г/моль, экспериментальная М: (m/z): [М+2Н]+/2=861,5.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=16,4 мин; изократическое элюирование: 37% В за период времени 30 мин, rt=15,4 мин (В=0,07% TFA в ацетонитриле).
Пример 30: Синтез соединения 30
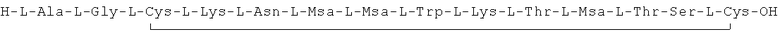
Данное соединение получали, как описано в Примере 1. Использовали 0,1 г смолы и 0,1 г неочищенного продукта получили с такими же соотношениями эквивалентов.
Характеристики:
ЭРИ-МС: Теоретическая М=1762,9 г/моль, экспериментальная М: (m/z): [М+2Н]+/2=882,6
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=18,3 мин; изократическое элюирование: 40% В за период времени 30 мин, rt=17,8 мин (В=0,07% TFA в ацетонитриле).
Пример 31: Синтез соединения 31

Данное соединение синтезировали, следуя общему протоколу, описанному для синтеза предыдущих аналогов, начиная с 1 г амидной смолы Rink (0,45 ммоль/г). Пептидил-смолу (200 мг, 0,09 ммоль) суспендировали в 1 мл DCM и 0,1 мл 0,4 М Lid в DMF в реакторе высокого давления. Добавляли 15 мг (0,018 ммоль) катализатора Граббса второго поколения и смесь оставляли взаимодействовать в течение 1 ч в условиях микроволнового излучения при 100°С в микроволновой аппаратуре СЕМ Discovery. Сразу после окончания реакции обмена пептидил-смолу пропускали в реактор, оснащенный фильтровальной пластиной, и промывали DMF, DCM, МеОН и диэтиловым эфиром. Пептидил-смолу обрабатывали смесью TFA:TIS:H2O в течение 1 ч и соединение выделяли фильтрованием. Диэтиловым эфиром вызывали выпадение осадка в фильтрате. Полученную суспензию фильтровали через фильтровальную пластину и фильтраты отбрасывали. Остаток промывали диэтиловым эфиром, выбрасывая фильтраты при каждой промывке. Твердое вещество подвергали сублимационной сушке с получением 40 мг неочищенного продукта.
Характеристики:
ЭРИ-МС: Теоретическая М=1597,8 г/моль, экспериментальная М: (m/z): [M+H+]=1597,8.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 20-35% В за 6 мин, rt=1,74 мин (В=0,07% TFA в ацетонитриле).
Пример 32: Анализ связывания с пятью рецепторами sstr1, sstr2, sstr3, sstr4 и sstr5
Анализ связывания с пятью рецепторами sstr1, sstr2, sstr3, sstr4 и sstr 5 проводили с использованием мембран из клеток СНО-К1 (АТСС, Американская коллекция типовых культур), в которых соматостатиновые рецепторы sstr1, sstr2, sstr3, sstr4 или sstr5 (плазмиды Invitrogen) были избирательно трасфицированы. 125I-Tyr11-соматостатин-14 использовали в качестве радиоактивного лиганда и соматостатин-14 использовали в качестве холодного лиганда. Трансфицированные клетки выделяли центрифугированием, остаток после центрифугирования ресуспендировали в Tris-буфере и белки определяли методом Брэдфорда. Кривые зависимости доза-эффект строили для определения IC50 и Ki с теми аналогами соматостатина, которые вытесняли 125I-Tyr11-соматостатин-14 до концентрации 10 мкМ. Мембраны из клонов, экспрессирующих различные рецепторы, инкубировали с фиксированной концентрацией радиометки (0,1 нМ) в присутствии возрастающих концентраций соматостатина-14 и аналогов, от 1 пМ до 1 мкМ включительно. Смесь инкубировали в 96-луночных планшетах в течение 1 ч при 30°С, и после этого ее фильтровали в харвестере для отделения связанной радиоактивности от несвязанной радиоактивности. Фильтр, который содержал мембраны, которые имели связанный 125I-Tyr11-соматостатина 4, покрывали сцинтилляционной жидкостью и считывали в счетчике MicroBeta. Радиоактивность, полученную в отсутствие соматостатина-14, рассматривали как общее связывание, а радиоактивность, полученную в присутствии 1 мкМ соматостатина-14, рассматривали как неспецифическое связывание. Специфическим связыванием считается разница между общим и неспецифическим связыванием. Рассчитывали процент специфического связывания в каждой точке. В Таблицах 1-5 представлены результаты в виде % специфического связывания аналогов соматостатина с соматостатиновыми рецепторами 1-5 относительно соматостатина.
Пример 33: Стабильность
Новые соединения инкубировали с 90% сывороткой крови человека при 37°С. Аликвоты извлекали в разные моменты времени инкубации. Ацетонитрил добавляли для осаждения белков из сыворотки, центрифугировали и надосадочную жидкость фильтровали и впрыскивали в колонку ОФ-ВЭЖХ (градиентное элюирование: 20-80% В за период времени 30 мин, В=0,07% TFA в ацетонитриле). Исчезновение исходного продукта анализировали, используя площадь, соответствующую исходному продукту, и рассчитывали период полужизни.
Новые соединения имеют период полужизни больше, чем период полужизни соматостатина. Соединение 8 имеет период полужизни 5,2 ч. Соединения 10 и 11 имеют периоды полужизни 10,5 ч и 8,1 ч соответственно. Соединение 21 имеет период полужизни 41,7 ч. Соединения 24, 25 и 26 имеют периоды полужизни 26,2, 24,6 и 41 ч соответственно. Соединение 27 имеет период полужизни 43,9 ч, и соединение 30 имеет период полужизни 93,3 ч.
Пример 34: Синтез соединения 32

Введение С-концевого остатка осуществляли, как описано в Примере 1, начиная с 1 г 2-хлортритильной смолы Введение следующих 7 аминокислот (фрагмент 7-14) осуществляли в автоматическом реакторе для синтеза Liberty-СЕМ с исходной функционализацией 1,6 мэкв./г, в масштабе 1 мМ, и 3 экв. Fmoc-аминокислоты, 3 экв. НОВТ и 3 экв. DIPCDI. Введение последних 6 аминокислот осуществляли на 1,887 г пептидил-смолы, как описано в Примере 1, с таким же соотношением эквивалентов. Введение три(tBu)-DOTA-OH осуществляли с использованием 2,5 экв. три(tBu)-DOTA-OH, 2,5 экв. гексафторфосфата бензотриазол-1-ил-окситрипирролидинофосфония, 2,5 экв. HOBt и 5 экв. DIEA в DMF в течение 60 мин. Введение DOTA контролировали тестированием с использованием нингидрина. Получили 0,8454 г пептидил-смолы.
Последующие окисление и удаление защитных групп осуществляли, как описано в Примере 1, и получили 0,383 г неочищенного продукта.
Неочищенный продукт очищали в полупрепаративной системе, оснащенной колонкой NW50, упакованной диоксидом кремния Kromasil 10 микрон, с получением 0,103 г очищенного продукта.
Характеристики:
ЭРИ-МС: Теоретическая М=2065,7 г/моль, экспериментальная М: (m/z): [М+2Н]+2=1034,6.
Аналитическая ОФ-ВЭЖХ: Градиентное элюирование: 25-60% В за период времени 20 мин, rt=13,1 мин; изократическое элюирование: 32% В за период времени 30 мин, rt=12,5 мин (В=0,07% TFA в ацетонитриле).
| название | год | авторы | номер документа |
|---|---|---|---|
| АНАЛОГИ КОРТИСТАТИНА ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ И/ИЛИ ИММУНОПАТОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2014 |
|
RU2678315C2 |
| ГЛИКОЗИЛИРОВАННЫЕ ПОЛИПЕПТИДЫ И ЛЕКАРСТВЕННЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ДАННЫЕ ПОЛИПЕПТИДЫ | 2012 |
|
RU2624034C2 |
| ГЛИКОЗИЛИРОВАННЫЕ ПОЛИПЕПТИДЫ И ЛЕКАРСТВЕННЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ДАННЫЕ ПОЛИПЕПТИДЫ | 2012 |
|
RU2627184C2 |
| СПОСОБ МОДУЛЯЦИИ ПРОЛИФЕРАЦИИ КЛЕТОК МЕДУЛЛЯРНОЙ КАРЦИНОМЫ ЩИТОВИДНОЙ ЖЕЛЕЗЫ | 2002 |
|
RU2275934C2 |
| КОМБИНАЦИЯ АНАЛОГОВ СОМАТОСТАТИНА С РАЗЛИЧНОЙ СЕЛЕКТИВНОСТЬЮ В ОТНОШЕНИИ ПОДТИПОВ РЕЦЕПТОРОВ СОМАТОСТАТИНА ЧЕЛОВЕКА | 2007 |
|
RU2451520C2 |
| СПОСОБ МОДУЛЯЦИИ ПРОЛИФЕРАЦИИ КЛЕТОК МЕДУЛЛЯРНОЙ КАРЦИНОМЫ ЩИТОВИДНОЙ ЖЕЛЕЗЫ | 2005 |
|
RU2317824C2 |
| СПОСОБ МОДУЛЯЦИИ ПРОЛИФЕРАЦИИ КЛЕТОК МЕДУЛЛЯРНОЙ КАРЦИНОМЫ ЩИТОВИДНОЙ ЖЕЛЕЗЫ | 2002 |
|
RU2352578C2 |
| АНТАГОНИСТЫ СОМАТОСТАТИНА | 2002 |
|
RU2328504C2 |
| ПРИМЕНЕНИЕ АНАЛОГОВ СОМАТОСТАТИНА ПРИ МЕНИНГИОМЕ | 2008 |
|
RU2523416C2 |
| АНТАГОНИСТЫ СОМАТОСТАТИНА | 2002 |
|
RU2263678C2 |















Изобретение относится к пептидным производным общей формулы (I), их стереоизомерам, их смесям и/или их фармацевтически приемлемым солям, к способам их получения, к фармацевтическим композициям, содержащим их, и к применению их для лечения, предупреждения и/или диагностики тех состояний, расстройств и/патологий, при которых экспрессируются соматостатиновые рецепторы sstr1, sstr2, sstr3, sstr4 и/или sstr5. 3 н. и 11 з.п. ф-лы, 5 табл., 33 пр.
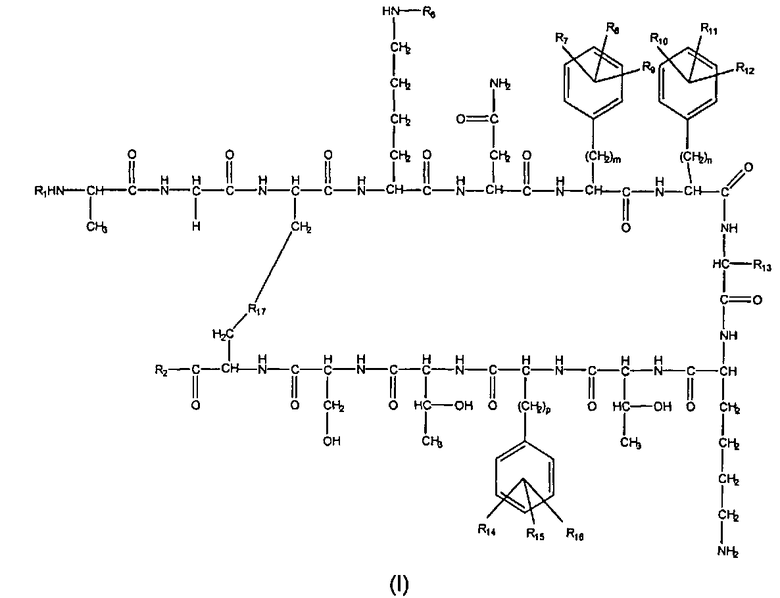
1. Соединение общей формулы (I)

его стереоизомеры, их смеси и/или их фармацевтически приемлемые соли, где:
R1 выбран из группы, состоящей из Н, ацетила, трет-бутаноила, гексаноила, 2-метилгексаноила, циклогексанкарбоксила, октаноила, деканоила, лауроила, миристоила, пальмитоила, стеароила, бегенила, олеоила и линолеоила, хелатирующего агента, выбранного из группы, состоящей из DOTA (1,4,7,10-тетраазациклододекантетрауксусная кислота), DTPA (диэтилентриаминопентауксусная кислота) и ТЕТА (триэтилентетрамин), и полиэтиленгликолевого полимера общей формулы (II),
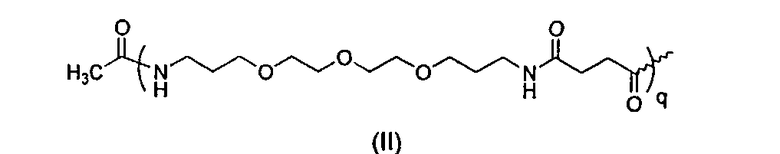
где q находится в пределах от 1 до 5;
R2 выбран из группы, состоящей из -NR3R4 и -OR3;
R6 выбран из группы, состоящей из H, ацетила, трифторацетила, изопропила, пальмитоила, аллилоксикарбонила, 2-хлорбензила, формила, группы N-[1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)этил] и бензилоксикарбонила;
R7, R8, R9, R10, R11, R12, R14, R15 и R16 независимо друг от друга выбраны из группы, состоящей из Н и нециклической алифатической группы;
m означает целое число, выбранное из 0-6, при условии, что когда R7, R8 и R9 представляют собой Н, тогда m является иным, чем 0;
n означает целое число, выбранное из 0-6, при условии, что когда R10, R11 и R12 представляют собой H, тогда n является иным, чем 0;
p означает целое число, выбранное из 0-6, при условии, что когда R14, R15 и R16 представляют собой Н, тогда p является иным, чем 0;
R13 выбран из группы, состоящей из L-(3-хинолил)метила, D-(3-хинолил)метила, L-(3-индолил)метила и D-(3-индолил)метила;
R17 выбран из группы, состоящей из -SS- и -CH=CH-;
R3 и R4 независимо выбраны из группы, состоящей из Н, метила, этила, гексила, додецила и гексадецила;
при условии, что когда R6, R7, R8, R9, R10, R11, R12, R14, R15 и R16 все представляют собой Н, n, m и p равны 1, и R13 представляет собой L-(3-индолил)метил или D-(3-индолил)метил, тогда R17 не представляет собой -S-S-.
2. Соединение по п.1, где хелатирующий агент в R1 образует комплекс с детектируемым элементом или радиотерапевтическим элементом.
3. Соединение по п.1, где R1 выбран из группы, состоящей из H, ацетила, лауроила, миристоила, пальмитоила или полимера общей формулы (II), где q находится в пределах от 1 до 5, R2 представляет собой -NR3R4 или -OR3, где R3 и R4 независимо выбраны из H, метила, этила, гексила, додецила и гексадецила, R6 представляет собой Н, R7, R8 и R9 представляют собой метил и находятся в орто-, пара-, орто-конфигурации или мета-, пара-, мета-конфигурации, m равно 0 или 1, R10, R11, R12, R14, R15 и R16 представляют собой Н, n и p равны 1, R13 выбран из группы, состоящей из L-(3-индолил)метила и D-(3-индолил)метила, и R17 представляет собой -S-S-.
4. Соединение по п.1, где R1 выбран из группы, состоящей из Н, ацетила, лауроила, миристоила, пальмитоила или полимера общей формулы (II), где q находится в пределах от 1 до 5, R2 представляет собой -NR3R4 или -OR3, где R3 и R4 независимо выбраны из Н, метила, этила, гексила, додецила и гексадецила, R6 представляет собой Н, R10, R11 и R12 представляют собой метил и находятся в орто-, пара-, орто-конфигурации или мета-, пара-, мета-конфигурации, n равно 0 или 1, R7, R8, R9, R14, R15 и R16 представляют собой Н, m и p равны 1, R13 выбран из группы, состоящей из L-(3-индолил)метила и D-(3-индолил)метила, и R17 представляет собой -S-S-.
5. Соединение по п.1, где R1 выбран из группы, состоящей из Н, ацетила, лауроила, миристоила, пальмитоила или полимера общей формулы (II), где q находится в пределах от 1 до 5, R2 представляет собой -NR3R4 или -OR3, где R3 и R4 независимо выбраны из Н, метила, этила, гексила, додецила и гексадецила, R6 представляет собой Н, R14, R15 и R16 представляют собой метил и находятся в орто-, пара-, орто-конфигурации или мета-, пара-, мета-конфигурации, p равно 0 или 1, R7, R8, R9, R10, R11 и R12 представляют собой Н, m и n равны 1, R13 выбран из группы, состоящей из L-(3-индолил)метила и D-(3-индолил)метила, и R17 представляет собой -S-S-.
6. Соединение по п.1, где R1 выбран из группы, состоящей из Н, ацетила, лауроила, миристоила, пальмитоила или полимера общей формулы (II), где q находится в пределах от 1 до 5, R2 представляет собой -NR3R4 или -OR3, где R3 и R4 независимо выбраны из Н, метила, этила, гексила, додецила и гексадецила, R6 представляет собой Н, R7, R8, R9, R10, R11 и R12 представляют собой метил и находятся в орто-, пара-, орто-конфигурации или мета-, пара-, мета-конфигурации, m и n равны 0 или 1, R14, R15 и R16 представляют собой Н, p равно 1, R13 выбран из группы, состоящей из L-(3-индолил)метила и D-(3-индолил)метила, и R17 представляет собой -S-S-.
7. Соединение по п.1, где R1 выбран из группы, состоящей из Н, ацетила, лауроила, миристоила, пальмитоила или полимера общей формулы (II), где q находится в пределах от 1 до 5, R2 представляет собой -NR3R4 или -OR3, где R3 и R4 независимо выбраны из Н, метила, этила, гексила, додецила и гексадецила, R6 представляет собой Н, R7, R8, R9, R14, R15 и R16 представляют собой метил и находятся в орто-, пара-, орто-конфигурации или мета-, пара-, мета-конфигурации, m и p равны 0 или 1, R10, R11 и R12 представляют собой Н, n равно 1, R13 выбран из группы, состоящей из L-(3-индолил)метила и D-(3-индолил)метила, и R17 представляет собой -S-S-.
8. Соединение по п.1, где R1 выбран из группы, состоящей из Н, ацетила, лауроила, миристоила, пальмитоила или полимера общей формулы (II), где q находится в пределах от 1 до 5, R2 представляет собой -NR3R4 или -OR3, где R3 и R4 независимо выбраны из Н, метила, этила, гексила, додецила и гексадецила, R6 представляет собой Н, R10, R11, R12, R14, R15 и R16 представляют собой метил и находятся в орто-, пара-, орто-конфигурации или мета-, пара-, мета-конфигурации, n и p равны 0 или 1, R7, R8 и R9 представляют собой Н, m равно 1, R13 выбран из группы, состоящей из L-(3-индолил)метила и D-(3-индолил)метила, и R17 представляет собой -S-S-.
9. Соединение по п.1, где R1 выбран из группы, состоящей из Н, ацетила, лауроила, миристоила, пальмитоила или полимера общей формулы (II), где q находится в пределах от 1 до 5, R2 представляет собой -NR3R4 или -OR3, где R3 и R4 независимо выбраны из Н, метила, этила, гексила, додецила и гексадецила, R6 выбран из группы, состоящей из ацетила, пальмитоила, трифторацетила, изопропила, аллилоксикарбонила, 2-хлорбензила, группы N-[1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)этил], R7, R8, R9, R10, R11, R12, R14, R15 и R16 представляют собой H, m, n и p равны 1, R13 выбран из группы, состоящей из L-(3-индолил)метила и D-(3-индолил)метила, и R17 представляет собой -S-S-.
10. Соединение по п.1, где R1 выбран из группы, состоящей из Н, ацетила, лауроила, миристоила, пальмитоила или полимера общей формулы (II), где q находится в пределах от 1 до 5, R2 представляет собой -NR3R4 или -OR3, где R3 и R4 независимо выбраны из Н, метила, этила, гексила, додецила и гексадецила, R6 представляет собой Н, R7, R8, R9, R10, R11, R12, R14, R15 и R16 представляют собой H, m, n и p равны 1, R13 выбран из группы, состоящей из L-(3-хинолил)метила и D-(3-хинолил)метила, и R17 представляет собой -S-S-.
11. Соединение по п.1, где R1 выбран из группы, состоящей из Н, ацетила, лауроила, миристоила, пальмитоила или полимера общей формулы (II), где q находится в пределах от 1 до 5, R2 представляет собой -NR3R4 или -OR3, где R3 и R4 независимо выбраны из Н, метила, этила, гексила, додецила и гексадецила, R6 представляет собой Н, R7, R8, R9, R10, R11, R12, R14, R15 и R16 представляют собой H, m, n и p равны 1, R13 выбран из группы, состоящей из L-(3-индолил)метила и D-(3-индолил)метила, и R17 представляет собой -СН=СН-.
12. Соединение по любому из пп.1-11 для лечения, предупреждения и/или диагностики тех состояний, расстройств и/или патологий, при которых экспрессируются соматостатиновые рецепторы sstr1, sstr2, sstr3, sstr4 и/или sstr5 или их комбинации, акромегалии, симптоматического лечения гастроэнтеропанкреатических нейроэндокринных опухолей, диареи, рака, опухолей, нейродегенеративных заболеваний, болезни Альцгеймера, глазных заболеваний, диабетической ретинопатии, отека желтого пятна, офтальмопатии Грейвса, патологий иммунной системы, аллергий, красной волчанки, лимфопролиферативного расстройства, воспаления, артрита, инфекций, варикозного расширения вен пищевода, боли, заживления ран, регенерации ткани, хронического панкреатита, гипертрофической легочной остеоартропатии, тиреотрофической аденомы, синдрома Кушинга, невропатической боли, рестеноза, ангиогенеза, гипертиреоидизма, гипотиреоидизма, гиперинсулинемии, псориаза, гиперкальциемии, болезни Педжета, кахексии и синдрома Золлингера-Эллисона.
13. Способ получения соединения общей формулы (I), его стереоизомеров, их смесей или их косметически или фармацевтически приемлемых солей по любому из пп.1-11, который осуществляют твердофазным синтезом или синтезом в растворе.
14. Фармацевтическая композиция, содержащая фармацевтически эффективное количество по меньшей мере одного соединения общей формулы (I), его стереоизомеров, их смесей и/или их фармацевтически приемлемых солей по любому из пп.1-11 и по меньшей мере один фармацевтически приемлемый эксципиент, для лечения, предупреждения и/или диагностики тех состояний, расстройств и/или патологий, при которых экспрессируются соматостатиновые рецепторы sstr1, sstr2, sstr3, sstr4 и/или sstr5 или их комбинации.
| WO 1993001206 A1, 21.01.1993 | |||
| RU 99114018 А, 20.05.2001 | |||
| US 4211693 A1, 08.07.1980 | |||
| Способ получения производных соматостатина | 1974 |
|
SU586837A3 |
| GILON C ET AL: "CONFORMATIONAL ANALYSIS OF SOMATOSTATIN AND SELECTED ANALOGS IN ORIENTED POLY OXY ETHYLENE BY IR DICHROISM" BIOPOLYMERS, vol | |||
| Способ изготовления электрических сопротивлений посредством осаждения слоя проводника на поверхности изолятора | 1921 |
|
SU19A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| DIRKX J ET AL: "Conformational studies on somatostatin : a | |||
Авторы
Даты
2014-08-20—Публикация
2010-05-06—Подача