Изобретение относится к областям медицинской и молекулярной генетики и к генотерапии. Необходимость создания кассетных генетических конструкций, одновременно экспрессирующих несколько антиВИЧ-1 siPHK, связано с присущей ВИЧ-1 способностью быстро образовывать мутантные штаммы и ускользать от действия направленных против него siPHK в ходе генотерапии с помощью РНК-интерференции. Таким образом, чем на большее число мишеней направлена терапевтическая антивирусная конструкция, тем эффективнее она будет в преодолении эффекта быстрого мутирования вируса ВИЧ-1. При экспрессии кассетной конструкции палиндромы образуют РНК-шпильки, которые нарезаются клеточным ферментом Дайсером с образованием siPHK, являющихся действующим агентом РНК-интерференции.
При получении кассетных генетических конструкций, экспрессирующих шпильки РНК, возникают трудности, связанные с клонированием нескольких палиндромов одновременно. Настоящее изобретение предлагает способы их преодоления.
Существуют три основных стратегии использования так называемой комбинаторной РНК интерференции (co-RNAi):
(1) использование кассетных генетических конструкций, кодирующих несколько коротких РНК (shPHK - short hairpin РНК), каждая из которых экспрессируется под своим промотором;
(2) использование кассетных генетических конструкций, экспрессирующих под одним промотором одну большую шпильку РНК, состоящую из тандемно расположенных последовательностей коротких shPHK, не содержащих петли;
(3) использование кассетных генетических конструкций, в которых в составе вектора, полученного на основе природной микроРНК (miPHK), под одним промотором экспрессируется несколько микроРНК (или shPHK, имитирующих miPHK).
[A direct comparison of strategies for combinatorial RNA interference. Lambeth LS, Van Hateren NJ, Wilson SA, Nair V. BMC Mol Biol. 2010 Oct 11; 11:77.; Combinatorial RNAi against HIV-1 using extended short hairpin RNAs. Liu YP, von Eije KJ, Schopman NC, Westerink JT, ter Brake O, Haasnoot J, Berkhout B. Mol Ther. 2009 Oct; 17(10):1712-23; Inhibition of HIV-1 by multiple siRNAs expressed from a single microRNA polycistron. Liu YP, Haasnoot J, ter Brake O, Berkhout B, Konstantinova P. Nucleic Acids Res. 2008 May; 36(9):2811-24. Epub 2008 Mar 16.].
Наиболее близким к данному изобретению являются способы создания генетических конструкций, обеспечивающих экспрессию siPHK внутри ВИЧ-инфицированных клеток организма (Патент РФ №2385939, 29 августа 2008 г., а также Патент РФ №2425150, 23 ноября 2009). Предложенный способ отличается от вышеуказанных тем, что предполагает не пошаговое создание кассетной конструкции путем добавления каждой отдельной шпильки в уже готовую кассету, а одномоментное получение готовой кассеты с нужным числом шпилек.
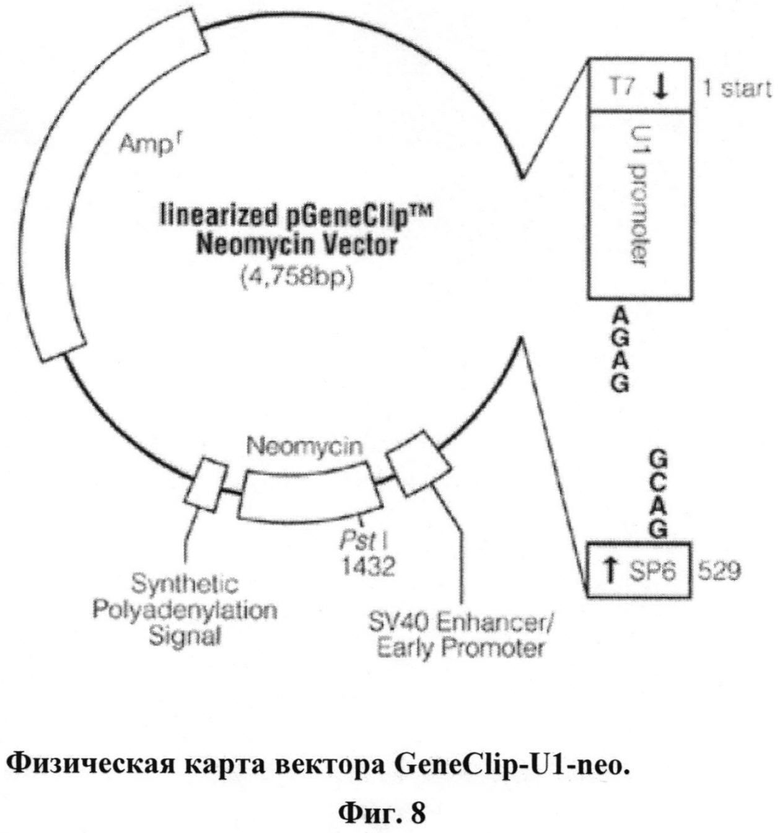
Техническим результатом предлагаемого изобретения является разработка быстрого и экономичного протокола получения генетических конструкций, одновременно экспрессирующих несколько биологически активных siPHK, позволяющего в течение 1-2 недель из набора коротких (размером не более 50 н) олигонуклеотидов получить нужное количество кассетных генетических конструкций в экспрессирующем векторе. Метод представлен на примере получения генетической конструкции, направленной на ингибирование двух мишеней в геноме ВИЧ-1 и одной мишени в мРНК корецептора CCR5. Данная конструкция получена на базе вектора GeneClip™U1 Neomycin (Accession number AY745746), http://www.promega.com/pnotes/89/12416_21/12416_21.pdf).
Предлагаемый протокол представляет собой следующую последовательность действий:
1 - дизайн и синтез олигонуклеотидов, предполагающий перекрывание пары олигонуклеотидов только в области петли (Фиг.1);
2 - попарный отжиг и достройка частично комплементарных олигонуклеотидов;
3 - рестрикция димеров олигонуклеотидов подходящими рестриктазами для получения липких концов, необходимых для направленного лигирования (Фиг.1 и 2);
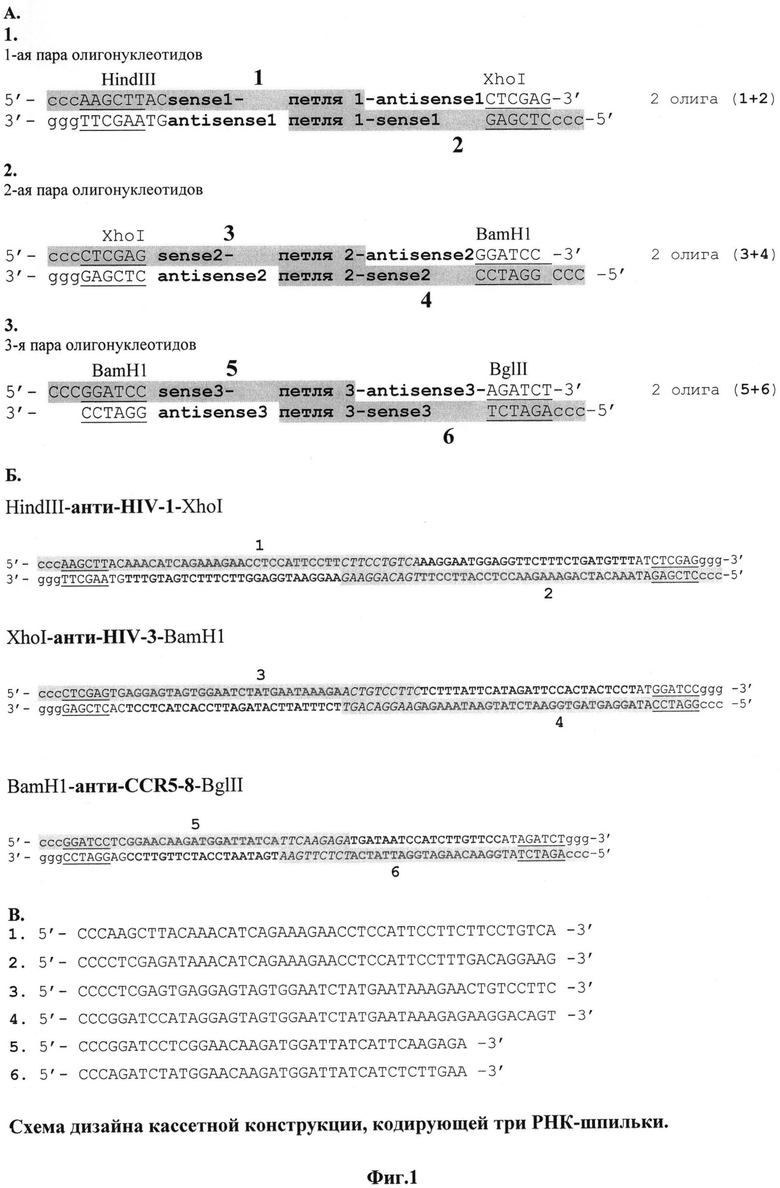
4 - лигирование трех пар достроенных и рестриктированных олигонуклеотидов (фрагментов кассеты) в одну линейную молекулу (Фиг.3);
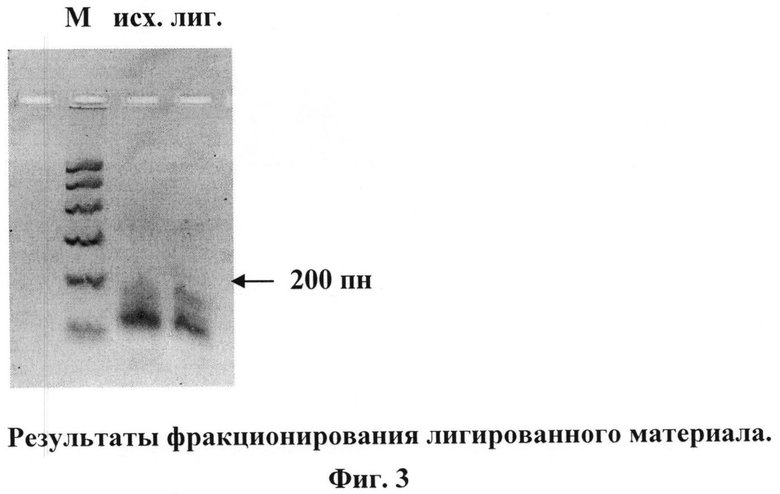
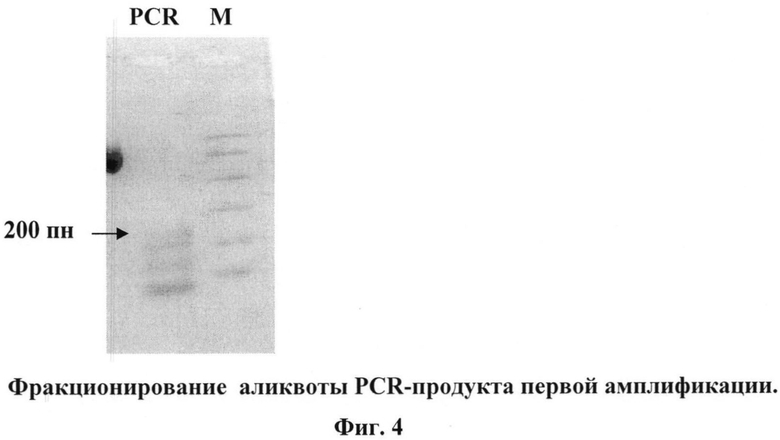
5 - две последовательные PCR-амплификации, фракционирование в агарозных мини-гелях, электроэлюции (Фиг.4-6);
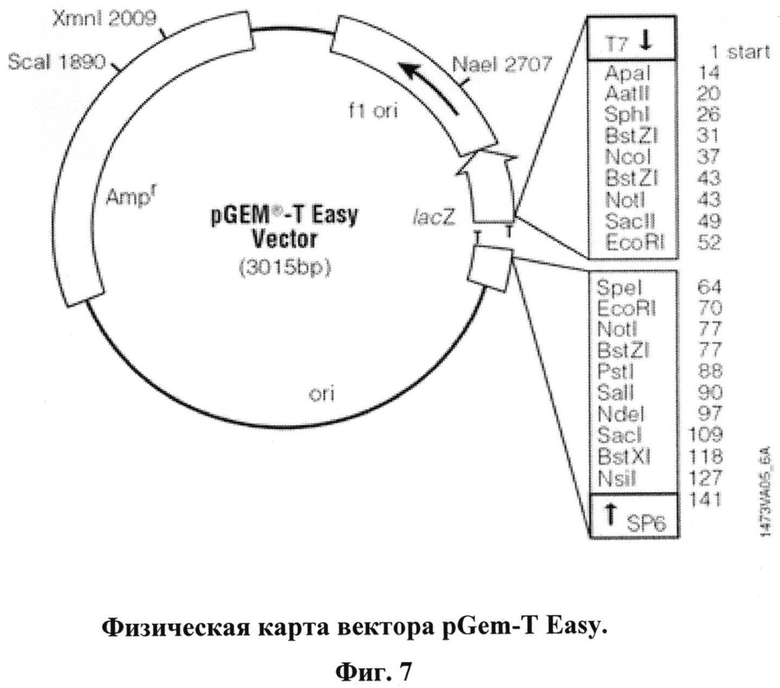
6 - лигирование элюированной ДНК в вектор pGemT-easy (см. физическую карту вектора на Фиг.7);
7 - трансформация клеток Е.coli (штамм JM109) и отбор плазмидных клонов с помощью гибридизации колоний с 32P-зондами;
8 - сиквенирование и отбор плазмидных клонов, содержащих полноразмерные ДНК кассет;
9 - переклонирование созданных кассет в конечный вектор для их экспрессии в клетках человека (см. физическую карту экспрессирующего вектора GeneClip™U1 Neomycin на Фиг.8).
1. Дизайн кассетной конструкции, синтез олигонуклеотидов
На Фиг.1A представлена схема дизайна конструкции, кодирующей три РНК-шпильки и схематически показаны олигонуклеотиды, которые необходимо синтезировать для получения данной конструкции. На Фиг.1Б и B в качестве примера использования метода представлены схемы и нуклеотидные тексты отдельных фрагментов кассеты, а также и тексты используемых олигонуклеотидов, соответственно. Приведены нуклеотидные тексты трех шпилек в составе кассеты, кодирующей анти-HIV-1, анти-HIV-3 и анти-CCR5-8 shPHK. В составе каждой шпильки выделены и обозначены цифрами (1-6) последовательности искусственно синтезированных олигонуклеотидов, использующихся для отжига в процессе получения данной кассетной конструкции. Отдельно приведены используемые последовательности шести искусственно синтезированных олигонуклеотидов.
2. Попарный отжиг частично комплементарных олигонуклеотидов и достройка.
Берут по 1 мкг каждого олигонуклеотида в объеме 20 мкл, отжиг проводят в универсальном буфере для рестрикции (40 mM TrisHCl, pH 7,4; 50 mM NaCl; 10 mM MgCl2; 10 mM β-меркаптоэтанол) при понижении температуры с 65°C до комнатной в течение 10-20 мин. Далее проводят достройку частично комплементарных олигонуклеотидов в присутствии смеси dNTPs и фрагмента Кленова при 15°C.
3. Осаждение ДНК этанолом и ее рестрикция подходящими рестриктазами, что обеспечивает направленное лигирование фрагментов кассет.
Каждую пару достроенных олигонуклеотидов переосаждают (с гликогеном) и рестриктируют соответствующими рестриктазами. Полученные таким образом фрагменты кассет смешивают в одной пробирке (в V=60 мкл) и совместно переосаждают. Осадок растворяют в 30 мкл H2O (до концентрации 100 нг/мкл).
4. Направленное лигирование трех фрагментов кассет в одну линейную молекулу (размером ~200 пн) в объеме 20 мкл.
3 мкл (300 нг) общего раствора фрагментов кассет (п.3) берут на лигирование в объеме 20 мкл при +8°C (сутки или ночь).
5. Две PCR-амплификации, электрофорезы в агарозных мини-гелях и электроэлюции.
1 мкл лигированной смеси (п.4) используют для PCR-амплификации в объеме 30 мкл (95°C-61°C-72°C, по 1 мин, 33 цикла).
В качестве праймеров используют концевые олигонуклеотиды (олиги 1 и 6 на Фиг.1)
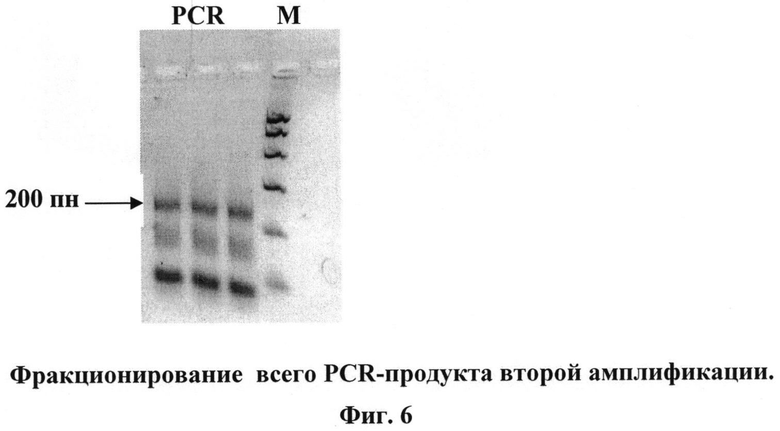
Весь PCR продукт фракционируют в 2,5% агарозном мини-геле и элюируют полосу нужного размера (в данном случае полосу величиной около 200 пн). Половину элюата используют для повторной PCR-амплификации (95°C-61°C-72°C, по 1 мин, 8 циклов) с теми же праймерами. При фракционировании в 2,5% агарозном мини-геле появляется мажорная полоса 200 пн, которую элюируют.
6. Лигирование полученного элюата в вектор pGemT-easy (см. физическую карту вектора на Фиг.7).
7. Трансформация клеток E.coli, штамма JM109 и гибридизация колоний с тремя зондами, соответствующими трем частям кассеты.
Вектор pGemT-easy позволяет проводить сине-белую селекцию колоний на среде с X-Gal/IPTG. Тем не менее, из-за наличия ложноположительных белых колоний для успешного отбора плазмидных клонов желательно использовать и гибридизацию колоний, используя 32P-зонды, соответствующие трем разным частям кассеты, каждая из которых кодирует отдельную shPHK.
8. Определение нуклеотидной последовательности (секвенирование) ДНК кассет, содержащихся в отобранных плазмидных клонах.
9. Вырезание кассеты из промежуточного вектора и переклонирование в другой вектор.
После секвенирования и отбора правильного текста кассету вырезают из промежуточного плазмидного вектора pGemT-easy по Not-1 сайту и переклонируют в другой вектор, например, GeneClip™U1 Neomycin для тестирования активности данной кассетной конструкции с помощью котрансфекции в культуре клеток человека.
Время, затраченное на получение кассеты, складывается из:
- 2, 3 и 4 пункты - 1 сутки
- 5 и 6 пункты - 1-2 суток
- 7 и 8 пункты - 3-4 суток.
Таким образом, через 5-7 дней в векторе pGemT-easy можно получить сразу несколько кассетных конструкций. Переклонирование в вектор для экспрессии занимает 3-4 дня. То есть, используя представленный протокол, за 1 неделю можно получить несколько кассетных конструкций в векторе, способном экспрессировать антивирусные shPHK и предназначенном для тестирования биологической активности этих shPHK.
Проблемы, которые возникают с получением кассетных конструкций, обычно связаны с трудностями клонирования шпилечных конструкций при одновременном использовании смеси частично перекрывающихся олигонуклеотидов. Эти трудности клонирования связаны с тем, что образуются более короткие внутримолекулярные шпильки, которые резко понижают выход конечной двуспиральной ДНК при достройке фрагментом Кленова, что препятствует клонированию полноразмерного продукта. Трудности клонирования можно преодолеть, используя:
1) пошаговое получение каждой новой конструкции на основе предыдущей с меньшим числом шпилек
или
2) только 2 олигонуклеотида размером свыше 100 н.
Первый вариант требует гораздо больше времени, чем предложенное нами одномоментное получение кассеты с нужным числом шпилек. Во втором варианте синтез олигонуклеотидов такого размера является дорогим и к тому же часто неуспешным из-за большого числа ошибок в тексте длинных олигонуклеотидов. Поэтому ценность представленного протокола состоит в его быстроте и экономичности.
Более подробно данный протокол рассмотрен на примере получения кассетной конструкции, одновременно экспрессирующей три shPHK, две из которых направлены против мишеней в транскриптах ВИЧ-1 и одна - в мРНК клеточного гена-корецептора CCR5.
Пример 1. Протокол, используемый для получения кассетной генетической конструкции, одновременно экспрессирующей три shPHK, атакующие транскрипты ВИЧ-1 и CCR5.
1. Дизайн кассетной конструкции
HindIII-anti-HIV-1-27-XhoI-anti-HIV-3-27-BamH1-anti-CCR5-19-BglII. Числа 27 и 19 обозначают количество нуклеотидов в стволе РНК-шпильки. Тексты используемых олигонуклеотидов представлены на Фиг.1Б и В.
2. Отжиг и достройка олигонуклеотидов
- олигонуклеотиды разводят до концентрации 500 нг/мкл;
- берут по 1 мкл каждого олигонуклеотида (по 500 нг);
- + 16 мкл H2O;
- + 2 мкл 10x универсального буфера для рестрикции (40 mM TrisHCl, pH 7,4; 50 mM NaCl; 10 mM MgCl2; 10 mM β-меркаптоэтанол);
- + 0,2 мкл 100x BSA (5 мг/мл);
- ставят отжиг цепей при охлаждении на водяной бане с 65°C до 25°C в течение 10-20 мин;
- + 1 мкл 10 мМ смеси dXTP;
- + 1 мкл фрагмента Кленова ДНК-полимеразы I (5 ед./мкл);
- инкубируют в течение 1 часа на водяной бане при 15°C;
- фермент инактивируют 10 мин при 65°C.
3. Осаждение с гликогеном и рестрикция рестриктазами EcoRI и BamHI
1) Осаждение ДНК
К каждой паре достроенных олигонуклеотидов добавляют по:
- 2 мкл 0,1М ЭДТА,
- 2 мкл 1M NaCl,
- 1 мкл гликогена (1 мг/мл);
- смешивают;
- + 80 мкл 96% этанола;
- инкубируют 10 мин во льду;
- трясут 10 мин для образования крупчатого осадка;
- для осаждения ДНК центрифугируют 10 мин на mini-spin;
- с помощью водоструйного насоса отсасывают микрокапли.
2) Рестрикция
К осадку (1 мкг ДНК) добавляют 18 мкл H2O - осадок растворяют типом (лучше на льду, чтобы не было денатурации ДНК);
- + 2 мкл 10x универсального буфера для рестрикции;
- + 0,2 мкл 100x BSA (5 мг/мл);
- + по 5 единиц рестриктаз;
- инкубируют при 37°C, 2 часа;
- инактивируют рестриктазы при 65°C 10 мин.
4. Совместное переосаждение трех фрагментов кассеты
Объединяют все достроенные и рестриктированные олигонуклеотиды (по 20 мкл) в одном 0,5 мл эппендорфе в общем объеме 60 мкл. Осаждают ДНК с гликогеном (см. выше). Растворяют осадок в 30 мкл H2O (до концентрации 100 нг/мкл).
5. Лигирование трех фрагментов кассеты в одну линейную молекулу (размером ~200 пн)
Готовят смесь:
- фрагменты кассеты (п.3) - 3 мкл (300 нг);
- 10x лигазный буфер фирмы "Promega" - 2 мкл;
- 100x БСА - 0,2 мкл (5 мг/мл);
- H2O - до 20 мкл;
- перемешивают;
- инкубируют при 37°C, 3 мин;
- при t=25°C добавляют 1 мкл T4 ДНК-лигазы (3 ед.);
- инкубируют при +8°C, сутки (ночь);
- фракционируют в 2,5% мини-геле аликвоту 10 мкл (в ожидаемой области должна быть видна слабая полоса 200 пн). Фото геля приведено на Фиг.3.
6. Первая PCR-амплификация на 1 мкл лигазной смеси
Из лигазной смеси (п.5) берут 1 мкл на PCR (в объеме 30 мкл) со следующими параметрами: 95°C-61°C-72°C, 33 цикла.
Фракционируют аликвоту 3 мкл в 2,5% мини-геле (видна минорная полоса 200 пн). Фото геля приведено на Фиг.4.
7. Фракционирование в 2,5% агарозном мини-геле всего PCR-продукта
Фото геля приведено на Фиг.5.
- элюируют полосу 200 пн;
- растворяют элюат в 15 мкл H2O.
8. Вторая PCR-амплификация
7 мкл элюата (п.7) берут на вторую PCR (95°C-61°C-72°C, по 1 мин, 8 циклов).
При фракционировании в 2,5% мини-геле полноразмерная полоса 200 пн видна ярче. Фото геля приведено на Фиг.6.
- элюируют полосу 200 пн;
- растворяют элюат в 20 мкл H2O;
- 10 мкл элюата используют для лигирования в вектор pGemT-easy.
9. Лигирование в вектор pGemT-easy
- H2O - 3,8 мкл
- 10x лигазный буфер ("Promega") - 2 мкл
- 100хБСА - 0,2 мкл
- вектор pGemT-easy (50ng/µl) - 2 мкл (100 ng) (см. физическую карту вектора на Фиг.7)
- элюат - 10 мкл
- 37°C, 3 мин
- при t=25°C +2 мкл лигазы (3 ед./мкл)
- инкубируют при +4°C, сутки (ночь).
10. Приготовление четырех 32P зондов для гибридизации колоний
Зонды готовят, используя 32P-PCR.
1. Общий зонд готовят из смеси достроенных олигонуклеотидов.
2. Смеси 1+2 олигов, 3+4 и 5+6 используют для детекции соответственно первой, второй и третьей шпилек в составе кассеты.
11. Трансформация в клетки E.coli
-10 мкл лигазной смеси используют для трансформации штамма JM109. Посев на 9 см чашки с нижним LB-агаром, содержащим ампициллин (100 мкг/мл), X-Gal (30 мкл 4% р-ра в диметилформамиде)) и IPTG (10 мкл 0,1 М раствора).
12. Переколы колоний и гибридизация
- перекалывают белые колонии (около 100 штук);
- проводят гибридизацию колоний сначала с общим зондом для отбора всех клонов, содержащих вставки, имеющие олигонуклеотиды;
- позитивные клоны перекалывают на три фильтра для гибридизации с тремя отдельными зондами: 1+2; 3+4; 5+6 (для отбора клонов, содержащих все части кассеты);
- отбирают клоны, гибридизующиеся со всеми тремя зондами;
- секвенируют клоны для проверки правильности текстов кассет.
Краткое описание чертежей
На Фиг.1 приведена схема дизайна кассетной конструкции, кодирующей три РНК-шпильки. А - приведены схемы последовательностей, кодирующих отдельные шпильки в составе кассеты. Sense - последовательность ДНК, кодирующая смысловую цепь shPHK, antisense - последовательность ДНК, кодирующая антисмысловую цепь shPHK. Петля - последовательность ДНК, кодирующая одноцепочечную петлю в shPHK. Обозначены введенные в последовательности олигов сайты рестрикции: HindIII, XhoI, BamH1 и EcoR1. Затенены последовательности искусственно синтезированных олигонуклеотидов, использующихся для отжига (размером не более 50 н.). Б - приведены нуклеотидные тексты трех шпилек в составе кассеты, кодирующей анти-HIV-1, анти-HIV-3 и анти-CCR5-8 shPHK. В составе каждой шпильки выделены и обозначены цифрами (1-6) последовательности искусственно синтезированных олигонуклеотидов, использующихся для отжига в процессе получения данной кассетной конструкции. В - отдельно приведены используемые последовательности шести искусственно синтезированных олигонуклеотидов.
На Фиг.2 схематически представлены основные этапы протокола. "s" и "as" обозначают смысловую и антисмысловую цепи в стволах РНК-шпилек, соответственно; "loop" обозначает петлю. Цифрами 1-6 обозначены используемые в данном протоколе олигонуклеотиды.
На Фиг.3 приведены результаты фракционирования лигированного материала. М - маркер ("Promega"); исх. - смесь фрагментов кассеты (п.4); лиг. - аликвота лигазной смеси, полоса размером 200 пн показана стрелкой.
На Фиг.4 приведены результаты фракционирования аликвоты PCR-продукта первой амплификации. М - маркер ("Promega"). PCR - аликвота PCR-продукта первой амплификации, полоса размером 200 пн показана стрелкой.
На Фиг.5. показаны результаты фракционирование всего PCR-продукта первой амплификации. М - маркер ("Promega"). PCR - весь PCR-продукт первой амплификации, полоса размером 200 пн показана стрелкой.
На Фиг.6. показаны результаты фракционирование всего PCR-продукта второй амплификации. М - маркер ("Promega"). PCR - весь PCR-продукт второй амплификации, полоса размером 200 пн показана стрелкой.
На Фиг.7 приведена физическая карта вектора pGem-T Easy. Вектор использовался для промежуточного клонирования вставки с тремя шпилечными районами в ходе создания кассетной генетической конструкции с использованием представленного протокола.
На Фиг.8 приведена физическая карта экспрессирующего вектора GeneClip-U1-neo. Вектор использовался для создания кассетной генетической конструкции, вызывающей РНК-интерференцию, направленную против транскриптов вируса и мРНК CCR5, которая получена с использованием представленного протокола.

Изобретение относится к области молекулярной биологии и генотерапии. Способ предусматривает проведение следующих операций: дизайн кассетной конструкции, синтез олигонуклеотидов; попарный отжиг и достройка частично комплементарных олигонуклеотидов; осаждение и рестрикция фрагментов кассеты подходящими рестриктазами; одновременное лигирование отдельных фрагментов кассеты в одну линейную молекулу; две PCR-амплификации, электрофорез в агарозном мини-геле и электроэлюция; лигирование в вектор pGemT-easy; трансформация и отбор позитивных клонов с помощью colony-гибридизации; секвенирование ДНК плазмидных клонов; переклонирование кассет в вектор для экспрессии. Способ позволяет получить кассетные генетические конструкции, одновременно экспрессирующие несколько shPHK. 8 ил, 1 пр.
Способ получения кассетных генетических конструкций, одновременно экспрессирующих несколько shPHK,
отличающийся тем, что исходные пары олигонуклеотидов, предназначенных для кодирования каждой shPHK, отжигаются только в области петель и проводится две PCR-амплификации, что позволяет обогатиться полноразмерной ДНК, соответствующей кассете,
и представляющий собой следующую последовательность операций:
1) дизайн и синтез перекрывающихся в областях петель нескольких пар олигонуклеотидов, соответствующих каждой отдельной shPHK и имеющих одинаковые тексты (например, текст смысловой цепи кодируемой shPHK), за исключением 5′-концевых сайтов рестрикции и 3′-концевых областей, соответствующих одноцепочечным петлям в составе кодируемой shPHK:

где жирным шрифтом указаны тексты смысловых цепей кодируемых shPHK;
2) попарный отжиг и достройка указанных частично комплементарных олигонуклеотидов, что приводит к получению отдельных фрагментов кассеты по числу кодируемых ею shPHK;
3. осаждение фрагментов ДНК, представляющих отдельные части кассеты, и рестрикция подходящими рестриктазами, которые создают липкие концы, необходимые для лигирования фрагментов кассеты в правильной последовательности;
4) одновременное лигирование отдельных фрагментов ДНК, составляющих кассету, в одну линейную молекулу;
5) две PCR-амплификации лигированной ДНК, электрофорез амплификата в агарозном мини-геле и электроэлюция фрагмента ДНК, соответствующего полноразмерной кассете;
6) лигирование фрагмента ДНК, соответствующего полноразмерной кассете, в вектор pGemT-easy;
7) трансформация и отбор позитивных плазмидных клонов с помощью colony-гибридизации;
8) секвенирование ДНК плазмидных клонов;
9) переклонирование кассет в вектор для экспрессии,
позволяющий в течение 1-2 недель из набора коротких (размером не более 50 н) олигонуклеотидов получить требуемое количество кассетных генетических конструкций в экспрессирующем векторе.
| WO2010140862 A2 09.12.2010 | |||
| Yaowaluck Roshorma et al.: A Simple and Cost Effective Method to Generate | |||
| dsRNA for RNAi Studies in Invertebrates, ScienceAsia 33 (2007): 35-39 | |||
| WO 2010023544 A1 04.03.2010 | |||
| WO 2007010840 A1 25.01.2007 | |||
| Прибор для измерения температуры | 1928 |
|
SU13375A1 |
Авторы
Даты
2014-08-20—Публикация
2012-03-01—Подача