Область изобретения
Настоящее изобретение относится к улучшенному способу очистки даптомицина, представленного химическим наименованием N-деканоил-L-триптофил-D-аспарагинил-L-аспартил-L-треонилглицил-L-орнитил-L-аспартил-D-аланил-L-аспартилглицил-D-серил-трео-3-метил-L-глутамил-3-антранилоил-L-аланин-εI-лактон. Даптомицин можно представить формулой I:
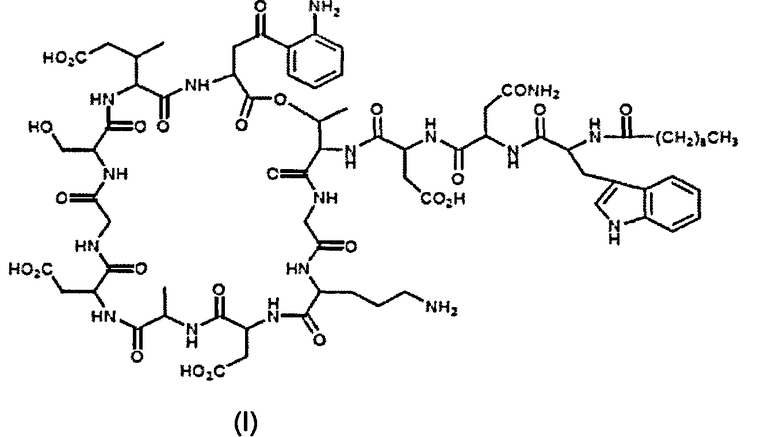
Предшествующий уровень техники
Даптомицин является липопептидным антибиотиком с активностью против грамположительных организмов. Даптомицин получают в ходе ферментации Strepromyces roseospoms и затем очистки ферментативного бульона. Механизм действия даптомицина заключается в том, что он связывается с мембранами бактерий и вызывает быструю деполяризацию мембранного потенциала. Это снижение мембранного потенциала вызывает ингибирование синтеза белка, ДНК и РНК, что приводит к гибели бактериальной клетки. Даптомицин одобрен для сложных инфекций кожи и кожных структур (cSSSI от complicated skin and skin structure infections) и инфекций кровотока Staphylococcus aureus (Золотистого стафилококка) (бактериемия). Cubist Pharmaceuticals продает даптомицин под торговой маркой Кубицин®.
Впервые даптомицин был описан в середине 1980-х годов в некоторых патентах и журналах; US 4,537,717 и Debono M. et al, Journal of Antibiotics, 1986, Vol.XL, No 6, 761-777. После этого было несколько публикаций относительно улучшенных способов ферментации и способов очистки.
В US 4,885,243 описан улучшенный способ ферментации для получения даптомицина. Данный способ описывает введение декановой жирной кислоты, или ее эфира, или солей в ферментативный бульон Strepromyces roseosporus. В ходе ферментации декановая жирная кислота встраивается в молекулу с образованием декановой боковой цепи даптомицина.
В предшествующем уровне техники описано несколько способов очистки даптомицина. В US 4,874,843 описан способ очистки даптомицина, согласно которому ферментативный бульон фильтруют и добавляют в хроматографическую колонку, содержащую смолу HP-20. После элюирования частично очищенный даптомицин пропускают через колонку, содержащую смолу HP-20ss, и затем добавляют в другую колонку, содержащую смолу HP-20. В дополнение к этим стадиям описаны попытки увеличить чистоту с помощью некоторых дополнительных хроматографических стадий без какого-либо успеха. Кроме того, в патенте 4,874,843 указано, что при использовании смолы без функциональных групп и водного раствора и включении стадии, на которой воду удаляют физическим образом, и затем смолу повторно увлажняют полярным органическим растворителем, чистота продукта увеличивается от 80% до 93%. Данный способ занимает много времени и не очень пригоден для промышленного производства.
Патент US RE 39071 описывает две основных примеси, найденные при производстве даптомицина, ангидро-даптомицин и бета-изомер даптомицина. Кроме того, в US RE 39071 заявлено, что используя способ, описанный в примере 1-3, можно получить продукт даптомицина, содержащий менее 6 % двух упомянутых примесей. Пример 3 описывает способ, согласно которому даптомицин промежуточного уровня качества затем очищают способом, включающим четыре хроматографические стадии и дополнительные стадии деминерализации, концентрирования и лиофилизации. На стадиях хроматографирования для промывки и элюирования используется ацетонитрил и, кроме того, этот способ надлежит выполнять с охлажденными растворами и в охлаждаемой комнате.
Патент US 6,696,412 раскрывает способ очистки даптомицина, при котором используют стадию анионообменной хроматографии, где применяют модифицированный буфер для элюирования, и используют стадию микрофильтрации, на которой даптомицин образует мицеллы. В данном патенте описано несколько способов, которые представляют собой комбинацию двух указанных выше стадий в сочетании с другими стадиями очистки, известными квалифицированному специалисту в данной области техники. Высокоочищенный продукт даптомицина определен в патенте как даптомицин с уровнем чистоты 95-97%.
Сущность изобретения
Согласно настоящему изобретению создан улучшенный способ очистки даптомицина, который дает в результате продукт с чистотой по меньшей мере 95%. Описанный способ является более простым чем те способы, что описаны в предшествующем уровне техники, и как описано ниже, исключает чрезмерное использование модифицированных буферов и избавляет от применения ацетонитрила, что благоприятно для окружающей среды.
Согласно способу по изобретению применяются стадии анионообменной хроматографии и обращено-фазовой хроматографии. Кроме того, можно осуществлять стадии обычной фильтрации и лиофилизацию конечного продукта.
Согласно одному воплощению раствор одновалентной соли, используемый в качестве элюирующего буфера на стадиях анионообменной хроматографии, представляет собой раствор хлорида натрия в воде.
Элюирующий буфер стадии б) обращено-фазовой хроматографии в настоящем изобретении представляет собой водный спирт. Предпочтительно водный спирт представляет собой водный этанол. Согласно одному воплощению настоящего изобретения даптомицин элюируют на стадии обращено-фазовой хроматографии, используя элюирующий буфер, содержащий 40-70% этанола в воде.
Настоящее изобретение может быть проиллюстрировано стадиями, приведенными на реакционной схеме 1.
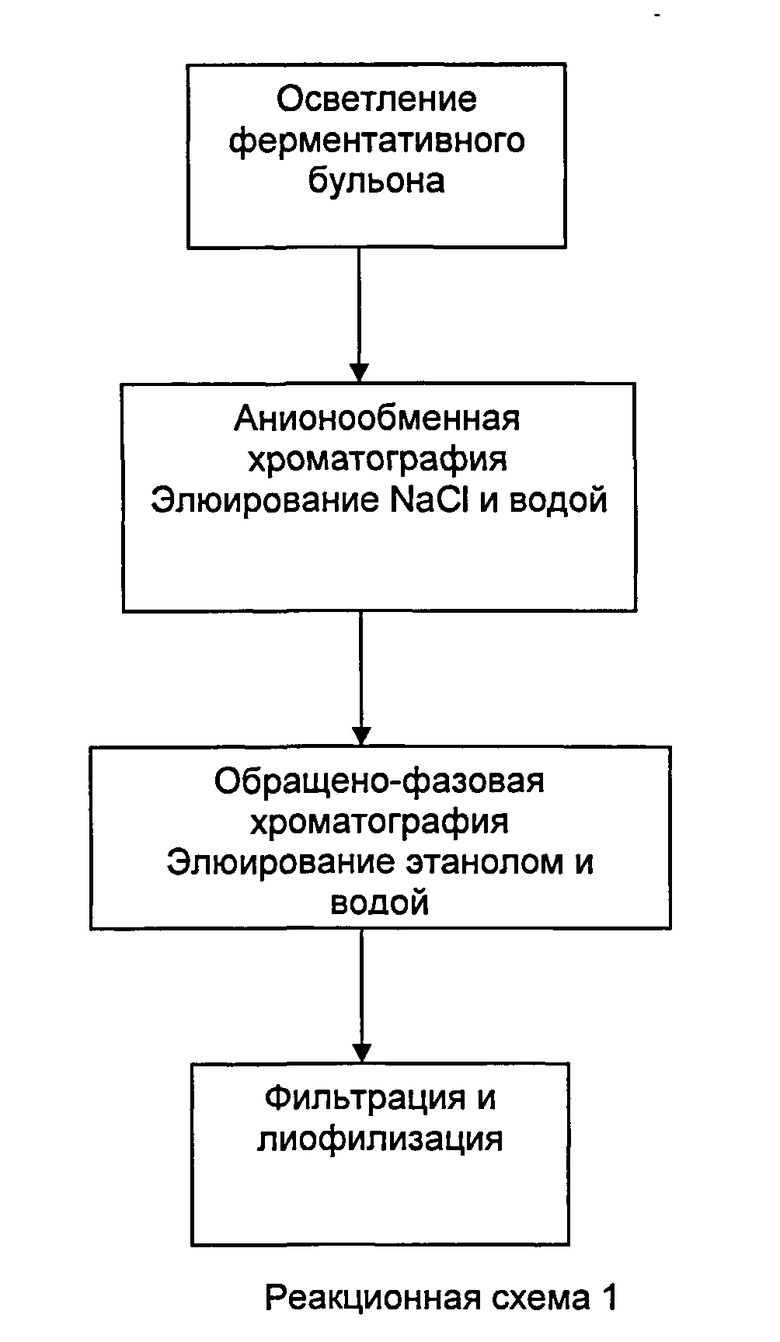
Настоящее изобретение дает в результате продукт даптомицина с итоговой чистотой 95% или более. Количество ангидро-даптомицина изменяется между 0,5-1,5% и количество бета-изомера составляет менее 0,5%.
Согласно данному изобретению создан способ очистки, который проще, чем способы, известные в данной области, в отношении используемых буферов и стадий, что позволяет избежать применения растворителей, которые являются токсичными для окружающей среды. Кроме того, это приводит к очень хорошему отделению и низким уровням двух важнейших примесей: ангидро-даптомицина и бета-изомера даптомицина. Способ по изобретению дает простой процесс очистки, обеспечивающий продукт, который по меньшей мере такой же чистый, как и продукты, описанные в предшествующем уровне техники.
Подробное описание изобретения
Исходное вещество для способа по настоящему изобретению может быть получено способом, описанным в US 4,885,243, где жирная кислота, которую вводят, представляет собой декановую кислоту.
Согласно настоящему изобретению даптомицин очищают, используя в качестве первой стадии анионную хроматографию и затем в качестве второй стадии обращено-фазовую хроматографию.
Ферментативный бульон, используемый в качестве исходного вещества по настоящему изобретению, может быть предварительно обработан до указанных хроматографических стадий для удаления больших частиц и биомассы.
В качестве способа предварительной обработки ферментативный бульон, используемый в качестве исходного вещества по настоящему изобретению, может быть пропущен через одну или более стадий осветления. Квалифицированному специалисту в данной области известны различные пригодные стадии осветления. Неограниченные примеры стадий осветления, пригодных для предварительной обработки ферментативного бульона по настоящему изобретению, представляют собой обратный осмос, центрифугирование, ультрафильтрацию, микрофильтрацию, нанофильтрацию и диафильтрацию. Для осветления возможно использовать даже стадию анионного обмена с высокопористой смолой.
Следует понимать, что различные сочетания способов осветления, хорошо известных квалифицированному специалисту, могут быть использованы согласно настоящему изобретению для предварительной обработки ферментативного бульона перед дальнейшей очисткой даптомицина с помощью анионообменной хроматографии и обращено-фазовой хроматографии.
Осветленный ферментативный бульон добавляют в анионообменную колонку. Согласно настоящему изобретению можно использовать как сильные анионообменные смолы, такие как Capto Q, Q Sepharose XL, Q Sepharose FF, Source 15 Q, Source 30 Q или Macroprep High Q, или эквиваленты, так и слабые анионообменные смолы, такие как имеющиеся в продаже смолы DEAE Sepharose PF (диэтиламинозтил сефароза), ANX Sepharose FF, Source 15 Q. Предпочтительной смолой является в высокой степени поперечно-сшитая агарозная смола с декстрановым поверхностным наполнителем, подобная имеющейся в продаже смоле Capto Q. После загрузки осветленного раствора колонку промывают водой.
Элюирующий буфер стадии а) анионообменной хроматографии в настоящем способе представляет собой раствор одновалентной соли. Указанной одновалентной солью может быть, например, хлорид, такой как NaCl или KCl. Также могут быть использованы другие одновалентные соли, такие как одновалентные соли ацетата, такие как ацетат натрия.
Согласно одному воплощению даптомицин может быть элюирован из колонки с помощью градиента NaCl в воде с градиентом от 0,1 М NaCl до 1,5 М NaCl, предпочтительно от 0,2 М NaCl до 1,0 М NaCl.
Частично очищенный даптомицин затем добавляют в обращено-фазовую колонку. Предпочтительной обращено-фазовой смолой является пористая смола однородного размера, полученная из полистирола и дивинилбензола, подобная имеющейся в продаже смоле Source PRC 30, SP20ss, HP20ss или эквивалентным типам смол на основе полистирола. Затем раствор даптомицина вводят в колонку, колонку промывают водой, содержащей 15% спирт, такой как 15% этанол.
Даптомицин может быть элюирован водным спиртом, например С1-С3 алкильным спиртом, таким как метанол, этанол или изопропанол. Согласно одному воплощению настоящего изобретения даптомицин элюируют из обращено-фазовой колонки, используя этанол в качестве элюирующего растворителя.
Даптомицин согласно одному воплощению элюируют из обращено-фазовой колонки с помощью градиента этанола в воде. Градиент составляет 5-80% этанола и предпочтительно 40%-70% этанола.
В одном предпочтительном воплощении изобретения существует дополнительная стадия обращено-фазовой хроматографии. Предпочтительное воплощение изобретения состоит в пропускании через две обращено-фазовые колонки при разных pH для улучшения чистоты продукта. В одном предпочтительном воплощении первую колонку проходят при нейтральном pH и вторую колонку проходят при кислом pH. Не является существенным порядок прохождения двух обращено-фазовых хроматографических стадий в отношении pH. Первая колонка может быть пройдена при кислом pH и вторая при нейтральном pH, или наоборот.
Согласно одному воплощению изобретения первую обращено-фазовую хроматографическую колонку элюируют при pH 6,5-8,5, предпочтительно при pH 7,5-8,0. Согласно другому воплощению изобретения вторую обращено-фазовую хроматографическую колонку элюируют при pH 2,5-3,5, предпочтительно при pH 3,0-3,1.
Колонка, которая используется на стадии обращено-фазовой хроматографии в способе по настоящему изобретению, может представлять собой смолу на основе стирола, такую как имеющаяся в продаже смола Source 30RPC. Также могут быть использованы другие эквивалентные смолы для обращено-фазовой хроматографии, такие как SP20ss, HP20ss или эквивалентные типы смол на основе полистирола, известные квалифицированному специалисту.
Очищенный даптомицин затем фильтруют и лиофилизируют при стандартных условиях. Конечный очищенный даптомицин имеет чистоту по меньшей мере 95%.
Экспериментальная часть
Пример 1
После осветления раствор частично очищенного даптомицина загружали в анионообменную колонку. Исходное вещество осветляли диафильтрацией.
Очистка с помощью ионообменной хроматографии:
Диафильтрованный даптомицин загружали в анионообменную колонку, смола Capto Q.
Буферы следующего состава готовили в отдельных сосудах:
Доводили pH исходного раствора до 6-8 с помощью разбавленного NaOH перед загрузкой. Даптомицин связывался со смолой при максимальной емкости 20 г/л смолы. После связывания со смолой связанные с ферментацией примеси сначала вымывали буфером 1, а затем буфером 2.
Элюирование и повторное получение даптомицина проводили в изократическом режиме с буфером 3. После элюирования колонку десорбировали с буфером 4, чтобы удалить оставшийся даптомицин или сильно связанные примеси.
Даптомицин собирали, исходя из объема около 5 - 10 BV (объем пропущенного раствора, отнесенный к объему сорбента).
Обращено-фазовая хроматография I (ОФХ I):
Даптомицин очищали с помощью ВЭЖХ, используя смолу Source 30RPC на основе стирола.
Буферы для этой стадии готовили в отдельных сосудах:
Даптомицин очищали при нейтральном pH (pH 7,5-8,0). Сначала колонку уравновешивали с буфером 1. Даптомицин загружали в колонку (максимальная степень загрузки <30 г/л смолы) перед тем, как менее гидрофобные примеси вымывали (главным образом продукты распада), используя буфер 2.
Затем даптомицин повторно извлекали с помощью градиентного элюирования от 15 до 60% этанола (градиентное смешивание буфера 1 с 2) по 12-16 BV. Даптомицин собирали, исходя из УФ сигнала.
Обращено-фазовая хроматография II:
Исходя из чистоты, фракции собирали и объединяли с полученными на первой стадии обращено-фазовой хроматографии (ОФХ I) и доводили pH до 3,0-3,1 с уксусной кислотой при быстром перемешивании для предотвращения выпадения в осадок даптомицина в сосуде.
Буферы для этой стадии готовили в отдельных сосудах:
Раствор даптомицина с достигнутым pH загружали в колонку (максимальная степень загрузки <30 г/л смолы) и менее гидрофобные примеси вымывали буфером 1. Элюирование и повторное извлечение даптомицина проводили, используя градиент этанола от 35% до 70%, смешивая буфер 2 и 3, по 8-12 BV.
Даптомицин собирали, исходя из УФ-сигнала.
Пример 2
Чтобы осветлить ферментативный бульон использовали несколько способов осветления. Во-первых, ферментативный бульон центрифугировали для удаления больших частиц и биомассы. pH ферментативного бульона составлял 6,4, а сухой материал (СМ) составлял около 6-7%. После центрифугирования надосадочная жидкость содержала только 3% СМ. Затем надосадочную жидкость дополнительно предварительно фильтровали через 25-100 мкм фильтр, чтобы удалить частицы больше, чем 25-100 мкм.
Центрифугированный и предварительно фильтрованный раствор затем ультрафильтровали через фильтр Pellicon 2, 500 кДа (Millipore) для удаления больших молекул. После ультрафильтрации раствор сверхконцентрировали в ходе нанофильтрации. Используемый фильтр был DL-серии, 350 Да (GE Osmonics). Концентрат содержал 5 г/л даптомицина и имел pH 6.
Затем концентрат очищали на анионообменной хроматографической колонке согласно настоящему изобретению. Используемая смола представляла собой Capto Q (90 мкм) от GE Healthcare. При необходимости рН концентрата доводили до 6 с NaOH перед загрузкой его в колонку. Затем концентрат загружали в колонку, колонку промывали водой и даптомицин элюировали ступенчатым градиентом NaCl. Элюирующие растворы содержали 0,2 М, 0,4 М и 1,0 М NaCl в воде. Объединенные фракции из анионообменной колонки содержали около 2,5 г/л даптомицина.
Объединенные фракции из анионообменной колонки затем загружали в первую обращено-фазовую хроматографическую колонку (ОФХ I). Используемая смола представляла собой Source 30RPC (30 мкм) от GE Healthcare. После загрузки колонку промывали водой и элюировали градиентом 20-50% этанола при pH 7-8. Пул фракций на этой стадии содержал около 6 г/л даптомицина.
Затем этот пул фракций загружали во вторую обращено-фазовую колонку с той же самой смолой. После загрузки раствора даптомицина из предыдущей обращено-фазовой колонки колонку промывали водой и даптомицин элюировали градиентом 20-50% этанола при pH 3,0. Пул фракций на этой стадии содержал около 8 г/л даптомицина.
Затем раствор даптомицина подвергали стадии нанофильтрации с 350 Да мембраной DL-серии от GE Osmonics.
После нанофильтрации раствор даптомицина лиофилизировали при стандартных условиях.
Чистота конечного продукта находится в пределах 95-97%.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЧИСТКИ ЛИПОПЕПТИДА (ВАРИАНТЫ), АНТИБИОТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ОЧИЩЕННОГО ЛИПОПЕПТИДА (ВАРИАНТЫ) | 2001 |
|
RU2311460C9 |
| СПОСОБ НЕПРЕРЫВНОЙ МНОГОСТАДИЙНОЙ ОЧИСТКИ АНТИТЕЛ | 2014 |
|
RU2662668C2 |
| УЛУЧШЕНИЕ АФФИННОЙ ХРОМАТОГРАФИИ ИММУНОГЛОБУЛИНОВ ПУТЕМ ПРИМЕНЕНИЯ ФЛОКУЛЯЦИИ ДО ЗАХВАТА | 2020 |
|
RU2794431C1 |
| УЛУЧШЕННЫЕ СПОСОБЫ ОЧИСТКИ ВЕКТОРОВ НА ОСНОВЕ РЕКОМБИНАНТНОГО AAV | 2010 |
|
RU2588387C2 |
| СПОСОБ ПРОИЗВОДСТВА ФАКТОРА VIII, ИМЕЮЩЕГО УЛУЧШЕННОЕ СООТНОШЕНИЕ FVIII:C/FVIII:Ag | 2015 |
|
RU2695428C2 |
| СПОСОБ ОЧИСТКИ БЕЛКА СЛИЯНИЯ | 2015 |
|
RU2698654C2 |
| СПОСОБ ОЧИСТКИ БЕЛКА ФАКТОРА РОСТА | 2011 |
|
RU2571926C2 |
| СПОСОБ ОЧИСТКИ ФАКТОРА СВЕРТЫВАНИЯ КРОВИ VIII | 2009 |
|
RU2698392C2 |
| КОЛОНОЧНЫЕ СПОСОБЫ ОЧИСТКИ ВЕКТОРА НА ОСНОВЕ AAV | 2018 |
|
RU2772876C2 |
| СПОСОБ ОЧИСТКИ ФАКТОРА СВЕРТЫВАНИЯ КРОВИ VIII | 2009 |
|
RU2567811C2 |
Изобретение относится к способу очистки даптомицина, включающий стадии а) загрузки частично очищенного даптомицина в анионообменную хроматографическую колонку и последующие стадии очистки б) и в) в обращено-фазовых хроматографических колонках, где элюирующий буфер на стадии а) представляет собой раствор одновалентной соли и элюирующий буфер на стадии б) и в) представляет собой водный спирт. 3 н. и 13 з.п. ф-лы, 2 пр.
1. Способ очистки даптомицина, включающий стадии, на которых
а) загружают раствор, содержащий частично очищенный даптомицин, в анионообменную хроматографическую колонку и элюируют первый элюат первым элюирующим буфером, где частично очищенный даптомицин возможно очищают из ферментативного бульона, содержащего даптомицин, с использованием одной или нескольких стадий осветления;
б) загружают первый элюат со стадии а) в обращено-фазовую хроматографическую колонку и элюируют второй элюат вторым элюирующим буфером с pH 6,5-8,5;
в) загружают второй элюат со стадии б) во вторую обращено-фазовую хроматографическую колонку и элюируют третий элюат третьим элюирующим буфером с pH 2,5-3,5; и
г) возможно фильтруют и лиофилизируют третий элюат,
где первый элюирующий буфер в а) представляет собой раствор одновалентной соли и второй и третий элюирующий буфер в б) и г) представляет собой водный спирт.
2. Способ по п.1, где продукт стадии в) обращено-фазовой хроматографии дополнительно очищают в ходе одной или нескольких стадий фильтрации.
3. Способ по п.2, где продукт обращенной фазы дополнительно подвергают стадии лиофилизации.
4. Способ по п.1, где одновалентная соль первого элюирующего буфера в а) представляет собой NaCl.
5. Способ по п.4, где элюирующий буфер представляет собой 0,1-1,5 М NaCl.
6. Способ по п.1, где элюирующий буфер в б) представляет собой водный этанол.
7. Способ по п.6, где элюирующий буфер представляет собой 5-80% этанол.
8. Способ по п.1, где стадию анионообменной хроматографии осуществляют, используя в высокой степени поперечно-сшитую агарозную смолу с декстрановым поверхностным наполнителем.
9. Способ по п.1, где стадию обращено-фазовой хроматографии осуществляют, используя колонку со смолой на основе стирола.
10. Способ очистки даптомицина, включающий стадии, на которых
а) подвергают ферментативный бульон, содержащий даптомицин, одной или нескольким стадиям осветления с получением раствора;
б) загружают раствор со стадии а) в анионообменную хроматографическую колонку и элюируют первый элюат первым элюирующим буфером;
в) загружают раствор со стадии б) в первую обращено-фазовую хроматографическую колонку и элюируют второй элюат вторым элюирующим буфером с pH 6,5-8,5;
г) загружают второй элюат со стадии в) во вторую обращено-фазовую хроматографическую колонку и элюируют третий элюат третьим элюирующим буфером с pH 2,5-3,5;
д) подвергают третий элюат со стадии г) одной или нескольким стадиям фильтрации с получением фильтрата; и
е) подвергают фильтрат д) лиофилизации, получая в результате очищенный порошок даптомицина,
где первый элюирующий буфер в б) представляет собой раствор одновалентной соли и второй и третий элюирующий буфер в в) и г) представляет собой водный спирт.
11. Способ по п.10, где стадии осветления в а) представляют собой одну или комбинацию следующих методик: обратный осмос, центрифугирование, фильтрация, ультрафильтрация, нанофильтрация, анионообменная хроматография.
12. Способ по п.10, где элюирующий раствор в б) представляет собой NaCl.
13. Способ по п.12, где элюирующий буфер представляет собой 0,1-1,5 М NaCl.
14. Способ по п.10, где элюирующий буфер в в) представляет собой водный этанол.
15. Способ по п.14, где элюирующий буфер представляет собой 5-80% этанол.
16. Способ очистки даптомицина, включающий стадии, на которых
а) загружают раствор, содержащий частично очищенный даптомицин, в анионообменную хроматографическую колонку и элюируют первый элюат первым элюирующим буфером, где частично очищенный даптомицин возможно очищают из ферментативного бульона, содержащего даптомицин, с использованием одной или нескольких стадий осветления;
б) загружают первый элюат со стадии а) в обращено-фазовую хроматографическую колонку и элюируют второй элюат вторым элюирующим буфером с pH 2,5-3,5;
в) загружают второй элюат со стадии б) во вторую обращено-фазовую хроматографическую колонку и элюируют третий элюат третьим элюирующим буфером с pH 6,5-8,5; и
г) возможно фильтруют и лиофилизируют третий элюат,
где первый элюирующий буфер в а) представляет собой раствор одновалентной соли и второй и третий элюирующий буфер в б) и г) представляет собой водный спирт.
| СПОСОБ ОЧИСТКИ ЛИПОПЕПТИДА (ВАРИАНТЫ), АНТИБИОТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ОЧИЩЕННОГО ЛИПОПЕПТИДА (ВАРИАНТЫ) | 2001 |
|
RU2311460C9 |
| CN 101899094 A, 01.12.2010 | |||
| Прибор для определения кривизны скважин | 1930 |
|
SU21978A1 |
| Деревянный торцевой шкив | 1922 |
|
SU70A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2014-08-20—Публикация
2010-02-19—Подача