Настоящее изобретение касается способа очистки фактора свертывания крови VIII (далее используют аббревиатуру FVIII) и фракции, содержащей FVIII, которая может быть получена в соответствии со способом настоящего изобретения.
Предпосылки к созданию изобретения
Гемофилия представляет собой группу наследственных генетических расстройств, которые ослабляют способность организма контролировать свертывание крови или коагуляцию. В наиболее общей форме, при гемофилии A наблюдается дефицит свертывания FVIII, и гемофилия A встречается у приблизительно 1 из 5000-10000 родившихся мальчиков. Белок FVIII является важнейшим кофактором при коагуляции крови, который обладает способностью выполнять множество функций. Дефицит FVIII можно устранять с помощью выделенных из плазмы концентратов FVIII или с помощью FVIII, полученного рекомбинантными методами. Лечение с помощью концентратов FVIII позволяет больным гемофилией вести нормальный образ жизни. Исторически гемофилию A лечили с помощью FVIII, полученного из плазмы крови человека. В плазме крови при нормальных условиях молекула FVIII всегда связывается с ее кофактором, фактором Виллебрандта (vWf), который придает молекуле FVIII устойчивость к различным формам дегенерации.
На рынке появились выделенные из плазмы продукты на основе FVIII различной степени чистоты, в которых присутствуют бóльшие или меньшие количества vWf. Как правило, продукты с небольшими количествами vWf содержат добавленный альбумин человека или другие стабилизаторы, в том числе включают повышенное содержание соли для стабилизации молекулы FVIII. Способы, которые используют для очистки FVIII, обычно представляют собой сочетание различных способов осаждения, таких как криоосаждение, осаждение с помощью гидроксида алюминия и т.п., а также хроматографические стадии, в основном стадии ионообменной хроматографии, аффинной хроматографии и гель-хроматографии.
Для улучшения продуктов на основе FVIII применяли аффинную хроматографию, которая эффективно удаляет примеси и позволяет получить FVIII высокой степени чистоты, в том числе позволяет снизить и содержание vWf (Farrugia et al., Biotechnology and plasma fractionation industry; The impact of advances in the production of coagulation FVIII. Biotechnology, Vol. 3, No. 1, February 1993). Недостаток аффинной хроматографии заключается в том, что она является сравнительно дорогостоящей, а также в том, что моноклональные антитела, которые используют в качестве аффинных лигандов, имеют животное происхождение.
В середине 80-х годах наблюдались случаи переноса вирусов, связанные с продуктами на основе FVIII, выделенными из плазмы. Несмотря на то, что указанная проблема была решена за счет применения специфических стадий удаления вируса, она явилась толчком для разработки рекомбинантных продуктов на основе FVIII (rFVIII). В 90-е годы на рынке появился первый продукт на rFVIII, и в настоящее время на рынке имеются три различных продукта rFVIII (две полноразмерные молекулы и одна молекула с удаленным B-доменом, в которой неактивная часть молекулы FVIII удалена, с целью повысить продуктивность клетки-хозяина (Eriksson et al., The manufacturing process for B-domain deleted recombinant FVIII. Seminars in Hematology, Vol. 38, No 2, Suppl. 4 (April), 2001: pp. 24-31)) высокой степени чистоты (все без vWf).
Все способы очистки, которые используют для очистки rFVIII, представляют собой сочетание различных методов хроматографии (см. Bhattacharyya et al., обзорная статья; Recombinant FVIII for Haemophilia "An overview of production technologies". CRIPS Vol.4, No.3, July-September 2003). Одним из них является хорошо известный иммуноаффинный метод (даже имеются вещества, позволяющие решить указанную проблему, например, вещества, обладающие сродством к пептидам (Kelly et al., Development and validation of an affinity chromatography step using a peptide ligand for cGMP production of FVIII.), или выделенные из дрожжей фрагменты антител (FVIII аффинная смола VIIISelect - GE Health сare, каталожный № 17-5450, которая уже поступает на рынок), применяемые для FVIII, выделенного из плазмы.
Поскольку во всех продуктах rFVIII отсутствует vWf, то определенные меры должны быть предприняты для стабилизации молекулы FVIII с тем, чтобы она не теряла своей активности (стабилизации от агрегации, от протеаз, от абсорбции на поверхности и т.д.). В один из продуктов добавляют хелатообразующий агент (ЭДТК и т.п.) с тем, чтобы защитить FVIII от разложения под действием металлопротеаз (US-A-5831026). Стратегиями, которые были опробованы для повышения устойчивости молекул rFVIII, являются добавление альбумина, апротинина, инсулина или даже совместная экспрессия rFVIII с vWf (с последующим его удалением на стадии очистки) (см. Bhattacharyya et al., обзорная статья; Recombinant FVIII for Haemophilia "An overview of production technologies". CRIPS Vol. 4, No. 3, July-September 2003).
Другая стратегия (для разработки процесса, в котором не используются добавки, полученные от млекопитающих, и хелатообразующие агенты) приводится в EP-A-1707634, где сочетание повышенного содержания солей приводит к стабилизации получаемого rFVIII и увеличению его выхода (Wang et.al, Coagulation FVIII, structure and stability. International Journal of Pharmaceuticals, 259 (2003), 1-15.). Однако указанный метод имеет определенные недостатки. Например, относительно высокое содержание соли делает указанным способ непригодным для проведения прямой обработки в ионообменнике без разбавления (и возможной дестабилизации, см. Parti et al., In vitro stability of recombinant FVIII. Haemophilia (2000), 6, 513-522. Biotechnology and Bioengineering, Vol. 87, No. 3, Aug 5, 2004.).
В WO-A-2009/007451 раскрывается способ очистки FVIII с использование полимера со смешанной модальностью или многомодальной смолы. Способ очистки основан на взаимодействии белка FVIII со смолой со смешанной модальностью или многомодальной смолой, содержащей лиганды, которые включают гидрофобную часть и отрицательно заряженную часть, и элюировании указанного белка FVIII с помощью элюирующего буфера, который включает, по крайней мере, 1,5 М соли, по меньшей мере, 40% (масс./об.) этиленгликоля, пропиленгликоля или их смеси и ионы кальция.
В EP-A-1707634 раскрывается способ выделения белков, полученных рекомбинантными методами, в том числе такие способы, как иммуноаффинная хроматография, аффинная хроматография, осаждение белка, буферные обмены, ионообменная хроматография, хроматография с гидрофобными взаимодействиями, смешанная хроматография с гидрофобными взаимодействиями/ионообменная хроматография, хроматография с хелатообразованием, углеводная аффинная хроматография, такая как лектиновая или гепариновая аффинная хроматография, эксклюзионная хроматография, электрофорез, диализ, использование различных осадителей, таких как полиэтиленгликоль, сульфат аммония, этанол, адсорбция на гидроксиапатите, адсорбция на фильтрующих мембранах, применение лигандов, связанных с магнитными частицами, и т.д. Тем не менее, он идентифицирует конкретные стадии хроматографической очистки.
В WO-A-2005-082483 раскрыт способ очистки антител от одной или более примесей в жидкости, который включает приведение указанной жидкости в контакт с первой хроматографической смолой, состоящей из основы, на которую иммобилизованы многомодальные лиганды, с целью абсорбции антител смолой, при этом каждый многомодальный лиганд содержит, по меньшей мере, одну катионообменную группу и, по меньшей мере, одну ароматическую или гетероароматическую циклическую систему. Чтобы высвободить антитела из смолы, добавляют элюат, и полученный элюат вводят в контакт со второй хроматографической смолой.
В WO-A-2005/121163 раскрыт способ выделения одного или нескольких белков из раствора белка. Способ включает стадию получения раствора белка, содержащего один или более специфичных белков и имеющего заранее заданную величину рН и заранее заданную ионную силу или проводимость, стадию нанесения указанного раствора белка на насадочную колонку или расширенную насадочную колонку, содержащую адсорбент, и получение одного или более белков с колонки; где в белковый раствор добавлен спирт.
Описание изобретения
Одной из целей настоящего изобретения является устранение недостатков известного из области техники способа очистки за счет разработки нового способа. Другой целью настоящего изобретения является способ очистки FVIII, в частности, получаемого из источников, которые содержат много соли, в частности, в том виде, в каком они используются для приготовления рекомбинантного FVIII.
Указанные цели достигаются в способе очистки фактора свертывания крови FVIII за счет проведения последовательности стадий очистки с помощью хроматографии, при этом, по крайней мере, одну операцию хроматографии осуществляют с использованием многомодальной смолы. Термин “многомодальная смола” в настоящем описании означает применяемое в хроматографии вещество, включающее основу и присоединенные в основе функциональные группы, при этом указанные функциональные группы взаимодействуют с химическими группами соединения, которое необходимо выделить. В конкретном варианте осуществления настоящего изобретения многомодальная смола включает присоединенные к матрице функциональные группы, и указанные функциональные группы способны взаимодействовать с FVIII путем ионных взаимодействий и других типов взаимодействий, таких как образование водородных связей и/или гидрофобное взаимодействие.
В соответствии с настоящим изобретением, предлагается способ очищения или обогащения фактора свертывания крови FVIII с использованием хроматографии, который включает стадии обеспечения фракции, содержащей FVIII, в водном растворе с высокой ионной силой; приведения фракции, содержащей FVIII, в контакт с многомодальной смолой; необязательного промывания многомодальной смолы, на которую абсорбирован FVIII, водным промывочным буфером; элюирования содержащих FVIII фракций водным элюирующим буфером, содержащим, по крайней мере, одну аминокислоту, которая положительно заряжена при рН 6-8; и необязательно сбор содержащих FVIII фракций в очищенной или обогащенной форме.
Многомодальная (или смешанная) хроматография представляет собой инструментарий для очистки белков. Она описана, например, в спецификации компании GE Health Care (11-0035-45AA) для Capto Adhere, спецификации компании GE Health Care (28-9078-88AA) для Capto MMC и патентной заявке EP 07114856.3 "A process for the isolation and purification of a target protein, free of prion proteins".
Указанные способы обладают определенными преимуществами и недостатками. Одним из преимуществ является возможность связывать белки в среде с большой концентрацией соли, по сравнению с той, которая часто используется при проведении обменной хроматографии. Недостаток заключается в том, что элюирование часто включает использование относительно жестких условий, таких как, например, рН меньше или больше нейтрального значения рН, как индивидуально, так и в сочетании с другими параметрами элюирования. FVIII является относительно нестойким белком, например, по отношению к значениям рН за пределами нейтрального значения; рН 6-8 (Wang et. al., Coagulation FVIII, structure and stability. International Journal of Pharmaceuticals, 259 (2003), 1-15.). Настоящее изобретение решает указанную проблему путем проведения элюирования в мягких условиях при рН, близком к нейтральному, что позволяет сохранить активность молекулы FVIII и облегчает применение многоодальной хроматографии в сочетании со стабилизирующим действием повышенной концентрации соли, что описано, например, в EP-A-1707634.
В соответствии с одним вариантом осуществления настоящего изобретения, многомодальную хроматографию можно провести на хроматографической колонке. Ее можно рассматривать как первый этап захвата. Способ по настоящему изобретению можно также осуществить как порционный процесс. Настоящее изобретение также облегчает процесс очистки без добавления полученных от человека или животного стабилизирующих добавок и позволяет провести процесс, вовсе их не используя (иммуноаффинные смолы на основе моноклональных антител). Использование многомодальной смолы, в частности, как стадии захвата, обеспечивает также более сильное связывание по сравнению с обычными ионообменными смолами, что приводит к получению на этой стадии продукта в виде более концентрированного элюата, что оказывает благоприятное влияние на устойчивость продукта.
Способ настоящего изобретения в общем случае относится к очистке рекомбинантного FVIII (rFVIII), в частности, рекомбинантного FVIII, у которого удален В-домен.
Как правило, раствор содержит FVIII в растворе с большой концентрацией соли, соответствующей проводимости в диапазоне от приблизительно 25 до приблизительно 200 мС/см при 25°С.
В другом варианте осуществления настоящего изобретения FVIII наносят на многомодальную смолу, и после связывания с многомодальной смолой проводят последующее элюирование с использованием подходящего буфера.
После нанесения смеси, содержащей FVIII, и связывания FVIII с многомодальной смолой молекулу FVIII элюируют из многомодальной смолы с помощью элюирующего буфера, содержащего, по крайней мере, одну аминокислоту, которая положительно заряжена при рН 6-8, и, в частности, аминокислотой, которая положительно заряжена при рН 6-8, является лизин, аргинин и/или гистидин.
Кроме того, буфер может включать, по крайней мере, одно органическое соединение, содержащее гидроксильную группу, такое как спирт, по крайней мере, одно органическое соединение, содержащее аминогруппу, такое как аминокислота, источник ионов Ca2+, по крайней мере, одно соединение для регулирования ионной силы буфера, такое как неорганические соли, например, NaCl, в частности, с концентрацией ≤ 1 М, неионогенный детергент и буферное вещество для поддержания рН в диапазоне от приблизительно 6 до приблизительно 8, в частности, для поддержания приблизительно нейтрального значения рН.
В еще одном варианте осуществления настоящего изобретения спирт может быть выбран из группы, включающей метанол, пропанол и этиленгликоль; аминокислота может быть выбрана из группы, включающей аргинин, лизин и гистидин; источником Ca2+ может быть CaCl2; неорганические соли могут быть выбраны из группы, включающей KCl и NaCl; неионогенный детергент может быть выбрано из группы, включающей Tween 20, Tween 80 и Pluronic F68; буферное вещество может быть выбрано из группы, включающей цитрат натрия, гистидин, HEPES, MES и ацетат натрия при рН 6-8.
В частности, концентрация аминокислоты, которая положительно заряжена при рН 6-8, составляет, по меньшей мере, >0,4 М, в частности, >0,5 М. Если использовать концентрацию конкретной аминокислоты больше, чем 1 М, то дальнейших преимуществ не наблюдается. Как правило, количество аргинина находится в диапазоне от приблизительно 0,4 М до приблизительно 1 М, в частности, в диапазоне от приблизительно 0,7 М до приблизительно 0,9 М. Органическое соединение, содержащее гидроксильную группу, такое как спирт, например, этиленгликоль, содержится, в частности, в количестве от 0% (об./об.) до 30% (об./об.), в частности, от приблизительно 5% до 15%. Концентрация ионов кальция должна быть в диапазоне от 0,0001 М до приблизительно 0,1 М, в частности, от приблизительно 0,001 М до приблизительно 0,03 М. Концентрация соединения для регулирования ионной силы буфера должна быть в таком диапазоне, чтобы обеспечивалась проводимость от приблизительно 15 до приблизительно 200 мС/см при 25°С. Количество неионогенного детергента, как правило, составляет от приблизительно 0,001% до 1%.
В одном варианте осуществления настоящего изобретения многомодальную смолу обрабатывают промывочным буфером. Его используют для того, чтобы вымыть примеси и сохранить FVIII прежде, чем FVIII будет высвобожден.
В еще одном варианте осуществления настоящего изобретения используемая “многомодальная” хроматографическая смола включает, по крайней мере, один из следующих фрагментов:
i) положительно заряженный лиганд N-бензил-N-метилэтаноламин,
ii) отрицательно заряженный лиганд 2-(бензоиламино)бутановую кислоту,
iii) фенилпропильный лиганд,
iv) N-гексильный лиганд,
v) 4-меркаптоэтилпиридиновый лиганд,
vi) лиганд 3-((3-метил-5-((тетрагидрофуран-2-илметил)амино)фенил)амино)бензойную кислоту, или их сочетания.
В частности, в способе настоящего изобретения “многомодальная” хроматографическая смола выбрана из следующих коммерчески доступных смол HEP Hypercel™; PPA Hypercel™; Capto Adhere™; Capto MMC™; MEP Hypercel™.
В другом варианте осуществления настоящего изобретения стадию многомодальной хроматографии комбинируют со стадией аффинной хроматографии FVIII, где аффинность обеспечивает белковый лиганд, такой как фрагмент антитела, который экспрессируется в дрожжах.
В соответствии со способом настоящего изобретения, последовательность операций очистки включает также стадии удаления/инактивации патогенов, которые представляют собой стадию инактивации с использованием химических реагентов, стадию отделения по размерам, хроматографические стадии или их комбинации, которые основаны на различных физиологических свойствах, нацеленных против удаляемого патогена.
В конкретном варианте осуществления способа по настоящему изобретению последовательность операций очистки включает также следующие стадии:
i. использование анионной мембраны, такой как Sartobind Q, в частности, для уменьшения содержания ДНК;
ii. катионная многомодальная смола, такая как Capto MMC;
iii. катионообменная смола, такая как SP Sepharose FF;
iv. использование второй анионной мембраны, такой как Sartobind FF, в частности, для дальнейшего уменьшения содержания ДНК;
v. стадия инактивации с использованием химических реагентов для вирусов с липидной оболочкой, в частности, стадия инактивирующей обработки типа “растворитель/детергент” с использованием три-н-бутилфосфата и Triton X-100, как раскрыто в EP-A-131740;
vi. аффинная смола на основе белкового лиганда, который экспрессируется в дрожжах, такая как VIIISelect, или анионная многомодальная хроматографическая смола, такая как Capto Adhere;
vii. стадия удаления патогенов путем фильтрации с использованием фильтра со средним размером пор приблизительно 20 нм, такого как Planova 20N;
viii. анионообменная смола, такая как Q Sepharose FF;
ix. смола для эксклюзионной хроматографии, такая как Superdex 200pg.
В частности, в способе настоящего изобретения условия элюирования на стадии катионного обмена основаны на использовании ионов Ca2+, концентрация которых находится в диапазоне 0,15-0,25 M, а общая проводимость элюирующего буфера не превышает 25 мС/см при 25°С.
При осуществлении способа настоящего изобретения чистота получаемого продукта составляет >4000 IU/мг, после последней стадии очистки предпочтительно составляет >9000 IU/мг и более предпочтительно >10000 IU/мг белка, а содержание примеси ДНК составляет <1000 пг/1000 IU FVIII, предпочтительно <100 пг/1000 IU FVIII и более предпочтительно <10 пг/1000 IU FVIII.
Кроме того, целью настоящего изобретения является композиция вещества, при этом композиция вещества содержит очищенный рекомбинантный FVIII, который может быть получен способом по настоящему изобретению (без добавления или использования любых добавок человеческого или животного происхождения, таких как альбумин или иммуноаффинные лиганды на основе моноклонального антитела).
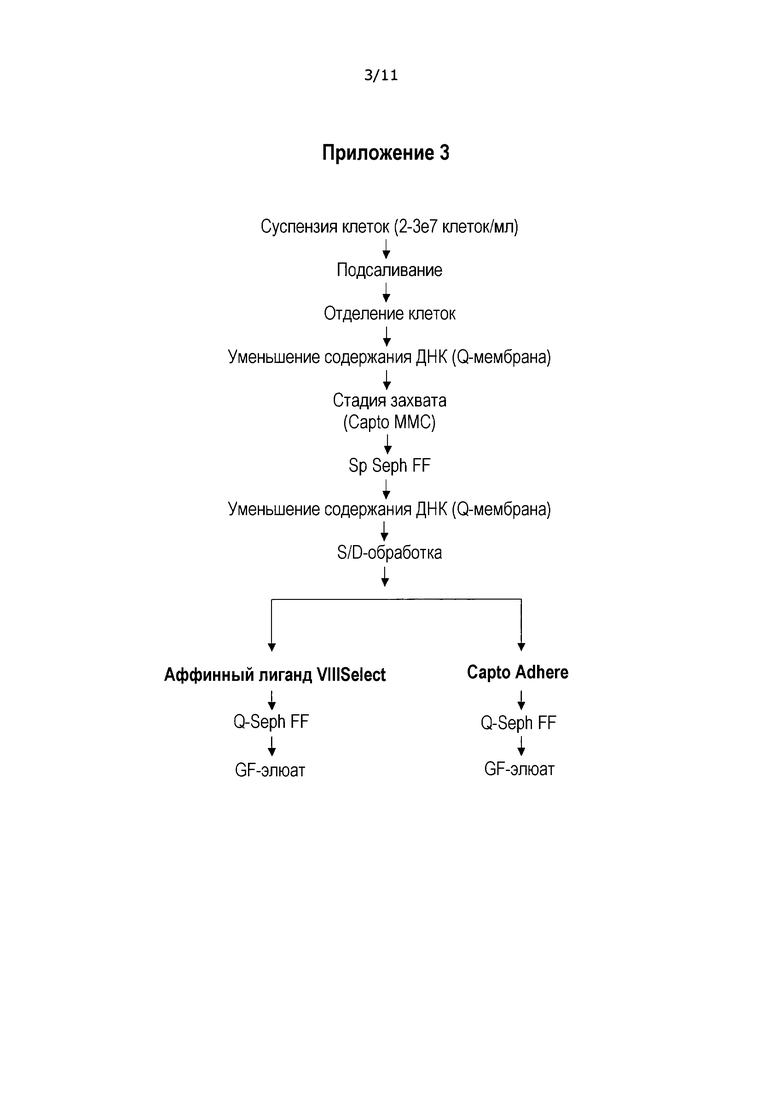
В Приложении 1 приведена последовательность операций в соответствии с настоящим изобретением, где стадию захвата проводят с использованием многомодальной смолы. Суспензию клеток подвергают обработке путем добавления соли, отделения клеток с последующей стадией уменьшения содержания ДНК, которую, преимущественно, проводят на Q мембране. Q мембрана (например, Sartobind Q от компании Sartorious) представляет собой обладающую сильными основными свойствами анионообменную смолу, содержащую четвертичные аммониевые группы в качестве анионообменного фрагмента. В определенном диапазоне значений рН и проводимости Q мембрана специфично связывает ДНК, в то время как продукт (и белки клетки-хозяина) остаются в фильтрате. В отличие от обычной ионообменной колоночной хроматографии, заряженный лиганд связан с основой мембраны, что обеспечивает высокий выход и простоту применения. Стадия захвата представляет собой способ настоящего изобретения с использованием многомодальной смолы. За стадией захвата следует разделение на катионообменной смоле, SP Sepharose FF™ (GE HealthCare) с последующим дополнительным удалением ДНК на Q мембране. Проводят обработку для инактивации вируса по типу “растворитель/детергент” (метод S/D), которая раскрыта, например, в EP-A-131740, а затем следующую стадию очистки, например, на аффинной смоле VIII Select™. Дальнейшее концентрирование/чистовую обработку проводят на ионообменной колонке, например, на Q Sepharose FF™ (GE HealthCare). Концентрированный продукт затем подвергают обработке на колонке гель-хроматографии (в частности, Superdex 200 p.g.™ (GE HealthCare)), чтобы сменить буфер и удалить возможные агрегаты и фрагменты. Полученный продукт, GF элюат, собирают. Соответствующие стадии более подробно разъясняются в примерах.
В Приложениях 2 и 3 приведен альтернативный вариант осуществления настоящего изобретения, где специфическая аффинная стадия (VIIISelect™ (GE HealthCare)), показанная в Приложении 1, заменена многомодальной хроматографией; Capto Adhere™ (GE HealthCare). Неожиданно последовательность стадий очистки, показанная в Приложении 2, обеспечивает ту же самую степень чистоты, что и последовательность стадий очистки, описанная в Приложении 1 (включая специфическую аффинную стадию с использованием антител). Указанный результат повторяют для тех же исходных веществ, как описано в Приложении 3. Полученный результат подтверждает достаточный потенциал неоднократного использования многомодального метода очистки (как на стадии захвата; Capto MMC ™ (GE HealthCare), так и последующей стадии очистки с использованием Capto Adhere™ (GE HealthCare), как показано в Приложении 2 и 3) с применением специфических условий элюирования для FVIII в соответствии с настоящим изобретением.
Настоящее изобретение далее поясняется следующими неограничивающими примерами.
ПРИМЕРЫ
Во всех примерах действительные значения в М (молярные) приведены в мол/кг (т.е. 10 г соли добавляют к 1000 г воды, а не 10 г соли добавляют к воде для получения 1000 мл раствора).
Пример 1: Получение суспензии клеток, содержащей FVIII
Клетки
Используемая клеточная линия является производной клеточной линии эмбриона человека 293 (HEK 293), которая адаптирована для выращивания в не содержащей сыворотки среде. Указанный хозяин, HEK 293F, устойчиво трансфицируют полигенным экспрессирующим кластером, несущим ген FVIII человека с удаленным В-доменом под управлением сильного промотора (EP-A-1739179).
Способ культивирования
Клетки выращивают в не содержащей сыворотку среде, используя обычное оборудование и в соответствии с обычными способами, хорошо известными из области техники, например, во встряхиваемых или перемешиваемых культурах в колбах для тканевых культур, в колбах на качалках или в биореакторах (в системах для одноразового использования или обычных перемешиваемых корпусных реакторах) в виде порционных клеточных культур, культур с подпиткой, перфузионных клеточных культур или непрерывных хемостатных культур (Freshney, R.I. (2000), Culture of animal cells: a manual of basic technique, 4th ed, Wiley-Liss; Spier, R.E. ed. (2000), Encyclopedia of cell technology, Wiley, New York; Enfors, S-O and Häggström, L. (2000), Bioprocess technology: fundamentals and applications, Högskoletryckeriet, Royal Institute of Technology, Stockholm; Vinci, V.A. and Parekh, S.R. (2003), Handbook of industrial cell culture: mammalian, microbial, and plant cells, Humana Press, USA). Как правило, для увеличения числа клеток и титров продукта, превышающих стандартные уровни при использовании порционных методов выращивании культур, используют перфузионную среду. Выход продукта и количество белков клетки-хозяина меняется в зависимости от способа культивирования:
- титр продукта, как правило, увеличивается с числом клеток;
- содержание общего белка и содержание ДНК, как правило, увеличивается с числом клеток;
- содержание общего белка и содержание ДНК может также возрастать с увеличением ожидаемого жизненного цикла;
- получаемые порционно клеточные культуры накапливают белок и ДНК; ничего извне не добавляется, ничего не удаляется;
- в перфузионных способах клеточная культура отмывается от продуктов обмена веществ, белка, ДНК и других примесей; для улавливания клеток, как правило, используют фильтры или клеточные центрифуги.
Поскольку рекомбинантный продукт связан с клетками, то результатом сбора клеток, выросших в культуре, является суспензия клеток. Свойства выросших в культуре клеток (титр продукта и вышеуказанные примеси) различаются в зависимости от используемого способа культивирования.
Пример 2: Получение исходного FVIII, освобожденного от клеток
Освобожденный от клеток исходный FVIII для проведения хроматографической очистки получают следующим образом. Маточный раствор хлорида натрия и хлорида кальция добавляют к суспензии клеток, полученной в соответствии с Примером 1, таким образом, чтобы их конечная концентрация составила 0,3 М и 30 мМ, соответственно, а проводимость составила 30-40 мС/см при 25°С. Раствор перемешивают в течение приблизительно 30 мин, а затем клетки удаляют центрифугированием с последующей фильтрацией, чтобы удалить любые клеточные остатки (для предотвращения засорения на последующих стадиях с использованием колонок).
Пример 3: Условия элюирования при использовании многомодальной катионной смолы Capto MMC
Проводят следующую серию экспериментов с целью сравнения условия элюирования при использовании многомодальной катионной смолы Capto MMC.
Пример 3а. Оценка различных концентраций соли и рН на элюирование FVIII из смолы Capto MMC (справочный пример)
Колонка и смола
В колонку С10/20 помещают слой смолы Capto MMC высотой 10 см (1 объем колонки (CV) = 8 мл). Смолу Capto MMC получают от компании GE HealthCare (каталожный № 17-5317).
Исходные вещества
В качестве исходных веществ используют раствор белка, содержащий rFVIII, который получают, как указано в Примере 2.
Выравнивающий буфер
0,01 М L-гистидина, 0,01 М CaCl2, 0,3 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 7,0, проводимость 31±3 мС/см при 25°С.
Колонку выравнивают с помощью выравнивающего буфера, а затем загружают исходные вещества со скоростью 5 мл/мин. FVIII связывается со смолой в указанных условиях обработки выравнивающим буфером (невозможно обнаружить FVIII в фильтрате). Затем колонку подвергают различным условиям элюирования, как указано в Таблице 1, и полученное в итоге на выходе из колонки количество FVIII анализируют по методу FVIII:С и рассчитывают в процентах по отношению к взятому количеству FVIII.
** Элюирующий буфер содержит 0,05 М L-гистидина, 0,05 М CaCl2 и 0,02% масс./масс. Polysorbate 80.
Выводы из справочного примера 3a
Как видно из Таблицы 1, связывание FVIII в колонке с Capto MMC не является ионным взаимодействием.
Справочный пример 3b. Оценка условий элюирования для Capto MMC при различных концентраций NaCl при постоянном 50%-ном содержании этиленгликоля
Колонка и смола
В колонку XK16/20 помещают слой смолы Capto MMC высотой 10 см (1 объем колонки (CV) = 4 мл). Смолу Capto MMC получают от компании GE HealthCare (каталожный № 17-5317).
Исходные вещества
В качестве исходных веществ используют раствор белка, содержащий rFVIII, который получают, как указано в Примере 2.
Выравнивающий буфер
0,01 М L-гистидина, 0,01 М CaCl2, 0,3 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 7,0, проводимость 31±3 мС/см при 25°С.
Колонку выравнивают с помощью выравнивающего буфера, а затем загружают исходные вещества со скоростью 1 мл/мин. FVIII связывается со смолой в указанных условиях обработки выравнивающим буфером (невозможно обнаружить FVIII в фильтрате). Затем колонку подвергают различным условиям элюирования, как указано в Таблице 2, и полученное в итоге на выходе из колонки количество FVIII анализируют по методу FVIII:С и рассчитывают в процентах по отношению к взятому количеству FVIII.
Выводы из справочного примера 3b
Как видно из Таблицы 2, связывание FVIII в колонке с Capto MMC можно ингибировать с помощью комбинации этиленгликоля и NaCl. 50%-ный этиленгликоль обычно используют в качестве буфера для элюирования для обычных аффинных смол на основе белка. Элюирование FVIII улучшается, этиленгликоль комбинируют с повышенными концентрациями хлорида натрия вплоть до 1,5 М. Два исследованных значения рН (рН 6,5 и 7,5) не изменяют степень выделения FVIII в пределах границ устойчивости белка (приблизительно рН 6-8). Повышение концентрации NaCl до 2,5 М не улучшает извлечение FVIII:C в элюате.
Пример 3c. Варьирование содержания аргинина в качестве компонента элюирования для Capto MMC
Колонка и смола
В колонку Tricorn 5/100 помещают слой смолы Capto MMC высотой 8 см (1 объем колонки (CV) = 1,6 мл). Смолу Capto MMC получают от компании GE HealthCare (каталожный № 17-5317-10).
Исходные вещества
В качестве исходных веществ используют раствор белка, содержащий rFVIII, который получают, как указано в Примере 2.
Выравнивающий буфер
0,01 М L-гистидина, 0,01 М CaCl2, 0,3 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 7,0, проводимость 31±3 мС/см при 25°С.
Колонку выравнивают с помощью выравнивающего буфера, а затем загружают исходные вещества со скоростью 0,6 мл/мин. FVIII связывается со смолой в указанных условиях обработки выравнивающим буфером (невозможно обнаружить FVIII в фильтрате). Затем колонку подвергают различным условиям элюирования (в каждом случае используют объем, приблизительно равный 10 объемам колонки (CV)), как указано в Таблице 3, и полученное в итоге на выходе из колонки количество FVIII анализируют по методу FVIII:С и рассчитывают в процентах по отношению к взятому количеству FVIII.
Выводы из примера 3c (по настоящему изобретению)
Как видно из Таблицы 3, связывание FVIII в колонке с Capto MMC неожиданно можно ингибировать с помощью комбинации этиленгликоля и аргинина. Элюирование FVIII наблюдается в элюатах, содержащих вплоть до 0,9 М аргинина вместе с 20% (масс./масс.) этиленгликоля.
Пример 3d (по настоящему изобретению). Сравнение аргинина и лизина в качестве компонента элюирования для Capto MMC
Колонка и смола
В колонку Tricorn 50/100 или С10/20 помещают слой смолы Capto MMC высотой 4-8 см (1 объем колонки (CV) = 1,6-3 мл). Смолу Capto MMC получают от компании GE Healthcare (каталожный № 17-5317).
Исходные вещества
В качестве исходных веществ используют раствор белка, содержащий rFVIII, который получают, как описано в Примере 2.
Выравнивающий буфер
0,01 М L-гистидина, 0,01 М CaCl2, 0,3 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 7,0, проводимость 31±3 мС/см при 25°С.
Колонку выравнивают с помощью выравнивающего буфера, а затем загружают исходные вещества со скоростью, которая соответствует времени контактирования 1-2 мин. FVIII связывается со смолой в указанных условиях обработки выравнивающим буфером (невозможно обнаружить FVIII в фильтрате). Затем колонку подвергают различным условиям элюирования, как указано в Таблице 4, и полученное в итоге на выходе из колонки количество FVIII анализируют по методу FVIII:С и рассчитывают в процентах по отношению к взятому количеству FVIII.
Выводы из примера 3d (по настоящему изобретению)
Как видно из Таблицы 4, связывание FVIII в колонке с Capto MMC исследуют, используя 20% этиленгликоля в сочетании с лизином и аргинином при различных концентрациях. Аргинин элюирует FVIII лучше, чем лизин, а концентрация 0,75 М, видимо, позволяет извлечь приблизительно 90%. Вероятно, можно использовать меньшие количества любой из аминокислот в сочетании с этиленгликолем в качестве промывочной стадии для удаления примесей из молекулы FVIII, прежде чем элюировать VIII, например, используя 0,75 М аргинина.
Пример 3e. Оценка чистоты и степени извлечения с использованием различных условия промывки и элюирования для смолы Capto MMC
Колонка и смола
Смолу Capto MMC помещают в различные колонки (высота слоя 2-9 см, объем колонки 1,6-48 мл). Смолу Capto MMC получают от компании GE Healthcare (каталожный № 17-5317).
Исходные вещества
В качестве исходных веществ используют растворы белка, содержащие rFVIII, который получают, как описано в Примере 2, с типичной чистотой приблизительно 100 IU FVIII/мг белка (как видно в Примере 19, Таблица 18)
Выравнивающий буфер
0,01 М L-гистидина, 0,01 М CaCl2, 0,3 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 7,0, проводимость 31±3 мС/см при 25°С.
Колонку выравнивают с помощью выравнивающего буфера, а затем загружают исходные вещества с соответствующими скоростями (в зависимости от размера колонки они приблизительно составляют 13-300 см/час). FVIII связывается со смолой в указанных условиях обработки выравнивающим буфером (невозможно обнаружить FVIII в фильтрате). Затем колонку подвергают различным условиям промывки и элюирования, как указано в Таблице 5, и полученное в итоге на выходе из колонки количество FVIII анализируют по методу FVIII:С и рассчитывают в процентах по отношению к взятому количеству FVIII.
** Определяют методом Брэдфорда
Выводы из примера 3e
Как видно из Таблицы 5, комбинация 20% этиленгликоля и 0,4 М аргинина на стадии промывки до применения больших концентраций аргинина в элюирующем буфере позволяет получить с более высоким выходом более чистый продукт, при этом концентрация аргинина в промывочном буфере не должна превышать 0,4 М, поскольку в противном случае наблюдается относительно низкая степень извлечения FVIII.
Выводы из примера 3
Очевидно, что катионную многомодальную смолу (Capto MMC) нельзя элюировать, используя обычные условия элюирования для ионообменной смолы (высокое содержание соли) или для смолы с гидрофобными взаимодействиями (низкое содержание соли). Повышенное содержание несущей заряд аминокислоты как индивидуально, так и в сочетании с этиленгликолем, неожиданно позволяет высвободить связанную молекулу FVIII из смолы Capto MMC. Кроме того, концентрации NaCl, аргинина, лизина и этиленгликоля можно варьировать в процессе промывки и элюирования смолы, чтобы оптимизировать степень извлечения и чистоту полученного из Capto MMC элюата.
Пример 4: Условия элюирования для многомодальной анионной смолы Capto Adhere (сравнительный пример)
Проводят следующую серию экспериментов, чтобы оценить различные условия элюирования с использованием многомодальной анионной смолы Capto Adhere.
Колонка и смола
В колонку С10/20 помещают слой смолы Capto Adhere высотой 13,5 см. Смолу Capto Adhere получают от компании GE Healthcare (каталожный № 17-5444).
Исходные вещества
В качестве исходных веществ используют раствор белка, содержащий rFVIII, который получают, как описано в Примере 6С.
Выравнивающий буфер
0,01 М L-гистидина, 0,01 М CaCl2, 0,3 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 6,5, проводимость 30±3 мС/см при 25°С.
Колонку выравнивают с помощью выравнивающего буфера, после чего загружают исходные вещества. Затем колонку подвергают различным условиям элюирования, как указано в Таблице 6, и анализируют полученное в итоге на выходе из колонки количество FVIII.
Условия элюирования А
0,01 М L-гистидина, 0,01 М CaCl2, 0,3 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 6,5, проводимость 30±3 мС/см при 25°С.
Условия элюирования В (большое содержание соли)
0,05 М L-гистидина, 0,05 М CaCl2, 2,0 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 6,5, проводимость 140±5 мС/см при 25°С.
Условия элюирования С (низкое содержание соли)
0,01 М L-гистидина, 0,01 М CaCl2, 0,1 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 6,5, проводимость 13±3 мС/см при 25°С.
Условия элюирования D (низкое содержание аминокислоты и низкое содержание этиленгликоля)
0,01 М L-гистидина, 0,01 М CaCl2, 0,3 M NaCl, 0,3 М гидрохлорида аргинина, 20% масс./масс. этиленгликоля, 0,02% масс./масс. Polysorbate 80, pH 6,5, проводимость 28±3 мС/см при 25°С.
Условия элюирования E (аминокислота)
0,01 М L-гистидина, 0,01 М CaCl2, 0,3 M NaCl, 0,8 М гидрохлорида аргинина, 0,02% масс./масс. Polysorbate 80, pH 6,5, проводимость 53±2 мС/см при 25°С.
Выводы из Примера 4
Очевидно, что анионную многомодальную смолу (Capto Adhere) нельзя элюировать, используя обычные условия элюирования для ионообменной смолы (высокое содержание соли) или для смолы с гидрофобными взаимодействиями (низкое содержание соли). Повышенное содержание несущей заряд аминокислоты как индивидуально, так и в сочетании с этиленгликолем, неожиданно позволяет высвободить связанную молекулу FVIII.
Пример 5. Сравнение стадии с использованием обычной катионообменной смолы (SP Sepharose FF) с катионообменной многомодальной смолой (Capto MMC) в качестве стадии очистки (стадии захвата)
Колонка и смола
Слой смолы Capto MMC высотой 11 см помещают в колонку С10/20 (1 объем колонки (CV) = 8,5 мл). Смолу Capto MMC получают от компании GE Healthcare (каталожный № 17-5317).
Слой смолы SP Sepharose FF высотой 18 см помещают в колонку XK26/20 (1 объем колонки (CV) = 100 мл). Смолу SP Sepharose FF получают от компании GE Healthcare (каталожный № 17-0729).
Исходные вещества
В качестве исходных веществ используют раствор белка, содержащий rFVIII, который получают, как описано в Примере 2 (в обоих экспериментах используют идентичные исходные вещества). Для смолы SP Sepharose FF, исходные вещества, для того чтобы FVIII мог с ней связаться, перед добавлением смолы разбавляют разбавляющим буфером до проводимости 12 мС.
Разбавляющий буфер для SP
0,01 М L-гистидина, 0,01 М CaCl2, 0,07 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 6,5.
Выравнивающий буфер для MMC
0,01 М L-гистидина, 0,01 М CaCl2, 0,3 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 7,0, проводимость 31±3 мС/см при 25°С.
Выравнивающий буфер для SP
0,01 М L-гистидина, 0,01 М CaCl2, 0,1 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 6,5, проводимость 12±2 мС/см при 25°С.
Колонки выравнивают с помощью выравнивающего буфера, а затем загружают исходные вещества со скоростью, соответственно, 5 мл/мин и 40 мл/мин. FVIII связывается со смолой в указанных условиях обработки выравнивающим буфером (невозможно обнаружить FVIII в фильтрате). Затем полимерные композиции подвергают различным условиям промывки и элюирования, принципы которой описаны в Примере 3d (промывка с использованием 0,75 М лизина + 20% этиленгликоля) и Примере 3b (элюирование с использованием 1,5 М NaCl + 50% этиленгликоля) для стадии Capto MMC и в Примере 6b для стадии SP Sepharose FF (промывка с использованием 0,15 М NaCl и элюирование с использованием 0,36 М NaCl). Данные Таблицы 7 позволяют исследовать отличия между двумя стадиями очистки.
OgH07-648
OgH07-647
** Определяют по методу Брэдфорда
Выводы из Примера 5 (сравнительного)
Приведенные в Таблице 7 результаты показывают, что использование стадии Capto MMC в качестве стадии захвата/очистки для FVIII предоставляет несколько преимуществ, а именно:
- Лучшее извлечение FVIII
- Более высокую чистоту относительно белков клетки-хозяина
- Более высокую чистоту относительно ДНК
- Лучшую способность связывать FVIII/мл смолы
- Более короткое время проведения процесса благодаря меньшему разбавлению (смолу MMC можно обрабатывать раствором с большей проводимостью).
Пример 6: Специфические компоненты (Ca) для элюирования и промывки FVIII и его очистки на катионообменной смолe (SP Sepharose FF) (сравнительный)
Следующую серию экспериментов проводят с целью оценки различных условий элюирования с использованием смолы SP Sepharose FF.
Пример 6a. Хлорид натрия и аргинин в качестве специфического компонента для элюирования и промывки, используемого для катионообменной смолы (SP Sepharose FF)
Колонка и смола
Слой смолы SP Sepharose FF высотой 15 см помещают в колонку XK16. Смолу SP Sepharose FF получают от компании GE Healthcare (каталожный № 17-0729).
Исходные вещества
В качестве исходных веществ используют раствор белка, содержащий rFVIII, который получают по Примеру 2 и затем подвергают обработке с использованием смолы Capto MMC, как описано в Примере 9. Элюат после колонки с Capto MMC разбавляют в 12 раз с помощью разбавляющего буфера до меньшей величины проводимости, которая приблизительно составляет 12 мС/см, что позволяет белку-мишени связаться со смолой SP Sepharose FF.
Разбавляющий буфер для SP
0,01 М L-гистидина, 0,01 М CaCl2, 0,07 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 6,5.
Выравнивающий буфер
0,01 М L-гистидина, 0,01 М CaCl2, 0,1 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 6,5, проводимость 12±2 мС/см при 25°С.
Колонку выравнивают с помощью выравнивающего буфера, после чего загружают исходные вещества. Затем колонку подвергают различным условиям элюирования, как указано в Таблице 8, и анализируют полученное в итоге на выходе из колонки количество FVIII.
** Определяют методом Брэдфорда
Промывочный раствор А
0,01 М L-гистидина, 0,01 М CaCl2, 0,15 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 6,5, проводимость 16,5-18,0 мС/см при 25°С.
Элюирующий буфер
0,01 М L-гистидина, 0,035 М CaCl2, 0,34 M NaCl, 0,2 М D-сорбита, 0,045 М гидрохлорида аргинина, 0,02% масс./масс. Polysorbate 80, pH 6,5, проводимость 36±2 мС/см при 25°С.
Вывод из Примера 6а (сравнительного)
Связанный FVIII эффективно элюируется из колонки с SP Sepharose FF, когда используют элюирующий буфер с проводимостью 36 мС/см. Указанную проводимость создает концентрация NaCl и частично концентрации CaCl2 и аргинина. Сорбит и аргинин добавляют в буфер для стабилизации молекулы FVIII в процессе обработки, замораживания и оттаивания.
Пример 6b. Хлорид натрия в качестве специфического компонента для элюирования и промывки, используемого для катионообменной смолы (SP Sepharose FF)
Колонка и смола
Слой смолы SP Sepharose FF высотой 15 см помещают в колонку С10/20. Смолу SP Sepharose FF получают от компании GE Healthcare (каталожный № 17-0729).
Исходные вещества
В качестве исходных веществ используют раствор белка, содержащий rFVIII, который получают по Примерам 2 и 9. Элюат после колонки с Capto MMC разбавляют в 12 раз с помощью разбавляющего буфера до меньшей величины проводимости, что позволяет белку-мишени связаться со смолой SP Sepharose FF.
Разбавляющий буфер
0,01 М L-гистидина, 0,01 М CaCl2, 0,01 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 6,5.
Выравнивающий буфер
0,01 М L-гистидина, 0,01 М CaCl2, 0,1 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 6,5, проводимость 12±2 мС/см при 25°С.
Колонку выравнивают с помощью выравнивающего буфера, после чего загружают исходные вещества. Затем колонку подвергают различным условиям элюирования, как указано в Таблице 9, и анализируют полученное в итоге на выходе из колонки количество FVIII.
** Определяют методом Брэдфорда
Промывочный раствор B
0,01 М L-гистидина, 0,01 М CaCl2, 0,15 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 6,5, проводимость 16,5-18,0 мС/см при 25°С.
Элюирующий буфер
0,01 М L-гистидина, 0,035 М CaCl2, 0,36 M NaCl, 0,2 М D-сорбита, 0,02% масс./масс. Polysorbate 80, pH 6,5, проводимость 36±2 мС/см при 25°С.
Вывод из Примера 6b
Используют элюирующий буфер с проводимостью 36 мС/см. По сравнению с элюирующим буфером, который использовали в эксперименте 5а, аргинин исключают, а проводимость доводят до величины 36 мС/см, добавив немного большее количество концентрата NaCl. Процент элюированного FVIII немного ниже, чем в эксперименте 5а, указывая на то, что аргинин играет положительную роль в данном процессе.
Пример 6c. Хлорид кальция в качестве специфического компонента для элюирования и промывки, используемого для катионообменной смолы
Колонка и смола
Слой смолы SP Sepharose FF высотой 15,5 см помещают в колонку XK26. Смолу SP Sepharose FF получают от компании GE Healthcare (каталожный № 17-0729).
Исходные вещества
В качестве исходных веществ используют раствор белка, содержащий rFVIII, который получают по Примерам 2 и 9. Элюат после колонки с Capto MMC разбавляют в 12 раз с помощью разбавляющего буфера до меньшей величины проводимости, что позволяет белку-мишени связаться со смолой SP Sepharose FF.
Разбавляющий буфер
0,01 М L-гистидина, 0,01 М CaCl2, 0,05 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 6,5.
Выравнивающий буфер
0,01 М L-гистидина, 0,01 М CaCl2, 0,1 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 6,5, проводимость 12±2 мС/см при 25°С.
Колонку выравнивают с помощью выравнивающего буфера, после чего загружают исходные вещества. Затем колонку подвергают различным условиям элюирования, как указано в Таблице 10, и анализируют полученное в итоге на выходе из колонки количество FVIII.
** Определяют методом Брэдфорда
Промывочный раствор B
0,01 М L-гистидина, 0,01 М CaCl2, 0,15 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 6,5, проводимость 16,5-18,0 мС/см при 25°С.
Промывочный раствор C (сорбит)
0,01 М L-гистидина, 0,01 М CaCl2, 0,1 M NaCl, 0,2 М D-сорбита, 0,02% масс./масс. Polysorbate 80, pH 6,5, проводимость 12±2 мС/см при 25°С.
Элюирующий буфер (хлорид кальция)
0,02 М L-гистидина, 0,2 М CaCl2, 0,1 M NaCl, 0,2 М D-сорбита, 0,02% масс./масс. Polysorbate 80, pH 6,5, проводимость 18,7 (18,0-19,0) мС/см при 25°С.
Вывод из Примера 6c (6a, 6b)
В данном эксперименте (6с) в элюирующем буфере концентрация NaCl ниже, и используют бóльшие концентрации CaCl2. Указанная замена дает проводимость 18,7 мС/см. Элюирующая способность FVIII из SP Sepharose FF такая же хорошая, что в эксперименте 5а, где проводимость элюирующего буфера составляла 36 мС/см. Неожиданно обнаруживается, что степень извлечения FVIII одинакова или лучше при использовании элюирующего буфера, проводимость которого практически вдвое меньше. Обычно при проведении ионообменной хроматографии элюирование белков сильно зависит от проводимости (ионной силы) и/или величины рН. Из данного примера следует, что ион Ca2+ оказывает специфическое действие, а не просто оказывает влияние за счет увеличения ионной силы, на молекулу FVIII. Этот вывод подтверждается также чистотой, которая оказывается выше (2811 в сравнении с 362 и 948, соответственно, в Примерах 6a и 6b), когда проводят элюирование с помощью раствора на основе Са с меньшей проводимостью.
Пример 7: Очистка с аффинным лигандом FVIII, полученным из дрожжей
Следующий эксперимент проводят с целью оценки условий элюирования с использованием аффинной смолы VIIISelect.
Колонка и смола
Слой смолы VIIISelect высотой семь сантиметров помещают в колонку С10/20. Смолу VIIISelect получают от компании GE Healthcare (каталожный № 17-5450).
Исходные вещества
В качестве исходных веществ используют полученный после SP Sepharose элюат, содержащий rFVIII, который получают по методике, приведенной в Примере 6 для стадии SP Sepharose FF (промывка с использованием 0,15 М NaCl и элюирование с использованием 0,36 М NaCl).
Композиции буферов:
Буфер А (Выравнивающий буфер, содержащий используемые в методе S/D химические реагенты)
0,3 мол/кг NaCl, 0,02 мол/кг CaCl2 (2×H2O), 0,02 мол/кг L-гистидина, 1% масс./масс. Triton X-100, 0,3% масс./масс. TNBP, pH: 6,5±0,1, проводимость: 31±3 мС/см при +25°С.
Промывочный раствор В (Выравнивающий буфер, не содержащий используемые в методе S/D химические реагенты)
0,3 мол/кг NaCl, 0,02 мол/кг CaCl2, 0,02 мол/кг L-гистидина, 0,02% масс./масс. Polysorbate 80, pH: 6,5±0,1, проводимость: 31±3 мС/см при +25°С.
Промывочный раствор С (Промывочный буфер с большим содержанием соли)
1,0 мол/кг NaCl, 0,02 мол/кг CaCl2, 0,02 мол/кг L-гистидина, 0,02% масс./масс. Polysorbate 80, pH: 6,5±0,1, проводимость 85±3 мС/см при +25°С.
Буфер D (Элюирующий буфер)
1,5 мол/кг NaCl, 0,02 мол/кг CaCl2, 0,02 мол/кг L-гистидина, 0,02% масс./масс. Polysorbate 80, 50% (масс./масс.) этиленгликоля (EG), pH: 6,5±0,1, проводимость: 39±3 мС/см при +25°С.
Приведенные выравнивающий, промывочный и элюирующий буферы не ограничиваются указанными значениями рН, концентрациями и типами буферной добавки, солей или детергента.
Колонку выравнивают с помощью выравнивающего буфера А, после чего загружают исходные вещества. После этого колонку подвергают различным условиям промывки и элюирования, как указано в Таблице 11, и анализируют полученное в итоге на выходе из колонки количество FVIII.
Результаты экспериментов с использованием VIIISelect
На фиг.1 приведен окрашенный серебром образец SDS-PAGE, показывающий степень чистоты для исходного вещества (полоса 1) и элюата VIIISelect (полоса 2) после стадии аффинной хроматографии.
Выводы из Примера 7
Стадия с использованием VIIISelect является мощной стадией очистки, которая позволяет получить чистый элюат.
Пример 8: Сравнение последовательности операции очистки с использованием аффинной смолы VIIISelect или же многомодальной смолы (Capto Adhere) (Приложение 3)
В небольшом масштабе осуществляют две различные схемы очистки в соответствии с Примером 7 (VIIISelect) и Примером 10 (Capto Adhere).
Сравнение степени извлечения и чистоты FVIII при использовании стадии очистки с помощью FVIIISelect или Capto Adhere
* Определяют методом Брэдфорда
** Определяют аминокислотным анализом
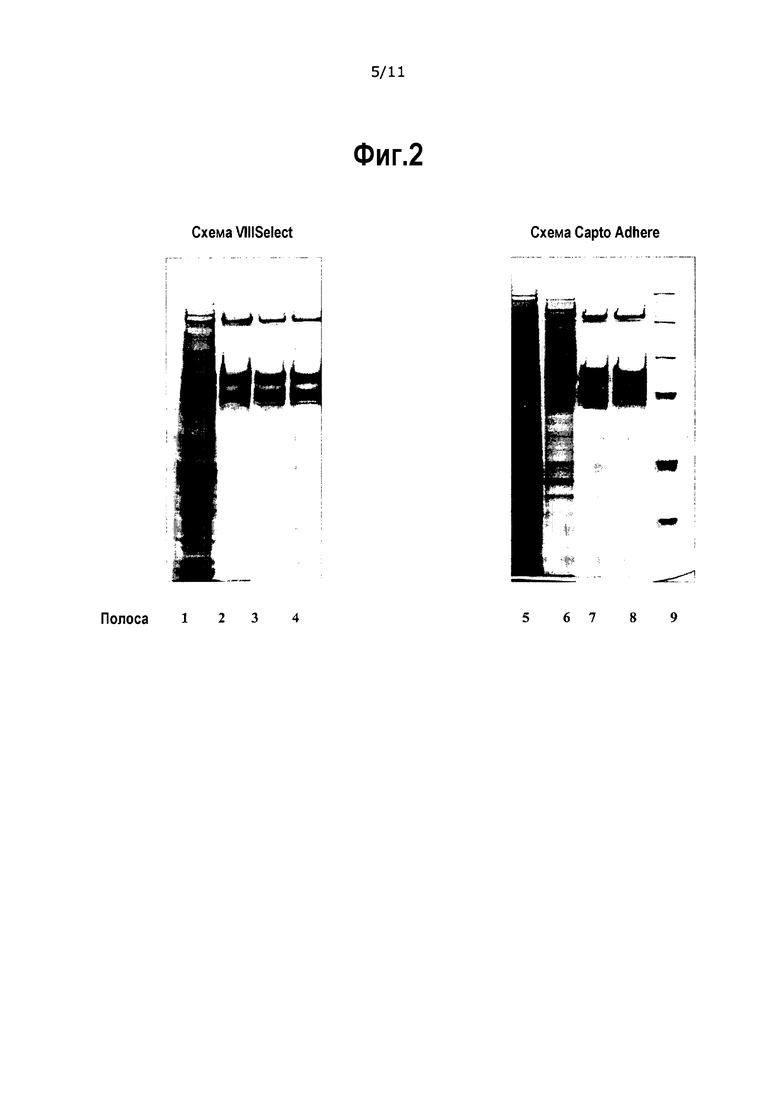
На фиг.2 приведены окрашенные серебром образцы SDS-PAGE, описанные в Таблице 12; Сравнение схемы очистки с использованием VIIISelect и схемы очистки с использованием Capto Adhere.
Полоса 1 показывает чистоту исходного вещества (SP-фильтрата) перед загрузкой в колонку VIIISelect с концентрацией FVIII, равной 483 IU/мл.
Полоса 2 показывает чистоту навески элюата VIIISelect с концентрацией FVIII, равной 500 IU/мл.
Полоса 3 показывает чистоту навески, которую загружают с концентрацией FVIII, равной 500 IU/мл, после последовательности операций очистки SP - VIIISelect - Q Seph.
Полоса 4 показывает чистоту навески, которую загружают с концентрацией FVIII, равной 385 IU/мл, после последовательности операций очистки SP – VIIISelect - Q Seph – гель-фильтрация.
Полоса 5 показывает чистоту исходного вещества (SP-фильтрата) перед загрузкой в колонку Capto Adhere с концентрацией FVIII, равной 493 IU/мл.
Полоса 6 показывает чистоту навески элюата Capto Adhere с концентрацией FVIII, равной 500 IU/мл.
Полоса 7 показывает чистоту навески, которую загружают с концентрацией FVIII, равной 500 IU/мл, после последовательности операций очистки SP - Capto Adhere - Q Seph.
Полоса 8 показывает чистоту навески, которую загружают с концентрацией FVIII, равной 493 IU/мл, после последовательности операций очистки SP – Capto Adhere - Q Seph – гель-фильтрация.
Полоса 9 показывает молекулярный маркер.
Выводы из Примера 8
Та же самая степень чистоты может быть достигнута либо с помощью аффинной стадии при использовании VIIISelect, либо хроматографической стадии при использовании Capto Adhere, если чистоту сравнивают в конечном продукте (GF-элюат). Чистота после стадии VIIISelect выше, по сравнению с чистотой после стадии Capto Adhere, однако после остальных стадий очистки (Q и GF) использованные аналитические методы не выявляют различий в чистоте. Степень извлечения с использованием стадии Capto Adhere несколько выше, по сравнению с последовательностью, в которой используют VIIISelect.
Пример 9: Осуществление последовательности стадий очистки в промышленном масштабе с использованием аффинной смолы VIIISelect
С целью исследования воспроизводимости степени извлечения и чистоты, указанные ниже стадии 1-9 проводят для 3-4 экспериментальных серий в полупромышленном масштабе. Каждую экспериментальную серию получают из исходной суспензии клеток объемом 40-100 л, как описано в Примерах 1-2.
СТАДИЯ 1. Стадия № 1 уменьшения содержания ДНК (анионная хроматография)
Первичное уменьшение содержания ДНК проводят фильтрованием через Q-мембрану (Sartobind Q, компания Sartorious). Перед проведением фильтрации Q-мембрану выравнивают с помощью буфера (Таблица 13).
Буфер, который используют для Q-мембраны
Фильтрат клеток (из Примера 2) пропускают через Q-мембрану и собирают фильтрат, содержащий продукт. Мембрану промывают выравнивающим буфером, чтобы извлечь из мембраны любые остатки FVIII.
СТАДИЯ 2. Стадия захвата (Многомодальная хроматография, Capto MMC)
Первичную очистку и концентрирование продукта (захват) проводят для 500-10000 IU FVIII/мл геля многомодальной катионообменной хроматографии (Capto MMC). Гель перед загрузкой продукта выравнивают с помощью выравнивающего буфера для Capto MMC. Фильтрат со стадии 1 загружают в колонку с Capto MMC, после чего споласкивают выравнивающим буфером для Capto MMC и последовательно промывают промывочными буферами 1-3 с последующим элюированием FVIII, как описано в Таблице 14.
СТАДИЯ 3. Катионообменная хроматография, SP Sepharose FF
Раствор, содержащий FVIII (Capto MMC элюат) со стадии 2, подвергают дальнейшей очистке с помощью геля SP-Sepharose FF (GE HealthCare (каталожный № 17-0729). Перед загрузкой продукта колонку выравнивают с помощью выравнивающего буфера для SP-Sepharose, и раствор белка разбавляют таким образом, чтобы его ионная сила и рН соответствовали выравнивающему буферу и FVIII смог связаться с гелем. Разбавленный раствор белка помещают в колонку SP Sepharose, после чего споласкивают выравнивающим буфером, а затем промывают промывочным буфером и элюируют FVIII, как описано в Таблице 15.
Буферы, которые используют при проведении катионообменной хроматографии
СТАДИЯ 4. Стадия № 2 уменьшения содержания ДНК (анионная хроматография)
Первичное уменьшение содержания ДНК проводят фильтрованием через Q-мембрану (Sartobind Q, компания Sartorious). Перед проведением фильтрации Q-мембрану выравнивают с помощью буфера (Таблица 16).
Буфер, который используют для Q-мембраны
SP-элюат со стадии 3 фильтруют через Q-мембрану, и содержащий продукт фильтрат собирают для проведения дальнейшей обработки. Мембрану промывают выравнивающим буфером, чтобы извлечь из мембраны любые остатки FVIII.
СТАДИЯ 5. Инактивация вирусов (обработка типа “растворитель/детергент” (S/D))
Фильтрат со стадии 4 подвергают инактивирующей вирусы S/D обработке (обработка типа “растворитель/детергент”) с использованием 1%-ного Triton X-100 и 0,3%-ного три(н-бутил)фосфата (TNBP). Инактивацию вирусов проводят при перемешивании при комнатной температуре приблизительно в течение 1 час.
СТАДИЯ 6. Очистка с использованием полученной из дрожжей аффинной хроматографической смолы
Раствор FVIII после инактивации вируса со стадии 5 подвергают обработке с помощью аффинной колонки VIIISelect в соответствии с описанием Примера 7. На один миллилитр смолы берут навеску приблизительно 5-20000 IU FVIII.
СТАДИЯ 7. Нанофильтрация
VIIISelect элюат со стадии 6 подвергают нанофильтрации, чтобы удалить потенциальные случайные агенты, такие как вирусы без оболочки, используя нанофильтр Planova 20N (Asahi Kasei Medical). Собирают фильтрат, содержащий продукт.
СТАДИЯ 8. Стадия анионообменной хроматографии (Q-Sepharose FF)
Смолу Q Sepharose FF получают от компании GE HealthCare (каталожный № 17-0510). В качестве исходного вещества используют нанофильтрат, полученный на стадии 7, при этом концентрацию соли и значение рН можно отрегулировать таким образом, чтобы они соответствовали выравнивающему буферу в Таблице 17. Разбавленный раствор белка помещают в колонку Q Sepharose FF с навеской 5000-25000 IU/мл геля, которую затем споласкивают выравнивающим буфером и промывают промывочным буфером с последующим элюированием FVIII, как указано в Таблице 17.
Буферы, которые используют при проведении анионообменной хроматографии (Q-Sepharose FF)
СТАДИЯ 9. Стадия гель-хроматографии
Смолу для гель-фильтрации (Superdex 200pg, GE HealthCare, каталожный № 17-1043) помещают в колонку в виде слоя с высотой 60-75 см. В качестве исходного вещества используют Q-элюат, полученный на стадии 8. Колонку выравнивают с помощью физиологически приемлемой композиции, которая защищает продукт от адсорбции на поверхности и стабилизирует его в процессе замораживания, хранения, сублимационной сушки и т.д. Q-элюат помещают в колонку в количестве, составляющем 2-8% от общего объема колонки. Из колонки собирают элюат (GF-элюат), содержащий полученный FVIII, свободный от фрагментов и агрегатов.
Обобщенные результаты стадий очистки, описанных на стадиях 1-4, для четырех экспериментальных серий, полученных в полупромышленных масштабах (из приблизительно 50 л (BPP077-078) и 100 л (BPP080-081) суспензии клеток (приведена в Примере 1)
Полученные при захвате экспериментальные серии BPP077 и BPP078 объединяют вместе для проведения последующей очистки в виде экспериментальной серии BPP079, в то время как экспериментальную серию BPP080 обозначают как BPP083, а экспериментальную серию BPP081 обозначают как BPP084.
Обобщенные результаты хроматографических стадий, описанных на стадиях 5-9, для завершающей стадии очистки трех полупромышленных экспериментальных серий
** Выход рассчитан для стадии GF,
*** Определяют методом Брэдфорда,
**** Определяют аминокислотным анализом
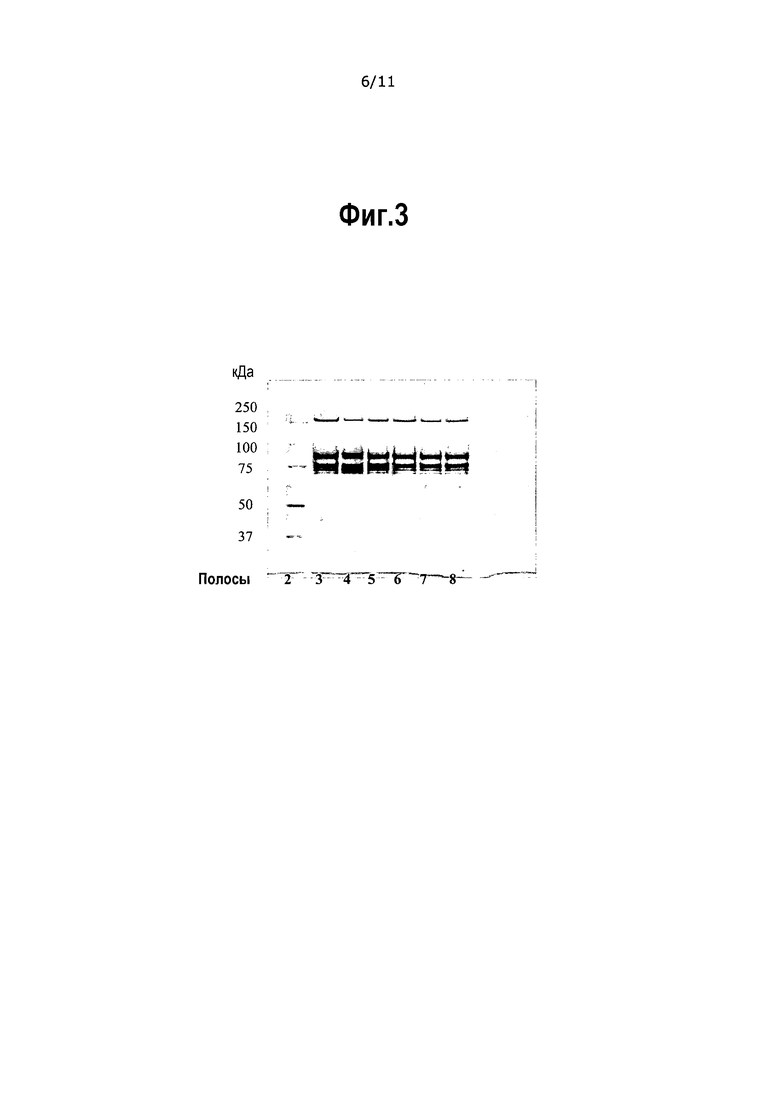
На фиг.3 приведен окрашенный серебром SDS-PAGE образ конечного продукта до (полоса 3 – BBP083, полоса 7 – BBP084) и после (полоса 6 – С810А139, полоса 8 – С811А139) приготовления состава, очищенного в соответствии с Примером 9 (Таблицы 18-19). Полоса 2 показывает молекулярный маркер, полоса 3 показывает контрольный образец FVIII, а полоса 4 показывает коммерчески доступный продукт FVIII (ReFacto® - лот C66202).
На фиг.4 показан результат вестерн-блоттинга FVIII с использованием поликлональных антител FVIII против человека. Полосы 1 и 10 пустые, полоса 2 показывает стандарт молекулярной массы (Precision Plus Protein Western C от компании Bio-rad), полоса 3 показывает коммерчески доступный продукт FVIII (ReFacto® - лот C66202), полосы 4-6 показывают контрольные образцы FVIII, полосы 7-9 показывают финальную композицию продуктов экспериментальных серий BPP079, BPP083 и BPP084, очищенных в соответствии с Примером 9 (Таблица 17-18). Перед проведением анализа по методу вестерн-блоттинга образцы разбавляют до концентрации FVIII, соответствующей 5 IU FVIII:C/мл.
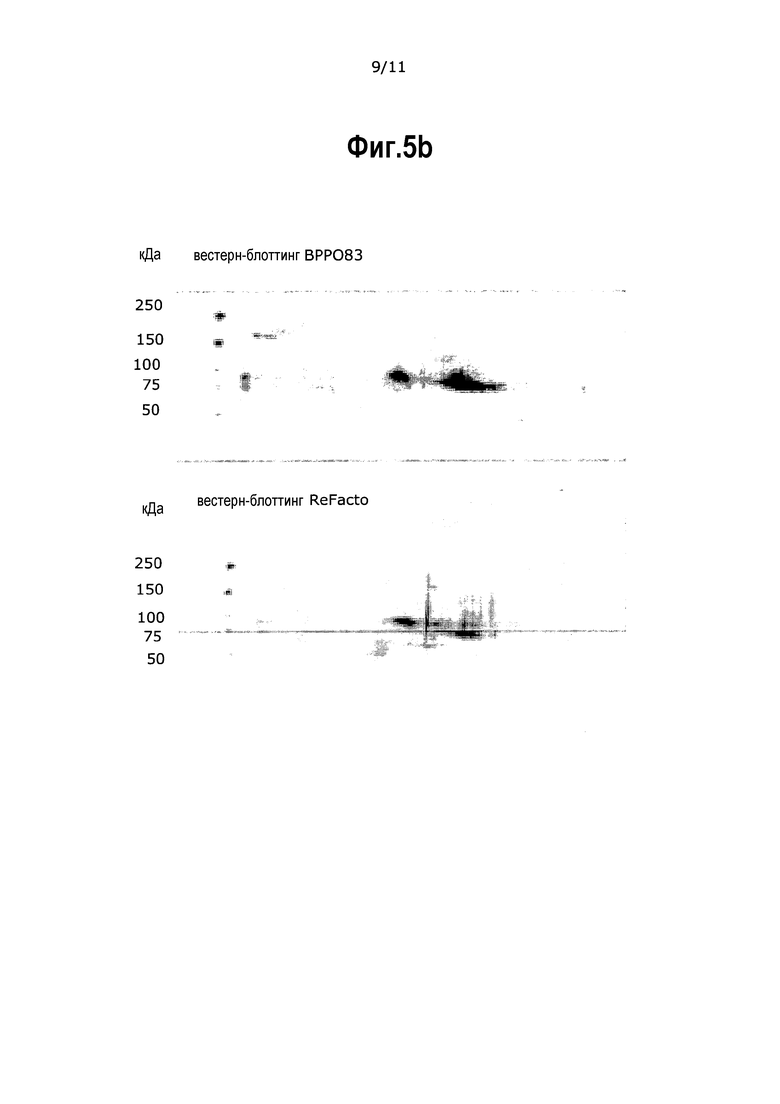
На фиг.5 приведен результат двумерного PAGE после окрашивания серебром и вестерн-блоттинга конечных композиций продуктов BPP079 и BPP083, конечного продукта (GF-элюат) экспериментальных серий BPP079 GF-элюат и BPP083 GF-элюат, очищенных в соответствии с Примером 9 (Таблицы 17-18). В качестве вещества сравнения используют коммерчески доступный продукт FVIII (ReFacto® - лот 70591). Левое стекло: окрашенные серебром изображения гелей с BPP079 и BPP083 GF-элюатами и ReFacto®. Правое стекло: изображение вестерн-блоттинга с BPP083 GF-элюатами и ReFacto®.
Выводы из Примера 9
Описанный способ очистки может быть осуществлен в промышленном масштабе по методу, который воспроизводим с точки зрения степени извлечения, чистоты и качества продукта. Кроме того, он удовлетворяет самым высоким требованиям по чистоте продукта, так что указанный продукт может быть использован для лечения людей.
Пример 10: Осуществление последовательности стадий очистки в промышленном масштабе без использования специфического аффинного лиганда (анионная многомодальная смола; используют Capto Adhere)
С целью исследования воспроизводимости степени извлечения и чистоты, стадии очистки 2-3 (Capto MCC и SP Sepharose FF) и стадию 5 (инактивация вируса), как описано в Примере 9, проводят для двух партий (BPP068-069) в полупромышленном масштабе. Для проведения дальнейших обработок две экспериментальные серии затем объединяют в одну экспериментальную серию (BPP071) и проводят операции в соответствии со стадиями 6-9 Примера 9, за исключением того, что стадию 6 (обработка гелем VIIISelect) заменяют на стадию анионообменной многомодальной хроматографии (Capto Adhere). Полностью последовательность операций очистки можно изучить в Приложении 2. Каждую партию (BPP068-069) изначально получают из приблизительно 50 л суспензии клеток, как описано в Примерах 1-2.
Стадия Capto Adhere
В анионообменную многомодальную колонку (Capto Adhere, GE HealthCare, каталожный № 17-5444) помещают 5000-10000 IU FVIII/мл смолы. Гель перед помещением продукта выравнивают с помощью выравнивающего буфера. Раствор после инактивации вируса (как описано в Примере 9 на стадии 5) помещают в колонку Capto Adhere, которую затем споласкивают выравнивающим буфером и последовательно промывают промывочными буферами 1-3, после чего элюируют FVIII, как описано в Таблице 20.
Обобщенные результаты двух первых хроматографических стадий (в соответствии с Примером 9, стадии 2-3) очистки двух полупромышленных экспериментальных серий
* Определяют методом Брэдфорда
Обобщенные результаты хроматографических стадий (стадия 5 Примера 9, Capto Adhere, стадии 8-9 Примера 9) заключительной части очистки одной полупромышленной экспериментальной серии
3) Выход рассчитан для стадии Q Sepharose
4) Выход рассчитан для стадии гель-фильтрации
* Определяют методом Брэдфорда
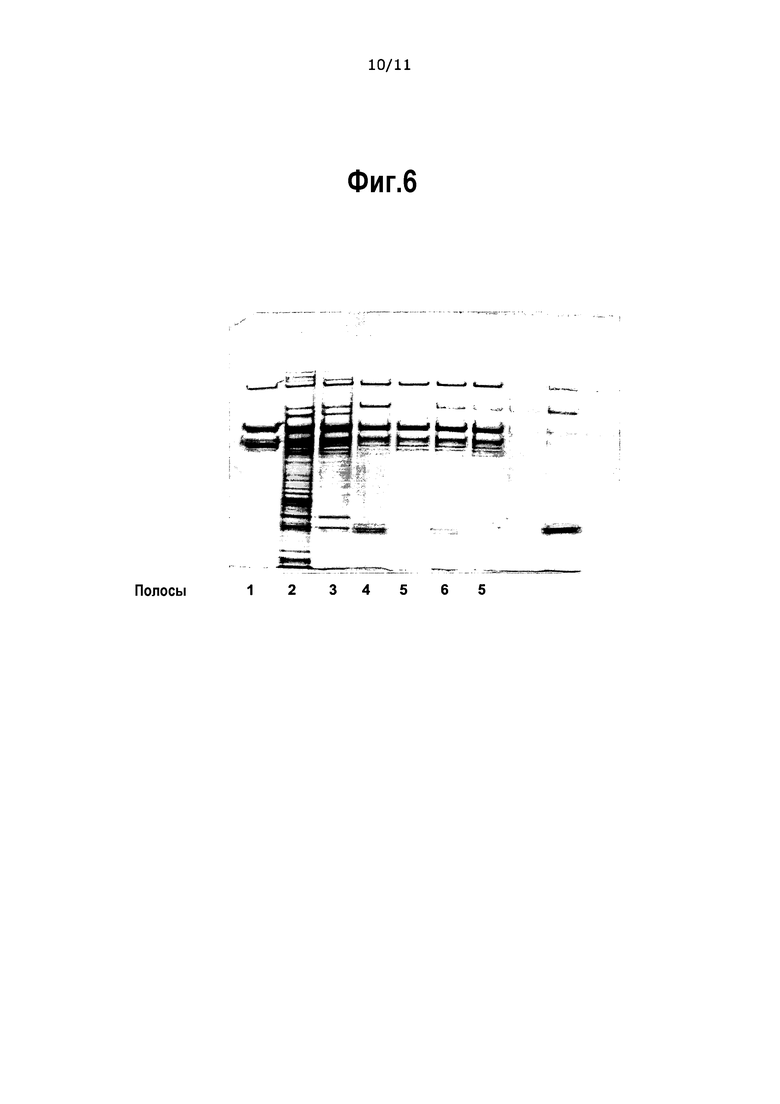
На фиг.6 приведены окрашенные серебром образцы геля SDS-PAGE из полупромышленной экспериментальной серии BPP071, очищенной в соответствии с Примером 10. Полоса 1 показывает коммерчески доступный продукт FVIII (ReFacto®). Полоса 2 показывает исходное вещество (SP-фильтрат) перед стадией Capto Adhere. Полоса 3 показывает степень чистоты Capto Adhere элюата. Полоса 4 показывает чистоту после последовательности обработок SP фильтрат – Capto Adhere – Q Seph. Полоса 5 показывает чистоту после последовательности очистки SP фильтрат – Capto Adhere – Q Seph – гель-фильтрация.
На фиг.7 приведен гель по методу вестерн-блоттинга для образцов экспериментальной серии BPP071, очищенной в соответствии с Примером 10. Полоса 1 показывает коммерчески доступный продукт FVIII (ReFacto®). Полоса 2 показывает Capto Adhere элюат. Полоса 3 показывает результат последовательности очисток SP фильтрат – Capto Adhere – Q Seph. Полоса 4 показывает результаты после последовательности очистки SP фильтрат – Capto Adhere – Q Seph – гель-фильтрация.
Выводы из Примера 10
Способ очистки экспериментальной серии, включающий стадию многомодальной хроматографии (Capto Adhere) вместо использования аффинного лиганда VIIISelect, позволяет добиться той же самой степени извлечения, чистоты и качества продукта в конечном GF-элюате.
Описание анализа
FVIII:C. Методика отбора на основе Coatest
Способ основан на проведении двухстадийной процедуры, и его осуществляют по методике с использованием микропланшетов для титрования. На первой стадии генерируют активированный фактор X (Xa) за счет протекания каскада внутренних реакций, в которых FVIII:C действует как кофактор. На второй стадии проводят определение фактора Xa с использованием синтетического хромогенного субстрата, S-2222, в присутствии ингибитора тромбина I-2581, чтобы предотвратить гидролиз субстрата тромбином. Реакцию останавливают, добавив кислоту, и активность FVIII:C, которая пропорциональна высвобождению pNa (п-нитроанилина), определяют фотометрически на длине волны 405 нм по отношению к холостому контрольному реагенту.
Способ соответствует требованиям Европейской Фармакопеи. Единицу FVIII:C выражают в международных единицах (IU), как определено в Международном стандарте концентрата (IS), установленном Всемирной организацией здравоохранения (WHO). По стандартной методике для предварительных разбавлений оценивают буфер, содержащий 1% BSA вместо жесткой гемофильной плазмы. См. также литературные ссылки (European Pharmacopoeia Supplement 2000, general Methods, 2.7.4. Assay of Blood Coagulation FVIII; Rosén S. (1984) Assay of FVIII: C with a Chromogenic Substrate. J. Haematol., Suppl 40, vol. 33, 139-145, 1984; Carlebjörk G., Oswaldsson U., Rosén S. (1987) A simple and accurate micro plate assay for the determination of FVIII activity. Thrombosis Research 47; 5-14, 1987; Mire-Sluis A. R., Gerrard T., Gaines das R., Padilla A. and Thorpe R. Biological assays: Their Role in the development and quality Control of Recombinant Biological Medicinal Products. Biological, 24, 351-362 (1996)).
Определение общего белка по Брэдфорду
Определение белка методом Брэдфорда основано на том наблюдении, что максимум поглощения для кислого раствора красителя Кумасси бриллиантового синего G-250 сдвигается с 465 нм до 595 нм, когда происходит связывание с белком. Как гидрофобные, так и ионные взаимодействия стабилизируют анионную форму красителя, вызывая видимое изменение цвета. Анализ удобен, поскольку коэффициент экстинкции раствора комплекса краситель-альбумин постоянен в 10-кратном диапазоне концентраций. Для получения дальнейшей информации см. также ссылку Bradford, M.M. A rapid and sensitive method for the quantisation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry 72: 248-254. 1976.
Определение общего белка аминокислотным анализом (AAA)
Перед проведением AAA все белки гидролизуют с помощью 6 М HCl в течение 24 час при температуре 110°С. Аминокислоты разделяют методом катионообменной хроматографии на сульфированной полистирольной смолы и непрерывно определяют в элюенте. Детектирование основано на функционализации нингидрина после колонки с использованием двойного промотора для одновременного измерения на длине волны 440 нм для пролина и гидроксипролина и на длине волны 570 нм для всех других аминокислот. Обе аминокислоты аспарагин и глутамин определяются при проведении AAA как аспарагиновая кислота и глутаминовая кислота, соответственно. Таким образом, результаты для аспарагиновой кислоты и глутаминовой кислоты представляют собой суммарное значение для аспарагиновой кислоты/аспарагина (Asx) и глутаминовой кислоты/глутамина (Glx), соответственно, в исходном образце. Триптофан при использовании данного способа не генерирует различимого ответа и, таким образом, не определяется в AAA. Цистеин разрушается в процессе гидролиза и количественно не определяется. Проведение AAA подробно описано в следующей ссылке: Total protein AAA analytical method. Spackman, D. H., Stein, W. H., and Moore, S. (1958) Anal. Biochem. 30: 1190-1206.
Чистота или удельная активность (FVIII:C/общий белок)
Чистоту (которую также называют удельной активностью) для образца рассчитывают, используя значение, полученное из анализа FVIII:C, и делят его на значение, полученное из анализа общего белка.
SDS-PAGE (определение молекулярной массы)
Электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) включает разделение белков в зависимости от их размера. Данный способ описывает методику SDS-PAGE белков, которую проводят в восстановительных условиях. При нагревании образца в денатурирующих и восстановительных условиях белки разворачиваются и покрываются анионным поверхностно-активных веществом додецилсульфатом натрия (SDS), приобретая большой общий отрицательный заряд, который пропорционален длине цепи полипептида. При загрузке в матрицу полиакриламидного геля и помещении в электрическое поле отрицательно заряженные молекулы белка мигрируют к положительно заряженному электроду и разделяются по типу молекулярных сит, т.е. по их молекулярной массе. Полиакриламидные гели не позволяют молекулам большего размера мигрировать также быстро, как молекулам меньшего размера. Поскольку отношение заряда к массе практически одинаково для SDS-денатурированных полипептидов, то конечное разделение белков практически полностью зависит от разности относительной молекулярной массы полипептидов. В геле однородной плотности относительное расстояние миграции белка (Rf) обратно пропорционально логарифму его массы. Если белки известной массы прогоняют одновременно с неизвестными, то можно построить на графике зависимость между Rf и массой, и оценить значения для массы неизвестных белков. Полосы белков, разделенные электрофорезом, визуализируют окрашиванием серебром. Оценку проводят визуально, проводя сравнение внешнего вида со стандартами, сравнительным (эталонным) образцом и анализируемыми образцами.
Аналитический способ для ДНК (количественная полимерная цепная реакция, qPRC)
Анализ представляет собой количественный ЦПР (qPRC) в реальном масштабе времени на основе химического взаимодействия SYBR Green 1. Он основан на публикации Umetani et al. с некоторыми внесенными улучшениями (Umetani N., Kim J., Hiramatzu S., Reber H. A., Hines O. J., Bilchik A. J. and Hoon DSB Increased Integrity of Free Circulating DNA in Sera of Patients with Colorectal or Periampullary Cancer: Direct Quantitative PCR for ALU Repeats. Clin. Chem. 2006;52: 1062-1069). В течение каждого цикла ПЦР фрагмент размером 115 пар оснований из семейства последовательности ALU амплифицируют с использованием праймеров, ALU115-F and ALU115-R. Часто встречающееся семейство последовательности ALU ограничивается геномом представителей семейства Hominidae (шимпанзе, горилла, человек и орангутанг), однако в указанном анализе амплифицируется лишь ДНК человека. Указанная методика позволяет провести высокопроизводительный анализ остаточных ДНК HEK29F в бесклеточной культуральной среде и контроль последующих стадии ее очистки.
Вестерн-блоттинг, анализ молекулярно-массового распределения
Белки и пептиды в препаратах FVIII разделяют в соответствии с молекулярной массой методом электрофореза в полиакриламидном геле (PAGE) с додецилсульфатом натрия (SDS) в восстановительных условиях. Затем белки переносят методом электрофореза из матрицы геля на мембраны из нитроцеллюлозы, которые затем инкубируют с блокирующим агентом. Затем добавляют поликлональные антитела овцы против полной молекулы FVIII, и второе антитело, которое специфично для Fc части антител козла/овцы. На третьей стадии добавляют растворимые комплексные антитела козла против пероксидазы хрена (HRP) и добавляют HRP. После этого обнаруживают полипептиды FVIII по появлению синих полос после инкубирования с субстратом 4-хлор-1-нафтолом.
Двумерный электрофорез в полиакриламидном геле (2-D PAGE)
2-D PAGE проводят, чтобы изучить картину полос при проведении электрофореза для белковых цепей Human-cl rhFVIII. Изоэлектрическое фокусирование проводят одномерно, используя линейный градиент рН в диапазоне от 3 до 10. Двумерный SDS-PAGE проводят, используя полиакриламидные гели, в градиенте 3-8%. Гели либо окрашивают серебряным красителем с последующим двумерным прогоном, либо подвергают вестерн-блоттингу (O'Farrell P.H (1975) High resolution two-dimensional electrophoresis of proteins. J. Biol. Chem. 250: 4007-4021).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЧИСТКИ ФАКТОРА СВЕРТЫВАНИЯ КРОВИ VIII | 2009 |
|
RU2567811C2 |
| СПОСОБ ПРОИЗВОДСТВА ФАКТОРА VIII, ИМЕЮЩЕГО УЛУЧШЕННОЕ СООТНОШЕНИЕ FVIII:C/FVIII:Ag | 2015 |
|
RU2695428C2 |
| СПОСОБ ОЧИСТКИ ВИТАМИН К-ЗАВИСИМЫХ БЕЛКОВ, ТАКИХ КАК КОАГУЛЯЦИОННЫЙ ФАКТОР IX | 2011 |
|
RU2590726C2 |
| СПОСОБ ОЧИСТКИ ВИТАМИН К-ЗАВИСИМЫХ БЕЛКОВ, ТАКИХ КАК КОАГУЛЯЦИОННЫЙ ФАКТОР VII | 2011 |
|
RU2731720C2 |
| СПОСОБ ОЧИСТКИ БЕЛКА ФАКТОРА РОСТА | 2011 |
|
RU2571926C2 |
| СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ ЦЕЛЕВОГО БЕЛКА БЕЗ ПРИМЕСИ ПРИОНОВОГО БЕЛКА PrP | 2008 |
|
RU2491292C2 |
| СПОСОБ ОТДЕЛЕНИЯ ФАКТОРА VIII ОТ ПРОДУКТОВ КРОВИ | 2017 |
|
RU2734783C2 |
| СПОСОБ ОЧИСТКИ БЕЛКОВ | 2011 |
|
RU2610667C2 |
| СПОСОБ ОЧИСТКИ БЕЛКА ФАКТОРА СВЕРТЫВАНИЯ VIII И СПОСОБ СТАБИЛИЗАЦИИ БЕЛКА ФАКТОРА VIII | 2008 |
|
RU2493163C2 |
| СПОСОБ ОЧИСТКИ БЕЛКА СЛИЯНИЯ | 2015 |
|
RU2698654C2 |






Изобретение относится к области биотехнологии. Описана композиция, подходящая для лечения гемофилии А, содержащая очищенный рекомбинантный FVIII, полученный способом очистки или обогащения фактора свертывания крови FVIII с использованием хроматографии. В одном из вариантов реализации фактор связывания крови FVIII получают способом хроматографии, включающим стадии: обеспечение фракции, содержащей FVIII, приведение фракции в контакт с катионной многомодальной смолой, промывание катионной многомодальной смолы водным промывочным буфером и элюирование содержащих FVIII фракций водным элюирующим буфером. Предложенное изобретение расширяет арсенал средств для лечения гемофилии А. 15 з.п. ф-лы, 7 ил., 22 табл., 10 пр.
1. Композиция, подходящая для лечения гемофилии A, содержащая очищенный рекомбинантный FVIII, полученный способом очистки или обогащения фактора свертывания крови FVIII с использованием хроматографии, включающим следующие стадии:
- обеспечение фракции, содержащей FVIII, в водном растворе с высокой ионной силой;
- приведение фракции, содержащей FVIII, в контакт с катионной многомодальной смолой;
- промывание катионной многомодальной смолы, на которую абсорбирован FVIII, водным промывочным буфером;
- элюирование содержащих FVIII фракций водным элюирующим буфером, содержащим по крайней мере одну аминокислоту, которая положительно заряжена при рН от 6 до 8; и
где последовательность очистки дополнительно включает следующие стадии в определенной последовательности:
i. осуществление хроматографии с катионообменной смолой;
ii. добавление анионной мембраны;
iii. стадия инактивации с использованием химических реагентов для вирусов с липидной оболочкой;
iv. осуществление хроматографии с аффинной смолой на основе белкового лиганда, содержащего фрагмент антитела, экспрессированного в дрожжах;
v. стадия удаления патогенов путем фильтрации с использованием фильтра со средним размером пор 20 нм;
vi. осуществление хроматографии с анионобменной смолой;
vii. осуществление хроматографии со смолой для эксклюзионной хроматографии,
отличающаяся тем, что чистота после последней стадии очистки составляет более 4000 IU/мг и что содержание ДНК составляет менее 1000 пг/1000 IU FVIII.
2. Композиция по п.1, где анионная мембрана представляет собой Sartobind Q, в частности, для уменьшения содержания ДНК.
3. Композиция по п.1, где катионная многомодальная смола представляет собой Capto MMC.
4. Композиция по п.1, где катионообменная смола представляет собой SP Sepharose FF.
5. Композиция по п.1, где стадия инактивации с использованием химических реагентов для вирусов с липидной оболочкой представляет собой инактивирующую обработку типа “растворитель/детергент” с использованием три-н-бутилфосфата и Triton X-100.
6. Композиция по п.1, где аффинная смола на основе белкового лиганда представляет собой VIIISelect.
7. Композиция по п.1, где стадия удаления патогенов путем фильтрации осуществляется с использованием фильтра со средним размером пор приблизительно 20 нм, в частности Planova 20N.
8. Композиция по п.1, где анионообменная смола представляет собой Q Sepharose FF.
9. Композиция по п.1, где смола для эксклюзионной хроматографии представляет собой Superdex 200pg.
10. Композиция по п.1, отличающаяся тем, что рекомбинантный FVIII получен из производной эмбриональных клеток почек человека 293.
11. Композиция по п.1, отличающаяся тем, что рекомбинантный FVIII представляет собой FVIII с удаленным B-доменом.
12. Композиция по п.1, отличающаяся тем, что водный раствор, содержащий FVIII, представляет собой раствор с большой концентрацией соли, соответствующей проводимости от приблизительно 25 до приблизительно 200 мС/см при 25°С.
13. Композиция по п.1, отличающаяся тем, что аминокислота, которая положительно заряжена при рН от 6 до 8, выбрана из группы аминокислот, содержащей такие аминокислоты как лизин, аргинин, гистидин и их комбинаций, в частности, в концентрациях менее 0,4М, в частности менее 0,5М.
14. Композиция по п.1, где элюирующий буфер дополнительно содержит по меньшей мере одну гидроксильную группу, которая содержит органические соединения, такие как спирт, по меньшей мере одну аминогруппу, содержащую органическое соединение, такое как аминокислота, по меньшей мере один источник ионов Ca2+, по меньшей мере одно соединение для регулирования ионной силы буфера, такое как неорганические соли, по меньшей мере один неионогенный детергент и по меньшей мере одно буферное вещество для поддержания рН в диапазоне от приблизительно 6 до приблизительно 8, в частности для поддержания приблизительно нейтрального значения рН.
15. Композиция по п.1, отличающаяся тем, что последовательность очистки дополнительно включает стадии удаления/инактивации патогенов, включающие стадии хроматографии, которые основаны на различных физиологических свойствах, направленных на удаляемый патоген.
16. Композиция по п.1, отличающаяся тем, что чистота после последней стадии очистки составляет более 9000 IU/мг и, предпочтительно, более 10000 IU/мг белка, а содержание ДНК составляет менее 100 пг/1000 IU FVIII, предпочтительно менее 10 пг/1000 IU FVIII.
| Прибор для отбирания средней пробы сыпучих материалов | 1929 |
|
SU19370A1 |
| Машина для разработки лоскута и войлочных отходов | 1954 |
|
SU101003A1 |
| ФАКТОР ФОН ВИЛЛЕБРАНДА ИЛИ ФАКТОР VIII И ФАКТОР ФОН ВИЛЛЕБРАНДА ДЛЯ ЛЕЧЕНИЯ КОАГУЛОПАТИИ, ИНДУЦИРОВАННОЙ ИНГИБИТОРАМИ ТРОМБОЦИТОВ | 2009 |
|
RU2563236C2 |
| СПОСОБ ЭВАКУАЦИИ ПОСТРАДАВШИХ | 2012 |
|
RU2486936C1 |
| US 8022187 B2, 20.09.2011. | |||
Авторы
Даты
2019-08-26—Публикация
2009-06-24—Подача