Изобретение имеет отношение к медицине, а именно к геномной дактилоскопии, медицинской генетике, молекулярно-биологическим исследованиям, генетической и лабораторной диагностике в области прогнозирования фенотипических признаков на основании генетических данных в популяции.
Каждый человек, как и любой живой организм, имеет свой характерный фенотип, отличающий его от других ему подобных организмов. Согласно современным представлениям влияние генетических факторов на экспрессию и пенетрантность (проявление) фенотипических признаков в значительной мере обусловлено наличием «качественного» генетического полиморфизма, обусловленного, главным образом, однонуклеотидными заменами, так называемыми single nucleotide polymorphism (SNP). На сегодняшний день обнаружено большое число SNP в различных генах и/или участках генома, которые связаны с разнообразными количественными фенотипическими признаками человека, такими как длина тела, вес, спектр липопротеинов и другими. Для поиска генов - кандидатов сложных фенотипов используются как классические методы (анализ сцепления и анализ ассоциаций), так и особенно популярный в настоящее время полногеномный анализ ассоциаций (метод GWAS) (Аульченко Ю.С. Разработка и применение методов полногеномного анализа генетических ассоциаций сложных признаков: дис. на соискание уч. ст. д-ра биол. наук / Аульченко Ю.С.- Новосибирск, 2010. - 291 с.).
Длина тела (рост) является классическим полигенным признаком, важным для идентификации личности. С позиции генетики длина тела человека является полигенно наследуемым признаком. Многочисленные исследования показали, что доля дисперсии длина тела, обусловленная наследственными факторами, составляет 80-90% (Weedon, M.N., G. Lettre, R.M. Freathy, С.M. Lindgren, В.F. Voight et al., 2007 A common variant of HMGA2 is associated with adult and childhood height in the general population. Nat Genet 39: 1245-1250; Аульченко, 2010). Полногеномный анализ ассоциаций, проведенный на материале пяти европейских популяций, позволил идентифицировать пять «локусов длины тела»: rs12106790 (ген CD86), rs11205415 (SH3BP31), rs849140 (JAZF1), rs1772810 (PDXD8) и rs17051743 (ADAM28). Общий вклад дисперсии по этим генам в отношении длины тела человека составляет, однако, только около 3-5% (Аульченко, 2010). Кроме того, не понятно, как на основании этих маркеров можно делать прогноз для разных этнических групп, а также для мужчин и женщин в отдельности.
В целом, результаты проведенных исследований свидетельствуют о том, что длина тела человека определяется большим числом генетических локусов и их аллельными состояниями. Однако на данный момент нет четкого представления о роли данных локусов в формировании конкретных признаков, не выявлены наиболее значимые генетические маркеры, существуют серьезные ограничения в статистических методах обработки данных при анализе количественных признаков (QTL). Все это свидетельствует об актуальности комплексных и широкомасштабных исследований генетических маркеров длины тела.
В основу изобретения положена задача определения роли и значимости локусов в формировании конкретных признаков для индивидуума и выявления наиболее значимых генетических маркеров длины тела человека.
Решение поставленной задачи обеспечивается тем, что:
А) изобретение базируется на проведенном генетического исследования более 300 образцов ДНК неродственных индивидуумов возрасте от 21 до 60 лет в рамках русской популяции, не имеющих тяжелых наследственных и мультифакторных заболеваний;
Б) в изобретении задействованы только те генетические маркеры, для которых предварительно была подтверждена: положительная ассоциация SNP маркера с признаком (которая не менее чем дважды повторяется в исследованиях, выполненных по типу «ген-фенотип» и полногеномных исследованиях ассоциаций); функциональная значимость продукта предполагаемого гена-кандидата (участие в метаболических путях, определяющих развитие и размеры тела человека); функциональная значимость генетического маркера (однонуклеотидные замены, расположены в промоторной области, границе экзон-интронных стыков и в экзонах); частота минорной аллели 10-40%;
В) изобретение подразумевает использование математической модели на основе линейной регрессии для расчета длины тела человека.
Задачей настоящего изобретения является разработка способа прогнозирования роста человека на основе генетических маркеров, позволяющих оценить его у мужчин и женщин в российской популяции.
Технический результат изобретения основан на прогнозировании длины тела человека на основании исследования образца ДНК, включающего генетический анализ гена амелогенина (AML) методом ПЦР с целью верификации пола, исследования генетических показателей методом ПЦР с дальнейшей обработкой эндонуклеазами ферментативного гидролиза (рестрикции) участков генов секреторного рецептора гормона роста (rs572169 гена GSHR), ко-репрессороподобного лигандзависимого ядерного рецептора (rs6830062 гена LCORL), связывающего белка циклин-зависимых киназ (rs4800148 гена CABLES1) у мужчин и генов хейджхок-взаимодействующего белка (rs1812175 гена HHIP) и ядерного белка с цинковыми пальцами (rs849140 гена JAZF1) у женщин и математической обработке результатов исследования.
Технический результат достигается следующим образом.
В способе прогнозирования длины тела человека на основании исследования ДНК в рамках русской популяции, в котором с помощью метода ПЦР проводят исследование участков гена амелогенина (AML) с целью верификации пола и используют локусы GSHR, LCORL, CABLES1, HHIP и JAZF1 и линейную регрессию, на основании чего длину тела человека рассчитывают на основании исследования методом ПЦР с дальнейшей обработкой эндонуклеазами ферментативного гидролиза (рестрикции) и/или методом ПЦР в реальном времени участков генов секреторного рецептора гормона роста (rs572169 гена GSHR), ко-репрессороподобного лигандзависимого ядерного рецептора (rs6830062 гена LCORL), связывающего белка циклин-зависимых киназ (rs4800148 гена CABLES1) в образцах ДНК мужского пола и участков генов хейджхок-взаимодействующего белка (rs1812175 гена HHIP) и ядерного белка с цинковыми пальцами (rs849140 гена JAZF1) в образцах ДНК женского пола путем выявления генотипов по всем соответствующим генам, делая вывод о длине тела мужчин, подставляя значения генотипов в формулу: Y=176,17+3,01*X1-1,95*Х2-1,73*Х3, где X1=0 (при генотипе G/G по гену GSHR), X1=1 (при генотипе G/A по гену GSHR) и X1=2 (при генотипе А/А по гену GSHR); Х2=0 (при генотипе А/А по гену LCORL), X2=1 (при генотипе A/G по гену LCORL), X2=2 (при генотипе G/G по гену LCORL); Х3=0 (при генотипе А/А по гену CABLES1), Х3=1 (при генотипе G/A по гену CABLES1), Х3=2 (при генотипе G/G по гену CABLES1); и делая вывод о длине тела женщин, подставляя значения генотипов в формулу: Y=163.3-1.33*X1+0.89*X2, где X1=0 (при генотипе G/G по гену HHIP), X1=1 (при генотипе A/G по гену HHIP), X1=2 (при генотипе А/А по гену HHIP) и Х2=0 (при генотипе G/G по гену JAZF1), Х2=1 (при генотипе A/G по гену JAZF1), X2=2 (при генотипе А/А по гену JAZF1).
В качестве маркера определения пола используют анализ продуктов амплификации участка гена амелогенина (AML), кодирующего компонент зубной эмали, с помощью гель-электрофореза. Данный ген несут обе половые хромосомы X и Y. Однако в половых хромосомах он находится в разных аллельных состояниях - последовательность гена в Y-хромосоме на 6 пар нуклеотидов длиннее, чем в X-хромосоме. При амплификации соответствующего участка гена у мужчин образуется два фрагмента ПЦР разной длины, у женщин образуется два продукта ПЦР одинаковой длины. Анализ продуктов амплификации с помощью электрофореза в агарозном или полиакриламидном геле позволяет установить половую принадлежность. Присутствие на электрофореграмме двух фрагментов ДНК, соответствующих размерам ПЦР-продуктов при амплификации участка гена амелогенина с X- и Y-хромосом, будет свидетельствовать о том, что исследуемый образец принадлежит мужчине. Присутствие на электрофореграмме одного фрагмента ДНК, соответствующего по длине участку гена амелогенина только с X-хромосомы, будет указывать на то, что образец принадлежит женщине.
В качестве генетических показателей из всех возможных вариантов генов, ассоциированных с длиной тела человека, используют наиболее значимые полиморфные варианты генов rs572169 гена GSHR, rs6830062 гена LCORL, rs4800148 гена CABLES1, rs1812175 гена HHIP и rs849140 гена JAZF1, ассоциированные с длиной тела человека, которые были выделены на основании проведенного исследования 52 маркеров у более 300 человек. С помощью линейной модели с факторным анализом (GLM) составлены выражения, на основании которых можно предсказать длину тела человека для мужчины: Y=176,17+3,01*X1-1,95*X2-1,73*X3, где X1=0 (при генотипе G/G по гену GSHR), X1=1 (при генотипе G/A по гену GSHR) и X1=2 (при генотипе А/А по гену GSHR); Х2=0 (при генотипе А/А по гену LCORL), X2=1 (при генотипе A/G по гену LCORL), X2=2 (при генотипе G/G по гену LCORL); Х3=0 (при генотипе А/А по гену CABLES1), Х3=1 (при генотипе G/A по гену CABLES1), Х3=2 (при генотипе G/G по гену CABLES1); и для женщины: Y=163.3-1.33*X1+0.89*X2, где X1=0 (при генотипе G/G по гену HHIP), X1=1 (при генотипе A/G по гену HHIP), X1=2 (при генотипе А/А по гену HHIP) и Х2=0 (при генотипе G/G по гену JAZF1), X2=1 (при генотипе A/G по гену JAZF1), X2=2 (при генотипе А/А по гену JAZF1). Подобное выражение рассчитано, используя регрессионный анализ при исследовании длины тела у более 300 индивидов мужского и женского пола в рамках русской популяции (p<0,004). Ошибка в предсказании длины тела составляет ±4,6 см.
Изобретение поясняется результатами анализа ПЦР продуктов гена AML и результатами анализа ПЦР продуктов после обработок эндонуклеазами ферментативного гидролиза (рестрикции) участков генов GSHR, LCORL, CABLES1, HHIP и JAZF1, приведенными на электрофореограммах (Фиг.1-7), а также описанными математическими выражениями для подсчета длины тела.
Для осуществления способа предлагаются следующие шаги.
1. Сбор биологического материала для генетического исследования.
Материалом для генетического исследования могут быть лимфоциты периферической крови, «пятна крови», буккальный эпителий и другие материалы, полученные от обследуемого пациента.
2. Выделение ДНК из полученного материала.
На сегодняшний день известно множество способов выделения ДНК. В последнее время широкое распространение получили методы, позволяющие экстрагировать высокоочищенную ДНК, а также автоматизировать процесс ее выделения. Это широкий спектр коммерческих наборов реагентов, производимых американскими и европейскими компаниями.
ДНК может быть выделена самыми разнообразными способами в зависимости от того, какой был взят биоматериал:
- классическими методами:
с использованием протеиназы К, с последующей депротеинизацией либо фенольным методом, либо солевым методом;
- с помощью коммерческих наборов;
- автоматически (с помощью специальных роботов и специальных наборов).
3. Исследование участков гена AML.
Можно использовать самые разнообразные молекулярно-генетические методы: полимеразную цепную реакцию (ПЦР), ПЦР в реальном времени и многие др.
Для получения специфических продуктов ПЦР подбирают праймеры. Их разрабатывают согласно общепринятым критериям.
В качестве праймеров для проведения полимеразной цепной реакции используют уникальные последовательности, приведенные ниже:
для исследования участка гена AML:
Праймеры:
Прямой F:  ′
′
Обратный R: 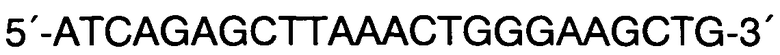
После подбора праймеров проводят амплификацию. Причем температура отжига праймеров должна быть одинакова (она составляет 65°C).
Существуют разнообразные химические подходы к синтезу олигонуклеотидных праймеров, например фосфодиэфирный метод, гидрофосфорильный метод и т.д., но наибольшее распространение в настоящее время имеет фосфорамидитный метод. Синтез праймеров осуществляют, используя автоматические ДНК/РНК синтезаторы, например, (без ограничения) производства фирмы Applied Biosystems (США) или аналогичные.
Непосредственно полимеразная цепная реакция может быть проведена с использованием любого вида термостабильной полимеразы, работающей в соответствующем буфере. Для построения новой цепи в буфер добавляется смесь дНТФ (дАТФ, дГТФ, дЦТФ, дТТФ) в принятых концентрациях. Для проведения ПЦР могут быть использованы готовые коммерчески доступные наборы, содержащие все необходимые компоненты за исключением праймеров.
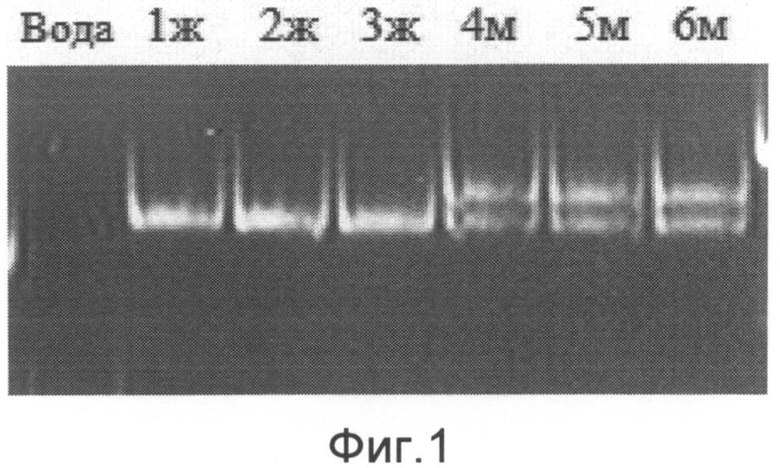
Проведение реакции позволяет наработать достаточное количество ПЦР-продукта для дальнейшего анализа в ПААГ. После проводят детекцию фрагментов ДНК в полиакриламидном или ином гелях разной процентности, рекомендованной для разделения соответствующих ПЦР продуктов. Подтверждением результата наличия ПЦР-продуктов служат соответствующие бэнды (полосы) (на фиг.1 приведены примеры электрофореграмм ПЦР-продуктов с образцами ДНК мужчин и женщин. Примечание: вода - отрицательный контроль, 1ж-3ж - образцы женщин, 4м-6м - образцы мужчин).
Как видно, при добавлении в реакционную смесь образцов ДНК, принадлежащих мужчинам, на электрофореграмме детектируются 2 фрагмента, соответствующие ожидаемым размерам ПЦР-продуктов при амплификации участка гена амелогенина с обеих половых хромосом. При добавлении ДНК, принадлежащих женщинам, виден только один фрагмент, соответствующий по длине участку гена амилогенина с Х-хромосомы. При отсутствии ДНК ампликоны не образуются, бэнды на электрофореграмме не зарегистрированы.
4. Исследование участков генов, включающих rs572169 гена GSHR, rs6830062 гена LCORL, rs4800148 гена CABLES1, rs1812175 гена HHIP и rs849140 гена JAZF1.
Для получения специфических продуктов ПЦР подбирают праймеры. Их разрабатывают согласно общепринятым критериям.
В качестве праймеров для проведения полимеразной цепной реакции используют уникальные последовательности, приведенные ниже:
для исследования участка гена GSHR:
Праймеры:
Прямой F: 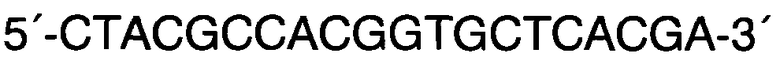
Обратный R: 
для исследования участка гена LCORL:
Прямой F: 
Обратный R: 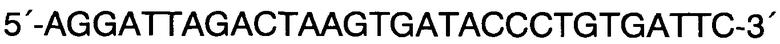
для исследования участка гена CABLES1:
Прямой F: 
Обратный R: 
для исследования участка гена HHIP:
Прямой F: 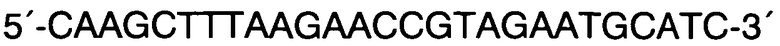
Обратный R: 
для исследования участка гена JAZF1:
Прямой F: 
Обратный R: 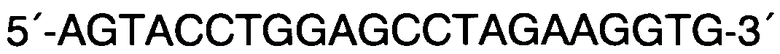
После подбора праймеров проводят амплификацию. Причем температура отжига праймеров должна быть одинакова (она составляет 60°C). Олигопраймеры синтезируют по стандартным условиям, как описано выше. ПЦР проводят также по стандартной схеме (см. выше).
Проведение реакции позволяет наработать достаточное количество ПЦР-продукта для дальнейшего анализа эндонуклеазами ферментативного гидролиза (рестрикцией).
Непосредственно рестрикция эндонуклеазами может быть проведена с использованием определенных ферментов, способных «расщеплять» ПЦР продукты в определенных сайтах (указанных ниже), которые работают в соответствующих буферах и при соответствующих условиях, рекомендованных производителями. Для рестрикции могут быть использованы ферменты разных производителей.
для исследования участка гена GSHR:
Рестриктаза BspAC I (C↑CGC)
для исследования участка гена LCORL:
Рестриктаза BamH I (G↑GATCC)
для исследования участка гена CABLES1:
Рестриктаза Acl I (AA↑CGTT)
для исследования участка гена ННIР:
Рестриктаза Taq I (T↑CGA)
для исследования участка гена JAZF1:
Рестриктаза Fsp4H I (GC↑NGC)
После обработки эндонуклеазами ферментативного гидролиза (рестрикции) проводят детекцию фрагментов ДНК в полиакриламидном или ином гелях разной процентности, рекомендованной для разделения соответствующих ПЦР продуктов. Подтверждением результата прохождения ферментативного гидролиза служит наличие соответствующих бэндов.
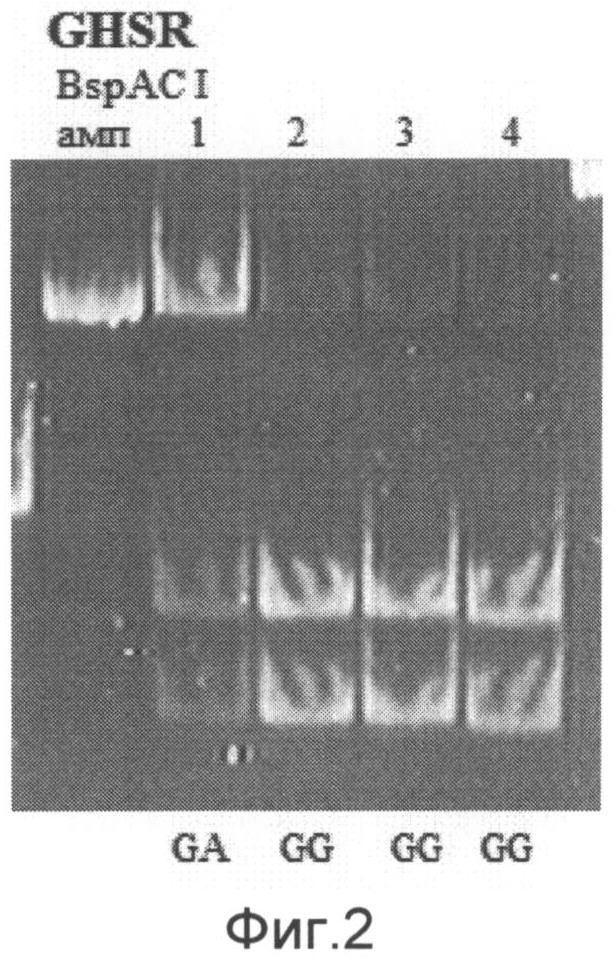
При анализе гена GSHR можно выявить три ПЦР фрагмента длиной 211 п.н., 114 п.н. и 96 п.н., соответствующие разным генотипам. О наличии генотипа G/G в исследуемом образце судят по наличию двух ПЦР-фрагментов длиной 114 п.н. и 96 п.н. О наличии генотипа G/A в исследуемом образце судят по наличию трех ПЦР-фрагментов длиной 211 п.н., 114 п.н. и 96 п.н. О наличии генотипа А/А в исследуемом образце судят по наличию ПЦР-фрагмента длиной 211 п.н. (на фиг.2 приведен пример электрофореграммы после проведения энзиматической рестрикции для гена GHSR. Примечание: амп. - амплификат, 1-4 - образцы ДНК, G/A, G/G - соответствующие генотипы).
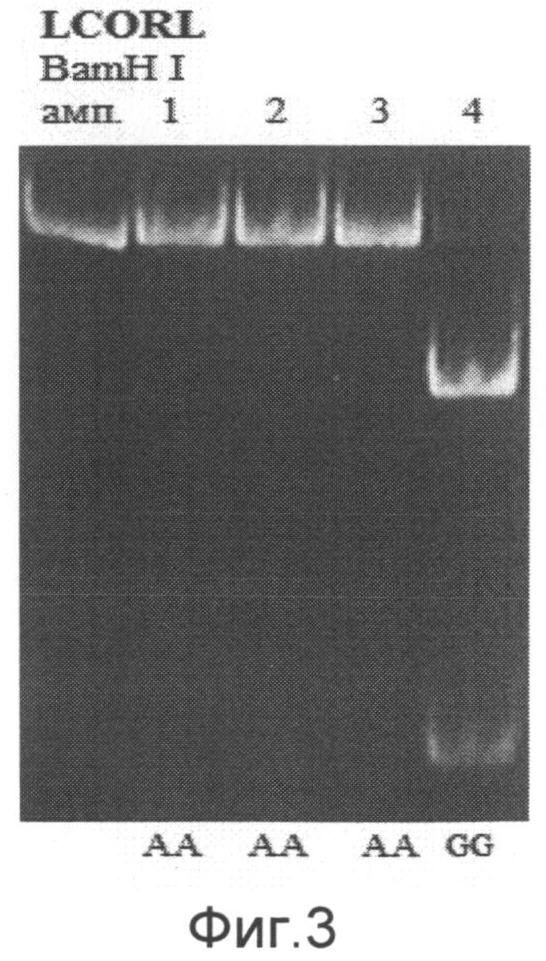
При анализе гена LCORL можно выявить три ПЦР-фрагмента длиной 196 п.н., 138 п.н. и 58 п.н., соответствующие разным генотипам. О наличии генотипа G/G в исследуемом образце судят по наличию двух ПЦР-фрагментов длиной 138 п.н. и 58 п.н. О наличии генотипа A/G в исследуемом образце судят по наличию трех ПЦР-фрагментов длиной 196 п.н., 138 п.н. и 58 п.н. О наличии генотипа А/А в исследуемом образце судят по наличию ПЦР-фрагмента длиной 196 п.н. (на фиг.3 показан пример электрофореграммы после проведения энзиматической рестрикции для гена LCORL Примечание: амп. - амплификат, 1-4 - образцы ДНК, А/А, G/G - соответствующие генотипы).
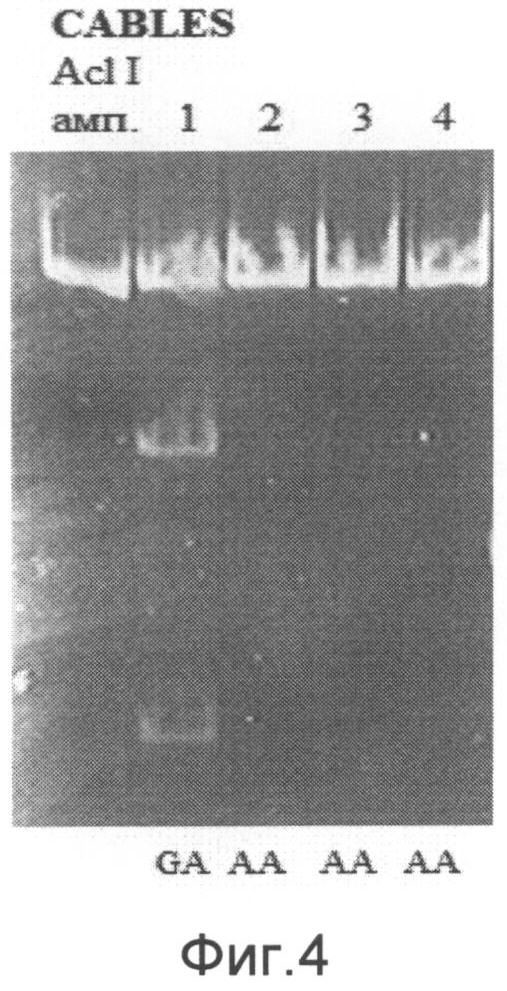
При анализе гена CABLES можно выявить три ПЦР-фрагмента длиной 274 п.н., 185 п.н. и 89 п.н., соответствующие разным генотипам. О наличии генотипа G/G в исследуемом образце судят по наличию двух ПЦР-фрагментов длиной 185 п.н. и 89 п.н. О наличии генотипа G/A в исследуемом образце судят по наличию трех ПЦР-фрагментов длиной 274 п.н., 185 п.н. и 89 п.н. О наличии генотипа А/А в исследуемом образце судят по наличию ПЦР-фрагмента длиной 274 п.н (на фиг.4 приведен пример электрофореграммы после проведения энзиматической рестрикции для гена CABLES. Примечание: амп. - амплификат, 1-4 - образцы ДНК, G/A, G/G - соответствующие генотипы).
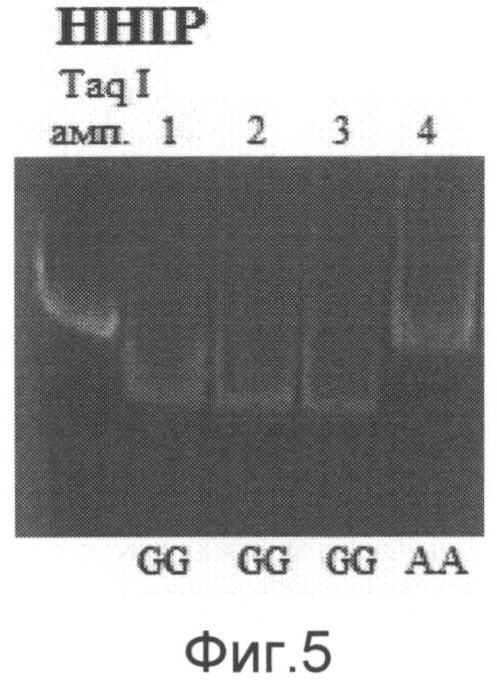
При анализе гена HHIP можно выявить три ПЦР-фрагмента длиной 250 п.н., 224 п.н. и 26 п.н., соответствующие разным генотипам. О наличии генотипа G/G в исследуемом образце судят по наличию двух ПЦР-фрагментов длиной 224 п.н. и 26 п.н. О наличии генотипа A/G в исследуемом образце судят по наличию трех ПЦР-фрагментов длиной 250 п.н., 224 п.н. и 26 п.н. О наличии генотипа А/А в исследуемом образце судят по наличию ПЦР-фрагмента длиной 250 п.н. (на фиг.5 показан пример электрофореграммы после проведения энзиматической рестрикции для гена HHIP. Примечание: амп. - амплификат, 1-4 - образцы ДНК, А/А, G/G - соответствующие генотипы).
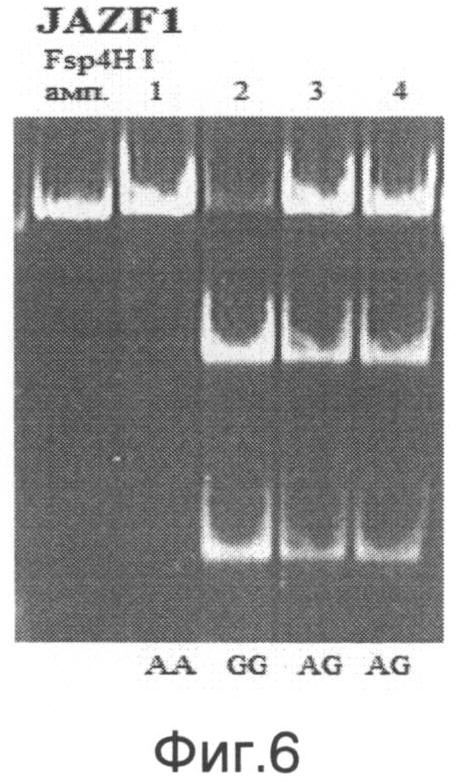
При анализе гена JAZF1 можно выявить три ПЦР-фрагмента длиной 219 п.н., 140 п.н. и 79 п.н., соответствующие разным генотипам. О наличии генотипа G/G в исследуемом образце судят по наличию двух ПЦР-фрагментов длиной 140 п.н. и 79 п.н. О наличии генотипа A/G в исследуемом образце судят по наличию трех ПЦР-фрагментов длиной 219 п.н., 140 п.н. и 79 п.н. О наличии генотипа А/А в исследуемом образце судят по наличию ПЦР-фрагмента длиной 219 п.н (на фиг.6 приведен пример электрофореграммы после проведения энзиматической рестрикции для гена JAZF1. Примечание: амп. - амплификат, 1-4 - образцы ДНК, А/А, G/A, G/G - соответствующие генотипы.).
5. Прогнозирование длины тела.
Прогнозирование длины тела мужчин осуществляют по следующей формуле:
Y=K0+K1*X1+K2*X2+K3*X3,
где K0=176,17; K1=3,01; K2=-1,95; K3=-1,73; где X1=0 (при генотипе G/G по гену GSHR), X1=1 (при генотипе G/A по гену GSHR) и X1=2 (при генотипе А/А по гену GSHR); Х2=0 (при генотипе А/А по гену LCORL), X2=1 (при генотипе A/G по гену LCORL), Х2=2 (при генотипе G/G по гену LCORL); Х3=0 (при генотипе А/А по гену CABLES1), Х3=1 (при генотипе G/A по гену CABLES1), Х3=2 (при генотипе G/G по гену CABLES 1).
Прогнозирование длины тела женщин осуществляют по следующей формуле:
Y=K0+K1*X1+K2*X2,
где K0=163.30; K1=-1.33; K2=0.89; где X1=0 (при генотипе G/G по гену HHIP), X1=1 (при генотипе A/G по гену HHIP), X1=2 (при генотипе А/А по гену HHIP) и Х2=0 (при генотипе G/G по гену JAZF1), Х2=1 (при генотипе A/G по гену JAZF1), Х2=2 (при генотипе А/А по гену JAZF1).
Изобретение подтверждается примерами конкретного осуществления способа.
Пример 1. Использование предложенного способа для прогнозирования длины тела
На месте преступления найден образец крови индивида X, для которого необходимо составить некоторую описательную характеристику, включающую длину тела человека.
Для этого из образца крови стандартным методом выделяют ДНК.
Для образца ДНК готовят ПЦР смесь в пробирках объемом 25 мкл. Состав смеси следующим: 67 мМ трис-HCI, pH 8,8 при 25°C; 16,6 мМ (NH4)2SO4; 6,7 мМ MgCl2; 6,7 мкм ЭДТА; 10 мМ 2-меркаптоэтанола, 170 мкг БСА, смесь четырех основных dNTP в концентрации 0,8 мМ каждого, термостабильная ДНК-полимераза 0,5 ед/мкл, и праймеры для исследования участка гена AML по 10 пмоль каждого. В каждую пробирку вносят по 1 мкл ДНК. В каждую пробирку вносят по 1 мкл ДНК. Всю смесь нагревают при 95°C в течение 5 мин, затем проводят 10 циклов амплификации с использованием любого отечественного и зарубежного термоциклера по следующей схеме: 95°C - 15 сек, 65°C - 20 сек; затем 20 циклов по схеме: 95°C - 10 сек, 60°C - 20 сек, 72°C - 30 сек. Завершающая инкубация: 72°C - 5 мин.
Далее выполняют идентификацию ПЦР-продукта, используя электрофоретическое разделение продуктов ПЦР в 6% полиакриламидном геле (ПААГ), приготовленном на десятикратном трис-боратном буфере в аппарате для вертикального электрофореза с длиной стекла 20-22 см. Для приготовления 40 мл 6% геля смешивают: 8 мл 30% p-p акриламида (29 г акриламида; 1 г N,N метилен-бисакриламида на 100 мл водного раствора), 4 мл 10х ТБЕ (89 мМ трис-борат (pH 8,3-8,6), 2 мМ ЭДТА), 28 мл дистиллированной воды, 40 мкл тетраэтилендиамина (TEMED), 400 мкл персульфата аммония (PSA). Перед заливкой раствор тщательно перемешивают. После амплификации непосредственно к аликвотам реакционной смеси (~10 мкл) добавляют буфер для нанесения проб (~2 мкл) и проводят электрофорез (шестикратный буфер для нанесения проб состоит из 0,25% бромфенола, 0,25% ксилен-цианола и 15% фикола). Электрофорез проводят при напряжении 100 В до тех пор, пока образец не входит в гель и не проходит около 1 см от начала лунок. В дальнейшем напряжение увеличивают до 300 В. Остановку электрофореза проводят за 1 см до выхода бромфенола из геля. Затем гель окрашивают в водном растворе этидиум-бромида (0,5 мкг/мл), а визуализация результатов проводят в проходящем ультрафиолетовом свете на трансиллюминаторе Macrovue (LKB, Великобритания).
Как видно, при добавлении в реакционную образца ДНК, принадлежащего мужчине, на электрофореграмме детектируются 2 фрагмента, соответствующие ожидаемым размерам ПЦР-продуктов при амплификации участка гена амелогенина с обеих половых хромосом (см. образец №5 на фиг.1).
Далее для образца ДНК мужчины готовят ПЦР смесь в 3-х пробирках объемом 25 мкл (соответствующие трем генам: GSHR, LCORL, CABLES1). Состав смеси следующим: 67 мМ трис-HCI, pH 8,8 при 25°C; 16,6 мМ (NH4)2SO4; 6,7 мМ MgCl2; 6,7 мкм ЭДТА; 10 мМ 2-меркаптоэтанола, 170 мкг БСА, смесь четырех основных dNTP в концентрации 0,8 мМ каждого, термостабильная ДНК-полимераза 0,5 ед/мкл, и праймеры по 10 пмоль для каждого гена в отдельности. В каждую пробирку вносят по 10-100 нг ДНК. Всю смесь нагревают при 94°C в течение 5 мин, затем проводят 37 циклов амплификации с использованием любого отечественного и зарубежного термоциклера (ПЦР-амплификатора) по следующей схеме: 94°C - 30 сек, 60°C - 30 сек, 72°C - 1 мин. Завершающая инкубация: 72°C - 5 мин.
Далее выполняют идентификацию ПЦР-продуктов, используя электрофоретическое разделение продуктов ПЦР в 6% полиакриламидном геле (ПААГ) (как описано выше).
После подтверждения прохождения амплификации по наличию соответствующих бэндов (полос) (для гена GSHR - 211 п.н., для гена LCORL - 196 п.н., для гена CABLES1 - 274 п.н.), получившийся продукт ПЦР подвергают ферментативному гидролизу по схеме (на одно исследование):
для гена GSHR:
- 0,5 мкл эндонуклеазы рестрикции BspAC I (Сибэнзим)
- 1,5 мкл буфер О (Сибэнзим)
- 8 мкл воды
- 5 мкл продукта ПЦР
для гена LCORL:
- 0,5 мкл эндонуклеазы рестрикции BamH I (Сибэнзим)
- 1,5 мкл буфер G (Сибэнзим)
- 8 мкл воды
- 5 мкл продукта ПЦР
для гена CABLES1:
- 0,5 мкл эндонуклеазы рестрикции Acl I (Сибэнзим)
- 1,5 мкл буфер Y (Сибэнзим)
- 8 мкл воды
- 5 мкл продукта ПЦР
Гидролиз проводят в течение 12 часов при температуре 37°C.
Данные эндонуклеазы ферментативного гидролиза (рестрикции) расщепляют специфическую последовательность ДНК на вышеуказанные фрагменты или же этого не происходит.
Затем проводят электрофорез в 8% полиакриламидном геле. Определяемые мутации приведены на фигуре 7.
На фиг.7 представлена электрофореграмма результата обработки эндонуклеазами ферментативного гидролиза (рестрикции) BspAC I, BamH I, Acl I ПЦР продуктов генов GSHR, LCORL, CABLES1, соответственно.
Дорожка 1 А, Б, В - соответствует ПЦР продукту амплификации соответствующего гена (амп.).
Дорожка 2 А соответствует генотипу G/G по гену GSHR.
Дорожка 2 Б соответствует генотипу А/А по гену LCORL.
Дорожка 2 В соответствует генотипу G/G по гену CABLES.
Далее прогнозирование длины тела мужчин осуществляют по следующей формуле:
Y=176,17+3,01*X1-1,95*X2-1,73*X3, где X1=0 (при генотипе G/G по гену GSHR), Х2=0 (при генотипе А/А по гену LCORL), Х3=0 (при генотипе А/А по гену CABLES1).
Т.е. Y=176,17+3,01*0-1,95*0-1,73*0=176,17.
Прогнозная длина тела для индивида Х составляет 176,17 см ±4,6 см.
Предлагаемый способ основан на генетическом исследовании, прост в исполнении, не требует высокоспециализированного оборудования.
Предлагаемый способ может быть применен в таких медицинских организациях, как судебно-криминалистические лаборатории, медико-генетические лаборатории, организации, осуществляющие анализы в области геномной дактилоскопии, и др.
Способ имеет важное практическое значение. Он позволяет, не имея никакой информации, кроме наличия биологического образца, предсказать длину тела человека.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ РИСКА РАЗВИТИЯ МЕТАБОЛИЧЕСКОГО СИНДРОМА У ДЕТЕЙ НА ОСНОВЕ ГЕНЕТИЧЕСКИХ И БИОХИМИЧЕСКИХ МАРКЕРОВ | 2012 |
|
RU2492485C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФИЗИЧЕСКОЙ РАБОТОСПОСОБНОСТИ ЧЕЛОВЕКА | 2008 |
|
RU2414511C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ГЕСТОЗА НА ОСНОВЕ ГЕНЕТИЧЕСКИХ МАРКЕРОВ | 2010 |
|
RU2431842C1 |
| СПОСОБ ДИАГНОСТИКИ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ И ДИАГНОСТИЧЕСКИЙ НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2005 |
|
RU2304775C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ НАРУШЕНИЯ ФЕРТИЛЬНОСТИ У МУЖЧИН | 2006 |
|
RU2314530C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ЭССЕНЦИАЛЬНОЙ ГИПЕРТЕНЗИИ У ЖЕНЩИН | 2011 |
|
RU2458144C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ПРЕЖДЕВРЕМЕННЫХ РОДОВ | 2016 |
|
RU2626510C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА ВОЗНИКНОВЕНИЯ ГИПЕРТОНИЧЕСКОЙ БОЛЕЗНИ У МУЖЧИН | 2011 |
|
RU2456608C1 |
| Способ диагностики полиморфизма гена NHLRC2, обуславливающего генетический дефект дупликации развития крупного рогатого скота абердин-ангусской породы | 2018 |
|
RU2715330C2 |
| Способ диагностики предрасположенности к почечно-клеточному раку на основе ПЦР-ПДРФ | 2019 |
|
RU2723090C1 |

Изобретение относится к области биотехнологии и касается способа прогнозирования длины тела человека в рамках русской популяции. Представленный способ основан на исследовании ДНК, в котором с помощью метода ПЦР и при использовании определенных праймеров проводят исследование участков генов амелогенина (AML), используя локусы генов секреторного рецептора гормона роста (GSHR), ко-репрессороподобного лигандзависимого ядерного рецептора (LCORL) и связывающего белка циклин-зависимых киназ (CABLES1) в образцах ДНК мужского пола и генов хейджхок-взаимодействующего белка (HHIP) и ядерного белка с цинковыми пальцами (JAZF1) в образцах ДНК женского пола. Вывод о длине тела делается путем подставления полученных значений в определенную формулу и математической обработки результатов исследования. Охарактеризованное решение может быть использовано в геномной дактилоскопии, медицинской генетике, молекулярно-биологических исследованиях в области прогнозирования фенотипических признаков на основании генетических данных в популяции. 7 ил., 1 пр.
Способ прогнозирования длины тела человека на основании исследования ДНК в рамках русской популяции, в котором с помощью метода ПЦР с праймерами F: 5′-CCCTGGGCTCTGTAAAGAATAGTG-3′ и R: 5′-ATCAGAGCTTAAACTGGGAAGCTG-3′ проводят исследование участков гена амелогенина AML с целью верификации пола и используют локусы GSHR, LCORL, CABLES1, HHIP и JAZF1 и линейную регрессию, отличающийся тем, что длину тела человека рассчитывают на основании исследования методом ПЦР с дальнейшей обработкой эндонуклеазами ферментативного гидролиза или рестрикции и/или методом ПЦР в реальном времени участков генов секреторного рецептора гормона роста rs572169 гена GSHR с праймерами F: 5′-CTACGCCACGGTGCTCACGA-3′ и R: 5′-CTCGTTGGTGTCCCAAGGGTC-3′, ко-репрессороподобного лигандзависимого ядерного рецептора rs6830062 гена LCORL с праймерами F: 5′-CAGGTTATTAGCAGCTTTGAACTCTTAACGT-3′ и R: 5′-AGGATTAGACTAAGTGATACCCTGTGATTC-3′, связывающего белка циклин-зависимых киназ rs4800148 гена CABLES1 с праймерами 5′-ACATCTCTCCTCCATAGGGAACAC-3′ и R: 5′-CACACAAGAGGTACTCAGAACTCC-3′ в образцах ДНК мужского пола и участков генов хейджхок-взаимодействующего белка rs1812175 гена HHIP с праймерами 5′-CAAGCTTTAAGAACCGTAGAATGCATC-3′ и R: 5′-GAGAAAAGGCTTAGAAACATGGCTG-3′ и ядерного белка с цинковыми пальцами rs849140 гена JAZF1 с праймерами 5′-GAGGATAGCACTGCCTGCAATG-3′ и R: 5′-AGTACCTGGAGCCTAGAAGGTG-3′ в образцах ДНК женского пола путем выявления генотипов по всем соответствующим генам, делая вывод о длине тела мужчин, подставляя значения генотипов в формулу: Y=176,17+3,01*X1-1,95*X2-1,73*X3, где X1=0 при генотипе G/G по гену GSHR, X1=1 при генотипе G/A по гену GSHR и X1=2 при генотипе А/А по гену GSHR; Х2=0 при генотипе А/А по гену LCORL, Х2=1 при генотипе A/G по гену LCORL, Х2=2 при генотипе G/G по гену LCORL; Х3=0 при генотипе А/А по гену CABLES1, Х3=1 при генотипе G/A по гену CABLES1, Х3=2 при генотипе G/G по гену CABLES1; и делая вывод о длине тела женщин, подставляя значения генотипов в формулу: Y=163.3-1.33*X1+0.89*X2, где X1=0 при генотипе G/G по гену HHIP, X1=1 при генотипе A/G по гену HHIP, X1=2 при генотипе А/А по гену HHIP и Х2=0 при генотипе G/G по гену JAZF1, Х2=1 при генотипе A/G по гену JAZF1, Х2=2 при генотипе А/А по гену JAZF1.
| АЛЕКСАНЯНЦ Г.Д | |||
| и др., Генетические и средовые детерминанты, определяющие прогнозирование длины тела, Фундаментальные исследования, 2008, N11, стр.91-93 | |||
| Nicole Soranzo et al., Meta-Analysis of Genome-Wide Scans for Human Adult | |||
| Stature Identifies Novel Loci and Associations with | |||
| Measures of Skeletal Frame Size, PLoS Genetics, April 2009, Volume 5, Issue 4, e1000445, p.p.1-13 |
Авторы
Даты
2014-10-20—Публикация
2012-10-23—Подача