Изобретение относится к области медицины, а именно к урологии, и может быть использовано для лечения больных с доброкачественной гиперплазией предстательной железы (ДГПЖ).
Доброкачественная гиперплазия предстательной железы (ДГПЖ) - прогрессирующее состояние, характеризующееся увеличением простаты, сопровождающееся симптомами нижних мочевых путей (СНМП). Приблизительно у 75% мужчин старше 50 лет есть симптомы, являющиеся следствием ДГПЖ, и 20-30% в течение жизни потребуется хирургическое вмешательство по поводу ДГПЖ (Roehrborn C.G. Male lower urinary tract symptoms (LUTS) and benign prostatic hyperplasia (BPH). Med Clin North Am., 2011, Jan; 95(1): 87-100; Кузьменко B.B., Кочетов M.B., Семенов Б.В. Доброкачественная гиперплазия предстательной железы. - Воронеж. - 2008).
Прогрессирование ДГПЖ проявляется в усилении расстройств мочеиспускания, ухудшении качества жизни, возрастании риска острой задержки мочи (ОЗМ) и необходимости хирургического вмешательства (Лоран О.Б., Лукьянов И.В. Практическая урология: что нового в лечении ДГПЖ - взгляд эксперта. Русский медицинский журнал. 2008 г. №29. С.1988).
Целью лечения ДГПЖ является улучшение качества жизни пациента, уменьшение выраженности СНМП и предотвращение развития осложнений.
Показаний к проведению хирургических вмешательств при ДГПЖ становится все меньше и, несмотря на совершенствование хирургической техники и медицинского оборудования, в последние годы прослеживается тенденция к снижению удельного веса выполняемых оперативных вмешательств по поводу ДГПЖ (Untergasser G., Madersbacher S., Berger P. Benign prostatic hyperplasia: age-related tissue-remodeling. Exp. Gerontol 2005; 40:121-8). Одной из причин этого является разработка и внедрение в клиническую практику новых патогенетически обоснованных схем консервативной терапии ДГПЖ, неудовлетворенность клиницистов отдаленными результатами хирургического лечения, удорожанием себестоимости операции и интрагоспитальных затрат на больного (Auffenberg G, Helfan B, McVary K: Established medical therapy for benign prostatic hyperplasia. UrolClinNorthAm 2009; 36:443).
Медикаментозное лечение согласно рекомендациям EAU включает в себя применение препаратов из групп ингибиторов 5 α-редуктазы и α-адреноблокаторов (Oelke М. et al. Guidelines on Management of Male Lower Urinary Tract Symptoms. 2013). В последние десятилетия медикаментозное лечение стало настолько эффективным, что у большинства больных вопрос об оперативном лечении откладывается на неопределенное время. (Höfner K., Tunn U-W., Reich O., H. Rübben Surgery for Benign Prostatic Hyperplasia. Deutsch Arzteblatt 2007; 104(36): A 2424-2429).
Таким образом, актуальным является поиск дальнейших путей усовершенствования консервативной терапии ДГПЖ, как альтернативы хирургическому лечению.
Интермиттирующая (прерывистая) терапия (ИТ) - метод медикаментозного лечения, основанный на прерывистом курсовом назначении лекарственных средств. Этот метод имеет распространение в медицинской практике при проведении патогенетического лечения различных хронических заболеваний. В урологии наиболее широкое применение этого метода известно при проведении антибактериальной терапии воспалительных заболеваний мочевых путей. За последние годы метод интермиттирующей гормональной терапии получил широкое распространение в России при лечении больных раком простаты.
При консервативном лечении больных доброкачественной гиперплазией предстательной железы возможность применения данного метода широко не обсуждалась. Возможность отмены или прерывистого применения α-1-адреноблокаторов известна в зарубежной и отечественной литературе. ИТ ингибиторами 5 α-редуктазы мало изучена, имеются единичные публикации, где дана оценка течения ДГПЖ у больных, самостоятельно прервавших лечение ингибиторов 5 α-редуктазы. (Jeong Y.V. et al. Urology, 2009). Нами в научно-медицинской и патентной литературе не выявлены публикации о возможности проведения контролируемой комбинируемой интермиттирующей медикаментозной терапии ДГПЖ.
Известен способ контроля за лечением опухолей предстательной железы по патенту РФ №2079132, (10.05.1997), включающий предварительное выявление заболевания путем определения содержания ДНК в опухолевых клетках биологического материала. Способ отличается тем, что в качестве биологического материала используют утреннюю мочу до и после пальцевого обследования предстательной железы (ПРИ) и при обнаружении в ней после ПРИ увеличения количества клеток с содержанием ДНК больше, чем тетраплоидное и/или более 5-7 количества клеток с содержанием ДНК больше, чем у нормальных диплоидных, по сравнению с пробой мочи до ПРИ, судят о наличии в ней опухолевых клеток из предстательной железы. Контроль над последующим лечением осуществляют по изменению этих показателей, при этом по уменьшению их значений судят о правильности выбранной тактики лечения.
Недостаток способа состоит в сложности интерпретации результатов процедуры и применим только в онкологии. Как указывают сами авторы, сравнительный анализ процентного содержания клеток, находящихся в G0 и G1 фазах цикла и элементов с плоидностью менее 20 показывает, что по этим показателям группы больных, страдающих аденомами и раком предстательной железы, мало отличаются друг от друга, хотя и отличаются от контроля (p<0,05).
Известен способ выбора метода лечения ДГПЖ по патенту РФ №2124314 (10.01.1999), согласно которому проводят клинико-инструментальное обследование пациента, фиксируют показатели социального характера: возраст, наличие сопутствующей патологии, оценивают качество жизни, время утраты нетрудоспособности, характер трудовой деятельности после лечения. Оценивают показатели инструментального обследования: массу предстательной железы, количество остаточной мочи, характер рубцово-склеротических изменений простаты, показатель объемной скорости мочеиспускания, характер роста долей предстательной железы, коэффициент растяжения мышц мочевого пузыря. Определяют по трехбалльной шкале показатели коэффициента состояния здоровья и выбирают в зависимости от коэффициента консервативное лечение, лазерную абляцию простаты, трансуретральную резекцию простаты, аденомэктомию.
Недостатком способа является сложность определения и оценки большого количества факторов, что отражается на его точности.
Известен способ лечения ДГПЖ по патенту РФ №2167687 (27.05.2001) методом ее визуальной лазерной абляции. Каждому пациенту перед лечением индивидуально подбирают экспозиционную дозу лазерного воздействия. Для этого проводят обследование больного, в процессе которого определяют: тип роста долей предстательной железы, массу предстательной железы, степень склерозирования предстательной железы, среднюю объемную скорость мочеиспускания, максимальную мощность сокращения детрузора и реактивность организма на лазерное воздействие. Используя полученные показатели по формуле N=Nmax [1] [2] [3] [4] и [5] и [6], вычисляют оптимальную экспозиционную дозу лазерного воздействия.
Недостаток способа: большой объем исследуемых показателей, инвазивность, вероятность рецидивов, отсутствие гистологического контроля.
Известен способ определения вида лечения больных с доброкачественной гиперплазией предстательной железы по патенту РФ №2205001 (27.05.2003), заключающийся в выполнении урофлоуметрии, отличающийся тем, что повторную урофлоуметрию проводят через 2 недели после приема 1-блокатора, например Тамсулозина, и в случае улучшения уродинамических показателей продолжают медикаментозную терапию, а в случае ухудшения - назначают хиругическое лечение.
Недостаток способа: невысокая эффективность метода урофлоуметрии, возможность резкого снижения АД у больного. Кроме того, 1-блокатор оказывает воздействие только на рецепторы гладкой мускулатуры, то есть на ирритативную симптоматику.
Известен способ терапевтического лечения доброкачественной гиперплазии простаты по патенту РФ №2215537 (10.11.2003). Для этого вводят препарат цетрореликс в дозе 0,5 мг/день в виде монотерапии или в комбинации с ингибиторами α-редуктазы или агентами, блокирующими адренергические α1-рецепторы. После введения цетрореликса в течение периода времени 1-12 недель в течение 1-12 недель вводят ингибитор α-редуктазы, или блокатор адренергических α1-рецепторов, или лекарственный препарат естественного происхождения, используемый для лечения ВРН, или альтернативно после введения цетрореликса в течение 1-12 недель непрерывно вводят блокатор адренергических α1-рецепторов и затем через шесть месяцев вводят антагонист LHRH в комбинации с ингибитором α-редуктазы или блокатором адренергических α1-рецепторов.
Описан способ лечения ДГПЖ путем назначения дутастерида, при этом, считают минимальным сроком назначения дутастерида 6 месяцев (Коган М.И. Клинический разбор случая доброкачественной гиперплазии предстательной железы. РМЖ. Том 19, №16 (410), 2011). Критерием эффективности препарата, по мнению автора, являются данные ТРУЗИ, которое выполняется исходно перед терапией и через 6 мес. лечения.
Недостатком данного способа является отсутствие комплексного подхода к контролю над терапией - использование только ТРУЗИ простаты.
Прототипом изобретения выбран способ лечения ДГПЖ - Т.С. Перепанова, В.А. Максимов, Е.Н. Давыдова, П.Л. Хазан (Сетегис при лечении доброкачественной гиперплазии предстательной железы. Интермиттирующий режим дозирования. - РМЖ, 1458. - 2011 г.), заключающийся в приеме α-1-адреноблокатора - теразозин (Сетегис) - в интермиттирующем режиме дозирования, отличающийся тем, что назначалась доза - 1 мг препарата в течение 1 недели, далее - 2 мг - в течение следующей недели, далее в зависимости от суммы показателей по международной шкале симптомов нарушенного мочеиспускания (I-PSS) - если улучшение симптомов нарушенного мочеиспускания было свыше 30% по сравнению с предыдущим визитом, то пациента оставляли на дозе 2 мг, если меньше - увеличивали дозу до 5 мг. В последней дозе сохраняли режим дозирования в течение 2-х месяцев (от начала терапии), при сохранении клинического эффекта - выполнялся переход на интермиттирующий режим лечения в той же (последней) дозе, прием препарата осуществлялся через день в течение 4-х месяцев. Результаты лечения оценивались следующим образом: как хороший клинический эффект - улучшение симптомов нарушенного мочеиспускания по шкале I-PSS более чем на 30%, улучшение качества жизни на 1-2 пункта, улучшение максимальной скорости потока мочи на 2-4 мл/с от исходного, улучшение самочувствия, отсутствие неблагоприятных побочных действий препарата. Отсутствие эффекта - нет улучшения симптомов нарушенного мочеиспускания по данным уродинамического обследования (урофлоуметрии), шкале I-PSS, качества жизни, увеличение количества остаточной мочи, нарушение функции почек, острая задержка мочеиспускания, необходимость оперативного лечения и т.д.
Сравнивали показатели объема мочеиспускания (V), максимальной (Qmax) и средней скорости мочеиспускания (Qmean), времени мочеиспускания (t) и остаточной мочи (PVV), суммы баллов по шкале I-PSS и качества жизни (QoL) до начала лечения, через 2 месяца после лечения (ежедневная доза теразозина) и через 4 месяца после лечения (доза теразозина через день).
К недостатку способа-прототипа относится отсутствие применения интермиттирующей терапии у пациентов, получающих стандартную комбинированную терапию ДГПЖ и отсутствие специфических маркеров контроля над ней.
Указанные недостатки устраняются в заявляемом изобретении.
Задачей настоящего изобретения является оптимизация сроков медикаментозного лечения и повышение его эффективности у пациентов с ДГПЖ путем вычисления лабораторного маркера эффективности терапии с последующим определением показаний к продолжению или прекращению фармакотерапии - проведения интермиттирующей терапии (ИТ).
Поставленная задача решается тем, что осуществляют клинико-инструментальное обследование пациента до начала консервативной терапии ДГПЖ (дутастерид в дозировке 0,5 мг 1 раз в сутки и тамсулозин в дозировке 0,4 мг 1 раз в сутки) и каждые 3 месяца после лечения. Фиксируют показатели симптомов нижних мочевых путей и качества жизни, связанного с мочеиспусканием (шкала I-PSS - Qol), максимальную скорость потока мочи, определяют количество остаточной мочи ультразвуковым методом, определяют объем простаты методом трансректального ультразвукового исследования; определяют уровень общего ПСА крови и общего тестостерона в сыворотке крови.
Вычисляют лабораторный маркер эффективности терапии 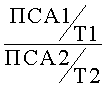
Технический результат, получаемый от применения заявляемого способа лечения ДГПЖ, состоит в том, что данный способ позволяет во время проведения консервативной терапии заболевания определить объективные показания к отмене и возобновления медикаментозного лечения ДГПЖ, что значительно повышает качество лечения, в то время как пролонгация фармакотерапии ведет к удорожанию и неоправданному затягиванию лечения, увеличению медикаментозной нагрузки на организм больного. Срок 3-6 мес. обусловлен тем, что при контроле в более короткие сроки динамика исследуемых параметров недостаточно отчетлива.
В последние десятилетия благодаря многочисленным исследованиям в теории патогенеза ДПГЖ произошли значительные изменения. Выявлена роль гипоталамо-гипофизарно-гонадной системы в контроле роста, развития и функции предстательной железы. Одним из основных положений теории патогенеза ДГПЖ является роль фермента 5 α-редуктазы (5 α-P) и дигидротестостерона (ДГТ) (Лоран О.Б., Лукьянов И.В. Практическая урология: что нового в лечении ДГПЖ - взгляд эксперта. Русский медицинский журнал. 2008 г. №29. С.1988).
Нарушение ферментативного баланса приводит к потере контроля за течением внутриклеточных обменных процессов и способствует развитию ДГПЖ, которая проявляется в виде разрастания гиперплазированной ткани простаты (механический фактор); повышением активности и тонуса α-1-адренорецепторов предстательной железы, шейки мочевого пузыря и простатического отдела уретры, ведущими к гипертонусу (спазму) их гладкомышечных структур (динамический компонент); нарушением метаболических процессов в ткани простаты, ведущим к возникновению расстройств кровообращения этих органов и асептическому воспалению (Jie Tang and Jing Chun Yang Etiopathogenesis of benign prostatic hyperplasia. Indian J Urol. 2009 Jul-Sep; 25(3): 312-317).
В работах последнего времени подчеркивается значение стромы и стромально-эпителиальных взаимоотношений в индуцировании простатического роста при ДГПЖ. Развитие, дифференциация, пролиферация и поддержание жизнеспособности простатических клеток регулируется тонкими взаимодействиями стимулирующих и ингибирующих факторов роста (Bostwick D.G. Pathology of benign prostatic hyperplasia. In: Kirby R., McConnel J., Fitzpatrick J (eds) Textbook of benign prostatic hyperplasia. Oxford: ISIS, 1996: 91-104.8. Clifford G.M., Farmer RDT. Medical therapy for benign prostatic hyperplasia: a review of the literature. Eur Urol 2000; 38:2-19).
При ДГПЖ отмечается повышенная активность α-1-адренорецепторов, приводящая к спастическому состоянию основания мочевого пузыря, задней уретры и гладкомышечных элементов простаты, поэтому имеется возможность существенного уменьшения уретрального сопротивления у больных ДГПЖ при нарушении взаимодействия медиатора симпатической нервной системы с α-1-адренорецепторами (Nasu К., Moriyama N., Kawabe К. Et al. Quantification and distribution of α1-adrenoceptor subtype mRNAs in human prostate: comparison of benign hypertrophied tissue and non hypertrophied tissue// Br. J. Pharmacol. - 1996. - vol.119. - p.797-803).
Установлено, что хорошим предиктором прогрессирования доброкачественной гиперплазии предстательной является простатспецифический антиген (ПСА) (Bartsch, G. et al. Consensus statement: the role of prostatespecific antigen in managing the patient with benign prostatic hyperplasia. BJU Int, suppl, 93:27, 2004).
Дигидротестостерон (ДГТ) - андроген, вырабатываемый из тестостерона под действием изоферментов 5α-редуктаз 1 и 2 типов, является ключевым компонентом для инициации и поддержания аномального роста ткани предстательной железы (ПЖ), формирования доброкачественной гиперплазии предстательной железы. Необходимо отметить, что ДГТ, как и ПСА, является основным фактором, экзокринно секретируемым эпителиальными клетками ПЖ (Bruchovsky, N., et al. Kinetic parameters of 5 alpha-reductase activity in stroma and epithelium of normal, hyperplastic, and carcinomatous human prostates. J Clin Endocrinol Metab, 67: 806, 1988. Geller, J et al. DHT concentrations in human prostate cancer tissue. J Clin Endocrinol Metab, 46: 440, 1978). Ингибиторы 5 α-P снижают концентрацию ПСА в крови и количественный показатель этого снижения зависит от длительности терапии. Снижение концентрации ПСА в сыворотке крови может достигать 50% через 1 год после начала терапии ингибиторами 5 α-P (Etzioni, R. D. et al. Long-term effects of finasteride on prostate specific antigen levels: results from the prostate ancer prevention trial. J Urol, 174:877, 2005).
Основная причина улучшения гормонального фона (повышение уровня тестостерона) объясняется блокадой 5α-редуктаз 1 и 2 типа дутастеридом, а также снижением метаболизма тестостерона в дигидротестостерон, что также может служить показателем эффективности консервативной терапии.
Дутастерид является двойным ингибитором, действующим на 5α-редуктазу 1 и 2 типов (Bramson, Н.N. et al. Unique preclinical characteristics of GG745, a potent dual inhibitor of 5AR. J Pharmacol Exp her, 282: 1496, 1997). Это приводит к более длительному подавлению образования ДГТ в клетках ПЖ. (Clark, R.V. et al. Effective suppression of dihydrotestosterone (DHT) by GI198745, a novel, dual 5 alpha reductase inhibitor. J Urol, suppl., 161: 268, abstract 1037, 1999).
Дутастерид, воздействуя на гиперплазированную ткань простаты, опосредованно, через подавление активности изоферментов 5-α-редуктазы 1 и 2 типа вызывает атрофические изменения железистых и стромальных компонентов тканей простаты. Атрофия ткани приводит к уменьшению объема простаты и непосредственно самой гиперплазии, опосредованно улучшая мочеиспускание, что обеспечивает ремиссию заболевания, позволяющую отменить консервативную терапию.
Эффективность тамсулозина обычно выражается уже через 2 недели от начала КТ и связана с подавлением активности α-1-адренорецепторов.
Таким образом, снижение ПСА с одной стороны и повышение уровня тестостерона с другой свидетельствует об эффективности действия дутастерида - подавлении центров пролиферации в простате.
Эти положения легли в основу наших исследований с целью получения объективных показателей отмены медикаментозного лечения.
Подробное описание метода и примеры его клинического выполнения.
Способ осуществляется следующим образом.
Для консервативного комбинированного лечения ДГПЖ отбираются пациенты, не имеющие абсолютных показаний к операции, таких как: камень мочевого пузыря; повторяющаяся гематурия; не разрешившаяся консервативно острая задержка мочи; двусторонний уретерогидронефроз; хроническая почечная недостаточность. Противопоказанием к терапии также считается отказ пациента от консервативного лечения.
Больным согласно показаниям (клинические рекомендации Европейской Ассоциации Урологов, 2013) назначают консервативная терапия - дутастерид в дозировке 0,5 мг 1 раз в сутки и тамсулозин в дозировке 0,4 мг 1 раз в сутки. До начала медикаментозной терапии больные обследовались в стандартном объеме (рекомендации совещания совета Экспертов по лечению аденомы предстательной железы, Москва, 2009) - заполнение опросника международной шкалы простатических симптомов IPSS-QOl, выполнение урофлоуметрии, определение количества остаточной мочи, определение объема простаты методом ТРУЗИ, определение общего ПСА крови, дополнительно оценивается общий тестостерон (в нМоль/л) в сыворотке крови. Фиксируют полученные данные.
Простатспецифический антиген и общий тестостерон крови определяют методом иммуноферментного анализа с использованием автоматического ИФ-анализатора «Alisey» (Италия). Уровень общего тестостерона измеряют в ммоль/мл, референтные значения нормы составляли 12-36 ммоль/мл.
После назначения комбинированной консервативной терапии: дутастерид в дозировке 0,5 мг 1 раз в сутки и тамсулозин 0,4 мг 1 раз в сутки, каждые 3 месяцев (согласно общепринятым стандартам) пациент выполняет контрольные обследования, на основании которых вычисляют лабораторный маркер эффективности терапии 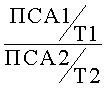
При достижении пациентами ремиссии заболевания по стандартным показателям и определения значения лабораторного маркера эффективности терапии, равным или большим 3, консервативную терапию ДГПЖ прекращают. Больного продолжают наблюдать с кратностью посещения 1 раз в 3 месяца, при снижении показателя лабораторного маркера эффективности терапии меньше 3, консервативную интермиттирующую терапию возобновляют в обычных дозировках.
Под нашим наблюдением находилось 357 больных ДГПЖ, из которых 270 пациентам проводилась консервативная интермиттирующая терапия в период 2007-2013 г. Из нашего общего количества больных, которым проводилась ИТ, 75 пациентам терапия отменена в сроки 6-24 месяца. В исследование включались пациенты с купированными явлениями простатита (исключить повышение ПСА, связанное с воспалительным процессом) и не получающие тестостеронзаместительную терапию (исключить повышение тестостерона, связанное с экзогенным воздействием). Перевод на интермиттирующую терапию был обусловлен достижением у них полной медицинской и социальной реабилитации.
Результаты исследования нами обобщены и представлены в таблице 1.
Установлено, что при достижении пациентами клинической ремиссии ДГПЖ уровень общего ПСА крови снизился в среднем на 54%, уровень общего тестостерона крови вырос на 26%. Вычисленное значение лабораторного маркера эффективности терапии 
Наши исследования показали, что значение лабораторного маркера эффективности терапии 
У остальных больных продолжали комбинированное лечение или монотерапию дутастеридом. Сроки и частота перевода больных на ИТ были различными, но в целом при дальнейшем лечении это было возможным у многих пациентов и зависело от тяжести исходных показателей. В общей наблюдаемой группе больных прерывистая терапия дутастеридом была возможной у 25,4% больных.
Работоспособность предлагаемого способа подтверждается следующими клиническими примерами.
Пример 1. Пациент Н-ев, 50 лет, жалуется на чувство тяжести над лоном, частое мочеиспускание. Из анамнеза известно, что нарушения мочеиспускания отмечает около 1,5 лет. Год назад больному выполнялась полифокальная биопсия простаты - гистологически железисто-стромальная гиперплазия с очагами ПИН низкой степени. Терапию не получал. При обследовании: IPSS - 11 баллов, QoL - 5 баллов. Максимальная скорость мочеиспускания составила 18,8 мл/с, объем предстательной железы при ТРУЗИ - 56,7 см3, объем остаточной мочи - 35 мл. Уровень ПСА крови у пациента составил 2,15 нг/мл, общего тестостерона крови - 9,7 нмоль/мл.
Больному согласно показаниям назначена консервативная терапия в режиме дутастерид 0,5 г один раз в сутки и тамсулозин 0,4 г в сутки. Контроль эффективности терапии проводился каждые 3 месяца. Через 3 месяца уровень ПСА крови у пациента составил 1,3 нг/мл, общего тестостерона крови - 10,4 нмоль/мл.
Больной проходил стандартное клинико-инструментальное обследование, включающее определение лабораторного маркера эффективности терапии.
Значение лабораторного маркера эффективности терапии 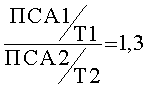
К 6 визиту (15 месяцев после начала терапии) пациент не предъявляет жалоб. При обследовании: уровень IPSS - 3 балла, QoL - 1 балл. Максимальная скорость мочеиспускания возросла на 25% и составила 25,1 мл/с. Объем предстательной железы уменьшился на 23% - 43,9 см3. Остаточной мочи у пациента не выявлено. Уровень ПСА крови составил 1,0 нг/мл, общего тестостерона крови - 15,7 нмоль/мл. Лабораторный маркер эффективности терапии составил 3,7, что говорило о возможности перевести пациента на ИТ.
Пациенту была отменена терапия, динамическое наблюдение за течением заболевания продолжено в прежнем режиме.
При 9 визите (24 месяца наблюдения), пациент жалоб не предъявляет. IPSS - 4 балла, QoL - 1 балл. Максимальная скорость мочеиспускания - 23,4 мл/с. Объем предстательной железы при ТРУЗИ составил 66,4 см3. Объем остаточной мочи - 10 мл. Уровень общего ПСА крови - 1,3 нг/мл, общего тестостерона крови - 17,1 нмоль/мл. Лабораторный маркер эффективности терапии - 2,9. Учитывая снижение ЛМЭТ, пациенту повторно возобновлена терапия (перевод в интермиттирующий режим) - назначен дутастерид 0,5 мг один раз в сутки. Продолжает терапию под наблюдением врача.
Пример 2. Пациент Б-ов, 58 лет, предъявляет жалобы на затрудненное мочеиспускание, вялую струю мочи. Вышеуказанные жалобы отмечает около полугода. При обследовании: IPSS - 15 баллов, QoL - 4, максимальная скорость мочеиспускания составила - 7,5 мл/с, объем простаты - 53,3 см3, объем остаточной мочи - 100 мл. Уровень общего ПСА крови - 3,77 нг/мл, общего тестостерона крови - 9,3 ммоль/мл. Пациенту выполнена полифокальная биопсия простаты, гистологически выявлена железисто-стромальная гиперплазия.
Назначена терапия: дутастерид 0,5 мг 1 раз в сутки и тамсулозин 0,4 мг 1 раз в сутки.
Через 3 месяца уровень ПСА крови у пациента составил 2,9 нг/мл, общего тестостерона крови - 12,5 нмоль/мл.
Больной проходил стандартное клинико-инструментальное обследование включающее определение лабораторного маркера эффективности терапии.
Значение лабораторного маркера эффективности терапии 
При 6 визите, через 15 месяцев после начала терапии, пациент жалоб не предъявлял. При обследовании: IPSS - 6, QoL - 2, Qmax - 12,4 мл/с, объем простаты - 34,4 см3, объем остаточной мочи - 30 мл, общий ПСА крови - 0,93 нг/мл, общий тестостерон крови - 21,8 ммоль/мл. Лабораторный маркер эффективности терапии - 10. Терапия отменена. Продолжено динамическое наблюдение.
При 9 явке (24 месяца наблюдения): жалоб нет, общий ПСА крови - 1,22 нг/мл, общий тестостерон крови - 9,8 ммоль/мл, лабораторный маркер эффективности терапии - 3,3. Терапия не возобновлена. Продолжено динамическое наблюдение.
Таким образом, заявленный способ интермиттирующей терапии у пациентов с доброкачественной гиперплазией предстательной железы обладает следующими преимуществами. Способ позволяет выбрать оптимальную продолжительность лечения для каждого пациента, что значительно повышает качество лечения, снизить сроки и стоимость терапии, уменьшить медикаментозную нагрузку на организм больного.
Заявленный способ интермиттирующей терапии у пациентов с доброкачественной гиперплазией предстательной железы апробирован на большом клиническом материале и может быть рекомендован в урологическую практику.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КОМБИНИРОВАННОГО ЛЕЧЕНИЯ ДОБРОКАЧЕСТВЕННОЙ ГИПЕРПЛАЗИИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ КРУПНЫХ РАЗМЕРОВ У ПАЦИЕНТОВ СТАРЧЕСКОГО ВОЗРАСТА ИЛИ С ВЫРАЖЕННОЙ ИНТЕРКУРРЕНТНОЙ ПАТОЛОГИЕЙ | 2015 |
|
RU2585431C1 |
| СПОСОБ ЛЕЧЕНИЯ ДОБРОКАЧЕСТВЕННОЙ ГИПЕРПЛАЗИИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2012 |
|
RU2489093C1 |
| Способ определения тактики лечения симптомов нижних мочевых путей, ассоциированных с доброкачественной гиперплазией простаты на фоне дефицита тестостерона | 2022 |
|
RU2795840C1 |
| СПОСОБ ЛЕЧЕНИЯ АДЕНОМЫ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ В СОЧЕТАНИИ С ХРОНИЧЕСКИМ АБАКТЕРИАЛЬНЫМ ПРОСТАТИТОМ | 2014 |
|
RU2568369C1 |
| СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ДОБРОКАЧЕСТВЕННОЙ ГИПЕРПЛАЗИИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2014 |
|
RU2574014C2 |
| СПОСОБ ЛЕЧЕНИЯ ДОБРОКАЧЕСТВЕННОЙ ГИПЕРПЛАЗИИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2009 |
|
RU2408399C1 |
| Способ предотвращения травмы наружного сфинктера уретры при выполнении трансуретральной лазерной энуклеации доброкачественной гиперплазии предстательной железы | 2021 |
|
RU2757678C1 |
| СПОСОБ ВИЗУАЛИЗАЦИИ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ДОБРОКАЧЕСТВЕННОЙ ГИПЕРПЛАЗИИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2018 |
|
RU2681508C1 |
| Способ создания доступа к хирургическому объекту при выполнении плазменной трансуретральной энуклеации доброкачественной гиперплазии простаты | 2019 |
|
RU2700488C1 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ ДОБРОКАЧЕСТВЕННОЙ ГИПЕРПЛАЗИЕЙ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2003 |
|
RU2250748C2 |
Изобретение относится к медицине, а именно к урологии, и может быть использовано для интермиттирующей терапии у пациентов с доброкачественной гиперплазией предстательной железы (ДГПЖ). Проводят клинико-инструментальное обследование пациента и назначают фармпрепараты. При этом у пациента определяют показатель общего ПСА и показатель общего тестостерона в сыворотке крови до начала лечения, включающего дутастерид в дозировке 0,5 мг 1 раз в сутки и тамсулозин в дозировке 0,4 мг 1 раз в сутки, и через каждые 3 месяца после лечения. Определяют значение лабораторного маркера эффективности терапии 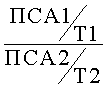
Способ интермиттирующей терапии у пациентов с доброкачественной гиперплазией предстательной железы (ДГПЖ), включающий выполнение клинико-инструментального обследования пациента с ДГПЖ и назначение фармпрепаратов, отличающийся тем, что у пациента определяют показатель общего ПСА и показатель общего тестостерона в сыворотке крови до начала лечения, включающего дутастерид в дозировке 0,5 мг 1 раз в сутки и тамсулозин в дозировке 0,4 мг 1 раз в сутки, и через каждые 3 месяца после лечения, определяют значение лабораторного маркера эффективности терапии  ,
,
где
ПСА1 - показатель общего ПСА до лечения,
ПСА2 - показатель общего ПСА после лечения,
T1 - показатель общего тестостерона до лечения,
T2 - показатель общего тестостерона после лечения,
и при значении лабораторного маркера эффективности терапии равном 3 или более указанную терапию пациенту отменяют, при уменьшении значения лабораторного маркера эффективности терапии менее 3 указанную терапию возобновляют.
| СПОСОБ ОПРЕДЕЛЕНИЯ ВИДА ЛЕЧЕНИЯ БОЛЬНЫХ С ДОБРОКАЧЕСТВЕННОЙ ГИПЕРПЛАЗИЕЙ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2001 |
|
RU2205001C2 |
| СПОСОБ ВЫБОРА МЕТОДА ЛЕЧЕНИЯ ДОБРОКАЧЕСТВЕННОЙ ГИПЕРПЛАЗИИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 1996 |
|
RU2124314C1 |
| Аэродинамические весы | 1938 |
|
SU61513A1 |
| ПЕРЕПАНОВА Т.С | |||
| и др | |||
| Сетегис при лечении доброкачественной гиперплазии предстательной железы | |||
| Интермиттирующий режим дозирования.// РМЖ, 2011, N24, найдено из Интернета на сайте http://www.rmj.ru/numbers_7.htm | |||
| SLAWIN KM | |||
| The medical therapy of prostatic symptoms study: what will we learn? // Rev Urol | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
Авторы
Даты
2014-10-27—Публикация
2013-06-26—Подача