Устройство для электрохимического исследования коррозии металлов относится к области исследования коррозионного поведения материалов в различных средах с помощью построения коррозионных диаграмм, что позволяет оценить характер воздействия отдельных факторов на скорость коррозии, а также выявить наиболее значимый (лимитирующий) процесс (установить степень анодного, катодного и омического контроля).
Данное устройство позволяет проводить исследования коррозионных процессов графическим методом, который имеет ряд преимуществ перед аналитическими методами, а именно: аналитические методы достаточно хорошо согласуются с результатом эксперимента при исследовании простых случаев коррозионного процесса, графические же зависимости легко устанавливаются экспериментально даже для наиболее сложных случаев коррозии, которые отвечают реальным условиям эксплуатации металлических конструкций [1].
Наиболее удобной, наглядной и поэтому распространенной является коррозионная диаграмма Эванса. На данных диаграммах по оси ординат откладывают значение потенциала, а на оси абсцисс - величины катодного и анодного токов, вне зависимости от того, что они имеют противоположное направление.
Электродвижущая сила (ЭДС) гальванического элемента представляет собой разность между равновесными (стационарными) потенциалами катода и анода, измеренными при отсутствии тока в цепи
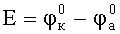
При протекании тока в системе в соответствии с кинетическими особенностями катодного и анодного процессов в системе наблюдается анодная и катодная поляризация, следовательно, разность потенциалов между электродами уменьшается до величины U. Если омические потери в коррозионной системе пренебрежимо малы, то устанавливается общее для электродов значение потенциала и ток коррозии достигает максимума.
Для расчета скорости коррозии (плотности тока коррозии) необходимо учитывать кинетические особенности протекания процессов на аноде и катоде. Для этого необходимо использовать анодную и катодную поляризуемости:
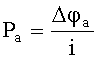
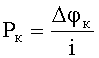
Для расчета скорости коррозии можно воспользоваться следующим уравнением:
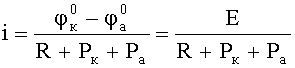
Таким образом, скорость коррозионного процесса определяется сопротивлением отдельных ее составляющих: омический контроль, катодная и анодная поляризуемости.
Произвести расчет степени анодного, катодного и омического контроля можно по следующим формулам:
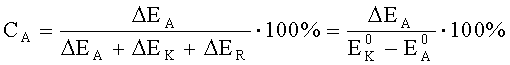
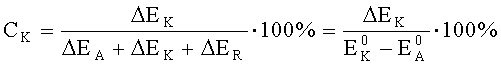
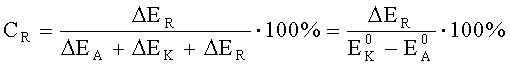
где CA - степень анодного контроля;
CK - степень катодного контроля;
CR - степень омического контроля;
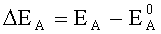
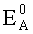
EA - эффективный потенциал анода (потенциал анода при пропускании через него тока), В;

EK - эффективный потенциал катода (потенциал анода при пропускании через него тока), В;
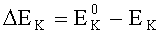
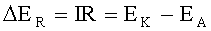
R - омическое сопротивление, Ом;
EK-EA - эффективная разность потенциалов электродов при токе пары I, В.
Затем, зная величину коррозионного тока, произвести расчет весового показателя коррозии 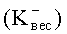
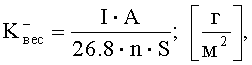
где I - сила коррозионного тока, А; A - атомная масса металла, г; n - число электронов, принимающих участие в электрохимическом акте, S - площадь поверхности анодного образца, м2.
Определение степени контроля каждой из вышеперечисленных составляющих имеет большое практическое значение, т.к. для эффективного управления процессом коррозии необходимо оказывать влияние на лимитирующую стадию.
Известно устройство для экспериментального построения коррозионной диаграммы [2], с помощью которого, по мнению авторов, можно проводить исследования замкнутого коррозионного элемента.
Исследуемые электроды погружаются в раствор, к ним подводятся электроды сравнения. Замыкая цепь тумблером, измеряют коррозионный ток с помощью «нулевого амперметра». Одновременно с этим измеряют потенциал одного и второго исследуемых электродов с помощью измерителя потенциала и переключателя.
Достоинствами данной схемы является простота исполнения и проведения эксперимента.
В качестве недостатков можно выделить:
1) невозможность регулировки тока в цепи, следовательно, нет возможности измерить потенциалы электродов при разном токе;
2) включение миллиамперметра в цепь не позволяет измерить ток короткозамкнутого коррозионного элемента вследствие наличия сопротивления шунта прибора;
3) использование миллиамперметра не позволяет исследовать коррозионные элементы с малыми токами, включение микроамперметра в цепь приведет к увеличению электрического сопротивления шунта, и следовательно, приведет к еще большим погрешностям определения максимального тока коррозионного макроэлемента.
Имеются и другие схемы, предназначенные для измерения потенциалов электродов коррозионного элемента и силы тока, протекающего при различных условиях [3]. Данные схемы позволяют определить токи короткозамкнутого элемента, а также устранить влияние внутреннего сопротивления коррозионной пары.
Наиболее близким по технической сущности является устройство [4], которое позволяет определить потенциалы электродов при отсутствии тока в цепи, а также потенциалы при различных значениях силы тока.
Исследуемые электроды и электроды сравнения помещаются в раствор электролита, находящийся в сосудах. Растворы в сосудах соединяются электролитическим ключом. Измерение потенциалов электродов в отсутствии тока в цепи производят с помощью милливольтметра и переключателя. Для измерения потенциалов электродов при определенном значении силы коррозионного тока при замкнутой цепи на магазине сопротивлений выставляют необходимое значение электрического сопротивления и измеряют силу тока с помощью миллиамперметра, при этом измеряют установившиеся значения электродных потенциалов при помощи милливольтметра и переключателя. Установка предполагает проведение исследования при постоянной и регулируемой температуре, что достигается использованием термостата в комплексе с мешалкой и термометром.
На основании получаемых экспериментальных данных строится коррозионная диаграмма, анализ которой позволяет рассчитать степень анодного, катодного и омического контроля, а также весовой показатель коррозии.
Однако данная схема имеет ряд существенных недостатков, а именно:
- измерение силы тока миллиамперметром или микроамперметром приводит к тому, что в цепь последовательно к добавочному сопротивлению включается шунт, имеющий собственное сопротивление, которое зависит от выбираемого диапазона измерения силы тока.
- измерение силы коррозионного тока в широком диапазоне значений невозможно, т.к. при переключении диапазона измерения меняется сопротивление шунта и это непременно влияет на протекание процессов в исследуемом коррозионном элементе.
Техническим результатом предлагаемого устройства является упрощение схемы установки для измерения силы тока практически короткозамкнутого коррозионного элемента.
Это достигается тем, что в устройстве для электрохимического исследования коррозии металлов, включающем магазин сопротивлений для регулировки тока и приборы для регистрации потенциалов и силы тока, согласно предлагаемому изобретению вместо миллиамперметра или микроамперметра применяется высокоомный цифровой милливольтметр, подключенный параллельно к калиброванному резистору (8) (фиг.3), подключенному последовательно с магазином сопротивлений и имеющему малое значение электрического сопротивления (десятые доли и единицы Ом). Измеряя падение напряжения на данном резисторе, можно из закона Ома вычислить величину силы тока, протекающего через исследуемую цепь.
Преимуществами данной схемы являются:
- возможность исследования различных коррозионных элементов, дающих как очень маленькие значения силы тока (микроамперы), так и значительно большие (миллиамперы и выше);
- возможность измерения потенциалов электродов коррозионного элемента при различных значениях силы тока в цепи вплоть до тока, близкого к току короткого замыкания;
- установка для проведения исследований проста в изготовлении и использовании.
Не выявлены решения, имеющие признаки заявляемого способа.
На фиг.1 представлена схема предлагаемого устройства.
На фиг.2 приведен пример коррозионной диаграммы (по оси ординат - значение потенциала электродов, а на оси абсцисс - величины катодного и анодного токов, вне зависимости от того, что они имеют противоположное направление).
Установка для электрохимического исследования коррозии металлов (фиг.1) включает в себя цепь для измерения потенциалов электродов, цепь для измерения коррозионного тока, а также термостат.
Цепь для измерения потенциалов состоит из электродов (1), погруженных в растворы, находящиеся в сосудах (4). Растворы соединяются электролитическим ключом (3). В каждый раствор погружается электрод сравнения (например, хлорсеребряный электрод) (2). Переключатель (6) и милливольтметр (7) позволяют измерять потенциалы металлических электродов относительно применяемого электрода сравнения.
Цепь для измерения коррозионного тока состоит из электродов (1), погруженных в растворы, находящиеся в сосудах (4). Растворы соединяются электролитическим ключом (3). Между электродами последовательно включены: тумблер (5), калиброванный резистор (8) с подключенным параллельно к нему высокоомным цифровым милливольтметром (9), магазин сопротивлений (10).
Термостат состоит из сосуда, заполненного теплоносителем, наример водой (13), в который погружены сосуды с исследуемыми электродами, а также мешалка (11) и термометр (12).
Электрохимическое исследование коррозионного элемента осуществляется следующим образом. В соответствии со схемой (фиг.1) собирается установка.
Металлические образцы частично изолируют по длине термоусадочной трубкой или лаком для создания определенной площади поверхности и предотвращения контакта металлической поверхности с границей раздела фаз «раствор-воздух». Затем производят обработку поверхности в соответствии с ГОСТ 9.305-84.
При разомкнутом тумблере (5) измеряют потенциалы исследуемых металлических образцов при отсутствии тока в цепи (стационарный потенциал металлического электрода), который затем пересчитывают относительно стандартного водородного электрода (СВЭ). При замыкании цепи тумблером (5) выставляется с помощью магазина сопротивлений (10) необходимое значение электрического сопротивления и милливольтметром (9) измеряют падение напряжения на калиброванном резисторе (8). Полученное значение напряжения используют для расчета силы тока в исследуемой цепи из закона Ома.
По полученным экспериментальным данным строят коррозионную диаграмму в координатах 
Затем производят расчет степени анодного, катодного и омического контроля, а также весового показателя коррозии 
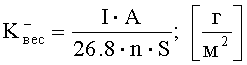
В заключение можно сделать вывод о механизме контактной коррозии исследуемых металлов в условиях испытания (контролирующем факторе), о коррозионной стойкости анода, об эффективности работы протектора.
Источники информации
1. Томашов Н.Д. Теория коррозии и защиты металлов. - М.: Изд. АН СССР, 1960. - 591 с.
2. Стэнжала С., Китовски А., Шафраньска И. Оценка электрохимических свойств алюминиевых покрытий, наносимых методом погружения, как антикоррозионной защиты низкоуглеродистых сталей в среде животноводческих объектов // Защита металлов. - 1987. - т.XXIII, №3. - С.419-423.
3. Розенфельд И.Л., Вашков О.И. К методике измерения токов коррозионных элементов
4. Томашов Н.Д., Жук Н.П., Титов В.А., Веденеева М.А. Лабораторные работы по коррозии и защите металлов. - М.: Металлургия, 1961 г., 239 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| Устройство для неразрушающего электрохимического контроля состояния поверхности металлических образцов в электролите | 2021 |
|
RU2761767C1 |
| ИНГИБИТОР КОРРОЗИИ МЕДИ И МЕДЬСОДЕРЖАЩИХ СПЛАВОВ | 2022 |
|
RU2813268C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МЕЖКРИСТАЛЛИТНОЙ КОРРОЗИИ И КОРРОЗИОННЫХ ПОВРЕЖДЕНИЙ НАРУЖНЫХ ПОВЕРХНОСТЕЙ ПОДЗЕМНЫХ И ПОДВОДНЫХ ТРУБОПРОВОДОВ | 2011 |
|
RU2457465C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОРРОЗИОННОЙ АКТИВНОСТИ ГЛИКОЛЕЙ В ТЕПЛООБМЕННОМ ОБОРУДОВАНИИ | 2021 |
|
RU2777000C1 |
| Устройство для экспериментального исследования процесса коррозионно-механического изнашивания | 2017 |
|
RU2730054C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СТОЙКОСТИ МЕТАЛЛА ПОДЗЕМНЫХ ТРУБОПРОВОДОВ К СТРЕСС-КОРРОЗИИ | 2002 |
|
RU2222000C2 |
| Комплекс для исследования электрохимических характеристик корпусных конструкций судов и плавучих технических сооружений | 2018 |
|
RU2695961C1 |
| СПОСОБ ИЗМЕРЕНИЯ ПОЛЯРИЗАЦИОННОГО ПОТЕНЦИАЛА МЕТАЛЛИЧЕСКИХ ПОДЗЕМНЫХ СООРУЖЕНИЙ | 2006 |
|
RU2353941C2 |
| Способ определения скорости коррозии | 2016 |
|
RU2644251C1 |
| Способ измерения поляризационного потенциала стальных трубопроводов | 2017 |
|
RU2645424C1 |
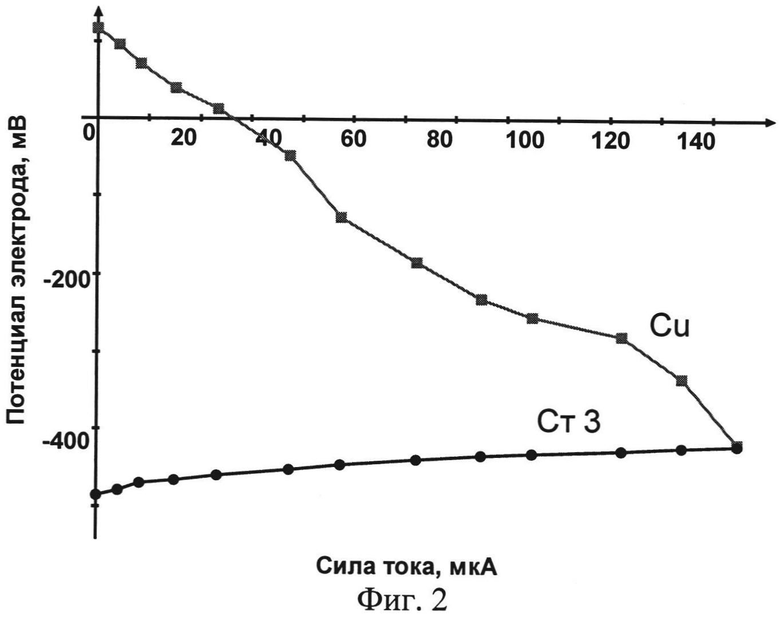
Устройство для электрохимического исследования коррозии металлов относится к области исследования коррозионного поведения материалов в различных средах с помощью построения коррозионных диаграмм, что позволяет оценить характер воздействия отдельных факторов на скорость коррозии, а также выявить наиболее значимый (лимитирующий) процесс (установить степень анодного, катодного и омического контроля). Установка для электрохимического исследования коррозии металлов (фиг. 1) включает в себя цепь для измерения потенциалов электродов, цепь для измерения коррозионного тока, а также термостат. Цепь для измерения потенциалов состоит из электродов (1), погруженных в растворы, находящиеся в сосудах (4). Растворы соединяются электролитическим ключом (3). В каждый раствор погружается электрод сравнения (например, хлорсеребряный электрод) (2). Переключатель (6) и милливольтметр (7) позволяют измерять потенциалы металлических электродов относительно применяемого электрода сравнения. Цепь для измерения коррозионного тока состоит из электродов (1), погруженных в растворы, находящиеся в сосудах (4). Растворы соединяются электролитическим ключом (3). Между электродами последовательно включены: тумблер (5), калиброванный резистор (8) с подключенным параллельно к нему высокоомным цифровым милливольтметром (9), магазин сопротивлений (10). Термостат состоит из сосуда, заполненного теплоносителем, наример водой (13), в который погружены сосуды с исследуемыми электродами, а также мешалка (11) и термометр (12). Электрохимическое исследование коррозионного элемента осуществляется следующим образом. В соответствии со схемой (фиг.1) собирается установка. Металлические образцы частично изолируют по длине термоусадочной трубкой или лаком для создания определенной площади поверхности и предотвращения контакта металлической поверхности с границей раздела фаз «раствор-воздух». Затем производят обработку поверхности в соответствии с ГОСТ 9.305-84. При разомкнутом тумблере (5) измеряют потенциалы исследуемых металлических образцов при отсутствии тока в цепи (стационарный потенциал металлического электрода), который затем пересчитывают относительно стандартного водородного электрода (СВЭ). При замыкании цепи тумблером (5) выставляется с помощью магазина сопротивлений (10) необходимое значение электрического сопротивления, и милливольтметром (9) измеряют падение напряжения на калиброванном резисторе (8). Полученное значение напряжения используют для расчета силы тока в исследуемой цепи из закона Ома. По полученным экспериментальным данным строят коррозионную диаграмму в координатах 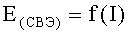

Устройство для электрохимического исследования коррозии металлов, включающее магазин сопротивлений для регулировки тока и приборы для регистрации потенциалов и силы тока, отличающееся тем, что для измерения силы тока коррозии используется милливольтметр, подключенный параллельно к калиброванному резистору с известным электрическим сопротивлением.
| Томашов Н.Д | |||
| и др | |||
| Лабораторные работы по коррозии и защите металлов | |||
| - М.: Металлургия, стр | |||
| Коловратный насос с кольцевым поршнем, перемещаемым эксцентриком | 1921 |
|
SU239A1 |
| Государственный стандарт союза сср единая система защиты от коррозии и старения подземные сооружения | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| CN103091242 A 08.05.2013 | |||
| WO 2008031453 A1 20.03.2008 | |||
Авторы
Даты
2014-11-20—Публикация
2013-07-09—Подача