ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым пневмококковым вакцинам. Изобретение также относится к вакцинации субъектов, в частности субъектов с ослабленным иммунитетом, против пневмококковых инфекций с использованием указанных новых пневмококковых вакцин.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Пневмококковые заболевания являются важной проблемой здравоохранения во всем мире. Инфекции, вызванные пневмококками, являются важной причиной заболеваемости и смертности во всем мире. Пневмония, фебрильная бактериемия и менингит являются наиболее частыми проявлениями инвазивного пневмококкового заболевания, в то время как распространение бактерий по дыхательным путям может приводить к инфекции среднего уха, синуситу или рецидивирующему бронхиту. По сравнению с инвазивным заболеванием неинвазивные проявления обычно менее тяжелые, но встречаются значительно чаще.
Несмотря на важность пневмококкового заболевания, информации об ущербе от заболевания, в частности в развивающихся странах, недостаточно. Это отчасти обусловлено неизбежной проблемой постановки этиологического диагноза в случаях пневмонии. Тем не менее, согласно доступным данным острые респираторные инфекции приводят к смерти приблизительно 2,6 миллиона детей младше пяти лет ежегодно. Пневмококк является причиной более 1 миллиона этих летальных исходов, большая часть из которых происходит в развивающихся странах, где пневмококк является, вероятно, наиболее важным патогеном у детей раннего возраста. В Европе и Соединенных Штатах пневмококковая пневмония является наиболее распространенной внебольничной бактериальной пневмонией, которая, согласно оценкам, поражает приблизительно 100 из 100000 взрослых ежегодно. Соответствующие цифры для фебрильной бактериемии и менингита составляют 15-19 на 100000 и 1-2 на 100000 соответственно. Риск одного или более чем одного из этих проявлений значительно выше у детей и пожилых людей, а также людей с ослабленным иммунитетом любого возраста. Даже в экономически развитых областях инвазивное пневмококковое заболевание приводит к высокой смертности; для взрослых показатель смертности от пневмококковой пневмонии составляет в среднем 10%-20%, в то же время он может превышать 50% в группах высокого риска. Общепризнанно, что пневмония является наиболее частой причиной смерти от пневмококковых заболеваний во всем мире.
Этиологический агент пневмококковых заболеваний, Streptococcus pneumoniae (пневмококк), является грамположительным инкапсулированным кокком, окруженным полисахаридной капсулой. Различия состава этой капсулы позволяют серологически различать приблизительно 90 капсульных типов, некоторые из которых часто связаны с пневмококковым заболеванием, другие - редко. Инвазивные пневмококковые инфекции включают пневмонию, менингит и фебрильную бактериемию; частыми неинвазивными проявлениями являются средний отит, синусит и бронхит.
Устойчивость пневмококков к основным антимикробным агентам, таким как пенициллины, цефалоспорины и макролиды, является серьезной и быстро растущей проблемой во всем мире.
Состояния, связанные с повышенным риском серьезного пневмококкового заболевания, включают детский и пожилой возраст (дети, пожилые люди) и ослабленный иммунитет по любой причине, включая, без ограничения, инфекцию, вызванную вирусом иммунодефицита человека (ВИЧ-инфекцию), другие хронические вирусные инфекции, серповидно-клеточную анемию, диабет, рак и лечение рака, курение, хроническую органную недостаточность, трансплантацию органов и иммуносупрессивную терапию.
Недавнее развитие широко распространенной устойчивости микроорганизмов к основным антибиотикам и увеличивающееся число людей с ослабленным иммунитетом подчеркивают неотложную потребность в более эффективных пневмококковых вакцинах.
Некоторые недостатки современной вакцинации включают: необходимость нескольких введений для обеспечения защитного эффекта; задержку выработки защитных антител; распространенность людей, не отвечающих на вакцины (эта проблема особенно важна у индивидов с ослабленным иммунитетом); стоимость получения антигенов и изготовления вакцин, что является очень существенным ограничением при разработке новых конъюгированных пневмококковых вакцин; слабые защитные свойства антител с низкой аффинностью; снижение титров антител с течением времени.
Задачей новой пневмококковой вакцины по изобретению является по меньшей мере частичное преодоление некоторых из этих недостатков, в частности, с целью вакцинации субъектов с ослабленным иммунитетом против пневмококковых инфекций.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В первом аспекте настоящее изобретение направлено на новые пневмококковые вакцины, содержащие один или более чем один антиген полисахаридов пневмококков, конъюгированный с белком-носителем, в качестве антигена и агонист Toll-подобного рецептора-9 (TLR-9) в качестве адъюванта.
В другом аспекте настоящее изобретение направлено на применение пневмококковой вакцины, содержащей один или более чем один антиген полисахаридов пневмококков, конъюгированный с белком-носителем, в качестве антигена и агонист TLR-9 в качестве адъюванта, для вакцинации субъектов с ослабленным иммунитетом.
В одном аспекте изобретение направлено на любую пневмококковую вакцину, раскрытую здесь, для применения в вакцинации субъектов с ослабленным иммунитетом, предпочтительно любых субъектов с ослабленным иммунитетом, раскрытых здесь.
В другом аспекте настоящее изобретение направлено на применение любых пневмококковых вакцин, раскрытых здесь, для вакцинации субъектов с ослабленным иммунитетом, предпочтительно любых субъектов с ослабленным иммунитетом, раскрытых здесь.
В другом аспекте настоящее изобретение направлено на любые вакцины, раскрытые здесь, для предотвращения или лечения заболеваний, вызванных инфекцией S. pneumoniae, предпочтительно у субъекта с ослабленным иммунитетом.
В другом аспекте настоящее изобретение направлено на способ иммунизации субъекта, предпочтительно любых субъектов с ослабленным иммунитетом, раскрытых здесь, против заболеваний, вызванных инфекцией S. pneumoniae, включающий введение указанному субъекту иммунопротективной дозы любой вакцины, раскрытой здесь.
В другом аспекте настоящее изобретение направлено на применение любых вакцин, раскрытых здесь, для изготовления лекарственного средства для предотвращения или лечения заболеваний, вызванных инфекцией S. pneumoniae, предпочтительно у субъекта с ослабленным иммунитетом.
В другом аспекте настоящее изобретение направлено на любые пневмококковые вакцины, раскрытые здесь, и по меньшей мере один агонист TLR-9, раскрытый здесь.
В другом аспекте настоящее изобретение направлено на любые пневмококковые вакцины, раскрытые здесь, и по меньшей мере один агонист TLR-9, раскрытый здесь, для применения в вакцинации любых субъектов с ослабленным иммунитетом, раскрытых здесь.
Агонист Toll-подобного рецептора-9 (агонист TLR-9) по изобретению
В одном воплощении настоящего изобретения агонист TLR-9 для использования в настоящем изобретении представляет собой CpG-олигонуклеотид. CpG-олигонуклеотид при использовании здесь относится к иммуностимулирующему CpG-олигодезоксинуклеотиду (CpG ODN), и, соответственно, эти термины использованы взаимозаменяемо, если не указано иное. Иммуностимулирующие CpG-олигодезоксинуклеотиды содержат один или более чем один иммуностимулирующий CpG-мотив, представляющий собой неметилированный динуклеотид цитозин-гуанин, возможно в окружении определенных предпочтительных оснований. Состояние метилирования иммуностимулирующего CpG-мотива обычно относится к цитозиновому остатку динуклеотида. Иммуностимулирующий олигонуклеотид, содержащий по меньшей мере один неметилированный CpG-динуклеотид, представляет собой олигонуклеотид, который содержит 5'-неметилированный цитозин, связанный фосфатной связью с 3'-гуанином, и активирует иммунную систему посредством связывания с Toll-подобным рецептором-9 (TLR-9). В другом воплощении иммуностимулирующий олигонуклеотид может содержать один или более чем один метилированный CpG-динуклеотид, активирующий иммунную систему через TLR9, но не так сильно, как если бы CpG-мотив(ы) был(и) неметилированным(и). Иммуностимулирующие CpG-олигонуклеотиды могут содержать один или более чем один палиндром, который, в свою очередь, может охватывать CpG-динуклеотид. CpG-олигонуклеотиды описаны в нескольких выданных патентах, опубликованных заявках на патенты и других публикациях, включая патенты США №6194388, 6207646, 6214806, 6218371, 6239116 и 6339068.
Были идентифицированы различные классы иммуностимулирующих CpG-олигонуклеотидов. Их называют классами А, В, С и Р, и они описаны более подробно ниже. Способы по изобретению включают применение иммуностимулирующих CpG-олигонуклеотидов этих различных классов.
Олигонуклеотиды любого класса могут быть подвергнуты Е-модификации, усиливающей их активность. Е-модификация может представлять собой замещение 5'-концевого нуклеотида галогеном; примеры таких замещений включают, без ограничения, замещение бромуридином или йодуридином. Е-модификация может также включать замещение 5'-концевого нуклеотида этилуридином.
Иммуностимулирующие CpG-олигонуклеотиды «класса А» функционально характеризуются способностью индуцировать высокие уровни секреции интерферона-альфа (IFN-α) плазмацитоидными дендритными клетками (pDC) и индукцией активации естественных клеток-киллеров (NK-клеток) при минимальных эффектах на активацию В-клеток. Структурно, для этого класса типичны стабилизированные поли-С-последовательности на 5'- и 3'-концах. Он также имеет палиндромную последовательность с фосфодиэфирными связями, содержащую CpG-динуклеотиды, по меньшей мере из 6 нуклеотидов, например, но не обязательно, он содержит один из следующих гексамерных палиндромов: GACGTC, AGCGCT или AACGTT, описанных Yamamoto и коллегами. Yamamoto S et al. J. Immunol 148:4072-6 (1992). Класс А иммуностимулирующих CpG-олигонуклеотидов и типичные последовательности этого класса были описаны в непредварительной заявке на патент США №09/672126 и опубликованной РСТ-заявке PCT/USOO/26527 (WO 01/22990), поданных 27 сентября 2000 г.
В одном воплощении CpG-олигонуклеотид «класса А» по изобретению имеет следующую последовательность нуклеиновой кислоты: 5' GGGGACGACGTCGTGGGGGGG 3' (SEQ ID NO:1).
Некоторые неограничивающие примеры олигонуклеотидов класса А включают:
5' G*G*G_G_A_C_G_A_C_G_T_C_G_T_G_G*G*G*G*G*G 3' (SEQ ID NO:2); где * относится к фосфоротиоатной связи, и _ относится к фосфодиэфирной связи.
Иммуностимулирующие CpG-олигонуклеотиды «класса В» функционально характеризуются способностью активировать В-клетки и pDC, за исключением относительно слабой индукции IFN-α и активации NK-клеток. Структурно, олигонуклеотиды этого класса обычно могут быть полностью стабилизированы фосфоротиоатными связями, но они могут также иметь одну или более чем одну фосфодиэфирную связь, предпочтительно между цитозином и гуанином CpG-мотива (CpG-мотивов), в случае чего молекулу называют полумягкой («semi-soft»). В одном воплощении агонист TLR-9 для использования в настоящем изобретении представляет собой' CpG-олигонуклеотид класса В, представленный по меньшей мере формулой:
5' X1X2CGX3X4 3', где X1, Х2, Х3 и Х4 представляют собой нуклеотиды. В одном воплощении Х2 представляет собой аденин, гуанин или тимин. В другом воплощении Х3 представляет собой цитозин, аденин или тимин.
В другом воплощении агонист TLR-9 для использования в настоящем изобретении представляет собой CpG-олигонуклеотид класса В, представленный по меньшей мере формулой:
5' N1X1X2CGX3X4N2 3', где X1, X2, Х3 и Х4 представляют собой нуклеотиды, и N представляет собой любой нуклеотид, и N1 и N2 представляют собой последовательности нуклеиновой кислоты, каждая из которых состоит из приблизительно 0-25 N. В одном воплощении X1X2 представляет собой динуклеотид, выбранный из группы, состоящей из GpT, GpG, GpA, ApA, ApT, ApG, CpT, CpA, CpG, TpA, ТрТ и TpG; и Х3Х4 представляет собой динуклеотид, выбранный из группы, состоящей из ТрТ, ApT, TpG, ApG, CpG, ТрС, АрС, СрС, TpA, ApA и CpA. Предпочтительно, X1X2 представляет собой GpA или GpT, и Х3Х4 представляет собой ТрТ. В других воплощениях X1 или Х2 либо X1 и Х2 представляют собой пурин, и Х3 или Х4 либо Х3 и Х4 представляют собой пиримидин, или X1X2 представляет собой GpA, и Х3 или Х4 либо Х3 и Х4 представляют собой пиримидин. В одном предпочтительном воплощении X1X2 представляет собой динуклеотид, выбранный из группы, состоящей из ТрА, АрА, АрС, ApG и GpG. В еще одном воплощении Х3Х4 представляет собой динуклеотид, выбранный из группы, состоящей из ТрТ, ТрА, TpG, АрА, ApG, GpA и СрА. В другом воплощении X1X2 представляет собой динуклеотид, выбранный из группы, состоящей из ТрТ, TpG, ApT, GpC, CpC, CpT, TpC, GpT и CpG; Х3 представляет собой нуклеотид, выбранный из группы, состоящей из А и Т, и Х4 представляет собой нуклеотид, но когда X1X2 представляет собой TpC, GpT или CpG, Х3Х4 не представляет собой TpC, ApT или АрС.
В другом предпочтительном воплощении CpG-олигонуклеотид имеет последовательность 5' TCN1TX1X2CGX3X4 3'. В некоторых воплощениях CpG-олигонуклеотиды по изобретению содержат X1X2, выбранный из группы, состоящей из GpT, GpG, GpA и АрА, и Х3Х4, выбранный из группы, состоящей из ТрТ, CpT и TpC.
Последовательностями CpG-олигонуклеотидов класса В по изобретению являются последовательности, широко описанные выше, а также раскрытые в опубликованных РСТ-заявках на патенты PCT/US95/01570 и PCT/US97/19791 и в патентах США №6194388, 6207646, 6214806, 6218371, 6239116 и 6339068. Типичные последовательности включают, без ограничения, последовательности, раскрытые в этих последних заявках и патентах.
В одном воплощении CpG-олигонуклеотид «класса В» по изобретению имеет следующую нуклеотидную последовательность:
5' TCGTCGTTTTTCGGTGCTTTT 3' (SEQ ID NO:3), или
5' TCGTCGTTTTTCGGTCGTTTT 3' (SEQ ID NO:4), или
5' TCGTCGTTTTGTCGTTTTGTCGTT 3' (SEQ ID NO:5), или
5' TCGTCGTTTCGTCGTTTTGTCGTT 3' (SEQ ID NO:6), или
5' TCGTCGTTTTGTCGTTTTTTTCGA 3' (SEQ ID NO:7).
В любой из этих последовательностей все связи могут представлять собой фосфоротиоатные связи. В другом воплощении в любой из этих последовательностей одна или более чем одна связь может быть фосфодиэфирной, предпочтительно между «С» и «G» CpG-мотива, что делает CpG-олигонуклеотид полумягким. В любой из этих последовательностей 5' Т может быть замещен этилуридином или галогеном; примеры замещений галогенами включают, без ограничения, замещение бромуридином или йодуридином.
Некоторые неограничивающие примеры олигонуклеотидов класса В включают:
5' T*C*G*T*C*G*T*T*T*T*T*C*G*G*T*G*C*T*T*T*T 3' (SEQ ID NO:8), или
5' T*C*G*T*C*G*T*T*T*T*T*C*G*G*T*C*G*T*T*T*T 3' (SEQ ID NO:9), или
5' T*C*G*T*C*G*T*T*T*T*G*T*C*G*T*T*T*T*G*T*C*G*T*T 3' (SEQ ID NO:10), или
5' T*C*G*T*C*G*T*T*T*C*G*T*C*G*T*T*T*T*G*T*C*G*T*T 3' (SEQ ID NO:11), или
5' T*C*G*T*C*G*T*T*T*T*G*T*C*G*T*T*T*T*T*T*T*C*G*A 3' (SEQ ID NO:12),
где * относится к фосфоротиоатной связи.
Иммуностимулирующие CpG-олигонуклеотиды «класса С» функционально характеризуются способностью активировать В-клетки и NK-клетки и индуцировать IFN-a. Структурно, олигонуклеотиды этого класса обычно содержат область с одним или более чем одним иммуностимулирующим CpG-мотивом типа класса В и палиндром или область, сходную с палиндромом, богатые GC, что позволяет молекулам формировать структуры вторичного (например, «стебель-петля») или третичного (например, димер) типа. Некоторые из этих олигонуклеотидов имеют как обычную «стимулирующую» CpG-последовательность, так и «мотив с высоким содержанием GC» или «мотив, нейтрализующий В-клетки». Эти олигонуклеотиды с комбинацией мотивов оказывают иммуностимулирующие эффекты, занимающие промежуточное положение между эффектами, связанными с обычными CpG-олигонуклеотидами класса В (то есть сильной индукцией активации В-клеток и активации дендритных клеток (DC)), и эффектами, связанными с CpG ODN класса А (то есть сильной индукцией IFN-α и активации NK-клеток при относительно слабой индукции активации В-клеток и DC). Krieg AM et al. (1995) Nature 374:546-9; Ballas ZK et al. (1996) J Immunol 157:1840-5; Yamamoto S et al. (1992) J Immunol 148:4072-6.
Иммуностимулирующие олигонуклеотиды класса С с комбинацией мотивов могут иметь полностью стабилизированные каркасы (например, когда все связи являются фосфоротиоатными), химерные каркасы (с фосфодиэфирными связями в центральной области) или полумягкие каркасы (например, с фосфодиэфирной связью в пределах CpG-мотива). Этот класс описан в заявке на патент США US 10/224523, поданной 19 августа 2002 г.
Один стимулирующий домен или мотив CpG-олигонуклеотида класса С определен формулой: 5' X1DCGHX2 3'. D представляет собой нуклеотид, не являющийся С. С представляет собой цитозин. G представляет собой гуанин. Н представляет собой нуклеотид, не являющийся G. X1 и Х2 представляют собой любую нуклеотидную последовательность длиной 0-10 нуклеотидов. X1 может содержать CG, в случае чего непосредственно перед этим CG предпочтительно присутствует Т. В некоторых воплощениях DCG представляет собой TCG. X1 предпочтительно имеет длину 0-6 нуклеотидов. В некоторых воплощениях Х2 не содержит никаких поли-G- или поли-А-мотивов. В других воплощениях иммуностимулирующий олигонуклеотид имеет поли-Т-последовательность на 5'-конце или на 3'-конце. При использовании здесь «поли-А» или «поли-Т» будет относиться к участку из четырех или более следующих друг за другом А или Т, соответственно, например 5" АААА 3" или 5" ТТТТ 3'. При использовании здесь «поли-С-конец» будет относиться к участку из четырех или более следующих друг за другом G, например 5" GGGG 3', расположенному на 5'-конце или 3'-конце нуклеиновой кислоты. При использовании здесь «поли-G-олигонуклеотид» будет относиться к олигонуклеотиду, имеющему формулу 5' X1X2GGGX3X4 3', где X1, Х2, Х3 и Х4 представляют собой нуклеотиды, и предпочтительно по меньшей мере один из Х3 и Х4 представляет собой G. Некоторые предпочтительные варианты домена, стимулирующего В-клетки, имеющего такую формулу, включают TTTTTCG, TCG, TTCG, TTTCG, TTTTCG, TCGT, TTCGT, TTTCGT, TCGTCGT.
Второй мотив CpG-олигонуклеотида класса С называют Р или N, и он расположен сразу за X1 ближе к 5'-концу или сразу за Х2 ближе к 3'-концу.
N представляет собой последовательность, нейтрализующую В-клетки, начинающуюся тринуклеотидом CGG и имеющую длину по меньшей мере 10 нуклеотидов. Мотив, нейтрализующий В-клетки, содержит по меньшей мере одну CpG-последовательность, в которой перед CG присутствует С или в которой после CG присутствует G (Krieg AM et al. (1998) Proc Natl Acad Sd USA 95:12631-12636), или представляет собой CG-содержащую последовательность ДНК, в которой С пары CG метилирован. Нейтрализующие мотивы или последовательности имеют некоторую степень иммуностимулирующей способности, когда они присутствуют в мотиве, который без них не является стимулирующим, но когда они присутствуют в контексте других иммуностимулирующих мотивов, они снижают иммуностимулирующий потенциал других мотивов.
Р представляет собой палиндром с высоким содержанием GC, содержащий последовательность длиной по меньшей мере 10 нуклеотидов.
При использовании здесь «палиндром» и, эквивалентно, «палиндромная последовательность» будут относиться к инвертированному повтору, то есть такой последовательности, как ABCDEE'D'C'B'A', где А и А', В и В', и так далее представляют собой основания, способные образовывать обычные пары оснований Уотсона-Крика.
При использовании здесь «палиндром с высоким содержанием GC» будет относиться к палиндрому, имеющему состав оснований, по меньшей мере на две трети представленный G и С. В некоторых воплощениях домен с высоким содержанием GC расположен предпочтительно ближе к 3'-концу от «домена, стимулирующего В-клетки». Таким образом, в случае палиндрома с высоким содержанием GC длиной 10 оснований палиндром содержит по меньшей мере 8 G и С. В случае палиндрома с высоким содержанием GC длиной 12 оснований палиндром также содержит по меньшей мере 8 G и С. В случае палиндрома с высоким содержанием GC длиной 14 оснований по меньшей мере десять оснований палиндрома представляют собой G и С. В некоторых воплощениях палиндром с высоким содержанием GC состоит исключительно из G и С.
В некоторых воплощениях палиндром с высоким содержанием GC имеет состав оснований, по меньшей мере на 81% представленный G и С. Таким образом, в случае такого палиндрома с высоким содержанием GC длиной 10 оснований палиндром состоит исключительно из G и С. В случае такого палиндрома с высоким содержанием GC длиной 12 оснований предпочтительно по меньшей мере десять оснований (83%) палиндрома представляют собой G и С. В некоторых предпочтительных воплощениях палиндром с высоким содержанием GC длиной 12 оснований состоит исключительно из G и С. В случае палиндрома с высоким содержанием GC длиной 14 оснований по меньшей мере двенадцать оснований (86%) палиндрома представляют собой G и С. В некоторых предпочтительных воплощениях палиндром с высоким содержанием GC длиной 14 оснований состоит исключительно из G и С. С-основания палиндрома с высоким содержанием GC могут быть неметилированными, или они могут быть метилированными.
Обычно этот домен имеет по меньшей мере 3 С и G, более предпочтительно 4 С и G и наиболее предпочтительно 5 или более С и G. В том, чтобы число С и G в этом домене было одинаковым, нет необходимости. Предпочтительно, С и G расположены таким образом, что они способны образовывать самокомплементарный дуплекс или палиндром, такой как CCGCGCGG. Эта последовательность может содержать А или Т, но предпочтительно самокомплементарность по меньшей мере частично сохранена, как, например, в мотивах CGACGTTCGTCG или CGGCGCCGTGCCG. Когда комплементарность не сохранена, предпочтительно некомплементарные пары оснований представляют собой TG. В предпочтительном воплощении присутствуют не более 3 расположенных друг за другом оснований, не являющихся частью палиндрома, предпочтительно не более 2 и наиболее предпочтительно только 1. В некоторых воплощениях палиндром с высоким содержанием GC включает по меньшей мере один тример CGG, по меньшей мере один тример CCG или по меньшей мере один тетрамер CGCG. В других воплощениях палиндром с высоким содержанием GC не является CCCCCCGGGGGG или GGGGGGCCCCCC, CCCCCGGGGG или GGGGGCCCCC.
По меньшей мере один G области с высоким содержанием GC может быть заменен на инозин (I). В некоторых воплощениях Р включает более чем один I.
В определенных воплощениях иммуностимулирующий олигонуклеотид имеет одну из следующих формул: 5' NX1DCGHX2 3', 5' X1DCGHX2N 3', 5' PX1DCGHX2 3', 5' X1DCGHX2P 3', 5' X1DCGHX2PX3 3', 5' X1DCGHPX3 3', 5' DCGHX2PX3 3', 5' TCGHX2PX3 3', 5' DCGHPX3 3' или 5' DCGHP 3'.
Согласно изобретению предложены другие иммуностимулирующие олигонуклеотиды, определенные формулой 5' N1PyGN2P 3'. N1 представляет собой любую последовательность длиной 1-6 нуклеотидов. Ру представляет собой пиримидин. G представляет собой гуанин. N2 представляет собой любую последовательность длиной 0-30 нуклеотидов. Р представляет собой палиндром с высоким содержанием GC, содержащий последовательность длиной по меньшей мере 10 нуклеотидов.
N1 и N2 могут содержать более чем 50% пиримидина и более предпочтительно более чем 50% Т. N1 может включать CG, в случае чего непосредственно перед этим CG предпочтительно присутствует Т. В некоторых воплощениях N1PyG представляет собой TCG и наиболее предпочтительно TCGN2, где N2 не является G.
NiPyGN2P может включать один или более чем один инозиновый (I) нуклеотид. С или G в N1 могут быть заменены инозином, но CpI более предпочтителен, чем IpG. Для инозиновых замен, таких как IpG, оптимальная активность может быть достигнута с использованием «полумягкого» или химерного каркаса, где связь между IG или CI является фосфодиэфирной. N1 может включать по меньшей мере один мотив CI, TCI, IG или TIG.
В определенных воплощениях N1PyGN2 представляет собой последовательность, выбранную из группы, состоящей из TTTTTCG, TCG, TTCG, TTTCG, TTTTCG, TCGT, TTCGT, TTTCGT и TCGTCGT.
В одном воплощении CpG-олигонуклеотиды «класса С» по изобретению имеют следующую последовательность нуклеиновой кислоты:
5' TCGCGTCGTTCGGCGCGCGCCG 3' (SEQ ID NO:13), или
5' TCGTCGACGTTCGGCGCGCGCCG 3' (SEQ ID NO:14), или
5' TCGGACGTTCGGCGCGCGCCG 3' (SEQ ID NO:15), или
5' TCGGACGTTCGGCGCGCCG 3' (SEQ ID NO:16), или
5' TCGCGTCGTTCGGCGCGCCG 3' (SEQ ID NO:17), или
5' TCGACGTTCGGCGCGCGCCG 3' (SEQ ID NO:18), или
5' TCGACGTTCGGCGCGCCG 3' (SEQ ID NO:19), или
5' TCGCGTCGTTCGGCGCCG 3' (SEQ ID NO:20), или
5' TCGCGACGTTCGGCGCGCGCCG 3' (SEQ ID NO:21), или
5' TCGTCGTTTTCGGCGCGCGCCG 3' (SEQ ID NO:22), или
5' TCGTCGTTTTCGGCGGCCGCCG 3' (SEQ ID NO:23), или
5' TCGTCGTTTTACGGCGCCGTGCCG 3' (SEQ ID NO:24), или
5' TCGTCGTTTTCGGCGCGCGCCGT 3' (SEQ ID NO:25).
В любой из этих последовательностей все связи могут представлять собой фосфоротиоатные связи. В другом воплощении в любой из этих последовательностей одна или более чем одна связь может быть фосфодиэфирной, предпочтительно между «С» и «G» CpG-мотива, что делает CpG-олигонуклеотид полумягким.
Некоторые неограничивающие примеры олигонуклеотидов класса С включают:
5' T*C_G*C_G*T*C_G*T*T*C_G*G*C*G*C_G*C*G*C*C*G 3' (SEQ ID NO:26), или
5' T*C_G*T*C_G*A*C_G*T*T*C_G*G*C*G*C_G*C*G*C*C*G 3' (SEQ ID NO:27), или
5' T*C_G*G*A*C_G*T*T*C_G*G*C*G*C_G*C*G*C*C*G 3' (SEQ ID NO:28), или
5' T*C_G*G*A*C_G*T*T*C_G*G*C*G*C*G*C*C*G 3' (SEQ ID NO:29), или
5' T*C_G*C_G*T*C_G*T*T*C_G*G*C*G*C*G*C*C*G 3' (SEQ ID NO:30), или
5' T*C_G*A*C_G*T*T*C_G*G*C*G*C_G*C*G*C*C*G 3' (SEQ ID NO:31), или
5' T*C_G*A*C_G*T*T*C_G*G*C*G*C*G*C*C*G 3' (SEQ ID NO:32), или
5' T*C_G*C_G*T*C_G*T*T*C_G*G*C*G*C*C*G 3' (SEQ ID NO:33), или
5' T*C_G*C_G*A*C_G*T*T*C_G*G*C*G*C_G*C*G*C*C*G 3' (SEQ ID NO:34), или
5' T*C*G*T*C*G*T*T*T*T*C*G*G*C*G*C*G*C*G*C*C*G 3' (SEQ ID NO:35), или
5' T*C*G*T*C*G*T*T*TT*C*G*G*C*G*G*C*C*G*C*C*G 3' (SEQ ID NO:36), или
5' T*C*G*T*C_G*T*T*T*T*A*C_G*G*C*G*C*C_G*T*G*C*C*G 3' (SEQ ID NO:37), или
5' T*C_G*T*C*G*T*T*T*T*C*G*G*C*G*C*G*C*G*C*C*G*T 3' (SEQ ID NO:38),
где * относится к фосфоротиоатной связи и _ относится к фосфодиэфирной связи.
В любой из этих последовательностей 5" Т может быть замещен этилуридином или галогеном; примеры замещений галогенами включают, без ограничения, замещение бромуридином или йодуридином.
Иммуностимулирующие CpG-олигонуклеотиды «класса Р» описаны в WO 2007/095316 и характеризуются тем фактом, что они содержат области, образующие дуплекс, такие как, например, полные или неполные палиндромы на обоих (5'- и 3'-) концах или близи обоих (5'- и 3'-) концов, что придает им способность образовывать структуры более высокого порядка, такие как конкатемеры. Эти олигонуклеотиды, называемые олигонуклеотидами класса Р, в некоторых случаях обладают способностью индуцировать значительно более высокие уровни секреции IFN-α, чем олигонуклеотиды класса С. Олигонуклеотиды класса Р обладают способностью к спонтанной самосборке с образованием конкатемеров in vitro и/или in vivo. Без связи с конкретной теорией механизма действия этих молекул одна возможная гипотеза состоит в том, что это свойство придает олигонуклеотидам класса Р большую способность к перекрестному связыванию с TLR9 внутри определенных иммунокомпетентных клеток, индуцируя паттерн иммунной активации, отличающийся от описанных ранее классов CpG-олигонуклеотидов.
В одном воплощении агонист TLR-9 для использования в настоящем изобретении представляет собой CpG-олигонуклеотид класса Р, содержащий 5'-домен, активирующий TLR, и по меньшей мере две палиндромные области, одна из которых представляет собой 5'-палиндромную область длиной по меньшей мере 6 нуклеотидов и связана с 3'-палиндромной областью длиной по меньшей мере 8 нуклеотидов либо непосредственно, либо через спейсер, где олигонуклеотид включает по меньшей мере один YpR-динуклеотид. В одном воплощении указанный олигонуклеотид не является T*C_G*T*C_G*A*C_G*T*T*C_G*G*C*G*C_G*C*G*C*C*G (SEQ ID NO:27). В одном воплощении CpG-олигонуклеотид класса Р включает по меньшей мере один неметилированный CpG-динуклеотид. В другом воплощении домен, активирующий TLR, представляет собой TCG; TTCG, TTTCG, TYpR, TTYpR, TTTYpR, UCG, UUCG, UUUCG, TTT или TTTT. В еще одном воплощении домен, активирующий TLR, расположен в 5'-палиндромной области. В другом воплощении домен, активирующий TLR, расположен непосредственно за 5'-палиндромной областью, ближе к 5'-концу. В еще одном воплощении 5'-палиндромная область имеет длину по меньшей мере 8 нуклеотидов. В другом воплощении 3'-палиндромная область имеет длину по меньшей мере 10 нуклеотидов. В другом воплощении 5'-палиндромная область имеет длину по меньшей мере 10 нуклеотидов. В еще одном воплощении 3'-палиндромная область включает неметилированный CpG-динуклеотид. В другом воплощении 3'-палиндромная область включает два неметилированных CpG-динуклеотида. В другом воплощении 5'-палиндромная область включает неметилированный CpG-динуклеотид. В еще одном воплощении 5'-палиндромная область включает два неметилированных CpG-динуклеотида. В другом воплощении 5'- и 3'-палиндромные области имеют показатель устойчивости дуплекса по меньшей мере 25. В другом воплощении 5'- и 3'-палиндромные области имеют показатель устойчивости дуплекса по меньшей мере 30. В другом воплощении 5'- и 3'-палиндромные области имеют показатель устойчивости дуплекса по меньшей мере 35. В другом воплощении 5'- и 3'-палиндромные области имеют показатель устойчивости дуплекса по меньшей мере 40. В другом воплощении 5'- и 3'-палиндромные области имеют показатель устойчивости дуплекса по меньшей мере 45. В другом воплощении 5'- и 3'-палиндромные области имеют показатель устойчивости дуплекса по меньшей мере 50. В другом воплощении 5'- и 3'-палиндромные области имеют показатель устойчивости дуплекса по меньшей мере 55. В другом воплощении 5'- и 3'-палиндромные области имеют показатель устойчивости дуплекса по меньшей мере 60. В другом воплощении 5'- и 3'-палиндромные области имеют показатель устойчивости дуплекса по меньшей мере 65.
В одном воплощении две палиндромные области соединены непосредственно. В другом воплощении две палиндромные области соединены 3'-3'-связью. В другом воплощении две палиндромные области перекрываются на один нуклеотид. В еще одном воплощении две палиндромные области перекрываются на два нуклеотида. В другом воплощении две палиндромные области не перекрываются. В другом воплощении две палиндромные области соединены спейсером. В одном воплощении спейсер представляет собой нуклеиновую кислоту, имеющую длину 1-50 нуклеотидов. В другом воплощении спейсер представляет собой нуклеиновую кислоту, имеющую длину 1 нуклеотид. В другом воплощении спейсер представляет собой ненуклеотидный спейсер. В одном воплощении ненуклеотидный спейсер представляет собой D-спейсер. В другом воплощении ненуклеотидный спейсер представляет собой линкер. В одном воплощении олигонуклеотид имеет формулу 5' XP1SP2T 3', где X представляет собой домен, активирующий TLR, P1 представляет собой палиндром, S представляет собой спейсер, Р2 представляет собой палиндром и Т представляет собой 3'-хвост длиной 0-100 нуклеотидов. В одном воплощении Х представляет собой TCG, TTCG или TTTCG. В другом воплощении Т имеет длину 5-50 нуклеотидов. В еще одном воплощении Т имеет длину 5-10 нуклеотидов. В одном воплощении S представляет собой нуклеиновую кислоту, имеющую длину 1-50 нуклеотидов. В другом воплощении S представляет собой нуклеиновую кислоту, имеющую длину 1 нуклеотид. В другом воплощении S представляет собой ненуклеотидный спейсер. В одном воплощении ненуклеотидный спейсер представляет собой D-спейсер. В другом воплощении ненуклеотидный спейсер представляет собой линкер. В другом воплощении олигонуклеотид не является антисмысловым олигонуклеотидом или рибозимом. В одном воплощении Pi имеет высокое содержание А и Т. В другом воплощении P1 включает по меньшей мере 4 Т. В другом воплощении Р2 представляет собой полный палиндром. В другом воплощении Р2 имеет высокое содержание G-C. В еще одном воплощении Р2 представляет собой CGGCGCX1GCGCCG, где X1 представляет собой Т или отсутствует.
В одном воплощении олигонуклеотид включает по меньшей мере одну фосфоротиоатную связь. В другом воплощении все межнуклеотидные связи олигонуклеотида представляют собой фосфоротиоатные связи. В другом воплощении олигонуклеотид включает по меньшей мере одну связь, подобную фосфодиэфирной. В другом воплощении связь, подобная фосфодиэфирной, представляет собой фосфодиэфирную связь. В другом воплощении с олигонуклеотидом конъюгирована липофильная группа. В одном воплощении липофильная группа представляет собой холестерин.
В одном воплощении агонист TLR-9 для использования в настоящем изобретении представляет собой CpG-олигонуклеотид класса Р с 5'-доменом, активирующим TLR, и по меньшей мере двумя комплементарность-содержащими областями, 5'- и 3'-комплементарность-содержащей областью, каждая из которых имеет длину по меньшей мере 8 нуклеотидов и связана с другой либо непосредственно, либо через спейсер, где олигонуклеотид включает по меньшей мере один пиримидин-пуриновый динуклеотид (YpR-динуклеотид) и где по меньшей мере одна из комплементарность-содержащих областей не является полным палиндромом. В одном воплощении олигонуклеотид включает по меньшей мере один неметилированный CpG-динуклеотид. В другом воплощении домен, активирующий TLR, представляет собой TCG, TTCG, TTTCG, TYpR, TTYpR, TTTYpR, UCG, UUCG, UUUCG, TTT или TTTT. В другом воплощении домен, активирующий TLR, расположен в 5'-комплементарность-содержащей области. В другом воплощении домен, активирующий TLR, расположен непосредственно за 5'-комплементарность-содержащей областью, ближе к 5'-концу. В другом воплощении 3'-комплементарность-содержащая область имеет длину по меньшей мере 10 нуклеотидов. В еще одном воплощении 5'-комплементарность-содержащая область имеет длину по меньшей мере 10 нуклеотидов. В одном воплощении S'-комплементарность-содержащая область включает неметилированный CpG-динуклеотид. В другом воплощении 3'-комплементарность-содержащая область включает два неметилированных CpG-динуклеотида. В еще одном воплощении 5'-комплементарность-содержащая область включает неметилированный CpG-динуклеотид. В другом воплощении 5'-комплементарность-содержащая область включает два неметилированных CpG-динуклеотида. В другом воплощении комплементарность-содержащие области включают по меньшей мере один аналог нуклеотидов. В другом воплощении комплементарность-содержащие области образуют внутримолекулярный дуплекс. В одном воплощении внутримолекулярный дуплекс включает по меньшей мере одну пару оснований, не являющуюся парой оснований Уотсона-Крика. В другом воплощении пара оснований, не являющаяся парой оснований Уотсона-Крика, представляет собой G-T, G-A, G-G или С-А. В одном воплощении комплементарность-содержащие области образуют межмолекулярные дуплексы. В одном воплощении по меньшей мере один межмолекулярный дуплекс включает по меньшей мере одну пару оснований, не являющуюся парой оснований Уотсона-Крика. В другом воплощении пара оснований, не являющаяся парой оснований Уотсона-Крика, представляет собой G-T, G-A, G-G или С-А. В еще одном воплощении комплементарность-содержащие области содержат ошибочное спаривание. В еще одном воплощении комплементарность-содержащие области содержат два ошибочных спаривания. В другом воплощении комплементарность-содержащие области содержат промежуточный нуклеотид. В другом воплощении комплементарность-содержащие области содержат два промежуточных нуклеотида.
В одном воплощении 5'- и 3'-комплементарность-содержащие области имеют показатель устойчивости дуплекса по меньшей мере 25. В другом воплощении 5'- и 3'-комплементарность-содержащие области имеют показатель устойчивости дуплекса по меньшей мере 30. В другом воплощении 5'- и 3'-комплементарность-содержащие области имеют показатель устойчивости дуплекса по меньшей мере 35. В другом воплощении комплементарность-содержащие области имеют показатель устойчивости дуплекса по меньшей мере 40. В другом воплощении комплементарность-содержащие области имеют показатель устойчивости дуплекса по меньшей мере 45. В другом воплощении комплементарность-содержащие области имеют показатель устойчивости дуплекса по меньшей мере 50. В другом воплощении комплементарность-содержащие области имеют показатель устойчивости дуплекса по меньшей мере 55. В другом воплощении комплементарность-содержащие области имеют показатель устойчивости дуплекса по меньшей мере 60. В другом воплощении комплементарность-содержащие области имеют показатель устойчивости дуплекса по меньшей мере 65.
В другом воплощении две комплементарность-содержащие области соединены непосредственно. В другом воплощении две палиндромные области соединены 3'-3'-связью. В еще одном воплощении две комплементарность-содержащие области перекрываются на один нуклеотид. В еще одном воплощении две комплементарность-содержащие области перекрываются на два нуклеотида. В другом воплощении две комплементарность-содержащие области не перекрываются. В другом воплощении две комплементарность-содержащие области соединены спейсером. В другом воплощении спейсер представляет собой нуклеиновую кислоту, имеющую длину 1-50 нуклеотидов. В другом воплощении спейсер представляет собой нуклеиновую кислоту, имеющую длину 1 нуклеотид. В одном воплощении спейсер представляет собой ненуклеотидный спейсер. В другом воплощении ненуклеотидный спейсер представляет собой D-спейсер. В еще одном воплощении ненуклеотидный спейсер представляет собой линкер.
В одном воплощении олигонуклеотид класса Р имеет формулу 5' XNSPT 3', где Х представляет собой домен, активирующий TLR, N представляет собой неполный палиндром, Р представляет собой палиндром, S представляет собой спейсер и Т представляет собой 3'-хвост длиной 0-100 нуклеотидов. В другом воплощении Х представляет собой TCG, TTCG или TTTCG. В другом воплощении Т имеет длину 5-50 нуклеотидов. В другом воплощении Т имеет длину 5-10 нуклеотидов. В другом воплощении S представляет собой нуклеиновую кислоту, имеющую длину 1-50 нуклеотидов. В другом воплощении S представляет собой нуклеиновую кислоту, имеющую длину 1 нуклеотид. В другом воплощении S представляет собой ненуклеотидный спейсер. В другом воплощении ненуклеотидный спейсер представляет собой D-спейсер. В другом воплощении ненуклеотидный спейсер представляет собой линкер. В другом воплощении олигонуклеотид не является антисмысловым олигонуклеотидом или рибозимом. В другом воплощении N имеет высокое содержание А и Т. В другом воплощении N включает по меньшей мере 4 Т. В другом воплощении Р представляет собой полный палиндром. В другом воплощении Р имеет высокое содержание G-C. В другом воплощении Р представляет собой CGGCGCX1GCGCCG, где X1 представляет собой Т или отсутствует. В другом воплощении олигонуклеотид включает по меньшей мере одну фосфоротиоатную связь. В другом воплощении все межнуклеотидные связи олигонуклеотида представляют собой фосфоротиоатные связи. В другом воплощении олигонуклеотид включает по меньшей мере одну связь, подобную фосфодиэфирной. В другом воплощении связь, подобная фосфодиэфирной, представляет собой фосфодиэфирную связь. В другом воплощении с олигонуклеотидом конъюгирована липофильная группа. В одном воплощении липофильная группа представляет собой холестерин.
В одном воплощении CpG-олигонуклеотид «класса Р» по изобретению имеет следующую последовательность нуклеиновой кислоты: 5' TCGTCGACGATCGGCGCGCGCCG 3' (SEQ ID NO:39).
В указанных последовательностях все связи могут представлять собой фосфоротиоатные связи. В другом воплощении одна или более чем одна связь может быть фосфодиэфирной, предпочтительно между «С» и «G» CpG-мотива, что делает CpG-олигонуклеотид полумягким. В любой из этих последовательностей 5' Т может быть замещен этилуридином или галогеном; примеры замещений галогенами включают, без ограничения, замещение бромуридином или йодуридином.
Неограничивающий пример олигонуклеотидов класса Р включает:
5' T*C_G*T*C_G*A*C_G*A*T*C_G*G*C*G*C_G*C*G*C*C*G 3' (SEQ ID NO:40),
где * относится к фосфоротиоатной связи и _ относится к фосфодиэфирной связи.
В одном воплощении все межнуклеотидные связи CpG-олигонуклеотидов, раскрытых здесь, представляют собой фосфодиэфирные связи («мягкие» олигонуклеотиды, как описано в РСТ-заявке WO 2007/026190). В другом воплощении CpG-олигонуклеотидам по изобретению придана устойчивость к деградации (например, они стабилизированы). «Стабилизированный олигонуклеотид» относится к олигонуклеотиду, относительно устойчивому к деградации in vivo (например, экзо- или эндонуклеазой). Стабилизация нуклеиновых кислот может быть проведена путем модификации каркаса. Олигонуклеотиды с фосфоротиоатными связями обеспечивают максимальную активность и защищают олигонуклеотид от деградации внутриклеточными экзо- и эндонуклеазами.
Иммуностимулирующие олигонуклеотиды могут иметь химерный каркас, содержащий комбинации фосфодиэфирных и фосфоротиоатных связей. В целях настоящего изобретения химерный каркас относится к частично стабилизированному каркасу, где по меньшей мере одна межнуклеотидная связь является фосфодиэфирной или подобна фосфодиэфирной и где по меньшей мере одна другая межнуклеотидная связь представляет собой стабилизированную межнуклеотидную связь, где по меньшей мере одна фосфодиэфирная связь или связь, подобная фосфодиэфирной, и по меньшей мере одна стабилизированная связь отличаются друг от друга. Когда фосфодиэфирная связь предпочтительно расположена в CpG-мотиве, такие молекулы называют «полумягкими», как описано в РСТ-заявке WO 2007/026190.
Другие модифицированные олигонуклеотиды включают комбинации фосфодиэфирных, фосфоротиоатных, метилфосфонатных, метилфосфоротиоатных, фосфородитиоатных связей и/или п-этокси-связей.
Поскольку было сообщено, что боранофосфонатные связи являются стабилизированными по сравнению с фосфодиэфирными связями, для целей химерного характера каркаса боранофосфонатные связи могут быть классифицированы либо как подобные фосфодиэфирным, либо как стабилизированные, в зависимости от контекста. Например, в некоторых воплощениях химерный каркас по настоящему изобретению может включать по меньшей мере одну фосфодиэфирную (фосфодиэфирную или подобную фосфодиэфирной) связь и по меньшей мере одну боранофосфонатную (стабилизированную) связь. В других воплощениях химерный каркас по настоящему изобретению может включать боранофосфонатные (фосфодиэфирные или подобные фосфодиэфирным) и фосфоротиоатные (стабилизированные) связи. «Стабилизированная межнуклеотидная связь» будет обозначать межнуклеотидную связь, относительно устойчивую к деградации in viva (например, экзо- или эндонуклеазой) по сравнению с фосфодиэфирной межнуклеотидной связью. Предпочтительные стабилизированные межнуклеотидные связи включают, без ограничения, фосфоротиоатные, фосфородитиоатные, метилфосфонатные и метилфосфоротиоатные. Другие стабилизированные межнуклеотидные связи включают, без ограничения, пептидные, алкильные, нефосфорные (dephospho) и другие, как описано выше.
Модифицированные каркасы, такие как фосфоротиоаты, могут быть синтезированы с применением автоматизированных методик с применением либо фосфорамидатной, либо Н-фосфонатной химии. Арил- и алкилфосфонаты могут быть получены, например, как описано в патенте США №4469863; и алкилфосфотриэфиры (в которых заряженная кислородная группировка алкилирована, как описано в патенте США №5023243 и европейском патенте №092574) могут быть получены автоматизированным твердофазным синтезом с использованием имеющихся в продаже реагентов. Были описаны способы осуществления других модификаций и замен в каркасе ДНК. Uhlmann E et al. (1990) Chem Rev 90:544; Goodchild J (1990) Bioconjugate Chem 1:165. Также известны способы получения химерных олигонуклеотидов. Например, такие методики описаны в патентах, выданных Uhlmann et al.
Модифицированные ODN со смешанным каркасом могут быть синтезированы, как описано в РСТ-заявке WO 2007/026190.
Олигонуклеотиды по изобретению могут также включать другие модификации. Они включают неионные аналоги ДНК, такие как алкил- и арилфосфаты (в которых заряженный фосфонатный кислород заменен алкильной или арильной группой), фосфодиэфиры и алкилфосфотриэфиры, в которых заряженная кислородная группировка алкилирована. Было показано, что нуклеиновые кислоты, содержащие диол, такой как тетраэтиленгликоль или гексаэтиленгликоль, на одном или обоих концах, также в значительной степени устойчивы к расщеплению нуклеазами.
Размер CpG-олигонуклеотида (то есть, число нуклеотидных остатков в соответствии с длиной олигонуклеотида) также может способствовать стимулирующей активности олигонуклеотида. Для облегчения проникновения в клетки минимальная длина CpG-олигонуклеотидов по изобретению предпочтительно составляет 6 нуклеотидных остатков. Олигонуклеотиды любого размера, превышающего 6 нуклеотидов (даже длиной несколько тысяч оснований) способны индуцировать иммунный ответ при наличии достаточных иммуностимулирующих мотивов, поскольку более крупные Олигонуклеотиды подвержены внутриклеточной деградации. В определенных воплощениях CpG-олигонукпеотиды имеют длину 6-100 нуклеотидов, предпочтительно 8-30 нуклеотидов. В важных воплощениях нуклеиновые кислоты и олигонуклеотиды по изобретению не являются плазмидами или векторами экспрессии.
В одном воплощении CpG-олигонуклеотид, раскрытый здесь, содержит замены или модификации, как, например, замены или модификации оснований и/или сахаров, как описано в 134-147 абзацах WO 2007/026190.
В одном воплощении CpG-олигонуклеотид по настоящему изобретению химически модифицирован. Примеры химических модификаций известны специалисту в данной области техники и описаны, например, в Uhlmann E. et al. (1990), Chem. Rev. 90:543, S.Agrawal, Ed., Humana Press, Totowa, USA 1993; Crooke, S.T. et al. (1996) Annu. Rev. Pharmacol. Toxicol. 36:107-129; и Hunziker J. et al., (1995), Mod. Synth. Methods 7:331-417. Олигонуклеотид по изобретению может иметь одну или более чем одну модификацию по сравнению с олигонуклеотидом той же последовательности, состоящим из природной ДНК или РНК, где каждая модификация расположена в определенной фосфодиэфирной межнуклеозидной связи, и/или в определенной β-D-рибозной единице, и/или в положении определенного природного нуклеозидного основания.
В некоторых воплощениях изобретения CpG-содержащие нуклеиновые кислоты могут быть просто смешаны с иммуногенными носителями в соответствии со способами, известными специалистам в данной области техники (см., например, WO 03/024480).
В определенном воплощении настоящего изобретения любая вакцина, раскрытая здесь, содержит от 2 мкг до 100 мг CpG-олигонуклеотида, предпочтительно от 0,1 мг до 50 мг CpG-олигонуклеотида, предпочтительно от 0,2 мг до 10 мг CpG-олигонуклеотида, предпочтительно от 0,3 мг до 5 мг CpG-олигонуклеотида, предпочтительно от 0,3 мг до 5 мг CpG-олигонуклеотида, еще предпочтительнее от 0,5 до 2 мг CpG-олигонуклеотида, еще предпочтительнее от 0,75 до 1,5 мг CpG-олигонуклеотида. В предпочтительном воплощении любая вакцина, раскрытая здесь, содержит приблизительно 1 мг CpG-олигонуклеотида.
Пневмококковые вакцины
Пневмококковая вакцина по настоящему изобретению будет обычно содержать конъюгированные антигены капсульных сахаридов, имеющих происхождение из по меньшей мере семи серотипов S. pneumoniae. Число капсульных сахаридов S. pneumoniae может варьировать от 7 разных серотипов (или «v», валентностей) до 23 разных серотипов (23v). В одном воплощении представлено 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22 или 23 разных серотипов. В одном воплощении представлено 10 или 11 разных серотипов. В одном воплощении представлено 7 или 13 разных серотипов. Антигены капсульных сахаридов конъюгированы с белком-носителем, как описано ниже.
В другом воплощении изобретения вакцина может содержать конъюгированные сахариды S. pneumoniae и неконъюгированные сахариды S. pneumoniae. Предпочтительно, общее число серотипов сахаридов меньше или равно 23. Например, вакцина может содержать 7 конъюгированных серотипов и 16 неконъюгированных сахаридов. В другом воплощении вакцина может содержать 13 конъюгированных серотипов и 10 неконъюгированных сахаридов. Сходным образом, вакцина может содержать 8, 9, 10, 11, 12, 13, 14, 15 или 16 конъюгированных сахаридов и 15, 14, 13, 12, 11, 10, 9, 8 или 7 соответственно неконъюгированных сахаридов.
1. В одном воплощении вакцина по изобретению содержит конъюгированные сахариды S. pneumoniae из серотипов 4, 6В, 9V, 14, 18С, 19F и 23F.
2. В другом воплощении вакцина по изобретению содержит, в дополнение к пункту 1, изложенному выше, конъюгированные сахариды S. pneumoniae из серотипа 1.
3. В другом воплощении вакцина по изобретению содержит, в дополнение к пункту 1 или 2, изложенному выше, конъюгированные сахариды S. pneumoniae из серотипа 5.
4. В другом воплощении вакцина по изобретению содержит, в дополнение к пункту 1, 2 или 3, изложенному выше, конъюгированные сахариды S. pneumoniae из серотипа 7F.
5. В другом воплощении вакцина по изобретению содержит, в дополнение к пункту 1, 2, 3 или 4, изложенному выше, конъюгированные сахариды S. pneumoniae из серотипа 3.
6. В другом воплощении вакцина по изобретению содержит, в дополнение к пункту 1, 2, 3, 4 или 5, изложенному выше, конъюгированные сахариды S. pneumoniae из серотипа 6А.
7. В другом воплощении вакцина по изобретению содержит, в дополнение к пункту 1, 2, 3, 4, 5 или 6, изложенному выше, конъюгированные сахариды S. pneumoniae из серотипа 19А.
8. В другом воплощении вакцина по изобретению содержит, в дополнение к пункту 1, 2, 3, 4, 5, 6 или 7, изложенному выше, конъюгированные сахариды S. pneumoniae из серотипа 22F.
9. В другом воплощении вакцина по изобретению содержит, в дополнение к пункту 1, 2, 3, 4, 5, 6, 7 или 8, изложенному выше, конъюгированные сахариды S. pneumoniae из серотипа 15.
10. В другом воплощении вакцина по изобретению содержит, в дополнение к пункту 1, 2, 3, 4, 5, 6, 7, 8 или 9, изложенному выше, конъюгированные сахариды S. pneumoniae из серотипа 8.
11. В другом воплощении вакцина по изобретению содержит, в дополнение к пункту 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, изложенному выше, конъюгированные сахариды S. pneumoniae из серотипа 12F.
12. В другом воплощении вакцина по изобретению содержит, в дополнение к пункту 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11, изложенному выше, конъюгированные сахариды S. pneumoniae из серотипа 2.
13. В другом воплощении вакцина по изобретению содержит, в дополнение к пункту 1, 2, 3, 4, 5, 6, 7, 8, 9, 11 или 12, изложенному выше, конъюгированные сахариды S. pneumoniae из серотипа 9N.
14. В другом воплощении вакцина по изобретению содержит, в дополнение к пункту 1, 2, 3, 4, 5, 6, 7, 8, 9, 11, 12 или 13, изложенному выше, конъюгированные сахариды S. pneumoniae из серотипа 10А.
15. В другом воплощении вакцина по изобретению содержит, в дополнение к пункту 1, 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 13 или 14, изложенному выше, конъюгированные сахариды S. pneumoniae из серотипа 11А.
16. В другом воплощении вакцина по изобретению содержит, в дополнение к пункту 1, 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 13, 14 или 15, изложенному выше, конъюгированные сахариды S. pneumoniae из серотипа 11А.
17. В другом воплощении вакцина по изобретению содержит, в дополнение к пункту 1, 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 13, 14, 15 или 16, изложенному выше, конъюгированные сахариды S. pneumoniae из серотипа 17F.
18. В другом воплощении вакцина по изобретению содержит, в дополнение к пункту 1, 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 13, 14, 15, 16 или 17, изложенному выше, конъюгированные сахариды S. pneumoniae из серотипа 20.
19. В другом воплощении вакцина по изобретению содержит, в дополнение к пункту 1, 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 13, 14, 15, 16, 17 или 18, изложенному выше, конъюгированные сахариды S. pneumoniae из серотипа 33F.
В одном воплощении вакцина по изобретению содержит конъюгированные сахариды S. pneumoniae из серотипов 4, 6В, 9V, 14, 18С, 19F и 23F.
В одном воплощении вакцина по изобретению содержит конъюгированные сахариды S. pneumoniae из серотипов 1, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, 19F и 23F.
В одном воплощении вакцина по изобретению содержит конъюгированные сахариды S. pneumoniae из серотипов 1, 4, 5, 6В, 7F, 9V, 14, 18С, 19F и 23F.
В одном воплощении вакцина по изобретению содержит конъюгированные сахариды S. pneumoniae из серотипов 1, 3, 4, 5, 6В, 7F, 9V, 14, 18С, 19F и 23F.
В предпочтительном воплощении антигены капсульных сахаридов конъюгированы с белком-носителем, независимо выбранным из группы, состоящей из столбнячного анатоксина (ТТ), дифтерийного анатоксина (DT), CRM197, С-фрагмента ТТ, PhtD, слитых белков PhtDE (в частности, описанных в WO 01/98334 и WO 03/54007), нейтрализованного пневмолизина и белка D.
В предпочтительном воплощении антигены капсульных сахаридов конъюгированы с белками-носителями, выбранными из группы, состоящей из: DT (дифтерийного анатоксина), ТТ (столбнячного анатоксина) или С-фрагмента ТТ, CRM197 (нетоксичного, но антигенно идентичного варианта дифтерийного токсина), других точечных мутантов DT, таких как CRM176, CRM228, CRM45 (Uchida et al. J. Biol. Chem. 218; 3838-3844, 1973); CRM9, CRM45, CRM102, CRM103 и CRM107, и других мутаций, описанных Nicholls and Youle в Genetically Engineered Toxins, Ed: Frankel, Maecel Dekker Inc, 1992; делеции или замены Glu-148 на Asp, Gin, или Ser, и/или Ala 158 на Gly, и других мутаций, раскрытых в US 4709017 или US 4950740; мутации по меньшей мере одного или более чем одного из остатков Lys 516, Lys 526, Phe 530 и/или Lys 534 и других мутаций, раскрытых в US 5917017 или US 6455673; или фрагмента, раскрытого в US 5843711, пневмококкового пневмолизина (Kuo et al. (1995) Infect Immun 63; 2706-13), включая некоторым образом нейтрализованный пневмолизин, например dPLY-GMBS (WO 04081515, РСТ/ЕР2005/010258) или dPLY-formol, PhtX, включая PhtA, PhtB, PhtD, PhtE (последовательности PhtA, PhtB, PhtD или PhtE раскрыты в WO 00/37105 или WO 00/39299) и слитые белки белков Pht, например слитые белки PhtDE, слитые белки PhtBE, Pht A-E (WO 01/98334, WO 03/54007, WO 2009/000826), OMPC (белка наружной мембраны менингококков, обычно выделяемого из N. meningitidis серогруппы В, ЕР 0372501), PorB (из N. meningitidis), PD (белка D Haemophilus influenzae, см., например, ЕР 0594610 В), или их иммунологически функциональных эквивалентов, синтетических пептидов (ЕР 0378881, ЕР 0427347), белков теплового шока (WO 93/17712, WO 94/03208), коклюшных белков (WO 98/58668, ЕР 0471177), цитокинов, лимфокинов, факторов роста или гормонов (WO 91/01146), искусственных белков, содержащих множество эпитопов, распознаваемых человеческими CD4+Т-клетками, из антигенов, имеющих происхождение из различных патогенов (Falugi et al. (2001) Eur J Immunol 31; 3816-3824), таких как белок N19 (Baraldoi et al. (2004) Infect Immun 72; 4884-7), поверхностный белок пневмококков PspA (WO 02/091998), белки, связанные с усвоением железа (WO 01/72337), токсин А или В С. difficile (WO 00/61761).
В одном воплощении антигены капсульных сахаридов конъюгированы с DT (дифтерийным анатоксинов). В другом воплощении антигены капсульных сахаридов конъюгированы с ТТ (столбнячным анатоксином).
В другом воплощении антигены капсульных сахаридов конъюгированы с С-фрагментом ТТ.
В другом воплощении антигены капсульных сахаридов конъюгированы с PD (белком D Haemophilus influenzae, см., например, ЕР 0594610 В).
В предпочтительном воплощении антигены капсульных сахаридов по изобретению конъюгированы с белком CRM197. Белок CRM197 представляет собой нетоксичную форму дифтерийного токсина, но иммунологически неотличим от дифтерийного токсина. CRM197 продуцируют С. diphtheriae, инфицированные нетоксикогенным фагом β197tox-, полученным путем мутагенеза токсикогенного бета-фага коринебактерий с использованием нитрозогуанидинов (Uchida, Т. et al. 1971, Nature New Biology 233:8-11). Белок CRM197 имеет такую же молекулярную массу, как и дифтерийный токсин, но отличается от него заменой одного основания (гуанина на аденин) в структурном гене. Эта замена одного основания приводит к аминокислотной замене (глицина на глутаминовую кислоту) в зрелом белке и устраняет токсичные свойства дифтерийного токсина. Белок CRM197 является безопасным и эффективным носителем сахаридов, зависимым от Т-клеток. Дополнительные подробности о CRM197 и его получении могут быть обнаружены, например, в US 5614382.
В одном воплощении, если белок-носитель одинаков для 2 или более сахаридов композиции, сахариды могут быть конъюгированы с одной и той же молекулой белка-носителя (при этом с молекулами-носителями конъюгированы еще 2 разных сахарида) (см., например, WO 04/083251).
Альтернативно, каждый сахарид может быть по отдельности конъюгирован с различными молекулами белка-носителя (при этом с каждой молекулой белка-носителя конъюгирован сахарид только одного типа). В указанном воплощении капсульные сахариды называют конъюгированными с белком-носителем по отдельности.
В одном воплощении антигены капсульных сахаридов по настоящему изобретению имеют происхождение из разных серотипов S. pneumoniae и конъюгированы с одним или более чем одним белком-носителем. В одном воплощении вакцина по изобретению содержит конъюгаты капсульных сахаридов 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22 или 23 разных серотипов, где CRM197 является белком-носителем.
В одном воплощении вакцина по изобретению содержит конъюгаты капсульных сахаридов 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22 или 23 разных серотипов, где белок D является белком-носителем.
В одном воплощении сахарид из серотипа 1, 2, 3, 4, 5, 6В, 7F, 8, 9N, 9V, 10А, 11А, 12F, 14, 15В, 17F, 18С, 19А, 19F, 20, 22F, 23F или 33F конъюгирован с белком D.
В одном воплощении сахарид из серотипа 1, 2, 3, 4, 5, 6В, 7F, 8, 9N, 9V, 10А, 11А, 12F, 14, 15 В, 17F, 18С, 19А, 19F, 20, 22F, 23F или 33F конъюгирован с CRM197.
В одном воплощении сахариды из по меньшей мере серотипов 1 и 3, 1 и 4, 1 и 5, 1 и 6А, 1 и 6В, 1 и 7, 1 и 9V, 1 и 14, 1 и 22F, 1 и 23F, 3 и 4, 3 и 5, 3 и 6А, 3 и 6В, 3 и 7F, 3 и 9V, 3 и 14, 3 и 22F, 3 и 23F, 4 и 5, 4 и 6А, 4 и 6В, 4 и 7F, 4 и 9V, 4 и 14, 4 и 22F, 4 и 23F, 5 и 6А, 5 и 6 В, 5 и 7F, 5 и 9V, 5 и 14, 5 и 22F, 5 и 23F, 6А и 6В, 6А и 7F, 6А и 9V, 6А и 14, 6А и 22F, 6А и 23F, 6В и 7F, 6В и 9V, 6В и 14, 6В и 22F, 6В и 23F, 7F и 9V, 7F и 14, 7F и 22F, 7F и 23F, 9V и 14, 9V и 22F, 9V и 23F, 14 и 22F, 14 и 23F или 22F и 23F конъюгированы с CRM197.
В одном воплощении сахариды из по меньшей мере серотипов 1, 3 и 4; 1, 3 и 5; 1, 3 и 6А; 1, 3 и 6В; 1, 3 и 7F; 1, 3 и 9V; 1, 3 и 14; 3, 4 и 7F; 3, 4 и 5; 3, 4 и 7F; 3, 4 и 9V; 3, 4 и 14; 4, 5 и 7F; 4, 5 и 9V; 4, 5 и 14; 5, 7F и 9V; 5, 7F и 14; 7F, 9V и 14; 1, 3, 4 и 5; 3, 4, 5 и 7F; 4, 5, 7F и 9V; 4, 5, 7F и 14; 4, 5, 9V и 14; 4, 7F, 9V и 14; 5, 7F, 9V и 14; или 4, 5, 7F, 9V и 14 конъюгированы с CRM197.
В одном воплощении сахариды из по меньшей мере серотипов 1 и 3, 1 и 4, 1 и 5, 1 и 6А, 1 и 6В, 1 и 7, 1 и 9V, 1 и 14, 1 и 22F, 1 и 23F, 3 и 4, 3 и 5, 3 и 6А, 3 и 6В, 3 и 7F, 3 и 9V, 3 и 14, 3 и 22F, 3 и 23F, 4 и 5, 4 и 6А, 4 и 6В, 4 и 7F, 4 и 9V, 4 и 14, 4 и 22F, 4 и 23F, 5 и 6А, 5 и 6В, 5 и 7F, 5 и 9V, 5 и 14, 5 и 22F, 5 и 23F, 6А и 6В, 6А и 7F, 6А и 9V, 6А и 14, 6А и 22F, 6А и 23F, 6В и 7F, 6В и 9V, 6В и 14, 6В и 22F, 6В и 23F, 7F и 9V, 7F и 14, 7F и 22F, 7F и 23F, 9V и 14, 9V и 22F, 9V и 23F, 14 и 22F, 14 и 23F или 22F и 23F конъюгированы с белком D.
В одном воплощении сахариды из по меньшей мере серотипов 1, 3 и 4; 1, 3 и 5; 1, 3 и 6А; 1, 3 и 6В; 1, 3 и 7F; 1, 3 и 9V; 1, 3 и 14; 3, 4 и 7F; 3, 4 и 5; 3, 4 и 7F; 3, 4 и 9V; 3, 4 и 14; 4, 5 и 7F; 4, 5 и 9V; 4, 5 и 14; 5, 7F и 9V; 5, 7F и 14; 7F, 9V и 14; 1, 3, 4 и 5; 3, 4, 5 и 7F; 4, 5, 7F и 9V; 4, 5, 7F и 14; 4, 5, 9V и 14; 4, 7F, 9V и 14; 5, 7F, 9V и 14; или 4, 5, 7F, 9V и 14 конъюгированы с белком D.
В одном воплощении вакцина по изобретению содержит конъюгаты капсульных сахаридов из 7 разных серотипов, где CRM197 является белком-носителем.
В одном воплощении вакцина по изобретению содержит конъюгаты капсульных сахаридов из 7 разных серотипов, где белок D является белком-носителем.
В одном воплощении вакцина по изобретению содержит конъюгаты капсульных сахаридов из 10 разных серотипов, где CRM197 является белком-носителем.
В одном воплощении вакцина по изобретению содержит конъюгаты капсульных сахаридов из 10 разных серотипов, где белок D является белком-носителем.
В одном воплощении вакцина по изобретению содержит конъюгаты капсульных сахаридов из 11 разных серотипов, где CRM197 является белком-носителем.
В одном воплощении вакцина по изобретению содержит конъюгаты капсульных сахаридов из 11 разных серотипов, где белок D является белком-носителем.
В одном воплощении вакцина по изобретению содержит конъюгаты капсульных сахаридов из 13 разных серотипов, где CRM197 является белком-носителем.
В одном воплощении вакцина по изобретению содержит конъюгаты капсульных сахаридов из 13 разных серотипов, где белок D является белком-носителем.
В одном воплощении вакцина по изобретению содержит конъюгаты капсульных сахаридов из 23 разных серотипов, где CRM197 является белком-носителем.
В одном воплощении вакцина по изобретению содержит конъюгаты капсульных сахаридов из 23 разных серотипов, где белок D является белком-носителем.
В одном воплощении вакцина по изобретению содержит сахарид из серотипов 4, 6В, 9V, 14, 18С, 19F и 23F, конъюгированный с белком D.
В одном воплощении вакцина по изобретению содержит сахарид из серотипов 4, 6В, 9V, 14, 18С, 19F и 23F, конъюгированный с CRM197.
В одном воплощении вакцина по изобретению содержит сахарид из серотипов 1, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, 19F и 23F, конъюгированный с белком D.
В одном воплощении вакцина по изобретению содержит сахарид из серотипов 1, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 18C, 19A, 19F и 23F, конъюгированный с CRM197.
В одном воплощении вакцина по изобретению содержит сахарид из серотипов 1, 4, 5, 6В, 7F, 9V, 14, 18C, 19F и 23F, конъюгированный с белком D.
В одном воплощении вакцина по изобретению содержит сахарид из серотипов 1, 4, 5, 6В, 7F, 9V, 14, 18C, 19F и 23F, конъюгированный с CRM197.
В одном воплощении вакцина по изобретению содержит сахарид из серотипов 1, 3, 4, 5, 6В, 7F, 9V, 14, 18C, 19F и 23F, конъюгированный с белком D.
В одном воплощении вакцина по изобретению содержит сахарид из серотипов 1, 3, 4, 5, 6В, 7F, 9V, 14, 18C, 19F и 23F, конъюгированный с CRM197.
В одном воплощении вакцина по изобретению содержит сахарид из серотипа 1, 2, 3, 4, 5, 6В, 7F, 8, 9N, 9V, 10A, 11А, 12F, 14, 15В, 17F, 18C, 19A, 19F, 20, 22F, 23F и 33F, конъюгированный с белком D.
В одном воплощении вакцина по изобретению содержит сахарид из серотипов 1, 2, 3, 4, 5, 6В, 7F, 8, 9N, 9V, 10A, 11А, 12F, 14, 15В, 17F, 18C, 19A, 19F, 20, 22F, 23F и 33F, конъюгированный с CRM197.
В одном воплощении вакцина по изобретению содержит сахарид из серотипов 1, 4, 5, 6В, 7F, 9V, 14 и 23F, конъюгированный с белком D, сахарид из серотипа 18C, конъюгированный со столбнячным анатоксином (ТТ), и сахарид из серотипа 19F, конъюгированный с дифтерийным анатоксином (DT).
В одном воплощении вакцина по изобретению содержит сахарид из серотипов 1, 4, 5, 7F, 9V, 19F и 23F, конъюгированный со столбнячным анатоксином (ТТ), и сахарид из серотипов 3, 14, 18C и 6В, конъюгированный с дифтерийным анатоксином (DT).
В одном воплощении вакцина по изобретению содержит сахарид из серотипов 1, 4, 5, 6В, 7F, 9V, 14 и 23F, по отдельности конъюгированный с белком D, сахарид из серотипа 18C, конъюгированный со столбнячным анатоксином (ТТ), и сахарид из серотипа 19F, конъюгированный с дифтерийным анатоксином (DT).
В одном воплощении вакцина по изобретению содержит сахарид из серотипов 1, 4, 5, 7F, 9V, 19F и 23F, по отдельности конъюгированный со столбнячным анатоксином (ТТ), и сахарид из серотипов 3, 14, 18С и 6В, конъюгированный с дифтерийным анатоксином (DT).
В данном описании термин «сахарид» может означать полисахарид или олигосахарид и включает и то, и другое. Капсульные полисахариды Streptococcus pneumoniae содержат повторяющиеся олигосахаридные единицы, которые могут содержать до 8 сахарных остатков. См. обзор олигосахаридных единиц для ключевых серотипов Streptococcus pneumoniae в JONES, Christopher. Vaccines based on the cell surface carbohydrates of pathogenic bacteria. An. Acad. Bras. Cienc, June 2005, vol.77, no.2, p.293-324. Table II ISSN 0001-3765.
Антигены капсульных сахаридов по изобретению получают стандартными методиками, известными специалистам в данной области техники. Обычно конъюгаты полисахаридов получают отдельными способами и включают в одну лекарственную композицию. Например, в одном воплощении пневмококков каждого полисахаридного серотипа выращивают на соевой среде. Затем проводят очистку отдельных полисахаридов центрифугированием, осаждением, ультрафильтрацией и колоночной хроматографией. Очищенные полисахариды химически активируют для придания сахаридам способности взаимодействовать с белком-носителем. После активации каждый капсульный полисахарид по отдельности конъюгируют с белком-носителем с образованием гликоконъюгата. В одном воплощении каждый капсульный полисахарид конъюгируют с одним и тем же белком-носителем. В этом воплощении конъюгацию проводят восстановительным аминированием. Химическую активацию полисахаридов и последующую конъюгацию с белком-носителем проводят обычными способами. См., например, патенты США №4673574 и 4902506.
После конъюгации капсульного полисахарида с белком-носителем проводят очистку полисахаридно-белковых конъюгатов (обогащение относительно количества полисахаридно-белкового конъюгата) с применением множества методик. Эти методики включают процессы концентрации/диафильтрации, осаждение/элюирование, колоночную хроматографию и фильтрацию с использованием пористых фильтров. См., например, US 2007/0184072 или WO 2008/079653. После очистки отдельных гликоконъюгатов их смешивают для изготовления вакцины по настоящему изобретению. Изготовление композиции из иммуногенной композиции по настоящему изобретению может быть осуществлено с применением способов, признанных в данной области техники. Например, отдельные пневмококковые конъюгаты могут быть смешаны с физиологически приемлемым наполнителем для изготовления композиции. Примеры таких наполнителей включают, без ограничения, воду, забуференный физиологический раствор, полиолы (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль) и растворы декстрозы.
Количество конъюгата в каждой дозе вакцины выбирают как количество, индуцирующее иммунопротективный ответ без существенных нежелательных побочных эффектов у обычных вакцинируемых. Такое количество будет варьировать в зависимости от конкретного используемого иммуногена и способа его представления. В одном воплощении каждая доза содержит 0,1-1000 мкг каждого сахарида или сахаридно-белкового конъюгата, предпочтительно 2-100 мкг, более предпочтительно 4-40 мкг.
В одном воплощении каждая доза содержит 0,1-20 мкг, 1-10 мкг или 1-5 мкг сахарида.
В одном воплощении вакцина по изобретению содержит каждый капсульный сахарид S. pneumoniae в дозе 0,1-20 мкг, 0,5-10 мкг, 0,5-5 мкг или 1-5 мкг сахарида. В одном воплощении капсульные сахариды могут присутствовать в разных дозах, например некоторые капсульные сахариды могут присутствовать в дозе приблизительно или точно 2 мкг, или некоторые капсульные сахариды могут присутствовать в дозе приблизительно или точно 4 мкг.
В определенном воплощении настоящего изобретения вакцина содержит сахарид из серотипов 4, 6В, 9V, 14, 18С, 19F и 23F, по отдельности конъюгированный с CRM197, где каждый капсульный сахарид S. pneumoniae присутствует в дозе 2 мкг, за исключением сахарида из серотипа 6 В, присутствующего в дозе 4 мкг.
В определенном воплощении настоящего изобретения вакцина содержит сахарид из серотипов 4, 6В, 9V, 14, 18С, 19F и 23F, по отдельности конъюгированный с CRM197, где каждый капсульный сахарид S. pneumoniae присутствует в дозе 4 мкг, за исключением сахарида из серотипа 6 В, присутствующего в дозе 8 мкг.
В определенном воплощении настоящего изобретения вакцина содержит сахарид из серотипов 4, 6В, 9V, 14, 18С, 19F и 23F, по отдельности конъюгированный с CRM197, где каждый капсульный сахарид S. pneumoniae присутствует в дозе 6 мкг, за исключением сахарида из серотипа 6 В, присутствующего в дозе 12 мкг.
В определенном воплощении настоящего изобретения вакцина содержит сахарид из серотипов 4, 6В, 9V, 14, 18С, 19F и 23F, по отдельности конъюгированный с CRM197, где каждый капсульный сахарид S. pneumoniae присутствует в дозе 8 мкг, за исключением сахарида из серотипа 6 В, присутствующего в дозе 16 мкг.
В определенном воплощении настоящего изобретения вакцина содержит сахарид из серотипов 1, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, 19F и 23F, по отдельности конъюгированный с CRM197, где каждый капсульный сахарид S. pneumoniae присутствует в дозе 2 мкг, за исключением сахарида из серотипа 6В, присутствующего в дозе 4 мкг.
В определенном воплощении настоящего изобретения вакцина содержит сахарид из серотипов 1, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, 19F и 23F, по отдельности конъюгированный с CRM197, где каждый капсульный сахарид S. pneumoniae присутствует в дозе 4 мкг, за исключением сахарида из серотипа 6В, присутствующего в дозе 8 мкг.
В определенном воплощении настоящего изобретения вакцина содержит сахарид от серотипов 1, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, 19F и 23F, по отдельности конъюгированный с CRM197, где каждый капсульный сахарид S. pneumoniae присутствует в дозе 6 мкг, за исключением сахарида из серотипа 6В, присутствующего в дозе 12 мкг.
В определенном воплощении настоящего изобретения вакцина содержит сахарид из серотипов 1, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, 19F и 23F, по отдельности конъюгированный с CRM197, где каждый капсульный сахарид S. pneumoniae присутствует в дозе 8 мкг, за исключением сахарида из серотипа 6В, присутствующего в дозе 16 мкг.
В определенном воплощении настоящего изобретения вакцина, раскрытая здесь, содержит 5-500 мкг, предпочтительно 10-200 мкг, еще более предпочтительно 20-100 мкг белка-носителя CRM197.
В одном воплощении настоящего изобретения вакцина, раскрытая здесь, содержит 20-50 мкг, предпочтительно 20-40 мкг, еще более предпочтительно 25-30 мкг, еще более предпочтительно приблизительно 28 или 29 мкг белка-носителя CRM197.
В одном воплощении настоящего изобретения вакцина, раскрытая здесь, содержит 40-100 мкг, предпочтительно 40-80 мкг, еще более предпочтительно 50-60 мкг, еще более предпочтительно приблизительно 57 или 58 мкг белка-носителя CRM197.
В определенном воплощении настоящего изобретения вакцина, раскрытая здесь, содержит буфер с хлоридом натрия и/или сукцинатом натрия в качестве эксципиентов.
В одном воплощении пневмококковая вакцина для использования здесь представляет собой 7-валентную конъюгированную пневмококковую вакцину (Prevenar) или 13-валентную конъюгированную пневмококковую вакцину, раскрытую в US 2007/0184072 (Prevenar 13). 7-валентная вакцина Prevenar содержит сахарид из серотипов 4, 6В, 9V, 14, 18С, 19F и 23F, по отдельности конъюгированный с CRM197. 13-валентная вакцина Prevenar содержит сахарид из серотипов 1, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, 19F и 23F, по отдельности конъюгированный с CRM197.
В одном воплощении вакцина по изобретению содержит сахарид из серотипов 1, 4, 5, 6В, 7F, 9V, 14 и 23F, по отдельности конъюгированный с белком D, сахарид из серотипа 18С, конъюгированный со столбнячным анатоксином (ТТ), и сахарид из серотипа 19F, конъюгированный с дифтерийным анатоксином (DT), где каждый капсульный сахарид S. pneumoniae присутствует в дозе 1 мкг, за исключением сахаридов из серотипов 4, 18С и 19F, присутствующих в дозе 3 мкг. В определенном воплощении настоящего изобретения указанная вакцина содержит 5-500 мкг, предпочтительно 7-100 мкг белка D в качестве белка-носителя, 2-200 мкг, предпочтительно 4-50 мкг столбнячного анатоксина (ТТ) в качестве белка-носителя и 1-100 мкг, предпочтительно 2-25 мкг дифтерийного анатоксина (DT) в качестве белка-носителя. В определенном воплощении настоящего изобретения указанная вакцина содержит 9-16 мкг белка D в качестве белка-носителя, 5-10 мкг столбнячного анатоксина (ТТ) в качестве белка-носителя и 3-6 мкг дифтерийного анатоксина (DT) в качестве белка-носителя.
В одном воплощении вакцина по изобретению содержит сахарид из серотипов 1, 4, 5, 6В, 7F, 9V, 14 и 23F, по отдельности конъюгированный с белком D, сахарид из серотипа 18С, конъюгированный со столбнячным анатоксином (ТТ), и сахарид из серотипа 19F, конъюгированный с дифтерийным анатоксином (DT), где каждый капсульный сахарид S. pneumoniae присутствует в дозе 2 мкг, за исключением сахаридов из серотипов 4, 18С и 19F, присутствующих в дозе 6 мкг. В определенном воплощении настоящего изобретения указанная вакцина содержит 10-1000 мкг, предпочтительно 14-200 мкг белка D в качестве белка-носителя, 4-400 мкг, предпочтительно 8-100 мкг столбнячного анатоксина (ТТ) в качестве белка-носителя и 2-200 мкг, предпочтительно 4-50 мкг дифтерийного анатоксина (DT) в качестве белка-носителя. В определенном воплощении настоящего изобретения указанная вакцина содержит 18-32 мкг белка D в качестве белка-носителя, 10-20 мкг столбнячного анатоксина (ТТ) в качестве белка-носителя и 6-12 мкг дифтерийного анатоксина (DT) в качестве белка-носителя.
В одном воплощении вакцина по изобретению содержит сахарид из серотипов 1, 4, 5, 6В, 7F, 9V, 14 и 23F, по отдельности конъюгированный с белком D, сахарид из серотипа 18С, конъюгированный со столбнячным анатоксином (ТТ), и сахарид из серотипа 19F, конъюгированный с дифтерийным анатоксином (DT), где каждый капсульный сахарид S. pneumoniae присутствует в дозе 3 мкг, за исключением сахаридов из серотипов 4, 18С и 19F, присутствующих в дозе 9 мкг. В определенном воплощении настоящего изобретения указанная вакцина содержит 15-1500 мкг, предпочтительно 21-300 мкг белка D в качестве белка-носителя, 6-600 мкг, предпочтительно 12-150 мкг столбнячного анатоксина (ТТ) в качестве белка-носителя и 3-300 мкг, предпочтительно 6-75 мкг дифтерийного анатоксина (DT) в качестве белка-носителя. В определенном воплощении настоящего изобретения указанная вакцина содержит 27-48 мкг белка D в качестве белка-носителя, 15-30 мкг столбнячного анатоксина (ТТ) в качестве белка-носителя и 9-18 мкг дифтерийного анатоксина (DT) в качестве белка-носителя.
В одном воплощении вакцина по изобретению содержит сахарид из серотипов 1, 4, 5, 6В, 7F, 9V, 14 и 23F, по отдельности конъюгированный с белком D, сахарид из серотипа 18С, конъюгированный со столбнячным анатоксином (ТТ), и сахарид из серотипа 19F, конъюгированный с дифтерийным анатоксином (DT), где каждый капсульный сахарид S. pneumoniae присутствует в дозе 4 мкг, за исключением сахаридов из серотипов 4, 18С и 19F, присутствующих в дозе 12 мкг. В определенном воплощении настоящего изобретения указанная вакцина содержит 20-2000 мкг, предпочтительно 28-400 мкг белка D в качестве белка-носителя, 8-800 мкг, предпочтительно 16-200 мкг столбнячного анатоксина (ТТ) в качестве белка-носителя и 4-400 мкг, предпочтительно 8-100 мкг дифтерийного анатоксина (DT) в качестве белка-носителя. В определенном воплощении настоящего изобретения указанная вакцина содержит 36-64 мкг белка D в качестве белка-носителя, 20-40 мкг столбнячного анатоксина (ТТ) в качестве белка-носителя и 12-24 мкг дифтерийного анатоксина (DT) в качестве белка-носителя.
В определенном воплощении настоящего изобретения вакцина, раскрытая здесь, содержит буфер с хлоридом натрия в качестве эксципиентов.
В одном воплощении пневмококковая вакцина для использования здесь представляет собой 10-валентную конъюгированную пневмококковую вакцину, имеющуюся в продаже под торговым названием Synflorix™.
Дополнительный(ые) адъювант (адъюванты)
В некоторых воплощениях пневмококковые вакцины, раскрытые здесь, содержат по меньшей мере один, два или три адъюванта, в дополнение к по меньшей мере одному адъюванту агонисту TLR-9, раскрытому здесь. Термин «адъювант» относится к соединению или смеси, усиливающей иммунный ответ на антиген. Антигены могут действовать главным образом в качестве системы доставки, главным образом в качестве иммуномодулятора, или иметь существенные свойства и того, и другого. Подходящие адъюванты включают адъюванты, подходящие для применения у млекопитающих, включая людей.
Примеры известных подходящих адъювантов типа «система доставки», которые могут быть использованы у людей, включают, без ограничения, квасцы (например, фосфат алюминия, сульфат алюминия или гидрат окиси алюминия), фосфат кальция, липосомы, эмульсии типа «масло в воде», такие как MF59 (4,3%, масс./об., сквалена, 0,5%, масс./об., полисорбата 80 (Tween 80), 0,5%, масс./об., сорбитантриолеата (Span 85)), эмульсии типа «вода в масле», такие как монтанид (Montanide) и микрочастицы или наночастицы поли(D,L-лактида-со-гликолида) (PLG).
Примеры известных подходящих адъювантов иммуномодулирующего типа, которые могут быть использованы у людей, включают, без ограничения, сапониновые экстракты из коры дерева Aquilla (QS21, Quil А), агонисты Toll-подобного рецептора-4 (TLR4), такие как MPL (монофосфориллипид A), 3DMPL (3-O-деацилированный MPL) или GLA-AQ, LT/CT-мутанты, цитокины, как, например, различные интерлейкины (например, интерлейкин-2 (IL-2), интерлейкин-12 (IL-12)) или гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) и тому подобное.
Примеры известных подходящих адъювантов иммуномодулирующего типа со свойствами как систем доставки, так и иммуномодуляторов, которые могут быть использованы у людей, включают, без ограничения, иммуностимулирующие комплексы (ISCOM) (см., например, Sjolander et al. (1998) J. Leukocyte Biol. 64:713; WO 90/03184, WO 96/11711, WO 00/48630, WO 98/36772, WO 00/41720, WO 06/134423 и WO 07/026190) или GLA-ЕМ, представляющий собой комбинацию агониста TLR4 и эмульсии типа «масло в воде».
Для ветеринарного применения, включая, без ограничения, проведение экспериментов на животных, могут быть использованы полный адъювант Фрейнда (CFA), неполный адъювант Фрейнда (IFA), эмульсиген (Emulsigen), N-ацетилмурамил-L-треонил-О-изоглутамин (thr-MDP), N-ацетилнормурамил-L-аланил-О-изоглутамин (CGP 11637, называемый nor-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин (CGP 19835A, называемый МТР-РЕ) и RIBI, содержащий три компонента, выделенные из бактерий, монофосфориллипид А, димиколат трегалозы и скелетные компоненты клеточной стенки (cell wall skeleton, CWS) (MPL+TDM+CWS) в 2% эмульсии сквалена/Tween 80.
Другие типичные адъюванты для усиления эффективности пневмококковых вакцин, раскрытых здесь, включают, без ограничения: (1) эмульсионные композиции типа «масло в воде» (с или без других специфических иммуностимулирующих агентов, таких как мурамилпептиды (см. ниже) или компоненты клеточной стенки бактерий), такие как, например, (а) SAF, содержащий 10% сквалена, 0,4% Tween 80, 5% блокированный плюроником полимер L121, и thr-MDP, либо микрофлюидизированный (microfluidized) с получением субмикронной эмульсии, либо перемешанный на вортексе с получением эмульсии с большим размером частиц, и (б) адъювантная система RIBI™ (RAS) (Ribi Innmunochem., Hamilton, MT), содержащая 2% сквалена, 0,2% Tween 80 и один или более чем один компонент клеточной стенки бактерий, такой как монофосфориллипид A (MPL), димиколат трегалозы (TDM) и скелетные компоненты клеточной стенки (CWS), предпочтительно MPL+CWS (DETOX™); (2) сапониновые адъюванты, такие как QS21, STIMULON™ (Cambridge Bioscience, Worcester, MA), Abisco® (Isconova, Sweden) или Iscomatrix® (Commonwealth Serum Laboratories, Australia), или могут быть использованы полученные из них частицы, такие как ISCOM (иммуностимулирующие комплексы), которые могут быть без дополнительного детергента, например, WO 00/07621; (3) полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA); (4) цитокины, такие как интерлейкины (например, интерлейкин-1 (IL-1), IL-2, интерлейкин-4 (IL-4), интерлейкин-5 (IL-5), интерлейкин-6 (IL-6), интерлейкин-7 (IL-7), IL-12 (WO 99/44636) и так далее), интерфероны (например, гамма-интерферон), макрофагальный колониестимулирующий фактор (M-CSF), фактор некроза опухоли (TNF) и так далее; (5) монофосфориллипид А (MPL) или 3-O-деацилированный MPL (3dMPL) (см., например, GB-2220221, ЕР-А-0689454), возможно, по существу без квасцов при использовании с пневмококковыми сахаридами (см., например, WO 00/56358); (6) комбинации 3dMPL с, например, QS21 и/или эмульсиями типа «масло в воде» (см., например, ЕР-А-0835318, ЕР-А-0735898, ЕР-А-0761231); (7) простой эфир полиоксиэтилена или сложный эфир полиоксиэтилена (см., например, WO 99/52549); (8) поверхностно-активное вещество из сложного эфира полиоксиэтиленсорбитана в комбинации с октоксинолом (WO 01/21207) или поверхностно-активное вещество из простого или сложного полиоксиэтиленалкилового эфира в комбинации с по меньшей мере одним дополнительным неионным поверхностно-активным веществом, таким как октоксинол (WO 01/21152); (9) сапонин и иммуностимулирующий олигонуклеотид (например, CpG-олигонуклеотид) (WO 00/62800); (10) иммуностимулятор и частицу соли металла (см., например, WO 00/23105); (11) сапонин и эмульсию типа «масло в воде», например, WO 99/11241; (12) сапонин (например, QS21)+3dMPL+IM2 (возможно+стерин), например, W098/57659; (13) другие вещества, действующие как иммуностимулирующие агенты, повышая эффективность композиции. Мурамилпептиды включают N-ацетилмурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетилнормурамил-L-аланил-D-изоглутамин (nor-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин (МТР-РЕ) и так далее.
В предпочтительном воплощении пневмококковые вакцины, раскрытые здесь, содержат квасцы, гидрат окиси алюминия, фосфат алюминия или сульфат алюминия в качестве дополнительного адъюванта к по меньшей мере одному адъюванту агонисту TLR-9, раскрытому здесь.
В определенном воплощении настоящего изобретения вакцина содержит сахарид из серотипов 4, 6В, 9V, 14, 18С, 19F и 23F, по отдельности конъюгированный с CRM197, где каждый капсульный сахарид S. pneumoniae присутствует в дозе 2 мкг, за исключением сахарида из серотипа 6В, присутствующего в дозе 4 мкг, и дополнительно содержит 0,5 мг фосфата алюминия и, возможно, буфер с хлоридом натрия и сукцинатом натрия в качестве эксципиентов.
В определенном воплощении настоящего изобретения вакцина содержит сахарид из серотипов 4, 6В, 9V, 14, 18С, 19F и 23F, по отдельности конъюгированный с CRM197, где каждый капсульный сахарид S. pneumoniae присутствует в дозе 4 мкг, за исключением сахарида из серотипа 6В, присутствующего в дозе 8 мкг, и дополнительно содержит 1 мг фосфата алюминия и, возможно, буфер с хлоридом натрия и сукцинатом натрия в качестве эксципиентов.
В определенном воплощении настоящего изобретения вакцина содержит сахарид из серотипов 4, 6В, 9V, 14, 18С, 19F и 23F, по отдельности конъюгированный с CRM197, где каждый капсульный сахарид S. pneumoniae присутствует в дозе 6 мкг, за исключением сахарида из серотипа 6В, присутствующего в дозе 12 мкг, и дополнительно содержит 1,5 мг фосфата алюминия и, возможно, буфер с хлоридом натрия и сукцинатом натрия в качестве эксципиентов.
В определенном воплощении настоящего изобретения вакцина содержит сахарид из серотипов 4, 6В, 9V, 14, 18С, 19F и 23F, по отдельности конъюгированный с CRM197, где каждый капсульный сахарид S. pneumoniae присутствует в дозе 8 мкг, за исключением сахарида из серотипа 6В, присутствующего в дозе 16 мкг, и дополнительно содержит 2 мг фосфата алюминия и, возможно, буфер с хлоридом натрия и сукцинатом натрия в качестве эксципиентов.
В определенном воплощении настоящего изобретения вакцина содержит сахарид из серотипов 1, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, 19F и 23F, по отдельности конъюгированный с CRM197, где каждый капсульный сахарид S. pneumoniae присутствует в дозе 2 мкг, за исключением сахарида из серотипа 6В, присутствующего в дозе 4 мкг, и дополнительно содержит 0,5 мг фосфата алюминия и, возможно, буфер с хлоридом натрия и сукцинатом натрия в качестве эксципиентов.
В определенном воплощении настоящего изобретения вакцина содержит сахарид из серотипов 1, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, 19F и 23F, по отдельности конъюгированный с CRM197, где каждый капсульный сахарид S. pneumoniae присутствует в дозе 4 мкг, за исключением сахарида из серотипа 6В, присутствующего в дозе 8 мкг, и дополнительно содержит 1 мг фосфата алюминия и, возможно, буфер с хлоридом натрия и сукцинатом натрия в качестве эксципиентов.
В определенном воплощении настоящего изобретения вакцина содержит сахарид из серотипов 1, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, 19F и 23F, по отдельности конъюгированный с CRM197, где каждый капсульный сахарид S. pneumoniae присутствует в дозе 6 мкг, за исключением сахарида из серотипа 6В, присутствующего в дозе 12 мкг, и дополнительно содержит 1,5 мг фосфата алюминия и, возможно, буфер с хлоридом натрия и сукцинатом натрия в качестве эксципиентов.
В определенном воплощении настоящего изобретения вакцина содержит сахарид из серотипов 1, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 18C, 19A, 19F и 23F, по отдельности конъюгированный с CRM197, где каждый капсульный сахарид S. pneumoniae присутствует в дозе 8 мкг, за исключением сахарида из серотипа 6В, присутствующего в дозе 16 мкг, и дополнительно содержит 1,5 мг фосфата алюминия и, возможно, буфер с хлоридом натрия и сукцинатом натрия в качестве эксципиентов.
В одном воплощении пневмококковая вакцина представляет собой 7-валентную конъюгированную пневмококковую вакцину (Prevenar) или 13-валентную конъюгированную пневмококковую вакцину, раскрытую в US 2007/0184072 (13vPnC).
Субъекты с ослабленным иммунитетом
В предпочтительном воплощении настоящего изобретения субъект, подлежащий вакцинации вакцинами по настоящему изобретению, представляет собой субъекта с ослабленным иммунитетом. Предпочтительно, указанный субъект с ослабленным иммунитетом представляет собой млекопитающее, такое как кошка, овца, свинья, лошадь, бык, собака или человек. В наиболее предпочтительном воплощении указанный субъект представляет собой человека.
Индивида с ослабленным иммунитетом обычно определяют как человека, демонстрирующего ослабленную или сниженную способность к развитию нормальной гуморальной или клеточной защиты от заражения инфекционными агентами.
В одном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации пневмококковой вакциной, страдает от заболевания или состояния, нарушающего функционирование иммунной системы и приводящего к гуморальному ответу, недостаточному для защиты от пневмококкового заболевания или лечения пневмококкового заболевания.
В одном воплощении указанное заболевание представляет собой первичный иммунодефицит. Предпочтительно, указанный первичный иммунодефицит выбран из группы, состоящей из: комбинированных Т- и В-клеточных иммунодефицитов, дефицитов антител, четко определенных синдромов, заболеваний с нарушением регуляции иммунной системы, фагоцитарных расстройств, врожденных иммунодефицитов, аутовоспалительных расстройств и недостаточности системы комплемента.
В одном воплощении указанный комбинированный Т- и В-клеточный иммунодефицит выбран из группы, состоящей из: дефицита γс, дефицита JAK3, дефицита α-цепи рецептора интерлейкина-7, дефицита CD45 или дефицита CD35/CD3E, дефицита RAG 1/2, дефицита DCLRE1C, дефицита аденозиндезаминазы (ADA), ретикулярной дисгенезии, синдрома Оменна, дефицита ДНК-лигазы IV типа, дефицита лиганда CD40, дефицита CD40, дефицита пуриннуклеозидфосфорилазы (PNP), дефицита молекул главного комплекса гистосовместимости (МНС) II класса, дефицита CD3γ, дефицита CD8, дефицита ZAP-70, дефицита ТАР-1/2 и дефицит доменов типа «крыловидная спираль» («winged helix»).
В одном воплощении указанный дефицит антител выбран из группы, состоящей из: агаммаглобулинемии, сцепленной с Х-хромосомой, дефицита btk, агаммаглобулинемии Брутона, дефицита тяжелых цепей µ, дефицита I 5, дефицита Igα, дефицита BLNK, тимомы с иммунодефицитом, вариабельного неклассифицируемого иммунодефицита (CVID), дефицита ICOS, дефицита CD19, дефицита TACI (TNFRSF13B), дефицита рецептора BAFF, дефицита AID, дефицита UNG, делеций тяжелых цепей, дефицита цепей каппа, изолированного дефицита иммуноглобулинов подкласса G (IgG), дефицита иммуноглобулинов подклассов A (IgA) и IgG, селективного дефицита иммуноглобулинов А, дефицита специфических антител к определенным антигенам при нормальных концентрациях В-клеток и иммуноглобулинов (Ig), транзиторной гипогаммаглобулинемии новорожденных (THI).
В одном воплощении указанный четко определенный синдром выбран из группы, состоящей из: синдрома Вискотта-Олдрича, атаксии-телеангиэктазии, синдрома, подобного атаксии, Неймегенского синдрома хромосомной нестабильности, синдрома Блума, синдрома Ди-Джорджи (при связи с дефектами тимуса), гипоплазии хрящей и волос, синдрома Шимке, синдрома Германского-Пудлака 2 типа, синдрома гипер-lgE, хронического кандидоза кожи и слизистых оболочек.
В одном воплощении указанное заболевание с нарушением регуляции иммунной системы выбрано из группы, состоящей из: синдрома Чедиака-Хигаси, синдрома Грисцелли 2 типа, дефицита перфоринов, дефицита MUNC13D, дефицита синтаксина-11, лимфопролиферативного синдрома, сцепленного с Х-хромосомой, аутоиммунного лимфопролиферативного синдрома, например, типа 1а (дефекты CD95), типа 1b (дефекты Fas-лиганда), типа 2а (дефекты CASP10), типа 2b (дефекты CASP8), APECED (аутоиммунной полиэндокринопатии с кандидозом и эктодермальной дистрофией) и IPEX (синдрома полиэндокринопатии с нарушением регуляции иммунной системы и энтеропатией, сцепленного с Х-хромосомой).
В одном воплощении указанное фагоцитарное расстройство выбрано из группы, состоящей из: дефицита ELA2 (с миелодисплазией), дефицита GFI1 (с Т/В-лимфопенией), дефицита рецептора гранулоцитарного колониестимулирующего фактора (G-CSFR) (не поддающегося коррекции гранулоцитарным колониестимулирующим фактором (G-CSF)), синдрома Костманна, периодической наследственной нейтропении, нейтропении/миелодисплазии, сцепленной с Х-хромосомой, дефицита адгезии лейкоцитов 1, 2 и 3 типа, дефицита RAC2, дефицита бета-актина, локализованного юношеского периодонтита, синдрома Папиллона-Лефевра, дефицита специфических гранул, синдрома Швахмана-Даймонда, хронической гранулематозной болезни (сцепленных с Х-хромосомой и аутосомных форм), дефицита глюкозо-6-фосфатдегидрогеназы нейтрофилов, дефицита IL-12 и β1-цепи интерлейкина-23 (IL-23), дефицита IL-12p40, дефицита рецептора-1 интерферона-γ, дефицита рецептора-2 интерферона-γ и дефицита STAT1 (2 форм).
В одном воплощении указанный врожденный иммунодефицит выбран из группы, состоящей из: гипогидротической эктодермальной дисплазии, дефицита NEMO, дефицита IKBA, дефицита IRAK-4, WHIM-синдрома (бородавки, гипогаммаглобулинемия, инфекции, миелокатексис) и бородавчатой эпидермодисплазии.
В одном воплощении указанное аутовоспалительное расстройство выбрано из группы, состоящей из: семейной средиземноморской лихорадки, периодического синдрома, ассоциированного с рецептором TNF (TRAPS), синдрома гипер-IgD (HIDS), заболеваний, связанных с CIAS1, синдрома Макла-Уэллса, семейного холодового аутовоспалительного синдрома, мультисистемного воспалительного заболевания неонатального возраста, РАРА-синдрома (стерильный гнойный артрит, гангренозная пиодермия, акне) и синдрома Блау.
В одном воплощении указанная недостаточность системы комплемента выбрана из группы, состоящей из: дефицита C1q (волчаночный синдром, ревматоидное заболевание, инфекции), дефицита C1r (то же), дефицита С4 (то же), дефицита С2 (волчаночный синдром, васкулит, полимиозит, гнойные инфекции), дефицита С3 (рецидивирующие гнойные инфекции), дефицита С5 (инфекции, вызванные нейссериями, системная красная волчанка (SLE)), дефицита С6 (то же), дефицита С7 (то же, васкулит), дефицита С8а и C8b (то же), дефицита С9 (инфекции, вызванные нейссериями), дефицита С1-ингибитора (наследственный ангионевротический отек), дефицита фактора I (гнойные инфекции), дефицита фактора Н (гемолитико-уремический синдром, мембранозно-пролиферативный гломерулонефрит), дефицита фактора D (инфекции, вызванные нейссериями), дефицита пропердина (инфекции, вызванные нейссериями), дефицита МВР (гнойные инфекции) и дефицита MASP2. В одном воплощении указанное аутовоспалительное расстройство выбрано из группы, состоящей из дефицитов С1, С2, С3 и С4.
В одном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, страдает от заболевания, поражающего иммунную систему, представляющего собой приобретенный иммунодефицит. Приобретенный иммунодефицит может быть обусловлен несколькими факторами, включая бактериальные или вирусные инфекции (такие как ВИЧ-инфекция), рак (такой как лейкоз или миелома), другие хронические расстройства, но также старением, недостаточностью питания или различными видами лечения (такими как лечение глюкокортикоидами, химиотерапевтическими лекарственными средствами).
В определенном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, страдает от заболевания, выбранного из групп, состоящих из: ВИЧ-инфекции, синдрома приобретенного иммунодефицита (СПИД), рака, хронических расстройств сердца или легких, застойной сердечной недостаточности, сахарного диабета, хронического заболевания печени, алкоголизма, цирроза, подтекания спинномозговой жидкости, кардиомиопатии, хронического бронхита, эмфиземы, хронической обструктивной болезни легких (ХОБЛ), дисфункции селезенки (такой как серповидно-клеточная болезнь), недостаточности функции селезенки (асплении), злокачественного новообразования системы крови, лейкоза, множественной миеломы, болезни Ходжкина, лимфомы, почечной недостаточности, нефротического синдрома и астмы.
В определенном воплощении субъект с ослабленным иммунитетом, подлежащий вакцинации, страдает от заболевания, выбранного из групп, состоящих из: дисфункции селезенки (такой как серповидно-клеточная болезнь), недостаточности функции селезенки (асплении), лейкоза, множественной миеломы, болезни Ходжкина и лимфомы.
В предпочтительном воплощении субъект с ослабленным иммунитетом, подлежащий вакцинации, страдает от ВИЧ-инфекции или синдрома приобретенного иммунодефицита (СПИД).
В определенном воплощении субъект с ослабленным иммунитетом, подлежащий вакцинации, страдает от ВИЧ-инфекции или синдрома приобретенного иммунодефицита (СПИД) и получает лечение, состоящее из приема по меньшей мере одного антиретровирусного лекарственного средства, выбранного из группы, состоящей из: ненуклеозидного ингибитора обратной транскриптазы, ингибитора протеазы и ингибитора обратной транскриптазы, являющегося аналогом нуклеозидов (например, абакавира). В определенном воплощении указанное лечение состоит из приема по меньшей мере трех лекарственных средств, принадлежащих по меньшей мере к двум классам антиретровирусных лекарственных средств, выбранных из группы, состоящей из: ненуклеозидного ингибитора обратной транскриптазы, ингибитора протеазы и ингибитора обратной транскриптазы, являющегося аналогом нуклеозидов (например, абакавира). В определенном воплощении указанное лечение состоит из приема по меньшей мере двух ингибиторов обратной транскриптазы, являющихся аналогами нуклеозидов, либо с ингибитором протеазы, либо с ненуклеозидным ингибитором обратной транскриптазы.
В определенном воплощении субъект с ослабленным иммунитетом, подлежащий вакцинации, страдает от ВИЧ-инфекции или синдрома приобретенного иммунодефицита (СПИД) и получает высокоэффективную антиретровирусную терапию (ВЭАРТ). В одном воплощении указанная ВЭАРТ состоит из схемы лечения 3 лекарственными средствами, включающей ненуклеозидный ингибитор обратной транскриптазы, ингибитор протеазы и/или ингибитор обратной транскриптазы, являющийся аналогом нуклеозидов (например, абакавир), или схемы лечения 2 лекарственными средствами, включающей комбинацию ненуклеозидного ингибитора обратной транскриптазы и ингибитора протеазы.
В определенном воплощении субъект с ослабленным иммунитетом, подлежащий вакцинации, страдает от ВИЧ-инфекции или синдрома приобретенного иммунодефицита (СПИД), и не получает высокоэффективную антиретровирусную терапию (ВЭАРТ) или не получает антиретровирусную терапию, или указанный субъект никогда не получал антиретровирусные лекарственные средства.
В определенном воплощении субъект с ослабленным иммунитетом, подлежащий вакцинации, представляет собой ВИЧ-инфицированного пациента без виремии. В другом воплощении субъект с ослабленным иммунитетом, подлежащий вакцинации, представляет собой ВИЧ-инфицированного пациента с виремией.
В определенном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, страдает от туберкулеза или заболеваний, передающихся половым путем, например сифилиса или гепатита.
В одном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, страдает от недостаточности питания.
В одном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, страдает от старения. В определенном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, представляет собой взрослого человека в возрасте 55 лет или старше, более предпочтительно взрослого человека в возрасте 65 лет или старше. В одном воплощении субъект с ослабленным иммунитетом, подлежащий вакцинации, представляет собой взрослого человека в возрасте 70 лет или старше, в возрасте 75 лет или старше или в возрасте 80 лет или старше.
В определенном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, принимает лекарственное средство или получает лечение, снижающее сопротивляемость организма инфекции.
В определенном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, принимает лекарственное средство, выбранное из группы, состоящей из химиотерапевтических лекарственных средств (например, лекарственных средств для лечения рака), модифицирующих заболевание противоревматических лекарственных средств, иммуносупрессивных лекарственных средств, используемых после трансплантации органов, и глюкокортикоидов.
В одном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, принимает иммуносупрессивное лекарственное средство для перорального введения, выбранное из группы, состоящей из: такролимуса (прографа), микофенолата мофетила (селлсепта), сиролимуса (рапамуна), преднизона, циклоспорина (неорала, сандиммуна, генграфа (Gengraf)) и азатиоприна (имурана). В одном воплощении субъект с ослабленным иммунитетом принимает по меньшей мере два или три указанных иммуносупрессивных лекарственных средства для перорального введения.
В одном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, принимает иммуносупрессивное лекарственное средство, выбранное из группы, состоящей из: эверолимуса, микофеноловой кислоты, кортикостероидов (таких как преднизолон или гидрокортизон), моноклональных антител против α-цепи рецептора интерлейкина-2 (IL-2Rα) (таких как базиликсимаб или даклизумаб), антитимоцитарного глобулина (ATG) и антилимфоцитарного глобулина (ALG). В одном воплощении субъект с ослабленным иммунитетом принимает по меньшей мере два или три указанных иммуносупрессивных лекарственных средства.
В определенном воплощении настоящего изобретения у субъекта с ослабленным иммунитетом, подлежащего вакцинации, проведена трансплантация органа, или трансплантация костного мозга, или кохлеарная имплантация.
В определенном воплощении настоящего изобретения у субъекта с ослабленным иммунитетом, подлежащего вакцинации, проведена лучевая терапия.
В определенном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, является курильщиком.
В определенном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, страдает от астмы и получает лечение кортикостероидами для перорального введения.
В определенном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, является уроженцем Аляски или американским индейцем.
В определенном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, имеет количество лейкоцитов менее 5×109 клеток на литр, или менее 4×109 клеток на литр, или менее 3×109 клеток на литр, или менее 2×109 клеток на литр, или менее 1×109 клеток на литр, или менее 0,5×109 клеток на литр, или менее 0,3×109 клеток на литр, или менее 0,1×109 клеток на литр.
Количество лейкоцитов. Число лейкоцитов (WBC) в крови. Количество WBC обычно определяют как часть клинического анализа крови (СВС). Лейкоциты являются клетками крови, борющимися с инфекцией и отличающимися от красных клеток крови (переносящих кислород), известных как эритроциты. Существуют различные типы лейкоцитов, включая нейтрофилы (полиморфно-ядерные лейкоциты, PMN), палочкоядерные клетки (несколько незрелые нейтрофилы), лимфоциты Т-типа (Т-клетки), лимфоциты В-типа (В-клетки), моноциты, эозинофилы и базофилы. Количество лейкоцитов отражает количество лейкоцитов всех типов. Нормальный диапазон количества лейкоцитов обычно составляет от 4300 до 10800 на кубический миллиметр крови. Это также может быть названо количеством лейкоцитов и выражено в международных единицах как 4,3-10,8×109 клеток на литр.
В определенном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, страдает от нейтропении. В определенном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, имеет количество нейтрофилов менее 2×109 клеток на литр, или менее 1×109 клеток на литр, или менее 0,5×109 клеток на литр, или менее 0,1×109 клеток на литр, или менее 0,05×109 клеток на литр.
Уменьшенное количество лейкоцитов или «нейтропения» представляет собой состояние, характеризующееся аномально сниженными уровнями нейтрофилов в циркулирующей крови. Нейтрофилы являются определенной разновидностью лейкоцитов, способствующей предотвращению и борьбе с инфекциями. Чаще всего причиной нейтропении у пациентов с раком выступают побочные эффекты химиотерапии. Индуцированная химиотерапией нейтропения повышает риск инфекции у пациента и нарушает лечение рака.
Чем меньше количество нейтрофилов в крови и чем дольше у пациентов нет достаточного количества нейтрофилов, тем выше восприимчивость пациента к развитию бактериальной или грибковой инфекции. Нейтрофилы являются основным компонентом механизмов антибактериальной защиты. При уменьшении количества нейтрофилов до 1,0, 0,5 и 0,1×109/л частота жизнеугрожающих инфекций резко возрастает от 10% до 19% и 28% соответственно.
В определенном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, имеет количество CD4+ клеток менее 500/мм3, или количество CD4+ клеток менее 300/мм3, или количество CD4+ клеток менее 200/мм3, количество CD4+ клеток менее 100/мм3, количество CD4+ клеток менее 75/мм3, или количество CD4+ клеток менее 50/мм3.
Результаты исследования количества CD4 клеток обычно сообщают как число клеток на мм3. Нормальное количество CD4 клеток составляет от 500 до 1600, и количество CD8 клеток составляет от 375 до 1100. Количество CD4 клеток сильно уменьшено у людей с ВИЧ-инфекцией.
В одном воплощении изобретения любой субъект с ослабленным иммунитетом, раскрытый здесь, представляет собой человека мужского пола или человека женского пола.
Схема лечения
В некоторых случаях может быть необходима лишь одна доза вакцины по изобретению, но в некоторых обстоятельствах, таких как условия более выраженного иммунодефицита, может быть введена вторая, третья или четвертая доза.
В одном воплощении первую дозу вводят на 0 сутки и одну или более чем одну бустер-дозу вводят с интервалами в диапазоне от приблизительно 2 до приблизительно 24 недель, предпочтительно с интервалом между введениями 4-8 недель.
В одном воплощении первую дозу вводят на 0 сутки и бустер-дозу вводят через приблизительно 3 месяца.
Как показано в разделе «Примеры», некоторые недостатки современной вакцинации могут быть преодолены с использованием вакцины по изобретению. В частности, вакцина по изобретению может уменьшить число вакцинаций, необходимое для достижения серопротекции, ускорить сероконверсию, возможно, позволяя проводить вакцинацию после инфицирования, уменьшить долю субъектов, не отвечающих на вакцинацию, уменьшить необходимое количество антигена, повысить авидность и защитную активность антител и/или получить более стабильные уровни антител.
Эти преимущества представляют особый интерес при лечении субъектов с ослабленным иммунитетом.
ПРИМЕРЫ
Пример 1: Иммунный ответ на пневмококковую вакцину с агонистом Toll-подобного рецептора 9 в качестве адъюванта у ВИЧ-инфицированных взрослых
Было проведено исследование II фазы у 96 ВИЧ-инфицированных пациентов.
Задачи
Основная задача:
- сравнить число пациентов с сильным ответом на вакцину, определенным по повышению уровней IgG к пневмококкам по меньшей мере 5 из 7 серотипов в 2 раза и по уровням IgG к пневмококкам по меньшей мере 5 из 7 серотипов по меньшей мере 1 мкг/мл (согласно количественным измерениям IgG), в группе CpG 7909 и контрольной группе.
Дополнительные задачи:
- провести качественное (функциональное) сравнение гуморального ответа на введение пневмококковой вакцины с CpG 7909 или без CpG 7909;
- оценить безопасность и переносимость CpG 7909 в качестве адъюванта для пневмококковой вакцины;
- проанализировать изменения состояния носительства пневмококков после введения пневмококковой вакцины.
Основные оцениваемые параметры
Эффективность
Первичная: количественный показатель специфичных противокапсульных антител (7 серотипов).
Вторичная: функциональная активность специфичных противокапсульных антител (в отношении серотипов пневмококков 6В, 14, 19F и 23F); число и выраженность нежелательных и серьезных нежелательных явлений; микробиологические изменения колонизации глотки пневмококками; исходное количество CD4 клеток и показатель sCD163.
Безопасность/переносимость
Нежелательные явления (АЕ); серьезные нежелательные явления (SAE); лабораторные исследования (гематология, клиническая биохимия, то есть вирусная нагрузка (РНК ВИЧ) и количество CD4 клеток); физикальное обследование.
План исследования: плацебо-контролируемое, рандомизированное, двойное слепое исследование. Общий размер выборки: 96 участников (48 на группу).
Исследуемые лекарственные средства и композиции: CpG 7909 (синтетический агонист Toll-подобного рецептора 9) в забуференном фосфатом физиологическом растворе (PBS-буфере). CpG 7909 представляет собой CpG ODN класса В с последовательностью 5'-TCGTCGTTTTGTCGTTTTGTCGTT-3' (SEQ ID NO:5), и он синтезирован с полностью фосфоротиоатным каркасом.
Доза исследуемого лекарственного средства: 1 мг CpG 7909 (100 мкл) в смеси с каждой пневмококковой вакциной.
Контроли: 100 мкл нейтрального PBS-буфера (идентичного по цвету и вязкости исследуемому лекарственному средству) с каждой пневмококковой вакциной.
Путь введения: внутримышечная инъекция. Маскировка: двойное слепое исследование. Включение; рандомизация.
Проводили рандомизацию подходящих пациентов в соотношении 1:1 для получения пневмококковой вакцины с CpG 7909 или без CpG 7909.
Иммунизация
Вакцины хранили в их исходной упаковке согласно описанию изготовителя и смешивали с адъювантом (CpG 7909 или плацебо) непосредственно перед иммунизацией. Иммунизацию проводили введением в верхнюю часть левой или правой дельтовидной мышцы по выбору субъекта.
Продолжительность исследования для каждого участника: 10 месяцев от первой вакцинации до последнего наблюдения.
Прекращение участия субъектов в исследовании
Для анализа «субъектом, прекратившим участие в исследовании», является любой субъект, не пришедший на завершающий визит, предусмотренный протоколом.
Субъекта признают «субъектом, прекратившим участие в исследовании», если не были проведены процедуры согласно исследованию, не было осуществлено последующее наблюдение, и от данного субъекта не была получена последующая информация, начиная от даты прекращения участия в исследовании/последнего контакта.
Субъектов, прекративших участие в исследовании, не заменяли. Прекращение получения исследуемого продукта субъектом
Субъектом, прекратившим получение исследуемого продукта, является любой субъект, не получивший полного лечения, то есть если с момента прекращения получения исследуемого продукта не было введено ни одной последующей запланированной дозы. Прекращение получения исследуемого продукта субъектом не является обязательно прекращением участия в исследовании, поскольку могут быть проведены другие процедуры согласно исследованию или последующее наблюдение (безопасность или иммуногенность), если они запланированы в протоколе.
Данные, подлежащие включению в индивидуальную регистрационную карту:
- дата рождения, пол, расовая принадлежность, рост, масса тела, номер в исследовании;
- нежелательные явления, о которых сообщил субъект, включая начало и продолжительность (время до разрешения);
- положительные данные при физикальном обследовании;
- история болезни;
- другие вакцины, полученные вне исследования в течение периода исследования;
- любые изменения регулярного лечения на протяжении исследования;
- предшествующие состояния или признаки и/или симптомы, присутствующие у субъекта до начала исследования/первой вакцинации;
- все лабораторные данные, полученные на протяжении исследования.
Критерии включения участников:
1) письменное информированное согласие и заявление о полномочиях, предоставленные в соответствии с местной нормативной и этической практикой с использованием формы информационного листка участника и информированного согласия, одобренной ответственным этическим комитетом;
2) участники мужского или женского пола в возрасте по меньшей мере 18 лет;
3) ВИЧ-серопозитивные индивиды.
Критерии исключения участников:
1) беременность, определенная по положительному результату теста на бета-субъединицу хорионического гонадотропина человека (бета-ХГЧ) в моче (для субъектов женского пола);
2) нежелание участника применять надежные способы контрацепции для продолжения исследования; надежные способы контроля рождаемости включают: фармакологическую контрацепцию, включая контрацепцию с использованием пероральной, парентеральной и чрескожной доставки; презервативы со спермицидом; диафрагмы со спермицидом; хирургическую стерилизацию; вагинальное кольцо; внутриматочное устройство; воздержание; и состояние после менопаузы (для субъектов женского пола);
3) грудное вскармливание во время исследования (для субъектов женского пола);
4) последний результат определения количества CD4 клеток менее 200×106 клеток/мкл;
5) вирусная нагрузка (РНК ВИЧ) более 50 копий/мл при проведении ВЭАРТ (определенной как введение по меньшей мере трех антиретровирусных лекарственных средств, включая либо ингибитор протеазы, либо ненуклеозидный ингибитор обратной транскриптазы (NNRTI), то есть комбивир 300/150 мг×2 + стокрин 600 мг×1 в течение по меньшей мере 6 месяцев);
6) предшествующее включение в это исследование;
7) любое медицинское, психиатрическое, социальное или профессиональное состояние или другая ответственность, которые, по мнению главного исследователя (PI), помешают оценке задач исследования (такие как серьезное злоупотребление алкоголем, тяжелая наркотическая зависимость, деменция);
8) неспособность соблюдать схему лечения согласно протоколу;
9) введение пневмококковой вакцины за 5 или менее лет до включения;
10) запланированное участие в других исследованиях вакцин во время исследования.
Процедуры
В исследование были включены пациенты, согласившиеся участвовать в исследовании, соответствующие критериям включения/исключения. Перед иммунизацией получали образцы крови для измерения исходных параметров. При рандомизации участников распределяли в соотношении 1:1 в группы с одной из двух исследуемых схем лечения:
- экспериментальная группа: две дозы 7-валентной конъюгированной пневмококковой вакцины (Prevenar®, Wyeth)+1 мг CpG 7909 (0 сутки), две дозы 7-валентной конъюгированной пневмококковой вакцины (Prevenar®, Wyeth)+1 мг CpG 7909 (90 сутки) и одна доза 23-валентной полисахаридной вакцины (Pneumo Novum®, Sanofi Pasteur MSD)+1 мг CpG 7909 (270 сутки);
- контрольная группа: две дозы 7-валентной конъюгированной пневмококковой вакцины (Prevenar®, Wyeth)+100 мкл плацебо (0 сутки), две дозы 7-валентной конъюгированной пневмококковой вакцины (Prevenar®, Wyeth)+100 мкл плацебо (90 сутки) и одна доза 23-валентной полисахаридной вакцины (Pneumo Novum®, Sanofi Pasteur MSD)+100 мкл плацебо (270 сутки).
Получали образцы крови, и последующее врачебное наблюдение включало физикальное обследование и историю болезни, регистрацию АЕ (нежелательных явлений)/8АЕ (серьезных нежелательных явлений), сбор данных о вакцинациях вне исследования и любой другой информации, которая может быть важной для внесения в CRF. Завершающий визит проводили на 300 сутки.
Субъекта, пришедшего на завершающий визит или доступного для завершающего контакта, предусмотренного этим протоколом, рассматривали как завершившего исследование.
Инъекции вакцин и исследуемого лекарственного средства/плацебо
Всем субъектам инъекции проводили на 0, 90 и 270 сутки. Все иммунизации проводили инъекцией в дельтовидную мышцу правого или левого плеча (по выбору участника).
- На 0 и 90 сутки участникам исследования проводили одну внутримышечную инъекцию двойной дозы Prevenar 1,0 мл+0,1 мл исследуемого лекарственного средства (CpG 7909)/плацебо. В обоих случаях объем, вводимый в плечо, составляет 1,1 мл.
- На 270 сутки участникам исследования проводили одну внутримышечную инъекцию 0,5 мл Pneumo Novum+0,1 мл исследуемого лекарственного средства (CpG 7909)/плацебо. В обоих случаях объем, вводимый в плечо, составляет 1,1 мл.
Исследователи и участники не знали, какую, экспериментальную или контрольную, инъекцию проводили. Объем и внешний вид каждого инъекционного продукта были идентичны.
Основной параметр эффективности и анализ гуморального ответа
Исследование было разработано для выявления различий между экспериментальной и контрольной группами по числу пациентов с сильным ответом на пневмококковую вакцину, определенным по повышению уровней IgG к пневмококкам по меньшей мере 5 из 7 серотипов в 2 раза и по уровням IgG к пневмококкам по меньшей мере 5 из 7 серотипов по меньшей мере 1 мкг/мл (согласно количественным измерениям IgG). Исследование было разработано не для выявления различий заболеваемости пневмонией или подтвержденным инвазивным/неинвазивным пневмококковым заболеванием. Для этого были необходимы значительное число участников и более длительный период последующего наблюдения. Наиболее широко используемой оценкой иммунного ответа на пневмококковые вакцины является количественное определение серотип-специфичных противокапсульных антител. Полученные недавно данные показывают, что специфичность этого метода может быть улучшена включением стадии абсорбции 22F с удалением посредством этого перекрестно-реагирующих антител с низкой авидностью. Количественное определение серотип-специфичных IgG было проведено в Statens Serum Institut (SSI), Copenhagen, Denmark с применением твердофазного иммуноферментного анализа (ELISA), включающего стадию абсорбции 22F. В SSI не знали о распределении по группам лечения.
Дополнительные параметры эффективности и анализ гуморального ответа
Количественное определение серотип-специфичных противокапсульных антител не дает никакой информации о функциональных свойствах антител. Они могут быть оценены проточно-цитометрическим анализом опсонофагоцитирующей активности, позволяющим получить косвенную информацию о способности антител опсонизировать проникших в организм пневмококков и содействовать их уничтожению.
Качественный анализ проводили с применением проточно-цитометрического анализа опсонофагоцитирующей активности, позволяющего измерить функциональную (опсонофагоцитирующую) активность (ОРА) серотип-специфичных антител. Кратко, из 10 мкл исследуемой сыворотки приготавливают восемь двукратных разведений в ОРА-буфере. В каждую лунку добавляют аликвоты объемом 20 мкл суспензии множества бактерий или множества гранул, содержащей 1 х 105 пневмококков каждого целевого серотипа или гранул с конъюгированными полисахаридами пневмококков, и планшет инкубируют в течение 1 часа при 37°С с горизонтальным встряхиванием (200 об/мин). После этого в каждую лунку добавляют 20 мкл стерильной сыворотки от кроликов в возрасте 3-4 недели (Pel-Freez, Brown Deer, Wis.), за исключением контрольных лунок с клетками HL60, в которые добавляют 20 мкл ОРА-буфера. После инкубации при 37°С в течение 20 минут с встряхиванием (200 об/мин на орбитальном шейкере) в каждую лунку добавляют 30 мкл отмытых полиморфно-ядерных лейкоцитов (PMN) HL60 (2,5×104 мл) с получением соотношения эффектор:мишень 1:4 (для каждого типа мишени). Конечный объем в лунке составляет 80 мкл, при этом конечное разведение в первой лунке серии разведений составляет 1:8. Планшет затем инкубируют в течение 60 минут с встряхиванием при 37°С. В каждую лунку добавляют еще 80 мкл ОРА-буфера для обеспечения достаточного объема для проточно-цитометрического анализа и содержимое лунок переносят в микротитровальные пробирки (Bio-Rad, Hercules, Calif.). На каждом планшете можно проанализировать до 12 образцов сыворотки, включая образец контроля качества. Проточно-цитометрический анализ проводили с использованием Flow Applications, Inc, III, USA51.
Носительство пневмококков
Введение пневмококковой вакцины может повлиять на носительство пневмококков в глотке. Колонизация глотки пневмококками может также влиять на иммунный ответ на введение пневмококковой вакцины. По этой причине важно установить состояние носительства до и после введения пневмококковой вакцины. Оценивали колонизацию ротоглотки по задней стенке глотки с использованием мазка для культурального исследования BBL (Becton Dickson Microbiology Systems, Cockeysville, MD, USA) через ротовую полость. Образцы маркировали согласно индивидуальным номерам (ID), замораживали при -20°С за несколько часов и затем отправляли в Statens Serum Institut, где проводили выделение, культивирование и серотипирование. Это проводили на 0 сутки и еще раз при последующем наблюдении на 270 сутки.
Нежелательные явления (АЕ)
АЕ представляет собой любое нежелательное медицинское проявление у субъекта, принимающего участие в клиническом исследовании, которое совпадает по времени с применением лекарственного средства, вне зависимости от того, считают ли это проявление связанным с лекарственным средством.
Таким образом, АЕ может представлять собой любой нежелательный или непредвиденный признак (включая отклоняющиеся от нормы лабораторные данные), симптом или заболевание (новое или обостренное), совпадающие по времени с применением лекарственного средства.
В данном исследовании АЕ классифицировали в соответствии с Общими критериями токсичности (Common Toxicity Criteria) версии 2.0.
Определение серьезного нежелательного явления (SAE)
Нежелательным явлением, возникающим во время клинического исследования, является любое нежелательное событие, связанное с применением участником лекарственного средства. Явление серьезно, и о нем будет сообщено контролирующим органам, если исходом для участника является:
1) смерть;
2) угроза жизни;
3) госпитализация (первичная или длительная);
4) инвалидность;
5) необходимость вмешательства для предотвращения стойкого ухудшения или повреждения;
6) врожденное расстройство/аномалия (для беременных женщин).
Определение подозреваемой непредвиденной серьезной нежелательной реакции (SUSAR)
Подозреваемая непредвиденная серьезная нежелательная реакция (Suspected Unexpected Serious Adverse Reaction, SUSAR), возникающая во время исследования и о которой необходимо сообщать:
- Явление должно представлять собой SAE.
- Необходима определенная степень вероятности, что событие является нежелательной реакцией на введенное лекарственное средство.
Нежелательная реакция должна быть неожиданной, то есть не предусмотренной в брошюре исследователя (Investigator's Brochure) (для нелицензированного лекарственного средства).
Оценка данных: критерии оценки задач
Все конечные точки сравнивали между группой, получавшей экспериментальную вакцину (с CpG 7909), и группой, получавшей контрольную вакцину (с плацебо).
В подысследовании (substudy) проводили сравнение конечных точек в двух (нерандомизированных) группах лечения (с ВЭАРТ или без ВЭАРТ).
Первичные конечные точки
Через шесть месяцев после второй вакцинации Prevenar.
- Пациенты с сильным ответом на пневмококковую вакцину, определенным по повышению уровней IgG к пневмококкам по меньшей мере 5 из 7 серотипов в 2 раза и по уровням IgG к пневмококкам по меньшей мере 5 из 7 серотипов по меньшей мере 1 мкг/мл (согласно количественным измерениям IgG).
Вторичные конечные точки
Иммуногенность
Через три месяца после первой вакцинации Prevenar.
- Пациенты с сильным ответом на пневмококковую вакцину, определенным по повышению уровней IgG к пневмококкам по меньшей мере 5 из 7 серотипов в 2 раза и по уровням IgG к пневмококкам по меньшей мере 5 из 7 серотипов по меньшей мере 1 мкг/мл (согласно количественным измерениям IgG).
- Опсонофагоцитирующая активность в отношении серотипов 6В, 14, 19F и 23F, представленная в титрах.
- Серотип-специфичный гуморальный ответ, определенный по повышению уровней IgG в 2 раза и уровням IgG по меньшей мере 1 мкг/мл.
- Серотип-специфичный гуморальный ответ, определенный по изменению уровней IgG.
Через шесть месяцев после второй вакцинации Prevenar.
- Опсонофагоцитирующая активность в отношении серотипов 6В, 14, 19F и 23F, представленная в титрах.
- Серотип-специфичный гуморальный ответ, определенный по повышению уровней IgG в 2 раза и уровням IgG по меньшей мере 1 мкг/мл.
- Серотип-специфичный гуморальный ответ, определенный по изменению уровней IgG.
Через один месяц после вакцинации Pneumo Novum.
- Пациенты с сильным ответом на пневмококковую вакцину, определенным по повышению уровней IgG к пневмококкам по меньшей мере 5 из 7 серотипов в 2 раза и по уровням IgG к пневмококкам по меньшей мере 5 из 7 серотипов по меньшей мере 1 мкг/мл (согласно количественным измерениям IgG).
- Опсонофагоцитирующая активность в отношении серотипов 6В, 14, 19F и 23F, представленная в титрах.
- Серотип-специфичный гуморальный ответ, определенный по повышению уровней IgG в 2 раза и уровням IgG по меньшей мере 1 мкг/мл.
- Серотип-специфичный гуморальный ответ, определенный по изменению уровней IgG.
- Средние геометрические концентрации антител в стандартном иммуноферментном анализе для серотипов 1, 4, 7F, 9V, 14, 18C и 19F.
Колонизация глотки
Через шесть месяцев после второй вакцинации Prevenar.
- Число индивидов с колонизацией пневмококками.
Прогностические факторы гуморального ответа
Исходно
- Факторы риска относительно ответа на вакцину через шесть месяцев после второй вакцинации Prevenar.
Вторичные конечные точки
Реактогенность и безопасность у всех субъектов.
Анализируемые популяции
Популяция для оценки безопасности: все пациенты, получившие по меньшей мере одну вакцинацию.
- Частота запрашиваемых и общих симптомов в течение периода продолжительностью 4 суток (от 0 суток до 3 суток) после каждого введения вакцины.
- Частота незапрашиваемых симптомов в течение 1 месяца после каждого введения вакцины.
- Изменения количества CD4 клеток и вирусной нагрузки во время исследования.
Безопасность оценивали при физикальном обследовании, анализе нежелательных явлений (в соответствии с Общими критериями токсичности версии 2.0), лабораторных исследований и показателей контроля ВИЧ-инфекции (РНК ВИЧ и количества CD4 клеток).
Статистические анализы
Исходные показатели
Различия исследуемых групп на 0 сутки будут оценивать критерием суммы рангов Манна-Уитни (непрерывные переменные) и критерием хи-квадрат (дихотомические и категориальные переменные).
Первичная конечная точка
Коэффициенты распространенности пациентов с сильным ответом через шесть месяцев после второй вакцинации Prevenar при сравнении двух групп с разными схемами вакцинации (с/без CpG 7909) оценивали критерием хи-квадрат. Планируют использование регрессионной модели Пуассона с коррекцией по возрасту, исходному количеству CD4 клеток и ВЭАРТ (с ВЭАРТ или без ВЭАРТ) в начале исследования.
Вторичные конечные точки
Сравнение конечных точек между исследуемыми группами проводили критерием хи-квадрат. Планируют использование регрессии Пуассона (дихотомические конечные точки) или линейной регрессии (непрерывные конечные точки) с коррекцией на соответствующие возможные факторы, способные повлиять на результаты исследования.
Факторы риска относительно получения сильного ответа на вакцину (классифицируемого как сильный ответ на вакцину) через шесть месяцев после второй вакцинации Prevenar будут оценивать многомерной регрессией Пуассона.
Данные о безопасности
Данные о безопасности записывали и сравнивали критерием хи-квадрат.
Размер оцениваемой выборки
Популяция, начавшая получать лечение (ITT-популяция): все рандомизированные участники.
Вычисляют размер выборки для первичной конечной точки (коэффициентов распространенности пациентов с сильным ответом через шесть месяцев после второй вакцинации Prevenar при сравнении двух групп с разными схемами вакцинации). Были выбраны следующие вероятности ошибок I рода и II рода:
- вероятность ошибки 1 рода (а)=0,05 (двусторонняя);
- вероятность ошибки II рода (β)=0,20 (показатель степени (power)=1-β=0,80).
- Первичная конечная точка: доля пациентов с сильным ответом на вакцину (определенным по повышению уровней IgG к пневмококкам по меньшей мере 5 из 7 серотипов в 2 раза и по уровням IgG к пневмококкам по меньшей мере 5 из 7 серотипов по меньшей мере 1 мкг/мл).
- N представляет собой необходимое число участников в каждой группе.
Предполагая показатель 30% в группе контрольной вакцины и показатель 60% в группе экспериментальной вакцины, для выявления различий показателей при оценке регрессией Пуассона необходимый размер выборки составляет 42 пациента. Ожидаемый процент выбывания составляет 10%. Таким образом, для исследования было необходимо в общей сложности 94 субъекта.
Согласно способу, рекомендованному регулирующими органами, вычислен двусторонний 95% доверительный интервал (CI) различий иммунного ответа.
Пример 2: Иммуногенность и безопасность пневмококковых вакцин с агонистом TLR9 в качестве адъюванта у ВИЧ-инфицированных взрослых. Результаты рандомизированного, двойного слепого, плацебо-контролируемого исследования
Проводили клиническое исследование, описанное в Примере 1. Исследование представляло собой плацебо-контролируемое рандомизированное исследование II фазы у ВИЧ-инфицированных пациентов, которых вакцинировали двумя дозами PCV (конъюгированной пневмококковой вакцины) (Prevnar)±1 мг CpG 7909 на 0 и 3 месяцах и одной дозой PPV (пневмококковой полисахаридной вакцины)±1 мг CpG 7909 на 9 месяце. Иммуногенность и безопасность оценивали на 0, 3, 4, 9 и 10 месяцах. Первичной конечной точкой была доля пациентов с сильным ответом на вакцину, определенным по повышению уровней IgG к пневмококкам по меньшей мере 5 из 7 серотипов, входящих в PCV, в 2 раза и по уровням IgG к пневмококкам по меньшей мере 5 из 7 серотипов, входящих в PCV, по меньшей мере 1 мкг/мл (количественное определение IgG посредством ELISA, Statens Serum Institute, Copenhagen, Denmark) на 9 месяце.
Результаты. Как показано в Таблице 1, в исследование были включены 96 участников. В каждой группе было 48 участников, 38 из которых получали антиретровирусную терапию (APT).
Как показано в Таблице 3 и на Фиг.1, доля пациентов с сильным ответом на вакцину после иммунизации PCV в группе CpG была существенно больше, чем в группе адъюванта-плацебо (48,8% против 25,0%, р=0,018). Усиленные ответы наблюдали также на 3 (51,1% против 39,6%, р=0,26), 4 (77,3% против 56,3%, р=0,033) и 10 (87,8% против 51,1%, р<0,001) месяцах.
HR-пациенты с сильным ответом на пневмококковую вакцину, определенным по повышению уровней IgG к пневмококкам по меньшей мере 5 из 7 серотипов, входящих в Prevnar, в 2 раза и по уровням IgG к пневмококкам по меньшей мере 5 из 7 серотипов, входящих в Prevnar, по меньшей мере 1 мкг/мл (по количественным измерениям IgG); PCV - конъюгированная пневмококковая вакцина; PPV-23 - 23-валентная пневмококковая полисахаридная вакцина
На Фиг.2 и 3 показано различие относительного lgG-ответа на два серотипа, входящие в PCV (9v и 14), в группах CPG и плацебо.
На Фиг.4 и 5 показан относительный lgG-ответ на два серотипа, не входящие в PCV (1 и 7f), в группах CPG и плацебо (как и следовало ожидать, повышение IgG в связи с иммунизацией PCV не наблюдали).
После иммунизации PPV обе группы (+/-CpG) демонстрируют существенные ответы. Тем не менее, CpG не усиливал гуморальный ответ на серотипы, не входящие в PCV (1 и 7f), после иммунизации PPV.
Как показано в Таблице 4 (на страницах 67-71), данные о средних геометрических концентрациях (GMC) антител IgG выявили увеличенные GMC-отношения от исходного уровня до 3, 4, 9 и 10 месяцев почти для всех серотипов, входящих в PCV-7, для экспериментальной группы по сравнению с контрольной группой. Как и следовало ожидать, GMC антител к 3 серотипам, не входящим в PCV (1, 7F и 19А), после иммунизации PCV-7 существенно не изменялись. После PPV-23 в обеих группах происходило повышение GMC антител к серотипам, не входящим в PCV-7, в 2-5 раз (наименьшее для серотипа 19А), но значимых различий GMC-отношений между группами не было.
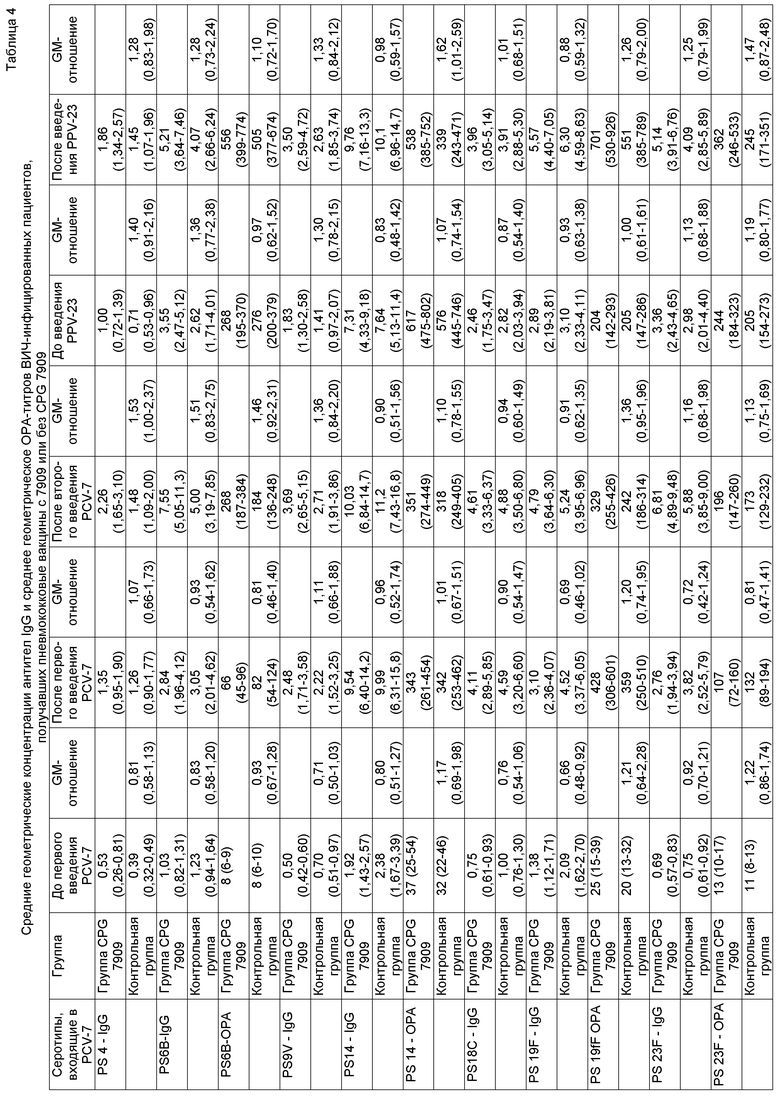
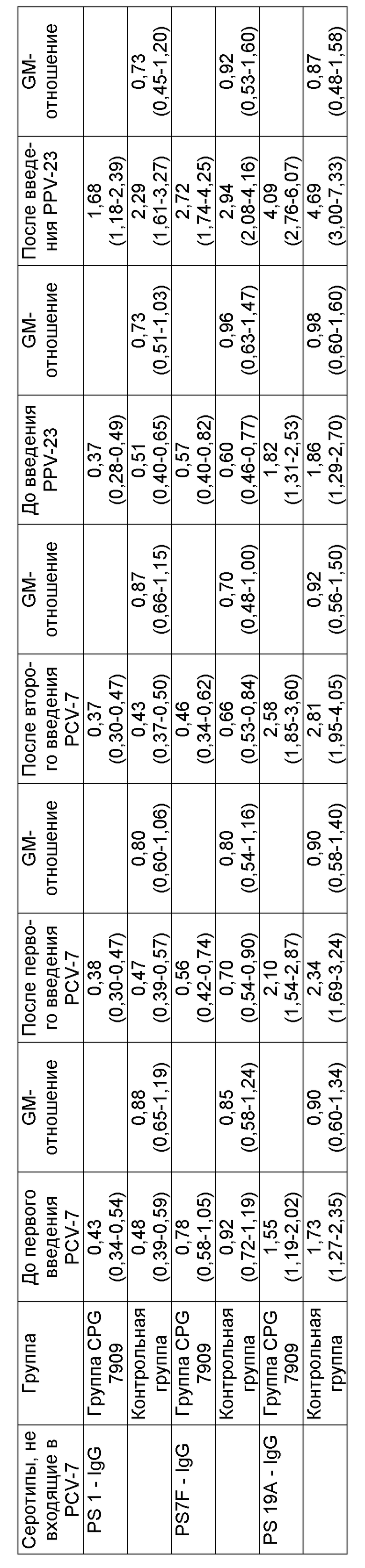
Участников иммунизировали двумя дозами PCV-7 (Prevnar®, Wyeth)±1 мг CPG 7909 на 0 и 3 месяцах и одной дозой PPV-23 (Pneumo Novum®, Sanofi Pasteur MSD)±1 мг CPG 7909 на 9 месяце, а - все включенные в PPV-23; ОРА - опсонофагоцитирующая активность; PS - серотип пневмококков; GM-отношение - отношение средних геометрических; PCV-7 - 7-валентная конъюгированная пневмококковая вакцина; PPV-23 - 23-валентная пневмококковая полисахаридная вакцина.
Как показано в Таблице 2, легкие системные и местные реакции на инъекцию PCV были более частыми в группе CpG (100% против 81,3%, р=0,002). Умеренные-тяжелые гриппоподобные симптомы наблюдали в группе CpG после PPV.
Ни в одной группе не было нежелательных эффектов на количество CD4+клеток (см. Фиг.6) или функции органов.
Выводы. В популяции, о которой известно, что она слабо отвечает на иммунизацию, добавление CPG 7909 к конъюгированной пневмококковой вакцине значительно увеличивало долю пациентов с сильным ответом на вакцину.
CPG 7909 и конъюгированная пневмококковая вакцина (Prevnar) были безопасны, и во время исследования не наблюдали нежелательные эффекты на функции органов или прогрессирование ВИЧ-инфекции. Пациенты хорошо переносили комбинацию CPG 7909 и конъюгированной пневмококковой вакцины (Prevnar), и нежелательными явлениями были легкие местные реакции и гриппоподобные симптомы. В этом исследовании CPG 7909, по-видимому, не усиливал ответ на серотипы, не входящие в Prevnar, после введения пневмококковой полисахаридной вакцины.
Пример 3: Адъювант агонист TLR9 индуцирует клеточную анамнестическую реакцию в ответ на конъюгированную пневмококковую вакцину у ВИЧ-инфицированных взрослых
Авторы изобретения исследовали влияние CPG 7909 на индукцию клеточной анамнестической реакции в ответ на конъюгированную пневмококковую вакцину.
Методы. На 0 и 4 месяце исследования получали и хранили (замораживали) мононуклеарные клетки периферической крови (РВМС) от 40 ВИЧ-инфицированных индивидов, включенных в двойное слепое плацебо-контролируемое исследование фазы Ib/IIa из Примера 1 (по 20 субъектов в каждой группе).
Замороженные РВМС размораживали, тестировали на жизнеспособность и переносили в 96-луночные планшеты для тканевых культур с плоским дном. Клетки инкубировали в течение ночи при 37°С и стимулировали на следующий день очищенными полисахаридами пневмококков (серотипов (ST) 6В и 14). Через 48 часов инкубации собирали надосадочные жидкости и измеряли концентрации цитокинов с использованием Luminex. Относительный ответ вычисляли как отношение концентраций цитокинов после и до иммунизации, принимая во внимание предсуществующий иммунитет к Streptococcus pneumoniae, а также устраняя погрешность, обусловленную врожденным распознаванием.
Результаты. Как показано на Фиг.7, 8 и 9, через один месяц после второго введения конъюгированной пневмококковой вакцины относительный цитокиновый ответ в группе CPG 7909 был значительно выше, чем в группе с адъювантом-плацебо для IFN-гамма (ST6B): 1,22 против 0,82, р=0,004; (ST14): 1,21 против 0,89, р=0,04; TNF-альфа (ST6B): 1,49 против 0,82, р=0,03; (ST14): 1,76 против 0,85, р=0,01); IL-6 (ST6B): 2,11 против 0,83, р=0,0084; (ST14): 1,64 против 0,81, р=0,0357), IFN-альфа (ST6B): 1,55 против 0,84, р=0,0014; (ST14): 1,43 против 0,90, р=0,0466). Цитокиновые ответы в группе CPG 7909, значительно повышенные по сравнению с контрольной группой, также наблюдали для IL-1B, IL-2R, воспалительного белка макрофагов-1-альфа (MIP-1-альфа), воспалительного белка макрофагов-бета (MIP-бета), моноцитарного хемотаксического белка-1 (МСР-1) и интерферон-γ индуцибельного белка-10 (IP-10).
Вывод. Результаты, полученные авторами изобретения, показывают, что у ВИЧ-инфицированных людей адъювант агонист TLR9, вводимый вместе с конъюгированной пневмококковой вакциной, индуцировал клеточную анамнестическую реакцию на полисахариды пневмококков, чего не наблюдали при введении вакцины самой по себе.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ ДЛЯ ПРИМЕНЕНИЯ В ПНЕВМОКОККОВЫХ ВАКЦИНАХ | 2016 |
|
RU2712622C2 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ ДЛЯ ПРИМЕНЕНИЯ В ПНЕВМОКОККОВЫХ ВАКЦИНАХ | 2021 |
|
RU2827429C1 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ КОНЪЮГИРОВАННЫЕ КАПСУЛЬНЫЕ САХАРИДНЫЕ АНТИГЕНЫ, И ИХ ПРИМЕНЕНИЕ | 2021 |
|
RU2774075C1 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ КОНЪЮГИРОВАННЫЕ КАПСУЛЬНЫЕ САХАРИДНЫЕ АНТИГЕНЫ, И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2771293C2 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ КОНЪЮГИРОВАННЫЕ КАПСУЛЬНЫЕ САХАРИДНЫЕ АНТИГЕНЫ, И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2778704C2 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ КОНЪЮГИРОВАННЫЕ КАПСУЛЬНЫЕ САХАРИДНЫЕ АНТИГЕНЫ, И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2687460C2 |
| Иммуногенные композиции, содержащие конъюгированные антигены капсульного сахарида, наборы, содержащие эти композиции, и их применения | 2016 |
|
RU2721128C2 |
| Капсульные полисахариды Streptococcus pneumoniae и их конъюгаты | 2015 |
|
RU2688831C2 |
| Мультивалентная композиция на основе конъюгатов пневмококковый полисахарид-белок | 2013 |
|
RU2606152C1 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ ДЛЯ ПРИМЕНЕНИЯ В ПНЕВМОКОККОВЫХ ВАКЦИНАХ | 2018 |
|
RU2762723C2 |













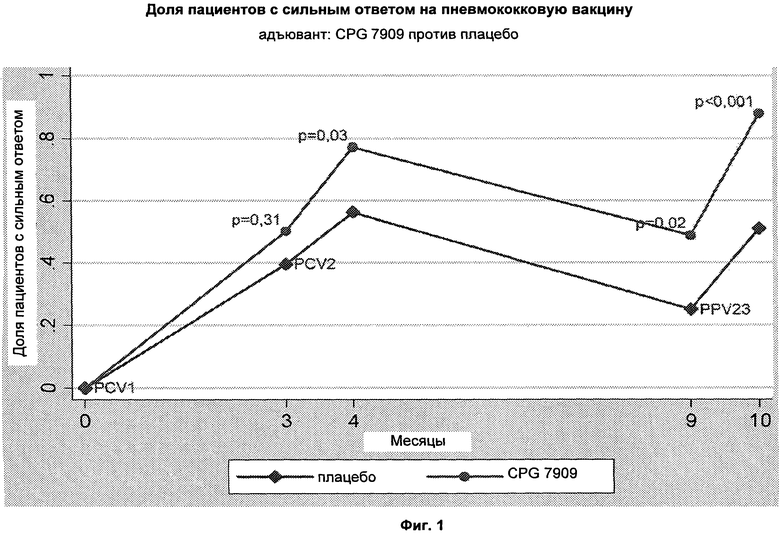
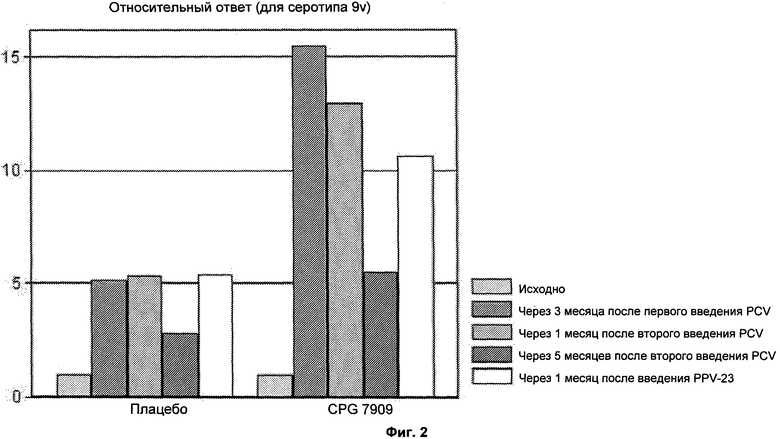
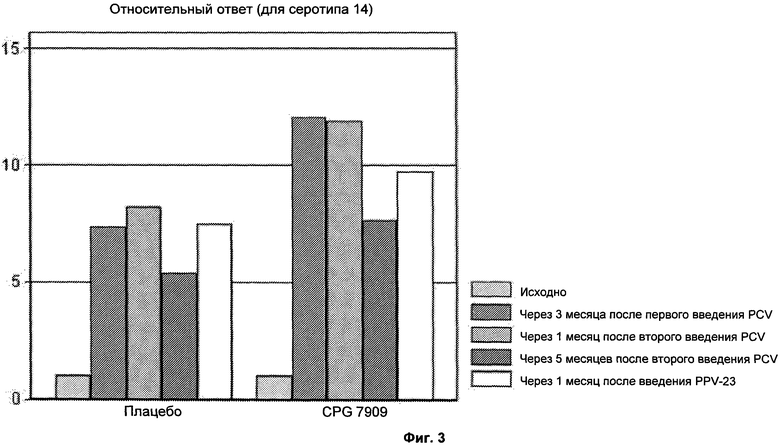
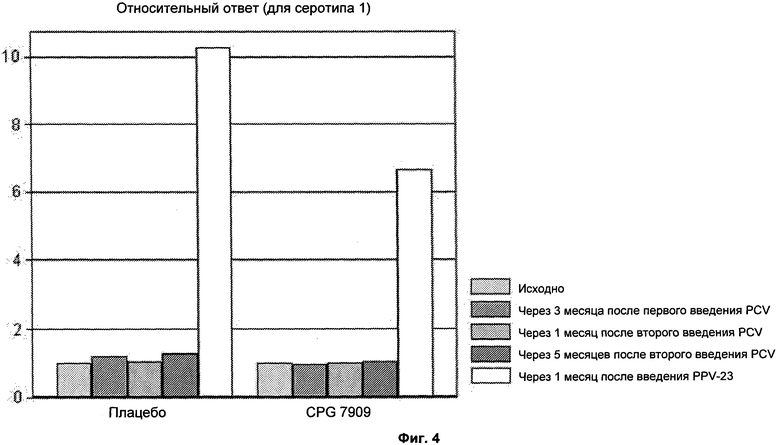
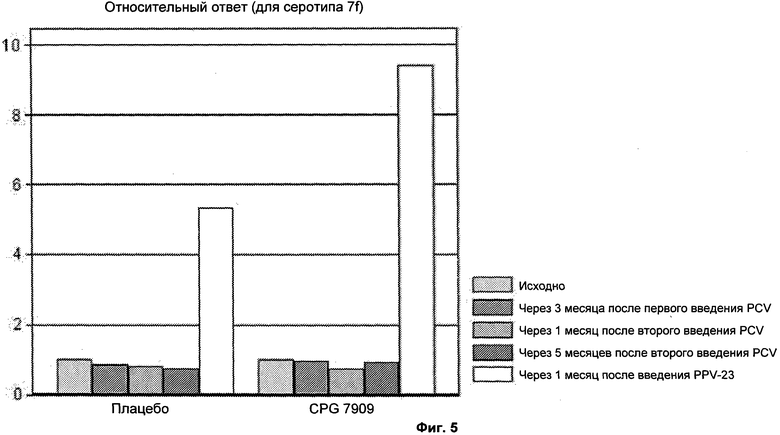
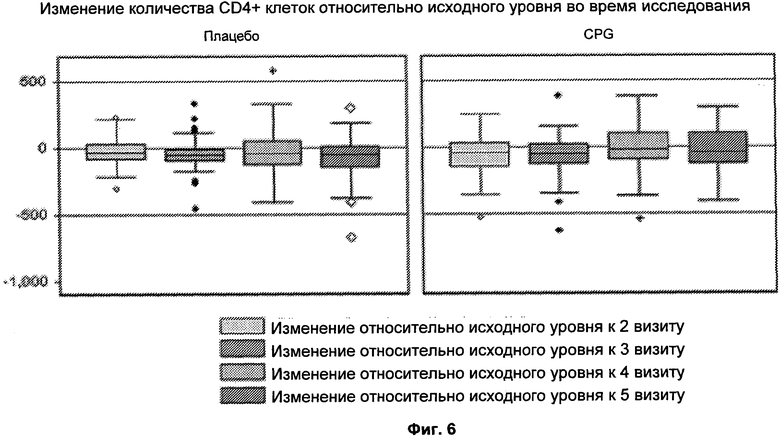
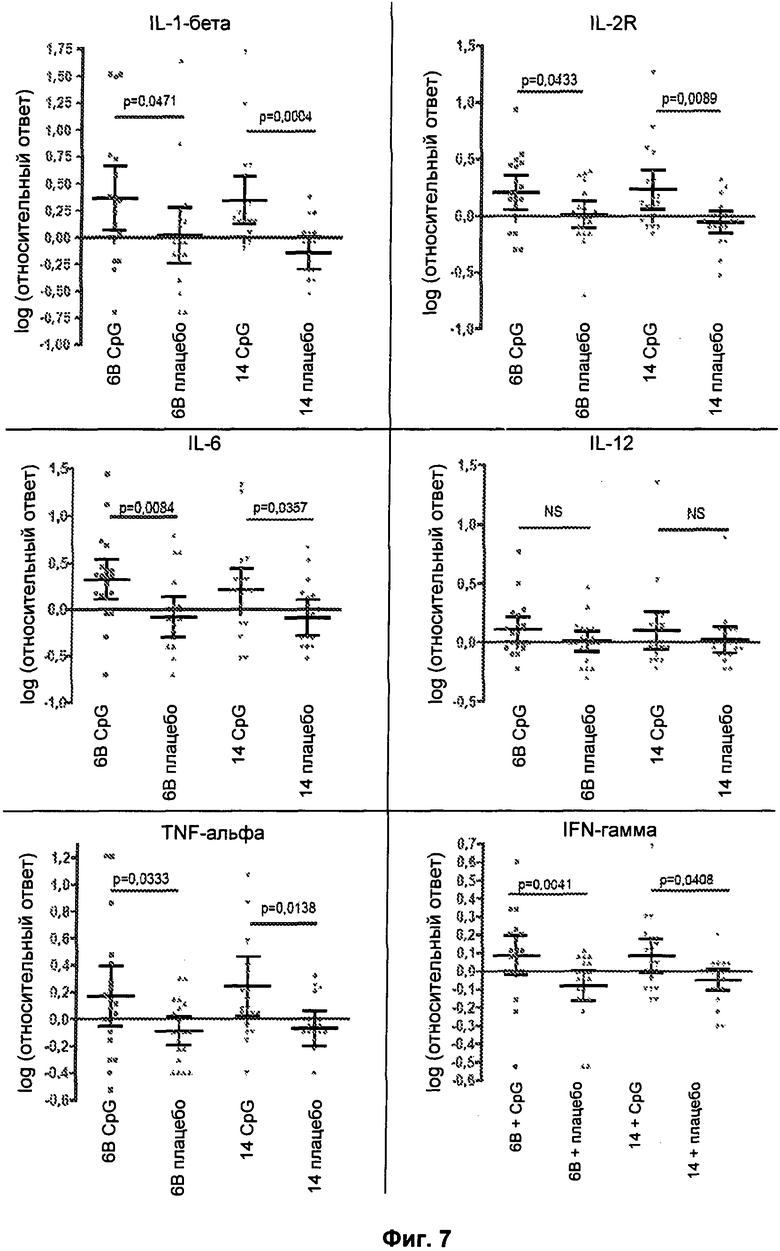
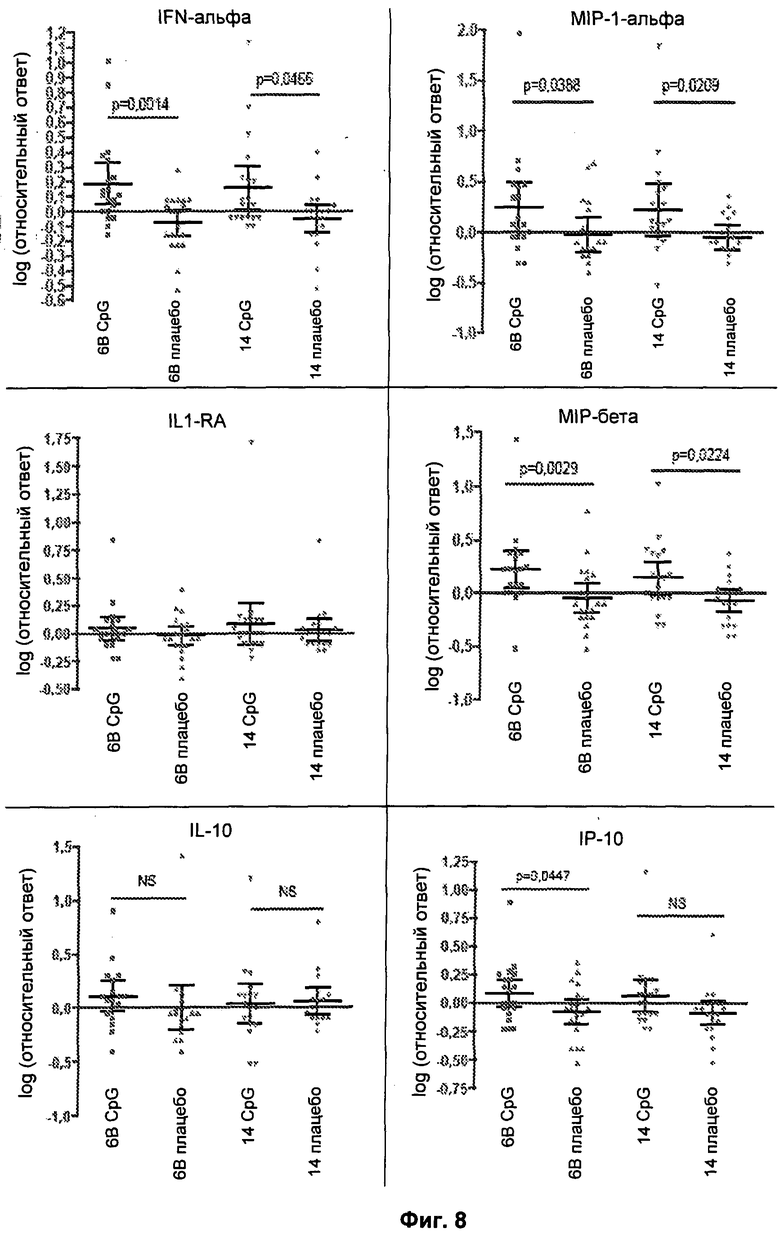
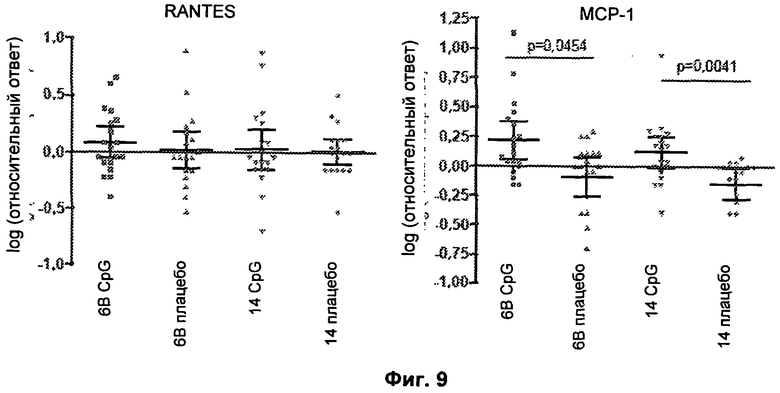
Группа изобретений относится к медицине и касается пневмококковой вакцины, содержащей сахарид из серотипов 4, 6B, 9V, 14, 18C, 19F и 23F, по отдельности конъюгированный с CRM197, и по меньшей мере один агонист Toll-подобного рецептора-9 (TLR-9) в качестве адъюванта, где указанный агонист Toll-подобного рецептора-9 представляет собой CpG-олигонуклеотид. Также группа изобретений касается применения пневмококковой вакцины для изготовления лекарственного средства для предотвращения или лечения заболеваний, вызванных инфекцией S.pneumoniae; способа иммунизации субъекта против заболеваний, вызванных инфекцией S.pneumoniae, включающего введение указанному субъекту иммунопротективной дозы вакцины. Добавление CpG В-класса к конъюгированной пневмококковой вакцине обеспечивает значительное увеличение доли пациентов с повышенной реакцией, хорошую переносимость и индуцирование клеточной памяти в отношении пневмококковых полисахаридов. 6 н. и 39 з.п. ф-лы, 9 ил., 4 табл., 3 пр.
1. Пневмококковая вакцина, содержащая сахарид из серотипов 4, 6B, 9V, 14, 18C, 19F и 23F, по отдельности конъюгированный с CRM197, и по меньшей мере один агонист Toll-подобного рецептора-9 (TLR-9) в качестве адъюванта, где указанный агонист Toll-подобного рецептора-9 представляет собой CpG-олигонуклеотид и имеет нуклеотидную последовательность, выбранную из группы, состоящей из:
5′ TCGTCGTTTTTCGGTGCTTTT 3′ (SEQ ID NO: 3),
5′ TCGTCGTTTTTCGGTCGTTTT 3′ (SEQ ID NO: 4),
5′ TCGTCGTTTTGTCGTTTTGTCGTT 3′ (SEQ ID NO: 5),
5′ TCGTCGTTTCGTCGTTTTGTCGTT 3′ (SEQ ID NO: 6) и
5′ TCGTCGTTTTGTCGTTTTTTTCGA 3′ (SEQ ID NO: 7).
2. Пневмококковая вакцина по п.1, где указанный CpG-олигонуклеотид выбран из группы, состоящей из:
5′ T*C*G*T*C*G*T*T*T*T*T*C*G*G*T*G*C*T*T*T*T 3′ (SEQ ID NO: 8), или
5′′ T*C*G*T*C*G*T*T*T*T*T*C*G*G*T*C*G*T*T*T*T 3′ (SEQ ID NO: 9), или
5′ T*C*G*T*C*G*T*T*T*T*G*T*C*G*T*T*T*T*G*T*C*G*T*T 3′ (SEQ ID NO: 10), или
5′ T*C*G*T*C*G*T*T*T*C*G*T*C*G*T*T*T*T*G*T*C*G*T*T 3′ (SEQ ID NO: 11), или
5′ T*C*G*T*C*G*T*T*T*T*G*T*C*G*T*T*T*T*T*T*T*C*G*A 3′ (SEQ ID NO: 12),
где * относится к фосфоротиоатной связи.
3. Пневмококковая вакцина по п.1, содержащая от 0,2 мг до 10 мг CpG-олигонуклеотида.
4. Пневмококковая вакцина по п.1, содержащая приблизительно 1 мг CpG-олигонуклеотида.
5. Пневмококковая вакцина по п.1, дополнительно содержащая сахарид из серотипов 1, 3, 5, 6А, 7F и 19А, по отдельности конъюгированный с CRM197.
6. Пневмококковая вакцина по п.1, дополнительно содержащая сахарид из серотипов 1, 5 и 7F, по отдельности конъюгированный с CRM197.
7. Пневмококковая вакцина по п.1, дополнительно содержащая сахарид из серотипов 1, 3, 5 и 7F, по отдельности конъюгированный CRM197.
8. Пневмококковая вакцина по п.1, где количество конъюгата в каждой дозе вакцины составляет 0,1-1000 мкг каждого сахаридно-белкового конъюгата.
9. Пневмококковая вакцина по п.8, где количество конъюгата в каждой дозе вакцины составляет 2-100 мкг.
10. Пневмококковая вакцина по п.8, где количество конъюгата в каждой дозе вакцины составляет 4-40 мкг.
11. Пневмококковая вакцина по п.1, где каждая доза содержит 0,1-20 мкг, 1-10 мкг или 1-5 мкг сахарида.
12. Пневмококковая вакцина по п.1, содержащая каждый капсульный сахарид S.pneumoniae в дозе 0,1-20 мкг, 0,5-10 мкг, 0,5-5 мкг или 1-5 мкг сахарида.
13. Пневмококковая вакцина по п.1, содержащая сахарид из серотипов 4, 6B, 9V, 14, 18С, 19F и 23F, по отдельности конъюгированный с CRM197, где каждый капсульный сахарид S.pneumoniae присутствует в дозе 2 мкг, за исключением сахарида из серотипа 6B, присутствующего в дозе 4 мкг.
14. Пневмококковая вакцина по п.1, дополнительно содержащая сахарид из серотипов 1, 3, 5, 6А, 7F и 19А, по отдельности конъюгированный с CRM197, где каждый капсульный сахарид S.pneumoniae присутствует в дозе 2 мкг, за исключением сахарида из серотипа 6B, присутствующего в дозе 4 мкг.
15. Пневмококковая вакцина по п.1, содержащая буфер с хлоридом натрия и/или сукцинатом натрия в качестве эксципиентов.
16. Пневмококковая вакцина по п.1, содержащая по меньшей мере один, два или три адъюванта в дополнение к по меньшей мере одному адъюванту агонисту TLR-9.
17. Пневмококковая вакцина по п.1, содержащая дополнительный адъювант.
18. Пневмококковая вакцина по п.1, содержащая квасцы, гидрат окиси алюминия, фосфат алюминия или сульфат алюминия в качестве дополнительного адъюванта к по меньшей мере одному адъюванту агонисту TLR-9.
19. Пневмококковая вакцина по п.1, содержащая сахарид из серотипов 4, 6B, 9V, 14, 18С, 19F и 23F, по отдельности конъюгированный с CRM197, где каждый капсульный сахарид S.pneumoniae присутствует в дозе 2 мкг, за исключением сахарида из серотипа 6B, присутствующего в дозе 4 мкг, дополнительно содержащая 0,5 мг фосфата алюминия и, возможно, буфер с хлоридом натрия и сукцинатом натрия в качестве эксципиентов.
20. Пневмококковая вакцина по п.1, дополнительно содержащая сахарид из серотипов 1, 3, 5, 6А, 7F и 19А, по отдельности конъюгированный с CRM197, где каждый капсульный сахарид S.pneumoniae присутствует в дозе 2 мкг, за исключением сахарида из серотипа 6B, присутствующего в дозе 4 мкг, дополнительно содержащая 0,5 мг фосфата алюминия и, возможно, буфер с хлоридом натрия и сукцинатом натрия в качестве эксципиентов.
21. Пневмококковая вакцина по любому из пп.1-20 для предотвращения или лечения заболеваний, вызванных инфекцией S.pneumoniae.
22. Пневмококковая вакцина по любому из пп.1-20 для предотвращения или лечения заболеваний, вызванных инфекцией S.pneumoniae, у субъекта с ослабленным иммунитетом.
23. Пневмококковая вакцина по п.22, где указанный субъект с ослабленным иммунитетом представляет собой человека.
24. Пневмококковая вакцина по п.22, где указанный субъект с ослабленным иммунитетом страдает от заболевания, поражающего иммунную систему.
25. Пневмококковая вакцина по п.24, где указанное заболевание представляет собой любой первичный иммунодефицит.
26. Пневмококковая вакцина по п.24, где указанное заболевание представляет собой приобретенный иммунодефицит.
27. Пневмококковая вакцина по п.22, где субъект с ослабленным иммунитетом, подлежащий вакцинации, представляет собой взрослого человека в возрасте 55 лет или старше, более предпочтительно взрослого человека в возрасте 65 лет или старше.
28. Пневмококковая вакцина по п.22, где субъект с ослабленным иммунитетом, подлежащий вакцинации, представляет собой взрослого человека в возрасте 70 лет или старше, в возрасте 75 лет или старше или в возрасте 80 лет или старше.
29. Применение пневмококковой вакцины по любому из пп.1-20 для изготовления лекарственного средства для предотвращения или лечения заболеваний, вызванных инфекцией S.pneumoniae.
30. Применение пневмококковой вакцины по любому из пп.1-20 для изготовления лекарственного средства для предотвращения или лечения заболеваний, вызванных инфекцией S.pneumoniae, у субъекта с ослабленным иммунитетом.
31. Применение пневмококковой вакцины по любому из пп.1-20 для вакцинации субъекта с ослабленным иммунитетом.
32. Применение по п.30 или 31, где указанный субъект с ослабленным иммунитетом представляет собой человека.
33. Применение по п.30 или 31, где указанный субъект с ослабленным иммунитетом страдает от заболевания, поражающего иммунную систему.
34. Применение по п.33, где указанное заболевание представляет собой любой первичный иммунодефицит.
35. Применение по п.33, где указанное заболевание представляет собой приобретенный иммунодефицит.
36. Применение по п.30 или 31, где субъект с ослабленным иммунитетом, подлежащий вакцинации, представляет собой взрослого человека в возрасте 55 лет или старше, более предпочтительно взрослого человека в возрасте 65 лет или старше.
37. Применение по п.30 или 31, где субъект с ослабленным иммунитетом, подлежащий вакцинации, представляет собой взрослого человека в возрасте 70 лет или старше, в возрасте 75 лет или старше или в возрасте 80 лет или старше.
38. Способ иммунизации субъекта против заболеваний, вызванных инфекцией S.pneumoniae, включающий введение указанному субъекту иммунопротективной дозы вакцины по любому из пп.1-20.
39. Способ иммунизации субъекта с ослабленным иммунитетом против заболеваний, вызванных инфекцией S.pneumoniae, включающий введение указанному субъекту иммунопротективной дозы вакцины по любому из пп.1-20.
40. Способ по п.39, где указанный субъект с ослабленным иммунитетом представляет собой человека.
41. Способ по п.39 или 40, где указанный субъект с ослабленным иммунитетом страдает от заболевания, поражающего иммунную систему.
42. Способ по п.41, где указанное заболевание представляет собой любой первичный иммунодефицит.
43. Способ по п.41, где указанное заболевание представляет собой приобретенный иммунодефицит.
44. Способ по п.39 или 40, где субъект с ослабленным иммунитетом, подлежащий вакцинации, представляет собой взрослого человека в возрасте 55 лет или старше, более предпочтительно взрослого человека в возрасте 65 лет или старше.
45. Способ по п.39 или 40, где субъект с ослабленным иммунитетом, подлежащий вакцинации, представляет собой взрослого человека в возрасте 70 лет или старше, в возрасте 75 лет или старше или в возрасте 80 лет или старше.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| COOPER C.L., et al., CPG 7909 adjuvant plus hepatitis B virus vaccination in HIV-infected adults achieves long-term seroprotection for up to 5 years | |||
| Clin Infect Dis | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
Авторы
Даты
2014-12-20—Публикация
2010-03-17—Подача