Настоящее изобретение относится к области детского питания. В частности настоящее изобретение относится к детским питательным смесям, содержащим пробиотические микроорганизмы. Эти пробиотические микроорганизмы могут быть нереплицирующимися пробиотическими микроорганизмами, такими как, например, подвергнутые тепловой обработке биоактивные микроорганизмы.
Грудное молоко является идеальной пищей для здорового роста и развития младенцев. В 2001 Всемирная Организация Здравоохранения (ВОЗ) изменила рекомендуемое время исключительно грудного вскармливания с 4-6 месяцев до 6 месяцев, таким образом, согласно принятому решению грудное вскармливание следует поощрять и стимулировать.
Однако не все матери способны кормить своих грудных детей исключительно грудным молоком в течение 6 месяцев или по различным причинам делают другой выбор.
Общая доля исключительно грудного вскармливания составляла согласно UNICEF в 1999 году 46%. Однако ситуация варьирует существенным образом в зависимости от страны. Например, сообщалось, что в Либерии доля исключительно грудного вскармливания составляет 73%, в то время как в Кении только 5%.
Множество факторов может оказывать влияние на выбор исключительно грудного вскармливания, и этот выбор, как правило, связан с экономическими, социальными и культурными традициями.
Кроме того, значительная часть всех матерей не способна обеспечить значительное количество молока для своих грудных детей, поэтому необходимо дополнительное питание.
Детская смесь представляет собой лучшую питательную альтернативу для тех грудных детей, кто не находится на грудном вскармливании или находится на неполном грудном вскармливании.
Федеральный закон о пищевых продуктах, лекарственных препаратах и косметических средствах (FFDCA) определяет детскую смесь как «пищу, которая подразумевает или представлена для индивидуального, исключительно диетического применения в качестве питания для младенцев в силу имитации ею человеческого молока или ее соответствия в качестве полной или частичной замены человеческого молока» (FFDCA 201 (z)).
Одна важная функция питания младенцев на ранних сроках жизни заключается в создании здоровой кишечной флоры и в развитии сильной иммунной системы.
Здоровая кишечная флора будет способствовать функциональности желудочно-кишечного тракта, что в свою очередь поможет основательному перевариванию проглоченной пищи и будет уменьшать желудочные боли у новорожденных.
Поэтому целесообразным было бы дополнительное улучшение иммуностимулирующего воздействия детских смесей для дополнительного улучшения их противовоспалительного эффекта и для облегчения переваривания.
Следовательно, в данной области существует необходимость создания детской питательной смеси, которая позволит обеспечить младенца питанием, которое настолько близко по составу к материнскому молоку, насколько это возможно. Такая детская питательная смесь должна обладать улучшенным иммуномодулирующим воздействием, противовоспалительным воздействием и/или должна облегчать переваривание. Предпочтительно, если это достигается при использовании натуральных ингредиентов, которые безопасны для введения без побочных эффектов и которые легко вводятся в детские питательные смеси на современном уровне развития промышленных технологий.
Авторы изобретения взялись за поиск решения для удовлетворения этой потребности. Следовательно, задача настоящего изобретения заключалась в улучшении современного уровня техники и в получении детской питательной смеси, которая удовлетворяет потребностям, обозначенным выше.
Авторы изобретения неожиданно обнаружили, что они могут решить эту задачу с помощью объекта независимого пункта формулы изобретения. Зависимые пункты дополнительно развивают идею настоящего изобретения.
Соответственно, авторы настоящего изобретения предложили получение детской питательной смеси, содержащей пробиотики, для введения младенцам.
Правила управления по контролю за продуктами и лекарствами определяют младенцев как людей не старше 12 месяцев (Статья 21, Свод федеральных нормативных актов 21 CFR 105.3 (е)).
Было обнаружено, что пробиотики способны обеспечивать пользу для здоровья в форме детских смесей. Кроме того, например, бифидобактерии присутствуют в грудном молоке и являются частью того, что придает грудному молоку его природные защитные свойства.
Следовательно, добавление пробиотических микроорганизмов к детским питательным смесям позволит их составу в большей мере напоминать грудное молоко.
Однако поскольку, как правило, конкретные порошковые детские питательные смеси, которые восстанавливаются водой, имеют срок годности, который превышает срок годности йогуртовых напитков, содержащих пробиотики, пробиотики, как правило, не добавляли к таким детским питательным смесям из-за неуверенности в том, что жизнеспособность пробиотиков может быть обеспечена в течение продолжительного срока хранения.
Итак, авторы настоящего изобретения способны продемонстрировать, что даже нереплицирующиеся пробиотики могут быть полезны для здоровья и могут быть даже более полезными.
Следовательно, одно воплощение настоящего изобретения является детской питательной смесью, которую вводят младенцу в качестве единственного источника питания или в качестве единственного дополнительного источника питания дополнительно к грудному вскармливанию и которая обеспечивает полноценное питание младенца и содержит пробиотические микроорганизмы.
Композиция обеспечивает полноценное питание, если младенец получает все требуемые питательные элементы из композиции и в дополнительных источниках питания нет необходимости.
Детская питательная смесь может быть представлена в виде жидкой композиции, готовой к употреблению, или в виде сухой композиции, которую следует восстановить водой перед использованием.
Если смесь представлена в виде сухой композиции, то предпочтительно, чтобы композиция обладала активностью воды ниже 0,2, предпочтительно ниже 0,15 для дополнительного увеличения стабильности при хранении. Большинство бактерий, например, не растет при активности воды ниже 0,91, и большая часть плесневых грибов прекращает рост при активности воды ниже 0,8.
Активность воды (aw) представляет собой меру энергетического состояния воды в системе. Она определяется как давление паров воды, поделенное на давление паров чистой воды. Следовательно, дистиллированная вода имеет давление воды 1.
Детская питательная смесь согласно настоящему изобретению может обладать энергетической ценностью в интервале 62-68 ккал/100 мл.
Как правило, детская питательная смесь может содержать источник белков в количестве 1,5-2,8 г/100 ккал, источник углеводов в количестве 10-12 г/100 ккал и источник липидов в количестве 5-5,5 г/100 ккал.
Источник белков может состоять из белков пшеницы и казеина. Например, могут использоваться пшеница и казеин в соотношении в диапазоне около 70:30. Однако при повышенной потребности в белке пшеница и казеин могут использоваться в соотношении в диапазоне 20:80-50:50.
Источник углеводов преимущественно может состоять из лактозы. Однако также могут использоваться лактоза и мальтодекстрин с соотношением, например, в диапазоне 3:1-1:1.
Детская питательная смесь по настоящему изобретению может содержать 0,2-0,3 г LC-PUFA/100 г жирных кислот. LC-PUFA могут, например, содержать комбинацию ARA и DHA. Было продемонстрировано, что смеси, содержащие DHA и ARA, обеспечивают физическое и умственное развитие, подобное развитию при грудном вскармливании младенца.
Детская питательная смесь по настоящему изобретению также может содержать 1,5-2,5 мг нуклеотидов на 100 мл смеси. Подразумевается, что нуклеотиды и их основания не являются 'незаменимыми', так как они могут синтезироваться в организме младенца из более простых соединений. Однако в некоторые моменты процессы синтеза могут не соответствовать потребностям, например, в периоды быстрого обновления клеточной популяции, как в процессе нормального роста, так и при кишечном заболевании. В эти моменты времени организм в значительной степени полагается на диетические источники нуклеотидов.
Детская питательная смесь может содержать частично или исключительно нереплицирующиеся пробиотические микроорганизмы.
Авторы неожиданно обнаружили, что, например, по величине воздействия, усиливающего иммунитет, и/или по величине противовоспалительного воздействия нереплицирующиеся пробиотические организмы могут быть еще более эффективными, чем реплицирующиеся пробиотические микроорганизмы.
Это удивительно, поскольку пробиотики часто определяются как «живые микроорганизмы, которые при введении в адекватных количествах приносят пользу здоровью организма-хозяина» (Руководство ПСО/ВОЗ). В подавляющем большинстве опубликованных работ имеют дело с живыми пробиотиками. Кроме того, в нескольких исследованиях изучали пользу здоровью, приносимую нереплицирующимися бактериями, и в большинстве из этих исследований указано, что инактивация пробиотиков, например, тепловой обработкой приводит к потере пробиотиками предусмотренной пользы для здоровья (Rachmilewitz, D., et al., 2004, Gastroenterology 126:520-528; Castagliuolo, et al., 2005, FEMS Immunol. 43:197-204; Gill, H.S. and K. J. Rutherfurd, 2001, Br. J.Nutr. 86:285-289; Kaila, M., et al., 1995, Arch. Dis. Child 72:51-53.). Некоторые исследования демонстрируют, что инактивированные пробиотики могут сохранять некоторое воздействие на здоровье (Rachmilewitz, D., et al., 2004, Gastroenterology 126:520-528; Gill, H.S. and К. J. Rutherfurd, 2001, Br. J.Nutr. 86:285-289), но ясно, что живые пробиотики рассматривались в данной области до настоящего времени как более эффективные.
Детская питательная смесь согласно настоящему изобретению может содержать пробиотические микроорганизмы в любом эффективном количестве, например в количестве, соответствующем около 106-1012 КОЕ/г сухой массы.
Пробиотические микроорганизмы могут быть нереплицирующимися пробиотическими микроорганизмами.
«Нереплицирующиеся» пробиотические микроорганизмы включают пробиотические бактерии, которые были подвергнуты тепловой обработке. Они включают микроорганизмы, которые являются инактивированными, мертвыми, нежизнеспособными и/или которые представлены в виде фрагментов, таких как ДНК, метаболиты, цитоплазматические соединения и/или материалы клеточной стенки.
«Нереплицирующийся» означает, что невозможно обнаружить жизнеспособные клетки и/или колониеобразующие единицы классическими способами рассева на чашках. Такие классические способы рассева на чашках сведены вместе в книге о микробиологии: James Monroe Jay, Martin J. Loessner, David A. Golden. 2005. Modem food microbiology. 7th edition. Springer Science, New York, N.Y. 790 p. Как правило, отсутствие жизнеспособных клеток может быть продемонстрировано следующим образом: на чашках с агаром отсутствует видимая колония или в жидкой среде для роста не увеличивается мутность после инокуляции различными концентрациями бактериальных препаратов («нереплицирующиеся» образцы) и инкубации в соответствующих условиях (аэробной и/или анаэробной атмосфере в течение по меньшей мере 24 часов).
Пробиотики определены для цели настоящего изобретения как «микробные клеточные препараты или компоненты микробных клеток с полезным воздействием на здоровье или самочувствие организма-хозяина» (Salminen S, Ouwehand A. Benno Y. et al "Probiotics: how should they be defined" Trends Food Sci. Technol. 1999:10 107-10).
Возможность применения нереплицирующихся пробиотических организмов дает некоторые преимущества. В исключительных случаях у младенцев с тяжелыми нарушениями иммунитета использование живых пробиотиков может быть ограничено из-за потенциального риска развития бактериемии. Нереплицирующиеся пробиотики могут быть использованы без каких-либо проблем.
Кроме того, предоставление нереплицирующихся пробиотических микроорганизмов делает возможным горячее восстановление с сохранением пользы для здоровья.
Детские питательные смеси по настоящему изобретению содержат пробиотические микроорганизмы и/или нереплицирующиеся пробиотические микроорганизмы в количестве, достаточном, по меньшей мере, для получения частичной пользы для здоровья. Количество, достаточное для осуществления этого, определяется как «терапевтически эффективная доза». Эффективные для данной цели количества будут зависеть от множества факторов, известных специалистам в данной области, таких как масса и общее состояние здоровья младенца, и воздействие пищевой матрицы.
В профилактических применениях, детскую питательную смесь согласно изобретению вводят восприимчивому к расстройству или в ином случае имеющему риск развития расстройства потребителю в количестве, которое является достаточным для, по меньшей мере, частичного уменьшения риска развития данного расстройства. Такое количество определяется как «профилактически эффективная доза». Опять же, точное количество зависит от множества факторов, таких как состояние здоровья и масса младенца, и от воздействия пищевой матрицы.
Специалист в данной области будет способен скорректировать терапевтически эффективную дозу и/или профилактически эффективную дозу соответствующим образом.
Как правило, детская питательная смесь по настоящему изобретению содержит пробиотические микроорганизмы и/или нереплицирующиеся пробиотические микроорганизмы в терапевтически эффективной дозе и/или в профилактически эффективной дозе.
Как правило, терапевтически эффективная доза и/или профилактически эффективная доза находится в диапазоне около 0,005 мг - 1000 мг пробиотических микроорганизмов и/или нереплицирующихся пробиотических микроорганизмов в ежедневной дозе.
В численном выражении, нереплицирующиеся микроорганизмы после «высокотемпературной кратковременной» обработки могут присутствовать в композиции в количестве, соответствующем от 104 до 1012 эквивалентных КОЕ/г сухой композиции. Очевидно, нереплицирующиеся микроорганизмы не образуют колоний, соответственно, данный термин понимается как количество нереплицирующихся микроорганизмов, которое получено из 104-1012 КОЕ/г реплицирующихся бактерий. Данный термин включает микроорганизмы, которые являются инактивированными, нежизнеспособными или мертвыми или присутствуют в виде фрагментов, таких как ДНК или клеточная стенка и/или цитоплазматические соединения. Другими словами, количество микроорганизмов, которые содержит детская питательная смесь, выражается в виде колониеобразующей способности (КОЕ) того количества микроорганизмов, которые были живыми независимо от того, являются ли они, по сути, нереплицирующимися, например инактивированными или мертвыми, фрагментированными или являются ли они смесью любых из представленных состояний.
Предпочтительно, если нереплицирующиеся микроорганизмы присутствуют в количественном эквиваленте от 10 до 10 КОЕ/г сухой детской питательной смеси, а еще более предпочтительно в количественном эквиваленте в диапазоне от 10 до 10 КОЕ/г сухой детской питательной смеси.
Пробиотики могут быть приведены в нереплицирующееся состояние любым способом, известным в данной области.
Доступными в настоящее время технологиями приведения пробиотических штаммов в нереплицирующееся состояние являются тепловая обработка, γ-облучение, УФ-обработка и применение химических агентов (формалина, парафармальдегида).
Было бы предпочтительно применить способ приведения пробиотиков в нереплицирующееся состояние, который является относительно простым в применении в производственной обстановке пищевой промышленности.
В настоящее время большинство находящихся на рынке продуктов с пробиотиками инактивируют тепловой обработкой в процессе их производства. Следовательно, было бы удобно, если бы было можно подвергать пробиотики тепловой обработке или вместе с полученным продуктом, или, по меньшей мере, аналогичным образом, с сохранением при этом или улучшением полезных свойств пробиотиков или даже с приобретением нового полезного для потребителя свойства.
Однако инактивация пробиотических микроорганизмов тепловыми обработками, как правило, связана в литературе, по меньшей мере, с частичной потерей пробиотической активности.
Авторы в настоящее время неожиданно обнаружили, что приведение пробиотических микроорганизмов в нереплицирующееся состояние, например, тепловой обработкой не приводит к потере пробиотических благоприятных воздействий, но, наоборот, может усилить существующие благоприятные воздействия и даже создать новые благоприятные воздействия.
Поэтому одним воплощением настоящего изобретения является детская питательная смесь, в которой нереплицирующиеся пробиотические микроорганизмы были приведены в нереплицирующееся состояние тепловой обработкой.
Такая тепловая обработка может быть проведена при по меньшей мере 71,5°С в течение по меньшей мере 1 секунды.
Могут быть применены длительные тепловые обработки или кратковременные тепловые обработки.
В промышленных масштабах сегодня, как правило, предпочтительными являются кратковременные тепловые обработки, такие как УВТ-подобные тепловые обработки. Данный тип тепловой обработки снижает бактериальную обсемененность и снижает время обработки, тем самым уменьшая порчу питательных веществ.
Авторы впервые демонстрируют факт того, что пробиотические микроорганизмы, подвергнутые тепловой обработке при высоких температурах в течение коротких периодов времени, демонстрируют противовоспалительные иммунные профили независимо от их начальных свойств. Конкретно, либо развивается новый противовоспалительный профиль, либо существующий противовоспалительный профиль улучшается с помощью этой тепловой обработки.
Таким образом, возможным стало получение нереплицирующихся пробиотических микроорганизмов с противовоспалительным иммунным профилем путем применения определенных параметров тепловой обработки, которые соответствуют типичной промышленно применяемой тепловой обработке, даже если живые эквиваленты не являются противовоспалительными штаммами.
Поэтому, например, такая тепловая обработка может представлять собой высокотемпературную обработку при около 71,5-150°С в течение около 1-120 секунд. Высокотемпературная обработка может являться высокотемпературной, кратковременной (ВТКВ) обработкой или ультравысокотемпературной (УВТ) обработкой.
Пробиотические микроорганизмы могут быть подвергнуты высокотемпературной обработке при температуре около 71,5-150°С в течение короткого периода времени около 1-120 секунд.
Более предпочтительно, если микроорганизмы могут быть подвергнуты высокотемпературной обработке при температуре около 90-140°С, например 90-120°С, в течение короткого периода времени около 1-30 секунд.
Данная высокотемпературная обработка приводит микроорганизмы, по меньшей мере частично, в нереплицирующееся состояние.
Высокотемпературная обработка может быть проведена при нормальной атмосферном давлении, но также может быть проведена при высоком давлении. Типичные диапазоны давления составляют от 1 до 50 бар, предпочтительно от 1 до 10 бар, еще более предпочтительно от 2 до 5 бар. Очевидно, предпочтительно, если пробиотики являются инактивированными тепловой обработкой в среде, которая является либо жидкой, либо твердой, при применении тепла. Идеальное применяемое давление будет, следовательно, зависеть от природы композиции, в которой предоставлены микроорганизмы, и от используемой температуры.
Высокотемпературная обработка может быть проведена в температурном диапазоне около 71,5-150°С, предпочтительно около 90-120°С, еще более предпочтительно около 120-140°С.
Высокотемпературная обработка может быть проведена в течение короткого периода времени около 1-120 секунд, предпочтительно около 1-30 секунд, еще более предпочтительно около 5-15 секунд.
Данные временные интервалы обозначают время, в течение которого пробиотические микроорганизмы подвергаются воздействию данной температуры. Следует отметить, что в зависимости от природы и количества композиции, в которой предоставляются микроорганизмы, и в зависимости от структуры используемого нагревательного прибора время нагревания может меняться.
Однако, как правило, детскую питательную смесь согласно настоящему изобретению и/или микроорганизмы обрабатывают с помощью высокотемпературной кратковременной обработки (ВТКВ), мгновенной пастеризации или с помощью ультравысокотемпературной обработки (УВТ).
УВТ-обработка является ультравысокотемпературным технологическим процессом или ультравысокотемпературной обработкой (оба сокращенно УВТ), включающей, по меньшей мере, частичную стерилизацию композиции нагреванием в течение короткого периода времени, около 1-10 секунд, при температуре, превышающей 135°С (275°F), которая является температурой, необходимой для уничтожения бактериальных спор в молоке. Например, обработка молока данным способом при использовании температуры, превышающей 135°С, позволяет снизить бактериальную обсемененность в течение необходимого периода удержания (до 2-5 с), что делает возможным проведение проточного процесса.
Существует два основных типа систем УВТ: прямая и непрямая. В прямой системе продукты обрабатывают инъекцией пара, или нагнетанием пара, тогда как в непрямой системе продукты нагревают с помощью плоского теплообменника, трубчатого теплообменника или скребкового теплообменника. Комбинация систем УВТ может быть применена на любой стадии или множестве стадий в процессе приготовления продукта.
ВТКВ-обработка определяется следующим образом (высокотемпературная кратковременная). Способ пастеризации для достижения 5 кратного логарифмического уменьшения, уничтожающий 99,9999% от числа жизнеспособных организмов в молоке. Способ считается достаточным для разрушения почти всех дрожжей, плесени и распространенных бактерий, вызывающих порчу, а также гарантирует достаточное разрушение распространенных патогенных термоустойчивых организмов. При ВТКВ-технологии молоко нагревают до 71,7°С (161°F) в течение 15-20 секунд.
Мгновенная пастеризация является способом тепловой пастеризации скоропортящихся напитков, таких как фруктовые и овощные соки, пиво и молочные продукты. Она осуществляется до заполнения в контейнеры, для того чтобы уничтожить микроорганизмы, вызывающие порчу, сделать продукты безопаснее и увеличить срок их хранения. Жидкость движется в контролируемом непрерывном потоке, в то же время подвергаясь воздействию температур от 71.5°С (160°F) до 74°С (165°F) в течение около 15-30 секунд.
Для цели настоящего изобретения термин «высокотемпературная кратковременная обработка» должен включать, например, высокотемпературные кратковременные (ВТКВ) обработки, УВТ-обработки и мгновенную пастеризацию.
Так как такая тепловая обработка обеспечивает получение нереплицирующихся пробиотиков с улучшенным противовоспалительным профилем, то пероральная диетическая добавка по настоящему изобретению может быть предназначена для применения в профилактике или лечении воспалительных расстройств.
Воспалительные расстройства, которые могут быть подвергнуты лечению или профилактике с помощью детской питательной смеси по настоящему изобретению, ничем конкретно не ограничены. Например, они могут быть выбраны из группы, состоящей из острых воспалений, таких как сепсис, ожоги, и хронических воспалений, таких как воспалительное заболевание кишечника, например болезнь Крона, язвенный колит, паучит; некротический энтероколит; кожных воспалений, таких как воспаление, индуцированное УФ или химическими соединениями, экзема, раздраженная кожа; из синдрома раздраженной толстой кишки; воспаления глаз; аллергии, астмы и их комбинаций.
При применении продолжительных тепловых обработок для приведения пробиотических микроорганизмов в нереплицируемое состояние такую тепловую обработку можно проводить в температурном диапазоне около 70-150°С в течение от около 3 минут до 2 часов, предпочтительно в диапазоне 80-140°С в течение 5-40 минут.
Хотя в предшествующем уровне техники известно, что бактерии, приведенные в нереплицирующееся состояние с помощью продолжительной тепловой обработки, как правило, менее эффективны, чем живые клетки по показателю их пробиотических свойств, авторам настоящего изобретения удалось продемонстрировать, что подвергнутые тепловой обработке пробиотики являются лучшими при стимуляции иммунной системы по сравнению с их живыми эквивалентами.
Настоящее изобретение также относится к пероральной диетической добавке, содержащей пробиотические микроорганизмы, которые приведены в нереплицирующееся состояние с помощью тепловой обработки по меньшей мере при температуре около 70°С в течение по меньшей мере около 3 минут.
Иммуноусиливающие воздействия нереплицирующихся пробиотиков были подтверждены иммунопрофилированием in vitro. В использованной in vitro модели применяется профилирование цитокинов из человеческих мононуклеарных клеток периферической крови (англ. Peripheral Blood Mononuclear Cell, PBMC) и данная модель популярна в данной области как стандартная модель для проверки иммуномодулирующих соединений (Schultz et al., 2003, Journal of Dairy Research 70, 165-173;Taylor et al., 2006, Clinical and Experimental Allergy, 36, 1227-1235; Kekkonen et al., 2008, World Journal of Gastroenterology, 14, 1192-1203).
In vitro анализ на РВМС использовался несколькими авторами/исследовательскими командами, например, для классификации пробиотиков в соответствии с их иммунным профилем, т.е. в соответствии с их противо- или провоспалительными характеристиками (Kekkonen et al., 2008, World Journal of Gastroenterology, 14, 1192-1203). Например, было продемонстрировано, что этот анализ дает возможность прогноза противовоспалительного эффекта пробиотиков-кандидатов в мышиных моделях кишечного колита (Foligne, В., et al., 2007, World J.Gastroenterol. 13:236-243). Более того, данный анализ регулярно используется для считывания данных при клинических испытаниях, и было показано, что он дает результаты, которые согласуются с клиническими исходами (Schultz et al., 2003, Journal of Dairy Research 70, 165-173; Taylor et al., 2006, Clinical and Experimental Allergy, 36, 1227-1235).
Аллергические заболевания неуклонно растут на протяжении последних десятилетий, и в настоящее время они рассматриваются ВОЗ как эпидемия. В общем виде аллергию рассматривают как результат дисбаланса между Th1- и Th2-ответами иммунной системы, который приводит к сильному сдвигу по направлению к продуцированию Th2-медиаторов. Следовательно, аллергия может быть смягчена, отрицательно регулирована или предотвращена путем восстановления соответствующего баланса между Th1 и Th2 плечами иммунной системы. Это подразумевает необходимость уменьшения Th2-ответов или увеличения, по меньшей мере, временно Th1-ответов. Последние, являясь предполагаемой характерной чертой вторичного иммунного ответа, часто сопровождаются, например, более высокими уровнями IFNγ, TNF-α и IL-12 (Kekkonen et al., 2008, World Journal of Gastroenterology, 14, 1192-1203; Viljanen M. et al., 2005, Allergy, 60, 494-500).
Детская питательная смесь по настоящему изобретению, следовательно, предоставляет возможность лечения или профилактики расстройств, которые связаны с ослабленной иммунной защитой.
Следовательно, расстройства, связанные с ослабленной иммунной защитой, которые могут быть подвергнуты лечению или профилактике с помощью детской питательной смеси согласно настоящему изобретению, ничем конкретно не ограничены.
Например, они могут быть выбраны из группы, состоящей из инфекций, конкретно бактериальных, вирусных, грибковых и/или паразитарных инфекций; фагоцитарного дефицита; иммунодепрессии от легкой до тяжелой стадии, как, например, иммунодепрессии, индуцированной стрессом или иммунодепрессивными лекарственными средствами, химиотерапией или лучевой терапией; естественных состояний менее иммунокомпетентных иммунных систем, таких как иммунные системы новорожденных; аллергий; и их комбинаций.
Детская питательная смесь, описанная в настоящем изобретении, также предоставляет возможность усиления ответа младенца на вакцины, конкретно на пероральные вакцины.
Эффективным будет любое количество нереплицирующихся микроорганизмов. Однако, как правило, предпочтительно, если по меньшей мере 90%, предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 98%, наиболее предпочтительно по меньшей мере 99%, идеально по меньшей мере 99,9%, наиболее идеально все пробиотики являются нереплицирующимися.
В одном воплощении настоящего изобретения, все микроорганизмы являются нереплицирующимися.
Следовательно, в детской питательной смеси по настоящему изобретению по меньшей мере 90%, предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 98%, наиболее предпочтительно по меньшей мере 99%, идеально по меньшей мере 99,9%, наиболее идеально все пробиотики могут быть нереплицирующимися.
Для целей настоящего изобретения могут применяться все пробиотические микроорганизмы.
Например, пробиотические микроорганизмы могут быть выбраны из группы, состоящей из бифидобактерий, лактобацилл, пропионовых бактерий или их комбинаций, например Bifidobacterium longum, Bifidobacterium lactis, Bifidobacterium ш, Bifidobacterium breve, Bifidobacterium infantis, Bifidobacterium adolescentis, Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus paracasei, Lactobacillus salivarius, Lactobacillus reuteri, Lactobacillus rhamnosus, Lactobacillus johnsonii, Lactobacillus plantarum, Lactobacillus fermentum, Lactococcus lactis. Streptococcus thermophilus, Lactococcus lactis, Lactococcus diacetylactis, Lactococcus cremoris, Lactobacillus bulgaricus, Lactobacillus helveticus, Lactobacillus delbrueckii, Escherichia coli и/или их смесей.
Детская питательная смесь согласно настоящему изобретению может, например, содержать нереплицирующиеся пробиотические микроорганизмы, выбранные из группы, состоящей из Bifidobacterium longum NCC 3001, Bifidobacterium longum NCC 2705, Bifidobacterium breve NCC 2950, Bifidobacterium lactis NCC 2818, Lactobacillus johnsonii Lal, Lactobacillus paracasei NCC 2461, Lactobacillus rhamnosus NCC 4007, Lactobacillus reuteri DSM17938, Lactobacillus reuteri ATCC55730, Streptococcus thermophilus NCC 2019, Streptococcus thermophilus NCC 2059, Lactobacillus casei NCC 4006, Lactobacillus acidophilus NCC 3009, Lactobacillus casei ACA-DC 6002 (NCC 1825), Escherichia coli Nissle, Lactobacillus bulgaricus NCC 15, Lactococcus lactis NCC 228 или из их комбинаций.
Все такие штаммы являются или депонированными согласно Будапештскому договору и/или являются коммерчески доступными.
Штаммы, депонированные согласно Будапештскому договору, представлены ниже:
Bifidobacterium longum NCC 3001: ATCC BAA-999
Bifidobacterium longum NCC 2705: CNCM 1-2618
Bifidobacterium breve NCC 2950: CNCM 1-3865
Bifidobacterium lactis NCC 2818: CNCM 1 -3446
Lactobacillus paracasei NCC 2461: CNCM 1-2116
Lactobacillus rhamnosus NCC 4007: CGMCC 1.3724
Streptococcus themophilus NCC 2019: CNCM 1-1422
Streptococcus themophilus NCC 2059: CNCM 1-4153
Lactococcus lactis NCC 2287: CNCM 1-4154
Lactobacillus casei NCC 4006: CNCM 1-1518
Lactobacillus casei NCC 1825: ACA-DC 6002
Lactobacillus acidophilus NCC 3009: ATCC 700396
Lactobacillus bulgaricus NCC 15: CNCM 1-1198
Lactobacillus johnsonii Lal CNCM 1-1225
Lactobacillus reuteri DSM17938 DSM17938
Lactobacillus reuteri ATCC55730 ATCC55730
Escherichia coli Nissle 1917: DSM 6601
Специалист в данной области поймет, что можно свободно комбинировать все признаки описанного в данном документе настоящего изобретения, не отходя от раскрытого объема притязаний изобретения.
Дополнительные преимущества и особенности настоящего изобретения очевидны из приведенных ниже Примеров и Фигур.
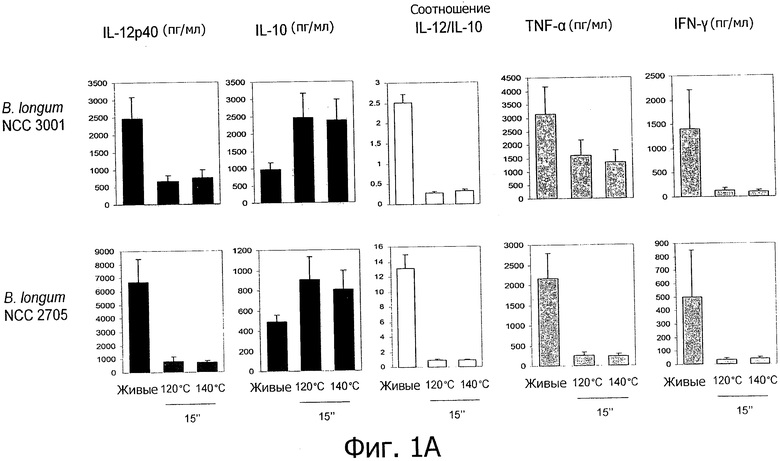
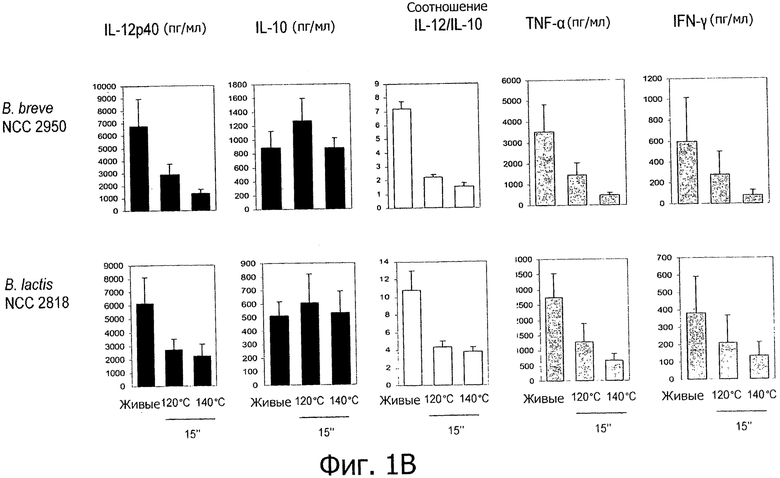
Фигуры 1А и В демонстрируют усиление противовоспалительных иммунных профилей пробиотиков, подвергнутых «высокотемпературной кратковременной обработке».
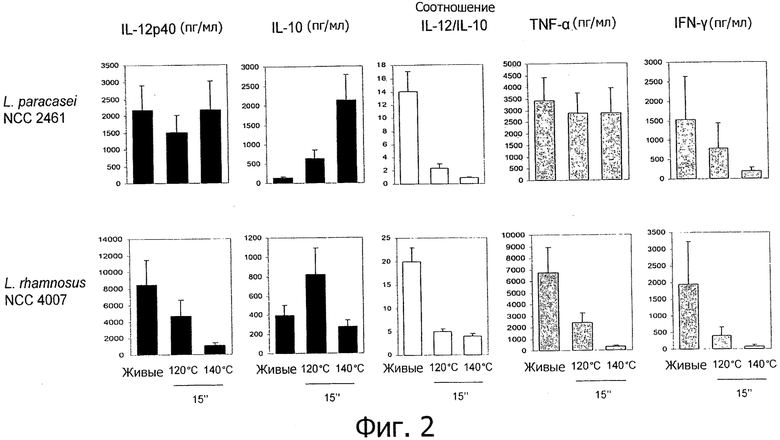
Фигура 2 демонстрирует не противовоспалительные пробиотические штаммы, которые становятся противовоспалительными, т.е. которые демонстрируют ярко выраженные противовоспалительные иммунные профили in vitro после «высокотемпературной кратковременной обработки».
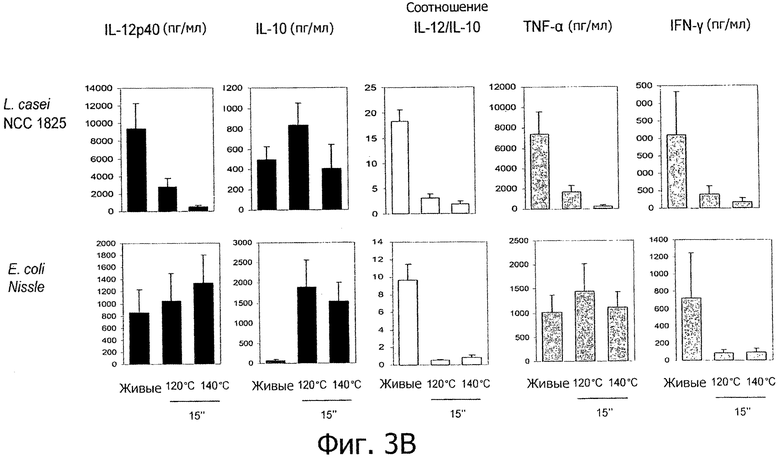
Фигуры 3А и В демонстрируют пробиотические штаммы, используемые в коммерчески доступных продуктах, которые демонстрируют усиление или появление новых противовоспалительных иммунных профилей in vitro после «высокотемпературной кратковременной обработки».
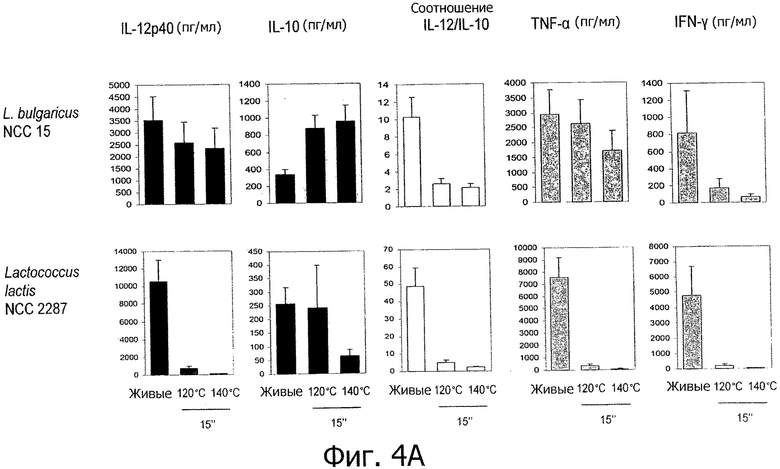
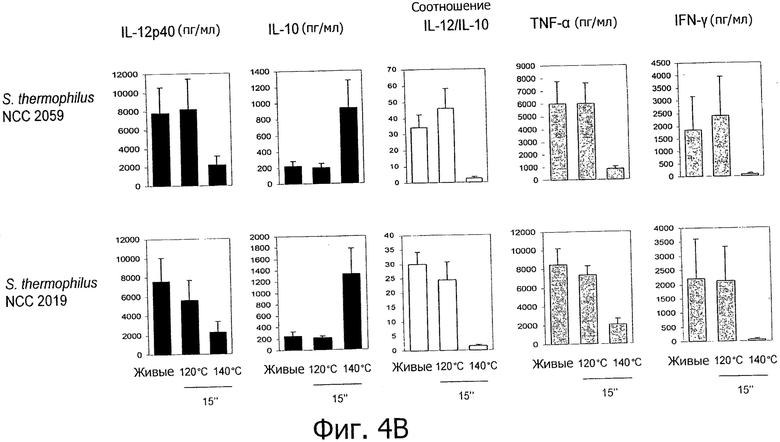
Фигуры 4А и В демонстрируют молочные заквасочные штаммы (т.е. заквасочные штаммы LeI), которые демонстрируют усиление или появление новых противовоспалительных иммунных профилей in vitro при тепловой обработке высокими температурами.
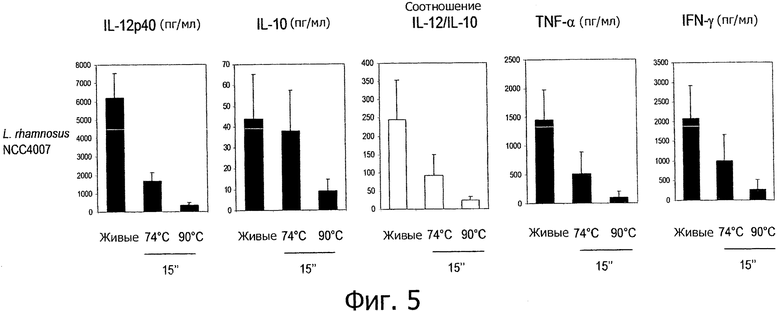
Фигура 5 демонстрирует непротивовоспалительный пробиотический штамм, который демонстрирует противовоспалительный иммунный профиль in vitro после ВТКВ-обработки.
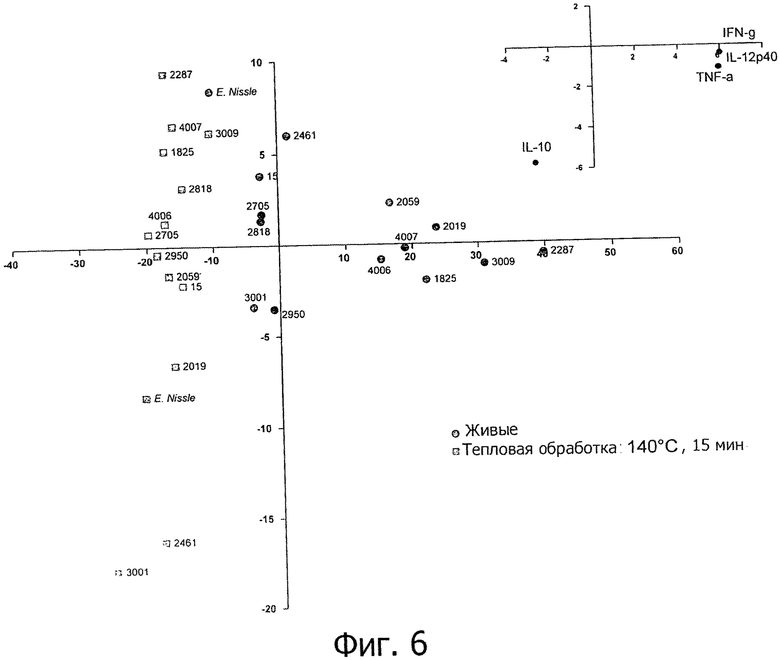
Фигура 6: анализ основных компонентов на основе данных РВМС (IL-12p40, IFN-γ, TNF-α, IL-10), полученных с использованием живых и подвергнутых тепловой обработке (140°С в течение 15 секунд) форм пробиотических и молочных заквасочных штаммов. Все данные характеризуют один штамм, живой или подвергнутый тепловой обработке, идентифицированный по его NCC-номеру или по названию.
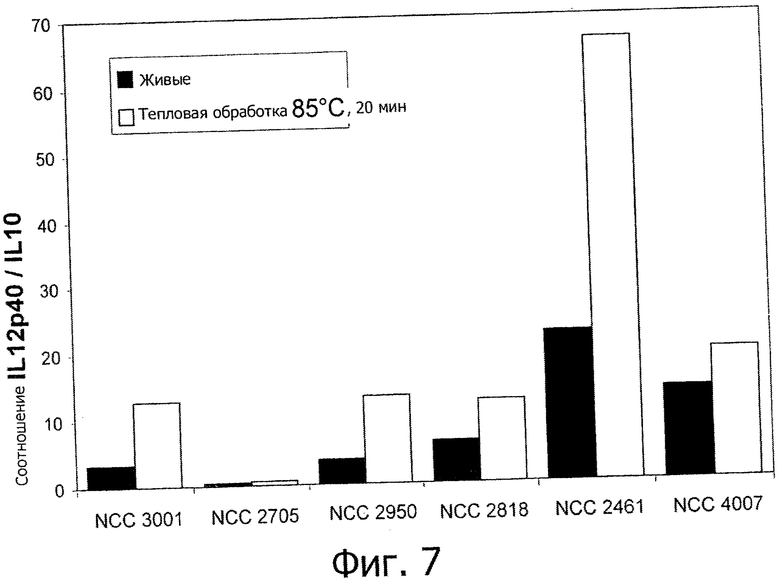
Фигура 7 демонстрирует соотношения IL-12p40/IL-10 живых и подвергнутых тепловой обработке штаммов (85°С, 20 мин). В целом, тепловая обработка при 85°С в течение 20 мин приводит к увеличению соотношений IL-12p40/IL-10 в отличие от данных, соответствующих «высокотемпературной кратковременной обработке» по настоящему изобретению (Фигуры 1, 2, 3, 4 и 5).
Фигура 8 демонстрирует усиление in vitro секреции цитокинов человеческими клетками РВМС, которые стимулировали бактериями, подвергнутыми тепловой обработке.
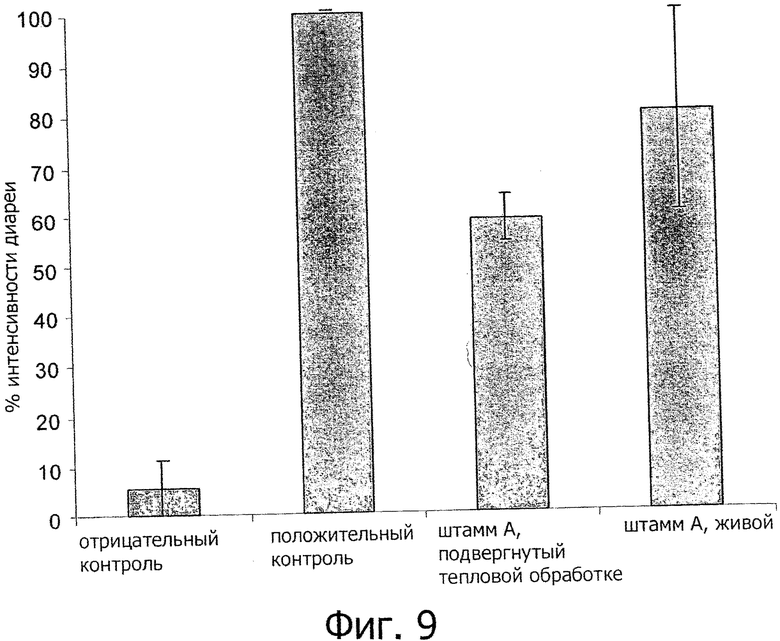
Фигура 9 демонстрирует процент интенсивности диареи, наблюдаемой у OVA-сенсибилизированных мышей, стимулированных с использованием физиологического раствора (отрицательный контроль), OVA-сенсибилизированных мышей, стимулированных с использованием OVA (положительный контроль) и у OVA-сенсибилизированных мышей, стимулированных с использованием OVA и обработанных бактериями Bifidobacterium breve NCC2950, которые были подвергнуты тепловой обработке, или живыми бактериями. Результаты представлены в виде процента интенсивности диареи (Среднее значение±стандартная ошибка среднего, рассчитанные для 4 независимых экспериментов), при 100% интенсивности диареи, соответствующей симптомам, развившимся в группе положительного контроля (мыши, сенсибилизированные и стимулированные аллергеном).
Пример 1:
Методология
Бактериальные препараты:
Предполагается, что польза для здоровья, оказываемая живыми пробиотиками иммунной системе организма-хозяина, как правило, является штаммспецифичной. Было продемонстрировано, что пробиотики, индуцирующие IL-10 на высоком уровне и/или индуцирующие провоспалительные цитокины на низком уровне in vitro (РВМС-анализ), являются сильными противовоспалительными штаммами in vivo (Foligne, В., et al., 2007, World J.Gastroenterol. 13:236-243).
Для исследования противовоспалительных свойств пробиотиков, подвергнутых тепловой обработке, использовали несколько пробиотических штаммов. Это штаммы Bifidobacterium longum NCC 3001, Bifidobacterium longum NCC 2705, Bifidobacterium breve NCC 2950, Bifidobacterium lactis NCC 2818, Lactobacillus paracasei NCC 2461, Lactobacillus rhamnosus NCC 4007, Lactobacillus casei NCC 4006, Lactobacillus acidophilus NCC 3009, Lactobacillus easel ACA-DC 6002 (NCC 1825), и Escherichia coli Nissle. Также тестировали несколько штаммов заквасочных культур, включающих некоторые штаммы, коммерчески используемые для получения Lcl-ферментированных продуктов «Nestle»: Streptococcus thermophilus NCC 2019, Streptococcus thermophilus NCC 2059, Lactobacillus bulgaricus NCC 15 и Lactococcus lactis NCC 2287.
Бактериальные клетки культивировали в 5-15 л биореакторах в условиях, оптимизированных для каждого штамма. Применимы все типичные среды для бактериального роста. Такие среды известны специалистам в данной области. Когда рН доводили до значения 5,5, то непрерывно добавляли 30% раствор основания (или NaOH или Са(ОН)2). При поддержании адекватных, анаэробных условий в свободное пространство над продуктом выпускали СО2, E.coli при этом культивировали в стандартных аэробных условиях.
Бактериальные клетки собирали центрифугированием (5000 × g, 4°C) и ресуспендировали в фосфатно-солевом буфере (PBS) в достаточном объеме с целью достижения конечной концентрации около 109-1010 кое/мл. Часть препарата замораживали при -80°С в 15% глицерине. Другую часть клеток подвергали тепловой обработке с помощью:
- ультравысокой температуры: 140°С в течение 15 с; путем инжекции непрямого пара;
- высокотемпературной кратковременной обработки (ВТКВ): 74°С, 90°С и 120°С в течение 15 с путем инжекции непрямого пара;
- продолжительной низкотемпературной обработки (85°С, 20 мин) на водяной бане.
После тепловой обработки образцы держали замороженными при -80°С до использования.
In vitro иммунопрофилирование бактериальных препаратов
Определяли иммунные профили живых и подвергнутых тепловой обработке бактериальных препаратов (т.е. способность индуцировать секрецию специфических цитокинов клетками крови человека in vitro). Человеческие мононуклеарные клетки периферической крови (РВМС) выделяли из кровяных фильтров. После разделения клеток в градиенте плотности мононуклеарные клетки собирали и отмывали дважды сбалансированным солевым раствором Хенкса. Затем клетки ресуспендировали в среде Дульбекко, модифицированной по способу Исков (Iscove's Modified Dulbecco's Medium) (IMDM, Sigma), дополненной 10% фетальной телячьей сывороткой (Bioconcept, Париж, Франция), 1% L-глутамином (Sigma), 1% пенициллином/стрептомицином (Sigma) и 0,1% гентамицином (Sigma). РВМС (7×105 клеток/на лунку) затем инкубировали с живыми и подвергнутыми тепловой обработке бактериями (эквивалентное количество 7×106 КОЕ/на лунку) в 48-луночных планшетах в течение 36 ч. Воздействия живых и подвергнутых тепловой обработке бактерий тестировали на РВМС из 8 доноров-индивидуумов, разделенных на два отдельных эксперимента. Через 36 часов инкубации культуральные чашки замораживали и хранили при -20°С до измерения цитокинов. Профилирование цитокинов осуществляли параллельно (т.е. в одном и том же эксперименте на одних и тех же партиях РВМС) для живых бактерий и для их подвергнутых тепловой обработке эквивалентов.
Уровни цитокинов (IFN-γ, IL-12p40, TNF-α и IL-10) определяли с помощью ИФА в надосадочных жидкостях клеточных культур через 36 часов инкубации (R&D DuoSet Human IL-10, BD OptEIA Human IL12p40, BD OptEIA Human TNF, BD OptEIA Human IFN-γ), следуя инструкциям изготовителей. IFN-γ, IL-12p40 и TNF-α являются провоспалительными цитокинами, тогда как IL-10 является мощным противовоспалительным медиатором. Результаты представлены в виде среднего (пг/мл) +/- стандартная ошибка среднего 4 индивидуальных доноров и являются репрезентативными для двух индивидуальных экспериментов, осуществленных с 4 донорами в каждом. Соотношение IL-12p40/IL-I0 рассчитывают для каждого штамма в качестве прогнозируемой величины in vivo противовоспалительного воздействия (Foligne, В., et al., 2007, World J.Gastroenterol. 13:236-243).
Числовые значения для цитокинов (пг/мл), определенные с помощью ИФА (см. выше) для каждого штамма, заносили в программу «BioNumerics v5.10 software» (Applied Maths, Синт-Мартенс-Латем, Бельгия). Анализ основных компонентов (РСА, расчетный метод) осуществляли на основе этой группы данных. Вычитание средних значений по признакам и деление на вариантность по признакам было включено в данный анализ.
Результаты
Противовоспалительные профили, полученные с помощью обработок типа ультравысокотемпературной обработки (УВТ)/высокотемпературной кратковременной обработки (ВТКВ).
Исследуемые пробиотические штаммы подвергали воздействию серии тепловых обработок (ультравысокотемпературная (УВТ), высокотемпературная кратковременная (ВТКВ) и при 85°С в течение 20 мин) и сравнивали их иммунные профили с профилями живых клеток in vitro. При инкубации с человеческими клетками РВМС живые микроорганизмы (пробиотики и/или молочные заквасочные культуры) индуцировали продуцирование цитокинов на разном уровне (Фигуры 1, 2, 3, 4 и 5). Тепловая обработка этих микроорганизмов модифицировала уровни цитокинов, продуцируемых РВМС, зависимым от температуры образом. «Высокотемпературные кратковременные» обработки (120°С или 140°С в течение 15 сек) давали нереплицирующиеся бактерии с противовоспалительными иммунными профилями (Фигуры 1, 2, 3 и 4). Фактически, штаммы, подвергнутые обработке типа УВТ (140°С, 15 с), индуцировали меньше провоспалительных цитокинов (TNF-α, ifn-γ, IL-12p40) при этом с сохранением или с индукцией дополнительного продуцирования IL-10 (по сравнению с живыми эквивалентами). Полученные в результате соотношения IL-12p40/IL-10 были ниже для любых штаммов, подвергнутых обработке типа УВТ, по сравнению с живыми клетками (Фигуры 1, 2, 3 и 4). Это наблюдение также было верным для бактерий, подвергнутых обработке типа ВТКВ, т.е. подвергнутых воздействию 120°С в течение 15 с (Фигуры 1, 2, 3 и 4), или 74°С и 90°С в течение 15 с (Фигура 5). Тепловые обработки (обработки типа УВТ или типа ВТКВ) обладали аналогичным эффектом в отношении in vitro иммунных профилей пробиотических штаммов (Фигуры 1, 2, 3 и 5) и молочных заквасочных культур (Фигура 4). Анализ основных компонентов на основе данных с РВМС, полученных с живыми и подвергнутыми тепловой обработке (140°С, 15 с) пробиотическими и молочными заквасочными штаммами, выявил, что живые штаммы распространялись вдоль оси х, что говорит о том, что штаммы демонстрируют очень разные иммунные профили in vitro, от слабых (левая панель) до сильных (правая панель) индукторов провоспалительных цитокинов. Штаммы, подвергнутые тепловой обработке, кластеризуются на левой панели графика, демонстрируя, что провоспалительные цитокины гораздо слабее индуцируются штаммами, подвергнутыми тепловой обработке (Фигура 6). Напротив, бактерии, подвергнутые тепловой обработке при 85°С в течение 20 мин, индуцировали больше провоспалительных цитокинов и меньше IL-10 по сравнению с живыми клетками, которые приводят к получению более высоких соотношений IL-12p40/IL-10 (Фигура 7).
Противовоспалительные профили усиливаются или генерируются с помощью обработок типа УВТ и ВТКВ.
Штаммы, подвергнутые обработкам УВТ и ВТКВ, демонстрируют противовоспалительные профили независимо от их соответствующих исходных иммунных профилей (живые клетки). Было показано, что пробиотические штаммы, которые, как известно, являются противовоспалительными in vivo и демонстрируют противовоспалительные профили in vitro (В. longum NCC 3001, В. longum NCC 2705, В. breve NCC 2950, В. lactis NCC 2818), демонстрируют усиление противовоспалительных профилей in vitro после «высокотемпературных кратковременных» обработок. Как показано на Фигуре 1, соотношения IL-12p40/IL-10 штаммов Bifidobacterium, подвергнутых обработке типа УВТ, были ниже, чем эти соотношения живых эквивалентов, демонстрируя, таким образом, улучшенные противовоспалительные профили образцов, подвергнутых обработке типа УВТ. Более удивительно то, что образование противовоспалительных профилей с помощью обработок типа УВТ и ВТКВ подтверждалось для непротивовоспалительных живых штаммов. Оба штамма, живые L. rhamnosus NCC 4007 и L. paracasei NCC 2461, демонстрируют высокие соотношения IL-12p40/IL-10 in vitro (Фигуры 2 и 5). Было показано, что два штамма не являются защитными против TNBS-индуцированного колита у мышей. Соотношения IL-12p40/IL-10, индуцированные с помощью L. rhamnosus NCC 4007 и L. paracasei NCC 2461, существенно снижались после «высокотемпературных кратковременных» обработок (У ВТ или ВТКВ), достигая уровня настолько низкого, как тот, который получают с использованием штаммов Bifidobacterium. Эти низкие соотношения IL-12p40/IL-10 наблюдаются благодаря низкому уровню продуцирования IL-12p40, объединенному с отсутствием изменений (L. rhamnosus NCC 4007) или с мощной индукцией секреции IL-10 (L. paracasei NCC 2461) (Фигура 2).
Как следствие:
- противовоспалительные профили живых микроорганизмов могут быть усилены с помощью тепловых обработок типа УВТ и типа ВТКВ (например, В. longum NCC 2705, В. longum NCC 3001, В. breve NCC 2950, В. lactis NCC 2818),
- противовоспалительные профили могут быть получены из непротивовоспалительных живых микроорганизмов (например, L. rhamnosus NCC 4007, L. paracasei NCC 2461, молочных заквасочных культур S. thermophilus NCC 2019) с помощью тепловых обработок типа УВТ и типа ВТКВ,
- противовоспалительные профили также показаны для штаммов, выделенных из коммерчески доступных продуктов (Фигуры 3А и В), включая пробиотический штамм E.coli.
Влияние обработок типа УВТ/ВТКВ было похожим для всех проверенных пробиотиков и молочных заквасочных культур, например, бифидобактерий и стрептококков.
Обработки типа УВТ/ВТКВ применяли к нескольким штаммам лактобацилл, бифидобактерий и стрептококков, демонстрирующим различные иммунные профили in vitro. Все штаммы индуцировали меньше провоспалительных цитокинов после обработок типа УВТ/ВТКВ, чем их живые эквиваленты (Фигуры 1, 2, 3, 4, 5 и 6), что говорит о том, что воздействие обработок типа УВТ/ВТКВ, оказываемое на иммунные свойства полученных в результате нереплицирующихся бактерий, может быть общим для всех пробиотиков, конкретно для штаммов лактобацилл, бифидобактерий и конкретных штаммов E.coli, а также для всех молочных заквасочных культур, конкретно для стрептококков, лактококков и лактобацилл.
Пример 2:
Методология
Бактериальные препараты:
Пять пробиотичесих штаммов использовали для исследования иммуностимулирующих свойств нереплицирующихся пробиотиков: 3 бифидобактерии (B. longum NCC3001, В. lactis NCC2818, В. breve NCC2950) и 2 лактобациллы (L paracasei NCC2461, L. rhamnosus NCC4007).
Бактериальные клетки выращивали на MRS при периодической ферментации при 37°С в течение 16-18 часов без контроля рН. Бактериальные клетки осаждали (5000 × g, 40°С) и ресуспендировали в фосфатно-солевом буфере для разведения в соленой воде для достижения конечной концентрации около 1010 КОЕ/мл. В. longum NCC3001, В. lactis NCC2818, L. paracasei NCC2461, L. rhamnosus NCC4007 подвергали тепловой обработке при 85°С в течение 20 мин на водяной бане. В. breve NCC2950 подвергали тепловой обработке при 90°С в течение 30 минут на водяной бане. Повергнутые тепловой обработке бактериальные суспензии разделяли на аликвоты и хранили замороженными при -80°С до использования. Живые бактерии хранили при -80°С в PBS-15% глицерин до использования.
In vitro иммунопрофилирование бактериальных препаратов
Определяли иммунные профили живых и подвергнутых тепловой обработке бактериальных препаратов (т.е. способность индуцировать секрецию специфических цитокинов клетками крови человека in vitro). Человеческие мононуклеарные клетки периферической крови (РВМС) выделяли из кровяных фильтров. После разделения клеток в градиенте плотности мононуклеарные клетки собирали и отмывали дважды сбалансированным солевым раствором Хенкса. Затем клетки ресуспендировали в среде Дульбекко, модифицированной по способу Исков (Iscove's Modified Dulbecco's Medium) (IMDM, Sigma), дополненной 10% фетальной телячьей сывороткой (Bioconcept, Париж, Франция), 1% L-глутамином (Sigma), 1% пенициллином/стрептомицином (Sigma) и 0,1% гентамицином (Sigma). РВМС (7×105 клеток/на лунку) затем инкубировали с живыми и подвергнутыми тепловой обработке бактериями (эквивалентное количество 7×106 КОЕ/на лунку) в 48-луночных планшетах в течение 36 часов. Воздействия живых и подвергнутых тепловой обработке бактерий тестировали на РВМС из 8 доноров-индивидуумов, разделенных на два отдельных эксперимента. Через 36 часов инкубации культуральные чашки замораживали и хранили при -20°С до измерения цитокинов. Профилирование цитокинов осуществляли параллельно (т.е. в одном и том же эксперименте на одних и тех же партиях РВМС) для живых бактерий и для подвергнутых тепловой обработке. Уровни цитокинов (IFN-γ, IL-12p40, TNF-α и IL-10) в надосадочных жидкостях клеточных культур через 36 часов инкубации определяли с помощью ИФА (R&D DuoSet Human IL-10, BD OptEIA Human IL12p40, BD OptEIA Human TNF, BD OptEIA Human IFN-γ), следуя инструкциям изготовителей. IFN-γ, IL-12p40 и TNF-α являются провоспалительными цитокинами, тогда как IL-10 является мощным противовоспалительным медиатором. Результаты представлены в виде среднего (пг/мл) +/- стандартная ошибка среднего 4 индивидуальных доноров и являются репрезентативными для двух индивидуальных экспериментов, осуществленных с 4 донорами в каждом.
In vivo воздействие живых и подвергнутых тепловой обработке Bifidobacterium breve NCC2950 при предотвращении аллергической диареи
Мышиную модель аллергической диареи применяли для проверки промотирующего Th1 воздействия В. breve NCC2950 (Brandt E.B et al. JCI 2003; 112(11): 1666-1667). После сенсибилизации (2 перитонеальные инъекции Овальбумина (OVA) и алюминиевокалиевыми квасцами с интервалом 14 дней; дни 0 и 14) самцов мышей Balb/c перорально стимулировали OVA 6 раз (дни 27, 29, 32, 34, 36, 39), что привело к временным клиническим симптомам (диарея) и изменениям иммунных параметров (концентрации в плазме общего IgE, OVA-специфичного IgE, мышиной протеазы 1 тучных клеток, т.е. ММСР-1). Bifidobacterium breve NCC2950 живые или подвергнутые тепловой обработке при 90°С в течение 30 минут вводили зондом за 4 дня до сенсибилизации OVA (дни -3, -2, -1, 0 и дни 11, 12, 13 и 14) и в течение периода стимулирования (дни с 23-39). Использовали ежедневную бактериальную дозу около 109 КОЕ или эквивалент КОЕ/мышь.
Результаты
Индукция секреции «провоспалительных» цитокинов после тепловой обработки.
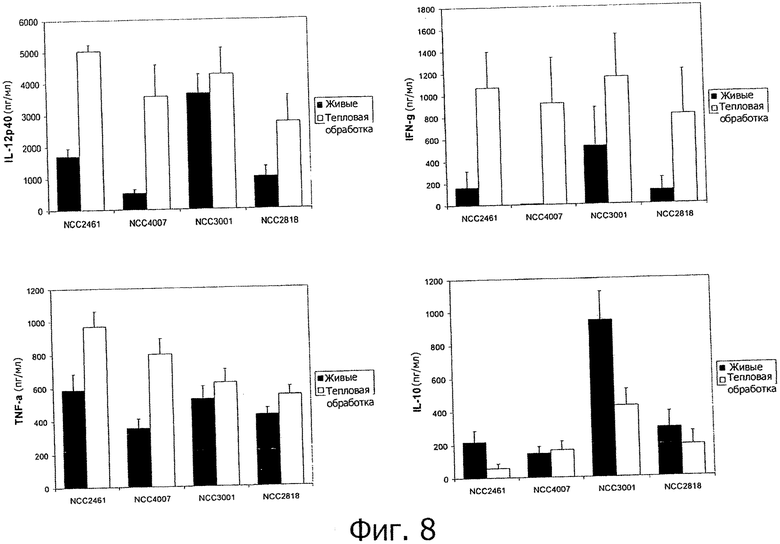
Способность подвергнутых тепловой обработке бактериальных штаммов стимулировать секрецию цитокинов человеческими мононуклеарными клетками периферической крови (РВМС) оценивали in vitro. Иммунные профили, основанные на четырех цитокинах, в результате стимуляции РВМС инактивированными тепловой обработкой бактериями, сравнивали с профилями, индуцированными живыми бактериальными клетками в том же самом in vitro анализе.
Подвергнутые тепловой обработке препараты помещали на чашки и оценивали отсутствие каких-либо жизнеспособных единиц. Подвергнутые тепловой обработке бактериальные препараты не дают колонии после рассевания.
Живые пробиотики индуцировали другие и штаммзависимые уровни продуцирования цитокинов при инкубации с человеческими РВМС (Фигура 8). Тепловая обработка пробиотиков модифицирует уровни цитокинов, полученных с помощью РВМС по сравнению с их живыми эквивалентами. Подвергнутые тепловой обработке бактерии индуцируют больше провоспалительных цитокинов (TNF-α, IFN-γ, IL-12p40), чем их живые эквиваленты. Напротив подвергнутые тепловой обработке бактерии индуцировали подобные или более низкие количества IL-10 по сравнению с живыми клетками (Фигура 8). Эти данные демонстрируют, что подвергнутые тепловой обработке бактерии способны сильнее стимулировать иммунную систему, чем их живые эквиваленты,? и, следовательно, способны лучше усиливать ослабленные иммунные защиты. Другими словами, in vitro данные демонстрируют улучшенное иммунное усиливающее воздействие бактериальных штаммов после тепловой обработки.
Для иллюстрации усиленного воздействия подвергнутых тепловой обработке В.breve NCC2950 (по сравнению с живыми клетками) на иммунную систему тестировали и живые, и подвергнутые тепловой обработке В.breve NCC2950 (штамм А) в животной модели аллергической диареи.
По сравнению с положительной контрольной группой интенсивность диареи значительно и сообразно снизилась после обработки подвергнутыми тепловой обработке В. breve NCC2950 (41.1%±4.8), тогда как интенсивность диареи снизилась только на 20±28.3% после обработки живыми В.breve NCC2950. Эти результаты показывают, что подвергнутые тепловой обработке В.breve NCC2950 демонстрируют более сильное защитное воздействие против аллергической диареи, чем их живые эквиваленты (Фигура 9).
Как следствие, было показано, что способность пробиотиков усиливать иммунную защиту стала лучше после тепловой обработки.
ПРИМЕРЫ 3-6:
Могут быть получены следующие детские питательные смеси:

Изобретение относится к области детского питания. Детская питательная смесь, которую вводят младенцу в качестве единственного источника питания или в качестве единственного дополнительного источника питания в дополнение к грудному вскармливанию, содержит нереплицирующиеся пробиотические микроорганизмы, которые приведены в нереплицирующееся состояние высокотемпературной обработкой при 71,5-150°С в течение 1-120 секунд. Изобретение позволяет получить питательную смесь с улучшенными противовоспалительными иммуногенными свойствами. 14 з.п. ф-лы, 12 ил., 6 пр.
1. Детская питательная смесь, которую вводят младенцу в качестве единственного источника питания или в качестве единственного дополнительного источника питания в дополнение к грудному вскармливанию, которая обеспечивает полноценное питание младенца и содержит нереплицирующиеся пробиотические микроорганизмы, в которой нереплицирующиеся пробиотические микроорганизмы приведены в нереплицирующееся состояние высокотемпературной обработкой при 71,5-150°С в течение 1-120 секунд.
2. Детская питательная смесь по п.1, обладающая энергетической ценностью в диапазоне 62-68 ккал/100 мл и содержащая источник белка в количестве 1,5-2,8 г/100 ккал, источник углеводов в количестве 10-12 г/100 ккал и источник липидов в количестве 5-5,5 г/100 ккал.
3. Детская питательная смесь по п.2, содержащая 0,2-0,3 г LC-PUFA/100 г жирных кислот, где LC-PUFA является комбинацией ARA и DHA.
4. Детская питательная смесь по п.2, содержащая 1,5-2,5 мг нуклеотидов на 100 мл смеси.
5. Детская питательная смесь по п.1, содержащая пробиотические микроорганизмы в количестве, соответствующем от около 106 до 1012 КОЕ.
6. Детская питательная смесь по п.1, в которой высокотемпературная обработка является высокотемпературной/кратковременной (ВТКВ) обработкой или ультравысокотемпературной (УВТ) обработкой.
7. Детская питательная смесь по п.1, в которой высокотемпературную обработку проводят при 90-140°С в течение 1-120 секунд.
8. Детская питательная смесь по п.1, в которой высокотемпературную обработку проводят при 120-140°С в течение 1-120 секунд.
9. Детская питательная смесь по п.1, в которой высокотемпературную обработку проводят при 71,5-74°С в течение 15-30 секунд.
10. Детская питательная смесь по п.1, в которой высокотемпературную обработку проводят при 74-120°С в течение 15-20 секунд.
11. Детская питательная смесь по любому из п.1-6 для применения при профилактике или лечении воспалительных расстройств.
12. Детская питательная смесь по п.1, в которой по меньшей мере 90%, предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 98%, наиболее предпочтительно по меньшей мере 99%, идеально по меньшей мере 99,9%, наиболее идеально все пробиотики являются нереплицирующимися.
13. Детская питательная смесь по п.1, в которой пробиотические микроорганизмы выбраны из группы, состоящей из бифидобактерий, лактобацилл, пропионовых бактерий или их комбинаций, например Bifidobacterium longum, Bifidobacterium lactis, Bifidobacterium animalis, Bifidobacterium breve, Bifidobacterium infantis, Bifidobacterium adolescentis, Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus paracasei, Lactobacillus salivarius, Lactobacillus reuteri, Lactobacillus rhamnosus, Lactobacillus johnsonii, Lactobacillus plantarum, Lactobacillus fermentum, Lactococcus lactis, Streptococcus thermophilus, Lactococcus lactis, Lactococcus diacetylactis, Lactococcus cremoris, Lactobacillus bulgaricus, Lactobacillus helveticus, Lactobacillus delbrueckii, Escherichia coli и/или их смесей.
14. Детская питательная смесь по п.13, в которой пробиотические микроорганизмы выбраны из группы, состоящей из Bifidobacterium longum NCC 3001, Bifidobacterium longum NCC 2705, Bifidobacterium breve NCC 2950, Bifidobacterium lactis NCC 2818, Lactobacillus johnsonii LaI, Lactobacillus paracasei NCC 2461, Lactobacillus rhamnosus NCC 4007, Lactobacillus reuteri DSM17938, Lactobacillus reuteri ATCC55730, Streptococcus thermophilus NCC 2019, Streptococcus thermophilus NCC 2059, Lactobacillus casei NCC 4006, Lactobacillus acidophilus NCC 3009, Lactobacillus casei ACA-DC 6002 (NCC 1825), Escherichia coli Nissle, Lactobacillus bulgaricus NCC 15, Lactococcus lactis NCC 2287 или из их комбинаций.
15. Детская питательная смесь по п.1, содержащая около 0,005 мг - 1000 мг нереплицирующихся микроорганизмов в ежедневной дозе.
| WO 2008106373 A1, 04.09.2008 | |||
| WO 2004112507 A1, 29.12.2004 | |||
| WO 2008153377 A1, 18.12.2008 | |||
| СМЕСЬ ДЛЯ ДЕТЕЙ ПЕРВЫХ МЕСЯЦЕВ ЖИЗНИ ИЛИ СТАРШЕ | 2004 |
|
RU2346449C2 |
Авторы
Даты
2015-01-27—Публикация
2010-05-11—Подача