Настоящее изобретение в основном относится к области пробиотических микроорганизмов, в частности к области нереплицирующихся пробиотических микроорганизмов. Воплощения настоящего изобретения относятся к композициям, содержащим пробиотические микроорганизмы, переведенные в нереплицирующееся состояние экструзией. Такие композиции могут использоваться для лечения или предупреждения расстройств, связанных с нарушениями иммунной защиты.
Пробиотики могут быть определены как «живые микроорганизмы, которые при введении в надлежащих количествах приносят пользу здоровью организма» (FAO/WHO (Продовольственная и сельскохозяйственная организация ООН/Всемирная организация здравоохранения), (2001) Health and Nutritional Properties of Probiotics in Food including Powder Milk with Live Lactic Acid Bacteria («Здоровье и питательные свойства пробиотиков в пищевых продуктах, включая сухое молоко с живыми молочнокислыми бактериями»). Отчет Объединенной экспертно-консультационной комиссии FAO/WHO по оценке влияющих на здоровье и питательных свойств пробиотиков в пищевых продуктах, включая сухое молоко с живыми молочнокислыми бактериями). Поэтому живым пробиотикам посвящено огромное количество литературных публикаций. При этом в нескольких исследованиях изучалась полезность для здоровья введения нереплицирующихся бактерий, однако их авторы пришли к заключению о том, что инактивация пробиотиков под воздействием тепла обычно приводит к потере их подразумеваемой пользы для здоровья (Rachmilewitz, D. и др., 2004, Gastroenterology 126:520-528; Castagliuolo и др., 2005, FEMS Immunol. Med. Microbiol. 43:197-204; Gill, H.S. и К.J. Rutherford, 2001, Br. J. Nutr. 86:285-289; Kaila, M. и др., 1995, Arch. Dis. Child 72:51-53; Wagner, R.D. и др., 2000, J. Food Prot. 63:638-644).
Тем не менее, некоторые исследования показывали, что инактивированные пробиотики способны сохранять некоторую способность воздействия на здоровье. Это может зависеть, например, от способа, применяемого для их инактивации (Rachmilewitz, D., и др К., 2004, Gastroenterology 126:520-528; Gill, H.S. и К.J. Rutherford. 2001, Br. J. Nutr. 86:285-289). Использовавшиеся в литературе технологии приведения пробиотических штаммов в нереплицирующееся состояние в основном представлены тепловой обработкой, γ-облучением, обработкой ультрафиолетовым светом или химическими реагентами (формалин, параформальдегид).
Возможность применения в пищевых продуктах нереплицирующихся пробиотиков давала бы несколько значительных преимуществ. Поскольку обеспечение пищевых продуктов с жизнеспособными пробиотиками, к тому же переносящими длительные сроки хранения, представляет собой нетривиальную задачу, возможность использования нереплицирующихся пробиотиков исключила бы все связанные с этим проблемы.
Кроме того, в этом случае стало бы возможным значительное расширение ассортимента продуктов, дополненных пробиотиками и связанной с ними пользой для здоровья.
Однако, для того, чтобы быть применимым в пищевой промышленности, используемый для перевода пробиотиков в нереплицирующееся состояние способ должен подходить для применения в промышленном масштабе, γ-облучение, УФ-обработка или использование химических реагентов могут оказаться в этом отношении проблематичными. Даже тепловая обработка для некоторых категорий продуктов может оказаться непростой.
Кроме того, было бы желательно, если бы нереплицирующееся пробиотические микроорганизмы не просто сохраняли небольшую часть своей способности влиять на состояние здоровья, а сохраняли бы существенную часть или всю свою способность влияния на состояние здоровья по сравнению с их жизнеспособными аналогами.
Настоящее изобретение обращается именно к этим потребностям.
Соответственно, задача настоящего изобретения состояла в том, чтобы обеспечить в данной области композицию, которая может легко производиться в промышленном масштабе для очень широкого ассортимента продуктов и которая содержит нереплицирующиеся пробиотические микроорганизмы с по существу такими же или даже улучшенными по сравнению с их живыми аналогами полезными для здоровья свойствами.
Авторы настоящего изобретения решили эту задачу с помощью объектов независимых пунктов формулы изобретения. Основную идею настоящего изобретения развивают зависимые пункты формулы изобретения.
Авторы настоящего изобретения неожиданно обнаружили, что удовлетворять описанным выше требованиям способны композиции, содержащие пробиотические микроорганизмы или молочные закваски, приведенные в нереплицирующееся состояние экструзией.
Экструзия является широко применяемым в настоящее время в пищевой промышленности технологическим способом. Она позволяет выполнять формование посредством проталкивания материала через область с высокой температурой и/или давлением с одновременным сдвигом. Параметры процесса, такие как нагревание, давление, механический сдвиг и, при необходимости, быстрое испарение в экструдируемых материалах, а также их комбинации, могут регулироваться для получения различных типов конечных продуктов. На основе различных исходных материалов с помощью экструзии можно получать большое разнообразие форм и текстур. Обычно экструдированные материалы включают металлы, полимеры, керамику и продовольственные продукты. Пищевые продукты, такие как макаронные изделия, снэки/закусочные пищевые продукты, зерновые завтраки, мороженое, кондитерские изделия и даже некоторые корма для домашних животных и готовые к употреблению закуски, включая продукты, предназначенные для употребления с помощью пальцев, главным образом производятся экструзией.
Экструдер может состоять из источника электропитания, обеспечивающего функционирование одного или двух шнеков, питатель для дозирования ингредиентов сырья и окружающего шнеки цилиндра. Шнеки предназначены для того, чтобы вызывать сжатие, генерировать сдвиговое напряжение и продвигать сырье. В зависимости от изготавливаемого продукта в цилиндр могут вводиться жидкие ингредиенты и вода. Также внутри экструдера может происходить процесс термообработки, когда в продукте под действием прилагаемого давления создается внутренние трение и вырабатывается тепло. Температура узла цилиндра управляется индукционными обмотками для нагревания и циркуляцией воды для охлаждения. В конце ингредиенты пищевого продукта проталкиваются к имеющему соответствующую форму отверстию, формующей головке с фильерами, которая придает продукту необходимую форму с увеличением разнообразия текстур и форм.
Перед другими производственными процессами экструзионный способ имеет два основных преимущества: способность создавать очень сложные в поперечном сечении продукты и способность работать в непрерывном режиме.
Авторы настоящего изобретения обнаружили, например, что подвергнутые экструзии микроорганизмы штамма В. longum NCC3001 при инкубировании в течение 36 часов показали кривую зависимости «доза - эффект» продуцирования цитокинов человеческими РВМС.
В этой связи одним воплощением настоящего изобретения является композиция, содержащая нереплицирующиеся пробиотические микроорганизмы, которые приводятся в нереплицирующееся состояние экструзионной обработкой.
«Нереплицирующиеся» пробиотические микроорганизмы включают пробиотические бактерии, которые являются инактивированными, мертвыми, нежизнеспособными и/или присутствующими в виде фрагментов, таких как ДНК, метаболиты, цитоплазматические соединения или материалы клеточной оболочки.
«Нереплицирующиеся» означает, что никаких жизнеспособных клеток и/или колониеобразующих единиц классическими методами культивирования обнаружено быть не может. Такие классические методы культивирования сведены воедино в книге по микробиологии James Monroe Jay, Martin J. Loessner, David A. Golden. 2005. Modem food microbiology («Современная микробиология пищевых продуктов»). 7 издание. Springer Science, Нью-Йорк, N.Y. 790 стр. Как правило, отсутствие жизнеспособных клеток может быть показано следующим образом: отсутствие каких-либо видимых колоний на чашках с агаровой средой или отсутствие возрастающего помутнения в жидкой среде для выращивания после засева бактериальными препаратами в различных концентрациях («нереплицирующиеся» образцы) и выдерживания в подходящих условиях (аэробная и/или анаэробная атмосфера на протяжении по меньшей мере 24 ч).
Пробиотики для целей настоящего изобретения определяются как «препараты микробиологических клеток или компоненты микробиологических клеток, обладающие благотворным воздействием на состояние здоровья или самочувствие организма». (Salminen S, Ouwehand A. Benno Y. и др. «Probiotics: how should they be defined» («Пробиотики: как их следует определять») Trends Food Sci. Technol. 1999:10 107-10).
Возможность применения нереплицирующихся пробиотических микроорганизмов предлагает несколько преимуществ. Они могут легко применяться с широким ассортиментом продуктов. Возможность использования экструзии для перевода пробиотиков в нереплицирующееся состояние еще больше увеличивает количество продуктов, к которым могут быть применены все еще являющиеся биологически активными нереплицирующиеся пробиотические микроорганизмы. При этом могут быть обойдены проблемы, связанные с попытками сохранения жизнеспособности пробиотиков до момента их употребления или даже до их попадания в кишечник.
Далее, например, у младенцев или маленьких детей с серьезными иммунными нарушениями применение живых пробиотиков может быть ограничено исключительными случаями, обусловленными наличием потенциального риска развития бактериемии. Нереплицирующиеся Пробиотики могут применяться безо всяких проблем.
Помимо этого, снабжение нереплицирующимися пробиотическими микроорганизмами делает возможным восстановление в горячей воде при сохранении полезных для здоровья качеств.
Например, может выполняться экструдирование матрицы совместно с пробиотическими микроорганизмами, а затем такая матрица может добавляться в качестве ингредиента к широкому ассортименту продуктов. Специалисты в данной области смогут определить подходящие для такого способа матрицы.
В качестве варианта, пробиотические микроорганизмы могут совместно экструдироваться со смесью исходных материалов, обеспечивая при этом непосредственное получение конечного продукта.
Соответственно, в одном воплощении пробиотические микроорганизмы могут экструдироваться совместно с композицией.
Для целей настоящего изобретения может применяться экструзионный процесс любого типа. Предпочтительный вид экструзионного процесса зависит от желательной композиции и формы конечного продукта. Специалисты в данной области смогут выбрать экструзионный процесс надлежащим образом. Marshall, R.T и др. (2003), Ice cream («Мороженое»), Kluwer Academic/Plenum Publishers, New York; Smith, J.S. & Hui, Y.H. (2004). Food processing: principles and applications («Технология производства пищевых продуктов: принципы и область применения»). Blackwell Publishing Ltd., Oxford, UK; и Bouvier, J.-M. (2001). Breakfast cereals («Блюда из зерновых продуктов для завтрака»). Обзор по экструзионным технологиям приводится в Extrusion cooking: technologies and applications («Экструзия с тепловой обработкой: технологии и области применения»), Woodhead Publishing Ltd., под редакцией Robin G., Кембридж, Англия.
Например, экструзия может выбираться из группы, состоящей из низкотемпературной замораживающей экструзии, холодной экструзии, экструзии с тепловой обработкой или их комбинаций.
Низкотемпературная замораживающая экструзия обычно используется, например, в производстве мороженого или замороженных йогуртов и, как правило, выполняется при температуре в диапазоне от 0°С до -20°С, например, при -15°С.
Холодная экструзия может использоваться, например, для производства макаронных изделий и может выполняться при температуре в диапазоне 20-90°С, например, 25-40°С или 60-90°С с содержанием влаги, превышающим 30 масс.% (например, между 30-40 масс.%). В промышленных условиях холодная экструзия может выполняться с производительностью 1000-8000 кг/час.
Экструзия с тепловой обработкой может проводиться в условиях непосредственного расширения или в условиях косвенного расширения.
Непосредственное расширение в объеме может использоваться, например, для производства экструдированных зерновых завтраков, кормов для домашних животных и кормов для рыбы. Оно может осуществляться при температуре выше 100°С (например, 110°С-180°С и содержании влаги ниже 20 масс.% (например, 16 масс.% - 20 масс.%). Скорость вращения шнеков может составлять 200 об/мин - 1300 об/мин, например, 200 об/мин - 450 об/мин; с давлением в формующей головке 1-150 бар, например 100-150 бар.
При использовании непрямого расширения в объеме экструдер может применяться для приготовления теста/густой массы, сопровождаемого образованием гранул, превращением в хлопья, обжаркой и/или нанесением покрытия. Этот способ может использоваться, например, для производства снеков и зерновых завтраков. Он выполняется при температуре выше 100°С с содержанием влаги в диапазоне 22-26 масс.%. Скорость вращения шнеков может быть ниже 200 об/мин.
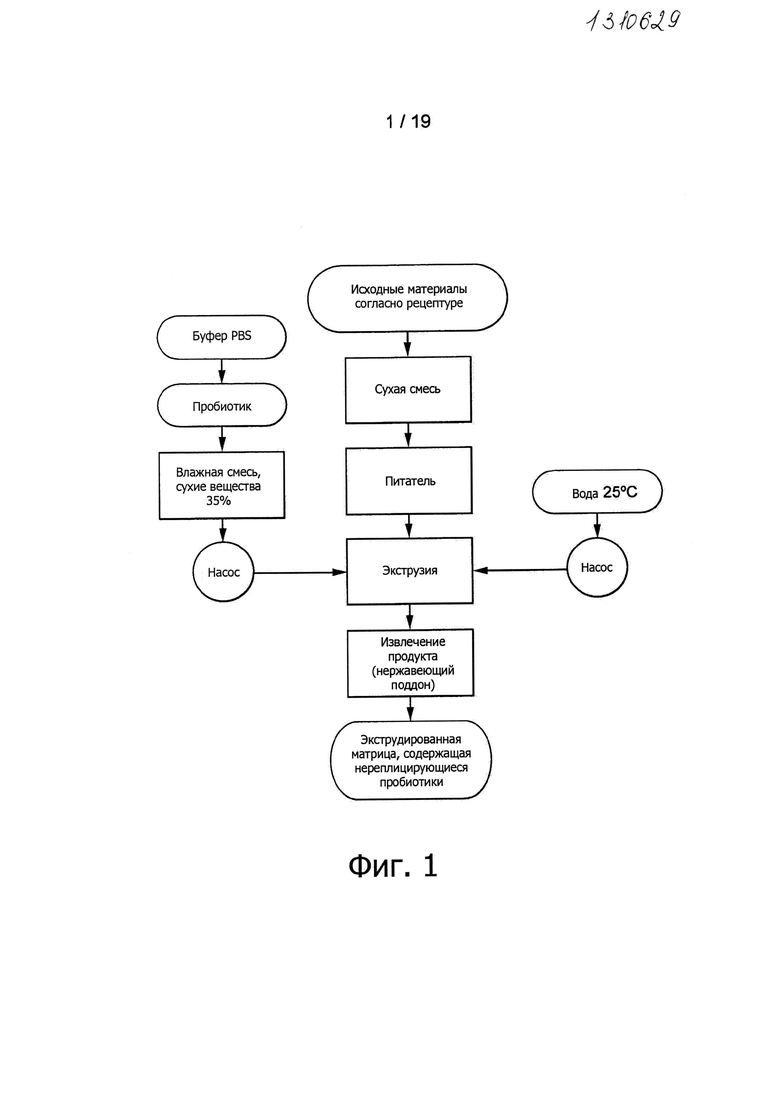
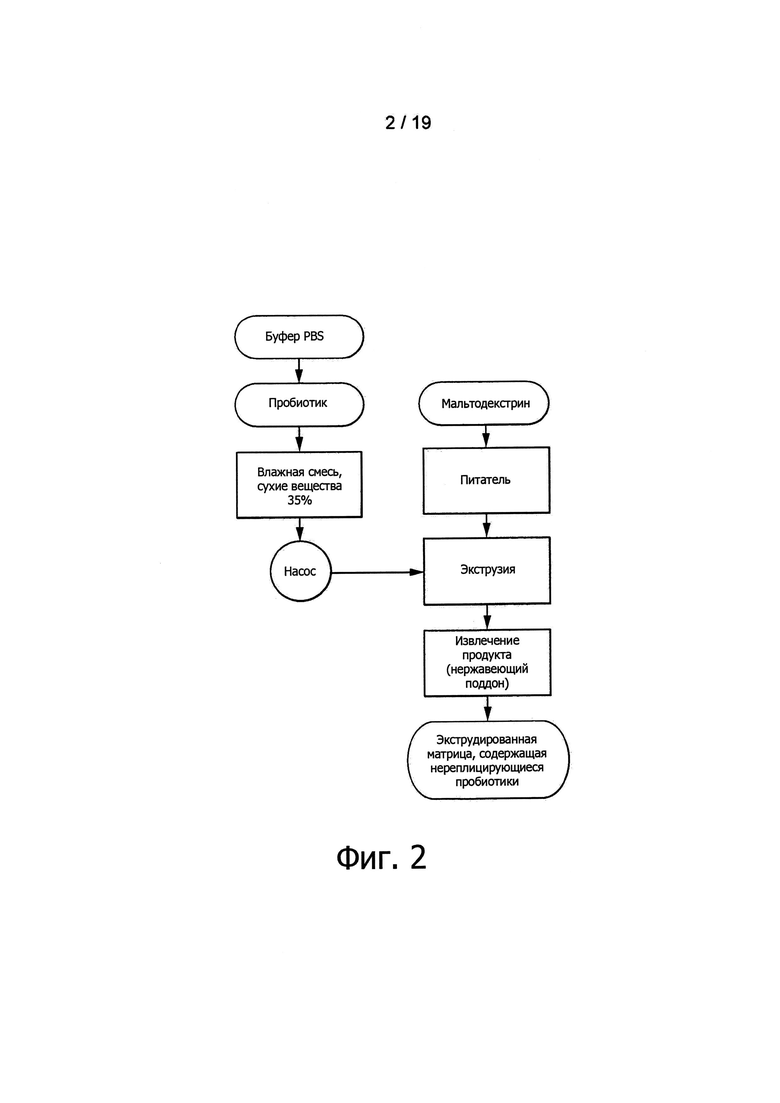
В частности, в случае холодной экструзии или экструзии с тепловой обработкой пробиотические микроорганизмы могут обеспечиваться либо как часть сухой сырьевой смеси, либо как часть влажной смеси, которая добавляется к сухой смеси на стадии экструзии. Фигуры 1 и 2 иллюстрируют примеры обоих способов. Разумеется, пробиотические микроорганизмы также могут быть добавленными к сухой смеси и к влажной смеси.
Так, в одном воплощении композиция настоящего изобретения может стать доступной или может быть получена способом, содержащим добавление пробиотических микроорганизмов к сырью, экструдирование сухой смеси при добавлении воды и извлечение экструдированного материала, содержащего нереплицирующиеся пробиотические микроорганизмы.
В одном альтернативном воплощении композиция настоящего изобретения может стать доступной или может быть получена способом, содержащим преобразование сырья в сухую смесь, добавление к сухой смеси в ходе стадии экструзии влажной смеси, содержащей воду и пробиотические микроорганизмы, и извлечение экструдированного материала, содержащего нереплицирующиеся пробиотические микроорганизмы.
Также реализуемыми являются комбинации обоих способов.
Композиция настоящего изобретения может являться конечным продуктом или же может быть ингредиентом, который может использоваться для приготовления продуктов.
Стадия экструзии может выполняться при температуре в диапазоне от -20°С до 0°С, в диапазоне от 15°С до 45°С, в диапазоне от 60°С до 90°С, в диапазоне от 90°С до 130°С или в диапазоне от 110°С до 180°С, например, от 85°С до 160°С или от 110°С до 130°С. Содержание воды на стадии экструзии может быть в диапазоне 30-40 масс.% или 16-20 масс.%. Давление в формующей головке может быть в диапазоне 1-200 бар, например, 50-200 бар, 100-150 бар или, например, 55-125 бар при экструзии и 1-55 бар при холодной экструзии.
Могут использоваться любые сырьевые материалы. Выбор сырья будет широко варьировать и зависеть от конечного продукта. Специалисты в данной области смогут выбрать подходящий сырьевой материал.
Например, сырье для зерновых продуктов может включать муку, крахмал или его производные, сахар, соль, солодовый экстракт или другие подслащивающие вещества, устойчивые к теплу витамины, минеральные вещества, вкусоароматические вещества и/или красители.
Сырье для кормов для домашних животных может включать зерно, мясо, источник липидов, витамины и/или минеральные вещества.
Сырье для макаронных изделий может включать пшеничную муку грубого помола из твердой пшеницы сорта дурум, ее смесь с мукой и/или яичным желтком.
Сырье для мороженого может включать яйца, молоко, сливки, сахар и/или вкусоароматические вещества.
Сырье для замороженных йогуртов может включать йогурт, сахар и/или вкусоароматические вещества.
Пробиотические микроорганизмы могут вводиться в процесс экструзии в таком количестве, чтобы конечный продукт содержал нереплицирующиеся Пробиотические микроорганизмы в количестве, соответствующем до около 106-1012 эквивалентов КОЕ/порция.
При этом для композиций, которые являются ингредиентами для дальнейших продуктов, количество добавляемых пробиотиков должно быть более высоким.
Композиция согласно настоящему изобретению может содержать нереплицирующиеся Пробиотические микроорганизмы в любом эффективном количестве, например, в количестве, соответствующем до около 106-1012 эквивалентов КОЕ/порция.
Композиции настоящего изобретения содержат нереплицирующиеся Пробиотические микроорганизмы в количестве, достаточном для по меньшей мере частичного обеспечения благотворного воздействия на здоровье. Подходящее для обеспечения такого действия количество определяется как «терапевтически эффективная доза». Эффективные для этих целей количества зависят от многих известных специалистам в данной области факторов, таких как масса тела и общее состояние здоровья, а также от эффекта, оказываемого матрицей пищевого продукта.
При профилактических применениях композиции согласно данному изобретению назначаются восприимчивым или иным образом подверженным риску развития определенного заболевания индивидуумам в количестве, которое является достаточным для по меньшей мере частичного снижения риска развития такого заболевания. Такое количество определяется как представляющее собой «профилактически эффективную дозу». Аналогично, точные количества зависят от ряда таких факторов, как состояние здоровья и масса тела, а также от эффекта, оказываемого матрицей пищевого продукта.
Специалисты в данной области смогут отрегулировать терапевтически эффективную дозу и/или, соответственно, профилактически эффективную дозу.
В целом композиция настоящего изобретения содержит нереплицирующиеся пробиотические микроорганизмы в терапевтически эффективной дозе и/или в профилактически эффективной дозе.
Как правило, терапевтически эффективная доза и/или профилактически эффективная доза может находиться в диапазоне около 0,005 мг - 1000 мг нереплицирующихся пробиотических микроорганизмов в сутки.
В численном выражении подвергнутые экструдированию нереплицирующиеся микроорганизмы могут присутствовать в композиции в количествах, эквивалентно соответствующих 104-1012 КОЕ/г сухой композиции. Очевидно, что нереплицирующиеся микроорганизмы не образуют колоний, поэтому этот термин следует понимать как количество нереплицирующихся микроорганизмов, которое получается из от 104 до 1012 КОЕ/г реплицирующихся бактерий. Они включает микроорганизмы, которые являются инактивированными, мертвыми, нежизнеспособными и/или присутствуют в виде фрагментов, таких как ДНК или цитоплазматические соединения. Другими словами, количество микроорганизмов, которое содержит данная композиция, вне зависимости от того, являются ли они на самом деле живыми, инактивированными, мертвыми или фрагментированными или же представляют собой смесь любых из этих состояний, выражается в терминах способности данного количества микроорганизмов образовывать колонии (КОЕ), как если бы все эти микроорганизмы являлись бы живыми.
Предпочтительно нереплицирующиеся микроорганизмы присутствуют в количестве, эквивалентном величине между 104 и 109 КОЕ/г сухой композиции, еще более предпочтительно в количестве, эквивалентном величине между 105 и 109 КОЕ/г сухой композиции.
Эффективными могут быть любые количества нереплицирующихся микроорганизмов. Однако предпочтительно, чтобы в целом по меньшей мере 90%, предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 98%, наиболее предпочтительно по меньшей мере 99%, идеально по меньшей мере 99,9%, наиболее идеально все пробиотики являлись бы нереплицирующимися.
В одном воплощении настоящего изобретения все микроорганизмы являются нереплицирующимися.
Соответственно, в композиции настоящего изобретения по меньшей мере 90%, предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 98%, наиболее предпочтительно по меньшей мере 99%, идеально по меньшей мере 99,9%, наиболее идеально все пробиотики являются нереплицирующимися.
Для целей настоящего изобретения могут применяться любые пробиотические микроорганизмы.
Например, пробиотические микроорганизмы могут выбираться из группы, состоящей из бифидобактерий, молочнокислых бактерий, пропионовокислых бактерий стрептококков, лактококков, энтерококков и Escherichia или их комбинаций, например Bifidobacterium longum, Bifidobacterium lactis, Bifidobacterium animalis, Bifidobacterium breve, Bifidobacterium infantis, Bifidobacterium adolescentis, Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus paracasei, Lactobacillus salivarius, Lactobacillus reuteri, Lactobacillus rhamnosus, Lactobacillus johnsonii, Lactobacillus plantarum, Lactobacillus fermentum, Lactobacillus lactis, Lactobacillus helveticus, Streptococcus thermophilus, Lactococcus lactis, Lactococcus diacetylactis, Lactococcus cremoris, Lactobacillus bulgaricus, Lactobacillus helveticus, Lactobacillus delbrueckii, Escherichia coli и/или их смесей.
Композиция в соответствии с настоящим изобретением может, например, содержать нереплицирующиеся пробиотические микроорганизмы, выбранные из группы, состоящей из Bifidobacterium longum NCC 3001, Bifidobacterium longum NCC 2705, Bifidobacterium breve NCC 2950, Bifidobacterium lactis NCC 2818, Bifidobacterium lactis Bbl2, Lactobacillus johnsonii NCC 533, Lactobacillus paracasei NCC 2461, Lactobacillus rhamnosus NCC 4007, Lactobacillus reuteri DSM17983, Lactobacillus reuteri ATCC55730, Streptococcus thermophilus NCC 2019, Streptococcus thermophilus NCC 2059, Lactobacillus casei NCC 4006, Lactobacillus acidophilus NCC 3009, Lactobacillus casei ACA-DC 6002 (NCC 1825), Escherichia coli Nissle, Lactobacillus bulgaricus NCC 15, Lactococcus lactis NCC 2287 или их комбинаций.
Все эти штаммы были или депонированы согласно Будапештскому договору, и/или являются предлагаемыми к продаже на рынке.
Депонированными согласно Будапештскому договору являются следующие штаммы:
Штаммы, именуемые ATCC, были депонированы в Американской коллекции типовых культур (ATCC Patent Depository), 10801 University Blvd., Manassas, VA 20110, США.
Штаммы, именуемые CNCM, были депонированы в COLLECTION NATIONALE DE CULTURES DE MICROORGANISMES (CNCM), 25 rue du Docteur Roux, F-75724 PARIS Cedex 15, Франция.
Штаммы, именуемые CGMCC, были депонированы в Китайском главном коллекционном центре микробиологических культур, Институт микробиологии Академии наук Китая, Zhongguancun, P.O.Box2714, Пекин 100080, Китай.
Штаммы, именуемые ACA-DC, были депонированы в Греческом координационном центре коллекций микроорганизмов. Лаборатория молочных продуктов. Отдел теоретических основ и технологии пищевых продуктов. Сельскохозяйственный университет Афин, 75, Iera odos, Botanikos, Афины, 118 55, Греции.
Штаммы, именуемые DSM, были депонированы в DSMZ-Deutsche Sammlung von Mikroorganismen und Zeilkulturen GmbH, Inhoffenstr., 7 В, 38124 Braunschweig, Германия.
Композиция настоящего изобретения может быть любой композицией. Например, композиция может выбираться из группы, состоящей из пищевых продуктов, кормовых продуктов для домашних животных, зерновых продуктов, питательных композиций, нутрицевтиков, пищевых добавок, косметических композиций, биологически активных добавок к пище и/или десертов.
Авторы настоящего изобретения смогли продемонстрировать, что экструзия пробиотических микроорганизмов приводит к нереплицирующимся пробиотическим микроорганизмам, которые, тем не менее, являются биологически активными. В частности, они показывают сильную иммуностимулирующую активность, усиленную или вновь приобретенную по сравнению с соответствующими жизнеспособными пробиотическими микроорганизмами.
Соответственно, композиция настоящего изобретения может предназначаться для применения в терапии или профилактике расстройств, связанных с нарушенной или ослабленной иммунной системой.
Настоящее изобретение также распространяется на применение пробиотических микроорганизмов, которые были приведены в нереплицирующееся состояние экструзией, в целях приготовления композиции, предназначенной для терапии или профилактики расстройств, связанных с нарушениями или ослаблением иммунной системой.
Усиливающее иммунную систему действие нереплицирующихся пробиотиков было подтверждено in vitro иммунным профилем. В in vitro модели используется цитокиновый профиль человеческих мононуклеарных клеток периферической крови (РВМС) и хорошо принимается в данной области в качестве стандартной модели для исследования иммуномодулирующих соединений (Schultz и др., 2003, Journal of Dairy Research 70, 165-173; Taylor и др., 2006, Clinical and Experimental Allergy, 36, 1227-1235; Kekkonen и др., 2008, World Journal of Gastroenterology, 14, 1192-1203).
Испытания РВМС in vitro применялись несколькими авторами/ исследовательскими группами, например, для классифицирования пробиотиков согласно их иммунным профилям, то есть по их анти- или провоспалительным показателям (Kekkonen и др., 2008, World Journal of Gastroenterology, 14, 1192-1203). Было показано, например, что такие испытания позволяют прогнозировать противовоспалительное действие исследуемых пробиотиков в отношении кишечного колита в моделях на мышах (Foligne В. и др., 2007, World J. Gastroenterol. 13:236-243). Более того, это испытание регулярно применяется в качестве показательного в клинических исследованиях и была продемонстрирована его способность обеспечивать результаты, согласующиеся с клиническими данными (Schultz и др., 2003, Journal of Dairy Research 70, 165-173; Taylor и др., 2006, Clinical and Experimental Allergy, 36, 1227-1235).
За последние десятилетия непрерывно увеличивается распространенность аллергических заболеваний и в настоящее время они рассматриваются ВОЗ в качестве эпидемических. В общих чертах аллергия, как полагают, является следствием дисбаланса между иммунными ответами Th1 и Th2, приводящего к сильному сдвигу в сторону продуцирования медиаторов Th2. Поэтому аллергия может быть смягчена, подавлена или предотвращена посредством восстановления надлежащего соответствия между Th1 и Th2 компонентами иммунной системы. Это подразумевает необходимость в снижении Th2-ответов или усилении, по меньшей мере временном, ответа ТЫ. Последнее было бы показателем укрепления иммунной системы, часто сопровождаемого, например, высокими уровнями IFNγ, TNF-α и IL-12 (World Journal of Gastroenterology, 14, 1192-1203; Viljanen M. и др., 2005, Allergy, 60, 494-500).
При этом связанное с нарушением иммунной защиты расстройство может выбираться из группы, состоящей из инфекций, в частности, бактериальных, вирусных, грибковых и/или паразитарных инфекций, например, инфекций дыхательных путей или желудочно-кишечных инфекций; фагоцитарной недостаточности; угнетения иммунитета слабой или тяжелой степени, вызванного стрессом или действием иммунодепрессивных лекарственных препаратов, химиотерапии или лучевой терапии; натуральных состояний сниженной иммунокомпетентности иммунной системы, например, у новорожденных или пожилых; аллергий; воспалительных расстройств и их комбинаций.
Поскольку компетентность иммунной системы у новорожденных или пожилых людей обычно снижена, композиции настоящего изобретения могут быть особенно подходящими для применения в этих группах.
Перед иммунной системой детей обычно встает большое количество задач из-за тесных контактов с другими детьми в школе или учреждениях дневного ухода за детьми.
Дети имеют возраст вплоть до 18 лет, маленькие дети - это дети в возрасте вплоть до 12 лет и младенцы - дети младше 12 месяцев.
Пожилыми являются люди, преодолевшие первые 3/4 их ожидаемой продолжительности жизни.
Соответственно, композиции настоящего изобретения может быть применимой для введения детям, например, маленьким детям или младенцам, пожилым людям и или домашним животным.
Кроме того, поскольку в наибольшей степени иммунная система подвергается испытаниям в течение дня, может быть предпочтительным употребление композиции настоящего изобретения по утрам, чтобы хорошо подготовить иммунную систему к предстоящим ей задачам.
Таким образом, композиция настоящего изобретения может предназначаться для приема по утрам.
Специалистам в данной области очевидно, что они могут свободно объединять все описанные здесь признаки настоящего изобретения без отступления от его раскрываемого здесь объема. В частности, описанные признаки композиции настоящего изобретения могут быть применены к применению настоящего изобретения и наоборот.
Дополнительные преимущества настоящего изобретения будут очевидны из следующих далее Фигур и Примеров.
Фигура 1 представляет блок-схему процесса, применяемого для получения экструдированной матрицы, содержащей нереплицирующиеся пробиотические микроорганизмы (пробиотические микроорганизмы, введенные в экструдер в виде влажной смеси).
Фигура 2 представляет блок-схему процесса, применяемого для получения экструдированной матрицы, содержащей нереплицирующиеся пробиотические микроорганизмы (пробиотические микроорганизмы, введенные в экструдер в виде влажной смеси), с помощью холодной экструзии.
Фигура 3 представляет блок-схему альтернативного способа, который может применяться для получения экструдированной матрицы, содержащей нереплицирующиеся пробиотические микроорганизмы (пробиотические микроорганизмы представляют часть сухой смеси).
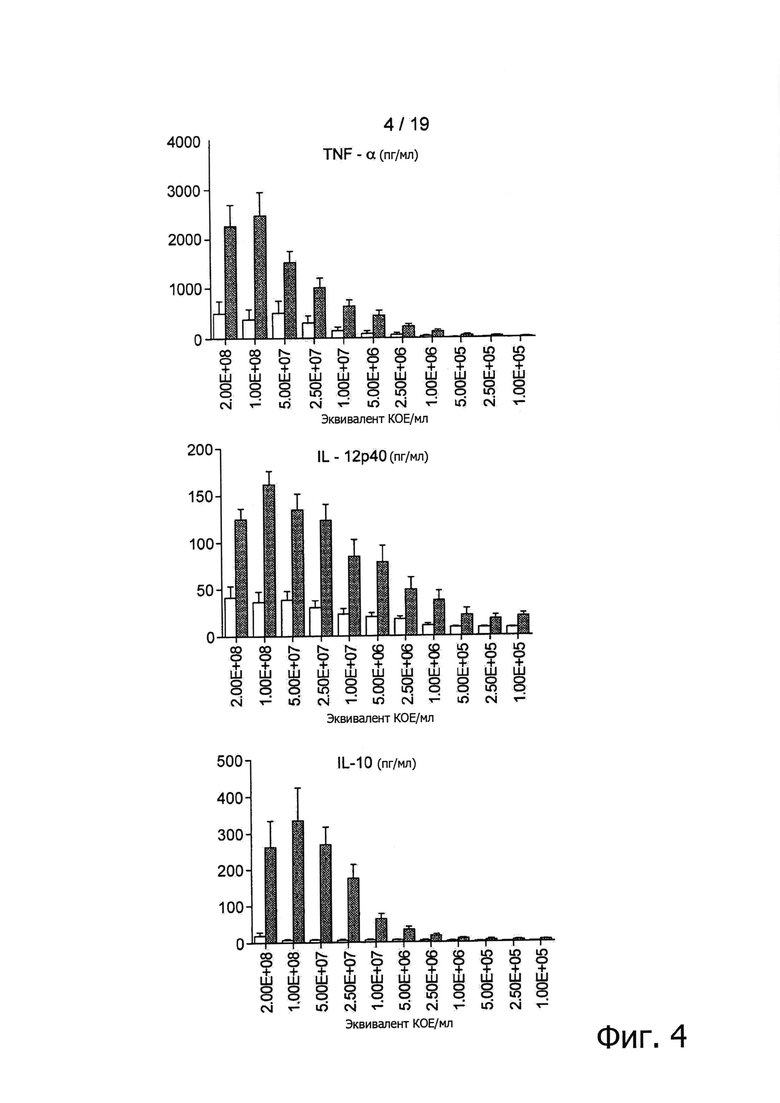
Фигура 4 показывает кривую зависимости «доза - эффект» продуцирования цитокинов человеческими РВМС при инкубации в течение 36 ч с подвергнутыми экструдированию образцами В. longum NCC3001, полученными при 130°С (черные столбцы) и экструдированными контрольными образцами (серые столбцы). Уровень цитокинов измерялся с помощью мультиплексного анализа. Результаты представлены в виде среднего +/- SEM по четырем различным донорам.
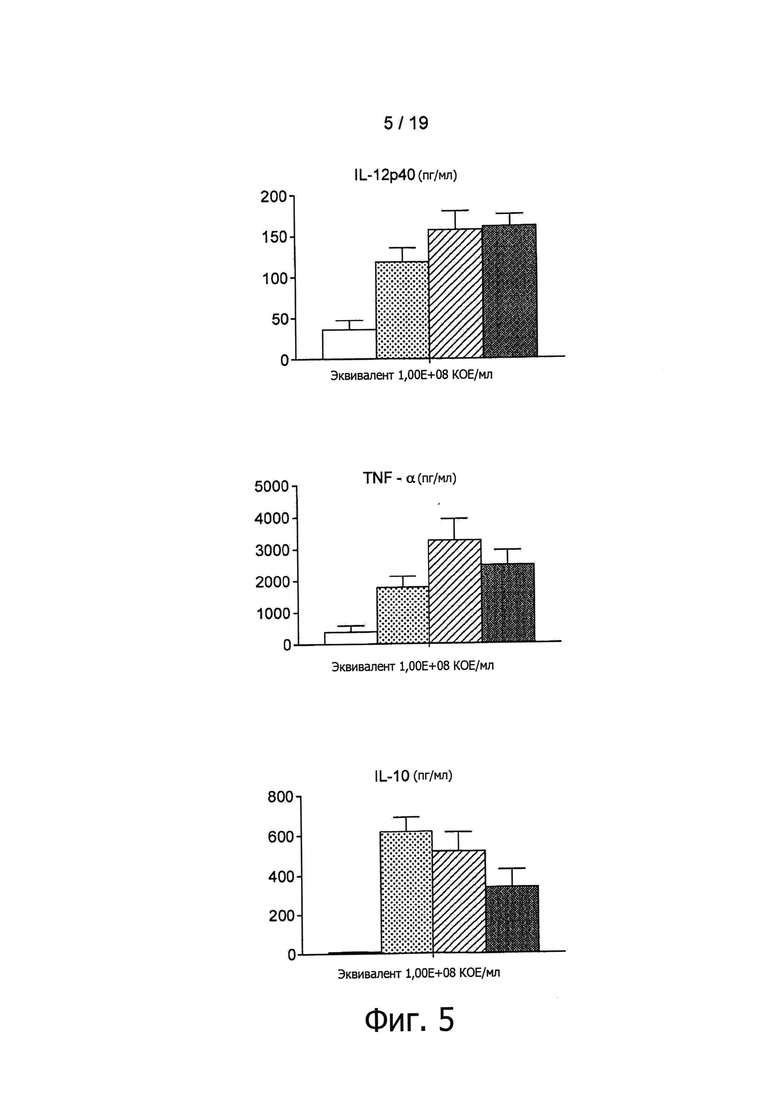
Фигура 5 показывает продуцирование цитокинов человеческими РВМС при инкубации в течение 36 ч с образцами экстру дированных пробиотиков (В. longum NCC3001) и экструдированными контрольными образцами. Бактерии экструдировались при 110°С (серые столбцы), 120°С (заштрихованные столбцы) или 130°С (черные столбцы). Контрольные экструдированные образцы представлены незакрашенными столбцами. Уровень цитокинов измерялся с помощью мультиплексного анализа. Результаты представлены в виде среднего +/- SEM по четырем различным донорам.
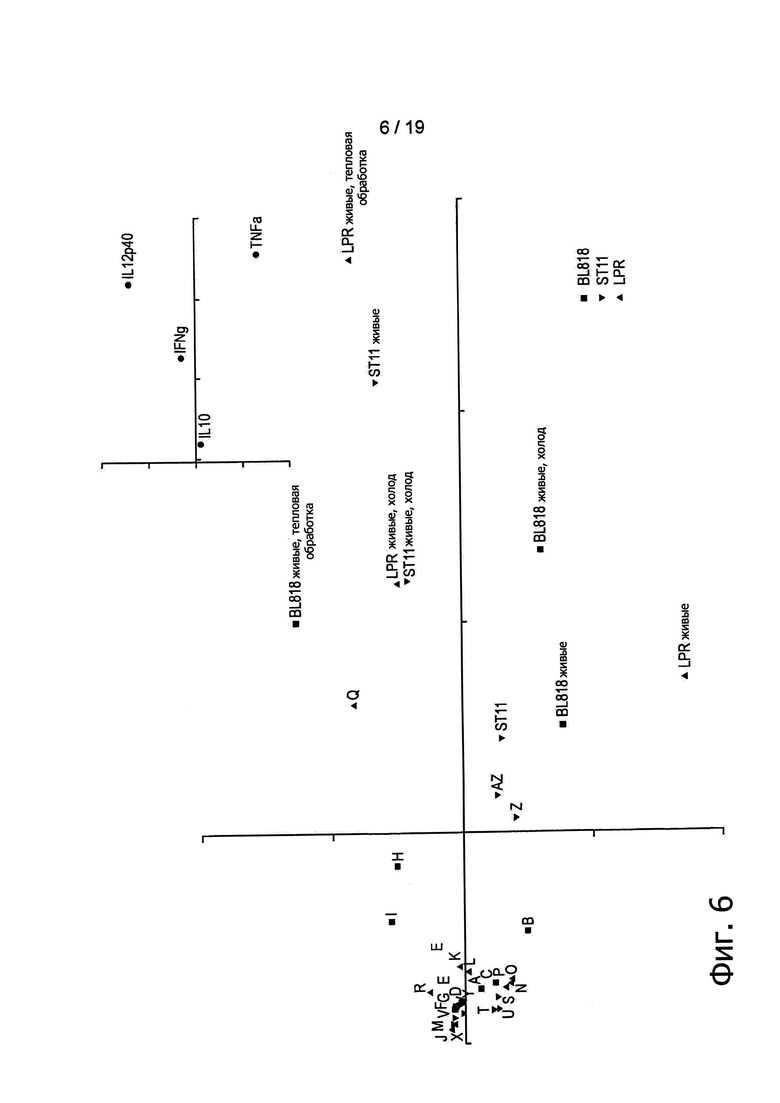
Фигура 6 демонстрирует результаты анализа РСА цитокиновых профилей нескольких экструдированных образцов. Легенда: A:BL818 800 об/мин, B:BL818 1000 об/мин, C:BL818 1200 об/мин, D:BL818 85°C, E:BL818 100°C, F:BL818 120°C, G:BL818 140°C, H:BL818 120°C/15 с, I:BL818 140°C/15 с, J:LPR 800 об/мин, K:LPR 1000 об/мин, L:LPR 1200 об/мин, M:LPR 85°C, N:LPR 100°C, 0:LPR 120°C, P:LPR 140°C, Q:LPR 120°C/15 с, R:LPR 140°C/15 с, S:ST11 800 об/мин, T:ST11 1000 об/мин, U:ST11 1200 об/мин, V:ST11 85°C, W:ST11 100°C, X:ST11 120°C, Y:ST11 140°C, Z:ST11 120°C/15 с, AZ:ST11 140°C/15c.
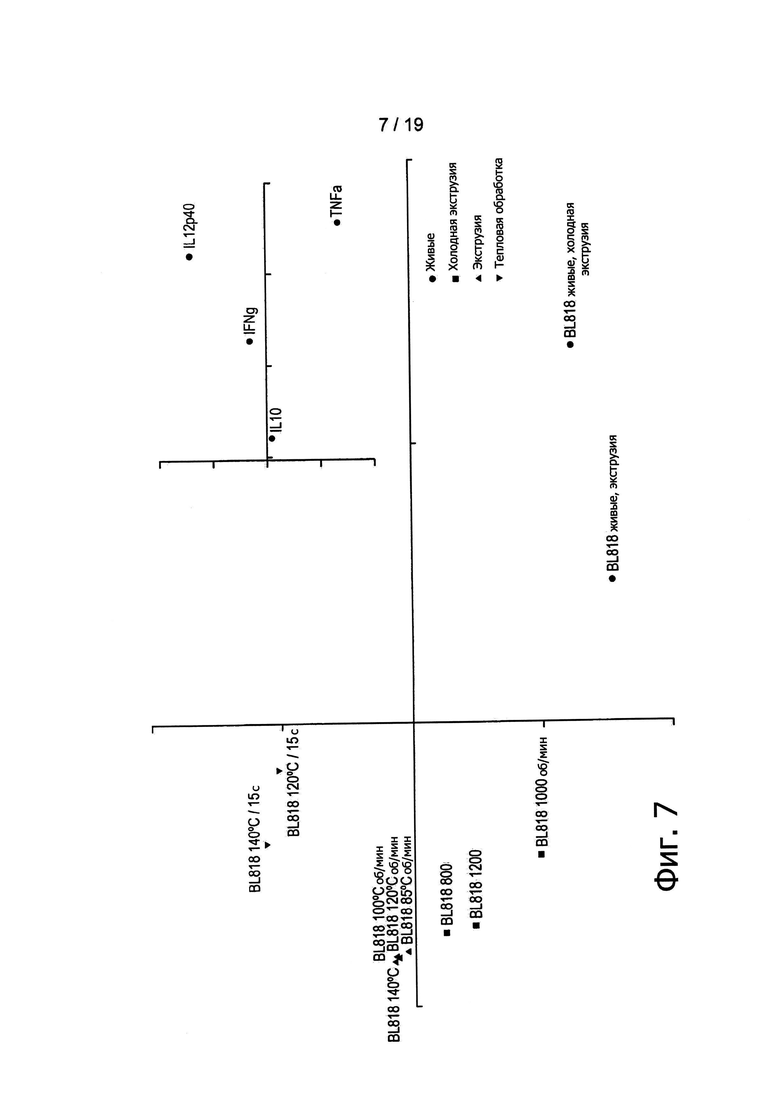
Фигура 7 демонстрирует результаты анализа РСА цитокиновых профилей различных экструдированных препаратов В. longum BL818.
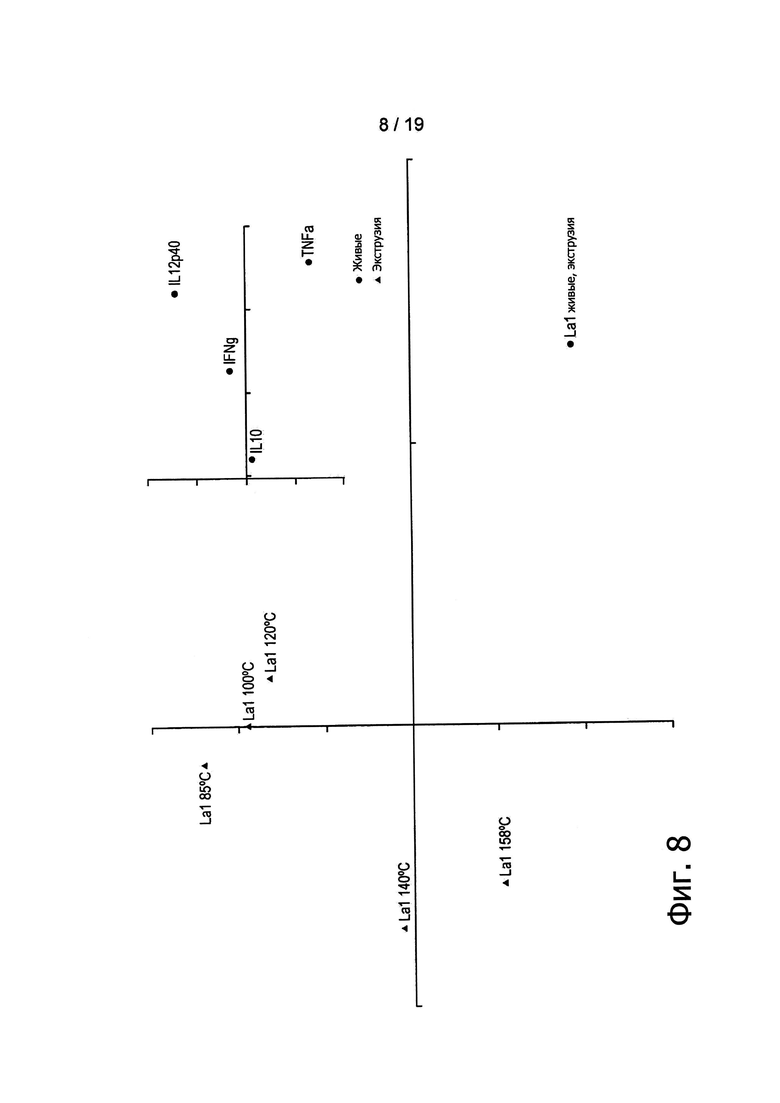
Фигура 8 демонстрирует результаты анализа РСА цитокиновых профилей различных экструдированных препаратов L. johnsonii ST11.
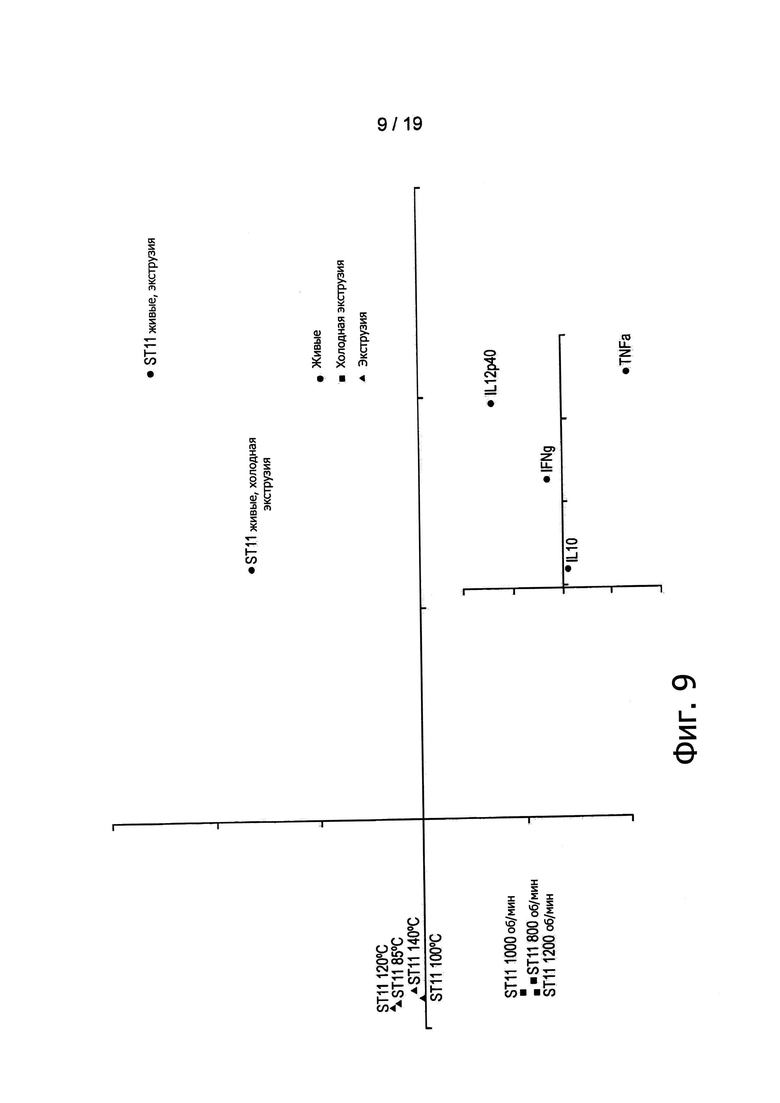
Фигура 9 демонстрирует результаты анализа РСА цитокиновых профилей различных экструдированных препаратов L. paracasei ST11.
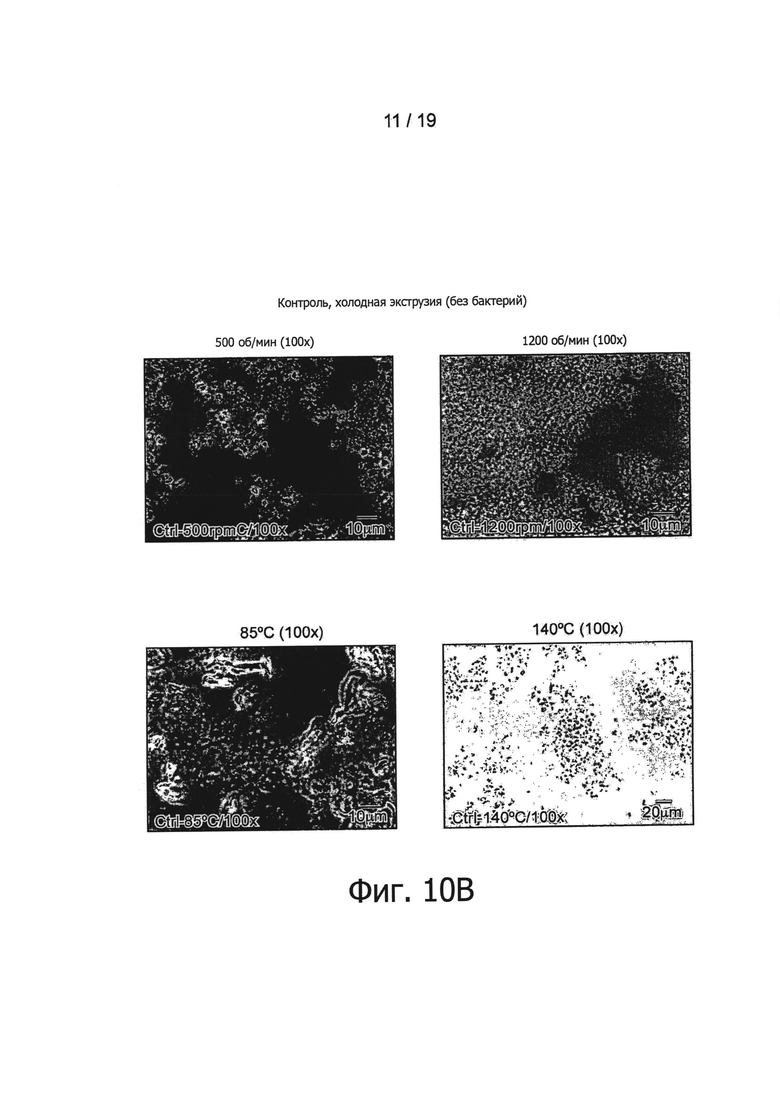
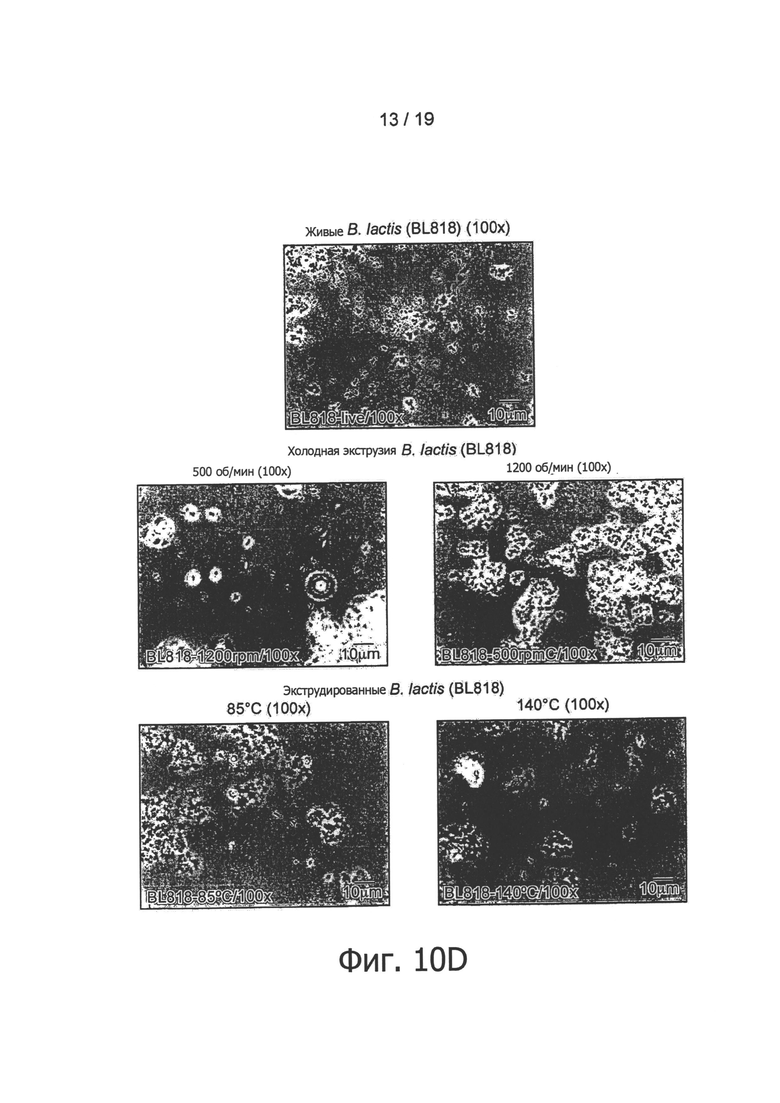
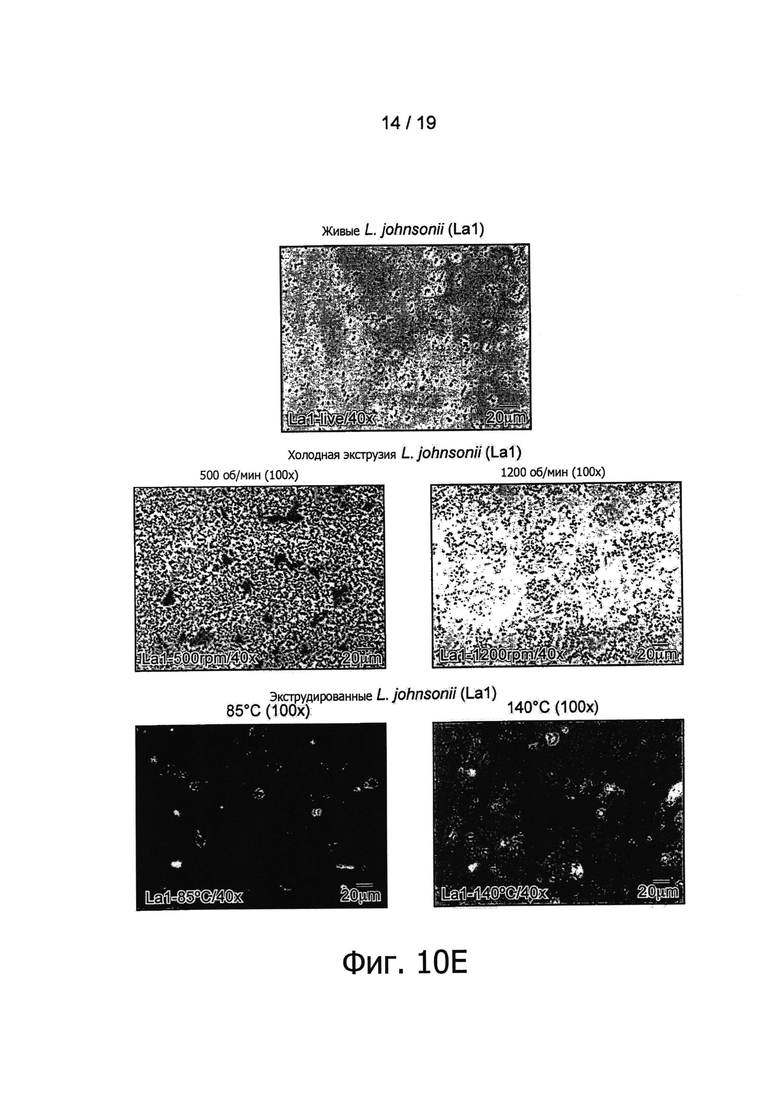
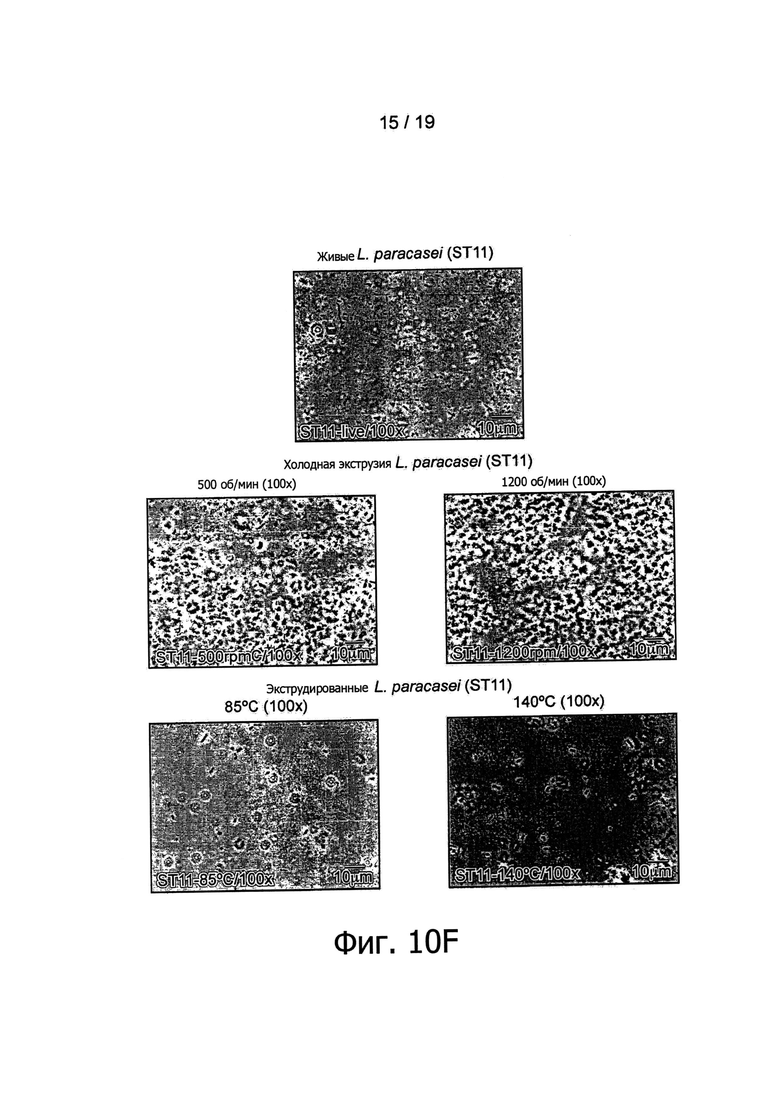
Фигура 10 представляет обнаружение бактерий в экструдированных образцах В. longum NCC3001 методом оптической микроскопии.
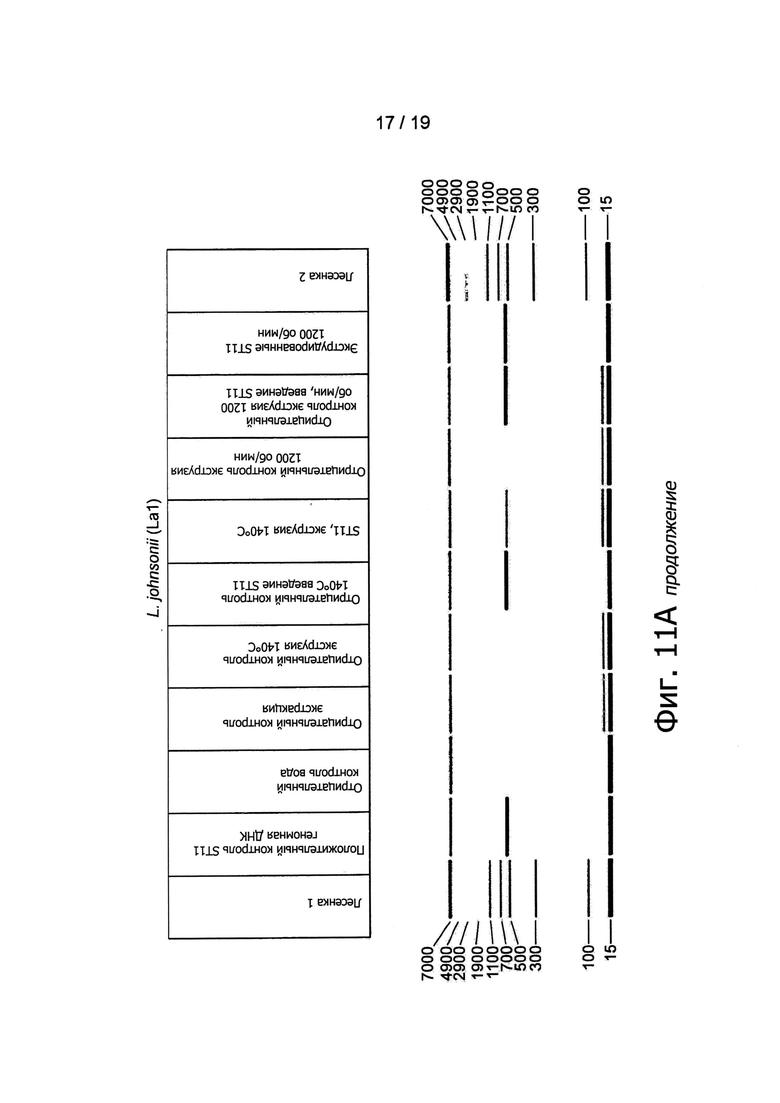
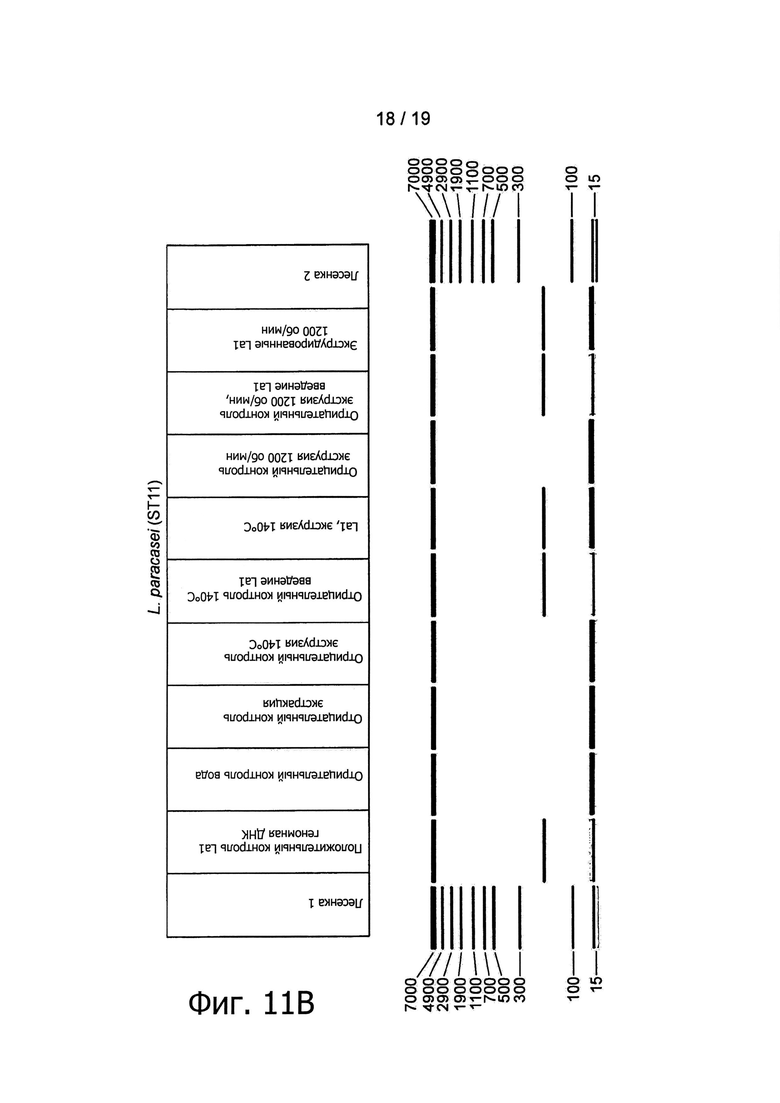
Фигура 11 представляет обнаружение бактериальной ДНК в экструдированных образцах ПЦР-анализом.
Методы и материалы.
Бактериальные препараты.
Порошки L. rhamnosus NCC 4007 (CGMCC 1.3724, LPR), L. paracasei NCC 2461 (CNCM I-2116, ST11), В. lactis NCC 2818 (CNCM I-3446, BL818), L. johnsonii NCC 533 (CNCM I-1225, La1) и В. longum NCC 3001 (ATCC BA-999, BL999) были ресуспендированы в фосфатно-солевом буфере (PBS, Sigma) с достижением конечной величины TS (общее содержание сухих веществ) в 35% или обеспечением итогового жидкого раствора, содержащего около 5×109 КОЕ/мл.
Рецептуры для экструдирования.
Была приготовлена сухая смесь рисового крахмала, кукурузной крупы, двузамещенного фосфата кальция, карбоната кальция, мальтодекстрина и сухого молока согласно рецептурам, представленным в Таблицах 1 и 2. Все ингредиенты смешивались в течение 30 минут с помощью смесителя периодического действия (смеситель Prodima, AC-MS (Prodima, St-Sulpice, Швейцария)).
Экструзия.
Эксперименты проводились с использованием двухшнекового экструдера с вращением в одном направлении (Evolum BC25, Clextral, Firminy, FR) согласно блок-схеме, представленной на Фигуре 1. Температуры экструзии задавались шестью зонами нагревания так, чтобы достичь температур продукта в 85, 100, 110, 120, 130, 140 и 160°С. Для экспериментов использовались шесть цилиндров, от №1 (первая питающая зона) до №6 (перед подводящим каналом экструзионной головки). В осевом профиле использовались два различных вида шнековых элементов: C2F и C1F. Использовалась кольцевая экструзионная головка 3 мм для получения экструдированных труб. Сухая смесь вводилась в подающий цилиндр экструдера при скорости потока 10-12,0 кг/час с помощью питателя K-Tron (K-Tron, Lenzburg, CH). Бактериальный препарат (описанный выше) вводился в цилиндр экструдера №2 с помощью насоса при скорости потока 0,69-0,87 г/час. В соответствии с температурой нагревания в цилиндр экструдера №2 впрыскивалась вода со скоростью потока 20-60 мл/мин. Скорость вращения шнеков устанавливалась равной 500 об/мин. Развивающееся в подводящем канале экструзионной головки давление составляло между 55 и 125 бар. Содержащие бактерии экструдированные продукты обрезались вручную и извлекались на поддон из нержавеющей стали, а затем кондиционировались в алюминиевых мешках. Для аналитических нужд при 85°С, 100°С, 110°С, 120°С, 130°С, 140 или 160°С и в тех же самых условиях были экструдированы контрольные эталонные образцы без бактерий (далее «экструдированный контроль»).
Альтернативный способ показан на Фигуре 3, при котором пробиотики добавляются к сухой рецептуре смеси (Пример 1, Таблица 1).
Холодная экструзия.
Эксперименты проводились с использованием двухшнекового экструдера с вращением в одном направлении (Evolum BC25, Clextral, Firminy, FR) согласно блок-схеме, представленной на Фигуре 2. Температура экструзии регулировалась шестью охлаждаемыми зонами для обеспечения температуры продукта между 25 и 40°С. Для экспериментов использовались шесть цилиндров, от №1 (первая питающая зона) до №6 (перед подводящим каналом экструзионной головки). В осевом профиле использовались два различных вида шнековых элементов: C2F и C1F. Использовалась кольцевая экструзионная головка 3 мм для образования экструдированных труб. Сухая смесь вводилась в подающий цилиндр экструдера при скорости потока 8,0 кг/час с помощью питателя К-Tron (К-Tron, Lenzburg, CH). Бактериальный препарат (описанный выше) вводился в цилиндр экструдера №3 с помощью насоса при скорости потока 2 кг/час. Скорость вращения шнеков устанавливалась в 200, 500, 800, 1000 и 1200 об/мин. Развивающееся в подводящем канале экструзионной головки давление составляло между 1 и 70 бар. Содержащие бактерии экструдированные продукты обрезались вручную и извлекались на поддон из нержавеющей стали, а затем кондиционировались в алюминиевых мешках. Для аналитических нужд при 200, 500, 800, 1000 и 1200 об/мин и в тех же самых условиях были экструдированы контрольные эталонные образцы без бактерий (далее «экструдированный контроль»).
Экстракция бактерий из экструдированного продукта.
Для микроскопических исследований.
Бактерии извлекались из экструдированных образцов следующим образом: Взвешивалось 25 г экструдированных образцов и смешивалось с 225 мл триптоновой соли и антивспенивающего агента (Sigma). Далее смесь подвергалась в течение 90 секунд механическому разрушению в гомогенизаторе Stomacher и инкубации в течение 15 минут при 68°С. После чего были проведены две последовательные стадии фильтрации через, соответственно, 40 мкм и 5 мкм фильтры. Экструдированные продукты, не содержащие пробиотиков, то есть «экструдированные контрольные образцы» или «контроль», были подвергнуты обработке согласно такому же регламенту. Отфильтрованные образцы, далее именуемые «экструдированными пробиотиками», до применения сохранялись при 4°С.
Определение цитокинового профиля мононуклеарных клеток периферической крови человека.
Бактерии извлекались из экструдированных образцов следующим образом:
Взвешивалось 10 г экструдированных образцов и смешивалось с 90 мл фосфатно-солевого буфера (Sigma). После этого смесь в течение 90 секунд подвергалась механическому разрушению в гомогенизаторе Stomacher. Далее был выполнен один стадия фильтрации через 40 мкм фильтр. Экструдированные продукты, не содержащие пробиотиков, то есть «экструдированные контрольные образцы» или «контроль», были подвергнуты обработке согласно такому же регламенту и использовались в качестве контрольных при анализах in vitro. Отфильтрованные образцы, далее именуемые «экструдированными пробиотиками», до применения сохранялись при -20°С.
Экстракция бактерий из образцов, полученных холодной экструзией.
Бактерии извлекались из экструдированных образцов следующим образом: Взвешивалось 2 г экструдированных образцов и смешивалось с 18 мл фосфатно-солевого буфера (Sigma). Затем смесь гомогенизировалась в течение нескольких секунд. Экструдированные продукты, не содержащие пробиотиков, то есть «экструдированные контрольные образцы» или «контроль», были подвергнуты обработке согласно такому же регламенту и использовались в качестве контрольных при анализах in vitro. Отфильтрованные образцы, далее именуемые «экструдированными пробиотиками», сохранялись при -20°С до применения (определение иммунного профиля цитокинов РВМС человека).
Выделение человеческих РВМС.
Мононуклеарные клетки периферической крови (РВМС) человека были выделены из лейкоцитарных пленок, полученных в трансфузионном центре CHUV (Lausanne). Клетки были разбавлены 1:2 сбалансированным солевым раствором Хенкса (HBSS) (Sigma, Lachen, Швейцария). После центрифугирования на градиенте плотности с применением среды Histopaque (Sigma) одноядерные клетки собирались с границы раздела фаз и дважды промывались с HBSS. Клетки затем были ресуспендированы в среде Дульбекко, модифицированной по способу Исков, (IMDM, Sigma), дополненной 10% эмбриональной телячьей сыворотки (Bioconcept, Париж, Франция), 1% L-глютамина (Sigma), 1% пенициллина/стрептомицина (Sigma) и 0,1% гентамицина (Sigma). РВМС (7×105 клеток на лунку) затем инкубировались в течение 36 час с различными дозами экструдированных пробиотиков (дозировки представлены на фигурах) в 48-луночных планшетах. Влияние экструдированных пробиотиков и экструдированных контрольных образцов было проверено на РВМС, полученных от 8 различных доноров, разделенных на два отдельных эксперимента. После 36 час инкубации культуральные планшеты были заморожены и до измерений цитокинов сохранялись при -20°С.
Измерения цитокинов.
Уровни цитокинов (IL-12p40, TNF-α и IL-10) в супернатанте клеточной культуры определялись после инкубирования в течение 36 часов мультиплексным анализом на основе электрохемилюминесценции (MesoScale Discovery, Gaithersbwg, MD), следуя инструкциям изготовителя. IL-12p40 и TNF-α являются провоспалительными цитокинами, тогда как IL-10 является мощным противовоспалительным и регуляторным медиатором. Результаты выражены в виде среднего (пг/мл)+/-SEM по 4 индивидуальным донорам и являются репрезентативными для двух отдельных экспериментов, выполненных с 4 донорами в каждом.
Анализ РСА.
Численные показатели цитокинов (пг/мл), определенные по данным мультиплексного анализа (см. выше) для каждого штамма, были введены в программу BioNumerics v5.10 ((Applied Maths, Sint-Martens-Latem, Бельгия). К этому набору данных был применен метод главных компонент (РСА, методика задания размерности). В этот анализ было включено определение разницы средних величин по признакам и деление полученного показателя на величину дисперсии по этим признакам. Штаммы, индуцирующие высокие уровни провоспалительных цитокинов, сгруппированы с правой стороны диаграммы в противоположность штаммам, индуцирующим высокие количества противовоспалительных цитокинов, собранным в левой части поля.
Оптическая микроскопия.
Бактерии были экстрагированы из экструдированных образцов, как описано выше в разделе «Экстракция бактерий из экструдированного продукта» с некоторыми изменениями. Образцы были подвергнуты ферментативному перевариванию альфа-амилазой в течение 1 часа при 68°С перед стадией фильтрации, сопровождаемым изучением методом оптической микроскопии (увеличение ×40 и ×100).
Для исследований PCR:
Экстракция ДНК из экструдированных бактерий для PCR.
ДНК извлекалась из экструдированных образцов с помощью набора QIAquick and QIAamp (Qiagen) согласно указаниям поставщика со следующим модифицированием. Было взвешено 2 г экструдированных образцов и смешано с 10 мл СТАВ (гексадецилтриметиламмоний бромид) (AppliChem) и 225 мкл протеазы (Qiagen) для достижения конечной концентрации 450 мкг/мл. Затем смесь инкубировалась на водяной бане в течение 1 часа при 65°С. Препарат центрифугировался, водная фаза отбиралась и смешивалась с равным объемом хлороформа (Merck). После центрифугирования супернатант был перенесен с 5 объемами РВ буфера (Qiagen) на колонку Maxi QIAamp, подсоединенную к вакуумному насосу с максимальным разрежением -600 мбар. Колонка дважды промывалась буфером РЕ (Qiagen) и осушалась центрифугированием. Очищенная ДНК в течение 5 минут элюировалась с 1 мл буфера ЕВ (Qiagen) и выделялась после центрифугирования. Вторая очистка выполнялась так же, как и предыдущая, с помощью элюирования ДНК на колонке QIAquick (Qiagen).
Полимеразная цепная реакция (PCR).
PCR выполнялись в амплификаторе Thermocycler (GeneAmp PCR System 9700, Applied Biosystem). 1 мкл очищенной ДНК добавлялся к 24 мкл амплифицируемой смеси. Амплификация выполнялась в 0,2 мл пробирках Thermo-Strip, содержащих рабочий буферный раствор: по 2,5 ммоль нуклеотидов dATP, dCTP, dGTP, dTTP (Roche Applied Science), 10 пмол/мкл каждого специфичного праймера, 2,5 мкл 10х буфера PCR, содержащего 15 ммоль MgC12 (Applied Biosystem), 1,25 единиц AmpliTaq Gold (Applied Biosystem), и не содержащая нуклеазу вода. Было выполнено 30 циклов амплификации, при этом каждый цикл состоял из стадии денатурации (30 с при 94°С), сопровождаемой 30-секундной стадией отжига при 60°С и стадией элонгации (30 с при 72°С). Стадия элонгации в ходе последнего цикла была продолжена до 7 минут при 72°С. После этого продукты PCR были подвергнуты анализу методом электрофореза на агарозном геле или автоматизированным электрофоретическим разделением (LabChip GXII, Caliper).
Электрофорез.
Продукты PCR визуализировались на агарозном геле.
10 мкл продукта PCR было смешано с 2 мкл синего загрузочного буфера и помещено на 1,2% агарозный гель, содержащий 1 × SYBR. Электрофорез образцов и лесенки маркеров молекулярной массы проводился в течение 1 часа при 80 В. Были сделаны снимки геля под УФ-освещением.
Автоматизированное электрофоретическое разделение ДНК.
Был приготовлен ДНК-чип добавлением красителя геля и маркера ДНК (Caliper). Продукты PCR помещались в 96-луночный планшет и загружались в LabChip GXII. Образцы детектировались по лазерно-индуцированной флуоресценции и полученные данные в автоматическом режиме анализировались системным программным обеспечением, представляющим сведения о размере (pb) и количестве (нг/мкл) продукта. Результаты представлены в виде смоделированного гель-электрофоретического изображения.
Результаты.
С помощью исследования РВМС были определены in vitro иммунные профили экструдированных образцов В. longum NCC3001. Измерялись уровни провоспалительных (TNF-α и IL-12p40) и противовоспалительных цитокинов (IL-10) в супернатантах клеточной культуры после инкубирования в течение 36 ч. Контрольные экструдированные продукты без бактериальных добавок индуцировали низкие уровни про- и противовоспалительных цитокинов (Фигура 4). Включение в экструзионный процесс (температура 130°С) живых В. longum NCC3001 резко стимулировало продуцирование цитокинов дозозависимым образом. Наибольшая индукция цитокинов была обнаружена при дозировке, эквивалентной около 108 КОЕ/мл (Фигура 4).
После этого авторы изобретения обратились к выяснению вопроса о том, ведет ли экструзия при различных температурах (110°С и 120°С) к сходной in vitro иммуноактивации. Для этих целей было выполнено сравнение образцов, полученных в результате экструзии при трех различных температурах в дозировке, эквивалентной 109 КОЕ/г. Как показано на Фигуре 5, все экструдированные образцы, содержащие В. longum NCC3001, эффективно по сравнению с контролем активировали иммунные клетки крови. По-видимому, применявшиеся в ходе экструзии температуры не оказывали воздействия на иммунные профили экструдированных образцов В. longum, поскольку при каждой проверенной температуре индуцировались относительно высокие уровни цитокинов Фигура 5). Как показано на Фигуре 1, В. longum NCC3001 добавлялись в экструдер в виде живых бактерий (1010 КОЕ/мл). Были проверены остаточные количества жизнеспособных микроорганизмов в конце процесса посевом образцов на агаре MRS + цистеин. Все добавленные бактерии в результате этого процесса были приведены в нереплицирующееся состояние, поскольку никаких колоний ни в одном из образцов, экструдированных при 110°С, 120°С и 130°С, не наблюдалось (данные не показаны). Наличие, в противоположность контрольному образцу, палочковидных бактерий в экструдированных продуктах, содержащих В. longum NCC3001 (Фигура 10, увеличение ×100), дало авторам возможность заключить, что in vitro иммуноактивация, описанная выше для экструдированных образцов В. longum NCC3001, происходит вследствие наличия в конечных продуктах нежизнеспособных бактерий.
Тогда авторы изобретения обратились к вопросу о возможности достижения сходной in vitro иммуноактивации при экструзии различных штаммов, при различных температурах (от 85°С до 140°С) и при различных скоростях вращения шнеков (от 200 об/мин до 1200 об/мин. Для этих целей было выполнено сравнение образцов, полученных в результате экструзии четырех дополнительных штаммов, при пяти различных температурах и при пяти различных скоростях вращения шнеков, в дозировке, эквивалентной 109 КОЕ/г. Как показано на Фигуре 6, экструдированные образцы, содержащие нереплицирующиеся L. paracasei NCC2461 (ST11), B. lactis NCC2818 (BL818) и L. johnsonii NCC533, эффективно по сравнению с контролем активировали иммунные клетки крови. Эти данные находятся в согласии с данными, ранее полученными для В. longum NCC3001 (Фигура 4). По-видимому, применявшиеся в ходе экструзии температуры (то есть горячая или холодная экструзия) не оказывали воздействия на иммунные профили экструдированных образцов В. longum, поскольку при каждой проверенной температуре индуцировались относительно высокие уровни цитокинов (Фигура 5). Аналогичным образом скорости вращения шнеков, превышающие 600 об/мин, обеспечивали образование нереплицирующихся штаммов (отсутствие при посеве обнаруживаемых КОЕ), которые, тем не менее, служили триггерным фактором для иммунных клеток (Фигуры 7 и 9). Таким образом, вне зависимости от температуры, механический сдвиг может применяться для приведения пробиотиков в нереплицирующееся состояние при сохранении их способности стимулировать иммунные клетки.
Анализы РСА показали, что экструдированные бактерии вызывали in vitro активацию иммунных клеток (Фигуры 7, 8 и 9). Однако экструдированные и живые бактерии оказались в различных группах, что указывает на то, что в сравнении с живыми микроорганизмами контроля экструдированные бактерии способны демонстрировать улучшенные или вновь приобретенные иммунные свойства.
Палочковидные формы были обнаружены микроскопией во всех образцах, экструдированных с различными штаммами пробиотиков, но не в их соответствующих контрольных группах (см., например. Фигуру 10). Наличие пробиотических штаммов в экструдированных образцах было подтверждено анализом PCR, использующим штаммоспецифические антитела (Фигура 11). Например, была обнаружена хромосомная ДНК L. paracasei NCC2461, В. longum NCC3001, В. lactis NCC2818 и L. johnsonii NCC533, что подтверждено определенными полосами на смоделированном гель-электрофоретическом изображении или на агарозном геле.
Как показано на Фигурах 1 и 3, пробиотические бактерии добавлялись в экструдер в виде живых бактерий (1010 КОЕ/мл). Были проверены остаточные количества жизнеспособных микроорганизмов в конце процесса посевом образцов на агаре MRS +/- цистеин. Все добавленные бактерии в результате этого процесса были приведены в нереплицирующееся состояние, поскольку никаких колоний ни в одном из образцов, экструдированных при температурах от 85°С до 160°С и при 140°С, а также при холодной экструзии со скоростями вращения шнека от 800 об/мин до 1200 об/мин, не наблюдалось (данные не показаны). Наличие, в противоположность контрольным образцам, палочковидных бактерий в экструдированных продуктах (Фигура 10, увеличение ×100) дало авторам возможность заключить, что in vitro иммуноактивация, наблюдавшаяся в ответ на экструдированные продукты, происходит вследствие присутствия в конечных продуктах нежизнеспособных бактерий.
В результате авторами изобретения было показано, что экструзия исходных материалов с живыми пробиотическими бактериями при различных температурах и условиях сдвига приводила к экструдированным продуктам, содержащим нереплицирующиеся пробиотические микроорганизмы, обладающие иммуностимулирующим действием. Согласно сведениям авторов, о способе применения экструзии для образования нежизнеспособных нереплицирующиеся пробиотиков, которые, тем не менее, являются способными активировать иммунную систему, никогда ранее не сообщалось. Данный принцип может быть распространен на любые пробиотические бактерии или молочные закваски и любые температуры или условия экструзии. Таким образом, данное изобретение описывает новый способ получения нереплицирующихся пробиотиков, которые обладают полезными для здоровья свойствами, и приводит к новым концепциям экструдированных продуктов. В частности, настоящее изобретение также описывает новый способ образования нереплицирующихся пробиотиков, которые демонстрируют улучшенные или вновь приобретенные иммуностимулирующие качества.





Изобретение относится к области пробиотических микроорганизмов, в частности к композициям, содержащим пробиотические микроорганизмы, переведенные в нереплицирующееся состояние экструзией. Предложен также способ получения пищевой композиции. Способ предусматривает обеспечение пробиотических микроорганизмов либо как сухой сырьевой смеси, либо как части влажной смеси, которая добавлена к сухой смеси на стадии экструзии, совместное экструдирование сырья и пробиотических микроорганизмов, приводящее пробиотические микроорганизмы в нереплицирующееся состояние, и извлечение экструдированного продукта, содержащего нереплицирующиеся пробиотические микроорганизмы. Изобретение позволяет получить композицию, содержащую нереплицирующиеся пробиотические микроорганизмы, обладающую улучшенными противовоспалительными и иммуногенными свойствами. 2 н. и 10 з.п. ф-лы, 2 табл., 19 ил., 2 пр.
1. Пищевая композиция, содержащая нереплицирующиеся пробиотические микроорганизмы, которая получена экструзионной тепловой обработкой, включающей стадии:
- обеспечение пробиотических микроорганизмов либо как сухой сырьевой смеси, либо как части влажной смеси, которая добавлена к сухой смеси на стадии экструзии;
- совместное экструдирование сырья и пробиотических микроорганизмов, приводящее пробиотические микроорганизмы в нереплицирующееся состояние; и
- извлечение экструдированного продукта, содержащего нереплицирующиеся пробиотические микроорганизмы.
2. Композиция по п. 1, содержащая нереплицирующиеся пробиотические микроорганизмы в количестве, соответствующем от около 106 до 1012 КОЕ на порцию.
3. Композиция по п. 1, в которой по меньшей мере 90% пробиотических микроорганизмов являются нереплицирующимися.
4. Композиция по любому из пп. 1-3, в которой пробиотические микроорганизмы выбраны из группы, состоящей из бифидобактерий, молочнокислых бактерий, пропионовокислых бактерий, стрептококков, лактококков, энтерококков, Escherichia или их комбинаций, например Bifidobacterium longum, Bifidobacterium lactis, Bifidobacterium animalis, Bifidobacterium breve, Bifidobacterium infantis, Bifidobacterium adolescentis, Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus paracasei, Lactobacillus salivarius, Lactobacillus reuteri, Lactobacillus rhamnosus, Lactobacillus johnsonii, Lactobacillus plantarum, Lactobacillus fermentum, Lactocobacillus lactis, Lactocobacillus helveticus, Streptococcus thermophilus, Lactococcus lactis, Lactococcus diacetylactis, Lactococcus cremoris, Lactobacillus bulgaricus, Lactobacillus helveticus, Lactobacillus delbrueckii, Escherichia coli и/или их смесей.
5. Композиция по п. 4, в которой пробиотические микроорганизмы выбраны из группы, состоящей из Bifidobacterium longum NCC 3001, Bifidobacterium longum NCC 2705, Bifidobacterium breve NCC 2950, Bifidobacterium lactis NCC 2818, Lactobacillus johnsonii NCC533, Lactobacillus paracasei NCC 2461, Lactobacillus rhamnosus NCC 4007, Lactobacillus reuteri DSM17938, Lactobacillus reuteri ATCC55730, Streptococcus thermophilus NCC 2019, Streptococcus thermophilus NCC 2059, Lactobacillus casei NCC 4006, Lactobacillus acidophilus NCC 3009, Lactobacillus casei ACA-DC 6002 (NCC 1825), Escherichia coli Nissle, Lactobacillus bulgaricus NCC 15, Lactococcus lactis NCC 2287 или их комбинаций.
6. Композиция по любому из пп. 1-3, содержащая в расчете на суточную дозу около 0,005-1000 мг нереплицирующихся пробиотических микроорганизмов.
7. Композиция по любому из пп. 1-3, которая выбрана из группы, состоящей из пищевых продуктов, кормовых продуктов для домашних животных, зерновых продуктов, питательных композиций, нутрицевтиков, пищевых добавок, биологически активных добавок к пище и/или десертов.
8. Композиция по п. 1 для применения в профилактике или терапии расстройств, связанных с нарушениями иммунной защиты.
9. Композиция по п. 8, в которой связанное с нарушением иммунной защиты расстройство выбрано из группы, состоящей из инфекций, в частности бактериальных, вирусных, грибковых и/или паразитарных инфекций, например инфекций дыхательных путей или желудочно-кишечных инфекций; фагоцитарной недостаточности; угнетения иммунитета слабой или тяжелой степени, вызванного стрессом или действием иммунодепрессивных лекарственных препаратов, химиотерапии или лучевой терапии; натуральных состояний сниженной иммунокомпетентности иммунной системы, например, у новорожденных или пожилых; аллергий; воспалительных расстройств и их комбинаций.
10. Композиция по п. 8 или 9, предназначенная для введения детям, пожилым людям или домашним животным.
11. Композиция по п. 8 или 9, предназначенная для введения по утрам.
12. Способ производства пищевой композиции, содержащей нереплицирующиеся пробиотические микроорганизмы, путем экструзионной тепловой обработки, который включает стадии:
- обеспечение пробиотических микроорганизмов либо как сухой сырьевой смеси, либо как части влажной смеси, которая добавлена к сухой смеси на стадии экструзии;
- совместное экструдирование сырья и пробиотических микроорганизмов, приводящее пробиотические микроорганизмы в нереплицирующее состояние; и
- извлечение экструдированного продукта, содержащего нереплицирующиеся пробиотические микроорганизмы.
| US 6254910 B1, 03.07.2001 | |||
| WO 2007019901 A1, 22.02.2007 | |||
| 0 |
|
SU162099A1 | |
| WO 2010008879 A2, 21.01.2010 | |||
| US 2009297664 A1, 03.12.2009 | |||
| US 2008206212 A1, 28.09.2008. | |||
Авторы
Даты
2016-05-10—Публикация
2011-11-11—Подача