ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области ядерной медицины, а точнее к способам изготовления радиофармацевтических диагностических средств для позитронно-эмиссионной томографии.
УРОВЕНЬ ТЕХНИКИ
На сегодняшний день успех лечения многих болезней зависит от того, насколько рано и успешно была проведена диагностика заболевания. Современная медицина располагает большим количеством диагностических методов. Это и методы визуализации (рентгенография, магнитно-резонансная томография (МРТ), позитрон-эмиссионная томография, компьютерная томография и др.), и биохимические анализы, и биопсия (для диагностики новообразований).
Современные методы позитронно-эмиссионной томографии (двухфотонной эмиссионной томографии) основаны на детектировании пары гамма-квантов, образующихся в результате аннигиляции позитронов после распада нестабильных радиоизотопов в тканях и клетках, при этом локацию источников излучения производят с учетом того обстоятельства, что в результате аннигилляции образуется два кванта, а направления, в которых они распространяются, строго противоположны друг другу.
Одно из главных преимуществ позитронно-эмиссионной томографии состоит в том, что в отличие от иных способов диагностики, включение радионуклидов в состав биологически-активных соединений позволяет исследовать их распределение и метаболизм в организме человека в динамике. Во многих случаях это обстоятельство делает ПЭТ незаменимым способом исследования, несмотря на сравнительно низкую пространственную разрешающую способность современных ПЭТ-сканеров.
В качестве радиоизотопов в позитронно-эмиссионной томографии применяются радионуклиды, подверженные позитронному бета-распаду. Наиболее распространенными являются углерод-11 (T1/2 20,4 минут), азот-13 (T1/2 9,96 минут), кислород-15 (T1/2 2,03 минут) фтор-18 (T1/2 109,8 минут) иод.
С точки зрения дозовой нагрузки (чем меньше T1/2, тем большую дозу радиофармацевтического препарата можно ввести в организм пациента единовременно при сохранении той же общей дозы), удобства транспортировки и получения радиофармацевтических препаратов (T1/2 не должен быть слишком коротким, чтобы за период между моментом изготовления и моментом введения в организм перед исследованием в препарате сохранялось необходимое количество радиоизотопа), и разрешающей способности ПЭТ-сканеров (увеличивается с уменьшением энергии излучения) наиболее оптимальными являются радионуклиды с периодом полураспада больше 60 минут и низкой энергией излучения.
По совокупности ядерно-физических и химических свойств галлий-68 является одним из наиболее удобных радионуклидов для изготовления радиофармацевтических препаратов для позитронно-эмиссионной томографии.
Это обусловлено доступностью и удобством применения германий-68/галлий-68 генераторов галлия-68, большим периодом полураспада материнского германия-68 (T1/2 примерно 250 дней), обеспечивающего длительный срок эксплуатации генератора в лабораторных условиях (см. статьи Astia, M. et al. Validation of 68Ge/68Ga generator processing by chemical purification for routine clinical application of 68Ga-DOTATOC. // Nuclear Medicine and Biology. - 2008. - Vol.35. - P.721-724; Zhemosekov K.P. et al. Processing of generator-produced 68Ga for medical application. J. Nucl. Med. - 2007. - Vol.10. - P.1741-1748; McAlister D.R., Horwitz E.P. Automated two column generator systems for medical radionuclides. Applied Radiation and Isotopes 67 (2009) 1985-1991). При этом галлий-68, напротив, имеет весьма малый период полураспада (T1/2=68,1 мин), что позволяет использовать радиофармацевтические препараты необходимой активности, не создавая при этом значительной дозовой нагрузки на пациента. Кроме того, катион галлия-68 (III) формирует широкий спектр устойчивых комплексных соединений со многими лигандами, содержащими кислород, азот и серу как атомы-доноры, что делает его пригодным для синтеза большого количества хелатных комплексов и макромолекул различного функционального назначения.
Известные радиофармацевтические препараты, преимущественно, содержат галлий-68 в виде комплексов с бидентатными лигандами, связанными с различными биоспецифическми молекулами. Наиболее значимыми полидентатными представителями используемых бифункциональных хелатирующих агентов являются ациклические лиганды N,N'-бис(2,2-диметил-2-меркаптоэтил)этилендиамин-N,N'-диуксусная кислота (6SS), трис-аминометилэтан (TAME), диэтилентриаминпентауксусная кислота (DTPA), этилендиаминтетрауксусная кислота (EDTA) и дифероксамин (DFO), а также макроциклические 1,4,7-триазациклононан-N,N',N''-триуксусная кислота (NOTA), 1,4,8,11-тетраазациклотетрадекан-1,4,8,11-тетрауксусная кислота (TETA) и 1,4,7,10-тетраазациклодекан-N,N',N'',N'''-тетрауксусная кислота (DOTA) и их производные (статьи Maecke H.R. et al. 68Ga-Labeled Peptides in Tumor Imaging, J. Nucl. Med. 46:172S-178S (2005); Breeman W.A.P. et al Radiolabelling DOTA-peptides with 68Ga. Eur. J. Nucl. Med. Mol. Imaging. - 2005. - V.33. - P.478-85 и патентные документы WO 2005/057589, US 20080277350, RU 2343965 C2, US 7586102 B2, WO 2004/089425 A1 и US 7728310 B2).
Несмотря на известность общих подходов к созданию биоконъюгатов галлия-68 и подходов к изготовлению биосовместимых наночастиц, до настоящего времени какие-либо попытки создания радиофармацевтических препаратов в форме наночастиц, содержащих галлий-68, не предпринимались, либо не увенчались успехом. Между тем, создание подобных препаратов могло бы способствовать повышению точности диагностики онкологических заболеваний тех органов, для которых характерно наиболее существенное накопление наночастиц, а именно печени, почек и мозга (см. Semete B. et al. In vivo evaluation of the biodistribution and safety of PLGA nanoparticles as drug delivery systems. Nanomedicine: Nonotechnology, Biology, and Medicine, - 6 (2010) - P.662-671). Кроме того, создание частиц этого типа могло бы стать важным шагом на пути к созданию нацеленных радиофармацевтических препаратов, на основе наночастиц, содержащих наряду с изотопной меткой, различные биоспецифические молекулы, такие как антитела и лиганды рецепторов, характерных для нормальных и малигнизированных клеток.
Одна из проблем, которая препятствует созданию подобных наночастиц, состоит в том, что элюаты коммерчески доступных генераторов германий-68/галлий-68, наряду с галлием-68 содержат большое количество (на 7÷10 порядков больше) конкурирующих катионов, препятствующих образованию комплексов галлия-68 (III). Наличие в рабочем растворе примесей Cd (II); Co (II); Cu (II); In (III); Fe (II); Fe (III); Lu (III); Ni (II); Zn (II) уже в количестве 1 µM может быть серьезной проблемой (Breeman W.A.P. et al Radiolabelling DOTA-peptides with 68Ga. Eur. J. Nucl. Med. Mol. Imaging. - 2005. - V.33. - P.478-85). К тому же элюаты, получаемые с генератора, имеют низкий pH (обычно получают 5,0 мл раствора с pH 1,0), а после разбавления буфером до pH 5,0 получают значительный объем раствора с весьма низкой концентрацией галлия-68. Таким образом, применение наночастиц для изготовления радиофармацевтических препаратов галлия-68 без дополнительной очистки и концентрирования элюата возможно только в том случае, если их сорбционная емкость будет достаточной для связывания не только галлия-68, но и всех мешающих катионов, а их специфичность к галлию-68 будет достаточной для практически полного связывания галлия-68 из растворов с концентрацией менее 1·10-6 M.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Терминам и выражениям, используемым в настоящем тексте, придают следующее значение, если из контекста не следует иное значение.
DIPEA - диизопропилэтиламин
EDC - N-(3-диметиламинопропил)-N'-этилкарбонат
lgβ1 - константа устойчивости комплексного соединения в растворе
PDI - индекс полидисперсности
PLGA - сополимер молочной и гликолевой кислоты
PSD - гранулометрическая характеристика
Resomer 202S - биоразлагаемый сополимер D- и L-молочной кислоты с молекулярной массой 10-18 кДа, характеристической вязкостью 0,16-0,24 дл/г, температурой стеклования 38-42°C, свободные карбоксильные группы этерифицированы.
Resomer 502H - биоразлагаемый сополимер молочной и гликолевой кислоты (50:50) с молекулярной массой 7-17 кДа, характеристической вязкостью 0,16-0,24 дл/г, температурой стеклования 42-46°C, имеются свободные карбоксильные группы
Resomer 752H - биоразлагаемый сополимер молочной и гликолевой кислоты (75:25) с молекулярной массой 7-17 кДа, характеристической вязкостью 0,14-0,22 дл/г, температурой стеклования 42-46°C, имеются свободные карбоксильные группы
ZAVeD - средний размер частиц
ZP - дзета-потенциал
Биоразлагаемый полимер - полимер, способный при его введении в организм человека под действием ферментов полностью расщепляется до безвредных некумулирующихся метаболитов, которые могут быть выведены выделительными системами организма.
Биосовместимость - свойство материала, проявляющееся в том, что при введении в организм материал не вызывает реакций непереносимости или аллергических реакций.
ДМСО - диметилсульфоксид
Кислотный индекс - количество миллиэквивалентов KOH, необходимых на грамм полимера для нейтрализации свободной кислотности
Полилактид - биосовместимый биоразлагаемый полимер, выбранный из группы, состоящей из сополимера молочной и гликолевой кислоты и сополимера D и L-молочной кислоты.
Наночастицы (сокращенно - НЧ) - мелкодисперсные частицы, образующие коллоидные системы, в частности суспензии, эмульсии, аэрозоли, гели и золи.
Остальные термины и выражения используют в обычном смысле, известном специалистам в данной области техники.
Задача настоящего изобретения состоит в создании способа получения высокодисперсных биосовместимых частиц для изготовления диагностических радиофармацевтических средств на основе радионуклида галлия-68 для позитронно-эмиссионной томографии.
Технический результат состоит в создании нетоксичного (при эффективных концентрациях) радиофармацевтического средства, обеспечивающего эффективное связывание катионов галлия-68 (III) из сильно разбавленных загрязненных катионами металлов элюатов и высокую концентрацию галлия-68 (III) в связанной форме.
Свободный и связанный с частицами галлий-68 по-разному распределяется в организме, что позволяет легко отличать высококонтрастные скопления связанного галлия-68 с четкими контурами от размытых зон, обогащенных свободным галлием-68. За счет повышения содержания галлия-68 (III) в готовой к введению лекарственной форме по сравнению с растворами галлия-68 (III) стало возможным вводить его в кровоток в болюсном режиме - короткими инъекциями в небольшом объеме жидкости.
Кроме того, можно ожидать, что вследствие незначительного проникновения наночастиц в интерстициальную жидкость, лимфу и лимфоузлы, лимфотоксичность галлия-68 в связанной с частицами форме будет ниже, чем у несвязанных аналогов.
В основе настоящего изобретения положен тот факт, что, как неожиданно было обнаружено, емкость полилактидных частиц с нековалентно связанными комплексами галлия (III) намного превышает емкость частиц с лигандами, ковалентно связанными с поверхностью полилактидных частиц.
Вышеуказанная задача решена благодаря тому, что в способе получения биосовместимых высокодисперсных частиц для in situ изготовления диагностических средств для позитронно-эмиссионной томографии посредством объединения указанных частиц с раствором, содержащим катионы галлия-68 (III)
(а) используют, по меньшей мере, бидентатные ароматические лиганды, имеющие атомы-доноры неподеленной пары электорнов для образования по меньшей мере двух координационных связей с катионом галлия (III), а именно атом(ы) кислорода, непосредственно связанный(-ые) с ароматическим кольцом, и/или атом(ы) азота в ароматическом кольце, при этом константа устойчивости lgβ1 комплексов упомянутых лигандов с катионом галлия (III) в воде при нормальных условиях составляет по меньшей мере 5,0;
(б) используют раствор, содержащий сополимеры молочной кислоты, выбранные из группы, состоящей из сополимеров D- и L-молочной кислоты и сополимеров молочной и гликолевой кислоты, в малополярном растворителе;
(в) используют водный раствор стабилизатора;
(г) (i) объединяют раствор лиганда (а) в малополярном растворителе с раствором (б) и по меньшей мере тремя объемами раствора (в) и интенсивно перемешивают, либо
(ii) объединяют раствор лиганда (а) в полярном растворителе с раствором (б), интенсивно перемешивают смесь с получением высокогомогенной смеси, добавляют по меньшей мере три объема раствора (в) и интенсивно перемешивают с получением высокогомогенной смеси;
(д) упаривают высокогомогенную смесь, полученную на стадии (г) с получением суспензии;
(е) фильтруют суспензию, полученную на стадии (д) посредством фильтра с размером пор менее 30 мкм, с получением фильтрата, содержащего вышеупомянутые частицы.
В предпочтительной форме осуществления способа к фильтрату, полученному на стадии (е), добавляют лиопротектор, замораживают и лиофилизуют. В качестве лиопротектора могут добавлять (но не обязательно) глюкозу, трегалозу, лактозу, сахарозу и/или маннит, предпочтительно - 1%-ный маннит.
Термин «лиопротектор» относится к соединению, которое, будучи включено в лиофилизуемую композицию, будет защищать химические соединения от отрицательных воздействий замораживания и вакуумирования, таких как воздействия, обычно сопровождающие лиофилизацию, например повреждение, адсорбция и потери от вакуума, применяемого в лиофилизации.
Настоящее изобретение не ограничено применением конкретного лиопротектора; примеры подходящих лиопротекторов включают, без ограничений, углеводороды, такие как сахариды, моно-, ди- или полисахариды, например глюкозу, галактозу, фруктозу, сахарозу, трегалозу, мальтозу, лактозу, амилозу, амилопектин, циклодекстрины, декстран, инулин, растворимый крахмал, гидроксиэтилкрахмал (HES), сахарные спирты, например маннитол, сорбит и полигликоли, такие как полиэтиленгликоли. Список веществ с лиопротективным действием приведен в публикации Acta Pharm, Technol. 34 (3), pp.129-139 (1988), содержание которой введено здесь ссылкой. Указанные лиопротективные агенты могут применяться по отдельности или как смеси одного или более соединений.
Также настоящее изобретение не ограничено каким-либо конкретным количеством используемого лиопротектора. Однако оптимальная весовая концентрация лиопротективных агентов в эмульсии до лиофилизации составляет от примерно 1 до примерно 25%, предпочтительно от примерно 2 до примерно 20% и еще более предпочтительно от примерно 5 до примерно 10%.
Заморозку на стадии (ж) могут (но не обязательно) осуществлять до температуры от -196 до -60°C, предпочтительно - до температуры -75°C.
Не менее 90% частиц в лиофилизате, полученном на этапе (ж), могут иметь (но не обязательно) размер 100÷800 нанометров, причем при диспергировании в фармацевтически приемлемом носителе или растворителе частицы образуют пригодную для внутривенного введения устойчивую суспензию, в которой не менее 90% наночастиц имеют размер 200÷800 нанометров.
Лиганды могут быть (но не обязательно) выбраны из группы, состоящей из антрахинонов, флавонов, оксихинолинов, трифенилметанов, имеющих заместители, содержащие атом кислорода, или содержащие атом азота в ароматическом кольце.
Предпочтительно лиганды выбраны группы, состоящей из ализарина, хинализарина, ализаринового красного, кверцетина, 8-оксихинолина и алюминона.
Упомянутый сополимер может иметь (но не обязательно) характеристическую вязкость 0,10÷0,30 дл/г.
Упомянутый сополимер может являться (но не обязательно) сополимером D, L-молочной и гликолевой кислоты с соотношением молочная кислота : гликолевая кислота от 5:1 до 1:5.
Предпочтительно, когда упомянутый сополимер является гидрофильным и имеет кислотный индекс выше 1 мэкв KOH, более предпочтительно выше 1,2, еще более предпочтительно 1,5 мэкв КОН на грамм сополимера.
Малополярный растворитель, в котором растворены сополимеры молочной кислоты, может быть (но не обязательно) выбран из группы, состоящей из этилацетата, хлороформа, дихлорметана или их смеси.
Используемый здесь термин «малополярный растворитель» относится к не смешивающимся с водой растворителям, то есть к таким растворителям, что при его смешивании с водой образуются две отдельные фазы. Не смешиваемые с водой растворители обычно известны в уровне техники как аполярные или неполярные растворители, в отличие от полярных растворителей (таких, как вода). Не смешиваемые с водой растворители, как правило, почти нерастворимы в воде. Для целей настоящего изобретения органическими растворителями, подходящими для эмульгирования с водным растворителем, являются растворители с растворимостью в воде менее примерно 10 г/л. Предпочтительно растворимость указанного растворителя в воде составляет примерно 1,0 г/л или меньше, более предпочтительно примерно 0,2 г/л или меньше и, намного более предпочтительно, примерно 0,01 г/л или меньше. Особенно предпочтительными растворителями являются растворители с растворимостью в воде 0,001 г/л или меньше. В частности, нерастворимые органические растворители (например, перфторуглероды) могут иметь растворимость вплоть до примерно 1,0·10-6 г/л (например, перфтороктан 1,66·10-6 г/л).
Органический растворитель предпочтительно является лиофилизуемым, т.е. указанный растворитель имеет достаточно высокое давление пара при температурах лиофилизации, например, между -30°C и 0°C, чтобы позволить эффективное и полное испарение/сублимацию в пределах приемлемых времен, например 24-48 часов. Предпочтительно давление пара органического растворителя выше примерно 0,2 кПа при 25°C.
Органический растворитель может быть выбран из широкого круга растворителей любой химической природы, то есть не смешиваемых с водой и лиофилизуемых, как указано выше, и которые предпочтительно являются жидкими при комнатной температуре (25°C). Если используется растворитель с точкой кипения ниже, чем комнатная температура, емкость, содержащая эмульгирующую смесь, может преимущественно быть охлаждена ниже точки кипения указанного растворителя, например, до 5°C или 0°C.
Подходящие органические растворители включают, без ограничений, алканы, такие как разветвленные или предпочтительно прямые (C5-C10)-алканы, например пентан, гексан, гептан, октан, нонан, декан; алкены, такие как (C5-C10)-алкены, например 1-пентен, 2-пентен, 1-октен; циклоалканы, такие как (C5-C8)-циклоалканы, возможно замещенные одной или двумя метальными группами, например циклопентан, циклогексан, циклооктан, 1-метилциклогексан; ароматические углеводороды, такие как бензол и производные бензола, замещенные одной или двумя метальными или этильными группами, например бензол, толуол, этилбензол, 1,2-диметилбензол, 1,3-диметилбензол; простые алкиловые эфиры и кетоны, такие как дибутиловый эфир и диизопропилкетон; галогенированные углеводороды или простые эфиры, такие как хлороформ, четыреххлористый углерод, 2-хлор-1-(дифторметокси)-1,1,2-трифторэтан (энфлюран), 2-хлор-2-(дифторметокси)-1,1,1-трифторэтан (изофлюран), тетрахлор-1,1-дифторэтан и, в частности, перфторированные углеводороды или простые эфиры, такие как перфторпентан, перфторгексан, перфторгептан, перфторметилциклогексан, перфтороктан, перфторнонан, перфторбензол и перфтордекалин, метилперфторбутиловый эфир, металперфторизобутиловый эфир, этилперфторбутиловый эфир, этилперфторизобутиловый эфир и их смеси.
Смешивание на стадии (г)(i) могут осуществлять (но не обязательно) 3÷10 минут на емкостном гомогенизаторе при 19000÷30000 оборотах ротора в минуту, а затем 3÷10 минут на гомогенизаторе высокого давления при давлении 20000÷30000 psi.
Смешивание на стадии (г)(ii) предпочтительно осуществляют 1,5÷10 минут на емкостном гомогенизаторе при 19000÷30000 оборотах ротора в минуту.
Высокогомогенную смесь на стадии (д) могут упаривать (но не обязательно) на роторном испарителе.
Фильтрование на стадии (е) могут осуществлять (но не обязательно) на стеклянном фильтре с размером пор, по существу, 10 микрометров.
В качестве стабилизатора на стадии (в) могут использовать (но не обязательно) водный раствор поливинилового спирта, предпочтительно, 1,0% в/о водный раствор поливинилового спирта с молекулярной массой 9,0÷80 кДа.
В одном из вариантов осуществления способа частицы, полученные на этапе (е), промывают и после этого помещают в раствор, содержащий катионы галлия-68 (III).
В еще одном из вариантов осуществления способа pH раствора, содержащего катионы галлия-68 (III), доводят до pH 3,0÷8,0, предпочтительно до pH приблизительно 5,0.
Частицы могут содержать (но не обязательно) стехиометрический избыток лиганда и катионов металлов в растворе, содержащем катионы галлия-68 (III).
Упомянутые частицы могут дополнительно конъюгировать (но не обязательно) с авидином и/или стрептавидином для придания способности избирательно связываться с биоспецифическими биотинилированными лигандами, предпочтительно - с моноклональными антителами.
Упомянутые частицы могкт дополнительно конъюгировать (но не обязательно) с биоспецифическими лигандами.
Упомянутые биоспецифические лиганды могут быть (но не обязательно) выбраны из группы, состоящей из моноклональных антител, активных фрагментов пептидных гормонов, активных фрагментов интегринсвязывающих белков и RGD-пептида.
Упомянутые биоспецифические лиганды могут быть выбраны (но не обязательно) из группы, состоящей из моноклональных антител, специфичных к факторам свертывания крови, предпочтительно к тканевому тромбопластину.
Упомянутые биоспецифические лиганды могут быть выбраны (но не обязательно) из группы, состоящей из моноклональных антител, специфичных к сосудистому эндотелиальному фактору роста (VEGF).
В другом аспекте настоящее изобретение относится к способу изготовления радиофармацевтического препарата для позитронно-эмиссионной томографии, в котором частицы, полученные вышеописанным способом, помещают в раствор, содержащий галлий-68 (III) с pH 3,0÷8,0.
Упомянутые частицы перед помещением в упомянутый раствор могут (но не обязательно) промывать.
В другом своем аспекте изобретение относится к применению частиц, полученных вышеописанным способом, в котором упомянутые частицы объединяют с раствором, содержащим катионы галлия-68 (III), и вводят в организм человека перед проведением позитронно-эмиссионной томографии.
В предпочтительном варианте осуществления упомянутые частицы перед помещением в упомянутый раствор могут (но не обязательно) промывать.
В еще одном аспекте изобретение относится к биосовместимым высокодисперсным частицам для изготовления радиофармацевтического препарата для позитронно-эмиссионной томографии, характеризующимся тем, что они получены в соответствии с вышеописанным способом.
В еще одном аспекте изобретение относится к применению частиц, полученных в соответствии с вышеописанным способом, для изготовления радиофармацевтического препарата для позитронно-эмиссионной томографии.
Позитронно-эмиссионную томографию могут (но не обязательно) совмещать с компьютерной томографией.
Позитронно-эмиссионную томографию также могут (но не обязательно) совмещать с магнитно-резонансной (ядерно-магнитной) томографией.
В качестве контраста в упомянутой магнитно-резонансной томографии могут (но не обязательно) использовать упомянутые частицы с предварительно сорбированными катионами гадолиния (III).
В еще одном своем аспекте изобретение относится к диагностической радиофармацевтической композиции для позитронно-эмиссионной томографии, характеризующейся тем, что она содержит эффективное количество галлия-68 (III), связанного с частицами, изготовленными вышеописанным способом.
Эффективное количество в расчете на массу тела 50÷90 кг соответствует активности 2÷5 мКи.
В одном из предпочтительных вариантов осуществления после объединения раствор инкубируют, центрифугируют, удаляют супернатант и ресуспендируют в фармацевтически приемлемом растворе для парентерального введения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 показан ЯМР-спектр модифицированного ализарина по примеру 1.
На фиг.2 показан спектр Resomer 752H, ковалентно-модифицированного ализарином, по примеру 1.
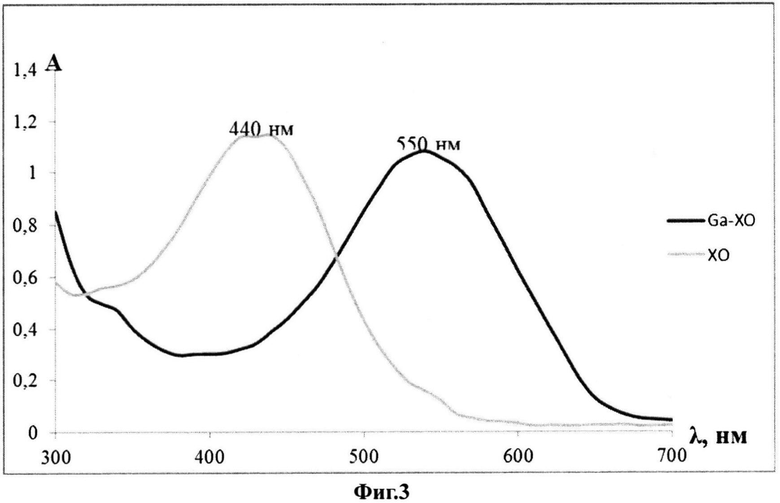
На фиг.3 показаны спектры поглощения ксиленолового оранжевого и его комплекса с галлием (III) в водно-органической среде (вода-ДМСО, pH<1,0 (0,1 н H2SO4)).
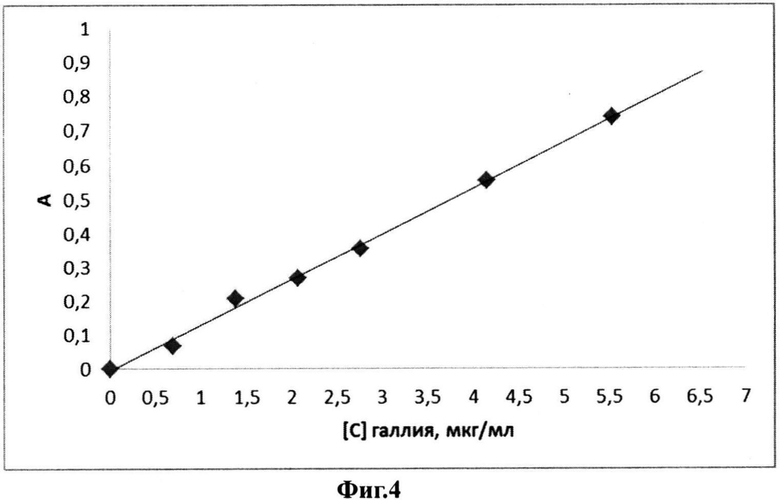
На фиг.4 показан градуировочный график для определения свободного галлия (вода-ДМСО, pH<1,0 (0,1 н H2SO4)); длина волны 550 нм.
На фиг.5 показаны градуировочный график для определения общего содержания галлия (вода-ДМСО, pH<1,0 (0,1 н H2SO4)); длина волны 550 нм.
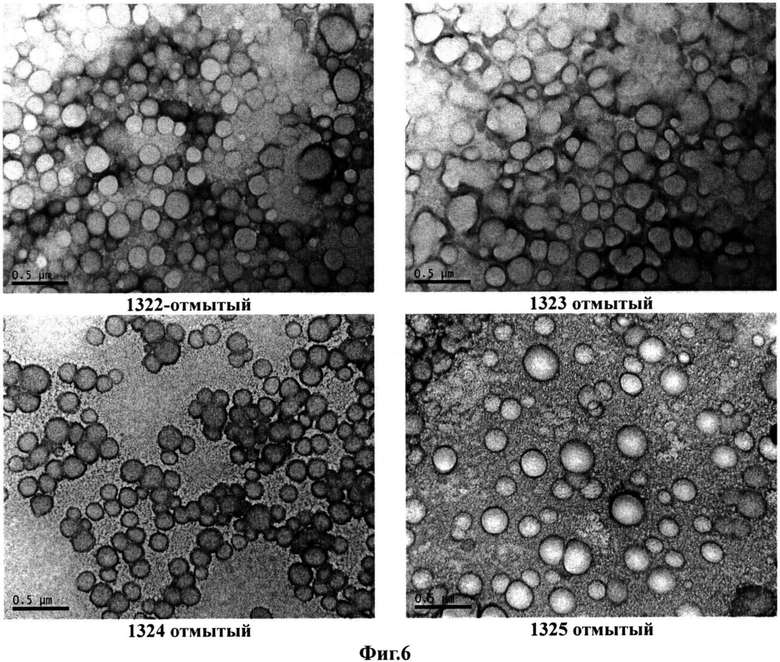
На фиг.6 показаны микрофотографии образцов по примеру 2.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Содержание галлия, входящего в виде комплексов в состав полилактидных частиц, а также степень включения галлия (III) в полилактидные частицы, определяют посредством спектрофотометрии растворов с использованием индикатора - ксиленолового оранжевого, образующего окрашенные комплексы с галлием (III) при pH 1,0 и менее. Данный способ основан на том, что в кислой среде комплексы галлия (III) с анализируемыми лигандами разрушаются и не мешают определению содержания галлия в виде его комплекса с индикатором. Поглощение измеряют при длине волны 550 нм (см. фиг.3).
Концентрацию свободного (не связанного с полилактидными частицами) галлия (III) определяют по предварительно построенному градуировочному графику (измеряют поглощение при длине волны 550 нм) (фиг.1 и фиг.2).
Для выявления возможного мешающего влияния собственного поглощения органических реагентов определяют концентрацию в отсутствии и в присутствии органических реагентов. Концентрация органических реагентов в анализируемом растворе соответствовала максимальному теоретически возможному содержанию органических реагентов в препарате.
Результаты валидации способа определения галлия (III) на примере полилактидных частиц с кверцетином, хинализарином и ализарином представлены в таблице 1+.
Как следует из таблицы 1, присутствие хинализарина в растворе приводит к завышению результатов определения концентрации галлия. Поэтому для определения галлия в растворах, содержащих данный реагент, используют метод добавок.
Для определения концентрации свободного галлия (III) в суспензии полилактидных частиц лиофилизат ресуспендируют в объеме воды, составляющем 0,5 от исходного, количественно переносят в центрифужную пробирку, отделяют полилактидные частицы центрифугированием (Avanti J-301, 180C, 20000 об/мин, 30 мин) и отбирают супернатант. Далее к смеси 0,1% водного раствора индикатора (0,2 мл), 1 н. H2SO4 (0,1 мл) и 0,5 мл диметилсульфоксида добавляют 0,2 мл супернатанта, перемешивают, инкубируют 30 мин при комнатной температуре и определяют концентрацию свободного галлия (III) по предварительно построенному градуировочному графику (фиг.4).
Для определения общего содержания галлия (III) в полилактидных частицах их растворяют в диметилсульфоксиде и по предварительно построенному градуировочному графику для растворов галлия (III) в смеси вода:ДМСО = 1:1 (об.:об.) (фиг.5). При этом учитывают, что концентрация раствора полилактида в 50% диметилсульфоксиде, не должна превышать 1 мг/мл.
Для определения общего содержания галлия (III) в лиофилизате полилактидных частиц лиофилизат, полученный из 1 или 2 мл, суспензии полилактидных частиц растворяют в 5,0 или 10,00 мл диметилсульфоксида, соответственно. В мерные колбы вместимостью 10,00 мл вносят 2 мл 0,1% водного раствора индикатора, 1 мл H2SO4 (1 N), аликвотную часть суспензии образца частиц PLGA (от 1 до 5 мл, по необходимости) и доводят содержание диметилсульфоксида в колбе до 5,00 мл. Далее объем раствора в колбе доводят до метки дистиллированной водой, перемешивают и через 30 минут измеряют оптическую плотность растворов.
Для определения общего содержания галлия (III) в осадках полилактидных частиц после центрифугирования осадок, оставшийся в центрифужной пробирке после отбора супернатанта, ресуспендируют и вновь лиофилизируют. Содержимое флакона после лиофилизации растворяют в диметилсульфоксиде (из расчета 5 мл диметилсульфоксида на осадок во флаконе, полученный из 1 мл исходного лиофилизата). В колбу объемом 10 мл вносят 2 мл 0,1% водного раствора индикатора, 1 мл 1 н H2SO4 и 5 мл раствора частиц PLGA в диметилсульфоксиде (в случае, если во флаконе было всего 5 мл, то его переносят количественно). Раствор доводят до метки водой, перемешивают и через 30 минут измеряют поглощение при 550 нм.
Вышеописанный способ определения галлия (III) в лиофилизате валидировали с использованием лиофилизата полилактидных частиц, содержащих хинализарин. Установлено незначительное мешающее влияние собственной окраски хинализарина на результаты определения концентрации галлия. Поэтому для определения галлия в лиофилизатах полилактидных частиц, содержащих хинализатрин, используют метод добавок. Результаты валидации способа представлены в таблице 2.
Таким образом, погрешность составляет 3,4%, а способ позволяет с достаточной точностью определять содержание галлия в образцах полилактидных частиц.
Степень связывания вычисляют как выраженное в процентах отношение содержания галлия (III) в осадке полилактидных частиц к содержанию галлия (III) в супернатанте, полученном после центрифугирования суспензии полилактидных частиц после их инкубации в растворе галлия (III).
ПРИМЕР 1 (СРАВНИТЕЛЬНЫЙ)
Получение и исследование полилактидных частиц, содержащих ковалентно связанный лиганд, образующий устойчивые комплексы с галлием (III)
Этап 1
Получение модифицированного ализарина для ковалентного связывания с полилактидными частицами
Растворяют 0,6 г ализарина 1 (2,5 ммоль), 1,0 г (6,3 ммоль) карбоэтоксипиперазина, 0,14 г KOH и 0,07 г параформа в 2,5 мл воды и 2,5 мл этанола и перемешивают при 75°C в течение 24 часов. Затем добавляют еще 0,1 г параформа и перемешивают еще 24 часа при той же температуре. После этого растворитель отгоняют, к остатку добавляют 30 мл воды и подкисляют уксусной кислотой до тех пор, пока цвет реакционной смеси изменится с фиолетового на желто-коричневый. Осадок соединения 2 отфильтровывают, промывают водой и смешивают с 15 мл воды и 15 мл HCl. Полученный раствор кипятят при перемешивании 4 часа. После охлаждения раствор фильтруют, фильтрат упаривают досуха. К остатку добавляют 20 мл этанола и снова упаривают. После этого остаток нагревают с 10 мл этанола до кипения. К кипящему раствору добавляют 30 мл ацетонитрила. Выпавший осадок отфильтровывают, промывают ацетонитрилом и сушат. Получают 227 мг продукта.
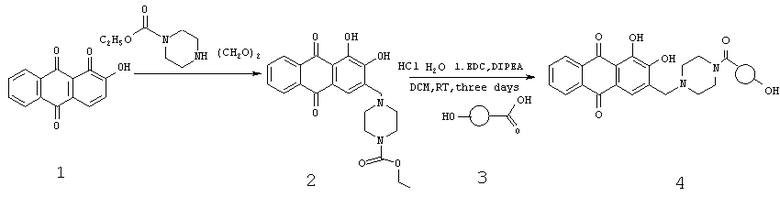
Модифицированный ализарин (220 мг, 0,54 ммоль) смешивают с резомером 360 мг Resomer 752H 3 (приблизительно 0,097 ммоль свободных карбоксильных групп), 192 мг EDC (0,65 ммоль), и 258 мг DIPEA (2 ммоль) перемешивают в 8,0 мл дихлорметана в течение 3-х суток. Смесь выливают в 100 мл воды и 50 мл этилацетата. Органическую фазу отделяют и промывают 8 раз в 100 мл дистиллированной воды. При каждой промывке добавляют 10 мл этилацетата. Промывают до тех пор, пока промывной раствор перестанет окрашиваться. После этого органическую фазу промывают 3-4 раза 100 мл 1% HCl и затем 1 раз 100 мл воды. Органическую фазу сушат сульфатом натрия и упаривают до объема 10 мл. К остатку при перемешивании добавляют 30 мл гексана. Выпавший осадок фильтруют и сушат. Получают 205 мг полимера.
Из сравнения ЯМР-спектров (растворитель - ДМСО, частота 400,46 МГц) модифицированного ализарина 2 и резомера 752H с привитым ализарином следует, что массовое содержание ализарина в продукте составляет приблизительно 5,8%. Кроме того, продукт содержит незначительные примеси гексана и этилацетата.
Этап 2
Получение полилактидных частиц, содержащих ковалентно связанный ализарин
Раствор полилактида (200 мг) и 50 мг модифицированного ализарином полилактида, полученного на этапе 1, в 5 мл дихлорметана смешивали с 25 мл 0,5%-ного раствора поливинилового спирта (9-10 тысяч Дальтон), 2 мин гомогенизировали на гомогенизаторе Turax при 23600 об/мин, затем - 5 мин на гомогенизаторе Avestin при 15000-20000 psi. Дихлорметан отгоняли на роторе до давления 15 миллибар, фильтровали на стеклянном фильтре с порами 10 мкм, добавляли 2,5% маннита, замораживали при -70°C и лиофилизовали на аппарате ALPHA 2-4LSC (Martin Christ GmbH).
Этап 3
Сорбция галлия (III) полилактидными частицами, полученными на этапе 2
Полилактидные частицы, полученные на этапе 2, ресуспендировали и трижды промывали дистиллированной водой от свободного ализарина методом осаждения-ресуспендирования в дистиллированной воде (центрифугирование - 30 минут при 13,2 тысяч об/мин и температуре 18°C на центрифуге 5415R (Eppendorf, Германия)).
Далее осадок частиц ресуспендировали в 1 мл ацетатного буфера с pH 5,0, прибавляли раствор сульфата галлия (III) с концентрацией 12,84 мг/мл и перемешивали на магнитной мешалке 2 часа при 250 об/мин. Супернатант и осадок разделяли центрифугированием 30 минут на центрифуге Beckman при 20000 об/мин и температуре 18°C.
Этап 4
Определение содержания галлия (III) в осадке полилактидных частиц, полученных на этапе 3 и в супернатанте
Модифицированные ализарином полилактидные частицы (образцы №№1324 и 1325) получают вышеописанным способом с использованием полимеров Resomer 752H / Resomer752H-ализарин (5:1) и Resomer 502H / Resomer502H-ализарин (5:1), соответственно. Сорбцию галлия (III) осуществляют в растворе сульфата галлия (III), содержащего заведомый избыток галлия (III) по отношению к ализариновым группам (около 3:1 и 2:1 для образцов 1324 и 1325, соответственно). Содержание свободного галлия (III) в супернатанте и галлия (III), связанного с ковалентно-модифицированными ализарином полилактидными частицами, определяли спектрофотометрически, вышеописанным способом. Полученные результаты представлены в таблице 3.
ПРИМЕР 2
Получение полилактидных частиц с нековалентно связанными лигандами, способными образовывать устойчивые комплексы с галлием (III)
Используют бидентатные лиганды, удовлетворяющие следующим требованиям:
(1) лиганды относятся к классу аренов, в которых донорами неподеленной пары электронов для образования двух координационных связей с катионом галлия (III) служат атомы кислорода, непосредственно связанные с ароматическим кольцом, и/или атомы азота ароматического кольца;
(2) константа устойчивости lgβ1 не менее 5,0.
Желательно использовать лиганды, образующие с галлием (III) комплексы с коэффициентом экстракции неполярными растворителями, несмешивающимися с водой, из растворов в воде, полярных растворителях, или их смесей, больше 10, причем особенно желательно, когда дополнительно свободный лиганд растворим в полярном растворителе лучше, чем его комплекс с галлием (III).
Предпочтительными классами лигандов являются антрахиноны, флавоны, оксихинолины и трифенилметаны.
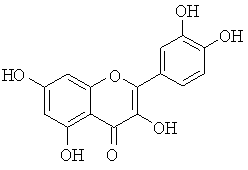
Конкретными примерами подходящих лигандов являются ализарин, хинализарин, ализариновый красный, кверцетин, 8-оксихинолин и алюминон (таблица 4).



Этап 1
Получение полилактидных частиц, содержащих нековалентно связанные комплексы галлия с лигандами
Для получения полилактидных частиц использовали 2 способа.
Первый способ. Объединяют 5 мл органического растворителя (этилацетата, хлороформа или дихлорметана), содержащего 50 мг/мл Resomer 752H или Resomer 202S, и лиганд (из расчета полимер : лиганд 50:1÷1000:1 м/м) и 25 мл водного раствора поливинилового спирта с молекулярной массой 9-10 кДа (1%, в/о). Полученную смесь гомогенизируют 5 мин на гомогенизаторе Ultra-Turrax при 23600 об/мин, затем - 5 мин на гомогенизаторе высокого давления Авестин при давлении 20000-25000 psi. Далее удаляют растворитель на роторном испарителе. Полученную суспензию фильтруют через стеклянный фильтр с размером пор 10 мкм, добавляют лиопротектор, - 1% маннит, - разливают по 2 мл во флаконы, замораживают при -70°C и лиофилизируют. Этим способом получены образцы 1163-1191.
Второй способ. Растворяют 250 мг Resomer 502H в 3 мл дихлорметана. К полученному раствору прибавляют 2,0 мл водного раствора, содержащего 5÷25 мг ализаринового красного C, гомогенизируют смесь 2 мин на гомогенизаторе Turrax при 23600 об/мин и переносят в стакан с 25 мл водного раствора поливинилового спирта с молекулярной массой 9-10 кДа (1%, в/о). Повторно гомогенизируют смесь 5 мин на гомогенизаторе Turrax при 23600 об/мин, затем удаляют растворитель на роторе. Суспензию фильтруют через стеклянный фильтр с размером пор 10 мкм, измеряют объем и добавляют 1% маннита. Образцы разливают по флаконам (по 2 мл), замораживают при -70°C и лиофилизуют. Этим способом получены образцы 1324-1331.
Этап 2
Получение раствора комплекса галлия (III) и связанного с полилактидными частицами лиганда
Полилактидные частицы, полученные на этапе 1 примера 2, ресуспендировали и обрабатывали в соответствии с этапом 3 по примеру 1 с получением супернатанта и осадка. Далее характеристики частиц определяют в соответствии с этапом 4 по примеру 1.
Характеристики некоторых частиц PLGA, содержащих комплексы галлия (III) с лигандами, представлены в таблицах 6 и 9.
В таблице 7 представлены результаты определения содержания галлия (III) в полилактидных частицах после сорбции.
В таблице 8 представлены результаты определения степени связывания галлия (III) полилактидными частицами с ализарином красным S и алюминоном до и после отмывки в течение 2 часов.
Фотографии полилактидных частиц после отмывки представлены на фигуре 6. Хорошо видно, что частицы круглые и вокруг явный контрастный ободок - поверхность покрыта контрастным веществом, по-видимому, комплексом галлия с лигандами.
Сравнение эффективности полилактидных частиц по примеру 1 и 2
Ожидалось, что степень связывания галлия частицами с нековалентной связью лиганда и полимерного ядра будет существенно ниже, чем в случае лиганда, ковалентно связанного с образующим ядро частицы полилактидом. Однако неожиданно обнаружено, что такие частицы связывают галлий (III) лучше частиц по примеру 1, о чем свидетельствуют данные таблиц 3 и 9. Относительно малое включение галлия (III) в образцах по примеру 1, по-видимому, связано с невысокой сорбционной емкостью поверхности частиц.
Удельная сорбционная емкость полилактидных частиц по изобретению по отношению к катионам галлия (III), примерно в 2 раза выше, чем у сравнительных частиц по примеру 1, и может доходить до 80÷100 мкг галлия (III) на 10 мг полилактида. При этом остаточное содержание галлия (III) в навеске частиц по изобретению с начальным содержанием 100 мкг галлия (III)/мг полимера при инкубации в плазме крови в первые 15 минут и далее будет всегда выше, чем таковое у сравнительных частиц с начальным содержанием 40 мг галлия (III)/мг полимера.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ, ИЗЛУЧАЮЩИЕ ПОЗИТРОНЫ И СОДЕРЖАЩИЕ НЕОРГАНИЧЕСКИЕ ЧАСТИЦЫ, И ИХ ПРИМЕНЕНИЕ В МЕДИЦИНЕ, В ЧАСТНОСТИ ДЛЯ ДИАГНОСТИЧЕСКИХ ПРОЦЕДУР | 2008 |
|
RU2461392C2 |
| СПОСОБ ПОЛУЧЕНИЯ СИНТЕТИЧЕСКИХ МЕТАЛЛ-ПОЛИМЕРНЫХ КОМПЛЕКСОВ РАДИОИЗОТОПА ГАЛЛИЯ-68 | 2015 |
|
RU2588144C1 |
| КОНЪЮГИРОВАННЫЕ БИСФОСФОНАТЫ ДЛЯ ДИАГНОСТИКИ И ТЕРАПИИ ЗАБОЛЕВАНИЙ КОСТЕЙ | 2015 |
|
RU2742660C2 |
| СПОСОБ ВИЗУАЛИЗАЦИИ ВОСПАЛЕНИЙ | 2014 |
|
RU2571486C1 |
| СОЕДИНЕНИЕ ДЛЯ ДИАГНОСТИКИ ОПУХОЛЕЙ, ЭКСПРЕССИРУЮЩИХ ПСМА, И КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2019 |
|
RU2730507C1 |
| СПОСОБ ПОЛУЧЕНИЯ РАДИОФАРМАЦЕВТИЧЕСКОГО ПРЕПАРАТА С ГАЛЛИЕМ-68 ДЛЯ ВИЗУАЛИЗАЦИИ МЕТАСТАЗОВ СКЕЛЕТА МЕТОДОМ ПЭТ | 2020 |
|
RU2757258C1 |
| Радиофармацевтический препарат для диагностики рака предстательной железы методом позитронной эмиссионной томографии и способ его получения | 2022 |
|
RU2796106C1 |
| Способ радиоактивного мечения | 2014 |
|
RU2675371C2 |
| РАДИОФАРМАЦЕВТИЧЕСКИЕ ПРОДУКТЫ | 2007 |
|
RU2448733C2 |
| ОСТЕОТРОПНЫЙ РАДИОФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ ДЛЯ ПЭТ-ВИЗУАЛИЗАЦИИ | 2014 |
|
RU2614235C2 |



Изобретение относится к способу получения биосовместимых высокодисперсных полилактидных частиц для in situ изготовления диагностических средств для позитронно-эмиссионной томографии посредством объединения указанных частиц с раствором, содержащим катионы галлия-68 (III). Заявленный способ включает объединение раствора в полярном растворителе бидентатного ароматического лиганда, а именно кверцетина, хинализарина, ализарина или 8-гидроксихинолина с раствором, содержащим сополимеры молочной кислоты в малополярном растворителе и интенсивное перемешивание полученной смеси с получением высокогомогенной смеси. Затем добавляют по меньшей мере три объема водного раствора поливинилового спирта с молекулярной массой 9,0÷80 кДа и интенсивно перемешивают с получением высокогомогенной смеси. Полученную смесь выпаривают с получением суспензии, которую фильтруют посредством фильтра с размером пор менее 30 мкм, с получением фильтрата, добавляют лиопротектор, замораживают и лиофилизуют. Изобретение также относится к биосовместимым высокодисперсным частицам для изготовления радиофармацевтического препарата для позитронно-эмиссионной томографии, их применению для проведения позитронно-эмиссионной томографии и к диагностической композиции, содержащей эффективное количество галлия-68 (III), связанного с указанными выше частицами. 6 н. и 27 з.п. ф-лы, 8 табл., 6 ил., 2 пр.
1. Способ получения биосовместимых высокодисперсных полилактидных частиц для in situ изготовления диагностических средств для позитронно-эмиссионной томографии посредством объединения указанных частиц с раствором, содержащим катионы галлия-68 (III), в котором:
(а) используют, по меньшей мере, бидентатные ароматические лиганды, а именно кверцетин, хинализарин, ализарин и 8-гидроксихинолин;
(б) используют раствор, содержащий сополимеры молочной кислоты, выбранные из группы, состоящей из сополимеров D- и L-молочной кислоты и сополимеров молочной и гликолевой кислоты, в малополярном растворителе;
(в) используют водный раствор стабилизатора, а именно поливинилового спирта с молекулярной массой 9,0÷80 кДа;
(г) объединяют раствор лиганда (а) в полярном растворителе с раствором (б), интенсивно перемешивают смесь с получением высокогомогенной смеси, добавляют по меньшей мере три объема раствора (в) и интенсивно перемешивают с получением высокогомогенной смеси;
(д) упаривают высокогомогенную смесь, полученную на стадии (г) с получением суспензии;
(е) фильтруют суспензию, полученную на стадии (д) посредством фильтра с размером пор менее 30 мкм, с получением фильтрата, содержащего вышеупомянутые частицы;
(ж) к фильтрату, полученному на стадии (е), добавляют лиопротектор, замораживают и лиофилизуют.
2. Способ по п.1, в котором в качестве лиопротектора добавляют глюкозу, трегалозу, лактозу, сахарозу и/или маннит, предпочтительно 1%-ный маннит.
3. Способ по п.1, в котором на стадии (ж) заморозку осуществляют до температуры от -196 до -60°С, предпочтительно до температуры -75°С.
4. Способ по п.1, в котором в лиофилизате, полученном на этапе (ж), не менее 90% частиц имеют размер 100÷800 нм, а при диспергировании в фармацевтически приемлемом носителе или растворителе образуют пригодную для внутривенного введения устойчивую суспензию, в которой не менее 90% наночастиц имеют размер 200÷800 нм.
5. Способ по п.1, в котором упомянутый сополимер имеет характеристическую вязкость 0,10÷0,30 дл/г.
6. Способ по п.1, в котором упомянутый сополимер является сополимером D, L-молочной и гликолевой кислоты с соотношением молочная кислота:гликолевая кислота от 5:1 до 1:5.
7. Способ по п.1, в котором упомянутый сополимер является гидрофильным и имеет кислотный индекс выше 1 мэкв КОН, более предпочтительно, выше 1,2, еще более предпочтительно 1,5 мэкв КОН на грамм сополимера.
8. Способ по п.1, в котором малополярный растворитель, в котором растворены сополимеры молочной кислоты, выбран из группы, состоящей из этилацетата, хлороформа, дихлорметана или их смеси.
9. Способ по п.1, в котором смешивание на стадии (г) осуществляют 3÷10 мин на емкостном гомогенизаторе при 19000÷30000 оборотах ротора в минуту, а затем 3÷10 мин на гомогенизаторе высокого давления при давлении 20000÷30000 psi.
10. Способ по п.1, в котором смешивание на стадии (г) осуществляют 1,5÷10 мин на емкостном гомогенизаторе при 19000÷30000 оборотах ротора в минуту.
11. Способ по п.1, в котором высокогомогенную смесь на стадии (д) упаривают на роторном испарителе.
12. Способ по п.1, в котором фильтрование на стадии (е) осуществляют на стеклянном фильтре с размером пор, по существу, 10 мкм.
13. Способ по п.1, в котором в качестве стабилизатора на стадии (в) используют водный раствор поливинилового спирта, предпочтительно, 1,0% в/о водный раствор поливиниового спирта с молекулярной массой 9,0÷80 кДа.
14. Способ по п.1, в котором частицы, полученные на этапе (е), промывают и дополнительно помещают в раствор, содержащий катионы галлия-68 (III).
15. Способ по п.14, в котором рН раствора, содержащего катионы галлия-68 (III), доводят до рН 3,0÷8,0, предпочтительно - до рН приблизительно 5,0.
16. Способ по п.14, в котором частицы содержат стехиометрический избыток лиганда и катионов металлов в растворе, содержащем катионы галлия-68 (III).
17. Способ по п.1, в котором упомянутые частицы дополнительно конъюгируют с авидином и/или стрептавидином для придания способности избирательно связываться с биоспецифическими биотинилированными лигандами, предпочтительно с моноклональными антителами.
18. Способ по п.1, в котором упомянутые частицы дополнительно конъюгируют с биоспецифическими лигандами.
19. Способ по п.18, в котором упомянутые биоспецифические лиганды выбраны из группы, состоящей из моноклональных антител, активных фрагментов пептидных гормонов, активных фрагментов интегринсвязывающих белков и RGD-пептида.
20. Способ по п.18, в котором упомянутые биоспецифические лиганды выбраны из группы, состоящей из моноклональных антител, специфичных к факторам свертывания крови, предпочтительно - к тканевому тромбопластину.
21. Способ по п.18, в котором упомянутые биоспецифические лиганды выбраны из группы, состоящей из моноклональных антител, специфичных к сосудистому эндотелиальному фактору роста (VEGF).
22. Способ изготовления радиофармацевтического препарата для позитронно-эмиссионной томографии, в котором частицы, полученные в соответствии со способом по любому из пп.1-16, помещают в раствор, содержащий галлий-68 (III) с рН 3,0÷8,0.
23. Способ по п.22, в котором упомянутые частицы перед помещением в упомянутый раствор промывают.
24. Способ применения частиц, полученных способом по любому из пп.1-16, для проведения позитронно-эмиссионной томографии, в котором упомянутые частицы объединяют с раствором, содержащим катионы галлия-68 (III), и вводят в организм человека перед проведением позитронно-эмиссионной томографии.
25. Способ по п.24, в котором упомянутые частицы перед помещением в упомянутый раствор промывают.
26. Биосовместимые высокодисперсные частицы для изготовления радиофармацевтического препарата для позитронно-эмиссионной томографии, характеризующиеся тем, что они получены в соответствии со способом по любому из пп.1-16.
27. Применение частиц, полученных в соответствии со способом по любому из пп.1-16, для изготовления радиофармацевтического препарата для позитронно-эмиссионной томографии.
28. Применение по п.27, в котором позитронно-эмиссионную томографию совмещают с компьютерной томографией.
29. Применение по п.27, в котором позитронно-эмиссионную томографию совмещают с магнитно-резонансной (ядерно-магнитной) томографией.
30. Применение по п.29, в котором в качестве контраста в упомянутой магнитно-резонансной томографии используют упомянутые частицы с предварительно сорбированными катионами гадолиния (III).
31. Диагностическая радиофармацевтическая композиция для позитронно-эмиссионной томографии, характеризующаяся тем, что она содержит эффективное количество галлия-68 (III), связанного с частицами, изготовленными способом по любому из пп.1-16.
32. Композиция по п.31, в которой эффективное количество в расчете на массу тела 50÷90 кг соответствует активности 2÷5 мКи.
33. Композиция по п.31, в которой после объединения раствор инкубируют, центрифугируют, удаляют супернатант и ресуспендируют в фармацевтически приемлемом растворе для парентерального введения.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| EA 201001854 A1 29.06.2012 | |||
| EA 200900731 A1 30.06.2010 | |||
Авторы
Даты
2015-02-10—Публикация
2013-06-10—Подача